Область техники
Настоящее изобретение относится к композиции для снижения экссудации белков сыворотки, более конкретно к композиции для улучшения при состояниях, таких как атопический дерматит, атопическая экзема, кожный зуд, атопическое воспаление полости носа (ринит), атопическая эритема или эритродерма, контактный дерматит, астма, хроническое обструктивное заболевание легких и т.д., посредством снижения экссудации белков сыворотки в коже и слизистой оболочке.
Предпосылки изобретения
В целях теоретического понимания атопических заболеваний и улучшения, и лечения их симптомов исследователями предпринято множество попыток понять иммунорегуляторные механизмы в живом организме или механизмы передачи сигнала в клетке и способы применения механизмов равно как и развития иммунологии и цитологии. С другой стороны, некоторые ученые проводят исследования для выявления причин изменения заболеваний при развитии современной цивилизации, а именно при изменении режима питания или при воздействии загрязняющих веществ.
Среди этих различных открытий общим фактом, выявленным в исследованиях атопических заболеваний, является то, что у пациентов с атопическими заболеваниями происходит экссудация белков сыворотки через кожу или слизистую оболочку, независимо от понимания того, что атопические заболевания могут быть вызваны иммунологическими причинами. Однако не проводили исследований для того, чтобы явно определить, происходит ли экссудация белков сыворотки через кожу и слизистые оболочки как результат развития атопических заболеваний или экссудация белков сыворотки через кожу или слизистую оболочку запускает атопические заболевания.
Известно, что экссудацию белков сыворотки через эпидермис или слизистую оболочку выявляют, главным образом, с использованием сывороточного альбумина в качестве маркерного белка. Известно, что уровень экссудации сывороточного альбумина при кожных заболеваниях тесно коррелирует с тяжестью заболеваний. По мере того, как происходит значительная экссудация белков сыворотки через кожу, в крови возникает гипоальбуминемия (Worm et al., 1981. Br.J.Dermatol. 104: 389-396; Worm and Rossing, 1980. J.Invest. Dermatol. 75: 302-305). Пациенты страдают от симптомов, развившихся вследствие аллергической астмы и ринита, таких как кишечная лимфангиэктазия, которая возникает при значительной потере альбумина через внутреннюю стенку кишечника (Esenberh, 1976. Ann. Allergy, 36: 342-350). В случае детей потеря альбумина при тяжелых кожных заболеваниях приводит к задержке их роста (Abrahamov, 1986. Eur. J. Pediatr. 145: 223-226), а также, помимо лимфангиэктазии, сопровождается олигурией и акроцианозом (Capulong et al., 1996. Pediatr. Allergy Immunol. 7: 100-102). Было описано, что уровень экссудации альбумина в поврежденных областях кожи тесно связан с тяжестью состояний, даже в случае атопической экземы и контактного дерматита (David et al., 1990. Br.J.Dermatol. 122: 485-489; Wijsbek et al., 1991. Int. J.Microcirc. Clin. Exp.10: 193-204).
Было описано, что экссудация белков сыворотки, включающих в себя альбумин, была обнаружена даже в мокроте пациентов, страдающих от симптомов астмы и хронического обструктивного заболевания легких (Schoonbrood et al., 1994. Am.J.Respir. Crit. Care Med. 150:1519-1527; Anderson & Persson, 1988. Agents Actions Suppl. 23: 239-260), и также было описано, что в случае хронического кашля экссудация альбумина происходит без признаков эозинофилии (Pizzichini et al., 1999. Can. Respir. J. 6:323-330).
Экссудацию белков сыворотки индуцируют химические вещества, такие как метилсалицилат, фенол, кротоновое масло, бензалконий и т.д. (Patrick et al., 1985. Toxicol. Appl. Pharmacol. 81: 476-490); толуол, м-ксилол, циклогексан и т.д. (Iyadomi et al., 1998. Ind. Health 36:40-51). Для проведения исследования раздражения кожи в моделях на животных использовали 2,4-динитрофторбензол, и он также индуцирует экссудацию белков сыворотки (Nakamura et al., 2001. Toxical. Pathol. 29:200-207). Было описано, что все вещества, представляющие собой органические растворители, не приводят к экссудации белков сыворотки и уровни экссудации также варьируют в зависимости от структуры химических веществ. Экссудацию белков сыворотки легко индуцировать химическими веществами, обладающими ароматическими кольцами, однако на нее оказывают значительное влияние органические растворители, такие как ацетон.
С учетом того, что атопические заболевания возникают вследствие западных особенностей питания (Weiland et al., 1999. Lancet 353:2040-2041; von Mutis et al., 1998. Lancet 351:862-866; Dunder et al., 2001. Allergy 56:425-428), исследователи обратили внимание на изменения компонентов и содержание липидов, употребляемых людьми. С наступлением 1970-ых, некоторые исследователи обнаружили, что дисбаланс метаболизма человека возникает вследствие избыточного употребления ненасыщенных жирных кислот и транс-масел, которые являются основными компонентами растительного масла, которое вызывает усиление атопического заболевания.
В отличие от других тканей и органов в легких млекопитающих, включая человека, существуют различные фосфолипиды, обладающие очень высоким содержанием двунасыщенных жирных кислот, и находящийся на поверхности легких сурфактант обладает, в частности, очень высоким содержанием дипальмитоилфосфатидилхолина (DPPC). Известно, что этот компонент выполняет функцию снижения поверхностного натяжения в легких. Снижение поверхностного натяжения сурфактантом на поверхности легкого может облегчать дыхание при ингаляции воздуха в легкие и предотвращает склеивание стенок альвеол друг с другом или спадания их структуры при выдохе. Липидный компонент сурфактанта состоит приблизительно на 90% из фосфолипида (приблизительно 70% фосфолипида представляют собой двунасыщенный фосфолипид) и приблизительно на 10% из нейтрального жира (большая часть нейтрального жира представляет собой холестерин) (Reviews: Jon Goerke 1998. Biochem. Biophy. Acta. 1408:79-89; Veldhuizen et al., 1998. Biochim. Biophys. Acta. 90-108).
Одним из научных результатов, который следует дополнительно рассматривать в дополнение к описанным выше фактам, является каскад реакций для синтеза липидов сурфактанта в легких. Один факт состоит в том, что большая часть холестерина, находящегося в легком человека, доставляется из крови. Холестерин, синтезированный в легком, составляет только приблизительно 1%, и остальная часть холестерина должна быть доставлена из крови (Hass and Longmore, 1979. Biochim. Biophys. Acta 573:166-174). Известно, что фосфолипиды, составляющие большую часть сурфактанта легких, синтезируются и секретируются эпителиальными клетками II типа, однако большая часть жирных кислот, составляющих фосфолипиды, доставляется из VLDL (липопротеин очень низкой плотности) в крови (Rama et al., 1997. J. Clin. Invest. 99: 2020-2029).
SP-A (белок сурфактанта А) представляет собой один из основных белков, представленных в сурфактанте легких, который исследовали в течение последних 30 лет. Белок SP-A синтезируется и секретируется эпителиальными клетками II типа, находящимися в альвеолах, а также он представлен на поверхности тонкого кишечника, в евстахиевой трубе уха, в слезной жидкости и т.д. Его молекулярная масса составляет приблизительно 700 кДа (как определено в анализе посредством гель-фильтрации), и его 18 идентичных элементов, каждый из которых обладает молекулярной массой 32 кДа, собираются с образованием зрелого белка, выполняющего свою функцию. Известно, что этот белок обладает разнообразными биологическими функциями, однако их можно разделить, главным образом, на две группы. Первая функция представляет собой иммунологическую функцию, в соответствии с которой SP-А защищает легкие, связывая бактерии или вирусы, а также клещей домашней пыли, пыльцу и т.д., которые проникают в легкие при вдохе. Второй функцией является участие в поддержании гомеостаза сурфактанта в легком (Tino and Wright, 1998. Biochim. Biophys. Acta. 1408: 241-263; Haagsman, Biochim. Biophys. Acta. 1408: 264-277; Crouch & Wright, 2001. Annu. Rev. Physiol. 63:521-524; Haagsman and Diemel, 2001. Compar. Biochem. Physiol. 129: 191-108).
Описание изобретения
Таким образом, настоящее изобретение предназначено для решения проблем предшествующего уровня техники, и, таким образом, целью настоящего изобретения является предоставление композиции для лечения и/или для смягчения течения заболеваний, связанных с экссудацией белков сыворотки.
В целях осуществления указанной выше цели, настоящее изобретение относится к композиции, включающей в себя двунасыщенные фосфолипиды в качестве эффективных компонентов, для лечения или смягчения течения заболеваний, связанных с экссудацией белков сыворотки.
Двунасыщенные фосфолипиды по настоящему изобретению предпочтительно получают из животных, более предпочтительно из крупного рогатого скота и свиней и наиболее предпочтительно из их бронхиального альвеолярного смыва (лаважа) или их гомогенатов легочной ткани.
Также двунасыщенные фосфолипиды по настоящему изобретению предпочтительно представляют собой дипальмитоилфосфатидилхолин и/или дипальмитоилфосфатидилинозитол.
Также композиция по настоящему изобретению предпочтительно дополнительно включает в себя ионы кальция и органическую кислоту, содержащую карбоксильную группу(ы), где органическая кислота, включающая в себя карбоксильную группу(ы), предпочтительно включает в себя, но не ограничивается ими, метаболизируемую органическую кислоту, например молочную кислоту, янтарную кислоту, фумаровую кислоту или лимонную кислоту. Кроме того, композиция по настоящему изобретению, если необходимо, может дополнительно включать в себя дополнительные вещества, например глицерин. В композиции по настоящему изобретению двунасыщенные фосфолипиды предпочтительно представлены в концентрации от 1 до 700 мг/мл. Указанный выше диапазон концентраций является наиболее предпочтительным, поскольку двунасыщенные фосфолипиды оказывают слабый терапевтический эффект или эффект смягчения течения в концентрации 1 мг/мл или менее, и вследствие того, что высокая вязкость суспензии приводит к невозможности ее гомогенизации, их трудно использовать в концентрации 700 мг/мл или более.
Также настоящее изобретение относится к композиции для лечения кожных заболеваний, содержащих композицию по настоящему изобретению. Также настоящее изобретение относится к косметической композиции, содержащей композицию по настоящему изобретению.
Связанные с экссудацией сывороточных белков заболевания по настоящему изобретению включают в себя, но не ограничиваются ими, заболевания, выбранные из группы, состоящей из атопического дерматита, атопической экземы, кожного зуда, атопического воспаления носовой полости, атопической эритемы или эритродермы, контактного дерматита, астмы и хронического обструктивного заболевания легких, и т.д.
Ниже настоящее изобретение описано подробно.
Исходя из того, что атопические заболевания обладают общим симптомом, состоящим в том, что происходит экссудация белков сыворотки через кожу или слизистую оболочку вследствие снижения функционирования эндотелиально-эпителиального барьера, которое происходит вследствие повышенного захвата ненасыщенных жирных кислот и транс-масел, для настоящего изобретения использовали новую модель на животных. Было обнаружено, что если эмульгированное в физиологическом растворе экстрагированное из растений масло вводить интратрахеально в легкое мыши, у животного происходит экссудация белков сыворотки в легком. Также обнаружено, что симптом экссудации белков сыворотки можно уменьшить или ослабить посредством интратрахеального введения стабильных биологических компонентов - композиции, изобретенной в ходе этой работы, - которые полностью метаболизируются in vivo. Кроме того, также обнаружено, что композиция, содержащая двунасыщенные фосфолипиды, выделенные из легкого животного, ионы кальция в определенной концентрации и органическую кислоту, которая содержит карбоксильную группу(ы), благоприятно воздействует на пораженную область кожи пациентов с атопическими заболеваниями.
Для настоящего изобретения было обнаружено, что в бронхиальном альвеолярном смыве или гомогенате легкого здорового животного при агрегации белка SP-A в присутствии двухвалентных катионов с последующим центрифугированием после осаждения образуется уникальный слой, содержащий идеальное сочетание двунасыщенных фосфолипидов. Настоящее изобретение относится к способу, включающему в себя стадии удаления белков сурфактанта (особенно, растворимых в органическом растворителе белков SP-B и SP-C) и гидрофобных пептидов, которые могут вызывать иммунный ответ у человека, холестерина и ненасыщенных фосфолипидов из слоя после осаждения, с последующим получением идеального сочетания фракций двунасыщенных фосфолипидов, находящихся в здоровом легком животного. Исходя из открытий, что белок SP-A проявляет сильное неспецифичное гидрофобное взаимодействие в отсутствие двухвалентных катионов, требуется определенная концентрация ионов кальция, если композицию, содержащую фракцию двунасыщенных фосфолипидов, наносят на кожу или слизистую оболочку пациентов с атопическим заболеванием для ослабления или снижения экссудации белков сыворотки, а также органических кислот, имеющих карбоксильную группу(ы), которые могут метаболизироваться в клетке, например, для предотвращения агрегации двунасыщенных фосфолипидов при определенной концентрации ионов кальция в композиции дополнительно добавляют цитрат или лимонную кислоту.
Краткое описание чертежей
Эти и другие признаки, аспекты и преимущества предпочтительных вариантов осуществления настоящего изобретения более подробно описаны в представленном ниже подробном описании с учетом чертежей.
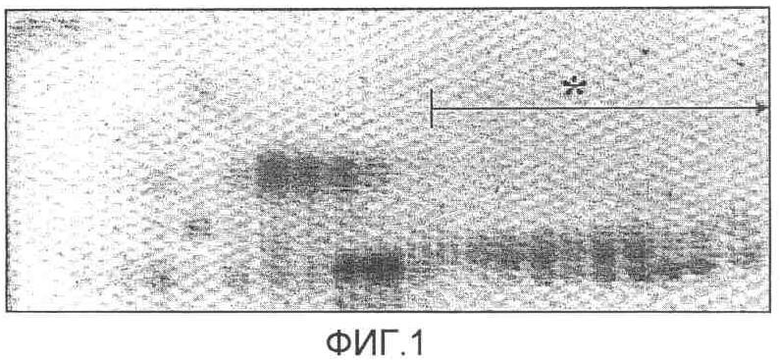
На фиг.1 представлена диаграмма, на которой показана визуализация с использованием TLC совокупных липидов, полученных из легкого животного.
На фиг.1 обозначением * указана фракция двунасыщенных фосфолипидов.
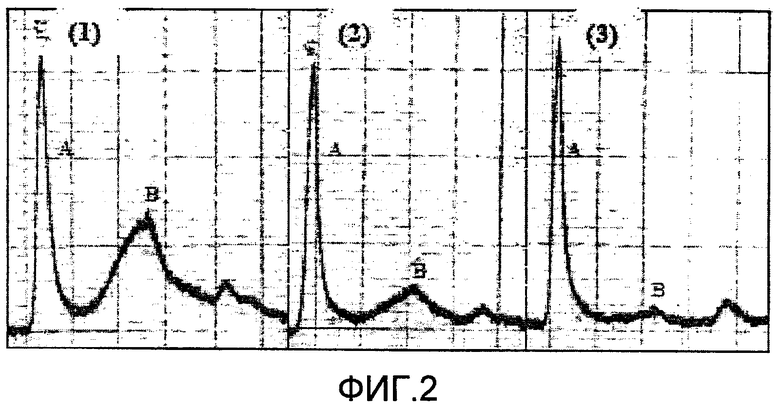
На фиг.2 представлена хроматографическая диаграмма, демонстрирующая результаты характера элюирования белков при каждом проведении колоночной хроматографии после индуцирования экссудации белков сыворотки в легком крысы с последующим ее ослаблением с помощью композиции. На фиг.2 на диаграмме 1 показан профиль белков легких у крысы, у которой экссудацию белков сыворотки индуцировали посредством введения эмульгированного в физиологическом растворе кукурузного масла в легкое крысы, на диаграмме 2 показан профиль белков легких после введения композиции крысе, у которой ранее была индуцирована экссудация белков сыворотки, и на диаграмме 3 представлен профиль белков легких контрольной крысы. А обозначает пик для белков, содержащих SP-A (молекулярная масса приблизительно 700 кДа), и В обозначает пик для белков, содержащих сывороточный альбумин (приблизительно 70 кДа). Уровень ослабления или снижения экссудации белков сыворотки оценивали посредством сравнения размеров двух пиков, А и В.
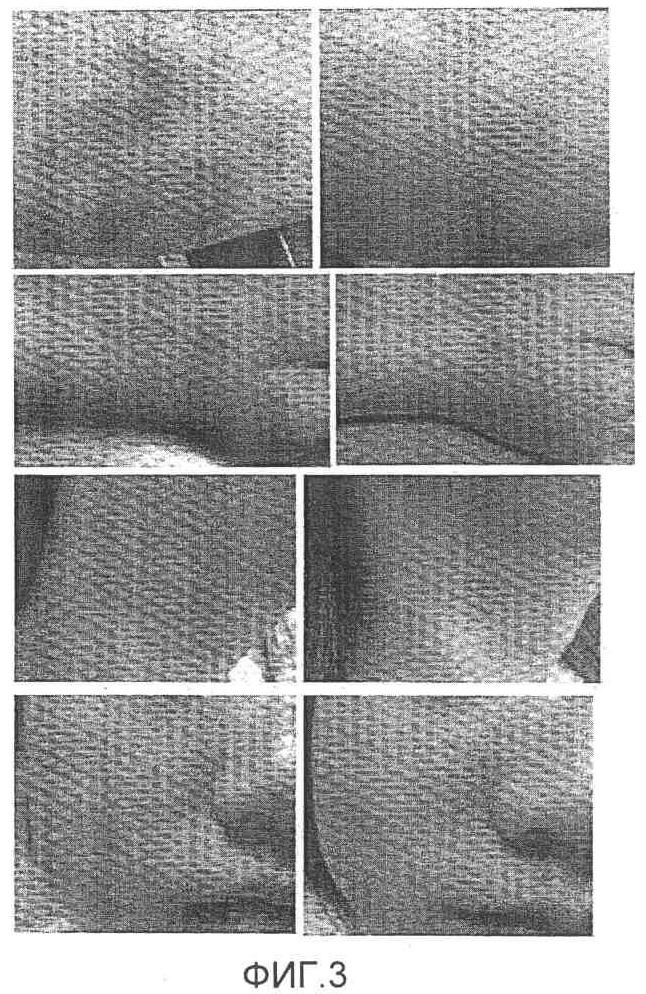
На фиг.3 представлена фотография, на которой показаны результаты после применения композиции при атопических кожных заболеваниях (от 2 до 4 недель). На левых частях фотографии показано состояние кожи до нанесения композиции. На правых частях фотографии показаны результаты после применения композиции. Применение композиции проводили в течение периода времени от 2 до 4 недель, на верхней фотографии представлен пациент, страдающий атопической экземой, на второй сверху фотографии показан пациент, страдающий атопическим дерматитом, включающим в себя изъязвление кожи, на третьей сверху фотографии представлен пациент, страдающий атопической эритемой, и на нижней фотографии показан пациент, страдающий атопическим дерматитом.
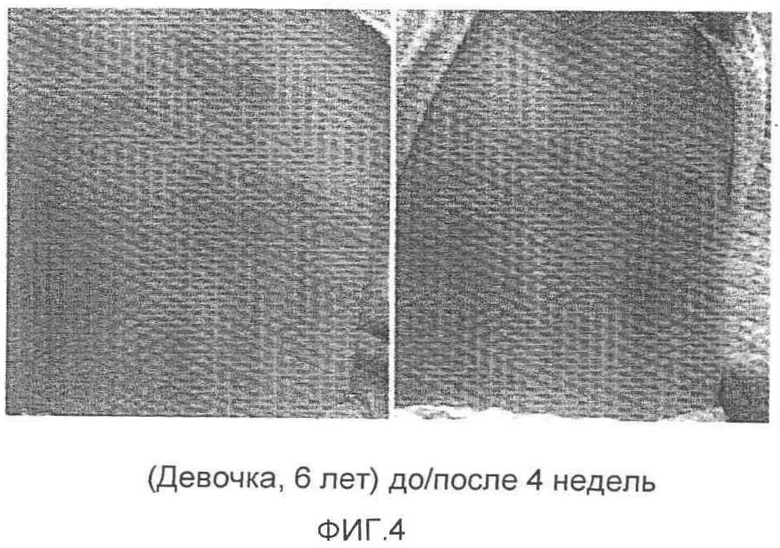
На фиг.4 представлена фотография, на которой показан результат до/после применения композиции. Этот результат показан на фотографиях, полученных до применения композиции при атопическом кожном заболевании, развившемся на спине девочки в возрасте 6 лет (слева), и после применения композиции при атопическом кожном заболевании в течение 4 недель (справа).
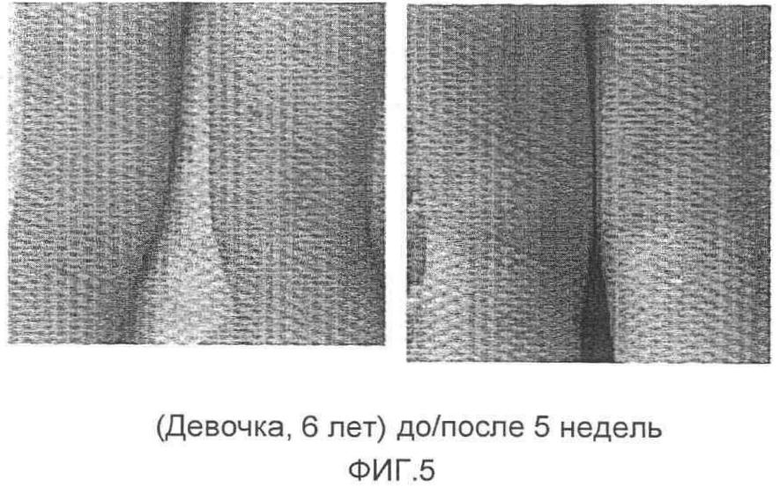
На фиг.5 представлена фотография, на которой показан результат до/после применения композиции. Этот результат показан на фотографиях, полученных до применения композиции при атопическом кожном дерматите, включающем в себя изъязвление кожи, развившемся в подколенной области колена девочки в возрасте 6 лет (слева) и после применения композиции при атопическом кожном дерматите в течение 5 недель (справа).
На фиг.6 представлена фотография, на которой показан результат до/после применения композиции. Этот результат показан на фотографиях, полученных до применения композиции при общем атопическом кожном заболевании, развившемся в подколенной области колена женщины в возрасте 16 лет (слева) и после применения композиции при атопическом кожном заболевании в течение 3 недель (справа).
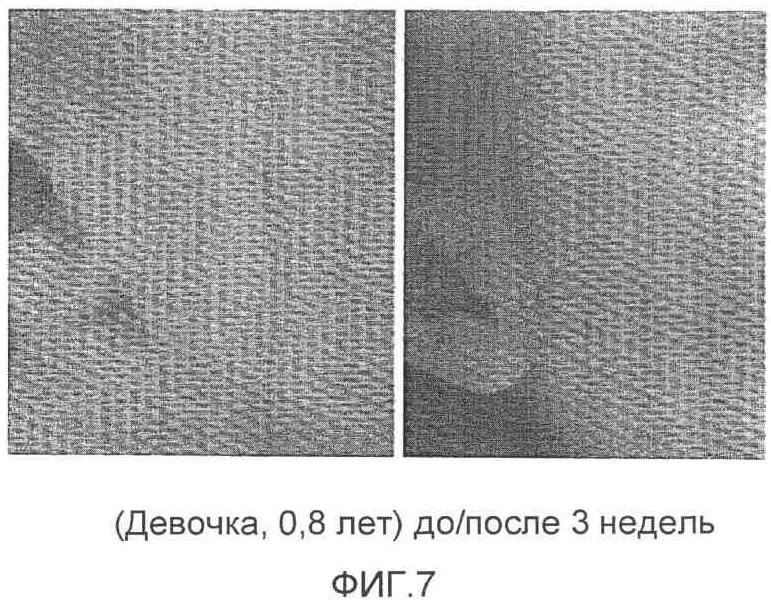
На фиг.7 представлена фотография, на которой показан результат до/после применения композиции. Этот результат показан на фотографиях, полученных до применения композиции при атопическом кожном заболевании на ранней стадии, развившемся на лице 10-месячной девочки (слева) и после применения композиции при атопическом кожном заболевании в течение 3 недель (справа).
Предпочтительные варианты осуществления изобретения
Ниже в настоящем описании на основании предпочтительных вариантов осуществления настоящее изобретение описано более подробно (см. также фиг. 8-12). Однако следует понимать, что представленное здесь описание представляет собой только предпочтительный пример исключительно в целях иллюстрации, и оно не предназначено для ограничения объема этого изобретения.
Пример 1: экстракция фракции двунасыщенных фосфолипидов из бронхиального альвеолярного смыва свиньи
(1) Способ получения бронхиального альвеолярного смыва
Легкое, полученное от здоровой свиньи, промывали посредством введения в легкое осмотического физиологического раствора, содержащего 5 мМ хлорид кальция (СаСl2). Промывание проводили при комнатной температуре посредством введения приблизительно 0,6 л раствора в одно легкое с использованием нагнетательного насоса, с последующим сбором смыва, который выделялся из легкого. Промывание проводили 15 л физиологического раствора на легкое. Собранный бронхиальный альвеолярный смыв сразу помещают на баню лед-вода и охлаждают.
(2) Способ получения осажденной фазы сурфактанта из бронхиального альвеолярного смыва с использованием процесса агрегации.
По мере того, как бронхиальный альвеолярный смыв, включающий в себя ионы кальция (5 мМ), держали в бане с ледяной водой в течение 1 часа, начинала происходить агрегация белка SP-А с липидами сурфактанта. Этот раствор центрифугировали на центрифуге (Component-R, Hanil, Republic of Korea) с функцией вращения с низким ускорением. Раствор центрифугировали при 4°С в течение 35 минут с центробежной силой 4500 g. После центрифугирования осадок образует три отдельных слоя. Небольшое количество нижнего слоя содержит клетки и нерастворимые и/или денатурированные белки, и большое количество промежуточного слоя и небольшое количество верхнего слоя содержит как липиды сурфактанта, так и белки сурфактанта, которые требуются для этого изобретения. Промежуточный и верхний слои осадка собирали и проводили экстракцию органическим растворителем с получением фракции двунасыщенных фосфолипидов.
(3) Первичная экстракция органическим растворителем
К смеси поверхностно-активных белков и липидов сурфактанта, полученных на предыдущей стадии, добавляли 2-кратный объем дистиллированной воды, а затем смесь суспендировали. К образцу добавляли такой же объем смешанного растворителя (объемное соотношение 2:1) из хлороформа и метанола и перемешивали при 30°С в течение 30 минут. Образец центрифугировали в течение 15 минут с центробежной силой 1000 g, а затем собирали слой органического растворителя для последующего процесса выделения.
(4) Экстракция фракции двунасыщенных фосфолипидов с использованием колоночной хроматографии с диоксидом кремния
Из образца, полученного при первичной экстракции с органическим растворителем, выпаривали растворитель с использованием ротационного вакуумного испарителя (Eyela, Japan), а затем образец повторно растворяли в хлороформе. Образец помещали в колонку, имеющую отношение диаметра к высоте 1:5, заполненную диоксидом кремния (Merck, с размером пор 230-400). Перед нанесением образца на колонку колонку с диоксидом кремния предварительно промывали чистым хлороформом. Для того чтобы избавиться от холестерина и поверхостно-активных белков, которые являются растворимыми в органическом растворителе, особенно в ацетоне, и для получения фракции двунасыщенных фосфолипидов использовали системы растворителей в следующем порядке: после помещения образца в хлороформ: чистый хлороформ - чистый ацетон - чистый хлороформ - смешанный растворитель хлороформ:метанол (объемное соотношение 9:1)-смешанный растворитель хлороформ:метанол (объемное соотношение 4:1) и смешанный растворитель хлороформ:метанол:вода (объемное соотношение 8:6:1) в качестве конечного растворителя. Растворимые в органическом растворителе поверхностно-активные белки и гидрофобные пептиды элюировали на ранней стадии работы колонки при промывании колонки растворителем из чистого ацетона и чистого хлороформа, и фракцию двунасыщенных фосфолипидов, которая требуется для настоящего изобретения, элюировали с помощью последней системы растворителей. Каждый фосфолипидный компонент фракций идентифицировали с использованием 2D-TLC (2-мерной тонкослойной хроматографии) с использованием стандартных липидов (коммерчески доступных от Sigma) (фиг.1). Основными компонентами экстрагированных двунасыщенных фосфолипидов были дипальмитоилфосфатидилхолин и дипальмитоилфосфатидилинозитол.
(5) Дополнительная обработка экстрагированных фракций двунасыщенных фосфолипидов
Экстрагированный из колонки конечный образец пропускали через 3-слойную ватмановскую фильтровальную бумагу №1, а затем с использованием ротационного вакуумного испарителя удаляли растворитель. К не содержащему растворитель образцу добавляли чистый этанол, а затем фильтровали с использованием фильтра PVDF (поливинилиденфторид, размер пор 0,22 мкм, Millipore). Этанол снова выпаривали с использованием испарителя. Промывание образца этанолом проводили 2 раза. Следовое количество оставшегося этанола удаляли с использованием лиофильной сушилки. Порошковую форму двунасыщенных фосфолипидов хранили при -70°С в герметичном контейнере, заполненном газоообразным азотом.
Пример 2: экстракция фракции двунасыщенных фосфолипидов из бронхиального альвеолярного смыва крупного рогатого скота
Повторяли способ для стадий (1)-(5), описанных в примере 1, с получением фракции двунасыщенных фосфолипидов из бронхиального альвеолярного смыва крупного рогатого скота за исключением того, что вместо свиньи использовали крупный рогатый скот.
Пример 3: способ получения фракции двунасыщенных фосфолипидов из гомогената ткани легкого здоровой свиньи
(1) Первичная гомогенизация ткани легкого животного
150 г ткани легкого, полученной от здоровой свиньи, нарезали до размера приблизительно 2 см×2 см. К нарезанным фрагментам легкого добавляли 700 мл охлажденного осмотического физиологического раствора, содержащего 3 мМ двухвалентных положительных ионов (хлорид кальция), а затем гомогенизировали с помощью измельчителя с металлическими лезвиями. Гомогенизацию проводили 6 раз при низкой скорости вращения, каждый раз в течение 20 секунд. В процессе гомогенизации измельчитель часто охлаждали с использованием бани с ледяной водой, чтобы предотвратить повышение температуры. Ткани легкого нарезали приблизительно до размера боба без полной гомогенизации на ранней стадии.
(2) Способ удаления сыворотки из первичного гомогената без потери липидов сурфактанта
Первичный гомогенат, полученный таким способом, держали в течение 1 часа на бане с ледяной водой для обеспечения легкой экссудации сыворотки из гомогенизированной ткани, обладающей большой площадью поверхности, и одновременно для обеспечения агрегации компонентов сурфактанта в присутствии двухвалентных ионов (ионы кальция, 3 мМ). Гомогенат держали в течение 1 часа, а затем центрифугировали при 4°С в течение 40 минут с центробежной силой 4500 g с использованием центрифуги с функцией вращения с низким ускорением. После центрифугирования удаляли раствор, содержащий сыворотку, за исключением осадка и плавающих примесей (часть ткани легкого размером с маленький боб, гомогенизированная не полностью, вследствие того, что она включает в себя воздух).
(3) Вторичная гомогенизация ткани легкого и осаждение липидов сурфактанта
К не содержащему сыворотки первичному гомогенату ткани легкого добавляли 500 мл 75 мМ раствора хлорида натрия (половинная концентрация физиологического раствора), содержащего 5 мМ двухвалентные положительные ионы (ионы кальция), а затем ткань каждую минуту гомогенизировали с помощью измельчителя с металлическими лезвиями. В этом процессе использовали гипотонический раствор, легко получая многослойные структуры, которые выполняют функцию резервуара липидов сурфактанта, находящихся внутри эпидермальных клеток II типа в альвеолах. Гомогенизацию проводили от 6 до 8 раз при высокой скорости вращения, каждый раз в течение 40 секунд, и измельчитель часто охлаждали с использованием бани с ледяной водой, чтобы предотвратить повышение температуры в ходе процесса гомогенизации. Вторично гомогенизированный образец держали при 4°С в течение 1 часа для предотвращения коагуляции свертывающих белков крови и в то же время для обеспечения агрегации белка SP-А с липидами сурфактанта в присутствии ионов кальция. Образец центрифугировали при 4°С в течение 40 минут с центробежной силой 4500 g с использованием центрифуги с функцией вращения с низким ускорением. После центрифугирования образец формирует два отдельных слоя, которые отчетливо отличаются по цвету и структуре. Супернатант из слоя осажденной фазы отдельно отбирали и для фракционирования двунасыщенных фосфолипидов подвергали процессу экстракции органическим растворителем. Определенное количество липидов сурфактанта, объединенных в нижнем слое центрифужных пробирок, можно было экстрагировать при повторном добавлении физиологического раствора, содержащего 5 мМ ионов кальция, добавленных к нижнему слою, и путем повторного суспендирования с последующим центифугированием таким же способом, как описано выше. Повторно сформированный верхний слой осажденной фазы собирали и объединяли с полученным ранее образцом, а затем подвергали процессу экстракции органическим растворителем.
(4) Способ получения фракции двунасыщенных фосфолипидов
Повторяли способ на стадиях (3)-(5), описанных в примере 1, с получением фракции двунасыщенных фосфолипидов из гомогената ткани легкого.
Пример 4: способ получения фракции двунасыщенных фосфолипидов из гомогената ткани легкого здорового крупного рогатого скота
Повторяли способ, описанный в примере 3, с получением фракции двунасыщенных фосфолипидов из бронхиального альвеолярного смыва крупного рогатого скота, за исключением того, что вместо свиньи использовали крупный рогатый скот.
Экспериментальный пример 1: эксперимент на животных
1-1. Индукция экссудации белков сыворотки в легком животного.
Кукурузное масло (коммерчески доступное от Sigma Co.) и физиологический раствор стерилизовали с использованием автоклава. Смешивали 500 мкл (микролитров) кукурузного масла и 1500 мкл физиологического раствора, а затем сильно встряхивали до получения гомогенной суспензии. Суспензию интратрахеально вводили в легкие взрослых крыс Sprague-Dawley для индукции экссудации белков сыворотки в легком. В целях исследования эффекта плацебо контрольным крысам интратрахеально вводили только стерильный физиологический раствор. Через 2 недели после введения крысам из групп проводили анестезию с использованием анестетика кетамина (Yuhan Co. Ltd., republic of Korea), а затем сразу умерщвляли с использованием газообразного диоксида углерода. Легкие получали сразу после умерщвления экспериментального животного и легкое промывали физиологическим раствором (содержащим 3 мМ хлорид кальция) в общем количестве 50 мл для сбора бронхиального альвеолярного смыва от каждого животного.
1-2. Тестирование эффекта применяемых компонентов композиции на ослабление или уменьшение экссудации белков сыворотки.
Экссудацию белков сыворотки индуцировали у животных таким же способом, как описано выше, а затем через 1 неделю после индукции процесса экссудации белков сыворотки интратрахеально вводили композиции, содержащие фракцию двунасыщенных фосфолипидов, полученную, как в примерах с 1 по 4. Извлечение легкого и бронхиального альвеолярного смыва из экспериментальных животных проводили через 1 неделю после интратрахеального введения композиций.
Введенная крысам композиция для ослабления или уменьшения экссудации белков сыворотки в легком представляла собой двунасыщенные фосфолипиды в концентрации 30 мг/мл, 1,5 мМ хлорид кальция, 7,5 мМ цитрат (тринатриевая цитратная соль) и 125 мМ хлорид натрия, и значение рН раствора было доведено до 6,0. Перед введением животному раствор сильно встряхивали с получением гомогенной суспензии.
1-3. Анализ индукции и ослабления экссудации белков сыворотки у тестируемых животных.
(1) Получение образцов от всех экспериментальных животных
Бронхиальные альвеолярные смывы, полученные от животных каждой экспериментальной группы, центрифугировали при 4°С в течение 30 минут с центробежной силой 4500 g с использованием центрифуги с функцией вращения с низким ускорением. Из осадка отбирали только слой сурфактанта, агрегированного в присутствии ионов (ионов кальция) с SP-A. К отобранному осадку добавляли приблизительно 3-кратный объем физиологического раствора (включающий в себя 3 мМ хлорид кальция) и осадок снова центрифугировали. Суспензию центрифугировали с такой же центробежной силой с получением осадка. Процесс промывания, описанный выше, повторяли два раза для очистки осадка с использованием того же раствора. Суспензию конечного осадка разделяли в 1-миллилитровые маленькие центифужные пробирки и объем осадка доводили до 200 мкл.
К 200 мкл описанного выше осадка сурфактанта добавляли 1 мл буферизованного посредством 10 мМ Tris физиологического раствора (рН 7,4, 10 мМ Tris-HCl, 140 мМ NaCl), содержащего 10 мМ ЭДТА (этилендиаминтетрауксусную кислоту), а затем осадок суспендировали в растворе. К раствору по каплям добавляли цвиттер-ионный детергент CHAPS (Amresco, USA) при осторожном встряхивании до растворения суспензии посредством CHAPS. В целях растворения образца использовали маточный раствор CHAPS в концентрации 10% (мас./об., приблизительно 162 мМ), и конечная концентрация CHAPS в образце составляла приблизительно 65 мМ.
(2) Анализ
От каждого образца (2 мл), полученного в ходе описанного выше процесса, отбирали 1 мл образец и наносили на хроматографическую колонку, заполненную смолой Sephacry S-400HR (1,5 см×20 см, Amersham Bioscience) для анализа характера элюирования белков. Гель-фильтрацию проводили с использованием GradiFrac (Pharmacia). В то же время буферный раствор, используемый при проведении хроматографии в качестве подвижного буфера, представлял собой 10 мМ буферный раствор Tris (pH 7,4), включающий в себя 5 мМ ЭДТА, 1 мМ CHAPS и 140 мМ NaCl. Уровень экссудации белков сыворотки и уровень снижения белков определяли соответственно посредством сравнения размера (величины) пика для SP-A в области молекулярной массы 700 кДа с размером пика для альбумина в области молекулярной массы 70 кДа из графика УФ-поглощения белков, элюированных из колонки (см. фиг.2).
1-4. Результаты эксперимента на животных.
Исходя из графика характера элюирования белков для образцов, полученных от группы тестируемых крыс, у которых индуцировали экссудацию белков сыворотки, для образцов от крыс, у которых экссудацию белков сыворотки ослабляли посредством введения композиция, для образцов, полученных от крыс, которым вводили только физиологический раствор, и для образцов, полученных от крыс, которым введение не проводили, вычисляли соотношения размеров пиков для белков в области молекулярной массы 700 кДа и размеров пиков для белков в области молекулярной массы 70 кДа соответственно. Соотношения размеров двух пиков (величины), полученные от групп крыс, представлены в следующей ниже таблице.
Исходя из полученных результатов, представленных в таблице 1, было обнаружено, что композиции, содержащие фракцию двунасыщенных фосфолипидов, экстрагированных из бронхиального альвеолярного смыва и из гомогената ткани легкого здорового животного, в качестве основного компонента снижают экссудацию сывороточных белков у тестируемых крыс. Размер пика для белков, содержащих альбумин в качестве основного белка, был снижен приблизительно на 50%, если композицию вводили интратрахеально только один раз, по сравнению с результатами для крыс, у которых индуцировали экссудацию белков сыворотки. Такое сниженное количество, показанное в таблице, отражает значение, вычисленное только исходя из ряда критериев гель-фильтрации.
Однако действительное снижение количества экссудата значительно выше, чем вычисленное значение, представленное в таблице 1. Причина этого заключается в том, что в среднем получают 2-3 мл осадка (объем/животное), главным образом, если образцы бронхиального альвеолярного смыва получены от нормальных крыс, однако количество осадка, полученного от крыс, у которых индуцировали экссудацию сывороточного белка, было от 3 до 5 раз выше, чем количество от нормальных крыс, хотя количество осадка может широко варьировать в зависимости от субъектов. Однако количества осадков от крыс, у которых экссудацию белков сыворотки ослабляли посредством композиции по настоящему изобретению, были практически одинаковыми или были больше максимально в 2 раза, чем количества осадка, полученного от контрольных крыс. Таким образом, было показано, что композиция по настоящему изобретению значительно снижает общее количество осадка по сравнению с осадком, полученным от крыс, у которых индуцировали экссудацию белка. Однако эти значения не представлены здесь количественно, поскольку количества осадка, получаемого от тестируемых крыс, может значительно варьировать в зависимости от экспериментальных факторов, таких как экспериментальная температура, пластичность тканей легкого, способностей исследователя и т.д. Таким образом, снижение белков сыворотки, представленное на фиг.2 и в таблице, не отражает общего количества белков. Оно показывает только соотношение между размерами пика для SP-A и размерами пика для сывороточных альбуминов как основных белков фракции. Поскольку измеряли общие количества белков сыворотки, снижаемые посредством композиции по настоящему изобретению (см. В на фиг.2(2)), можно обнаружить, что в действительности снижение уровня является очень значительным.
Исходя из представленных выше результатов было обнаружено, что наиболее идеальная композиция двунасыщенных фосфолипидов для ослабления или снижения экссудации белков сыворотки представляла собой композицию, выделенную из бронхиального альвеолярного смыва здорового животного. Однако фракция двунасыщенных фосфолипидов, полученная из гомогената обескровленной ткани легкого, в результате также проявляла практически такой же уровень ослабления экссудации белков сыворотки.
Экспериментальный пример 2: тестирование на добровольцах с атопическим кожным заболеванием
2-1. Нанесение используемой композиции на кожу.
(1) Композиция
В тесте использовали фракцию двунасыщенных фосфолипидов, полученную способом гомогенизации легкого свиньи с использованием процесса агрегации сурфактанта посредством двухвалентных положительных ионов (ионов кальция) и отфильтрованную через фильтр PVDF (поливинилиденфторид, размер пор 0,2 мкм, Millipore) с размером пор 0,22 мкм. Фракцию лиофилизировали. Высушенные двунасыщенные фосфолипиды в определенной концентрации эмульгировали в изоосмотическом физиологическом растворе, а затем автоклавировали. Также автоклавировали маточный раствор хлорида кальция, маточный раствор цитрата (тринатриевая цитратная соль) и глицерин соответственно. Все стерилизованные компоненты (раствор) смешивали в асептических условиях до концентрации двунасыщенных фосфолипидов 15 мг/мл, 1,5 мМ ионов кальция, 7,5 мМ цитрата (тринатриевой цитратной соли) и 10% (соотношение объем/объем) глицерина с рН 6,0. Глицерин добавляли в количестве 10% от общей концентрации для обеспечения вязкости (или клейкости) раствора, чтобы двунасыщенные фосфолипиды могли легко распространяться на коже при механическом усилии в процессе нанесения на кожу. Смешанные компоненты интенсивно встряхивали с получением гомогенной суспензии и затем далее использовали.
(2) Применение
Нанесение на кожу проводили капельно (приблизительно 30 мкл) в виде раствора (описанного выше) на каждые 2 см×2 см поврежденной поверхности кожи с последующим осторожным втиранием раствора до его полной адсорбции на кожу. Рекомендуют, чтобы раствор наносили по меньшей мере 2 раза в сутки. Также рекомендуют, чтобы в течение периода нанесения композиции не использовали косметических средств или мыла с сильным запахом, которые содержат химические вещества, имеющие ароматическое кольцо(а).
2-2-1. Результаты эксперимента на первых добровольцах (наблюдение невооруженным глазом).
Тесты на добровольцах проводили на 15 участках кожи 8 добровольцев (в возрасте от 5 до 40 лет, средний возраст 33 года, 4 мужчины и 4 женщины), страдающих атопическими кожными заболеваниями. Нанесение композиции на кожу проводили в течение периода времени от 2 до 4 недель, где период определяли как по тяжести, так и по улучшению кожных состояний. Было обнаружено, что в процессе периода нанесения происходило улучшение симптомов атопических кожных заболеваний у всех тестируемых добровольцев до такой степени, что трудно было различить границы ранее поврежденных участков кожи.
Наблюдали, что на коже приблизительно через 3 суток после нанесения композиции не происходило повторного образования струпьев, образованных вследствие атопических заболеваний кожи при высыхании экссудатов. В случае добровольцев с атопической эритемой симптом исчезал настолько, что край поврежденного вследствие атопического кожного заболевания участка кожи нельзя было различить через 1 неделю после нанесения композиции. Было подтверждено, что раны полностью заживали через 3,5 недели (приблизительно 25 суток) после нанесения композиции в случае пациентов с осложнениями в виде гангрены кожи (изъязвление кожи) (см. фиг.3).
2-2-2. Результаты экспериментов на второй группе добровольцев (наблюдение невооруженным глазом).
Другие тесты на добровольцах проводили с участием 27 добровольцев (в возрасте от 0,8 до 42 лет, средний возраст 23,4 года, 13 мужчин и 14 женщин), страдающих атопическими кожными заболеваниями. Нанесение композиции на кожу проводили в течение периода от 2 до 5 недель. Улучшение симптомов атопических кожных заболеваний произошло у 25 добровольцев, за исключением 5 добровольцев, в той степени, что трудно было отличить границы исходной области пораженной кожи. У 2 пациентов с осложнением атопического кожного заболевания и симптомом тяжелого воспаления сальной железы на лице и спине соответственно не было показано значительного улучшения состояния. У 3 добровольцев, которые обладали очень толстым ороговением кожи в результате очень длительной болезни атопическим кожным заболеванием, было показано небольшое улучшение состояния кожи в процессе периода применения. У 3 из 25 добровольцев, у которых произошло явное улучшение симптомов, необходимо было проведение лечения антибактериальной мазью в процессе нанесения композиции вследствие того, что у них была выявлена кожная инфекция и самостоятельно у пациентов инфекция не проходила. Фотографии, демонстрирующие результаты улучшения состояния кожи, представлены на фиг.4-7.
Экспериментальный пример 3: действие кальция и органической кислоты, добавленных к композиции по настоящему изобретению.
Для определения действия ионов кальция и органической кислоты в композиции на лечение атопических заболеваний, получали композиции с различным составом и наносили их на поврежденные участки пациентов с атопическим заболеванием. Пациентов отбирали при условии, что тяжесть заболевания у них является схожей как на руках, так и на ногах и использовали их для исследования. Участки тела, пораженные атопическим заболеванием, наблюдали невооруженным глазом.
3-1. Получение композиций, имеющих различный состав.
Автоклавировали раствор, в котором заключительную лиофилизированную фракцию двунасыщенных фосфолипидов эмульгировали в дистиллированной воде, раствор цитрата тринатриевой соли/лимонная кислота (маточный раствор, рН=6), стандартный раствор CaCl2 и глицерин. После автоклавирования каждый из компонентов смешивали с получением композиций со следующими концентрациями.
Основная композиция (полная) по настоящему изобретению: 20 мг/мл высушенного фосфолипида, 1,5 мМ CaCl2, 7,5 мМ цитрат/лимонная кислота, 10% (об/об.) глицерина.
Контроль 1 (без цитрата): 20 мг/мл высушенного фосфолипида, 1,5 мМ CaCl2, 10% (об./об.) глицерина.
Контроль 2 (без Са): 20 мг/мл высушенного фосфолипида, 7,5 мМ цитрат/лимонная кислота, 10% (об./об.) глицерина.
Для каждой из композиций рН доводили до 6,0.
3-2. Способ нанесения и пациенты.
Отбирали пациентов, у которых тяжесть атопического заболевания была схожей на руках и на ногах, и наносили Контроль 1 (без цитрата) или Контроль 2 (без Са) на правую пораженную часть пациента, а полную композицию по настоящему изобретению наносили на левую часть. По одной капле (приблизительно 30 мкл) композиции наносили на пораженные участки размером 2 см на 2 см и растирали до тех пор, пока композиция не будет равномерно распределена. Рекомендуется наносить композицию от двух до четырех раз в день и в случае, если заболевание связано с другой инфекцией, каждую из композиций наносили на кожу и впоследствии наносили фузицидиновую кислоту (название продукта: Фузидин, Dong-Wha Pharmaceutical Industrial Co Ltd).
Семь пациентов участвовали в сравнительном испытании Контроля 1 (без цитрата) и им было в среднем 10,4 лет (5-15 лет, пять мальчиков и две девочки). Трое участвовали в исследовании Контроля 2 (без Са) и им было в среднем 11,6 лет (от 7 до 15 лет, двое мальчиков и одна девочка). Исследование действия компонентов осуществляли в течение одной недели.
3-3. Результаты и выводы.
(1) Сравнение между действием Контроля 1 (без цитрата) и полной композицией по настоящему изобретению.
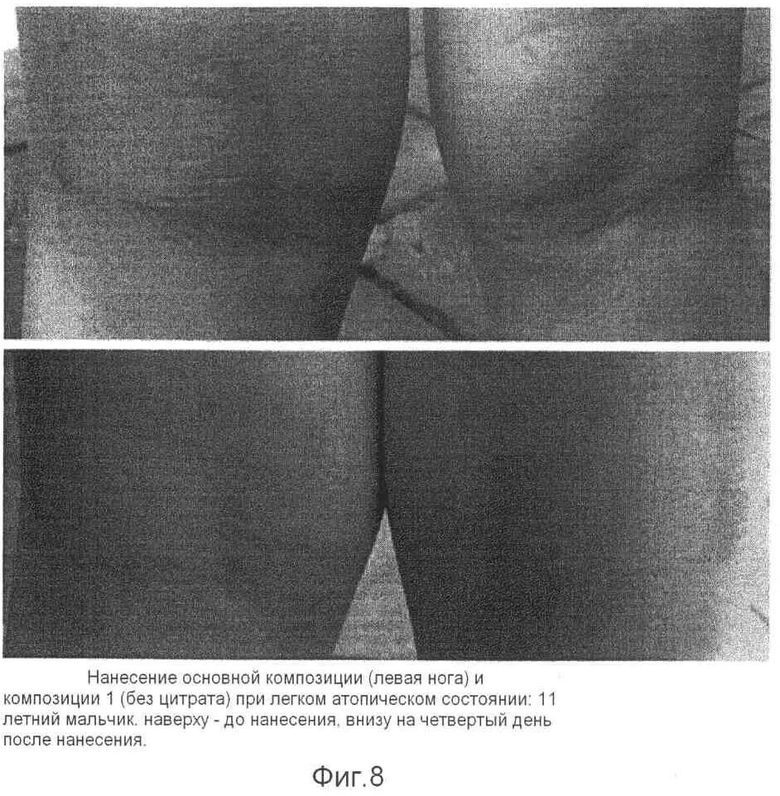
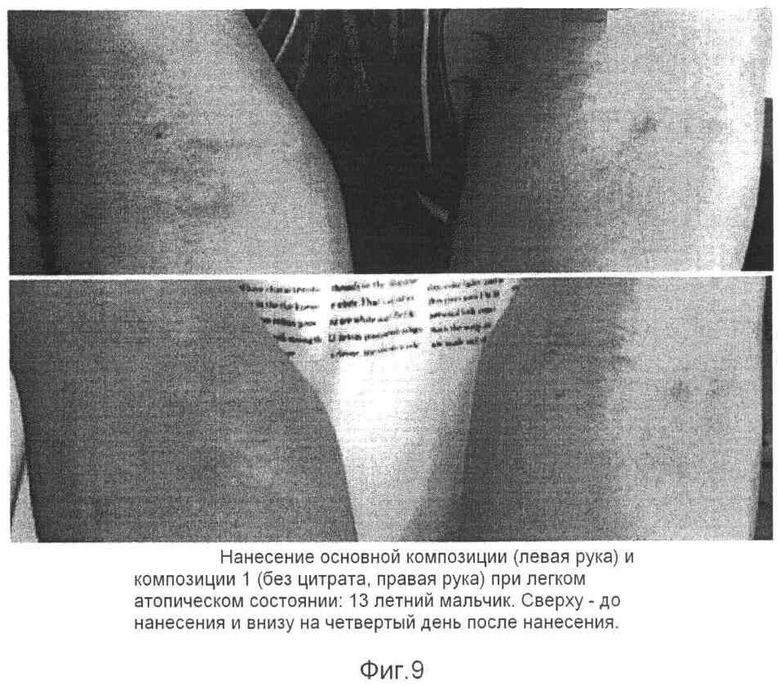
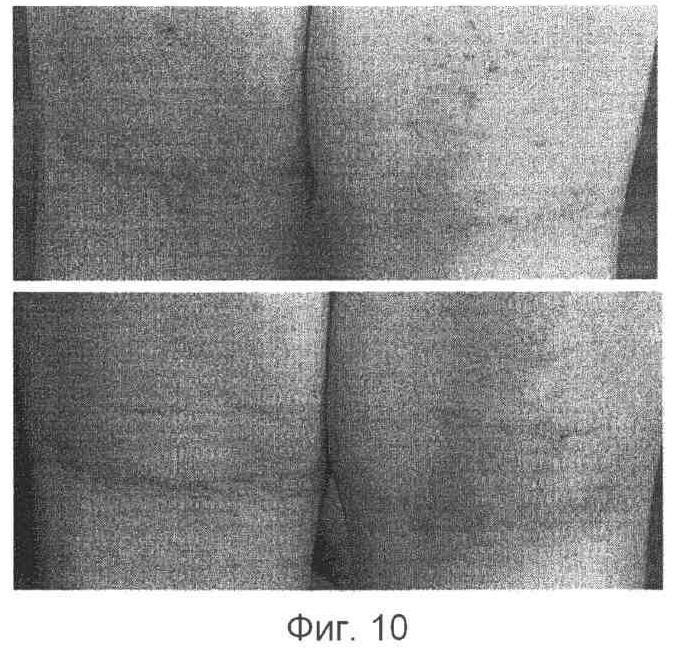
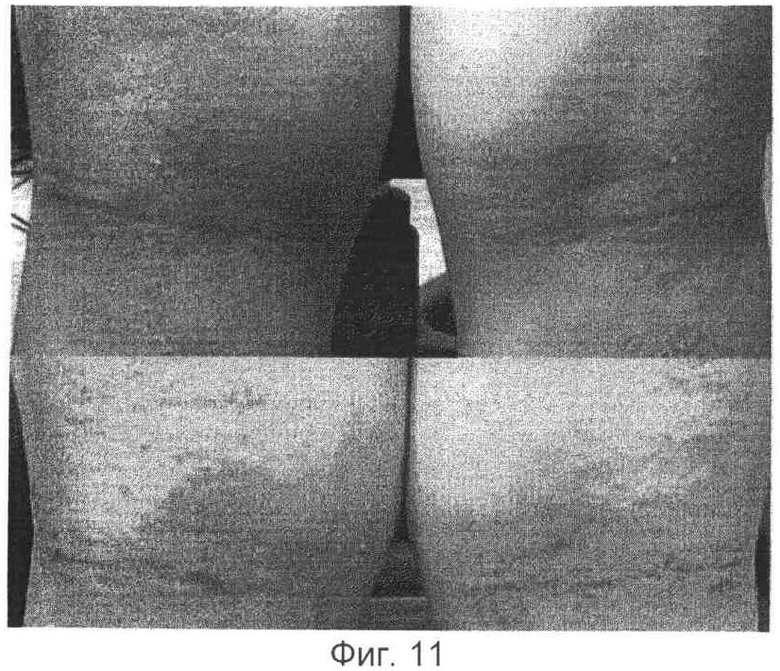
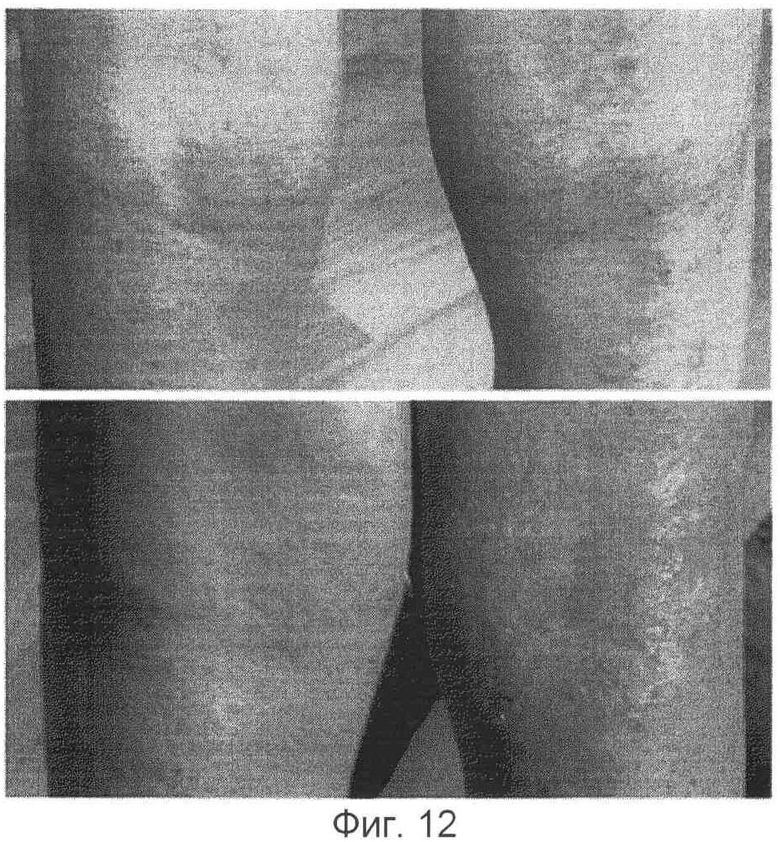
Композицию контроля 1 без лимонной кислоты/цитрата наносили на правую часть, пораженную атопическим заболеванием, а композицию, содержащую кальций и лимонная кислота/цитрат по настоящему изобретению наносили на левую часть, пораженную атопическим заболеванием кожи для сравнения действия каждой из композиции. В результате было установлено, что терапевтическое действие каждой из двух композиций было более ярко выражено, по мере того как атопическое заболевание кожи становилось более тяжелым. В случае легкого атопического дерматита на первый взгляд обе композиции демонстрировали надлежащее терапевтическое действие, однако у испытуемых (6 из 7 пациентов), которым наносили на правую часть композицию контроля (Композиция 1), обнаруживали очаг раздражения (зуд) (см. фиг.8-12).
(2) Сравнение действия контроля 2 (без Са) и полной композиции по изобретению.
Композицию контроля (Композиция 2), полученную добавлением фосфолипида и лимонной кислоты за исключением ионов кальция к полной композиции, наносили на правую часть, пораженную атопическим заболеванием, а полную композицию наносили на левую часть поврежденной атопическим заболеванием кожи. В результате было установлено, что Композиция 2 обладает сильно выраженным раздражающим действием на кожу. Через 2-3 часа после ее нанесения на кожу все испытуемые (3 из 3) пациентов жаловались на сильный зуд на месте нанесения. Сравнительное исследование было немедленно остановлено в виду многочисленных жалоб со стороны испытуемых.
3) Заключение.
В то время как двунасыщенный фосфолипид напрямую наносили на ткани в ожидании надлежащего терапевтического действия на атопическое заболевание кожи, наличие органических кислот, содержащих карбоксильную группу, такую как цитрат, является необходимостью, чтобы двунасыщенный фосфолипид не мог связываться кальцием и легко наноситься на ткани без изменения концентрации кальция, обязательно присутствующем в тканях. В частности, отмечается, что цитрат играет ключевую роль в облегчении патологического состояния, обусловленного поступлением ненасыщенных жирных кислот в избытке, поскольку цитрат предотвращает фосфолипидные молекулы от агрегирования их ионами кальция, а также регулирует синтез жирных кислот в цитоплазме.
Промышленная применимость
Как описано выше, композиция, содержащая двунасыщенные фосфолипиды, по настоящему изобретению оказывает значительный эффект в отношении лечения или смягчения симптомов атопических заболеваний и т.д., вызванных экссудацией белков сыворотки в коже и слизистой оболочке.

Изобретение относится к композиции для снижения экссудации белков сыворотки, а именно к композиции, способной вызывать улучшения при таких состояниях, как атопический дерматит, атопическая экзема, кожный зуд, атопическое воспаление полости носа, атопическая эритема или эритродерма, контактный дерматит, астма, хроническое обструктивное заболевание легких и т.д. посредством снижения экссудации белков сыворотки в коже и слизистой оболочке. 3 з. и 6 н.п. ф-лы, 12 ил.
1. Композиция для лечения и смягчения течения заболеваний с признаками экссудации белков сыворотки, содержащая двунасыщенные фосфолипиды, ионы кальция и органическую кислоту(ы), содержащую карбоксильную(ные) группу(ы), где заболевания, связанные с экссудацией белков сыворотки, выбраны из группы, состоящей из атопического дерматита, атопической экземы, кожного зуда, атопического воспаления полости носа, атопической эритемы или эритродермы, контактного дерматита, астмы и хронического обструктивного заболевания легких.
2. Композиция по п.1, где двунасыщенные фосфолипиды экстрагированы из животных.
3. Композиция по п.1, где двунасыщенные фосфолипиды экстрагированы из крупного рогатого скота и свиньи.
4. Композиция по п.2, где двунасыщенные фосфолипиды экстрагированы из бронхиального альвеолярного смыва или гомогената ткани легкого.
5. Композиция по п.1, где двунасыщенные фосфолипиды включают дипальмитоилфосфатидилхолин, дипальмитоилфосфатидилинозитол или их смесь.
6. Композиция по п.1, дополнительно содержащая глицерин.
7. Композиция для лечения кожных заболеваний, содержащая в качестве активных компонентов двунасыщенные фосфолипиды, ионы кальция и органическую кислоту(ы), содержащую карбоксильную(ные) группу(ы).
8. Композиция для наружного нанесения на кожу, содержащая в качестве активных компонентов двунасыщенные фосфолипиды, ионы кальция и органическую кислоту (ы), содержащую карбоксильную(ные) группу(ы).
9. Композиция по п.1, где двунасыщенные фосфолипиды представлены в концентрации от 1 до 700 мг/мл.
| WO 9930722 A1, 24.06.1999 | |||
| HOHLFELD J | |||
| et al | |||
| The role of pulmonary surfactant in obstructive airways disease | |||
| Eur | |||
| Respir | |||
| J | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| PISON U | |||
| et al | |||
| Host defence capacities of pulmonary surfactant: evidence for 'non-surfactant' functions of the surfactant system. | |||
Авторы
Даты
2010-11-10—Публикация
2006-02-23—Подача