Область техники
Изобретение относится к ветеринарии и представляет собой композицию на основе человеческого рекомбинантного интерферона альфа-2b, обладающую противовирусным и иммуномодулирующим действием.
Предшествующий уровень техники
Использование в медицине человеческого рекомбинантного интерферона в качестве противовирусного и иммуномодулирующего средства в последние годы получило широкое распространение. Часто для проведения подобной терапии используют свечи или растворы местного применения (например, препарат Гриппферон).
Известен препарат в форме раствора или сухой лиофилизированной массы для приготовления раствора, содержащий следующие компоненты: раствор рекомбинантного альфа-2 интерферона человека с активностью 2·106-4·107 МЕ/мл 1-100 мкг/мл, ацетат альфа-токоферола 0,1-5 мкг/мл, полиглюкин 0.1-1.0 мг/мл, ЭДТА 0.8-1.6 мг/мл, буферобразующие соли в количестве, обеспечивающем pH в диапазоне от 5.0 до 8.4 (патент РФ №2294372). Композиция обеспечивает стабильность препарата интерферона в течение всего срока годности. Данная композиция может являться основой инъекционного препарата, однако полученный препарат не будет обладать пролонгированным действием.
Известен препарат в форме раствора для применения в качестве глазных капель, интраназально, интравагинально, интрауретально, для введения в гайморовы пазухи и для орошения слизистой оболочки респираторного тракта. Препарат обладает пролонгированным действием и содержит в мг на 1 мл: интерферон человеческий рекомбинантный (1-50)·103 ME, лимонную кислоту 1-3, борную кислоту 8-11, натрия тетраборат 5-10, унитол 1-5, альбумин сывороточный человеческий 1-5, натрия хлорид 1-3, натрия карбоксиметилцеллюлозу или гидроксиэтилцеллюлозу 5-50 и воду очищенную до 1 мл (патент РФ №2270692). Данный препарат предназначен для местного применения и не рассматривается в качестве инъекционного препарата вследствие значительно меньших количеств интерферона, чем необходимо для проведения инъекционной терапии. Кроме того, в составе препарата используется альбумин сывороточный человеческий, использование которого в инъекционных формах препаратов связано с рисками заражения пациентов вирусами ВИЧ, гепатита и какими-либо другими вирусами.
Известен препарат в форме стабильного инъекционного раствора, содержащий в 1 мл следующие компоненты: безводный двузамещенный фосфат натрия 1,8 мг, моногидрат однозамещенного фосфата натрия 1,3 мг, дигидроэтилендиаминтетраацетат динатрия 0,1 мг, полисорбат 80-0,1 мг, метилпарабен 1,2 мг, пропилпарабен 0,12 мг, хлорид натрия 7,5 мг, вода для инъекций до 1 мл. При этом концентрация интерферона альфа-2 составляет (5-50)х106 МЕ/мл (патент РФ №2157236). Данный препарат является инъекционным раствором, однако не обеспечивает пролонгированного эффекта.
Наиболее близким к предложенному лекарственному средству является препарат, содержащий в 1 г следующие компоненты: интерферон человеческий рекомбинантный (104-3·106) ME, полиэтиленгликоль 4000-6000 0,0001-0,5, полиглюкин 0,001-0,1, структурообразователь (мальтоза, манит, глюкоза, фруктоза) 0,01-0,8, набухающее и диспергирующее вещество (целлюлоза, метилцеллюлоза, ацетилфталилцеллюлоза, натрий карбоксиметилцеллюлоза и т.д.) 0,001-0,1 и целевая добавка остальное. При этом препарат представляет собой смесь для формирования таблетки или содержимого капсулы. В качестве интерферона используют сухую субстанцию, сублимированную из раствора, содержащего полиглюкин, структурообразователь и рекомбинантный человеческий интерферон, адсорбированный полиэтиленгликолем (RU, патент №2292907, 03.03.2006, A61K 38/19,..). Однако данный препарат не является инъекционным, а указанная композиция должна была увеличить биодоступность рекомбинантного человеческого интерферона в таблетированном виде. Подобная композиция не будет обеспечивать пролонгированного эффекта.
Подробное описание изобретения
В области ветеринарной сельскохозяйственной медицины использование свечей, растворов местного применения или таблеток является трудоемким и неудобным процессом. При этом для подобных препаратов необходимо использовать более высокие концентрации интерферона, что связано с большей массой животных по сравнению с людьми. В этой области наиболее удобной формой препарата являются инъекционные растворы. Но и использование инъекционных форм, в случае, если терапию препаратом необходимо проводить несколько раз в неделю, является затратным процессом, т.к. в случае проведения сезонной терапии необходимо обработать все поголовье. В этом случае экономически выгодным является использование препарата интерферона, обладающего пролонгированным действием, который бы позволил весь курс лечения проводить за одну-две инъекции.
Целью настоящего изобретения является создание лекарственного средства для ветеринарии на основе человеческого рекомбинантного интерферона альфа-2b, обладающего противовирусным и иммуномодулирующим действием, в виде стабильного инъекционного раствора или лиофилизата для приготовления инъекционного раствора. При этом указанное средство должно обладать пролонгированным действием.
Поставленная цель была достигнута путем создания лекарственного средства, в котором в качестве активного вещества используют гидрофобный комплекс интерферона и двух биологических полимеров - декстрана и метилцеллюлозы, за счет которых высвобождение интерферона в организме происходит постепенно и достигается пролонгация его действия. В качестве декстрана используется декстран с молярной массой 30000 или 60000 или смесь их. Так же композиция содержит фосфатный буфер для стабилизации pH. Наиболее оптимальное соотношение компонентов следующее: человеческий рекомбинантный интерферон альфа-2b (10-200) млн ME, декстран (5-10) мг, метилцеллюлоза (1-20) мг, натрий фосфатный буфер 50 ммоль, натрий хлористый 8,7 мг, калий хлористый 0,3 мг, кислота соляная или натрия гидроксид до pH (5,0-7,5), вода для инъекций до 1 мл. Лекарственное средство представляет собой стабильный стерильный раствор для инъекций или стерильный лиофилизат для приготовления раствора для инъекций.
Лекарственное средство предназначено для инъекционного введения - внутримышечно, подкожно, внутривенно.
Сущность изобретения поясняется в следующих примерах.
Пример 1. Получение лекарственного средства в виде раствора для инъекций
В емкость на 150 л последовательно заливают воду для инъекций по ФС 42-2620-97 - 70 л, засыпают Na2HPO4*12H2O 1696 г и NaH2PO4*2H2O 41,3 г и растворяют. При постоянном перемешивании в емкость засыпают 5000 г декстрана 70000 и 1500 г метилцеллюлозы. Растворяют при постоянном перемешивании. Доводят pH раствора гидрооксидом натрия или соляной кислотой до 8,0 и доводят объем до 100 л водой для инъекций. Охлаждают раствор до (4±2)°C. При постоянном перемешивании добавляют концентрированный раствор человеческого рекомбинантного интерферона в количестве 22,8 мл или 1010 ME (исходная концентрация интерферона 2 мг/мл или 4,4·108 МЕ/мл). Полученный раствор инкубируют в течение 16 часов при температуре (4±2)°C и постоянном медленном перемешивании около 10-20 rpm. Далее при постоянном объеме и при температуре (4±2)°C проводят тангенсальную диафильтрацию с использованием 50 кДа ультрафильтрационных фильтрационных элементов с площадью поверхности не менее 3 м, не менее 4-х объемов, против 50 мМ натрий фосфатного буфера, pH 6,5. Диафильтрацию прекращают по достижению pH значения 6,8-7,1. Выход интерферона в данном процессе составляет (97±5)% по данным биологического тестирования с использованием человеческих диплоидных фибробластов и вируса везикулярного стоматита.
В емкость на 600 л заливают воду для инъекций с температурой (23±2)°C 400 л, засыпают 4350 г хлористого натрия, 150 г хлористого кальция, Na2HPO4*12H2O 6784 г и Na2HPO4*2H2O 165,2 г и растворяют при постоянном перемешивании. В емкость заливают раствор комплекса интерферона, декстрана и метилцеллюлозы. Доводят pH гидрооксидом натрия или соляной кислотой до 6,5 и доводят объем до 500 л водой для инъекций в случае необходимости.
Раствор подвергают асептической фильтрации в стерильную емкость, переводят в помещение класса «А», где осуществляют асептический розлив в 10, 20 или 100 мл флаконы. Флаконы укупоривают резиновыми пробками и обкатывают алюминиевыми колпачками. Полученный препарат содержит (18-22) млн ME интерферона в мл, в виде комплекса с декстраном и метилцеллюлозой.
Пример 2. Получение лекарственной формы в виде лиофилизата для приготовления раствора для инъекций
В емкость на 150 л последовательно заливают воду для инъекций по ФС 42-2620-97 70 л, засыпают Na2HPO4*12H2O 1696 г и Na2HPO4*2H2O 41,3 г и растворяют. При постоянном перемешивании в емкость засыпают 5000 г декстрана 70000 и 1500 г метилцеллюлозы. Растворяют при постоянном перемешивании. Доводят pH раствора гидрооксидом натрия или соляной кислотой до 8,0 и доводят объем до 100 л водой для инъекций. Охлаждают раствор до (4±2)°C. При постоянном перемешивании добавляют концентрированный раствор человеческого рекомбинантного интерферона в количестве 22,8 мл или 1010 ME (исходная концентрация интерферона 2 мг/мл или 4,4·108 МЕ/мл). Полученный раствор инкубируют в течение 16 часов при температуре (4±2)°С и постоянном медленном перемешивании около 10-20 rpm. Далее при постоянном объеме и при температуре (4±2)°C проводят тангенсальную диафильтрацию с использованием 50 кДа ультрафильтрационных фильтрационных элементов с площадью поверхности не менее 3 м2, не менее 4-х объемов, против 50 мМ натрий фосфатного буфера, содержащего 8,7 г/л хлорида натрия и 0,3 г/л хлорида калия, pH 5,5. Диафильтрацию прекращают по достижении pH значения 5,8-6,1. Выход интерферона в данном процессе составляет (98±5)% по данным биологического тестирования с использованием человеческих диплоидных фибробластов и вируса везикулярного стоматита. Полученный раствор быстро нагревают до (30±2)°C в течение примерно 30 минут и подвергают асептической фильтрации в стерильную емкость. Стерильный раствор переводят в помещение класса «А», где осуществляют асептический розлив в 10 мл флаконы по 2 мл при комнатной температуре. Флаконы замораживают на -40°C на 24 часа, после чего переносят в лиофильную сушилку и проводят сублимирование. По окончании процесса флаконы в асептических условиях укупоривают стерильными резиновыми пробками и обкатывают алюминиевыми колпачками. Полученный лиофилизат содержит 90-110 млн ME интерферона на флакон в виде комплекса с декстраном и метилцеллюлозой.
Пример 3. Исследование физико-химического состава раствора лекарственного средства и проверка стабильности лекарственного средства
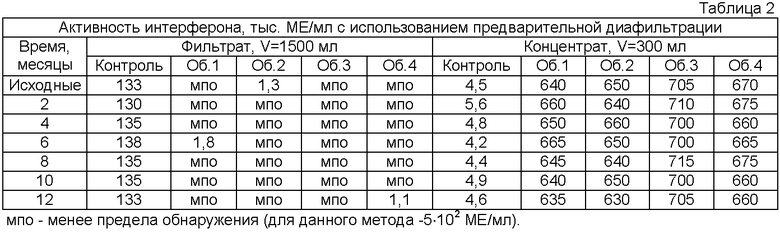
В процессе хранения в течение 1 года проводили исследования опытных партий полученного лекарственного препарата. В качестве аналитических методов использовали ультрафильтрацию с использованием лабораторной ультрафильтрационной установки Биомакс (Миллипор) с размерами пор 100 кДа с целью определения стабильности комплекса интерферона, декстрана и метилцеллюлозы и метод определения биологической активности интерферона с использованием человеческих диплоидных фибробластов в качестве тест-культуры и вируса везикулярного стоматита в качестве тест-вируса. Определение биологической активности проводили как самого раствора препарата, так и раствора препарата, подвергнутого предварительной диафильтрации для определения стабильности комплекса интерферона с декстраном и метилцеллюлозой. Препарат в виде лиофилизата предварительно растворяли в воде для инъекций добавлением во флакон 10 мл воды. Диафильтрацию проводили следующим образом: 10 мл раствора препарата разводили до 300 мл 50 мМ натрий-фосфатным буфером, pH 7,0. На установке Биомакс проводили диафильтрацию при постоянном объеме, 5 объемов. Проводили определение биологической активности интерферона в концентрате (V=300 мл) и в фильтрате (V=1500 мл). В качестве контроля ультрафильтрации в аналогичном процессе использовали раствор интерферона в фосфатном буфере, который не находился в комплексе с декстраном и метилцеллюлозой, с содержанием интерферона 667 тыс. ME/мл (200 млн ME в 300 мл). Результаты представлены в табл. 1 и 2. Как видно из Табл. 1, препарат не теряет активности в течение всего срока хранения. Данные Табл. 2 показывают отсутствие в образцах интерферона в свободной форме и подтверждают стабильность комплекса интерферона с декстраном и метилцеллюлозой в течение всего срока хранения.
Пример 4. Исследование фармакокинетики лекарственного средства
В качестве экспериментальных животных брали свиней и телят.
А). Исследование фармакокинетики лекарственного средства на свиньях.
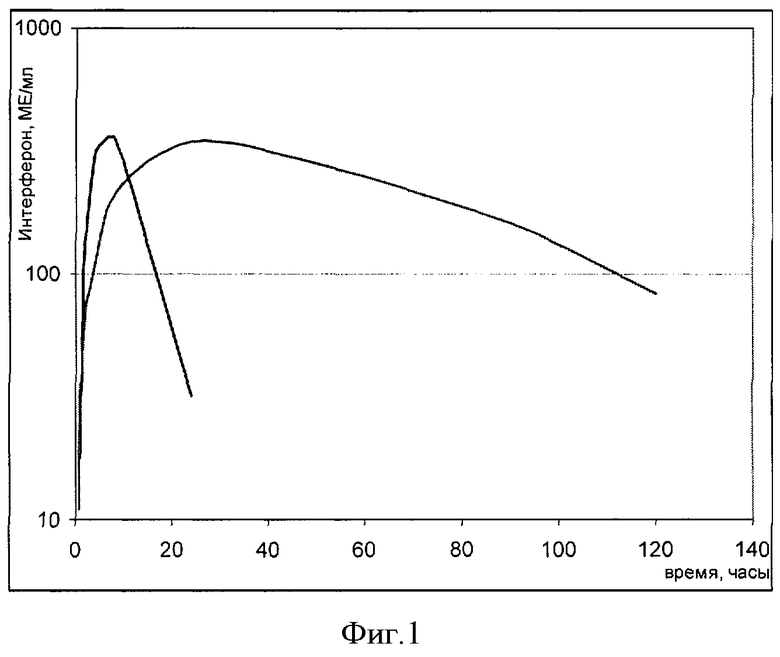
Изучение препарата проводили на восьми свиньях с массой тела 150±20 кг. Животные содержались в стандартных условиях при свободном доступе к корму и воде. Перед инъекциями препарата животных взвешивали. Препарат, опытная серия 020507 (препарат в виде раствора для инъекций, содержание интерферона 20 млн МЕ/мл), вводили однократно, внутримышечно, в дозе 200 тыс. ME на кг массы тела. Объем инъекции составлял 1,3-1,7 мл препарата, в зависимости от массы животного. В качестве препарата сравнения использовали стерильный раствор интерферона в концентрации 20 млн МЕ/мл в фосфатном буфере, приготовленный накануне опыта. Кровь у экспериментальных животных отбирали до введения препарата и после введения через 0,5, 1, 2, 4, 8, 24, 48, 72, 96 и 120 часов. Отобранные пробы крови выдерживали при комнатной температуре до образования сгустка, после чего образцы центрифугировали в течение 15 минут при 2500 об/мин и отбирали по 4 мл сыворотки и замораживали. Транспортировка проб осуществлялась на льду. До анализа пробы сыворотки хранили в замороженном виде. Определение активности интерферона в крови осуществляли методом ИФА с использованием моноклональных антител на человеческий рекомбинантный интерферон альфа-2b. Результаты представлены на фиг. 1. Было определено, что максимальная концентрация интерферона в крови после введения препарата достигалась на (23±6) часов, в то время как при введении контроля (6±1) часов. Сmax были сравнимы. Площади под кривыми концентрация-время, AUC в интервале от 0 до бесконечности составляли (5100±1100) и (26800±8700) для контроля и препарата соответственно, т.е. для препарата площадь под кривой была выше в 5,2 раза. В то же время период полувыведения интерферона после инъекции контроля составил (4±1) часов, а после введения препарата (26±8) часов.
Б). Исследование фармакокинетики лекарственного средства на телятах.
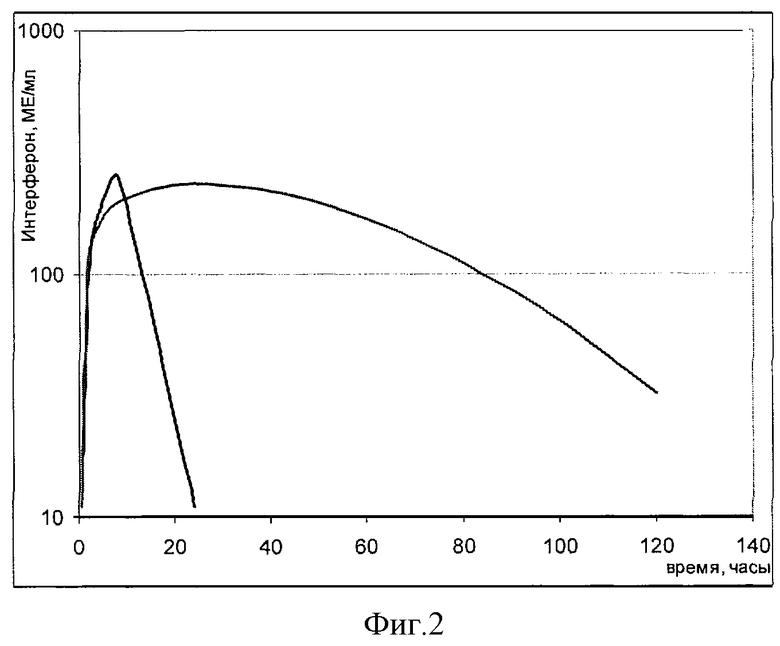
В качестве экспериментальных животных брали телят черно-пестрой породы, в возрасте 7 месяцев с массой около 195-208 кг в количестве 8-ми голов. В течение проведения эксперимента животные имели свободный доступ к воде и корму. Условия содержания животных были аналогичными условиям содержания стада. За несколько часов перед применением препаратов телят взвешивали и рассчитывали количества вводимых препаратов. Препарат, опытная серия 040607 (препарат в виде лиофилизата для приготовления раствора для инъекций, содержание интерферона 100 млн МЕ/флакон), растворяли в 10 мл воды для инъекций и вводили однократно, внутримышечно, в дозе 200 тыс. ME на кг массы тела. Объем инъекции составлял около 4,0 мл препарата, в зависимости от массы животного. В качестве препарата сравнения использовали стерильный раствор интерферона в концентрации 10 млн МЕ/мл в фосфатном буфере, приготовленный накануне опыта. Кровь у экспериментальных животных отбирали до введения препарата и после введения через 0,5, 1, 2, 4, 8, 24, 48, 72, 96 и часов. Отобранные пробы крови выдерживали при комнатной температуре до образования сгустка, после чего образцы центрифугировали в течение 15 минут при 2500 об/мин и отбирали по 4 мл сыворотки и замораживали. Транспортировка проб осуществлялась на льду. До анализа пробы сыворотки хранили в замороженном виде. Определение активности интерферона в крови осуществляли методом ИФА с использованием моноклональных антител на человеческий рекомбинантный интерферон альфа-2b. Результаты представлены на фиг. 2. Было определено, что максимальная концентрация интерферона в крови после введения препарата достигалась на (27±8) часов, в то время как при введении контроля (7±1) часов. Сmax были сравнимы. Площади под кривыми концентрация-время, AUC в интервале от 0 до бесконечности составляли (3300±940) и (17300±9300) для контроля и препарата соответственно, т.е. для препарата площадь под кривой была выше в 5,2 раза. В то же время период полувыведения интерферона после инъекции контроля составил (4±1) часов, а после введения препарата (23±8) часов.
Хотя указанное изобретение описано в деталях со ссылкой на Примеры, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены и такие изменения и замены не выходят за рамки настоящего изобретения.
Изобретение относится к ветеринарии и представляет собой композицию для ветеринарии, обладающую пролонгированным противовирусным и иммуномодулирующим действием, содержащую комплекс человеческого рекомбинантного интерферона альфа-2b, сорбированного на двух полимерах - декстране и метилцеллюлозе, и солевой буфер для стабилизации рН в районе 5,0-7,5, а также лекарственное средство пролонгированного действия для ветеринарии в виде стерильного раствора для инъекций или стерильного лиофилизата для приготовления раствора для инъекций, содержащее вышеуказанную композицию. 2 н. и 2 з.п. ф-лы, 2 табл, 2 ил.
1. Композиция для ветеринарии, обладающая пролонгированным противовирусным и иммуномодулирующим действием, содержащая комплекс человеческого рекомбинантного интерферона альфа-2b, сорбированного на двух полимерах - декстране и метилцеллюлозе, и солевой буфер для стабилизации рН в районе 5,0-7,5.
2. Композиция по п.1, отличающаяся тем, что используют декстран с молярной массой 30000 или 60000 или их смесь.
3. Лекарственное средство пролонгированного действия для ветеринарии в виде стерильного раствора для инъекций или стерильного лиофилизата для приготовления раствора для инъекций, содержащее композицию по любому из пп.1 и 2.
4. Лекарственное средство по п.3, отличающееся тем, что используют следующее соотношение компонентов (на мл):
человеческий рекомбинантный интерферон альфа-2b 10-200 млн ME
декстран 5-10 мг
метилцеллюлоза 1-20 мг
натрий фосфатный буфер 50 ммоль
натрий хлористый 8,7 мг
калий хлористый 0,3 мг
кислота соляная или натрия гидроксид до рН 5,0-7,5
вода для инъекций до 1 мл
| ЛЕЧЕБНОЕ СРЕДСТВО | 2000 |
|
RU2187332C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИВИРУСНОГО ДЕЙСТВИЯ | 1991 |
|
RU2095081C1 |
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ПРОТИВОВИРУСНЫМ И АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 2006 |
|
RU2292907C1 |
Авторы
Даты
2010-11-27—Публикация
2009-03-13—Подача