Изобретение относится к медицине, фармацевтической промышленности, в частности к противовирусным препаратам, и касается создания новых лекарственных форм, содержащих интерферон.
В клинической практике для лечения вирусных инфекций, в частности гепатита В, широко применяется рекомбинантный альфа-2-интерферон - один из известных субтипов лейкоцитарного интерферона.
Известно, что заключение рекомбинантного альфа-интерферона в липосомы усиливает его антипролиферативную активность в эксперименте на опухолевых клетках (Eppstein D.A., Stewart W.E. Altered Pharmacological Properties of Liposome-Associated Human Interferon-Alpha. J. Virology, 1982, vol.41, N 2, p.575-582). Причем различные способы ассоциации с мембраной липосом в зависимости от состава липидов приводят к измененной фармакокинетике интерфероновых препаратов в эксперименте на мышах (Killion J.J., Fan D., Bucana CD., Frangos D.N., Price J.E., Fidler I. J. Augmentation of Antiproliferative Activity of Interferon Alfa Against Human Bladder Tumor Cell Lines by Encapsulation of Interferon Alta Within Liposomes. J. of the Nat. Cancer Inst, 1989, vol.81, N 18 p.1387-1392).
Известен противовирусный препарат местного действия для внутрикожного введения на основе интерферона-альфа, заключенного в липосомы (международная заявка, WO №91/01719, МПК А61К 9/127, опубл. 1991). Препарат исследован на экспериментальной модели инфекции герпеса у морских свинок. Липосомы получены из липидов, характерных для рогового слоя кожи.
Известна липосомальная лекарственная форма для перорального применения, содержащая человеческий альфа-интерферон (патент США №5503828, МПК А61К 38/00, опубл. 02.04.1996 г.). Однако конкретный состав лекарственной формы не указан.
Известен другой противовирусный препарат на основе рекомбинантного бета-интерферона, заключенного в липосомы, предназначенный для местного или парентерального (подкожного, внутримышечного) применения (Европейский патент №172007, МПК А61К 9/127, опубл. 1986). Для парентерального применения противовирусный препарат в липосомальной форме содержит:
Рекомбинантный бета-интерферон, ME - 2×108
Человеческий сывороточный альбумин, г - 1,25
Декстроза, г - 1,25
Смесь диарахидоилфосфатидилхолина и
дипальмитоилфосфатидилглицерина (7:3), ммоль - 2,0
Солевой раствор (0,9%), мл - 100
Недостатком такого липосомального препарата является содержание в композиции человеческого сывороточного альбумина, что приводит к возможному развитию аллергических состояний у больных, длительно применяющих интерферон. Кроме того, метод получения данной композиции предусматривает предварительное растворение липидов, образующих липосому, в органических растворителях, например таких как пропанол, бутанол, циклогексан. Несмотря на последующую лиофилизацию липидной смеси следовые количества этих растворителей могут присутствовать в итоговой лекарственной композиции, вызывая нежелательные побочные эффекты у больных, применяющих препарат. Кроме того, состав данной композиции не обеспечивает возможность получения лиофильно высушенного биологически активного лекарственного средства, пригодного для длительного хранения, что значительно уменьшает возможность применения препарата в медицинских целях.
Наиболее близким аналогом (прототипом) является липосомальное противовирусное лекарственное средство для перорального применения, содержащее биологически активный компонент - рекомбинантный интерферон-альфа-2, компоненты, формирующие липосомы - фосфатидилхолин и холестерин, стабилизатор - сахарозу, антиоксиданты - альфа-токоферол и аскорбиновую кислоту, представляющее собой лиофилизат или изотонический раствор (патент РФ №2123328, МПК А61К 9/127, опубл. 20.12.98), при следующем соотношении компонентов лиофилизата, мг:
Рекомбинантный интерферон-альфа-2, ME - (2,5-10)×105
Фосфатидилхолин - 60-80
Холестерин - 6-10
альфа-Токоферол - 6-10
Витамин С -1-2
Сахароза - 40-90.
Такое липосомальное лекарственное средство обеспечивает проявление биологической активности, свойственной интерферону-альфа-2, при пероральном пути введения препарата и достижение терапевтического эффекта от применения этой лекарственной формы без проявления побочных эффектов, сопровождающих парентеральный способ введения интерферона.
Указанное липосомальное лекарственное средство имеет недостаточный срок хранения (активность интерферона альфа-2 практически на постоянном уровне сохраняется не более 12 месяцев).
Техническим результатом предлагаемого изобретения является увеличение срока хранения липосомальной лекарственной формы, при котором активность альфа-интерферона сохраняется на постоянном уровне до 30 и более месяцев.
Указанный технический результат достигается тем, что в липосомальном пероральном противовирусном лечебно-профилактическом средстве, включающем рекомбинантный интерферон-альфа человека, фосфатидилохолин, холестерин, альфа-токоферол, согласно изобретению, оно дополнительно содержит лактозу, натрия хлорид, натрий фосфорнокислый двузамещенный 12-водный и натрий фосфорнокислый однозамещенный 2-водный, при этом оно представляет собой лиофилизат при следующем содержании компонентов лиофилизата, мг:
Наличие в липосомальной мембране холестерина и витамина Е в заявленных соотношениях обеспечивают относительную стабильность липосом в желудочно-кишечном тракте до места всасывания липидов в организме, и, соответственно сохранение биологической активности интерферона, заключенного в них.
За счет уменьшения диаметра отверстия мембраны до 0,1 мкм (при экструзии липосомального продукта) удалось уменьшить размер липосом до 0,15 мкм, что позволило сохранить загрузку интерферона в липосомы на прежнем (как в прототипе) уровне, так как коэффициент загрузки прямо пропорционален суммарной величине поверхности липидного бислоя и обратно пропорционален размеру липосом.
При использовании интерферона в количестве менее 250 тыс.МЕ выявляется недостаточная клиническая эффективность заявляемой лекарственной формы при пероральном приеме, а увеличение количества интерферона в разовой дозе более 1 млн. ME нецелесообразно, так как не приводит к дальнейшему усилению терапевтического эффекта препарата и может вызвать нежелательные побочные эффекты, характерные для высоких доз интерферона.
Экспериментальные исследования показали, что концентрации фосфатидилхолина в пределах 40-42 мг/мл, холестерина в пределах 4,0-5,0 мг/мл и токоферола в пределах 0,5-0,6 мг/мл оптимальны для включения заданного количества интерферона в липосомы со средним размером частиц 0,15 мкм.
Содержание лактозы в диапазоне 90,0-92,0 мг/мл липидной композиции обеспечивает стабильное сохранение липосомальной мембраны в процессе лиофилизации, а ее содержание более 92,0 мг/мл по данным авторов не дает дополнительных преимуществ.
Введение таких компонентов, как натрий хлорид, натрий фосфорнокислый двузамещенный 12-водный и натрий фосфорнокислый однозамещенный 2-водный в заявляемых концентрациях, обеспечивает сохранение активности интерферона на стадии приготовления лекарственной формы.
Кроме того, замена сахарозы на лактозу обеспечивает повышение устойчивости готовой лекарственной формы на стадии хранения. Лактоза - невосстанавливающийся дисахарид и поэтому подвержена окислению в гораздо меньшей степени по сравнению с сахарозой, что позволило (по сравнению с прототипом) отказаться от использования аскорбиновой кислоты в качестве антиоксиданта.
Витамин Е (альфа-токоферол), присутствующий в липосомах в заявленных соотношениях, оказывает достаточное антиокислительное и стабилизирующее действие на интерферон и липидные компоненты.
Повышение устойчивости интерферона на стадии приготовления лекарственной формы достигается за счет введения в состав регидратирующего раствора фосфатно-солевого буфера с характеристиками, близкими к таковым у субстанции интерферона, что снижает инактивирующее воздествие таких факторов, как осмоляльность и кислотно-щелочной баланс.
Пример 1. Технология получения липосомальной формы
Липосомы заявленного состава со средним размером 0,15 мкм получают методом экструзии мультиламеллярных везикул через поликарбонатные мембраны со средним размером пор 0,1 мкм.
В круглодонную колбу (V=20 л), содержащую 400 мл этанола, вносят 17,43 г фосфатидилхолина, растворяют при перемешивании, добавляют 1,99 г холестерина, растворенного в 36 мл смеси хлороформ: этанол в объемном соотношении 1:2, перемешивают, добавляют 0,25 г альфа-токоферола и выпаривают под вакуумом до получения сухой липидной пленки на стенках колбы. После выпаривания продувают липидную пленку инертным газом для предотвращения окисления липидов. Добавляют в колбу раствор субстанции рекомбинантного интерферона-альфа (из расчета 500 тыс. МЕ/мл в конечной лекарственной форме после лиофилизации получаемой суспензии), содержащий кроме нее следующие компоненты:
Содержимое перемешивают до полной гидратации липидной пленки в течение 30 мин при комнатной температуре. Полученную липосомальную суспензию подвергают последовательной формирующей и стерилизующей фильтрации через поликарбонатные мембраны фирмы "Nuclepore" (диаметр пор 0,4; 0,2 и 0,1 мкм) под давлением инертного газа (азот, аргон). В асептических условиях разливают по 1 мл суспензии во флаконы, замораживают при -40°С и проводят лиофильную сушку препарата до достижения остаточной влажности (7±1) мас.%. Сразу после сушки флаконы с препаратом герметично укупоривают в атмосфере инертного газа в асептических условиях. Перед употреблением к лиофильно высушенному препарату добавляют 1,0 мл воды и встряхивают до получения однородной суспензии молочно-белого цвета.
Средний диаметр липосом, полученных методом экструзии мультиламеллярных везикул через поликарбонатные мембраны и имеющих заявляемый состав, составляет 0,15 мкм.
При анализе антивирусной активности липосомальной суспензии установлено, что не более 25% интерферона остается неинкапсулированным.
Пример 2. Для тестирования in vitro антивирусной активности липосомальной формы интерферона, полученной, как указано в примере 1, используют метод подавления цитопатогенного действия вируса везикулярного стоматита (ВВС) штамм "Индиана" в культуре диплоидных фибробластов легкого эмбриона человека (Л-68), выращенной в монослое в 96-луночных микропланшетах фирмы "Linbro" (Реаферон для инъекций сухой. Фармакопейная статья. ВФС-42-227 ВС-89). Предварительно ВВС пассеруют на куриных эмбрионах по ТУ 42-14-97-79, не менее 3-х пассажей (заражающая доза 102-103 ТЦД50/0,1 мл при инфекционной активности 105-106 ТЦД50/0,1 мл). Для контроля степени окисленности липидов используют метод, основанный на измерении концентрации продуктов перекисного окисления липидов по реакции с тиобарбитуровой кислотой (Yagi K.-Lipid peroxidation. Assay for blood plasma and serum. Methods Enzymol, 1984, vol. 105, p.328-333).
Перед определением антивирусной активности липосомальную суспензию инкубируют (20±2) мин при температуре (22±1°С) в присутствии 1% (V/V) тритона Х-100 для разрушения липосом. Для определения активности готовят двукратные разведения (выше и ниже предполагаемого титра) исследуемых препаратов и ОСО активности (активность которого выражена в международных единицах - МЕ-ОСО активности, ФС 42-28-90-87) в среде 199 или Игла с 2%-ной сыворотки плодов коров по ФС 42-7 ВС-85 (поддерживающая среда) и антибиотиками. На каждое разведение используют не менее 4-х лунок с монослоем культуры клеток. Из лунок удаляют среду и вносят по 0,1 мл предполагаемых разведений липосомального интерферона. 4 лунки с культурой клеток оставляют в качестве контрольных. Кроме того, 16 лунок оставляют для контроля дозы индикаторного вируса. В эти лунки вносят по 0,1 мл поддерживающей среды. Инокулированные и контрольные культуры инкубируют в течение 1 сут при (37±1)°С а атмосфере с (5,0±0,5)% СО2, после чего в каждую с испытываемыми материалами вносят определенную заранее дозу ВВС, соответствующую 100 ТЦД50 в 0,1 мл. Одновременно осуществляют контроль взятой дозы вируса на предназначенных для этой цели 16 лунках с культурой. Используют по 4 лунки на каждое разведение вируса, начиная с разведения, соответствующего 100 ТЦД50, до разведения соответствующего 0,1 ТЦД50, с коэффициентом разведения, равным 10. После внесения индикаторного вируса и титрования его дозы культуру клеток инкубируют на протяжении 2-х суток при температуре, равной (37±1)°С, в атмосфере с (5,0±1)% СO2, под контролем дозы вируса.
Учет результатов противовирусной активности липосомального интерферона осуществляют, когда доза внесенного вируса соответствует 100 ТЦД50. Если дозу вируса, соответствующую 100 ТЦД50, рассчитывают на основании учета результатов через 24 ч после заражения, то и учет титрования препарата осуществляют через 24 ч. Учет результатов опыта возможен, если нет признаков дегенерации в контрольной культуре. За титр липосомального интерферона принимают величину, обратную разведению препарата, при котором клеточная культура в 50% лунок оказывается полностью защищенной от цитопатического действия вируса. Пересчет активности в ME осуществляют по формуле
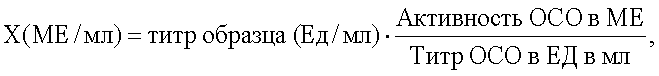
Как известно, фармацевтически приемлемым является срок хранения лекарственного средства не менее 6 месяцев, предпочтительнее не менее 1 года. Для подтверждения стабильности лиофильно высушенной липосомальной лекарственной формы рекомбинантного альфа-2-интерферона заявленного состава нами в течение 36 месяцев исследовалась противовирусная активность препарата. Препарат хранился в рефрижераторе при температуре 4°С. В течение всего срока наблюдения степень окисленности липидов оставалась неизменной. Как показали исследования, в течение 30 месяцев хранения не обнаружено снижения противовирусной активности заявляемого лекарственного средства (см. таблицу).
Таким образом, по сравнению с прототипом срок хранения заявляемого препарата альфа-интерферона в липосомальной форме увеличился в 2,5 раза.
Промышленная применимость
Изобретение может быть использовано в медицине в комплексной терапии заболеваний вирусной этиологии и в любых других случаях, при которых показано применение препаратов интерферона.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛИПОСОМАЛЬНОЕ ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ ИНТЕРФЕРОНА АЛЬФА-2b ЧЕЛОВЕКА В КАПСУЛИРОВАННОЙ ФОРМЕ ДЛЯ ВАГИНАЛЬНОГО ПРИМЕНЕНИЯ | 2014 |
|
RU2552851C1 |
| Способ получения липидной смеси и липосомальное пероральное противовирусное лечебно-профилактическое средство с использованием указанной липидной смеси | 2020 |
|
RU2746320C1 |
| ЛИПОСОМАЛЬНОЕ ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ | 1996 |
|
RU2123328C1 |
| Липосомальное средство для лечения хронического атрофического гастрита | 2019 |
|
RU2724021C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ГЕРПЕТИЧЕСКОГО СТОМАТИТА У ДЕТЕЙ | 2011 |
|
RU2444372C1 |
| Способ получения липосомальной косметической сыворотки в сухой лиофилизированной форме для ухода за кожей лица, шеи и зоны декольте | 2023 |
|
RU2825130C1 |
| ЛИПОСОМАЛЬНЫЙ ИНДУКТОР ИНТЕРФЕРОНА | 2004 |
|
RU2306936C2 |
| ТЕРМОСТАБИЛЬНАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИВИРУСНОЙ И АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ И ЕЕ ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2718554C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pET32a-IFG144, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ИНТЕРФЕРОНА ГАММА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI JM109/pET32a-IFG144 - ПРОДУЦЕНТ БЕЛКА ИНТЕРФЕРОН ГАММА, СПОСОБ ПОЛУЧЕНИЯ ИНТЕРФЕРОНА ГАММА И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2022 |
|
RU2809358C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО В ЛИПОСОМАЛЬНОЙ ФОРМЕ | 2000 |
|
RU2176518C1 |
Изобретение относится к медицине, фармацевтической промышленности, в частности к противовирусным, препаратам и касается создания новых лекарственных форм, содержащих интерферон. Липосомальное противовирусное лечебно-профилактическое средство включает рекомбинантный интерферон-альфа человека, фосфатидилохолин, холестерин, альфа-токоферол, лактозу, натрия хлорид, натрий фосфорнокислый двузамещенный 12-водный и натрий фосфорнокислый однозамещенный 2-водный, при этом оно представляет собой лиофилизат. Изобретение обеспечивает увеличение срока хранения липосомальной лекарственной формы, при котором активность интерферона-альфа сохраняется на постоянном уровне до 30 месяцев. 1 табл.
Липосомальное пероральное противовирусное лечебно-профилактическое средство, включающее рекомбинантный интерферон-альфа человека, фосфатидилохолин, холестерин, альфа-токоферол, отличающееся тем, что оно дополнительно содержит лактозу, натрия хлорид, натрий фосфорнокислый двузамещенный 12-водный и натрий фосфорнокислый однозамещенный 2-водный, при этом оно представляет собой лиофилизат при следующем содержании компонентов лиофилизата, мг:
| ЛИПОСОМАЛЬНОЕ ПРОТИВОВИРУСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ | 1996 |
|
RU2123328C1 |
| CN 1660413 А, 31.08.2005 | |||
| WO 9741885 A1, 13.11.1997. | |||
Авторы
Даты
2009-07-20—Публикация
2008-04-24—Подача