ОБЛАСТЬ ТЕХНИКИ
Область настоящего изобретения относится к способу получения производных этилендиамина, имеющих галогенированную карбаматную группу и ацильную группу, и промежуточных веществ для получения производных.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Известно, что производные этилендиамина, имеющие галогенированную карбаматную группу и ацильную группу, пригодны, как показано в Патентном Документе 1, в качестве фунгицидов. Для получения подобных соединений очень важно получать производные этилендиамина, имеющие карбаматную группу, которые являются промежуточными веществами при получении их соединений с большой эффективностью.
Примеры обычных способов получения производных этилендиамина, имеющих карбаматную группу, включают (I) способ, включающий превращение аминоспиртов, имеющих карбаматную группу, в аддукты с фталимидом с использованием фталимида, трифенилфосфина и диэтилазодикарбоксилата, и затем снятие защиты с аддукта с фталимидом гидразином (непатентный документ 1), (II) способ, включающий проведение каталитического гидрирования аминонитрилов, имеющих карбаматную группу, в этаноле, насыщенном аммиаком, в присутствии никеля Ренея (непатентный документ 2) и подобное.
Патентный документ 1: WO 2005042474
Непатентный документ 1: Tetrahedron Asymmetry, т. 11, стр. 1907-1910, 2000
Непатентный документ 2: Synthetic Communications, т. 24, № 12, стр. 1767-1772, 1994
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Поскольку вышеупомянутый способ (I), как описано в непатентном документе 1, использует диэтилазодикарбоксилат или гидразин, что приводит к получению большого количества побочных продуктов реакции и к сложностям с безопасностью, то трудно сказать, что он является пригодным для применения в промышленности.
С другой стороны, вышеупомянутый способ (II), как описано в непатентном документе 2, является превосходным с точки зрения выхода и также является пригодным для промышленного получения. Однако, когда вышеупомянутый способ (II) применяется, например, к аминонитрилам, имеющим галогензамещенную карбаматную группу, таким как производные 2,2,2-трифторэтоксикарбониламинонитрила, то в результате исследования, проведенного настоящими изобретателями, становится ясно, что соединение, получаемое превращением карбаматной группы в уреидную группу, происходит без реакции восстановления.
Другими словами, поскольку галогензамещенная карбаматная группа имеет хорошую реакционную способность по сравнению с обычными углеводородными карбаматными группами, оказалось, что чрезвычайно сложно использовать сведения предшествующего уровня техники. В то же время стало ясно, что реакционная способность становится проблемой как тогда, когда получают соединение, имеющее галогензамещенную карбаматную группу, так и тогда, когда проводится реакция восстановления нитрила. По этой причине для каждого промежуточного продукта производства необходимо разработать эффективный способ получения.
Настоящее изобретение заключается в достижении новой цели эффективного получения производных этилендиамина, имеющих галогенированную карбаматную группу и ацильную группу, и обеспечить способ, который являлся бы благоприятным для промышленного производства производных этилендиамина.
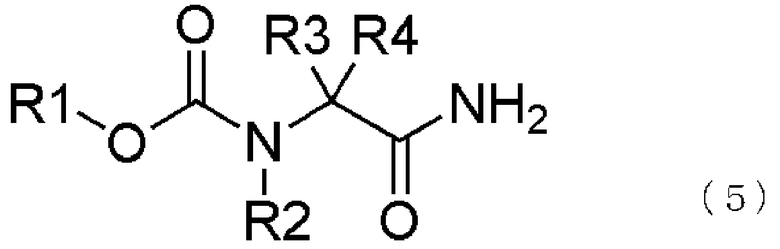
Настоящие изобретатели провели всестороннее исследование и в результате обнаружили эффективное решение вышеуказанной проблемы в проведении каталитического гидрирования аминонитрилов, имеющих галогензамещенную карбаматную группу, в присутствии кислоты и затем ацилировании образующегося продукта. Более того, мы обнаружили, что аминонитрилы получаются с высоким выходом при проведении галогенированного карбаматирования амидов аминокислот в присутствии воды и взаимодействии затем образующегося продукта с восстанавливающим агентом, таким как реагент Вильсмейера. Таким образом было создано настоящее изобретение.
То есть настоящее изобретение раскрыто в аспектах, описанных ниже:
[1] способ получения соединения, представленного общей формулой (4), включающий
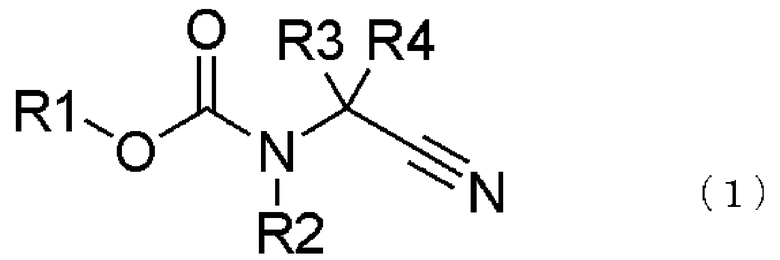
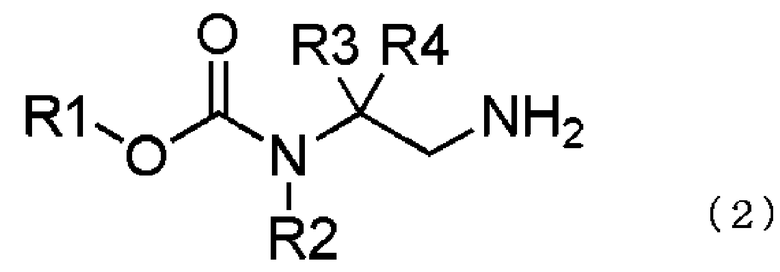
превращение соединения, представленного общей формулой (1), в соединение, представленное общей формулой (2), путем каталитического гидрирования соединения, представленного общей формулой (1), в присутствии кислоты, и
взаимодействием соединения, представленного общей формулой (2), с соединением, представленным общей формулой (3),
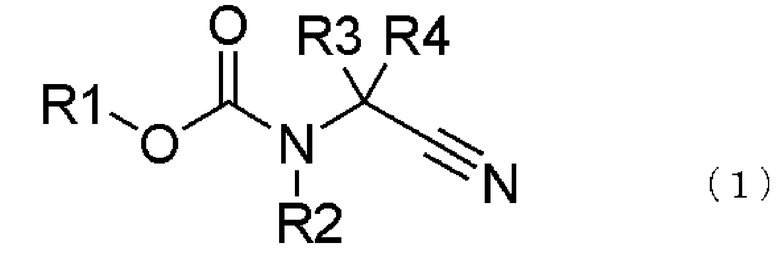
где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена, или циклоалкильную группу, имеющую от 3 до 5 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 или R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной; арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота),
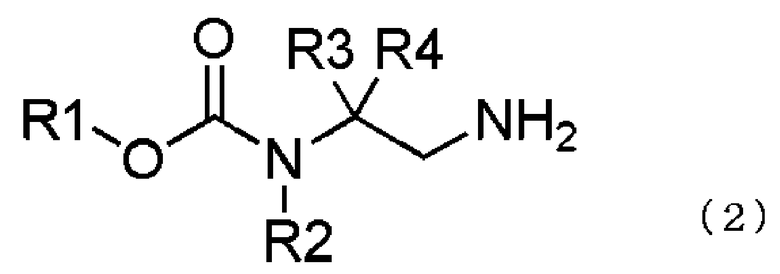
где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше,
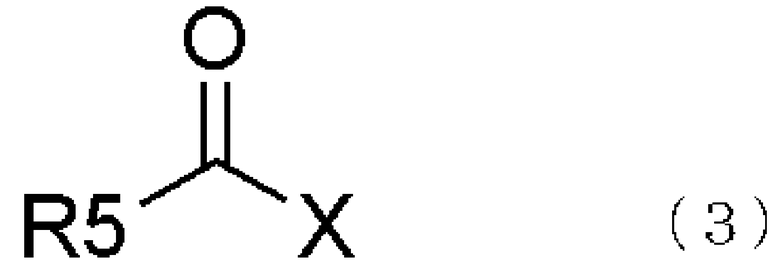
где в формуле R5 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и X представляет уходящую группу;
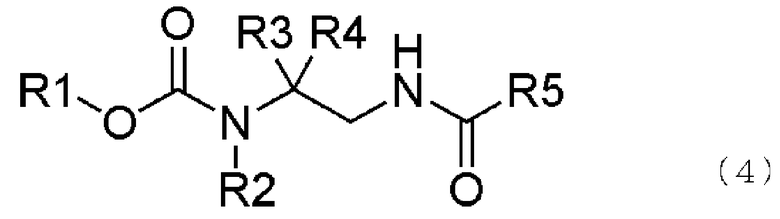
где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше,
[2] способ получения соединения, представленного общей формулой (4), как описано в [1], в котором соединение, представленное общей формулой (1), получается взаимодействием соединения, представленного общей формулой (5) с восстанавливающим агентом,
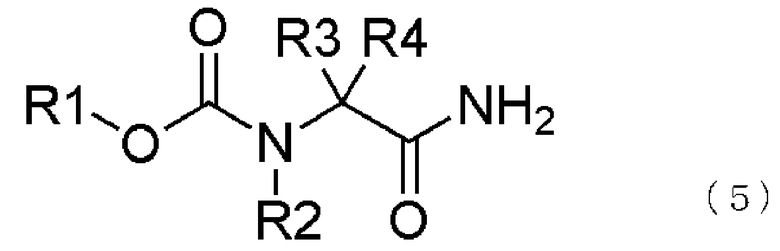
где в формуле R1, R2, R3 и R4 являются теми же самыми, что и описано выше;
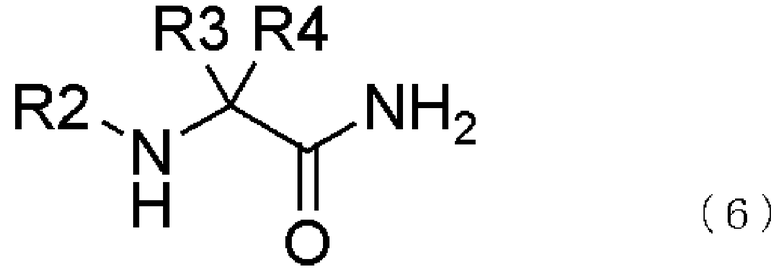
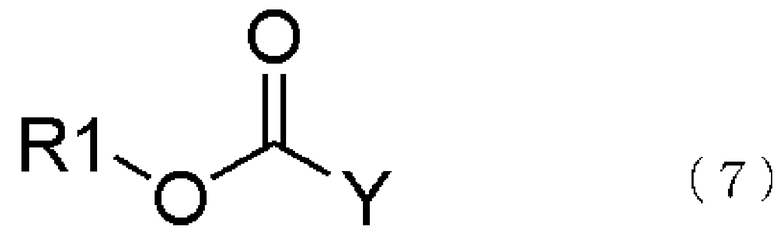
[3] способ получения соединения, представленного общей формулой (4), как описано в [2], в котором соединение, представленное общей формулой (5), получается взаимодействием соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7), в присутствии воды,
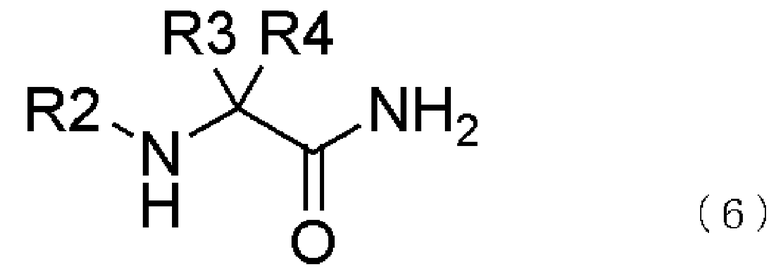
где в формуле R2, R3 и R4 являются теми же самыми, что и описано выше;
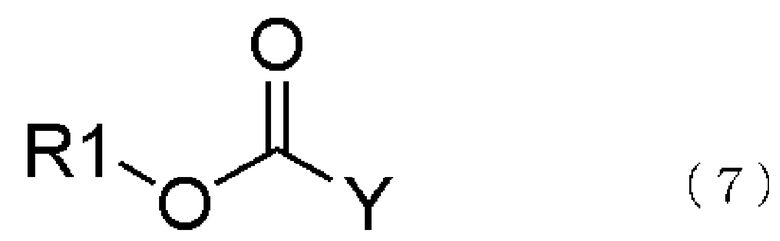
где в формуле R1 является тем же самым, что и описано выше; и Y представляет атом галогена;
[4] способ получения соединения, представленного общей формулой (4), как описано в [1], в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота); и R5 представляет собой арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной;
[5] способ получения соединения, представленного общей формулой (4), как описано в [2], в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота); и R5 представляет собой арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной;
[6] способ получения соединения, представленного общей формулой (4), как описано в [3], в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота); и R5 представляет собой арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной;
[7] способ получения соединения, представленного общей формулой (4), как описано в [4], в формуле которой R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора;
[8] способ получения соединения, представленного общей формулой (4), как описано в [5], в формуле которой R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора;
[9] способ получения соединения, представленного общей формулой (4), как описано в [6], в формуле которой R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора;
[10] способ получения соединения, представленного общей формулой (2), включающий
каталитическое гидрирование соединения, представленного общей формулой (1), в соединение, представленное общей формулой (2), в присутствии кислоты,
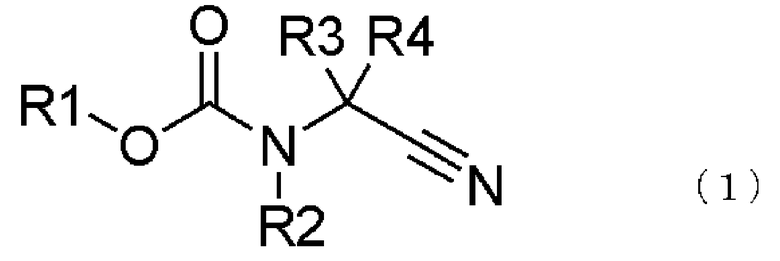
где в формуле R1, R2, R3 и R4 те же самые, что и описаны в [1],
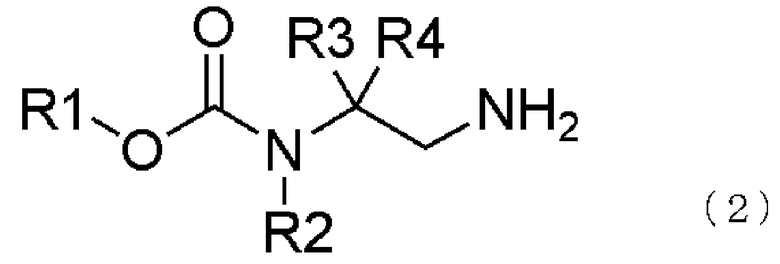
где в формуле R1, R2, R3 и R4 те же самые, что и описаны в [1];
[11] способ получения соединения, представленного общей формулой (2), как описано в [10], в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[12] способ получения соединения, представленного общей формулой (2), как описано в [11], в формуле которого R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора;
[13] способ получения соединения, представленного общей формулой (1), включающий
превращение образующегося продукта в соединение, представленное общей формулой (1), взаимодействием соединения, представленного общей формулой (5), с восстанавливающим агентом,
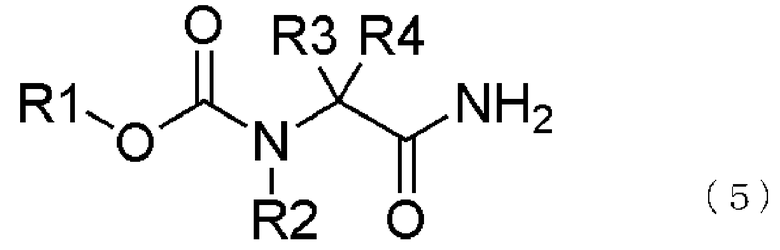
где в формуле R1, R2, R3 и R4 те же самые, что и описаны в [2],
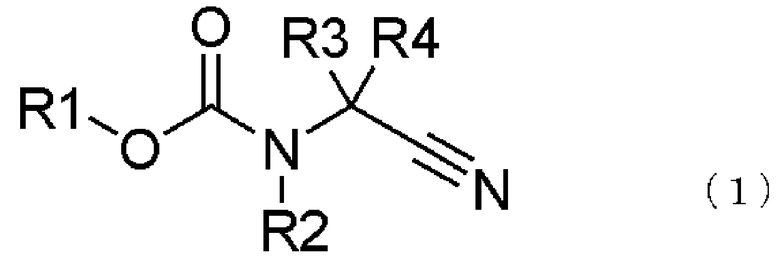
где в формуле R1, R2, R3 и R4 те же самые, что и описаны в [2];
[14] способ получения соединения, представленного общей формулой (1), как описано в [13], в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[15] способ получения соединения, представленного общей формулой (1), как описано в [14], в котором в формулах R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора;
[16] способ получения соединения, представленного общей формулой (5), включающий
превращение образующегося продукта в соединение, представленное общей формулой (5), взаимодействием соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7), в присутствии воды,
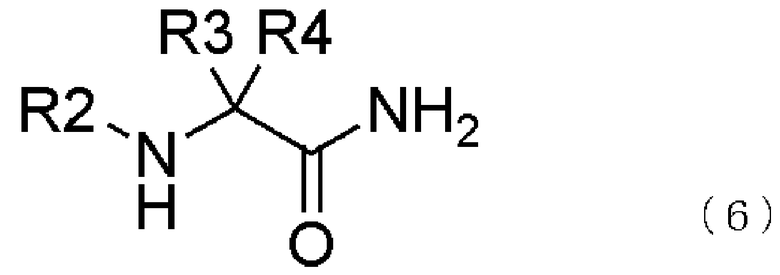
где в формуле R2, R3 и R4 те же самые, что и описаны в [3],
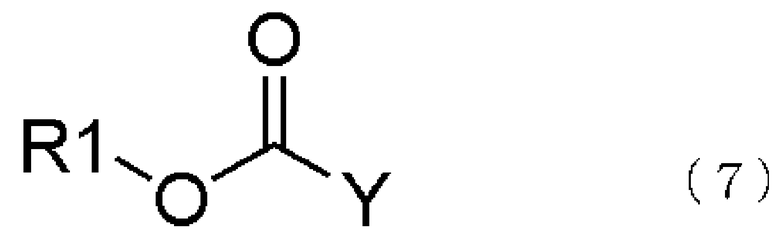
где в формуле R1 и Y те же самые, что и описаны в [3];
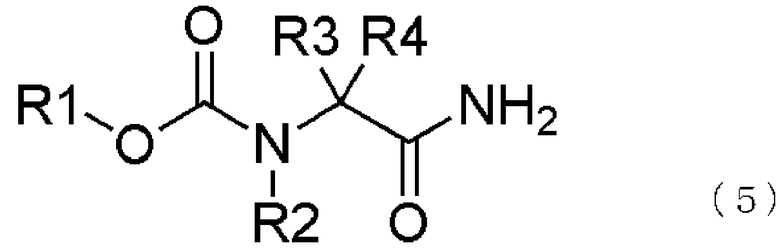
где в формуле R1, R2, R3 и R4 те же самые, что и описаны в [3];
[17] способ получения соединения, представленного общей формулой (5), как описано в [16], в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[18] способ получения соединения, представленного общей формулой (5), как описано в [17], в котором в формулах R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора;
[19] соединение, представленное общей формулой (2),
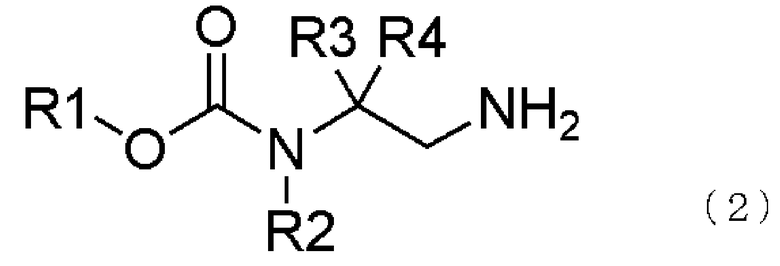
где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[20] соединение, представленное общей формулой (2), как описано в [19], где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной; и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[21] соединение, представленное общей формулой (1),
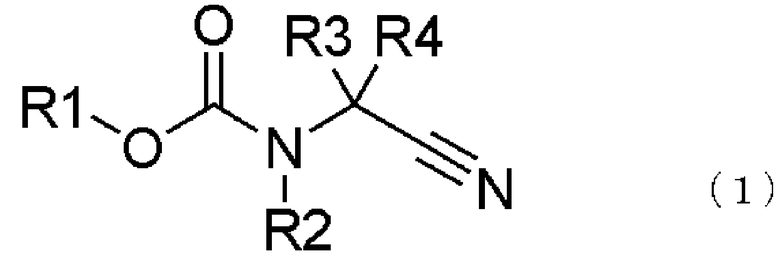
где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[22] соединение, представленное общей формулой (1), как описано в [21], где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной; и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[23] соединение, представленное общей формулой (1),
где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
[24] соединение, представленное общей формулой (5), как описано в [23], где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной; и любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
В соответствии с настоящим изобретением возможно обеспечить новый способ получения производных этилендиамина, имеющих галогенированную карбаматную группу и ацильную группу, и новые промежуточные соединения для получения производных. Кроме того, каталитическое гидрирование в настоящем изобретении имеет такие преимущества, как то, что катализатор реакции может быть использован в цикле, промышленные отходы могут быть уменьшены, реагент, который является проблемным в отношении безопасности, может быть исключен, и производные могут быть получены с высоким выходом. По этой причине настоящее изобретение является превосходным с точки зрения экологии, экономической эффективности, безопасности и производительности и является полезным в качестве промышленного способа получения.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Ниже настоящее изобретение будет описано более подробно.
Настоящее изобретение относится к способу получения соединения, представленного общей формулой (4), включающему
превращение соединения, представленного общей формулой (1), в соединение, представленное следующей общей формулой (2), путем осуществления каталитического гидрирования соединения, представленного следующей общей формулой (1), в присутствии кислоты, и
взаимодействием соединения, представленного общей формулой (2), с соединением, представленным общей формулой (3),
В формуле (1) R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота);
В формуле (2) R1, R2, R3 и R4 те же самые, что и описаны в выше.
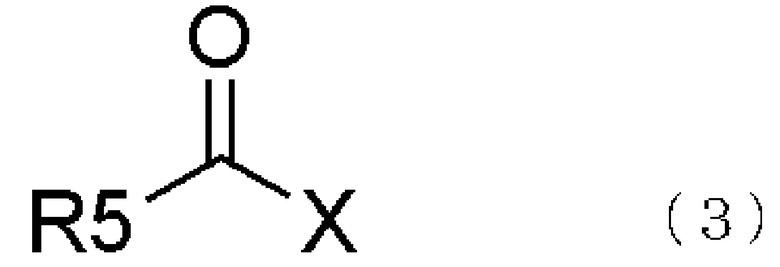
В формуле (3) R5 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и X представляет уходящую группу;
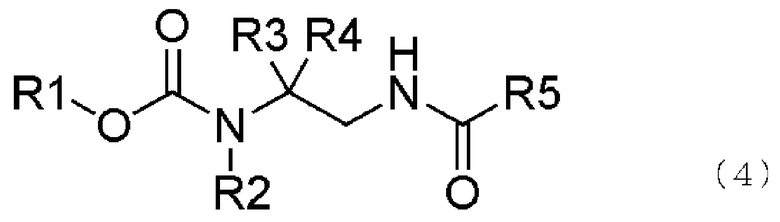
В формуле (4) R1, R2, R3 и R4 те же самые, что и описаны выше.
В соединении, представленном общей формулой (1), R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена.
Атом галогена в R1 общей формулы (1) представляет фтор, хлор, бром, иод и подобное.
Алкильная группа, имеющая от 1 до 6 атомов углерода в R1 общей формулы (1), представляет линейную алкильную группу, такую как метильная группа, этильная группа, пропильная группа, бутильная группа, пентильная группа, гексильная группа или подобные; или разветвленную алкильную группу, такую как изопропильная группа, изобутильная группа, втор-бутильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 3-метилбутильная группа, 1,1-диметилпропильная группа, 2,2-диметилпропильная группа, 1,2-диметилпропильная группа, 1-метилпентильная группа, 2-метилпентильная группа, 3-метилпентильная группа, 4-метилпентильная группа, 1,1-диметилбутильная группа, 1,2-диметилбутильная группа, 1,3-диметилбутильная группа, 2,2-диметилбутильная группа, 2,3-диметилбутильная группа, 3,3-диметилбутильная группа или подобные. В этих алкильных группах может быть по меньшей один атом галогена. Если две или более части алкильных групп замещены галогенами, то галогены могут быть одинаковыми или различными. В этом отношении ограничений нет.
Циклоалкильная группа, имеющая от 3 до 6 атомов углерода в R1 в общей формуле (1), представляет циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу или подобные.
В соединении, представленном общей формулой (1), R2 представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной.
Алкильная группа, имеющая от 1 до 6 атомов углерода в R2 в общей формуле (1), является той же самой, что и группы, описанные в R1 в общей формуле (1).
Циклоалкильная группа, имеющая от 3 до 6 атомов углерода в R2 в общей формуле (1), является той же самой, что и группы, описанные в R1 в общей формуле (1).
Примеры заместителей в арильной группе, которая может быть замещенной, или в гетероарильной группе, которая может быть замещенной, в R2 в общей формуле (1) включают алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа и подобные; циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и подобные; галогензамещенные алкильные группы, такие как трифторметильная группа, дифторметильная группа, бромодифторметильная группа, трифторэтильная группа и подобные; алкоксигруппы, такие как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и подобные; галогензамещенные алкоксигруппы, такие как трифторметоксигруппа, дифторметоксигруппа, трифторэтоксигруппа и подобные; алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутоксикарбонильная группа, втор-бутоксикарбонильная группа и подобные; арилоксикарбонильные группы, такие как феноксикарбонильная группа и подобные; алкилсульфонильные группы, такие как метансульфоновая группа, этансульфоновая группа, пропансульфоновая группа, бутансульфоновая группа и подобные; галогензамещенные алкилсульфонильные группы, такие как трифторметансульфоновая группа, дифторметансульфоновая группа, трифторэтансульфоновая группа и подобные; алкилкарбонильные группы, такие как метилкарбонильная группа, этилкарбонильная группа, пропилкарбонильная группа, изопропилкарбонильная группа и подобные; циклоалкилкарбонильные группы, такие как циклопропилкарбонильная группа, циклобутилкарбонильная группа, циклопентилкарбонильная группа, циклогексилкарбонильная группа и подобные; арилкарбонильные группы, такие как бензоильная группа и подобные; алкилкарбонилоксигруппы, такие как метилкарбонилоксигруппа, этилкарбонилоксигруппа, пропилкарбонилоксигруппа, изопропилкарбонилоксигруппа и подобные; циклоалкилкарбонилоксигруппы, такие как циклопропилкарбонилоксигруппа, циклобутилкарбонилоксигруппа, циклопентилкарбонилоксигруппа, циклогексилкарбонилоксигруппа и подобные; и арилкарбонилоксигруппы, такие как бензоилоксигруппа и подобные. Число заместителей в арильной группе или гетероарильной группе не ограничено. Более того, если две или более части арильной группы или гетероарильной группы являются замещенными, то заместители могут быт одинаковыми или разными. В этом отношении ограничений нет.
Арильная группа в R2 в общей формуле (1) представляет фенильную группу, нафтильную группу, антранильную группу, фенантранильную группу и подобные.
Примеры гетероарильной группы в R2 общей формулы (1) включают азотсодержащие гетероциклические группы, такие как пиридильная группа, пиримидильная группа, пиразолильная группа, пиразинильная группа, пиридазинильная группа. Имидазолильная группа, индолильная группа, хинолильная группа, хиноксалильная группа, бензимидазолильная группа и подобные; кислородсодержащие гетероциклические группы, такие как тетрагидрофуранильная группа, фуранильная группа, пиранильная группа, диоксанильная группа, 2,3-дигидробензо[1,4]диоксинильная группа, бензофуранильная группа и подобные; и гетероциклические группы, содержащие два или более гетероатомов, такие как оксазолильная группа, изоксазолильная группа, бензоксазолильная группа, бензоизоксазолильная группа и подобные.
В соединении, представленном общей формулой (1), R3 или R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной. Более того, R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 могут быть связаны с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
В R3 и R4 общей формулы (1) примеры заместителя в алкильной группе, имеющей от 1 до 5 атомов углерода, которая может быть замещенной, в циклоалкильной группе, имеющей от 3 до 6 атомов углерода, которая может быть замещенной, арильной группе, которая может быть замещенной, арилалкильной группе, которая может быть замещенной, гетероарильной группе, которая может быть замещенной, включают алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа и подобные; циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и подобные; галогензамещенные алкильные группы, такие как трифторметильная группа, дифторметильная группа, бромодифторметильная группа, трифторэтильная группа и подобные; алкоксигруппы, такие как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и подобные; циклоалкоксигруппы, такие как циклопропоксигруппа, циклобутоксигруппа, циклопентилоксигруппа, циклогексилоксигруппа и подобные; галогензамещенные алкоксигруппы, такие как трифторметоксигруппа, дифторметоксигруппа, трифторэтоксигруппа и подобные; алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутоксикарбонильная группа, втор-бутоксикарбонильная группа и подобные; циклоалкоксикарбонильные группы, такие как циклопропоксикарбонильная группа, циклобутоксикарбонильная группа, циклопентилоксикарбонильная группа, циклогексилоксикарбонильная группа и подобные; арилоксикарбонильные группы, такие как феноксикарбонильная группа и подобные; алкилсульфонильные группы, такие как метансульфоновая группа, этансульфоновая группа, пропансульфоновая группа, бутансульфоновая группа и подобные; галогензамещенные алкилсульфонильные группы, такие как трифторметансульфоновая группа, дифторметансульфоновая группа, трифторэтансульфоновая группа и подобные; алкилкарбонильные группы, такие как метилкарбонильная группа, этилкарбонильная группа, пропилкарбонильная группа, изопропилкарбонильная группа и подобные; циклоалкилкарбонильные группы, такие как циклопропилкарбонильная группа, циклобутилкарбонильная группа, циклопропилкарбонильная группа, циклопентилкарбонильная группа, циклогексилкарбонильная группа и подобные; арилкарбонильные группы, такие как бензоильная группа и подобные; алкилкарбонилоксигруппы, такие как метилкарбонилоксигруппа, этилкарбонилоксигруппа, пропилкарбонилоксигруппа, изопропилкарбонилоксигруппа и подобные; циклоалкилкарбонилоксигруппы, такие как циклопропилкарбонилоксигруппа, циклобутилкарбонилоксигруппа, циклопентилкарбонилоксигруппа, циклогексилкарбонилоксигруппа и подобные; и арилкарбонилоксигруппы, такие как бензоилоксигруппа и подобные; и галогены, такие как фтор, хлор, бром, иод и подобные. Что касается алкильной группы, циклоалкильной группы, арилалкильной группы, гетероарилалкильной группы, арильной группы или гетероарильной группы, если замещенными являются две или более их части, то заместители могут быт одинаковыми или разными. В этом отношении ограничений нет. Однако исключением является трифторметильная группа R3 или R4, и также являются исключением галогензамещенные ароматические группы, подвергаемые каталитическому гидрированию, например галогенированные арильные группы, такие как хлорофенил, бромофенил, фенил и подобные, или галогенированные гетероарильные группы, такие как хлоропиридин и подобные.
Алкильная группа, имеющая от 1 до 6 атомов углерода в R3 или R4 в общей формуле (1), является той же самой, что и группы, описанные в R1 в общей формуле (1).
Циклоалкильная группа, имеющая от 3 до 6 атомов углерода в R3 или R4 в общей формуле (1), является той же самой, что и группы, описанные в R1 в общей формуле (1).
Арильная группа в R3 или R4 в общей формуле (1) является той же самой, что и группы, описанные в R2 в общей формуле (1).
В арилалкильной группе в R3 или R4 в общей формуле (1) арильная часть является той же самой, что и арильная группа, описанная в R2 в общей формуле (1), в то время как ее алкильная часть представляет алкильную группу, имеющую от 1 до 4 атомов углерода.
Примеры гетероарильной группы в R3 или R4 общей формулы (1) включают азотсодержащие гетероциклические группы, такие как пиридильная группа, пиримидильная группа, пиразолильная группа, пиразинильная группа, пиридазинильная группа, имидазолильная группа, индолильная группа, хинолильная группа, хиноксалильная группа, бензимидазолильная группа и подобные; кислородсодержащие гетероциклические группы, такие как тетрагидрофуранильная группа, фуранильная группа, пиранильная группа, диоксанильная группа, 2,3-дигидробензо[1,4]диоксинильная группа, бензофуранильная группа и подобные; и гетероциклические группы, содержащие два или более гетероатомов, такие как оксазолильная группа, изоксазолильная группа, бензоксазолильная группа, бензоизоксазолильная группа и подобные.
В гетероарильной группе в R3 или R4 в общей формуле (1) гетероарильная часть является той же самой, что и гетероарильная группа, описанная в R2 в общей формуле (1), в то время как ее алкильная часть представляет алкильную группу, имеющую от 1 до 4 атомов углерода.
Если соединение, представленное общей формулой (1), имеет асимметрический атом углерода, то может быть использовано оптически активное вещество или рацемат.
Каталитическое гидрирование соединения, представленного общей формулой (1), возможно провести в присутствии кислоты для превращения соединения, представленного общей формулой (1), в соединение, представленное общей формулой (2).
Соответственно, образование побочного продукта может быть подавлено, и соединение, представленное общей формулой (2), может быть получено с высоким выходом.
В соединении, представленном общей формулой (2), R1, R2, R3 и R4 являются теми же самыми, что описано в общей формуле (1).
Используемая кислота не ограничена, если она не разлагает соединение, представленное общей формулой (1) или (2). Могут быть использованы, например, органические кислоты или неорганические кислоты.
Примеры органической кислоты включают муравьиную кислоту, уксусную кислоту, метансульфоновую кислоту и подобные, в то время как примеры неорганической кислоты включают хлороводородную кислоту, серную кислоту, фосфорную кислоту и подобные.
Количество используемой кислоты не ограничено, если требуемая реакция проходит, но обычно оно составляет не менее чем от 1 эквивалента до 20 эквивалентов.
В качестве способа каталитического гидрирования может быть приведен способ проведения каталитического гидрирования с такими металлами, как палладий, платина, родий, рутений и подобные. Данные металлы могут быть использованы в виде оксида металла, хлорида металла или подобного.
Количество используемого металла для осуществления способа каталитического гидрирования особо не ограничено, если реакция проходит, но из экономических соображений предпочтительно, что оно составляло или было не более чем вес общей формулы (1).
В качестве типа используемого металла могут использоваться металлы, нанесенные на активированный уголь, SiO2, Al2O3, BaSO4, TiO2, ZrO2, ThO2, диатомовую землю или подобные.
Растворитель, используемый для осуществления способа каталитического гидрирования, особо не ограничен, если реакция проходит. Их конкретные примеры включают спиртовые растворители, такие как метанол, этанол, изопропанол и подобные; ароматические растворители, такие как бензол, толуол, ксилол и подобные; углеводородные растворители, такие как гексан, гептан и подобные; амидные растворители, такие как диметилформамид, диметилацетамид, 1-метил-2-пирролидон и подобные; эфирные растворители, такие как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран, диоксан и подобные; сложноэфирные растворители, такие как этилацетат, бутилацетат, изопропилацетат и подобные, и вода. Данные растворители могут быть использованы по отдельности, или же два или более их вида могут быть использованы в сочетании в произвольном соотношении.
Количество используемого растворителя особо не ограничено, но обычно предпочтительно, чтобы оно составляло от 3 до 40 весовых частей по отношению к весу общей формулы (1).
Тип реакции особо не ограничен, но предпочтительно, чтобы соединение, представленное общей формулой (1), или соединение, представленное общей формулой (1), разбавленное вышеописанным растворителем, прибавляли по каплям к растворителю, содержащему металл и кислоту, в присутствии источника водорода.
Давление реакции особо не ограничено, и реакция может проводиться при атмосферном давлении или при приложенном давлении.
Используемый источник водорода для каталитического гидрирования не ограничен, если реакция проходит, но наряду с газообразным водородом может быть использовано гидрирование с переносом с циклогексеном, муравьиной кислотой и формиатом и подобные.
Эквивалент используемых циклогексена, муравьиной кислоты и формиата для проведения реакции гидрирования с переносом не ограничен, если количество генерируемого водорода составляет не менее чем 2 эквивалента, но из экономических соображений предпочтительно, чтобы от не менее чем 2 эквивалента до не более чем 10 эквивалентов.
Применение соединения, представленного общей формулой (2), полученного вышеуказанной реакцией, на следующей стадии особо не ограничено. Реакционный раствор, содержащий соединение, представленное общей формулой (2), может быть подвергнуто обычной доочистке, такой как удаление растворителя, жидкостное разделение и подобные, и затем использовано на следующей стадии без осуществления выделения и очистки, или оно может быть использовано на следующей стадии в виде соли неорганической кислоты, такой как хлороводородная кислота, серная кислота, фосфорная кислота и подобные, или органической кислоты, такой как щавелевая кислота, фумаровая кислота, малеиновая кислота, муравьиная кислота, уксусная кислота, метансульфоновая кислота или подобные.
Соединение, представленное общей формулой (2), также содержит соль, образованную неорганической кислотой или органической кислотой. Примеры неорганической кислоты включают хлороводородную кислоту, серную кислоту, фосфорную кислоту и подобные, в то время как примеры органической кислоты включают щавелевую кислоту, фумаровую кислоту, малеиновую кислоту, муравьиную кислоту, уксусную кислоту, метансульфоновую кислоту или подобные.
Образующийся продукт может быть превращен в соединение, представленное общей формулой (4), взаимодействием соединения, представленного общей формулой (2), с соединением, представленным общей формулой (3).
В соединении, представленном общей формулой (3), R5 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной.
В R5 примеры заместителей в алкильной группе, имеющей от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильной группе, имеющей от 3 до 6 атомов углерода, арильной группе, которая может быть замещенной, арилалкильной группе, которая может быть замещенной, или гетероарильной группе, которая может быть замещенной, или гетероарилалкильной группе, которая может быть замещенной, включают алкильные группы, такие как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа и подобные; циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа и подобные; галогензамещенные алкильные группы, такие как трифторметильная группа, дифторметильная группа, бромодифторметильная группа, трифторэтильная группа и подобные; алкоксигруппы, такие как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и подобные; циклоалкоксигруппы, такие как циклопропоксигруппа, циклобутоксигруппа, циклопентилоксигруппа, циклогексилоксигруппа и подобные; галогензамещенные алкоксигруппы, такие как трифторметоксигруппа, дифторметоксигруппа, трифторэтоксигруппа и подобные; алкоксикарбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутоксикарбонильная группа, втор-бутоксикарбонильная группа и подобные; циклоалкоксикарбонильные группы, такие как циклопропоксикарбонильная группа, циклобутоксикарбонильная группа, циклопентилоксикарбонильная группа, циклогексилоксикарбонильная группа и подобные; арилоксикарбонильные группы, такие как феноксикарбонильная группа и подобные; алкилтиогруппы, такие как метилтиогруппа, этилтиогруппа, пропилтиогруппа, бутилтиогруппа и подобные; галогензамещенные алкилтиогруппы, такие как трифторметилтиогруппа, дифторметилтиогруппа, трифторэтилтиогруппа и подобные; алкилсульфонильные группы, такие как метансульфиновая группа, этансульфиновая группа, пропансульфиновая группа, бутансульфиновая группа и подобные; галогензамещенные алкилсульфинильные группы, такие как трифторметансульфиновая группа, дифторметансульфиновая группа, трифторэтансульфиновая группа и подобные; алкилсульфонильные группы, такие как метансульфоновая группа, этансульфоновая группа, пропансульфоновая группа, бутансульфоновая группа и подобные; галогензамещенные алкилсульфонильные группы, такие как трифторметансульфоновая группа, дифторметансульфоновая группа, трифторэтансульфоновая группа и подобные; алкилкарбонильные группы, такие как метилкарбонильная группа, этилкарбонильная группа, пропилкарбонильная группа, изопропилкарбонильная группа и подобные; циклоалкилкарбонильные группы, такие как циклопропилкарбонильная группа, циклобутилкарбонильная группа, циклопропилкарбонильная группа, циклопентилкарбонильная группа, циклогексилкарбонильная группа и подобные; арилкарбонильные группы, такие как бензоильная группа и подобные; алкилкарбонилоксигруппы, такие как метилкарбонилоксигруппа, этилкарбонилоксигруппу, пропилкарбонилоксигруппа, изопропилкарбонилоксигруппа и подобные; циклоалкилкарбонилоксигруппы, такие как циклопропилкарбонилоксигруппа, циклобутилкарбонилоксигруппа, циклопентилкарбонилоксигруппа, циклогексилкарбонилоксигруппа и подобные; арилкарбонилоксигруппы, такие как бензоилоксигруппа и подобные; и галогены, такие как фтор, хлор, бром, иод и подобные. Число заместителей в арильной группе или гетероарильной группе не ограничено. Более того, если замещенными являются две или более части арильной группы или гетероарильной группы, то заместители могут быть одинаковыми или разными. В этом отношении ограничений нет.
Алкильная группа, имеющая от 1 до 6 атомов углерода в R5 в общей формуле (3), является той же самой, что и группы, описанные в R1 в общей формуле (1).
Циклоалкильная группа, имеющая от 3 до 6 атомов углерода в R5 в общей формуле (3), является той же самой, что и группы, описанные в R1 в общей формуле (1).
Арильная группа в R5 в общей формуле (3), является той же самой, что и группы, описанные в R2 в общей формуле (1).
В арилалкильной группе в R5 общей формулы (3) ее арильная часть является той же самой, что и арильная группа, описанная в R2 общей формулы (1), в то время как ее алкильная часть представляет алкильную группу, имеющую от 1 до 4 атомов углерода.
Примеры гетероарильной группы в R5 общей формулы (3), включают азотсодержащие гетероциклические группы, такие как пиридильная группа, пиримидильная группа, пиразолильная группа, пиразинильная группа, пиридазинильная группа, имидазолильная группа, индолильная группа, хинолильная группа, хиноксалильная группа, бензимидазолильная группа и подобные; серосодержащие гетероциклические группы, такие как тетрагидротиенильная группа, тиенильная группа, тиопиранильная группа, бензотиенильная группа и подобные; кислородсодержащие гетероциклические группы, такие как тетрагидрофуранильная группа, фуранильная группа, пиранильная группа, диоксанильная группа, 2,3-дигидробензо[1,4]диоксинильная группа, бензофуранильная группа и подобные; и гетероциклические группы, содержащие два или более гетероатомов, такие как оксазолильная группа, изоксазолильная группа, тиазолильная группа, изотиазолильная группа, бензоксазолильная группа, бензоизоксазолильная группа, бензотиазолильная группа, бензоизотиазолильная группа и подобные.
В гетероарилалкильной группе в R5 общей формулы (3) ее гетероарильная часть является той же самой, что и гетероарильная группа, описанная в R5 общей формулы (3), в то время как ее алкильная часть представляет алкильную группу, имеющую от 1 до 4 атомов углерода. В соединении, представленном общей формулой (3), Х представляет уходящую группу.
Примеры уходящей группы, представленной Х в общей формуле (3), включают атомы галогена, такие как фтор, хлор, бром, иод и подобные; алкоксигруппы, такие как метоксигруппа, этоксигруппа и подобные; арилоксигруппы, такие как феноксигруппа, 4-нитрофенильная группа и подобные; ацилоксигруппы, такие как ацетилоксигруппа, бензоилоксигруппа и подобные; алкоксикарбонилоксигруппы, такие как метоксикарбонилоксигруппа, этоксикарбонилоксигруппа, изобутоксикарбонилоксигруппа и подобные; арикарбонилоксигруппы, такие как фенилкарбонилоксигруппа и подобные; алкилтиогруппы, такие как метилтиогруппа и подобные; 2,5-диоксопирролидинилоксигруппа, бензотриазолилоксигруппа, имидазолилоксигруппа и подобные.
В соединении, представленном общей формулой (4), R1, R2, R3 и R4 являются теми же самыми, что описано в общей формуле (1), в то время как R5 является же самым, что описано в общей формуле (3).
Примеры используемых оснований включают неорганические основания, такие как гидроксид натрия, гидроксид калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия и подобные; и органические основания, такие как пиридин, коллидин, пиколин, 4-диметиламинопирролидин, лутидин, триэтиламин, диизопропиламин, диизопропилэтиламин, трибутиламин, 1,8-диазобицикло[5,4,0]ундек-7-ен, 1,4-диазобицикло[2,2,0]октан, имидазол и подобные. Данные основания могут быть использованы по отдельности, или могут быть использованы в сочетании два или более их вида в произвольном соотношении. Основание может быть использовано в количестве не менее 1 эквивалента по отношению к кислоте, если соединение, представленное общей формулой (2), образует соль с кислотой. Или, если кислота образуется во время реакции, основание может быть использовано в количество не менее 1 эквивалента по отношению к образующейся кислоте. Из экономических соображений предпочтительно, чтобы верхний предел составлял не более чем 10 эквивалентов.
Когда соединение, представленное общей формулой (2), взаимодействует с соединением, представленным общей формулой (3), то используемый растворитель особо не ограничен, если образуется соединение, представленное общей формулой (4). Конкретные примеры растворителя включают галогенсодержащие растворители, такие как дихлорметан, хлороформ и подобные; ароматические растворители, такие как бензол, толуол, ксилол и подобные; углеводородные растворители, такие как гексан, гептан и подобные; амидные растворители, такие как диметилформамид, диметилацетамид, 1-метил-2-пирролидон и подобные; мочевинные растворители, такие как 1,3-диметил-2-имидазолидинон, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон и подобные; сложноэфирные растворители, такие как этилацетат, бутилацетат, изопропилацетат и подобные; эфирные растворители, такие как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран, диоксан и подобные; нитрильные растворители, такие как ацетонитрил, пропионитрил и подобные; спиртовые растворители, такие как изопропанол, трет-бутиловый спирт и подобные; и вода. Данные растворители могут быть использованы по отдельности, или могут быть использованы в сочетании два или более их вида в произвольном соотношении.
Количество используемого растворителя особо не ограничено, но обычно оно составляет от не менее чем в 3 раза более веса до не более чем в 40 раз более веса соединения, представленного общей формулой (2).
Когда соединение, представленное общей формулой (2), взаимодействует с соединением, представленным общей формулой (3), температура реакции особо не ограничена, если соединение не разлагается, но обычно она составляет от не менее чем -10 до не более чем 150 градусов Цельсия или не более чем температура кипения растворителя.
Способ получения соединения, представленного общей формулой (1), особо не ограничен, и могут быть приобретены продажные реактивы. Или может быть использовано соединение, представленное общей формулой (1), которое получено взаимодействием соединения, представленного общей формулой (8), с соединением, представленным общей формулой (7), которое получается, если обратиться к реакции Штреккера, поясненной в опубликованной заявке Японии № 2002-34593, Tetrahedron: Asymmetry, т. 12, стр. 219-228, 2001; Journal of American Chemical Society, т. 124, № 34, стр. 10012-10014, 2002 или подобные.
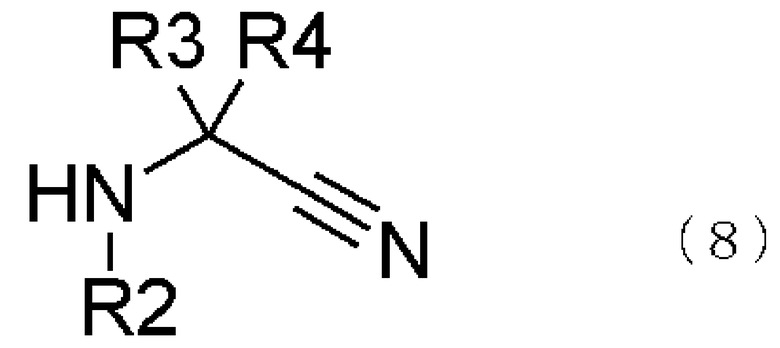
В общей формуле (8) R2, R3 и R4 те же самые, что и описаны в общей формуле (1).
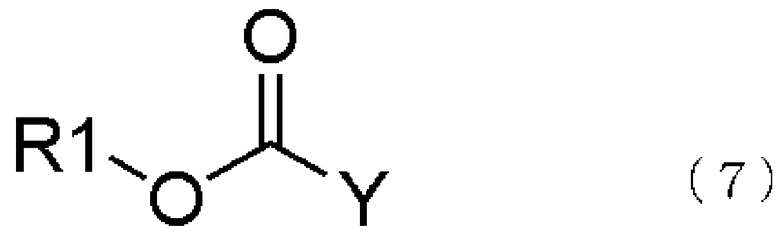
В общей формуле (7) R1 тот же самый, что и описан в общей формуле (1); и Y представляет атом галогена, такой как фтор, хлор, бром, иод или подобные.
К тому же, соединение, представленное общей формулой (1), может быть получено взаимодействием соединения, представленного общей формулой (5), с восстанавливающим агентом,
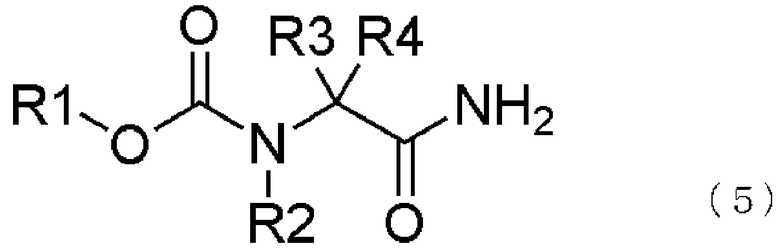
Реакция соединения, представленного общей формулой (5), с восстанавливающим агентом будет описано ниже.
В соединении, представленном общей формулой (5), R1, R2, R3 и R4 те же самые, что и описаны в общей формуле (1).
Примеры восстанавливающего агента включают галогенирующие агенты, такие как тионилхлорид, оксалилхлорид, фосген, оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора, тионилбромид, трибромид фосфора, мезилхлорид, тозилхлорид и подобные; производные карбодиимида, такие как N,N'-дициклогексилкарбодиимид, N,N'-диизопропилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид и подобные; ангидриды, такие как уксусный ангидрид, трифторуксусный ангидрид и подобные; реагент Вильсмейера и подобные.
Реагент Вильсмейера относится к соединению, представленному общей формулой (9), которое получается из производных формамида, таких как диметилформамид или подобные, галогенирующего агента,
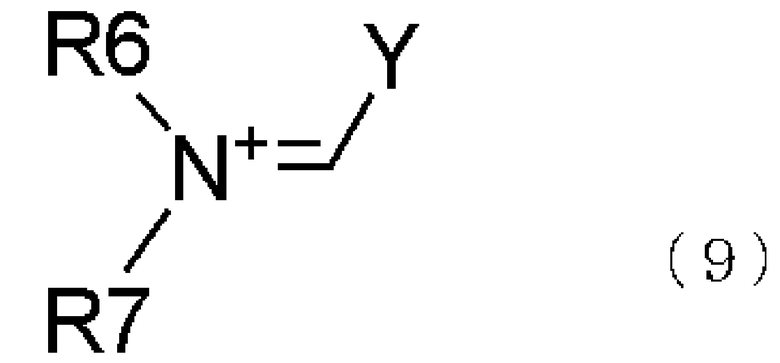
В общей формуле (9) R6 и R7 каждый независимо представляет алкильную группу, имеющую от 1 до 3 атомов углерода; и Y представляет атом галогена.
Соединение, представленное общей формулой (9), также содержит соль, полученную с галогенирующим агентом.
Алкильная группа, имеющая от 1 до 3 атомов углерода, в R6 и R7 общей формулы (9) представляет метильную группу, этильную группу, пропильную группу или подобные. Атом галогена в Y общей формулы (9) представляет атом галогена, такой как фтор, хлор, бром, иод или подобные.
Использование восстанавливающего агента особо не ограничено. Может быть использован либо способ, включающий добавление субстрата к восстанавливающему агенту, либо способ, включающий добавление восстанавливающего агента к субстрату.
Использование восстанавливающего агента, если это реагент Вильсмейера, также особо не ограничено. Может быть осуществлен способ, включающий предварительное приготовление реагента Вильсмейера в растворителе, добавление затем к нему соединения, представленного общей формулой (5), либо способ, включающий введение в растворитель, содержащий производные формамида, соединения, представленного общей формулой (5), и галогенирующего агента.
Количество восстанавливающего агента особо не ограничено, если оно составляет не менее чем 1 эквивалент, по отношению к соединению, представленному общей формулой (5), но обычно оно составляет от не менее чем 1 эквивалента до не менее чем 10 эквивалентов.
Количество восстанавливающего агента, если это реагент Вильсмейера, особо не ограничено, если галогенирующий агент используется в количестве не менее чем 1 эквивалент по отношению к соединению, представленному общей формулой (5), и производные формамида используются в не менее чем каталитическом количестве. Количество галогенирующего агента обычно составляет от не менее чем 1 эквивалент до не менее 10 эквивалентов, в то время как количество производных формамида обычно составляет от не менее чем 0,1 эквивалент до не менее 10 эквивалентов по отношению к соединению, представленному общей формулой (5). Более того, производные формамида также могут быть использованы в качестве растворителя.
Когда соединение, представленное общей формулой (5), превращают в соединение, представленное общей формулой (1), то используемый растворитель особо не ограничен, если это протонный растворитель. Конкретные примеры растворителя включают галогенсодержащие растворители, такие как дихлорметан, хлороформ и подобные; ароматические растворители, такие как бензол, толуол, ксилол и подобные; углеводородные растворители, такие как гексан, гептан и подобные; амидные растворители, такие как диметилформамид, диметилацетамид, 1-метил-2-пирролидон и подобные; эфирные растворители, такие как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран, диоксан и подобные; нитрильные растворители, такие как ацетонитрил, пропионитрил и подобные; мочевинные растворители, такие как 1,3-диметил-2-имидазолидинон, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон и подобные; и сложноэфирные растворители, такие как этилацетат, бутилацетат, изопропилацетат и подобные. Растворители могут быть использованы по отдельности, или могут быть использованы в сочетании два или более их вида в произвольном соотношении.
Среди используемых восстанавливающих агентов настоящего изобретения предпочтительно, чтобы использовался реагент Вильсмейера.
Количество растворителя особо не ограничено, но обычно предпочтительно, чтобы оно составляло от 3 до 40 раз более веса соединения, представленного общей формулой (5).
Когда соединение, представленное общей формулой (5), превращают в соединение, представленное общей формулой (1), температура реакции особо не ограничена, если реакция проходит, но обычно она составляет от не менее чем -10 до не более чем 150 градусов Цельсия или не более чем температура кипения растворителя.
Благодаря такой обычной реакции соединение, представленное общей формулой (1), может быть получено с высоким выходом. По этой причине реакция является полезной в качестве способа промышленного получения соединения, представленного общей формулой (1).
В настоящем изобретении вышеупомянутое соединение, представленное общей формулой (5), может быть получено взаимодействием соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7), в присутствии воды,
Способ получения соединения, представленного общей формулой (5), будет объяснен ниже.
В общей формуле (6) R2, R3 и R4 те же самые, что и описаны в общей формуле (1).
Соединение, представленное общей формулой (6), также содержит соль, образованную неорганической кислотой или органической кислотой. Примеры неорганической кислоты включают хлороводородную кислоту, серную кислоту, фосфорную кислоту и подобные, в тое время как примеры органической кислоты включают муравьиную кислоту, уксусную кислоту, метансульфоновую кислоту и подобные.
Для общей формулы (6) могут быть использованы коммерческие продукты. В этом случае могут быть использованы свободная форма или их соль.
В общей формуле (7) R1 тот же самый, что и в общей формуле (1); в то время как Y представляет атом галогена, такой как фтор, хлор, бром, иод или подобные.
Также как и способ получения соединения, представленного общей формулой (5), соединение может быть получено с хорошей эффективностью взаимодействием соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7), в присутствии воды. Реакция, проводимая в присутствии воды, является особенностью настоящего изобретения. Благодаря данной особенности выход соединения, представленного общей формулы (5), значительно увеличивается.
Количество используемого соединения, представленного общей формулой (7), особо не ограничено, если оно составляет не менее чем 1 эквивалент по отношению к соединению, представленному общей формулой (6), но из экономических соображений оно составляет от не менее чем 1 эквивалента до не менее чем 5 эквивалентов.
Когда соединение, представленное общей формулой (6), взаимодействует с соединением, представленным общей формулой (7), то может быть использовано основание. Примеры оснований включают неорганические основания, такие как гидроксид нартия, гидроксид калия, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия и подобные; и органические основания, такие как пиридин, коллидин, пиколин, 4-диметиламинопирролидин, лутидин, триэтиламин, диизопропиламин, диизопропилэтиламин, трибутиламин, 1,8-диазобицикло[5,4,0]ундек-7-ен, 1,4-диазобицикло[2,2,0]октан, имидазол и подобные. Данные основания могут быть использованы по отдельности, или могут быть использованы в сочетании два или более их вида в произвольном соотношении.
Количество использованного основания составляет не менее 1 эквивалента по отношению к соединению, представленному общей формулой (6), или оно особо не ограничено, если оно составляет не менее чем 2 эквивалента, если соединение, представленное общей формулой (6), является солью. Из экономических соображений предпочтительно, чтобы верхний предел составлял не более чем 10 эквивалентов.
Если соединение, представленное общей формулой (6), взаимодействует с соединением, представленным общей формулой (7), используемый растворитель является водой или растворителем, содержащим воду. Два или более растворителя могут быть использованы в сочетании в произвольном соотношении. Конкретные примеры растворителя для смешения включают галогенсодержащие растворители, такие как дихлорметан, хлороформ и подобные; ароматические растворители, такие как бензол, толуол, ксилол и подобные; углеводородные растворители, такие как гексан, гептан и подобные; амидные растворители, такие как диметилформамид, диметилацетамид, 1-метил-2-пирролидон и подобные; мочевинные растворители, такие как 1,3-диметил-2-имидазолидинон, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон и подобные; сложноэфирные растворители, такие как этилацетат, бутилацетат, изопропилацетат и подобные; эфирные растворители, такие как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран, диоксан и подобные; нитрильные растворители, такие как ацетонитрил, пропионитрил и подобные.
Соединение, представленное общей формулой (7), может быть разбавлено растворителем и добавлено по каплям. Используемый растворитель в данном случае особо не ограничен, если он не взаимодействует с соединением, представленным общей формулой (7). Конкретные примеры растворителя для смешения включают галогенсодержащие растворители, такие как дихлорметан, хлороформ и подобные; ароматические растворители, такие как бензол, толуол, ксилол и подобные; углеводородные растворители, такие как гексан, гептан и подобные; амидные растворители, такие как диметилформамид, диметилацетамид, 1-метил-2-пирролидон и подобные; мочевинные растворители, такие как 1,3-диметил-2-имидазолидинон, 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидинон и подобные; сложноэфирные растворители, такие как этилацетат, бутилацетат, изопропилацетат и подобные; эфирные растворители, такие как диэтиловый эфир, диизопропиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран, диоксан и подобные; нитрильные растворители, такие как ацетонитрил, пропионитрил и подобные.
Количество используемого растворителя особо не ограничено, но обычно предпочтительно, чтобы оно составляло от 3 до 40 раз больше веса соединения, представленного общей формулой (6).
Температура реакции особо не ограничена, если соединение не разлагается, но обычно она составляет от не менее чем -30 до не более чем 150 градусов Цельсия или не более чем температура кипения растворителя.
Как описано выше, соединение, представленное общей формулой (4), то есть производные этилендиамина, имеющие галогенированную карбаматную группу и арильную группу, может быть эффективно получено.
ПРИМЕРЫ
Настоящее изобретение детально проиллюстрировано ниже со ссылками на примеры. Однако настоящее изобретение не ограничивается данными примерами.
Здесь и далее тетрагидрофуран называется ТГФ; диизопропиловый эфир как ИПЭ; диметилформамид как ДМФА; и изопропиловый спирт как ИПС.
Пример 1
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-валинамида (далее называемого соединение (I))
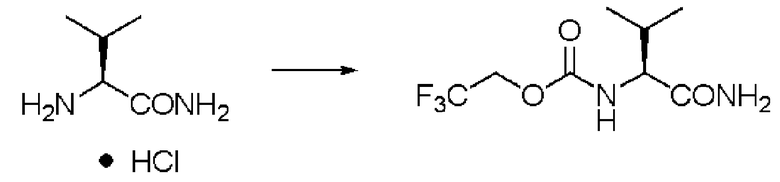
К 25,0 г валинамида гидрохлорида добавляли 325 мл воды, и при добавлении 8% водного раствора гидроксида натрия рН реакционного раствора становился 8. К раствору добавляли по каплям 35 мл диоксана, содержащего 31,94 г хлорида N-(2,2,2-трифторэтоксикарбонила и 8% водный раствор гидроксида натрия, поддерживая в то же время рН 8±0,5 при комнатной температуре. После завершения добавления по каплям раствор перемешивали в течение 2 часов, и затем отфильтровывали осадок и высушивали в вакууме. Заглавное соединение было получено в виде белого твердого вещества.
Количество: 37,80 г (выход: 95%).
1Н ЯМР (ДМСО-d6) δ 0,84 (3H, д, J=6,83 Гц), 0,86 (3H, д, J=6,83 Гц), 1,98 (1H, м), 3,78 (1H, дд, J=6,83, 8,78 Гц), 4,64 (2H, м), 7,05 (1H, уш.с), 7,37 (1H, уш.с), 7,61 (1H, д, J=8,78 Гц).
Сравнительный пример 1
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-валинамида в отсутствии воды
К 30 мл раствора ТГФ, содержащего 3,0 г валинамида гидрохлорида, добавляли 5,25 мл пиридина, и затем к раствору добавляли по каплям 5 мл ТГФ, содержащего 3,83 г 2,2,2-трифторэтоксикарбонила гидрохлорида. Образующуюся смесь перемешивали при комнатной температуре в течение 3 часов, и затем к смеси добавляли воду и этилацетат, и проводили разделение жидкостей. Органический слой промывали 1N хлороводородной кислотой, насыщенным раствором карбоната натрия и насыщенным раствором хлорида натрия, и затем высушивали над сульфатом натрия. После удаления сульфата натрия добавляли ИПЭ, и получающуюся смесь перемешивали. Полученный белый осадок был соединением (I), а выход составил 47% (количество: 2,25 г). Даже когда та же реакция проводилась с использованием триэтиламина вместо пиридина, выход составлял 30%. Из данных результатов реакции было определено, что в примере 1, осуществленном с водным растворителем, выход реакции был заметно выше.
Пример 2
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-валинонитрила (далее называемого соединение (II))
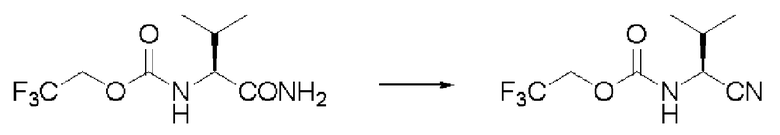
К 350 мл толуола добавляли 35,0 г соединения (I) и 35 мл ДМФА, и образующуюся смесь перемешивали при комнатной температуре. К суспензии осторожно добавляли по каплям 35 мл толуола, содержащего 22,01 г оксалилхлорида. Раствор перемешивали при той же температуре в течение 2 часов, и затем к смеси добавляли 350 мл воды, и проводили разделение жидкостей. Далее, отделенный органический слой промывали 350 мл воды, и затем отгоняли растворитель при пониженном давлении. Затем после отгонки при от 116 до 122 градусов Цельсия при 0,3 мм рт.ст. была выделена фракция дистиллята. Полученное бесцветное и прозрачное маслянистое вещество было заглавным соединением.
Количество: 29,89 г (выход: 92%).
1Н ЯМР (CDCl3) δ 1,10 (3Н, д, J=6,83 Гц), 1,12 (3H, д, J=6,83 Гц), 2,09 (1H, септ, J=6,83 Гц), 4,4-4,6 (3H, м), 5,31 (1H, уш.д).
Пример 3
Синтез соединения (II) по способу получения заранее Вильсмейера
К 5 мл толуола, содержащего 1 мл ДМФА, при комнатной температуре добавляли по каплям 5 мл толуола, содержащего 433 мкл оксалилхлорида. Образующийся раствор перемешивали при комнатной температуре в течение 30 минут, и затем в него ввели 1,0 г соединения (I), и оставили взаимодействовать в течение 3 часов. Органический слой промывали водой, и затем очищали хроматографией на силикагеле, получив соединение (II).
Количество: 0,92 г (выход: >99%).
Пример 4
Синтез соединения (II) с этилацетатом в качестве растворителя
Синтез проводили тем же способом, что и в примере 2, за исключением того, что было использовано 5,0 г соединения (I), растворитель был изменен с толуола на этилацетат, и способ очистки был изменен с перегонки на колоночную хроматографию. В результате может быть получено соединение (II).
Количество: 4,45 г (выход: 96%).
Пример 5
Синтез (2S)-3-метил-N2-(2,2,2-трифторэтоксикарбонил)-бутан-1,2-диамина гидрохлорида (далее называемого соединение (III)) (1)

К 180 мл ИПС последовательно добавляли 26,8 г уксусной кислоты, 2,0 г 5% палладия на угле (вода: 49,5%, продукт N.E.Chem.) и 14,1 г формиата аммония, и образующийся раствор полностью перемешивали. К раствору при комнатной температуре по каплям прибавляли 10 мл ИПС, содержащего 10,0 г соединения (II), и затем раствор перемешивали при той же температуре в течение 2,5 часов. Катализатор удаляли фильтрацией, и затем растворитель отгоняли при пониженном давлении. К остатку добавляли воду и этилацетат. Потом для проведения разделения жидкостей добавляли карбонат калия до тех пор, пока рН воды не становился примерно 10. К отделенному органическому слою добавляли сульфат натрия, и высушивали органический слой и фильтровали. После этого к раствору добавляли раствор 4N хлороводорода в этилацетате. Когда раствор сконцентрировали при пониженном давлении, белое твердое вещество выпало в осадок, и осадок отфильтровали, получив заглавное соединение.
Количество: 10,5 г (выход: 89%).
1Н ЯМР (ДМСО-d6) δ 0,83 (3H, д, J=6,83 Гц), 0,85 (3H, д, J=6,83 Гц), 1,77 (1H, септ, J=6,83 Гц), 2,74 (1H, дд, J=9,76, 13,17 Гц), 2,93 (1H, дд, J=3,42, 13,17 Гц), 3,54 (1H, м), 4,55 (1H, м), 4,73 (1H, м), 7,67 (1H, д, J=9,27 Гц), 8,02 (3H, уш.с).
Пример 6
Синтез соединения (III) (2)
50 мл ИПС, содержащего 3,30 г соединения (II), 9,0 г уксусной кислоты, 0,6 г 5% палладия на угле (вода: 49,5%, продукт N.E.Chem.) были герметизированы в автоклаве с газообразным водородом при 2,1 МПа, и затем реакцию проводили при комнатной температуре. После проведения реакции в течение 5 часов катализатор был удален, и образующийся раствор сконцентрировали при пониженном давлении. На этой стадии, когда свободная форма соединения (III) была количественно проанализирована высокоэффективной жидкостной хроматографией, выход реакции составлял 95%. К остатку добавляли воду и этилацетат, и затем для проведения разделения жидкостей рН раствора был доведен до 10,7 добавлением 8% водного раствора гидроксида натрия. Органический слой высушивали над сульфатом натрия и фильтровали, и затем к раствору добавляли 4N раствор хлороводорода в этилацетате. Когда раствор сконцентрировали при пониженном давлении, белое твердое вещество выпало в осадок, и осадок отфильтровали, получив заглавное соединение.
Количество: 3,60 г (выход: 92%).
Пример 7
Синтез соединения (III) (3)
Реакцию проводили тем же способом, что и в примере 6, за исключением того, что вместо ИПС был использован метанол, и каталитическое количество было в 5 раз больше. Свободная форма соединения (III) была получена с выходом реакции 93%.
Пример 8
Синтез соединения (III) (4)
Реакцию проводили тем же способом, что и в примере 7, за исключением того, что вместо метанола был использован этанол. Свободная форма соединения (III) была получена с выходом реакции 91%.
Сравнительный пример 1
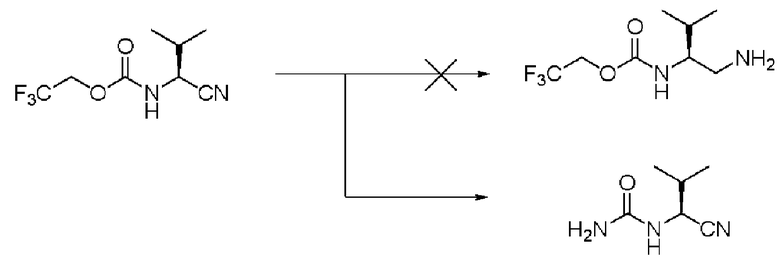
Восстановление соединения (II) проводили по способу непатентного документа 2. 30 мл насыщенного аммиаком этанола, содержащего 0,6 г соединения (II) и 0,6 никеля Ренея (продукт Wako Pure Chemical Industries, Ltd.), были герметизированы в автоклаве с газообразным водородом при 0,35 МПа, и затем реакцию проводили при комнатной температуре. После проведения реакции в течение 5 часов катализатор был удален, и растворитель отогнали при пониженном давлении. Когда добавили ИПЭ и отфильтровали осадок, полученное соединение не было свободной формой требуемого соединения (III), но оказался N-(аминокарбонил)-L-валинонитрилом (далее называемым примесью (I)). Как описано выше, было определено, что требуемое соединение не может быть получено обычным способом.
Количество примеси (I): 0,16 г (выход: 42%).
1Н ЯМР (ДМСО-d6) δ 0,95 (3H, д, J=6,83 Гц), 0,98 (3H, д, J=6,83 Гц), 1,94 (1H, м), 4,43 (1H, м), 5,78 (2H, с), 6,75 (1H, уш.с).
Пример 9
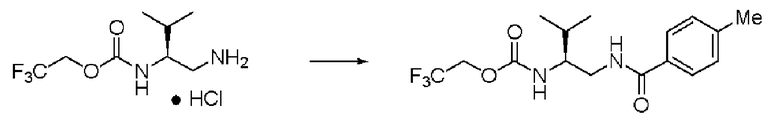
Синтез (2S)-3-метил-N1-толуоил-N2-(2,2,2-трифторэтоксикарбонил)-бутан-1,2-диамина (далее называемого соединение (IV)) (1)
К 25 мл воды, содержащей 1,91 г гидрокарбоната натрия, добавляли 20 мл этилацетата и 2,0 г соединения (III), и перемешивали образующуюся смесь. К раствору по каплям добавляли 1,40 г хлорангидрида толуиловой кислоты. Раствор перемешивали в течение 2,5 часов, и затем провели разделение жидкостей. К органическому слою добавляли сульфат натрия, органический слой высушивали над сульфатом натрия и фильтровали. Затем раствор сконцентрировали при пониженном давлении. Далее к остатку дополнительно добавляли 30 мл ИПЭ, и осадок полностью промывали и затем отфильтровывали. Полученное белое твердое вещество было заглавным соединением.
Количество: 2,33 г (выход: 89%).
Пример 10
Синтез соединения (IV) (2)
К смешанному раствору из 20 мл этилацетата и 30 мл воды добавляли 2,0 г соединения (III), и затем добавлением 8 вес.% водного раствора гидроксида натрия рН установили равным 8. Затем, поддерживая рН от 7,5 до 8,5, к смеси по каплям добавляли раствор этилацетата, содержащий 1,4 г хлорангидрида толуиловой кислоты. После завершения реакции проводили разделение жидкостей, и органический слой высушивали над сульфатом натрия. Сульфат натрия удаляли, и затем растворитель отгоняли при пониженном давлении. Далее добавляли ИПЭ, и осадок отфильтровывали. Полученное белое твердое вещество было заглавным соединением.
Количество: 2,19 г (выход: 84%).
Пример 11
Синтез (2S)-3-метил-N1-(1-метил-3-трифторметил-1Н-пиразол-4-карбонил)-N2-(2,2,2-трифторэтоксикарбонил)-бутан-1,2-диамина
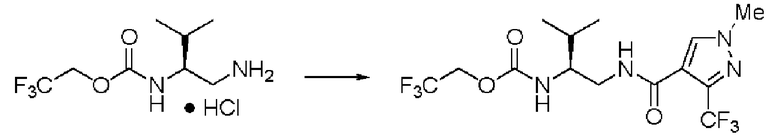
Реакцию проводили тем же способом, что и в примере 9, за исключением того, что был использован 1,0 г соединения (III), и вместо хлорангидрида толуиловой кислоты был использован 1-метил-3-трифторметил-1Н-пиразол-4-карбонилхлорид.
Выход белого твердого вещества: 1,24 г (92%).
1Н ЯМР (CDCl3) δ 0,98 (3H, д, J=6,83 Гц), 1,00 (3H, д, J=6,83 Гц), 1,85 (1H, м), 3,53 (2H, м), 3,66 (1H, м), 3,95 (3H, с), 4,42 (2H, м), 5,13 (1H, уш.д), 6,30 (1H, уш.с), 7,86 (1H, s).
Пример 12
Синтез (2S)-3-метил-N1-(2,4-дихлорбензоил)-N2-(2,2,2-трифторэтоксикарбонил)-бутан-1,2-диамина
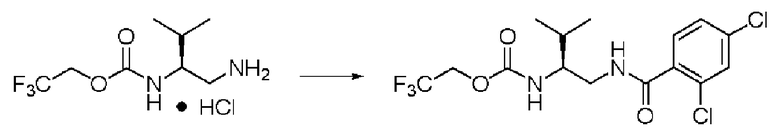
Реакцию проводили тем же способом, что и в примере 9, за исключением того, что было использовано 0,5 г соединения (III), и вместо хлорангидрида толуиловой кислоты был использован хлорид 2,4-дихлорбензоила.
Выход белого твердого вещества: 0,64 г (96%).
1Н ЯМР (CDCl3) δ 0,99 (3H, д, J=6,83 Гц), 1,01 (3H, д, J=6,83 Гц), 1,88 (1H, м), 3,53 (1H, м), 3,65 (1H, м), 3,68 (1H, м), 4,43 (2H, м), 5,16 (1H, д, J=8,78 Гц), 6,50 (1H, уш.с), 7,30 (1 H, дд, J=1,95, 8,29 Гц), 7,41 (1H, д, J=1,95 Гц), 7,55 (1H, д, J=8,23 Гц).
Пример 13
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-лейцинамида (далее называемого соединение (V))
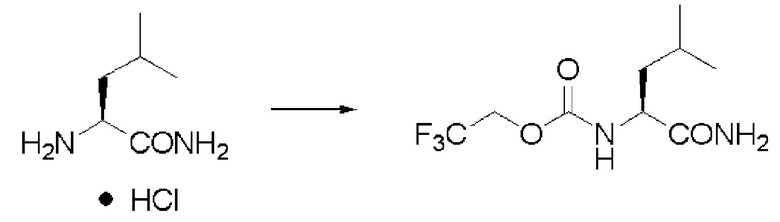
Реакцию проводили тем же способом, что и в примере 1, за исключением того, что был использован лейцинамида гидрохлорид вместо валинамида гидрохлорида, и было использовано 5,0 г лейцинамида гидрохлорида.
Количество белого твердого вещества: 7,0 г (выход: 91%).
1Н ЯМР (ДМСО-d6) δ 0,85 (3H, д, J=6,34 Гц), 0,87 (3H, д, J=6,83 Гц), 1,47 (2H, м), 1,59 (1H, м), 3,96 (1H, м), 4,69 (2H, м), 6,98 (1H, с), 7,36 (1H, с), 7,74 (1H, д, J=8,29 Гц).
Пример 14
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-лейцинонитрила (далее называемого соединение (VI))
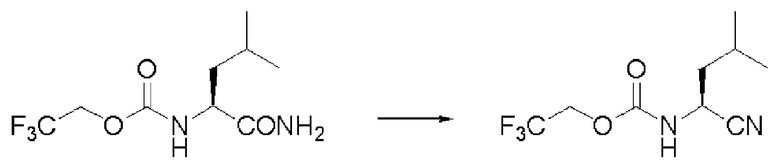
Реакцию проводили тем же способом, что и в примере 2, за исключением того, что было использовано соединение (V) вместо соединения (I), и было использовано 5,0 г соединения (V). На этой стадии очистка проводилась не перегонкой, а колоночной хроматографией.
Количество желтого маслянистого вещества: 4,41 г (95%).
1Н ЯМР (CDCl3) δ 0,99 (6H, д, J=6,34 Гц), 1,7-1,9 (3H, м), 4,47 (1H, м), 4,53 (1H, м), 4,62 (1H, м), 5,31 (1H, уш.д).
Пример 15
Синтез (2S)-4-метил-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина гидрохлорида (далее называемого соединение (VII))
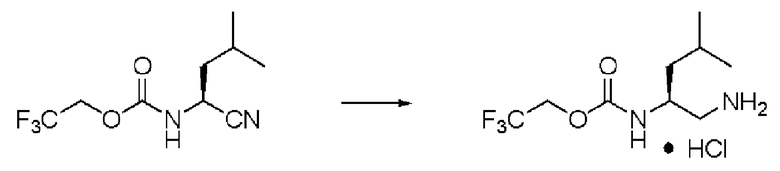
Реакцию проводили тем же способом, что и в примере 5, за исключением того, что было использовано соединение (VI) вместо соединения (II), и было использовано 2,5 г соединения (VI).
Количество белого твердого вещества: 2,32 г (выход: 79%).
1Н ЯМР (ДМСО-d6) δ 0,86 (3H, д, J=6,34 Гц), 0,88 (3H, д, J=6,34 Гц), 1,27 (1H, м), 1,36 (1H, м), 1,56 (1H, м), 2,73 (1H, дд, J=8,78, 12,69 Гц), 2,82 (1H, дд, J=4,39, 12,69 Гц), 3,76 (1H, м), 4,57 (1H, м), 4,69 (1H, м), 7,67 (1H, д, J=8,78 Гц), 8,06 (3H, уш.с).
Пример 16
Синтез (2S)-4-метил-N1-толуолил-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина
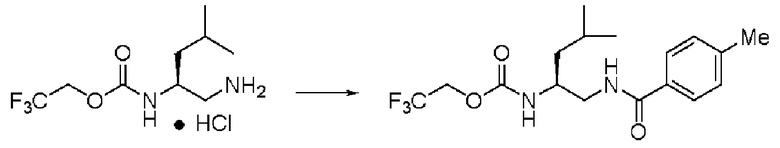
Реакцию проводили тем же способом, что и в примере 9, за исключением того, что было использовано соединение (VII) вместо соединения (III), и было использовано 0,5 г соединения (VII).
Количество белого твердого вещества: 0,56 г (87%).
1Н ЯМР (CDCl3) δ 0,94 (3H, д, J=6,34 Гц), 0,95 (3H, д, J=6,34 Гц), 1,38 (1H, м), 1,43 (1H, м), 1,70 (1H, м), 2,39 (3H, с), 3,49 (1H, м), 3,53 (1H, м), 3,92 (1H, м), 4,41 (2H, м), 5,19 (1H, д, J=8,78 Гц), 6,71 (1H, уш.с), 7,22 (2H, д, J=7,81 Гц), 7,65 (2H, д, J=7,81 Гц).
Пример 17
Синтез (2S)-4-метил-N1-(1-метил-3-трифторметил-1Н-пиразол-4-карбонил)-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина
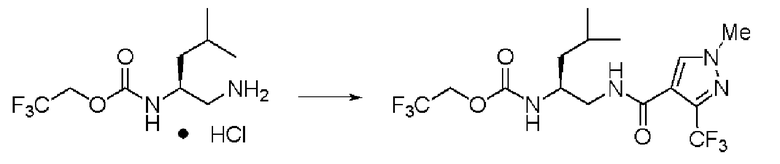
Реакцию проводили тем же способом, что и в примере 9, за исключением того, что было использовано соединение (VII) вместо соединения (III), и вместо хлорангидрида толуиловой кислоты был использован хлорид 1-метил-3-трифторметил-1Н-пиразол-4-карбонила, и было использовано 0,3 г соединения (VII).
Выход белого твердого вещества: 0,36 г (выход: 80%).
1Н ЯМР (CDCl3) δ 0,93 (3H, д, J=6,34 Гц), 0,95 (3H, д, J=6,34 Гц), 1,38 (2H, м), 1,68 (1H, м), 3,45 (1H, м), 3,54 (1H, м), 3,89 (1H, м), 3,96 (3H, с), 4,43 (2H, м), 5,05 (1H, д, J=8,78 Гц), 6,34 (1H, уш.с), 7,87 (1H, с).
Пример 18
Синтез (2S)-4-метил-N1-(2,4-дихлорбензоил)-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина
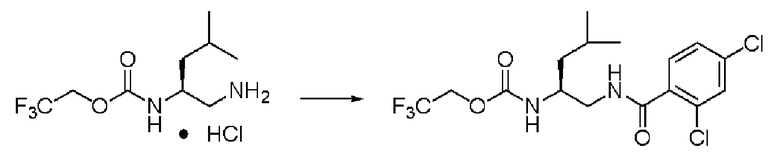
Реакцию проводили тем же способом, что и в примере 9, за исключением того, что было использовано соединение (VII) вместо соединения (III), и вместо хлорангидрида толуиловой кислоты был использован хлорид 2,4-дихлорбензоила, и было использовано 0,2 г соединения (VII).
Количество белого твердого вещества: 0,29 г (выход: 97%).
1Н ЯМР (CDCl3) δ 0,94 (3H, д, J=5,37 Гц), 0,96 (3H, д, J=6,34 Гц), 1,42 (2H, м), 1,71 (1H, м), 3,54 (2H, м), 3,93 (1H, м), 4,42(2H, м), 5,08 (1H, д, J=8,30 Гц), 6,57 (1H, уш.с), 7,30 (1 H, дд, J=1,95, 8,29 Гц), 7,41 (1H, д, J=1,95 Гц), 7,56 (1H, д, J=8,29 Гц).
Пример 19
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-изолейцинамида (далее называемого соединение (VIII))
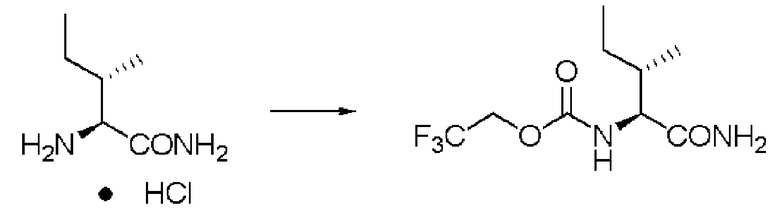
Реакцию проводили тем же способом, что и в примере 1, за исключением того, что был использован изолейцинамида гидрохлорид вместо лейцинамида гидрохлорида, и было использовано 5,0 г изолейцинамида гидрохлорида.
Количество белого твердого вещества: 7,31 г (выход: 95%).
1Н ЯМР (ДМСО-d6) δ 0,82 (6H, м), 1,13 (1H, м), 1,41 (1H, м), 1,71 (1H, м), 3,81 (1H, т, J=8,29 Гц), 4,64 (2H, кв, J=9,27 Гц), 7,05 (1H, с), 7,39 (1H, с), 7,65 (1H, д, J=8,29 Гц).
Пример 20
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-изолейцинонитрила (далее называемого соединение (IX))
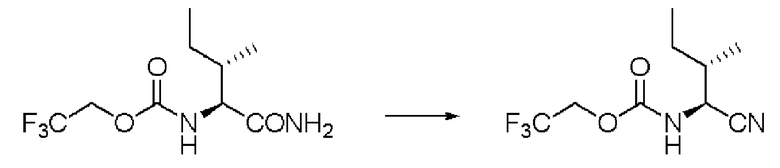
Реакцию проводили тем же способом, что и в примере 2, за исключением того, что было использовано соединение (VIII) вместо соединения (I), и было использовано 5,0 г соединения (VIII). На этой стадии очистка проводилась не перегонкой, а колоночной хроматографией.
Количество бесцветного маслянистого вещества: 4,53 г (выход: 97%).
1Н ЯМР (CDCl3) δ 0,98 (3H, т, J=7,32 Гц), 1,10 (3H, д, J=6,83 Гц), 1,34 (1H, м), 1,59 (1H, м), 1,83 (1H, м), 4,48 (1H, м), 4,53(1H, м), 4,59 (1H, м), 5,35 (1H, уш.д).
Пример 21
Синтез (2S,3S)-3-метил-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина гидрохлорида (далее называемого соединение (X))
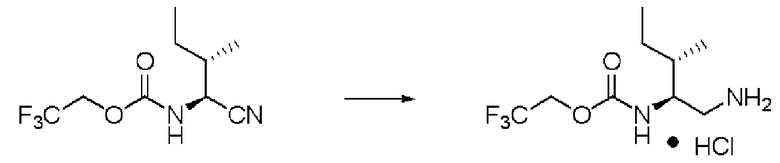
Реакцию проводили тем же способом, что и в примере 5, за исключением того, что было использовано соединение (IX) вместо соединения (II), и было использовано 2,5 г соединения (IX).
Количество светло-персикового твердого вещества: 2,56 г (выход: 92%).
1Н ЯМР (ДМСО-d6) δ 0,84 (6H, м), 1,11 (1H, м), 1,36 (1H, м), 1,53 (1H, м), 2,75 (1H, дд, J=10,25, 12,69 Гц), 2,92 (1H, дд, J=2,93, 12,69 Гц), 3,60 (1H, м), 4,55 (1H, м), 4,72 (1H, м), 7,73 (1H, д, J=8,78Гц), 8,10 (3H, уш.с).
Пример 22
Синтез (2S, 3S)-3-метил-N1-толуолил-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина
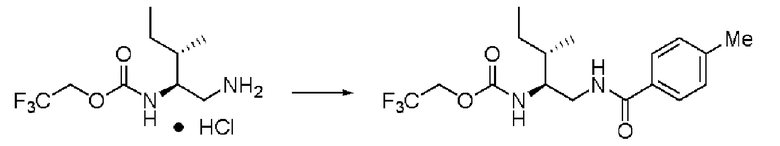
Реакцию проводили тем же способом, что и в примере 9, за исключением того, что было использовано соединение (X) вместо соединения (III), и было использовано 0,5 г соединения (X).
Количество белого твердого вещества: 0,56 г (87%).
Пример 23
Синтез (2S,3S)-3-метил-N1-(1-метил-3-трифторметил-1Н-пиразол-4-карбонил)-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина
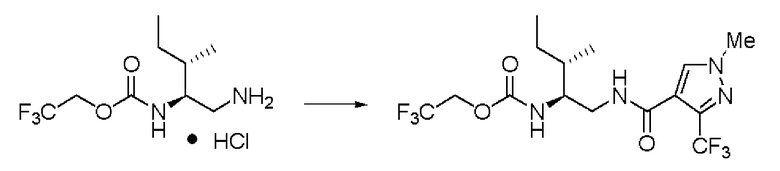
Реакцию проводили тем же способом, что в примере 9, за исключением того, что соединение (Х) использовали вместо соединения (III), хлорид 1-метил-3-трифторметил-1Н-пиразол-4-карбонила использовали вместо хлорангидрида толуиловой кислоты, и использовали 0,3 г соединения (Х).
Количество белого твердого вещества: 0,45 г (выход: >99%).
1Н ЯМР (CDCl3) δ 0,94 (3H, т, J=7,32 Гц), 0,97 (3H, д, J=6,83 Гц), 1,19 (1H, м), 1,5-1,6 (2H, м), 3,53 (2H, м), 3,72 (1H, м), 3,95 (3H, с), 4,43 (2H, м), 5,16 (1H, уш.с), 6,30 (1H, уш.с), 7,85 (1H, с).
Пример 24
Синтез
(2S,3S)-3-метил-N1-(2,4-дихлорбензоил)-N2-(2,2,2-трифторэтоксикарбонил)-пентан-1,2-диамина
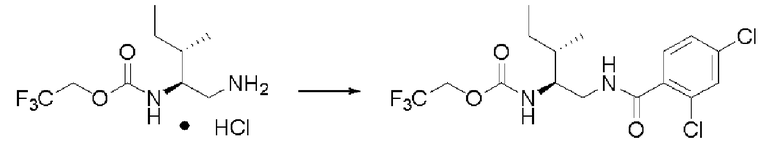
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (Х) использовали вместо соединения (III), 2,4-дихлорбензоилхлорид использовали вместо хлорангидрида толуиловой кислоты, и использовали 0,2 г соединения (Х) и 2,4-дихлорбензоилхлорида.
Количество белого твердого вещества: 0,27 г (выход: 90%).
1Н ЯМР (CDCl3) δ 0,95 (3H, т, J=7,32 Гц), 0,99 (3H, д, J=6,83 Гц), 1,22 (1H, м), 1,55 (1H, м), 1,67 (1H, м), 3,52 (1H, м), 3,64 (1H, м), 3,76 (1H, м), 4,42 (2H, м), 5,21 (1H, д, J=8,78 Гц), 6,50 (1H, уш.с), 7,29 (1H, дд, J=1,95, 8,29 Гц), 7,41 (1H, д, J=1,95 Гц), 7,54 (1H, д, J=8,29 Гц).
Пример 25
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-фенилаланинамида (далее называемого соединением (XI))
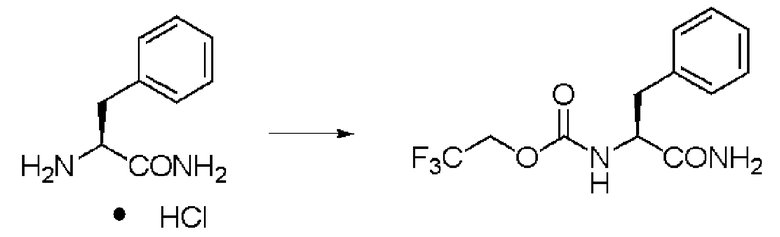
Реакцию проводили тем же способом, что в Примере 1, за исключением того, что фенилаланинамид использовали вместо валинамида гидрохлорида, и использовали 5,0 г фенилаланинамида гидрохлорида.
Белое твердое вещество: 6,76 г (выход: 93%).
1Н ЯМР (ДМСО-d6) δ 2,75 (1H, м), 2,99 (1H, м), 4,15 (1 H, м), 4,57 (2H, м), 7,09 (1H, уш.с), 7,20 (1H, м), 7,24 (1H, м), 7,27 (3H, м), 7,51 (1H, уш.с), 7,85 (1H, д, J=8,19 Гц).
Пример 26
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-фенилаланиннитрила (далее называемого соединением (XII))
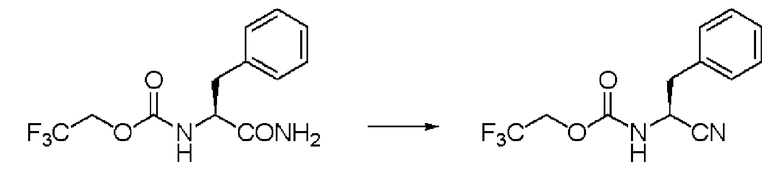
Реакцию проводили тем же способом, что в Примере 2, за исключением того, что соединение (XI) использовали вместо соединения (I), и использовали 5,0 г соединения (XI). На этой стадии очистку проводили не перегонкой, а колоночной хроматографией.
Белое твердое вещество: 3,97 г (выход: 85%).
1Н ЯМР (CDCl3) δ 3,13 (2Н, м), 4,49 (2Н, м), 4,86 (1Н, м), 5,29 (1Н, уш.д), 7,28 (2Н, м), 7,37 (3Н, м).
Пример 27
Синтез (2S)-N2-(2,2,2-трифторэтоксикарбонил)-3-фенил-пропан-1,2-диамина гидрохлорида (далее называемого соединением (XIII))
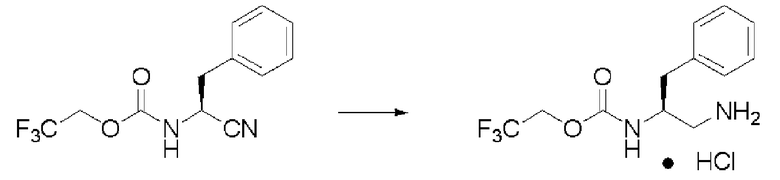
Реакцию проводили тем же способом, что в Примере 5, за исключением того, что соединение (XII) использовали вместо соединения (II), и использовали 2,0 г соединения (XII).
Количество белого твердого вещества: 2,04 г (выход: 88%).
1Н ЯМР (DMSO-d6) δ 2,72 (1H, м), 2,85 (3H, м), 3,91 (1H, м), 4,56 (2H, м), 7,21 (3H, м), 7,30 (2H, м), 7,80 (1H, д, J=8,78 Гц), 8,09 (3H, уш.с).
Пример 28
Синтез (2S)-N1-толуоил-N2-(2,2,2-трифторэтоксикарбонил)-3-фенилпропан-1,2-диамина
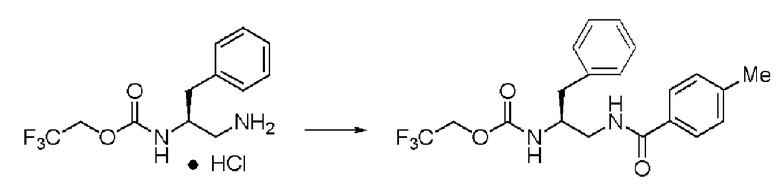
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (XIII) использовали вместо соединения (III), и использовали 0,3 г соединения (XIII).
Белое твердое вещество: 0,35 г (выход: 93%).
1Н ЯМР (CDCl3) δ 2,39 (3H, с), 2,83 (1H, дд, J=7,81, 14,15 Гц), 3,0 (1H, дд, J=6,83, 14,15 Гц), 3,53 (1H, м), 3,59 (1H, м), 4,11 (1H, м), 4,40 (2H, м), 5,63 (1H, д, J=7,81 Гц), 6,52 (1H, уш.с), 7,24 (5H, м), 7,33 (2H, м), 7,62 (2H, д, J=7,81 Гц).
Пример 29
Синтез (2S)-N1-(1-метил-3-трифторметил-1Н-пиразол-4-карбонил)-N2-(2,2,2-трифторэтоксикарбонил)-3-фенилпропан-1,2-диамина
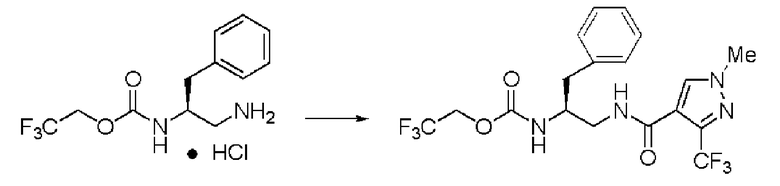
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (XIII) использовали вместо соединения (III), 1-метил-3-трифторметил-1Н-пиразол-4-карбонил хлорид использовали вместо хлорангидрида толуиловой кислоты, и использовали 0,2 г соединения (XIII).
Количество белого твердого вещества: 0,28 г (выход: 97%).
1Н ЯМР (CDCl3) δ 2,81 (1H, дд, J=7,81, 14,15 Гц), 2,97 (1H, дд, J=6,83, 14,15 Гц), 3,52 (2H, м), 3,96 (3H, с), 4,03 (1H, м), 4,41 (2H, м), 5,50 (1H, д, J=7,81 Гц), 6,30 (1H, уш.с), 7,20 (2H, м), 7,24 (1H, м), 7,33 (2H, м), 7,88 (1H, с).
Пример 30
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-аланинамида (далее называемого соединением (XIV))
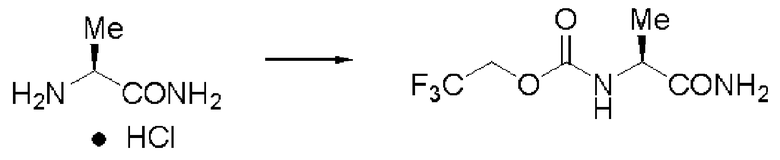
15,0 г гидрохлорида аланинамида прибавляли к 250 мл воды, содержащей 25,29 г натрия гидрокарбоната и 300 мл этилацетата, и полученную смесь перемешивали до тех пор, пока она не стала однородной. К раствору при комнатной температуре в течение 30 минут прибавляли по каплям раствор этилацетата, содержащий 23,48 г 2,2,2-трифторэтоксикарбонилхлорида. Раствор перемешивали при той же температуре 2 часа, и затем проводили разделение жидкостей. Органический слой сушили над сульфатом натрия и фильтровали, и затем растворитель отгоняли при пониженном давлении. К остатку прибавляли гексан, и раствор перемещивали. После этого осадок фильтровали для получения заглавного соединения.
Количество белого твердого вещества: 24,61 г (выход: 95%).
1Н ЯМР (ДМСО-d6) δ 1,21 (3H, д, J=7,32 Гц), 3,96 (1H, м), 4,62 (2H, м), 6,98 (1H, уш.с), 7,33 (1H, уш.с), 7,76 (1H, д, J=7,81 Гц).
Пример 31
Синтез нитрила N-(2,2,2-трифторэтоксикарбонил)-L-аланина (далее называемого соединением (XV))
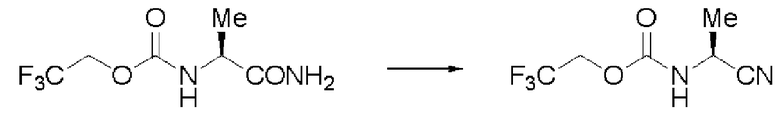
Реакцию проводили тем же способом, что в Примере 2, за исключением того, что соединение (XIV) использовали вместо соединения (I), и использовали 31,0 г соединения (XIV). На этой стадии очистку проводили не перегонкой, а колоночной хроматографией.
Количество белого твердого вещества: 25,83 г (выход: 91%).
1Н ЯМР (CDCl3) δ 1,61 (3H, д, J=7,32 Гц), 4,47 (1H, м), 4,53 (1H, м), 4,67 (1H, м), 5,38 (1H, уш.д).
Пример 32
Синтез (2S)-N2-(2,2,2-трифторэтоксикарбонил)-пропан-1,2-диамина гидрохлорида (далее называемого соединением (XVI))
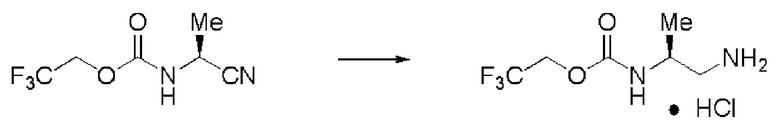
Реакцию проводили тем же способом, что в примере 5, за исключением того, что соединение (XV) использовали вместо соединения (II), и использовали 2,0 г соединения (XII).
Количество белого твердого вещества: 2,05 г (выход: 85%).
1Н ЯМР (ДМСО-d6) δ 1,12 (3Н, т, J=6,83 Гц), 2,81 (1Н, м), 3,79 (1Н, м), 4,60 (1Н, м), 4,67 (1Н, м), 7,76 (1Н, д, J=8,29 Гц), 8,12 (3Н, уш.с).
Пример 33
Синтез (2S)-N1-толуоил-N2-(2,2,2-трифторэтоксикарбонил)-пропан-1,2-диамина
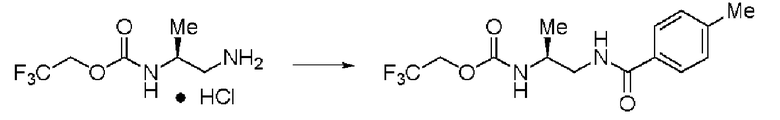
Реакцию проводили тем же способом, что в примере 9, за исключением того, что соединение (XVI) использовали вместо соединения (III), и использовали 0,5 г соединения (XVI).
Количество белого твердого вещества: 0,56 г (выход: 84%).
1Н ЯМР (CDCl3) δ 1,26 (3Н, д, J=6,83 Гц), 2,39 (3Н, с), 3,53 (2H, м), 3,95 (1H, м), 4,41 (2H, м), 5,50 (1H, уш.д, J=7,32 Гц), 6,74 (1H, уш.с), 7,22 (2H, д, J=7,81 Гц), 7,66 (2H, д, J=7,81 Гц).
Пример 34
Синтез (2S)-N1-(1-метил-3-трифторметил-1Н-пиразол-4-карбонил)-N2-(2,2,2-трифторэтоксикарбонил)-пропан-1,2-диамина
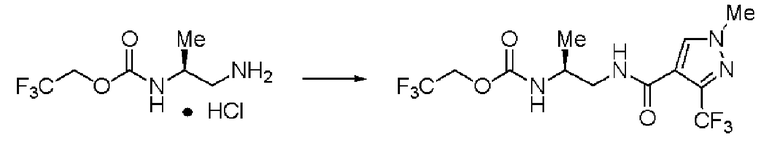
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (XVI) использовали вместо соединения (III), 1-метил-3-трифторметил-1Н-пиразол-4-карбонил хлорид использовали вместо хлорангидрида толуиловой кислоты, и использовали 0,3 г соединения (XVI).
Количество оранжевого твердого вещества: 0,38 г (выход: 79%).
1Н ЯМР (CDCl3) δ 1,24 (3H, д, J=6,83 Гц), 3,50 (2H, м), 3,93 (1H, м), 3,96 (3H, с), 4,42 (2H, м), 5,34 (1H, д, J=7,32 Гц), 6,39 (1H, уш.с), 7,89 (1H, s).
Пример 35
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-пролинамида (далее называемого соединением (XV-2))
К 65 мл воды, содержащей 5,0 г пролинамида прибавляли по каплям 7 мл диоксана, содержащего 8,54 г хлорида 2,2,2-трифторэтоксикарбонила при комнатной температуре. Когда рН реакционного раствора стал 8, то одновременно начали прибавление по каплям 8 вес.% водного раствора гидроксида натрия, и рН реакционного раствора поддерживали при 8±0,5. После завершения прибавления по каплям раствор перемешивали 2 часа, и затем к раствору прибавляли этилацетат для разделения жидкостей. Органический слой сушили над сульфатом натрия и фильтровали, и затем фильтрат поместили под пониженное давление для удаления растворителя. Полученное твердое соединение являлось заглавным веществом.
Количество белого твердого вещества: 8,48 г (выход: 81%).
1Н ЯМР (ДМСО-d6) δ 1,82 (3H, м), 2,16 (1H, м), 3,38 (1H, м), 3,46 (1H, м), 4,13 (1H, м), 4,6-4,7 (2H, м), 6,99 (1H, с), 7,41 (1H, с).
Пример 36
Синтез N-(2,2,2-трифторэтоксикарбонил)-L-пролинонитрила (далее называемого соединением (XVI-2))
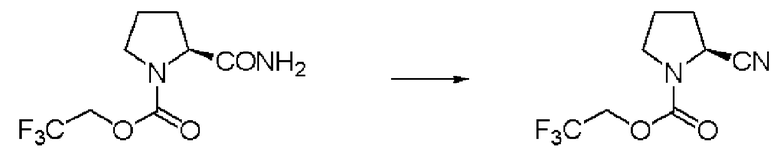
Реакцию проводили тем же способом, что в примере 2, за исключением того, что соединение (XVI-2) использовали вместо соединения (I), и использовали 5,0 г соединения (XVI-2). На данной стадии очистку проводили не перегонкой, а колоночной хроматографией.
Количество желтого прозрачного маслообразного вещества: 4,13 г (выход: 89%).
1Н ЯМР (CDCl3) δ 2,1-2,3 (4H, м), 3,46 (1H, м), 3,63 (1H, м), 4,49 (1H, м), 4,61 (2H, м).
Пример 37
Синтез (2S)-N2-(2,2,2-трифторэтоксикарбонил)-2-(аминометил)-пирролидина гидрохлорида (далее называемого соединением (XVII))

Реакцию проводили тем же способом, что в примере 5, за исключением того, что соединение (XVI-2) использовали вместо соединения (II), и использовали 2,0 г соединения (XII).
Количество белого твердого вещества: 1,67 г (выход: 71%).
1Н ЯМР (ДМСО-d6) δ 1,8-2,0 (4H, м), 2,86 (1H, м), 2,96 (1H, м), 3,38 (2H, м), 4,03(1H, м), 4,69 (2H, м), 8,19 (3H, уш.с).
Пример 38
Синтез (2S)-N-(2,2,2-трифторэтоксикарбонил)-2-(N-толуоил-аминометил)-пирролидина
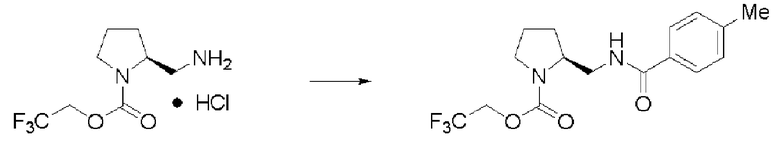
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (XVII) использовали вместо соединения (III), и использовали 0,5 г соединения (XVII).
Количество белого твердого вещества: 0,50 г (выход: 80%).
1Н ЯМР (CDCl3) δ 1,8-2,2 (4H, м), 2,39 (3H, с), 3,4-3,5 (3H, м), 3,68 (1H, м), 4,19 (1H, м), 4,52 (2H, м), 7,23 (2H, д, J=8,2 9 Гц), 7,72 (2H, д, J=8,29 Гц), 7,79 (1H, уш.с).
Пример 39
Синтез (2S)-N-(2,2,2-трифторэтоксикарбонил)-2{N-(1-метил-3-трифторметил-1Н-пиразол-4-карбонил)-аминометил}-пирролидина
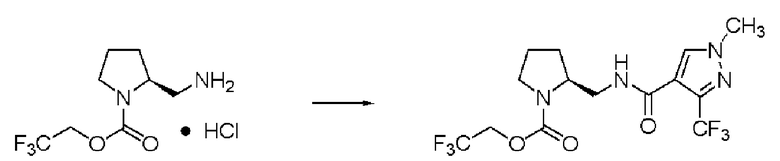
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (XVII) использовали вместо соединения (III), 1-метил-3-трифторметил-1Н-пиразол-4-карбонил хлорид использовали вместо хлорангидрида толуиловой кислоты, и использовали 0,3 г соединения (XVII).
Количество бесцветного и прозрачного масла: 0,46 г (выход: >0,99%).
1Н ЯМР (CDCl3) δ 1,8-2,2 (4H, м), 3,4-3,7 (4H, м), 3,96 (3H, с), 4,10 (1H, м), 4,49 (2H, м), 7,11 (1H, уш.с), 7,80 (1H, с).
Пример 40
Синтез (2S)-N-(2,2,2-трифторэтоксикарбонил)-2{N-(2.4-дихлорбензоил)-аминометил}-пирролидина
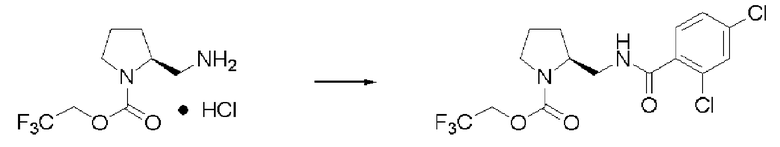
Реакцию проводили тем же способом, что в примере 9, за исключением того, что соединение (XVII) было использовано вместо соединения (III), 2,4-дихлорбензоилхлорид был использован вместо хлорангидрида толуиловой кислоты, и использовали 0,3 г соединения (XVII).
Количество бесцветного и прозрачного масла: 0,37 г (выход: 81%).
1Н ЯМР (CDCl3) δ 1,7-2,2 (4Н, м), 3,4-3,8 (4Н, м), 4,13 (1Н, м), 4,48 (2Н, м), 7,29 (1Н, дд, J=1,95, 8,30 Гц), 7,34 (1H, уш.д), 7,42 (1H, д, J=1,95 Гц), 7,53 (1H, д, J=8,30 Гц).
Пример 41
Синтез N-метил-N-(2,2,2-трифторэтоксикарбонил)-L-валинамида (далее называемого соединением (XVIII))
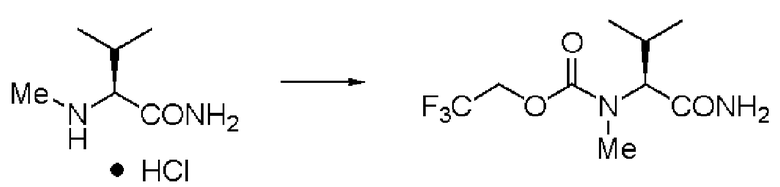
К 60 мл воды, содержащей 3,0 г N-метил-L-валинамида и 4,54 г гидрокарбоната натрия, при комнатной температуре в течение 20 минут прибавляли по каплям 6 мл диоксана, содержащего 3,51 г хлорида 2,2,2-трифторэтоксикарбонила. Образующийся раствор перемешивали 2 часа, и затем к раствору прибавляли этилацетат, осуществляли разделение жидкостей. Органический слой сушили над сульфатом натрия и фильтровали, и затем растворитель отгоняли при пониженном давлении. Полученное соединение являлось заглавным соединением.
Количество бесцветного маслянистого вещества: 6,41 г (выход: >99%).
1Н ЯМР (CDCl3) δ 0,89 (3H, д), 0,99 (3H, д), 2,28 (1H, м), 2,94 (3H, с, мажор), 2,95 (3H, с, минор), 4,09 (1H, д), 4,51 (2H, м), 5,60 (1H, уш.с), 6,04 (1H, уш.с).
Пример 42
Синтез N-метил-N-(2,2,2-трифторэтоксикарбонил)-L-валинонитрила (далее называемого соединением (XIX))
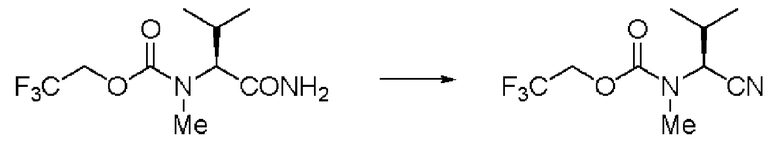
Реакцию проводили тем же способом, что в примере 2, за исключением того, что соединение (XVIII) использовали вместо соединения (I), и использовали 4,27 г соединения (XVIII). На данной стадии очистку проводили не перегонкой, а колоночной хроматографией.
Количество бесцветного маслообразного вещества: 3,36 г (выход: 85%).
1Н ЯМР (CDCl3) δ 0,94 (3H, д, J=6,34 Гц), 1,18 (3H, д, J=6,34 Гц), 2,13 (1H, м), 3,01 (3H, с), 4,4-4,6 (2H, м), 4,80 (1H, д, J=10,73 Гц).
Пример 43
Синтез (2S)-3-метил-N2-метил-N2-(2,2,2,трифторэтоксикарбонил)-бутан-1,2-диамина гидрохлорида (далее называемого соединением (XVII))

Реакцию проводили тем же способом, что в примере 5, за исключением того, что соединение (XIX) использовали вместо соединения (II), и использовали 2,40 г соединения (XIX).
Количество белого твердого вещества: 2,49 г (выход: 89%).
1Н ЯМР (ДМСО-d6) δ 0,77 (3H, д, J=6,34 Гц ), 0,93 (3H, д, J=6,34 Гц), 1,83 (1H, м), 2,76 (3H, с), 3,00 (2H, м), 3,77 (1H, м), 4,60 (1H, м), 4,77 (1H, м), 7,99 (3H, уш.с).
Пример 44
Синтез (2S)-3-метил-N2-метил-N1-{4-(трифторметил)бензоил}-N2-(2,2,2-трифторэтоксикарбонил)-бутан-1,2-диамина
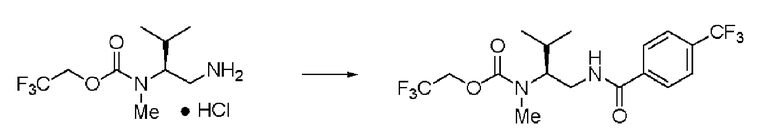
Реакцию проводили тем же способом, что в Примере 9, за исключением того, что соединение (XX) использовали вместо соединения (III), хлорид 4-(трифторметил)бензоила был использован вместо хлорангидрида толуиловой кислоты, и использовали 0,3 г соединения (XX).
Количество белого твердого вещества: 0,43 г (выход: 96%).
1Н ЯМР (CDCl3) δ 0,93 (3H, м), 1,07 (3H, м), 1,95 (1H, м), 2,85 (3H, с, мажор), 2,86 (3H, с, минор), 3,55 (1H, м), 3,78-3,89 (2H, м), 4,45 (1H, м), 4,53 (1H, м), 6,15 (1H, уш.с, J=минор), 6,55 (1H, уш.с, мажор), 7,78 (2H, м), 7,81 (2H, м).
Пример 45
Синтез (2S)-3-метил-N1-{4-(трифторметил)бензоил}-N2-(бензофуран-2-карбонил)-бутан-1,2-диамина
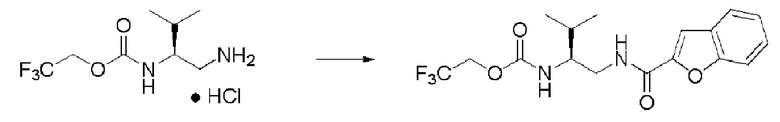
Чтобы получить N-(бензофуран-2-карбонил)-имидазол к 5 мл ТГФ, содержащего 0,28 г бензофуран-2-карбоновой кислоты, добавляли 0,33 г N,N'-карбонилдиимидозола, и образующуюся смесь перемешивали в течение 1 часа. К раствору последовательно добавляли 0,23 г имидазола и 0,3 г соединения (III) и оставляли взаимодействовать в течение 3 часов. К раствору добавляли этилацетат и воду, и проводил разделение жидкостей. После этого 1N хлороводород, насыщенный водный раствор гидрокарбоната натрия и насыщенный раствор хлорида натрия последовательно отделяли от органического слоя. Полученный органический слой высушивали над сульфатом натрия и отфильтровали, и затем отгоняли растворитель при пониженном давлении. К остатку добавляли ИПЭ, и отфильтровывали белый осадок. Полученное соединение было заглавным соединением.
Количество белого твердого вещества: 0,35 г (выход: 84%).
В соответствии с настоящим изобретением возможно обеспечить способ, который имеет преимущества при промышленном получении производных этилендиамина, имеющих галогенированную карбаматную группу и арильную группу, и его значение для промышленной применимости велико.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ЗАМЕЩЕННЫЕ СУЛЬФАМАТНЫЕ ПРОТИВОСУДОРОЖНЫЕ ПРОИЗВОДНЫЕ | 2003 |
|
RU2328502C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛАЛАНИНА | 2001 |
|
RU2286340C2 |
| ИНГИБИТОРЫ КСАНТИН-ФОСФОДИЭСТЕРАЗЫ V, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРИМЕНЕНИЕ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2302420C9 |
| КОМПЛЕКСЫ | 2015 |
|
RU2682680C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРСОДЕРЖАЩЕГО ПРОИЗВОДНОГО АЦИЛУКСУСНОЙ КИСЛОТЫ, СПОСОБ ПОЛУЧЕНИЯ ФТОРСОДЕРЖАЩЕГО ПРОИЗВОДНОГО СЛОЖНОГО ЭФИРА ПИРАЗОЛКАРБОНОВОЙ КИСЛОТЫ И СПОСОБ ПОЛУЧЕНИЯ ФТОРСОДЕРЖАЩЕГО ПРОИЗВОДНОГО ПИРАЗОЛКАРБОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2456275C2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА | 2007 |
|
RU2409570C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
| ПРОИЗВОДНЫЕ ЭФИРА ГЕТЕРОАРИЛКАРБОНОВОЙ КИСЛОТЫ | 2013 |
|
RU2664544C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОФЕНОВОГО ПРОИЗВОДНОГО И ЕГО ПРОМЕЖУТОЧНОГО ПРОДУКТА | 2009 |
|
RU2495877C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛА | 2005 |
|
RU2382786C2 |
Изобретение относится к способу получения производных этилендиамина 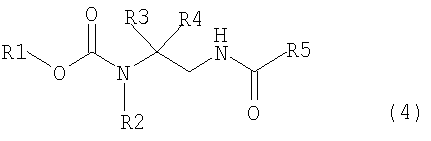
имеющих галогенированную карбаматную группу и ацильную группу, заключающемуся в каталитическом гидрировании аминонитрила с галогензамещенной карбаматной группой в присутствии кислоты и последующем проведении ацилирования образующегося аминопроизводного. Исходный аминонитрил может быть получен с высоким выходом реакцией амида аминокислоты с галогензамещенным карбаматирующим агентом в присутствии воды и последующим взаимодействием образующегося амида, имеющего галогензамещенную карбаматную группу, с восстанавливающим агентом, таким как реагент Вильсмейера. 7 н. и 15 з.п. ф-лы.
1. Способ получения соединения, представленного общей формулой (4), включающий
превращение соединения, представленного общей формулой (1), в соединение, представленное общей формулой (2), путем осуществления каталитического гидрирования соединения, представленного общей формулой (1), в присутствии кислоты, и
взаимодействием соединения, представленного общей формулой (2), с соединением, представленным общей формулой (3),
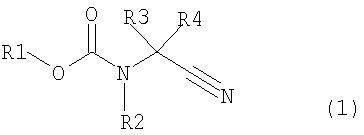
где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 или R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота),
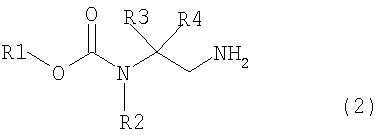
где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше,
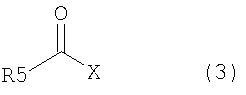
где в формуле R5 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и Х представляет уходящую группу;
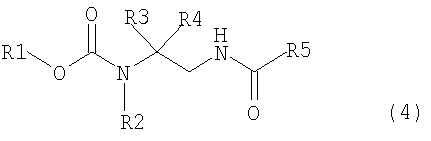
где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше.
2. Способ получения соединения, представленного общей формулой (4), как описано в п.1, в котором соединение, представленное общей формулой (1), получается взаимодействием соединения, представленного общей формулой (5), с восстанавливающим агентом,
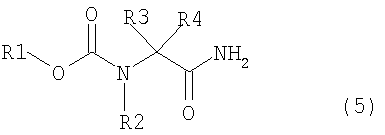
где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше.
3. Способ получения соединения, представленного общей формулой (4), как описано в п.2, в котором соединение, представленное общей формулой (5), получается взаимодействием соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7), в присутствии воды
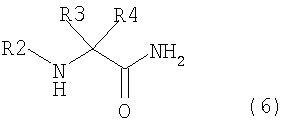
где в формуле R2, R3 и R4 являются теми же самыми, что и описано выше,
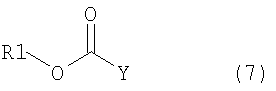
где в формуле R1 является тем же самым, что и описано выше; и Y представляет атом галогена.
4. Способ получения соединения, представленного общей формулой (4), как описано в п.1, в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота); и R5 представляет собой арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной.
5. Способ получения соединения, представленного общей формулой (4), как описано в п.2, в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота); и R5 представляет собой арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной.
6. Способ получения соединения, представленного общей формулой (4), как описано в п.3, в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота); и R5 представляет собой арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной.
7. Способ получения соединения, представленного общей формулой (4), как описано в п.4, в формуле которой R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора.
8. Способ получения соединения, представленного общей формулой (4), как описано в п.5, в формуле которой R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора.
9. Способ получения соединения, представленного общей формулой (4), как описано в п.6, в формуле которой R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора.
10. Способ получения соединения, представленного общей формулой (2), включающий
превращение соединения, представленного общей формулой (1), в соединение, представленное общей формулой (2), проведением каталитического гидрирования соединения, представленного общей формулой (1), в присутствии кислоты,
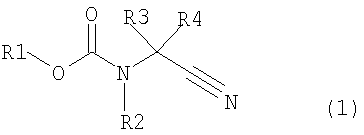
в котором в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арилалкильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота),

где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше.
11. Способ получения соединения, представленного общей формулой (2), как описано в п.10, в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
12. Способ получения соединения, представленного общей формулой (2), как описано в п.11, в формуле которого R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора.
13. Способ получения соединения, представленного общей формулой (1), включающий
превращение образующегося продукта в соединение, представленное общей формулой (1)
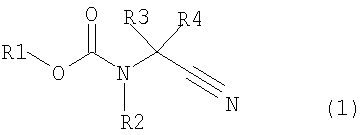
взаимодействием соединения, представленного общей формулой (5), с восстанавливающим агентом,

в котором в формуле R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора, R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
14. Способ получения соединения, представленного общей формулой (5), включающий
превращение образующегося продукта в соединение, представленное общей формулой (5), взаимодействием соединения, представленного общей формулой (6), с соединением, представленным общей формулой (7), в присутствии воды,

где в формуле R2 представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; или любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота),

где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; и Y представляет атом галогена,

где в формуле R1, R2, R3 и R4 те же самые, что и описаны выше.
15. Способ получения соединения, представленного общей формулой (5), как описано в п.16, в котором в формулах R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом галогена; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной, и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
16. Способ получения соединения, представленного общей формулой (5), как описано в п.17, в котором в формулах R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора.
17. Соединение, представленное общей формулой (2)

где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляют атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
18. Соединение, представленное общей формулой (2), как описано в п.19, где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной; и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
19. Соединение, представленное общей формулой (1)
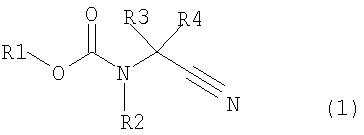
где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
20. Соединение, представленное общей формулой (1), как описано в п.21, где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной; и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
21. Соединение, представленное общей формулой (5)

где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора, или циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, арильную группу, которая может быть замещенной, или гетероарильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, циклоалкильную группу, имеющую от 3 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, арилалкильную группу, которая может быть замещенной, гетероарильную группу, которая может быть замещенной, или гетероарилалкильную группу, которая может быть замещенной; и R3 и R4 могут быть связаны друг с другом с образованием кольцевой структуры, имеющей от 3 до 6 атомов углерода, или любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
22. Соединение, представленное общей формулой (5), как описано в п.23, где в формуле R1 представляет алкильную группу, имеющую от 1 до 6 атомов углерода, которая замещена по меньшей мере одним атомом фтора; R2 представляет атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и R3 и R4 каждый независимо представляет атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода, которая может быть замещенной, арильную группу, которая может быть замещенной, или арилалкильную группу, которая может быть замещенной; и любой из R3 и R4 может быть связан с R2 с образованием кольцевой структуры, имеющей в сумме от 5 до 6 атомов (от 4 до 5 атомов углерода и 1 атом азота).
| М | |||
| North et al | |||
| Tetrahedron, 1990, vol.46, no.24, pp.8267-8290 | |||
| УСТРОЙСТВО для ОХЛАЖДЕНИЯ НОЖА МИКРОТОМА | 0 |
|
SU167011A1 |
| WO 2005042474 A1 (Mitsui Chemicals, Inc.) 05.12.2005 | |||
| V.T.Ravikumar, Synthetic Communications, 1994, vol.24, no.12, pp.1267-1772 | |||
| Воздушная турбина | 1924 |
|
SU2713A1 |
Авторы
Даты
2010-11-27—Публикация
2007-03-27—Подача