Предпосылки создания изобретения
Данное изобретение относится к новым производным фенилаланина и применению производных фенилаланина в качестве лекарственных средств. Данное изобретение относится также к соединениям, применимым в качестве терапевтических агентов или профилактических агентов для воспалительных заболеваний, в патологии которых участвует α4-интегрин-зависимый процесс адгезии. Сообщалось, что α4-интегрины задействованы в ревматоидном артрите, воспалительных заболеваниях пищеварительного тракта, системной красной волчанке, множественном склерозе, синдроме Шегрена, астме, псориазе, аллергии, диабете, сердечно-сосудистых заболеваниях, склерозе артерий, рестенозе, пролиферации опухолей, метастазировании опухолей и отторжении трансплантата. Соединения данного изобретения, обладающие антагонистическим действием на α4-интегрины, являются пригодными в качестве терапевтическиих агентов или профилактических агентов для вышеописанных заболеваний.
В реакциях воспаления обычно считается, что, когда микроорганизм проникает в ткань или когда ткань повреждена, лейкоциты играют важную роль для устранения микроорганизма или для репарации поврежденной ткани. Вполне понятно также, что в таких случаях лейкоциты, обычно циркулирующие в крови, должны проходить через стенку сосуда и заново направляться к поврежденной ткани. Было выяснено, что инфильтрация лейкоцитов из кровеносного сосуда в ткань осуществляется молекулами интегринов, которые являются группой гетеродимерных белков, экспрессирующихся на лейкоцитах. Молекулы интегринов классифицируются в по меньшей мере 8 субсемейств (субсемейства β1-β8), в зависимости от их β-цепей. Известными типичными субсемействами являются субсемейства β1 и β3, участвующие в адгезии клеточных ингредиентов к внеклеточному матриксу, такому как коллаген и фибронектин; субсемейство β2, участвующее в межклеточной (клетка-клетка) адгезии в иммунной системе; и субсемейство β7, которое в основном участвует в инфильтрации лейкоцитов в ткани слизистой оболочки (Shimizu et al., Adv. Immunol. 72: 325-380, 1999). Что касается вышеописанных α4-интегринов, известны два типа их молекул. Они являются молекулой VLA-4 (очень позднего антигена-4), принадлежащей к субсемейству β1 и содержащей цепь α4 β1, и молекулой LPAM-1 (молекулой-1 адгезии Пейеровых бляшек HEV (групповых лимфатических фолликулов) лимфоцитов)), принадлежащей к субсемейству β7 и содержащей цепь α4 β7. Обычно большинство лейкоцитов, циркулирующих в крови, имеют только низкую адгезионную аффинность в отношении клеток васкулярного эндотелия, и они не могут выходить из кровеносного сосуда. Однако, лимфоциты, содержащие в основном Т-клетки и В-клетки, способны выходить из кровеносного сосуда с использованием так называемого «хоминг»-феномена, где они перемещаются из крови в лимфоидную ткань через стенку лимфатического сосуда и затем они возвращаются в кровь через лимфатический сосуд в физиологических условиях. Известно, что молекулы LPAM-1 участвуют в хоминге лимфоцитов в лимфоидную ткань кишечного тракта, такую как Пейерова бляшка (Butcher et al., Adv. Immunol. 72: 209-253, 1999). С другой стороны, когда происходит воспаление, васкулярные эндотелиальные клетки сосудов активируются цитокином и хемокином, высвобождаемыми из воспаленной ткани, индуцируется экспрессия группы антигенов поверхности клетки (молекул адгезии), участвующих в адгезии (прикреплении) лейкоцитов к клеткам васкулярного эндотелия, и огромное количество лейкоцитов инфильтрируются из кровеносного сосуда в направлении воспаленной ткани через эти молекулы адгезии.
В качестве антигенов поверхности клеток на васкулярных эндотелиальных клетках, участвующих в адгезии лейкоцитов, были известны Е-селектин (молекула адгезии, в основном участвующая в адгезии нейтрофилов), ICAM-1 и VCAM-1, в основном участвующие в адгезии лимфоцитов, и MAdCAM-1, в основном участвующая в адгезии лимфоцитов в лимфоидной ткани кишечного тракта в виде Пейеровой бляшки (Shimuzu et al., Adv. Immunol. 72: 325-380, 1999). Сообщалось, что в этих молекулах адгезии VCAM-1 действует в качестве лиганда как VLA-4, так и LPAM-1, и что MAdCAM-1 действует в качестве лиганда LPAM-1. В качестве лиганда как VLA-4, так и LPAM-1, известен также фибронектин, который является типом внеклеточного матрикса (Shimuzu et al., Adv. Immunol. 72: 325-380, 1999). Субсемейство β1-интегринов, к которому принадлежит VLA-4, содержит по меньшей мере 6 интегринов (VLA-1 - VLA-6), использующих внеклеточные матриксы, такие как фибронектин, коллаген и ламинин, в качестве лигандов. Многие интегрины, использующие внеклеточные матриксы в качестве лигандов, такие как VLA-5, субсемейство β3 и субсемейство β5, узнают последовательность аргинин-глицин-аспарагиновая кислота (RGD) в фибронектине, витронектине, тенасцине и остеопонтине. С другой стороны, во взаимодействии VLA-4 и фибронектина не участвует последовательность RGD, но участвует сегмент пептида CS-1, содержащий последовательность лейцин-аспарагиновая кислота-валин (LDV), в качестве центральной последовательности (Pulido et al., J. Biol. Chem. 266: 10241-10245, 1991). Clements et al. обнаружили последовательность, сходную с LDV, в аминокислотных последовательностях VCAM-1 и MAdCAM-1. Было установлено, что вариант, полученный частичной модификацией CS-1-подобной последовательности молекул VCAM-1 и MAdCAM-1, не может взаимодействовать с VLA-4 или LPAM-1 (Clements et al., J. Cell Sci. 107: 2127-2135, 1994, Vonderheide et al., J. Cell. Biol. 125: 215-222, 1994, Renz et al., J. Cell. Biol. 125: 1395-1406, 1994 и Kilger et al., Int. Immunol. 9: 219-226, 1997). Таким образом, было обнаружено, что CS-1-подобная последовательность является важной для взаимодействия VLA-4/LPAM-1 и VCAM-1/MAdCAM-1.
Сообщалось также, что циклический пептид, имеющий CS-1-подобную структуру, является антагонистическим как в отношении взаимодействия VLA-4, так и LPAM-1 с VCAM-1, MAdCAM-1 или пептидом CS-1 (Vanderslice et al., J. Immunol. 158: 1710-1718, 1997). Описанные выше факты указывают на то, что все взаимодействия α4-интегрина и VCAM-1, MAdCAM-1 или фибронектина могут быть блокированы использованием подходящего антагониста α4-интегрина (термин «антагонист α4-интегрина» в данном описании обозначает вещество, антагонистическое в отношении α4 β1- или α4 β7-интегрина).
Известно также, что экспрессия VCAM-1 в васкулярных эндотелиальных клетках вызывается воспалительными факторами, такими как LPS, TNF-α или IL-1, и что, когда имеет место воспаление, инфильтрация лейкоцитов из кровеносного сосуда в ткань проводится посредством механизма адгезии VLA-4/VCAM-1 (Elices, Cell 60: 577-584, 1990, Osborn et al., Cell 59: 1203-1211, 1989 и Issekutz et al., J. Eex. Med. 183: 2175-2184, 1996). Поскольку VLA-4 экспрессируется на поверхности активированных лимфоцитов, моноцитов, эозинофилов, тучных клеток и нейтрофилов, механизм адгезии VLA-4/VCAM-1 играет важную роль для инфильтрации этих клеток в воспаленную ткань. Сообщалось, что VLA-4 экспрессируется на различных клетках саркомы, таких как клетки меланомы, и было также выяснено, что механизм адгезии VLA-4/VCAM-1 участвует в метастазировании этих опухолей. Исследование экспрессии VCAM-1 в различных патологических тканях сделало очевидным, что механизм адгезии VLA-4/VCAM-1 участвует в различных патологических стадиях. А именно, сообщалось, что, кроме активированных васкулярных эндотелиальных клеток, экспрессия VCAM-1 увеличивается в воспаленных тканях пациентов с аутоиммунными заболеваниями, например, в ревматоидной синовиальной мембране (van Dinther-Janssen, J. Immunol. 147: 4207-4210, 1991 и Morales-Ducret et al., J. Immunol. 149: 1424-1431, 1992), легких и эпителии дыхательных путей при астме (ten Hacken et al., Clin. Exp.Allergy 12: 1518-1525, 1998), и аллергическими заболеваниями (Randolph et al., J. Clin. Invest. 104: 1021-1029, 1999), у пациентов с системной красной волчанкой (Takeuchi et al., J. Clin. Invest. 92: 3008-3016, 1993), синдромом Шегрена (Edwards et al., Ann. Rheum. Dis. 52: 806-811, 1993), множественным склерозом (Steffen et al., Am. J. Pathol. 145: 189-201, 1994) и псориазом (Groves et al., J. Am. Acad. Dermatol. 29: 67-72, 1993), атеросклеротическими бляшками (O,Brien et al., J. Clin. Invest. 92:945-951, 1993); в кишечных тканях пациентов с воспалительными заболеваниями пищеварительного тракта, такими как болезнь Крона и язвенный колит (Koizumi et al., Gastroenterol. 103: 840-847, 1992 и Nakamura et al., Lab. Invest. 69: 77-85, 1993), в воспаленной ткани островков Лангерганса у пациентов с диабетом (Martin et al., J. Autoimmunol. 9: 637-643, 1996) и имплантатах при отторжении трансплантата сердца или почки (Herskowitz et al., Am. J. Pathol. 145: 1082-1094, 1994 и Hill et al., Kidney Int. 47: 1383-1391, 1995). Механизм адгезии VLA-4/VCAM-1 участвует в этих разнообразных заболеваниях.
Имеются многочисленные сообщения, показывающие, что введение in vivo антитела против VLA-4 или VCAM-1 было эффективным в улучшении заболеваний на моделях животных с воспалительными заболеваниями. Конкретно, Yednock et al. и Baron et al. сообщили, что введение in vivo антитела против α4-интегринов было эффективным в снижении коэффициента заболеваемости или подавлении энцефаломиелита в экспериментальных моделях аутоиммунного энцефаломиелита, т.е. моделях множественного склероза (Yednock et al., Nature 356: 63-66, 1992 и Baron et al., J. Exp.Med. 177: 57-68, 1993). Zeidler et al. сообщили, что введение in vivo антитела против α4-интегрина было эффективным в снижении коэффициента заболеваемости мышиным коллагеновым артритом (моделях ревматоидного артрита) (Zeidler et al., Autoimmunity 21: 245-252, 1995). Терапевтическое действие антитела против α4-интегрина на моделях астмы сообщалось Abraham et al. и Sagara et al. (Abraham et al., J. Clin. Invest. 93: 776-787, 1994 и Sagara et al., Int. Arch. Allergy Immunol. 112: 287-294, 1997). Действие антитела против α4-интегрина в моделях воспалительного заболевания пищеварительного тракта сообщалось Podolsky et al. (Podolsky et al., J. Clin. Invest. 92: 372-380, 1993). Действие антитела против α4-интегрина и антитела против VCAM-1 в моделях инсулинзависимого диабета сообщалось Baron et al. (Baron et al., J. Clin. Invest. 93: 1700-1708, 1994). В моделях павианов было показано, что рестеноз кровеносного сосуда после ангиопластики, проводимой вследствие артериосклероза, мог ингибироваться введением антитела против α4-интегрина (Lumsden et al., J. Vasc. Surg. 26: 87-93, 1997). Сообщалось также, что антитело против α4-интегрина или VCAM-1 является эффективным в ингибировании отторжения имплантата или ингибировании метастазирования рака (Isobe et al., J. Immunol. 153: 5810-5818, 1994 и Okahara et al., Cancer Res. 54: 3233-3236, 1994).
Как описано выше, в противоположность VCAM-1, MAdCAM-1, который является лигандом LPAM-1, конститутивно экспрессируется на высокоэндотелиальных венулах (HEV) в кишечной слизистой оболочке, мезентериальных лимфатических узлах, Пейеровой бляшке и селезенке, и он участвует в хоминге лимфоцитов слизистой оболочки. Известно также, что механизм адгезии LPAM-1/MAdCAM-1 не только играет физиологическую роль в хоминге лимфоцитов, но также участвует в некоторых патологических процессах. Briskin et al. сообщили об увеличении экспрессии MAdCAM-1 в воспаленных участках кишечного тракта пациентов с воспалительнымм заболеваниями пищеварительного тракта, такими как болезнь Крона и язвенный колит (Briskin et al., Am. J. Pathol. 151: 97-110, 1997). Hanninen et al. сообщили, что индукция экспрессии наблюдается в воспаленной ткани островка Лангерганса мыши NOD, которая является моделью инсулинзависимого диабета (Hanninen et al., J. Immunol. 160: 6018-6025, 1998). Тот факт, что механизм адгезии LPAM-1/MAdCAM-1 участвует в прогрессировании заболеваний, явствует из того, что состояние мышей-моделей с воспалительным заболеванием пищеварительного тракта (Picarella et al., J. Immunol. 158: 2099-2106, 1997) и вышеописанных мышей-моделей NOD улучшались при введении in vivo антитела против MAdCAM-1 или антитела против β7-интегрина (Hanninen et al., J. Immunol. 160: 6018-6025, 1998 и Yang et al., Diabetes 46: 1542-1547, 1997).
Вышеописанные факты указывают на возможность того, что применение блокирования механизма адгезии VLA-4/VCAM-1, LPAM-1/VCAM-1 или LPAM-1/MAdCAM-1 подходящим антагонистом является эффективным в лечении описанных выше хронических воспалительных заболеваний. Применение антитела против VLA-4 в качестве антагониста VLA-4 описано в WO 93/13798, WO 93/15764, WO 94/16094 и WO 95/19790. Пептидные соединения, такие как антагонисты VLA-4, описаны в WO 94/15958, WO 95/15973, WO 96/00581 и WO 96/06108. Аминокислотные производные, применимые в качестве антагонистов VLA-4, описаны в WO 99/10312, WO 99/10313, WO 99/36393, WO 99/37618 и WO 99/43642. Однако, ни одно из них практически не применяется для терапевтического лечения в настоящее время вследствие отсутствия пероральной биодоступности и иммуногенных свойств при использовании их в течение продолжительного периода времени.
Описание изобретения
Целью данного изобретения являются новые соединения, имеющие антагонистическое действие против α4-интегрина.
Другой целью данного изобретения являются новые соединения, имеющие антагонистическое действие против α4-интегрина, которые могут вводиться перорально.
Еще одной целью данного изобретения являются антагонисты α4-интегрина.
Следующей целью данного изобретения является создание фармацевтической композиции, содержащей такие новые соединения.
Дополнительной целью данного изобретения является обеспечение терапевтических агентов или профилактических агентов для заболеваний, в патологии которых участвует α4-интегрин-зависимый процесс адгезии, таких как воспалительные заболевания, ревматоидный артрит, воспалительные заболевания пищеварительного тракта, системная красная волчанка, множественный склероз, синдром Шегрена, астма, псориаз, аллергия, диабет, сердечно-сосудистые заболевания, склероз артерий, рестеноз, пролиферация опухолей, метастазирование опухолей и отторжение трансплантата.
С целью решения вышеописанных задач авторы данного изобретения синтезировали различные производные фенилаланина и испытали их антагонистическую активность против α4-интегрина, и обнаружили, что указанные новые производные фенилаланина имеют превосходную α4-интегрин-антагонистическую активность. Данное изобретение было выполнено на основе этого открытия.
Таким образом, данное изобретение обеспечивает производные фенилаланина следующей общей формулы (1) и их фармацевтически приемлемые соли:
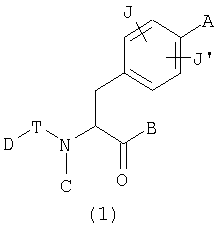
где А представляет одну из следующих общих формул (2), (3), (3-1) или (3-2):
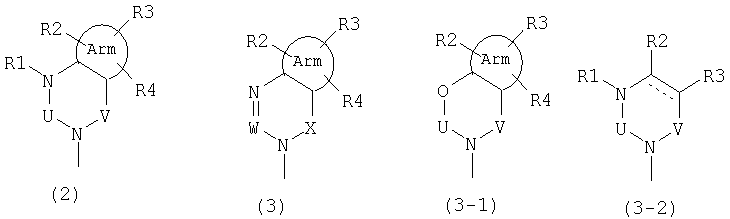
где Arm представляет циклическую алкильную группу или ароматическое кольцо, содержащее 0, 1, 2, 3 или 4 гетероатома, выбранных из группы, состоящей из атомов кислорода, серы и азота,
линия, состоящая из сплошной линии и пунктирной линии в формуле (3-2), представляет ординарную связь или двойную связь,
U, V и Х представляют С(=О), S(=O)2, C(-R5)(-R6), C(=C(R5)(R6)), C(=S), S(=O), P(=O)(-OH) или Р(-Н)(=О),
W представляет С(-R7) или атом азота,
R1, R2, R3, R4, R5, R6 и R7 могут быть одинаковыми или различными и каждый представляет атом водорода, атом галогена, гидроксильную группу; низшую алкильную группу; замещенную низшую алкильную группу; низшую алкенильную группу; замещенную низшую алкенильную группу; низшую алкинильную группу; замещенную низшую алкинильную группу; циклоалкильную группу, которая может содержать гетероатом (гетроатомы) в кольце; арильную группу, гетероарильную группу; низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкильную группу, замещенную арильной группой (арильными группами); низшую алкильную группу, замещенную гетероарильной группой (гетероарильными группами); низшую алкоксильную группу; низшую алкилтиогруппу; низшую алкоксильную группу и низшую алкилтиогруппу, замещенные циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу и низшую алкилтиогруппу, замещенные арильной группой (арильными группами); низшую алкоксильную группу и низшую алкилтиогруппу, замещенные гетероарильной группой (гетероарильными группами), циклоалкилоксигруппу, которая может содержать гетероатом (гетероатомы) в кольце, арилоксигруппу, гетероарилоксигруппу; низшую гидроксиалкильную группу; низшую гидроксиалкенильную группу; низшую гидроксиалкоксильную группу; низшую галогеналкильную группу; низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу; низшую галогеналкенильную группу; нитрогруппу; цианогруппу; замещенную или незамещенную аминогруппу; карбоксильную группу; низшую алкилоксикарбонильную группу, замещенную или незамещенную карбамоильную группу; низшую алканоильную группу; ароильную группу; низшую алкилсульфонильную группу; замещенную или незамещенную сульфамоильную группу или группу аммония,
R5 и R6 могут быть связаны вместе с образованием кольца, которое может содержать один или два атома кислорода, азота или серы,
В представляет гидроксильную группу, низшую алкоксильную группу или гидроксиламиногруппу,
С представляет атом водорода, низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкильную группу, замещенную арильной группой (арильными группами) или низшую алкильную группу, замещенную гетероарильной группой (гетероарильными группами),
D представляет низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, арильную группу, гетероарильную группу, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкильную группу, замещенную арильной группой (арильными группами), низшую алкильную группу, замещенную гетероарильной группой (гетероарильными группами), низшую алкоксильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу, замещенную арильной группой (арильными группами), низшую алкоксильную группу, замещенную гетероарильной группой (гетероарильными группами), циклоалкилоксигруппу, которая может содержать гетероатом (гетероатомы) в кольце, арилоксигруппу, гетероарилоксигруппу, низшую гидроксиалкильную группу, низшую гидроксиалкенильную группу, низшую гидроксиалкоксильную группу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкенильную группу, нитрогруппу, цианогруппу, замещенную или незамещенную аминогруппу, карбоксильную группу, низшую алкилоксикарбонильную группу, замещенную или незамещенную карбамоильную группу, низшую алканоильную группу, ароильную группу, низшую алкилтиогруппу, низшую алкилсульфонильную группу или замещеную или незамещенную сульфамоильную группу,
С и D могут быть связаны вместе с образованием кольца, которое может содержать один или два атома кислорода, азота или серы,
Т представляет межатомную связь, С(=О), C(=S), S(=O), S(=O)2, N(H)-C(=O) или N(H)-C(=S),
J и J' могут быть одинаковыми или различными и каждый представляет атом водорода, атом галогена, низшую алкильную группу, низшую алкоксигруппу или нитрогруппу,
при условии, что производные фенилаланина общей формулы (1) не включают в себя соединений, имеющих следующие формулы (А-1) или (А-2), когда А представляет формулу (3-2).

Данное изобретение обеспечивает антагонисты α4-интегрина, содержащие вышеописанное производное фенилаланина или его фармацевтически приемлемую соль в качестве активного ингредиента.
Данное изобретение обеспечивает также фармацевтическую композицию, содержащую вышеописанное производное фенилаланина или его фармацевтически приемлемую соль.
Данное изобретение обеспечивает также терапевтический агент или профилактический агент, содержащий производное фенилаланина или его фармацевтически приемлемую соль в качестве активного ингредиента для заболеваний, в патологии которых участвует α4-интегрин-зависимый процесс адгезии, таких как воспалительные заболевания, ревматоидный артрит, воспалительные заболевания пищеварительного тракта, системная красная волчанка, множественный склероз, синдром Шегрена, астма, псориаз, аллергия, диабет, сердечно-сосудистые заболевания, склероз артерий, рестеноз, пролиферация опухолей, метастазирование опухолей и отторжение трансплантата.
Наилучший способ проведения изобретения
Термин "низшая", например, в низшей алкильной группе, в данном описании обозначает, что эта группа имеет 1-6 атомов углерода и предпочтительно 1-4 атома углерода. Алкильные группы, алкенильные группы и алкинильные группы в алкильных группах, алкенильных группах, алкинильных группах, алкоксильных группах, алкилтиогруппах, алканоильных группах, алкиламиногруппах и т.п. могут быть либо неразветвленными (линейными), либо разветвленными. Примерами этих алкильных групп являются метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, вторичная бутильная группа, третичная бутильная группа, пентильная группа и гексильная группа. Предпочтительно, алкильные группы имеют 1-6 атомов углерода и более предпочтительно эти группы имеют 1-4 атома углерода. Алкенильными группами являются, например, винильная группа, пропенильная группа, бутенильная группа и пентенильная группа. Предпочтительно, алкенильные группы имеют 2-6 атомов углерода и более предпочтительно эти группы имеют 2-4 атома углерода. Алкинильные группы включают в себя этинильную группу, пропинильную группу и бутинильную группу. Предпочтительно, алкинильные группы имеют 2-8 атомов углерода и более предпочтительно эти группы имеют 2-4 атома углерода. Циклоалкильные группы обозначают замещенные или незамещенные циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, норборнильная группа, адамантильная группа и циклогексенильная группа. Предпочтительно, циклоалкильные группы имеют 3-8 атомов углерода и более предпочтительно эти группы имеют 3-5 атомов углерода. Алкоксильные группы включают в себя метоксильную группу, этоксильную группу, пропилоксигруппу, изопропилоксигруппу и т.д. Предпочтительно, алкоксильные группы имеют 1-6 атомов углерода и более предпочтительно эти группы имеют 1-4 атома углерода. Гетероатомы включают в себя азот, кислород, серу и т.д. Атомами галогена являются фтор, хлор, бром и иод. Галогеналкильные группы включают в себя хлорметильную группу, трихлорметильную группу, трифторметильную группу, трифторэтильную группу, пентафторметильную группу и т.д. Галогеналкоксильные группы включают в себя трихлорметоксильную группу, трифторметоксильную группу и т.д. Гидроксиалкильные группы включают в себя гидроксиметильную группу, гидроксиэтильную группу и т.д. Циклоалкильные группы, которые могут содержать гетероатом (гетероатомы) в кольце, могут быть либо замещенными, либо незамещенными. Примеры их включают в себя циклопентильную группу, циклогексильную группу, пиперидильную группу, пиперазинильную группу, морфолинильную группу, пирролидинильную группу, тетрагидрофуранильную группу и урацильную группу, которые являются 4-8-членной циклической группой, предпочтительно 5-7-членной циклической группой.
В данном описании арильные группы являются как замещенными, так и незамещенными арильными группами, такими как фенильная группа, 1-нафтильная группа и 2-нафтильная группа. Они являются предпочтительно фенильной группой и замещенной фенильной группой, а заместителями являются особенно предпочтительно атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Гетероарильными группами являются как замещенные, так и незамещенные гетероарильные группы, такие как пиридильная группа, пиразильная группа, пиримидинильная группа, пиразолильная группа, пирролильная группа, триазильная группа, фурильная группа, тиенильная группа, изоксазолильная группа, изотиазолильная группа, индолильная группа, хинолильная группа, изохинолильная группа и бензимидазолильная группа. Предпочтительными гетероарильными группами являются пиридильная группа, пиразильная группа, пиримидинильная группа, фурильная группа, тиенильная группа и замещенные пиридильная, фурильная и тиенильная группы. Особенно предпочтительными заместителями являются атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Низшие алкильные группы, замещенные арильной группой (арильными группами), включают в себя, например, замещенные или незамещенные бензильные группы и замещенные или незамещенные фенетильные группы. Особенно предпочтительными заместителями являются атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Низшие алкильные группы, замещенные гетероарильной группой (гетероарильными группами), включают в себя, например, пиридилметильную группу, и особенно предпочтительными заместителями являются атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Алканоильные группы включают в себя, например, формильные группы, ацетильные группы, пропаноильную группу, бутаноильную группу и пивалоильную группу. Ароильные группы включают в себя, например, замещенную или незамещенную бензоильную группу и пиридилкарбонильную группу, и их заместителями особенно предпочтительно являются атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Галогеналканоильные группы включают в себя, например, трихлорацетильную группу и трифторацетильную группу. Алкилсульфонильные группы включают в себя, например, метансульфонильную группу, этансульфонильную группу и т.д. Арилсульфонильные группы включают в себя, например, бензолсульфонильную группу и п-толуолсульфонильную группу. Гетероарилсульфонильные группы включают в себя, например, пиридилсульфонильную группу. Галогеналкилсульфонильные группы включают в себя, например, трифторметансульфонильную группу. Алкилоксикарбонильные группы включают в себя, например, метоксикарбонильную группу, этоксикарбонильную группу и трет-бутоксикарбонильную группу. Арилзамещенные алкоксикарбонильные группы включают в себя, например, бензилоксикарбонильную группу и 9-флуоренилметоксикарбонильную группу. Замещенные карбамоильные группы включают в себя, например, метилкарбамоильную группу, фенилкарбамоильную группу и замещенную фенилкарбамоильную группу, и их заместителями особенно предпочтительно являются атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Замещенные тиокарбамоильные группы включают в себя, например, метилтиокарбамоильную группу, фенилтиокарбамоильную группу и замещенную фенилтиокарбамоильную группу, и их заместителями особенно предпочтительно являются атомы галогена, алкоксильные группы, алкильные группы, гидроксильная группа, галогеналкильные группы и галогеналкоксильные группы. Замещенные аминогруппы в данном описании обозначают монозамещенные или дизамещенные аминогруппы, и их заместители включают в себя низшие алкильные группы, низшие алкильные группы, замещенные арильной группой, низшие алкильные группы, замещенные гетероарильной группой, низшие алканоильные группы, ароильные группы, низшие галогеналканоильные группы, низшие алкилсульфонильные группы, арилсульфонильные группы, гетероарилсульфонильные группы, галогеналкилсульфонильные группы, низшие алкилоксикарбонильные группы, арилзамещенные низшие алкилоксикарбонильные группы, замещенные или незамещенные карбамоильные группы и замещенные или незамещенные тиокарбамоильные группы. Группы аммония включают в себя, например, триалкиламмониевые группы.
Поскольку производные фенилаланина общей формулы (I) данного изобретения включают в себя асимметричные атомы углерода, можно считать, что производные фенилаланина общей формулы (I) являются оптическими изомерами, и соединения, указанные в данном изобретении, включают в себя указанные оптические изомеры. Однако, предпочтительной является L-форма.
Что касается соединения, в котором существует диастереомер, этот диастереомер и смесь диастереомеров включены в указанные производные фенилаланина. Поскольку производные фенилаланина общей формулы (I) данного изобретения включают в себя способный мигрировать атом водорода, можно считать, что производные фенилаланина общей формулы (I) данного изобретения включают в себя разнообразные таутомерные формы, и соединения, указанные в данном изобретении, включают в себя указанные таутомерные формы. Далее, карбоксильные группы соединения данного изобретения могут быть замещены подходящими заместителями, которые превращаются в карбоксильную группу in vivo. Примером таких заместителей является низшая алкоксикарбонильная группа.
В вышеописанной общей формуле (1) предпочтительно, чтобы группы, указанные как А, имели общие формулы (2) и (3), Arm в общих формулах (2) и (3) предпочтительно обозначает ароматическое кольцо и, в частности, бензольное кольцо, и предпочтительным является замещенное бензольное кольцо. R1 в общей формуле (2) предпочтительно является атомом водорода, низшей алкильной группой и замещенной низшей алкильной группой. Ее заместителями являются предпочтительно фенильная группа, цианогруппа и карбоксильная группа. Предпочтительно, R2-R4 общих формул (2) и (3) представляют атом водорода, галоген, гидроксильную группу, низшую алкильную группу, низшую алкоксигруппу, низшую галогеналкильную группу, замещенную или незамещенную аминогруппу и группу аммония.
Группа, представленная В, является предпочтительно гидроксильной группой. Предпочтительной является также низшая алкоксигруппа.
Группа, представленная С, предпочтительно является низшей алкильной группой или атомом водорода, и атом водорода является более предпочтительным.
В качестве групп, представленных D, предпочтительными являются циклоалкильные группы, которые могут содержать гетероатом (гетароатомы) в кольце, арильные группы и гетероарильные группы. Циклоалкильные группы, которые могут содержать гетероатом (гетероатомы) в кольце, арильные группы и гетероарильные группы являются либо незамещенными, либо замещенными, и заместителями являются заместители, описанные выше со ссылкой на R1, R2, R3, R4, R5, R6 и R7. Среди них группы, представленные D, особенно предпочтительно являются замещенной или незамещенной циклогексильной группой или фенильной группой. Их заместители являются предпочтительно 1-3, более предпочтительно 1 или 2 низшими алкильными группами или низшими алкоксильными группами или атомами галогена.
Группа, представленная J и J', предпочтительно является атомом водорода.
Группа, представленная Т, является предпочтительно С(=О).
Предпочтительно, U, V и Х обозначают С(=О) и C(=S), и особенно предпочтительной является C(=O). W обозначает предпочтительно С(-R7), и -R7 обозначает предпочтительно низшую алкильную группу, низшую алкоксильную группу и низшую алкилтиогруппу.
В общей формуле (1) данного изобретения А предпочтительно представляет одну из групп, указанных в виде общей формулы (2) или (3), и R1, R2, R3, R4, R5, R6 и R7 могут быть одинаковыми или различными и каждый представляет группы, указанные ниже:
атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, замещенную низшую алкильную группу, низшую алкенильную группу, замещенную низшую алкенильную группу, низшую алкинильную группу, замещенную низшую алкинильную группу, циклоалкильную группу, которая может содержать гетероатом (гетроатомы) в кольце, арильную группу, гетероарильную группу, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкильную группу, замещенную арильной группой (арильными группами), низшую алкильную группу, замещенную гетероарильной группой (гетероарильными группами), низшую алкоксильную группу, низшую алкилтиогруппу, низшую алкоксильную группу и низшую алкилтиогруппу, замещенные циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу и низшую алкилтиогруппу, замещенные арильной группой (арильными группами), низшую алкоксильную группу и низшую алкилтиогруппу, замещенные гетероарильной группой (гетероарильными группами), циклоалкилоксигруппу, которая может содержать гетероатом (гетероатомы) в кольце, арилоксигруппу, гетероарилоксигруппу, низшую гидроксиалкильную группу, низшую гидроксиалкенильную группу, низшую гидроксиалкоксильную группу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, низшую галогеналкенильную группу, нитрогруппу, цианогруппу, замещенную или незамещенную аминогруппу, карбоксильную группу, низшую алкилоксикарбонильную группу, замещенную или незамещенную карбамоильную группу, низшую алканоильную группу, ароильную группу, низшую алкилсульфонильную группу или замещенную или незамещенную сульфамоильную группу,
R5 и R6 могут быть связаны вместе с образованием кольца, которое может содержать один или два атома кислорода, азота или серы.
Предпочтительно, в общей формуле (1) данного изобретения В представляет гидроксильную группу или низшую алкоксильную группу,
С представляет атом водорода или низшую алкильную группу,
J и J' представляют водородную группу, и
в общих формулах (2) и (3) V и Х представляют любую из групп С=(О), S(=O)2 или С(-R5)(-R6),
U представляет любую из групп С=(О), S(=O)2, С(-R5)(-R6), С(=С(R5)(R6)), С(=S), S(=O), P(=O)(-OH) или P(-H)(=O).
Далее, предпочтительно, в общей формуле (1) В представляет гидроксильную группу или низшую алкоксильную группу,
С представляет атом водорода или низшую алкильную группу, J и J' представляют водородную группу, и
в общих формулах (2) и (3) Arm представляет бензольное кольцо или ароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, выбранных из группы, состоящей из атомов кислорода, серы и азота.
Далее, предпочтительно, в общей формуле (1) В представляет гидроксильную группу или низшую алкоксильную группу,
С представляет атом водорода или низшую алкильную группу,
J и J' представляют водородную группу, и
в общих формулах (2) и (3) Arm представляет бензольное кольцо или ароматическое кольцо, содержащее 1, 2, 3 или 4 гетероатома, выбранных из группы, состоящей из атомов кислорода, серы и азота,
V и Х представляют любую из групп С=(О), S(=O)2 или С(-R5)(-R6),
U представляет любую из групп С=(О), S(=O)2, С(-R5)(-R6), С(=С(R5)(R6)), С(=S), S(=O), P(=O)(-OH) или P(-H)(=O).
Предпочтительно, в общей формуле (1), С представляет атом водорода и Т представляет С(=О).
Предпочтительно также, в общей формуле (1), А представляет следующую формулу (3-3):
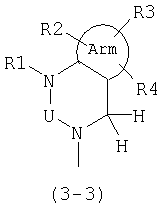
где Arm, U и R1-R4 имеют значения, описанные выше.
В общей формуле (3-3) Arm предпочтительно является ароматическим кольцом и особенно предпочтительно бензольным кольцом или замещенным бензольным кольцом. R1 в общей формуле (3-3) предпочтительно является атомом водорода, низшей алкильной группой или низшей алкильной группой, замещенной фенильной группой, цианогруппой или карбоксильной группой. R1-R4 в общей формуле (3-3) обозначают предпочтительно атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, низшую алкоксильную группу, цианогруппу, нитрогруппу, незамещенную аминогруппу или аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами).
В общей формуле (1) А предпочтительно представляет следующие формулы (3-4) или (3-5):
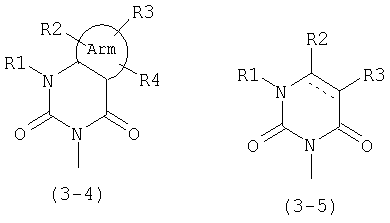
где Arm и R1-R4 имеют значения, описанные выше, и линия, состоящая из сплошной линии и пунктирной линии в формуле (3-5), представляет ординарную связь или двойную связь.
В общей формуле (1) D предпочтительно представляет следующие формулы (4-1), (4-2), (4-3) или (4-4):
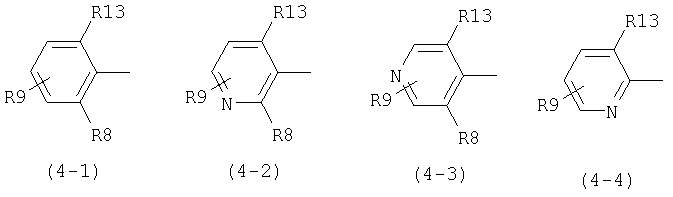
где R13 представляет атом галогена или метильную группу, R8 представляет атом галогена, метильную группу, трифторметильную группу, метоксигруппу или атом водорода, R9 представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), триалкиламмониевую группу, метансульфониламиногруппу и тетразолильную группу.
В приведенных выше формулах формула (4-1) является предпочтительной. В частности предпочтительно, когда в формуле (4-1) R13 и R8 представляют атом хлора и R9 представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу.
Предпочтительно также, в общей формуле (1) А представляет формулу (3-4), Arm обозначает бензольное кольцо, пиридиновое кольцо, пиразольное кольцо или циклогексановое кольцо, R1 обозначает низшую алкильную группу, R2, R3 и R4 могут быть одинаковыми или различными и каждый представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу.
Далее, предпочтительно, в общей формуле (1), А представляет формулу (3-4) или (3-5), D представляет (4-1), (4-2), (4-3) или (4-4), В обозначает гидроксильную группу или низшую алкоксильную группу, С обозначает атом водорода, каждый из J и J' обозначает атом водорода и Т обозначает С(=О).
В данном изобретении предпочтительно, в общей формуле (1), А представляет бензольное кольцо, пиридиновое кольцо, пиразольное кольцо или циклогексановое кольцо, R1 обозначает низшую алкильную группу, R2, R3 и R4 могут быть одинаковыми или различными и каждый представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами) или триалкиламмониевую группу, D представляет формулу (4-1), где R13 и R8 представляют атом хлора и R9 представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу, В обозначает гидроксильную группу или низшую алкоксильную группу, С обозначает атом водорода, каждый из J и J' обозначает атом водорода и Т обозначает С(=О).
В данном изобретении предпочтительно также, в общей формуле (1), А представляет формулу (3-3), и в формуле (3-3) U представляет С(=О) или С(=S), R1 представляет низшую алкильную группу, R2, R3 и R4 могут быть одинаковыми или различными и каждый представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу, С представляет атом водорода, D представляет формулу (4-1), (4-2), (4-3) или (4-4), Т представляет С(=О).
Далее, в данном изобретении предпочтительно А представляет формулу (3-3), и в формуле (3-3) U представляет С(=О) или С(=S), R1 представляет метильную группу или этильную группу, R2, R3 и R4 могут быть одинаковыми или различными и каждый представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами) или триалкиламмониевую группу, В представляет гидроксильную группу или низшую алкильную группу, С представляет атом водорода, D представляет формулу (4-1), где R13 и R8 представляют атом хлора и R9 представляет атом водорода, атом галогена, гидроксильную группу, низшую алкильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкоксильную группу, низшую алкилтиогруппу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкилтиогруппу, нитрогруппу, цианогруппу, аминогруппу, аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу, Т обозначает С(=О) и каждый из J и J' обозначает атом водорода.
В данном изобретении производные фенилаланина следующей общей формулы и их фармацевтически приемлемые соли являются предпочтительными:
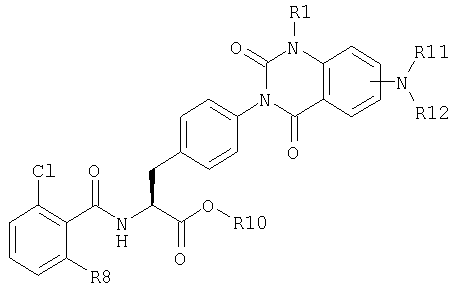
где R1 представляет метильную группу или этильную группу, R8 представляет атом галогена или метильную группу, R10 представляет атом водорода или низшую алкильную группу, R11 и R12 могут быть одинаковыми или различными и каждый представляет атом водорода, метильную группу, этильную группу или пропильную группу, R11 и R12 могут быть связаны вместе с образованием кольца, и в этом случае R11-R12 представляют триметилен, тетраметилен или пентаметилен. Особенно предпочтительноо, R10 представляет низшую алкильную группу.
Более конкретно, предпочтительными являются соединения, описанные в примерах, хотя они не являются ограничивающими данное изобретение.
В частности, предпочтительными являются соединения следующих формул и их фармацевтически приемлемые соли:
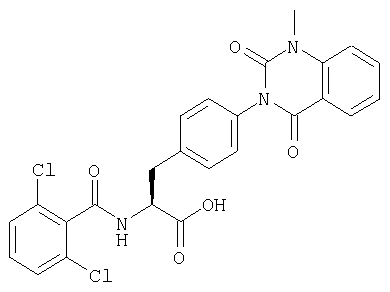
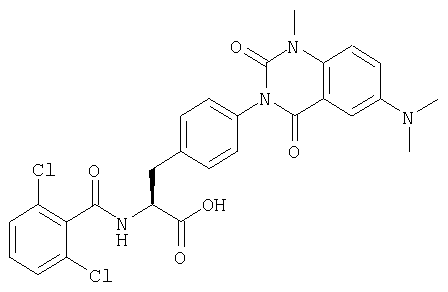
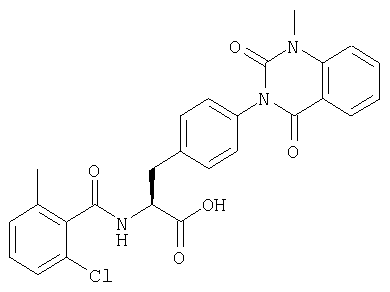
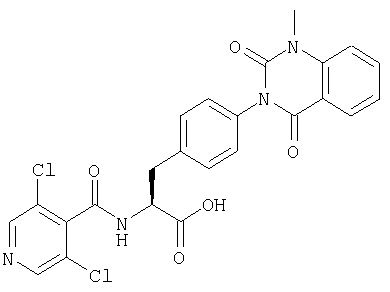
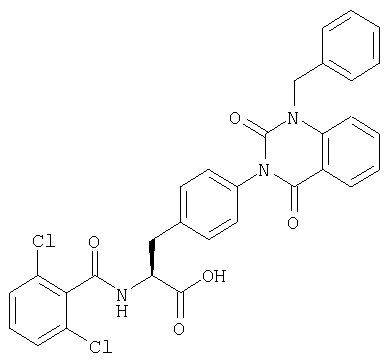
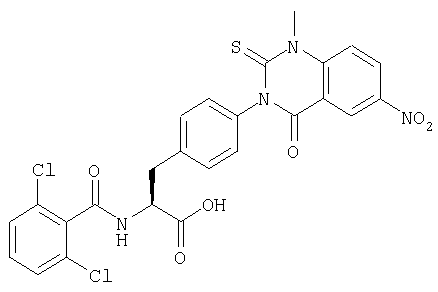
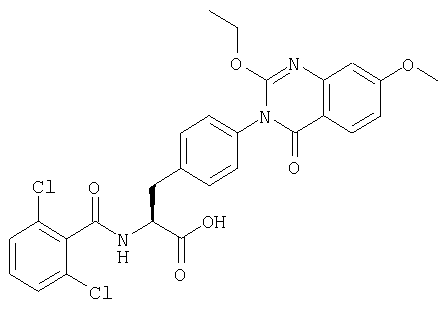
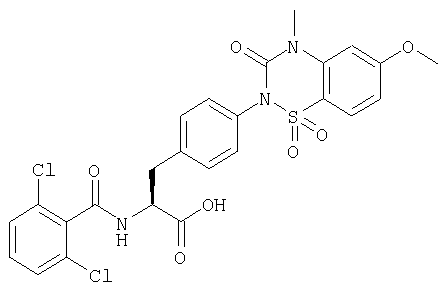
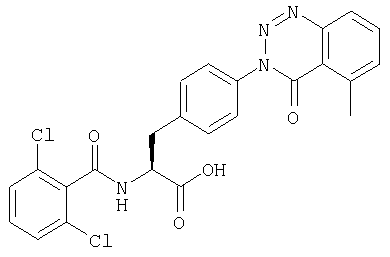
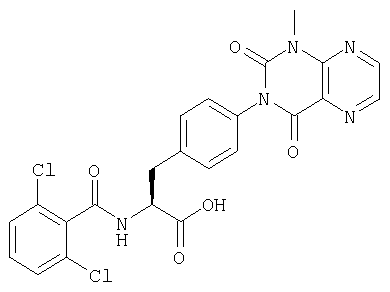
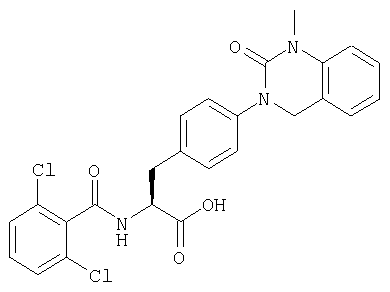
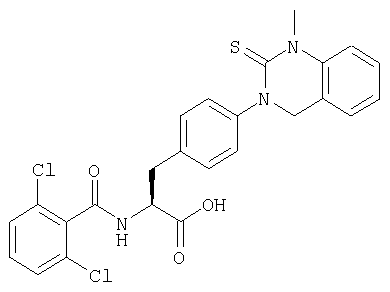
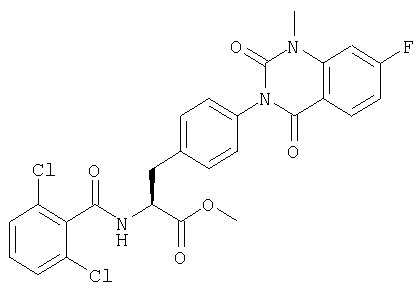
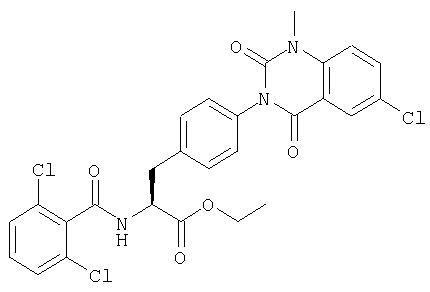
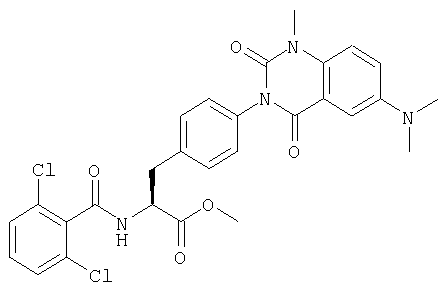
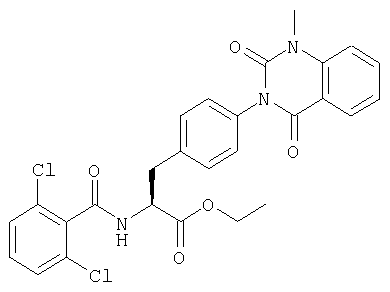
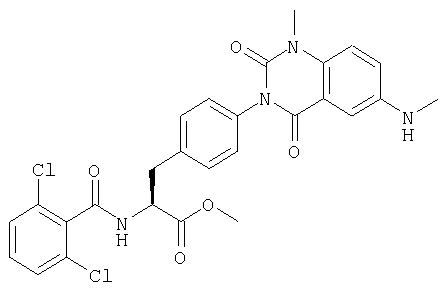
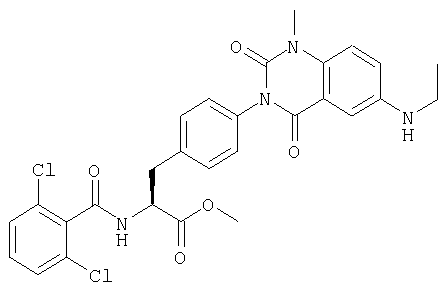
Производные фенилаланина (1) данного изобретения могут быть синтезированы, например, описанными ниже способами, если В является гидроксильной группой.
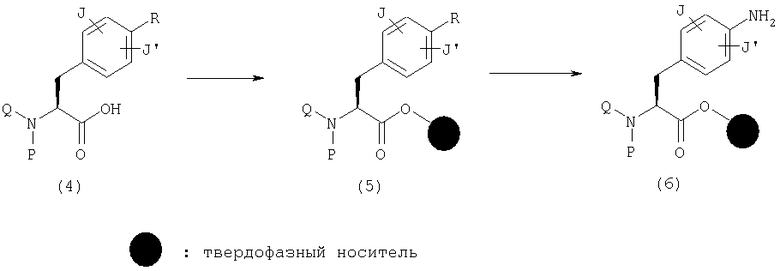
Подходящим образом защищенную карбоновую кислоту (4) загружают в смолу обычным способом. Заместитель Р карбоновой кислоты (4) имеет структуру С, описанную выше со ссылкой на общую формулу (1), это заместитель, который может быть превращен в С на любой стадии синтеза, или он является подходящим образом защищенной формой этих заместителей. Заместитель Q карбоновой кислоты (4) имеет структуру D-T, описанную выше со ссылкой на общую формулу (1), это заместитель, который может быть превращен в D-T на любой стадии синтеза, или он является подходящим образом защищенной формой этих заместителей. Далее, заместитель R карбоновой кислоты (4) имеет структуру заместителя, который может быть превращен в NH2, или подходящим образом защищенной формы группы NH2.
Что касается условий реакции загрузки смолы, эта реакция может проводиться с использованием, если необходимо, подходящей добавки, такой как HOAt (1-гидрокси-7-азабензотриазол), HOBt (1-гидроксибензотриазол) или DMAP (диметиламинопиридин), и конденсирующего агента, такого как ДИК (диизопропилкарбодиимид), ДЦК (дициклогексилкарбодиимид) или ЭДК (1-этил-3-(3-диметиламинопропил)карбодиимид) в органическом растворителе, таком как дихлорметан, ДМФ (N,N-диметилформамид) или НМП (N-метил-2-пирролидон). Например, при применении смолы Ванга реакцию проводят в присутствии пиридина и 2,6-дихлорбензоилхлорида в ДМФ с получением эфира (5). Эфир (5) может быть изменен до амина (6) при подходящих условиях, в зависимости от заместителя R. Например, при использовании нитрогруппы в качестве R эфир (5) может быть превращен в амин (6) в присутствии восстанавливающего агента, такого как SnCl2 или его гидраты, в растворителе, таком как НМП, ДМФ или этанол. В случае амина, защищенного группой Fmoc (9-флуоренилметоксикарбонильная группа) (FmocNH), защитная группа может быть удалена основанием, таким как пиперидин, в растворителе, таком как ДМФ, с получением амина (6).
Хиназолиндион (9), где А представляет общую формулу (2), а U и V оба обозначают С(=О) в общей формуле (1), может быть получен следующим способом. Сначала получают мочевину (7) реакцией амина (6) с изоцианатом, имеющим группу карбокслатного эфира в орто-положении. Затем хиназолиндион (8) может быть получен реакцией замыкания кольца (циклизации) основанием, таким как пиперидин, в растворителе, таком как ДМФ или ТМГ (тетраметилгуанидин). Далее, реагенты, такие как алкилгалогенид и арилгалогенид, реагируют с продуктом с образованием хиназолиндиона (9), или указанное соединение может быть также получено реакцией Митсунобу с использованием спирта.
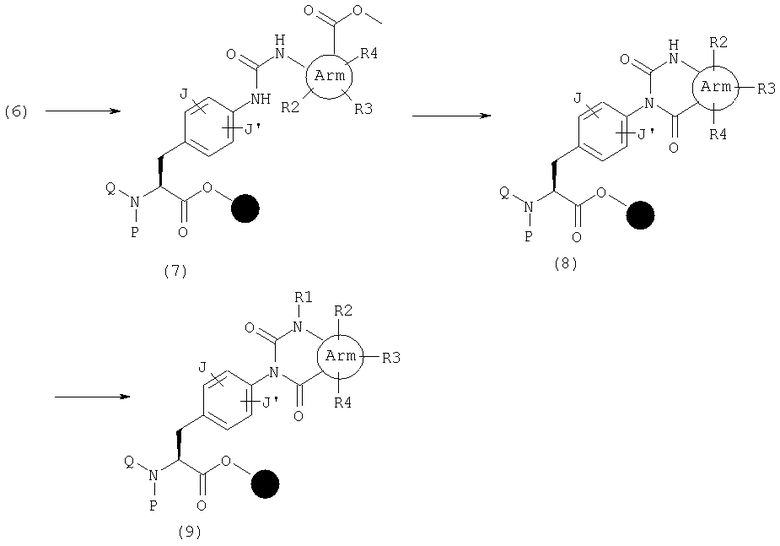
Хиназолиндион (9), в котором А представляет общую формулу (2), а U и V оба представляют С(=О) в общей формуле (1), может быть также синтезирован следующим способом. Сначала амид (10) может быть получен реакцией амина (6) с ацилхлоридом, имеющим нитрогруппу в орто-положении, в присутствии основания 2,6-лутидина в растворителе, таком как НМП, или реакцией его с карбоновой кислотой, имеющей нитрогруппу в орто-положении, активированной с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП или дихлорметан. Затем амин (11) получают восстановлением этой нитрогруппы SnCl2 или его гидратами и циклизуют реагентами, такими как КДИ (карбонилдиимидазол), трифосген или п-нитрофенилхлорформиат, с получением хиназолиндиона (8).
В качестве других способов синтеза, хиназолиндион (8) может быть также получен следующим способом. Сначала амид (11) может быть получен реакцией амина (6) с карбоновой кислотой, имеющей аминогруппу с орто-положении, активированной с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП или дихлорметан. Затем амид (11) циклизуют реагентами, такими как КДИ, трифосген или п-нитробензилхлорформиат, с получением хиназолиндиона (8). Этот способ используют в качестве одного из способов синтеза в том случае, когда А представляет общую формулу (3-1) и U и V оба являются С(=О) в общей формуле (1), когда разные салициловые кислоты используют вместо указанной выше карбоновой кислоты, и полученный амид (11) циклизуют такими реагентами, как КДИ, трифосген или п-нитрофенилхлорформиат, после добавления основания, такого как этаноламин.
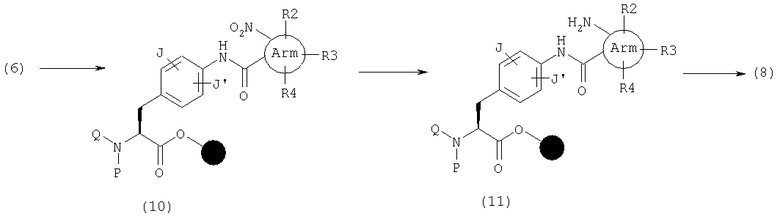
Хиназолиндион (9), в котором А представляет общую формулу (2), U и V являются оба С(=О) и R2, R3 или R4 обозначает оттягивающий электрон заместитель, такой как нитрогруппа, в общей формуле (1), может быть также синтезирован следующим способом. Сначала амид (42) может быть получен реакцией амина (6) с карбоновой кислотой, имеющей группу фтор в орто-положении, активированной с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП или дихлорметан. Затем, после получения амина (43) замещением группы фтора аминогруппой, этот амин (43) циклизуют реагентами, такими как КДИ, трифосген или п-нитрофенилхлорформиат, с получением хиназолиндиона (9).
В качестве примера способов синтеза эфира (12), где А представляет общую формулу (2), U обозначает С(=S) и V обозначает С(=О) в общей формуле (1), указанный эфир может быть получен реакцией амина (6) с изотиоцианатом, имеющим карбоксилатную группу в орто-положении.
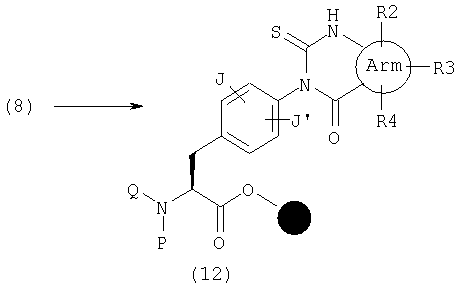
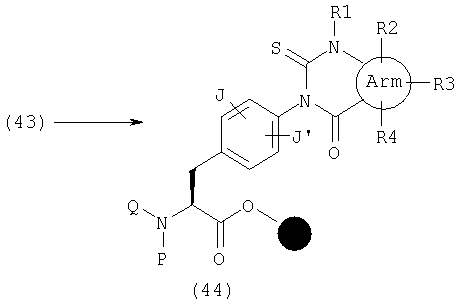
В качестве примера способов синтеза эфира (44), где А представляет общую формулу (2), U обозначает С(=S) и V обозначает С(=О) в общей формуле (6), указанный эфир может быть получен реакцией амина (43) с тиокарбонилдиимидазолом в растворителе, таком как декагидронафталин и толуол.
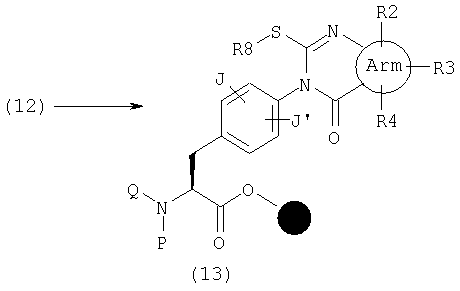
Другой эфир (13), где А представляет общую формулу (3) и W обозначает С(-R7) в общей формуле (1), в частности, где R7 представляет низшую алкилтиогруппу, низшую алкилтиогруппу, замещенную циклоалкильной группой, которая может содержать гетероатом (гетероатомы) в кольце, низшую алкилтиогруппу, замещенную арильной группой, или низшую алкилтиогруппу, замещенную гетероарильной группой, может быть получен реакцией эфира (12) с такими реагентами, как алкилгалогенид и арилгалогенид.
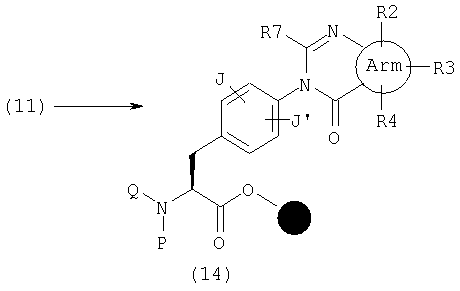
Далее, другой эфир (14), где А представляет общую формулу (3) и W обозначает С(-R7) в общей формуле (1), в частности, где R7 представляет атом водорода, низшую алкильную группу, низшую алкенильную группу, низшую алкинильную группу, циклоалкильную группу, которая может содержать гетероатом (гетероатомы) в кольце, арильную группу, гетероарильную группу, низшую алкильную группу, замещенную циклоалкильной группой (циклоалкильными группами), который могут содержать гетароатом (гетероатомы) в кольце, низшую алкильную группу, замещенную арильной группой (арильными группами), низшую алкильную группу, замещенную гетероарильной группой (гетероарильными группами), низшую алкоксильную группу, низшую алкоксильную группу, замещенную циклоалкильной группой (циклоалкильными группами), которая может содержать гетероатом (гетероатомы) в кольце; низшую алкоксильную группу, замещенную арильной группой (арильными группами), низшую алкоксильную группу, замещенную гетероарильной группой (гетероарильными группами), циклоалкиооксигруппу, которая может содержать гетероатом (гетероатомы) в кольце, арилоксигруппу, гетероарилоксигруппу, низшую гидроксиалкильную группу, низшую гидроксиалкенильную группу, низшую гидроксиалкоксильную группу, низшую галогеналкильную группу, низшую галогеналкоксильную группу, низшую галогеналкенильную группу, нитрогруппу, цианогруппу, замещенную или незамещенную аминогруппу, карбоксильную группу, низшую алкилоксикарбонильную группу, замещенную или незамещенную карбамоильную группу, низшую алканоильную группу, ароильную группу, низшую алкилтиогруппу, низшую алкилсульфонильную группу или замещенную или незамещенную сульфамоильную группу, может быть получен реакцией амина (11) с различными ортоформиатами или их эквивалентами. Указанный эфир может быть также получен окислением после реакции с альдегидом или ацеталем.
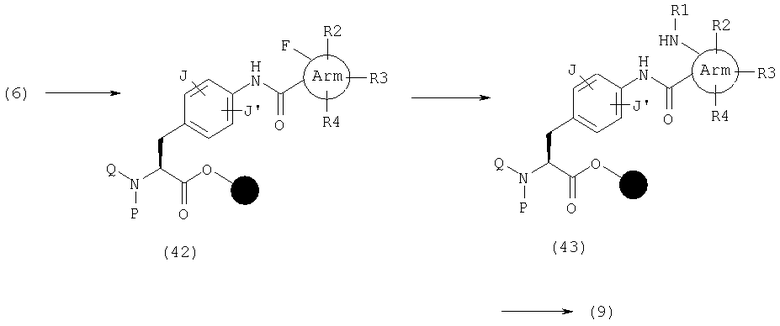
В числе эфиров (14), где А представляет общую формулу (3) и W обозначает С(-R7) в общей формуле (1), в частности, те, где R7 представляет замещенную аминогруппу, могут быть синтезированы следующим образом. Сначала Y в эфире (15) является группой, такой как азидная группа или аминогруппа, и каждая из них может быть изменена до иминофосфина (16) реакцией с трифенилфосфином или трифенилфосфином в присутствии диизопропилазодикарбоновой кислоты, соответственно. Затем карбодиимид (17) (n равно 0-4) получают реакцией Аза-Виттига иминофосфина (16) с изоцианатом, имеющим карбоксилатную группу в орто-положении. После нуклеофильной атаки по карбодиимидной части этого амина и замыкания кольца после этого может быть синтезирован эфир (18).
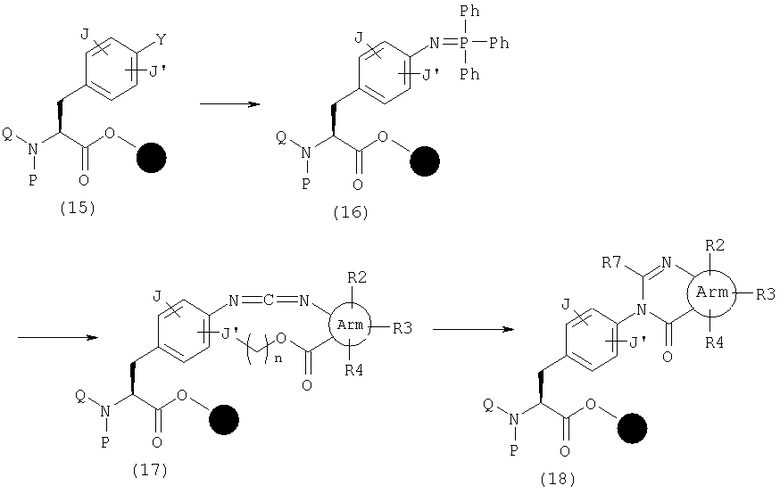
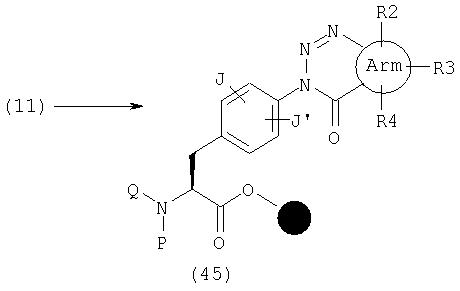
В качестве примера способов синтеза эфира (45), где А представляет общую формулу (3), W обозначает N и Х обозначает С(=О) в общей формуле (1), указанный эфир может быть получен реакцией амина (11) с нитритом натрия в растворителе, таком как уксусная кислота.
В качестве примера способов синтеза эфира (46), где А представляет общую формулу (2), U обозначает S(=O) и V обозначает С(=О) в общей формуле (1), указанный эфир может быть получен реакцией амина (43), например, с тионилхлоридом в растворителе, таком как дихлорметан.

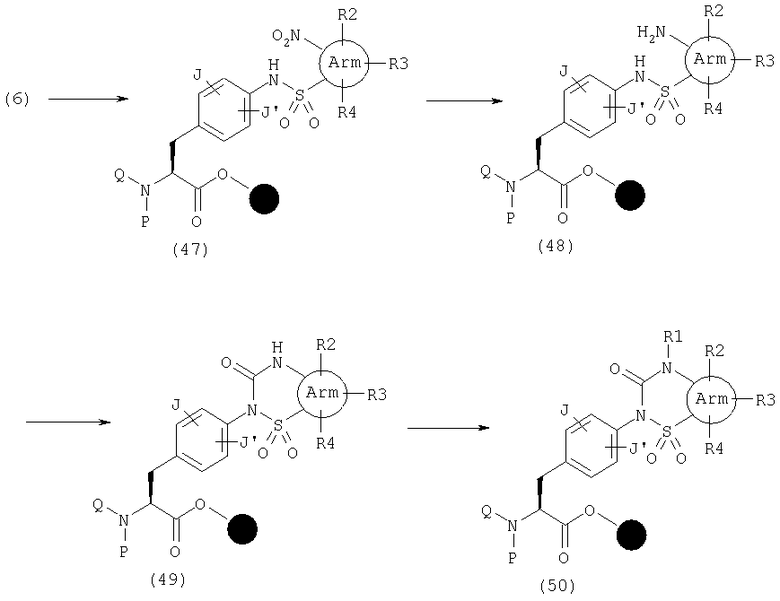
В качестве примера способов синтеза эфира (50), где А представляет общую формулу (2), U обозначает С(=O) и V обозначает S(=О)2 в общей формуле (1), указанный эфир может быть получен следующим способом. Сначала может быть получен сульфонамид (47) реакцией амина (6) с сульфонилхлоридом, имеющим нитрогруппу в орто-положении, в присутствии основания, такого как 2,6-лутидин, в растворителе, таком как НМП и дихлорметан. Затем амин (48) получают восстановлением нитрогруппы SnCl2 или его гидратами и циклизуют реагентами, такими как КДИ, трифосфген или п-нитрофенилхлорформиат, с получением (49). Затем с этим продуктом реагирует алкилгалогенид с образованием указанного эфира.
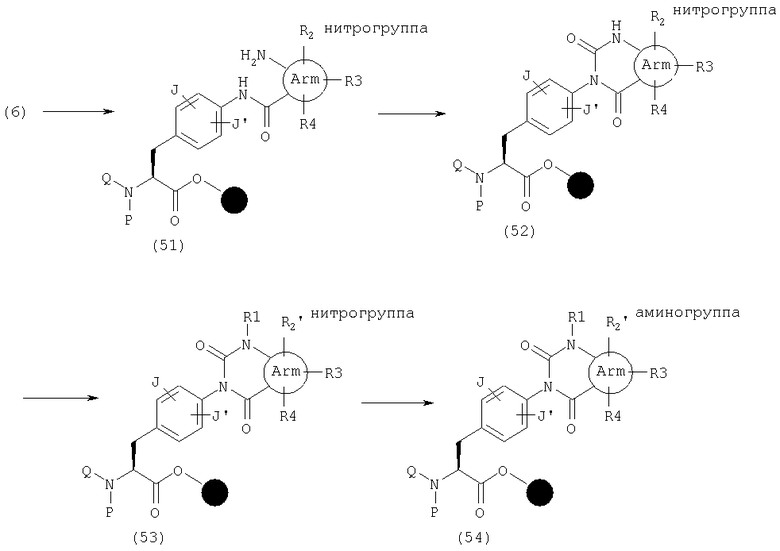
В качестве примера способов синтеза эфира (54), где А представляет общую формулу (2), U и V оба обозначают С(=О) и R2, R3 или R4 представляет аминогруппу в общей формуле (1), указанный эфир может быть получен следующим способом. Сначала амид (51) может быть получен реакцией амина (6) с карбоновой кислотой, имеющей нитрогруппу в качестве заместителя (заместителей) и аминогруппу в орто-положении, активированной с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП или дихлорметан. Затем получают (52) циклизацией реагентами, такими как КДИ, трифосген или п-нитрофенилхлорформиат. После реакции с алкилгалогенидом амин (54) может быть получен восстановлением нитрогруппы SnCl2, его гидратами или т.п.
В качестве примера способов синтеза эфира (54), где А представляет общую формулу (2), U и V оба обозначают С(=O) и R2, R3 или R4 представляет ациламиногруппу в общей формуле (1), указанный эфир может быть получен реакцией (54) с ацилгалогенидом в присутствии основания, такого как пиридин, в органическом растворителе, таком как ДМФ, НМП и дихлорметан.
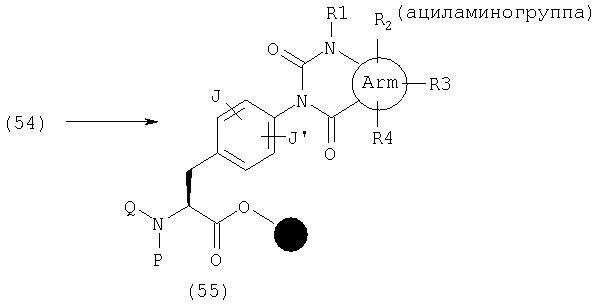
В качестве примера способов синтеза эфира (60), где А представляет общую формулу (2), U и V оба обозначают С(=О) и R2, R3 или R4 представляет замещенную аминогруппу в общей формуле (1), указанный эфир может быть получен следующим способом. Сначала амид (56) может быть получен реакцией амина (6) с карбоновой кислотой, имеющей группу фтор в качестве заместителя (заместителей) и нитрогруппу в орто-положении, активированной с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП или дихлорметан. Затем амин (57) может быть получен реакцией амида (56) с замещенным амином в растворителе, таком как НМП и ДМСО, и (58) получают восстановлением нитрогруппы SnCl2 или его гидратами или т.п. После получения (60) циклизацией (58) такими реагентами, как КДИ, трифосген или п-нитрофенилхлорформиат, (61) может быть получен реакцией Митсунобу с использованием спирта, диизопропилазодикарбоновой кислоты и т.п.

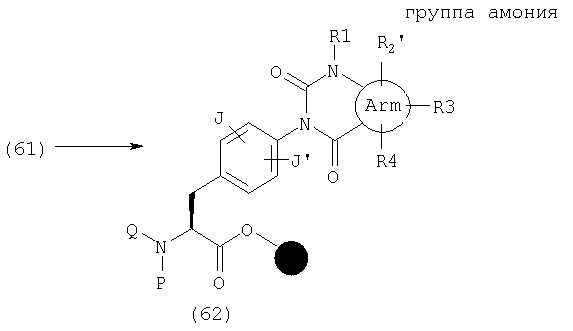
В качестве примера способов синтеза эфира (62), где А представляет общую формулу (2), U и V оба обозначают С(=О) и R2, R3 или R4 представляет группу аммония в общей формуле (1), указанный эфир может быть получен реакцией (61) с алкилгалогенидом в присутствии основания, такого как диизопропилэтиламин, в органическом растворителе, таком как ДМФ и НМП.
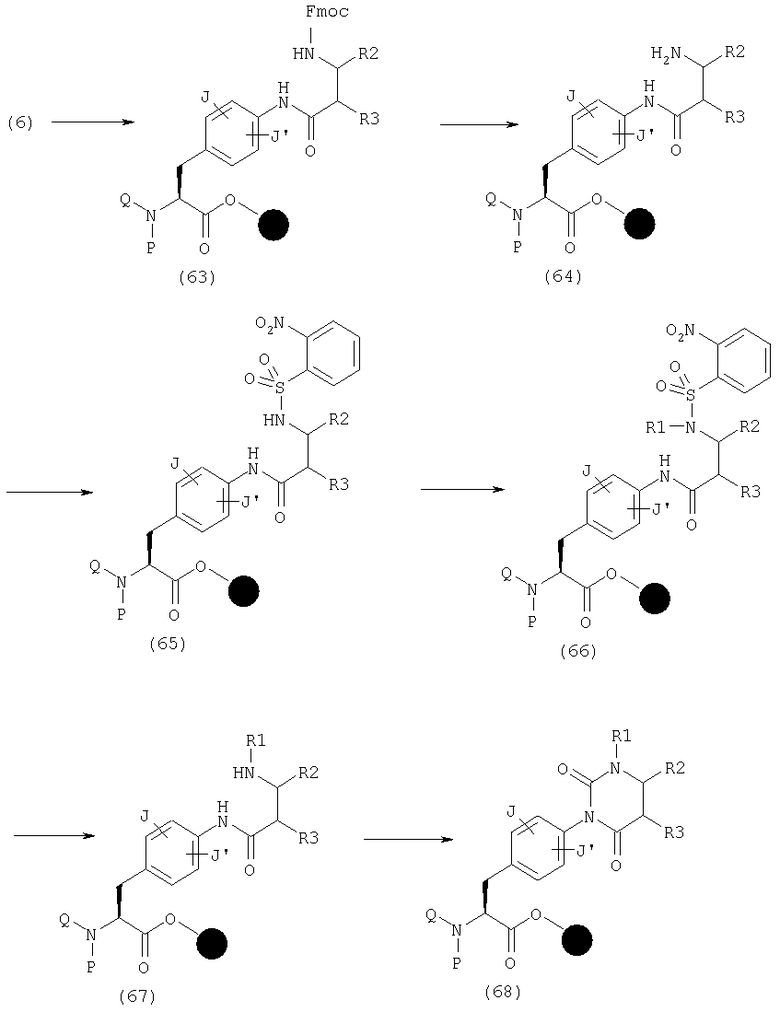
В качестве примера способов синтеза эфира (68), где А представляет общую формулу (3-2) в общей формуле (1), указанный эфир может быть получен следующим способом. Сначала может быть получен амид (63) реакцией амина (6) с карбоновой кислотой, имеющей аминогруппу, защищенную Fmoc, в β-положении, активированной с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП или дихлорметан. Затем амин (64) может быть получен удалением Fmoc и затем может быть получен сульфонамид (65) реакцией (64) с сульфонилхлоридом, имеющим нитрогруппу в качестве заместителя (заместителей), в присутствии основания, такого как 2,6-лутидин, в растворителе, таком как НМП и дихлорметан. Затем может быть получен (66) реакцией (65) с алкилгалогенидом в присутствии основания, такого как диизопропилэтиламин, и затем может быть получен амин (67) реакцией (66) с меркаптоэтанолом, диазабициклоундеценом и т.д. Это соединение циклизуют такими реагентами, как КДИ, трифосфген и п-нитрофенилхлорформиат, с получением эфира (68).
Когда А в производном фенилаланина (1) данного изобретения представляет общую формулу (3-3) и Arm обозначает бензольное кольцо, эфир может быть синтезирован в соответствии со следующим способом. Тот же самый способ может быть использован даже в том случае, когда Arm является другим, чем бензольное кольцо.
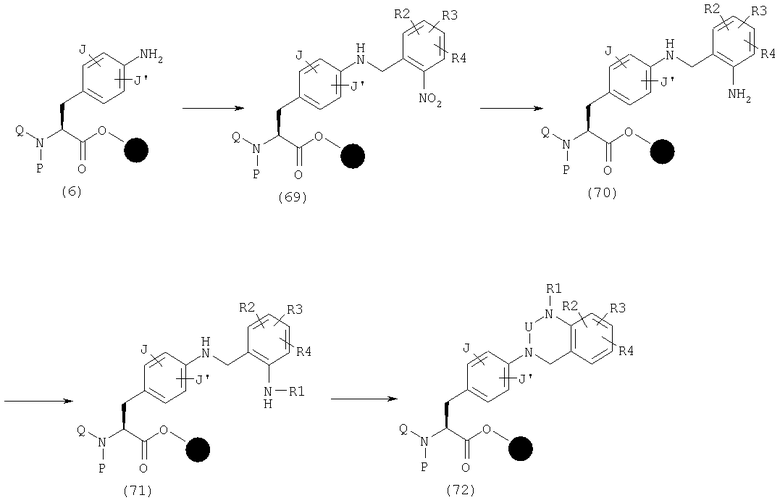
Сначала амин (6) реагирует с галогенированным метилбензолом, имеющим нитрогруппу в орто-положении, с образованием бензиламина (69). После восстановления указанного бензиламина хлоридом олова и т.п. с получением амина (70), амин (71) может быть получен превращением этого амина на бензольном кольце бензильной части, введенной в моно-R1-замещенную группу различными способами. Эфир (72) может быть получен, наконец, циклизацией реагентами, такими как КДИ, трифосфген и п-нитрофенилхлорформиат.
Часть D-T в общей формуле (1) может быть сконструирована следующим образом. Например, когда Т обозначает С(=О) и В обозначает гидроксильную группу в формуле (1), если в эфире (19) заместитель G имеет структуру С, заместитель (заместители), которые могут быть превращены в С в определенной точке процесса синтеза, или заместитель (заместители), которые имеют подходящим образом защищенную структуру, тогда заместитель Z имеет структуру (2), (3), (3-1), (3-2), или заместитель (заместители), которые могут быть превращены в А в определенной точке процесса синтеза, или заместитель (заместители) имеют подходящим образом защищенную структуру, эфир (19) может быть превращен в амин (20) удалением защиной группы (защитных групп) в подходящих условиях в зависимости от защитной группы Е. Например, когда в качестве Е используют группу Fmoc (9-флуоренилметоксикарбонильную группу), защитные группы могут быть удалены основанием, таким как пиперидин, в растворителе, таком как ДМФ. Амин (20) может быть превращен в амид (21) конденсацией карбоновой кислоты с использованием конденсирующего агента, такого как ДИК, и, если необходимо, подходящей добавки, такой как HOAt или HOBt, в органическом растворителе, таком как ДМФ, НМП и дихлорметан.
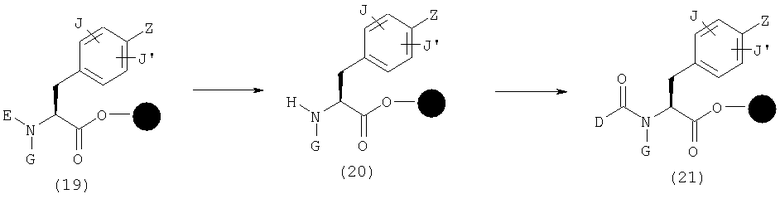
Затем, амин (20) реагирует с ацилгалогенидом, ангидридом карбоновой кислоты, сульфонилгалогенидом и ангидридом сульфоновой кислоты в присутствии органического основания, такого как триэтиламин, диизопропилэтиламин, пиридин и N,N-диметиламинопиридин, или неорганического основания, такого как карбонат калия и карбонат натрия, в органическом растворителе, таком как ДМФ, НМП и дихлорметан, и затем может образовать соответствующие амидную структуру и структуру сульфонамидокислоты.
Далее, амин (20) реагирует с различными изоцианатами и изотиоцианатами в присутствии органического основания, если необходимо, такого как триэтиламин, диизопропилэтиламин, пиридин и N,N-диметиламинопиридин, в органическом растворителе, таком как ДМФ, толуол и дихлорметан, и затем может образовывать соответствующие структуру мочевины и структуру тиомочевины.
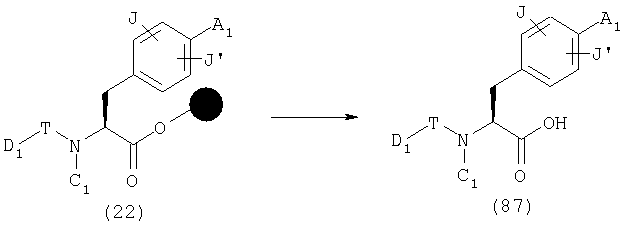
Эфиры, синтезированные вышеописанными способами, такие как (9), (12), (13), (14), (18), (21), (44), (45), (46), (50), (54), (55), (61), (62), (68) и (72), отщепляют от смолы при подходящих условиях с получением карбоновой кислоты (87). Например, при применении смолы Ванга, если, в эфире (22), каждый из А1, С1 и D1 обозначает А, С и D, соответственно, или группу, которая превращается в А, С и D, соответственно, в условиях отщепления, эфир (22) обрабатывают раствором кислоты, в том числе ТФУ (трифторуксусной кислоты), с получением раствора карбоновой кислоты (87). Затем чистая карбоновая кислота (87) может быть получена с применением хорошо известных способов выделения и очистки, таких как концентрирование, экстракция, кристаллизация, колоночная хроматография, ВЭЖХ и перекристаллизация, к полученной таким образом карбоновой кислоте (87).
Соединение, где В представляет низшую алкоксильную группу в общей формуле (1), может быть получено конденсацией карбоновой кислоты (87) с подходящим низшим спиртом в присутствии подходящего конденсирующего агента или кислотного катализатора.
Соединение, где В представляет гидроксиламиногруппу в общей формуле (1), может быть получено конденсацией карбоновой кислоты (87) с гидроксиламином в присутствии подходящего конденсирующего агента.
Производное фенилаланина (1) может быть синтезировано с применением твердофазных способов, показанных выше, к способам синтеза в фазе раствора, посредством выбора подходящей защитной группы и использования хорошо известных способов выделения и очистки.
Когда соединения общей формулы (1) могут образовывать их соли, достаточно, чтобы эти соли были фармацевтически приемлемыми солями. Когда соединение имеет кислотную группу, такую как карбоксильная группа, соли могут быть солями аммония или его солями с щелочными металлами, например, натрием и калием, его солями с щелочно-земельными металлами, например, кальцием и магнием, его солями с алюминием и цинком, его солями с органическими аминами, например, триэтиламином, этаноламином, морфолином, пиперидином и дициклогексиламином, и его солями с основными аминокислотами, например, аргинином и лизином. Когда это соединение имеет основную группу, соли могут быть солями с неорганическими кислотами, например, хлористоводородной кислотой, серной кислотой и фосфорной кислотой; солями с органическими кислотами, например, уксусной кислотой, лимонной кислотой, бензойной кислотой, малеиновой кислотой, фумаровой кислотой, винной кислотой и янтарной кислотой; и солями с органосульфоновыми кислотами, например, метансульфоновой кислотой и п-толуолсульфоновой кислотой. Соли могут быть образованы смешиванием соединения общей формулы (1) с необходимыми кислотой или основанием в правильном соотношении в растворителе или диспергирующем агенте или реакцией катионо- или анионообмена с другой солью.
Соединения общей формулы (1) данного изобретения включают в себя также их сольваты, такие как гидраты, и их аддукты со спиртами.
Соединения общей формулы (1) и их соли вводят пациентам в их чистом виде или в форме различных фармацевтических композиций. Дозированные формы фармацевтических композиций представляют собой, например, таблетки, порошки, пилюли, гранулы, капсулы, суппозитории, растворы, покрытые сахаром таблетки, депо и сиропы. Они могут быть приготовлены обычными помощниками врача с использованием общепринятого способа.
Например, таблетки готовят смешиванием производного фенилаланина, активного ингредиента данного изобретения, с любой из известных добавок, таких как инертные разбавители, например, лактоза, карбонат кальция и фосфат кальция; связывающие вещества, например, аравийская камедь, кукурузный крахмал и желатин; наполнители, например, альгиновая кислота, кукурузный крахмал и предварительно желатинированный крахмал; подслащивающие агенты, например, сахароза, лактоза и сахарин; ароматизатор, например, мята перечная, масло гаультерии Akamono (Gaultheria aderothrix) и вишня; смазывающие вещества, например, стеарат магния, тальк и карбоксиметилцеллюлоза; формообразующие вещества для мягких желатиновых капсул и суппозиториев, например, жиры, воски, полутвердые или жидкие полиолы, природные масла и отвержденные масла; и наполнители для растворов, например, вода, спирты, глицерины, полиолы, сахароза, инвертные сахара, глюкоза и растительные масла.
Антагонист, содержащий соединение (соединения) приведенной выше общей формулы (1) или его соль (их соли) в качестве активного ингредиента, применим в качестве терапевтического или профилактического агента для заболеваний, в патологии которых участвует α4-интегрин-зависимый процесс адгезии, таких как воспалительные заболевания, ревматоидный артрит, воспалительные заболевания пищеварительного тракта, системная красная волчанка, множественный склероз, синдром Шегрена, астма, псориаз, аллергия, диабет, сердечно-сосудистые заболевания, склероз артерий, рестеноз, пролиферация опухолей, метастазирование опухолей и отторжение трансплантата и т.д.
Доза соединения общей формулы (1) или его соли, используемая для вышеописанных целей, варьируется в зависимости от предполагаемого терапевтического эффекта, способа введения, периода лечения и возраста и веса тела пациента. Эта доза обычно равна 1 мкг-5 г в день для взрослых при пероральном введении и 0,01 мкг-1 г в день для взрослых при парентеральном введении.
Примеры
Нижеследующие примеры будут дополнительно иллюстрировать данное изобретение, и они являются всего лишь иллюстративными вариантами изобретения и никаким образом не ограничивают данное изобретение.
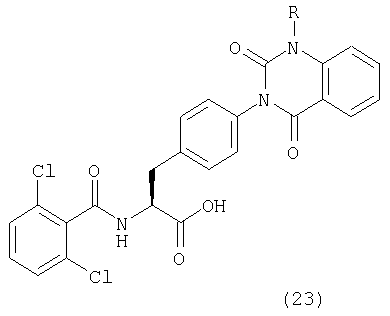
Пример 1 Синтез соединения следующей общей формулы (23), которое имеет заместитель (заместители) примера 1 таблицы 1
Процесс 1 Приготовление смолы
Fmoc-Phe(4-нитро)-ОН (2,5 г), 2,6-дихлорбензоилхлорид (0,745 мл) и пиридин (1,5 мл) в растворе НМП (N-метил-2-пирролидона) (25 мл) добавляли к смоле Ванга (0,76 ммоль/г, 2,3 г) и перемешивали при комнатной температуре в течение 16 часов. После удаления избытка растворителя смолу промывали ДМФ три раза, дихлорметаном три раза и НМП два раза. Для осуществления блокирования непрореагировавшей гидроксильной группы на смоле, смолу обрабатывали уксусным ангидридом (20 мл), пиридином (20 мл) и НМП (20 мл) в течение 2 часов. После удаления избытка растворителя смолу промывали ДМФ три раза и дихлорметаном три раза и сушили при пониженном давлении.
Процесс 2 Удаление группы Fmoc
Раствор в ДМФ 20% пиперидина (25 мл) добавляли к смоле, полученной в процессе 1, и давали реагировать в течение 15 минут. После удаления растворителя смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Реакция ацилирования
2,6-дихлорбензоилхлорид (1,1 мл), 2,6-лутидин (1,6 мл) и НМП (26 мл) добавляли к 2,0 г смолы, полученной в процессе 2, и давали реагировать в течение 6 часов. После удаления растворителя смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 4 Восстановление нитрогруппы
Раствор НМП (30 мл)·EtOH (1,5 мл) SnCl2·2Н2О (15,0 г) добавляли к 1,5 г смолы, полученной в процессе 3, и давали реагировать в течение 16 часов. После удаления растворителя смолу промывали ДМФ и дихлорметаном по три раза каждым.
Процесс 5 Образование кольца хиназолин-2,4-диона
2 г смолы, полученной в процессе 4, давали реагировать в растворе метил-2-изоцианатбензоата (1,92 г) в НМП (32 мл) в течение 16 часов. После удаления растворителя смолу промывали ДМФ и дихлорметаном по три раза каждым. К смоле добавляли раствор в ДМФ 20% пиперидина и оставляли на 1 час. После удаления растворителя смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 6 Алкилирование
Метилиодид (0,75 ммоль), 18-кроун-6 (30 мг), НМП (1 мл) и K2CO3 (35 мг) добавляли к 20 мг смолы, полученной в процессе 5, и давали реагировать в течение 3 дней. После удаления растворителя смолу промывали ДМФ, водой, ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 7 Отщепление от смолы
Смолу, полученную в процессе 6, обрабатывали трифторуксусной кислотой, содержащей 5% воды, в течение 1 часа. Остаток очищали жидкостной хроматографией высокого давления (вода/ацетонитрил) с получением 8 мг желаемого соединения. MS (ESI MH+): 512; CHNO: C25H19Cl2N3O5
Примеры 2-7
Соединения, описанные ниже, синтезировали согласно той же самой процедуре, какая описана в примере 1, за исключением того, что соответствующие реагенты алкилирования использовали в процессе 6 примера 1. Между тем, R в таблице 1 является заместителем (заместителями) в следующей общей формуле (23), и ту же самую процедуру, что и процедура примера 1, повторяли в примере 2, за исключением того, что процесс 6 примера 1 не проводили.
Пример 8 Синтез соединения следующей общей формулы (24), которое имеет заместитель (заместители) примера 8 таблицы 2
Процесс 1 Образование кольца хиназолин-2,4-диона и удаление группы Fmoc
Нитрогруппу смолы (1 г), полученной в процессе 1 примера 1, восстанавливали в соответствии с процессом 4 примера 1 и кольцо хиназолин-2,4-диона конструировали и группу Fmoc удаляли в соответствии с процессом 5 примера 1.
Процесс 2 Ацилирование, алкилирование и отщепление от смолы
Ацилирование проводили с использованием смолы, полученной в процессе 1 примера 8 (25 мг), 2,6-диметилбензойной кислоты (0,4 ммоль), ДИК (диизопропилкарбодиимида) (0,4 ммоль), HOAt (0,4 ммоль) и НМП (2 мл). Затем проводили алкилирование в соответствии с процессом 6 примера 1 и отщепление от смолы и очистку выполняли в соответствии с процессом 7 примера 1 с получением желаемого соединения (9 мг). MS (ESI MH+): 472; CHNO: С27Н25N3O5.
Примеры 9-13
Соединения, описанные ниже, синтезировали с использованием той же самой процедуры, которая описана в примере 8, за исключением того, что соответствующую карбоновую кислоту использовали в процессе 2 примера 8. R в таблице 2 является заместителем (заместителями) в следующей общей формуле (24). Далее, в примере 13 использовали вдвое больше ДИК и HOAt, чем в процессе 2 примера 8, для получения желаемого соединения (7 мг).

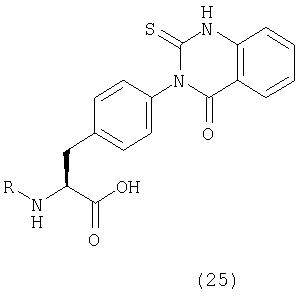
Пример 14 Синтез соединения следующей общей формулы (25), которое имеет заместитель (заместители) примера 14 таблицы 3
Процесс 1 Образование кольца хиназолин-2-тиоксо-4-она
Смоле, полученной в процессе 4 примера 1 (2,00 г), давали реагировать в растворе НМП (25 мл) метил-2-изотиоцианатбензоата (1,40 г) в течение 16 часов. После удаления растворителя реакции смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Отщепление от смолы
Смолу, полученную в процессе 1 (25 мг), обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения (10 мг). MS (ESI MH+): 513; CHNO: C24H17Cl2N3O4S.
Пример 15 Синтез соединения следующей общей формулы (25), которое имеет заместитель (заместители) примера 15 таблицы 3
Процесс 1 Ацилирование
Ацилирование проводили с использованием смолы, полученной в процессе 2 примера 1 (25 мг), 2,6 диметилбензойной кислоты (0,4 ммоль), ДИК (0,4 ммоль), HOAt (0,4 ммоль) и НМП (2 мл).
Процесс 2 Образование кольца хиназолин-2-тиоксо-4-она
Смоле, полученной в процессе 1 (2,00 г), давали реагировать в растворе в НМП (25 мл) метил-2-изотиоцианатбензоата (1,40 г) в течение 16 часов. После удаления растворителя реакции смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Отщепление от смолы
Смолу, полученную в процессе 1 (25 мг), обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения (8 мг). MS (ESI MH+): 474; CHNO: C26H23N3O4S.
Пример 16 Синтез соединения следующей общей формулы (26), которое имеет заместитель (заместители) примера 16 таблицы 4
Процесс 1 Алкилирование
Аллилбромид (0,5 ммоль), диизопропилэтиламин (1,0 ммоль) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 примера 14 (25 мг), и давали реагировать в течение 16 часов. После удаления растворителя реакции смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Отщепление от смолы
Смолу, полученную в процессе 1, обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения (6 мг). MS (ESI MH+): 554; CHNO: C27H21Cl2N3O4S.
Примеры 17-30
Соединения, показанные в таблице 4, синтезировали с использованием той же самой процедуры, которая описана в примере 16, за исключением того, что в процессе 1 примера 16 использовали смолу, полученную в процессе 1 примера 14 или процессе 2 примера 15, и соответствующий галогенид. Между тем, R1 и R2 в таблице 4 являются заместителем (заместителями) в следующей общей формуле (26).
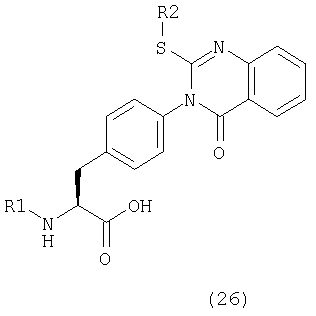
Данные ЯМР соединения примера 18: 1Н-ЯМР (CDCl3) δ = 2,53 (3H, с), 3,40 (2H, т, J=5,3 Гц), 5,20 (1H, т, J=5,3 Гц), 7,21-7,35 (6H, м), 7,41 (1H, т, J=7,5 Гц), 7,50 (2H, д, J=8,7 Гц), 7,65 (1H, д, J=8,4 Гц), 7,76 (1Н, т, J=6,9 Гц), 8,19 (1H, д, J=7,5 Гц)
Пример 31 Синтез соединения следующей общей формулы (27), которое имеет заместитель (заместители) примера 31 таблицы 5
Процесс 1 Ацилирование
2-нитробензоилхлорид (4 ммоль), 2,6-лутидин (8 ммоль) и НМП добавляли к смоле, полученной в процессе 4 примера 1 (1,00 г), и перемешивали в течение 16 часов. После этого смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Восстановление нитрогруппы
Смолу, полученную в процессе 1 (25 мг), обрабатывали в соответствии с процессом 4 примера 1 с получением имеющейся в виду смолы.
Процесс 3 Циклизация ортоэфира и отщепление от смолы
Триметилортоацетат (1 мл), АсОН (50 мкл) и НМП (1 мл) добавляли к смоле, полученной в процессе 2 (25 мг), и перемешивали при 50°С в течение 16 часов. После промывания ее ДМФ и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения (8 мг). MS (ESI MH+): 496; CHNO: C25H19Cl2N3O.
Примеры 32-44
Соединения, показанные в таблице 5, синтезировали с использованием той же самой процедуры, которая описана в примере 31, за исключением того, что смолу, полученную в процессе 4 примера 1 или процессе 1 примера 15, использовали в процессе 1 примера 31 и соответствующий ортоэфир использовали в процессе 3 примера 31. Между тем, R1 и R2 в таблице 5 являются заместителем (заместителями) в следующей общей формуле (27).
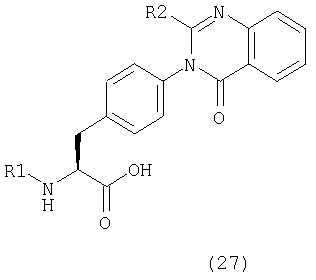
Данные ЯМР соединения примера 32: 1Н-ЯМР (CDCl3) δ = 1,21 (3H, т, J=7,4 Гц), 2,47 (2H, кв., J=7,4 Гц), 3,32-3,42 (2H, м), 5,19 (1Н, т, J=5,4 Гц), 7,10-7,20 (2H, м), 7,22-7,35 (4H, м), 7,43-7,54 (3H, м), 7,70-7,83 (2H, м), 8,21 (1H, д, J=7,8 Гц)
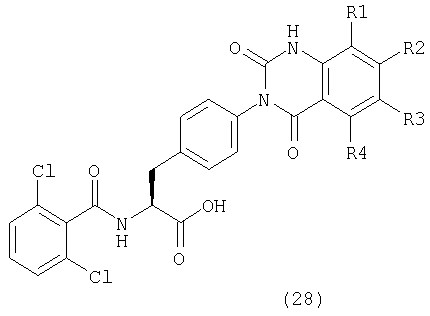
Пример 45 Синтез соединения следующей общей формулы (28), которое имеет заместитель (заместители) примера 45 таблицы 6
Процесс 1 Ацилирование
3-хлор-2-нитробензойную кислоту (210 мг, 1,04 ммоль), HOAt (141 мг, 1,04 ммоль), ДИК (161 мкл, 1,04 ммоль) и НМП (2 мл) добавляли к смоле, полученной в процессе 4 примера 1 (200 мг), и перемешивали в течение 64 часов. После этого смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Восстановление нитрогруппы
Смолу, полученную в процессе 1, обрабатывали в соответствии с процессом 4 примера 1.
Процесс 3 Образование кольца хиназолин-2,4-диона
Карбонилдиимидазол (844 мг, 5,21 ммоль) и НМП (2 мл) добавляли к смоле, полученной в процессе 2, и перемешивали при 80°С в течение 16 часов. После промывания ее ДМФ и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 532; CHNO: C24H16Cl3N3O5.
Примеры 46-54
Соединения, показанные в таблицах 6-7, синтезировали с использованием той же самой процедуры, которая описана в примере 45, за исключением того, что соответствующую замещенную 2-нитробензойную кислоту использовали в процессе 1 примера 45. Между тем, R1, R2, R3 и R4 в таблицах 6-7 являются заместителем (заместителями) в следующей общей формуле (28):
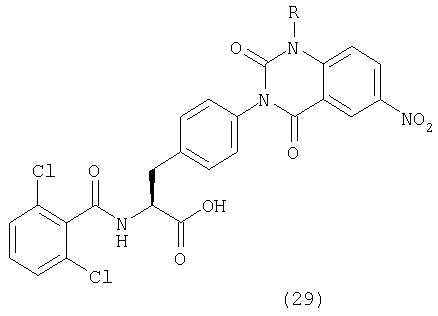
Пример 57 Синтез соединения следующей общей формулы (29), которое имеет заместитель (заместители) примера 57 таблицы 8
Процесс 1 Ацилирование
2-фтор-5-нитробензойную кислоту (1,63 г, 8,81 ммоль), HOAt (1,2 г, 8,81 ммоль), ДИК (675 мкл, 4,36 ммоль) и НМП (25 мл) добавляли к смоле, полученной в процессе 4 примера 1 (1 г), и перемешивали в течение 14 часов. После этого смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Замена группы фтор аминогруппой
Изопропиламин (400 мкл) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 (200 мг), и перемешивали в течение 21 часа. После этого смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Образование кольца хиназолин-2,4-диона
Карбонилдиимидазол (200 мг) и транс-декагидронафталин (2 мл) добавляли к смоле, полученной в процессе 2, и перемешивали при 95°С в течение 15 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 585; CHNO: C27H22Cl2N4O7.
Примеры 58-65
Соединения, показанные в таблице 8, синтезировали с использованием той же самой процедуры, которая описана в примере 57, за исключением того, что соответствующий амин использовали в процессе 2 примера 57. Между тем, R в таблице 8 является заместителем в следующей общей формуле (29):
Пример 66 Синтез соединения следующей общей формулы (30), которое имеет заместитель примера 66 таблицы 9
Процесс 1 Замена группы фтор аминогруппой
Раствор в ТГФ 2,0 М метиламина (3 мл) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 примера 57 (150 мг), и перемешивали в течение 14 часов. После этого смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Образование кольца хиназолин-2-тиоксо-4-она
Тиокарбонилдиимидазол (200 мг) и транс-декагидронафталин (2 мл) добавляли к смоле, полученной в процессе 1, и перемешивали при 95°С в течение 15 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 573; CHNO: C25H18Cl2N4O6S.
Примеры 67-69
Соединения, показанные в таблице 9, синтезировали с использованием той же самой процедуры, которая описана в примере 66, за исключением того, что соответствующий амин использовали в процессе 1 примера 66. Между тем, R в таблице 9 является заместителем в следующей общей формуле (30):
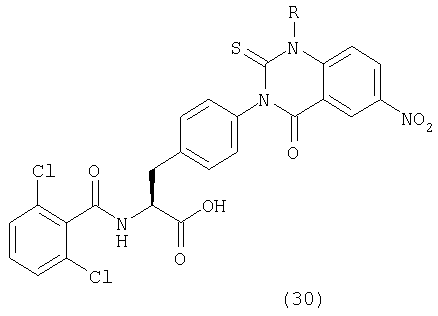
Пример 70 Синтез соединения следующей общей формулы (31), которое имеет заместители примера 70 таблицы 10
Процесс 1 Ацилирование
2-амино-3,6-дихлорбензойную кислоту (845 мг, 4,10 ммоль), HOAt (558 мг, 4,10 ммоль), ДИК (317 мкл, 2,05 ммоль) и НМП (11,5 мл) добавляли к смоле, полученной в процессе 4 примера 1 (500 мг), и перемешивали в течение 24 часов. После этого смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Образование кольца хиназолин-2,4-диона
Карбонилдиимидазол (200 мг) и транс-декагидронафталин (2 мл) добавляли к смоле, полученной в процессе 1 (200 мг), и перемешивали при 95°С в течение 15 часов. После этого смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Алкилирование
Смолу, полученную в процессе 2, алкилировали в соответствии с процессом 6 примера 1.
Процесс 4 Отщепление от смолы
Имеющееся в виду соединение получали в соответствии с процессом 7 примера 1. MS (ESI MH+): 580; CHNO: C25H17Cl4N3O5.
Примеры 71-80
Соединения примеров 71-75 синтезировали согласно той же самой процедуре, которая описана в примере 70, за исключением того, что соответствующие производные бензойной кислоты использовали в процессе 1 примера 70. Ту же самую процедуру, которая описана в примере 70, повторяли в примерах 76-80, за исключением того, что алкилирование в процессе 3 примера 70 не проводили. Между тем, R в таблице 10 является заместителями в следующей общей формуле (31).
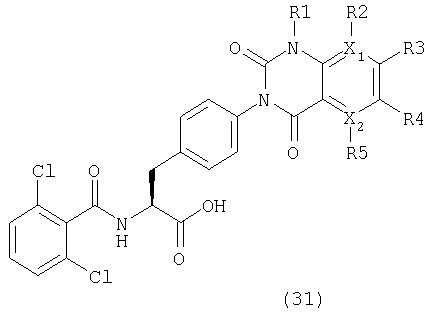
MS (MH+)
Пример 81 Синтез соединения следующей общей формулы (32), которое имеет заместители примера 81 таблицы 11
Процесс 1 Ацилирование
Смолу, полученную в процессе 4 примера 1, ацилировали в соответствии с процессом 1 примера 70.
Процесс 2 Образование кольца триазена
Нитрит натрия (150 г) и уксусную кислоту (4,5 мл) добавляли к смоле, полученной в процессе 1 (90 мг), и перемешивали в течение 24 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении имеющееся в виду соединение получали в соответствии с процессом 7 примера 1. MS (ESI MH+): 551; CHNO: C23H14Cl4N4O4.
Примеры 82 и 83
Соединения примеров 82 и 83, показанные в таблице 11, синтезировали согласно той же самой процедуре, которая описана в примере 81, за исключением того, что в процессе 1 примера 81 использовали соответствующую 2-аминобензойную кислоту. Между тем, R1, R2, R3 и R4 в таблице 11 являются заместителями в следующей общей формуле (32).
Пример 84 Синтез соединения следующей общей формулы (32), которое имеет заместители примера 84 таблицы 11
Процесс 1 Ацилирование, восстановление нитрогруппы
Ацилирование проводили с использованием смолы, полученной в процессе 4 примера 1 (1 г), 5-метокси-2-нитробензойной кислоты (1,62 г, 8,21 ммоль), ДИК (635 мкл, 4,11 ммоль), HOAt (1,12 г, 8,21 ммоль) и НМП (23 мл). Затем нитрогруппу восстанавливали в соответствии с процессом 2 примера 31.
Процесс 2 Образование кольца триазена, отщепление от смолы
Смолу, полученную в процессе 1, обрабатывали в соответствии с процессом 2 примера 81 и затем обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 513; CHNO: C24H18Cl2N4O5.
Примеры 85-89
Соединения примеров 85 и 89, показанные в таблице 11, синтезировали согласно той же самой процедуре, которая описана в примере 84, за исключением того, что в процессе 1 примера 84 использовали соответствующую 2-нитробензойную кислоту. Между тем, R1, R2, R3 и R4 в таблице 11 являются заместителями в следующей общей формуле (32).
Пример 90 Синтез соединения следующей общей формулы (32), которое имеет заместители примера 90 таблицы 11
Процесс 1 Образование кольца триазена, отщепление от смолы
Смолу, полученную в процессе 2 примера 31, обрабатывали в соответствии с процессом 2 примера 81 и затем обрабатывали в соответствии с процессом 2 примера 81 и затем обрабатывали в соответствии процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 483; CHNO: C23H16Cl2N4O4.
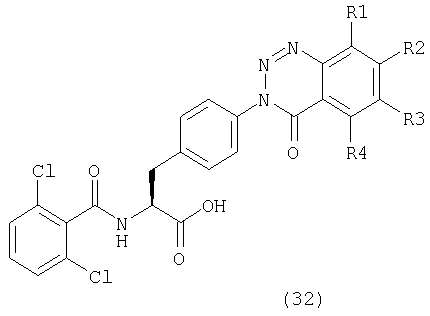
Пример 91 Синтез соединения следующей общей формулы (33), которое имеет заместители примера 91 таблицы 12
Процесс 1 Ацилирование, восстановление нитрогруппы
Ацилирование и восстановление нитрогруппы проводили в соответствии с процессом 1 примера 84 с использованием смолы, полученной в процессе 4 примера 1.
Процесс 2 Циклизация ортоэфиром и отщепление от смолы
Тетраэтоксиметан (800 мкл), уксусную кислоту (200 мкл) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 (150 мг), и перемешивали при 55°С в течение 15 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 556; CHNO: C27H23Cl2N3O6.
Примеры 92-94
Соединения примеров 92-94, показанные в таблице 12, синтезировали с использованием той же самой процедуры, которая описана в примере 91, за исключением того, что в процессе 1 примера 91 использовали соответствующую 2-нитробензойную кислоту. Между тем, R1, R2, R3 и R4 в таблице 12 являются заместителями в следующей общей формуле (33).
Пример 95 Синтез соединения следующей общей формулы (33), которое имеет заместители примера 95 таблицы 12
Процесс 1 Ацилирование
2-амино-4-фторбензойную кислоту (636 мг, 4,10 ммоль), HOAt (558 мг, 4,10 ммоль), ДИК (317 мкл, 2,05 ммоль) и НМП (11,5 мл) добавляли к смоле, полученной в процессе 4 примера 1 (500 мг), и перемешивали в течение 24 часов. После этого смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Циклизация ортоэфиром и отщепление от смолы
Смолу, полученную в примере 1, циклизовали в соответствии с процессом 2 примера 91 и затем имеющееся в виду соединение получали в соответствии с процессом 7 примера 1. MS (ESI MH+): 544; CHNO: C26H20Cl2FN3O5.
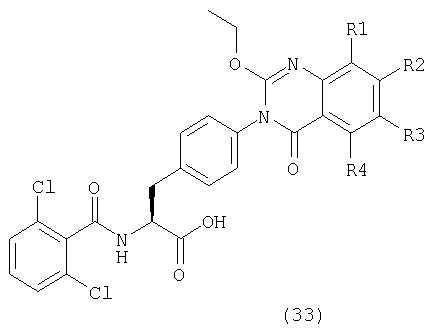
Пример 96 Синтез соединения следующей общей формулы (34), которое имеет заместитель примера 96 таблицы 13
Процесс 1 Ацилирование, восстановление нитрогруппы
Ацилирование проводили реакцией смолы, полученной в процессе 4 примера 1 (1 г), с 6-метил-2-нитробензойной кислотой (1,49 г, 8,21 ммоль), ДИК (635 мкл, 4,11 ммоль), HOAt (1,12 г, 8,21 ммоль) и НМП (23 мл) в течение 18 часов. Затем нитрогруппу восстанавливали в соответствии с процессом 2 примера 31.
Процесс 2 Циклизация
Карбонилдиимидазол (400 мг) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 (200 мг), и перемешивали при 95°С в течение 15 часов. После этого смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Алкилирование
Этилиодид (200 мкл) и тетраметилгуанидин (200 мкл) добавляли к смоле, полученной в процессе 2 (200 мг), и перемешивали в течение 24 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 540; CHNO: C27H23Cl2N3O5.
Пример 97
Соединения примера 97, показанные в таблице 13, синтезировали с использованием той же самой процедуры, которая описана в примере 96, за исключением того, что в процессе 3 примера 96 использовали соответствующий галогенид. Между тем, R в таблице 13 является заместителем в следующей общей формуле (34).
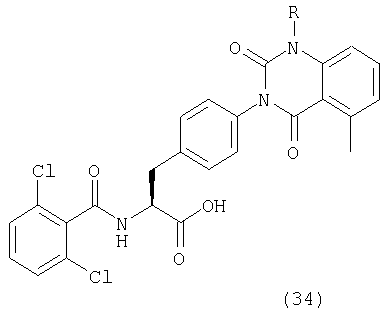
Пример 98 Синтез соединения следующей общей формулы (35), которое имеет заместители примера 98 таблицы 14
Процесс 1 Сульфонамидирование, восстановление нитрогруппы
2-нитробензолсульфонилхлорид (450 мг), 2,6-лутидин (450 мкл) и дихлорметан (10 мл) добавляли к смоле, полученной в процессе 4 примера 1 (400 мг), и перемешивали в течение 14 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении нитрогруппу восстанавливали в соответствии с процессом 2 примера 31.
Процесс 2 Циклизация
Карбонилдиимидазол (400 мг) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 (200 мг), и перемешивали при 95°С в течение 15 часов. После этого смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Алкилирование, отщепление от смолы
Метилиодид (400 мкл), диизопропилэтиламин (400 мкл) и НМП (2 мл) добавляли к смоле, полученной в процессе 2 (200 мг), и перемешивали в течение 17 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 548; CHNO: C24H19Cl2N3O6S.
Примеры 99-103
Соединения, показанные в таблице 14, синтезировали с использованием той же самой процедуры, которая описана в примере 98, за исключением того, что в процессе 1 примера 98 использовали соответствующие сульфонилхлориды. Между тем, R1, R2, R3, R4 и R5 в таблице 14 являются заместителями в следующей общей формуле (35), и ту же самую процедуру, которая описана для примера 98, повторяли в примерах 101-103, за исключением того, что в процессе 3 примера 98 не проводили алкилирование.
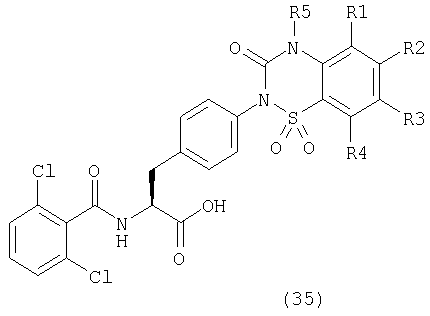
Пример 104 Синтез соединения следующей общей формулы (36), которое имеет заместитель примера 104 таблицы 15
Процесс 1 Ацилирование, образование кольца хиназолин-2,4-диона, алкилирование и восстановление нитрогруппы
Ацилирование проводили с использованием смолы, полученной в процессе 4 примера 1 (500 мг), 2-амино-5-нитробензойной кислоты (746 мг, 4,10 ммоль), ДИК (317 мкл, 2,05 ммоль), HOAt (558 мг, 4,10 ммоль) и НМП (11,6 мл). Затем конструировали кольцо хиназолин-2,4-диона в соответствии с процессом 2 примера 96 и алкилирование проводили в соответствии с процессом 6 примера 1. Затем нитрогруппу восстанавливали таким же образом, как в процессе 4 примера 1.
Процесс 2 Ацилирование
Уксусный ангидрид (600 мкл), пиридин (600 мкл) и НМП (3 мл) добавляли к смоле, полученной в процессе 1, и перемешивали в течение 19 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 569; CHNO: C27H22Cl2N4O6.
Примеры 105-107
Соединения, показанные в таблице 15, синтезировали с использованием той же самой процедуры, которая описана в примере 104, за исключением того, что в процессе 2 примера 104 использовали соответствующий хлорангидрид. Между тем, R в таблице 15 является заместителем в следующей общей формуле (36), и ту же самую процедуру, которая описана для примера 104, повторяли в примере 107, за исключением того, что в процессе 2 примера 104 не проводили ацилирование.
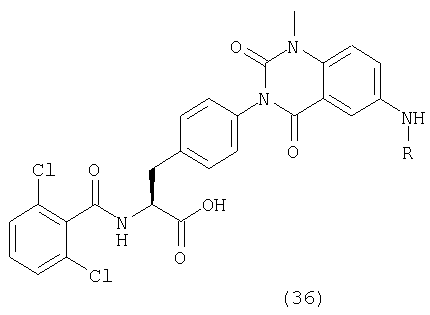
Пример 108 Синтез соединения следующей общей формулы (37), которое имеет заместитель примера 108 таблицы 16
Процесс 1 Ацилирование
Смолу, полученную в процессе 4 примера 1 (1 г), ацилировали с использованием 5-фтор-2-нитробензойной кислоты (1,63 г, 8,81 ммоль), ДИК (675 мкл, 4,36 ммоль), HOAt (1,2 г, 8,81 ммоль) и НМП (25 мл).
Процесс 2 Замена группы фтор аминогруппой, восстановление нитрогруппы
Раствор в ТГФ 2,0 М диметиламина (3 мл) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 (200 мг), и перемешивали в течение 14 часов. После промывания ее водой, ДМФ и дихлорметаном по три раза каждым и сушки при пониженном давлении нитрогруппу восстанавливали в соответствии с процессом 2 примера 31.
Процесс 3 Образование кольца хианазолин-2,4-диона
Смолу, полученную в процессе 2, обрабатывали в соответствии с процессом 2 примера 96 с получением кольца хиназолин-2,4-диона.
Процесс 4 Алкилирование
Трифенилфосфин (520 мг), метанол (80 мкл), 40% раствор в толуоле диизопропилазодикарбоновой кислоты (1 мл) и дихлорметан (2 мл) добавляли к смоле, полученной в процессе 3, и перемешивали в течение 7 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 555; CHNO: C27H24Cl2N4O5.
Примеры 109-111
Соединения примеров 109-111, показанные в таблице 16, синтезировали с использованием той же самой процедуры, которая описана в примере 108, за исключением того, что в процессе 2 примера 108 использовали соответствующий амин. Между тем, R в таблице 16 является заместителем в следующей общей формуле (37).
Пример 112 Синтез соединения следующей общей формулы (37), которое имеет заместитель примера 112 таблицы 16
Процесс 1 Замена группы фтор аминогруппой, восстановление нитрогруппы
Раствор в ТГФ 2,0 М диметиламина (3 мл) и НМП (2 мл) добавляли к смоле (200 мг), полученной в процессе 1 примера 108 (200 мг), и перемешивали в течение 14 часов. После промывания ее водой, ДМФ и дихлорметаном по три раза каждым и сушки при пониженном давлении нитрогруппу восстанавливали в соответствии с процессом 2 примера 31.
Процесс 3 Образование кольца хианазолин-2,4-диона
Смолу, полученную в процессе 2, обрабатывали в соответствии с процессом 2 примера 96 с получением кольца хиназолин-2,4-диона.
Процесс 4 Алкилирование
Метилиодид (400 мкл), диизопропилэтиламин (400 мкл) и НМП (2 мл) добавляли к смоле, полученной в процессе 3 (200 мг), и перемешивали в течение 17 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 569; CHNO: C28H27Cl2N4O5.
Пример 113
Соединение примера 113, показанное в таблице 16, синтезировали с использованием той же самой процедуры, которая описана в примере 112, за исключением того, что в процессе 1 примера 112 использовали соответствующий амин. Между тем, R в таблице 16 является заместителем в следующей общей формуле (37).
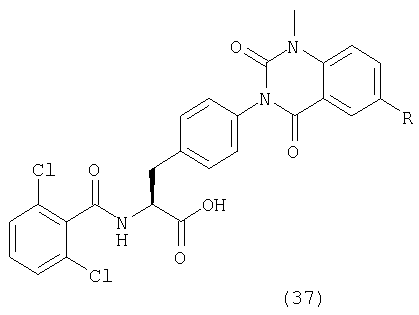
Формулы Х1 и Х2 описаны ниже.
Данные ЯМР соединения примера 108: 1Н-ЯМР (400 МГц, DMSO-d6) δ 2,94 (3H, м), 3,02 (1H, дд, J=10,2, 14,1 Гц), 3,22 (1Н, м, J=4,4, 14,1 Гц), 3,49 (3H, с), 4,82 (1H, м), 7,17 (2H, д), 7,24 (1H, д), 7,30 (1H, м), 7,36-7,45 (5H, м), 9,15 (1H, д).
13C- ЯМР (100 МГц, DMSO-d6) δ 30,90, 36,64, 40,77, 53,68, 109,21, 116,00, 116,22, 121,37, 128,26, 128,93, 129,90, 131,23, 131,82, 132,10, 135,23, 136,56, 137,57, 146,72, 150,38, 161,88, 163,91, 172,72.
Формула Х1
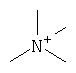
Формула Х2
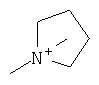
Пример 114 Синтез соединения следующей общей формулы (38), которое имеет заместители примера 114 таблицы 17
Процесс 1 Алкилирование
2,6-дихлорбензиловый спирт (531 мг), трифенилфосфин (786 мг), дихлорметан (3 мл) и 40% раствор в толуоле диизопропилазадикарбоновой кислоты (1,5 мл) добавляли к смоле, полученной в процессе 5 примера 1 (150 мг), и перемешивали в течение 14 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 656; CHNO: C31H21Cl4N3O5.
Примеры 115-123
Соединения примеров 115-123, показанные в таблице 17, синтезировали с использованием той же самой процедуры, которая описана в примере 114, за исключением того, что в процессе 1 примера 114 использовали соответствующий спирт. Между тем, R1, R2, R3, R4 и R5 в таблице 17 являются заместителями в следующей общей формуле (38).
Пример 124 Синтез соединения следующей общей формулы (38), которое имеет заместитель примера 124 таблицы 17
Процесс 1 Ацилирование
Смолу, полученную в процессе 4 примера 1 (150 мг), ацилировали с использованием N-фенилантраниловой кислоты (437 мг, 2,05 ммоль), HOAt (279 мг, 2,05 ммоль), ДИК (106 мкл, 1,03 ммоль) и НМП (6 мл).
Процесс 2 Образование кольца хиназолин-2,4-диона
Смолу, полученную в процессе 1, обрабатывали в соответствии с процессом 2 примера 96. После образования кольца хиназолин-2,4-диона смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 574; CHNO: C30H21Cl2N3O5.
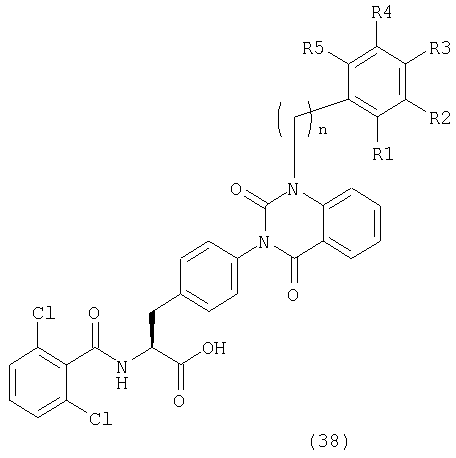
MS (MH+)
Пример 125 Синтез соединения следующей общей формулы (38), которое имеет заместитель примера 125 таблицы 18
Процесс 1 Синтез иминофосфина
Трифенилфосфин (7,86 г), 40% раствор в толуоле диизопропилазодикарбоновой кислоты (30 мл) и толуол (30 мл) добавляли к смоле, полученной в процессе 4 примера 1 (1 г), и перемешивали в течение 16 часов. После этого смолу промывали дихлорметаном десять раз и сушили при пониженном давлении.
Процесс 2 Синтез карбодиимида, нуклеофильное добавление амина и замыкание кольца
Метил-2-изоцианатбензоат (200 мг) и дихлорметан (1 мл) добавляли к смоле, полученной в процессе 1 (100 мг), перемешивали в течение 1 часа и промывали ДМФ и дихлорметаном по три раза каждым. Циклобутиламин (600 мкл) и НМП (3 мл) добавляли к полученной смоле и перемешивали в течение 13 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 551; CHNO: C28H24Cl2N4O4.
Примеры 126-130
Соединения, показанные в таблице 18, синтезировали с использованием той же самой процедуры, которая описана в примере 125, за исключением того, что в процессе 2 примера 125 использовали соответствующий указанный амин. Между тем, R в таблице 18 является заместителем в следующей общей формуле (39).
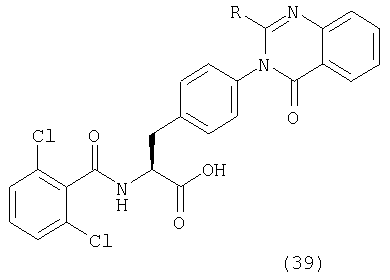
Пример 131 Синтез соединения следующей общей формулы (40), которое имеет заместитель примера 131 таблицы 18
Процесс 1 Замена группы фтор аминогруппой
Раствор в ТГФ 2,0 М диметиламина (3 мл) и НМП (2 мл) добавляли к смоле, полученной в процессе 1 примера 57 (150 мг), и перемешивали в течение 14 часов. Затем смолу промывали ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Замыкание кольца тионилхлоридом
Триазол (250 мг), тионилхлорид (80 мкл), дихлорметан (1 мл) и диизопропилэтиламин (400 мкл) добавляли к смоле, полученной в процессе 1, и перемешивали в течение 15 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 576; CHNO: C24H18Cl2N4O7S.
Примеры 132 и 133
Соединения, показанные в таблице 18, синтезировали с использованием той же самой процедуры, которая описана в примере 131, за исключением того, что в процессе 1 примера 131 использовали соответствующий указанный амин. Между тем, R в таблице 18 является заместителем в следующей общей формуле (40).
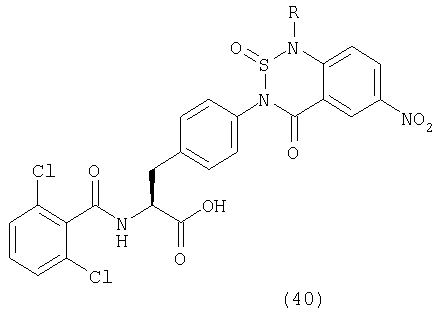
Пример 134 Синтез соединения следующей общей формулы (41), которое имеет заместитель примера 134 таблицы 19
Процесс 1 Ацилирование, удаление группы Fmoc
Ацилирование проводили реакцией смолы, полученной в процессе 4 примера 1 (500 мг), с Fmoc-β-аланином (810 мг, 2,60 ммоль), ДИК (200 мкл, 1,30 ммоль), HOAt (351 мг, 2,60 ммоль) и НМП (10 мл) в течение 18 часов и затем группу Fmoc удаляли в соответствии с процессом 2 примера 1.
Процесс 2 Замыкание кольца карбонилдиимидазолом
Карбонилдиимидазол (400 мг) и НМП (2 мл) добавляли к смоле, полученной в процессе 1, и перемешивали в течение 3 часов. Затем смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении. Затем к полученной смоле добавляли НМП (2 мл) и перемешивали при 95°С в течение 15 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 450; CHNO: C20H17Cl2N3O5.
Пример 135 Синтез соединения следующей общей формулы (41), которое имеет заместитель примера 135 таблицы 19
Процесс 1 2-нитросульфонилирование, алкилирование
2-нитросульфонилхлорид (176 мг), 2,6-лутидин (184 мкл) и дихлорметан (4 мл) добавляли к смоле, полученной в процессе 1 примера 134 (250 мг), и перемешивали при 4°С в течение 16 часов. После промывания ее ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении полученную смолу алкилировали в соответствии с процессом 4 примера 108.
Процесс 2 Удаление 2-нитросульфонильной группы
2-меркаптоэтанол (600 мкл), диазабициклоундецен (300 мкл) и НМП (3 мл) добавляли к смоле, полученной в процессе 1, и перемешивали в течение 1 часа. Затем эту смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 3 Замыкание кольца карбонилдиимидазолом
Карбонилдиимидазол (500 мг) и дихлорметан (2,5 мл) добавляли к смоле, полученной в процессе 2, и перемешивали в течение 10 часов. Затем смолу промывали ДМФ, метанолом и дихлорметаном по три раза каждым и сушили при пониженном давлении. Затем к полученной смоле добавляли карбонат калия (200 мг) и НМП (1 мл) и перемешивали при 95°С в течение 17 часов. После промывания ее водой, ДМФ, метанолом и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 464; CHNO: C21H19Cl2N3O5.
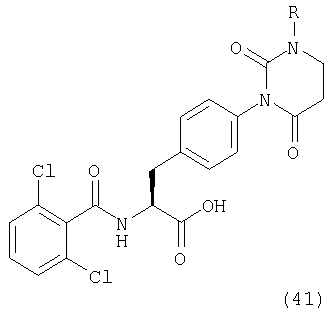
Пример 136 Синтез соединения следующей общей формулы (73), которое имеет заместители примера 136 таблицы 20
Процесс 1 Ацилирование, удаление О-ацильной группы
Салициловую кислоту (74 мг, 0,535 ммоль), PyBOP (278 мг, 0,535 ммоль), HOBt (120 мг, 0,89 ммоль), DIEA (0,186 мл, 1,068 ммоль) и ДМФ (3,6 мл) добавляли к смоле, полученной в процессе 4 примера 1, и перемешивали в течение 19 часов. Затем смолу промывали ДМФ, метанолом и дихлорметаном восемь раз и к полученной смоле добавляли смесь 30% этаноламин/ДМФ (5 мл) и перемешивали в течение 4 часов. Смолу опять промывали ДМФ, метанолом и дихлорметаном по восемь раз каждым.
Процесс 2 Замыкание кольца карбонилдиимидазолом, отщепление от смолы
Карбонилдиимидазол (98 мг) и дихлорметан (6 мл) добавляли к смоле, полученной в процессе 1 (50 мг), перемешивали в течение 1 часа и промывали дихлорметаном пять раз. Затем к полученной смоле добавляли дихлорметан (4 мл), перемешивали при комнатной температуре в течение 3 часов и промывали дихлорметаном пять раз. Затем имеющееся в виду соединение получали отщеплением от смолы и ВЭЖХ-очисткой в соответствии с процессом 7 примера 1 (3 мг). MS (ESI MH+): 499; CHNO: C24H16Cl2N2O6.
Примеры 137-144
Соединения, показанные в таблице 20, синтезировали с использованием той же самой процедуры, которая описана в примере 136, за исключением того, что в процессе 1 примера 136 использовали соответствующую салициловую кислоту. Между тем, R1, R2 и R3 в таблице 20 являются заместителями в следующей общей формуле (73).
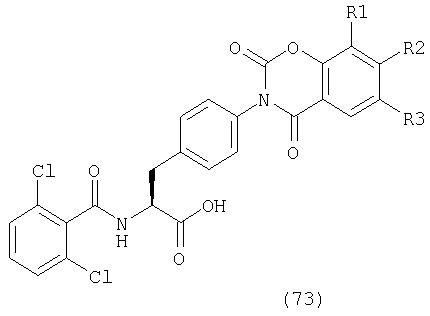
Пример 145 Синтез соединения следующей общей формулы (74)
Процесс 1 Замыкание кольца тиокарбонилдиимидазолом
Тиокарбонилдиимидазол (500 мг) и дихлорметан (2,5 мл) добавляли к смоле, полученной в процессе 1 примера 98, и перемешивали при комнатной температуре в течение 16 часов. Затем смолу промывали метанолом, ДМФ и дихлорметаном по три раза каждым и сушили при пониженном давлении.
Процесс 2 Отщепление от смолы
Смолу, полученную в процессе 1 (100 мг), обрабатывали в соответствии с процессом 7 примера 1 с получением 1,2 мг желаемого соединения. MS (ESI MH+): 550; CHNO: C23H17Cl2N3O5S2.
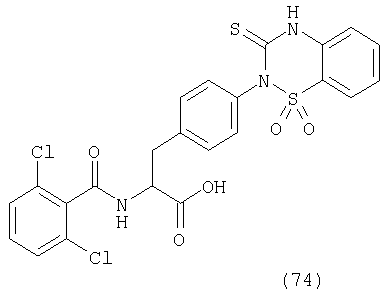
Пример 146 Синтез соединения следующей общей формулы (75)
Метилирование и отщепление от смолы
Диизопропилэтиламин (200 мкл), метилиодид (100 мкл) и НМП (3 мл) добавляли к 100 мг смолы, полученной в процессе 1 примера 145, и перемешивали при комнатной температуре в течение 16 часов. После промывания ее метанолом, ДМФ и дихлорметаном по три раза каждым и сушки при пониженном давлении смолу обрабатывали в соответствии с процессом 7 примера 1 с получением 13 мг желаемого соединения. MS (ESI MH+): 564; CHNO: C24H19Cl2N3O5S2.

Пример 147 Синтез соединения следующей общей формулы (76), которое имеет заместители примера 147 таблицы 21
Смолу, полученную в процессе 4 примера 1, получали для использования в качестве исходного материала. 500 мг 2-нитробензилбромида, 500 мкл диизопропилэтиламина и 5 мл НМП добавляли к 100 мг указанной смолы и перемешивали при комнатной температуре в течение 12 часов. После удаления растворителя реакции смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым. Раствор в НМП (0,5 мл)·EtOH (3 мл) SnCl2·2Н2О (1,5 г) добавляли к полученной смоле и давали реагировать в течение 16 часов. Растворитель реакции удаляли и смолу промывали НМП и дихлорметаном по три раза каждым. Затем к полученной смоле добавляли 200 мг 2-нитробензолсульфонилхлорида, 400 мкл 2,6-лутидина и 2 мл дихлорметана и давали реагировать при 0°С в течение 24 часов. После удаления растворителя реакции смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым. К сульфонамидной смоле добавляли 200 мкг метилиодида, 0,5 г карбоната калия и 7,5 мл НМП и встряхивали при 45°С в течение 24 часов. После удаления растворителя реакции смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым. К полученной смоле добавляли 200 мкл диазабициклоундецена, 400 мкл 2-меркаптоэтанола и 500 мкл НМП и перемешивали при комнатной температуре в течение 24 часов. Затем растворитель реакции удаляли и смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым. Затем к полученной смоле добавляли 500 мг карбонилдиимидазола и 4 мл дихлорметана и встряхивали при 50°С в течение 24 часов. Затем растворитель реакции удаляли и смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым и сушили при пониженном давлении. Полученную смолу обрабатывали 100% трифторуксусной кислотой в течение 1 часа и смолу фильтровали. Полученный фильтрат концентрировали и очищали обращенно-фазовой ВЭЖХ (SYMMETRY 19*50 мм, подвижная фаза: вода: ацетонитрил, оба из которых содержали 0,1% ТФУ) с получением 0,9 мг желаемого соединения. MS (ESI MH+): 498, 500; CHNO: C25H21Cl2N3O4.
Пример 148 Синтез соединения следующей общей формулы (76), которое имеет заместители примера 148 таблицы 21
Смолу в качестве исходного материала получали так же, как в примере 147. Тиокарбонилдиимидазол использовали вместо карбонилдиимидазола, используемого в примере 147, с получением 0,8 мг желаемого соединения. MS (ESI MH+): 514, 516; CHNO: C25H21Cl2N3O3S.
Пример 149 Синтез соединения следующей общей формулы (76), которое имеет заместители примера 149 таблицы 21
Смолу, полученную в процессе 4 примера 1, получали для использования в качестве исходного материала. 500 мг 2-нитробензилбромида, 500 мкл диизопропилэтиламина и 5 мл НМП добавляли к 100 мг указанной смолы и перемешивали при комнатной температуре в течение 12 часов. После удаления растворителя реакции смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым. Раствор в НМП (0,5 мл)·EtOH (3 мл) SnCl2·2Н2О (1,5 г) добавляли к полученной смоле и давали реагировать в течение 16 часов. После удаления растворителя реакции смолу промывали ДМФ и дихлорметаном по три раза каждым. Затем к полученной смоле добавляли 500 мг карбонилдиимидазола и 4 мл дихлорметана и встряхивали при 50°С в течение 24 часов. После удаления растворителя реакции смолу промывали дихлорметаном, НМП и дихлорметаном по три раза каждым и сушили при пониженном давлении. Полученную смолу обрабатывали 100% трифторуксусной кислотой в течение 1 часа и смолу фильтровали. Полученный фильтрат концентрировали и очищали обращенно-фазовой ВЭЖХ (SYMMETRY 19*50 мм, подвижная фаза: вода: ацетонитрил, оба из которых содержали 0,1% ТФУ) с получением 0,9 мг желаемого соединения. MS (ESI MH+): 484, 486; CHNO: C24H19Cl2N3O4.
Пример 150 Синтез соединения следующей общей формулы (76), которое имеет заместители примера 150 таблицы 21
1,6 мг желаемого соединения синтезировали так же, как в примере 149, с использованием 2-фтор-6-нитробензилбромида. MS (ESI MH+): 502, 504; CHNO: C24H18Cl2FN3O4.
Примеры 151-159
Соединения, показанные в таблице 21, синтезировали с использованием той же самой процедуры, которая описана в примере 147, за исключением того, что в процессе синтеза примера 147 использовали соответствующий алкилирующий реагент вместо метилиодида. Между тем, R1, RА1, RА2, RА3 и RА4 в таблице 21 являются заместителями в следующей общей формуле (76).
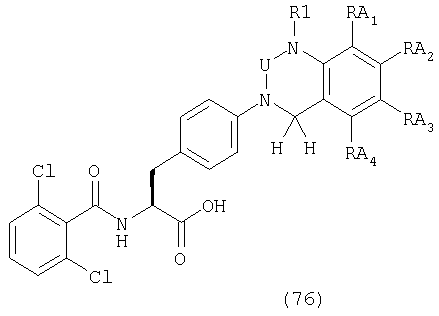
Пример 160 Синтез гидрохлорида метилового эфира (2S)-2-амино-3-[4-(1-метил-2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты
Процесс 1 Синтез гидрохлорида метилового эфира 4-нитрофенилаланина
1,49 мл тионилхлорида и 25 мл метанола смешивали, охлаждали на бане со смесью сухой лед-ацетонитрил и добавляли 2 г Вос-Phe(4-NO2)-OH. После перемешивания в течение 1 часа и удаления бани раствор нагревали до комнатной температуры и дополнительно перемешивали в течение 2,5 часов. Растворитель реакции концентрировали при пониженном давлении с получением 1,83 г желаемого соединения в виде белого порошка. MS (ESI MH+): 225; CHNO: C10H12N2O4·HCl.
Процесс 2 Синтез метилового эфира N-трет-бутоксикарбонил-4-нитрофенилаланина
521 мг гидрохлорида метилового эфира 4-нитрофенилаланина, полученного в процессе 1, растворяли в растворе 554 мкл триэтиламина в 10 мл тетрагидрофурана и к раствору добавляли 480 мг (Вос)2О при охлаждении на льду. Баню со льдом удаляли спустя 5 минут и раствор перемешивали в течение 4,5 часов. К растворителю реакции добавляли этилацетат (15 мл) и промывали 10% водным раствором лимонной кислоты, водой и насыщенным водным раствором NaCl, в указанном порядке. После сушки этилацетатного слоя раствор концентрировали при пониженном давлении с получением 735 мг желаемого соединения. MS (ESI MH+): 325; CHNO: C15H20N2O6.
Процесс 3 Синтез метилового эфира (2S)-2-трет-бутилоксикарбониламино-3-(4-аминофенил)пропионовой кислоты
648 мг метилового эфира N-трет-бутоксикарбонил-4-нитрофенилаланина, полученного в процессе 2, растворяли в 20 мл этанола и добавляли 150 мг 5% Pd/C и раствор перемешивали при комнатной температуре в течение 18 часов в атмосфере водорода (1 атм). После фильтрации через целит полученный продукт очищали на колонке силикагеля (гексан: этилацетат; 4:1→2:1) с получением 441 мг желаемого соединения. MS (ESI MH+): 295; CHNO: C15H22N2O4.
Процесс 4 Синтез метилового эфира (2S)-2-трет-бутилоксикарбониламино-3-[4-(2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты
683 мг метилового эфира (2S)-2-трет-бутилоксикарбониламино-3-(4-аминофенил)пропионовой кислоты, полученной в процессе 3, растворяли в 20 мл ацетонитрила и добавляли 412 мг метил-2-изоцианобензоата и перемешивали при 70°С в течение 16,5 часов. После охлаждения до комнатной температуры полученный порошок собирали фильтрованием и сушили с получением 588 мг желаемого соединения в виде белого порошка. MS (ESI MH+): 440; CHNO: C23H25N3O6.
Процесс 5 Синтез метилового эфира (2S)-2-трет-бутилоксикарбониламино-3-[4-(1-метил-2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты
1,0 г метилового эфира (2S)-2-трет-бутилоксикарбониламино-3-[4-(2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты, полученной в процессе 4, растворяли в 20 мл N,N-диметилформамида и добавляли 378 мг карбоната калия и 0,284 мл иодметана и перемешивали в течение 1 часа. К растворителю реакции добавляли дополнительно 70 мл этилацетата и промывали водой и насыщенным раствором NaCl. После сушки этилацетатного слоя растворитель концентрировали при пониженном давлении с получением 1,04 г желаемого соединения в виде желтого порошка. MS (ESI MH+): 454; CHNO: C24H27N3O6.
Процесс 6 Синтез гидрохлорида метилового эфира (2S)-2-амино-3-[4-(1-метил-2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты
500 мг метилового эфира (2S)-2-трет-бутилоксикарбониламино-3-[4-(1-метил-2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты, полученного в процессе 5, растворяли в 11 мл раствора 4 н хлористоводородная кислота-диоксан и перемешивали при комнатной температуре в течение 1 часа. Растворитель реакции концентрировали при пониженном давлении с получением 426 мг желаемого соединения в виде белого порошка. MS (ESI MH+): 354; CHNO: C19H19N3O4·HCl.
Пример 161 Синтез соединения следующей общей формулы (77), которое имеет заместители примера 161 таблицы 22
Смесь 88,2 мг 2-хлор-6-метилбензойной кислоты, 99,1 мг гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, 79,1 мг 1-гидроксибензотриазол·моногидрата, 107 мкл триэтиламина, 100 мг гидрохлорида метилового эфира (2S)-2-амино-3-[4-(1-метил-2,4-диоксо-1,3-дигидрохиназолин-3-ил)фенил]пропионовой кислоты и 1 мл дихлорметана перемешивали при 45°С в течение ночи. Смесь очищали в указанном порядке хроматографией на силикагеле (гексан-этилацетат) и обращенно-фазовой ВЭЖХ с получением желаемого соединения. MS (ESI MH+): 506; CHNO: C27H24N3O5Cl.
Пример 162 Синтез соединения следующей общей формулы (77), которое имеет заместители примера 162 таблицы 22
Смесь 20 мг соединения метилового эфира, полученного в примере 161, 2 мг гидроксида лития моногидрата, 1 мл тетрагидрофурана и 0,2 мл воды перемешивали при комнатной температуре в течение 1 часа. Затем добавляли хлористоводородную кислоту и раствор нейтрализовали, растворитель выпаривали. Имеющееся в виду соединения (6,0 мг) получали очисткой обращенно-фазовой ВЭЖХ. MS (ESI MH+): 492; CHNO: C26H22N3O5Cl.
Примеры 163, 166, 168, 170, 172, 174 и 176
Синтез соединения общей формулы (77), которое имеет заместители соответствующего примера таблицы 22
Имеющееся в виду соединение получали таким же образом, как в примере 161, за исключением того, что 2-хлор-6-метилбензойную кислоту заменяли соответствующей карбоновой кислотой в процессе синтеза соединения 161. См. Таблицу 22.
Примеры 164, 165, 167, 169, 171, 173 и 175
Синтез соединения общей формулы (77), которое имеет заместители соответствующего примера таблицы 22
Имеющееся в виду соединение получали таким же образом, как в примере 162, за исключением того, что использовали соответствующее являющееся метиловым эфиром соединение. См. Таблицу 22.
Пример 177 Синтез соединения общей формулы (77), которое имеет заместители соответствующего примера таблицы 22
Являющееся метиловым эфиром соединение получали таким же образом, как в примере 161, за исключением того, что 2-хлор-6-метилбензойную кислоту заменяли 2,6-дихлоркоричной кислотой в процессе синтеза примера 161. Затем имеющееся в виду соединение получали таким же образом, как в примере 162, за исключением того, что использовали полученный, как описано выше, метиловый эфир. См. таблицу 22.
Пример 178 Синтез соединения следующей общей формулы (78), которое имеет заместитель примера 178 таблицы 23
Процесс 1 2-нитросульфонилирование, метилирование
Смолу, полученную в процессе 1 примера 104, 2-нитросульфонилировали и метилировали в соответствии с процессом 4 примера 112.
Процесс 2 Удаление 2-нитросульфонильной группы
Смолу, полученную в процессе 1, обрабатывали в соответствии с процессом 2 примера 135 и удаляли 2-нитросульфонильную группу. Имеющееся в виду соединение получали в соответствии с процессом 7 примера 1. MS (ESI MH+): 541; CHNO: C26H22Cl2N4O5.
Пример 179 Синтез соединения следующей общей формулы (78), которое имеет заместитель примера 179 таблицы 23
Имеющееся в виду соединение получали таким же образом, как в примере 178, за исключением того, что в процессе 1 примера 178 использовали этилбромид. MS (ESI MH+): 555; CHNO: C27H24Cl2N4O5.
Между тем, R в таблице 23 является заместителем следующей общей формулы (78).
Примеры 180-189
Соединения в таблице 24 ниже синтезировали с использованием той же самой процедуры, которая описана в примере 45, за исключением того, что в процессе 1 примера 45 и процессах 6 и 7 примера 1 использовали соответствующую замещенную 2-нитробензойную кислоту. Между тем, R1, R2, R3 и R4 в таблице 24 являются заместителями следующей общей формулы (79).
Данные ЯМР соединения примера 180: 1Н-ЯМР (CDCl3) δ = 3,22-3,48 (2H, м), 3,83 (3H, с), 3,93 (3H, с), 5,16-5,23 (1Н, м), 7,16 (2H, д, J=7,8 Гц), 7,19-7,34 (6H, м), 7,44 (2H, д, J=8,7 Гц), 7,84 (1Н, дд, J=2,4, 6,6 Гц).
Пример 190 Синтез соединения следующей общей формулы (80), которое имеет заместитель примера 190 таблицы 25
Соединение (3,2 мг) общей формулы (23), которое имеет заместитель примера 1 в таблице 1, суспендировали в смешанном растворе метанола (73 мкл) и толуола (224 мкл) и к суспензии добавляли раствор в гексане 2 М триметилсилилдиазометана (73 мкл). Спустя 30 минут растворитель реакции концентрировали при пониженном давлении с получением 3 мг желаемого соединения. MS (ESI MH+): 526; CHNO: C26H21Cl2N3O5.
Пример 191 Синтез соединения следующей общей формулы (80), которое имеет заместитель примера 191 таблицы 25
Соединение (72,7 мг) общей формулы (79), которое имеет заместитель примера 183 в таблице 24, растворяли в смешанном растворе дихлорметана (10 мл) и изопропанола (0,2 мл). Добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (26 мг) и 4-диметиламинопиридин (26,2 мг) и перемешивали. После пермешивания раствора в течение 18 часов добавляли 1 н хлористоводородную кислоту и раствор экстрагировали этилацетатом. Водный слой дополнительно экстрагировали этилацетатом и смешивали с ранее экстрагированным слоем и промывали насыщенным раствором гидрокарбоната натрия и насыщенным водным раствором NaCl. Затем органический слой сушили безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный продукт очищали жидкостной хроматографией высокого давления (вода-ацетонитрил) с получением 10 мг желаемого соединения. MS (ESI MH+): 588; CHNO: C28H24Cl3N3O5.
Пример 192 Синтез соединения следующей общей формулы (80), которое имеет заместитель примера 192 таблицы 25
Соединение (12 мг) общей формулы (37), которое имеет заместитель примера 111 в таблице 16, растворяли в метаноле (0,5 мл), охлаждали до -78°С и добавляли тионилхлорид (0,04 мл). После перемешивания при комнатной температуре в течение 7,5 часов растворитель реакции концентрировали при пониженном давлении с получением 12 мг желаемого соединения. MS (ESI MH+): 597; CHNO: C30H30Cl2N4O5.
Примеры 193-202
Соединения, показанные ниже, синтезировали с использованием карбоновой кислоты, описанной в указанном соответствующем примере, в качестве исходного материала. В этой связи, примеры 193-195 и 201 синтезировали таким же образом, как описано в примере 191, за исключением того, что использовали подходящий спирт. Примеры 196-200 и 202 синтезировали таким же образом, как описано в примере 192. Между тем, R1, R2 и R3 в таблице 25 являются заместителями следующей общей формулы (80).
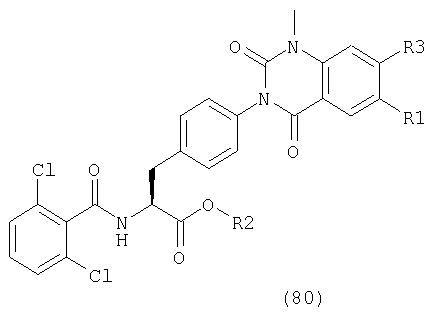
Данные ЯМР соединения примера 196: 1Н-ЯМР (400 МГц, DMSO-d6) δ 2,94 (3H, м), 3,02 (1H, м), 3,22 (1H, м), 3,58 (3H, с), 3,70 (3H, с), 4,82 (1H, м), 7,18-7,47 (10H, м), 9,28 (1Н, д).
13C-ЯМР (100 МГц, DMSO-d6) δ 30,88, 36,37, 40,75, 52,28, 53,66, 109,17, 116,00, 116,22, 121,35, 128,32, 128,99, 129,88, 131,36, 131,79, 132,07, 135,35, 136,35, 137,21, 146,74, 150,37, 161,89, 163,99, 171,72.
Пример 203
Синтез соединения следующей общей формулы (81)
Процесс 1 Ацилирование
Смолу, полученную в процессе 4 примера 1, ацилировали с использованием цис-2-[(9-флуоренилметилоксикарбонил)амино]-1-циклогексанкарбоновой кислоты (274 мг), ДИК (0,058 мл), HOAt (101 мг) и НМП (2,5 мл).
Процесс 2 Удаление 9-флуоренилметилоксикарбонильной группы
Смолу, полученную в процессе 1, перемешивали в растворе 20% пиперидин-НМП в течение десяти минут дважды и промывали НМП, метанолом и дихлорметаном по четыре раза каждым.
Процесс 3 Циклизация, отщепление от смолы
Смолу, полученную в процессе 2, обрабатывали таким же образом, как в процессе 2 примера 96, и затем обрабатывали в соответствии с процессом 7 примера 1 с получением желаемого соединения. MS (ESI MH+): 504; CHNO: C24H23Cl2N3O5.
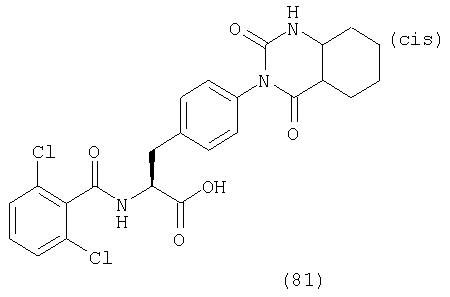
Примеры 205 и 206
Соединения следующей общей формулы (82), которые имеют заместители в таблице 26, синтезировали с использованием карбоновой кислоты, полученной в примере 108, в качестве исходного материала и таким же образом, как описано в примере 191, за исключением того, что использовали подходящий спирт. Между тем, R в таблице 26 является заместителем следующей общей формулы (82).
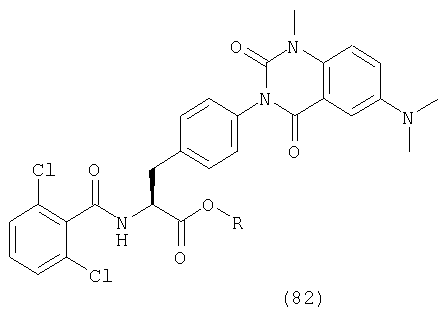
Примеры 207 и 208
Соединения следующей общей формулы (83), которые имеют заместители в таблице 27, синтезировали таким же образом, как описано в примере 149, за исключением того, что использовали указанный соответствующий 2-нитробензилбромид. Между тем, R1 и R2 в таблице 27 являются заместителями следующей общей формулы (83)
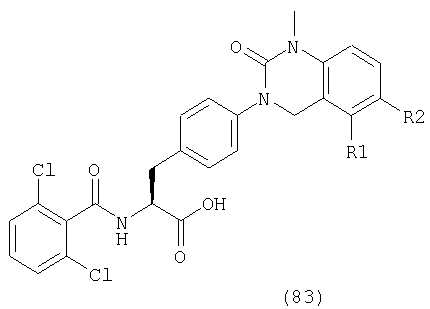
Пример 209
Соединение следующей общей формулы (84), которое имеет заместитель примера 209 в таблице 28, синтезировали таким же образом, как описано в примере 45, за исключением того, что в процессе 1 примера 45 и процессах 6 и 7 примера 1 3-хлор-2-нитробензойную кислоту заменяли 1-этил-4-нитро-1Н-пиразол-3-карбоновой кислотой. Между тем, R в таблице 28 является заместителем следующей общей формулы (84).
Пример 210
Соединение следующей общей формулы (84), которое имеет заместитель примера 210 в таблице 28, синтезировали с использованием соединения, полученного в примере 209, в качестве исходного материала и таким же образом, как описано в примере 192. Между тем, R в таблице 28 является заместителем следующей общей формулы (84).

Пример 211
Соединение следующей общей формулы (85) синтезировали следующим образом. Соединение общей формулы (23), которое имеет заместитель (заместители) примера 1 в таблице 1 (28,9 мг), растворяли в ДМФ (1 мл) и добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (12,9 мг), 1-гидрокси-7-азабензотриазол (10,7 мг), гидрохлорид гидроксиламина (11,5 мг) и N-метилморфолин (9,1 мг) и перемешивали. Затем добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (11,7 мг), 1-гидрокси-7-азабензотриазол (8,2 мг), гидрохлорид гидроксиламина (9,5 мг), N-метилморфолин (10,5 мг) и ДМФ (0,5 мл) и перемешивали. Спустя два часа к растворителю реакции добавляли воду и отделенные кристаллы сушили до 14,8 мг желаемого соединения. MS (ESI MH-): 525; CHNO: C25H20Cl2N4O5.
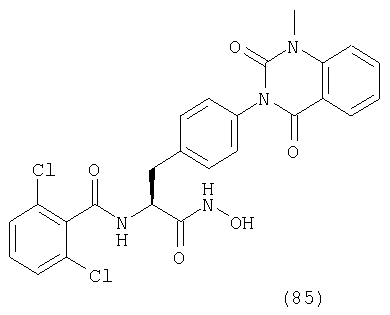
Пример 212 Синтез соединения следующей общей формулы (86), которое имеет заместитель примера 212 таблицы 29
Процесс 1 Синтез метилового эфира (2S)-2-(трет-бутоксикарбониламино)-3-[4-(1-метилурацил-3-ил)фенил]пропионовой кислоты
Смесь 30 мг (2S)-2-(трет-бутоксикарбониламино)-3-[4-(дигидроксиборанил)фенил]пропионовой кислоты, 25 мг 1-метилурацила, 27 мг ацетата меди(II), 40 мг триэтиламина и 4 мл дихлорметана перемешивали в течение ночи. Растворитель реакции разбавляли этанолом и фильтровали через целит. Оставшийся материал, полученный концентрированием фильтрата, разбавляли 1 н гидроксидом натрия и промывали этилацетатом. После подкисления водного слоя до кислого рН хлористоводородной кислотой раствор экстрагировали этилацетатом, промывали насыщенным водным раствором NaCl, сушили сульфатом магния и растворитель удаляли с получением неочищенного материала (2S)-2-(трет-бутоксикарбониламино)-3-[4-(1-метилурацил-3-ил)фенил]пропионовой кислоты. Этот неочищенный материал разбавляли 5 мл этанола и добавляли раствор в гексане, содержащий 2 М триметилсилилдиазометан, с получением метилового эфира продукта. Растворитель реакции концентрировали и очищали хроматографией на силикагеле (этилацетат-этанол) с получением указанного в заголовке соединения (7 мг). MS (ESI MH+): 404
1H-ЯМР (DMSO-d6) δ 1,45 (9H, с), 3,15 (2H, д), 3,40 (3H, с), 3,70 (3H, с), 4,60 (1H, м), 5,00 (1Н, м), 5,85 (1Н, д), 7,15 (2H, д), 7,20 (1Н, д), 7,30 (2H, д).
Процесс 2 Синтез метилового эфира (2S)-2-(2,6-дихлорбензоиламино)-3-[4-(1-метилурацил-3-ил)фенил]пропионовой кислоты
6 мл раствора в диоксане, содержащего 4 н хлорид водорода, добавляли к 86 мг метилового эфира (2S)-2-(трет-бутоксикарбониламино)-3-[4-(1-метилурацил-3-ил)фенил]пропионовой кислоты и перемешивали в течение 1 часа. К оставшемуся материалу, полученному удалением растворителя, добавляли 10 мл диметилформамида, 62 мкл триэтиламина и 34 мкл 2,6-дихлорбензоилхлорида и перемешивали в течение 30 минут. Растворитель реакции разбавляли этилацетатом, промывали 1 н хлористоводородной кислотой, водным раствором насыщенного гидрокарбоната натрия и насыщенным водным раствором NaCl и сушили сульфатом магния и растворитель удаляли с получением неочищенного материала указанного в заголовке соединения. Неочищенный материал очищали обращенно-фазовой ВЭЖХ с получением указанного в заголовке соединения (26 мг). MS (ESI MH+): 476. 1Н-ЯМР (CDCl3) δ 3,30 (2H, ушир.), 3,40 (3Н, с), 3,75 (3Н, с), 5,25 (1 Н, кв.), 5,85 (1Н, д), 6,40 (1Н, d), 7,15 (2H, д), 7,20-7,40 (6H, м).
Пример 213 Синтез соединения следующей общей формулы (86), которое имеет заместитель примера 213 таблицы 29
Смесь 10 мг метилового эфира (2S)-2-(2,6-дихлорбензоиламино)-3-[4-(1-метилурацил-3-ил)фенил]пропионовой кислоты, 3 мл раствора в диоксане, содержащего 4 н хлорид водорода, и 3 мл воды перемешивали при 80°С в течение 4 часов. После удаления растворителя неочищенный материал очищали обращенно-фазовой ВЭЖХ с получением указанного соединения (3 мг). MS (ESI MH+): 462.
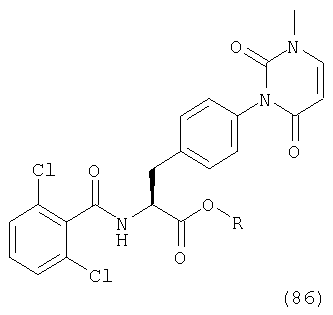
Ссылочный пример 1 2-хлор-6-трифторметилбензойная кислота
Смесь 500 мг 3-хлорбензотрифторида и 3 мл тетрагидрофурана охлаждали до -50°С и добавляли 2 мл 1,6 М раствора в гексане н-бутиллития и перемешивали в течение 1 часа. Смесь помещали в сухой лед и разбавляли водным раствором 1 н гидроксида натрия. После промывания ее толуолом, водные слои подкисляли хлористоводородной кислотой и экстрагировали этилацетатом. Неочищенный материал, полученный удалением растворителя, очищали обращенно-фазовой ВЭЖХ указанного соединения. Выход 244 мг.1H-ЯМР (DMSO-d6) δ 7,68 (1H, т), 7,80 (1Н, д), 7,88 (1H, д). МС (ESI m/z): 223 (M-H)-
Ссылочный пример 2 2-бром-6-хлорбензойная кислота
Смесь 500 мг 3-бромхлорбензола и 3 мл тетрагидрофурана охлаждали до -78°С и добавляли 1,3 мл 2,0 М литийдиизопропиламида в смеси гептан/тетрагидрофуран/этилбензол. После перемешивания в течение 2 часов смесь помещали в сухой лед и промывали и экстрагировали, как описано в Ссылочном примере 1, с получением неочищенного материала. Неочищенный материал промывали смешанным растворителем гексан/этилацетат с получением указанного соединения. Выход 317 мг
1H-ЯМР (DMSO-d6) δ 7,40 (1Н, т), 7,60 (1H, д), 7,70 (1H, д). МС (ESI m/z): 233 (M-H)-
Пример 214 Антагонистическая относительно VCAM-1 активность (тест связывания VCAM-1/α4 β1)
Определяли активность тест-соединения, антагонистического в отношении связывания клеточного штамма Jurkat (АТСС TIB-152) Т-клеток человека, о которых известно, что они экспрессируют интегрин α4 β1, с VCAM-1.
100 мкл/лунка раствора (500 нг/мл) рекомбинантного VCAM-1 человека (R&D systems), разбавленного буфером А (0,1 М NaHCO3, рН 9,6), добавляли в микротитрационный планшет, имеющий 96 лунок (Nunc Maxisorp). После инкубирования при 4°С в течение ночи несвязанный VCAM-1 удаляли промыванием один раз ЗФР. После завершения промывания добавляли буфер (буфер В), полученный разбавлением Block Ace (Dainippon Pharmaceutical Co., Ltd.) ЗФР до концентрации 1/4 в количестве 150 мкл/лунка. После инкубирования при комнатной температуре в течение 1 часа буфер В удаляли и планшет промывали ЗФР один раз.
Клетки Jurkat промывали модифицированной Дульбекко средой Игла (SIGMA, далее называемой "DMEM") дважды и затем инкубировали в DMEM, содержащей 10 мкг/мл Кальцеина-АМ (Wako Pure Chemical Industries. Ltd.) при 37°С в темном месте в течение 30 минут для флуоресцентного мечения. Клетки опять суспендировали в буфере для связывания (20 мМ HEPES, DMEM, содержащая 0,1% БСА).
50 мкл тест-соединения в различных концентрациях, полученных разведением буфером для связывания, добавляли к этому планшету. Сразу же после этого добавляли 50 мкл (конечный объем: 100 мкл на лунку) флуоресцентных клеток Jurkat (4×106 клеток/мл) и их инкубировали в темном месте при комнатной температуре в течение 30 минут. После встряхивания на планшет-шейкере (IKA MTS-4) при 800 об/мин в течение 30 секунд раствор немедленно удаляли для удаления несвязавшихся клеток. Количество флуоресценции связанных клеток, оставшихся в лунках, определяли флуоресцентным планшет-ридером (Wallac 1420 ARVO multi-label counter) (длина волны возбуждения фильтра: 485 нм, длина волны испускания: 535 нм). Полученная таким образом интенсивность флуоресценции пропорциональна числу клеток Jurkat, связанных с VCAM-1 и остающихся на планшете. Скорость связывания каждого тест-соединения в различных концентрациях определяли, в то время как интенсивность флуоресценции лунки, не содержащей тест-соединения, принимали за 100%. Рассчитывали концентрацию IC50 для 50% ингибирования связывания.
Полученные результаты этого испытания показаны в таблице 30.
Пример 215 Антагонистическая относительно VCAM-1 активность (тест связывания VCAM-1/α4 β7)
Определяли активность тест-соединения, антагонистического в отношении связывания штамма клеток лимфомы RPMI-8866 В-клеток человека, о которых известно, что они экспрессируют интегрин α4 β7, с VCAM-1.
100 мкл/лунка раствора (500 нг/мл) раствора рекомбинантного VCAM-1 человека (R&D systems), разбавленного буфером А (0,1 М NaHCO3, рН 9,6), добавляли в микротитрационный планшет, имеющий 96 лунок (Nunc Maxisorp). После инкубирования при 4°С в течение ночи несвязанный VCAM-1 удаляли промыванием один раз ЗФР. После завершения промывания добавляли буфер (буфер В), полученный разбавлением Block Ace (Dainippon Pharmaceutical Co., Ltd.) ЗФР до концентрации 1/4 в количестве 150 мкл/лунка. После инкубирования при комнатной температуре в течение 1 часа буфер В удаляли и планшет промывали ЗФР один раз.
Клетки RPMI-8866 промывали модифицированной Дульбекко средой Игла (SIGMA, далее называемой "DMEM") дважды и затем инкубировали в DMEM, содержащей 10 мкг/мл Кальцеина-АМ (Wako Pure Chemical Industries. Ltd.) при 37°С в темном месте в течение 30 минут для флуоресцентного мечения. Клетки опять суспендировали в буфере для связывания (20 мМ HEPES, DMEM, содержащая 0,1% БСА), содержащем 4 мМ MnCl2.
50 мкл тест-соединения в различных концентрациях, полученных разведением буфером для связывания, добавляли к этому планшету. Сразу же после этого добавляли 50 мкл (конечный объем: 100 мкл на лунку) флуоресцентных клеток RPMI-8866 (4×106 клеток/мл) и их инкубировали в темном месте при комнатной температуре в течение 30 минут. После встряхивания на планшет-шейкере (IKA MTS-4) при 800 об/мин в течение 30 секунд раствор немедленно удаляли для удаления несвязавшихся клеток. Количество флуоресценции связанных клеток, оставшихся в лунках, определяли флуоресцентным планшет-ридером (Wallac 1420 ARVO multi-label counter) (длина волны возбуждения фильтра: 485 нм, длина волны испускания: 535 нм). Полученная таким образом интенсивность флуоресценции пропорциональна числу клеток RPMI-8866, связанных в VCAM-1 и остающихся на планшете. Скорость связывания каждого тест-соединения в различных концентрациях определяли, в то время как интенсивность флуоресценции лунки, не содержащей тест-соединения, принимали за 100%. Рассчитывали концентрацию IC50 для 50% ингибирования связывания.
Полученные результаты этого испытания показаны в таблице 30.
Результаты определения антагонистической относительно VCAM-1 активности (IC50/ нмоль/л)
Таким образом, очевидно, что новые производные фенилаланина проявляли превосходную α4-интегрин-ингибирующую активность.
Поскольку новые производные фенилаланина данного изобретения имеют превосходную α4-интегрин-ингибирующую активность, данное изобретение обеспечивает терапевтический или профилактический агент для заболеваниий, в патологии которых участвует α4-интегрин-зависимый процесс адгезии, таких как воспалительные заболевания, ревматоидный артрит, воспалительные заболевания пищеварительного тракта, системная красная волчанка, множественный склероз, синдром Шегрена, астма, псориаз, аллергия, диабет, сердечно-сосудистые заболевания, склероз артерий, рестеноз, пролиферация опухолей, метастазирование опухолей и отторжение трансплантата. Вышеуказанные воспалительные заболевания пищеварительного тракта включают в себя болезнь Крона и язвенный колит.
Для этой цели соединение данного изобретения имеет высокую биодоступность и/или уровень в крови при пероральном введении. Таким образом, пероральное введение лекарственного средства является предпочтительным.
Соединение данного изобретения имеет также высокую стабильность в кислой или щелочной среде и является эффективным, например, в том случае, когда его можно применять в различных дозированных формах.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛАЛАНИНА | 2004 |
|
RU2390520C2 |
| ПРОИЗВОДНОЕ п-ФЕНИЛЕНДИАМИНА КАК РЕГУЛЯТОР КАЛИЕВЫХ КАНАЛОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И МЕДИЦИНСКОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2762562C1 |
| СОЕДИНЕНИЕ СУЛЬФОНАМИДА ИЛИ СУЛЬФИНАМИДА, ОБЛАДАЮЩЕЕ ЭФФЕКТОМ ИНДУЦИРОВАНИЯ ДЕГРАДАЦИИ БЕЛКА BRD4, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2830112C1 |
| НОВОЕ ПИРРОЛИДИНОВОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ АГОНИСТА РЕЦЕПТОРА МЕЛАНОКОРТИНА | 2015 |
|
RU2669938C2 |
| ПРОИЗВОДНЫЕ ДИАРИЛОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2267484C2 |
| ПРОИЗВОДНЫЕ БЕНЗОФУРАНА | 2003 |
|
RU2286344C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ФЕНИЛАЛАНИНА С ХИНАЗОЛИНДИОНОВЫМ СКЕЛЕТОМ И ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ, ПРИМЕНЯЕМЫХ ПРИ ПОЛУЧЕНИИ ТАКИХ ПРОИЗВОДНЫХ | 2007 |
|
RU2469028C2 |
| ПРОИЗВОДНОЕ СУЛЬФОНАМИДА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2014 |
|
RU2667520C9 |
| АЗАИНДОЛЬНОЕ ПРОИЗВОДНОЕ | 2015 |
|
RU2649575C1 |
| ПРОИЗВОДНЫЕ ЭФИРА ГЕТЕРОАРИЛКАРБОНОВОЙ КИСЛОТЫ | 2013 |
|
RU2664544C2 |
Предложены производные фенилаланина, обладающие антагонистической активностью в отношении α4-интегрина. Производные фенилаланина применяют в качестве терапевтических агентов для различных заболеваний, связанных с α4-интегрином. 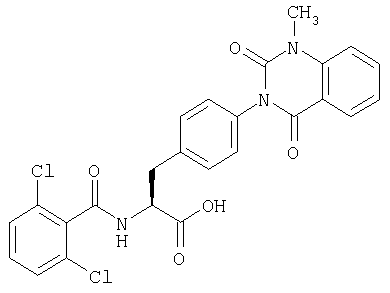
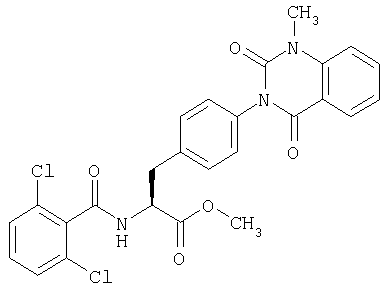
5 н. и 32 з.п. ф-лы, 30 табл.
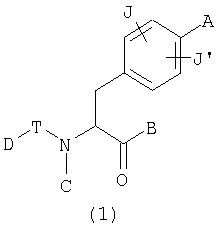
где А представляет одну из следующих общих формул (2), (3), (3-1) или (3-2):

где Arm представляет циклическую алкильную группу или ароматическое кольцо, содержащее 0, 1 или 2 атома азота,
линия, состоящая из сплошной линии и пунктирной линии в формуле (3-2), представляет одинарную или двойную связь,
U, V и Х представляют С(=O), S(=O)2, C(-R5)(-R6), C(=S), S(=O),
W представляет C(-R7) или атом азота,
R1 представляет атом водорода; низшую алкильную группу, которая может содержать заместитель(заместители), выбранные из группы, состоящей из 4-(1-пирролидино)бензолкарбонила, циано и НОС(=O)- группы; циклоалкильную группу; низшую алкильную группу, замещенную циклоалкильной группой; низшую алкильную группу, замещенную арильной группой, которая может быть замещена атомом(атомами) галогена или алкильной группой;
R2, R3 и R4 могут быть одинаковыми или различными и каждый представляет атом водорода; атом галогена; гидроксильную группу; низшую алкильную группу; низшую галогеналкильную группу; низшую алкоксильную группу; циклоалкильную группу, которая может содержать гетероатом в кольце, представляющую пирролидин; нитрогруппу; замещенную или незамещенную аминогруппу или группу аммония,
R5 и R6 каждый представляет атом водорода,
R7 представляет циклоалкильную группу, которая может содержать гетероатом в кольце; низшую алкоксильную группу; низшую алкилтиогруппу; низшую алкилтиогруппу, замещенную арильной группой; замещенную или незамещенную аминогруппу; аллилтиогруппу; 4-метоксифенацилтиогруппу; низшую алкильную группу; арильную группу; или низшую галогеналкильную группу;
В представляет гидроксильную группу, низшую алкоксильную группу или гидроксиламиногруппу,
С представляет атом водорода,
D представляет низшую алкенильную группу; циклоалкильную группу, которая может содержать атом азота в кольце; арильную группу, которая может содержать заместитель (заместители), выбранные из группы, состоящей из атомов галогена, низшего алкила, низшего алкокси, нитро; гетероарильную группу, где гетероатом представляет атом азота, которая может содержать заместитель (заместители), выбранные из атомов галогена;
Т представляет С(=O);
J и J' каждый представляет атом водорода,
при условии, что производные фенилаланина общей формулы (1) не включают соединений, имеющих следующие формулы (А-1) или (А-2), когда А представляет формулу (3-2):
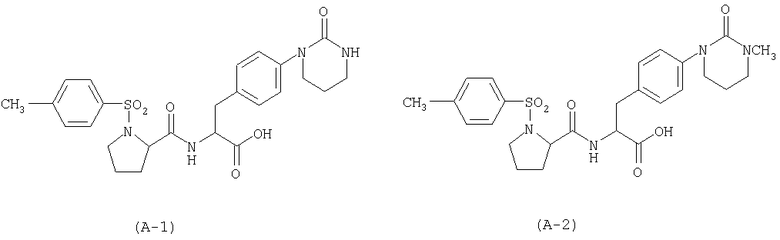
R1 представляет атом водорода; низшую алкильную группу, которая может содержать заместитель(заместители), выбранные из группы, состоящей из 4-(1-пирролидино)бензолкарбонила, циано и НОС(=O)-группы; циклоалкильную группу; низшую алкильную группу, замещенную циклоалкильной группой; низшую алкильную группу, замещенную арильной группой, которая может быть замещена атомом(атомами) галогена или алкильной группой;
R2, R3 и R4 могут быть одинаковыми или различными и каждый представляет атом водорода; атом галогена; гидроксильную группу; низшую алкильную группу; низшую галогеналкильную группу; низшую алкоксильную группу; циклоалкильную группу, которая может содержать гетероатом в кольце, представляющую пирролидин; нитрогруппу или замещенную или незамещенную аминогруппу,
R5 и R6 каждый представляет атом водорода,
R7 представляет циклоалкильную группу, которая может содержать гетероатом в кольце; низшую алкоксильную группу; низшую алкилтиогруппу; низшую алкилтиогруппу, замещенную арильной группой; замещенную или незамещенную аминогруппу; низшую алкильную группу; арильную группу; или низшую галогеналкильную группу.
С представляет атом водорода,
J и J' представляют атом водорода,
и в общих формулах (2) и (3),
V и Х представляют любую из групп С=(O), S(=O)2 и C(-R5)(-R6),
U представляет любую из групп С=(O), S(=O)2, C(-R5)(-R6), C(=S), S(=O).
С представляет атом водорода,
J и J' представляют атом водорода,
и в общих формулах (2) и (3) Arm представляет бензольное кольцо или ароматическое кольцо, содержащее 1 или 2 атома азота.
С представляет атом водорода,
J и J' представляют атом водорода,
и в общих формулах (2) и (3) Arm представляет бензольное кольцо или ароматическое кольцо, содержащее 1 или 2 атома азота,
V и Х представляют любую из групп С=(O), S(=O)2 и C(-R5)(-R6),
U представляет любую из групп С=(O), S(=O)2, C(-R5)(-R6), C(=S), S(=O).
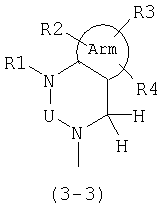
где Arm, U и R1-R4 имеют значения, описанные в п.1.
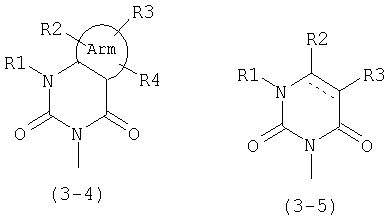
где Arm и R1-R4 являются такими же, что и описанные в п.1, и линия, состоящая из сплошной и пунктирной линии в формуле (3-5), представляет одинарную или двойную связь.
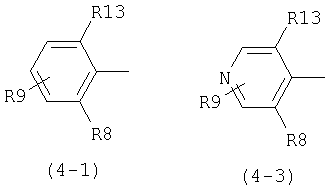
где в формуле (4-1)
R13 представляет атом галогена или метальную группу,
R8 представляет атом галогена, метальную группу, метоксигруппу или атом водорода,
R9 представляет атом водорода; атом галогена; низшую алкильную группу; нитрогруппу;
в формуле (4-3) каждый из R8, R9 и R13 представляет атом водорода или атом галогена.
в формуле (4-1) R13 и R8 представляют атом хлора и R9 представляет атом водорода; атом галогена; низшую алкильную группу; нитрогруппу.

где Arm и R1-R4 являются такими же, как описано в п.1, и линия, состоящая из сплошной линии и пунктирной линии в формуле (3-5), представляет одинарную или двойную связь, D представляет следующие формулы (4-1) или (4-3):

где в формуле (4-1)
R13 представляет атом галогена или метильную группу,
R8 представляет атом галогена, метильную группу, метоксигруппу или атом водорода,
R9 представляет атом водорода; атом галогена; низшую алкильную группу; нитрогруппу;
в формуле (4-3)
каждый из R8, R9 и R13 представляет атом водорода или атом галогена;
В представляет гидроксильную группу или низшую алкоксильную группу,
С представляет атом водорода,
J и J' представляют атом водорода и Т обозначает С(=O).
А представляет формулу (3-4),
Arm обозначает бензольное кольцо, пиридиновое кольцо, пиразольное кольцо или циклогексановое кольцо,
R1 обозначает низшую алкильную группу,
R2, R3 и R4 могут быть одинаковыми или различными и каждый обозначает атом водорода; атом галогена; гидроксильную группу; низшую алкильную группу; циклоалкильную группу, которая может содержать гетероатом в кольце, представляющую пирролидин; низшую алкоксильную группу, низшую галогеналкильную группу; аминогруппу; аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу;
D представляет следующую формулу (4-1):
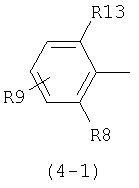
в формуле (4-1) R13 и R8 представляют атом хлора и R9 представляет атом водорода; атом галогена; низшую алкильную группу; нитрогруппу,
В представляет гидроксильную группу или низшую алкоксильную группу, С обозначает атом водорода,
J и J' представляют атом водорода и Т обозначает С(=O).
U представляет С(=O) или C(=S),
R1 представляет низшую алкильную группу,
R2, R3 и R4 могут быть одинаковыми или различными и каждый обозначает атом водорода; атом галогена; гидроксильную группу; низшую алкильную группу; циклоалкильную группу, которая может содержать гетероатом в кольце, представляющую пирролидин; низшую алкоксильную группу, низшую галогеналкильную группу; аминогруппу; аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу,
С представляет атом водорода, D представляет формулу (4-1) или (4-3)

где в формуле (4-1)
R13 представляет атом галогена или метильную группу,
R8 представляет атом галогена, метильную группу, метоксигруппу или атом водорода,
R9 представляет атом водорода; атом галогена; низшую алкильную группу; нитрогруппу;
в формуле (4-3)
каждый из R8, R9 и R13 представляет атом водорода или атом галогена и Т представляет С(=O).
А представляет формулу (3-3) и в формуле (3-3) U представляет С(=O) или C(=S),
R1 представляет метальную группу или этильную группу,
R2, R3 и R4 могут быть одинаковыми или различными и каждый обозначает атом водорода; атом галогена; гидроксильную группу; низшую алкильную группу; циклоалкильную группу, которая может содержать гетероатом в кольце, представляющую пирролидин; низшую алкоксильную группу, низшую галогеналкильную группу; аминогруппу; аминогруппу, замещенную низшей алкильной группой (низшими алкильными группами), или триалкиламмониевую группу,
В представляет гидроксильную группу или низшую алкоксильную группу,
С представляет атом водорода,
D представляет формулу (4-1), где R13 и R8 представляют атом хлора и R9 представляет атом водорода; атом галогена; низшую алкильную группу; нитрогруппу,
Т обозначает С(=O) и каждый из J и J' обозначает атом водорода.
где R1 представляет метильную группу или этильную группу,
R8 представляет атом галогена или метальную группу,
R10 представляет атом водорода или низшую алкильную группу,
R11 и R12 могут быть одинаковыми или различными и каждый представляет атом водорода, метальную группу, этильную группу или пропильную группу,
R11 и R12 могут быть связаны вместе с образованием кольца, и в этом случае R11-R12 представляют триметилен, тетраметилен или пентаметилен.
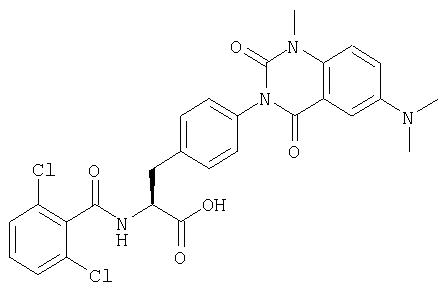
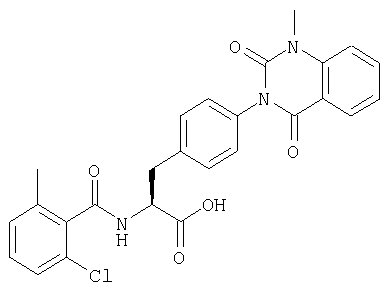
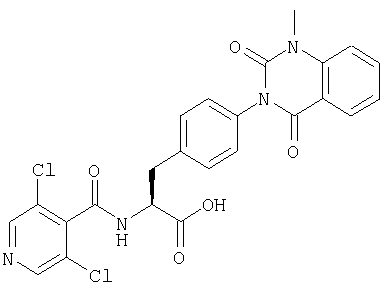
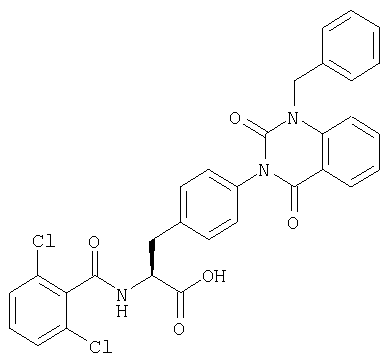
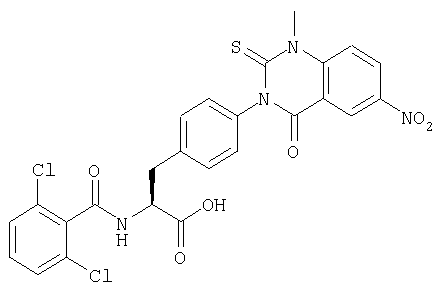
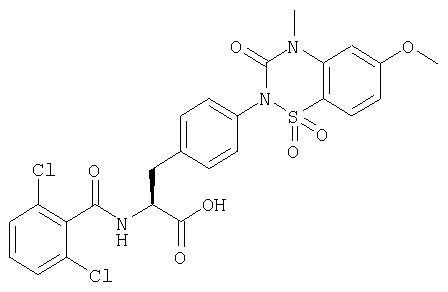
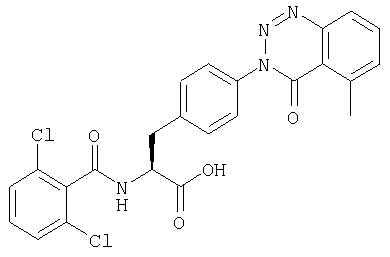
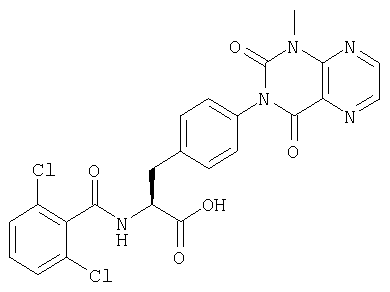
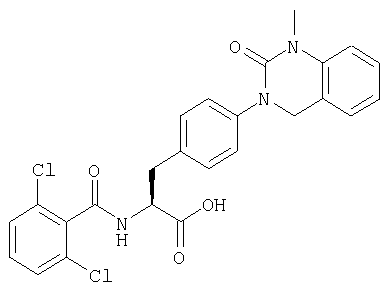
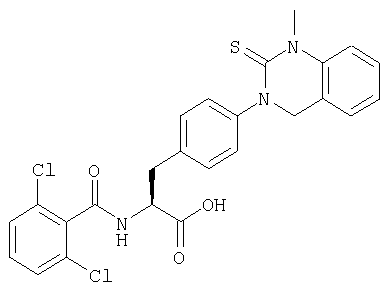
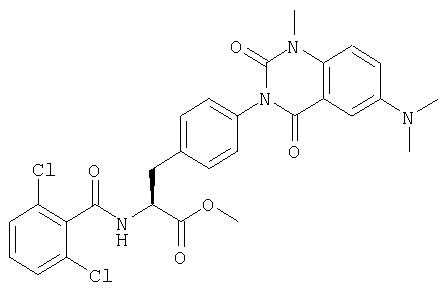
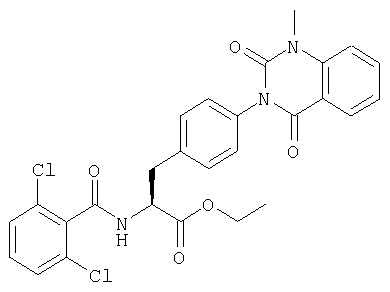

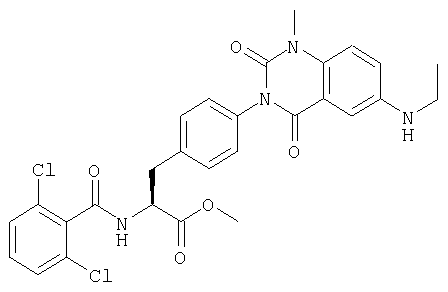
Приоритеты:
| Этиловый эфир N @ ,О-дифенилацетил-трео-DL-фенилсерина, проявляющий противовоспалительное действие | 1981 |
|
SU961297A1 |
| WO 9937618 A1, 27.09.1999 | |||
| WO 9935163 A1, 15.07.1999. | |||
Авторы
Даты
2006-10-27—Публикация
2001-08-15—Подача