Область техники
Настоящее изобретение относится к новым производным триазола, которые оказывают ингибирующее действие на связывание между сфингозин-1-фосфатом, оказывающим разнообразное физиологическое воздействие, и его рецептором Edg-1 (Эндотелиальным рецептором дифференциации генов 1 типа, S1P1). Настоящее изобретение также относится к фармацевтическим композициям, содержащим эти соединения в качестве активных ингредиентов, и синтетическим промежуточным соединениям этих соединений.
Уровень техники
Сфингозин-1-фосфат (в дальнейшем называемый «S1P») является физиологически активным липидом, который образуется при метаболизме сфинголипидов (типичный представитель сфингомиелин) в клетках. S1P известен как имеющий широкий спектр активностей, таких как индукция клеточной дифференцировки, стимуляция роста клеток, ингибирование подвижности клеток и ингибирование апоптоза, также известно, что он демонстрирует физиологическое действие, такое как ангиогенез, индукция брадикардии, активация клеток воспаления и активация тромбоцитов (непатентный документ 1).
Среди рецепторов S1P были показаны следующие 5 подтипов: Edg-1(S1P1), Edg-3(S1P3), Edg-5(S1P2), Edg-6(S1P4) и Edg-8(S1P5) (непатентный документ 2).
Среди этих подтипов Edg-1(S1P1) экспрессируется в иммуноцитах с высокой эффективностью (например в Т-клетках, в дендритных клетках) и в клетках сосудистого эндотелия, что наводит на мысль, что Edg-1(S1P1) вносит значительный вклад в стимулируемую Edg-1(S1P1) миграцию Т-клеток (непатентный документ 3), миграцию тучных клеток (непатентный документ 4), выход Т- и В-клеток из лимфатических органов (непатентный документ 5) и ангиогенез (непатентный документ 6), и вовлечен в аутоиммунные заболевания, такие как болезнь Крона, спастический колит, синдром Шегрена, рассеянный склероз и системная красная волчанка, а также в другие заболевания, такие как ревматоидные артриты, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартриты, связанная с возрастом дегенерация желтого пятна и т.д.
Таким образом, лиганды для Edg-1(S1P1) будут эффективны при лечении или предотвращении этих заболеваний.
Ранее известные лиганды для Edg-1(S1P1) включают некоторые виды производных тиофена (непатентный документ 7), производных фосфорной кислоты (патентные документы 1 и 2, непатентные документы 8 и 9) и производных тиазолидина (патентный документ 3), производных карбоновой кислоты (патентные документы 4, 5, 6 и 8, непатентные документы 10 и 11), производных, содержащих аминогруппу (патентный документ 7), и производных пиррола (патентный документ 9).
Патентный документ 1: WO2002-18395.
Патентный документ 2: JP 2003-137894 A.
Патентный документ 3: JP 2002-332278 A.
Патентный документ 4: WO2002-092068.
Патентный документ 5: WO2003-105771.
Патентный документ 6: WO2004-058149.
Патентный документ 7: WO2004-103279.
Патентный документ 8: WO2005-058848.
Патентный документ 9: WO2005-123677.
Непатентный документ 1: J Biol Chem. 2004, 279: 20555, FASEB J 2002, 16: 625, Proceedings of the Japanese Society for Immunology 2003, 33: 2-J-W30-20-P.
Непатентный документ 2: Pharmacol Res 2003, 47: 401.
Непатентный документ 3: FASEB J 2002, 16:1874.
Непатентный документ 4: J Exp Med 2004, 199: 959.
Непатентный документ 5: Nature 2004, 427: 355.
Непатентный документ 6: J Clin Invest 2000, 106: 951, Biocchim Biophys Acta 2002, 1582: 222.
Непатентный документ 7: J Biol Chem 2004, 279: 13839.
Непатентный документ 8: Bioorg Med Chem Lett 2003, 13: 3401.
Непатентный документ 9: J Med Chem. 2004, 47: 6662.
Непатентный документ 10: J Med Chem. 2005, 48: 6169.
Непатентный документ 11: J Biol Chem. 2005; 280: 9833.
Описание изобретения
Проблемы, решаемые изобретением
Настоящее изобретение имело целью предложение соединения с новой скелетной структурой, способного ингибировать связывание между S1P и его рецептором Edg-1 (S1P1) и являющегося пригодным для использования в качестве фармацевтического продукта.
Способы решения проблем
Изобретатели представленного изобретения проводили тщательные исследования в попытке обнаружить лигандные соединения для Edg-1 (S1P1). В результате, они обнаружили, что цель достигается применением производного триазола с формулой (I), представленной ниже, или его фармацевтически приемлемой соли (характерной чертой является то, что R3 в формуле является необязательно замещенной арильной группой). Эти данные привели к выполнению представленного изобретения. Триазоловое производное с формулой (I), приведенной ниже, является совершенно новым соединением. Хотя соединения, имеющие алкильную группу, соответствующую R3 в формуле (I), коммерчески доступны от Bionet в качестве реактивов, они отличаются по структуре от соединения по обсуждаемой заявке, а фармацевтическое применение соединений от Bionet было полностью неизвестным.
Далее следуют варианты осуществления производных триазола с формулой (I) и соединений с формулой (II), являющихся промежуточными соединениями производных триазола (в дальнейшем, все они обозначены как «соединения по представленному изобретению»).
1. Соединение, представленное формулой (I)
Формула 1
 ,
,
или его фармацевтически приемлемая соль, где А обозначает:
атом кислорода,
атом серы,
группу, представленную формулой -SO-,
группу, представленную формулой -SO2-,
группу, представленную формулой -CH2-, или
группу, представленную формулой -NR6-, где R6 обозначает атом водорода или алкильную группу, имеющую от 1 до 6 углеродных атомов;
R1 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из:
гидроксильной группы,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена фенильной группой, и
фенильной группы, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода,
циклоалкильную группу, имеющую от 3 до 8 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
фенильную группу;
R1A обозначает:
атом водорода или
алкильную группу, имеющую от 1 до 6 атомов углерода;
R1 и R1A необязательно образуют вместе с атомом углерода, к которому присоединены указанные R1 и R1A, циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
R2 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
R3 обозначает необязательно замещенную арильную группу;
R4 обозначает:
атом водорода или
алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную карбоксильной группой;
R5 обозначает:
(i) алкильную группу, имеющую от 1 до 10 атомов углерода,
(ii) алкильную группу, имеющую от 1 до 10 атомов углерода и замещенную от 1 до 2 заместителями, выбранными из группы, состоящей из:
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
пиридильной группы,
фенильной группы, фенокси группы и нафтильной группы, каждая из которых необязательно замещена от 1 до 2 заместителями, выбранными из группы, состоящей из атома галогена и алкокси группы, имеющей от 1 до 6 атомов углерода,
(iii) циклоалкильную группу, имеющую от 3 до 8 атомов углерода,
(iv) алкенильную группу, имеющую от 2 до 8 атомов углерода,
(v) алкенильную группу, имеющую от 2 до 8 атомов углерода и замещенную фенильной группой,
(vi) алкинильную группу, имеющую от 2 до 8 атомов углерода,
(vii) алкинильную группу, имеющую от 2 до 8 атомов углерода и замещенную фенильной группой, или
(viii) необязательно замещенную арильную группу.
2. Соединение по варианту осуществления 1 или его фармацевтически приемлемая соль, где в формуле (I):
R1 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкильную группу, имеющую от 1 до 6 атомов углерода и замещенную фенильной группой,
циклоалкильную группу, имеющую от 3 до 8 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
фенильную группу;
R1A обозначает атом водорода;
R2 обозначает:
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
R4 обозначает:
атом водорода или
алкильную группу, имеющую от 1 до 6 атомов углерода;
R5 обозначает:
(i) алкильную группу, имеющую от 1 до 10 атомов углерода,
(ii) алкильную группу, имеющую от 1 до 10 атомов углерода и замещенную от 1 до 2 заместителями, выбранными из группы, состоящей из:
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
фенильной группы,
нафтильной группы,
пиридильной группы и
фенильной группы, замещенной от 1 до 2 заместителями, выбранными из группы, состоящей из атома галогена и алкокси группы, имеющей от 1 до 6 атомов углерода,
(iii) циклоалкильную группу, имеющую от 3 до 8 атомов углерода,
(iv) алкенильную группу, имеющую от 2 до 8 атомов углерода,
(v) алкенильную группу, имеющую от 2 до 8 атомов углерода и замещенную фенильной группой,
(vi) алкинильную группу, имеющую от 2 до 8 атомов углерода,
(vii) алкинильную группу, имеющую от 2 до 8 атомов углерода и замещенную фенильной группой, или
(viii) необязательно замещенную арильную группу.
3. Соединение по варианту осуществления 1 или 2 или его фармацевтически приемлемая соль, где А является атомом кислорода или группой, представленной формулой -NR6-.
4. Соединение по варианту осуществления 1 или 2 или его фармацевтически приемлемая соль, где А является атомом кислорода.
5. Соединение по варианту осуществления 1 или 2 или его фармацевтически приемлемая соль, где А является группой, представленной формулой -NH-.
6. Соединение по любому из вариантов осуществления 1 и 3-5 или его фармацевтически приемлемая соль, где:
R1 обозначает алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из:
гидроксильной группы,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена фенильной группой, и
фенильной группы, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода;
R1A обозначает:
атом водорода или
алкильную группу, имеющую от 1 до 6 атомов углерода; и
R1 и R1A необязательно образуют вместе с атомом углерода, к которому присоединены указанные R1 и R1A, циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
7. Соединение по любому из вариантов осуществления 1 и 3-5 или его фармацевтически приемлемая соль, где:
R1 является:
алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более атомами галогена, или
бензильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода; и
R1A является атомом водорода.
8. Соединение по любому из вариантов осуществления 1-5 или его фармацевтически приемлемая соль, где R1 является метильной группой или этильной группой и R1A является атомом водорода.
9. Соединение по любому из вариантов осуществления 1-8 или его фармацевтически приемлемая соль, где R4 является атомом водорода.
10. Соединение по любому из вариантов осуществления 1-9 или его фармацевтически приемлемая соль, где R2 является алкильной группой, имеющей от 1 до 6 атомов углерода, или циклоалкильной группой, имеющей от 3 до 6 атомов углерода.
11. Соединение по любому из вариантов осуществления 1-9 или его фармацевтически приемлемая соль, где R2 является этильной группой или циклопропильной группой.
12. Соединение по любому из вариантов осуществления 1 и 3-11 или его фармацевтически приемлемая соль, где R5 является:
(i) алкильной группой, имеющей от 1 до 10 атомов углерода,
(ii) алкильной группой, имеющей от 1 до 10 атомов углерода и замещенной от 1 до 2 заместителями, выбранными из группы, состоящей из:
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
пиридильной группы и
фенильной группы, фенокси группы и нафтильной группы, каждая из которых необязательно замещена от 1 до 2 заместителями, выбранными из группы, состоящей из атома галогена и алкокси группы, имеющей от 1 до 6 атомов углерода,
(iii) алкенильной группой, имеющей от 2 до 8 атомов углерода и необязательно замещенной фенильной группой, или
(iv) фенильной группой, нафтильной группой, тиенильной группой, пирролильной группой, пиразолильной группой, пиридильной группой, фуранильной группой, бензотиенильной группой, изохинолинильной, изоксазолильной группами, тиазолильной группой, бензотиадиазолильной группой, бензоксадиазолильной группой, дигидробензодиоксепинильной группой, дигидробензодиоксинильной группой, бензодиоксолильной группой, дигидробензофуранильной группой, инданильной группой, урацильной группой, кумарильной группой, хроманильной группой, дигидроиндолильной группой, тетрагидронафтильной группой или тетрагидроизохинолинильной группой, каждая из которых необязательно замещена от 1 до 5 заместителями, выбранными из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более атомов фтора,
алкенильной группы, имеющей от 2 до 8 атомов углерода,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более атомами фтора,
пиразолильной группы, оксазолильной группы, изоксазолильной группы, тиадиазолильной группы и пиримидинильной группы, каждая из которых необязательно замещена одним или более заместителями, выбранными из группы Х, состоящей из метильной группы, трифторметильной группы, атома галогена и метилсульфонильной группы,
алкилтио группы, имеющей от 1 до 6 атомов углерода,
алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода,
бензолсульфонильной группы,
морфолиносульфонильной группы,
морфолинокарбониламино группы,
аминосульфонильной группы,
алкоксикарбонильной группы, имеющей от 2 до 10 атомов углерода,
морфолино группы, необязательно замещенной одной или несколькими алкильными группами, имеющими от 1 до 6 атомов углерода,
фенильной группы, необязательно замещенной одной или несколькими алкокси группами, имеющими от 1 до 6 атомов углерода,
фенокси группы,
пиридинкарбонильной группы,
пиридинокси группы,
цианогруппы,
алканоильной группы, имеющей от 2 до 7 атомов углерода и необязательно замещенной одним или более атомами фтора, и
алканоиламино группы, имеющей от 2 до 7 атомов углерода.
13. Соединение по любому из вариантов осуществления 1-11 или его фармацевтически приемлемая соль, где R5 является:
алкильной группой, имеющей от 1 до 10 атомов углерода и замещенной циклоалкильной группой, имеющей от 3 до 8 атомов углерода,
алкильной группой, имеющей от 1 до 10 атомов углерода и замещенной нафтильной группой,
алкенильной группой, имеющей от 2 до 8 атомов углерода и замещенной фенильной группой,
фенильной группой или нафтильной группой, каждая из которых необязательно замещена от 1 до 5 заместителями, выбранными из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода,
трифторметокси группы,
дифторметокси группы,
трифторметильной группы,
алкенильной группы, имеющей от 1 до 6 атомов углерода,
алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода,
алканоильной группы, имеющей от 2 до 7 атомов углерода,
алкоксикарбонильной группы, имеющей от 2 до 7 атомов углерода, и
цианогруппы,
пирролильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, и метоксикарбонильной группы,
фуранильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, трифторметильной группы и атома галогена,
тиенильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, трифторметильной группы, тиадиазолильной группы, оксазолильной группы и атома галогена, или
бензотиенильной группой, дигидробензодиоксепинильной группой, бензодиоксолильной группой, дигидробензодиоксинильной группой, дигидробензофуранильной группой, тетрагидронафтильной группой, инданильной группой, тиадиазолильной группой, бензоксадиазолильной группой или бензотиадиазолильной группой, каждая из которых необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, и атома галогена.
14. Соединение по любому из вариантов осуществления 1-11 или его фармацевтически приемлемая соль, где R5 является:
алкильной группой, имеющей от 1 до 6 атомов углерода и замещенной нафтильной группой,
алкенильной группой, имеющей от 2 до 6 атомов углерода и замещенной фенильной группой,
незамещенной фенильной группой,
фенильной группой, замещенной от 1 до 5 заместителями, выбранными из группы, состоящей из метильной группы, метокси группы и атома галогена,
фенильной группой, замещенной от 1 до 3 заместителями, выбранными из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода,
атома галогена,
метокси группы,
трифторметокси группы,
дифторметокси группы,
трифторметильной группы,
алкенильной группы, имеющей от 1 до 6 атомов углерода,
метилсульфонильной группы,
ацетильной группы,
метоксикарбонильной группы и
цианогруппы,
указанная фенильная группа замещена в положении 3 или 4 или в обоих;
нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
атома галогена,
алкильной группы, имеющей от 1 до 6 атомов углерода,
цианогруппы и
алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, или
бензотиенильной группой, бензоксадиазолильной группой, бензодиоксолильной группой, дигидробензодиоксинильной группой, дигидробензофуранильной группой, инданильной группой или бензотиадиазолильной группой, каждая из которых необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, и атома галогена.
15. Соединение по любому из вариантов осуществления 1-11 или его фармацевтически приемлемая соль, где R5 является:
фенильной группой, замещенной в каждом из положений 3 и 4 атомом галогена, или
нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода, и цианогруппы.
16. Соединение по любому из вариантов осуществления 1-15 или его фармацевтически приемлемая соль, где R3 является фенильной группой, нафтильной группой, пиразолильной группой, пиридильной группой, индолильной группой, бензотиазолильной группой, бензотиадиазолильной группой, пиразолопиримидинильной группой, хинолинильной группой, изохинолинильной группой, бензотиенильной группой или дигидрохинолинонильной группой, каждая из которых необязательно замещена от 1 до 3 заместителями, выбранными из группы, состоящей из следующих заместителей:
алкильной группы, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более атомами фтора,
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода, упомянутая алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из атома фтора, фенильной группы, аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, и морфолино группы;
фенокси группы,
фенильной группы,
карбоксильной группы,
алкоксикарбонильной группы, имеющей от 2 до 10 атомов углерода,
гидроксильной группы,
моноциклической насыщенной углеводородной группы, имеющей от 2 до 7 атомов углерода и имеющей один или несколько атомов азота в качестве атомов кольца, упомянутая насыщенная углеводородная группа необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода;
содержащей азот моноциклической ненасыщенной углеводородной группы,
морфолинильной группы, необязательно замещенной одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
пиперазино группы, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
формильной группы,
алканоильной группы, имеющей от 2 до 7 атомов углерода,
карбамоильной группы, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
аминосульфонильной группы, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, и
алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, и
группой с формулой -NR7R8, где:
каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
алканоильную группу, имеющую от 1 до 6 атомов углерода,
карбамоильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому они присоединены, 3-8-членное насыщенное углеводородное кольцо, упомянутое кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
17. Соединение по любому из вариантов осуществления 1-15 или его фармацевтически приемлемая соль, где R3 является:
2-нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода,
3-пиразолильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, трифторметильной группы и атома галогена, или
5-бензотиазолильной группой, 5-бензотиадиазолильной группой, 7-дигидрохинолинонильной группой, 7-изохинолинильной группой, 7-хинолинильной группой, 3-пиридильной группой или индолильной группой, каждая из которых необязательно замещена одной или несколькими алкильными группами, имеющими от 1 до 6 атомов углерода,
незамещенной фенильной группой или
замещенной фенильной группой (А), (В) или (С), описанной ниже:
(А) фенильная группа, замещенная в положении 4 заместителем, выбранным из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода,
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолино группы и фенильной группы,
атома галогена,
трифторметокси группы,
фенокси группы,
фенильной группы,
1-пирролильной группы и
-NRARB, где каждый из RA и RB является алкильной группой, имеющей от 1 до 6 атомов углерода, или RA и RB вместе с атомом азота, к которому присоединены указанные RA и RB, образуют 3-5-членное насыщенное углеводородное кольцо,
где указанная фенильная группа, замещенная в 4 положении, далее необязательно замещена в положении 3 заместителем, выбранным из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена и алкокси группы, имеющей от 1 до 6 атомов углерода;
(В) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из:
гидроксильной группы,
алкильной группы, имеющей от 1 до 6 атомов углерода, и
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолино группы и фенильной группы,
где указанная фенильная группа, замещенная в 3 положении, далее необязательно замещена одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или далее необязательно замещена в 4 положении атомом галогена; и
(С) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из азотсодержащих групп (i)-(v), описанных ниже, указанная фенильная группа далее необязательно замещена в 4 положении атомом галогена; и
(i) моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода и имеющая один или несколько атомов азота в качестве атомов кольца, указанная насыщенная углеводородная группа необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(ii) содержащая азот моноциклическая ненасыщенная углеводородная группа,
(iii) морфолинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(iv) пиперазино группа, необязательно замещенная алканоильной группой, имеющей от 2 до 7 атомов углерода, или алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, и
морфолино группы, и
(v) группа, представленная формулой -NR7R8, где:
каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
алканоильную группу, имеющую от 1 до 6 атомов углерода,
карбамоильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены указанные R7 и R8, 3-8-членное насыщенное углеводородное кольцо, указанное кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
18. Соединение по любому из вариантов осуществления 1-15 или его фармацевтически приемлемая соль, где R3 является фенильной группой, замещенной в положении 3 заместителем, выбранным из группы, состоящей из азотсодержащих групп (i)-(v), описанных ниже, указанная фенильная группа далее необязательно замещена в положении 4 атомом галогена:
(i) моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода и имеющая один или несколько атомов азота в качестве атомов кольца, указанная насыщенная углеводородная группа необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(ii) содержащая азот моноциклическая ненасыщенная углеводородная группа,
(iii) морфолинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(iv) пиперазино группа, необязательно замещенная алканоильной группой, имеющей от 2 до 7 атомов углерода, или алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, и
морфолино группы, и
(v) группа, представленная формулой -NR7R8, где:
каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
алканоильную группу, имеющую от 1 до 6 атомов углерода,
карбамоильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены указанные R7 и R8, 3-8-членное насыщенное углеводородное кольцо, указанное кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
19. Соединение по любому из вариантов осуществления 1-15 или его фармацевтически приемлемая соль, где R3 является фенильной группой, замещенной в положении 4 атомом фтора или атомом хлора.
20. Соединение по любому из вариантов осуществления 1-15 или его фармацевтически приемлемая соль, где R3 является 6-индолильной группой.
21. Фармацевтическая композиция, содержащая соединение по любому из вариантов осуществления 1-20 или его фармацевтически приемлемую соль.
22. Фармацевтическая композиция по варианту осуществления 21 для лечения аутоиммунных заболеваний, таких как болезнь Крона, аллергический колит, синдром Шегрена, рассеянный склероз и системная красная волчанка, ревматоидные артриты, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартриты или связанная с возрастом дегенерация желтого пятна.
23. Соединение, представленное формулой (II)
Формула 2
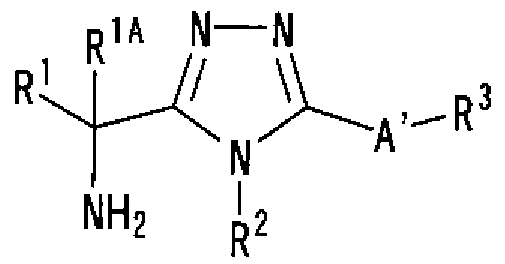 ,
,
или его соль, где R1, R1A, R2 и R3 определены как в варианте осуществления 1, и A' обозначает атом кислорода или NH.
24. Соединение по варианту осуществления 23 или его соль, где в формуле (II):
A' обозначает атом кислорода;
R1 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкильную группу, имеющую от 1 до 6 атомов углерода и замещенную фенильной группой,
циклоалкильную группу, имеющую от 3 до 8 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
фенильную группу;
R1A обозначает атом водорода; и
R2 обозначает:
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
циклоалкильную группу, имеющую от 3 до 6 атомов углерода.
25. Соединение по варианту осуществления 23 или его соль, где в формуле (II):
A' обозначает NH;
R1 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкильную группу, имеющую от 1 до 6 атомов углерода и замещенную фенильной группой,
циклоалкильную группу, имеющую от 3 до 8 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
фенильную группу;
R1A обозначает атом водорода; и
R2 обозначает:
алкильную группу, имеющую от 1 до 6 атомов углерода,
алкенильную группу, имеющую от 2 до 8 атомов углерода,
алкинильную группу, имеющую от 2 до 8 атомов углерода, или
циклоалкильную группу, имеющую от 3 до 6 атомов углерода.
26. Соединение по варианту осуществления 23 или его соль, где R1 обозначает алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из:
гидроксильной группы,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена фенильной группой, и
фенильной группы, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода;
R1A обозначает атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода; и
R1 и R1A необязательно образуют вместе с атомом углерода, к которому указанные R1 и R1A присоединены, циклоалкильную группу, имеющую от 3 до 6 атомов углерода.
27. Соединение по варианту осуществления 23 или его соль, где:
R1 является алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или несколькими атомами галогенов, или бензильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода; и
R1A является атомом водорода.
28. Соединение по любому из вариантов осуществления 23-25 или его соль, где R1 является метильной группой или этильной группой, и R1A является атомом азота.
29. Соединение по любому из вариантов осуществления 23-28 или его соль, где R2 является алкильной группой, имеющей от 1 до 6 атомов углерода, или циклоалкильной группой, имеющей от 3 до 8 атомов углерода.
30. Соединение по любому из вариантов осуществления 23-28 или его соль, где R2 является этильной или циклопропильной группой.
31. Соединение по любому из вариантов осуществления 23-30 или его соль, где:
R3 является фенильной группой, нафтильной группой, пиразолильной группой, пиридильной группой, индолильной группой, бензотиазолильной группой, бензотиадиазолильной группой, пиразолопиримидинильной группой, хинолинильной группой, изохинолинильной группой, бензотиенильной группой или дигидрохинолинонильной группой, каждая из которых необязательно замещена от 1 до 3 заместителями, выбранными из группы, состоящей из следующих заместителей:
алкильной группы, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или несколькими атомами фтора,
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
атома галогена,
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из атома фтора, фенильной группы, аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, и морфолино группы,
фенокси группы,
фенильной группы,
карбоксильной группы,
алкоксикарбонильной группы, имеющей от 2 до 10 атомов углерода,
гидроксильной группы,
моноциклической насыщенной углеводородной группы, имеющей от 2 до 7 атомов углерода и имеющей один или несколько атомов азота в качестве атомов кольца, указанная насыщенная углеводородная группа необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
содержащей азот моноциклической ненасыщенной углеводородной группы,
морфолинильной группы, необязательно замещенной одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
пиперазино группы, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из
алкильной группы, имеющей от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
формильной группы,
алканоильной группы, имеющей от 2 до 7 атомов углерода,
карбамоильной группы, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
аминосульфонильной группы, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, и
алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода; и
группы, представленной формулой -NR7R8, где:
каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
алканоильную группу, имеющую от 1 до 6 атомов углерода,
карбамоильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены указанные R7 и R8, 3-8-членное насыщенное углеводородное кольцо, указанное кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
32. Соединение по любому из вариантов осуществления 23-30 или его соль, где R3 является:
2-нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода;
3-пиразолильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, трифторметильной группы и атома галогена;
5-бензотиазолильной группой, 5-бензотиадиазолильной группой, 7-дигидрохинолинонильной группой, 7-изохинолинильной группой, 7-хинолинильной группой, 3-пиридильной группой или индолильной группой, каждая из которых необязательно замещена одной или несколькими алкильными группами, имеющими от 1 до 6 атомов углерода;
незамещенной фенильной группой или
замещенной фенильной группой (А), (В) или (С), описанной ниже:
(А) фенильная группа, замещенная в положении 4 заместителем, выбранным из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода,
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
алкокси группы, имеющей от 1 до 6 атомов углерода, упомянутая алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолино группы и фенильной группы,
атома галогена,
трифторметокси группы,
фенокси группы,
фенильной группы,
1-пирролильной группы и
-NRARB, где каждый из RA и RB является алкильной группой, имеющей от 1 до 6 атомов углерода, или RA и RB вместе с атомом азота, к которому присоединены указанные RA и RB, необязательно образуют 3-5-членное насыщенное углеводородное кольцо,
где указанная фенильная группа, замещенная в 4 положении, далее необязательно замещена в положении 3 заместителем, выбранным из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена и алкокси группы, имеющей от 1 до 6 атомов углерода;
(В) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из:
гидроксильной группы,
алкильной группы, имеющей от 1 до 6 атомов углерода, и
алкокси группы, имеющей от 1 до 6 атомов углерода, указанная алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолино группы и фенильной группы,
где указанная фенильная группа, замещенная в 3 положении, далее необязательно замещена одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или далее необязательно замещена в 4 положении атомом галогена; и
(С) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из азотсодержащих групп (i)-(v), описанных ниже, указанная фенильная группа далее необязательно замещена в положении 4 атомом галогена:
(i) моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода и имеющая один или несколько атомов азота в качестве атомов кольца, указанная насыщенная углеводородная группа необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(ii) азотсодержащая моноциклическая ненасыщенная углеводородная группа,
(iii) морфолинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(iv) пиперазино группа, необязательно замещенная алканоильной группой, имеющей от 2 до 7 атомов углерода, или алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, и
морфолино группы, и
(v) группа, представленная формулой -NR7R8, где:
каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода, указанная алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода,
алканоильную группу, имеющую от 1 до 6 атомов углерода,
карбамоильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены указанные R7 и R8, 3-8-членное насыщенное углеводородное кольцо, указанное кольцо необязательно замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
Настоящее изобретение описано в деталях следующим образом.
Термин «атом галогена» означает атом фтора, атом хлора, атом брома или атом йода.
Термин «алкильная группа, имеющая от 1 до 6 атомов углерода» относится к линейной или разветвленной алкильной группе, содержащей от 1 до 6 атомов углерода. Примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу и н-гексильную группу.
Термин «циклоалкильная группа, имеющая от 3 до 8 атомов углерода» относится к циклоалкильной группе, имеющей от 3 до 8 атомов углерода. Примеры включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу.
Термин «алкенильная группа, имеющая от 2 до 8 атомов углерода» относится к линейной или разветвленной алкенильной группе, содержащей от 2 до 8 атомов углерода. Примеры включают виниловую группу, аллиловую группу, 1-пропенильную группу, изопропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1,3-бутадиенильную группу, 2-метилаллильную группу, 2-метил-пропенильную группу, 2-пентенильную группу и 3-метил-бут-2-енильную группу.
Термин «алкинильная группа, имеющая от 2 до 8 атомов углерода» относится к линейной или разветвленной алкинильной группе, содержащей от 2 до 8 атомов углерода. Примеры включают этинильную группу, 2-пропинильную группу, 2-бутинильную группу, 1-метил-проп-2-инильную группу, 2-пентинильную группу и 4-пентинильную группу.
Термин «алкокси группа, имеющая от 1 до 6 атомов углерода» относится к линейной или разветвленной алкокси группе, содержащей от 1 до 6 атомов углерода. Примеры включают метокси группу, этокси группу, пропокси группу, изопропокси группу, бутокси группу, изобутокси группу, втор-бутокси группу, трет-бутокси группу, пентокси группу и гексилокси группу.
Термин «алкильная группа, имеющая от 1 до 10 атомов углерода» относится к линейной или разветвленной алкильной группе, содержащей от 1 до 10 атомов углерода. Примеры включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, трет-бутильную группу, втор-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу, н-гексильную группу, н-гептильную группу, н-октильную группу и н-гексадецильную группу.
Термин «алкилтио группа, имеющая от 1 до 6 атомов углерода» относится к линейной или разветвленной алкилтио группе, содержащей от 1 до 6 атомов углерода. Примеры включают метилтио группу, этилтио группу, пропилтио группу, изопропилтио группу, бутилтио группу, изобутилтио группу, пентилтио группу и гексилтио группу.
Термин «алкилсульфонильная группа, имеющая от 1 до 6 атомов углерода» относится к линейной или разветвленной алкилсульфонильной группе, содержащей от 1 до 6 атомов углерода. Примеры включают метансульфонильную группу, этансульфонильную группу, пропан-2-сульфонильную группу и гексансульфонильную группу.
Термин «алкоксикарбонильная группа, имеющая от 2 до 10 атомов углерода» относится к линейной или разветвленной алкоксикарбонильной группе, содержащей от 2 до 10 атомов углерода. Примеры включают алканоильную группу, имеющую от 2 до 7 атомов углерода, такую как метоксикарбонильная группа, этоксикарбонильная группа и т-бутоксикарбонильная группа, а также октилоксикарбонильная группа.
Термин «алканоильная группа, имеющая от 2 до 7 атомов углерода» относится к линейной или разветвленной алканоильной группе, содержащей от 2 до 7 атомов углерода. Примеры включают ацетильную группу, пропаноильную группу, бутаноильную группу и гексаноильную группу.
Термин «алканоильная группа, имеющая от 1 до 6 атомов углерода» относится к линейной или разветвленной алканоильной группе, содержащей от 1 до 6 атомов углерода. Примеры включают формильную группу, ацетильную группу, пропаноильную группу и бутаноильную группу.
Фраза «аминогруппа, необязательно замещенная одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая» предполагается включающей, например, аминогруппу, метиламиногруппу, этиламиногруппу, изопропиламиногруппу, гексиламиногруппу, диметиламиногруппу, диэтиламиногруппу, диизопропиламиногруппу и дигексиламиногруппу.
Фраза «аминосульфонильная группа, необязательно замещенная одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая» предполагается включающей, например, сульфамоильную группу, диметиламиносульфонильную группу и диэтиламиносульфонильную группу.
Фраза «карбамоильная группа, необязательно замещенная одной или несколькими алкильными группами, имеющими от 1 до 4 атомов углерода» предполагается включающей карбамоильную группу, метилкарбамоильную группу, этилкарбамоильную группу и пропилкарбамоильную группу.
Фраза «пиперазино группа, которая может быть замещенной» или «необязательно замещенная пиперазино группа» относится к пиперазино группе, которая может быть замещена (предпочтительно на ее атоме азота) одним или несколькими заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (где указанная алкильная группа может быть замещена аминогруппой, которая может быть замещена одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода), формильной группы, алканоильной группы, имеющей от 2 до 7 атомов углерода, карбамоильной группы, которая может быть замещена одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, аминосульфонильной группы, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, и алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода. Конкретные примеры включают пиперазино группу, метилпиперазино группу, изопропилпиперазино группу, диметиламиноэтилпиперазино группу и ацетилпиперазино группу.
Термин «моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода и имеющая один или несколько атомов азота в качестве атомов кольца» подразумевает 3-9-членное моноциклическое насыщенное углеводородное кольцо, содержащее один или два атома азота в качестве образующих кольцо атомов и замещенное на атоме углерода кольца. Примеры моноциклической насыщенной углеводородной группы включают азиридинильные группы, азетидинильные группы, пирролидинильные группы и пиперидинильные группы (например, 4-пиперидинильные группы).
Термин «азотсодержащая моноциклическая ненасыщенная углеводородная группа» относится к 5- или 6-членному ненасыщенному кольцу, содержащему от 1 до 3 атомов азота в качестве звеньев кольца. Примеры включают пирролильную группу (например, пирролил-1-ильную группу), имидазол-1-ильную группу (например, имидазолильную группу), пиразолильную группу, триазол-4-ильную группу (например, [1,2,4]триазол-4-ильную группу) и пиридильную группу.
3-5-членные насыщенные углеводородные кольца, образованные RA и RB вместе с атомом азота, к которому присоединены RA и RB, должны включать азиридинильную группу, азетидинильную группу и пирролидинильную группу.
3-8-членные насыщенные углеводородные кольца, образованные R7 и R8 (или RC и RD) вместе с атомом азота, к которому присоединены R7 и R8 (или RC и RD), должны включать азиридинильную группу, пирролидинильную группу и пиперидинильную группу.
Использованный здесь термин «арильная группа» относится к ароматической углеводородной группе, частично насыщенной ароматической углеводородной группе, ароматической гетероциклической группе или частично насыщенному ароматическому гетероциклическому кольцу. Ароматическая углеводородная группа относится, например, к ароматической углеводородной группе, содержащей от 6 до 14 атомов углерода, включая фенильную группу, нафтильную группу и антрильную группу.
Частично насыщенная ароматическая углеводородная группа относится к группе, полученной частичным насыщением полициклической ароматической углеводородной группы, имеющей от 6 до 14 атомов углерода. Примеры включают тетрагидронафтильную группу и инданильную группу.
Ароматическая гетероциклическая группа относится к моноциклической или полициклической ароматической гетероциклической группе, содержащей от 2 до 13 атомов углерода и имеющей от 1 до 6 гетероатомов (например, атомов кислорода, серы и/или азота). Примеры включают тиенильную группу, фуранильную группу, пирролильную группу, изотиазолильную группу, изоксазолильную группу, пиразолильную группу, тиазолильную группу, оксазолильную группу, имидазолильную группу, пиридильную группу, пиридазинильную группу, пиримидильную группу, пиразинильную группу, бензотиенильную группу, бензофуранильную группу, индолильную группу, бензотиазолильную группу, бензоксазолильную группу, бензимидазолильную группу, хинолинильную группу, изохинолинильную группу, бензоксадиазолильную группу, бензотиадиазолильную группу и пиразолопиримидинильную группу (например, 5,7-диметил-пиразоло[1,5-а]пиримидин-2-ильную группу).
Частично насыщенное ароматическое гетероциклическое кольцо относится к гетероциклическому кольцу, полученному путем частичного насыщения полициклической ароматической гетероциклической группы. Такое гетероциклическое кольцо может быть замещено оксо группой. Примеры включают дигидрохинолинолильную группу:
Формула 3
 ,
,
дигидробензофуранильную группу, дигидробензодиоксинильную группу, дигидробензодиоксепинильную группу, бензодиоксолильную группу, дигидробензоксазолильную группу и дигидробензоксазинильную группу.
В случае когда подобная арильная группа является замещенной, заместители для арильной группы включают перечисленные ниже, и арильная группа может быть замещена от 1 до 5 этими заместителями:
атом галогена, цианогруппа, нитрогруппа, сульфамоильная группа, гидроксильная группа, карбоксильная группа, алкильная группа, имеющая 1-6 атомов углерода, трифторметильная группа, метоксикарбонилэтильная группа, алкокси группа, имеющая от 1 до 6 атомов углерода (алкокси группа необязательно замещена фенильной группой, алкиламиногруппой, имеющей от 1 до 6 атомов углерода, диалкиламиногруппой, имеющей от 2 до 12 атомов углерода, или морфолино группой), трифторметокси группа, дифторметокси группа, цианоэтокси группа,
алкенильная группа, имеющая от 2 до 8 атомов углерода, алкинильная группа, имеющая от 2 до 8 атомов углерода,
циклоалкильная группа, имеющая от 3 до 8 атомов углерода, алканоильная группа, имеющая от 2 до 7 атомов углерода, трифторацетильная группа, алкоксикарбонильная группа, имеющая от 2 до 10 атомов углерода,
фенильная группа (фенильная группа необязательно замещена алканоильной группой, имеющей 2-7 атомов углерода, или алкокси группой, имеющей от 1 до 6 атомов углерода),
фенокси группа, необязательно замещенная алкокси группой, имеющей от 1 до 6 атомов углерода,
пиразолильная группа, 1-метил-5-трифторметил-1Н-пиразол-3-ильная группа, метилпиримидинильная группа, 2-метилсульфанил-пиримидин-4-ильные группы, оксазолильная группа (например, оксазол-5-ильная группа), изооксазол-5-ильная группа, 5-трифторметил-изооксазол-3-ильная группа, пиридилокси группа (например, 4-пиридилокси группа), пиридинкарбонильная группа, бензоильная группа, пирролильная группа (например, пиррол-1-ильная группа), имидазолильная группа (например, имидазол-1-ильная группа), тиазолильная группа, [1,2,3]тиадиазол-4-ильная группа, триазолильная группа (например, [1,2,4]триазол-4-ильная группа), алкилтио группа, имеющая от 1 до 6 атомов углерода (например, метилтио группа), алкилсульфонильная группа, имеющая от 1 до 6 атомов углерода (например, метансульфонильная группа), бензолсульфонильная группа, пирролидинсульфонильная группа, морфолинилсульфонильная группа, 4-пиперидинильная группа, необязательно замещенная алкильной группой, имеющей от 1 до 6 атомов углерода, морфолино группа, необязательно замещенная алкильной группой, имеющей от 1 до 6 атомов углерода, пиперазино группа, замещенная алкильной группой, имеющей от 1 до 6 атомов углерода, или алкильной группой, имеющей от 1 до 6 атомов углерода и замещенной диэтиламиногруппой или группой, представленной формулой -NR7R8, где каждый из R7 и R8 обозначает атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода (алкильная группа необязательно замещена алкокси группой, имеющей от 1 до 6 атомов углерода, или диметиламиногруппой), алканоильную группу, имеющую от 1 до 6 атомов углерода, карбамоильную группу, карбамоильную группу, замещенную одной или более алкильными группами, имеющими от 1 до 4 атомов углерода, морфолинокарбонильную группу, диметиламиносульфонильную группу или алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, насыщенное углеводородное кольцо, содержащее от 3 до 8 членов, при этом кольцо необязательно замещено диметилендиокси группой, оксо группой или гидроксильной группой (например, ацетамидные группы, диметиламино группы, метилуреидо группы, бутилуреидо группы, триметилуреидо группы, морфолинилкарбониламино), метоксиэтилуреидо группой, пиридилэтоксикарбониламино группой.
Термин «фармацевтически приемлемая соль» относится к соли щелочного металла, щелочноземельного металла, аммония или алкиламмония или соли неорганической или органической кислоты. Примеры включают соли натрия, калия, кальция, аммония, алюминия, триэтиламмония, ацетат, пропионат, бутират, формиат, трифторацетат, малеат, тартрат, цитрат, стеарат, сукцинат, этилсукцинат, лактобионат, глюконат, глюкогептат, бензоат, метансульфонат, этиленсульфонат, 2-гидроксиэтансульфонат, бензолсульфонат, паратолуолсульфонат, лаурилсульфат, малат, аспартат, глютамат, адипат, соль цистеина, соль N-ацетилцистеина, гидрохлорид, гидробромид, фосфат, сульфат, гидройодид, никотинат, оксалат, пикрат, тиоцианат, ундеканоат, соль акрилатного полимера и соль карбоксивинилового полимера.
Соединения по настоящему изобретению могут иметь стереоизомеры, включая оптические изомеры, диастереоизомеры и геометрические изомеры. Все эти стереоизомеры и их смеси также попадают в область действия настоящего изобретения. Некоторые из соединений и промежуточных соединений по настоящему изобретению могут также существовать, например, в виде кетон-енольных таутомеров.
Как показано в примере тестирования ниже, соединения по представленному изобретению демонстрируют высокую активность при ингибировании связывания между S1P и его рецептором, Edg-1 (S1P1). Таким образом, ожидается, что соединения будут иметь профилактическое или терапевтическое действие на аутоиммунные заболевания, такие как болезнь Крона, аллергический колит, синдром Шегрена, рассеянный склероз и системная красная волчанка, и такие заболевания, как ревматоидные артриты, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартриты и связанная с возрастом дегенерация желтого пятна.
Предпочтительные примеры соединений по настоящему изобретению описаны далее.
Предпочтительным примером A является атом кислорода или -NR6- (предпочтительно, чтобы R6 являлся водородом). Более предпочтительным примером A является атом кислорода.
Предпочтительным примером R1 является алкильная группа, имеющая от 1 до 6 атомов углерода, которая может быть замещена одним или несколькими атомами галогена, или бензиловой группой, которая может быть замещена одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода. Более предпочтительными являются метильная группа, этильная группа или бензильная группа, которая может быть замещена одним или более атомов галогена, или даже более предпочтительно - метильная группа.
Предпочтительным примером R1A является атом водорода.
Предпочтительными примерами R2 являются этильная группа и циклопропильная группа.
Предпочтительным примером R4 является атом водорода.
В предпочтительном варианте осуществления R3 является: необязательно замещенной фенильной группой; 2-нафтильной группой (нафтильная группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из атома галогена и алкильной группы, имеющей от 1 до 6 атомов углерода); 3-пиразолильной группой (пиразолильная группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), трифторметильной группы и атома галогена) или 5-бензотиазолильной группой, 5-бензотиадиазолильной группой, 7-дигидрохинолинонильной группой, 7-изохинолинильной группой, 7-хинолинильной группой, 3-пиридильной группой или индолильной (предпочтительно 6-индолильной) группой, каждая из которых необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода (предпочтительно метильной группой).
Термин «необязательно замещенная фенильная группа» в предпочтительном варианте осуществления включает незамещенные фенильные группы и замещенные фенильные группы (А)-(С), приведенные ниже:
(А) фенильная группа, замещенная в положении 4 заместителем, выбранным из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, циклоалкильной группы, имеющей от 3 до 8 атомов углерода, алкокси группы, имеющей от 1 до 6 атомов углерода (алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолино группы и фенильной группы), атома галогена, трифторметокси группы, фенокси группы, фенильной группы, 1-пирролильной группы и -NRARB (RA и RB являются алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или RA и RB вместе с атомом азота, к которому присоединены RA и RB, необязательно образуют 3-5-членное насыщенное углеводородное кольцо), где фенильная группа, замещенная в 4 положении, далее необязательно замещена в положении 3 заместителем, выбранным из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена и алкокси группы, имеющей от 1 до 6 атомов углерода;
(В) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из гидроксильной группы, алкильной группы, имеющей от 1 до 6 атомов углерода, и алкокси группы, имеющей от 1 до 6 атомов углерода (алкокси группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолино группы и фенильной группы), где фенильная группа, замещенная в 3 положении, далее необязательно замещена одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или далее необязательно замещена в 4 положении атомом галогена; и
(С) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из азотсодержащих групп (i)-(v), описанных ниже, указанная фенильная группа далее необязательно замещена в 4 положении атомом галогена, эти азотсодержащие группы предпочтительно имеют третичный азот и присоединены к фенильной группе на атоме азота:
(i) моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода, имеющая один или несколько атомов азота в качестве атомов кольца и замещенная фенильной группой на атоме углерода, указанная насыщенная углеводородная группа необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода (например, пиперидинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода, такая как 4-пиперидинильная группа);
(ii) содержащая азот моноциклическая ненасыщенная углеводородная группа (например, пирролильная группа, имидазолильная группа);
(iii) морфолинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода, такая как морфолино группа;
(iv) необязательно замещенная пиперазино группа (например, пиперазино группа, необязательно замещенная (предпочтительно на входящем в состав кольца атоме азота) одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (алкильная группа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, и морфолино группы), и алканоильной группы, имеющей от 2 до 7 атомов углерода); и
(v) группа, представленная формулой -NR7R8, где каждый из R7 и R8 обозначает атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода (алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, морфолино группой, гидроксильной группой или алкокси группой, имеющей от 1 до 6 атомов углерода), алканоильную группу, имеющую от 1 до 6 атомов углерода, карбамоильную группу, необязательно замещенную одной или более алкильными группами, имеющими от 1 до 4 атомов углерода каждая, морфолинокарбонильную группу, аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или R7 и R8 необязательно образуют вместе с атомом азота, к которому присоединены R7 и R8, 3-8-членное насыщенное углеводородное кольцо, которое необязательно замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
Предпочтительно, чтобы формула -NR7R8, по пункту (v) выше, была такой, как описанная ниже формула -NRCRD.
Каждый из RC и RD обозначает атом водорода, алкильную группу, имеющую от 1 до 6 атомов углерода (алкильная группа необязательно замещена аминогруппой, необязательно замещенной одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, гидроксильной группой или алкокси группой, имеющей от 1 до 4 атомов углерода), формильную группу, ацетильную группу, аминокарбонильную группу, диметиламиносульфонильную группу или метилсульфонильную группу, или RC и RD вместе с атомом азота, к которому присоединены RC и RD, образуют 3-8-членное насыщенное углеводородное кольцо, которое может быть замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиокси группы, оксо группы и гидроксильной группы.
В особенно предпочтительном варианте осуществления R3 является фенильной группой, замещенной в положении 4 атомом фтора или атомом хлора, 6-индолильной группой и азотсодержащими группами (i), (iv) и (v), показанными в пункте (С) выше, данная фенильная группа, замещенная заместителем, выбранным из перечисленной выше группы, необязательно далее замещена в 4 положении атомом галогена.
В предпочтительном варианте осуществления R5 является алкильной группой, имеющей от 1 до 10 атомов углерода (предпочтительно от 1 до 6 атомов углерода) и замещенной циклоалкильной группой, имеющей 3-8 атомов углерода; алкильной группой, имеющей от 1 до 10 атомов углерода (предпочтительно от 1 до 6 атомов углерода) и замещенной нафтильной группой; алкенильной группой, имеющей от 2 до 8 атомов углерода (предпочтительно от 2 до 6 атомов углерода) и замещенной фенильной группой; фенильной группой или нафтильной группой (предпочтительно 2-нафтильной группой), каждая из которых необязательно замещена 1-5 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена, алкокси группы, имеющей от 1 до 6 атомов углерода, трифторметокси группы, дифторметокси группы, трифторметильной группы, алкенильной группы, имеющей от 1 до 6 атомов углерода, алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, алканоильной группы, имеющей от 2 до 7 атомов углерода, алкоксикарбонильной группы, имеющей от 2 до 7 атомов углерода, и цианогруппы; пирролильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и метоксикарбонильной группы; фуранильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), трифторметильной группы и атома галогена; тиенильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), трифторметильной группы, тиадиазолильной группы, оксазолильной группы и атома галогена; или бензотиенильной группой (предпочтительно 2-бензотиенильной группы), фенильной группой, слитой с 5-7-членным насыщенным углеводородным кольцом, которое может содержать один или два атома кислорода в качестве образующих кольцо атомов (например, дигидробензодиоксепинильная группа, бензодиоксолильная группа, дигидробензодиоксинильная группа, дигидробензофуранильная группа, тетрагидронафтильная группа и инданильная группа), тиадиазолильной группой, бензоксадиазолильной группой или бензотиадиазолильной группой (предпочтительно 5-бензотиадиазолильные группы), каждая из которых необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и атома галогена.
В предпочтительном варианте осуществления R5 примеры «необязательно замещенной фенильной группы» включают незамещенную фенильную группу, фенильную группу, замещенную от 1 до 5 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), алкокси группы, имеющей от 1 до 6 атомов углерода (предпочтительно метокси группы), и атома галогена, и фенильную группу, замещенную в 3 или 4 положении или в обоих 1-3 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена, алкокси группы, имеющей от 1 до 6 атомов углерода (предпочтительно метокси группы), трифторметокси группы, дифторметокси группы, трифторметильной группы, алкенильной группы, имеющей от 1 до 6 атомов углерода, алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метилсульфонильной группы), метоксикарбонильной группы, ацетильной группы и цианогруппы, предпочтительно из атома галогена, метильной группы и метокси группы, и более предпочтительно атома галогена.
В предпочтительном варианте осуществления R5 примером «необязательно замещенной нафтильной группы» является нафтильная группа, необязательно замещенная одним или более заместителями (предпочтительно 1-3 заместителями), выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), цианогруппы и алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метилсульфонильной группы). Более предпочтительно он является нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и цианогруппы. Примеры в случае 2-нафтильной группы включают незамещенную 2-нафтильную группу и 2-нафтильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (замещающей в любых положениях, предпочтительно в положениях 5, 7 и/или 8), и других заместителей (замещающих в 5, 7 и/или 8 положении). Примеры в случае 1-нафтильной группы включают незамещенную нафтильную группу и 1-нафтильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (замещающей в любых положениях), и других заместителей, предпочтительно атома галогена (замещающих предпочтительно в 4 положении).
В особенно предпочтительном варианте осуществления R5 является фенильной группой, замещенной в 3 и 4 положениях атомом галогена, незамещенной 2-нафтильной группой и 2-нафтильной группой, замещенной в 5, 7 и/или 8 положении одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и цианогруппы.
Далее следуют особенно предпочтительные сочетания R3 и R5. В случае когда R3 является фенильной группой, замещенной в 4 положении атомом фтора или хлора, R5 является: алкильной группой, имеющей от 1 до 10 атомов углерода (предпочтительно от 1 до 6 атомов углерода) и замещенной нафтильной группой; алкенильной группой, имеющей от 2 до 8 атомов углерода (предпочтительно от 2 до 6 атомов углерода) и замещенной фенильной группой; замещенной фенильной группой (например, фенильной группой, замещенной 1-5 метильными группами, фенильной группой, замещенной в 3 или в 4 положении или в обоих 1-3 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы, этильной группы, пропильной группы), атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметил группы, алкенильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно винильной группы), метоксикарбонильной группы, ацетильной группы и цианогруппы); бензотиенильной группой, нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), цианогруппы и алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метилсульфонильной группы); пирролильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из метильной и метоксикарбонильной группы; тиенильной группой, замещенной одной или несколькими алкильными группами, имеющими от 1 до 6 атомов углерода (предпочтительно метильными группами); бензодиоксолильной группой, дигидробензодиоксинильной группой, дигидробензофуранильной группой, тетрагидронафтильной группой, инданильной группой или бензотиадиазолильной группой (предпочтительно 5-бензотиадиазолильной группой).
В случае когда R3 является 6-индолильной группой, R5 является: алкильной группой, имеющей от 1 до 10 атомов углерода (предпочтительно от 1 до 6 атомов углерода) и замещенной нафтильной группой; алкенильной группой, имеющей от 2 до 8 атомов углерода (предпочтительно от 2 до 6 атомов углерода) и замещенной фенильной группой; необязательно замещенной фенильной группой (например, незамещенной фенильной группой, фенильной группой, замещенной 1-5 метильными группами, фенильной группой, замещенной в 3 или в 4 положении или в обоих 1-3 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы, этильной группы, пропильной группы), атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, алкенильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно винильной группы), метоксикарбонильной группы, ацетильной группы и цианогруппы); бензотиенильной группой, нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), цианогруппы и алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метилсульфонильной группы); пирролильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и метоксикарбонильной группы; или бензодиоксолильной группой, дигидробензодиоксинильной группой, дигидробензофуранильной группой, тетрагидронафтильной группой, инданильной группой или бензотиадиазолильной группой (предпочтительно 5-бензотиадиазолильной группой), каждая из которых необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и атома галогена.
В случае когда R3 является вариантом осуществления, показанным выше в пункте (С), R5 является: алкильной группой, имеющей от 1 до 6 атомов углерода и замещенной циклоалкильной группой, имеющей от 3 до 8 атомов углерода; алкильной группой, имеющей от 1 до 10 атомов углерода (предпочтительно от 1 до 6 атомов углерода) и замещенной нафтильной группой; алкенильной группой, имеющей от 2 до 8 атомов углерода (предпочтительно от 2 до 6 атомов углерода) и замещенной фенильной группой; необязательно замещенной фенильной группой (например, незамещенной фенильной группой, фенильной группой, замещенной 1-5 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и атома галогена, фенильной группой, замещенной в 3 или в 4 положении или в обоих 1-3 заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена, метокси группы, трифторметокси группы, дифторметокси группы, трифторметильной группы, алкенильной группы, имеющей от 1 до 6 атомов углерода, алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метилсульфонильной группы), метоксикарбонильной группы, ацетильной группы, цианогруппы); нафтильной группы, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), цианогруппы и алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метилсульфонильной группы); пирролильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и метоксикарбонильной группы; тиенильной группой, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), трифторметильной группы, тиадиазолильной группы, оксазолильной группы и атома галогена; фуранильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), трифторметильной группы и атома галогена; или бензотиенильной группой, бензодиоксолильной группой, дигидробензодиоксинильной группой, дигидробензофуранильной группой, тетрагидронафтильной группой, инданильной группой, тиадиазолильной группой (предпочтительно 5-тиадиазолильной группой), бензоксадиазолильной группой или бензотиадиазолильной группой (предпочтительно 5-бензотиадиазолильной группой), каждая из которых необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода (предпочтительно метильной группы), и атома галогена.
Предпочтительное оптически активное соединение по настоящему изобретению, имеющее являющимся атомом водорода R1A, имеет приведенную ниже структуру.
Формула 4

Соединение по настоящему изобретению может быть синтезировано, например, описанным ниже способом.
Формула 5
Схема 1


(где R1, R1A, R2, R3 и R5 такие, как описано выше, R' обозначает алкильную группу, имеющую от 1 до 6 атомов углерода, R'' обозначает защитную группу для аминогруппы, являющуюся стабильной в щелочной среде (например, т-бутоксикарбонильную группу, бензилоксикарбонильную группу), L обозначает уходящую группу (например, атом галогена, такой как атом хлора, атом брома и атом йода, алкилсульфонилокси группа, такая как метансульфонилокси группа и п-толуолсульфонилокси группа, арилсульфонилокси группа, 2-оксо-1-оксазолильная группа), и A1 обозначает атом кислорода, атом серы или группу, представленную формулой -NR6-, где R6 обозначает атом водорода или алкильную группу, имеющую от 1 до 6 атомов углерода).
В представленном изобретении соединение, имеющее А, являющуюся атомом кислорода, атомом серы или группой, представленной формулой -NR6-, может быть синтезировано, например, способом, показанным на схеме 1.
Соединение, обозначенное формулой (b), может быть получено реакцией соединения формулы (a) с гидразином в растворителе или в отсутствие растворителя. Использованное количество гидразина составляет обычно 1-30 весовых эквивалентов по отношению к соединению (а), предпочтительно 5-30 весовых эквивалентов. Используемый при необходимости растворитель не ограничен особо до тех пор, пока он остается инертным. Примеры растворителей, которые могут использоваться, включают спирты, такие как метанол и этанол. Температура реакции была обычно от комнатной температуры до температуры кипения растворителя. Время реакции обычно 12-24 часа, но это зависит от температуры реакции и исходных веществ.
Соединение, представленное формулой (d), может быть получено реакцией соединения, представленного формулой (b), с соединением, представленным формулой (с), в растворителе или при отсутствии растворителя. Использованное количество соединения, представленного формулой (с), составляет обычно 1-3 весовых эквивалента по отношению к соединению, представленному формулой (b), предпочтительно 1,1-1,5 весовых эквивалента. Используемый растворитель не ограничен особо то тех пор, пока он остается инертным. Например, предпочтительно применяются спирты, такие как метанол или этанол, и галогенированные углеводороды, такие как дихлорметан и хлороформ. Температура реакции - обычно от комнатной до температуры кипения растворителя. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (e), может быть получено реакцией соединения формулы (d) с основанием в растворителе или в отсутствие растворителя для циклизации соединения. Используемое основание обычно включает гидроксиды щелочных металлов, такие как NaOH и KOH, и соли щелочных металлов, такие как NaHCO3 и K2CO3. Количество используемого основания составляет 1-10 весовых эквивалентов по отношению к соединению (d), предпочтительно 1,1-1,5 весовых эквивалента. Если необходим растворитель, следующие вещества могут быть использованы в качестве растворителя: вода, спирты, такие как метанол и этанол, эфиры, такие как диоксан и тетрагидрофуран (ТГФ), и смеси этих растворителей. Температура реакции была обычно от комнатной температуры до температуры кипения растворителя. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (g), может быть получено реакцией соединения формулы (e) с соединением формулы (f) в присутствии основания. Количество используемого соединения формулы (f) составляет 1-5 весовых эквивалентов, предпочтительно 1,1-1,5 весовых эквивалента, по отношению к соединению формулы (e). Используемое основание обычно включает гидроксиды щелочных металлов, такие как NaOH и KOH, соли щелочных металлов, такие как NaHCO3 и K2CO3, и амины, такие как триэтиламин, диизопропилэтиламин и диизопропиламин. Количество используемого основания составляет 1-10 весовых эквивалентов по отношению к соединению формулы (e), предпочтительно 1,0-3,0 весовых эквивалента. Температура реакции была от 0°С до температуры кипения растворителя, предпочтительно от 0°С до комнатной температуры. Используемый при необходимости растворитель особо не ограничен до тех пор, пока он остается инертным. Примеры применимых растворителей включают воду, эфиры, такие как диоксан и ТГФ, диметилформамид (ДМФ), N,N'-диметилацетамид (ДМА), N,N'-диметилпропиленмочевина (ДМПМ), гексаметилфосфорамид (ГМФА), и смеси этих растворителей. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (h), может быть получено реакцией соединения формулы (g) с окислителем в растворителе. Примеры окислителей, которые могут быть использованы включают органические пероксикислоты, такие как м-хлорпербензойная кислота, гексагидрат моноперфталата магния, пероксиуксусная кислота и пероксимуравьиная кислота, неорганические и органические перекиси, такие как перекись водорода, аддукт перекиси водорода и мочевины/фталловый ангидрид, трет-бутилгидропероксид и гидропероксид кумена, перйодат натрия, оксон (зарегистрированная торговая марка), N-бромосукцинимид, N-хлоросукцинимид, хлорамин-Т, гипохлорит трет-бутила, диацетат йодбензола и бром-1,4-диазабицикло[2,2,2]октановый комплекс аддукции. Количество используемого окислителя составляет 2-10 весовых эквивалентов по отношению к соединению формулы (g), предпочтительно 2-3 весовых эквивалента. Используемый при необходимости растворитель особо не ограничен до тех пор, пока он остается инертным. Примеры используемых растворителей включают галогенированные углеводороды, такие как метиленхлорид и хлороформ. Температура реакции была от 0°С до температуры кипения растворителя, предпочтительно от 0°С до 40°С. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (i), или соль этого соединения могут быть получены проведением реакции удаления защитной группы аминогруппы соединения, обозначенного формулой (h), в растворителе при обычных условиях, например, проведением реакции с кислотой. Примеры использованных кислот включают неорганические кислоты (например, соляную кислоту, бромоводородную кислоту, йодоводородную кислоту, серную кислоту, азотную кислоту) и органические кислоты (например, трифторуксусную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту). Количество используемой кислоты составляет 1-50 весовых эквивалентов относительно соединения, представленного формулой (h). Температура реакции была от 0°С до температуры кипения растворителя, предпочтительно от комнатной температуры до 40°С. Используемые растворители включают галогенированные углеводороды, такие как метиленхлорид и хлороформ. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (k), или фармацевтически приемлемая соль этого соединения могут быть получены в растворителе или в его отсутствие реакцией соединения формулы (i) с соединением формулы (j) (где А1 обозначает атом кислорода, атом серы или группу, представленную формулой -NR6-, где R3 описан выше) в присутствии основания и, если это необходимо, образования соли. Использованное количество соединения, представленного формулой (j), составляет обычно 1-5 весовых эквивалентов по отношению к соединению, представленному формулой (i), предпочтительно 1-3 весовых эквивалента. Примеры использованных оснований включают соли щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, dimsyl sodium, гидрид натрия, амид натрия, трет-бутоксикалий и трет-бутоксинатрий, амины, такие как триэтиламин, диизопропиламин, пирролидин и пиперидин, ацетат натрия и ацетат калия. Количество использованного основания составляет обычно 1-10 весовых эквивалентов по отношению к соединению представленному формулой (i), предпочтительно 1-3 весовых эквивалента. Температура реакции была от 0°С до температуры кипения растворителя, реакция может проводиться при обычном давлении, увеличенном давлении, микроволновом облучении и подобных условиях. Растворители, используемые в реакции, включают эфиры, такие как диоксан и ТГФ, ДМФ, ДМА, ДМПМ, ГМФА или подобные, или смеси этих растворителей. Время реакции обычно от 1 до 12 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (m), или его фармацевтически приемлемая соль могут быть получены реакцией соединения формулы (k) с соединением формулы (l) в растворителе или в отсутствие растворителя в присутствии основания и, если необходимо, образования соли. Использованное количество соединения, представленного формулой (l), составляет обычно 1-5 весовых эквивалентов по отношению к соединению, представленному формулой (k), предпочтительно 1-1,2 весовых эквивалента. Примеры использованных оснований включают гидроксиды щелочных металлов, такие как NaOH и KOH, соли щелочных металлов, такие как NaHCO3 и K2CO3, или амины, такие как триэтиламин, диизопропилэтиламин и диизопропиламин. Количество использованного основания составляет обычно 1-10 весовых эквивалентов по отношению к соединению, представленному формулой (k), предпочтительно 1-3 весовых эквивалента. Температура реакции была от 0°С до температуры кипения растворителя, предпочтительно от 0°С до комнатной температуры. Используемый при необходимости растворитель особо не ограничен до тех пор, пока он остается инертным. Примеры используемых растворителей включают галогенированные углеводороды, такие как метиленхлорид и хлороформ, эфиры, такие как диоксан и ТГФ, и смеси этих растворителей. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Формула 6
Схема 2

Схема 3



Схема 4
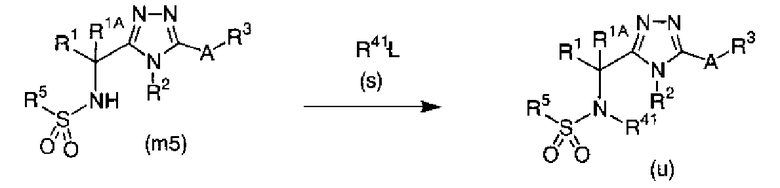
(где R1, R1A, R2, R3, R4, R5, R', R'', A и L описаны выше, и R41 такой же, как R4, за исключением атома водорода).
В настоящем изобретении соединение, имеющее А, обозначенную формулой -SO- или формулой -SO2-, может быть синтезировано способом, показанным на схеме 2.
Соединение, представленное формулой (m2), соединение, представленное формулой (m3), или фармацевтически приемлемые соли соединений могут быть получены реакцией соединений, полученных по схеме 1 и представленных формулой (m), и соединения, представленного формулой (m1), имеющего A1, являющуюся атомом серы, с окислителем и, если это необходимо, образования солей. Примеры окислителей, которые могут быть использованы, включают органические пероксикислоты, такие как м-хлорпербензойная кислота, гексагидрат моноперфталата магния, пероксиуксусная кислота и пероксимуравьиная кислота, неорганические и органические перекиси, такие как перекись водорода, аддукт перекиси водорода и мочевины/фталловый ангидрид, трет-бутилгидропероксид и гидропероксид кумена, перйодат натрия, оксон (зарегистрированная торговая марка), N-бромосукцинимид, N-хлоросукцинимид, хлорамин-Т, гипохлорит трет-бутила, диацетат йодбензола и бром-1,4-диазабицикло[2,2,2]октановый комплекс аддукции. Количество используемого окислителя составляет 1-10 весовых эквивалентов по отношению к соединению формулы (m1), предпочтительно 1-3 весовых эквивалента. Используемый при необходимости растворитель особо не ограничен до тех пор, пока он остается инертным. Примеры используемых растворителей включают галогенированные углеводороды, такие как метиленхлорид и хлороформ. Температура реакции составляет от -78°С до температуры кипения растворителя, предпочтительно от 0°С до 40°С. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
В настоящем изобретении соединение, имеющее А, обозначающую -CH2-, может быть синтезировано способом, показанным на схеме 3.
Соединение, обозначенное формулой (o), может быть получено реакцией соединения формулы (а) с соединением формулы (n) (где R2 описан выше) в присутствии или в отсутствие растворителя. Использованное количество соединения, представленного формулой (n), составляет 1-10 весовых эквивалентов по отношению к соединению, представленному формулой (a), предпочтительно 1-1,2 весовых эквивалента. Используемый при необходимости растворитель особо не ограничен до тех пор, пока он остается инертным. Примеры использованных растворителей включают спирты, такие как метанол и этанол. Температура реакции обычно составляет от комнатной температуры до температуры кипения растворителя, предпочтительно от комнатной температуры до 50°С. Время реакции обычно от 12 до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (p), может быть получено реакцией соединения формулы (o) с реагентом Лоуссона в присутствии или в отсутствие растворителя. Использованное количество реагента Лоуссона составляет 1-5 весовых эквивалентов по отношению к соединению, представленному формулой (o), предпочтительно 1-1,2 весовых эквивалента. Используемый растворитель включает эфиры, такие как диоксан и ТГФ, и смеси этих растворителей. Температура реакции составляет от комнатной температуры до температуры кипения растворителя, предпочтительно от комнатной температуры до 50°С. Время реакции обычно от 1 до 12 часов, но это зависит от температуры реакции и исходных веществ
Соединение, обозначенное формулой (r), может быть получено реакцией соединения формулы (p) с соединением, обозначенным формулой (q), в присутствии соединения ртути. Использованное количество соединения с формулой (q) составляет 1-10 весовых эквивалентов по отношению к соединению, представленному формулой (р), предпочтительно 1-1,2 весовых эквивалента. Примеры соединений ртути включают HgCl2 и Hg(OAc)2. Использованное количество соединения ртути составляет 1-10 весовых эквивалентов по отношению к соединению, представленному формулой (р), предпочтительно 1-1,2 весовых эквивалента. Используемый растворитель включает ацетонитрил, ТГФ, диоксан и подобные. Температура реакции составляет от комнатной температуры до температуры кипения растворителя, предпочтительно от комнатной температуры до 50°С. Время реакции обычно от 12 до 48 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, обозначенное формулой (k1), или его соль могут быть получены реакцией удаления защитной группы аминогруппы соединения, обозначенного формулой (r), в растворителе при обычных условиях, например, проведением реакции с кислотой. Примеры использованных кислот включают неорганические кислоты (например, соляную кислоту, бромоводородную кислоту, йодоводородную кислоту, серную кислоту, азотную кислоту) и органические кислоты (например, трифторуксусную кислоту, п-толуолсульфоновую кислоту, метансульфоновую кислоту). Количество используемой кислоты составляет 1-50 весовых эквивалентов относительно соединения, представленного формулой (r). Температура реакции составляет от 0°С до температуры кипения растворителя, предпочтительно от комнатной температуры до 40°С. Используемый при необходимости растворитель особо не ограничен до тех пор, пока он остается инертным. Примеры используемых растворителей включают галогенированные углеводороды, такие как метиленхлорид и хлороформ. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, представленное формулой (m4), или его фармацевтически приемлемая соль могут быть получены реакцией соединения, представленного формулой (k1), с соединением, представленным формулой (l), в растворителе или при отсутствии растворителя, в присутствии основания и, если необходимо, образования соли. Использованное количество соединения, представленного формулой (l), составляет обычно 1-5 весовых эквивалентов по отношению к соединению, представленному формулой (k1), предпочтительно 1-1,2 весовых эквивалента. Используемое основание включает гидрооксиды щелочных металлов, такие как NaOH и KOH, соли щелочных металлов, такие как NaHCO3 и K2CO3, и амины, такие как триэтиламин, диизопропилэтиламин и диизопропиламин. Количество используемого основания составляет 1-10 весовых эквивалентов, предпочтительно 1,0-3,0 весовых эквивалента. Температура реакции составляет обычно от комнатной до температуры кипения растворителя, предпочтительно от 0°С до комнатной температуры. Используемый растворитель не ограничен особо то тех пор, пока он остается инертным. Примеры используемых растворителей включают галогенированные углеводороды, такие как метиленхлорид и хлороформ, эфиры, такие как диоксан и ТГФ, и их смеси. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Соединение, представленное формулой (u), или его фармацевтически приемлемая соль могут быть получены реакцией в растворителе или при отсутствии растворителя соединения, представленного формулой (m5), с соединением, представленным формулой (s), в присутствии основания и, если необходимо, образования соли. Использованное количество соединения, представленного формулой (s), составляет обычно 1-10 весовых эквивалентов по отношению к соединению, представленному формулой (m5), предпочтительно 1-1,5 весовых эквивалента. Используемое основание включает гидроксиды щелочных металлов, такие как NaOH и KOH, соли щелочных металлов, такие как NaHCO3 и K2CO3, и амины, такие как триэтиламин, диизопропилэтиламин и диизопропиламин. Количество используемого основания составляет 1-10 весовых эквивалентов относительно соединения, представленного формулой (m5), предпочтительно 1,0-3,0 весовых эквивалента. Температура реакции была обычно от 0°С до температуры кипения растворителя, предпочтительно от 0°С до комнатной температуры. Используемый растворитель не ограничен особо то тех пор, пока он остается инертным. Примеры используемых растворителей включают воду, эфиры, такие как диоксан и ТГФ, диметилформамид (ДМФ), N,N'-диметилацетамид (ДМА), N,N'-диметилпропиленмочевина (ДМПМ), гексаметилфосфорамид (ГМФА), и смеси этих растворителей. Время реакции обычно от 30 минут до 24 часов, но это зависит от температуры реакции и исходных веществ.
Далее, функциональная группа может быть введена в R3 проведением описанных выше процессов присоединения защитных групп, снятия защитных групп и трансформации функциональной группы.
Для применения в качестве фармацевтических композиций соединения по настоящему изобретению могут быть дополнены обычно применяемыми наполнителями, добавками, регуляторами pH, солюбилизаторами и так далее, после чего введены с применением обычных способов в таблетки, гранулы, пилюли, капсулы, порошки, растворы, суспензии, инъекции и т.д. Полученные таким образом фармацевтические композиции могут быть введены как пероральные или парентеральные составы.
Соединение по представленному изобретению может быть введено взрослому пациенту в дозировке от 1 до 1000 мг в день в нескольких раздельных дозах. Эта дозировка может быть увеличена или уменьшена в соответствии с типом заболевания, возрастом, весом и симптомами пациента и подобным.
Положительное действие изобретения
Как показывает Пример тестирования ниже, было обнаружено, что соединения по настоящему изобретению являются сильными лигандами Edg-1 (S1P1).
Лучший способ выполнения изобретения
Нижеследующее описывает настоящее изобретение более детально, со ссылками на примеры и Пример тестирования.
Пример 1
3,4-Дихлоро-N-{(R)-1-[4-этил-5-(4-фторфенокси)-4H-[1,2,4]-триазол-3-ил]этил}бензолсульфонамид (соединение 12).
Формула 7
т-Бутиловый эфир (R)-(1-гидразинокарбонил-2-этил)карбаминовой кислоты
Формула 8

(1) Моногидрат гидразина (30 мл) добавляли к раствору метильного эфира N-(т-бутоксикарбонил)-D-аланина (41,8 г) в метаноле (180 мл), смесь перемешивали при комнатной температуре в течение 12 часов. Реакционный раствор концентрировали, полученные неочищенные кристаллы промывали смешанным растворителем из гексана и этилацетата (1:1, 300 мл), после чего высушивали для получения названного соединения в виде бесцветного порошка (32,6 г).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,14 (д, J=7,2 Гц, 3H), 1,37 (с, 9H), 3,30-4,09 (м, 3H), 6,70-6,90 (м, 1H), 8,96 (ушир.с, 1H).
(R)-2-(N-(т-бутоксикарбонил)амино)пропионил)-N-этилгидразинкарботиоамид
Формула 9
(2) Этилизотиоцианат (14,6 мл) добавляли к раствору соединения (30,8 г) из примера 1-(1) в этаноле (152 мл), смесь была нагрета с обратным холодильником в течение двух часов. Затем смесь охлаждали до комнатной температуры и полученные кристаллы отфильтровывали. Фильтрат концентрировали и полученный остаток очищали хроматографией на силикагеле со смесью растворителей из этилацетата и хлороформа для получения названного соединения в виде бесцветного аморфного вещества (43,2 г).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 0,98-1,28 (м, 6H), 1,40 (с, 9H), 3,25-3,65 (м, 2H), 3,77-3,95 (м, 1H), 7,20-7,39 (м, 1H), 7,45-7,60 (м, 1H), 9,25 (с, 1H), 10,00 (с, 1H).
т-Бутиловый эфир [(R)-1-(4-этил-5-меркапто-4H-[1,2,4]триазол-3-ил)этил]-карбамиловой кислоты
Формула 10
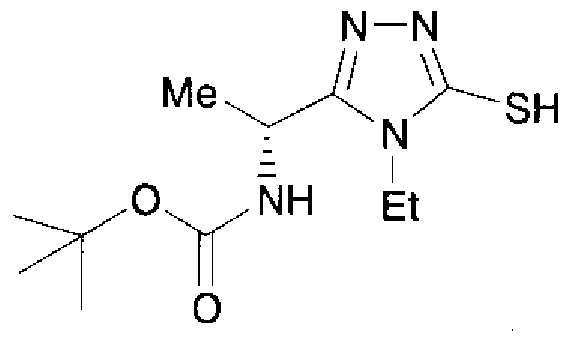
(3) К смешанному раствору соединения из примера 1-(2) (42,1 г) в метаноле (120 мл) и диоксане (240 мл) добавляли водный раствор гидроксида натрия 1 моль/л (218 мл), после чего смесь нагревали с обратным холодильником в течение трех часов. Реакционный раствор концентрировали, после чего добавляли соляную кислоту (2Н, 100 мл) в водном растворе. Смесь экстрагировали смешанным раствором из этилацетата, хлороформа и метанола (10:10:1, 500 мл). Органическую фазу высушивали над безводным сульфатом магния и выпаривали при пониженном давлении для удаления растворителя. Полученный остаток промывали смешанным растворителем - гексаном и этилацетатом (1:1, 300 мл), после чего высушивали для получения названного соединения в виде белого твердого вещества (29,22 г).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,21 (т, J=7,1 Гц, 3H), 1,30-1,50 (м, 3H), 1,39 (с, 9H), 3,82-4,05 (м, 2H), 4,72-4,88 (м, 1H), 7,58 (д, J=8,5 Гц, 1H), 13,60 (ушир.с, 1H).
т-Бутиловый эфир [(R)-1-(4-этил-5-метилсульфанил-4H-[1,2,4]триазол-3-ил)этил]-карбамиловой кислоты
Формула 11
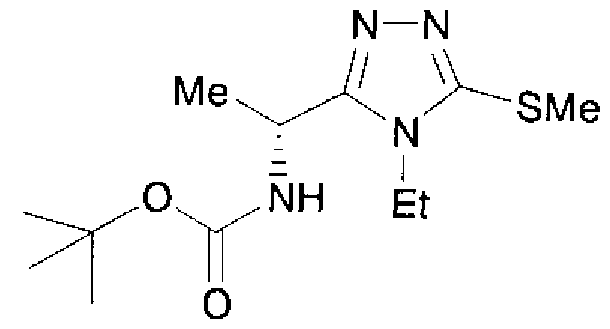
(4) К раствору соединения из примера 1-(3) (28,12 г) в ТГФ (200 мл) добавляли диизопропиламин (17,4 мл) и MeI (7,7 мл), после чего смесь перемешивалась при комнатной температуре один час. Затем полученные кристаллы фильтровали. Фильтрат концентрировали и полученные неочищенные кристаллы промывали смесью растворителей из гексана и этилацетата (3:1, 200 мл), после чего высушивали для получения названного соединения в виде белого порошка (29,5 г).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,21 (т, J=7,0 Гц, 3H), 1,38 (с, 9H), 1,45 (т, J=7,0 Гц, 3H), 2,62 (с, 3H), 3,80-4,00 (м, 2H), 4,85-4,92 (м, 1H), 7,52 (д, J=8,5 Гц, 1H).
т-Бутиловый эфир [(R)-1-(4-этил-5-метансульфонил-4H-[1,2,4]триазол-3-ил)этил]-карбамиловой кислоты
Формула 12

(5) К раствору соединения из примера 1-(4) (21,0 г) в хлороформе (293 мл) при охлаждении льдом в четыре приема добавляли м-хлорпербензойную кислоту (43,0 г), после чего смесь перемешивалась при комнатной температуре в течение трех часов, а затем при 40°C в течение одного часа. Затем к реакционному раствору для отделения органической фазы добавляли Na2S2O3 (12,9 г) и водный раствор гидроксида натрия (1 моль/л, 300 мл), органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния и выпаривали при пониженном давлении для удаления растворителя. Полученный остаток очищали проточной колоночной хроматографией на силикагеле со смешанным растворителем из гексана и этилацетата, после чего перекристаллизовывали с гексаном и хлороформом для получения названного соединения в виде белого порошка (17,2 г).
1H-ЯМР (300 МГц, CDCl3) δ м.д.: 1,44 (с, 9H), 1,49 (т, J=7,1 Гц, 3H), 1,67 (т, J=6,8 Гц, 3H), 3,53 (с, 3H), 4,25-4,59 (м, 2H), 4,92-5,20 (м, 2H).
Соли трифторуксусной кислоты (R)-1-(4-этил-5-метансульфанил-4H-[1,2,4]триазол-3-ил)этиламина
Формула 13

(6) К полученному в примере 1-(5) соединению (100,0 г) добавляли трифторуксусную кислоту (121 мл), после чего смесь перемешивалась при комнатной температуре в течение двух часов. Реакционный раствор концентрировали при пониженном давлении для получения названного соединения в виде белого порошка (103,8 г).
1H-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,37 (т, J=7,2 Гц, 3H), 1,59 (д, J=6,8 Гц, 3H), 3,65 (с, 3H), 4,21-4,50 (м, 2H), 4,72-4,90 (м, 1H), 8,69 (ушир.с, 3H).
(1R)-1-(4-этил-5(4-фторфенокси)-4H-[1,2,4]-триазол-3-ил)этиламин
Формула 14

(7) В устойчивой к давлению завинчивающейся пробирке к соединению, полученному в примере 1-(6), (1 г) добавляли N-N'-диметилпропиленмочевину (ДМПМ) (5 мл), 4-фторфенол (1,01 г) и карбонат цезия (2,94 г), после чего смесь перемешивалась при 200°C в течение одного часа. Смесь приводили к комнатной температуре, после чего добавляли насыщенный водный раствор хлорида натрия. Смесь экстрагировали этилацетатом (100 мл × 5). Органическую фазу высушивали над безводным сульфатом натрия, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали колоночной хроматографией (NH SiO2, гексан/этилацетат = 50/50 до 20/80, хлороформ/метанол = 30/1) для получения названного соединения (коричневое маслянистое вещество, 0,586 г).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,41 (т, J=7,3 Гц, 3Н), 1,58 (д, J=6,4 Гц, 3Н), 3,95-4,23 (м, 3Н), 6,90-7,15 (м, 2Н), 7,30-7,44 (м, 2Н).
3,4-дихлоро-N-{(R)-1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]-триазол-3-ил]этил}бензолсульфонамид (соединение 12)
Формула 15

(8) К раствору соединения из примера 1-(7) (0,554 г) в ТГФ (10 мл) при комнатной температуре добавляли триэтиламин (0,93 мл, 6,64 ммоль) и 3,4-дихлорбензолсульфонилхлорид (0,45 мл, 2,88 ммоль), после чего смесь перемешивалась при комнатной температуре в течение 2,5 часов. Затем добавляли этилацетат. Органическую фазу промывали 1Н водным раствором соляной кислоты, после чего насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали колоночной хроматографией (кислотный OH SiO2, гексан/этилацетат = 50/50 до 10/90), после чего перекристаллизовывали (этилацетат/гексан) для получения 0,447 г названного соединения (соединения 12) в виде бесцветного порошка.
Точка плавления: от 190,0°C до 192,0°C.
Пример 2
N-[(1R)-1-(4-этил-5(4-метилфениламино)-4Н-[1,2,4]триазол-3-ил)этил]3,4-дихлоробензолсульфонамид (соединение 61)
Формула 16
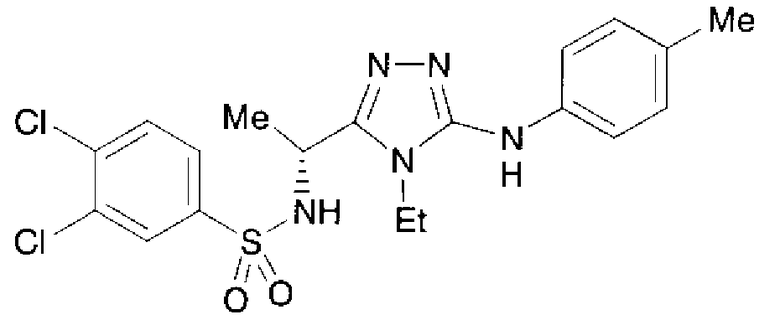
(R)-1-(4-этил-5-метансульфонил-4Н-[1,2,4]триазол-3-ил)этиламин
Формула 17

(1) К соединению, полученному в примере 1-(6), (4,30 г) добавляли н-BuNH2 (20 мл), после чего смесь перемешивалась при комнатной температуре в течение одного часа. Реакционный раствор концентрировали, полученный неочищенный продукт очищали хроматографией NH на силикагеле со смешанным растворителем из метанола и хлороформа (метанол/хлороформ = 10%) для получения названного соединения в виде бесцветных кристаллов (2,737 г).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,53 (т, J=7,3 Гц, 3H), 1,65 (д, J=6,8 Гц, 3H), 3,53 (с, 3H), 4,14-4,58 (м, 3H).
[5-((R)-1-аминоэтил)-4-этил-4Н-[1,2,4]триазол-3-ил]-4-метилфениламин
Формула 18

(2) Соединение, полученное в примере 2-(1), (437 мг), ДМПМ (2,0 мл), 4-толуидин (257 мг) и NaH (240 мг, 60-72% по весу в масле) помещали в устойчивую к давлению пробирку с завинчивающейся крышкой. Смесь перемешивалась при 200°C в течение 1,0 часа, после чего ее приводили к комнатной температуре, затем к реакционному раствору добавляли 10% метанол/хлороформ. Реакционный раствор фильтровали через NH силикагель, после чего концентрировали, полученное коричневое маслянистое вещество очищали способом хроматографии на колонках (NH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 5%) для получения названного соединения (коричневое маслянистое соединение, 224 мг).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,31 (т, J=7,3 Гц, 3H), 1,60 (д, J=6,6 Гц, 3H), 2,28 (с, 3H), 3,60-4,30 (м, 3H), 6,96-7,02 (м, 4H).
N-[(1R)-1-(4-этил-5(4-метилфениламино)-4Н-[1,2,4]триазол-3-ил)этил]3,4-дихлоробензолсульфонамид (соединение 61)
Формула 19
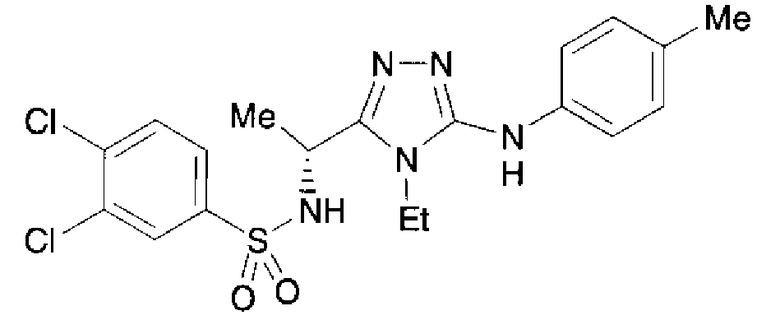
К раствору соединения по примеру 2-(2) (220 мг) и триэтиламина (0,249 мл) в ТГФ (9 мл) при комнатной температуре добавляли раствор 3,4-дихлоробензолсульфонилхлорида (0,249 мкл) в ТГФ (2 мл), после чего смесь перемешивалась при комнатной температуре в течение 5 часов. Нерастворимое вещество удаляли фильтрованием, полученный остаток концентрировали. Полученный неочищенный продукт очищали способом хроматографии на колонке с OH силикагелем (растворитель для элюции: этилацетат/гексан = 50-99%), после чего перекристаллизован (этилацетат-гексан) для получения 160 мг названного соединения (соединения 61) в виде бледно-желтого порошка.
1H-ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,18 (т, J=7,1 Гц, 3H), 1,30 (д, J=6,9 Гц, 3H), 2,23 (с, 3H), 3,87-4,03 (м, 2H), 4,63-4,72 (м, 1H), 7,00-7,12 (м, 2H), 7,35-7,45 (м, 2H), 7,74 (дд, J=8,6, 1,9 Гц, 1H), 7,86 (д, J=8,6 Гц, 1H), 7,96 (д, J=1,9 Гц, 1H), 8,27 (с, 1H), 8,57-8,66 (м, 1H).
Точка плавления: от 93,0°C до 99,0°C.
Пример 3
3,4-дихлоро-N-[(R)-1-(4-этил-5(4-метилбензолсульфанил)-4Н-[1,2,4]триазол-3-ил)этил]бензолсульфонамид (соединение 55)
Формула 20
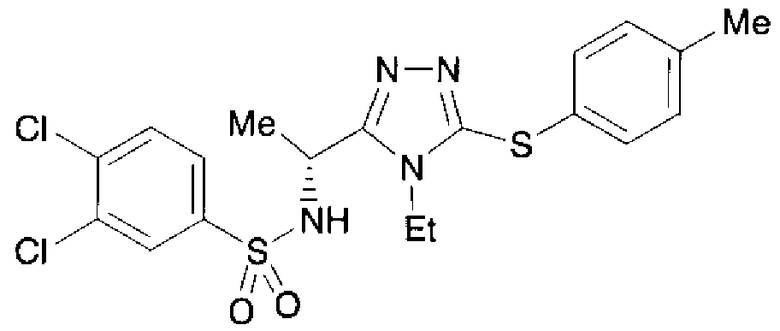
(R)-1-(4-этил-5(4-метилфенилсульфанил)-4Н-[1,2,4]триазол-3-ил)-этиламин
Формула 21
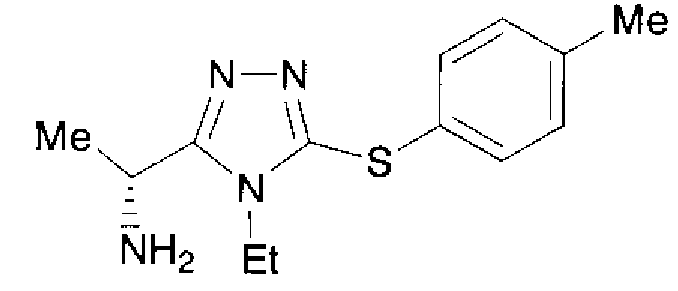
(1) Соединение, полученное в примере 1-(6), (5,00 г, 15,1 ммоль), 4-метилбензолтиол (3,74 г, 30,1 ммоль) и карбонат цезия (14,7 г, 45,1 ммоль) помещали в устойчивую к давлению пробирку с завинчивающейся крышкой. Смесь перемешивалась при 150°C в течение четырех часов, после чего ее приводили к комнатной температуре и добавляли смешанный растворитель - хлороформ/метанол (10/1). Нерастворимое вещество удаляли фильтрованием. Фильтрат удаляли выпариванием при пониженном давлении, полученный неочищенный продукт очищали способом хроматографии на колонке (NH SiO2, гексан/этилацетат = 50/50 до 10/90, хлороформ/метанол = 40/1) для получения 3,01 г названного соединения (бесцветное маслянистое вещество).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,21 (т, J=7,3 Гц, 3H), 1,59 (д, J=6,4 Гц, 3H), 2,31 (с, 3H), 4,00-4,18 (м, 3H), 7,06-7,14 (м, 2H), 7,26-7,30 (м, 2H).
3,4-дихлоро-N-[(R)-1-(4-этил-5(4-метилбензолсульфанил)-4Н-[1,2,4]триазол-3-ил)-этил]-бензолсульфонамид (соединение 55)
Формула 22
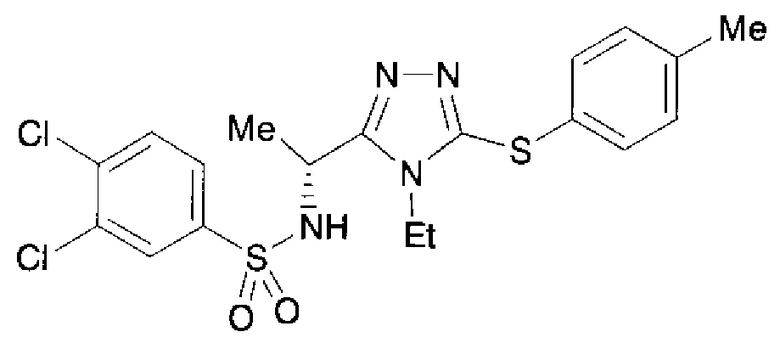
(2) Начиная с соединения, полученного в примере 3-(1), процедуру, описанную в примере 1-(8), повторяли для получения названного соединения.
1H-ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,08 (т, J=7,3 Гц, 3H), 1,32 (д, J=6,9 Гц, 3H), 2,28 (с, 3H), 3,90-4,11 (м, 2H), 4,78 (кв, J=6,9 Гц, 1H), 7,17-7,23 (м, 4H), 7,67-7,74 (м, 1H), 7,81-7,88 (м, 1H), 7,92-7,94 (м, 1H), 8,77 (с, 1H).
Выход 46%, точка плавления: от 141,0°C до 143,0°C.
Пример 4
3,4-дихлоро-N-[(R)-1-[4-этил-5(4-метилбензолсульфонил)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 57)
Формула 23

К раствору соединения (0,300 г) из примера 3-(2) в хлороформе (6 мл) добавляли м-хлорбензойную кислоту (0,329 г), после чего смесь перемешивалась при комнатной температуре 1 час. Затем добавляли следующую порцию м-хлорбензойной кислоты (0,329 г), после чего смесь перемешивалась при комнатной температуре в течение 15 часов. Затем добавляли следующую порцию м-хлорбензойной кислоты (0,329 г), после чего смесь перемешивалась при комнатной температуре в течение двух часов. После этого добавляли этилацетат и органическую фазу промывали 5% водным раствором Na2S2O3, затем - насыщенным водным раствором бикарбоната натрия, высушивали над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный остаток очищали способом колоночной хроматографии (на кислотном OH SiO2, гексан/этилацетат = от 70/30 до 40/60), а затем перекристаллизовывали для получения 0,196 г названного соединения (соединения 57) (бесцветное соединение в виде порошка).
1H-ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,25-1,35 (м, 6H), 2,45 (с, 3H), 4,23-4,40 (м, 2H), 4,78-4,86 (м, 1H), 7,52-7,56 (м, 2H), 7,62-7,67 (м, 1H), 7,78-7,82 (м, 1H), 7,86-7,94 (м, 3H).
Точка плавления: от 164,0°C до 165,0°C.
Пример 5
3,4-дихлоро-N-[(R)-1-[4-этил-5(4-метилбензил)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (Соединение 56)
Формула 24

т-Бутиловый эфир ((R)-1-этилкарбамоил-этил)-карбаминовой кислоты
Формула 25

(1) К раствору метилового эфира N-(т-бутоксикарбонил)-D-аланина (4,76 г) в метаноле (20 мл) добавляли 10 мл 70% водного раствора EtNH2, смесь перемешивалась при комнатной температуре в течение 19 часов. Реакционный раствор концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на кислотном OH SiO2, хлороформ/этилацетат = 10-50%) для получения 3,96 г названного соединения (бесцветного аморфного вещества).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,12 (т, J=7,2 Гц, 3H), 1,35 (д, J=7,2 Гц, 3H), 1,46 (с, 9H), 3,18-3,37 (м, 2H), 4,00-4,20 (м, 1H), 4,90-5,10 (м, 1H), 6,04-6,22 (м, 1H).
т-Бутиловый эфир ((R)-1-этилтиокарбамоил-этил)-карбаминовой кислоты
Формула 26

(2) К раствору соединения из примера 5-(1) (3,96 г) в ТГФ (92 мл) добавляли реагент Лоуссона (8,89 г), смесь перемешивалась при комнатной температуре в течение одного часа и при 50°С в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры, после чего нерастворимый осадок удаляли фильтрованием. Затем полученный остаток концентрировали. Полученный неочищенный продукт очищали способом колоночной хроматографии (на кислотном OH SiO2, хлороформ/этилацетат = 10-50%), а затем с помощью колоночной хроматографии на NH-силикагеле (этилацетат/гексан = 50%) для получения названного соединения (3,75 г) в виде бесцветного порошка.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,26 (т, J=7,2 Гц, 3H), 1,38-1,52 (м, 3H), 1,45 (с, 9H), 3,60-3,77 (м, 2H), 4,36-4,53 (м, 1H), 5,10-5,32 (м, 1H), 7,99-8,24 (м, 1H).
т-Бутиловый эфир [(R)-1-[4-этил-5(4-метилбензил)-4Н-[1,2,4]триазол-3-ил]-этил]-карбаминовой кислоты
Формула 27

(3) К раствору соединения, полученного в примере 5-(2), (1,61 г) и гидразида 4-метилфенилуксусной кислоты (1,25 г) в CH3CN (30 мл) добавляли 2,43 г Hg (OAc)2, после чего смесь перемешивалась при комнатной температуре в течение 42 часов. К реакционному раствору добавляли этилацетат, после чего нерастворимый осадок удаляли фильтрованием через целлит. Фильтрат промывали 1н. водным раствором KHSO4, а затем насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали способом колоночной хроматографии (на кислотном OH SiO2, этилацетат/гексан = 50-100%, метанол/хлороформ = 1/1) (на нейтральном OH SiO2, метанол/хлороформ=1/10) для получения 0,530 г названного соединения (бесцветного аморфного вещества).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,04 (т, J=7,3 Гц, 3H), 1,41 (с, 9H), 1,61 (д, J=6,9 Гц, 3H), 2,30 (с, 3H), 3,73-3,90 (м, 2H), 4,06-4,20 (м, 2H), 4,85-4,94 (м, 1H), 5,11-5,17 (м, 1H), 7,09 (с, 4H).
(R)-1-[4-этил-5-(4-метилбензил)-4Н-[1,2,4]триазол-3-ил]-этиламин
Формула 28
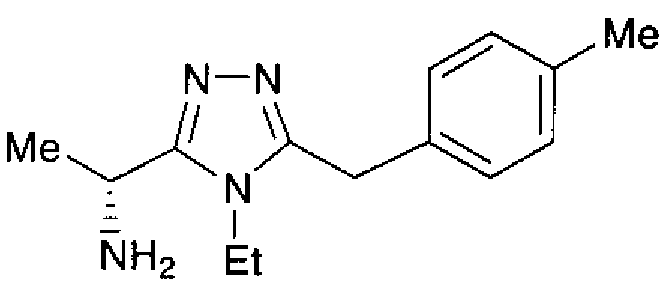
(4) К раствору соединения из примера 5-(3) (0,496 г) в хлороформе (5 мл) добавляли трифторуксусную кислоту (5 мл), после чего смесь перемешивалась при комнатной температуре в течение 18 часов. Затем добавляли водный раствор гидроксида натрия (1,0 н.) и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя, таким образом получали 0,148 г названного соединения в виде бесцветного маслянистого соединения.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,09 (т, J=7,3 Гц, 3H), 1,57 (д, J=6,9 Гц, 3H), 2,30 (с, 3H), 3,74-3,94 (м, 2H), 4,01-4,20 (м, 3H), 7,10 (с, 4H).
3,4-дихлоро-N-[(R)-1-[4-этил-5(4-метилбензил)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 56)
Формула 29

(5) К раствору соединения, полученного в примере 5-(4), (0,144 г) в ТГФ (3 мл) добавляли 0,25 мл триэтиламина и 0,707 мл 3,4-дихлорбензолсульфонилхлорида, после чего смесь перемешивалась при комнатной температуре в течение 3,5 часов. Затем добавляли 2н. водный раствор соляной кислоты, после чего смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный остаток очищали способом колоночной хроматографии (на кислотном OH SiO2, хлороформ/метанол = от 50/1 до 10/1), после чего перекристаллизовывали (этилацетат-гексан) для получения 0,100 г названного соединения (соединения 56) в виде бесцветного порошка.
1H-ЯМР (600 МГц, ДМСО-d6) δ м.д.: 0,91 (т, J=7,1 Гц, 3H), 1,26 (д, J=6,9 Гц, 3H), 2,23 (с, 3H), 3,77-3,92 (м, 2H), 4,00 (с, 2H), 4,60-4,70 (м, 1H), 7,03-7,12 (м, 4H), 7,64-7,68 (м, 1H), 7,79-7,82 (м, 1H), 7,89-7,91 (м, 1H), 8,64 (с, 1H).
Точка плавления: от 189,0°C до 191,0°C.
Пример 6
3,4-дихлоро-N-[(R)-1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-N-метил-бензолсульфонамид (соединение 115)
Формула 30
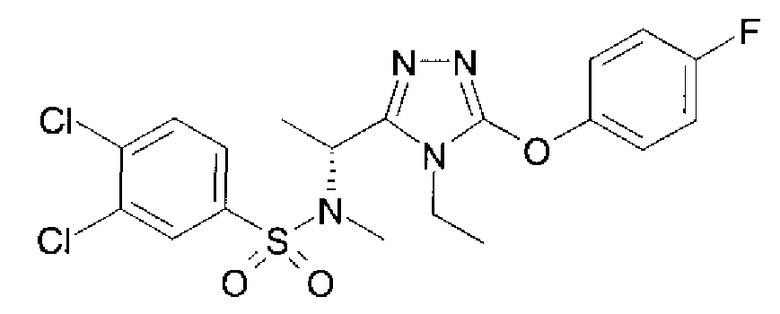
К раствору соединения 12 (150 мг) из примера 1 в диметилформамиде (2,0 мл) при комнатной температуре добавляли 78 мг K2CO3 и 0,22 мл MeI, после чего смесь перемешивалась при комнатной температуре в течение трех часов. К реакционному раствору добавляли воду, после чего смесь экстрагировали смешанным раствором из метанола и хлороформа (метанол/хлороформ = 1/4). Полученную органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали (MgSO4), фильтровали и выпаривали при пониженном давлении для удаления растворителя. После элюции остатка смешанным растворителем, состоящим из этилацетата и гексана, полученный элюат очищали способом колоночной хроматографии (на кислотном OH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 0-10%), после чего перекристаллизовывали (этилацетат-гексан) для получения 111 мг названного соединения в виде бесцветного порошка.
Точка плавления: от 125,5°C до 126,5°C.
Пример 7
3,4-дихлоро-N-((R)-1-[5-[3-(1,4-диокса-8-аза-спиро[4,5]декан-8-ил)-фенокси]-4-этил-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 87)
Формула 31
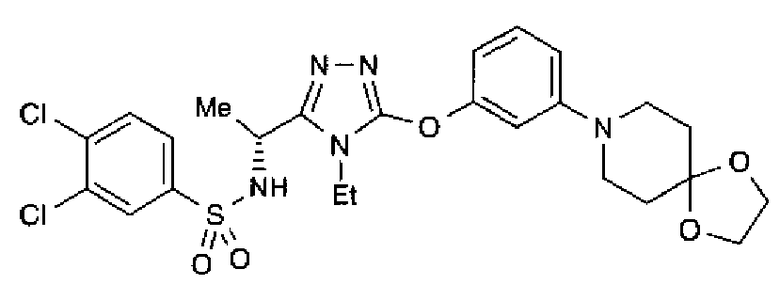
3-(1,4-диокса-8-аза-спиро[4,5]декен-8-ил)-фенол
Формула 32

3-бромфенол (1,50 г), 1,4-диокса-8-азаспиро[4,5]декан (1,49 г), Pd2(dba)3 (0,079 г), (2'-дициклогексилфосфанил-бифенил-2-ил)-диметиламин (0,082 г) и LiN(TMS)2 (20% раствор в ТГФ, 18 мл) помещали в устойчивую к давлению пробирку с завинчивающейся крышкой, после чего смесь перемешивалась при 65°C в течение 7,5 часов. Добавляли этилацетат, после чего органическую фазу промывали 1н. водным раствором соляной кислоты, а затем - насыщенным водным раствором бикарбоната натрия, высушивали над безводным сульфатом натрия, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный остаток очищали способом колоночной хроматографии (на кислотном OH SiO2, гексан/этилацетат = от 70/30 до 60/40) для получения 1,96 г названного соединения (коричневая маслянистая жидкость).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,79-1,83 (м, 4H), 3,27-3,35 (м, 4H), 3,98 (с, 4H), 4,86 (с, 1H), 6,28 (дд, J=8,0, 2,5 Гц, 1H), 6,41 (т, J=2,3 Гц, 1H), 6,51 (дд, J=8,5, 2,5 Гц, 1H), 7,08 (т, J=8,3 Гц, 1H).
(R)-1-[5-[3-(1,4-диокса-8-аза-спиро[4,5]декан-8-ил)-фенокси]-4-этил-4Н-[1,2,4]триазол-3-ил]-этиламин
Формула 33
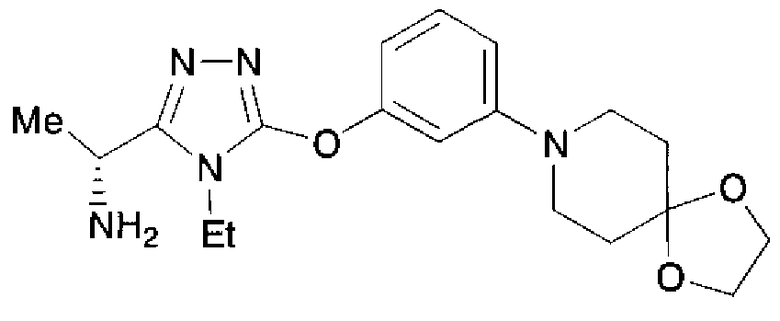
(2) Начиная с соединения, полученного в примере 7-(1), вместо 4-фторфенола, процедуру, сходную с использованной в примере 1-(7), повторяли для получения названного соединения (коричневое маслянистое вещество, выход 58%).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,38 (т, J=7,3 Гц, 3H), 1,57 (д, J=6,9 Гц, 3H), 1,77-1,83 (м, 4H), 3,27-3,36 (м, 4H), 3,95-4,06 (м, 6H), 4,14 (кв, J=6,9 Гц, 1H), 6,70-6,75 (м, 2H), 6,97 (т, J=2,3 Гц, 1H), 7,20 (т, J=8,3 Гц, 1H).
3,4-дихлоро-N-((R)-1-[5-[3-(1,4-диокса-8-аза-спиро[4,5]декан-8-ил)-фенокси]-4-этил-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 87)
Формула 34
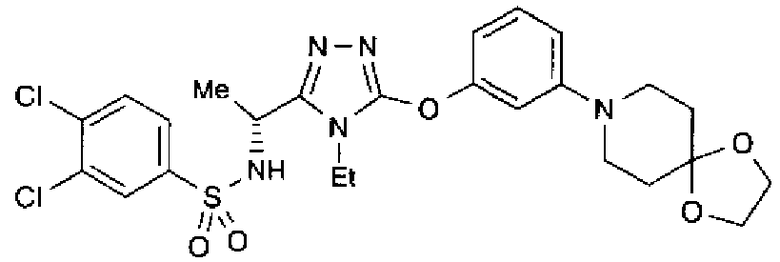
(3) Начиная с соединения, полученного в примере 7-(2), процедуру, сходную с использованной в примере 1-(8), повторяли для получения названного соединения (бесцветный порошок, выход 64%).
Точка плавления: от 174,0°C до 179,0°C.
Пример 8
3,4-дихлоро-N-((R)-1-[4-этил-5-[3-(4-оксо-пиперидин-1-ил)-фенокси]-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 88)
Формула 35

К раствору соединения из примера 7 (0,981 г) в ТГФ (10 мл) добавляли 8,4 мл 2н. водного раствора соляной кислоты, после чего смесь перемешивалась при комнатной температуре в течение одного часа. Затем добавляли концентрированную соляную кислоту (2 мл), после чего смесь перемешивалась при 50°C в течение шести часов. Насыщенный водный раствор бикарбоната натрия добавляли для нейтрализации, после чего смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над безводным сульфатом магния, фильтровали, после чего выпаривали при пониженном давлении для удаления растворителя. Полученный остаток очищали способом колоночной хроматографии (на кислотном OH SiO2, этилацетат), после чего перекристаллизовывали (хлороформ-гексан) для получения названного соединения (0,572 г, бесцветный порошок).
Точка плавления: от 188,5°C до 190,5°C.
Пример 9
3,4-дихлоро-N-((R)-1-[4-этил-5-[3-(4-гидрокси-пиперидин-1-ил)-фенокси]-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид
(соединение 93)
Формула 36
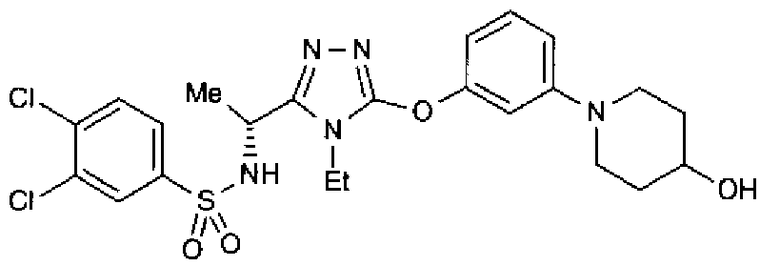
К раствору соединения из примера 8 (0,150 г) в метаноле (3,0 мл) при 0°C добавляли 0,021 г NaBH4, после чего смесь перемешивалась при комнатной температуре в течение 16 часов. Добавляли воду, после чего смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2 метанол/хлороформ = от 1/50 до 1/10), после чего перекристаллизовывали (этилацетат-гексан) для получения 0,113 г названного соединения (соединения 93) в виде бесцветного порошка.
Точка плавления: от 167,5°C до 169,5°C.
Пример 10
N-[(R)-1-[5-(3-амино-фенокси)-4-этил-4Н-[1,2,4]триазол-3-ил]-этил]-3,4-дихлорбензолсульфонамид (соединение 82)
Формула 37
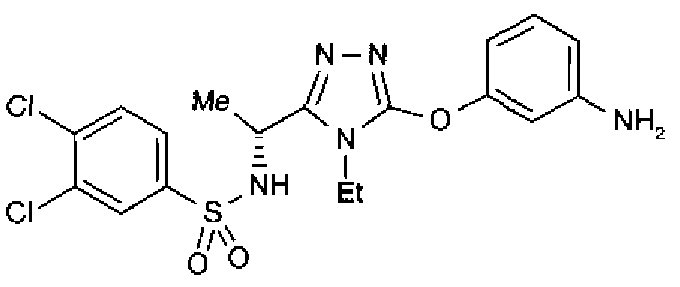
3-[5-((R)-1-амино-этил)-4-этил-4Н-[1,2,4]триазол-3-илокси]-фениламин
Формула 38

(1) Начиная с 3-аминофенола вместо 4-фторфенола, процедуру, аналогичную использованной в примере 1-(7), повторяли для получения названного соединения (коричневое маслянистое вещество, выход 99%).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,37 (т, J=7,1 Гц, 3H), 1,58 (д, J=6,9 Гц, 3H), 3,96-4,05 (м, 2H), 4,15 (кв, J=6,7 Гц, 1H), 6,45-6,50 (м, 1H), 6,62-6,67 (м, 1H), 6,71-6,75 (м, 1H), 7,11 (т, J=8,0 Гц, 1H).
N-[(R)-1-[5-(3-амино-фенокси)-4-этил-4Н-[1,2,4]триазол-3-ил]-этил]-3,4-дихлорбензолсульфонамид (соединение 82)
Формула 39

(2) К раствору соединения из примера 10-(1) (3,69 г) в ТГФ (15 мл) добавляли триэтиламин (4,16 мл) и 3,4-дихлоробензолсульфонилхлорид (3,73 г), смесь перемешивалась при комнатной температуре в течение ночи. Реакционный раствор концентрировали и полученный неочищенный продукт очищали способом колоночной хроматографии (NH SiO2, метанол/хлороформ), после чего перекристаллизовывали (этилацетат-гексан) для получения 3,60 г названного соединения (соединения 82) (бесцветного соединения в виде порошка).
Точка плавления: от 142,0°C до 145,0°C.
Пример 11
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-пиррол-1-ил-фенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-N-метил-бензолсульфонамид (соединение 86)
Формула 40

К раствору соединения из примера 10 (700 мг) в AcOH (4,6 мл) добавляли 2,5-диметокси-тетрагидрофуран (375 мкл), и смесь перемешивалась при температуре 130°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Затем добавляли воду и смесь экстрагировали метанолом/хлороформом (1/4). Затем органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный остаток очищали способом колоночной хроматографии (на кислотном OH SiO2, этилацетат/гексан = 33-100%, метанол/хлороформ = 5%), после чего перекристаллизовывали (этилацетат-гексан) для получения названного соединения (соединения 86) (173 мг, бесцветное соединение в виде порошка).
Точка плавления: от 176,0°C до 177,0°C.
Пример 12
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-формиламино-фенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 90)
Формула 41
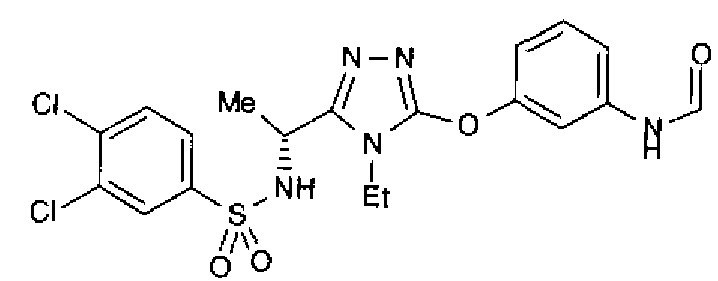
Смесь соединения, полученного в примере 10-(2), (300 мг) и этилформиата (1,1 мл) перемешивалась в течение 24 часов при 105°C. Реакционный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученный грубый неочищенный продукт очищали способом колоночной хроматографии (на кислотном OH SiO2, этилацетат/гексан = 50%-100%, метанол/хлороформ = 5%), после чего перекристаллизовывали (этилацетат-гексан) для получения названного соединения (соединения 90) (81 мг, бесцветный порошок).
Точка плавления: от 168,0°C до 170,0°C.
Пример 13
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-уреидо-фенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 91)
Формула 42

Смесь из соединения (300 мг), полученного в примере 10-(2), цианата калия (65 мг), AcOH (1,0 мл) и воды (0,5 мл) перемешивалась при комнатной температуре в течение одного часа. Добавляли воду, после чего смесь экстрагировали метанолом/хлороформом (1/4). Органическую фазу высушивали над MgSO4, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали способом колоночной хроматографии (на кислотном OH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 0,3%), после чего перекристаллизовывали (этилацетат-гексан) для получения названного соединения (соединения 91) (273 мг, бесцветный порошок).
Точка плавления: от 137,0°C до 138,0°C.
Пример 14
3,4-Дихлоро-N-((R)-1-[5-[3-(3,3-диметилуреидо)-фенокси]-4-этил-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 97)
Формула 43

К раствору соединения из примера 10-(2) (300 мг) и триэтиламина (368 мкл) в хлороформе (1,1 мл) добавляли 146 мкл хлорида диметилкарбамила (146 мкл), и смесь перемешивалась при комнатной температуре в течение трех часов. Реакционный раствор концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 0-3%), после чего перекристаллизовывали (этилацетат-гексан) для получения названного соединения (соединения 97) (93 мг, бесцветный порошок).
Точка плавления: от 158,0°C до 159,0°C.
Пример 15
3,4-Дихлоро-N-((R)-1-[4-этил-5-[3-(3-этилуреидо)-фенокси]-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 92)
Формула 44

К раствору соединения из примера 10-(2) (300 мг) в хлороформе (1,1 мл) добавляли этилизоцианат (63 мкл), и смесь перемешивалась при комнатной температуре в течение одного часа. Реакционный раствор концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 0-3%), после чего перекристаллизовывали (этилацетат-гексан) для получения названного соединения (соединения 97) (228 мг, бесцветный порошок).
Точка плавления: от 118,0°C до 120,0°C.
Пример 16
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-метансульфониламинофенокси)-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 102)
Формула 45

К раствору соединения из примера 10-(2) (300 мг) в пиридине (1,32 мл) добавляли метансульфонилхлорид (114 мг), после чего смесь перемешивалась при комнатной температуре в течение трех часов. Добавляли 1н. соляную кислоту, после чего смесь экстрагировали метанолом/хлороформом (1/4). Органическую фазу высушивали Na2SO4, фильтровали и концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 0-5%), после чего перекристаллизовывали (этилацетат-гексан) для получения названного соединения (соединения 102) (281 мг, бесцветный порошок).
Точка плавления: от 117,0°C до 118,0°C.
Пример 17
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-гидроксифенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 114)
Формула 46
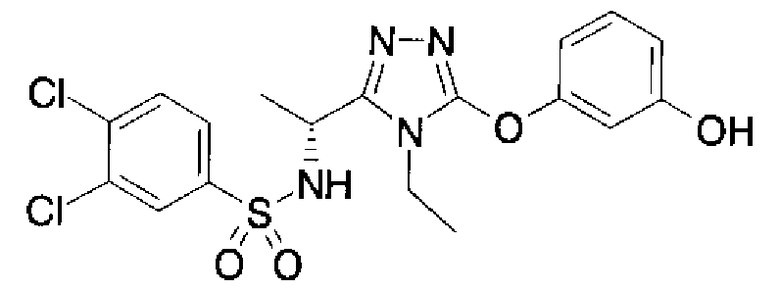
(R)-1-[5-(3-бензилокси-фенокси)-4-этил-4Н-[1,2,4]триазол-3-ил]-этиламин
Формула 47

(1) Начиная с 3-бензилоксифенола вместо 4-фторфенола, процедуру, сходную с использованной в примере 1-(7), повторяли для получения названного соединения (коричневое маслянистое вещество, выход 84%).
1H-ЯМР (600 МГц, CDCl3), δ м.д.: 1,39 (т, J=7,3 Гц, 3H), 1,60 (д, J=6,4 Гц, 3H), 3,96-4,09 (м, 2H), 4,17 (кв, J=6,9 Гц, 1H), 5,06 (с, 2H), 6,79-6,84 (м, 1H), 6,91-6,96 (м, 1H), 7,04-7,08 (м, 1H), 7,22-7,46 (м, 6H).
3-[5-((R)-1-аминоэтил)-4-этил-4Н-[1,2,4]триазол-3-илокси]-фенол
Формула 48

(2) Суспензию соединения (1,5 г) из примера 17-(1) и Pd(OH)2/C (150 мг, Pd 20% по весу) в метаноле (4,0 мл) перемешивали при комнатной температуре в течение дня в атмосфере водорода (приблизительно 1 атмосферное давление). Реакционную смесь фильтровали через целлит и выпаривали для удаления растворителя. Полученный грубый неочищенный продукт очищали способом колоночной хроматографии (на NH SiO2, метанол/хлороформ = 0-25%) для получения названного соединения (серое аморфное вещество, 323 мг).
1H-ЯМР (600 МГц, ДМСО-d6), δ м.д.: 1,23 (т, J=7,3 Гц, 3H), 1,54 (д, J=6,9 Гц, 3H), 3,82-4,09 (м, 2H), 4,60 (кв, J=6,0 Гц, 1H), 6,61-6,69 (м, 2H), 6,70-6,77 (м, 1H), 7,14-7,21 (м, 1H), 8,28-9,11 (м, 2H), 9,43-10,55 (м, 1H).
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-гидроксифенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 114)
Формула 49

(3) К раствору соединения из примера 17-(2) (200 мг) в ТГФ (2,0 мл) при комнатной температуре добавляли триэтиламин (0,255 мл) и 3,4-дихлорбензолсульфонилхлорид (198 мг), и смесь перемешивалась при комнатной температуре в течение 12 часов. Смесь выпаривали для удаления растворителя, после чего к полученному неочищенному продукту добавляли KOH (104 мг), этанол (4,0 мл) и воду (4,0 мл). Смесь перемешивалась при 120°C в течение 40 минут, после чего охлаждалась до комнатной температуры. Добавляли 1н. HCl, после чего смесь экстрагировали смешанным раствором метанола/хлороформа (метанол/хлороформ = 1/4), высушивали (MgSO4), фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали способом колоночной хроматографии (на кислом OH SiO2, этилацетат/гексан = 30-70%), после чего перекристаллизовывали (метанол/хлороформ/гексан) для получения 37 мг названного соединения (соединения 114) в виде бесцветного порошка.
Точка плавления: от 185,0°C до 186,0°C.
Пример 18
т-Бутиловый эфир 3-[5-[(R)-1-(3,4-дихлорбензолсульфониламино)-этил]-4-этил-4Н-[1,2,4]триазол-3-илокси]бензойной кислоты (соединение 118)
Формула 50

т-Бутиловый эфир 3-[5-((R)-1-аминоэтил)-4-этил-4Н-[1,2,4]триазол-3-илокси]бензойной кислоты
Формула 51
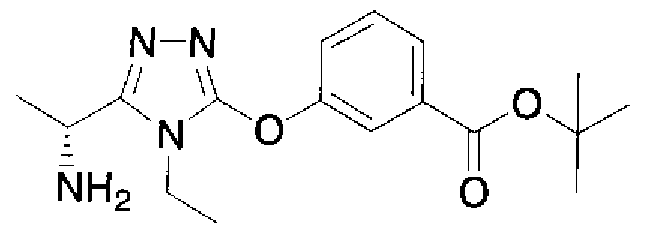
(1) Начиная с т-бутилового эфира 3-гидроксибензойной кислоты вместо 4-фторфенола, процедуру, сходную с использованной в примере 1-(7), повторяли для получения названного соединения (бесцветное маслянистое вещество, выход 24%).
1H-ЯМР (600 МГц, CDCl3), δ м.д.: 1,43 (т, J=7,1 Гц, 3H), 1,58-1,62 (м, 12H), 4,01-4,13 (м, 2H), 4,18 (кв, J=6,6 Гц, 1H), 7,42-7,46 (м, 1H), 7,61-7,65 (м, 1H), 7,82-7,85 (м, 1H), 7,87-7,91 (м, 1H).
т-Бутиловый эфир 3-[5-[(R)-1-(3,4-дихлорбензолсульфониламино)-этил]-4-этил-4Н-[1,2,4]триазол-3-илокси]бензойной кислоты (соединение 118)
Формула 52

(2) Начиная с соединения, полученного в примере 18-(1), процедуру, сходную с использованной в примере 1-(8), повторяли для получения названного соединения (бесцветный порошок, выход 68%).
1H-ЯМР (600 МГц, CDCl3), δ м.д.: 1,38 (т, J=7,3 Гц, 3H), 1,51 (д, J=6,9 Гц, 3H), 1,58 (с, 9H), 3,93-4,01 (м, 2H), 4,29-4,35 (м, 1H), 7,43-7,48 (м, 1H), 7,50-7,60 (м, 3H), 7,64-7,69 (м, 1H), 7,81-7,89 (м, 2H), 7,90-7,94 (м, 1H).
Пример 19
3-[5-[(R)-1-(3,4-дихлорбензолсульфониламино)-этил]-4-этил-4Н-[1,2,4]триазол-3-илокси]бензойная кислота (соединение 113)
Формула 53
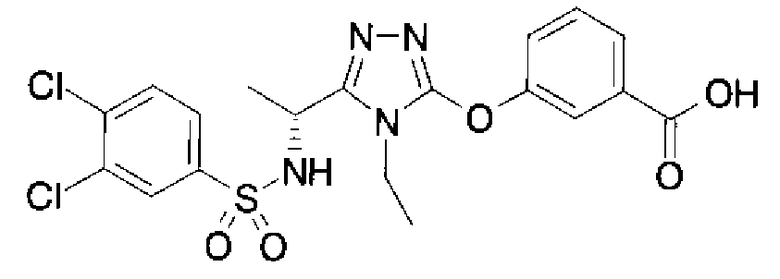
К раствору соединения из примера 18 (260 мг) в хлороформе (12,0 мл) добавляли трифторуксусную кислоту, и смесь перемешивалась при комнатной температуре в течение пяти дней. Смесь выпаривали для удаления растворителя, полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2, этилацетат/гексан = 50-99%, метанол/хлороформ = 0-20%), после чего перекристаллизовывали (метанол/хлороформ/гексан) для получения названного соединения (соединения 113) (101 мг, бесцветный порошок).
Точка плавления: от 183,0°C до 185,0°C.
Пример 20
N-[(R)-1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-4-метоксибензолсульфонамид (соединение 175)
Формула 54

К раствору соединения из примера 1-(7) (12,5 мг) в ТГФ (0,3 мл) добавляли триэтаноламин (25 мкл), а затем раствор 4-метоксибензолсульфонилхлорида (15,5 мг) в ТГФ (0,3 мл). Смесь перемешивалась при комнатной температуре в течение двух часов. В реакционную смесь добавляли PSA (название продукта VARIAN Inc. polymer supported amine, 1,4 мэкв/г) (75 мкл), и смесь перемешивалась при комнатной температуре в течение 12 часов. Нерастворимые частицы удаляли фильтрованием, полученный остаток выпаривали для удаления растворителя. Полученный неочищенный продукт очищали способом колоночной хроматографии (на кислом OH SiO2, этилацетат/гексан = 50-100%, метанол/хлороформ = 10%) для получения 10,7 мг названного соединения (соединения 175) в виде бесцветного порошка.
APCI MS (M-H)-: 419, APCI MS (M+H)+: 421.
Пример 21
3,4-Дихлоро-N-((R)-1-[4-этил-5-[3-(4-метил-пиперазин-1-ил)-фенокси]-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 45)
Формула 55
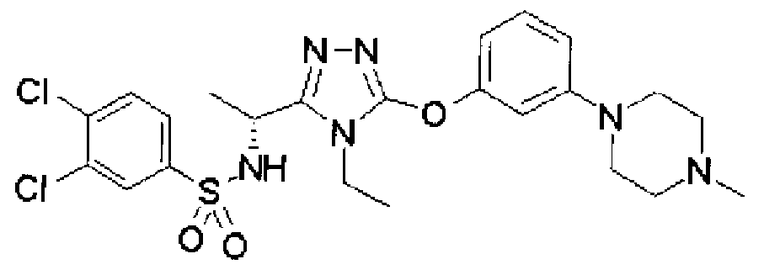
(1) Следующее соединение получали процедурой, сходной с той, что использовалась в примере 1-(7) (процедура будет детально описана ниже).
(R)-1-[4-Этил-5-[3-(4-метил-пиперазин-1-ил)-фенокси]-4Н-[1,2,4]триазол-3-ил]-этиламин
Формула 56
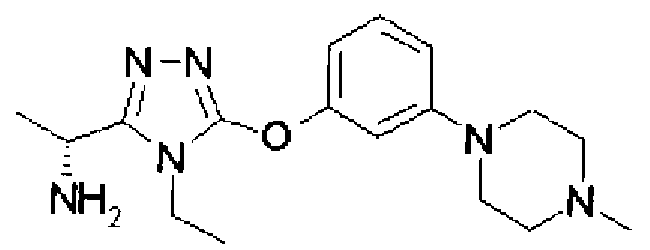
В устойчивой к давлению пробирке с завинчивающейся крышкой к соединению, полученному в примере 1-(6), (750 мг) добавляли N,N'-диметилпропилмочевину (ДМПМ) (4,0 мл), 3-(4-метил-пиперазин-1-ил)-фенол (500 мг) и карбонат цезия (2,21 г), после чего смесь перемешивалась при 160°C в течение трех часов. Реакционную смесь охлаждали до комнатной температуры, после чего добавляли насыщенный водный раствор хлорида натрия. Смесь экстрагировали этилацетатом. Органическую фазу высушивали над безводным сульфатом натрия, фильтровали и выпаривали при пониженном давлении для удаления растворителя. Полученный неочищенный продукт очищали способом колоночной хроматографии (на NH SiO2, хлороформ/метанол = 50/1-30/1) для получения названного соединения (в виде желтого маслянистого соединения, 427 мг).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,40 (т, J=7,3 Гц, 3H), 1,59 (д, J=6,9 Гц, 3H), 2,35 (с, 3H), 2,52-2,61 (м, 4H), 3,22-3,27 (м, 4H), 3,97-4,08 (м, 2H), 4,15 (кв, J=6,9 Гц, 1H), 6,71-6,80 (м, 2H), 6,99-7,03 (м, 1H), 7,20-7,25 (м, 1H).
(2) Следующее соединение получали процедурой, сходной с той, что использовалась в примере 1-(8) (процедура будет детально описана ниже).
3,4-Дихлоро-N-((R)-1-[4-этил-5-[3-(4-метил-пиперазин-1-ил)-фенокси]-4Н-[1,2,4]триазол-3-ил]-этил)-бензолсульфонамид (соединение 45)
Формула 57

К раствору соединения из примера 21-(1) (427 мг) в ТГФ (8 мл) при комнатной температуре добавляли триэтиламин (0,41 мл) и 3,4-дихлорбензолсульфонилхлорид (0,232 мл), и смесь перемешивалась при комнатной температуре в течение ночи. Реакционную смесь концентрировали, полученный остаток очищали способом колоночной хроматографии (на NH SiO2, хлороформ/метанол = 50/1-30/1), после чего перекристаллизовывали (этилацетат-гексан) для получения 280 мг названного соединения (соединения 45) в виде бесцветного порошка.
Точка плавления: от 194,0°C до 196,0°C.
Пример 22
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(1Н-индол-6-илокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 64)
Формула 58
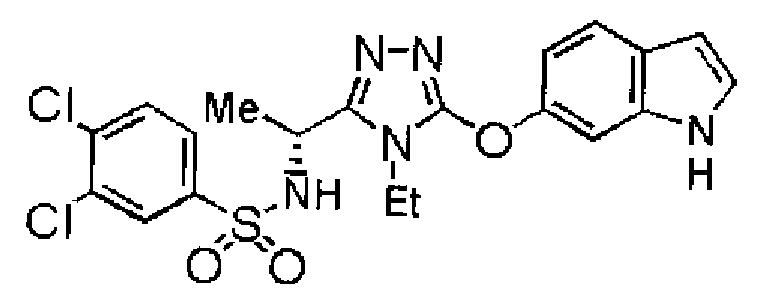
(1) Следующее соединение получали процедурой, сходной с той, что использовалась в примере 1-(7) (процедура будет детально описана ниже).
(R)-1-[4-Этил-5-(1Н-индол-6-илокси)-4Н-[1,2,4]триазол-3-ил]-этиламин
Формула 59
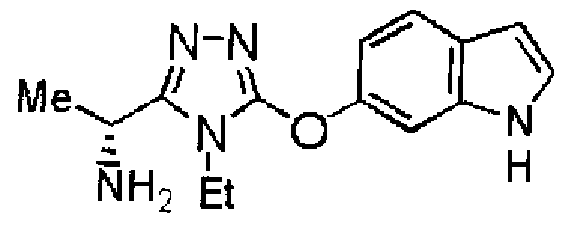
В устойчивой к давлению пробирке с завинчивающейся крышкой к соединению, полученному в примере 1-(6), (1,00 г) добавляли N,N'-диметилпропилмочевину (ДМПМ) (5,0 мл), 1Н-индол-6-ол (601 мг) и карбонат цезия (2,94 г), после чего смесь перемешивалась при 200°C в течение одного часа, а затем охлаждалась до комнатной температуры. Добавляли насыщенный раствор хлорида натрия, затем смесь экстрагировали этилацетатом. Органическую фазу высушивали (MgSO4), фильтровали и выпаривали при пониженном давлении для удаления растворителя. Затем полученный неочищенный продукт очищали способом колоночной хроматографии (NH SiO2, хлороформ/метанол = 50/1-30/1) для получения названного соединения (в виде желтого маслянистого соединения, 750 мг).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,42 (т, J=7,1 Гц, 3H), 1,58 (д, J=6,4 Гц, 3H), 3,98-4,10 (м, 2H), 4,15 (кв, J=6,7 Гц, 1H), 6,30-6,39 (м, 1H), 6,87-7,00 (м, 2H), 7,39-7,52 (м, 2H), 9,55 (с, 1H).
(2) Следующее соединение получали процедурой, сходной с той, что использовалась в примере 1-(8) (процедура будет детально описана ниже).
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(1Н-индол-6-илокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 64)
Формула 60

К раствору соединения из примера 22-(1) (748 мг) в ТГФ (10,0 мл) при комнатной температуре добавляли триэтиламин (0,77 мл) и 3,4-дихлорбензолсульфонилхлорид (1,02 г), и смесь перемешивалась при комнатной температуре в течение ночи. Реакционную смесь концентрировали, полученный остаток очищали способом колоночной хроматографии (на NH SiO2, хлороформ/метанол = 30/1), после чего перекристаллизовывали (CHCl3/MeOH/гексан) для получения 815 мг названного соединения (соединения 64) в виде бесцветного порошка.
Точка плавления: от 223,0°C до 224,0°C.
Пример 23
N-[(S)-2-Бензилокси-1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-3,4-дихлорбензолсульфонамид (соединение 695)
Формула 61

Начиная с метилового эфира (R)-2-амино-3-бензилокси-пропионовой кислоты вместо метилового эфира N-(т-бутоксикарбонил)-D-аланина, использованного в примере 1-(1), процедуру, сходную с использованной в примере 1, повторяли для получения названного соединения (соединения 695) в виде бесцветного порошка.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,31 (т, J=7,3 Гц, 3H), 3,65-4,03 (м, 4H), 4,35 (с, 2H), 4,67 (кв, J=7,9 Гц, 1H), 7,03-7,39 (м, 10 H), 7,68 (дд, J=8,8, 2,2 Гц, 1H), 7,93 (д, J=2,2 Гц, 1H).
Пример 24
3,4-Дихлоро-N-[(S)-1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-2-гидроксиэтил]-бензолсульфонамид (соединение 696)
Формула 62

К раствору соединения из примера 23 (69 мг) в CH2Cl2 (2,0 мл) добавляли AlCl3 (49 мг) и PhNMe2 (148 мг), и смесь перемешивалась при комнатной температуре в течение одного часа. Затем добавлен AcOEt, после чего смесь промывали 1н. соляной кислотой и насыщенным водным раствором хлорида натрия. Органическую фазу высушивали (Na2SO4), фильтровали и выпаривали при пониженном давлении для удаления растворителя. Затем полученный неочищенный продукт очищали способом колоночной хроматографии (на OH SiO2, AcOEt/гексан = 2/1) для получения 54 мг названного соединения (соединения 696) в виде бесцветного порошка.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,41 (т, J=7,5 Гц, 3H), 3,62 (дд, J=4,8, 11,8 Гц, 1H), 3,88 (дд, J=4,8, 11,8 Гц, 1H), 4,05 (кв, J=7,5 Гц, 2H), 4,51-4,60 (м, 1H), 7,04-7,13 (м, 2H), 7,23-7,31 (м, 3H), 7,53 (д, J=8,8 Гц, 1H), 7,70 (дд, J=8,8, 2,2 Гц, 1H), 7,93 (д, J=2,2 Гц, 1H).
Пример 25
3,4-Дихлоро-N-[(S)-1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-2-фторэтил]-бензолсульфонамид (соединение 689)
Формула 63

К раствору соединения из примера 24 (45 мг) в CH2Cl2 (2,0 мл) добавляли при 0°C раствор диэтиламиносульфотрифторида (ДАСТ) (16 мг) в CH2Cl2 (1,0 мл), и смесь перемешивалась при той же температуре в течение одного часа. Затем реакционный раствор добавляли к насыщенному водному раствору бикарбоната натрия, после чего смесь экстрагировали AcOEt. Органическую фазу высушивали (Na2SO4), фильтровали и выпаривали при пониженном давлении для удаления растворителя. Затем полученный неочищенный продукт очищали способом колоночной хроматографии (на OH SiO2, AcOEt/гексан = 30-50%) для получения 6 мг названного соединения (соединения 689) в виде бледно-желтого порошка.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,39 (т, J=7,5 Гц, 3H), 4,01 (кв, J=7,5 Гц, 2H), 4,45-4,86 (м, 3H), 6,98 (ушир, 1H), 7,05-7,36 (м, 4H), 7,48 (д, J=8,5 Гц, 1H), 7,69 (дд, J=8,5, 2,2 Гц, 1H), 7,93 (д, J=2,2 Гц, 1H).
Пример 26
3,4-Дихлоро-N-[1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-2,2,2-трифторэтил]-бензолсульфонамид (соединение 687)
Формула 64

Этиловый эфир 4-этил-5-меркапто-4Н-[1,2,4]триазол-3-карбоновой кислоты
Формула 65
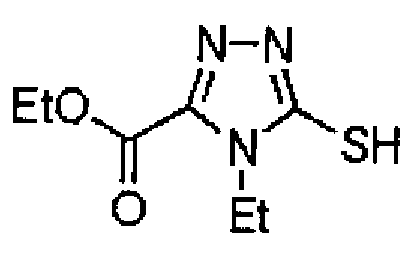
(1) К раствору диэтилформиата (48,64 г) в MeOH (100 мл) добавляли по каплям при -5°C в течение 1,5 часов раствор моногидрата гидразина (16,33 г) в MeOH (100 мл), затем при той же температуре добавляли этилизотиоцианат (29,00 г). Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Нерастворимое вещество удаляли фильтрованием, полученный остаток выпаривали для удаления растворителя. Полученное твердое вещество промывали смешанным раствором из гексана/AcOEt (1/1) и высушивали, полученный белый порошок (55,30 г) добавляли к 228 мл водного раствора NaOH (913 мг). Смесь перемешивалась при 70°C в течение четырех часов, при комнатной температуре в течение ночи, а затем при 100°C в течение семи часов. Реакционную смесь концентрировали до приблизительно 1/3, после чего добавляли насыщенный водный раствор NH4Cl (300 мл). Полученный белый преципитат отфильтровывали и высушивали для получения названного соединения (15,06 г) в виде бесцветного порошка.
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,38 (т, J=6,6 Гц, 3H), 1,45 (т, J=6,5 Гц, 3H), 4,40-4,57 (м, 4H), 11,58-11,84 (м, 1H).
Этиловый эфир 4-этил-5-метансульфанил-4Н-[1,2,4]триазол-3-карбоновой кислоты
Формула 66

(2) Начиная с соединения, полученного в примере 26-(1), процедуру, сходную с использованной в примере 1-(4), повторяли для получения названного соединения виде светло-желтого твердого вещества (выход 84%).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,31-1,50 (м, 6H), 2,80 (с, 3H), 4,31 (кв, J=7,2 Гц, 2H), 4,47 (кв, J=7,1 Гц, 2H).
Этиловый эфир 4-этил-5-метансульфонил-4Н-[1,2,4]триазол-3-карбоновой кислоты
Формула 67

(3) Начиная с соединения, полученного в примере 26-(2), процедуру, сходную с использованной в примере 1-(5), повторяли для получения названного соединения в виде светло-желтого твердого вещества (выход 84%).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,48 (т, J=7,1 Гц, 3H), 1,53 (т, J=7,2 Гц, 3H), 3,60 (с, 3H), 4,53 (кв, J=7,1 Гц, 2H), 4,75 (кв, J=7,2 Гц, 2H).
Этиловый эфир 4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-карбоновой кислоты
Формула 68
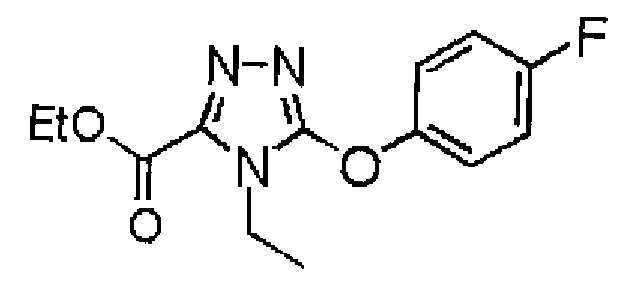
(4) К суспензии NaH (1,236 г, без масла) в ТГФ (68 мл) при 0°C добавляли 4-фторфенол (4,62 г), смесь нагревали до комнатной температуры и перемешивали в течение 30 минут. Реакционную смесь охлаждали до 0°С и добавляли раствор соединения (8,49 г), полученного в примере 26-(3), в ТГФ (20 мл). Смесь перемешивали при комнатной температуре 30 минут, а затем при 70°C в течение 1,5 часов. Температуру уменьшали до комнатной, после чего реакционную смесь добавляли к насыщенному водному раствору NH4Cl (500 мл). Смесь экстрагировали AcOEt (500 мл) и промывали насыщенным водным раствором хлорида натрия. Органическую фазу высушивали (MgSO4), фильтровали и концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на кислом OH SiO2, AcOEt/гексан = 10-99%) для получения названного соединения (5,144 г, светло-желтое твердое вещество).
1H-ЯМР (200 МГц, CDCl3) δ м.д.: 1,35-1,52 (м, 6H), 4,36 (кв, J=7,2 Гц, 2H), 4,48 (кв, J=7,2 Гц, 2H), 7,02-7,18 (м, 2H), 7,28-7,48 (м, 2H).
4-Этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-карбальдегид
Формула 69

(5) К раствору соединения из примера 26-(4) (5,00 г) в ТГФ (50 мл) при -5°C добавляли DiBAl-H (0,99 M раствор в толуоле, 36,1 мл), после чего смесь перемешивалась при той же температуре в течение трех часов. Затем к реакционному раствору добавляли 1н. соляную кислоту, после чего смесь экстрагировали AcOEt. Органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали (MgSO4), фильтровали и концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2, AcOEt /гексан = 5-40%) для получения названного соединения (2,22 г, бесцветного и маслянистого).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,44 (т, J=7,3 Гц, 3H), 4,37 (J=7,3 Гц, 2H), 7,10-7,17 (м, 2H), 7,36-7,40 (м, 2H).
4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-илметиленамид 4-метилбензол сульфоновой кислоты
Формула 70
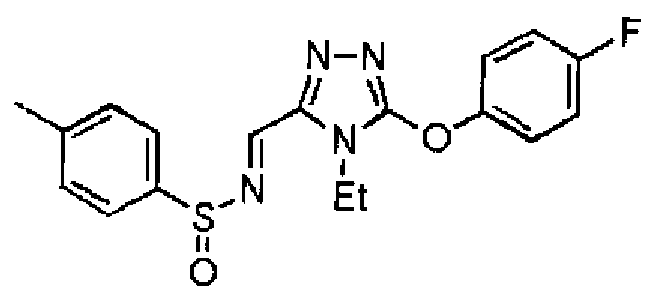
(6) Раствор соединения (1,00 г), полученного в примере 26-(5), амида 4-метилбензол сульфоновой кислоты (660 мг) и карбоната цезия (1,39 г) в хлороформе (21 мл) подвергали перемешиванию при 45°C в течение девяти часов. Реакционный раствор фильтровали через целлит и фильтрат концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (на нейтральном OH SiO2, AcOEt/гексан = 0-30%) для получения названного соединения (630 мг) в виде желтоватого твердого вещества.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,30 (т, J=7,1 Гц, 3H), 2,42 (с, 3H), 4,27-4,43 (м, 2H), 7,07-7,15 (м, 2H), 7,31-7,39 (м, 4H), 7,57-7,62 (м, 2H), 8,85 (с, 1H).
N-[1-[4-Этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-2,2,2-трифторэтил]-4-метилбензамид
Формула 71
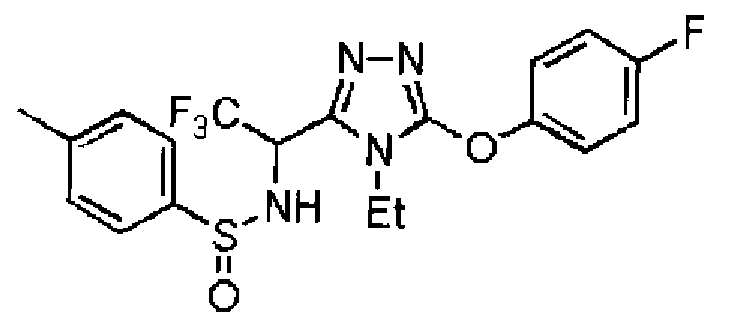
(7) Раствор (трифторметил)триметилсилана (120 мкл) в ТГФ (5,0 мл) добавляли при -35°C в атмосфере аргона к суспензии соединения (200 мг) из примера 26-(6) и тетраметилфторида (60 мг) в ТГФ (5,0 мл), после чего смесь перемешивалась при той же температуре в течение полутора часов. Следующую порцию тетраметилфторида (60 мг) и следующую порцию (трифторметил)триметилсилана (60 мг) добавляли к реакционному раствору при той же температуре, и смесь перемешивалась при той же температуре в течение двух часов, после чего нагревали до -10°C, добавляли насыщенный водный раствор хлорида аммония и водную фазу экстрагировали этилацетатом. Органическую фазу высушивали над сульфатом магния и фильтровали, затем фильтрат концентрировали. Полученный остаток очищали способом колоночной хроматографии (на нейтральном OH SiO2, AcOEt/гексан = 0-40) для получения названного соединения (219 мг) в виде желтоватого маслянистого вещества.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,32 (т, J=7,3 Гц, 3H), 2,40 (с, 3H), 3,80-3,87 (м, 2H), 4,86-4,92 (м, 1H), 5,59 (д, J=8,3 Гц, 1H), 7,06-7,13 (м, 2H), 7,27-7,31 (м, 2H), 7,32-7,37 (м, 2H), 7,53-7,59 (м, 2H).
1-[4-Этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-2,2,2-трифторэтиламин
Формула 72

(8) К раствору соединения из примера 26-(7) (215 мг) в метаноле (5,0 мл) при комнатной температуре добавляли HCl (4н., раствор в диоксане, 1,25 мл), после чего смесь перемешивалась при 85°C в течение двух часов. Реакционный раствор концентрировали, полученный остаток очищали способом колоночной хроматографии (на NH SiO2, AcOEt/гексан = 0-50%) для получения названного соединения (82 мг) в виде бесцветного маслянистого вещества.
(600 МГц, CDCl3) δ м.д.: 1,43 (т, J=7,3 Гц, 3H), 3,97-4,11 (м, 2H), 4,47-4,54 (м, 1H), 7,06-7,12 (м, 2H), 7,35-7,40 (м, 2H).
3,4-Дихлоро-N-[1-[4-этил-5-(4-фторфенокси)-4Н-[1,2,4]триазол-3-ил]-2,2,2-трифторэтил]-бензолсульфонамид (соединение 687)
Формула 73
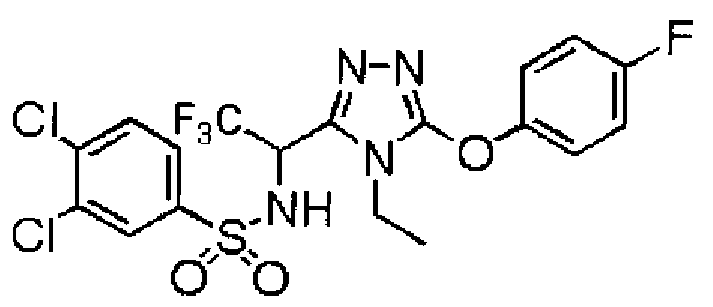
(9) Начиная с полученного в примере 26-(8) соединения, процедуру, сходную с использованной в примере 1-(8), повторяли для получения названного соединения (3 мг) в виде светло-желтого маслянистого вещества.
(600 МГц, CDCl3) δ м.д.: 1,43 (т, J=7,1 Гц, 3H), 3,91-4,07 (м, 2H), 5,06-5,13 (м, 1H), 7,07-7,16 (м, 2H), 7,29-7,35 (м, 2H), 7,50-7,57 (м, 1H), 7,67-7,74 (м, 1H), 7,90 (с, 1H).
Пример 27
N-((R)-1-[5-[3-(4-ацетилпиперазин-1-ил)-фенокси]-4-этил-4Н-[1,2,4]триазол-3-ил]-этил)-3,4-дихлорбензолсульфонамид (соединение 697)
Формула 74
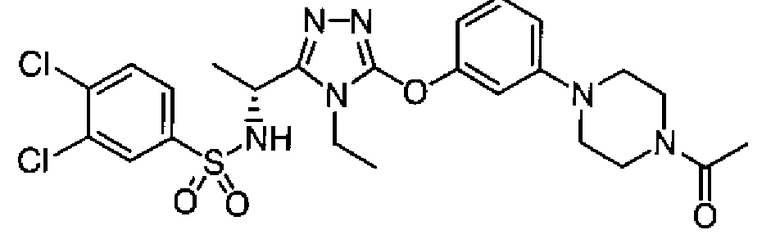
(R)-1-[4-Этил-5-(3-пиперазин-1-ил-фенокси)-4Н-[1,2,4]триазол-3-ил]-этиламин
Формула 75
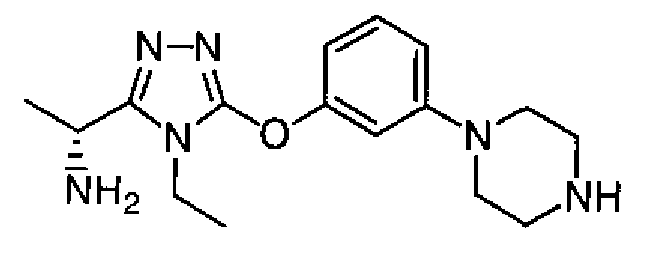
(1) В устойчивой к давлению пробирке с завинчивающейся крышкой к соединению, полученному в примере 1-(6), (2,08 г) добавляли ДМПМ (10 мл), 3-пиперазинфенол (1,34 г) и Cs2CO3 (6,13 г), после чего смесь перемешивалась при 200°C в течение 40 минут. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении, полученный неочищенный продукт очищали способом колоночной хроматографии (на NH SiO2, AcOEt или MeOH/CHCl3 = 1/50) для получения названного соединения (в виде желтого маслянистого соединения, 1,17 г).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,40 (т, J=7,1 Гц, 3H), 1,59 (д, J=6,9 Гц, 3H), 2,98-3,04 (м, 4H), 3,14-3,19 (м, 4H), 3,97-4,09 (м, 2H), 4,13-4,18 (м, 1H), 6,70-6,80 (м, 2H), 6,97-7,03 (м, 1H), 7,21-7,26 (м, 1H).
1-(4-[3-[5-((R)-1-Аминоэтил)-4-этил-4Н-[1,2,4]триазол-3-илокси]-фенил]-пиперазин-1-ил)-этанон
Формула 76
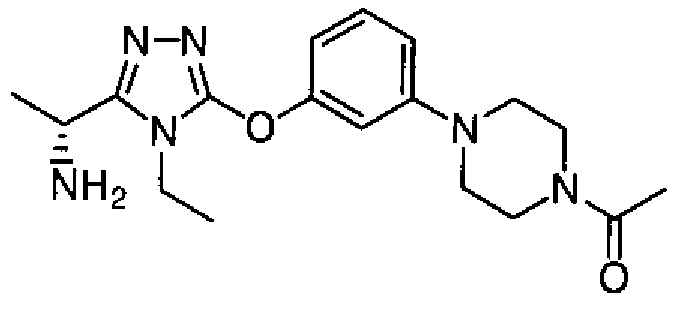
(2) К раствору соединения из примера 27-(1) (1,06 г) и Et3N (1,4 мл) в ТГФ (20 мл) при температуре -30°C добавляли AcCl (0,24 мл), после чего смесь перемешивалась при этой температуре в течение двух часов. Затем смесь нагревали до комнатной температуры, после чего перемешивали еще пять часов. Реакционную смесь концентрировали, полученный неочищенный продукт очищали способом колоночной хроматографии (на нейтральном OH SiO2, MeOH/CHCl3 = 1/5) для получения смеси (315 мг, бесцветное твердое вещество) названного соединения и гидрохлорида триэтиламина.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,35 (т, J=7,3 Гц, 3H), 1,72 (д, J=6,4 Гц, 3H), 2,12 (с, 3H), 3,14-3,23 (м, 4H), 3,57-3,64 (м, 2H), 3,71-3,77 (м, 2H), 3,87-4,10 (м, 2H), 4,57-4,66 (м, 1H), 6,70-6,81 (м, 2H), 6,95-6,99 (м, 1H), 7,21-7,26 (м, 1H).
N-((R)-1-[5-[3-(4-Ацетилпиперазин-1-ил)-фенокси]-4-этил-4Н-[1,2,4]триазол-3-ил]-этил)-3,4-дихлорбензолсульфонамид (соединение 697)
Формула 77
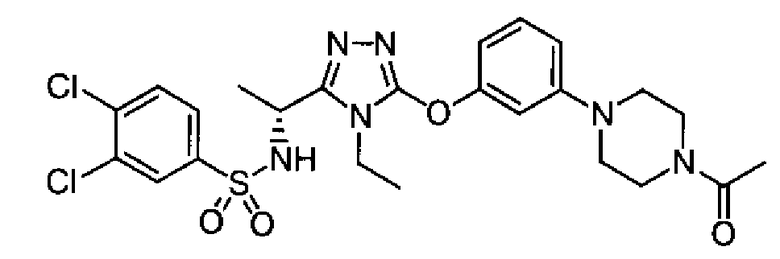
(3) К смеси (307 мг) 1-(4-[3-[5-(R)-1-аминоэтил)-4-этил-4Н-[1,2,4]триазол-3-илокси]-фенил]пиперазин-1-ил)-этанона, полученного в примере 27-(2), и гидрохлорида триэтиламина добавляли воду, 3,4-дихлорбензолсульфонилхлорид (0,13 мл) и K2CO3 (355 мг). Смесь перемешивалась при комнатной температуре в течение 15 часов. Преципитировавшее твердое вещество фильтровали и очищали способом колоночной хроматографии (на NH SiO2, MeOH/CHCl3 = 1/5) для получения названного соединения (соединения 697) (117 мг, бесцветный сироп).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,38 (т, J=7,3 Гц, 3H), 1,52 (д, J=6,9 Гц, 3H), 2,14 (с, 3H), 3,14-3,27 (м, 4H), 3,56-3,64 (м, 2H), 3,72-3,80 (м, 2H), 3,88-4,01 (м, 2H), 4,58-4,68 (м, 1H), 5,98-6,06 (м, 1H), 6,72-6,82 (м, 2H), 6,95-7,01 (м, 1H), 7,25-7,30 (м, 1H), 7,51-7,57 (м, 1H), 7,65-7,73 (м, 1H), 7,89-7,97 (м, 1H).
Пример 28
3,4-Дихлоро-N-[(R)-1-[4-этил-5-(3-пиперазин-1-ил-фенокси)-4Н-[1,2,4]триазол-3-ил]-этил]-бензолсульфонамид (соединение 683)
Формула 78
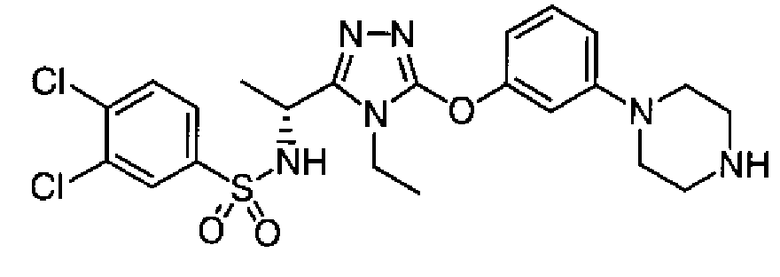
Смесь соединения (107 мг), полученного в примере 27-(3), NaOH (105 мг), воды (2,0 мл) и EtOH (4,0 мл) перемешивалась при 80°C в течение одного часа, а затем перемешивалась при 100°C в течение 18 часов. Смесь охлаждали до комнатной температуры, после чего экстрагировали AcOEt. Органическую фазу промывали насыщенным водным раствором хлорида натрия, высушивали (MgSO4), фильтровали и концентрировали. Полученный неочищенный продукт очищали способом колоночной хроматографии (на NH SiO2, MeOH/CHCl3 = 1/30), после чего перекристаллизовывали (AcOEt -гексан) для получения названного соединения (соединение 683) (55 мг, в виде бесцветного порошка).
1H-ЯМР (600 МГц, ДМСО-d6) δ м.д.: 1,24 (т, J=7,3 Гц, 3H), 1,31 (д, J=6,9 Гц, 3H), 2,77-2,86 (м, 4H), 3,03-3,10 (м, 4H), 3,81-3,99 (м, 2H), 4,67-4,75 (м, 1H), 6,56-6,62 (м, 1H), 6,76-6,85 (м, 2H), 7,19-7,27 (м, 1H), 7,69-7,77 (м, 1H), 7,88 (д, J=8,7 Гц, 1H), 7,93-7,97 (м, 1H).
Точка плавления: от 175,0°C до 178,0°C.
Соединения, показанные в таблице 1, получали с использованием соответствующих исходных соединений и процедур, описанных в примерах от 1 до 28.
Соединения, полученные в примерах выше, также показаны в Таблице 1 вместе с другими соединениями.
Пример тестирования (анализ связывания S1P1)
Способность соединений по настоящему изобретению ингибировать связывание Edg-1 (S1P1) определялась с использованием мембранной фракции клеток штамма HEK-293 с перенесенным в них геном человека Edg-1 (S1P1) в соответствии с методом, описанным в литературе (Science. 2002, 296: 346) (показано связывание с Kd = 0,15 нМ, Bmax = 2,5 фмоль/мкг по [33P]-S1P). Мембранную фракцию получали обработкой клеток солюбилизирующим буфером (1 мМ Tris/HCl, pH 7,2) в течение 10 минут на льду, центрифугированием при 1000g в течение 5 минут для удаления нерастворимых фракций, а затем центрифугированием при 40000g в течение 30 минут при 4°C. Полученную мембранную фракцию растворяли в буфере для связывания (20 мМ Tris-HCl, pH 7,4, 100 мМ NaCl, 15 мМ NaF, 2 мМ дезоксипиридоксина, 4 мг/мл свободного от жирных кислот BSA), после чего добавляли [33P]-S1P (производства ARC, конечная концентрация 0,1 нМ) и раствор исследуемого соединения в ДМСО (конечная концентрация соединения 10-5М, конечная концентрация ДМСО 0,1%). Затем смесь перемешивали, после чего обрабатывали температурой 30°C в течение одного часа. Мембранную фракцию собирали с использованием сборщика на GF/C фильтр unifilter-96 (производства Perkin Elmer), проводили четырехкратную промывку буфером для связывания, после чего фильтр высушивали. Добавляли двадцать пять мкл Microscint 0 (производства Perkin Elmer), после чего измеряли радиоактивность с использованием Top Count NXT (производства Packard) для расчета количества (А) [33P]-S1P, связанного с мембранной фракцией при добавлении соединения.
Похожую процедуру проводили в отсутствие исследуемого соединения и вычисляли количество связанного [33P]-S1P (B). Далее, похожую процедуру проводили в отсутствие исследуемого вещества с использованием клеток HEK-293, в которые не был введен ген Edg-1 (S1P1), и вычисляли количество фонового связанного [33P]-S1P (С).
Степени ингибирования связывания Edg-1 (S1P1), вычисленные с использованием следующего выражения, показаны в таблице 1.
Степень ингибирования (%) = [1-(A-C)/(B-C)]×100.
Далее вычисляли концентрации (IC50), при которых связывание в отсутствие исследуемого соединения ингибировали на 50%. Анализ связывания с мембранной системой проводился в присутствии исследуемых соединений с различными концентрациями, степени ингибирования связывания Edg-1 (S1P1) вычислялись с использованием выражения, приведенного выше. Затем значения IC50 вычисляли с использованием программного обеспечения для анализа данных Origin (Lightstone Corp.).
Каждое из приведенных ниже соединений имело значение IC50 35 нМ или ниже и показывало довольно высокую активность:
соединения 5, 13, 16, 18, 21, 23, 25, 26, 32, 35, 37, 43, 46, 64, 69, 76, 101, 102, 109, 122, 123, 125, 131, 134, 141, 142, 145, 665.
Следующие соединения имели значение IC50 10 нМ или ниже и показывали еще более высокую активность:
соединения 24, 39, 40, 70, 75, 87, 93, 94, 107, 111, 112, 121, 132, 133, 137, 138, 139, 140, 147, 151, 663, 666, 667, 669, 671, 681, 683, 690.
Конкретные значения IC50 для отдельных соединений были следующими (единицы: нМ):
соединение 3: 4,2. Соединение 7: 35,5. Соединение 8: 18,5. Соединение 10: 17,5. Соединение 11: 8,9. Соединение 12: 20,0. Соединение 14: 6,4. Соединение 15: 32,5. Соединение 22: 14,0. Соединение 28: 3,1. Соединение 34: 2,0. Соединение 36: 17,5. Соединение 38: 11,7. Соединение 42: 22,0. Соединение 45: 4,2. Соединение 46: 28,5. Соединение 49: 6,0. Соединение 61: 39,0. Соединение 73: 2,2. Соединение 74: 15,0. Соединение 83: 8,1. Соединение 88: 5,4. Соединение 99: 25,0. Соединение 100: 18,5. Соединение 105: 2,9. Соединение 108: 18,0. Соединение 120: 1,7. Соединение 129: 20,0. Соединение 130: 2,9. Соединение 136: 8,1. Соединение 143: 7,3. Соединение 144: 7,9. Соединение 146: 12,0. Соединение 148: 1,9. Соединение 149: 7,8. Соединение 670: 5,2. Соединение 678: 10,2. Соединение 680: 1,4. Соединение 688: 1,5. Соединение 691: 2,6. Соединение 692: 5,1. Соединение 694: 2,9. Соединение 698: 2,3.
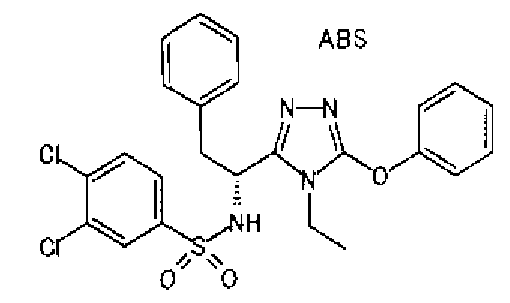







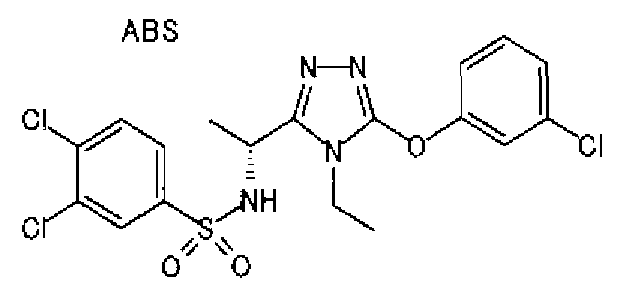

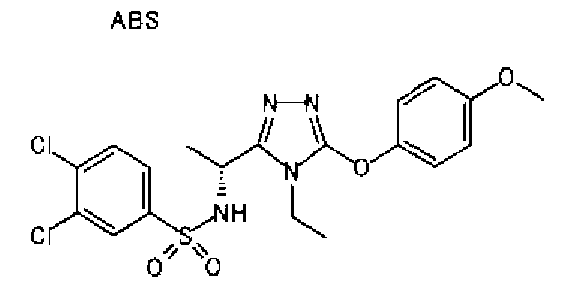




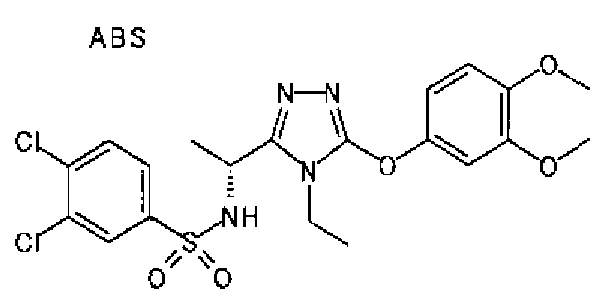
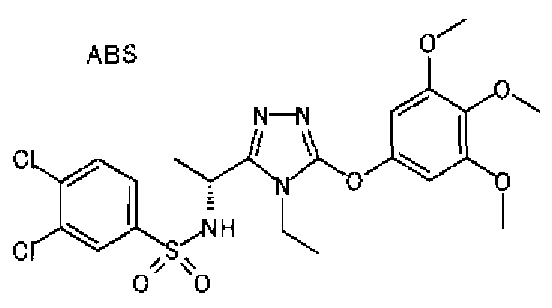




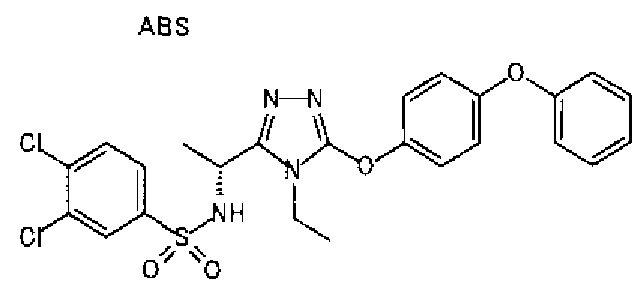


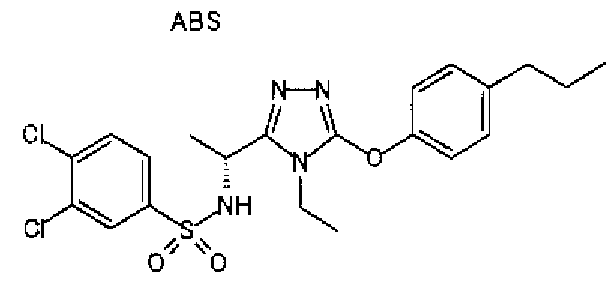



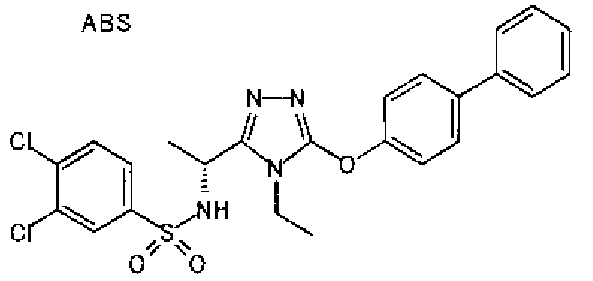
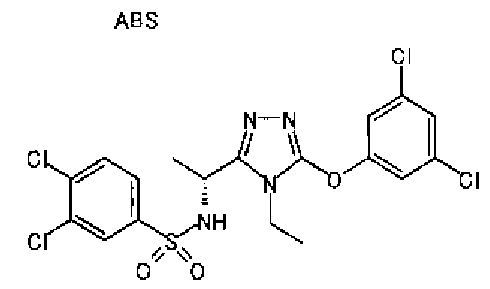

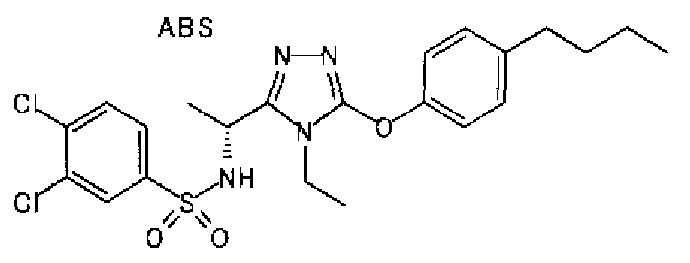



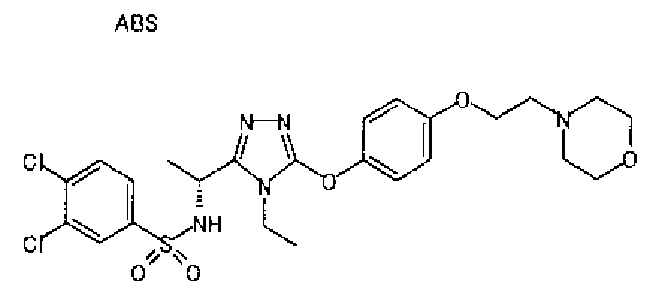











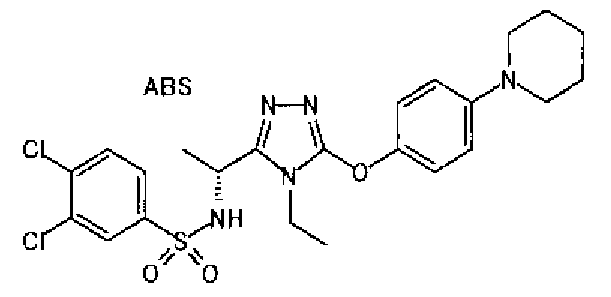
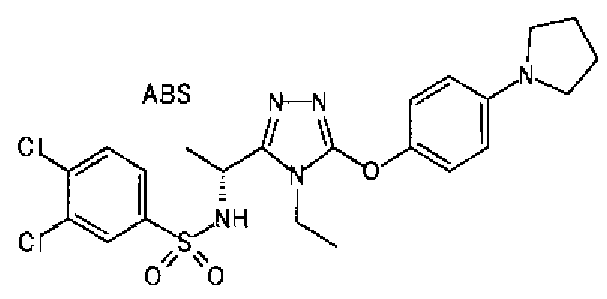







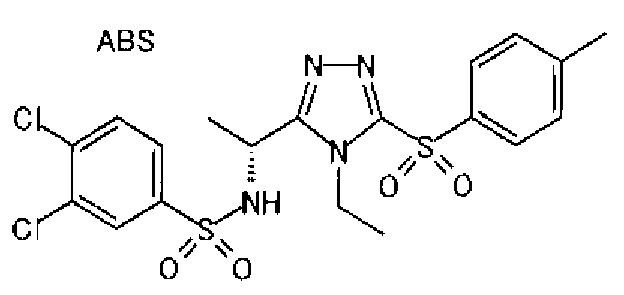


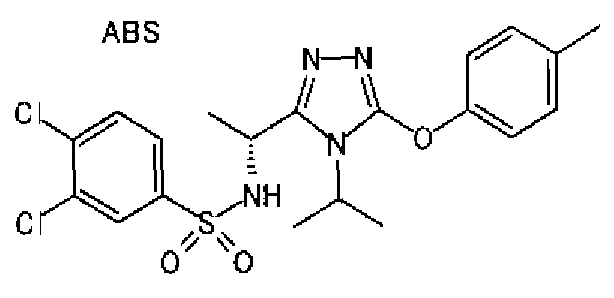
















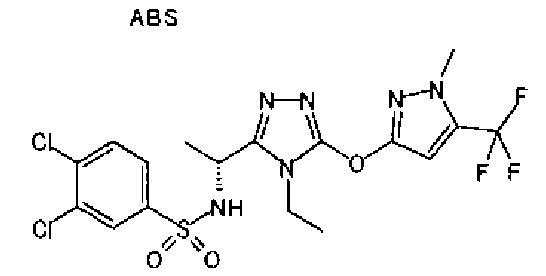





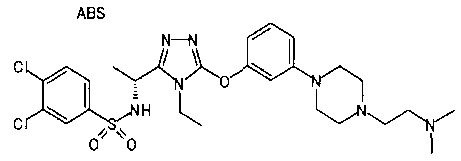

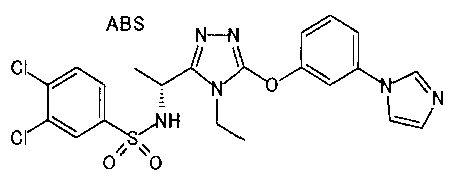


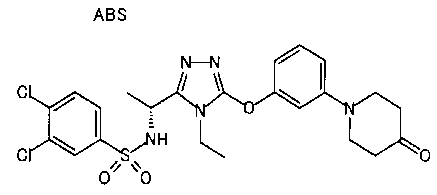
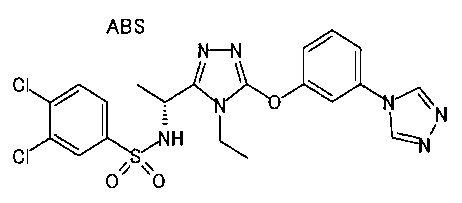

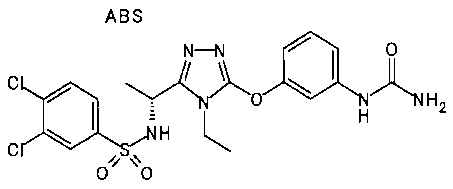

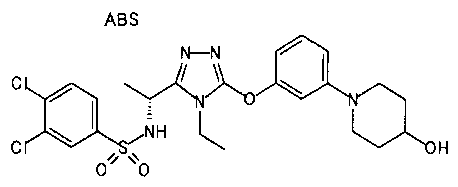


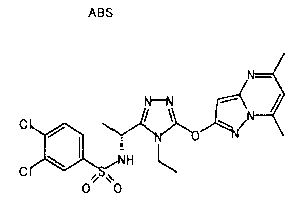





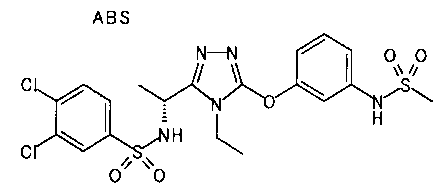





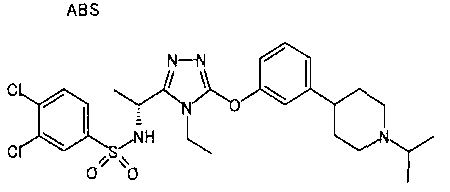
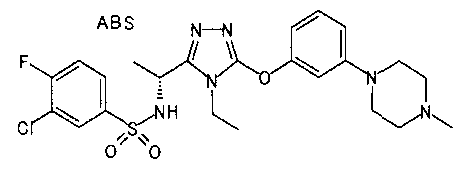









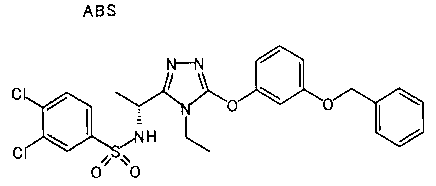






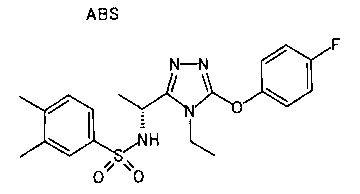
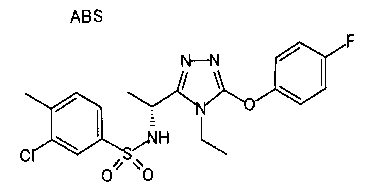

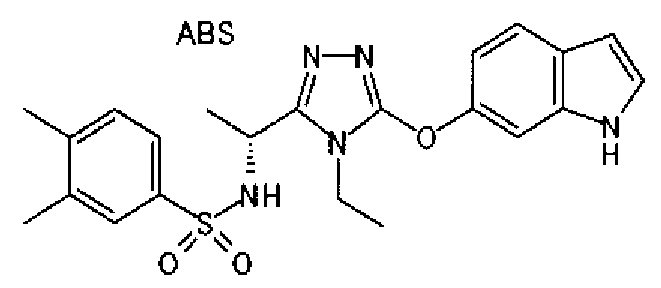


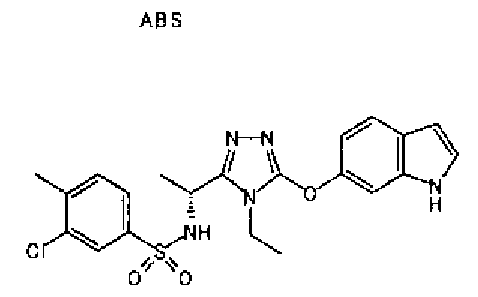
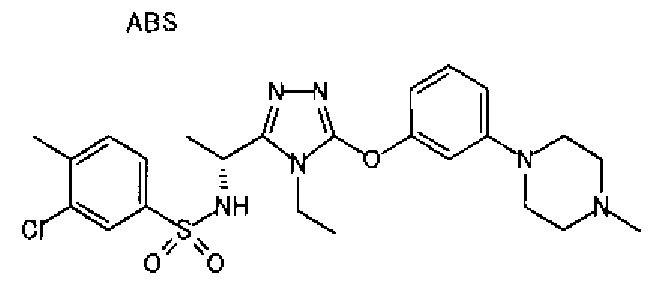



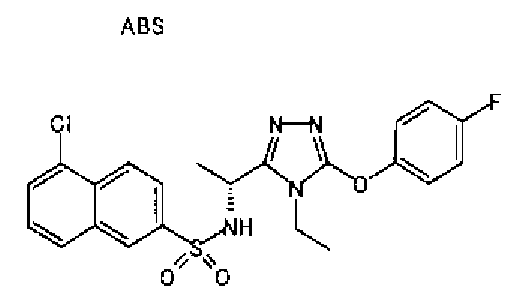



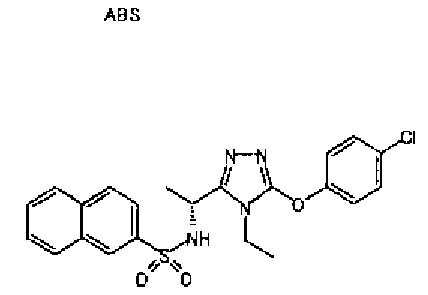


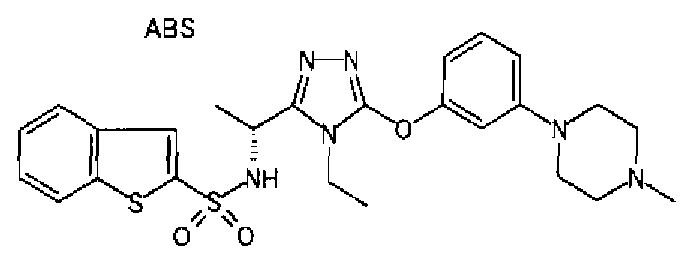

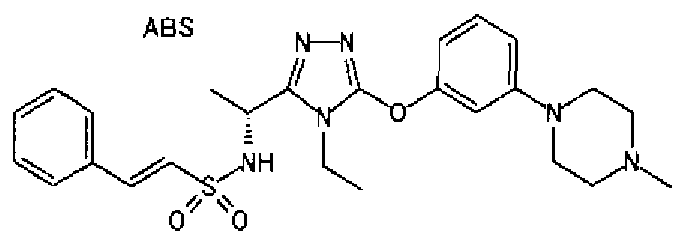

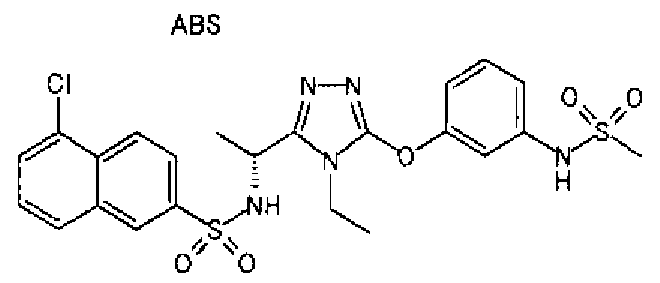


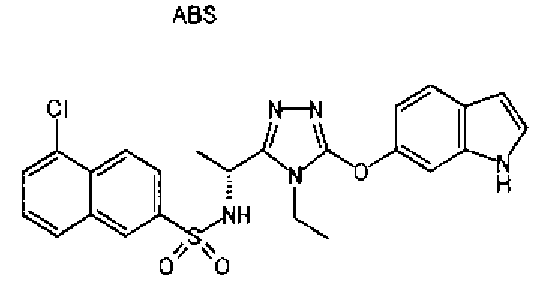
(M-H)-
(M+H)+
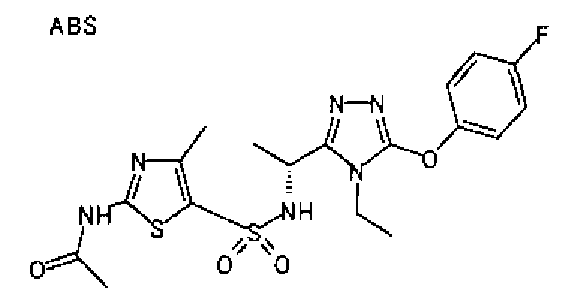
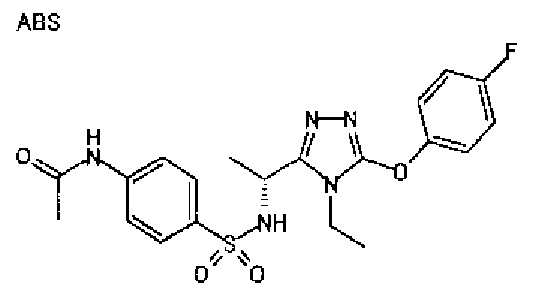

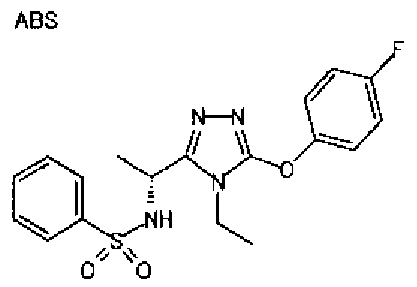
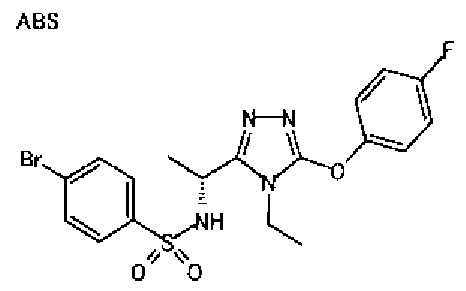

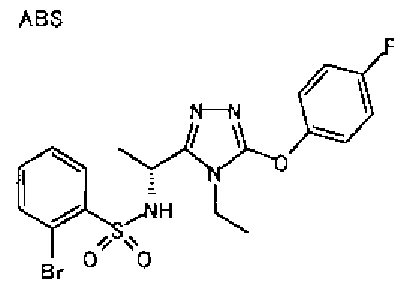

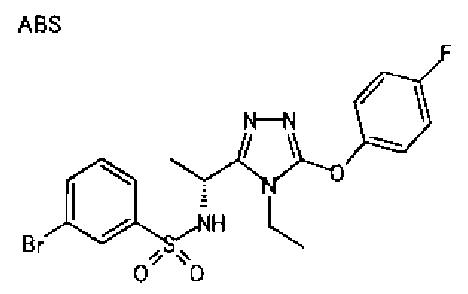


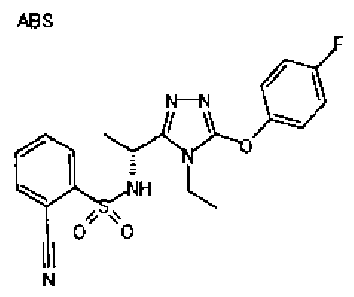


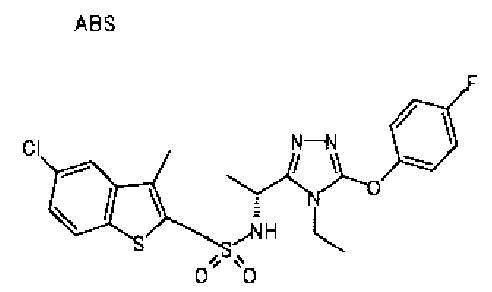


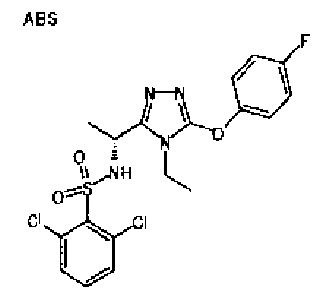


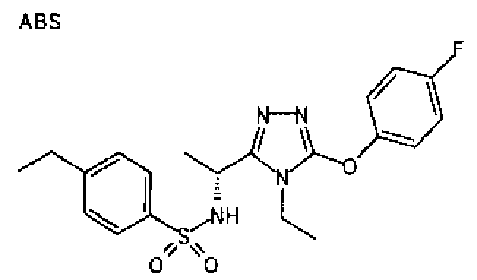


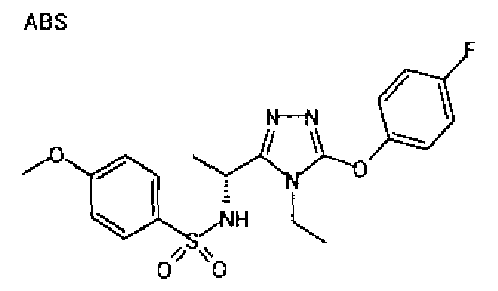

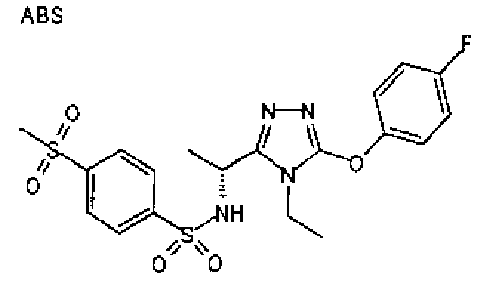





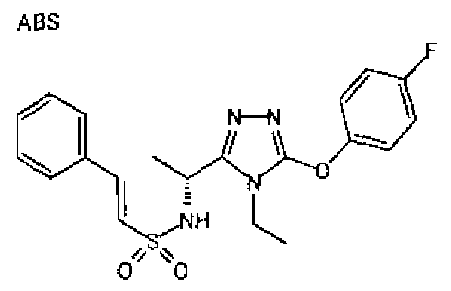
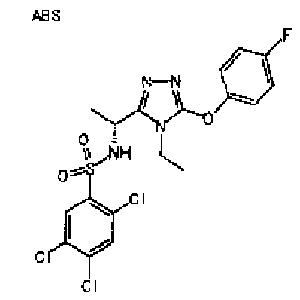
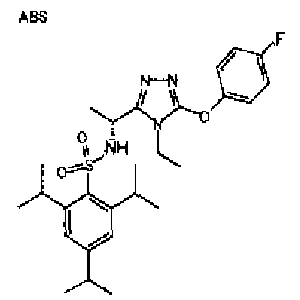
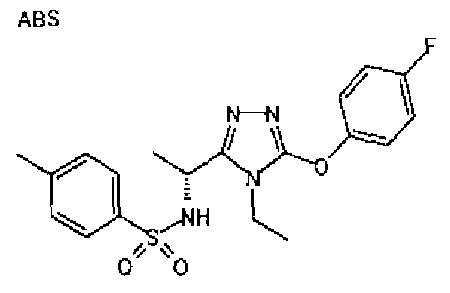
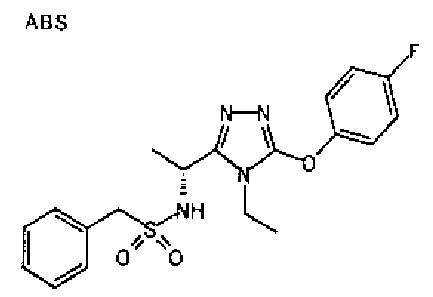

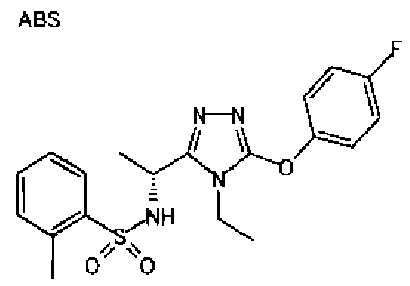

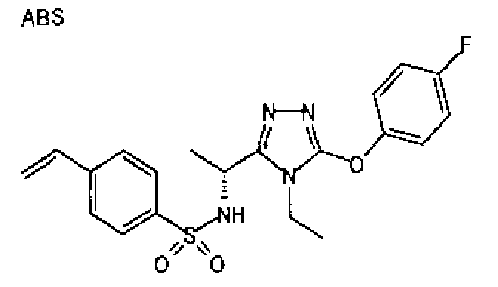
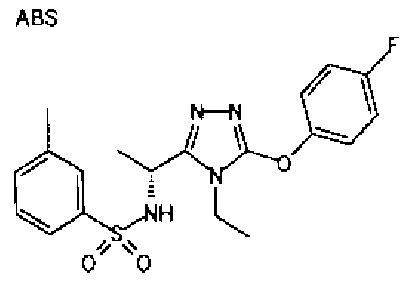
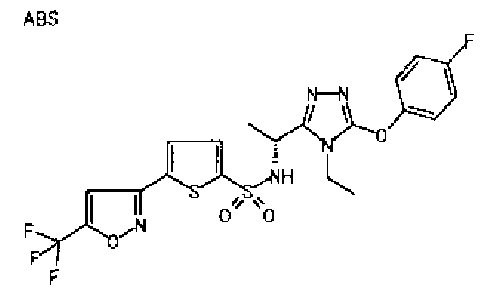
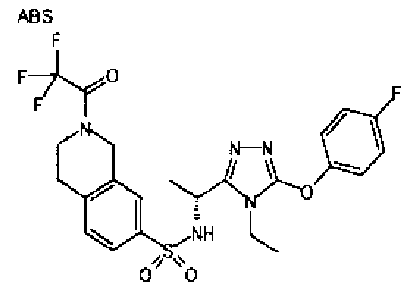
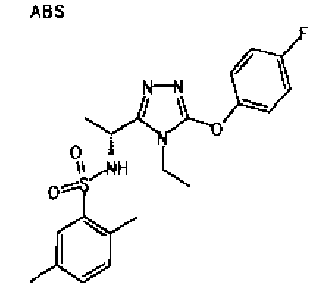

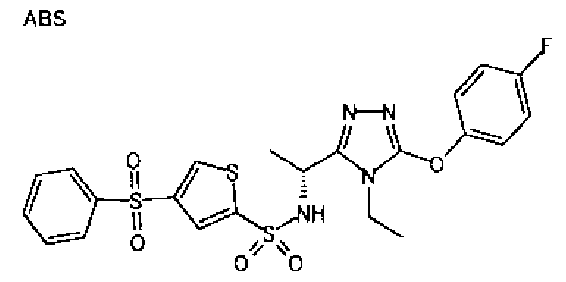


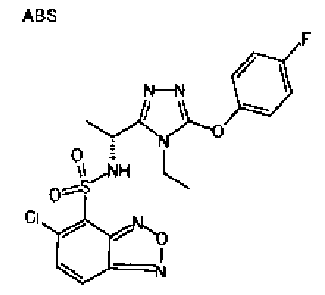


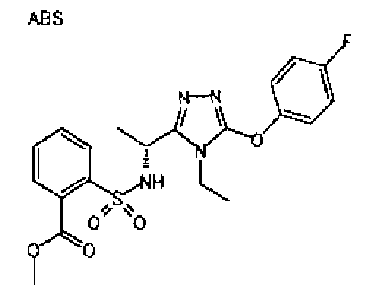

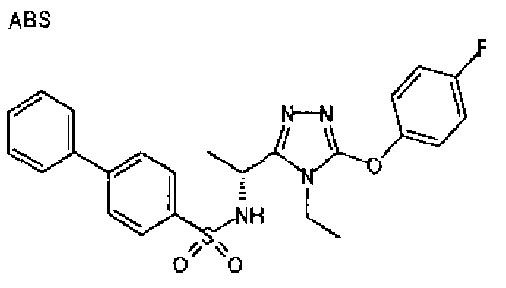



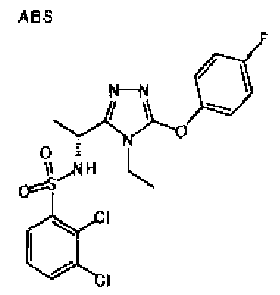
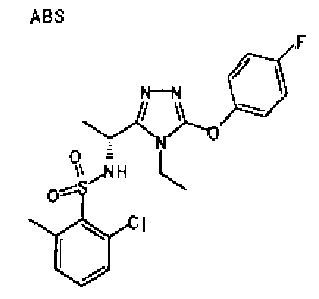




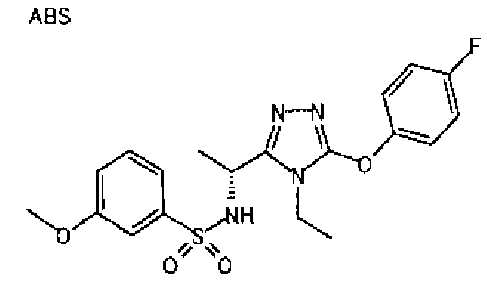
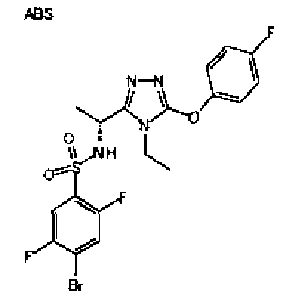
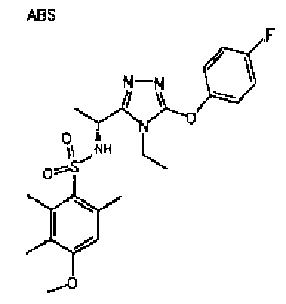

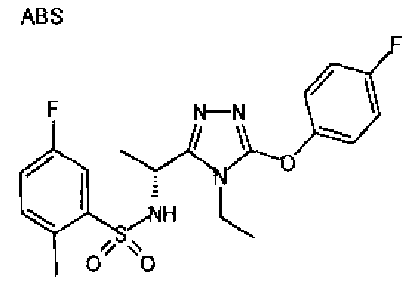




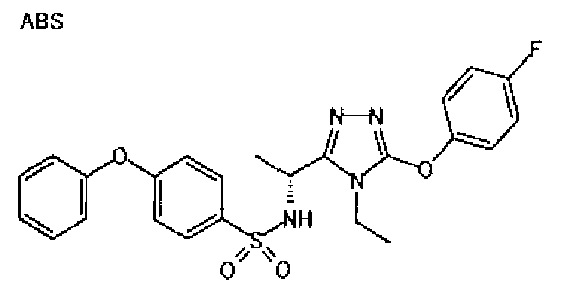





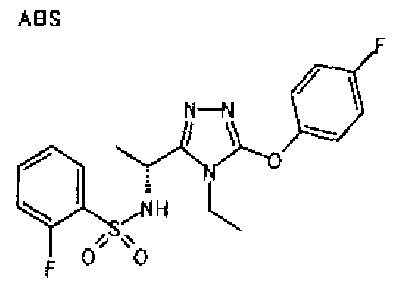


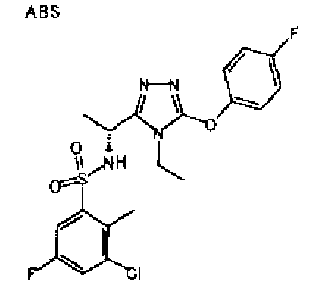
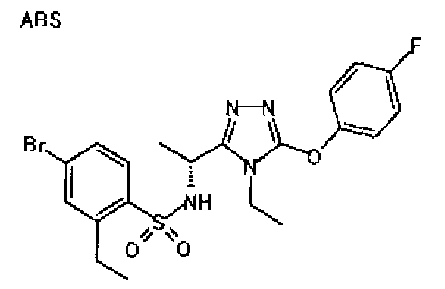



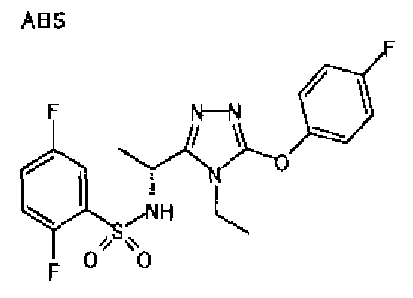

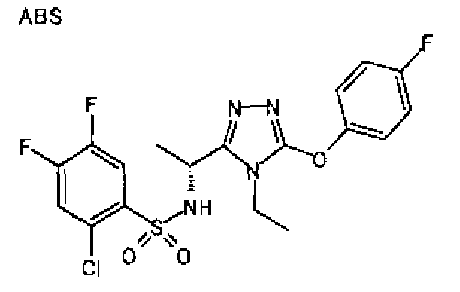
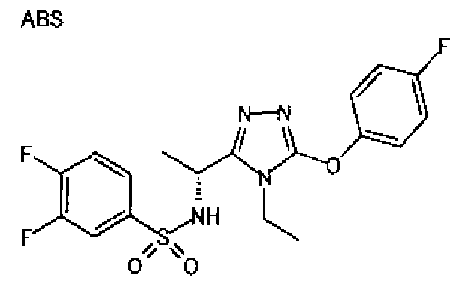


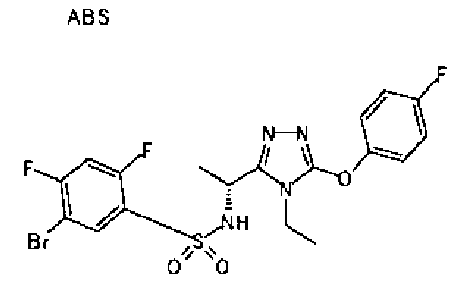
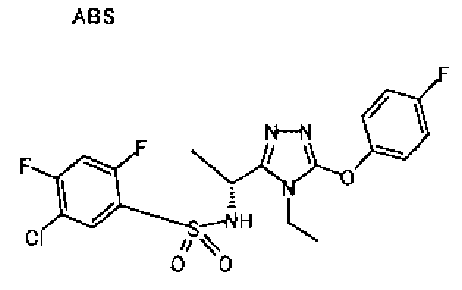





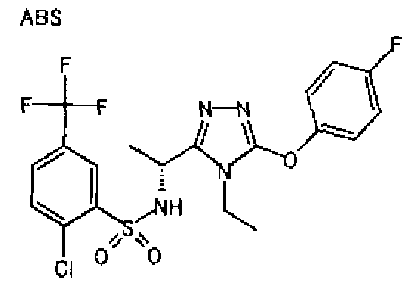




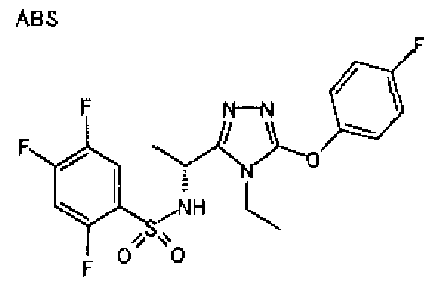


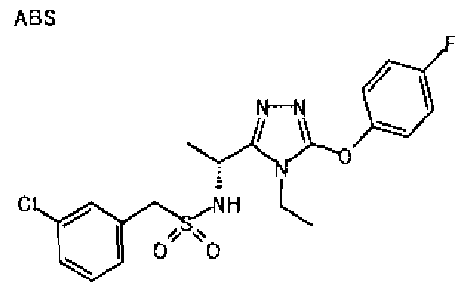
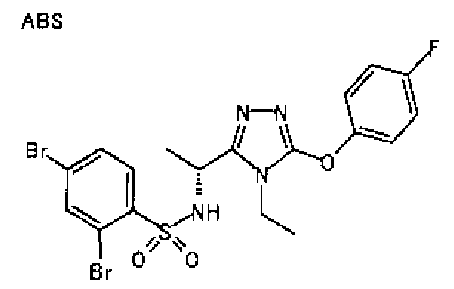


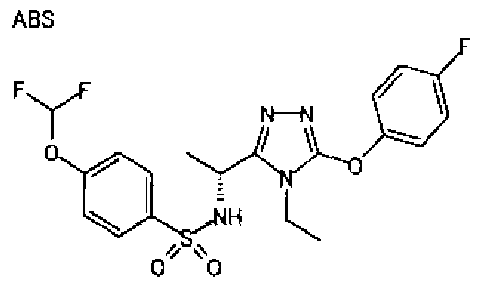
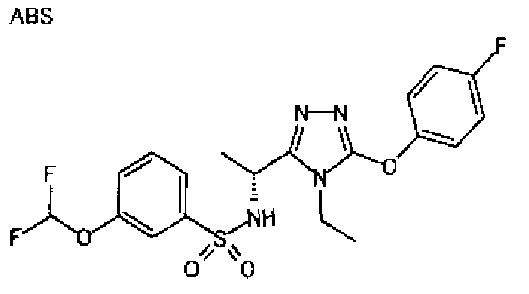






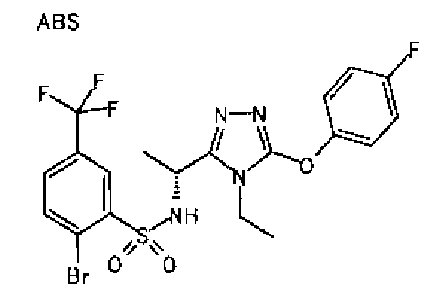


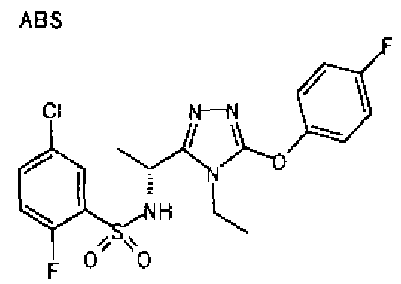


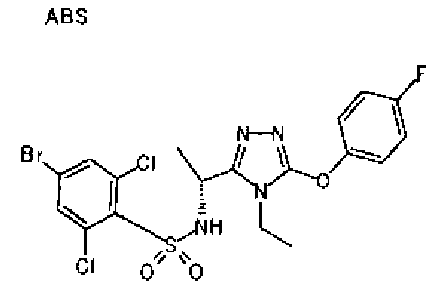
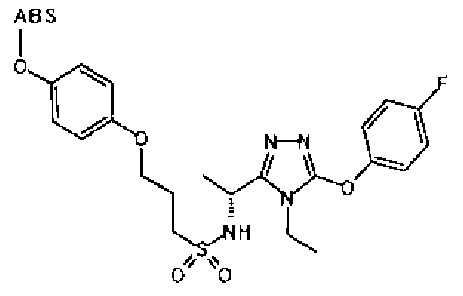


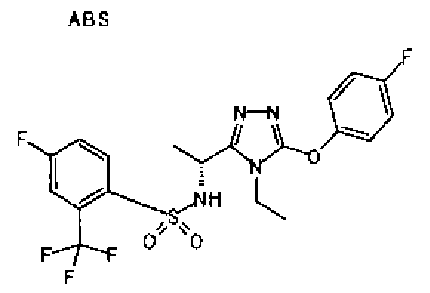


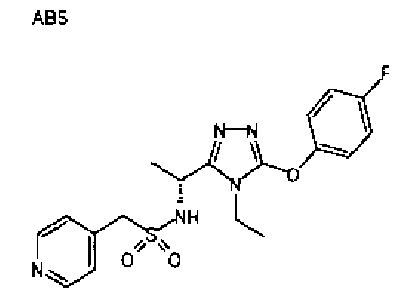

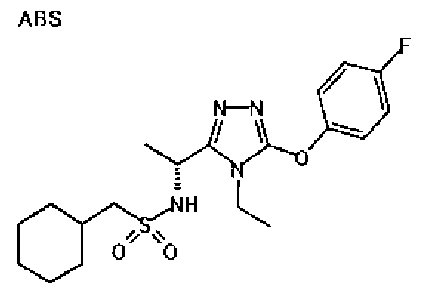



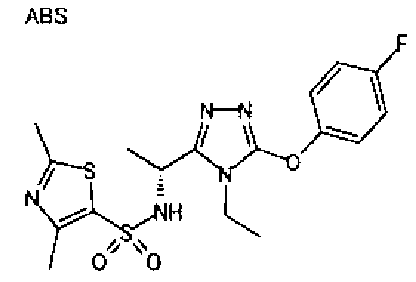



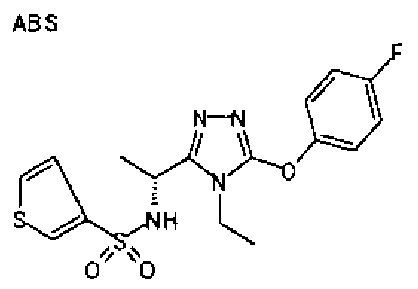

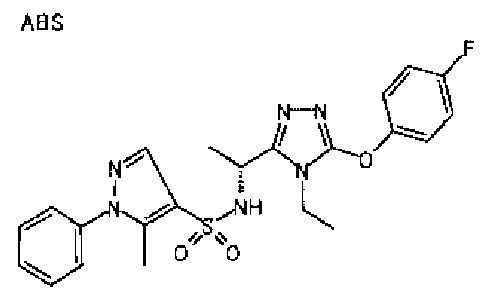

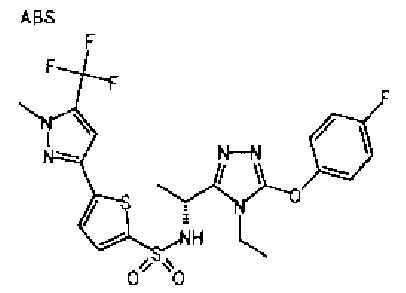



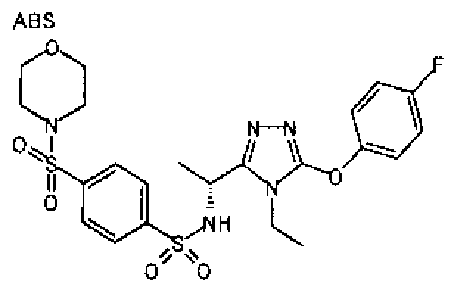
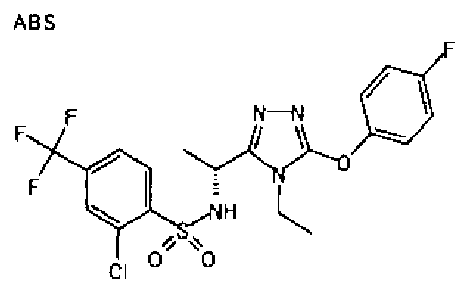


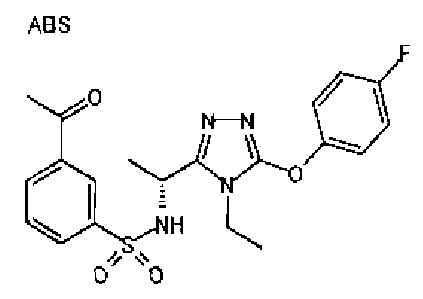

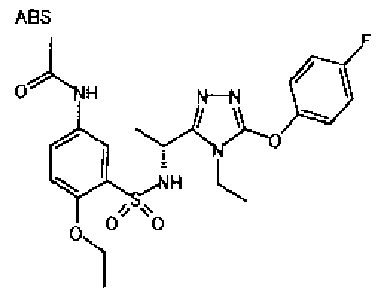


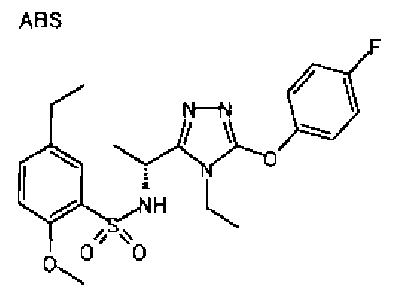
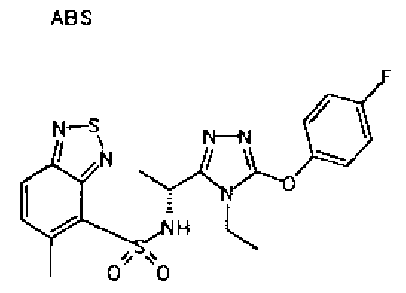



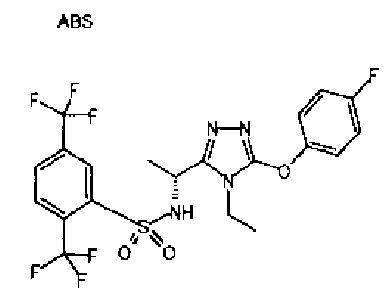




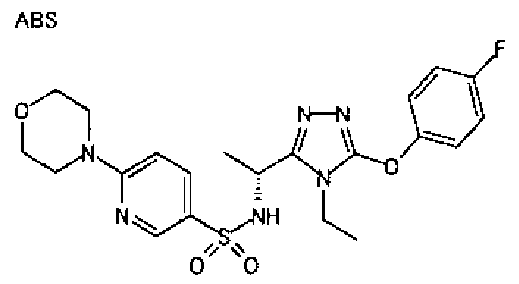

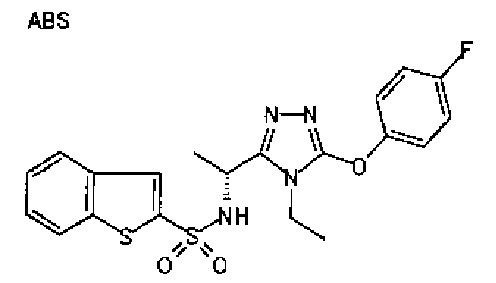



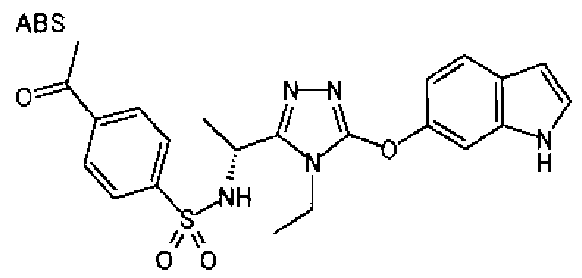
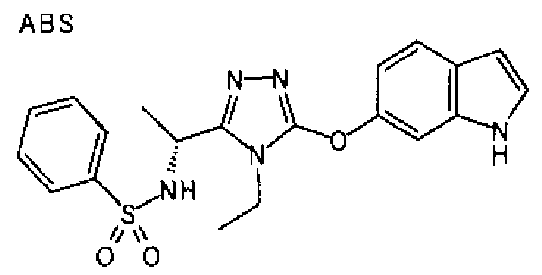
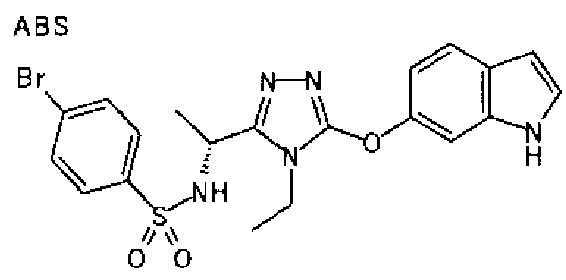


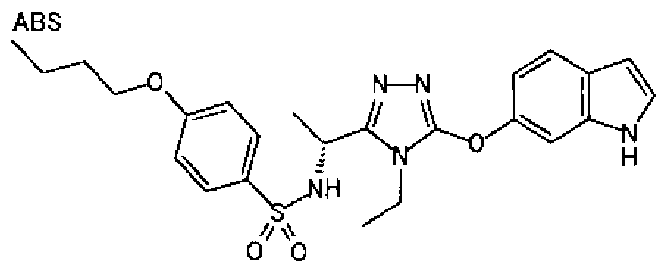
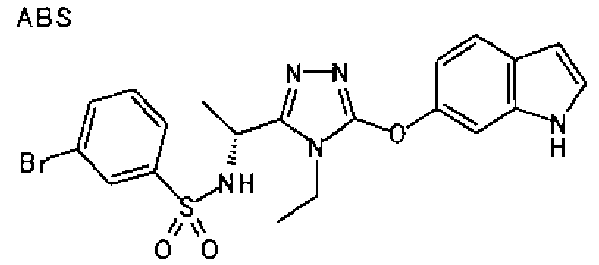

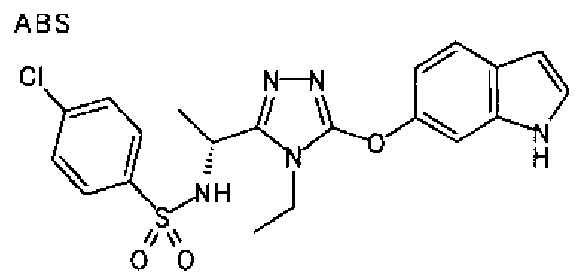








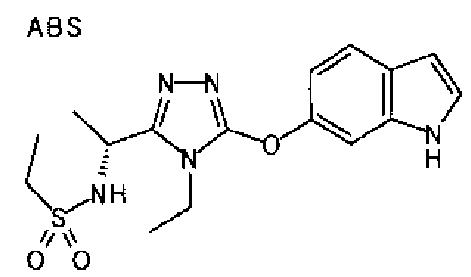




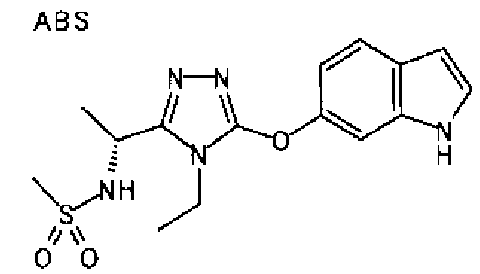










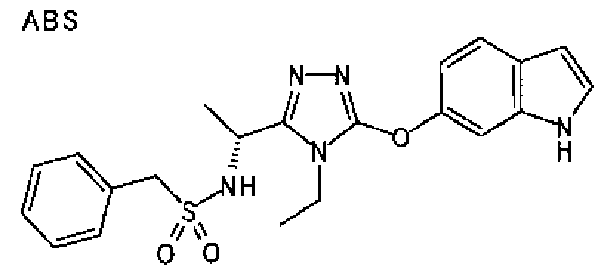




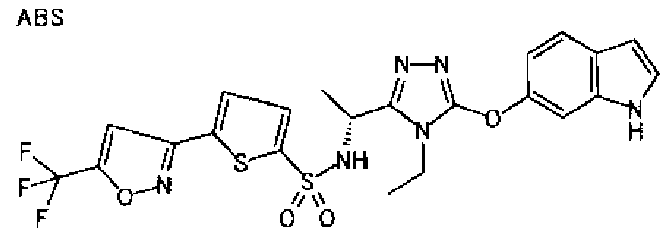

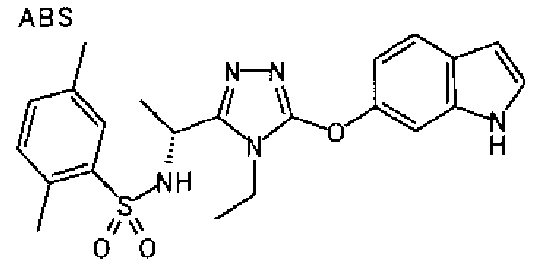
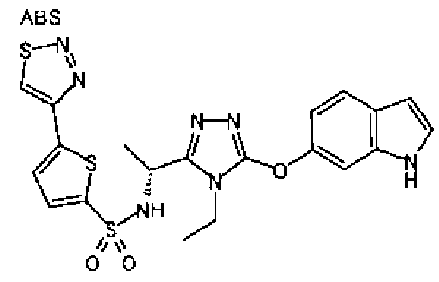
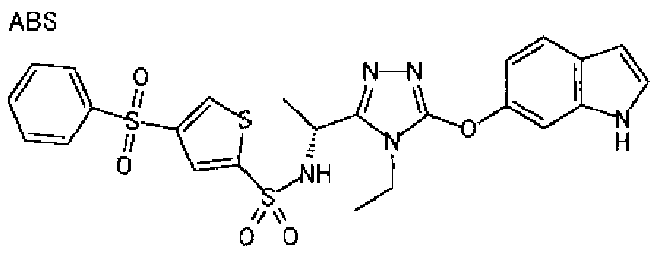


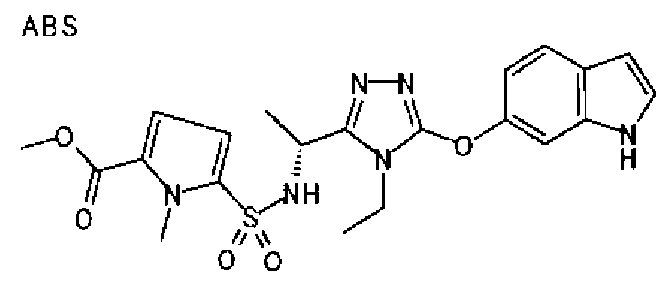




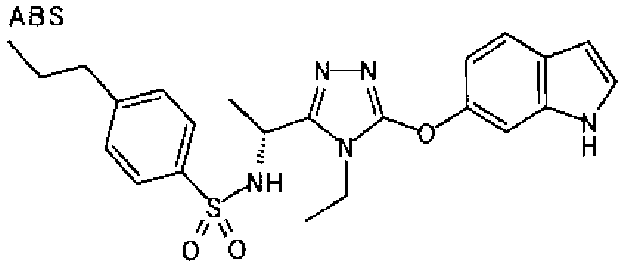




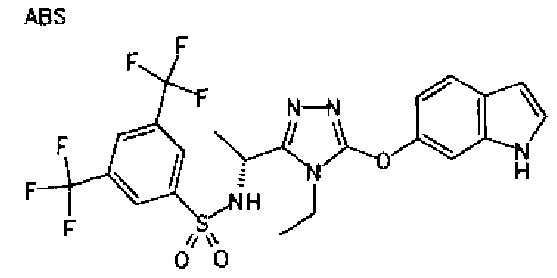







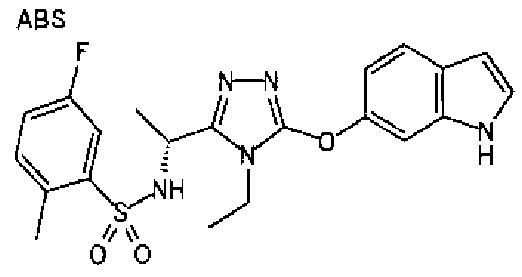



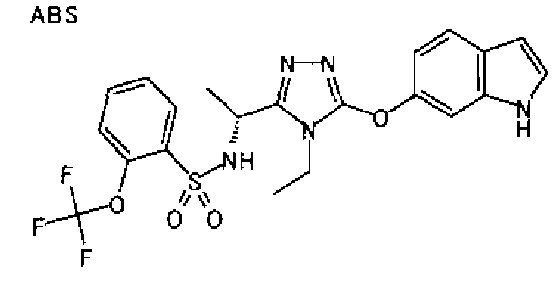


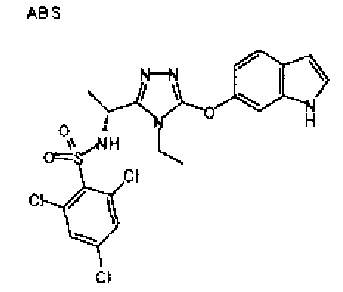




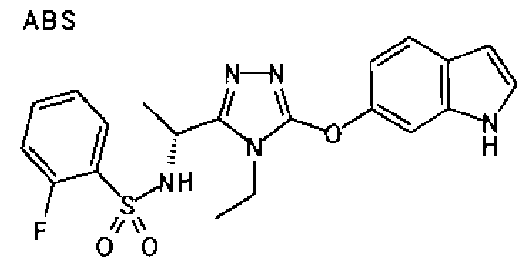

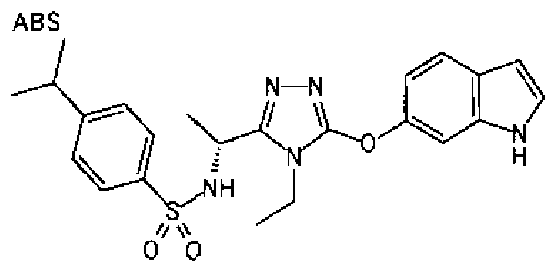






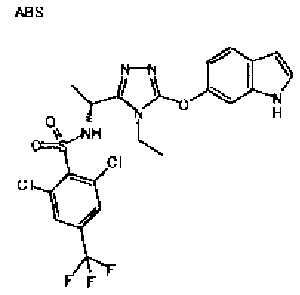



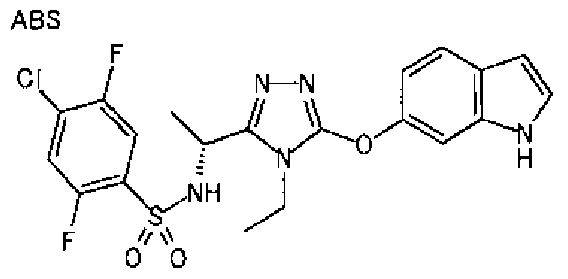

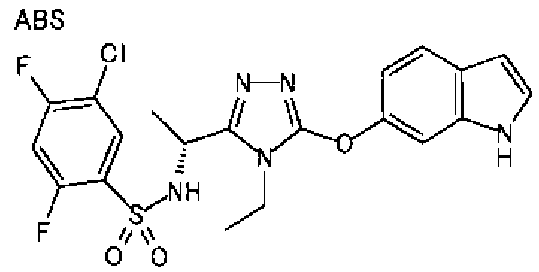

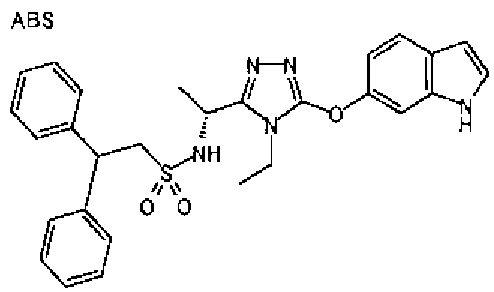


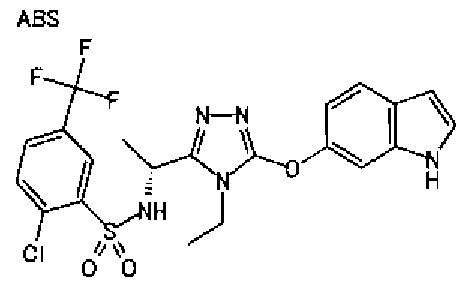

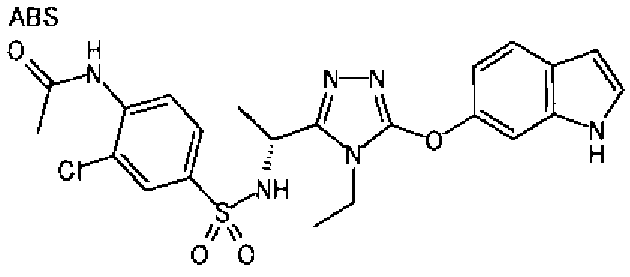
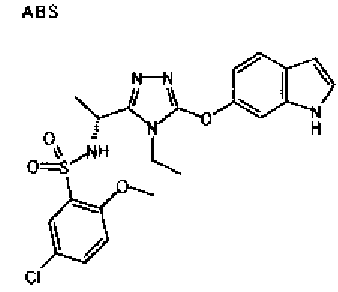



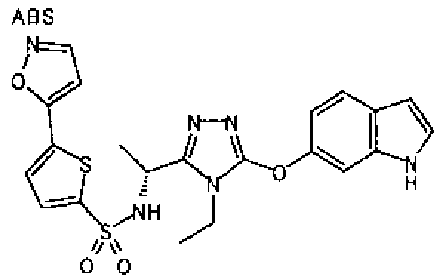
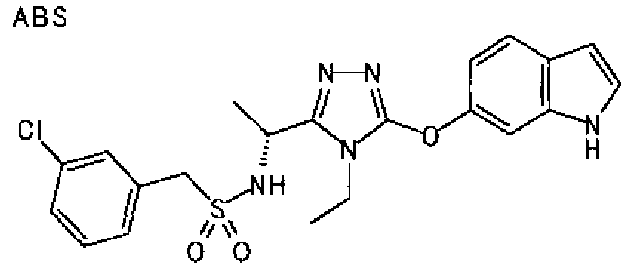
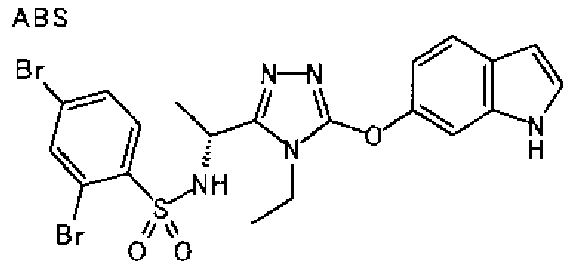

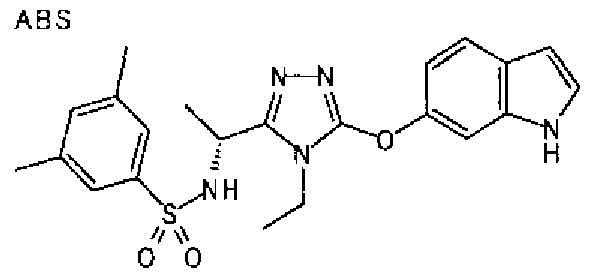
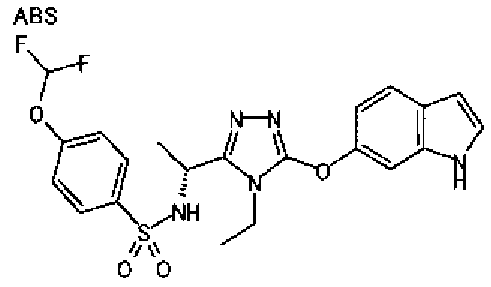










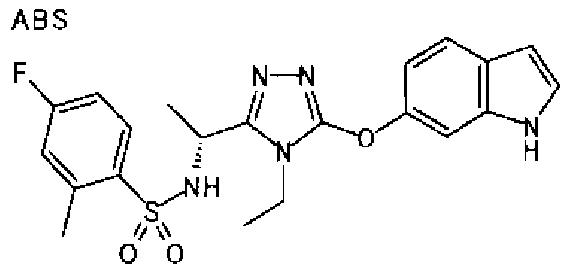









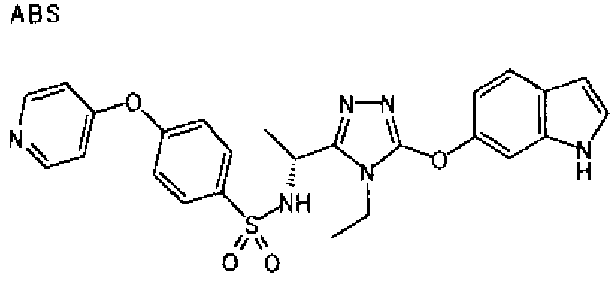
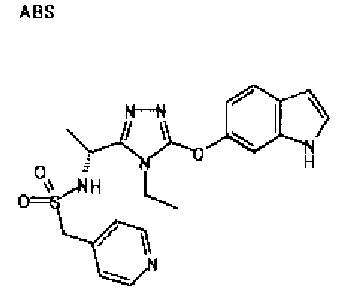


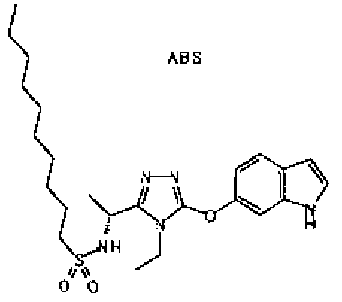
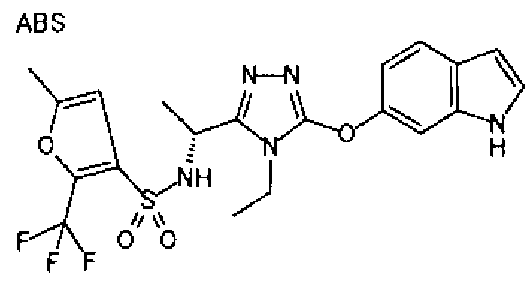
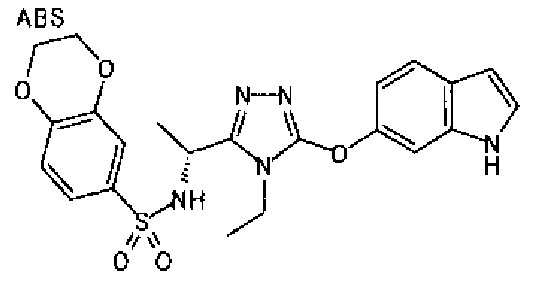





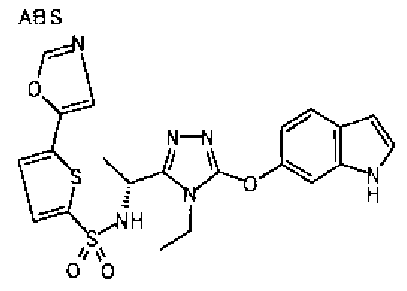
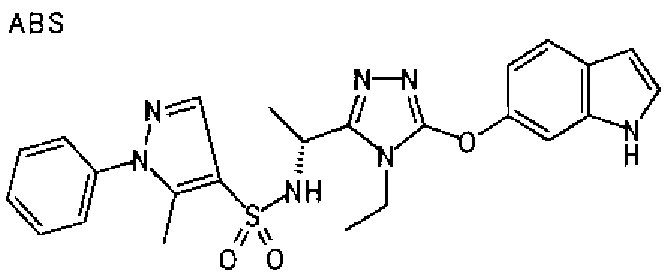
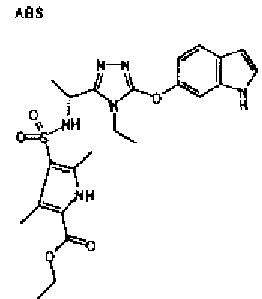




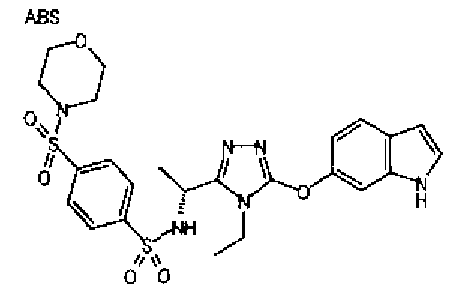




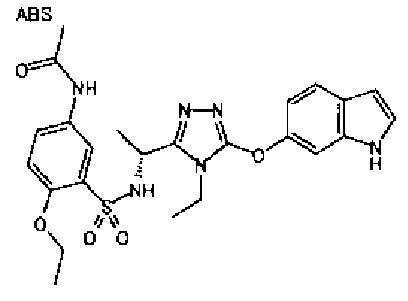



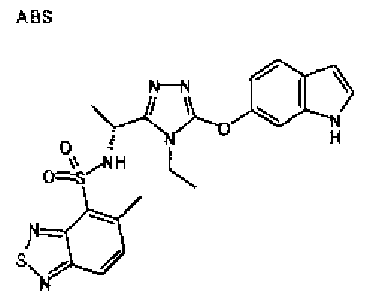








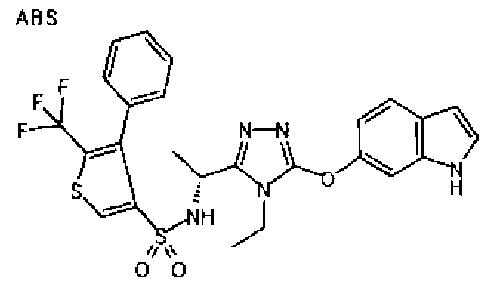


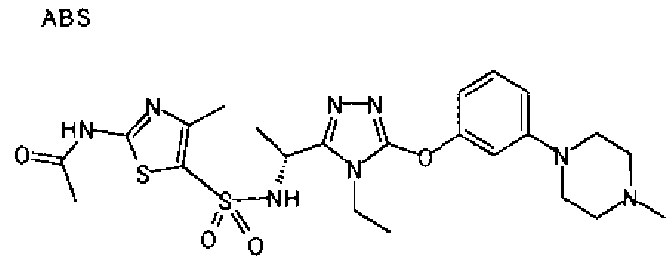


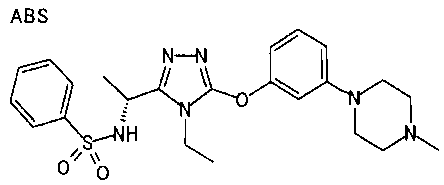

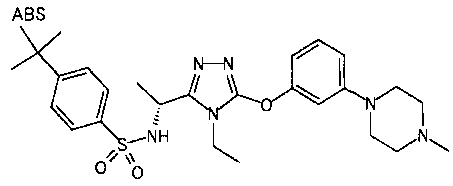
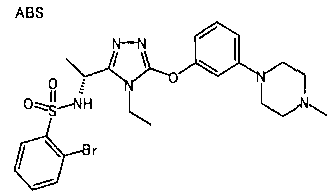
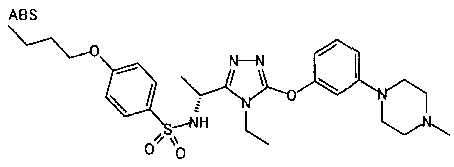

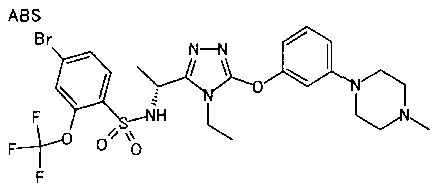



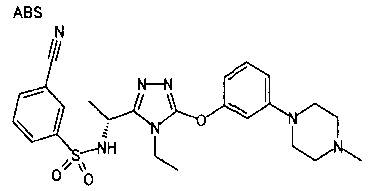



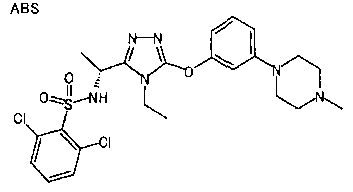


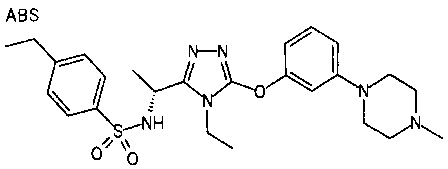



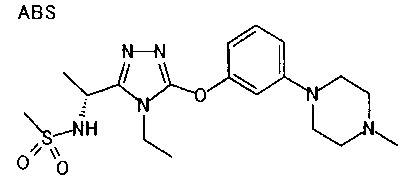




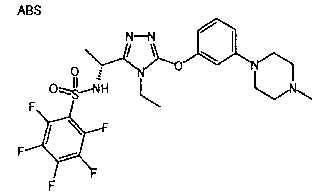
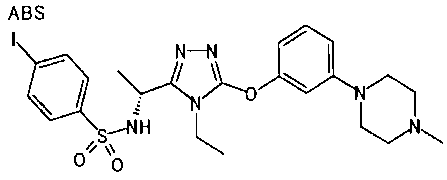


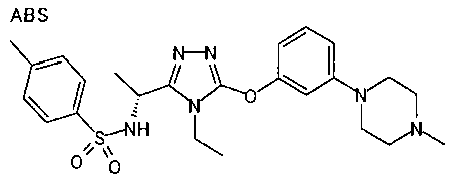
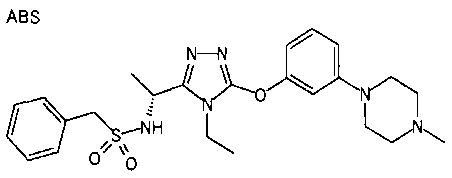

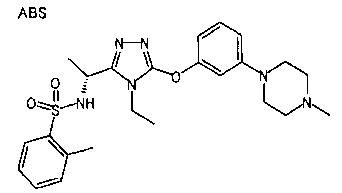

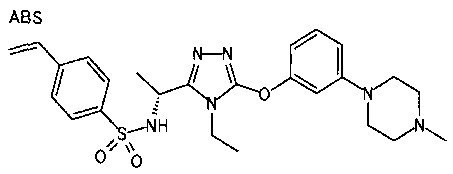
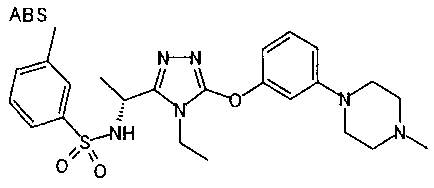


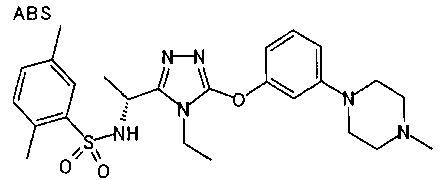


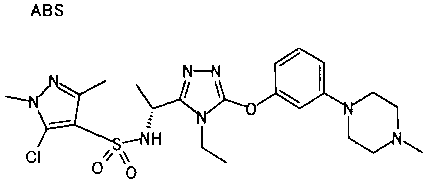
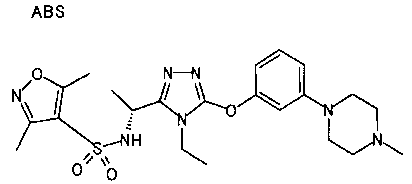















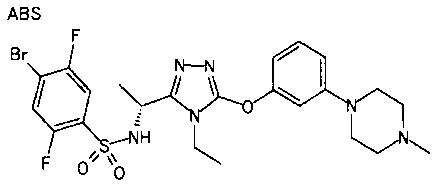

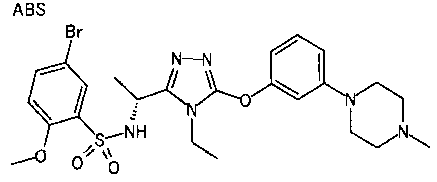
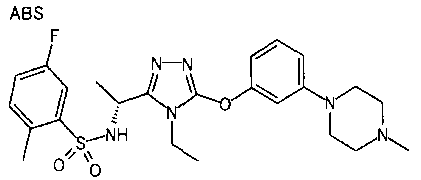

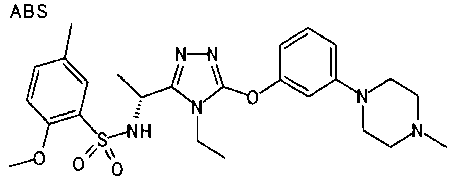

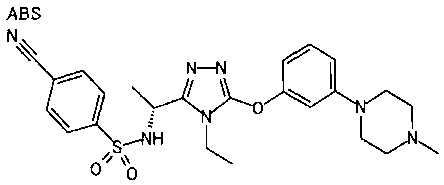

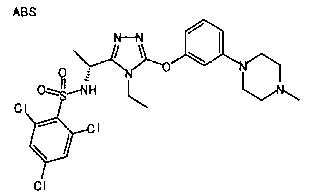





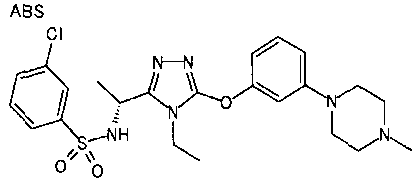



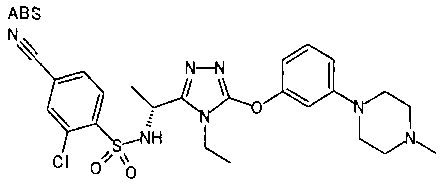


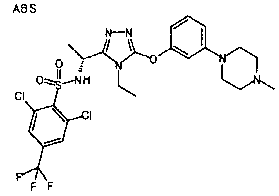






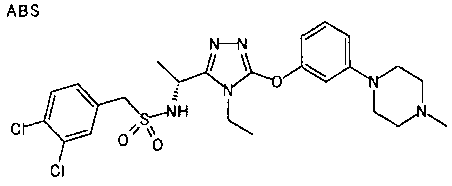












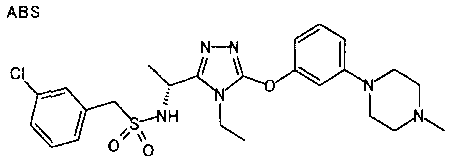





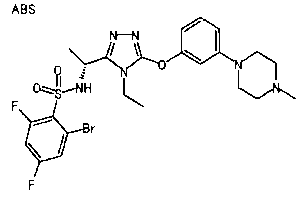





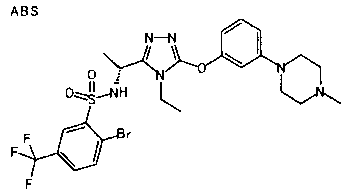
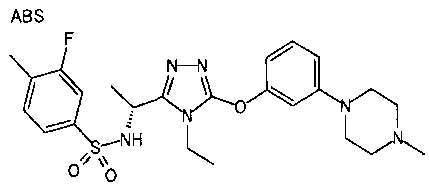

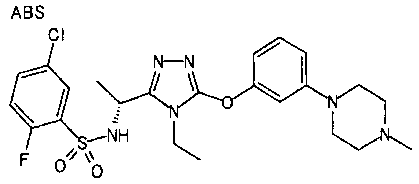













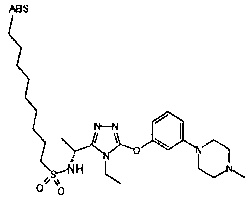





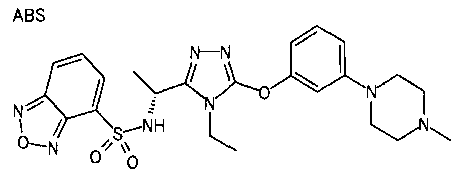



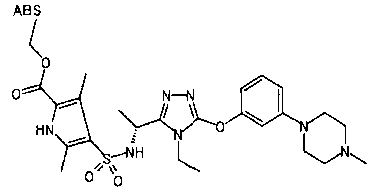






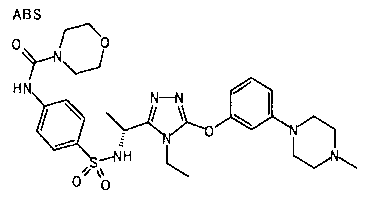


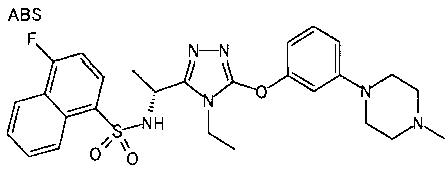


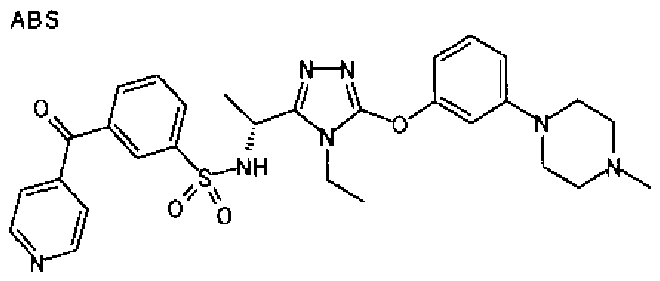


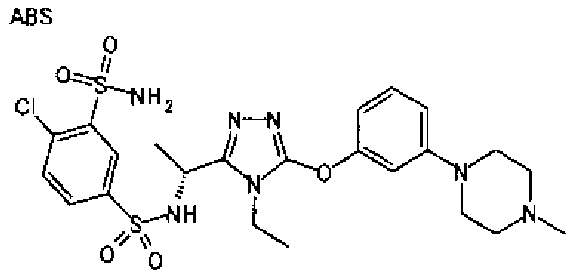




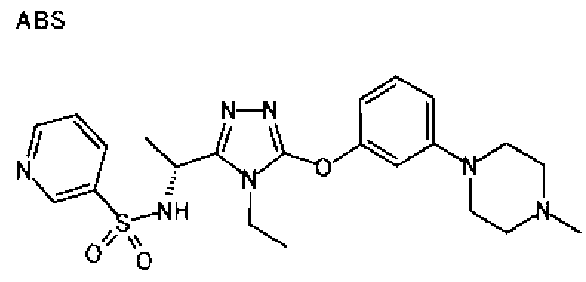
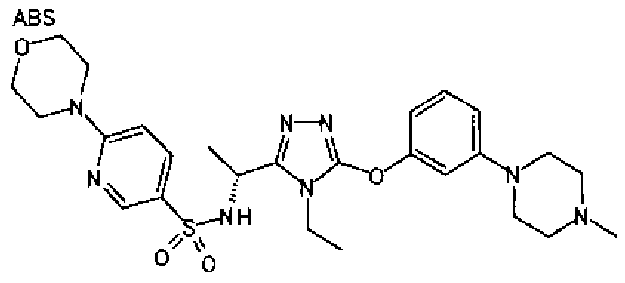
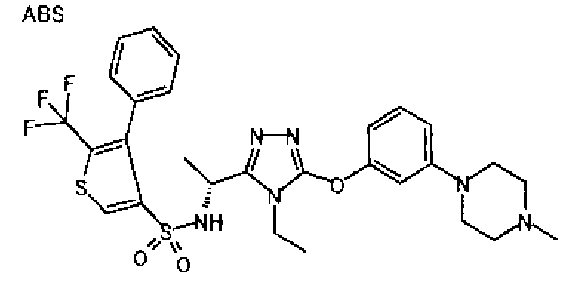

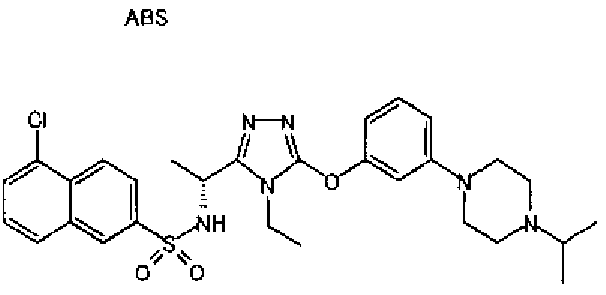

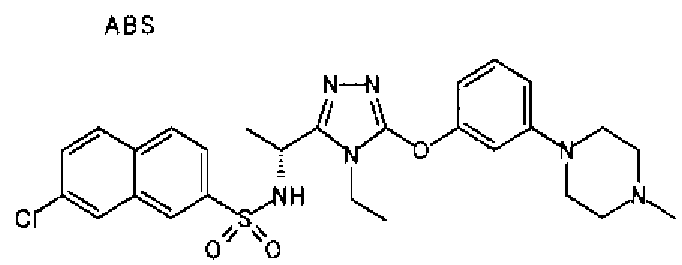






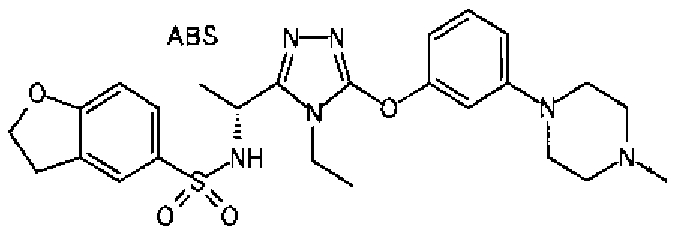


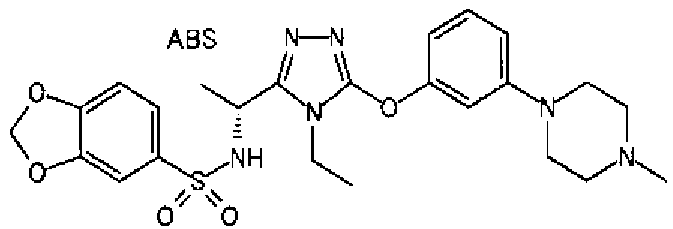





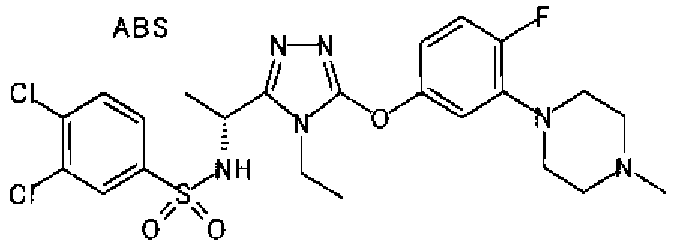












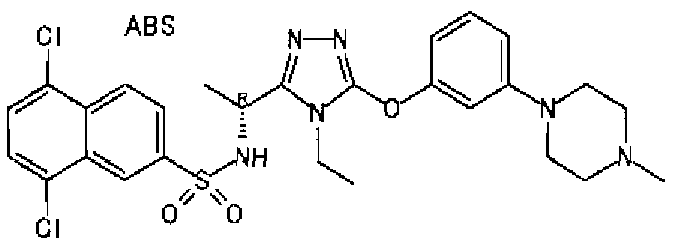


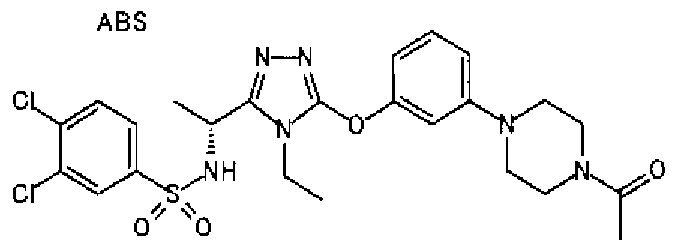

В таблице 1 некоторые соединения имели два набора данных для APCI MS (M-H)- и APCI MS (M+H)+, поскольку для изотопов атома хлора или атома брома обнаруживаются два пика.
Для приведенных ниже соединений показаны данные 1H-ЯМР.
Соединение 100: (600 МГц, ДМСО-d6) δ м.д.: 1,21 (т, J=7,1 Гц, 3H), 1,27 (д, J=6,9 Гц, 3H), 3,22 (с, 6H), 3,40-3,50 (м, 8H), 3,77-3,93 (м, 2H), 4,68 (кв, J=6,9 Гц, 1H), 6,34 (дд, J=7,3, 2,29 Гц, 1H), 6,52 (дд, J=8,3, 2,29 Гц, 1H), 6,56 (т, J=2,3 Гц, 1H), 7,12 (т, J=8,3 Гц, 1H), 7,70 (дд, J=8,3, 2,3 Гц, 1H), 7,85 (д, J=8,3 Гц, 1H), 7,92 (д, J=1,8 Гц, 1H), 8,66 (с, 1H).
Соединение 119: (600 МГц, CDCl3) δ м.д.: 1,34 (т, J=7,3 Гц, 3H), 1,50 (д, J=7,3 Гц, 3H), 3,89-3,98 (м, 2H), 4,59-4,65 (м, 1H), 5,06 (с, 2H), 6,37-6,42 (м, 1H), 6,80-6,95 (м, 2H), 7,01-7,04 (м, 1H), 7,24-7,36 (м, 2H), 7,36-7,44 (м, 4H), 7,49-7,53 (м, 1H), 7,67-7,73 (м, 1H), 7,93-7,96 (м, 1H).
Соединение 127: (600 МГц, CDCl3) δ м.д.: 1,38 (т, J=7,1 Гц, 3H), 1,49 (д, J=6,9 Гц, 3H), 2,41 (с, 3H), 3,93-4,02 (м, 2H), 4,59-4,65 (м, 1H), 5,47 (д, J=9,6 Гц, 1H), 7,05-7,10 (м, 2H), 7,31-7,37 (м, 3H), 7,61-7,64 (м, 1H), 7,80-7,82 (м, 1H).
Соединение 129: (600 МГц, ДМСО-d6) δ м.д.: 1,21-1,29 (м, 6H), 2,29 (с, 6H), 3,83-4,01 (м, 2H), 4,61 (кв, J=6,4 Гц, 1H), 6,43-6,47 (м, 1H), 6,89-6,93 (м, 1H), 7,34-7,40 (м, 3H), 7,52-7,60 (м, 3H), 8,24 (с, 1H), 11,18 (с, 1H).
Соединение 130: (600 МГц, ДМСО-d6) δ м.д.: 1,22 (д, J=6,8 Гц, 3H), 1,26 (т, J=7,1 Гц, 3H), 3,87-4,02 (м, 2H), 4,70 (кв, J=6,8 Гц, 1H), 6,43-6,45 (м, 1H), 6,77-6,80 (м, 1H), 7,28-7,30 (м, 1H), 7,36-7,38 (м, 1H), 7,50-7,53 (м, 1H), 7,67-7,75 (м, 2H), 7,83-7,86 (м, 1Н), 8,04-8,07 (м, 1Н), 8,12-8,19 (м, 2Н), 8,45-8,47 (м, 1Н), 8,52 (с, 1Н), 11,16 (с, 1Н).
Соединение 131: (600 МГц, ДМСО-d6) δ м.д.: 1,28 (т, J=7,1 Гц, 3H), 1,35 (д, J=6,9 Гц, 3H), 2,36 (с, 3H), 3,89-4,03 (м, 2H), 4,64-4,72 (м, 1H), 6,44-6,46 (м, 1H), 6,87-6,90 (м, 1Н), 7,36-7,38 (м, 2H), 7,53-7,57 (м, 1H), 7,82-7,84 (м, 1H), 7,88-7,91 (м, 1H), 8,77 (с, 1Н), 11,18 (с, 1Н).
Соединение 132: (600 МГц, ДМСО-d6) δ м.д.: 1,23-1,31 (м, 6H), 2,39 (с, 3H), 3,85-4,02 (м, 2H), 4,69 (кв, J=6,9 Гц, 1Н), 6,43-6,47 (м, 1Н), 6,88-6,92 (м, 1Н), 7,36-7,39 (м, 2H), 7,53-7,60 (м, 2H), 7,64-7,68 (м, 1Н), 7,77-7,80 (м, 1Н), 8,51 (с, 1Н), 11,18 (с, 1Н).
Соединение 134: (600 МГц, ДМСО-d6) δ м.д.: 1,29 (т, J=7,3 Гц, 3H), 1,36 (д, J=6,9 Гц, 3H), 3,89-4,05 (м, 2H), 4,67-4,73 (м, 1Н), 6,44-6,46 (м, 1Н), 6,86-6,90 (м, 1Н), 7,35-7,39 (м, 2H), 7,54-7,57 (м, 1Н), 7,83-7,88 (м, 1Н), 7,91-7,94 (м, 1Н), 9,01 (с, 1Н), 11,17 (с, 1Н).
Соединение 136: (600 МГц, ДМСО-d6) δ м.д.: 1,23-1,31 (м, 6H), 3,85-4,02 (м, 2H), 4,72 (кв, J=6,9 Гц, 1Н), 6,44-6,47 (м, 1Н), 6,87-6,91 (м, 1Н), 7,34-7,39 (м, 2H), 7,52-7,57 (м, 1Н), 7,97-8,05 (м, 4H), 8,74 (с, 1Н), 11,17 (с, 1Н).
Соединение 150: (200 МГц, CDCl3) δ м.д.: 0,94 (д, J=6,4 Гц, 3H), 0,97 (д, J=6,4 Гц, 3H), 1,30 (т, J=7,3 Гц, 3H), 2,00-2,20 (м, 1Н), 2,37 (с, 3H), 3,70-3,88 (м, 2H), 4,10 (дд, J=6,9, 9,4 Гц, 1Н), 6,71 (д, J=9,4 Гц, 2H), 7,12-7,22 (м, 4H), 7,40 (д, J=8,4 Гц, 1Н), 7,65 (дд, J=2,2, 8,4 Гц, 1Н), 7,84 (д, J=2,2 Гц, 1Н).
Соединение 668: (600 МГц, ДМСО-d6) δ м.д.: 1,19-1,25 (м, 6H), 2,22 (с, 3H), 2,41-2,46 (м, 4H), 2,49-2,54 (м, 3H), 3,11-3,17 (м, 4H), 3,83-3,99 (м, 2H), 4,65-4,71 (м, 1Н), 6,47-6,51 (м, 1Н), 6,77-6,82 (м, 2H), 7,17-7,22 (м, 1Н), 7,51-7,55 (м, 1Н), 7,77-7,84 (м, 2H), 8,01-8,10 (м, 2H), 8,38-8,51 (м, 2H).
Соединение 671: (200 МГц, CDCl3) δ м.д.: 0,89 (т, J=7,5 Гц, 3H), 1,23 (т, J=7,3 Гц, 3H), 1,70-2,06 (м, 2H), 2,42 (с, 3H), 2,66 (ушир.с, 4H), 3,29 (т, J=5,1 Гц, 4H), 3,68-3,92 (м, 2H), 4,38 (дд, J=7,0, 15,4 Гц, 1Н), 6,50 (ушир.с, 1Н), 6,56 (дд, J=2,0, 8,1 Гц, 1Н), 6,72 (дд, J=2,0, 8,4 Гц, 1Н), 6,89 (т, J=2,0 Гц, 1Н), 7,20 (т, J=8,4 Гц, 1Н), 7,46 (т, J=8,1 Гц, 1Н), 7,69 (д, J=8,0 Гц, 1Н), 7,80 (д, J=8,0 Гц, 1Н), 7,94 (д, J=2,0, 9,0 Гц, 1Н), 8,28 (д, J=9,0 Гц, 1Н), 8,4 (д, J=2,0 Гц, 1Н).
Соединение 672: (200 МГц, CDCl3) δ м.д.: 1,33 (т, J=7,3 Гц, 3H), 1,49 (д, J=6,8 Гц, 3H), 2,41 (с, 3H), 2,57-2,70 (м, 4H), 3,16-3,33 (м, 6H), 3,91 (кв, J=7,3 Гц, 2H), 4,52-4,69 (м, 3H), 5,08 (д, J=9,0 Гц, 1Н), 6,73 (дд, J=2,2, 8,6 Гц, 2H), 6,81 (д, J=9,0 Гц, 1Н), 6,97 (т, J=2,2 Гц, 1Н), 7,23 (т, J=8,1 Гц, 1Н), 7,62-7,68 (м, 2H).
Соединение 673: (200 МГц, CDCl3) δ м.д.: 1,31 (т, J=7,0 Гц, 3H), 1,33 (с, 6H), 1,49 (д, J=7,0 Гц, 3H), 1,80 (т, J=6,6 Гц, 2H), 2,39 (с, 3H), 2,59 (т, J=5,0 Гц, 4H), 2,79 (т, J=7,0 Гц, 2H), 3,25 (т, J=5,0 Гц, 4H), 3,90 (кв, J=7,0 Гц, 2H), 4,48-4,65 (м, 1Н), 5,07 (д, J=9,5 Гц, 1Н), 6,73 (дд, J=2,4, 8,1 Гц, 2H), 6,82 (д, J=9,2 Гц, 1Н), 6,97 (т, J=2,4 Гц, 1Н), 7,23 (т, J=8,1 Гц, 1H), 7,51-7,57 (м, 2H).
Соединение 674: (200 МГц, CDCl3) δ м.д.: 1,34 (т, J=7,3 Гц, 3H), 1,49 (д, J=6,8 Гц, 3H), 2,21 (квинт, J=6,0 Гц, 2H), 2,37 (с, 3H), 2,59 (т, J=4,6 Гц, 4H), 3,25 (т, J=4,6 Гц, 4H), 3,93 (кв, J=7,3 Гц, 2H), 4,27 (дд, J=6,0, 11,6 Гц, 4H), 4,51-4,66 (м, 1Н), 5,15 (д, J=9,5 Гц, 1Н), 6,74 (дд, J=2,2, 8,4 Гц, 1Н), 7,07-7,13 (м, 2H), 7,23 (т, J=8,1 Гц, 1Н), 7,38 (дд, J=2,4, 8,1 Гц, 1Н), 7,43 (д, J=2,0 Гц, 1Н).
Соединение 675: (200 МГц, CDCl3) δ м.д.: 1,36 (т, J=7,3 Гц, 3H), 1,49 (д, J=6,8 Гц, 3H), 2,39 (с, 3H), 2,59 (т, J=5,0 Гц, 4H), 3,26 (т, J=5,0 Гц, 4H), 3,95 (кв, J=7,3 Гц, 2H), 4,50-4,68 (м, 1Н), 5,18 (д, J=9,5 Гц, 1Н), 6,05 (с, 2H), 6,74 (дд, J=2,4, 8,1 Гц, 2H), 6,86 (д, J=8,4 Гц, 1Н), 6,98 (т, J=2,4 Гц, 1Н), 7,19-7,27 (м, 2H), 7,42 (дд, J=1,8, 8,1 Гц, 1Н).
Соединение 676: (200 МГц, CDCl3) δ м.д.: 1,27-1,33 (м, 15H), 1,47 (д, J=6,8 Гц, 3H), 2,43 (с, 3H), 2,61-2,72 (м, 4H), 3,25-3,33 (м, 4H), 3,90 (кв, J=7,5 Гц, 2H), 4,57 (дд, J=6,8, 9,2 Гц, 1Н), 5,13 (д, J=9,2 Гц, 1Н), 6,70-6,79 (м, 2H), 6,99 (т, J=2,2 Гц, 1Н), 7,22 (т, J=8,1 Гц, 1H), 7,41 (д, J=8,6 Гц, 1Н), 7,57 (дд, J=2,0, 8,1 Гц, 1Н), 7,79 (д, J=2,0 Гц, 1Н).
Соединение 677: (200 МГц, CDCl3) δ м.д.: 1,32 (т, J=7,3 Гц, 3H), 1,49 (д, J=6,8 Гц, 3H), 2,22 (с, 3H), 2,38 (с, 3H), 2,56-2,63 (м, 4H), 3,14-3,30 (м, 6H), 3,84-4,10 (м, 4H), 4,53-4,64 (м, 1Н), 5,25 (д, J=9,5 Гц, 1Н), 6,71-6,79 (м, 2H), 7,01 (т, J=2,4 Гц, 1Н), 7,22 (т, J=8,4 Гц, 1Н), 7,57 (с, 1Н), 7,69 (дд, J=2,0, 8,4 Гц, 1Н), 8,27 (д, J=8,4 Гц, 1Н).
Соединение 678: (200 МГц, CDCl3) δ м.д.: 1,32 (т, J=7,3 Гц, 3H), 1,46 (д, J=6,8 Гц, 3H), 2,11 (квинт, J=7,5 Гц, 2H), 2,36 (с, 3H), 2,58 (т, J=5,0 Гц, 4H), 2,94 (т, J=7,5 Гц, 4H), 3,25 (т, J=5,0 Гц, 4H), 3,92 (кв, J=7,3 Гц, 2H), 4,52-4,67 (м, 1Н), 5,15 (д, J=10,0 Гц, 1Н), 6,73 (дд, J=2,2, 8,1 Гц, 2H), 6,98 (т, J=2,2 Гц, 1Н), 7,22 (т, J=7,9 Гц, 1Н), 7,31 (д, J=8,1 Гц, 1Н), 7,62 (дд, J=2,2, 7,9 Гц, 1Н), 7,67 (с, 1Н).
Соединение 679: (600 МГц, ДМСО-d6) δ м.д.: 1,24 (т, J=7,1 Гц, 3H), 1,29 (д, J=6,9 Гц, 3H), 2,22 (с, 3H), 2,40-2,46 (м, 4H), 3,12-3,16 (м, 4H), 3,81-3,97 (м, 2H), 4,64-4,72 (м, 1H), 6,53-6,58 (м, 1Н), 6,60-6,65 (м, 1Н), 6,77-6,82 (м, 2H), 7,20 (т, J=8,3 Гц, 1Н), 7,60 (д, J=8,7 Гц, 1Н), 7,94-7,99 (м, 1Н), 8,17-8,23 (м, 2H), 8,54-8,61 (м, 1Н).
Соединение 698: (600 МГц, CDCl3) δ м.д.: 1,33 (т, J=7,1 Гц, 3H), 1,43 (д, J=6,9 Гц, 3H), 2,11 (с, 3H), 3,10-3,20 (м, 4H), 3,53-3,59 (м, 2H), 3,67-3,74 (м, 2H), 3,89-4,00 (м, 2H), 4,67 (кв, J=7,1 Гц, 1Н), 6,65-6,75 (м, 2H), 6,94-6,97 (м, 1Н), 7,21-7,25 (м, 1Н), 7,46-7,50 (м, 1Н), 7,69-7,73 (м, 1Н), 7,80-7,84 (м, 1Н), 7,95-7,99 (м, 1Н), 8,29-8,34 (м, 1Н), 8,45-8,47 (м, 1Н).
Далее описаны типичные способы подготовки исходных материалов, используемых для получения соединений по настоящей заявке.
Стандартные примеры 1-3
Начиная с соответствующего амина вместо 1,4-диокса-8-азаспиро[4,5]декана, использованного в примере 7-(1), процедуру, сходную с использованной в примере 7-(1), повторяли для получения названных соединений.
Стандартный пример 1
3-((2R,6S)-2,6-диметилморфолин-4-ил)-фенол
Формула 79

Коричневое маслянистое вещество, выход 71%.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,24 (д, J=6,0 Гц, 6H), 2,36-2,45 (м, 2H), 3,37-3,46 (м, 2H), 3,73-3,83 (м, 2H), 5,01 (с, 1H), 6,28-6,33 (м, 1H), 6,36-6,38 (м, 1H), 6,46-6,51 (м, 1H), 7,10 (т, J=8,0 Гц, 1H).
Стандартный пример 2
3-[4-(2-диметиламиноэтил)-пиперазин-1-ил]-фенол
Формула 80
Желтое маслянистое вещество, выход 12%.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 2,29 (с, 6H), 2,48-2,57 (м, 4H), 2,57-2,64 (м, 4H), 3,11-3,16 (м, 4H), 6,24-6,30 (м, 1H), 6,32-6,37 (м, 1H), 6,42-6,49 (м, 1H), 7,04-7,09 (м, 1H).
Стандартный пример 3
3-[(2-диметиламиноэтил)-метил-амино]-фенол
Формула 81

Коричневое маслянистое вещество, выход 42%.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 2,27 (с, 6H), 2,44-2,50 (м, 2H), 2,87 (с, 3H), 3,37-3,44 (м, 2H), 6,09-6,16 (м, 2H), 6,19-6,24 (м, 1H), 7,01 (т, J=8,0 Гц, 1H).
Стандартный пример 4
3-(4-изопропил-пиперазин-1-ил)-фенол
Формула 82

К раствору 3-пиперазин-1-ил-фенола (2,00 г) в ТГФ (40 мл) добавляли ацетон (1,95 г) и NaBH(OAc)3 (7,12 г), после чего смесь перемешивалась при комнатной температуре в течение 18 часов. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, после чего смесь экстрагировали этилацетатом. Органическую фазу высушивали (MgSO4) и фильтровали для получения названного соединения (1,48 г в виде бесцветного порошка).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,11 (д, J=6,4 Гц, 6H), 2,68-2,72 (м, 4H), 2,71-2,78 (м, 1H), 3,15-3,23 (м, 4H), 6,28-6,32 (м, 1H), 6,36 (т, J=2,3 Гц, 1H), 6,50 (дд, J=8,3, 2,3 Гц, 1H), 7,09 (т, J=8,3 Гц, 1H).
Стандартный пример 5
3-(1-изопропилпиперидин-4-ил)-фенол
Формула 83
Начиная с 3-пиперидин-4-ил-фенола вместо 3-пиперазин-1-ил-фенола, использованного в стандартном примере 4, процедуру, аналогичную той, что использовали в стандартном примере 4, повторяли для получения названного соединения (выход 31%, в виде бесцветного порошка).
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 1,16 (д, J=6,4 Гц, 6H), 1,76-1,86 (м, 2H), 1,91-2,01 (м, 2H), 2,31-2,50 (м, 3H), 2,92-3,02 (м, 1H), 3,08-3,19 (м, 2H), 6,66-6,72 (м, 2H), 6,74-6,79 (м, 1H), 7,11 (т, J=7,8 Гц, 1H).
Стандартный пример 6
4-фтор-3-(4-метил-пиперазин-1-ил)-фенол
Формула 84

4-бензилокси-2-хлор-1-фторбензол
Формула 85

(1) Суспензию 3-хлор-4-фторфенола (2,00 г), бензилхлорида (1,88 мл) и карбоната калия (2,82 мл) в диметилформамиде (10 мл) перемешивали при комнатной температуре в течение трех часов. К реакционной смеси добавляли воду, после чего смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, высушивали (MgSO4), фильтровали и концентрировали, полученный остаток очищали способом колоночной хроматографии на силикагеле (OH SiO2, AcOEt/гексан = 0-10%) для получения названного соединения (2,00 г) в виде светло-желтого маслянистого вещества.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 5,01 (с, 2H), 6,77-6,86 (м, 1H), 6,96-7,09 (м, 2H), 7,30-7,46 (м, 5H).
1-(5-бензилокси-2-фторфенил)-4-метил-пиперазин
Формула 86
(2) В атмосфере аргона при комнатной температуре соединение (7,5 г), полученное в стандартном примере 6-(1), а затем раствор 2,8,9-триизобутил-2,5,8,9-тетрааза-1-1 фосфино-бицикло[3,3,3]-ундекана (1,1 г) в толуоле (320 мл) добавляли к трис(дибензилиден)дипалладию (1,45 г) и т-бутоксинатрию (4,26 г). Затем при комнатной температуре добавляли раствор N-метилпиперазина (1,02 г) в толуоле (20 мл), после чего смесь перемешивали при 100°С в течение 60 часов. Реакционную смесь концентрировали, полученный остаток очищали способом колоночной хроматографии на силикагеле (NH SiO2, AcOEt/гексан = 0-30%) для получения названного соединения (2,27 г) в виде желтого маслянистого вещества.
1H-ЯМР (600 МГц, CDCl3) δ м.д.: 2,35 (с, 3H), 2,55-2,63 (м, 4H), 3,06-3,15 (м, 4H), 5,00 (с, 2H), 6,46-6,51 (м, 1H), 6,56-6,59 (м, 1H), 6,89-6,95 (м, 1H), 7,29-7,45 (м, 5H).
4-фтор-3-(4-метилпиперазин-1-ил)-фенол
Формула 87

(3) Суспензию соединения, полученного в эталонном примере 6-(2), (2,48 г) и гидрооксида палладия (10%, 250 мг) в метаноле (30 мл) перемешивали в атмосфере водорода при 65°C в течение двух с половиной часов, а затем при комнатной температуре в течение ночи. Реакционный раствор фильтровали через целлит и фильтрат концентрировали. Полученный остаток очищали способом колоночной хроматографии на силикагеле (NH SiO2, AcOEt/гексан = 0-99%, метанол/хлороформ = 0-10%). Затем полученное соединение снова очищали способом колоночной хроматографии на силикагеле (OH SiO2, метанол/хлороформ = 0-10%) для получения названного соединения (877 мг) в виде твердого вещества цвета охры.
1H-ЯМР (600 МГц, ДМСО-d6) δ м.д.: 2,21 (с, 3H), 2,39-2,48 (м, 4H), 2,89-2,99 (м, 4H), 6,26-6,31 (м, 1H), 6,35-6,39 (м, 1H), 6,84-6,91 (м, 1H), 9,20 (с, 1H).
Далее в качестве примера описан стандартный способ получения промежуточного соединения, представленного формулой (II) настоящего изобретения.
Начиная с соответствующих исходных материалов повторяли процедуры, описанные в примерах от 1-(1) до 1-(7), примерах 2-(1) и 2-(2), примерах 7-(1) и 7-(2), примерах 17-(1) и 17-(2), примере 18-(1), примере 21-(1), примере 22-(1), примере 23-(1) и примерах от 26-(1) до 26-(8), с последующим образованием солей, как это требуется для получения соединений или солей соединений, являющихся промежуточными соединениями, применяемыми при получении соединения с формулой (I) по представленному изобретению. Полученные промежуточные соединения представлены в таблице 2 наряду с промежуточными соединениями, полученными в примерах выше.
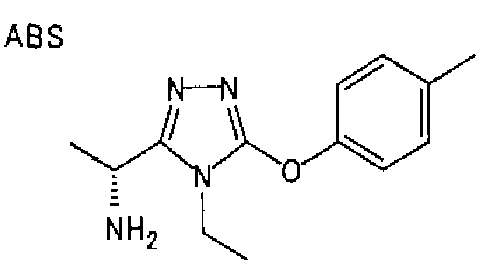


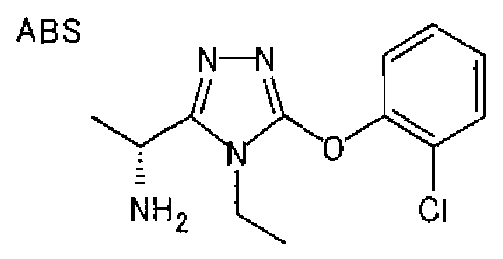










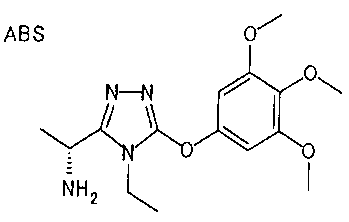


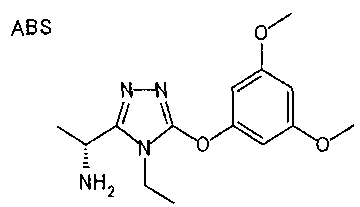
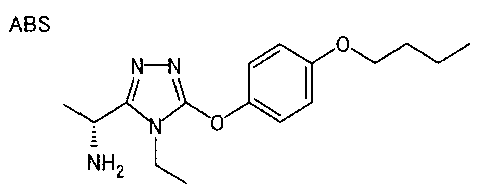





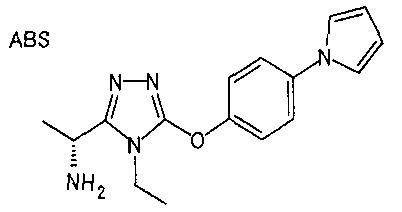

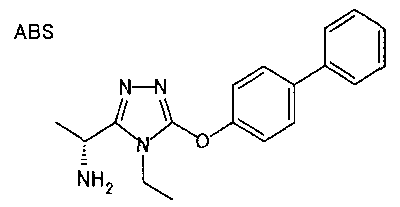

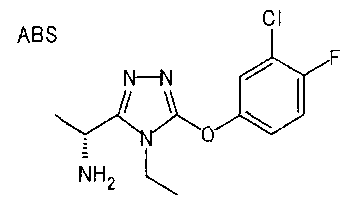




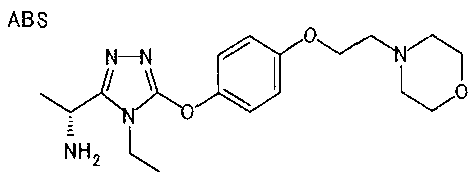
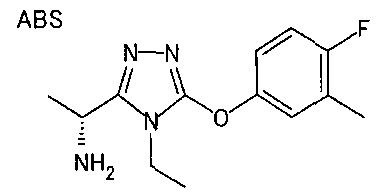
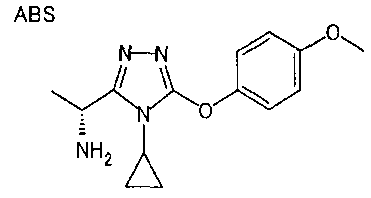

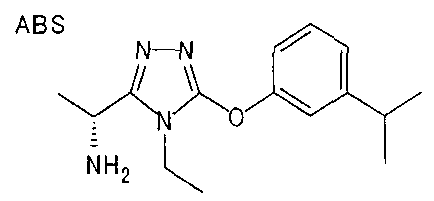
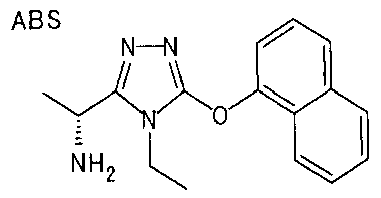
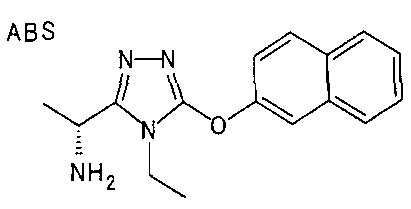


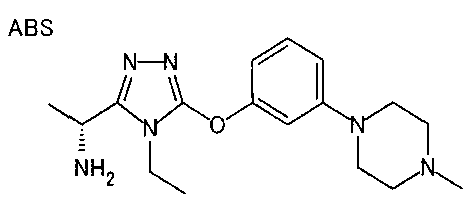

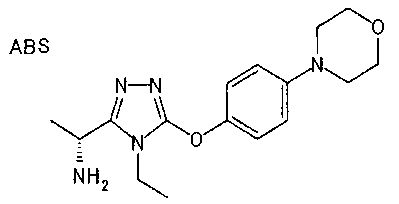


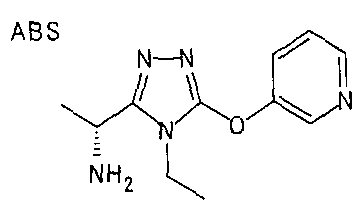
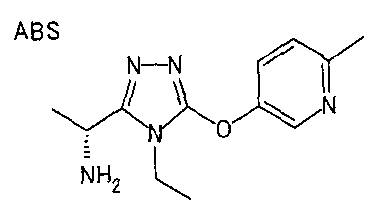
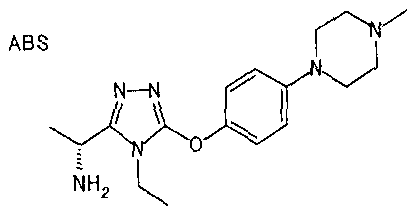
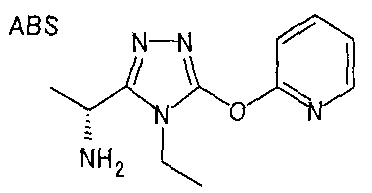



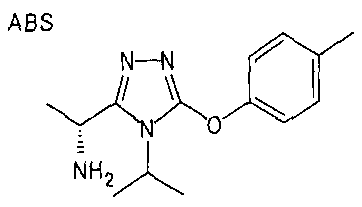

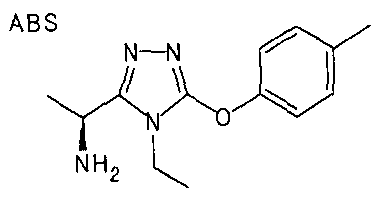

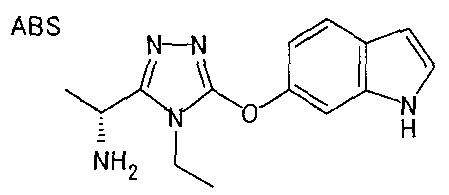








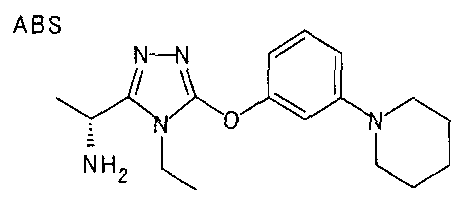
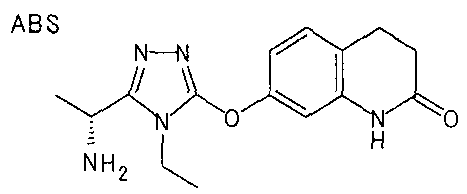



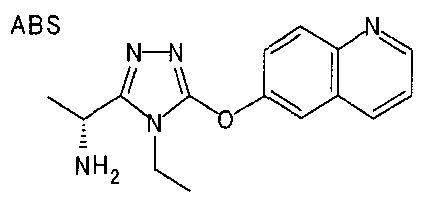

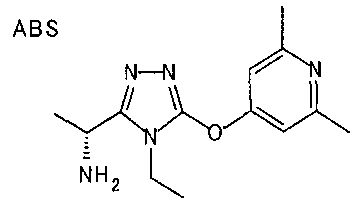






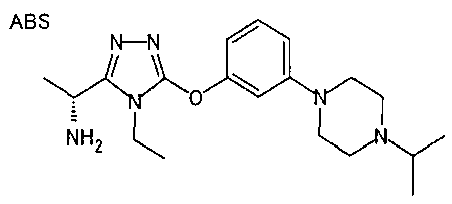

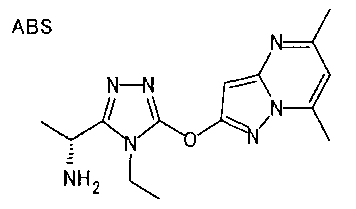
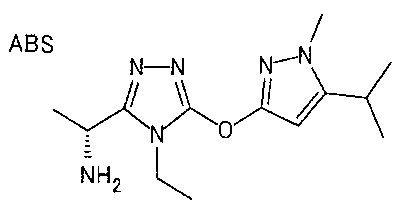



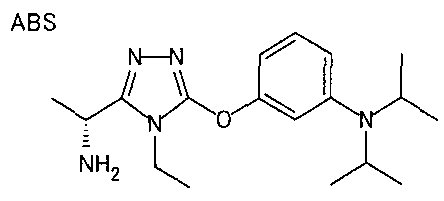

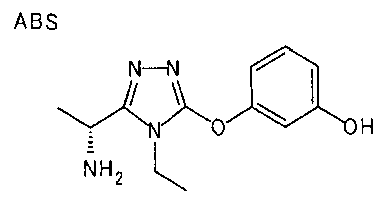

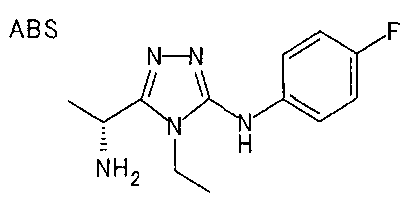


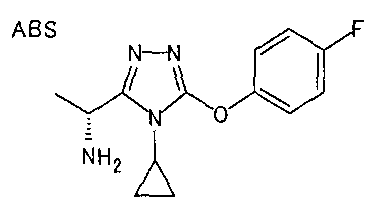

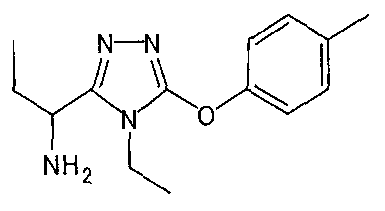

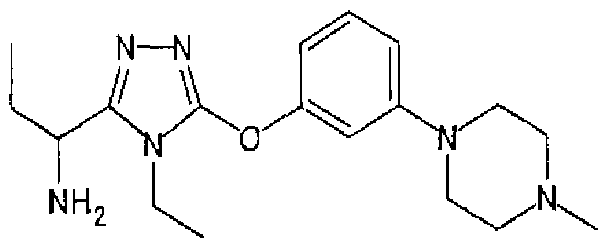
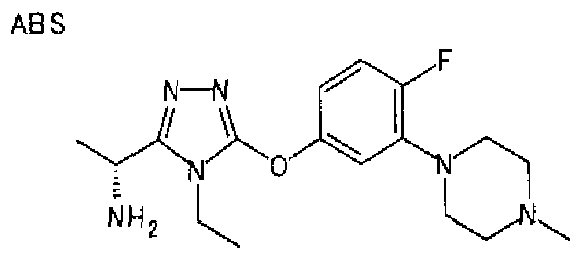
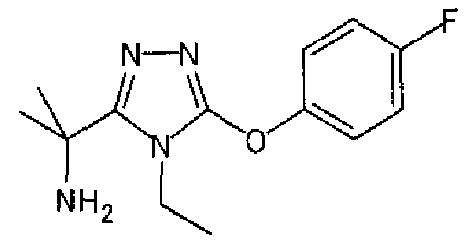
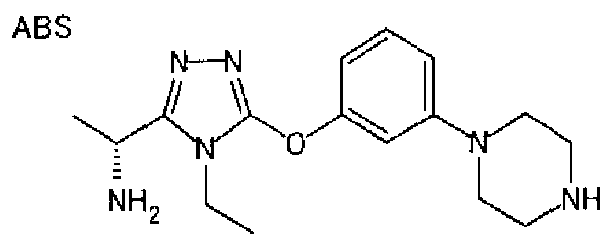




Промышленная применимость
Поскольку соединения по настоящему изобретению являются превосходными лигандами Edg-1 (S1P1), они могут использоваться в качестве препаратов для лечения или предотвращения аутоиммунных заболеваний, таких как болезнь Крона, аллергический колит, синдром Шегрена, рассеянный склероз и системная красная волчанка, и таких заболеваний, как ревматоидные артриты, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартриты и связанная с возрастом дегенерация желтого пятна.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОР СВЯЗЫВАНИЯ СФИНГОЗИН-1-ФОСФАТА | 2007 |
|
RU2395499C2 |
| α,ω ДИАРИЛАЛКАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2105752C1 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИНОНА И ТРИАЗИНОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ ПРЕПАРАТОВ | 2001 |
|
RU2279428C2 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ КАННАБИНОИДНОГО РЕЦЕПТОРА | 2004 |
|
RU2348620C2 |
| ЗАМЕЩЕННЫЕ БЕНЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2658919C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2001 |
|
RU2340611C2 |
| 5-ЧЛЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕКАРСТВЕННЫХ ЦЕЛЕЙ | 2008 |
|
RU2515968C2 |
| ПРОИЗВОДНЫЕ ДИАРИЛАЛКАНОВ, СОДЕРЖАЩИЕ АЛИЦИКЛИЧЕСКУЮ ГРУППУ, ПРОЯВЛЯЮЩИЕ АНТАГОНИЗМ В ОТНОШЕНИИ СЕРОТОНИН-2-РЕЦЕПТОРОВ И/ИЛИ ИНГИБИРУЮЩУЮ АКТИВНОСТЬ В ОТНОШЕНИИ СКВАЛЕН-СИНТАЗЫ, КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2139277C1 |
| ИНГИБИТОРЫ ГЛЮКОЗИЛЦЕРАМИДСИНТАЗЫ 2-АЦИЛАМИНОПРОПАНОЛЬНОГО ТИПА | 2009 |
|
RU2578947C2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА АМИДНОГО ТИПА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ | 2001 |
|
RU2232761C2 |
Описываются новые производные триазола общей формулы (1):
Формула (1) 
(где А -атом кислорода, серы, группа -СН2- или -NH-;
R1 обозначает C1-6алкильную группу, возможно замещенную;
R1A обозначает атом водорода или C1-6алкильную группу; или эти два радикала вместе с атомом углерода, к которому присоединены, образуют С3-6 циклоалкильную группу;
R2 обозначает С1-6алкильную группу или С3-6циклоалкильную группу;
R3 обозначает арильную группу или гетероарильную группу, которые могут быть замещены;
R4 обозначает атом водорода;
R5 обозначает C1-6алкильную группу, арильную или гетероарильную группу, которые могут быть замещены), фармацевтическая композиция, их содержащая, и промежуточные соединения. Данные соединения (1) имеют способность ингибировать связывание между S1P и его рецептором, Edg-1 (S1P1) и могут найти применение в медицине. 3 н. и 15 з.п. ф-лы, 2 табл.
1. Соединение, представленное формулой (I)
Формула 1
 ,
,
или его фармацевтически приемлемая соль,
где А обозначает:
атом кислорода,
атом серы,
группу, представленную формулой -CH2-, или
группу, представленную формулой -NR6-, где R6 обозначает атом водорода;
R1 обозначает:
алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из:
атома галогена и фенильной группы;
R1A обозначает:
атом водорода или
алкильную группу, имеющую от 1 до 6 атомов углерода;
R1 и R1A необязательно образуют вместе с атомом углерода, к которому присоединены указанные R1 и R1A, циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
R2 обозначает:
алкильную группу, имеющую от 1 до 6 атомов углерода, или
циклоалкильную группу, имеющую от 3 до 6 атомов углерода;
R3 является:
2-нафтильной группой, 3-пиразолильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, и трифторметильной группы, или
5-бензотиазолильной группой, 5-бензотиадиазолильной группой, 7-дигидрохинолинонильной группой, 7-изохинолинильной группой, 7-хинолинильной группой, 3-пиридильной группой или индолильной группой, каждая из которых необязательно замещена одной или несколькими алкильными группами, имеющими от 1 до 6 атомов углерода, незамещенной фенильной группой или замещенной фенильной группой (А), (В) или (С), описанной ниже:
(А) фенильная группа, замещенная в положении 4 заместителем, выбранным из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода,
циклоалкильной группы, имеющей от 3 до 8 атомов углерода,
алкоксигруппы, имеющей от 1 до 6 атомов углерода, указанная алкоксигруппа необязательно замещена одним или более заместителями, выбранными из группы, состоящей из аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, морфолиногруппы, и фенильной группы,
атома галогены,
трифторметоксигруппы,
феноксигруппы,
фенильной группы,
1-пирролильной группы и
-NRARB, где каждый из RA и RВ является алкильной группой, имеющей от 1 до 6 атомов углерода, или RA и RB месте с атомом азота, к которому присоединены указанные RA RB образуют 3-5-членное насыщенное углеводородное кольцо,
где указанная фенильная группа, замещенная в 4 положении, далее необязательно замещена в положении 3 заместителем, выбранным из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, атома галогена и алкоксигруппы, имеющей от 1 до 6 атомов углерода;
(B) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из:
гидроксильной группы,
алкильной группы, имеющей от 1 до 6 атомов углерода,
алкоксигруппы, имеющей от 1 до 6 атомов углерода, указанная алкоксигруппа необязательно замещена аминогруппой, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая,
где указанная фенильная группа, замещенная в 3 положении, далее необязательно замещена одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или далее необязательно замещена в 4 положении атомом галогена; и
(C) фенильная группа, замещенная в 3 положении заместителем, выбранным из группы, состоящей из азотсодержащих групп (i)-(v), описанных ниже, указанная фенильная группа далее необязательно замещена в 4 положении атомом галогена:
(i) моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода и имеющая один или несколько атомов азота в качестве атомов кольца, которая необязательно замещена одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(ii) имидазолильная группа, пирролильная группа или триазолильная группа,
(iii) морфолинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(iv) пиперазиногруппа, необязательно замещенная алканоильной группой, имеющей от 2 до 7 атомов углерода, или алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 углеродных атомов каждая, и
морфолиногруппы, и
(v) группа, представленная формулой -NR7R8,
где каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную аминогруппой, которая необязательно замещена одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, или алкоксигруппой, имеющей от 1 до 6 атомов углерода,
алканоильную группу, имеющую от 1 до 6 атомов углерода,
карбамоильную группу, необязательно замещенную одной или более алкильными группами, имеющими от 1 до 4 атомов углерода каждая,
морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или более алкильными группами, имеющими от 1 до 4 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому они присоединены, 3-8-членное насыщенное углеводородное кольцо, которое также может быть замещено одним или более заместителями, выбранными из группы, состоящей из диметилендиоксигруппы, оксогруппы и гидроксильной группы;
R4 обозначает атом водорода;
R5 является:
алкильной группой, имеющей от 1 до 6 атомов углерода и замещенной нафтильной группой,
алкенильной группой, имеющей от 2 до 6 атомов углерода и замещенной фенильной группой,
незамещенной фенильной группой,
фенильной группой, замещенной от 1 до 5 заместителями, выбранными из группы, состоящей из метильной группы, метоксигруппы и атома галогена,
фенильной группой, замещенной от 1 до 3 заместителями, выбранными из группы, состоящей из:
алкильной группы, имеющей от 1 до 6 атомов углерода,
атома галогена,
метоксигруппы,
трифторметоксигруппы,
дифторметоксигруппы,
трифторметильной группы,
алкенильной группы, имеющей от 1 до 6 атомов углерода,
метилсульфонильной группы,
ацетильной группы,
метоксикарбонильной группы и
цианогруппы,
указанная фенильная группа замещена в положении 3 или 4 или в обоих;
нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
атома галогена,
алкильной группы, имеющей от 1 до 6 атомов углерода,
цианогруппы и
алкилсульфонильной группы, имеющей от 1 до 6 атомов углерода, или
незамещенной бензотиенильной группой, бензодиоксолильной группой, дигидробензодиоксинильной группой, дигидробензофуранильной группой, инданильной группой или 5-бензотиадиазолильной группой, каждая из которых необязательно замещена одним или более заместителями, выбранными из группы, состоящей из алкильной группы, имеющей от 1 до 6 атомов углерода, и атома галогена.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где А является атомом кислорода.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где А является группой, представленной формулой -NH-.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где
R1 является:
алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более атомами галогена, или
бензильной группой; и
R1A является атомом водорода.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 является метильной группой или этильной группой, и R1A является атомом водорода.
6. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 является этильной группой или циклопропильной группой.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где R5 является:
фенильной группой, замещенной в каждом из положений 3 и 4 атомом галогена, или
нафтильной группой, необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из атома галогена, алкильной группы, имеющей от 1 до 6 атомов углерода, и цианогруппы.
8. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 является фенильной группой, замещенной в положении 3 заместителем, выбранным из группы, состоящей из азотсодержащих групп (i)-(v), описанных ниже, указанная фенильная группа далее необязательно замещена в положении 4 атомом галогена:
(i) моноциклическая насыщенная углеводородная группа, имеющая от 2 до 7 атомов углерода и имеющая один или несколько атомов азота в качестве атомов кольца, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(ii) имидазолильная группа, пирролильная группа или триазолильная группа,
(iii) морфолинильная группа, необязательно замещенная одной или более алкильными группами, имеющими от 1 до 6 атомов углерода,
(iv) пиперазиногруппа, необязательно замещенная алканоильной группой, имеющей от 2 до 7 атомов углерода, или алкильной группой, имеющей от 1 до 6 атомов углерода и необязательно замещенной одним или более заместителями, выбранными из группы, состоящей из:
аминогруппы, замещенной двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, и
морфолиногруппы, и
(v) группа, представленная формулой -NR7R8, где:
каждый из R7 и R8 обозначает:
атом водорода,
алкильную группу, имеющую от 1 до 6 атомов углерода и необязательно замещенную аминогруппой, которая необязательно замещена одной или двумя алкильными группами, имеющими от 1 до 6 углеродных атомов каждая, или алкоксигруппой, имеющей от 1 до 6 атомов углерода, алканоильную группу, имеющую от 1 до 6 атомов углерода, карбамоильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 4 атомов углерода каждая, морфолинокарбонильную группу,
аминосульфонильную группу, необязательно замещенную одной или двумя алкильными группами, имеющими от 1 до 6 атомов углерода каждая, или
алкилсульфонильную группу, имеющую от 1 до 6 атомов углерода, или
R7 и R8 необязательно образуют вместе с атомом азота, к которому они присоединены, 3-8-членное насыщенное углеводородное кольцо, необязательно замещенное одним или более заместителями, выбранными из группы, состоящей из диметилендиоксигруппы, оксогруппы и гидроксильной группы.
9. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 является фенильной группой, замещенной в положении 4 атомом фтора или атомом хлора.
10. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 является 6-индолильной группой.
11. Фармацевтическая композиция, обладающая ингибирующим действием на связывание между сфингозин-1-форфатом и его рецептором Edg-1, содержащая соединение по п.1 или его фармацевтически приемлемую соль.
12. Фармацевтическая композиция по п.11 для лечения аутоиммунных заболеваний, таких как болезнь Крона, аллергический колит, синдром Шегрена, рассеянный склероз и системная красная волчанка, ревматоидные артриты, астма, атопический дерматит, отторжение после трансплантации органов, рак, ретинопатия, псориаз, остеоартриты или связанная с возрастом дегенерация желтого пятна.
13. Соединение, представленное формулой (II)
Формула (II)

или его соль, где R1, R1A, R2 и R3 определены как в п.1, и А' обозначает атом кислорода или NH.
14. Соединение по п.13 или его соль, где в формуле (II):
А' обозначает атом кислорода.
15.Соединение по п.13 или его соль, где в формуле (II):
А' обозначает NH.
16.Соединение по п.13 или его соль, где
R1 является алкильной группой, имеющей от 1 до 6 атомов углерода, и необязательно замещенной одним или несколькими атомами галогена, или бензильной группой; и
R1A является атомом водорода.
17. Соединение по любому из пп.13-15 или его соль, где R1 является метильной группой или этильной группой, и R1A является атомом водорода.
18. Соединение по любому одному из пп.13-16 или его соль, где R2 является этильной или циклопропильной группой.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНОЕ И АКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2131421C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), ПРОИЗВОДНЫЕ 3,5-ДИФЕНИЛ-1,2,4-ТРИАЗОЛОВ, В НЕЕ ВХОДЯЩИЕ | 1997 |
|
RU2208010C2 |
Авторы
Даты
2011-01-20—Публикация
2007-02-05—Подача