Область техники, к которой относится изобретение
Настоящее изобретение относится к способу обнаружения окисленных форм аполипопротеина AI.
Уровень техники
Печеночно-клеточный рак (ПКР) является неопластическим заболеванием, занимающим пятое место по частоте встречаемости и третье место по смертности среди раковых заболеваний, причем каждый год диагностируют 500000 новых случаев. Хотя основные причины ПКР известны, в их числе вирус гепатита В (ВГВ) и вирус гепатита С (ВГС), употребление пищи, содержащей афлатоксины, или повышенное потребление алкоголя, прогноз течения заболевания у пациентов с ПКР плохой в связи с тяжелым состоянием к моменту постановки диагноза и отсутствием эффективных способов лечения. В связи с этим идентификация биомаркеров, позволяющая эффективно описать стадию заболевания, имеет большое значение.
Очевидно, что многие патологические процессы ассоциированы с количественными и функциональными изменениями молекулярных компонентов тканевых жидкостей. Исключая клеточные компоненты, сравнительный анализ образцов жидкостей тела от здоровых и больных субъектов возможен только на уровне анализа белков, но не на уровне транскрипции. Хотя цереброспинальная жидкость и моча используются в медицине для диагностики, особый интерес для этой цели представляет анализ белков сыворотки, поскольку она постоянно проникает в ткани и, следовательно, начало заболевания или состояние болезни могут быть установлены путем определения, измерения и описания тысяч отдельных циркулирующих в крови белков и пептидов. Кроме того, методы изучения сыворотки бескровны и неинвазивны, получение образцов не представляет сложности, методы легко и быстро выполнимы, а также недороги.
Традиционные методы, позволяющие диагностировать ПКР, например, на основании повышения уровня альфа-фетопротеина (АФП), эффективны не во всех случаях и диагностируют заболевание уже на существенно продвинутой стадии. Были проведены исследования по идентификации маркеров ПКР, используя высокоэффективные методы протеомики применительно к печени (Zeindl-Eberhart Е. и др. Hepatology 39, 2004, с. 540-549), которые требуют применения инвазивных подходов для проведения диагностики, и в сыворотке (Steel F.L. и др. Proteomics 3, 2003, с. 601-609, Quina Yu He и др. Proteomics 3, 2003, с. 666-674). Хотя такие методы подтвердили свою эффективность в выявлении молекулярных мишеней, связанных с развитием различных болезней, из-за методической сложности их клиническое применение невозможно. Ни один из указанных выше методов не предоставляет информации, которая могла бы быть использована в качестве основы для развития способов диагностики, применимых в клинической практике. С другой стороны, различные исследования, в том числе описанные выше, установили связь между снижением уровней содержания Аро AI и развитием заболеваний печени. Однако ранее не было установлено повышенного содержания изоформы Аро AI в сыворотке пациентов с печеночно-клеточным раком, что является объектом настоящего изобретения.
Объект изобретения
Объектом настоящего изобретения является способ обнаружения в биологическом образце, предпочтительно в сыворотке, увеличения кислотности изоформы аполипопротеина AI, окисленной по меньшей мере по остатку триптофана или метионина. Предпочтительной является изоформа аполипопротеина AI, окисленная по остаткам аминокислот W50 и W108.
Подробное описание изобретения
Настоящее изобретение относится к способу обнаружения увеличения окисления изоформ аполипопротеина AI по меньшей мере по одному остатку триптофана или метионина в их составе, или их фрагментов, которые содержат окисленные остатки. В предпочтительном варианте осуществления настоящего изобретения предусмотрено обнаружение увеличения окисления по меньшей мере одной окисленной изоформы аполипопротеина AI пo меньшей мере по одному остатку аминокислоты, выбранному из W50, W108 и M112, или ее фрагментов, содержащих указанные остатки. Остатки аминокислот W50 и W108 могут быть окислены до кинуренина, формилкинуренина, гидрокситриптофана или 3-ОН-кинуренина. С другой стороны, остаток M112 может быть окислен до M112-сульфоксида или метионинсульфона.
Кроме того, способ - объект настоящего изобретения, отличается тем, что указанное обнаружение осуществляют в выделенных биологических образцах. Такие образцы выделяют из: сыворотки, плазмы, крови, мочи, слюны, спинномозговой жидкости, слез, амниотической жидкости, смыва с ткани, тканевого гомогената и клеточного лизата. В предпочтительном варианте осуществления настоящего изобретения указанным биологическим образцом является сыворотка.
В одном из вариантов осуществления настоящего изобретения обнаружение окисленных изоформ аполипопротеина AI проводят в образцах, взятых от индивидуумов с гепатитом, предпочтительно с гепатитом В (вирус гепатита В-ВГВ).
В контексте настоящего изобретения понятие «индивидуум» относится к какому-либо животному, предпочтительно млекопитающему. В предпочтительном варианте осуществления настоящего изобретения индивидуумом является мужчина или женщина.
В способе, описанном в этом изобретении, обнаружение указанного повышения может быть проведено путем сравнения с очищенными стандартами Аро AI, взятыми в определенных количествах, или путем сравнения с количеством указанной изоформы, присутствующей в том же биологическом образце, полученном от контрольного здорового индивидуума.
В предпочтительном варианте осуществления настоящего изобретения увеличение окисленной формы в сыворотке по сравнению с уровнем ее содержания в контроле, наблюдаемое с помощью указанного способа, больше по меньшей мере в 1,5 раза, предпочтительно по меньшей мере в 2,5 раза.
Кроме того, настоящее изобретение отличается тем, что в нем используются методы обнаружения и количественной оценки окисленных изоформ Аро AI, выбранные из: масс-спектрометрии, иммуноисследований, жидкостной хроматографии, методов прямой и непрямой фотометрии, а также их комбинации. В предпочтительном варианте осуществления настоящего изобретения методы масс-спектрометрии выбраны из: тандемной масс-спектрометрии в сочетании с жидкостной хроматографией (ЖХ-МС) и ионизации лазерной десорбцией при содействии матрицы с времяпролетным масс-анализатором (MALDI-TOF-MS - matrix-assisted laser desorption/ionization mass spectrometry time-of-flight MS). Кроме того, в предпочтительном варианте осуществления настоящего изобретения иммунологические исследования выбраны из: гомогенных исследований, гетерогенных исследований, ферментного иммуноанализа (EIA, ELISA), исследований конкуренции, иммунометрических исследований (иммуносэндвич), турбидиметрических исследований, нефелометрических исследований и их комбинаций, которые подробно описаны в кн.: «The Immunoassay Book», под ред. David Wild, 2е издание, 2001, изд-во Nature Publishing Group, и включены в настоящее изобретение в виде ссылок. В предпочтительном варианте осуществления настоящего изобретения способы обнаружения и количественной оценки окисленных форм аполипопротеина AI заключаются в применении антител, аптамеров и/или лецитинов, которые специфически распознают указанные изоформы Аро AI и их фрагменты.
Настоящее изобретение также позволяет установить связь между повышением содержания изоформ аполипопротеина AI и наличием печеночно-клеточного рака у индивидуума, чей биологический образец анализировался. В особом варианте осуществления настоящего изобретения указанный печеночно-клеточный рак находится на ранней стадии.
Кроме того, настоящее изобретение относится к набору для обнаружения, описанного выше повышения в изоформах аполипопротеина AI (Apo AI), отличающегося тем, что он содержит реагенты для осуществления способов, используемых в настоящем изобретении. В предпочтительном варианте осуществления настоящего изобретения указанные реагенты выбраны из специфических лигандов изоформ Apo AI, маркерных компонентов для выявления изоформ Apo AI, буферов, растворителей, стандартов и контролей. В предпочтительном варианте осуществления настоящего изобретения набор необязательно содержит бутыли, флаконы, пробирки, иглы, твердые субстраты и инструкции.
В другом варианте настоящее изобретение относится к способу диагноза in vitro печеночно-клеточного рака, отличающегося тем, что он предусматривает обнаружение увеличения окисления изоформ аполипопротеина AI по меньшей мере по одному остатку триптофана или метионина, или их фрагментов, которые содержат по меньшей мере один из указанных окисленных остатков. Указанный способ диагностики отличается тем, что выявляет указанные окисленные изоформы аполипопротеина AI по способу, описанному в настоящем разделе.
Краткое описание фигур
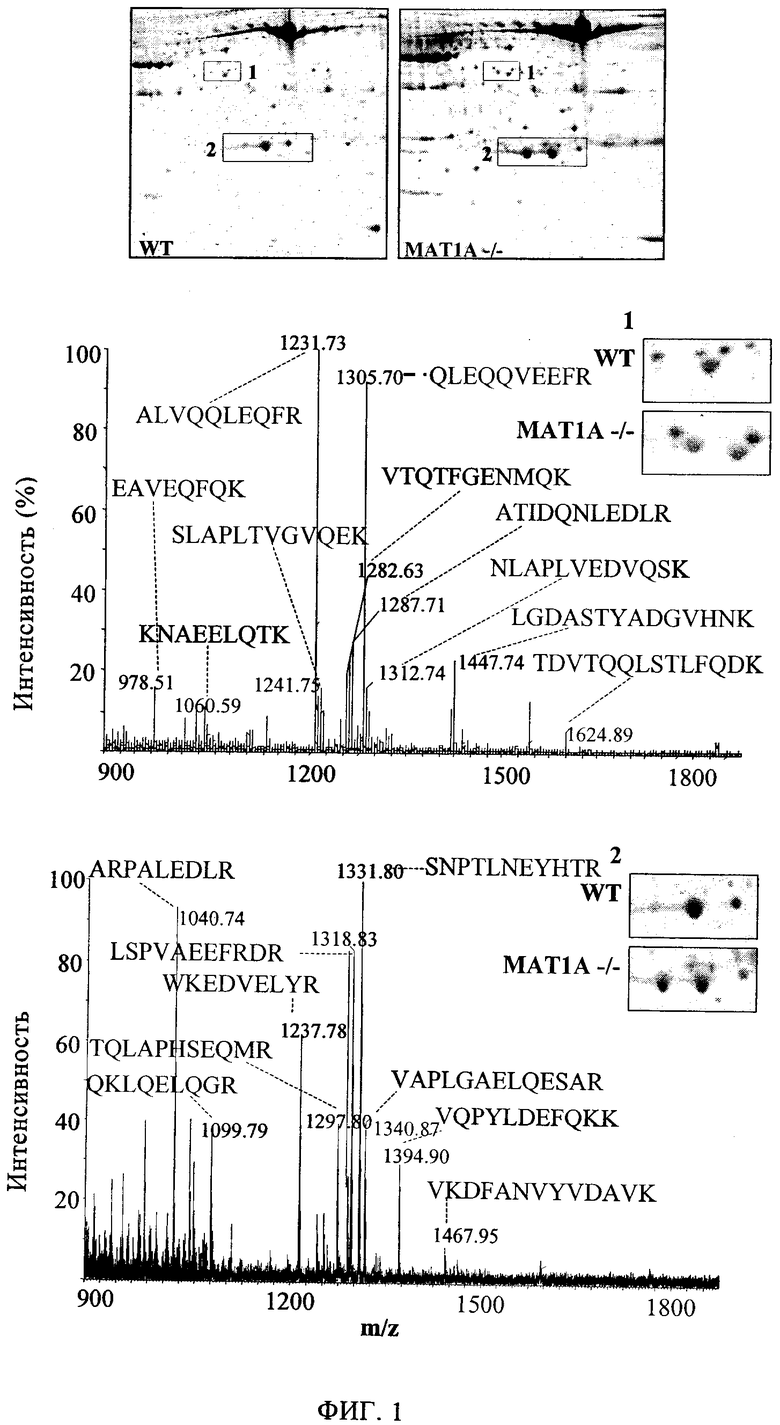
Фиг.1. Идентификация повышения уровней Apo AI и Apo AIV в сыворотке мышей линии MATIA-/-. Образцы сыворотки контрольных мышей (WT - дикий тип) и мышей линии MATIA-/- в возрасте 1, 3, 5, 12 и 18 месяцев анализируют с помощью двумерного электрофореза. Панель А представляет типичные гели трех независимых анализов. Отличающиеся полосы в геле идентифицированы в качестве зон 1 и 2. Панель Б показывает типичный спектр, полученный с помощью метода MALDI TOF MS, из полос 1 и 2 после расщепления трипсином. Обозначены пептиды, у которых последовательности совпадают с последовательностями Apo AIV (1) и Apo AI (2).
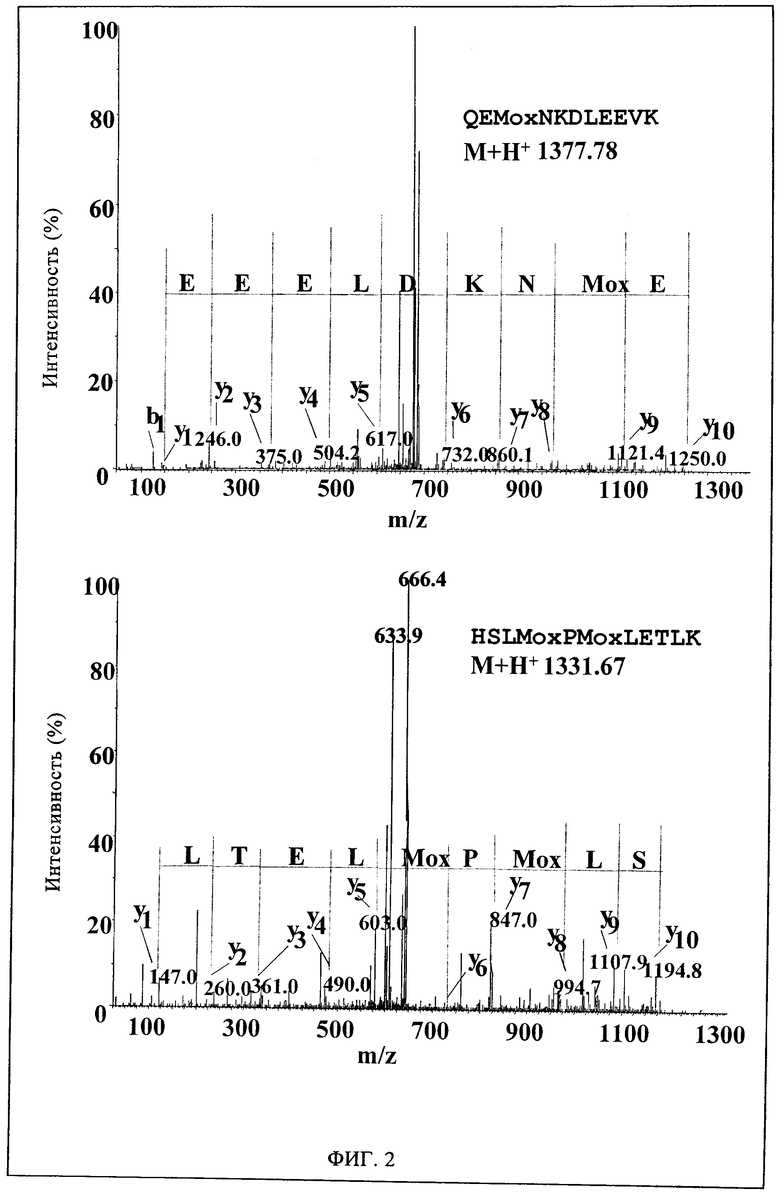
Фиг.2. Идентификация определенных остатков метионинсульфоксида в изоформе 1 Apo AI с помощью ESI-MS/MS. Пептиды, полученные в результате обработки трипсином Apo AI, разделяют с помощью нанопоточной жидкостной хроматографии с обращенной фазой. Колонку подсоединяют к тандемному масс-спектрометру с помощью электроспрея (ESI). Показаны спектры фрагментации пептидов, полученных из изоформы 1, которая содержит производные метионинсульфоксидов в положениях 85 и 116. Модификации были подтверждены в трех независимых экспериментах. Во всех исследованиях установлено, что в изоформах 2 и 3 остатки М85 и Ml16 не окислены.
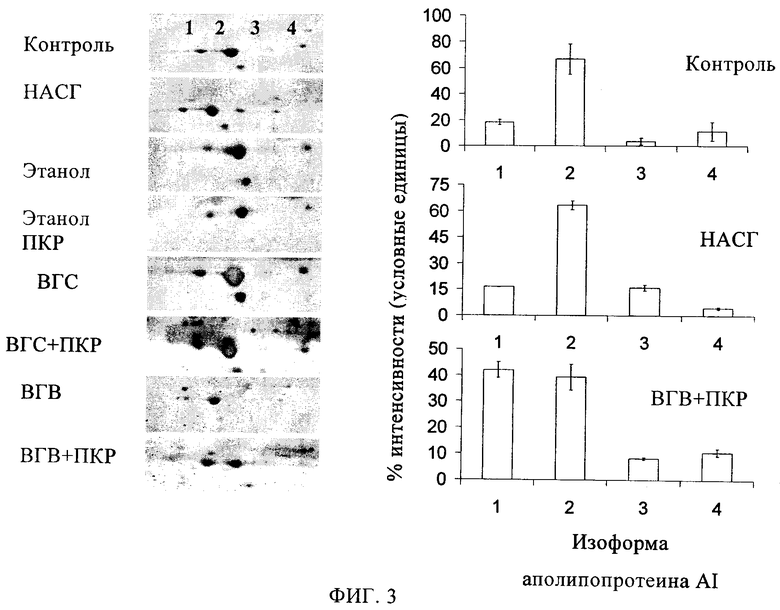
Фиг.3. Анализ изоформ аполипопротеина AI у людей с болезнями печени с помощью метода двумерного электрофореза. Анализируют изоформы аполипопротеина AI в сыворотке пациентов с указанными выше патологическими процессами в печени. Во всех группах анализируют образцы сыворотки от 6 пациентов, исключение составляют пациенты с неалкогольным стеатогепатитом (НАСТ), которых включено в исследование 15 человек. Панель А показывает срезы двумерного геля, содержащего четыре типа Аро AI. Полосы белка идентифицируют с помощью масс-спектрометрии MALDI TOF и секвенирования пептидов путем синтеза заново. Денситометрия полос Аро AI для этих групп, которые проявляют распределение изоформ, отличное от распределении у контрольных индивидуумов, показано на панеле Б. * и ** обозначают р<0,05, по сравнению с контрольными индивидуумами, в соответствии с t-тестом Стьюдента.
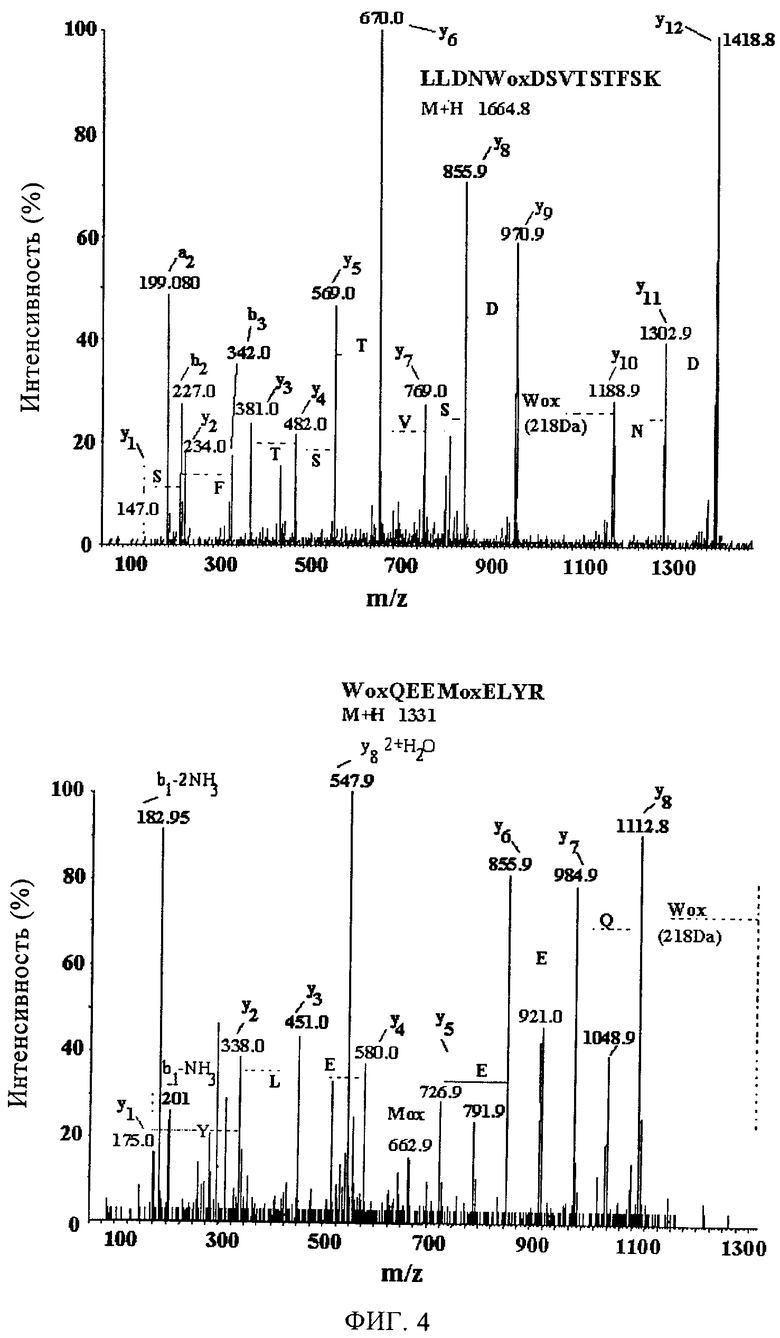
Фиг.4. Идентификация определенных производных метионинсульфоксида и формилкинуренина в изоформе 1 Аро AI человека. Пептиды, полученные в результате обработки трипсином изоформ Аро AI контрольных пациентов и пациентов с ВГВ+ПКР, разделяют с помощью нанопоточной жидкостной хроматографии с обращенной фазой. Элюированные пептиды были охарактеризованы с помощью тандемной масс-спектрометрии (ESI/MS/MS). Показаны спектры пептидов с определенными ионами метионинсульфоксида (M112) и формилкинуренина (W50 и W108). Модификации были подтверждены в трех независимых экспериментах, причем они обнаруживаются только в изоформе 1. Изоформы 2, 3 и 4 содержат неокисленные остатки метионина и триптофана.
Пример 1. В данном исследовании используют мышей линии MATIA-/-, которым свойственно постоянное снижение содержания фермента печени AdoMet, индуцирующее спонтанное развитие неалкогольного стеатогепатита (НАСТ) и печеночно-клеточного рака в возрасте 18 месяцев.
Образцы сыворотки получают у контрольных мышей дикого типа и мышей линии MATIA-/в возрасте 3, 5, 12 и 18 месяцев и последовательно изучают методом двумерного электрофореза и затем масс-спектрометрией. Таким способом добиваются разделения примерно 500 белков, сравнение которых проводят с помощью поисковой базы данных PDQUEST, при этом по меньшей мере двукратное увеличение или уменьшение расценивают в качестве отличия. С помощью такого критерия получают только две белковые полосы из сыворотки мышей MATIA-/-, увеличение которых постоянно наблюдают во всех исследованиях. Такие различия наблюдают у мышей, начиная с трехмесячного возраста.
Анализ с помощью ПМФ позволяет выявить такие две увеличенные белковые полосы аполипопротеина AIV и аполипопротеина AI (фиг.1). Поскольку ранее было установлено, что Аро AI ассоциирован с болезнями печени, такой анализ основывается на молекулярной характеристике специфически увеличенных форм, осуществляемой разрушением трипсином разных изоформ аполипопротеина AI, затем анализируют с помощью нано-жидкостной хроматографии, соединенной с время-пролетным масс-анализатором (Q TOF) микро-масс-спектрометром с помощью электроспрея (ESI/MS/MS). Пептиды с установленной последовательностью составляют более 40% последовательности Аро AI в трех изоформах (табл.1). Были установлены четыре остатка метионина, окисленные до метионинсульфоксида. Окисление Ml69 и М218 является обычным для трех изотопов Аро AI, и, следовательно, нельзя исключать ошибочного окисления, происходящего во время анализа образца. Однако сульфоксиды М85 и М216 обнаруживают только в изоформе 1 (фиг.2). Такая специфичность, подтвержденная тремя независимыми анализами, означает физиологическую значимость избирательного окисления остатков М85 и М216.
Таблица 1. Анализ изоформ Аро AI в сыворотке мышей с помощью LC/MS/MS. Пептиды получают из изоформ Аро A-I из сыворотки мышей линии MATIA-/ в результате их обработки трипсином и разделяют нанопоточной жидкостной хроматографией с обращенной фазой, соединенной с масс-спектрометром ESI/MS/MS. Последовательности пептидов Аро A-I устанавливают путем их синтеза заново. Окисленные остатки метионина подчеркнуты.
Пример 2.
Изучают уровни пост-трансляционного состояния Apo AI в образцах сыворотки, полученных от пациентов с различными патологическими поражениями печени, в том числе с неалкогольным стеатогепатитом (НАСГ), алкогольным циррозом, ВГВ, ВГЦ и ПКР. Четыре полосы идентифицируют в качестве Apo AI с помощью метода ПМФ (пептидного масс-фингерпринта) и определяют пептидную последовательность методом синтеза заново применительно ко всем образцам, а также методом двумерного вестерн-блоттинга. С помощью такого исследования устанавливают специфически связанные с патологией изменения относительного количества изоформ Apo. Все образцы сыворотки от пациентов с ВГВ и ПКР показывают увеличение содержания изоформы 1 в 2,5 раза по сравнению с контролями (относительное значение 41,93±3,00% по сравнению с 18,23±1,08% у контрольных индивидуумов)(фиг.3).
Затем было решено установить, является ли увеличение кислой изоформы Аро AI результатом увеличения состояния окисления белка. Продукты расщепления трипсином изоформ Аро AI от трех разных пациентов с ВГВ+ПКР анализируют с помощью нано-жидкостной хроматографии (нано-ЖХ), соединенной с время-пролетным масс-анализатором (Q TOF) микро-масс-спектрометром с помощью электроспрея (ESI/MS/MS). Установлено, что три специфических окисления специфичны для изоформы 1. Окисление метионина в положении 112 до метионинсульфоксида было установлено по +16 Да отклонению молекулярной массы иона (фиг.4). Кроме того, устанавливают, что ионы остатков триптофана в положениях 50 и 108 обладают дополнительными 32 единицами массы, которые сохраняются при формировании формилкинуренина в результате двух последовательных этапов окисления. M112 сульфоксид и формилкинуренин в положениях 50 и 108 обнаруживают только в изоформе 1 (табл.2), а последовательность пептидов-аналогов в изоформах 2, 3 и 4 содержат неокисленные остатки метионина и триптофана. Эти данные, полученные в трех независимых исследованиях, подтверждают физиологическую значимость таких модификаций.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ДЕТЕКЦИИ АПОЛИПОПРОТЕИНОВ | 2016 |
|
RU2763404C2 |
| ПЕПТИД, ОБЛАДАЮЩИЙ АНТИАТЕРОСКЛЕРОТИЧЕСКИМ ДЕЙСТВИЕМ И КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ АТЕРОСКЛЕРОЗА СОСУДОВ | 2012 |
|
RU2495048C1 |
| Липопротеиновые комплексы и их получение и применения | 2012 |
|
RU2627173C2 |
| ТРАНСГЕННЫЕ МЫШИ, ЭКСПРЕССИРУЮЩИЕ ЛИПОПРОТЕИН (А) ЧЕЛОВЕКА С ОТКЛЮЧЕННЫМ ГЕНОМ ВИТАМИНА С, И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ МОДЕЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2721254C2 |
| КОНЪЮГАТЫ И КОМПОЗИЦИИ ДЛЯ ИММУНОТЕРАПИИ И ПРОТИВООПУХОЛЕВОГО ЛЕЧЕНИЯ | 2010 |
|
RU2597989C2 |
| СТАБИЛИЗИРОВАННЫЕ СОЕДИНЕНИЯ ЭКСЕНДИНА-4 | 2003 |
|
RU2376314C2 |
| БИОМАРКЕРЫ, АССОЦИИРОВАННЫЕ С ПРЕДИАБЕТОМ, ДИАБЕТОМ И СВЯЗАННЫМИ С ДИАБЕТОМ СОСТОЯНИЯМИ | 2011 |
|
RU2596486C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2824045C2 |
| RA АНТИГЕННЫЕ ПЕПТИДЫ | 2004 |
|
RU2359974C2 |
| КОНЪЮГАТЫ ДЛЯ ВВЕДЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ | 2009 |
|
RU2567667C2 |
Изобретение относится к медицине и касается способа диагностики in vitro заболевания печени. Сущность способа заключается в том, что в биологических образцах, взятых у больных субъектов, определяют изоформы аполипопротеина AI (Apo-AI), в которой окислены остатки аминокислот W50, W108 и М112. Использование способа позволяет диагностировать печеночно-клеточный рак печени. 12 з.п. ф-лы, 2 табл., 4 ил.
1. Способ диагностики in vitro заболевания печени, выбранного из печеночно-клеточного рака и гепатита, отличающийся тем, что он включает обнаружение увеличения содержания окисленных изоформ аполипопротеина AI по меньшей мере по одному остатку триптофана или метионина или их фрагментов, которые содержат по меньшей мере один из указанных окисленных остатков, где данная процедура предусматривает следующие этапы:
а) выделение биологического образца от индивидуумов, которые страдают гепатитом,
б) определение уравнений окисленных изоформ аполипопротеина AI по меньшей мере по одному остатку триптофана или метионина или их фрагментов, которые содержат по меньшей мере один из указанных окисленных остатков, и
в) сравнение указанных уровней с очищенными стандартами Аро А1, взятыми в определенных количествах, или посредством сравнения с количеством указанной изоформы, присутствующей в том же образце, полученном от здорового контрольного индивидуума, и установление связи указанного увеличения изоформ аполипопротеина А1 с наличием печеночно-клеточной карциномы у индивидуума, у которого этот биологический образец был получен.
2. Способ по п.1, отличающийся тем, что включает обнаружение увеличения по меньшей мере одной окисленной изоформы аполипопротеина AI по меньшей мере по одному остатку, выбранному из W50, W108 и M112, или их фрагментов, которые содержат по меньшей мере один из указанных окисленных остатков.
3. Способ по п.2, отличающийся тем, что включает обнаружение увеличения по меньшей мере одной окисленной изоформы аполипопротеина AI в одной из комбинаций каких бы то ни было остатков W50, W108 и M112, либо двух из них, либо всех трех.
4. Способ по п.2, отличающийся тем, что остатки W50 и W108 окислены до кинуренина, формилкинуренина, гидрокситриптофана или 3-ОН-кинуренина.
5. Способ по п.2, отличающийся тем, что M112 окислен до M112-сульфоксида или метионинсульфона.
6. Способ по п.1, отличающийся тем, что указанный биологический образец выбран из сыворотки, плазмы, крови, мочи, слюны, спинномозговой жидкости и слез.
7. Способ по п.1, отличающийся тем, что этим биологическим образцом является сыворотка.
8. Способ по п.1, отличающийся тем, что указанный печеночно-клеточный рак находится на ранней стадии.
9. Способ по п.1, отличающийся тем, что обнаруживаемое увеличение в окисленной изоформе аполипопротеина AI по меньшей мере в 1,5 раза выше по отношению к контрольному уровню.
10. Способ по п.1, отличающийся тем, что наблюдаемое увеличение в окисленной изоформе аполипопротеина AI по отношению к контрольному уровню составляет по меньшей мере 2,5 раза.
11. Способ по п.1, отличающийся тем, что наличие окисленных изоформ аполипопротеина AI выявляют и оценивают количественно с помощью метода, выбранного из масс-спектрометрии, иммунологических анализов, химических исследований, жидкостной хроматографии, прямых и непрямых фотометрических методов и их комбинаций.
12. Способ по п.11, отличающийся тем, что методы спектрометрии выбраны из тандемной масс-спектрометрии в сочетании с жидкостной хроматографией (ЖХ-МС) и ионизации лазерной десорбцией при содействии матрицы с времяпролетным масс-анализатором (MALDI-TOF-MS).
13. Способ по п.11, отличающийся тем, что указанные иммунологические исследования выбраны из гомогенных исследований, гетерогенных исследований, ферментных иммуноанализов (EIA, ELISA), исследований конкуренции, иммунометрических исследований (иммуносэндвич), турбидиметрических исследований, нефелометрических исследований и их комбинаций.
| SIGAROV А.В | |||
| and STERN L.J | |||
| Enzymatic repair of oxidative damage to human apolipoprotein A-I // FEBS Lett., 1998, 433 (3), P.196-200 | |||
| FRANK P.G | |||
| and MARCEL Y.L | |||
| Apolipoprotein A-I: structure-function relantioships // J | |||
| Lipid | |||
| Res., 2000, 41(6):853-872 | |||
| KLON A.E | |||
| et al | |||
| Comparative models for human apolipoprotein A-I bound to lipid in discoidal high-density lipoprotein particles // biochemistry, 2002, 41 (36): 10895-10905. |
Авторы
Даты
2010-12-10—Публикация
2005-02-15—Подача