Изобретение относится к области иммунологии и медицины, а именно к новым пептидам общей формулы: Х-ЦЦ-Ц(У)-ЦЦ-Z,
где Х - В-клеточный эпитоп белка аполипопротеина В 100;
Ц - аминокислотный остаток, выбранный из К или R;
Y - иммуноадъювант, выбранный из группы Pam1CSS-; Pam2CSS-, Pam3CSS-.
Z - Т-хелперный эпитоп, выбранный из AKFVAAWTLTCAAA, KLI-PNASLIENCTKAEL, QYIKANSKFIGITE;
и препаратам на основе указанных пептидов для профилактики и лечения атеросклероза.
Атеросклероз представляет собой хроническое заболевание, в результате которого происходит вариабельная комбинация изменений внутренней оболочки (интимы) артерий, которое вызывает утолщение внутренних слоев (внутренней оболочки) больших и средних артерий, а также накопление липидов, сложных углеводов, фиброзной ткани, компонентов крови, кальцификацию. Атеросклероз снижает кровоток и может вызвать ишемию и некроз тканей в органах, снабжаемых сосудами, которые подверглись заболеванию. Атеросклероз является основной причиной сердечно-сосудистых заболеваний, включая инфаркт миокарда, инсульт и болезни периферических артерий. Он является основной причиной смертности в западном мире и, как предсказывают, в течение двух десятилетий станет ведущей причиной смертности во всем мире (RU 2322260, 2006).
Заболевание начинается с накопления липопротеинов, в первую очередь, липопротеинов низкой плотности (ЛПНП), во внеклеточном матриксе сосуда. Частицы ЛПНП подвергаются модификации в результате окисления. Продукты, вырабатываемые при окислении ЛПНП, являются токсичными для клеток сосудов, вызывают воспаление и инициируют образование бляшек. Во многих отношениях атеросклероз представляет собой ответ на повреждение, включающий воспаление и фиброз. Эпитопы в окисленных ЛПНП узнаются иммунной системой и вызывают стимуляцию образования антител, которые обычно направлены против структур на основе тех или иных пептидов, в частности, против айолипопротеина В (ApoB) и его фрагментов (RU 2322260, 2006).
ApoB является белком, постоянно ассоциирующимся с ЛПНП. ApoB содержит 4563 аминокислоты. Окисленные ЛПНП приводят к деградации ApoB на фрагменты, аполипопротеин В фрагментируется и альдегидные аддукты соединяются с положительно заряженными аминокислотами, в частности с лизином. При этом пептидные последовательности, которые обычно не экспонирующиеся из-за трехмерной структуры аполипопротеина В (иммунные реакции почти исключительно направлены против пептидных последовательностей длиной в 5-6 аминокислот), становятся доступными для иммунных клеток и становятся иммуногенными из-за гаптенилирования с альдегидами. Исходя из этого, можно предположить, что естественные и искусственно синтезированные пептиды на основе ApoB могут быть использованы для создания вакцин против атеросклероза.
В настоящее время показано (George et al. Atherosclerosis, Volume 138, 1998: "Hyperimmunization of apo-E-deficient mice with homologous malondialdehyde low-density lipoprotein suppresses early atherogenesis", p.147-152), что введение некоторых подобных пептидов против окисленных ЛПНП снижает развитие атеросклероза. Вместе с тем проведенные исследования показали, что это происходит далеко не всегда. В частности, при исследовании влияния пептидов, входящих в ApoB (RU 2296582, 2007), на развитие атеросклероза выяснилось, что иммунизация с применением смеси пептидов #10, 45, 154, 199 и 240 дает толчок к усилению развития атеросклероза. Иммунизация с применением других пептидных последовательностей, например, пептидных последовательностей #1 и с 30 по 34, в целом не влияет на развитие атеросклероза. Т.е. иммунные реакции против окисленных ЛПНП могут защищать против развития, вносить вклад в развитие атеросклероза и совсем не оказывать какого-либо эффекта в зависимости от того, на какие структуры окисленных ЛПНП они направлены.
В этой связи поиск пептидных структур ApoB, способных предотвращать развитие атеросклероза и служить основой для создания вакцин против атеросклероза является достаточно актуальной и практически важной задачей.
Наиболее близким по технической сущности и достигаемому решению к заявляемой группе изобретений являются фрагменты ApoB, а также фармацевтические композиции и вакцины на их основе, предлагаемые для профилактики и терапии атеросклероза (RU 2296582, 2007). В рамках изобретения были получены 38 пептидных последовательностей, перспективных для диагностики и лечения атеросклероза. Наиболее перспективными для лечения атеросклероза, по мнению, авторов являются пептиды p1-EEEMLENVSLVCPKDATRFK, p2-ATRFKHLRKYTYNYEAESSS, p74-VISIPRLQAEARSEILAHWS и p301-HTFLIYITELLKKLQSTTVM. Как показали исследования, проведенные авторами настоящего изобретения, среди других пептидов перспективными являются предлагаемые в ближайшем аналоге пептиды р45-IEIGLEGKGFEPTLEALFGK и р210-KTTKQSFDLSVKAQYKKNKH.
Наряду с возможностью использования индивидуальных пептидов отмечалась возможность применения в качестве вакцинных препаратов против атеросклероза смесей пептидов с канонизированным бычьим сывороточным альбумином и гидратом окиси алюминия.
Недостатком вышеуказанных пептидов и вакцинных препаратов является их недостаточная эффективность при атеросклерозе.
Задачей, решаемой авторами, являлось получения более эффективных препаратов для профилактики и лечения атеросклероза сосудов на основе пептидов, а также расширение круга возможных пептидных препаратов на основе фрагментов ApoB.
Применение фрагмента иммуноадъюванта в структуре должно было
обеспечить более простую доставку вакцинной конструкции к иммуноком-петентным клеткам.
Использование фрагмента T-хелперного эпитопа в заявляемом комплексе представлялось целесообразным в связи с возможностью в его присутствии снижения или исключения генетически обусловленных вариаций в иммунном ответе на B-эпитоп, исходя из того, что пептиды, которые кодируют T-клеточную детерминанту, стимулирующую Th-клетки млекопитающих, связываются с продуктами главного комплекса гистосовместимости второго типа большинства гаплотипов и вызывают сильный CD4+Th ответ у большинства членов аутбредной популяции. Это, в частности, наблюдалось в случае использования фрагмента QYIKANSKFIGITE столбнячного токсина, пептида KLIPNASLIENCTKAEL из белка вируса чумы собак, пептида GALNNRFQIKGVELKS из легкой цепи гемагглютинина вируса гриппа, или пептид AKFVAAWTLKAAA, получивший название PADRE (Panina-Bordignon P. et.al. Eur.J.Immunol. (1989) 19, 2237-2242).
Поставленная задача была решена путем использования для данных целей комплексных препаратов, имеющих в своей структуре как фрагменты ApoB-100, так дополнительно фрагменты иммуноадъюванта и T-хелперного эпитопа.
Технический результат достигался созданием пептида общей формулы:
X-ЦЦ-Ц(Y)-ЦЦ-Z,
где X - B-клеточный эпитоп белка аполипопротеина B 100;
Ц - аминокислотный остаток, выбранный из K или R;
Y - иммуноадъювант, выбранный из группы Pam1CSS-; Pam2CSS-, Pam3CSS-.
Z - T-хелперный эпитоп, выбранный из AKFVAAWTLKAAA, KLI-PNASLIENCTKAEL, QYIKANSKFIGITE;
и композиций на их основе.
В качестве B-клеточных эпитопов белка Apo-B 100 он содержит пептидные фрагменты Apo B 100, в частности, описанные в работе (RU 2296582, 2007). Лучшие результаты были получены при использовании для данных целей следующих пептидов: пептид, идентичный последовательности 43-62 аполипопротеина В 100 человека (p2); пептид, идентичный последовательности 661-680 аполипопротеина B 100 человека (p45); пептид, идентичный последовательности 3136-3155 аполипопротеина В 100 человека (p210).
В качестве иммуноадъюванта используются, как правило, известные соединения, способные обеспечивать активацию адаптивного иммунного ответа с образованием антигенспецифических в отношении определенного патогена клонов T- и B-лимфоцитов, а также Т-клеток памяти.
К их числу относятся, в частности, пептиды, из группы Pam1CSS-; Pam2CSS-, Pam3CSS-.
Лучшие результаты при применении пептидов достигались при использовании в качестве иммуноадъюванта соединения (Pam2Cys), имеющего структурную формулу
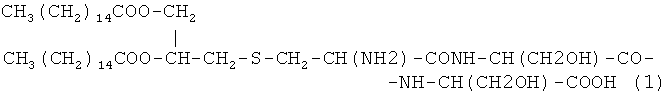
Между B-эпитопом и иммуноадъювантом расположена последовательность из двух остатков положительно заряженных аминокислот (например, лизина или аргинина). Аналогичная последовательность находится между иммуноадъювантом и Т-эпитопом. Эти последовательности служат сайтами, по которым проходит внутриклеточный процессинг вакцинной конструкции до свободных детерминант.
В качестве T-хелперного эпитопа были использованы пептиды
AKFVAAWTLKAAA,
KLIPNASLIENCTKAEL, и
QYIKANSKFIGITE.
Пептиды получают по стандартной технологии пептидного синтеза на твердой фазе, в растворе или используя методы ковергентного синтеза (например, описанной J.M. Steward and J.D.Young, "Solid Phase Peptide Synthesis", W.H. Freeman Co., San Francisco, 1969). При твердофазном синтезе первая аминокислота присоединяется к нерастворимому полимеру, наращивание полипептидной цепи производится последовательно или на стадии конденсации используются защищенные фрагменты, удаление избытков реагентов осуществляется фильтрованием с последующей промывкой Синтез может быть проведен с использованием Boc/Bzl или Fmoc/tBu технологии, или любой другой системы ортогональных защитных групп.По завершении сборки целевой последовательности проводят отщепление пептида от полимера, сопровождающееся, как правило, удалением постоянных защитных групп. Очистку конечного продукта проводят, как правило, хроматографическими методами, например, с помощью обращенно-фазовой или ионообменной высокоэффективной жидкостной хроматографии.
Проведенные испытания показали, что наряду с индивидуальными комплексными пептидами для предотвращения развития атеросклероза могут использоваться и их смеси. В частности, лучшие результаты были получены при использовании в качестве вакцины против атеросклероза препарата, содержащего смесь пептидов:
- Р2-ИРП2-ТЭ1:
Ac-ATRFKHLRKYTYNYEAESSS-KKK(Pam2CSS)KK-AKFVAAWTLKAAA
- Р45-ИРП2-ТЭ1:
Ac-IEIGLEGKGFEPTLEALFGK-KKK(Pam2CSS)KK-AKFVAAWTLKAAA
- Р210-ИРП2-ТЭ1:
Ac-KTTKQSFDLSVKAQYKKNKH-KKK(Pam2CSS)KK-AKFVAAWTLKAAA
в соотношении 0,25-0,5:0,25-0,5:0,25-0,5. Наибольшая эффективность достигалась при соотношении пептидов 1:1:1. Уменьшение доли одного из пептидов в смеси менее чем до 0,25 приводило к существенному падению антиате-росклеротической активности.
На фиг.1 приведены приведены микрофотографии препаратов нисходящей аорты en face у мышей Apo E (-/-)после окрашивания масляным красным О Оригинальное увеличение в 40 раз.
А) группа мышей №4 (иммунизация смесью пептидов), Б) группа мышей №1 (контроль, введение PBS), В) группа мышей №2 (контроль, введение AK-FVAAWTLKAAA-ТЭ 1). В приложении 1 приведены формулы основных используемых соединений.
Сущность и преимущества заявляемого изобретения иллюстрируются следующими примерами
Пример 1. Синтез исходных пептидов.
Синтез пептидов проводился твердофазным способом на синтезаторе Applied Biosystems 430A по методу in situ с использованием noc-boc-защищенных производных аминокислот (Schnolzer M. et. al. Int. J. Pept. Prot. Res. - 1992. - v.40. - N2 - р.180-193). В работе были использованы следующие производные трифункциональных аминокислот Boc-(Mts)-Arg-OH, Boc-(Bzl)-Ser-OH, Boc-(Bzl)-Thr-OH, Boc-(Dnp)-His-OH, Boc-(OBzl)-Glu-OH, Boc-(OBzl)-Asp, Boc-(ClZ)-Lys, Boc-(Cl2Bzl)-Tyr-OH. Для синтеза пептидов использован 0,1 мМ Вос-(Bzl)-Ser-РАМ-полимера, Boc-(Dnp)-His-PAM-полимера, Boc-(ClZ)-Lys-PAM-полимера и Boc-βAla-PAM-полимера. В качестве нерастворимой матрицы использован 1% сополимер стирола и дивинилбензола.
Деблокирование проводили неразбавленной трифторуксусной кислотой (TFA) два раза по 1 минуте. Нейтрализацию при первой конденсации осуществляли путем добавления 3х-кратного избытка диизопропилэтиламина непосредственно в реакционную смесь, на стадии присоединения аминокислотного остатка; повторную конденсацию проводили после дополнительной промывки пептидил-полимера 10% раствором диизопропилэтила-мина (DIPEA) в диметилформамиде (DMF). Присоединение аминокислотных остатков проводили методом 1-гидроксибензотриазоловых эфиров, используя 2-5-кратные избытки реагентов. Смесь производных аминокислот готовили непосредственно перед внесением в реакционный сосуд.
Контроль за полнотой реакции конденсации проводили с помощью нингидринового и бромфенолового тестов.
После завершения наращивания пептидной цепи пептидил-полимеры, содержащие гистидин, обрабатывали смесью DMF: этандитиол (EDT):DIPEA=7:2:1 в течение 30 минут и промывали DMF и хлористым метиленом (DCM). Все пептидил-полимеры обрабатывали TFA два раза по 1 минуте, промывали DCM и диэтиловым эфиром, извлекали из реактора и высушивали.
Отщепление пептидов от полимера и удаление боковых защитных группировок проводили с помощью жидкого фтористого водорода по Sn1/Sn2 механизмам в присутствии скавенджеров. Для этого 1 г пептидил-полимера помещали в реактор для работы с фтористым водородом (HF), добавляли 0.8 мл м-крезола, 0.2 мл EDT, 6.5 мл диметилсульфида (DMS) и 2.5 мл HF, и перемешивали 2 часа при 0°C. Затем упаривали DMS и HF и в реактор перегоняли 10 мл HF и смесь перемешивают при 0°C 1 час. После упаривания HF остаток переносили с помощью эфира на фильтр, промывали ацетонитрилом и эфиром. Продукт выделяли смыванием TFA в 200 мл эфира.
Выделенные грубые продукты, подвергались очистке методом полупрепаративной обращенно-фазовой ВЭЖХ на колонке Waters Prep Nova-Pak HR C-18, 6µ, 60Å, 19×300 mm в градиенте ацетонитрила 5-75% за 30 минут.Детекция при 220 нм. Фракцию, соответствующую пику основного продукта, после лиофильной сушки подвергали аминокислотному, масс-спектральному и ВЭЖХ анализам:
- условия ВЭЖХ анализа: аналитический хроматограф Gilson, Франция, колонка DeltaPak C-18, 5µm, 100А°, 3,6×150 mm; градиент (10-50)% ацетонитрила в 0,1% TFA за 20 минут;
- условия аминослотного анализа: аминокислотный анализатор LKB Alpha Plus 4151, Швеция; гидролиз:
- 4М метансульфокислота, содержащая 0.2% триптамина, 110°C, 22 часа;
- 12N соляная кислота, пропионовая кислота (1:1), 110°C, 22 часа.
- условия масс-спектрального анализа: массспектрометр Voyager-DE Bio-Spectrometry Workstation, Per Sepetive Biosystems, США. Все синтезированные пептиды имели аминокислотный состав и молекулярную массу, соответствующие теоретическим значениям. Чистота соединений по данным аналитической ОФ-ВЭЖХ составляла не менее 95%.
В результате применения данной методологии были получены пептиды, аналогичные полученным в наиболее близком аналоге, а именно p2-ATRFKHLRKYTYNYEAESSS; p45-IEIGLEGKGFEPTLEALFGK и p210-KTTKQSFDLSVKAQYKKNKH, которые затем были подвергнуты дальнейшей модификации с получением пептидов
p2MAP-(ATRFKHLRKYTYNYEAESSS)4K2KβA;
p45MAP-(IEIGLEGKGFEPTLEALFGK)4K2KβA и
p210MAP-(KTTKQSFDLSVKAQYKKNKH)4K2KβA
Пример 2. Получение целевых (комплексных) пептидов
Синтез пептидов проводился твердофазным методом с использованием Boc/Bzl стратегии в ручном режиме /J.M. Steward and J.D. Young, "Solid Phase Peptide Synthesis", W.H. Freeman Co., San Francisco, 1969/. Для временной защиты α-аминофункции использовали трет-бутилоксикарбонильную группу. Для блокирования боковых радикалов аргинина, лизина и гистидина использовали мезитиленсульфонильную, 2-хлорбензилоксикарбонильную и динитрофенильную группировки, соответственно. Серии, треонин, аспарагиновую и глутаминовую кислоты в полипептидную цепь вводили в виде соответствующих бензиловых эфиров, а триптофан в виде формильного производного по индольному кольцу. Боковая цепь остатка лизина, к которому впоследствии через спейсер был присоединен дипальмитоилоксипролилцистеин, была блокирована флюо-ренилметилоксикарбонильной группой.
В качестве нерастворимой матрицы были использованы соответствующие PAM-полимеры с начальной емкостью ~1 мМол/г.В качестве полимера использован 1% сополимер стирола и дивинилбензола. Наращивание полипептидной цепи вели методом in situ. Деблокирование проводили неразбавленной TFA два раза по 1 минуте.
Нейтрализацию при первой конденсации осуществляли путем добавления 3-кратного избытка DIPEA непосредственно в реакционную смесь на стадии присоединения аминокислотного остатка; повторную конденсацию проводили после дополнительной промывки пептидил-полимера 10% раствором DIPEA в DMF. Присоединение аминокислотных остатков проводили методом 1-гидроксибензотриазоловых эфиров, используя 3 кратные избытки реагентов. После присоединения аминокислотных остатков, соответствующих последовательности синтезируемых пептидов, проводили ацетилирование N-концевой аминогруппы, используя 40 эквивалентов уксусного ангидрида в DMF. Формильные группировки с остатков триптофана и динитрофенильная защита гистидина удалялись обработкой 20% раствором пиперидина в DMF в течение 30 минут.
Флюоренилметилоксикарбонильную группу с боковой цепи остатка лизина в положении 23 удаляли обработкой пептидил-полимера 50% раствором пиперидина в DMF. Серин (вводили в виде соответствующего бензилового эфира, а цистеин - как Fmoc(Trt)Cys-OH. После удаления тритила с сульфгидрильной группы цистеина присоединяли остаток 1-бром-2,3-гидрокси пропана, который потом ацилировали 1-гидроксибензотриазольным производным пальмитиновой кислоты в хлористом метилене. Fmoc группировку с альфа аминогруппы цистеина удаляли либо после введения остатков пальмитиновой кислоты (при получении диацильных производных), либо до их введения (при получении триа-цильных производных).
Удаление постоянных защитных групп и отщепление пептидов от нерастворимой матрицы проводили безводным жидким фтористым водородом в присутствии скавенджеров. В сосуд с пептидил-полимером переносили 9.5 мл фтористого водорода и 0.3 мл м- крезола и 0.2 мл этандитиола и перемешивании на магнитной мешалке при 0°C в течение 1 часа. Затем фтористый водород упаривали, и пептид высаживали эфиром из трифторуксусной кислоты.
Выделенные продукты подвергались очистке методом полупрепаративной обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке Waters Prep Nova-Pak HR С-18, 6µ, 60Å, 19×300 mm в градиенте ацетонитрила 5-75% за 30 минут.Детекция при 220 нм. Фракцию, соответствующую пику основного продукта, после лиофильной сушки подвергали окислению. Полученные целевые соединения были охарактеризованы данными масс-спектрометрии, аминокислотного и ВЭЖХ анализов.
Условия ВЭЖХ анализа: аналитический хроматограф Gilson, Франция, колонка DeltaPak С-18, 5µm, 100A°, 3,6×150 mm; градиент (15-65)% ацетонитрила в 0,1% TFA за 25 минут;
Условия аминослотного анализа: аминокислотный анализатор LKB Alpha Plus 4151, Швеция; гидролиз последовательным введением:
- 4M метансульфокислоты, содержащей 0.2% триптамина, при 110°C, в течение 22 часов;
- смесью 12N соляной и пропионовой кислот в соотношении 1:1, при 110°C, в течение 22 часов.
Условия масс-спектрального анализа: масс-спектрометр Voyager-DE Bio-Spectrometry Workstation, Per Sepetive Biosystems, США.
Все синтезированные пептиды имели аминокислотный состав и молекулярную массу, соответствующие теоретическим значениям. Чистота соединений по данным аналитической ОФ-ВЭЖХ составляла не менее 90%. Структуры полученных пептидов, молекулярные веса и времена выхода в условиях аналитической ОФ ВЭЖХ приведены в таблице 1.
В таблице использованы следующие обозначения:
ТЭ1 - универсальный T-клеточный эпитоп последовательности AK-FVAAWTLKAAA (PADRE); ТЭ2 - универсальный T-клеточный эпитоп последовательности KLIPNASLIENCTKAEL из слитого белка вируса чумы собак; ТЭ3-универсалъный T-клеточный эпитоп последовательности QYIKANSKFIGITE из столбнячного токсина;
ИРП(1-3) - иммунорегуляторные пептиды последовательности PamnCysSerSer-, отличающиеся количеством остатков пальмитиновой кислоты, где n=1-3, фланкированные остатками лизина; ИРП2*- - иммунорегуляторный пептид последовательности Pam2CysSerSer-, фланкированный остатками аргинина;
Ac - ацетил, остаток уксусной кислоты; K - остаток лизина; I - остаток изолейцина; Е - остаток глутаминовой кислоты; D - остаток аспарагиновой кислоты; C - остаток цистеина; T - остаток треонина; Q - остаток глютамина; S - остаток серина; V - остаток валина; Y - остаток тирозина; P - остаток пролина; R - остаток аргинина; L - остаток лейцина; F - остаток фенилаланина; W - остаток трип-тофана; A - остаток аланина; G - остаток глицина; N - остаток аспарагина: H - остаток гистидина.
Пример 4. Оценка влияния иммунизации пептидами на атеросклеротические бляшки аорты у мышей
Получение препаратов аорты и окрашивание бляшек выполняли по методике (Branen L. et. al. // The histichemical Journal, 2001, v.33, p.227-229). Аорту, дугу аорты и прилегающую к ней треть сердца выделяли после осторожной перфузии фосфатно-солевым буфером и затем 4% забуференным раствором пара-формальдегида. Жир с препарата как можно тщательнее удаляли. Затем аорту разрезали вдоль, раскрывали и помещали на предварительно покрытое овальбумином новое стекло, высушивали на воздухе 30 минут и фиксировали в течение суток в формалине. Раствор овальбумина для покрытия стекол приготавливали путем разведения 1:20 маточного раствора 15% куриного яичного альбумина фильтрованного, 50% глицерина и 0,2% азида натрия. Окрашивание бляшек проводили с использованием раствора красителя жирового красного О в метаноле и заключали под покровное стекло.
Измерения площадей бляшек проводили с помощью компьютеризированной гистоморфометрии. Препараты фотографировали с использованием системы визуализации, включавшей световой микроскоп DMLB и цифровой камеры DC 300 (Leica, Германия). Делали снимки каждого поля зрения при увеличении в 40 раз, при этом с каждого препарата для получения целой аорты делали около 20 снимков, затем соединяли для получения фотографии целой аорты с помощью программы Canon Fotostish на компьютере. Для морфометрических исследований фотографии калибровали, измеряли с использованием программы Image J. Каждую аорту просматривали под микроскопом на увеличении в 160-320 раз, при наличии сомнений уточняли границы бляшек на большем увеличении. Бляшки обводили каждую в отдельности. Затем с помощью программы Image J измеряли: количество бляшек, расположенных в местах отхождения сосудов, 2) количество бляшек аорты, не связанных с сосудами и 3) площадь каждой бляшки в микрометрах.
Получение препаратов и окрашивание срезов проводили, как было описано в статье (Fredrikson G.N. et al. Ingibition of atherosclerosis in ApoE-Null mict by immunization with Apo-100 peptide secuences // Atherosclerosis, Thrombosisand Molecular Biology, 2003, v.23, p.879-884). Участок дуги аорты и прилегающую к ней треть сердца заключали в ОСТ (Япония) и замораживали в жидком азоте. Изготавливали серийные криостатные срезы толщиной 10 мкм. Срезы начинали собирать, когда на препаратах появлялись створки клапана аорты. Срезы в порядке получения раскладывали на предметные стекла. Приготавливали по три-четыре стекла из одного образца. Для визуализации бляшек срезы окрашивали раствором красителя жирового красного О в изопропаноле, докрашивали гематоксилином Карацци и заключали под покровное стекло. С использованием системы визуализации получали микрофотографии срезов. Бляшки обводили каждую в отдельности. Затем с помощью программы Image J измеряли площадь каждой бляшки в микрометрах, а также измеряли площадь просвета аорты. Площадь бляшек учитывали на срезах, на которых четко визуализировались три клапана. Таким образом, оценивали в большинстве случаев по три среза от животного. На препаратах с использованием программы Image J измеряли площади бляшек и выражали их в виде процента от площади просвета аорты. Для оценки содержания коллагена срезы окрашивали по методу Ван-Гизона. Содержание коллагена в процентах оценивали с помощью компьютеризированной гистоморфометрии.
При статистической обработке данных различия между группами считали достоверными при p<0,05.
Исследования проводились в отношении 20 групп мышей по 12 штук в каждой группе:
Группа 1 - контрольная (PBS) Группы 2-19 - получали пептиды, полученные по примеру 2 в дозе 50 мг.
Препарат вводился в три этапа: в возрасте мышей 7-8 недель, в возрасте 9-10 недель и в возрасте 11-12 недель внутрибрюшинно. В течение 10-11 недели мыши находились на высокохолестериновом питании (Western diet). На 24-25 неделе их забивали и проводили исследования аорты.
Полученные результаты приведены в таблице 2. Полученные данные свидетельствуют, что лучшие результаты получены при использовании пептида Р210-ИРП2-ТЭ1.
Для подтверждения эффективности пептида по сравнению с входящими в него фрагментами было проведено сопоставление антисклеротической активности пептида Р210-ИРП2-ТЭ1 по сравнению с пептидом Р210 и смесью пептидов Р210 и ИРП2-ТЭ1. Полученные результаты (таблица 3) показали, что полученный пептид обладает повышенной эффективностью по сравнению со своими аналогами.
Пример 4. Получение композиции для профилактики и лечения атеросклероза сосудов на основе смеси пептидов. По 10 мг пептидов Р2-ИРП2-ТЭ1, Р45-ИРП2-ТЭ1 и Р210-ИРП2-ТЭ1 растворяли в 10 мл 0,02M натрий фосфатного буфера, рН7,4. Полученный раствор разливали по ампулам по 1 мл, замораживали и лиофилизировали. Используя разное весовое соотношение пептидов при приготовлении раствора для высушивания, получали смесь (смесь 1) с соотношением компонентов 1:1:1.
Пример 5. В условиях примера 4 получали смеси, содержащие пептиды Р2-ИРП2-ТЭ 1, Р45-ИРП2-ТЭ1 и Р210-ИРП2-ТЭ1 в соотношении компонентов
Смесь 2 - 0,25:0,5:0,25:
Смесь 3 - 0,5:0,25-0,25;
Смесь 4 - 0,25:0,25:0,5.
Пример 6. В условиях примера 3 было произведено изучение препаратов, полученных по примерам 4 и 5. Полученные результаты приведены в таблицах 4 и 5.
Как следует из представленных данных, количество и площадь «бляшек сосудов» в группе 4, иммунизированной смесью пептидов, были статистически достоверно более низкими по сравнению с контрольной группой 2, которым вводили Р210+ИРП2-ТЭ1. Различия между группой 4 и группами 1 -3 были статистически достоверными.
На рисунке 1 приведены микрофотографии препаратов нисходящей аорты en face у мышей Apo Е (-/-)после окрашивания масляным красным О Оригинальное увеличение в 40 раз. А) группа мышей №4 (иммунизация смесью пептидов), Б) группа мышей №1 (контроль, введение PBS), В) группа мышей №2 (контроль, введение ТЭ1). На микрофотографиях препаратов видно, что под микроскопом атеросклеротические бляшки четко визуализировались в виде темно-красных объектов на внутренней по поверхности аорты. Бляшки характеризовались расположением в просветах сосудов, отходящих от аорты («бляшки сосудов»). Некоторые бляшки оказывались не связанными расположением с сосудами («бляшки стенки аорты»). Наблюдается более низкое количество бляшек (красное окрашивание) в группе 4 (Рис.1А) по сравнению с контрольными группами 1 и 2 (Рис.1Б и В, соответственно).
Пример 7. Исследование содержания коллагена в бляшках синуса аорты
Дополнительно к измерению площадей бляшек синуса аорты проверяли, насколько иммунизация смесью пептидов будет влиять на фенотип бляшек, а именно - на количество коллагена. От количества коллагена зависит прочность самой бляшки, а это, в свою очередь, влияет на вероятность ее разрыва. Разрушение бляшки, особенно в аорте, является опасным осложнением атеросклероза у человека.
Мышам вводили пептид Р210 (группа 1), Р210+ИРП2-ТЭ1 (группа 2), Р210-ИРП2-ТЭ1 (группа 3) и смесь пептидов №1, Как показали результаты исследований (таблица 6), иммунизация в группах 2-4 приводила к выраженному увеличению среднего относительного количества коллагена в бляшке. Процент коллагена в бляшках в среднем увеличивался в 1,9 (2 группа); в 1,63 (3 группа) и в 1,82 (4 группа) раза по сравнению с 1 группой.
Различия между группами 1 и 2, 1 и 3 достоверны. В четвертой группе мы наблюдали выраженную тенденцию к увеличению количества коллагена в бляшках, отсутствие статистической достоверности можно объяснить тем, что в данной группе было меньшее количество животных.
Анализ полученных результатов показал, что заявляемые пептиды обладают более высокой антисклеротической активностью по сравнению с аналогами, а композиции на их основе представляют практический интерес в качестве вакцины для профилактики и лечения атеросклероза сосудов.
| название | год | авторы | номер документа |
|---|---|---|---|
| РАНОЗАЖИВЛЯЮЩАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2122401C1 |
| ИММУНОТЕРАПЕВТИЧЕСКОЕ ЛЕЧЕНИЕ | 2006 |
|
RU2454428C2 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАРАЗИТАРНЫХ И ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ С ИСПОЛЬЗОВАНИЕМ ИНТЕРЛЕЙКИНА-1 | 1995 |
|
RU2090208C1 |
| СТИМУЛЯТОР ПРОЛИФЕРАЦИИ РЕГУЛЯТОРНЫХ Т-ЛИМФОЦИТОВ И СПОСОБ ИХ СТИМУЛЯЦИИ | 2012 |
|
RU2499043C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОВОСПАЛИТЕЛЬНЫХ И ПРОАЛЛЕРГИЧЕСКИХ ИНТЕРЛЕЙКИНОВ В НАЗАЛЬНОМ СЕКРЕТЕ У ДЕТЕЙ РАННЕГО И ДОШКОЛЬНОГО ВОЗРАСТА ДЛЯ ДИАГНОСТИКИ ЭТИОЛОГИИ РЕЦИДИВИРУЮЩИХ ОСТРЫХ РИНОФАРИНГИТОВ И АДЕНОИДИТОВ | 2013 |
|
RU2569054C2 |
| СПОСОБ ДИАГНОСТИКИ ДИСБИОТИЧЕСКИХ НАРУШЕНИЙ В БИОПТАТАХ СЛИЗИСТЫХ НОСА, ГЛОТКИ У ДЕТЕЙ РАННЕГО И ДОШКОЛЬНОГО ВОЗРАСТА С ПОСТОЯННО РЕЦИДИВИРУЮЩИМИ ОСТРЫМИ РЕСПИРАТОРНЫМИ ИНФЕКЦИЯМИ | 2013 |
|
RU2576839C2 |
| Способ получения пептида Ac-His-Ala-Glu-Glu-NH | 2021 |
|
RU2767030C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОПАСНОСТИ ЭМБОЛОГЕННОГО РАЗРЫВА КАРОТИДНОЙ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ | 2019 |
|
RU2729733C1 |
| ЭКЗОГЕННО-ИНДУЦИРУЕМАЯ ЖИВОТНАЯ МОДЕЛЬ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2012 |
|
RU2532525C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОПАСНОСТИ ЭМБОЛОГЕННОГО РАЗРЫВА НЕСТАБИЛЬНОЙ КАРОТИДНОЙ АТЕРОСКЛЕРОТИЧЕСКОЙ БЛЯШКИ | 2019 |
|
RU2723741C1 |

Изобретение относится к области иммунологии и медицины, а именно к новым пептидам общей формулы: Х-ЦЦ-Ц(Y)-ЦЦ-Z, где Х - B-клеточный эпитоп белка аполипопротеина В 100; Ц - аминокислотный остаток, выбранный из K или R; Y - иммуноадъювант, выбранный из группы Pam1CSS-; Pam2CSS-, Pam3CSS-; Z - T-хелперный эпитоп, выбранный из AKFVAAWTLKAAA, KLIPNASLIENCTKAEL, QYIKANSKFIGITE. Заявляемые пептидные препараты обладают более высокой антисклеротической активностью по сравнению с аналогами, а композиции на их основе представляют практический интерес в качестве вакцины для профилактики и лечения атеросклероза сосудов. 2 н. и 7 з.п. ф-лы, 1 ил., 6 табл., 7 пр.
1. Пептид общей формулы:
X-ЦЦ-Ц(Y)-ЦЦ-Z,
где Х - B-клеточный эпитоп белка аполипопротеина В 100;
Ц - аминокислотный остаток, выбранный из K или R;
Y - иммуноадъювант, выбранный из группы Pam1CSS-; Pam2CSS-, Pam3CSS-;
Z - T-хелперный эпитоп, выбранный из AKFVAAWTLKAAA, KLIPNASLIENCTKAEL, QYIKANSKFIGITE;
для профилактики и лечения атеросклероза сосудов, обладающий антисклеротическим действием.
2. Пептид по п.1, отличающийся тем, что в качестве B-клеточного эпитопа белка аполипопротеина В 100 он содержит пептид p2 аполипопротеина В 100.
3. Пептид по п.1, отличающийся тем, что в качестве В-клеточного эпитопа белка аполипопротеина В 100 он содержит пептид p45 аполипопротеина В 100.
4. Пептид по п.1, отличающийся тем, что в качестве В-клеточного эпитопа белка аполипопротеина В 100 он содержит пептид p210 аполипопротеина В 100.
5. Пептид по п.1 p2-ИРП1-PADRE, имеющий общую формулу Ac-ATRFKHLRKYTYNYEAESSS-KKK(SSCPam1)KK-AKFVAAWTLKAAA.
6. Пептид по п.1 p45-ИРП1-PADRE, имеющий общую формулу Ac-IEIGLEGKGFEPTLEALFGK-KKK(SSCPam1)KK-AKFVAAWTLKAAA.
7. Пептид по п.1 p210-ИРП1-PADRE, имеющий общую формулу Ac-KTTKQSFDLSVKAQYKKNKH-KKK(SSCPam1)KK-AKFVAAWTLKAAA.
8. Композиция для профилактики и лечения атеросклероза сосудов на основе B-клеточного эпитопа белка аполипопротеина В 100, содержащий смесь пептидов по пп.5, 6 и 7 в соотношении 0,25-0,5:0,25-0,5:0,25-0,5.
9. Композиция по п.8, отличающаяся тем, что соотношение пептидов по пп.5, 6 и 7 составляет 1:1:1.
| ФРАГМЕНТЫ ПЕПТИДОВ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ВАКЦИНЫ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ АТЕРОСКЛЕРОЗА | 2002 |
|
RU2296582C2 |
| Приспособление к гидравлическому, производящему ошиновку колес, прессу для запрессовывания колец на ступицах колес крестьянского хода | 1928 |
|
SU12984A1 |
| US 6635623 B1, 21.10.2003 | |||
| WO 2011025978 A2, 03.03.2011. | |||
Авторы
Даты
2013-10-10—Публикация
2012-04-18—Подача