Настоящее изобретение относится к фотобелкам с усиленной биолюминесценцией и их использованию в качестве внутриклеточных индикаторов кальция. Фотобелки получают мутагенезом кодирующей последовательности клитина (clytin), и они проявляют усиленную биолюминесценцию, высокое сродство к кальцию и продолжительную световую эмиссию. Они удобны в использовании в клеточных исследованиях для определения изменений концентрации внутриклеточного кальция, в частности в исследованиях по подбору молекул, проводимых с использованием оборудования с высокой и ультравысокой пропускной способностью.
УРОВЕНЬ ТЕХНИКИ
Биолюминесценция представляет собой феномен, при котором видимый свет излучается живыми организмами или субстанциями, произведенными из них, через разнообразие хемилюминесцентных реакционных систем. Для биолюминесцентных реакций требуется три главных компонента: люцифирин, люцифераза и молекулярный кислород. Однако другие компоненты также могут потребоваться в некоторых реакциях, включая катионы (Ca++ и Mg++) и кофакторы (АТФ, НАД(Ф)Н). Люциферазы представляют собой ферменты, которые катализируют окисление субстрата люциферина и производят нестабильный интермедиат. Свет излучается, когда нестабильный интермедиат разрушается до основного состояния с образованием оксилюциферина. Существует много различных несвязанных типов люциферина, хотя многие виды из, по меньшей мере, семи типов используют один и тот же люциферин, известный как коэлентеразин (coelenterazine). Из некоторых животных (например, медузы) система люциферин/люцифераза может быть извлечена в виде стабильного “фотобелка”, который излучает свет при связывании кальция. Фотобелки отличаются от люцифераз в том, что они представляют собой устойчивые окисленные промежуточные комплексы люциферазы и люциферина. Фотобелки представлены во многих морских коэлентератах и позволяют данным организмам излучать свет для разных целей, включая размножение, питание и защиту 1. Существует много люминесцентных организмов, но до сих пор выделены только семь фотобелков, а именно талассиколин [2, 3], акворин [4-6], митрокомин (синоним халистаурин) [7, 8], клитин (синоним фиалидин) [8, 9], обелин [2, 6, 10, 11], мнемиопсин [12, 13] и беровин [12, 13]. Все указанные белки представляют собой комплексы, сформированные апобелком, хромофором имидазопиразином (коэлентеразин) и кислородом. Их структуры высоко консервативны, особенно в регионах, содержащих три кальцийсвязывающих участка (EF-hand структуры). Термин “фотобелок” обозначает люциферинсвязанный полипептид, который способен к люминесценции, в то время как термин “апобелок” используют для обозначения белка без люциферина.
Наиболее изученными фотобелками являются акворин, выделенный из Aequorea victoria [14], и обелин, выделенный из Obelia longissima [15]. Фотобелок может быть регенерирован из апофотобелка инкубацией с коэлентеразином, молекулярным кислородом, ЭДТА и 2-меркаптоэтанолом или дитиотреитолом. Поскольку коэлентеразин представляет собой общий люминесцентный субстрат, используемый фотобелками акворином, митрокомином, клитином и обелином, то реакция светоизлучения, видимо, одинакова в указанных четырех фотобелках [16, 17].
Фотобелок клитин был клонирован в 1993 г. Inouye и др. [18]. До настоящего времени исследования данного фотобелка практически не проводились. Проведено выравнивание первичных структур акворина, митрокомина, клитина и обелина, и показана высокая идентичность аминокислотных последовательностей. Также установлено, что Са2+-связывающие участки являются высоко консервативными [19]. Установлено, что Са2+-связывающий белок у гидрозоев (Hydrozoa) отличается от других Са2+-связывающих белков относительно высоким содержанием остатков цистеина, гистидина, триптофана, пролина и тирозина.
Анализ первичной структуры клитина показывает, что он содержит 198 аминокислотных остатков (а.о.) и принадлежит к семейству фотобелков.
Фотобелки широко используются в генных технологиях передачи информации для мониторинга клеточных событий, связанных с передачей сигнала и экспрессией генов.
Изучение клеточных событий и их регуляции требует чувствительных, неинвазивных аналитических методов. Фотобелки и, в целом, использование фотолюминесценции представляют собой превосходную систему передачи информации, поскольку они практически не имеют фонового излучения в отличие от флюоресцентных систем.
Фотобелки экспрессируют в клетках млекопитающих для мониторинга изменений концентрации кальция в ответ на различные воздействия. Концентрации внутриклеточного кальция могут быть измерены при добавлении кофактора коэлентеразина к клеткам млекопитающих, экспрессирующим фотобелок и улавливающим фотон излучения, которое показывает концентрацию внутриклеточного кальция. Использование клеток, которые экспрессируют и фотобелок, и рецептор, вовлеченный в модуляцию концентрации внутриклеточного кальция, обеспечивает применимую систему для отбора соединений и их воздействий на освобождение внутриклеточного кальция. Высокопроизводительные методы скрининга также могут быть созданы с использованием фотобелка в качестве системы передачи информации. Чувствительность данной системы и ее высокий сигнал по отношению к коэффициенту шума позволяет проводить исследования в малых объемах. Акворин вплоть до настоящего времени является наиболее используемым фотобелком для указанных исследовательских целей. Исследования потоков кальция обычно проводят в формате HTS, используя оптические скрининговые приборы, подходящие для одновременного анализа большого количества образцов и оборудованные системой получения люминесцентного изображения с CCD камерой-детектором. При этом одним из наиболее используемых инструментов в HTS является ридер FLIPR® (Fluorometric Imaging Plate Reader, Molecular Devices Corporation, Sunnyvale, CA, USA), который был разработан как высокопроизводительный прибор оптического скрининга для клеточных флюоресцентных исследований. Прибор оборудован оптическим детектором, который позволяет изолировать сигнал на клеточном монослое, увеличивая, таким образом, чувствительность клеточных исследований. Источником возбуждения может быть либо аргоновый лазер, либо источник с широкой полосой пропускания, как ксеноновая лампа.
Последние версии системы FLIPR® (FLIPR3 и FLIPRTETRA) со светонепроницаемой сверхчувствительной камерой с быстрой выдержкой, с проточным дозатором жидкости пригодны также и для люминесцентных исследований, хотя и с более низкой чувствительностью по сравнению с оборудованием на базе CCD камеры.
Для использования описанных выше инструментов FLIPR®, FLIPR3 и FLIPRTETRA, и, в целом, для всех инструментов с низкой чувствительностью в люминесцентных исследованиях фотобелок с усиленной световой эмиссией представляется высоко востребованным.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
По первому аспекту изобретение предоставляет собой выделенный фотобелок, содержащий аминокислотную последовательность, которая
a) способна связать коэлентеразин и кальций, создавая биолюминесценцию;
b) идентичен, по меньшей мере, на 90%, предпочтительно, по меньшей мере, на 95%, более предпочтительно, по меньшей мере, на 98% SEQ ID NO: 1 (клитин);
c) в выравнивании последовательностей с SEQ ID NO: 1 (клитин) представляет одну из следующих единичных или множественных замен (позиции остатков относятся к SEQ ID NO: 1):
i) C54→S;
ii) S132→C;
iii) K48→R, N195→D;
iv) Q68→R, A90→V, T184→I;
v) Y82→F, K110→N, F125→L, S149→R;
vi) G142→C;
vii) I53→V, S149→R;
viii) N18→D, I40→V, K56→R;
ix) Gly58→Glu, Asp69→Val, Ala70→Cys, Lys76→Arg, Lys77→Gly, Ile78→Cys, Asp81→Glu, Val86→Ile, Glu87→Ala, Ala90→Gln, Val92→Leu и Glu97→Gln.
В предпочтительном воплощении фотобелок содержит в своем составе аминокислотную последовательность, которую выбирают из группы SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9 и 10. По сравнению с известными или коммерчески доступными фотобелками фотобелки настоящего изобретения имеют усиленную биолюминесцентную активность и/или повышенную сродство к кальцию и/или продолжительную световую эмиссию.
Помимо замещений индикаторных остатков, которые подтверждают желаемую биолюминесцентную активность фотобелка, последовательность клитина может быть далее модифицирована без негативного влияния на биолюминесцентную активность фотобелка, особенно с помощью консервативных замещений аминокислотных остатков внутри индикаторных пределов, идентифицирующих последовательность. Кроме того, из последовательности клитина могут быть вырезаны небольшие участки без изменения его фотобелковой активности.
В другом аспекте изобретение направлено на полинуклеотидное кодирование фотобелка, как определено ранее. В предпочтительном воплощении полинуклеотидную последовательность оптимизируют для использования кодонов млекопитающих согласно SEQ ID NO: 11, 12, 13, 14, 15, 16, 17, 18, 19. В другом предпочтительном воплощении молекулы нуклеиновых кислот сливают с митохондриальными целевыми последовательностями [20, 21, 22].
Согласно другому аспекту изобретение предоставляет векторы экспрессии и клетки-хозяева, содержащие индикаторные полипептиды. Клетки-хозяева, экспрессирующие фотобелок, согласно настоящему изобретению производят интенсивную биолюминесценцию в ответ на стимуляцию кальцием, которая значительно выше, чем наблюдаемая с натуральными фотобелками, в частности с одним из наиболее часто используемых акворином.
В другом аспекте изобретение предоставляет клеточное исследование для определения внутриклеточной концентрации кальция посредством фотобелка согласно настоящему изобретению.
В предпочтительном воплощении изменения внутриклеточной концентрации кальция определяют с помощью:
a) обеспечения клеточной экспрессии фотобелка SEQ ID NO: 2-10, его вариантов или фрагментов;
b) нагрузки клеток коэлентеразином;
c) взаимодействия клеток с агентом, стимулирующим поступление кальция или высвобождение кальция из внутриклеточных депо;
d) определение биолюминесценции фотобелка.
Исследование предпочтительно проводят в высокопроизводительном формате, используя оптический скрининговый инструмент или прибор, подходящий для многопробного анализа, такой как система люминесцентного изображения с CCD камерой-детектором для высокой и ультравысокой производительности или с флюориметрическим планшетным ридером FLIPR®. В обеих данных системах фотобелки настоящего изобретения дают наивысший сигнал по сравнению с известными фотобелками, обычно используемыми в автоматизированных клеточных функциональных исследованиях.
В предпочтительном воплощении клетки, экспрессирующие фотобелок и рецептор, вовлеченный во внутриклеточную мобилизацию кальция, используют для тестирования молекул-кандидатов на их воздействие на рецепторную модуляцию. Обычно клетки трансфицируют векторами экспрессии, содержащими кодирующую последовательность фотобелка, и в отсутствие интересующего эндогенного рецептора или канала. Положительные клоны отбирают и высевают в подходящей среде, культивируемые клетки нагружают субстратом коэлентеразином и запускают исследование добавлением тестируемой молекулы или воздействия. Продуцируемую люминесценцию считают подходящей детекторной системой (CCD камера или люминометр). Исследование также может быть проведено в автоматическом приборе, оборудованном ридером многолуночных планшетов, в частности FLIPR® системой. В данном случае клетки, экспрессирующие фотобелок, помещают в лунки микропланшета, который после добавления тестируемой молекулы/воздействия считывают одновременно с записью сигнала.
Высокопроизводительные скрининговые исследования, совмещенные с системой передачи информации на основе фотобелка, имеют лучшую чувствительность и отношение сигнала к шуму. Клетки, экспрессирующие фотобелок данного изобретения, производят интенсивную фотолюминесценцию в ответ на кальциевую стимуляцию, которая, как правило, выше, чем наблюдаемая у натуральных фотобелков.
В другом аспекте изобретение предоставляет набор для исследования, включающий в себя препарат клеток, экспрессирующих указанный в изобретении фотобелок под контролем стабильного или индуцируемого промотора, и реагенты, необходимые для проведения данного исследования.
Кроме того, фотобелки настоящего изобретения могут быть использованы в качестве индикаторов внутриклеточного кальция в диагностических методах, основанных на измерении концентрации клеточных ионов кальция и/или притока/оттока клеточных ионов кальция.
Настоящее изобретение описано в деталях в следующей экспериментальной части.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты
Ферменты рестрикции приобретают в New England Biolabs и используют согласно инструкции производителя. Набор Ligation Independent Cloning (LIC) получен из Novagen (Nottingham, UK). Для in vitro транскрипции и трансляции используют набор TNT Quick coupled kit от Promega (Madison, WI). Реагенты для ПЦР и компетентные клетки E. coli штаммов XL-1Blue и BL21-Gold(DE3) получены от Stratagene (La Jolla, CA). Олигонуклеотиды приобретают в Primm (Milan). Коэлентеразин приобретают в Pharma Tech. International Inc. (Fairfield, NJ). Все другие реагенты были из стандартных источников и имели марку "чистый" и выше.
1. Создание библиотеки методом случайного мутагенеза и скрининг
1.1 Оптимизация фотобелка для экспрессии в клетках млекопитающих (GENEART GmbH, Regensburg, Germany)
Использование кодона гена клитина дикого типа адаптируют для кодонового смещения высокоэкспрессивных генов млекопитающих. Кроме того, по возможности избегают регионов с очень высоким (>80%) или очень низким (<30%) содержанием GC.
Для эффективной инициации трансляции консенсусную последовательность Козака вводят перед стартовым кодоном. Два стоп-кодона добавляют для эффективной терминации.
1.2 Случайный мутагенез
Набор GeneMorph II Random Mutagenesis (Stratagene) используют согласно инструкции производителя. Для достижения высокой степени мутагенеза используют два разных начальных количества целевой ДНК, 0,1 нг и 0,01 нг.
ПЦР-праймеры создают соответствующим образом с содержанием 5' LIC удлиняющих сегментов (показаны курсивом), соответствующих последовательностям, описанным в наборе Ek/LIC Cloning Kit (Novagen)
верхний: GATGACGACGACAAG-ATGGCCGACACCGCCAG (SEQ ID NO: 20)
нижний: GAGGAGAAGCCCGGT-TTATCAAGGACACGAAGT (SEQ ID NO: 21)
Амплификацию производят в термоциклере Perkin Elmer 2400 по следующему протоколу:
однократно следующая стадия:
30 раз следующие стадии:
однократно следующая стадия:
Ожидаемая длина специфического продукта ПЦР: 630 п.н.
Для количественного определения полученной ДНК продукты амплификации анализируют электрофорезом в 1% агарозном геле в буфере 1xTAE согласно стандартной процедуре, как описано Maniatis с соав. Пробы сравнивают с маркером молекулярного веса ДНК (MWXVI5 Roche).
1.3 Клонирование Ek/LIC
Набор Novagen Ligation Independent Cloning (LIC) используют согласно инструкции производителя для получения направленного клонирования продуктов ПЦР без обработки ферментами рестрикции и реакции сшивки. Выбирают вектор pET-30 Ek/LIC, сконструированный для экспрессии целевого белка непосредственно после сайта расщепления энтерокиназы.
1.4 Трансформация
Для хорошей экспрессии белков выбирают клетки BL21-Gold(DE3) (Stratagene), производные E.coli B, усовершенствованный штамм BL21. Генотип данного штамма: E.coli B F- ompT hsdS (rB - mB -) dcm+ Tetr gal λ (DE3) endA Hte. В данном штамме отсутствуют обе протеазы lon и ompT, которые могут разрушить белки во время очистки. Фенотип Hte увеличивает эффективность трансформации (>1×108 КОЕ/мкг pUC18 ДНК). Кроме того, ген endA, который кодирует эндонуклеазу I, инактивирован (не происходит деградации плазмидной ДНК).
Для получения компетентных клеток с высокой эффективностью трансформации следуют стандартному протоколу для приготовления и электротрансформирования клеток BL21-Gold(DE3), описанному в руководстве E. coli Pulser Transformation apparatus manual (BioRad).
Эффективность трансформации определяют с помощью pUC18 ДНК и pET ДНК векторов, и полученные значения составляют:
1×1010 КОЕ/мкг для pUC18 ДНК
1×108 КОЕ/мкг для pET ДНК
Используя указанные высокоэлектрокомпетентные клетки, получают библиотеку из приблизительно 84000 колоний, экспрессирующих случайным образом мутированный фотобелок - клитин.
1.5 Посев на планшеты, индукция и зарядка
Трансформированные клетки высевают на планшеты с LB агаром и выращивают в течение ночи при 37°C. После ночного роста колоний индукцию выполняют добавлением 10 мМ IPTG и 5 мМ ЭДТА и инкубацией 4 часа при 37°C. Колонии нагружают 10 мкМ раствором коэлентеразина и инкубируют в течение ночи при 4°C и в отсутствие света.
1.6 Измерение CCD камерой
Биолюминесценцию исследуют определением сигнала через фиксированный период времени, 30 сек. В момент времени 0, через 3 мин и через 5 мин после первого измерения.
1.7 Сбор колоний и повторное тестирование
Лучшие колонии собирают и выращивают в 1 мл жидкой среды LB и проводят повторное тестирование при условиях, описанных ранее.
2 Транскрипция и трансляции in vitro
Трансляцию фотобелков проводят в бесклеточной системе кроличьих ретикулоцитов (TNT Quick coupled kit, Promega) согласно инструкции производителя. Для каждой реакционной смеси для транскрипции/трансляции in vitro используют 500 нг ДНК. Реакционный объем (10 мкл) включает 8 мкл TNT T7 Quick Master Mix, 1,6 мкл ДНК, 0,2 мкл метионинового буфера и 0,2 мкл коэлентеразина (0,5 мМ). В конце 5 мкл каждого образца трансляционной смеси тестируют на световую эмиссию добавлением раствора кальция и измеряют на люминоскане Ascent (Labsystems).
3. Получение рекомбинантного белка
Для получения рекомбинантного белка используют протокол очистки малых количеств белка при нативных условиях. Из-за присутствия N-терминального His-тага в данной конструкции экспрессированные белки очищали на колонке Ni-NTA Spin Columns (Qiagen) согласно протоколу производителя.
4. Кривая концентрации кальция
Для оценки ответа фотобелка на различные концентрации кальция рекомбинантный белок в количестве 0,05 нг/лунку (96-луночного планшета) нагружают 10 мкМ коэлентеразином в течение ночи при 4°C.
После инкубации добавляют различные концентрации CaCl2 и измеряют испускаемый свет люминосканом Ascent со временем интеграции 20 мсек в течение общего времени 10 сек.
5. Экспрессия мутантного фотобелка в клетках млекопитающих
Реагенты
Ферменты рестрикции приобретают в New England Biolabs (Beverly, MA) и используют согласно инструкции производителя. Набор Rapid DNA ligation kit и Fugene transfection реагент приобретают в Roche (Basel, CH). Коэлентеразин получают от Pharma Tech. International Inc. (Fairfield, NJ). Все другие реагенты были из стандартных источников и имели марку "чистый" и выше.
Процедура клонирования
Наиболее перспективные мутантные фотобелковые клоны субклонируют для тестирования их экспрессии в клетках млекопитающих.
В качестве матрицы в ПЦР анализе используют 2 мкл плазмиды.
Стандартная процедура ПЦР соответствовала указанной Perkin Elmer. Используют следующий ПЦР протокол:
Праймеры:
верхний праймер: TCGTTGGGATCCGCCACCATGGCCGACACCGCC (SEQ ID NO: 22)
нижний праймер: GGGCCCTCTAGATTATCAAGGCACGAA (SEQ ID NO: 23)
ПЦР реакционная смесь:
Протокол амплификации, выполненной в термоциклере Perkin Elmer 2400:
однократно следующая стадия:
25 раз следующие стадии:
однократно следующая стадия:
Ожидаемая длина специфического продукта ПЦР: 630 п.н.
Продукты амплификации анализируют электрофорезом в 1% агарозном геле в буфере 1xTAE согласно стандартной процедуре, как описано Maniatis с соав.
Продукт ПЦР очищают на колонке Qiagen с гелем и обрабатывают ферментами рестрикции BamHI и XbaI.
Создание pcDNA3neo-/mito-мутированного клитина
Вектор pcDNA3 (Invitrogen) в собственной модификации содержит кодирующую последовательность митохондриального целевого пептида из субъединицы VIII цитохром С оксидазы человека (20, 21, 22), так что она может быть использована в рамке считывания 5'-конца использующего кодон гена оптимизированного фотобелка. Продукт амплификации, полученный в результате вышеупомянутого ПЦР, клонируют в данный модифицированный pcDNA3 вектор, лишенный гена устойчивости к неомицину, для экспрессии в клеточных линиях млекопитающих.
Сигнальная последовательность для митохондриальной направленности:
5'-ATGTCCGTCCTGACGCCGCTGCTGCTGCGGGGCTTGACAGGCTCGGC
CCGGCGGCTCCCAGTGCCGCGCGCCAAGATCCATTCGTTGGGATCCGCCACC-3' (SEQ ID NO: 24).
Создание pcDNA3neo-/cyto-мутированного-клитина
Ген мутированного клитина получают из pcrScript/h-мутированного-клитина вектора расщеплением ферментами рестрикции BamHI и XbaI и очищают. Затем ген мутированного клитина помещают в pcDNA3neo-вектор для получения pcDNA3neo-CYTO-h-мутированного-клитина.
Обе полученные конструкции проверяют полноразмерным дидеокси-секвенированием.
Клеточная культура
Культуральная среда, посев и инкубация: DMEM/F12 с глутамаксом (GIBCO cod. 31331-028), 10% ЭБС, 1% пен./стреп. (Invitrogen cod. 15140-122), 25 мМ Hepes буфер (GIBCO cod. 15630-056), 1,0 мМ пируват натрия (GIBCO cod. 11360-039), 1,5 г/л бикарбонат натрия (GIBCO cod. 25080-060).
Прекультуральные условия: клетки высевают для экспериментов, когда степень смыкания монослоя составляет 70-80%.
Условия клеточной культуры:
отделение дважды в неделю 3,0×105 клеток/фляшку Т75 (восстановление: 8,0×106 клеток).
Процесс селекции клона:
CHO-K1 трансфицируют воздействием pcDNA3Neo-/MITO-h-мутированного-клитина или pcDNA3Neo-/CYTO-h-мутированного-клитина.
Через 24 часа после трансфекции обработанные клетки высевают в 10×96-луночные планшеты в полной среде DMEM.
При слиянии монослоя 10×96-луночных планшетов дублируют на 10 белых планшетах. За 3,5 часов до измерения среду замещают 50 мкл/лунку буфером Тироде (2 мМ Ca2+ плюс коэлентеразин, 10 мкМ).
Положительные клоны выбирают, оценивая:
Первую селекцию проводят, лизируя клетки Тритоном Х-100. Условия для CCD камеры: низкая чувствительность, время интегрирования 1 сек, считывание в течение 5 сек.
Выбирают пять клонов, каждый разводят в 3×96-луночные планшеты.
При слиянии монослоя 15×96-луночных планшетов дублируют на 15 белых планшетах. За 3,5 часов до измерения среду замещают 50 мкл/лунку буфером Тироде (2 мМ Ca2+ и 10 мкМ коэлентеразин).
Вторую селекцию производят с 10 мкл АТФ, исследуя кинетику, и затем лизируют клетки Тритоном Х-100. Условия для CCD камеры: низкая чувствительность, время интегрирования 1 сек, считывание в течение 30 сек для измерения АТФ с последующими 30 сек для Тритона Х-100.
Производят четыре лимитирующих разведения выбранного лучшего клона, 0,3 клетки на лунку в 10×96-луночных планшетах.
Финальный клон выбирают после 4 лимитирующих разведений, отобранных с 0,25 мкМ ДНК, 5 мкМ коэлентеразина.
Полную оптимизацию исследования выполняют на клоне с наилучшим ответом.
Параметры измерения CCD камерой:
Клетки CHO высевают в различных концентрациях в 384 MTP (500, 750, 1000, 1500 клеток/лунку) в среде роста, дополненной, как указано выше, и измеряют CCD камерой через 24 и 48 часов после посева на планшеты. Перед экспериментами удаляют ростовую среду и нагружают клетки буфером Тироде плюс коэлентеразин при 37°C в течение 3 часов. В заключение наблюдают люминесценцию CCD камерой после добавления агониста (30 сек кинетически).
Измерения флюориметрическим планшетным ридером (FLIPR ® )
Параметры FLIPR 3 для стандартного протокола исследований определения люминесценции
планшеты с 384 белыми лунками с чистым дном
посев клеток за 24 часа до эксперимента
удаление среды
добавление буфера Тироде плюс коэлентеразин 25 мкл/лунку
инкубация 4 часа при 37 °C
эксперименты проводят в FLIPR3: двойное (2×) введение в буфере Тироде (25 мкл/лунку).
Значения всех параметров являются стандартными измерительными значениями за исключением следующих:
Предварительные стадии исследования:
1) Конфигурация камеры:
выдержка = 0,7
увеличение = 200
2) Параметры последовательности работы:
распределяющая насадка на 384 лунки
уровень = 30 мкл
скорость = 25 мкл/сек.
Параметры FLIPR TETRA для стандартного протокола исследований для определения люминесценции
планшеты с 384 белыми лунками с чистым дном
посев клеток за 24 часа до эксперимента
удаление среды
добавление буфера Тироде плюс коэлентеразин 25 мкл/лунку
инкубация 4 часа при 37 °C
эксперименты проводят в FLIPRTETRA: двойное (2×) введение в буфере Тироде (25 мкл/лунку).
Все значения параметров являются стандартными измерительными значениями за исключением следующих:
Настройка режима считывания:
1) Конфигурация камеры:
увеличение = 200
выдержка = 0,5
2) Параметры последовательности работы:
уровень = 30 мкл
скорость = 25 мкл/сек.
Контрольные соединения:
АТФ (Sigma, A-7699) растворяют в H2O в концентрации 100 мМ и хранят в аликвотах при -20°C. Делают свежеприготовленный рабочий раствор в буфере Тироде.
Композиция буфера Тироде: NaCl 130 мМ, KCl 5 мМ, CaCl2 2 мМ, MgCl2 1 мМ, NaHCO3 5 мМ, HEPES 20 мМ, pH 7,4.
IMETIT (Sigma, I-135)
ОПИСАНИЕ ФИГУР
Фиг.1: Повторное тестирование мутантных колоний с тремя концентрациями кальция.
Фиг.2: Транскрипция и трансляция in vitro. Измерение световой эмиссии после введения 5 мМ кальция.
Фиг.3: Транскрипция и трансляция in vitro. Измерение световой эмиссии после введения 1 мМ кальция.
Фиг.4: Кинетика измерения световой эмиссии после введения 1 мМ кальция для рекомбинантных фотобелков.
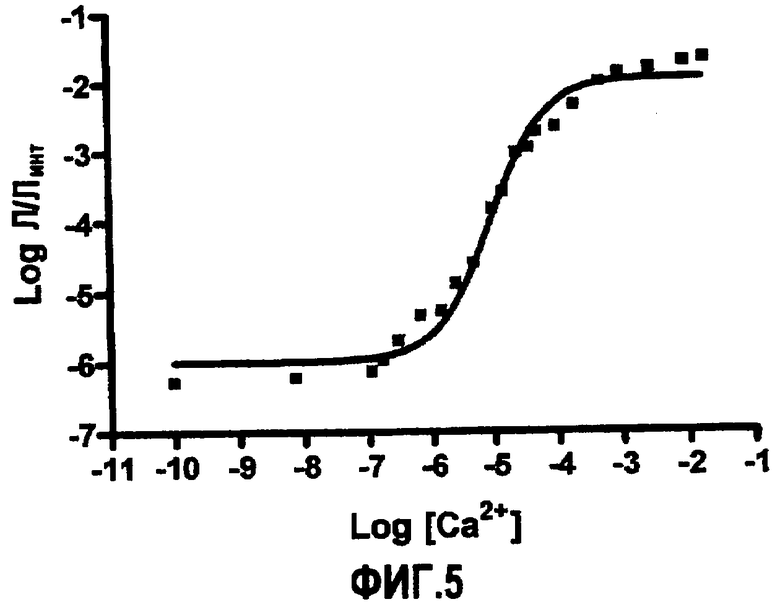
Фиг.5: Кривая зависимости от дозы кальция для рекомбинантного фотобелка 25N03b.
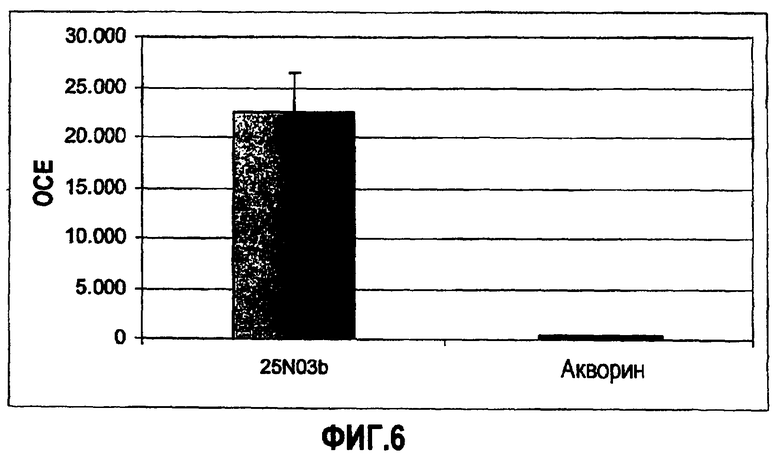
Фиг.6: Пик световой интенсивности для рекомбинантных фотобелков после введения 1 мМ кальция.
Фиг.7: Кинетика ответа на 10 мкМ АТФ в CCD камере для клеточной линии CHOK1/mito25N03b.
Фиг.8: Кривая зависимости от дозы АТФ для клеточной линии CHOK1/mito25N03b.
Фиг.9: Кинетика зависимости от дозы АТФ для клеточной линии CHOK1/mito12mutCly, полученная в CCD камере при тестировании 500 клеток/лунку через 24 часа после посева.
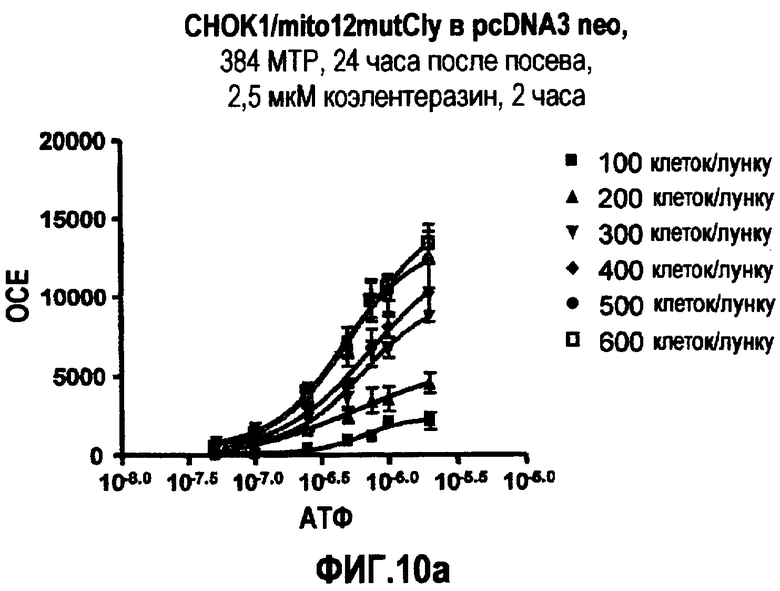
Фиг.10: Кривая зависимости от дозы АТФ для клеточной линии CHOK1/mito12mutCly, полученная в CCD камере с разным количеством клеток/лунку, с разными концентрациями коэлентеразина и временем инкубации.
Фиг.11: Кривая зависимости от дозы АТФ для клеточной линии CHOK1/cyto12mutCly, полученная в CCD камере, с разным количеством клеток/лунку.
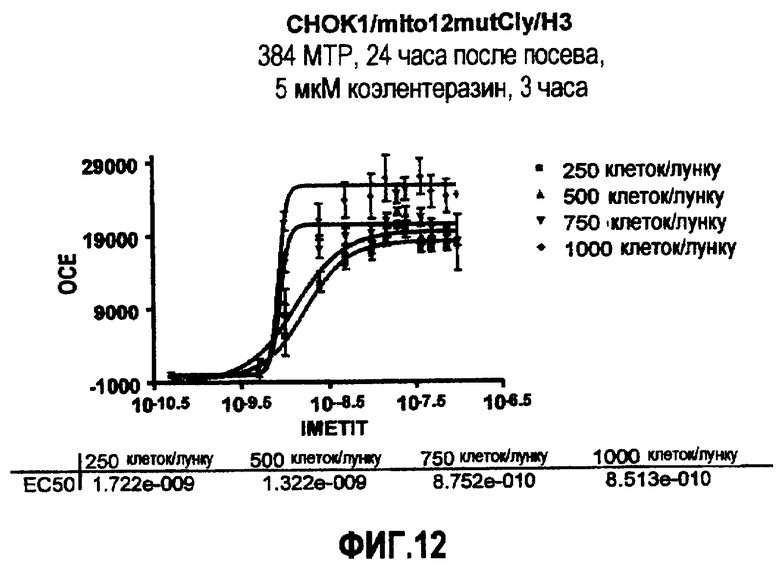
Фиг.12: Кривая зависимости от дозы IMETIT для клеточной линии CHOK1/mito12mutCly/H3, полученная в CCD камере, с разным количеством клеток/лунку.
Фиг.13: Кривая зависимости от дозы IMETIT для клеточной линии CHOK1/mito12mutCly/H3, полученная в FLIPR3.
Фиг.14: Кривая зависимости от дозы агониста A3 (IB MECA) для клеточной линии CHOK1/mito25N03b-A3, полученная в Lumitox CCD камере, 500 клеток/лунку, через 24 часа после посева, 5 мкМ коэлентеразина. Чувствительность камеры 5, измерение 60 сек.
Фиг.15: Кривая зависимости от дозы агониста A3 (IB MECA) для клеточной линии CHOK1/mito25N03b-A3, полученная в CyBi Lumax HT CCD камере, 2500 клеток/лунку, через 24 часа после посева, 5 мкМ коэлентеразина. Чувствительность камеры HV 10 аналог, измерение 60 сек.
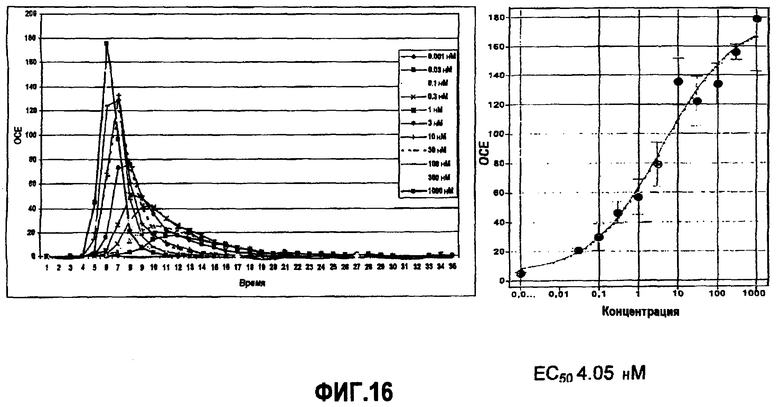
Фиг.16: Кривая зависимости от дозы агониста A3 (IB MECA) для клеточной линии CHOK1/mito25N03b-A3, полученная в FLIPTTETRA, 2500 клеток/лунку, через 24 часа после посева, 10 мкМ колентеразина. Время экспозиции 2 сек, увеличение 240.
ПРИМЕРЫ
1. Создание библиотеки методом случайного мутагенеза и скрининг
Библиотеку случайных мутантов получают с помощью набора GeneMorph II Random Mutagenesis (Stratagene). Для достижения высокой частоты мутаций используют два разных начальных количеств целевой ДНК: 0,1 нг и 0,01 нг. Всего люминесцентную активность проверяют у 83305 бактериальных колоний. Из них 1089 являются позитивными и, следовательно, обладают биолюминесцентными свойствами. Всего собирают 289 лучших колоний, из них повторным тестированием окончательно выбирают 16 наилучших.
На фиг.1 показаны результаты, полученные на кривой зависимости от дозы CaCl2, полученные с 8 мутантами.
2. Исследование фотобелков
Смешивают 5 мкл трансляционной смеси с 95 мкл фосфатного буфера непосредственно в 96-луночном планшете, который устанавливают в люминометер (Berthold). Для инициации световой эмиссии фотобелка в лунку вводят 5 пМ CaCl2 и записывают люминесценцию в течение 10 сек.
На фиг.2 показаны результаты in vitro транскрипции и трансляции ДНК 8 мутантов.
Проводят новый эксперимент in vitro транскрипции и трансляции с лучшим мутантом 25N03b (sequence ID n°16) и с фотобелком акворином (фиг.3) для сравнения световой эмиссии при введении 1 мМ CaCl2.
3. Рекомбинантный фотобелок и кривая концентрации кальция
Рекомбинантные фотобелки, соответствующие некоторым мутантам, получают при нативных условиях, следуя протоколу очистки малых количеств белка. Измеряют световую эмиссию после введения 1 мМ кальция, соответствующие кинетические кривые представлены на фиг.4.
Рекомбинантный мутантный фотобелок, соответствующий клону 25N03b, лучше охарактеризован на полной кривой зависимости от дозы кальция, которая показана на фиг.5.
В другом эксперименте сравнивают рекомбинантный фотобелок 25N03b с рекомбинантным акворином. Световая эмиссия, записанная после введения 1 мМ CaCl2, была выше в случае мутанта 25N03b, как показано на фиг.6.
4 Клеточные функциональные исследования
4.1 CHOmito25N03b-экспрессирующий клон (CHOK1/mito25N03b) получают трансфекцией клеток CHO-Kl (см. раздел Материалы и методы). Через 48 часов после трансфекции клетки трипсинизируют и помещают в 10×96-луночные планшеты MTP (Microtiter Plates) в полной среде MEM. При слиянии монослоя клеток 10×96 MTP дуплицируют, используя MATRIX (Hudson, NH, USA) в 10×96 белых MTP. За 3 часа до измерения среду в лунках замещают 50 мкл буфера Тироде, содержащего 2 мМ Ca2+ и 10 мкМ коэлентеразина. Клоны выбирают на основе их функционального ответа (люминесцентный сигнал) на АТФ, которая стимулирует CHO эндогенный рецептор P2Y и увеличивает концентрацию цитоплазматического Ca2+. В конце каждого эксперимента клетки лизируют перфузией раствора Тритон Х-100. Активный фотобелок восстанавливают, инкубируя клетки с 10 мкМ коэлентеразином, растворенном в буфере Тироде, содержащем 2 мМ Ca2+, в темноте при 37°C, в 5% CO2 атмосфере в течение 3 часов. Для измерения световой эмиссии клетки лизируют в присутствии кальция и записывают излучаемую люминесценцию. Число фотонов, испускаемых в первые 30 сек, интегрируют CCD камерой и визуализируют на экране. Клетки, трансфицированные пустой плазмидой или не трансфицированные, не увеличивают эмиссию фотонов. Для определения изменений концентрации кальция вводят 10 мкМ АТФ и определяют кинетику ответа. Полученная кривая представлена на фиг.7.
Финальный клон высевают в 384-луночный планшет и проверяют с возрастающими концентрациями АТФ, как показано на кривой зависимости от дозы на фиг.8.
Клеточную линию CHOK1/mito25N03b трансфицируют G-белоксвязывающим рецептором, аденозин А3 рецептором и химерным Gα-белком для переключения сигнала на PLC/IP путь. Создают стабильную клеточную линию (далее именуемую как CHOK1/mito25N03b/A3 клон).
После стимуляции агонистом рецептор А3 вызывает увеличение внутриклеточной концентрации кальция, которое измеряют люминесценцией mito25N03b.
Финальные клоны CHO клеточных линий, экспрессирующие mito25N03b и аденозин А3 рецептор человека, выращивают до 80-95% слияния монослоя в культуральных фляшках и собирают трипсинизацией. Готовят клеточные разведения различной плотности в 384-луночном планшете в ростовой среде (DMEM/F12, содержащей 10% фетальной бычьей сыворотки), и инкубируют 24 и 48 часов при 37°C во влажном инкубаторе с 5% CO2. В день эксперимента удаляют культуральную среду и для экспериментов с люминесценцией нагружают клетки 5 мкМ коэлентеразином в течение 3 часов при 37°C в 5% CO2. Кальциевый ответ стимулируют добавлением АТФ в различных концентрациях в каждую лунку. Кинетику отслеживают CCD камерой, которая вводит реагенты и записывает световую эмиссию для каждой лунки.
Готовят разведения агониста и антагониста в различных концентрациях в буфере Тироде. Приблизительно 25 мкл данных растворов вводят отдельно в каждую лунку и измеряют ответ CCD камерой, результаты представлены на фиг.15.
4.2 Для получения клеточной линии CHOK1/mitol2mutCly клетки CHOK1 трансфицируют мутантом 12mutCly (SEQ ID NO: 19), клонированным в pcDNA3neo-mito (см. раздел Материалы и методы).
Финальный клон выбирают на основе функционального ответа (люминесцентный сигнал) на АТФ, которая стимулирует CHO эндогенный рецептор P2Y и увеличивает концентрацию цитоплазматического Ca2+. В конце каждого эксперимента клетки лизируют перфузией раствора, содержащего Тритон Х-100. Активный фотобелок восстанавливают, инкубируя клетки с 2,5 или 5 мкМ коэлентеразина, растворенными в буфере Тироде, содержащем 2 мМ Ca2+, в темноте при 37°C, в 5% CO2 атмосфере в течение 3 часов. Для измерения световой эмиссии клетки лизируют в присутствии кальция и записывают излучаемую люминесценцию. Число фотонов, испускаемых в первые 30 сек, интегрируют люминометром на основе CCD камеры и визуализируют на экране. Клетки, трансфицированные пустой плазмидой или не трансфицированные, не увеличивают эмиссию фотонов. Клетки в различном количестве высевают в 384 MTP. Через 24 часа для определения изменений концентрации кальция вводят различные концентрации АТФ и определяют кинетику ответа. Примеры кинетических кривых, полученных на посеве 500 клеток/лунку за 24 часа до теста, представлены на фиг.9.
Высокая световая эмиссия и чувствительность к Ca2+, наблюдаемые в клеточной линии CHOK1/mitol2mutCly, позволяют использовать меньшее число клеток и более низкую концентрацию коэлентеразина даже при меньшем времени по сравнению со стандартными условиями для клеточных исследований на основе фотобелков.
На фиг.10a и 10b показаны примеры кривых зависимости от дозы АТФ, полученные при посеве от 100 до 600 клеток/лунку за 24 часа до теста и инкубации клеток с 2,5 и 5 мкМ коэлентеразина, растворенного в буфере Тироде, содержащем 2 мМ Ca2+, в темноте при 37°C, в 5% CO2 атмосфере в течение 2 и 3 часов.
Клеточную линию CHOK1 cytol2mutCly получают трансфекцией клеток CHO-Kl (см. раздел Материалы и методы).
Финальный клон выбирают на основе функционального ответа (люминесцентный сигнал) на АТФ, которая стимулирует CHO эндогенный рецептор P2Y и увеличивает концентрацию цитоплазматического Ca2+. В конце каждого эксперимента клетки лизируют перфузией раствора Тритон Х-100. Активный фотобелок восстанавливают, инкубируя клетки с 2,5 или 5 мкМ коэлентеразина, растворенными в буфере Тироде, содержащем 2 мМ Ca2+, в темноте при 37°C, в 5% CO2 атмосфере в течение 3 часов. Для измерения световой эмиссии клетки лизируют в присутствии кальция и записывают излучаемую люминесценцию. Число фотонов, испускаемых в первые 30 сек интегрируют люминометром на основе CCD камеры и визуализируют на экране. Клетки, трансфицированные пустой плазмидой или не трансфицированные, не увеличивают эмиссию фотонов. Клетки в различных количествах высевают в 384 MTP. Через 24 и 48 часов для определения изменений концентраций кальция вводят АТФ в различных концентрациях и определяют кинетику ответа. На фиг.11 показаны кривые зависимости от дозы АТФ, полученные при посеве 500, 1000 и 2000 клеток/лунку за 24 часа до теста, и инкубации клеток с 2,5 и 5 мкМ коэлентеразина, растворенного в буфере Тироде, содержащем 2 мМ Ca2+, в темноте при 37°C, в 5% CO2 атмосфере в течение 2 и 3 часов.
Клеточную линию CHOK1 mitol2mutCly трансфицируют G-белоксвязывающим рецептором, гистамин-3 рецептором и химерным Gα-белком для переключения сигнала на PLC/IP путь. Создают стабильную клеточную линию (далее именуемую как CHOK1/mito12mutCly/H3 клеточная линия) (см. раздел Материалы и методы).
После стимуляции агонистом (IMETIT) рецептор H3 вызывает увеличение внутриклеточной концентрации кальция, которое измеряют люминесценцией mito12mutCly.
На фиг.12 показаны кривые зависимости от дозы IMETIT, полученные при посеве 250, 500, 750 и 1000 клеток/лунку за 24 часа до теста и при инкубации клеток с 5 мкМ коэлентеразина, растворенного в буфере Тироде, содержащем 2 мМ Ca2+, в темноте при 37°C, в 5% CO2 атмосфере в течение 2 и 3 часов.
5. Клеточные исследования в FLIPR
CHOK1/mito25N03b/A3 и CHOK1/mitol2mutCly/H3 тестируют в FLIPR путем измерения сигнала люминесценции, вызванной активацией трансфекторного рецептора. Измеренная в FLIPR люминесценция представлена в единицах изменения люминесценции на фиг.13, где показаны результаты измерения испускания света, вызванного стимуляцией IMETIT на CHOK1/mitol2mutCly/H3. Высевают 500 клеток/лунку в 384 MTP за 24 часа до эксперимента. Среду удаляют и заменяют 25 мкл коэлентеразина в двойной (2×) концентрации (10 мкМ), растворенного в буфере Тироде, содержащем 2 мМ Ca2+, на 3 часа в темноте при 37°C, в 5% CO2 атмосфере. Соединение IMETIT (2×) в различных концентрациях добавляют к клеткам (25 мкл/лунку).
На фиг.16 люминесценция, измеренная FLIPRTETRA, представлена в ОСЕ (относительные световые единицы), где показаны результаты испускания света, вызванные IB-MECA стимуляцией на CHOK1/mito25N03b/A3. Высевают 2500 клеток/лунку в 384 MTP за 24 часа до эксперимента. Среду удаляют и вместо нее используют 25 мкл двойной (2×) концентрации коэлентеразина (10 мкМ), растворенного в буфере Тироде, содержащем 2 мМ Ca2+, на 3 часа в темноте при 37°C, в 5% CO2 атмосфере. Соединение IB-MECA (2×) в различных концентрациях добавляют к клеткам (25 мкл/лунку).
Список литературы
1. Kendall, J.M. and Badminton, M.N. (1998) Aequorea victoria bioluminescence moves into an exciting new era. Trends Biotechnology. 16(5):216-24.
2. Campbell, A.K., Hallet, R.A., Daw, M.E., Ryall, R.C., Hart and Herring P.J. (1981) Application of the photoprotein obelin to the measurament of free Ca++ in cells. In Bioluminescence and Chemiluminescence, basic Chemistry and Analytical applications (Edited by M.A. deLuca and W.D. McElroy), pp. 601-607. Academy Press, New York.
3. Herring, P.J. (1979) Some features of the bioluminescence of the radiolarian Thalassicola sp. Mar. Biol. 53, 213-216.
4. Shimomura, O., Johnson F.H., and Saiga, Y (1962) Extraction, purification and properties of aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J. Cell. Comp. Physiol. 59,223-239.
5. Shimomura, O., Johnson F.H., and Saiga, Y (1963) Further data on the bioluminescent protein, aequorin. J. Cell. Comp. Physiol. 62, 1-8.
6. Morin, J.G. and Hastings J.W. (1971) Biochemistry of the bioluminescence of colonial hydroids and other coelenterates. J. Cell. Physiol. 77, 305-311.
7. Shimomura, O., Johnson, F.H. and Saiga, Y. (1963) Extraction and properties of halistaurin, a bioluminescent protein from the hydromedusan Halistaura. J. Cell. Physiol. 62, 9-15.
8. Shimomura, O. and Shimomura, A. (1985) Halistaurin, phialidin and modified forms of aequorin as Ca++ indicator in biological systems. Biochem. J. 228,745-749.
9. Levine, L.D., and Ward, W.W. (1982) Isolation and characterization of a photoprotein “phialidin” and a spectrally unique green-fluorescent protein from the bioluminescent jellyfish Phialidium gregarium. Comp. Biochem. Physiol. 72B,77-85.
10. Morin, J.G. and Hastings (1971) Energy transfer in a bioluminescent system. J. Cell. Physiol. 77, 313-318.
11. Campbell, A.K. (1974) Extraction, partial purification and properties of obelin the calcium-activated protein from the hydroid Obelia geniculata. Biochem.J. 143,411-418.
12. Ward, W.W. and Selinger (1974) Extraction and purification of calcium-activated photoprotein from the ctenophores Mnemiopsis sp. and Bern ovata. Biochemistry 13, 1491-1499.
13. Ward, W.W. and Seliger H.H. (1974) Properties of mnemiopsin and berovin, calcium-activated photoproteins from the ctenophores Mnemiopsis sp. and Beroё ovata. Biochemistry 13, 1500-1510.
14. Johnson, F.H. and Shimomura, O. (1978) Introduction to the bioluminescence of medusae, with special reference to the photoprotein aequorin. Methods Enzymol. 57,271-291.
15. Illarionov B.A., Bondar V.S., Illarionova V.A., Vysotski E.S. Sequence of the cDNA encoding the Ca++-activated photoprotein obelin from the hydroid polyp Obelia longissima. Gene. 1995 14;153(2):273-4.
16. Blinks, J.R., Weir, W.G., Hess, P. and Prendergast, F.G. (1982). Measurement of Ca++ concentrations in living cells. Prog. Biophys. Mol. Biol. 40,1-114.
17. Markova S.V., Vysotski E.S., Blinks J.R., Burakova L.P., Wang B.C., Lee J., (2002) Obelin from the bioluminescent marine hydroid Obelia geniculata: cloning, expression and comparison of some properties with those of other Ca2+-regulated photoproteins. Biochemistry. 2002 Feb 19;41(7):2227-36.
18. Inouye S., Tsuji F.I. (1993) Cloning and sequence analysis of cDNA for the Ca(2+)-activated photoprotein, clytin. FEBS Lett. Jan 11;315(3):343-6.
19. Tsuji F.I., Ohmiya Y., Fagan T.F., Toh H., Inouye S. (1995) Molecular evolution of the Ca(2+)-binding photoproteins of the Hydrozoa. Photochem Photobiol. Oct 62(4):657-61.
20. Rizzuto, R., Simpson, A.W.M., Brini, M. and Pozzan, T. (1992) Rapid changes of mitochondrial Ca2+ revealed by specifically targeted recombinant aequorin. Nature, 358, 325-328.
21. Rizzuto, R., Brini, M., Murgia, M. and Pozzan, T. (1993) Microdomains with high Ca2+ close to IP3-sensitive channels that are sensed by neighbouring mitochondria. Science, 262, 744-747.
22. Rizzuto, R., Bastianutto, C., Brini, M., Murgia, M. and Pozzan, T. (1994) Mitochondrial Ca2+ homeostasis in intact cells. J. Cell Biol., 126, 1183-1194.















| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОБЕЛОК С ПОВЫШЕННОЙ БИОЛЮМИНЕСЦЕНЦИЕЙ | 2003 |
|
RU2340629C2 |
| СПОСОБЫ ИДЕНТИФИКАЦИИ МОДУЛЯТОРОВ GPR92 | 2017 |
|
RU2742608C2 |
| МУТАНТНЫЙ ФОТОПРОТЕИН (ВАРИАНТЫ) ДЛЯ ОПРЕДЕЛЕНИЯ ВНУТРИКЛЕТОЧНОГО КАЛЬЦИЯ ОДНОВРЕМЕННО В РАЗНЫХ ОРГАНЕЛЛАХ КЛЕТКИ | 2008 |
|
RU2402566C2 |
| СОПРЯЖЕННЫЕ С G-БЕЛКОМ РЕЦЕПТОРЫ DROSOPHILA, НУКЛЕИНОВЫЕ КИСЛОТЫ И СПОСОБЫ, ИМЕЮЩИЕ К НИМ ОТНОШЕНИЕ | 2003 |
|
RU2326385C2 |
| КОМПОЗИЦИЯ И СПОСОБ ПРОФИЛАКТИКИ, СНИЖЕНИЯ, ОБЛЕГЧЕНИЯ ИЛИ ЛЕЧЕНИЯ ИДИОПАТИЧЕСКОЙ РВОТЫ | 2014 |
|
RU2670516C2 |
| СПОСОБ ОЦЕНКИ КОМПЛЕКСНОЙ ЗАЩИТЫ КЛЕТОК ПРИ НЕЙРОВОСПАЛЕНИИ НА МОДЕЛИ IN VITRO ПРИ ВОЗДЕЙСТВИИ АГОНИСТОМ ПАР1 | 2022 |
|
RU2796524C1 |
| СПОСОБЫ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОСТИ ЛИГАНДА НАТРИЙ-ПРОТОННОГО АНТИПОРТЕРА | 2009 |
|
RU2519345C2 |
| Нуклеиновая кислота для аллотопической экспрессии гена MT-ND4 | 2023 |
|
RU2809065C1 |
| СПОСОБ ЗАЩИТЫ КЛЕТОК ОТ ПОВРЕЖДЕНИЯ ПРИ ГИПОКСИИ ПУТЕМ ГЛУТАТИОНИЛИРОВАНИЯ КАТАЛИТИЧЕСКОЙ СУБЪЕДИНИЦЫ Na, К-АТФазы | 2013 |
|
RU2544958C2 |
| ПРИМЕНЕНИЕ S1P | 2004 |
|
RU2362565C2 |












Настоящее изобретение относится к фотобелкам, производным клитина, и их использованию в качестве индикаторов внутриклеточного кальция и в клеточных исследованиях. Данные белки получают мутагенезом кодирующей последовательности клитина. Кроме того, предлагаются нуклеиновые кислоты, кодирующие данный белок, вектор, содержащий данные нуклеиновые кислоты, и клетка-хозяин, несущая вектор. Полученные белки проявляют усиленную биолюминесценцию, высокое сродство к кальцию и продолжительную световую эмиссию. Они могут найти применение в генных технологиях передачи информации для мониторинга клеточных событий, связанных с передачей сигнала и экспрессией генов. Также фотобелки настоящего изобретения могут быть использованы в качестве индикаторов внутриклеточного кальция в диагностических методах, основанных на измерении концентрации кальция в ответ на различные воздействия. 9 н. и 10 з.п. ф-лы, 16 ил.
1. Выделенный фотобелок, представляющий собой внутриклеточный индикатор кальция, содержащий аминокислотную последовательность, которая
a) способна связать коэлентеразин и кальций, производя биолюминесценцию;
b) идентична, по меньшей мере, на 90% SEQ ID NO: 1 (клитин);
c) при выравнивании последовательностей SEQ ID NO: 1, представляет одно из следующих единичных или множественных замещений (позиции остатке в относятся к SEQ ID NO: 1):
i) C54→S;
ii) S132→C;
iii) К48→Р, N195→D;
iv) Q68→R, A90→V, T184→I;
v) Y82→F, K110→N, F125→L149→R;
vi) G142→C;
vii) I53→V, S149→R;
viii) N18→D, I40→V, K56→R;
ix) Gly58→Glu, Asp69→Val, Ala70→Cys, Lys76→Arg, Lys77→Gly, Ile78→Cys, Asp81→Glu, Val86→Ile, Glu87→Ala, Ala90→Gln, Val92→Leu и Glu97→Gln.
2. Фотобелок по п.1, содержащий аминокислотную последовательность, идентичную, по меньшей мере, на 95% SEQ ID NO: 1.
3. Фотобелок по п.2, содержащий аминокислотную последовательность, идентичную, по меньшей мере, на 98% SEQ ID NO: 1.
4. Фотобелок по п.3, содержащий аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 2, 3, 4, 5, 6, 7, 8, 9 и 10.
5. Фотобелок по пп.1-4, где указанная последовательность дополнительно соединена с митохондриальной целевой последовательностью.
6. Выделенный полинуклеотид, кодирующий фотобелок по пп.1-5.
7. Полинуклеотид по п.6, имеющий последовательность SEQ ID NO: 11, 12, 13, 14, 15, 16, 17, 18 или 19.
8. Вектор экспрессии, содержащий полинуклеотид по любому из пп.6 и 7.
9. Прокариотическая или эукариотическая клетка-хозяин для продукции фотобелка по пп.1-5, содержащая вектор по п.8.
10. Клетка-хозяин из млекопитающего для продукции фотобелка по пп.1-5, определенная в п.9.
11. Способ для определения изменений внутриклеточной концентрации кальция in vitro, который включает:
a) обеспечение клеточной экспрессии фотобелка по пп.1-5;
b) нагрузки клетки коэлентразином;
c) взаимодействие клетки с агентом, вызывающим приток кальция в клетку или высвобождение кальция из внутриклеточных запасов;
d) определение фотобелковой биолюминесценции.
12. Способ по п.11, который выполняют в высокопроизводительном формате.
13. Способ по п.12, который выполняют с высокопроизводительным оптическим скрининговым аппаратом для многопробного анализа.
14. Способ скрининга соединений, модулирующих концентрацию внутриклеточного кальция, который включает:
a) обеспечение клеточной экспрессии фотобелка по пп.1-5;
b) нагрузки клетки коэлентразином;
c) взаимодействие клетки с соединением-кандидатом;
d) определение биолюминесценции фотобелка.
15. Способ по п.14, который выполняют в высокопроизводительном формате.
16. Способ по п.15, который выполняют с высокопроизводительным оптическим скрининговым аппаратом для многопробного анализа.
17. Применение фотобелка по пп.1-5 как индикатора внутриклеточного кальция.
18. Применение фотобелка по п.17 в клеточном высокопроизводительном исследовании.
19. Применение фотобелка по пп.1-5 для изготовления диагностической композиции.
| WO 03006497, 03.01.2003 | |||
| ФОТОБЕЛОК С ПОВЫШЕННОЙ БИОЛЮМИНЕСЦЕНЦИЕЙ | 2003 |
|
RU2340629C2 |
| VYSOTSKI E.S | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| CHIESA a el al.: "Recombinant aequorin and green fluorescent protein as valuable tools in the study of cell signaling", Biochem | |||
| J., | |||
Авторы
Даты
2010-12-27—Публикация
2006-03-09—Подача