Область техники, к которой относится изобретение
Изобретение относится к нейрофизиологии, фармакологии, медицине и экспериментальной биологии, а именно, к разработке способов комплексной регуляции нейровоспаления в экспериментальных условиях через ПАР1-опосредованные механизмы, реализуемой в стабилизации морфо-функциональных характеристик активированных провоспалительными факторами основных клеток-участников нейровопаления, а именно тучных клеток, нейронов и астроцитов.
Уровень техники
Согласно данным Всемирной организации здравоохранения (ВОЗ) предупреждение и эффективное лечение нейродегенеративных заболеваний являются актуальной задачей современной медицины. Нейровоспаление сопровождает и потенцирует повреждения нервной ткани, возникающие в результате травм и ряда нейродегенеративных заболеваний. Стойкое нейровоспаление в настоящее время признано механизмом, который может способствовать или даже вызывать повреждение ЦНС, связанное с патогенезом некоторых нейродегенеративных заболеваний [Lehnardt S. 2010. Innate immunity and neuroinflammation in the CNS: The role of microglia in toll-like receptor-mediated neuronal injury // Glia - V. 58. - № 3. - P. 253-63.; 2. Lyman M., Lloyd D.G., Ji X., Vizcaychipi M.P., Ma D. 2014. Neuroinflammation: The role and consequences // Neurosci. Res. - V. 79. - № 1. - P. 1-12.]. Поэтому нейровоспаление все больше привлекает внимание как мишень для лечения заболеваний головного мозга [Silver R, Curley JP. Mast cells on the mind: new insights and opportunities. Trends Neurosci. 2013 Sep;36(9):513-21. doi: 10.1016/j.tins.2013.06.001. Epub 2013 Jul 8. PMID: 23845731.; Skaper S.D., Facci L., Giusti P. 2014. Mast cells, glia and neuroinflammation: Partners in crime? // Immunology - V. 141. - № 3. - P. 314-27.].
В развитие и разрешение процессов нейровоспаления активно вовлекаются протеазы гемостаза. В настоящее время появляется все больше доказательств о вовлечении факторов свертывания крови в развитие заболеваний ЦНС. Система свертывания крови и ее протеазы одни из первых в организме реагируют на повреждающее воздействие. Основным потенциальным звеном-мишенью при этом выступают протеаза активируемые рецепторы 1 типа (ПАР1).
Одним из эндогенных агонистов ПАР1, запускающим антивоспалительные и цитопротекторные каскады, является активированный протеин С (АПС) [ Mosnier L.O., Sinha R.K., Burnier L., Bouwens E.A., Griffin J.H. 2012. Biased agonism of protease-activated receptor 1 by activated protein C caused by noncanonical cleavage at Arg46 // Blood - V. 120. - № 26. - P. 5237-46.].
Заявляемый способ основан на использовании в качестве молекулярной мишени ПАР1-опосредованной сигнализации, при этом для регуляции нейровоспаления in vitro используется агонист ПАР1 пептидной природы, аналогичный по структуре «привязанному лиганду», высвобождаемому АПС при ограниченном протеолизе ПАР1. Известно, что АПС связывается с эндотелиальным рецептором протеина С (ЭРПС), что ведет к специфическому расщеплению внеклеточного фрагмента ПАР-1, с образованием «привязанного лиганда», который, взаимодействуя со второй внеклеточной петлей, активирует рецептор. При этом показано, что блокирование ЭРПС отменяет цитопотекторное действие АПС, например, в условиях глутаматной эксайтотоксичности [Gorbacheva L., Davidova O., Sokolova E., Ishiwata S., Pinelis V., Strukova S., Reiser G. 2009. Endothelial protein C receptor is expressed in rat cortical and hippocampal neurons and is necessary for protective effect of activated protein C at glutamate excitotoxicity // J. Neurochem. - V. 111. - № 4. - P. 967-75.]. Таким образом, АПС рассматривается как один из перспективных нейропротекторных агентов при ряде нейродегенеративных заболеваний, например, при ишемическом инсульте [Cheng, Tong et al. 2006. “Activated protein C inhibits tissue plasminogen activator-induced brain hemorrhage.” Nature Medicine 12: 1278-85.].
В настоящее время ведется активный поиск пептидов агонистов ПАР - регуляторов воспаления, для чего актуальным является разработка способов проведения экспериментов с использованием клеточных моделей нейровоспаления для исследования антивоспалительного и цитопротекторного действия на них пептидов-агонистов ПАР1. Ключевые протеазы гемостаза и ПАР могут вовлекаться в процессы нейродегенерации как участники нейровоспаления при ишемическом повреждении мозга и при ряде нейропатологий. В связи с этим, исследование механизмов участия агонистов ПАР1 в регуляции функций клеток нейроваскулярной единицы при развитии нейровоспаления представляется весьма актуальным и перспективным как для фундаментальной физиологии, так и для практической медицины. Поиск агонистов ПАР - регуляторов воспаления, может быть, одним из перспективных направлений для терапевтических стратегий ингибирования процессов воспаления и нейродегенерации.
Наиболее близким к заявляемому решению является способ защиты клеток при нейровоспалении на модели in vitro при воздействии пептидом-агонистом ПАР1 - TR47, который продемонстрировал цитопротекторные свойства cинтетического пептида [Mosnier L.O., Sinha R.K., Burnier L., Bouwens E.A., Griffin J.H. 2012. Biased agonism of protease-activated receptor 1 by activated protein C caused by noncanonical cleavage at Arg46 // Blood - V. 120. - № 26. - P. 5237-46.]. Протокол известного способа включает следующие основные этапы: культивирование клеток линии EA.hy.926 (5×104 клеток/лунку) на вставках Transwell из поликарбонатной мембраны (Costar, размер пор 3 мкм, диаметр 12 мм); через 48 часов, после формирования монослоя, к клеткам добавляют пептид TR47 (50 μM, синтетический пептид, содержащий аминокислотные остатки 47-66 PAR1 человека 47-NPNDKYEPFWEDEEKN) в бессывороточной среде с 0,1% BSA (фракция V с низким содержанием жирных кислот и без эндотоксина, Calbiochem); далее через 4 часа добавляют провоспалительный фактор - тромбин (10нМ); через 10 минут среду во внутренней камере заменяли полной средой, содержащей 4% БСА и 0,67 мг/мл синего Эванса. Проницаемость эндотелиальных клеток определяли по поглощению синего Эванса во внешней камере при 650 нм. Синтетический пептид TR47, защищал эндотелиальные клетки от тромбин-вызванного повреждения, стабилизируя барьерную функцию эндотелия. Данный процесс был опосредован фосфорилированием Akt и GSK3β и активацией Rac1.
Однако данные исследования были проведены на культуре эндотелиальных клеток линии EA.hy.926, что не дает возможности в полной мере описать его влияние на основные клетки-участники нейровоспаления (нейроны, астроциты, тучные клетки). Недостатком TR47 также является его большая длина (20 аминокислотных остатков), в отличие от пептида-агониста ПАР1, используемого при разработке заявленного способа оценки защиты клеток при нейровоспалении на модели in vitro, что повышает его себестоимость при производстве; а также снижает его потенциальную возможность проникновения через ГЭБ.
Кроме того, известный способ имеет ряд существенных ограничений, которые не позволяют использовать его в качестве способа комплексной оценки подавления нейровоспаления. В частности, известный способ направлен лишь на один из симптомов воспаления - проницаемость сосудов, и не затрагивает напрямую его конечного результата - гибели клеток. В то время как предлагаемый способ включает в экспериментальную модель комплекс клеток (тучные, нейроны и астроциты), являющиеся ключевыми мишенями при нейровоспалении. Более того, заявленный способ обеспечивает коррекцию именно конечного результата нейровоспаления - защищая клетки мозга от гибели.
Кроме того, известный способ обеспечивает возможность коррекции лишь отдельных внутриклеточных сигнальных каскадов, что продемонстрировано лишь на эндотелиальных клетках, которые хотя и присутствуют в мозговой ткани, однако их функции там напрямую связаны с множеством других клеток, входящих в состав нейроваскулярной единицы, и, следовательно, также контролирующих процессы нейровоспаления. Заявленный способ, в отличие от наиболее близкого аналога, направлен на оценку защиты ключевых клеток, опосредующих воспаление в мозге, через коррекцию как отдельных сигнальных каскадов этих клеток, так и, в конечном счете, их свойств и функций.
Таким образом, заявленный способ демонстрирует возможность достижения защиты и оценку такой защиты для целой группы клеток мозга, стабилизирущей не только отдельные клеточные сигнальные каскады, но и их функции при индуцировании нейровоспаления целым спектром факторов, в отличие от ближайшего аналога, техническим результатом которого является лишь стабилизация эндотелиального слоя клеток на фоне восстановления лишь нескольких внутриклеточных каскадов на фоне действия лишь одного провоспалительного фактора - тромбина.
Технической проблемой является разработка способа оценки влияния агониста ПАР1 на защиту клеток при нейровоспалении на модели in vitro, устраняющего перечисленные выше недостатки, присущие наиболее близкому аналогу.
Раскрытие изобретения
Техническим результатом изобретения является возможность оценки агониста ПАР1 на комплексную защиту клеток при нейровоспалении на модели in vitro, основанную на оценке антивоспалительного и цитопротекторного действия ПАР1.
Технический результат достигается способом оценки комплексной защиты клеток при нейровоспалении на модели in vitro при воздействии агонистом ПАР1, включающим
формирование клеточных моделей воспаления in vitro: в виде изолированных клеточных культур из: нейронов и астроцитов, полученных, например, из новорожденных крысят линии Wistar, клеточной линии тучных клеток RBL-2H3; в виде композиций из клеточных культур нейронов и тучных клеток, композиций из клеточных культур астроцитов и тучных клеток; и последующую оценку морфо-функциональных характеристик клеточных моделей, активированных провоспалительными факторами, по результатам которой делают вывод о комплексной защите клеток при нейровоспалении, при этом воздействие агонистом ПАР1 на клеточные модели осуществляют до проведения провоспалительной активации клеток провоспалительными факторами. Для оценки морфо-функциональных характеристик формируют, по меньшей мере, 6 экспериментальных групп, где
первая группа представляет собой изолированные клеточные культуры нейронов, астроцитов, тучных клеток, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1;
вторая группа представляет собой изолированные клеточные культуры нейронов, астроцитов, тучных клеток, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1;
третья группа представляет собой композицию, включающую сокультивируемые нейроны с тучными клетками, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1;
четвертая группа представляет собой композицию, включающую сокультивируемые нейроны с тучными клетками, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1;
пятая группа представляет собой композицию, включающую сокультивируемые астроциты с тучными клетками, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1;
шестая группа представляет собой композицию, включающую сокультивируемые астроциты с тучными клетками, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1.
В качестве морфо-функциональных характеристик используют:
- клеточную гибель, которую оценивают с помощью биохимического метода с использованием реагентов МТТ или WST-1 или с помощью морфологического метода с использованием ДНК-/РНК-тропных красителей,
- секреторную активность клеток, которую оценивают с помощью флуориметрического метода, основанного на проведении реакции конденсации гистамина с ортофталевым альдегидом с образованием флюоресцирующего комплекса, с помощью фотометрического метода, основанного на проведении реакции расщепления β-гексозаминидазы специфического хромогенного субстрата - 4-нитрофенил-N-ацетил-β-D-глюкозаминида, а также с помощью иммуноферментного анализа (ELISA), чувствительного к IL-6,
- уровень свободного внутриклеточного кальция, который оценивают с помощью метода флуоресцентной микроскопии посредством высокоаффинного Ca2+ индикатора Fura-2 или Fluo-4,
- реорганизацию актинового цитоскелета посредством иммуноцитохимического окрашивания клеток с фаллоидином.
Вывод о том, что агонист ПАР1 обеспечивает комплексную защиту клеток, проявляющуюся в антивоспалительном и цитопротекторном действии, делают при выявлении секреторной активности в группе 1 на 20% и более по сравнению с группой 2; при выявлении факта реорганизации актинового цитоскелета в группе 1 по сравнению с группой 2; при повышении уровня свободного внутриклеточного кальция в группе 1 относительно группы 2; при клеточной гибели в группе 3 большей, чем в группе 4; при секреторной активности в группе 5 на 30% и более по сравнению с группой 6.
Культивирование нейронов, астроцитов и клеточной линии тучных клеток RBL-2H3, как правило, осуществляют в СО2-инкубаторе при 37°С и содержании СО2 5%. В качестве провоспалительных факторов используют липополисахарид (ЛПС), TNFα, АТФ, глутамат, гистамин, кальциевый ионофор А23187. Воздействие агонистом ПАР1 на клеточные модели осуществляют в количестве от 10 до 100 мкМ, по меньшей мере, за 15 мин до провоспалительной активации клеток. В качестве клеточных моделей воспаления in vitro используют первичную культуру гиппокампальных нейронов новорожденных крыс, включая 10 DIV культуру нейронов; первичную культуру астроцитов коры больших полушарий новорожденных крыс, включая 14 DIV культуру астроцитов; перитонеальные тучные клетки крыс и их культивируемые аналоги - клетки линии RBL-2H3 с 1 по10 пассаж.
В качестве агониста ПАР1 в одном из вариантов реализации эксперимента используют пептид АП9, который предварительно растворяют в дистиллированной воде в концентрации 20 мМ, данные аликвоты замораживают и используют в качестве стокового раствора, который вносят в культуральную среду к клеткам до конечной концентрации 10-100 мкМ за 15 минут до их активирования провоспалительными факторами.
Перед введением агониста ПАР1 в клеточную модель может быть проведена оценка функционального состояния клеток в клеточной модели, при этом в эксперименте используют клеточные модели, выживаемость клеток в которых составляет более 30-40% по сравнению с клетками моделей, которые не подвергались провоспалительной активации.
Разработанный способ позволяет на экспериментальных моделях регулировать процесс нейровоспаления с использованием ПАР1-опосредованных сигнальных каскадов в мультикомпанентной модели нейровоспаления, включающей основные клетки нейроваскулярной единицы мозга, а именно тучные клетки, нейроны и астроциты. При этом ключевым результатом является наличие анивоспалительного и нейропротекторного эффекта активации ПАР1 пептидом-агонистом в условиях провоспалительной стимуляции как изолированных клеточных культур, так и их сокультур в модели нейровоспаления in vitro.
Изобретение может найти применение при проведении исследовании механизмов нейровоспаления. Нейровоспаление, являясь неотъемлемой частью нейродегенеративного процесса, может служить универсальной мишенью для комплексной терапии целого ряда нейродегенеративных расстройств. Однако в настоящее время не вполне ясна роль разных типов клеток мозга в развитии этого сложного многофакторного процесса, что указывает на несомненную актуальность исследований механизмов нейровоспаления. Заявленный способ разработан по результатам моделирования сложного комплекса нейровоспалительного процесса, учитывающего эффекты компонентов провоспалительных воздействий и клеток-участников нейровоспаления. Для оценки ПАР1-опосредованного запуска нейропротекторного и антивоспалительного действия пептида-агониста в заявляемом изобретении использованы как тест-системы из изолированных первичных культур астроцитов коры больших полушарий и гиппокампальных нейронов новорожденных крыс, тучных клеток крыс, так и тест-системы, представляющие собой композиции сокультивирования тучных клеток с нейронами и тучных клеток с астроцитами. Данный подход позволил не только определить комплексный характер действия пептида-агониста ПАР1 на развитие нейровоспаления in vitro, но и продемонстрировал возможность использования данной модели для тестирования других препаратов нейропротекторной направленности.
Краткое описание чертежей
Изобретение поясняется иллюстративным материалом:
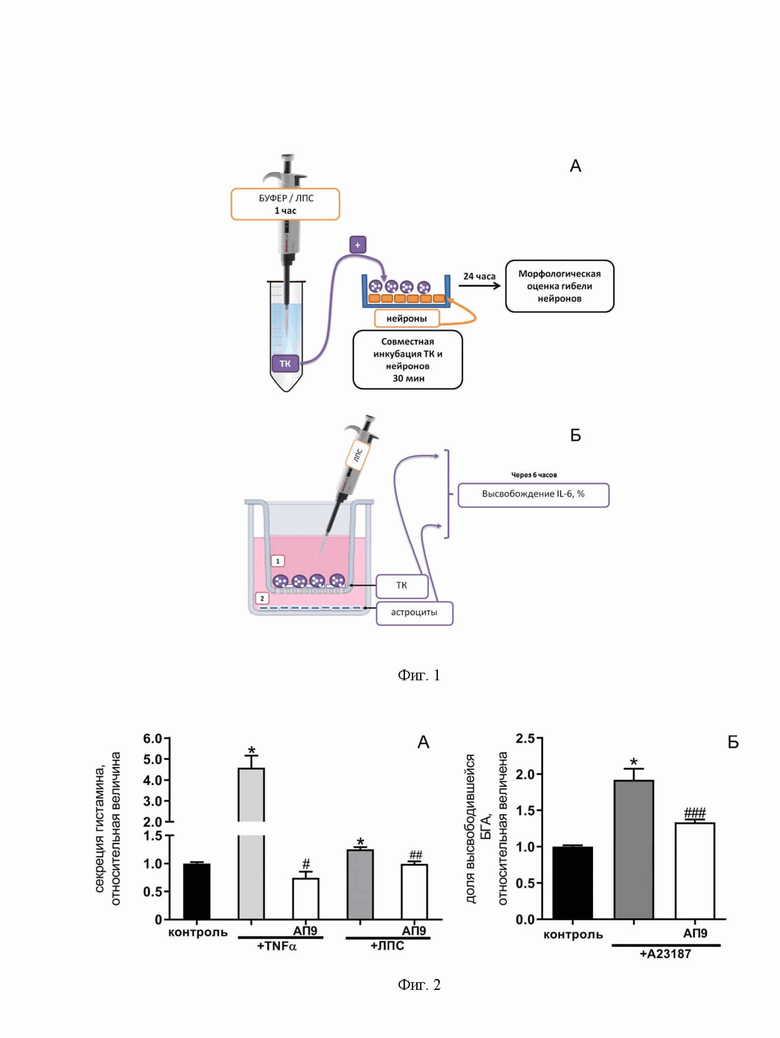
Фиг. 1. Схема моделирования нейровоспаления in vitro: А - сокультивирование тучных клеток и нейронов, Б - сокультивирование тучных клеток и астроцитов. ТК - тучные клетки;
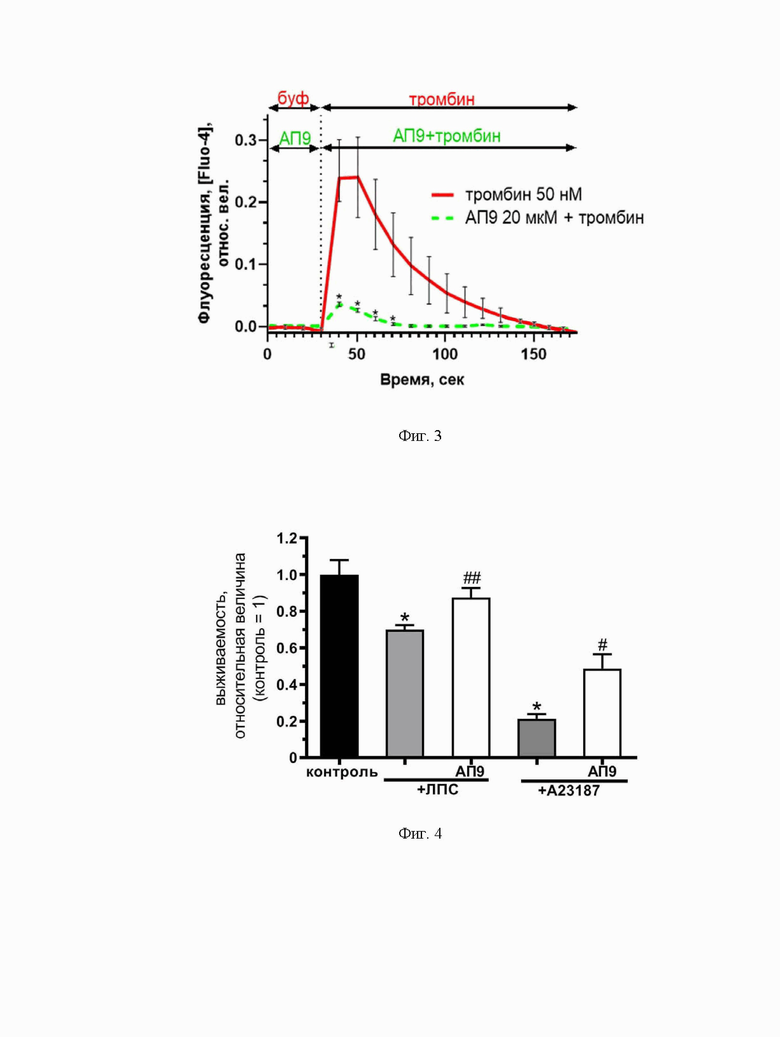
Фиг. 2. Диаграмма, демонстрирующая регуляцию пептидом-агонистом ПАР1 (АП9) (10 мкМ) секреторной активности тучных клеток, стимулированных провоспалительными агентами (TNFα (50 нг/мл), ЛПС (1 мкг/мл), А23187 (50 нМ)): А - уровень высвобождения гистамина тучными клетками, Б - уровень высвобождения β-гексозаминидазы тучными клетками. *p<0,05 по сравнению с контролем, #p<0,05 по сравнению с тучными клетками, активированными TNFα, ##p<0,1 по сравнению с тучными клетками, активированными ЛПС, ###p<0,05 по сравнению с тучными клетками, активированными А23187. Количество независимых экспериментов ≥ 3;
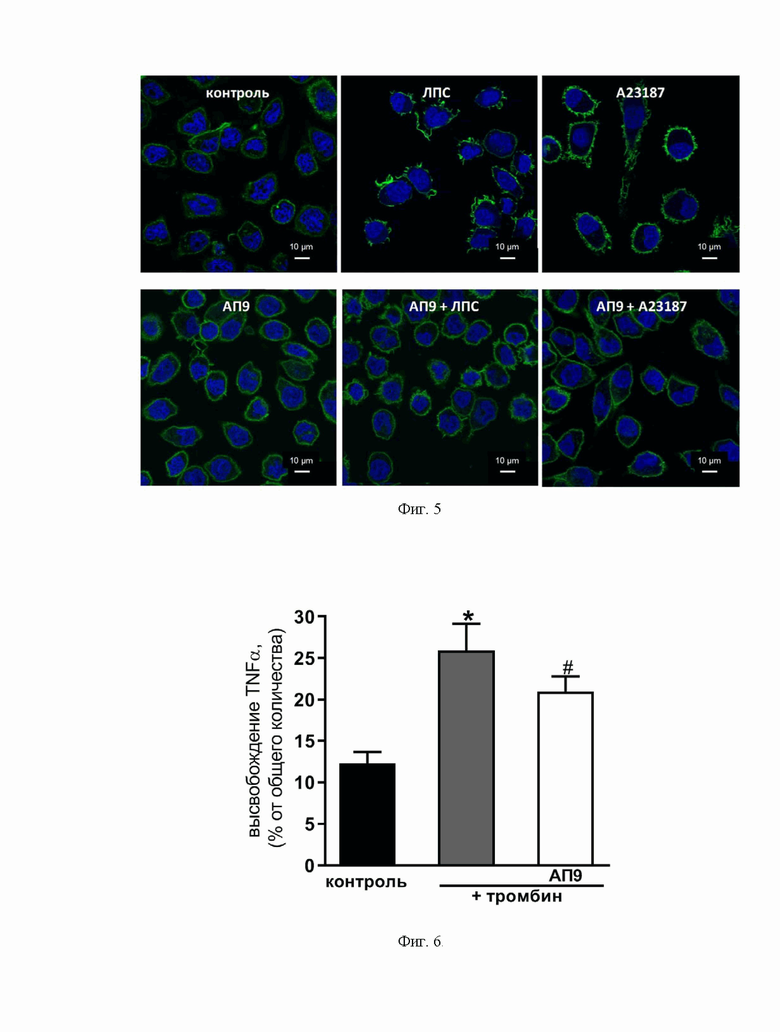
Фиг. 3. График, демонстрирующий регуляцию пептидом-агонистом ПАР1 (АП9) (20 мкМ) кальциевого ответа тучных клеток, активированных тромбином (50 нМ). *p<0,05 по сравнению с тучными клетками, активированными тромбином и не предобработанными АП9. Количество независимых экспериментов ≥ 3.
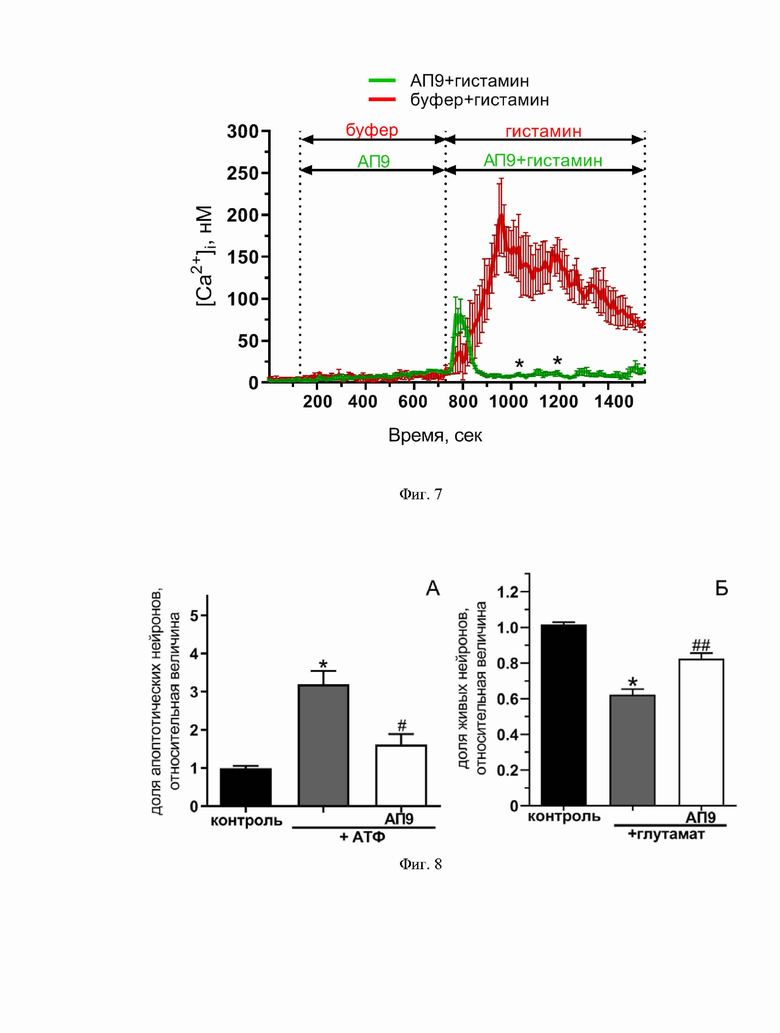
Фиг. 4. Диаграмма, демонстрирующая регуляцию пептидом-агонистом ПАР1 (АП9) (10 мкМ) уровня выживаемости тучных клеток, стимулированных провоспалительными агентами (ЛПС (1 мкг/мл), А23187 (50 нМ)). *p<0,05 по сравнению с контролем, #p<0,05 по сравнению с тучными клетками, активированными А23187, ##p<0,05 по сравнению с тучными клетками, активированными ЛПС. Количество независимых экспериментов ≥ 3.
Фиг. 5. Репрезентативные микрофотографии, демонстрирующие регуляцию пептидом-агонистом ПАР1 (АП9) (20 мкМ) реорганизации актинового цитоскелета тучных клеток, стимулированных провоспалительными агентами (ЛПС (1 мкг/мл), А23187 (50 нМ)). Зеленая флуоресценция - F-актин, синняя флуоресценция - клеточные ядра.
Фиг. 6. Диаграмма, демонстрирующая регуляцию пептидом-агонистом ПАР1 (АП9) (20 мкМ) секреторной активности астроцитов (уровень высвобождения TNFα), активированных тромбином (50 нМ). *р<0,05 по сравнению с контролем, #р<0,05 по сравнению с тучными клетками, активированными тромбином. Количество независимых экспериментов ≥ 3.
Фиг. 7. График, демонстрирующий регуляцию пептидом-агонистом ПАР1 (АП9) (100 мкМ) кальциевого ответа астроцитов, активированных гистамином (100 мкМ). *p<0,05 по сравнению с тучными клетками, активированными гистамином. Количество независимых экспериментов ≥ 3.
Фиг. 8. Диаграмма, демонстрирующая регуляцию пептидом-агонистом ПАР1 (АП9) (20 мкМ) уровня выживаемости нейронов, активированных провоспалитнельными агентами (АТФ (5 мМ), глутаматом (100 мкМ): А - доля апоптотических нейронов, Б - доля живых нейронов. *p<0,05 - по сравнению с контролем, #p<0,05 - по сравнению с нейронами, активированными АТФ, ##p<0,05 - по сравнению с нейронами, активированными глутаматом. Количество независимых экспериментов ≥ 3.
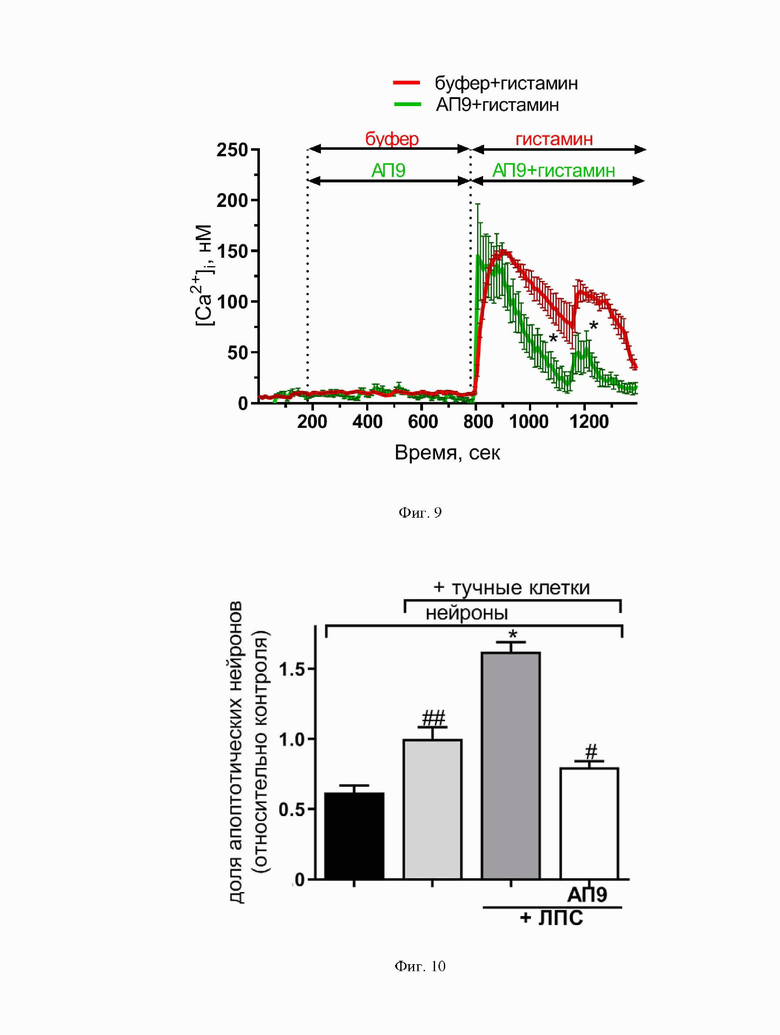
Фиг. 9. График, демонстрирующий регуляцию пептидом-агонистом ПАР1 (АП9) (100 мкМ) кальциевого ответа нейронов, активированных гистамином (100 мкМ). *p<0,05 по сравнению с нейронами, активированными гистамином и не предобработанные АП9. Количество независимых экспериментов ≥ 3.
Фиг. 10. Диаграмма, демонстрирующая регуляцию пептидом-агонистом ПАР1 (АП9) (20 мкМ) уровня выживаемости нейронов, сокультивируемых с тучными клетками, активированными ЛПС (1 мкг/мл). *p<0,05 по сравнению с контролем (нейроны сокультивировали с неактивированными тучными клетками), #p<0,05 по сравнению с нейронами, сокультивируемыми с активированными тучными клетками, ##p<0,05 по сравнению с изолированными нейронами. Количество независимых экспериментов ≥ 5.
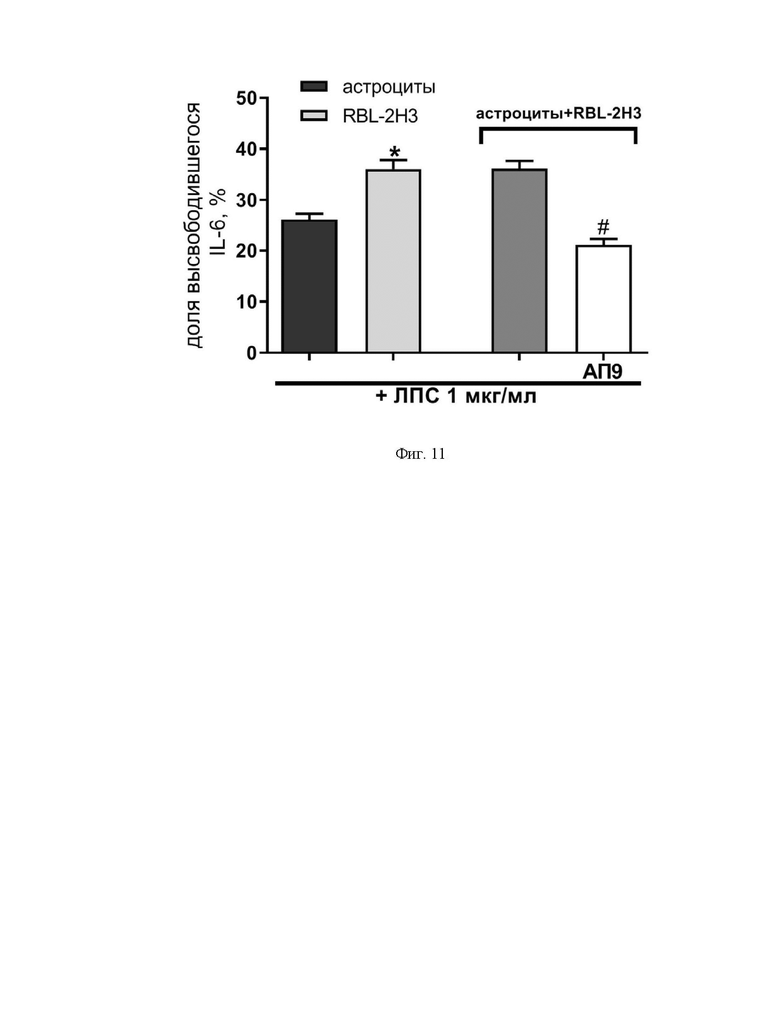
Фиг. 11. Диаграмма, демонстрирующая регуляцию пептидом-агонистом ПАР1 (АП9) (100 мкМ) секреции IL-6 астроцитами и тучными клетками при их сокультивировании в условии провоспалительной стимуляции ЛПС (1 мкг/мл). *p<0,05 по сравнению с астроцитами, #p<0,05 по сравнению с активированными ЛПС клетками. Количество независимых экспериментов ≥ 3.
Осуществление изобретения
Настоящее изобретение основано на оценке эффекта пептида-агониста ПАР1 в зависимости от типа клеток-участников нейровоспаления, провоспалительного стимулятора и характера функционального ответа клеток.
В эксперименте должно быть использовано не менее шести экспериментальных групп:
- культивируемые нейроны/астроциты/тучные клетки, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1 (группа 1);
- культивируемые нейроны/астроциты/тучные клетки, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1 (группа 2);
- сокультивирование нейронов с тучными клетками, подвергнутыми провоспалительной активации, но не предобработанных пептидом-агонистом ПАР1 (группа 3);
- сокультивирование нейронов с тучными клетками, подвергнутыми провоспалительной активации и предобработанных пептидом-агонистом ПАР1 (группа 4);
- сокультивирование астроцитов с тучными клетками, подвергнутыми провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1 (группа 5);
- сокультивирование астроцитов с тучными клетками, подвергнутыми провоспалительной активации и предобработанными пептидом-агонистом ПАР1 (группа 6).
Получение первичных культур клеток производят по стандартным протоколам [Ivanova A.E., Gorbacheva L.R., Strukova S.M.,Pinelis V.G., Reiser G. 2014. Activated protein C and thrombin participate in the regulation of astrocyte functions // Biochem. - V. 8. - P. 50-59., Gorbacheva L.R., Storozhevykh T.P., Pinelis V.G., Ishiwata S., Strukova S.M. 2006. Modulation of hippocampal neuron survival by thrombin and factor Xa // Biochemistry (Mosc.). - V. 71. - P. 1082-1089.]. Дальнейшее культивирование осуществляют в инкубаторе при 370С, 5% СО2. Экспериментальные воздействия производят на 10-14-дневных культурах. Далее, используя широкий спектр провоспалительных факторов, клетки подвергают условиям, имитирующим провоспалительную активацию в модели нейровоспаления in vitro. В качестве провоспалительной активации используют аппликацию клеток липополисахаридом (ЛПС) (1мкг/мл, 90 мин), TNFα (50 нг/мл, 60 мин), АТФ (5 мМ, 15 мин), глутаматом (100 мкМ, 30 мин), гистамином (100 мкМ, 10-15 мин). В качестве неспецифического активатора клеток выступает кальциевый ионофор А23187 (50 нМ, 24 часа). В качестве активатора ПАР1-опосредованного внутриклеточного сигналинга используют пептид АП9 в концентрации 10-100 мкМ, аппликацию клеток которым осуществляют, по меньшей мере, за 15 мин до провоспалительной стимуляции. Далее проводят оценку морфо-функционального состояния клеточных культур, а именно: клеточную гибель, пролиферацию, состояние актинового цитоскелета и уровень секреторной активности через 24-48 ч после воздействия провоспалительными факторами на фоне действия пептида в опытных группах и без предварительной обработки пептидом, и на фоне активаторов в контрольных группах. Кальциевый ответ клеток в условиях провоспалительной стимуляции оценивают в режиме реального времени.
Клеточная гибель может быть оценена с помощью реагента МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид) с использованием спектрофотометра по стандартному протоколу [Gorbacheva L.R., Storozhevykh T.P., Pinelis V. G., Davydova O.N., Ishiwata S., Strukova S.M., 2008. Activated protein C via PAR1 receptor regulates survival of neurons under conditions of glutamate excitotoxicity // Biochem. V. 73. P. 717-724.) или WST-1 (Galkov M.D., Ivanova A.E., Gulyaev M.V., Kiseleva E.V., Savinkova I.G., Gorbacheva L.R., 2020. The influence of β-arrestin-2 gene knockout in mice on survival of cultured astrocytes exposed to thrombin and on the cerebral thrombosis aftereffects in vivo // Biochem. V. 14. P. 17-23]. Данными методами оценивается оптическая плотность проб, интенсивность окраски которых прямопропорционально зависит от количества живых клеток. Полученное значение оптической плотности нормируют к таковому, измеренному в контрольной группе (принимается за 1), тем самым рассчитывая относительный уровень выживаемости клеток. Секреторная активность может быть оценена по уровню высвобождения провоспалительных факторов - гистамина, β-гексозаминидазы и IL-6 [Shore P.A., Burkhalter A., Cohn V.H. 1959. A method for the fluorometric assay of histamine in tissues // J. Pharmacol. Exp. Ther. - V. 127. - № 3. - P. 182-86.;Schwartz L.B., Austen K.F., Wasserman S.I. 1979. Immunologic release of beta hexosaminidase and beta-glucuronidase from purified rat serosal mast cells. // J. Immunol. - V. 123. - № 4. - P. 1445-50.]. Метод определения гистамина основан на реакции конденсации гистамина с ортофталевым альдегидом, в результате которой образуется флуоресцирующий комплекс. Флуоресценцию измеряют на планшетном спектрофлуориметре. Высвобождение гистамина оценивают как долю выводящегося гистамина к общему содержанию гистамина в клетках. Степень секреции β-гексозаминидазы может быть определена по расщеплению специфического хромогенного субстрата - 4-нитрофенил-N-ацетил-β-D-глюкозаминида. Оптическую плотность образцов измеряют на анализаторе иммуноферментных реакций «Униплан» АИФР-01. Высвобождение β-гексозаминидазы оценивают как долю выводящейся β-гексозаминидазы к общему содержанию β-гексозаминидазы в клетках. Анализ секреции IL-6 может быть произведен с помощью ELISA в соответствии с инструкциями производителя. Кальциевый ответ клеток на провоспалительную стимуляцию может быть оценен методом флуоресцентной микроскопии с помощью высокоаффинного Ca2+ индикатора Fura-2 или Fluo-4 [Grynkiewicz G., Poenie M., Tsien R.Y. 1985. A new generation of Ca2+ indicators with greatly improved fluorescence properties // J. Biol. Chem. - V. 260. - № 6. - P. 3440-50.]. Для оценки реорганизации актинового цитоскелета клетки инкубируют с фаллоидином (1:40), конъюгированным с Alexa 488. Далее производят съемку с помощью конфокального микроскопа LSM 700.
Для интерпретации данных сравнивают клеточные ответы в группах 1 относительно группы 2; 3 относительно группы 4; 5 относительно группы 6.
В случае, если пептид-агонист ПАР1, действительно, обладает способностью регулировать воспаление в модели in vitro и оказывает антивоспалительное и цитопротекторное действие, такие показатели провоспалительной активации клеток как секреторная активность, выживаемость, кальциевый ответ и т.д. будут менее выражены, чем в группах, лишенных предварительной аппликации пептида-агониста ПАР1 (АП9). Т.е. уровень высвобождения провоспалительных медиаторов клетками будет выше на 20% и более (ориентировочно на 20-30%) в группах 1 и 5 по сравнению с группами 2 и 6, соответственно. Выживаемость клеток в группах 2 и 4 будет выше на 20% и более по сравнению с группами 1 и 3, соответственно. А кальциевый ответ менее выражен в группе 2 по сравнению с 1 группой.
Полученный эффект связан с тем, что пептид АП9 запускает ПАР1-опосредованный сигналинг, проявляющийся в виде антивоспалительных и цитопротекторных эффектов. Согласно литературным данным, запуск цитопротекторного и антивоспалительного каскада через ПАР1 сопряжен с привлечением β-аррестина 2. Одним из дальнейших развивающихся путей может быть подавление экспрессии генов, индуцируемых NF-κB, и снижение клеточной гибели. Также показана ПАР1-зависимая возможность повышения стабильности межклеточных контактов, стабилизация клеточной мембраны и др.
Таким образом, предлагаемое изобретение позволяет выявлять наличие регулирования процесса нейровоспаления in vitro на основе ПАР1-опосредованного антивоспалительно и цитопротекторного действия пептида АП9. Если при оценке ключевого комплекса морфо-функциональных характеристик клеток-участников воспаления в условиях их провоспалительной стимуляции на фоне предварительной аппликации пептидом-агонистом ПАР1 (АП9) наблюдается тенденция к снижению выраженности их провоспалительного ответа, это свидетельствует о наличии антивоспалительного и цитопротекторного эффекта АП9 в модели воспаления in vitro.
Разработанный способ может быть использован в качестве эффективной и легко воспроизводимой тест-системы для оценки антивоспалительного и цитопротекторного потенциала пептидов-агонистов ПАР1 при комплексной регуляции нейровоспаления in vitro.
В настоящем изобретении в качестве частного варианта его реализации показана эффективность разработанного способа на основе выявления ПАР1-опосредованного антивоспалительного и цитопротекторного эффекта синтетического пептида-агониста ПАР1 - АП9, состоящего из девяти аминокислот. Ранее была установлена структура АП9 (NPNDKYEPF-NH2), которая совпадает со структурой N-конца ПАР1, расщепляемого АПС. Ранее было показано, что АП9 способен снижать гибель нейронов в условиях глутаматной эксайтотоксичности (Savinkova I.G., Gorbacheva L.R., Bespalova Z.D., Pinelis V.G., Strukova S.M., 2014. Peptides analogous to tethered ligands liberated by activated protein C exert neuroprotective effects in glutamate induced excitotoxicity // Biochem. V. 8. P. 116-120) или при действии на них активированных тучных клеток (Babkina I.I., Strukova S.M., Pinelis V.G., Reiser G., Gorbacheva L.R., 2016. New synthetic peptide protects neurons from death induced by toxic influence of activated mast cells via protease-activated receptor // Biochem. V. 10. P. 126-134.) in vitro.
Процессы, развивающиеся при повреждениях мозга и сопровождающиеся воспалительными реакциями, характеризуются вовлечением разных типов клеток, их взаимным влиянием друг на друга, что может играть важную роль в модулировании исхода повреждения. Особенно стоит отметить важность модуляции активности тучных клеток, астроцитов и нейронов в ЦНС при терапии нейровоспаления и нейродегенеративных заболеваний.
Примеры реализации изобретения.
Этап 1. Получение и ведение клеточных культур
Получение первичной культуры гиппокампальных нейронов
Весь процесс выделения клеток проводили на льду, центрифугу предварительно охлаждали до 4°С. Новорожденных крыс линии Wistar декапитировали, извлекали гиппокампы из мозга, помещали в раствор Хенкса HBSS («Gibco», США) без Ca2+ и Mg2+, содержащий 1 мМ пируват натрия, 10 мМ HEPES (рН 7.2) и измельчали. Далее клетки переносили в фосфатный буфер (PBS), содержащий DL-цистеин-HCl (0,2 мг/мл), BSA (0,2 мг/мл), глюкозу (5 мг/мл), папаин (0,5 мг/мл, «Sigma»), DNAasa (0,01 мг/мл) и инкубировали при 37°С 5 - 10 мин. Затем клетки перемещали и диспергировали в растворе Хенкса HBSS («Gibco», США) без Ca2+ и Mg2+, содержащем DNAasa (0,01 мг/мл) и центрифугировали при 200 g 4 минуты. Супернатант сливали, а к осажденным клеткам добавляли раствор Хенкса HBSS («Gibco», США) с Ca2+ и Mg2+, содержащий 1 мМ C3H3NaO3, 10 мМ HEPES (рН 7.2), диспергировали и центрифугировали при 200 g 4 минуты. Полученный осадок ресуспензировали в культуральной среде для нейронов (NBM, «Gibco», США), содержащей 0,5 мM L-glutamine, 2% Supplement B-27 и 100 Ед/мл пенициллина/стрептомицина («Gibco», США). Полученную суспензию клеток (1х106 клеток/мл) (100 мкл на 1 стекло) помещали на чашки Петри Glass Bottom, покрытые PEI (Sigma, USA). Через 1 ч (37°С, 5% СО2) смывали неприкрепившиеся клетки, добавляя 1.5 мл культуральной среды. Через 24 часа вносили в среду арабинозид (ARAC, 10-5 М) для подавления роста глиальных клеток. Далее осуществляли смену 1/3 среды в клетках каждые 3 дня. Культивирование клеток осуществляли в течение 10 дней.
Получение первичной культуры астроцитов
Весь процесс выделения клеток производили на льду, центрифугу предварительно охлаждали до 4°С. Новорожденных крыс линии Wistar декапитировали, извлекали головной мозг, помещали его в раствор Хенкса HBSS («Gibco», США) без Ca2+ и Mg2+, содержащий DNAasa (0,01 мг/мл). Далее полушария отделяли от ствола мозга, изымали гиппокамп и обонятельные луковицы, полушария очищали от пленок и сосудов и тщательно измельчали в камере Максимова. Измельченные полушария мозга переносили в раствор папаина 5 Ед./мл (Sigma, США) и инкубировали при 37°С в течение 7 - 8 минут. По истечении времени клетки отмывали от папаина раствором Хенкса HBSS без Ca2+ и Mg2+ с добавлением DNAasa (0,01 мг/мл), проводили тщательное ресуспендирование и пропускали через нейлоновое сито. Суспезию клеток центрифугировали (1800 rpm, 8 мин, 4°C), осадок ресуспендировали в среде DMEM, с добавлением 100 Ед/мл пенициллина/стрептомицина и HI FBS 10% (Invitrogen, США). Суспензию с клетками переносили на культуральные флаконы площадью 75 см2 и культивировали в течение 10 дней при 37°С, 5% CO2. При каждой смене культуральной среды флаконы помещали на шейкер на 1-2 часа с целью удаления микроглии и олигодендроцитов. На 10 день выращивания культуры астроциты снимали с флаконов раствором 0,05% трипсина-ЭДТА (Invitrogen, США) и рассеивали на чашки Петри Glass Bottom (MatTek, США) или культуральные планшеты и выращивали при 37°С в 5% CO2 инкубаторе. На 14 день культивации астроцитов, среда замещалась на бессывороточную на ночь, для подготовки клеток к экспериментальным воздействиям.
Получение перитонеальных тучных клеток
[Uvnäs B., Thon I.L. 1959. Isolation of "biologically intact" mast cells // Exp. Cell Res. - V. 18. - № 3. - P. 512-20, в модификации]
Крыс линии Wistar наркотизировали эфиром, декапитировали и обескровливали. В брюшную полость вводили 10 мл 145 мМ раствора NaCl, забуференного 10 мМ HEPES (pH 7.4), брюхо мягко массировали в течение 1 - 2 мин. Перитонеальную жидкость собирали, пробирку с клетками помещали на лед во время проведения работы, а затем центрифугировали в течение 10 мин при 800 об/мин. Супернатант сливали, осадок ресуспендировали в 2 мл буфера. Тучные клетки очищали на двухступенчатом градиенте фиколла (35% и 25% плотности) центрифугированием при 4°С и 1200 об/мин. Двухступенчатый градиент фиколла готовили следующим образом: на слой 35% фиколла (2 мл) наносили 3 мл 25% фиколла, растворенного в Na-HEPES-буфере (рН 7.4), содержащем 145 мМ NaCl, BSA (1 мг/мл) и глюкозу (2мг/мл). Пул тучных клеток при центрифугировании концентрируется на границе раздела растворов фиколла. Клетки осторожно собирали пипеткой из 25% фиколла, перемещали в пробирку со сбалансированным раствором (3 мл) следующего состава (в мМ): NaCl 145, HEPES 10, KCl 5, CaCl2 1, MgCl2 1, глюкоза 5, 0.1% BSA; рН 7.4 и промывали. После каждого промывания клетки центрифугировали в течение 10 мин при 1000 и 800 об/мин, соответственно. Осадок клеток после крайнего промывания ресуспендировали в малом объеме сбалансированного раствора (2 мл). Количество клеток, предварительно окрашенных толуидиновым синим, подсчитывали в камере Горяева по формуле: N = а × 2.5 × с × 105, где N - общее количество клеток в 1 мл, а - среднее количество клеток в большом квадрате, с - разведение.
Ведение клеточной линии RBL-2H3
В работе были использованы культивируемые аналоги тучных клеток - клетки линии RBL-2H3 [Eccleston E., Leonard B.J., Lowe J.S., Welford H.J. 1973. Basophilic leukaemia in the albino rat and a demonstration of the basopoietin // Nat. New Biol. - V. 244. - № 133. - P. 73-76.]. Эта линия клеток была получена из крыс линии Wistar с химически индуцированной базофильной лейкемией. Клетки обладают способностью к дегрануляции, в частности, гистамина. Клетки линии RBL-2H3 были взяты из ККК УНУ ИБР РАН.
Клетки выращивали на культуральных флаконах 25 см2 в среде α-МЕМ, содержащей 0,5 мМ L-glutamine, 10% HI FBS и 100 Ед/мл пенициллина/стрептомицина. Пассирование клеток осуществляли посредством промывания культурального флакона раствором Версена и 0.05% трипсина-ЭДТА один раз в три дня. Для экспериментов клетки культивировали на 96- и 48-луночных культуральных планшетах (по 5х104 и 8х104 клеток/лунку, соответственно) или на чашках Петри Glass Bottom (MatTek, США) (по 8х104 клеток/стекло) при 37°С и 5% СО2. Воздействия исследуемыми веществами осуществляли через 24 часа после нанесения клеточной суспензии на культуральные планшеты или чашки Петри.
Этап 2. Моделирование нейровоспаления in vitro.
Сокультивирование тучных клеток-нейронов и тучных клеток-астроцитов
а) тучные клетки активировали, инкубируя их в течение 1 часа в присутствии ЛПС (1 мкг/мл, Sigma, L3024). Далее суспензию тучных клеток (15-20 тыс. клеток) добавляли к культуре гиппокампальных нейронов, инкубировали в течение 30 минут, затем нейроны помещали в исходную культуральную среду. Выживаемость нейронов оценивали через 24 часа. Предобработку тучных клеток пептидом-агонистом ПАР1 (АП9) (10 мкМ) проводили за 15 мин до активации (Фиг. 1А).
б) Сокультивирование первичной культуры астроцитов и клеток линии RBL-2H3 осуществляли c использованием Transwell co-culture system. Через 6 часов после провоспалительного воздействия ЛПС на фоне/и без предварительной аппликации пептидом АП9 производили отбор культуральной среды из лунок (экстраклеточный для астроцитов) и из трансвеллов (экстраклеточный для RBL-2H3). Далее лизировали клетки согласно протоколу, описанному выше (лизат астроцитов (внутриклеточный для астроцитов) и RBL-2H3 (внутриклеточный для RBL-2H3)) (Фиг. 1Б). Пробы анализировали на IL-6 с помощью ELISA в соответствии с инструкциями производителя (Abcam, Великобритания). Предел чувствительности IL-6 составляет 30 пг/мл. Формула для расчета уровня секреции ИЛ 6, %: экстра / (экстра + внутри) * 100
Этап 3. Осуществление провоспалительного воздействия на изолированные клеточные культуры и их сокультуры с целью выявления основных критериев провоспалительного ответа специфических клеток-участников нейровоспаления
В результате исследования были выявлены основные критерии провоспалительного ответа специфических участников воспаления - тучных клеток (повышение секреции, снижение выживаемости, перестройка актинового цитоскелета); астроцитов (снижение выживаемости, изменение пролиферации, рост внутриклеточного кальция); а также нейронов (снижение выживаемости, рост внутриклеточного кальция). Для клеточных культур были выбраны провоспалительные факторы, способствующие развитию выраженных провоспалительных ответов клеток, связанных с их ключевым функционалом во время развития воспалительных реакций.
В ходе предварительных экспериментов на разных типах клеток были исследованы дозы и временные характеристики действия широкого спектра провоспалительных агентов. Наиболее выраженное действие на активацию клеток оказали следующие специфические факторы: ЛПС (Sigma, США) (1 мкг/мл, 90 мин), TNFα (Sigma, США) (50 нг/мл, 60 мин), АТФ (Sigma, США) (5 мМ, 15 мин), глутамат (Sigma, США) (100 мкМ, 30 мин) и гистамин (Sigma, США) (100 мкМ, 10-15 мин). Среди неспецифических активаторов клеток наиболее выраженным эффектом обладал кальциевый ионофор А23187 (Sigma, США) (50 нМ).
Перечисленные выше параметры были исследованы с использованием следующих протоколов:
В качестве критерия активации тучных клеток использовался уровень секреции гистамина и β-гексозаминидазы (БГА).
Измерение секреции β-гексозаминидазы (БГА) тучными клетками.
Степень секреции перитонеальных тучных клеток и клеток линии RBL-2H3 определялась по расщеплению специфического хромогенного субстрата - 4-нитрофенил-N-ацетил-β-D-глюкозаминида. Субстрат в концентрации 4 мМ, растворенный в 0,04 М цитратном буфере (рН 4.5), содержащем 0.9 % NaCl, добавлялся в соотношении 1 : 1 к полученным образцам. Инкубация с субстратом проводилась в 96 луночном планшете в течение 2 часов при температуре 40°С. Реакция останавливалась добавлением равного объема 0.2 М Глицин-NaOH (pH 10.7) буфера. После добавления стоп-реагента раствор приобретал ярко-желтую окраску, интенсивность которой была пропорциональна содержащемуся в нем количеству β-гексозаминидазы. Оптическую плотность образцов измерялась на анализаторе иммуноферментных реакций «Униплан» АИФР-01 (ЗАО «Пикон», Россия) при λ = 405 нм. Количество секретированной β-гексозаминидазы вычислялось по формуле: секреция = Х/((Х + Y)), где Х - оптическая плотность образца, содержащего фермент, выделившегося во время инкубации клеток с агонистами, Y - оптическая плотность образца, содержащего фермент, выделившегося после разрушения клеток.
Влияние тестируемых веществ на уровень секреции БГА представлено в относительных величинах, где доля высвобождаемой БГА клетками контрольной группы (спонтанная секреция) принята за 1.
Измерение секреции гистамина клетками линии RBL-2H3.
Для индукции секреции гистамина клетки линии RBL-2H3 инкубировались с исследуемыми веществами при 37°С, 5% СО2. Реакция останавливалась помещением планшета на лед. Анализ экстраклеточного гистамина проводился в клеточном супернатанте. Для определения внутриклеточного гистамина клетки разрушались 15 минутной инкубацией с 0.1% раствором детергента Тритона-Х100. Метод определения гистамина основан на реакции конденсации гистамина с ортофталевым альдегидом, в результате которой образуется флуоресцирующий комплекс. Для определения содержания гистамина к пробам добавлялся 1N NaОН и 0,1% раствор ортофталевого альдегида в 96% этаноле. Образовавшийся флуорофор стабилизировался подкислением раствора 3N НCl. Флуоресценция измерялась на плашечном спектрофлуориметре Multilabel counter 1420, VICTOR2 PerkinElmer при 460 нм, возбуждали при 355 нм.
Для каждой отдельной пробы рассчитывалась доля высвободившегося гистамина в процентах. Высвобождение гистамина = (концентрация гистамина в супернатанте)/(концентрация гистамина в супернатанте + концентрация внутриклеточного гистамина). Влияние тестируемых веществ на уровень секреции гистамина представлено в относительных величинах, где доля высвобождаемого гистамина клетками контрольной группы (спонтанная секреция) принята за 1.
Биохимический метод оценки гибели клеток (МТТ-тест) и реагент WST-1.
Основа МТТ метода при оценке содержания живых клеток в культуре - восстановление клетками солей тетразолия до сильно поглощающих в видимой области спектра формазанов. MTT (3 (4,5 диметил 2 тиазолил) 2,5-дифенил-2Н-тетразолийбромид) восстанавливается до формазана митохондриями только живых клеток. Водный раствор МТТ (Molecular Probes, США) добавлялся в культуральную среду до конечной концентрации 0.5 мг/мл, клетки инкубировались 2 часа при 37°С, 5% СО2. Растворение формазанов осуществлялось с помощью DMSO (Sigma, США). Оптическая плотность измерялась на фотометре iMark (Bio-Rad, США) при 530 нм. Оценивали результаты в относительных единицах по отношению к контролю равному 1.
Также для оценки содержания живых клеток использовался реактив WST-1, который также восстанавливается под действием дегидрогеназ живых клеток в формазан, но, в отличие от MTT-теста, не требует дальнейшего растворения кристаллов в DMSO. Это позволяет производить оценку, не нарушая структуры клеток. Реактив WST-1 (Promega, США) добавлялся в соотношении 1:10 к культуральной среде, в которой находились клетки. Далее клетки инкубировались 2 часа при 37°С, 5% СО2. Оптическая плотность измерялась при 450 нм. При обработке данных оптическую плотность контрольной принимали за 1.
Для морфологической оценки гибели нейронов и клеток линии RBL-2H3 использовались флуоресцентные красители: Hoechst 33342 (апоптоз), SYTO-13 (живые клетки). При апоптозе происходит фрагментация и конденсация хроматина, что обеспечивает более интенсивную флуоресценцию Hoechst 33342. В живых клетках хроматин распределен более равномерно по всему объему ядра, а интенсивность флуоресценции Hoechst 33342 ниже. Клетки с конденсированными и фрагментированными ядрами (т.е. с интенсивной флуоресценцией Hoechst 33342) относились к апоптотическим, их количество выражалось в относительных единицах, как доля от общего числа клеток. Окрашенные клетки визуально исследовались под флуоресцентным микроскопом (Axiovert 200 Zeiss, Германия).
Иммуноцитохимическое окрашивание
Для оценки реорганзации F-актина клетки инкубировали с фаллоидином (1:40), конъюгированным с Alexa 488. Далее клетки промывались (1x10 мин высокосолевым буфером (0,5 М NaCl, 20 мМ Na2HPO4); 1x10 мин 120 мМ Na-фосфатом; 1x10 мин 5 мМ Na-фосфатом). Для визуализации ядер к клеткам добавлялся ДНК-тропный краситель DAPI (1:500), разведенный в 5 мМ Na2HPO4. Далее клетки анализировались с помощью конфокального микроскопа LSM 700 (ZIESS, Germany).
Измерение внутриклеточной концентрации свободного Ca2+ ([Ca2+]i)
[Ca2+]i измерялся методом флуоресцентной микроскопии с помощью высокоаффинного Ca2+ индикатора Fura-2 или Fluo-4 (Molecular Probes, США).
Перед экспериментом клетки нагружались ацетоксиметильным (АМ) эфиром индикатора Fura-2 или Fluo-4 в культурной среде в течение 40 минут при 37°С в СО2-инкубаторе, добавляя индикаторы в концентрациях 1 - 2 мкМ. Для облегчения проникновения индикаторов сквозь клеточную мембрану загрузка осуществлялась в присутствии «мягкого» неионного детергента Pluronic F-127 (0,02%) (Molecular Probes, США), затем культура отмывалась HEPES-солевым буфером и выдерживалась в нем 10 - 15 минут для полной этерификации молекул индикатора.
Стекло с клетками помещалось на столик микроскопа ZEISS (РНИМУ имени Н.И. Пирогова). Флуоресценция Fura-2 возбуждалась облучением клеток поочередно светом с динами волн 340 и 380 нм в течение 100 - 200 мс, с интервалом 5 - 10 с; эмиссия регистрировалась в диапазоне 505-535 нм. Изменения [Ca2+]i оценивались, как отношение интенсивности флуоресценции Fura-2 при возбуждении на 340 и 380 нм с учетом фонового излучения. Расчет внутриклеточной концентрации свободного Ca2+ проводили, как описано в работе Grynkiewicz et al., 1985. Флуоресценция Fluo-4 возбуждалась облучением клеток светом с длиной волны 488 нм в течение 100-200 мс, с интервалом 10-13 с; эмиссия регистрировалась в диапазоне 505-535 нм. Данные Ca2+-зависимой флуоресценции Fluo-4 представлены в виде относительных значений, полученных в результате нормирования флуоресцентного сигнала в каждой клетке на эффект иономицина, принятый за единицу.
Этап 4. Установление наличие ПАР1-опосредованных антивоспалительных и цитопротекторных эффектов синтетического пептида в модели нейровоспаления in vitro.
Для разработки способа регуляции воспаления в модели нейровоспаления in vitro был использован синтетический пептид-агонист ПАР1 - АП9 в концентрации (10 - 100 мкМ). В экспериментальных группах инкубацию с АП9 проводили в течение 10-15 мин до провоспалительной стимуляции клеток. Далее производили оценку ключевых морфо-функциональных характеристик клеток согласно протоколам, описанным в предыдущем пункте.
Статистическая обработка данных
Статистический анализ данных проводился в программе GraphPad Prism 8 (GraphPad Software Inc., США) с помощью One-way ANOVA (с последующим применением теста Сидака для множественных сравнений) или Краскела-Уоллиса (с последующим применением теста Данна для множественных сравнений). Сравнение уровня цитозольного кальция проводили с помощью Two-way ANOVA (тест Даннета). Различия считали достоверными при р<0,05. Данные представлены в виде среднее ± стандартная ошибка среднего.
В качестве примера реализации данного изобретения были исследованы основные морфо-функциональные изменения клеток-участников нейровоспаления в условиях провоспалительной активации, а также выявлено влияние ПАР1-опосредованной регуляции воспалительного процесса in vitro.
Влияние пептида-агониста ПАР1 на тучные клетки в условиях их провоспалительной активации in vitro
В ходе реализации изобретения была продемонстрирована ПАР1-опосредованная возможность регуляции воспалительного ответа тучных клеток in vitro. Ключевыми формами провоспалительного ответа тучных клеток является повышение секреторной активности, что сопряжено с изменениями актинового цитоскелета, характерными для экзоцитоза, а также с их дальнейшей гибелью.
В результате проведенных экспериментов показано, что 15-ти минутная предобработка клеток пептидом-агонистом ПАР1 - АП9 (10 мкМ) - способствует снижению высвобождения основного провоспалительного фактора тучных клеток (гистамина) до контрольных значений (Фиг. 2А.). В качестве контрольной группы выступали интактные клетки, не подвергшиеся активации провоспалительными факторами TNFα (50 нг/мл) или ЛПС (1 мкг/мл). Кроме того, на фоне действия пептида наблюдалось также снижение в 1,4 раза секреции β-гексозаминидазы по сравнению с группой, активированной неспецифическим активатором - кальциевым ионофором А23187 (50 нМ) и не предобработанной пептидом. (Фиг. 2Б.).
Экзоцитоз медиаторов обычно сопряжен с повышением внутриклеточной концентрации кальция. В рамках разработанного способа было оценено влияние АП9 на [Ca2+]i в RBL-2H3. Нами показано, что 10-минутная предобработка клеток линии RBL-2H3 с АП9 приводила к существенному уменьшению амплитуды Са2+-ответа, вызванного обработкой клеток провоспалительной концентрацией тромбина (50 нМ). (Фиг. 3.)
В ходе реализации данного изобретения продемонстрировано цитопротекторное действие пептида-агониста ПАР1 в условии воспаления in vitro, что выражалось в повышении числа живых клеток в 1,3 и 2,3 раза по сравнению с активированными ЛПС и А23187 клетками, соответственно, не предобработанными пептидом АП9 (Фиг. 4.)
Установлено, что предобработка клеток пептидом перед провоспалительной активацией (ЛПС и А23187) способствовала стабилизации цитоскелета клеток до уровня контрольной группы (Фиг. 5.)
Влияние пептида-агониста ПАР1 на астроциты в условиях их провоспалительной активации in vitro
В ходе осуществления изобретения на первичной культуре астроцитов крыс было продемонстрировано подавление активации клеток, выраженное в снижение уровня секреции в 1,25 раза провоспалительного цитокина TNFα, спровоцированной высокой концентрацией тромбина 50 нМ, по сравнению с активированными клетками без предварительной обработки пептидом. (Фиг. 6.)
Также в рамках реализации изобретения установлено, что в условиях активации клеток провоспалительным медиатором - гистамином на фоне действия пептида наблюдается уменьшение амплитуды Са2+ ответа астроцитов на гистамин и смена двухфазного профиля ответа на однофазный (Фиг. 7.)
Влияние пептида-агониста ПАР1 на нейроны в условиях их провоспалительной активации in vitro
В результате осуществления изобретения на культуре гиппокампальных нейронов крыс обнаружено выраженное токсическое действие АТФ, характеризующееся ростом числа апоптотичеких клеток. Установлено, что АП9-опосредованная активация ПАР1 запускает цитопротекторные каскады, приводящие к снижению данного показателя в 2 раза (Фиг. 8А.). Из литературных данных известно, что избыточная активация нейронов может сопровождаться ростом внутриклеточной концентрации кальция и способствовать развитию глутаматной токсичности. Обнаружено, что в модели воспалительной активации клеток глутаматом in vitro предварительная аппликация пептида-агониста ПАР1 способствовала регуляции активации нейронов, повышая числа живых клеток. (Фиг. 8Б.)
В ходе реализации изобретения обнаружено, что предварительная инкубация нейронов, с последующей их активацией провоспалительным фактором - гистамином, способствовала изменению клеточного кальциевого ответа и уменьшению его выраженности, что проявлялось в сужении профиля Са2+-ответа, и уменьшению амплитуды второго пика (Фиг. 9.), по сравнению с контрольной группой, необработанных пептидом клеток.
Взаимодействие основных клеток-участников воспаления в условиях их провоспалительной активации на фоне действия пептида-агониста ПАР1.
В ходе реализации изобретения в модели нейровоспаления in vitro на сокультуре тучных клеток и нейронов установлено, что 30-минутная инкубация нейронов с суспензией тучных клеток, активированных ЛПС (1 мкг/мл, 60 мин), через 24 часа способствовала росту клеточной гибели в 2,6 раза, соответственно, по сравнению с контрольной группой, где инкубацию нейронов осуществляли с неактивированными тучными клетками. Показано, что предварительная аппликация АП9 тучных клеток оказывает антивоспалительное и цитопротнекторное действия, снижая уровень клеточной гибели нейронов в 1,8 раз, по сравнению с группой активированных тучных клеток без предварительной предобработки пептидом-агонистом ПАР1 (Фиг. 10.)
На следующем этапе осуществления изобретения показано, что 6-часовая аппликация ЛПС (1 мкг/мл) сокультуры тучных клеток и астроцитов способствует повышению уровня секреции провоспалительного цитокина IL-6. Реализация антивоспалительных свойств ПАР1-опосредованного сигналинга, запускаемого пептидом АП9, проявляется в существенном снижении уровня высвобождения IL-6 клетками при сокультивировании астроцитов и тучных клеток в условиях модели нейровоспаления in vitro (Фиг. 11.)
Результаты проведенных экспериментов подтвердили, что описанный в данном изобретении подход для комплексной регуляции воспаления при моделировании нейровоспаления in vitro характеризуется эффективностью, высокой воспроизводимостью результатов, а также комплексным подходом к изучению взаимосвязи основных клеток мозга.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ НЕЙРОПРОТЕКЦИИ В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2616509C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ НЕЙРОПРОТЕКТОРНЫМИ СВОЙСТВАМИ В ЭКСПЕРИМЕНТЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2614694C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОФИЛЯ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПЕПТИДОВ-АГОНИСТОВ РЕЦЕПТОРОВ, АКТИВИРУЕМЫХ ПРОТЕАЗАМИ, 1 ТИПА В ЭКСПЕРИМЕНТАЛЬНЫХ УСЛОВИЯХ, ИМИТИРУЮЩИХ ИШЕМИЧЕСКИЕ | 2020 |
|
RU2750893C1 |
| Способ применения тромбина и активированного протеина С в качестве антивоспалительных средств | 2020 |
|
RU2780490C2 |
| СРЕДСТВО ДЛЯ АНТИАГРЕГАТНОЙ, АНТИВОСПАЛИТЕЛЬНОЙ И ЦИТОПРОТЕКТОРНОЙ ТЕРАПИИ | 2012 |
|
RU2483746C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛИ В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2599438C1 |
| РАСТВОРЫ И СПОСОБЫ ИНГИБИРОВАНИЯ БОЛИ, ВОСПАЛЕНИЯ И РАЗРУШЕНИЯ ХРЯЩА | 2000 |
|
RU2271825C2 |
| ПРОИЗВОДНЫЕ ИЗОХИНОЛИНА И ИХ СОЛИ | 1994 |
|
RU2136664C1 |
| Генно-клеточный везикулярный терапевтический препарат и способ терапии рассеянного склероза посредством трансплантации генно-клеточного везикулярного терапевтического препарата | 2021 |
|
RU2762855C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛИ ОСНОВЕ IN VITRO РЕПРОГРАММИРОВАНИЯ МАКРОФАГОВ НА М1 ФЕНОТИП С ПОВЫШЕННОЙ СПОСОБНОСТЬЮ К ПРОДУКЦИИ ОКСИДА АЗОТА В ЭКСПЕРИМЕНТЕ | 2015 |
|
RU2599545C1 |
Настоящее изобретение относится к клеточной биологии и медицине, в частности к способу оценки комплексной защиты клеток при нейровоспалении на модели in vitro при воздействии агонистом рецепторов, активируемых протеазами, 1 типа (ПАР1). Для осуществления указанного способа сначала формируют клеточные модели воспаления in vitro в виде изолированных клеточных культур из нейронов, астроцитов и клеточной линии тучных клеток RBL-2H3, в виде композиций из клеточных сокультур нейронов и тучных клеток, композиций из сокультур астроцитов и тучных клеток. Далее осуществляют оценку морфофункциональных характеристик клеточных моделей, активированных провоспалительными факторами, по результатам которой делают вывод о комплексной защите клеток при нейровоспалении. При этом воздействие агонистом ПАР1 на клеточные модели осуществляют до проведения провоспалительной активации клеток провоспалительными факторами, а для оценки морфофункциональных характеристик формируют по меньшей мере 6 экспериментальных групп. Настоящее изобретение способствует достижению защиты и оценке такой защиты для целой группы клеток мозга, стабилизирущей не только отдельные клеточные сигнальные каскады, но и их функции при индуцировании нейровоспаления целым спектром факторов. 6 з.п. ф-лы, 11 ил., 4 пр.
1. Способ оценки комплексной защиты клеток при нейровоспалении на модели in vitro при воздействии агонистом рецепторов, активируемых протеазами, 1 типа (ПАР1), включающий
формирование клеточных моделей воспаления in vitro в виде изолированных клеточных культур из нейронов, астроцитов и клеточной линии тучных клеток RBL-2H3, в виде композиций из клеточных сокультур нейронов и тучных клеток, композиций из сокультур астроцитов и тучных клеток и последующую оценку морфофункциональных характеристик клеточных моделей, активированных провоспалительными факторами, по результатам которой делают вывод о комплексной защите клеток при нейровоспалении, при этом воздействие агонистом ПАР1 на клеточные модели осуществляют до проведения провоспалительной активации клеток провоспалительными факторами, а для оценки морфофункциональных характеристик формируют по меньшей мере 6 экспериментальных групп, где
первая группа представляет собой изолированные клеточные культуры нейронов, астроцитов, тучных клеток, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1;
вторая группа представляет собой изолированные клеточные культуры нейронов, астроцитов, тучных клеток, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1;
третья группа представляет собой композицию, включающую сокультивируемые нейроны с тучными клетками, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1;
четвертая группа представляет собой композицию, включающую сокультивируемые нейроны с тучными клетками, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1;
пятая группа представляет собой композицию, включающую сокультивируемые астроциты с тучными клетками, подвергнутые провоспалительной активации, но не предобработанные пептидом-агонистом ПАР1;
шестая группа представляет собой композицию, включающую сокультивируемые астроциты с тучными клетками, подвергнутые провоспалительной активации и предобработанные пептидом-агонистом ПАР1;
в качестве морфофункциональных характеристик используют:
- клеточную гибель, которую оценивают с помощью биохимического метода с использованием реагентов МТТ или WST-1 или с помощью морфологического метода с использованием ДНК-/РНК-тропных красителей,
- секреторную активность клеток, которую оценивают с помощью флуориметрического метода, основанного на проведении реакции конденсации гистамина с ортофталевым альдегидом с образованием флюоресцирующего комплекса, с помощью фотометрического метода, основанного на проведении реакции расщепления β-гексозаминидазы специфического хромогенного субстрата – 4-нитрофенил-N-ацетил-β-D-глюкозаминида, а также с помощью иммуноферментного анализа (ELISA), чувствительного к IL-6,
- уровень свободного внутриклеточного кальция, который оценивают с помощью метода флуоресцентной микроскопии посредством высокоаффинного Ca2+ индикатора Fura-2 или Fluo-4,
- реорганизацию актинового цитоскелета посредством иммуноцитохимического окрашивания клеток с фаллоидином;
при этом вывод о том, что агонист ПАР1 обеспечивает комплексную защиту клеток, проявляющуюся в антивоспалительном и цитопротекторном действии, делают при выявлении секреторной активности в группе 1 на 20% и более по сравнению с группой 2; при выявлении факта реорганизации актинового цитоскелета в группе 1 по сравнению с группой 2; при повышении уровня свободного внутриклеточного кальция в группе 1 относительно группы 2; при клеточной гибели в группах 1 и 3 большей, чем в группах 2 и 4 соответственно; при секреторной активности в группе 5 на 30% и более по сравнению с группой 6.
2. Способ по п. 1, характеризующийся тем, что культивирование нейронов, астроцитов и клеточной линии тучных клеток RBL-2H3 осуществляют в СО2-инкубаторе при 37°С и содержании СО2 5%.
3. Способ по п. 1, характеризующийся тем, что в качестве провоспалительных факторов используют липополисахарид, TNFα, АТФ, глутамат, гистамин, кальциевый ионофор А23187.
4. Способ по п. 1, характеризующийся тем, что воздействие агонистом ПАР1 на клеточные модели осуществляют в количестве от 10 до 100 мкМ по меньшей мере за 15 мин до провоспалительной активации клеток.
5. Способ по п.1, характеризующийся тем, что в качестве клеточных моделей воспаления in vitro используют первичную культуру гиппокампальных нейронов новорожденных крыс линии Wistar; первичную культуру астроцитов коры больших полушарий новорожденных крыс; перитонеальные тучные клетки крыс и их культивируемые аналоги - клетки линии RBL-2H3.
6. Способ по п.1, характеризующийся тем, что перед введением в клеточную модель агонист ПАР1 предварительно растворяют в дистиллированной воде в концентрации 20 мМ, данные аликвоты замораживают и используют в качестве стокового раствора, который вносят в культуральную среду к клеткам до конечной концентрации 10-100 мкМ за 15 минут до их активирования провоспалительными факторами.
7. Способ по п.1, характеризующийся тем, что перед введением агониста ПАР1 в клеточную модель проводят оценку функционального состояния клеток в клеточной модели, при этом используют клеточные модели, выживаемость клеток в которых составляет более 30-40% по сравнению с клетками моделей, которые не подвергались провоспалительной активации.
| MOSNIER L.O | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Кровля из глиняных обожженных плит с арматурой из проволочной сетки | 1921 |
|
SU120A1 |
| Прибор для получения стереоскопических впечатлений от двух изображений различного масштаба | 1917 |
|
SU26A1 |
| Колосниковая решетка | 1926 |
|
SU5237A1 |
| RAMACHANDRAN R | |||
| et al | |||
| Proteinases and signalling: pathophysiological and therapeutic implications via PARs and more, Br J Pharmacol., | |||
Авторы
Даты
2023-05-25—Публикация
2022-05-24—Подача