Ссылки на родственные заявки
Настоящая заявка представляет собой частично продолжающую заявки сер. №11/022262, поданной 23 декабря 2004 г., которая претендует на приоритет предварительной заявки сер. №60/611824, поданной 21 сентября 2004 г. Суть и содержание каждой из этих предшествующих заявок включены в настоящее описание в качестве ссылки.
Предпосылки создания изобретения
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым выделенным изолятам вируса PRRS дикого типа и к соответствующим улучшенным ослабленным (со сниженной вирулентностью) вирусам PRRS, применениям таких ослабленных вирусов в вакцинах и иммунологических композициях, а также к способам оценки уровня виремии (наличие вируса в кровотоке), скорости роста, гуморального иммунного ответа, и их комбинаций для таких изолятов и вирусов. Более конкретно настоящее изобретение относится к способу предсказания вирулентности новых или ранее не охарактеризованных изолятов вирусов PRRS и ослабления и применения таких изолятов в вакцинах и иммунологических композициях.
Описание известного уровня техники
Вирус репродуктивно-респираторного синдрома свиней (PRRSV) представляет собой покрытый оболочкой одноцепочечный РНК содержащий вирус, относящийся к семейству Arteriviridae (Cavanaugh, 1997). Он является возбудителем широко распространенной болезни свиней, которая впервые была описана как «таинственная болезнь свиней» в США в 1987 г. (Hill, 1990). Болезнь проявляется в виде респираторного заболевания во всех возрастных группах свиней, приводя к гибели некоторых молодых свиней и серьезных связанных с репродуктивной способностью проблем у самок в возрасте полового созревания.
Динамичная природа PRRSV обеспечивает постоянное изменение болезни и является благоприятной основой появления новых изолятов (Andreyev и др., 1997; Murtaugh и др., 1998; Meng, 2000). Тот факт, что PRRSV может столь легко изменяться в сочетании с его способностью наносить значительный ущерб свиноводам, делает важным его исследования (Mengeling и др., 1998; Pejsak и др., 1997) и разработку вакцин и других методов снижения опасности инфекции. Изменение уровней вирулентности изолятов было продемонстрировано по повреждениям легких и гибели свиней (Halbur и др., 1996), но попытки связать биологические и иммунологические различия со специфическими генетическими различиями оказались в основном безуспешными (Albina и др., 1998; Key и др., 2001; Yuan и др., 2001; Murtaugh и др., 2002; Grebennikova и др., 2004). Результаты оценки безопасности и эффективности вакцин против PRRS представлены в работе Labarque и др., (2003), Mengeling и др., (2003а) и Nodelijik и др. (2001). В этих исследованиях установлено, что в экспериментальных условиях модифицированные живые вакцины против PRRS снижают уровень и продолжительность виремии, а также лихорадку и повреждения легких после контрольного заражения вирулентным изолятом.
Opriessing и др. (2002) установили, что изоляты с высокой гомологией аминокислотной последовательности в открытой рамке считывания 5 (ОРС5), вызывали различную по степени серьезности пневмонию у свиней. Различия в реакции свиней на PRRSV зависят также от изменения хозяина (Mengeling и др., 20036). Вирулентность оценивали по скорости репликации и распределению PRRSV в организме свиней (Haynes и др., 1997), по способности макрофагов осуществлять клиренс меди (Thanawongnuwech и др., 1998) и по уровням анемии животного-хозяина (Halbur и др., 2002). Однако эти методы отличались недостаточной эффективностью с точки зрения предсказания вирулентности новых или ранее не охарактеризованных изолятов вируса PRRS.
Таким образом, в данной области существует потребность в создании метода предсказания вирулентности изолятов вируса PRRS. В данной области существует также необходимость в разработке метода предсказания вирулентности изолятов вируса PRRS, основанном на оценке in vivo скорости роста вируса PRRS и/или уровня виремии у свиней после введения или обработки изолятом свиней, ранее не зараженных вирусом PRRS.
Краткое изложение сущности изобретения
Настоящее изобретение позволяет преодолевать указанные выше проблемы и в нем предложены новые выделенные изоляты вируса PRRS дикого типа, ослабленные версии таких вирусов и соответствующие вакцины, содержащие ослабленные вирусы PRRS в фармацевтических композициях. Более конкретно настоящее изобретение относится к вирусам дикого типа, предлагаемым в изобретении, обозначенным как SDSU 73, 17198-6 и MN 184, и их смесям. Ослабленные версии этих вирусных изолятов и полные вакцины, содержащие ослабленные изоляты, обладают способностью обеспечивать развитие у свиней иммунитета in vivo к PRRS, не вызывая заметных клинических симптомов, связанных с PRRSV.
Другой особенностью ослабленных изолятов вирусов PRRS, предлагаемых в изобретении, является то, что при их использовании сохраняется в значительной степени уровень виремии, характерный для неослабленных вирусов дикого типа. Так, ослабленные вирусы характеризуются уровнем виремии, составляющим по меньшей мере примерно 50% и более предпочтительно по меньшей мере примерно 75%, от уровня виремии, характерного для неослабленных вирусов дикого типа. Благодаря этому ослабленные вирусы могут обеспечивать более быстрое развитие и более полный иммунитет свиней к PRRS.
Вирулентность вирусов дикого типа можно снижать различными методами, такими как повторные серийные пассажи в клеточной культуре, инсерция гена, «переключение» гена, делеция гена, замена пары оснований и чувствительная к температуре мутация. Такие ослабленные вирусы можно затем применять в различных иммунологических композициях, включая вакцины, с использованием методов, хорошо известных в данной области. В некоторых формах такие ослабленные вирусы можно дополнительно убивать или инактивировать с использованием методов, хорошо известных в данной области, перед внесением или включением в иммуногенную композицию, предлагаемую в настоящем изобретении. Примерами иммуногенных композиций, которые можно применять для предупреждения инфекции вирусом PRRS или снижения серьезности клинических симптомов инфекции вирусом PRRS, являются вакцины, созданные на основе Abst-1 или JA-142.
При создании изобретения было установлено также, что вакцины, предлагаемые в изобретении, можно хранить в условиях замораживания до применения без снижения требуемых характеристик вакцин. Это позволяет решить давно существующую в данной области проблему, поскольку известные ранее в данной области вакцины против PRRS не были пригодны для хранения при замораживании.
В настоящем изобретении предложены также способы предсказания уровня вирулентности нового или не охарактеризованного изолята вируса PRRS. Такие способы заключаются в том, что осуществляют оценку нового или ранее не охарактеризованного изолята вируса PRRS по меньшей мере по одному из следующих параметров: скорость роста вируса; уровень виремии; гуморальный иммунный ответ; или их комбинация. Результаты такой оценки затем применяют для предсказания степени вирулентности нового или ранее не охарактеризованного изолята. Способы в целом заключаются в том, что свиней ранее не зараженных вирусом PRRS, подвергают действию или обрабатывают определенным количеством нового или не охарактеризованного изолята PRRS и дают вирусу реплицироваться в течение периода времени, составляющего вплоть до примерно 15 дней, более предпочтительно примерно от 2 до 12 дней, еще более предпочтительно примерно от 3 до 10 дней и еще более предпочтительно примерно от 3 до 7 дней. Путь введения может быть общепринятым, включая оральный, внутриносовой, внутримышечный, в лимфатический узел, внутрикожный, внутрибрюшинный, подкожный путь и их комбинации, но наиболее предпочтительным является внутриносовое введение. Объем дозы для внутриносового введения предпочтительно составляет вплоть до примерно 5 мл, еще более предпочтительно от примерно 0,5 до примерно 4 мл, еще более предпочтительно от примерно 1 до примерно 3 мл и еще более предпочтительно примерно 2 мл. Концентрация вируса в каждой дозе должна составлять вплоть до примерно 5,0 log10 TCID50 (конечное значение инфицирующей дозы, способной вызывать заражение 50% тканевой культуры)/мл, более предпочтительно от примерно 1,0 до примерно 4,0 log10 TCID50/мл и еще более предпочтительно от примерно 2,5 до 3,5 log10 TCID50/мл и наиболее предпочтительно примерно 3,0 log10 TCID50/мл. В выбранный момент или моменты времени в течение указанного периода репликации из организма свиньи получают биологические образцы и оценивают скорость роста введенного вируса, уровень виремии, гуморальный иммунный ответ и/или их комбинацию. Полученные при такой оценке данные затем сравнивают со скоростью роста, уровнем виремии, гуморальным иммунным ответом и/или их комбинацией для известного и охарактеризованного изолята, в качестве меры предсказанной вирулентности нового или неизвестного изолята.
С помощью способов, предлагаемых в настоящем изобретении, скорость роста вируса PRRS, уровень виремии, гуморальный иммунный ответ и/или комбинацию этих характеристик оценивали у свиньи, несущей один из 8 вводимых ей различных изолятов PRRSV. Каждый из этих изолятов имел известный уровень вирулентности и связанных с ним клинических проявлений болезни. Эти же характеристики оценивали также у свиньи, которая несла комбинацию всех 8 вводимых ей изолятов.
Более конкретно сто (100) здоровых 2-3 недельных поросят произвольно разделяли по весу на 10 групп по 10 поросят в каждой группе. Всех поросят тестировали в отношении инфекции вирусом PRRS, с помощью твердофазного иммуноферментного анализа HerdChek ® PRRS ELISA 2XR (фирма IDEXX Laboratories Inc., Уэстбрук, шт. Мэн). Животным восьми групп вводили один из 8 изолятов, одной группе вводили комбинацию всех 8 изолятов, а последней группе вводили минимальную эссенциальную среду Игла (ЕМЕМ) и использовали ее в качестве контроля. Каждый образец, применяемый для инокуляции вируса, повторно титровали для подтверждения титра вируса. Предпочтительно титр вводимого вируса регулировали так, чтобы имитировать встречающийся в естественный условиях уровень экспозиции вирусом. Биологические образцы в виде крови собирали в различные моменты времени в течение эксперимента. Каждый образец анализировали путем выделения вируса, количественной оценки с использованием полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР), с помощью HerdChek ® PRRS ELISA 2XR, и специфического для белка PRRSV ELISA.
Выделение вирусов осуществляли с использованием CL2621-клеток (клеточная линия МА 104) путем серийного разведения сыворотки и объединения ее с ЕМЕМ, гентамицином (фирма Sigma Chemical Co., Сент-Луис, шт.Миссури) и Фунгизоном (фирма Invitrogen Corp., Гранд-Айленд, шт.Нью-Йорк). Затем разведения инкубировали и оценивали цитопатическое действие (ЦПД). Для определения титра использовали метод расчета Рида-Мюнха (Reed-Muench).
ОТ-ПЦР осуществляли с помощью набора QIAamp Viral RNA Mini-Kit ® (фирма Qiagen, Inc., Валенсия, шт.Калифорния) и PRRSV определяли с помощью анализа «в одной пробирке» фирмы Tetracore, Inc. (Геттисберг, шт.Мэриленд). Для количественной оценки вируса создавали стандартную кривую и концентрации неизвестных образцов определяли путем линейной экстраполяции пороговых значений цикла относительно известной концентрации продукта в виде 3' UTR-транскрипта.
Титр антител определяли с помощью ELISA на основе соотношений S/P (белок сыворотки), используя устройство HerdChek ® PRRS ELISA 2XR и инструкции производителя. Специфический для белка PRRSV ELISA осуществляли с использованием нуклеокапсида (N) и неструктурного белка 4 (nsp 4) рекомбинантного изолята VR2332, экспрессируемого в клетках BL21 (DE3)-RP (фирма Stratagene, Ла Джолла, шт.Калифорния).
Всех поросят взвешивали в начале и в конце эксперимента. Кроме того, каждый день эксперимента каждого поросенка обследовал ветеринар и оценивал в баллах клинические признаки заболевания PRRS. Все полученные данные обрабатывали статистически и сравнивали данные между группами.
Девять из десяти групп затем подвергали контрольному заражению второй раз, используя изолят вируса с более высокой вирулентностью, что позволяло дополнительно определять уровни специфической защиты (иммунитета) и эффективность вакцины относительно специфической защиты при использовании дикого типа (общее понятие при экспозиции живым вирусом). После этого контрольного заражения животных обследовали и осуществляли аутопсию для анализа с помощью выделения вируса и иммуногистохимии.
Настоящее изобретение относится также к иммуногенной композиции, содержащей ослабленный изолят вируса PRRS. В предпочтительных формах композиция может содержать также фармакологически совместимый носитель и/или адъювант. Одна из приведенных в качестве примера такая композиция может включать Abst-1 и/или ослабленную форму вируса PRRS для того, чтобы согласно предсказанию обладать вирулентностью при оценке с помощью описанных выше методов.
Настоящее изобретение относится также к усовершенствованному способу отбора изолята вируса PRRS для снижения его вирулентности и включения в иммуногенную композицию. Способ в целом заключается в том, что осуществляют стадии, на которых а) получают изолят вируса PRRS с неизвестной вирулентностью; б) вводят количественно указанный изолят вируса PRRS не зараженной PRRS свинье; в) дают указанному изоляту реплицироваться в организме свиньи в течение примерно 3-15 дней; г) оценивают скорость роста вируса и/или уровень виремии в течение этого периода; д) сравнивают скорость роста или уровень виремии со скоростью роста и/или уровнем виремии изолята вируса PRRS с известной вирулентностью; и е) отбирают изолят для снижения его вирулентности и включения в иммуногенную композицию на основе скорости роста и/или уровня виремии по сравнению с изолятами с известной вирулентностью. Предпочтительно для включения в иммуногенную композицию следует отбирать изолят, который согласно предсказанию является высоковирулентным, хотя можно использовать изоляты, которые согласно предсказанию обладают пониженной вирулентностью, включая изоляты, которые согласно предсказанию являются авирулентными. Причиной этого является тот факт, что изоляты, для которых предсказана более высокая вирулентность, обладают более высокой скоростью роста и/или уровнями виремии, что, как правило, индуцирует более сильный и обладающий большим защитным действием иммунный ответ. С помощью способов, предлагаемых в настоящем изобретении, отбор изолятов, предназначенных для включения в иммуногенные композиции, может быть упрощен и он может обеспечивать повышение вероятности получения эффективной вакцины, которая может осуществлять защиту от вирулентных изолятов вируса PRRS.
В контексте настоящего описания понятие «скорость роста» относится к оценке репликации вируса в организме свиньи в течение времени. Предпочтительные примеры такой оценки представлены в примере 1. Понятие «уровни виремии» в контексте настоящего описания относится к концентрации вируса, циркулирующего в крови свиньи. Предпочтительные примеры такой оценки также представлены в примере 1.
Краткое описание чертежей
На чертежах показано:
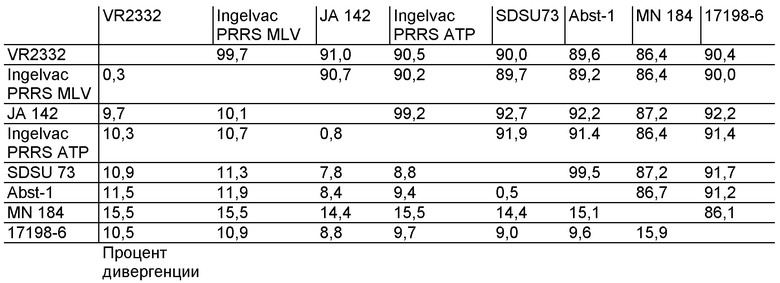
на фиг.1 - графическое изображение средних значений титров вируса в сыворотке относительно времени экспозиции в виде log10 TCID50/мл, которые получены в опыте на свиньях, описанном в примере 1;
на фиг.2 - графическое изображение средних значений концентрации вируса PRRSV в сыворотке, которые получены в опыте на свиньях, описанном в примере 1, при оценке с помощью ОТ-ПЦР в реальном времени;
на фиг.3 - графическое изображение средних значений соотношений S/P в зависимости от времени при анализе с помощью поступающего в продажу набора для ELISA;
на фиг.4 - графическое изображение результатов повторного анализа с помощью поступающего в продажу набору для ELISA данных о значениях log10 TCID50/мл, полученных в примере 1, где показана зависимость усредненных по группе данных в виде площадей под кривой для соотношений S/P, полученных с помощью ELISA, от усредненных по группе данных о площадях под кривой для log10TCID50/мл;
на фиг.5 - графическое изображение результатов повторного анализа с помощью поступающего в продажу набору для ELISA данных о концентрациях, полученных с помощью ОТ-ПЦР в примере 1, где показана зависимость усредненных по группе данных в виде площадей под кривой для соотношений, полученных с помощью ELISA, от усредненных по группе данных в виде площадей под кривой для концентраций, измеренных с помощью ОТ-ПЦР;
на фиг.6а - график зависимости абсорбции от времени для данных, полученных в примере 1;
на фиг.6б - график зависимости абсорбции от времени, иллюстрирующий воздействие изолята PRRSV на IgG-ответ на nsp 4, где данные представляют собой средние значения, полученные для 10 животных, за исключением погибших животных;
на фиг.7 - графическое изображение результатов повторного анализа с использованием данных об ответе на nsp 4 и log10 TCID50/мл, полученных в примере 1, где показана зависимость усредненных по группе данных в виде площадей под кривой для nsp 4 от усредненных по группе данных в виде площадей под кривой для log10 TCID50/мл;
на фиг.8 - графическое изображение результатов повторного анализа с использованием клинических баллов и данных log10 TCID50/мл, полученных в примере 1, где показана зависимость усредненных по группе данных в виде площадей под кривой для клинических баллов от усредненных по группе данных в виде площадей под кривой для log10 TCID50/мл; и
на фиг.9 - графическое изображение полученных с помощью иммуногистохимии баллов (IHC-баллов) для каждого изолята, указанного в настоящем описании.
Подробное описание предпочтительных вариантов осуществления изобретения
Ниже в примерах представлены предпочтительные изоляты и способы, предлагаемые в настоящем изобретении. Однако должно быть очевидно, что эти примеры даны только с целью иллюстрации и не должны рассматриваться как ограничивающие полный объем изобретения.
Пример 1
Материалы и методы:
Сто здоровых поросят 2-3-недельного возраста получали из не зараженного вирусом PRRS промышленного стада и содержали в Veterinary Resources, Inc., Эймс, шт.Айова под наблюдением ветеринара. Животные имели свободный доступ к корму и воде. Весь участвующий в этом опыте персонал, ухаживающий за животными и осуществляющий лабораторные анализы, не был осведомлен о вариантах обработки, которым подвергали различные группы животных. Поросят оценивали с помощью HerdChek® PRRS ELISA 2XR (IDEXX Laboratories Inc., Уэстбрук, шт.Мэн) для того, чтобы определить не заражен ли какой-либо поросенок PRRSV. Все поросята, которых использовали в опыте, описанном в этом примере, дали отрицательную реакцию. Затем поросят произвольно разделяли по весу на 10 групп по 10 поросят на группу.
В опыте, описанном в этом примере, применяли всего 8 изолятов PRRSV. Эти изоляты были обозначены как VR-2332, Ingelvac® PRRS MLV, JA 142, Ingelvac® PRRS ATP, SDSU 73, Abst-1, MN 184 и 17198-6. Эти 8 изолятов характеризовали историю болезни PRRS, обладали широким спектром уровней вирулентности и вызывали соответствующие клинические проявления болезни. Все изоляты вируса хорошо росли на клетках депонированной в АТСС клеточной линии CL2621 (CL2621 представляет собой собственную линию, полученную из NVSL, Эймс, шт.Айова) (линия клеток МА-104 почки обезьяны). Три первично полевых изолята, т.е. VR-2332, JA-142 и SDSU 73, имели также ослабленные формы, такие как Ingelvac® PRRS MLV (фирма Boehringer Ingelheim Vetmedica Inc., Сент-Джозеф, шт.Миссури), Ingelvac® PRRS ATP (фирма Boehringer Ingelheim Vetmedica Inc., Сент-Джозеф, шт.Миссури) и Abst-1 соответственно. Все эти ослабленные формы обладали низкой или не обнаруживаемой вирулентностью, полученной в результате пассажей in vitro с целью ослабления. Изолят PRRSV АТСС VR-2332 был выделен в 1991 г. в штате Миннесота и его применяли на третьем пассаже клеточной культуры. Ослабленная форма этого вируса поступает в продажу под товарным знаком Ingelvac® PRRS MLV. Изолят PRRSV JA 142 (АТСС № РТА-6504), предоставленный William Mengeling, National Animal Disease Center, Эймс, шт.Айова, был выделен в 1997 г. в штате Айова в серьезном случае нарушения репродуктивной системы, так называемого состояния «острого аборта», и его применяли на пятом пассаже клеточной культуры. Ослабленная форма JA 142 поступает в продажу под товарным знаком Ingelvac® PRRS АТР и зарегистрирована в АТСС под номером VR-2638. Изолят PRRSV SDSU 73 (АТСС № РТА-6322) был выделен в шт.Айова в серьезном случае заболевания репродуктивной системы в 1996 г. и его использовали на первом пассаже клеточной культуры. Ослабленную форму SDSU 73, обозначенную как Abst-1 (АТСС № РТА-6320), получали путем 52 пассажей. Изолят PRRSV 17198-6 (АТСС № РТА-6321) был получен в шт.Оклахома в 1997 г. из стада, страдающего серьезным заболеванием репродуктивной системы, и его применяли на стадии четвертого пассажа. Изолят PRRSV MN 184 (АТСС № РТА-6319) был получен в 2001 г. из свиноводческой фермы в южной Миннесоте, где у животных обнаружено серьезное заболевание репродуктивной системы и падеж свиноматок, и он предоставлен Kurt Rossow, University of Minnesota, Сент-Пол. Этот изолят применяли на первом пассаже клеточной культуры. Кроме того, получали пул, состоящий из комбинации всех изолятов.
В день 0 каждый из 8 изолятов PRRSV и пул PRRSV разводили до уровня примерно 3,0 log10 TCID50/мл в минимальной эссенциальной среде Игла (ЕМЕМ) (фирма JRH Bioscience, Ленекса, шт.Канзас), содержащей 4% ФБС (фирма JRH Bioscience, Ленекса, шт.Канзас) и осуществляли внутриносовое введение поросятам в дозе 2 мл (по 1 мл на ноздрю). Животным в необработанной контрольной группе вводили 2 мл среды. Инокулят титровали на 96-луночных планшетах, содержащих 3-дневные CL2621-клетки для подтверждения титра с помощью метода Рида-Мюнха (Reed и др., 1938). Поросятам вводили изоляты, данные об установленных титрах которых, а также информация об уровне вирулентности и о выделении, представлены в таблице 1.
Затем осуществляли сравнение изолятов для определения их генетического сходства путем анализа процента идентичности их последовательностей. Для определения идентичности последовательностей образцы вирусов передавали в Диагностическую лабораторию Университета штата Миннесота (University of Minnesota Diagnostic Laboratory) для анализа последовательностей. Были получены результаты для ОРС 5-6 и их затем сравнивали с консенсусной последовательностью вируса PRRS. Определяли различия в индивидуальных парах оснований и затем для изолятов оценивали % идентичности последовательностей. Как очевидно специалистам в данной области, можно осуществлять также поиск с помощью программы Blast на различных сайтах в сети Интернет.Например, Университет штата Миннесота предоставляет базу данных PRRSV (ccgb.umn.edu/cgi-bin/common/web_blast.cgi), в которой содержатся перечни последовательностей изолятов 1989-2003. Другим часто используемым сайтом является NCBI BLAST link, который можно найти на ncbi.nlm.nih.gov/BLAST.
Как видно из данных о проценте идентичности последовательностей и дендограммы, представленных в таблице 2, вирулентные полевые изоляты генетически являются различными и представляют собой разнообразную группу изолятов PRRSV. В противоположность этому родительские и применяемые в вакцине пары PRRSV генетически являются практически идентичными. Для осуществления парного сравнения и для получения дендограммы, представленной в таблице 2, использовали программное обеспечение Lasergene, которое можно применять в качестве инструмента для анализа последовательностей (фирма DNASTAR, Inc., Мэдисон, шт.Висконсин).
Таблица 2. Парное сравнение нуклеотидной последовательности ОРС5 вирулентных и ослабленных изолятов PRRSV, применяемых в опыте. Процент сходства представлен в верхней правой части, а процент дивергенции - в нижней левой части таблицы. На дендрограмме показано генетическое родство изолятов. Полосой обозначена 1 нуклеотидная замена на 100 остатков. VR2332 обозначает родительский изолят Ingelvac PRRS MLV, JA 142 обозначает родительский изолят Ingelvac PRRS ATP, a SDSU 73 обозначает родительский изолят Abst-1.
Процент идентичности
В день 49 осуществляли внутриносовое введение 2 мл вирулентного изолята PRRS MN 184 в группы 1-9. Изолят MN 184 разбавляли в MEM+4% ФТС так, чтобы концентрация соответствовала log 3,0±0,5 на мл. Разбавленную провокационную пробу вируса с целью оценки титровали в 96-луночных планшетах, содержащих 3-дневные клетки CL2621. Животных обследовали в течение 14 дней и затем осуществляли аутопсию.
Оценка виремии
Образцы крови получали из организма каждого поросенка в каждой группе с помощью вакуумного контейнера в дни 0, 1,3, 7, 15, 21, 28, 35, 42 и 49. Сыворотку отделяли от коагулированной цельной крови путем центрифугирования при 6000 об/мин в течение 20 мин. Затем образцы сыворотки разделяли для анализа выделения вируса, TCID50, количественной полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР), HerdChek® PRRS ELISA 2XR и специфического для PRRSV ELISA. В этом опыте образцы сыворотки обрабатывали непосредственно после сбора и охлаждали на льду в течение 3 ч после получения. Образцы хранили максимум в течение 24 ч при 4°С и затем при -70°С. Сыворотку, подлежащую анализу с помощью ОТ-ПЦР, замораживали до -70°С в день сбора и хранили до момента осуществления анализа, для чего только такое количество образцов, которое можно проанализировать в течение 24 ч, подвергали оттаиванию, экстрагировали и тестировали.
Для определения TCID50 по 100 мкл сыворотки от каждого поросенка добавляли в пробирку для разбавления, содержащую 900 мкл EMEMm + 2% ФБС + 50 мкг/мл гентамицина (фирма Sigma Chemical Co. Сент-Луис, шт.Миссури) + 2,5 мкг/мл Фунгизона (фирма Invitrogen Corporation, Гранд-Айленд, шт.Нью-Йорк). Эту пробирку встряхивали и 100 мкл переносили в другую пробирку для разведения, содержащую 900 мкл EMEMm + 2% ФБС + 50 мкг/мл гентамицина + 2,5 мкг/мл Фунгизона. Этот процесс повторяли до достижения конечного разведения 10. По 4 повторности каждого разведения вносили в 96-луночные планшеты, содержащие CL2621-клетки (клетки линии МА 104), по 100 мкл на лунку, выдерживали при 37°С и 4% СО2 в течение 8 дней. Затем в каждой лунке оценивали цитопатическое действие (ЦПД) и определяли титры с помощью метода расчета Рида-Мюнха. Для различных изолятов вируса по 100 мкл сыворотки добавляли с дублированием в опытные лунки, содержащие клетки линии МА 104. Затем планшеты инкубировали в течение 1 ч при 37°С и 4% CO2. После чего в каждую лунку добавляли по 500 мкл ЕМЕМ + 2% ФБС + 50 мкг/мл гентамицина + 2,5 мкг/мл Фунгизона. Планшеты инкубировали при 37°С в атмосфере 4% СО2 в течение 8 дней и затем оценивали ЦПД в каждой лунке.
Для экстракции вирусной РНК из сыворотки для осуществления количественной ОТ-ПЦР использовали набор QIAamp Viral RNA Mini-Kit ® (фирма Qiagen Inc. Валенсия, шт.Калифорния) согласно прилагаемым к набору инструкциям. Для осуществления ПЦР в реальном времени поступающий в продажу набор для ОТ-ПЦР-анализа в реальном времени в одной пробирке, предназначенный для выявления встречающегося в США PRRSV, получали от фирмы Tetracore Inc. (Геттисберг, шт.Мэриленд) и использовали для выявления РНК PRRSV. Связывающий малый желобок (MGB) 5'-нуклеазный зонд и праймеры создавали из 3'-нетранслируемой области (UTR) геномной области PRRSV путем сравнительного анализа последовательностей имеющихся в GenBank изолятов и на основе консервативных областей 3'UTR-праймера и зонда. РНК PRRSV транскрибировали с использованием реакции в одной пробирке в 25 мкл реакционного объема, содержащего основную смесь (мастер-смесь) фирмы Tetracore U.S. для PRRSV (18,9 мкл мастер-смеси, 2 мкл ферментной смеси 1, 0,1 мкл ферментной смеси 2) и 4 мкл экстрагированной ® РНК. Реакционные пробирки вносили в блок термоячейки Smart Cycler II® (фирма Cepheid, Саннивейл, шт.Калифорния) и устанавливали программное обеспечение для обнаружения флуоресценции, предназначенное для автоматического расчета исходного уровня за вычетом фона. Программа для термоячейки предусматривала проведение реакции при 52°С в течение 1800 с, 95°С в течение 900 с и 45 циклов при 94°С в течение 30 с, при 61°С в течение 60 с и при 72°С в течение 60 с. ПЦР рассматривали как позитивную, если пороговый уровень цикла (Ct) достигался через ≤45 циклов. Для количественной оценки известные количества полученного в результате серийных разведении in vitro продукта в виде транскрипта РНК (от 1×10-1 до 1×108 копий/мкл) применяли для получения стандартной кривой. Концентрации в виде количества копий /мл неизвестных образцов определяли путем линейной экстраполяции значений Ct относительно известной концентрации продукта в виде 3'иТР-транскрипта.
Оценка антител
Для определения с помощью ELISA S/P-соотношений использовали HerdChek® PRRS ELISA 2XR (фирма INDEXX Laboratories, Уэстбрук, шт.Массачусетс) согласно инструкциям производителя. Специфический для белка PRRSV HerdChek® ELISA осуществляли с использованием нуклеокапсида (N) и неструктурного белка 4 (nsp 4) рекомбинантного изолята VR2332, который экспрессировали в клетках линии BL21 (DE3)-RP (фирма Stratagene) из плазмиды рЕТ 24b в виде слитых белков, содержащих на N-конце mус-метку, а на С-конце 6×His-метку. Денатурированные белки подвергали диализу в противотоке 0,1М Трис-HCl, рН 8,0, 6М гуанидин-HCl, 2 мМ ЭДТК и доводили до концентрации 3 мг/мл. Добавляли ДТТ (дитиотреитол) до 300 мМ и раствор фильтровали через мембрану с размером пор 0,45 мкм. Восстановленный белок вносили в буфер для восстановления складчатости (100 мМ Трис-HCl, рН 8,0, 0,5М L-аргинин, 8 мМ окисленный глутатитон, 2 мМ ЭДТК, 10 мкМ пепстатин А, 10 мкМ леупептин и 1 мМ ФМСФ (фенилметилсульфонилфторид), фильтровали (0,22 мкм) и перемешивали в течение ночи. Очищенный белок концентрировали фильтрацией в тангенциальном потоке (устройство Pellicon XL Ultracel PLC 5 kd, фирма Millipore) и подвергали диализу в противотоке 20 мМ Трис-HCl, рН 8,0. Белки анализировали на биоанализаторе типа Agilent 2100, снабженным лабораторным чипом для белков (Protein LabChip). Растворы очищенных белков хранили при -80°С.
Специфические для белков ELISA осуществляли путем сенсибилизации титрационных микропланшетов 100 нг рекомбинантного белка в карбонатном буфере, рН 9,6 или только буфера. Планшеты блокировали с помощью 2,5%-ного обезжиренного сухого молока в забуференном фосфатом физиологическом растворе, содержащем 0,1% Tween 20 (ЗФРТ). 100 мкл разбавления сыворотки 1:2000 вносили с дублированием в лунки и выдерживали 2 ч, после чего планшеты отмывали ЗФРТ и связывание антитела выявляли путем инкубации в течение 1 ч с конъюгированным с пероксидазой из хрена козьим антителом к свиному IgG (тяжелая+легкая цепи (фирма KPL, Геттисберг, шт.Мэриленд), разбавленным в соотношении 1:5000, затем отмывали и оценивали изменение окраски в присутствии 100 мкл ТМВ-(тетраметилбензидин)-субстрата (фирма KPL). Реакция прекращали путем добавления 1М фосфорной кислоты и планшеты считывали при 450 нм.
Вес тела
Всех поросят взвешивали в день 0 (первый день опыта) и в день 49 (последний день опыта). Поросят взвешивали с использованием переносных электронных весов со шкалой, откалиброванной с помощью гирь в виде стержня, типа Weigh-Tronix модель 615XL, (фирма Weigh-Tronix Inc., Фэрмонт, шт.Миннесота). Шкалу калибровали с использованием сертифицированных гирь до и после каждого измерения.
Клиническая балльная оценка
Каждый день на протяжении опыта состояние каждого поросенка оценивали с помощью баллов от 1 до 4 для каждого клинического симптома после обследования ветеринаром респираторных симптомов, поведения и кашля. Здоровому животному соответствовал балл 3, максимальному клиническому проявлению заболевания соответствовал балл 9, а погибшему животному соответствовал балл 12. Образцы, полученные из организма всех погибших в процессе опыта животных, направляли в Ветеринарную диагностическую лабораторию Университета штата Айова (Iowa State University Veterinary Diagnostic Laboratory) для обследования в отношении патологии.
Иммуногистохимическая оценка легких
Образец легкого каждого поросенка фиксировали формалином в день аутопсии для оценки с помощью иммуногистохимии и микроскопического обследования в отношении повреждений, связанных с PRRSV. Это исследование осуществляли в Ветеринарной диагностической лаборатории Университета штата Айова (Iowa State University Veterinary Diagnostic Lab.).
Статистический анализ
Все данные вводили в систему статистического анализа (SAS), версия 8.02 для оценки результатов и их анализа. Суммарные статистические параметры, включающие среднее значение, стандартное отклонение квадратичной ошибки, медиану и распределение численностей, оценивали при необходимости для всех полученных в результате переменных. Данные, касающиеся веса тела, результатов ОТ-ПЦР и log10 TCID50/мл, анализировали с помощью однонаправленного дисперсионного анализа (ANOVA) для всех различий между группами с разными вариантами обработки с парным анализом различий между группами с разными вариантами обработки с помощью t-критерия минимальной существенной разницы. Все оценки различий между группами осуществляли с помощью двусторонних критериев. Различия рассматривались как статистически значимые при р≤0,05.
Для облегчения корреляционного анализа в данные были внесены некоторые изменения. Значения log10 TCID50/мл, составляющие <2,00, были приняты за 1,0. Отрицательные значения, полученные при ОТ-ПЦР, были приняты за 1,0, а все значения, полученные при ОТ-ПЦР, стандартизовали путем превращения перед анализом в десятичный логарифм log10. В корреляционные анализы не включали результаты, полученные для контрольной группы. Результаты, полученные для каждого поросенка, превращали в аппроксимирующие площади под кривой с помощью правила трапеции. Значения площадей под кривой рассчитывали для всего периода опыта с первого дня обследования до 15 дня и с 15 дня до дня последнего обследования, хотя на чертежах представлены данные только для всего периода опыта.
Результаты
Выделение вируса и количественная оценка с помощью log10 TCID50/мл
Перед днем обработки с целью заражения ни у одного из тестируемых животных не обнаружена положительная реакция на присутствие PRRSV. В день 1 после заражения путем внутриносового введения только у 13 животных в 5 тестируемых группах обнаружена положительная реакция на присутствие вируса. Однако через 3 дня после заражения у всех животных, которым вводили полевые изоляты, кроме изолята 17198-6, обнаружена положительная реакция на присутствие вируса, при этом средние значения log10 TCID50/мл составляли от 2,1 (SDSU-73) до 3,9 (MN 184). В противоположность этому у всех животных, инокулированных ослабленными изолятами, обнаружена отрицательная реакция при анализе клеточной культуры. Эти результаты представлены на фиг.1. Пики уровней виремии, составляющие от 3,6 до 4,6 log10 TCID50/мл, достигнуты к 7 дню для четырех из пяти вирулентных изолятов. Для изолята 17198-6 пик был достигнут к 15 дню. Титры сохранялись на уровне близком или превышающем 2 log10 TCID50/мл во всех группах, обработанных вирулентными изолятами, в течение 21 дня за исключением поросят, зараженных изолятом JA 142, у которых титры были ниже указанного уровня.
Уровни виремии у поросят, инокулированных ослабленными изолятами PRRSV, оказались ниже, чем у поросят, инокулированных вирулентными полевыми изолятами. Усредненные по группе данные о максимальных значениях титров ослабленных изолятов меньше на порядок самого низкого титра изолята из вирулентной группы. Изолят Abst-1 за исключением 3 дня после инокуляции больше не был ни разу повторно выделен. Уровни виремии Ingelvac® PRRS MLV колебались между 0,5 и 1,0 log10 TCID50/мл в дни 7-28, a Ingelvac® PRRS АТР варьировались от 0,4 до 1,2 log10 TCID50/мл в дни 7-28. Ослабленные изоляты вируса не были выделены из сыворотки после 28 дня, вирус повторно выделяли только из групп поросят, зараженных 2 вирулентными полевыми изолятами, пулом и изолятом MN 184, в течение 35 дней (см. также фиг.1). В дни 42 и 49 практически у всех поросят не обнаружено наличие вируса в крови.
В целом, установлено, что более вирулентные изоляты реплицируются быстрее и достигают более высоких титров в организме поросят по сравнению с ослабленными изолятами. В частности, у поросят, зараженных изолятом MN 184, обнаружено очень быстрое повышение репликации вируса, которое начиналось со дня 3 и достигало пика, превышающего 4,5 log10 TCID50/мл, ко дню 7. После достижения пика титры в кровотоке MN 184 равномерно понижались, но все еще оставались существенно более высокими (t-критерий, р≤0,5) по сравнению со всеми другими изолятами в дни 28 и 35. Аналогичная тенденция обнаружена для всех остальных обработанных вирулентными изолятами групп, а именно VR2332, JA 142, SDSU 73 и пулом (см. фиг.1). Для поросят, зараженных 17198-6, обнаружена такая же общая тенденция, которая описана для группы, зараженной MN 184, но титры оказались существенно более низкими.
Для групп поросят, которым вводили ослабленные изоляты (Ingelvac® PRRS MLV, Ingelvac® PRRS АТР и Abst-1), обнаружена другая тенденция. У них выявлено умеренное возрастание титра вируса, которое начиналось после 3 дня, достигая пика между 7 и 15 дням, при этом титр вируса более чем на порядок оказался ниже по сравнению с любой обработанной вирулентным изолятом группой и на несколько порядков ниже по сравнению с зараженной MN 184 группой. В день 35 или ранее титры, обнаруженные в группах, которые обрабатывали ослабленными изолятами, снижались до нуля (см. фиг.1).
При сравнении усредненных по группе данных после второй экспозиции выявлено очень резкое повышение титров вируса в группах, которым вводили ослабленные изоляты, в то время как в обработанных вирулентными изолятами группах обнаружено менее выраженное повышение титров или отсутствие повышения. Например, титр Abst-1 составлял 3,76 log через 7 дней после второй экспозиции, а титр MN 184 был равен нулю. В других обработанных ослабленными изолятами группах максимальные титры достигались через 3 дня после второй экспозиции. Самый высокий титр из обнаруженных для всех групп, обработанных вирулентными штаммами, составлял 1,32 log через 3 дня после экспозиции JA 142.
Количественная оценка вируса с помощью ОТ-ПЦР в реальном времени
Уровни виремии оценивали также с помощью ОТ-ПЦР в реальном времени, поскольку вероятно, рост в CL2621-клетках не был одинаковым для всех изолятов, а также поскольку ОТ-ПЦР может представлять собой более чувствительный метод оценки виремии, чем выращивание в клетках. Как видно из фиг.2, в группах, обработанных вирулентными изолятами, обнаружено резкое повышение средней концентрации в день 1, и во всех группах максимум, превышающий 8 log/мл, достигался между 7 и 15 днями. Затем в группах, которые обрабатывали вирулентными изолятами, концентрации постепенно снижались в течение нескольких следующих недель, достигая концентрации ниже 4 log/мл к 49 дню.
В группах, которые обрабатывали ослабленными изолятами, обнаружено существенно менее выраженное повышение концентрации, которое начиналось также примерно в день 1 и усредненный по группам титр никогда не достигал или не превышал 7 log/мл (фиг.2). Значения концентраций, обнаруженных в обработанных ослабленными изолятами группах, колебались, что приводило к широкому диапазону значений в течение нескольких недель после экспозиции. Колебания прежде всего зависели от единичных высоких значений, характерных для одного поросенка. Для трех групп, обработанных ослабленными изолятами, все максимальные значения достигались в разные дни опыта. В группе, обработанной Ingelvac® PRRS MLV, пик, которому соответствовала концентрация 4,31 log/мл, достигался в день 28, обработанной Ingelvac® PRRS АТР, пик на уровне 6,58 log/мл достигался в день 3, а в группе, обработанной Abst-1, пик на уровне 6,85 log/мл, который оказался наиболее высоким титром ослабленного изолята, достигался в день 35 (фиг.2). Кроме того, средняя концентрация в группах, обработанных вирулентными изолятами, оказалась существенно более высокой (Р<0,05) по сравнению со средней концентрацией в группах, обработанных ослабленными изолятами, в дни 3 и 15, но в день 49 средняя концентрация в группах, обработанных вирулентными изолятами, оказалась существенно более низкой (Р<0,05) по сравнению с группами, обработанными ослабленными изолятами.
HerdChek® PRRS ELISA 2XR
Как видно из фиг.3, при оценке гуморального иммунного ответа на PRRSV на основе соотношений S/P, которые определяли с помощью HerdChek® PRRS ELISA 2XR,
установлено, что средние значения в группах, обработанных вирулентными изолятами, повышались выше частоты отсечки 0,4 для положительного результата в день 15. В противоположность этому, средние значение в группах, обработанных ослабленными изолятами, оказались отрицательными и во всех трех группах сохранялись ниже уровня 0,4 в течение периода времени, превышающего 21 день. Для групп, обработанных Ingelvac® PRRS MLV и Ingelvac® PRRS ATP, обнаружены положительные результаты в день 28, но для группы, обработанной Abst-1, среднее соотношение S/P не превышало 0,4 до 42 дня.
При сравнении гуморального иммунного ответа в группах, зараженных вирулентными изолятами или пулом, и группах, инокулированных ослабленными изолятами, очевидно, что кинетические характеристики и уровни гуморального иммунного ответа связаны с уровнем виремии, прежде всего между 14 и 35 днями после заражения. Этот факт подтверждает также наличие корреляции между уровнями виремии и гуморальными иммунными ответами, определенными путем парного сравнения полученных с использованием HerdChek® PRRS ELISA 2XR соотношений S/P, и либо данными, полученными путем титрования вируса, либо данными, полученными с помощью ОТ-ПЦР. На фиг.4 и 5 показано, что гуморальный иммунный ответ тесно связан с вирусной нагрузкой в течение всего периода опыта, при этом коэффициент корреляции г равен 0,858 для данных, полученных путем титрования вируса, и г равен 0,794 для данных, полученных с помощью ОТ-ПЦР. Эти связи обладают высокой достоверностью (р<0,0001 в каждом случае). Кроме того, для ослабленных изолятов характерны слабые гуморальные иммунные ответы и вирусные нагрузки, а для вирулентных изолятов - сильные гуморальные иммунные ответы.
Специфический для белка PRRSV ELISA
Для дополнительного подтверждения зависимости между различными инокулятами PRRSV и гуморальными иммунными ответа, определяли титры антител к N, основному структурному белку, и nsp 4, важной, но минорной неструктурной протеазе. На фиг.6а проиллюстрировано, что кинетика IgG-ответа на нуклеокапсид N практически идентична во всех группах поросят, при этом пик титра обнаружен в день 28, после чего происходило резкое снижение в следующие 7-14 дней, а затем уровни сохранялись или слега повышались между 42 и 49 днями.
Величина ответа на все изоляты аналогична выявленной с помощью HerdChek® PRRS ELISA 2XR и согласуется с уровнями виремии. Наименьшие максимальные значения в день 28 выявлены в группах, которые инокулировали ослабленными изолятами, а наиболее высокий титр обнаружен у поросят, которых заражали самым вирулентным изолятом MN 184. К 49 дню титр антител к N оказался эквивалентным во всех группах, кроме групп, обработанных MN 184 и пулом, что позволяет предположить, что гуморальный иммунный ответ на MN 184 может быть качественно отличным. Кроме того, к 49 дню только 5 поросят выжили в каждой из этих двух групп, что привело к повышению уровня средней квадратичной ошибки в день 49 в группе, обработанной MN 184.
Как видно из фиг.6б, IgG-ответ на nsp 4 значительно отличался от ответа на N. Антитело к nsp 4 не было выявлено до дня 21, полный ответ был существенно более слабым и не было выявлено заметного ответа в группах, обработанных Ingelvac® PRRS MLV и Abst-1. Кроме того, величина ответа на nsp 4 не связана с уровнем виремии. Ответы на VR 2332, JA 142, MN 184 и пул все оказались эквивалентными, пик приходился на день 28 с последующим снижением ко дню 35, затем вновь повышался ко дню 42, при этом величина, время появления и продолжительность виремии варьировались в этих четырех группах. На фиг.7 проиллюстрировано, что при использовании повторного анализа результатов, а именно данных об ответе на nsp 4, полученных с помощью ELISA, в сравнении с данными о log10 TCID50/мл, не обнаружена корреляция между уровнем виремии и гуморальным иммунным ответом на nsp 4. Был обнаружен также очень слабый вторичный ответ на изолят MN 184 после вторичной экспозиции в день 49.
Вес тела
Не обнаружено существенного различия среднего веса тела во всех группах в день 0 эксперимента (Р=0,099). В день 49 поросята, инокулированные ослабленным изолятом Abst-1, имели самый высокий средний вес, который существенно превышал вес всех остальных групп за исключением контрольной группы (таблица 3). Кроме того, в день 49 средней вес во всех группах, обработанных вирулентными изолятами, за исключением 17198-6, был существенно ниже, чем в контрольной группе (таблица 3). Средний вес в группах, обработанных ослабленными изолятами Ingelvac® PRRS MLV и Ingelvac® PRRS ATP, и в контрольной группе оказался статистически эквивалентным (таблица 3).
Балльная оценка клинических симптомов
Повышение средних клинических баллов обнаружено только в четырех обработанных вирулентными изолятами группах: JA 142, SDSU 73, MN 184 и пул. Эти более высокие баллы сохранялись в течение всего опыта, в то время как для остальных групп, обработанных как вирулентными, так и ослабленными изолятами, на протяжении всего опыта клинические баллы практически соответствовали норме. Единственной основной причиной изменений средних клинических баллов в этом опыте была гибель одного или нескольких животных в соответствующей обработанной группе (таблица 4).
Вирулентные изоляты PRRSV 13/60=22%
Все случаи гибели в обработанных группах были связаны со случаями негнойной интерстициальной пневмонии со степенью тяжести от средней до тяжелой, которая являлась следствием PRRSV, сопровождающейся вторичной бактериальной инфекцией.
* Случаи смертности, обусловленные бактериальной пневмонией, не связанной с PRRSV.
** Пул, представляющий смесь всех 8 изолятов.
Установлено, что серьезность клинического заболевания тесно связана с вирусной нагрузкой (р<0,001 для титрования вируса). Как видно из фиг.8, клинические баллы оказались наиболее высокими для групп, зараженных MN 184 и пулом. 50% поросят в каждой группе погибли, и титрование вируса показало, что уровень заражения в этих группах оказался существенно более высоким, чем во всех остальных группах. Различия в вирусной нагрузке по данным ОТ-ПЦР оказались менее выраженными (данные не представлены), и корреляция клинических симптомов и вирусной нагрузки при оценке с помощью ОТ-ПЦР была ниже, чем в случае титрования вируса (ср. r=0,556 и r=0,803 соответственно). Клинические баллы в группе 10 (контроль) повысились после гибели двух поросят от бактериальной пневмонии. У обоих поросят не обнаружена положительная реакция на присутствие PRRSV по данным иммуногистохимического обследования ткани легкого, получены также отрицательные результаты при анализе выделения вируса и по данным ПЦР в реальном времени, а также полное отсутствие сероконверсии по данным HerdChek® PRRS ELISA 2XR или специфического для белка ELISA. Последние результаты свидетельствуют о том, что в организме животных, которые неожиданного погибли во время эксперимента, присутствовали различные бактериальные патогены, гибель, вероятно, была связана с вторичной бактериальной инфекцией (таблица 5).
Иммуногистологическая оценка легких
Хотя средние IHC-баллы и вызванные PRRSV повреждения, выявленные в индивидуальных группах, не отличались существенно, было обнаружено значимое различие между IHC-баллами и вирулентностью при их сравнении. Средние значения IHC-баллов и вызванных PRRSV повреждений представлены на фиг.9 и в таблице 6.
Обсуждение
Целью этого примера была оценка различных изолятов PRRSV с известными уровнями вирулентности для решения вопроса о том, можно ли взаимосвязь с репликацией in vivo использовать для предсказания вирулентности изолятов PRRSV без осуществления экспериментов по контрольному заражению. Кроме того, представлялось важным определить взаимосвязь между вирулентностью изолятов, уровнями виремии и гуморальным иммунным ответом. И, наконец, может представлять интерес создание вакцин против изолятов PRRSV, которые являются вирулентными при оценке способами, предлагаемыми в настоящем изобретении. Целью исследования было также создание таких вакцин, которые обеспечивали бы определенную степень защиты от других вирулентных изолятов; однако такая перекрестная эффективность может не являться универсальной для всех изолятов PRRSV и требуется ее дополнительная оценка. Однако очевидно, что при создании настоящего изобретения был создан эффективный инструмент для идентификации основных кандидатов для создания вакцины.
Для оценки изолятов PRRSV в одинаковых условиях необходимо использовать дозы лицензионных вакцин более низкие, чем минимальная иммунизирующая доза, утвержденная Министерством сельского хозяйства США (USDA), и которые не представляли бы собой репрезентативную поступающую в продажу дозу. Кроме того, применяемое в опыте внутриносовое введение вакцин на основе MLV не утверждено USDA, и его используют только для имитации экспозиции, более соответствующей естественным условиям. Обычная доза поступающих в продажу модифицированных живых вакцин против PRRS (Ingelvac PRRS и Ingelvac PRRS ATP) существенно превышает дозу, применяемую в данном эксперименте. Эти экспериментальные низкие дозы модифицированной живой вакцины против PRRS не представляют собой фактическую дозу и форму продукта, применяемого в полевых условиях, и это позволяет легко объяснить указанную серологическую реакцию. При использовании вакцины в поступающей в продажу дозе серологические титры, измеренные посредством IDEXX-анализа, должны выявляться к 14 дню. В этом опыте при использовании титров, составляющих примерно 3 log, серологическая реакция была замедленной и более низкой. Этот результат являлся ожидаемым, но такую схему эксперимента применяли для гарантии введения постоянного титра различным группам и для облегчения анализа и сравнения вирулентных и авирулентных изолятов. Хотя это не указано конкретно в примере, эффект дозы, вероятно, является существенно более значимым для ослабленного или менее вирулентного вируса, чем для вирулентного полевого изолята вируса, который может быстро расти и который можно выделять при уровне в сыворотке поросенка порядка 4 log/мл при 3-7-дневной экспозиции. При использовании более высокой рекомендованной для внутримышечного введения поступающей в продажу дозы соотношения S/P по данным HerdChek® PRRS ELISA 2XR превышали частоту отсечки 0,4 через 14 дней после вакцинации, что представляло собой половину того промежутка времени, в течение которого оценивали действие доз в этом опыте (Roof и др., 2003). Номинальная доза, применяемая в этом исследовании, т.е. 2×103 TCID50 на животное, вызывала 50%-ную смертность в группах, которым вводили MN 184, и образование во всех группах антител к нуклеокапсиду. Более высокие дозы не изучали, поскольку слишком высокая смертность в группах, зараженных высоковирулентными изолятами, могла снизить объективность полученных в этом опыте результатов. Кроме того, в предыдущих исследованиях установлено, что не обнаружено различия в клинических симптомах и в уровне виремии у молодых поросят, инокулированных изолятом PRRSV VR2332 в дозах 102,2, 103,2 и 104,2 TCID50 на животное.
Как данные о значениях log10 TCID50/мл, так и результаты, полученные с помощью ОТ-ПЦР в реальном времени, позволили установить, что уровни виремии существенно варьировались между группами после экспозиции PRRSV. Это свидетельствует о том, что скорость роста PRRSV в поросятах является фенотипическим признаком вируса, не зависящим от возможных вариаций чувствительности поросят к инфекции. Кроме того, ослабление PRRSV путем адаптации к росту на CL2621-клетках, не только снижало его способность к росту в организме поросят, но изменяло также кинетику репликации вируса, что приводило к тому, что пик виремии достигался в более поздние моменты времени. Аналогичные результаты были получены Chang и др. (2002), свидетельствующие о том, что пассаж в клеточных культурах изолята PRRSV с умеренной вирулентностью, такой как VR 2332, даже в течение ограниченного периода времени снижал скорость роста вируса в организме поросят и существенно откладывал момент достижения пика виремии. Однако достижение пика виремии в более поздние моменты времени не является диагностическим признаком для пассажа клеточной культуры in vitro или для ослабления, поскольку для высоковирулентного изолята 17198-6 также выявлено достижение пика виремии в более поздние моменты времени.
В целом для вирулентных изолятов обнаружены существенно более высокие уровни виремии в сыворотке по сравнению с ослабленными изолятами при эквивалентных дозах инокуляции. Например, наиболее высокий титр вируса из обнаруженных во всех группах, обработанных ослабленными изолятами, составлял 1,22 log в день 15 для поросят, которым вводили Ingelvac® PRRS АТР, в наиболее низкий титр вируса из обнаруженных во всех группах, обработанных вирулентными изолятами, составлял в день 15 2,40 log в обработанной SDSU 73 группе. Достижение пика виремии к 3-7 дню и обнаруженные уровни вируса (все >3,5 log/мл) оказались весьма постоянными для групп, обработанных вирулентными изолятами PRRSV, хотя для MN 184 характерны более высокий уровень и продолжительность виремии, при этом титры вируса были обнаружены в дни 28 и 35. Этот результат подтверждает концепцию о том, что более высоковирулентные изоляты PRRSV реплицируются с достижением существенного более высокого титра in vivo по сравнению с ослабленными изолятами или изолятами с низкой вирулентностью, однако не обнаружена прямая количественная зависимость между уровнем вирулентности и уровнем скорости роста in vivo для изолятов PRRSV дикого типа (Haynes и др., 1997). В группах обнаружено варьирование в широких пределах защиты от вторичной экспозиции с использованием изолята MN 184. Например, вирус не выявлен в группе, обработанной MN 184 или пулом, каждой из которых первоначально вводили изолят MN 184. Установлено, что Abst-1 обеспечивает очень незначительную защиту после экспозиции MN 184. Эти данные дополнительно подтверждают концепцию о том, что гомологичная экспозиция обеспечивает более высокий уровень защиты по сравнению с гетерологичной экспозицией. Гомологичная экспозиция с использованием вирулентных изолятов приводит к более выраженной защите, а гетерологичная экспозиция с использованием вирулентных изолятов приводит к менее выраженной защите, но к более высокой, чем при гетерологичной экспозиции с использованием ослабленных изолятов.
Результаты, полученные с помощью ОТ-ПЦР в реальном времени, статистически были аналогичны результатам оценки с помощью log10 TCID50/мл, что свидетельствует о том, что эти методы позволяет оценивать относительные уровни заражения вирусом различных групп. Коэффициент корреляции Пирсона между данными, полученными с помощью ОТ-ПЦР, и значениями log10 TCID50/мл в день 7 составил 0,89, а между средними результатами, полученными с помощью ОТ-ПЦР, и log10 TCID50/мл составлял 0,88. Концентрации, определенные с помощью ОТ-ПЦР в реальном времени, могут на несколько порядков превышать значения log10 TCID50/мл по нескольким причинам таким, как различия между частотой встречаемости вирусных частиц, содержащих ампликон-мишень, и частиц, обладающих полной инфективностью в отношении CL2621-клеток, и присутствие нейтрализующих антител, которые могут снижать инфективность (Dianzani и др., 2002). Однако мало вероятно, чтобы нейтрализующие антитела оказывали влияние на это различие, поскольку анализ проводили во все моменты времени, включая моменты, предшествующие производству гуморального иммунного ответа на PRRSV.
Количество копий/мл, определенное с помощью ОТ-ПЦР в реальном времени, выше, чем титры инфекционности, оцененные в виде TCID50/мл на клеточных культурах. Это связано с тем, что обычно стандартную кривую, построенную на основе количества копий генома вируса, применяли при количественной оценке с помощью ПЦР, при которой происходит непосредственная амплификация геномных последовательностей вируса, а не вирионов с известной инфективностью. Биологические анализы, например, с использованием клеточной культуры, могут позволять оценивать наличие инфективности, однако они не позволяют подсчитывать все инфекционные частицы, присутствующие в препарате. В других исследованиях были установлены факторы, которые могут оказывать влияние на титр инфекционности, такие как условия культивирования клеток и наличие in vivo антител, которые могут нейтрализовать вирус, что приводило к заниженной оценке количества инфекционных частиц в сыворотке, выраженное в виде TCID50/мл. Альтернативно этому может присутствовать некоторое количество неинфекционных или имеющих дефект репликации вирусов, что может выражаться в большем количестве копий.
В целом, полученные с помощью ELISA результаты подтверждают концепцию о том, что во время острой стадии заражения уровень гуморального иммунного ответа связан с уровнем вирусной репликации. Тенденция, показанная на фиг.4 и 5, иллюстрирует эту взаимосвязь. Замедленный и менее интенсивный гуморальный иммунный ответ стимулировался в клеточных культурах ослабленными изолятами вируса, а более быстрый и более интенсивный гуморальный иммунный ответ стимулировался вирулентными изолятами. Кроме того, эти данные продемонстрировали также, что по меньшей мере два фактора, такие как тип изолята и инфекционная доза, влияют на относительные величины соотношения S/P при анализе с использованием HerdChek® PRRS ELISA 2XR. Хотя полученные с помощью ELISA результаты, которые показаны на фиг.3, убедительно свидетельствуют о наличии положительного или отрицательного усредненного по группе ответа, важно отметить наличие вариабельности между индивидуальными животными. Некоторые поросята из групп, обработанных ослабленными изолятами, давали положительный ответ ранее дня 21, а некоторые поросята из групп, обработанных вирулентными изолятами, сохраняли способность давать отрицательный ответ вплоть до дня 21.
Анализ специфических гуморальных иммунных ответов на N и nsp 4 свидетельствует о том, что иммунные ответы на PRRSV варьируются по интенсивности независимо от применяемого для инокуляции изолята. Гуморальные иммунные ответы на белок N у животных, инокулированных высоковирулентными изолятами MN 184 и JA 142, свидетельствуют о тенденции, сходной с той, которая характерна для всех изолятов, но отличается более высоким уровнем. В организме поросят, инокулированных MN 184 и JA142, обнаружены также самые высокие титры вируса, что видно из фиг.1 и 2. Этот результат свидетельствует о том, что уровень гуморального иммунного ответа может быть связан с вирусной нагрузкой на стадии острого заражения, оцененной по титру вируса. Важно отметить, что зависимость ответа от времени оказалась одинаковой во всех группах, даже с учетом того, что время достижения пика титра было отложено при использовании высоковирулентного изолята 17198-6 и ослабленных изолятов. В противоположность этому гуморальный иммунный ответ на nsp 4 оказался низким во все моменты времени и для всех изолятов, как ослабленных, так и вирулентных. Зависимость от времени гуморального иммунного ответа на nsp 4 была эквивалентной во всех группах, несмотря на различия во времени, необходимом для достижения пика вирусной нагрузки среди групп, что соответствует зависимости, обнаруженной для гуморального иммунного ответа на N. Для всех поросят были выявлены невысокие уровни гуморального иммунного ответа на nsp 4, что видно из фиг.7.
Эти результаты свидетельствуют о том, что некоторые белки PRRSV вызывают более сильный ответ иммунной системы хозяина вне зависимости от вирулентности применяемого для обработки изолята. При этом данные свидетельствуют также о том, что уровень иммунного ответа на более иммуногенные белки, вероятно, связан с вирулентностью применяемого для обработки изолята или со способностью изолята к репликации in vivo. Возможно также, что различия в гуморальном иммунном ответе могут быть просто следствием генетических различий между изолятами, которые приводят к различиям в антигенной реактивности, в результате чего антитела к N и nsp 4 других изолятов не реагируют или слабо реагируют на рекомбинантные белки, экспрессируемые изолятом VR2332, который применяли для сенсибилизации планшетов для ELISA. Однако некоторые факты позволяют предположить, что установленные различия в уровнях антител отражают связанные с иммунологией ответы. Установлено, что изолят MN 184, который имеет наиболее выраженные генетические отличия от VR2332, что установлено путем сравнения ОРС 5, обладает также наиболее сильным гуморальным иммунным ответом на N. Kapur и др. (1996) ранее установили, что относительные различия в одной открытой рамке считывания между изолятами PRRSV, присутствуют также в других открытых рамках считывания. Кроме того, индивидуальные белки содержат консервативные и неконсервативные области (e.g. Kapur и др., 1996), и выраженная иммуногенная реактивность может быть направлена к консервативным эпитопам (Ostrowski и др., 2002). Однако на результаты, полученные с помощью ELISA, касающиеся гуморальных иммунных ответов на очищенные белки PRRSV, могут оказывать влияние генетические и антигенные вариации, и эти явления необходимо учитывать. Осуществляли повторную укладку рекомбинантных белков, однако никаких различий не обнаружено между данными, полученными с использованием планшетов для ELISA, сенсибилизированных не уложенными повторно или повторно уложенными белками.
Следует отметить, что примерно через 4-5 недель после инокуляции происходило относительно сильное снижение гуморального иммунного ответа на белки и N, и nsp 4. Аналогичный пик, обнаруженный через 1-2 недели, с последующим снижением реактивности антител ранее был описан у Foss и др. (2002) в отношении GP5, основного гликопротеина оболочки. В сочетании эти результаты позволяют предположить, что ответ на индивидуальные вирусные белки, вероятно, не дает полной картины иммунного ответа поросят на PRRSV, поскольку при оценке гуморального иммунного ответа с помощью HerdChek® PRRS ELISA 2XR не обнаружено достижение аналогичного кратковременного пика реактивности антител.
Пониженный рост и смертность наиболее существенно коррелировали с вирулентностью и скоростью роста вируса in vivo. Более низкий средний вес, обнаруженный в группах, которые обрабатывали вирулентными изолятами, наиболее вероятно, отражает различие в способности изолята PRRSV реплицироваться in vivo и индуцировать более серьезное заболевание у поросят. Эти результаты согласуются с полученными ранее данными о том, что заражение PRRSV может вызывать анорексию, сопровождающуюся снижением на 25-40% суточного прибавления веса (Thacker, 2003). Баллы, характеризующие клиническое состояние животных, которых обрабатывали вирулентными изолятами, быстро увеличивались вскоре после инокуляции, в то время как фактически не обнаружено изменение баллов, характеризующих состояние животных, которых обрабатывали ослабленным вирусом. Это увеличение клинических баллов отражалось в обнаруженном уровне смертности, составляющем 50%, 20% и 10% в группах, обработанных изолятами PRRSV MN 184, SDSU 73 и JA 142 соответственно. В противоположность этому, в группах, обработанных ослабленными изолятами, не обнаружено смертности. Взаимосвязь между быстрым ростом вируса и патогенезом вируса в одних и тех же условиях обработки вирусом становится наиболее очевидной при сравнении групп, экспонированных MN 184 и Abst-1. Титры инокуляции фактически были одинаковыми, 4,10 log/мл и 4,18 log/мл соответственно, а, кроме того, как показано на фиг.8, обнаружены заметные различия в механизме воздействия этих двух изолятов на поросят. Изолят Abst-1 практически был инертным, он хорошо реплицировался in vivo и не вызывал клинических симптомов. В отличие от этого изолят MN 184 реплицировался с достижением чрезвычайно высоких титров in vivo и вызывал серьезные клинические симптомы, что приводило к гибели 50% обработанных животных. Также важно, что в группе поросят, которых обрабатывали пулом всех изолятов вируса, обнаружены примерно такие же вирусологические, клинические и иммунологические ответы, что и у поросят, обработанных MN 184. Этот результат свидетельствует о том, что наиболее быстро реплицирующийся изолят вируса при смешанной инфекции, вероятно, выигрывает по сравнению с другими изолятами так, что конечный результат является практически таким же, что и при заражении только изолятом, который имеет наиболее высокий потенциал роста.
Обнаруженные важные различия in vivo между вирулентными и ослабленными изолятами PRRSV проливают свет на взаимосвязь между вирулентностью изолята и его ростом и репликацией in vivo. При введении поросятам в эквивалентных дозах более вирулентные изоляты имели титры log10 TCID50/мл и полученные с помощью ОТ-ПЦР концентрации, которые были заметно выше, чем у ослабленных изолятов. Вирулентные изоляты индуцировали более быстрый и интенсивный гуморальный иммунный ответ. Вирулентные изоляты оказывали отрицательное воздействие на прибавление веса и вызывали более высокий уровень смертности и более серьезные клинические симптомы по сравнению с ослабленными изолятами.
В заключение следует отметить, что пример и опыты, представленные в настоящем описании, свидетельствуют о том, что ослабленные и вирулентные изоляты PRRSV вызывают очень различные клинические симптомы, а также иммунные ответы, которые значительно отличаются по своей интенсивности. Эти различия связаны со способностью вируса к репликации in vivo, фенотипическим признаком, который можно оценивать количественно в образцах сыворотки и на основе которого можно разрабатывать систему предсказания вирулентности изолятов PRRSV.
Пример 2
В данном примере описано несколько методов ослабления изолятов вируса PRRS, а также их включения в иммуногенные композиции.
Материалы и методы:
Препарат вакцины получали путем включения модифицированного или ослабленного живого вируса с целью иммунизации свиней против инфекции, связанной с PRRS. Вирус PRRSV для препарата вакцины размножали в непрерывной клеточной линии МА-104, предпочтительно АТСС №CL2621. Клеточную линию выращивали в колбах, содержащих среду MEM, к которой добавляли 10% фетальной телячьей сыворотки. Значение рН сред доводили примерно до 7,2 и инкубировали примерно при 37°С. Затем клетки инокулировали вирусом путем добавления примерно 1 мл замороженного инокулята в жидкие среды. Вирусу давали абсорбироваться на клетках в течение 24 ч. В этот момент питательную среду заменяли поддерживающей средой, представляющей собой MEM, дополненную 4% фетальной телячьей сыворотки, рН 7,6. Температура окружающей среды предпочтительно составляла 35-37°С. Вирусу давали расти до тех пор пока 50% пласта клеток МА-104 не разрушалось вирусом. Затем образец замораживали и подготавливали к пассажу в другую колбу с МА-104-клетками. Этот процесс продолжали, осуществляя 25 пассажей вирусов в клеточную линию. Затем вирус размножали (пересевали) еще 12 раз при температуре примерно 31°С, а не при 35-37°С, используя методики, аналогичные описанным выше. 12-й пассаж замораживали в виде небольших аликвот, и он был обозначен как основной (мастер) посевной материал вируса.
Ниже изложены детали предпочтительного метода.
I. Среды:
а. Минимальная эссенциальная среда Игла (MEM), фирма JRH Biosciences, №200-2041
б. Фетальная телячья сыворотка (PCS), фирма JRH Biosciences
в. Питательная среда для выращивания клеток - МЕМ+10% фетальной телячьей сыворотки
г. Поддерживающая среда - МЕМ+4% фетальной телячьей сыворотки
д. Трипсин-Версен IX
е. Бикарбонат натрия 5%-ный или насыщенный
II. Тканевая культура:
Применяемая клеточная линия: МА-104 (клетки почки африканской зеленой мартышки, поддерживаемая на уровне 20 пассажей (пассаж 58-78)
III. Оборудование:
75-сантиметровые колбы для культуры тканей
Инкубатор, установленный на температуру 35-37°С.
Инкубатор, установленный на температуру 3°С.
Центрифуга
IV. Метод, применяемый для выращивания ослабленного вируса PRRSV при 25-37°С.
А. Приготовление маточной тканевой культуры:
5-7-дневную культуру клеток МА-104 в маточных флаконах площадью 75 см2 расщепляли в соотношении 1:4 следующим образом:
а. Сливали всю среду (50 мл на флакон).
б. Удаляли пласт клеток, используя 10 мл трипсина-версена, путем инкубации при 37°С в течение 5-10 мин.
в. Удаляли клетки из флакона и центрифугировали при 270g в течение 5-10 мин.
г. Декантировали супернатант и ресуспендировали клетки в 5-10 мл питательной среды (МЕМ+10% FCS).
д. Помещали все клетки в 200 мл МЕМ+10% FCS, после чего распределяли на четыре 75-сантиметровых флакона, по 50 мл на флакон для расщепления в соотношении 1:4. Затем флаконы выдерживали при 35-37°С до применения (можно также осуществлять процесс без добавления CO2).
е. Через 3 или 4 дня флаконы, в которых образовался полный клеточный пласт, были готовы к применению.
ж. Доводили значение рН 50 мл среды в колбе до 7,2 и затем в среду добавляли 1 мл вируса и выдерживали колбу при 35-37°С (можно также осуществлять процесс без добавления CO2).
з. Через 24 ч среду отбрасывали и в колбу повторно вносили 50 мл МЕМ+4% FCS, рН 7,6 и вновь выдерживали при 35-37°С.
и. Через 24 ч после замены жидкости должно проявиться ЦПД, и, когда в клеточном пласте обнаруживали 50-60% «окон», осуществляли замораживание.
к. Подвергали оттаиванию содержимое флакона и брали 1 мл этой жидкости и переносили в новый указанный выше 75-сантиметровый флакон для получения следующего пассажа вируса.
Эту процедуру проводили всего 25 раз, выращивание осуществляли при температуре 35-37°С.
Метод, применяемый для выращивания ослабленного вируса PRRSV при 31°С. Вирус, который пересевали 25 раз при 35-37°С, применяли для получения пассажа 1 для выращивания вируса при 31°С.
А. Приготовление маточной тканевой культуры:
5-7-дневную культуру клеток МА-104 в маточных флаконах площадью 75 см расщепляли в соотношении 1:4 следующим образом:
а. Сливали всю среду (50 мл на флакон).
б. Удаляли пласт клеток, используя 10 мл трипсина-версена, путем инкубации при 37°С в течение 5-10 мин.
в. Удаляли клетки из флакона и центрифугировали при 270Чg в течение 5-10 мин.
г. Декантировали супернатант и ресуспендировали клетки в 5-10 мл питательной среды (МЕМ+10% FCS).
д. Помещали все клетки в 200 мл МЕМ+10% FCS, после чего распределяли на четыре 75-сантиметровых флакона, по 50 мл на флакон для расщепления в соотношении 1:4. Затем флаконы выдерживали при 35-37°С до применения (можно также осуществлять процесс без добавления СО2).
е. Через 3 или 4 дня флаконы, в которых образовался полный клеточный пласт, были готовы к применению.
ж. Доводили значение рН 50 мл среды в колбе до 7,2 и затем в среду добавляли 1 мл вируса и выдерживали колбу при 31°С (можно также осуществлять процесс без добавления СО2).
з. Через 24 ч среду отбрасывали и в колбу повторно вносили 50 мл МЕМ+4% PCS, рН 7,6 и вновь выдерживали при 31°С.
и. Через 24 ч после замены жидкости должно проявиться ЦПД, и, когда в клеточном пласте обнаруживали 50-60% «окон», осуществляли замораживание.
к. Подвергали оттаиванию содержимое флакона и брали 1 мл этой жидкости и переносили в новый указанный выше 75-сантиметровый флакон для получения следующего пассажа вируса PRRS R-2332.
Эту процедуру проводили всего 12 раз, выращивание осуществляли при температуре 31°С. Двенадцатый пассаж вируса, выращенного при 31°С, обозначали как основной (мастер) посевной материал вируса для производства вакцины.
Ослабление вируса PRRS путем делеции гена
Специалист в данной области может осуществлять ослабление PRRSV с помощью общепринятого метода делеции гена. В целом, метод заключается в том, что осуществляют делецию гена, который кодирует вирулентый фенотип вируса. Такой метод можно адаптировать с учетом изложенного в таких ссылках как Elbers и др. (U.S. Pat. App.№20020012670) или Schall и др. (U.S. Pat. №6740324), суть и содержание которых включено в настоящее описание в качестве ссылки.
Ослабление вируса PRRS путем чувствительной к температуре мутации
Специалист в данной области может осуществлять также ослабление PRRSV с помощью общепринятого метода чувствительной к температуре мутации. В целом, метод заключается в том, что вызывают мутацию, которая ограничивает температурный диапазон, в котором вирус является активным. Метод описанный, например, у Skiadopoulos и др., «Identification of Mutations Contributing to the Temperature-Sensitive, Cold-Adapted, and Attenuation Phenotypes of the Live-Attenuated Cold-Passage 45 (cp45) Human Parainfluenza Virus 3 Candidate Vaccine», Journal of Virology. 73, №2, с.1374 (февраль 1999 г.), можно адаптировать применительно к PRRSV. Суть и содержание публикации Skiadopoulos и др. включены в настоящее описание в качестве ссылки.
Ослабление вируса PRRS путем создания инфекционного клона
Специалист в данной области может осуществлять также ослабление PRRSV с помощью общепринятого метода создания инфекционного клона. В целом, этот метод заключается в том, что создают клон полноразмерной кДНК требуемого генотипа вируса, этот клон обладает вирулентностью в организме животных-мишеней. Например, метод, описанный у Nielson и др., «Generation of an Infections Clone ofVR-2332, a Highly Virulent North American-Type Isolate of Procine Reproductive and Respiratory Syndrome Virus», Journal of Virology, 77, с.3702 (март 2003 г.), можно адаптировать для получения ослабленной версии PRRSV. Суть и содержание публикации Nielson и др. включены в настоящее описание в качестве ссылки.
Ослабление вируса PRRS путем инсерции гена
Специалист в данной области может осуществлять также ослабление PRRSV с помощью общепринятого метода инсерции гена. В целом, этот метод заключается в том, что в вирус осуществляют инсерцию гена, который ингибирует патогенные фенотипы вируса. Например, метод, описанный у Schall и др. (U.S. Pat. №6740324), можно адаптировать для получения такой ослабленной версии PRRSV. Суть и содержание публикации Schall и др. включены в настоящее описание в качестве ссылки.
Ослабление вируса PRRS путем замены
Специалист в данной области может осуществлять также ослабление PRRSV с помощью общепринятого метода замены кодона и пары оснований. В целом, этот метод заключается в том, что осуществляют замену кодона или пары оснований на другой кодон или пару оснований, в результате чего вирусный ген начинает кодировать белок, который ограничивает патогенность вируса. Например, метод, описанный у McAuliffe и др., «Codon Substitution Mutuations at Two Positions in the L Polymerase Protein of Human Parainfluenza Virus Type 1 Yield Viruses with a Spectrum of Attenuation In Vivo and Increased Phenotypic Stability In Vitro», Journal of Virology, 78, с.2029 (февраль 2004 г.), можно адаптировать для создания метода замены гены для получения ослабленного PRRSV. Кроме того, у Hurrelbrink и McMinn, «Attenuation of Murray Valley Encephalitis Virus by Site-Directed Mutagenesis of the Hinge and Putative Receptor-Binding Regions of the Envelope Protein», Journal of Virology, 75 с.7692 (август 2001 г.) и у Elbers и др. (US Pat. App. №.20020012670) описаны методы замены пары оснований, которые можно адаптировать для создания ослабленного изолята PRRSV. Суть и содержание публикаций McAuliffe и др., Hurrelbrink и McMinn и Elbers и др. включены в настоящее описание в качестве ссылки.
Ослабление вируса PRRS путем создания химерных конструкций вируса PRRS
Специалист в данной области может осуществлять также ослабление PRRSV с помощью общепринятого метода создания химерных конструкций. В целом, химерная конструкция представляет собой конструкцию, которая содержит гены различных видов для того, чтобы индуцировать антигенный ответ в клетке-хозяине. Например, такую конструкцию можно создавать, адаптируя метод, описанный у Harris и др. (U.S.Pat. App.№20040157307), для получения химерной конструкции, содержащей гены вируса PRRS.
Включение ослабленных изолятов вируса PRRS в иммуногенные композиции.
После получения новых ослабленных изолятов, предпочтительно с помощью одного из указанных выше методов, ослабленные изоляты можно включать в композиции, которые обладают способностью эффективно вызывать иммунный ответ против вирулентных изолятов вируса PRRS. В предпочтительных формах такие композиции должны обеспечивать у животного, которому ввели композицию в эффективном количестве, защитный иммунитет против заражения PRRS. Такой защитный иммунитет должен снижать серьезность клинических симптомов инфекции PRRS у вакцинированных животных, которые после этого экспонируются или заражаются вирулентным изолятом вируса PRRS. Предпочтительно такие клинические симптомы должны предотвращаться путем введения в эффективном количестве иммуногенной композиции или вакцины. В некоторых формах ослабленные изоляты вируса PRRS можно использовать для приготовления вакцины на основе модифицированного живого вируса, в которой ослабленные изоляты применяют в живом состоянии в иммуногенных композициях. В других формах ослабленные изоляты можно убивать или инактивировать до их включения в иммуногенные композиции.




| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНЫ, СОДЕРЖАЩИЕ ПАТОГЕНЫ СВИНЕЙ, ДЛЯ АССОЦИИРОВАННОГО НЕСМЕШАННОГО ПРИМЕНЕНИЯ | 2018 |
|
RU2756767C2 |
| Способ профилактического лечения свиней | 2017 |
|
RU2780233C2 |
| ВАКЦИНА ПРОТИВ ВЫСОКОПАТОГЕННОГО РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ (HP PRRS) | 2009 |
|
RU2561595C2 |
| КОМБИНАЦИЯ ВАКЦИН ДЛЯ ПРОФИЛАКТИЧЕСКОГО ЛЕЧЕНИЯ СВИНЕЙ | 2021 |
|
RU2834834C1 |
| СЕВЕРО-АМЕРИКАНСКИЙ ВИРУС РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ (PRRS) И ЕГО ПРИМЕНЕНИЯ | 2011 |
|
RU2592667C2 |
| ВАКЦИНА ДЛЯ СВИНЕЙ ПРОТИВ PRRS И LAWSONIA INTRACELLULARIS | 2014 |
|
RU2655615C1 |
| КОМБИНИРОВАННАЯ ВАКЦИНА ДЛЯ СВИНЕЙ | 2017 |
|
RU2761453C2 |
| ВАКЦИНА ДЛЯ ВНУТРИКОЖНОГО ПРИМЕНЕНИЯ ПРОТИВ ИНФЕКЦИИ ВИРУСА PCV2 И PRRS | 2017 |
|
RU2746127C2 |
| СХЕМА ВАКЦИНАЦИИ "ПРАЙМ-БУСТ" | 2019 |
|
RU2817873C2 |
| КОМБИНИРОВАННАЯ ВАКЦИНА PCV/MYCOPLASMA HYOPNEUMONIAE/PRRS (PCV/MYCOPLASMA HYOPNEUMONIAE/PRRS COMBINATION VACCINE) | 2013 |
|
RU2644256C2 |
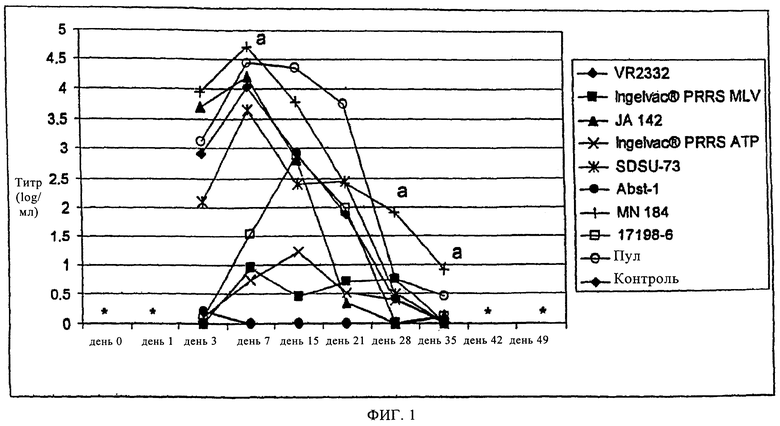
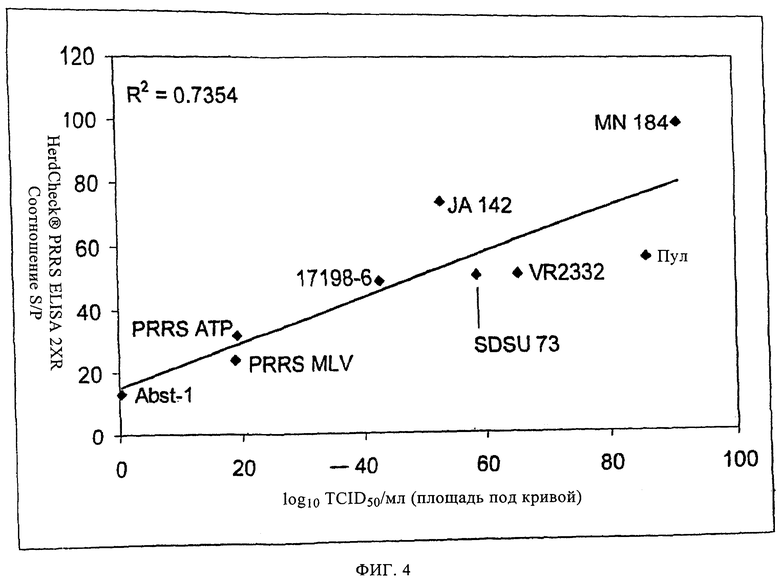
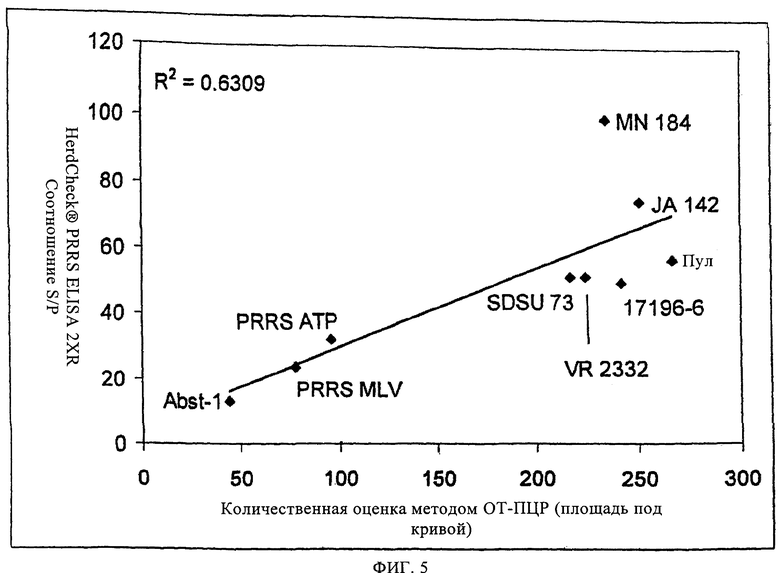
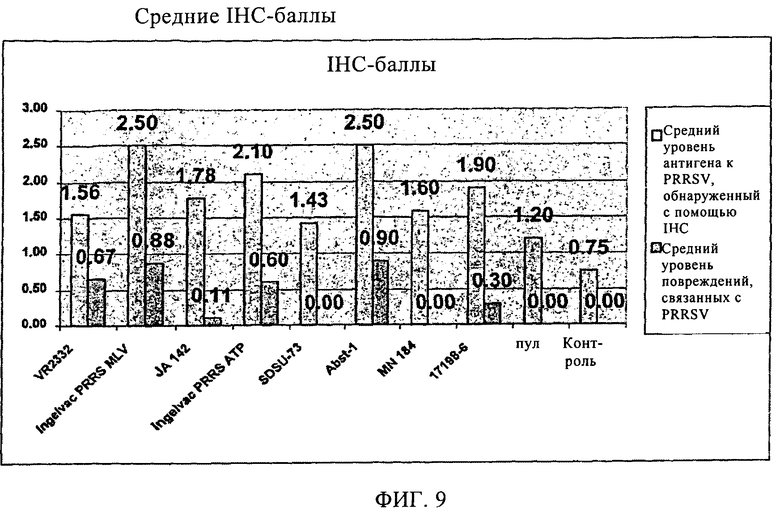
Группа изобретений относится к области вирусологии и включает способ прогнозирования вирулентности изолята вируса PRRS с неизвестной вирулентностью, а также композицию, которая содержит ослабленные формы вируса PRRS, для которых спрогнозирована вирулентность. Способ прогнозирования вирулентности заключается в том, что изолят вируса PRRS с неизвестной вирулентностью в определенном количестве вводят свинье и дают вирусу PRRS реплицироваться в течение периода времени от 3 до 15 дней. В течение этого периода оценивают скорость роста изолята вируса PRRS и/или уровень виремии и эти данные сравнивают с соответствующей скоростью роста и/или уровнем виремии изолята вируса PRRS с известной вирулентностью. Причем изолят вируса PRRS будет обладать высокой вирулентностью, когда скорость роста и/или уровень виремии аналогичны этим показателям изолята с высокой вирулентностью, и изолят вируса PRRS будет обладать низкой вирулентностью, когда скорость роста и/или уровень виремии аналогичны этим показателям изолята с низкой вирулентностью. Способ позволяет прогнозировать вирулентность новых и не охарактеризованных изолятов вирусов PRRS для их дальнейшего применения в иммунологических композициях. 2 н. и 10 з.п. ф-лы, 9 ил., 6 табл.
1. Способ прогнозирования вирулентности изолята вируса PRRS, имеющего неизвестную вирулентность, заключающийся в том, что вводят определенное количество изолята вируса PRRS свинье, не зараженной вирусом PRRS, дают вирусу реплицироваться в организме свиньи в течение периода времени, составляющего от 3 до 15 дней, оценивают скорость роста вируса и/или уровень виремии в течение этого периода и сравнивают скорость роста и/или уровень виремии со скоростью роста и/или уровнем виремии изолята вируса PRRS известной вирулентности для прогнозирования вирулентности изолята вируса PRRS неизвестной вирулентности, причем изолят вируса PRRS будет обладать высокой вирулентностью, когда скорость роста и/или уровень виремии аналогичны этим показателям изолята с высокой вирулентностью и, изолят вируса PRRS будет обладать низкой вирулентностью, когда скорость роста и/или уровень виремии аналогичны этим показателям изолята с низкой вирулентностью.
2. Способ по п.1, в котором период составляет от 3 до 7 дней.
3. Способ по п.1, заключающийся в том, что осуществляют стадию, на которой оценивают уровень виремии в течение указанного периода и сравнивают эту величину с уровнем виремии известного изолята вируса PRRS.
4. Способ по п.1, в котором количество вводимого вируса аналогично количеству, которое может получить животное при экспозиции в естественных условиях.
5. Способ по п.1, в котором вирус PRRS вводят методом, выбранным из группы, включающей оральное, внутриносовое, внутримышечное введение, введение в лимфатический узел, внутрикожное, внутрибрюшинное, подкожное введение и их комбинации.
6. Способ по п.1, в котором скорость роста и/или уровень виремии оценивают в биологическом образце, полученном из организма указанной свиньи.
7. Способ по п.1, в котором виремию оценивают по величине log10 TCID50/мл, с помощью полимеразной цепной реакции с обратной транскриптазой, специфического для вируса PRRS ELISA, специфического для белка вируса PRRS ELISA и их комбинаций.
8. Способ по п.1, заключающийся в том, что дополнительно осуществляют стадию, на которой обследуют свинью в отношении клинических симптомов инфекции PRRS после введения указанного изолята вируса PRRS.
9. Способ по п.8, в котором клинические симптомы включают респираторные, поведенческие симптомы, кашель и их комбинации.
10. Способ по п.1, в котором вводимое количество вируса PRRS представляет собой инокулят объемом вплоть до 5 мл, в котором концентрация вируса составляет вплоть до 5,0 log10 TCID50/мл.
11. Иммуногенная композиция, содержащая ослабленный изолят вируса PRRS и фармакологически совместимый носитель, где ослабленный изолят выбран из группы, включающей Abst-1 и ослабленные формы вируса PRRS, вирулентность которых предсказана с помощью способа по п.1.
12. Композиция по п.11, в которой ослабленный изолят представляет собой Abst-1.
| OPRIESSNIG T | |||
| et al., Comparison of Molecular and Biological Characteristics of a Modified Live Porcine Reproductive and Respiratory Syndrome Virus (PRRSV) Vaccine (Ingelvac PRRS MLV), the Parent Strain of the Vaccine (ATCC VR2332), ATCC VR2385, and Two Recent Field Isolates of PRRSV, Jornal of Virology, 2002 VOL.76, No.23 | |||
| HAYNES JS, HALBUR PG, |
Авторы
Даты
2010-12-27—Публикация
2005-09-21—Подача