Изобретение относится к области биотехнологии, ветеринарии, в частности к снижению содержания бактериальных патогенов в условиях, связанных с производством экологически чистых продуктов питания.
Уровень техники
Известно, что основной причиной заболевания людей пищевыми инфекциями является употребление продуктов питания, контаминированных бактериальными патогенами (клостридиями, кампилобактериями, сальмонеллами и др.), которые обитают в желудочно-кишечном тракте животных, в том числе у бройлерной птицы. Пищевые инфекции, по оценке ВОЗ, уносят ежегодно три миллиона жизней людей и наносят серьезный экономический ущерб даже в развитых странах, например в США ущерб от пищевых инфекций составляет от 6,5 до 34,9 миллиардов долларов (Buzby, J.C. et al., 1997, USDA, Economic Research Service, AER-756). Борьба с носительством бактериальных патогенов у сельскохозяйственных животных является актуальной задачей ветеринарии и медицины.
Для сдерживания роста и колонизации клостридиями, сальмонеллами и кампилобактериями кишечника птицы, а также последующего снижения содержания патогенов в мясе птицы при производстве бройлеров используют микрофлору кишечника здоровой птицы, либо чистые культуры микробных антагонистов - пробиотические штаммы (Nurmi and Rantala, 1973, Nature 241: 210-211; Stern, 1994, Poultry Science 73: 402-407; Патент США 5451400). Наиболее часто используются виды: Lactobacillus species, Bifidobacterium species, Enterococcus faecalis, Enterococcus faecium, Lactococcus lactis, Streptococcus cricetus, Leuconostoc mesenteroides, Pediococcus acidilactici, Sporolactobacillus inulinus, Streptococcus thermophilus. Следует, однако, отметить, что применение живых культур (пробиотиков) для лечения животных часто осложнено необходимостью длительного поддержания культур в жизнеспособном состоянии, использования протекторов для обеспечения хранения культур в замороженном или высушенном состоянии, а также трудностями дозирования культур для получения лечебного эффекта.
Известно, что большинство видов лактобактерий являются продуцентами различных антимикробных соединений, низкомолекулярных пептидов - бактериоцинов (Tagg et al., 1976, Bacteriol. Rev. 40: 722-756; Barefoot and Klaenhammer, 1984, Agents Chemother. 26: 328-334), бактериоциноподобных субстанций или иных химических соединений небелковой природы (Hamdan and Mikolajcik, 1974; Journal of Antibiotics 8: 631-636; Mikolajcik and Hamdan, 1975, Cult. Dairy Prod J 12: 8; Shahani et al., 1976, Cult Dairy Prod J 11: 14-17). С точки зрения практического применения наибольший интерес вызывают бактериоцины.
Бактериоцины - это рибосомально синтезируемые бактериями низкомолекулярные пептиды, обладающие антимикробными свойствами. В соответствии с классификацией Klaenhammer они подразделяются на три класса, из которых наиболее изучены и практически значимы бактериоцины класса 1, типичный представитель - низин, и бактериоцины класса 2 - так называемые педиоциноподобные бактериоцины, типичный представитель - педиоцин. Класс 3 - это большие неустойчивые к высокой температуре белки, например гельветицин J. Пока только один бактериоцин - низин, относящийся к классу 1, нашел широкое применение в индустрии кормов и продовольствия, в отношении других бактериоцинов до сих пор проводятся исследования с целью оценки возможности их практического использования.
В последнее десятилетие внимание исследователей привлечено к лактобактериям из рода Enterococcus как потенциальным продуцентам бактериоцинов, в частности к виду Enterococcus faecium, который имеет широкое практическое применение в производстве ферментированных продуктов питания, кормов и в приготовлении пробиотических препаратов (Franz and Holzapfel, 2004, Hoang-Dung Tran and friends. 6). Некоторые представители рода Enterococcus являются продуцентами бактериоцинов (энтероцинов), которые интенсивно изучаются в последние годы как потенциальные биопрезерванты (Ennahar et al., 2000, FEMS Microbiol. Reviews, 24, 85-106; Eijsink et al., 2002, Antonie van Leeuwenhoek, 81, 639-654).
Энтероцины, произведенные штаммами рода Enterococcus, ингибируют рост преимущественно грамположительных бактерий, включая представителей родов Listeria и Lactobacillus. Только некоторые из исследованных энтероцинов были способны ингибировать рост грамотрицательных бактерий. Так, например, энтероцины, синтезированные штаммами Enterococcus mundtii 39 и 115 (Ferreira et al., 2007, Brazilian Archives of Biology and Technology, Vol.50, n.2: pp.249-258), энтероцин 012, продуцируемый штаммом Enterococcus gallinarum (Jennes et al., 2000, J. of Appl. Microbiol., 88, 349-357), подавляли рост Salmonella Enteriditis. Энтероцин A, продуцируемый штаммом Enterococcus faecium EK13, ингибировал рост Salmonella enterica Dusseldorf, но не влиял на рост E.coli (Laukova et al., 2004, Vet. Med. - Czech, 49, (2): 47-51). Ограниченный спектр антимикробного действия известных энтероцинов, таким образом, является основным недостатком, лимитирующим возможности их практического применения.
Известны попытки повышения антибактериальной эффективности бактериоцинов лактобактерий в отношении грамотрицательных патогенов путем сочетанного воздействия энтероцитов и химических реагентов или электрического поля (Molinos et al., 2008, Food and Chemical Toxicology 46, 2912-2921). Такой подход, однако, усложняет и удорожает методику использования бактериоцинов, и он далеко не всегда бесспорен. Следовательно, поиск бактериоцинов, которые могли бы обладать сопоставимой антимикробной активностью как в отношении грамположительных, так и грамотрицательных бактериальных патогенов является актуальной задачей.
Несмотря на то что энтероциты способны ингибировать рост большинства известных видов грамположительных микроорганизмов, их активность в отношении спорообразующих патогенов обычно не высока. Например, бактериоцины - энтероцин A и энтероцин B, продуцируемые штаммом Enterococcus faecium Т136, не подавляли рост Clostridium perfringens и Clostridium botulinum при использовании даже относительно высоких концентраций, соответственно 3,75 мкг/мл и 5 мкг/мл (Casaus et al., Microbiology 1997, 143, 2287-2294). Как известно, Clostridium perfringens является возбудителем некротического энтерита у цыплят и этот патоген является причиной массового падежа птицы в условиях ее индустриального производства. Он также служит причиной пищевой инфекции и газовой гангрены у человека. Борьба с C.perfringens является важным направлением в области ветеринарии и медицины и поэтому поиск бактериоцинов, которые могут быть использованы вместо антибиотиков и химиопрепаратов, является важной задачей.
Известны новые штаммы рода Enterococcus, которые выделены из птиц и которые производят новые бактериоцины, способные ограничивать рост и развитие бактериальных патогенов грамотрицательной и грамположительной природы. Так, штамм Enterococcus faecalis NRRL B-30645 продуцирует бактериоцин энтероцин LWP21, который состоит из фракции 1 (мол. масса 2786 Да, pI 5.6) и фракции 2 (мол. масса 4986 Да, pI 8.4 (пат. США №7132102).
Известен также штамм Enterococcus durans (NRRL В-30511), который продуцирует бактериоцин LWP26 с мол. массой 3231 Да, pI 7.8 (патент США №7132102). При оценке антимикробной активности с использованием тестовых штаммов C.jejuni ATTC 11168, S.Enteritidis и E.coli 0157:Н7 значимо активными оказались только фракция 2 бактериоцина LWP 21 и бактериоцин LWP 26. Фракция 1 бактериоцина LWP 21 антагонистической активности против указанных тестовых штаммов не проявила (патент США №7132102). Следует отметить низкий уровень активности этих бактериоцинов в отношении C.perfringens, а также наличие признака гемолитичности у указанных штаммов-продуцентов, что ограничивает возможности их практического использования.
Указанные бактериоцины были получены путем глубинного культивирования штаммов-продуцентов, без применения дополнительных приемов, например индукторов или активаторов синтеза бактериоцина (патент США №7132102).
Наиболее близким к предлагаемому изобретению является штамм Enterococcus faecium NRRLB-30746, продуцирующий бактериоцин - энтероцин E50-52, имеющий молекулярную массу - 3932 Да и pI 7.8 (US Patent 20060223161).
В отличие от известных энтероцинов бактериоцин E50-52 проявляет in vitro высокий уровень антимикробной активности по отношению к патогенам, в том числе к их грамотрицательным представителям - Campylobacter и Salmonella spp. Минимальные подавляющие концентрации (МПК) этого бактериоцина для некоторых грамположительных и грамотрицательных патогенов варьируют от 0.1 мкг/мл до 0.05 мкг/мл, но активность этого бактериоцина в отношении патогенных C.perfringens невысока (выше 5,0 мкг/мл). Следует отметить отсутствие данных об уровне антимикробной активности этого бактериоцина in vivo, например, в отношении инфекций, вызванных у птиц C.perfringens, а также Campylobacter и Salmonella spp.
Таким образом, указанные бактериоцины недостаточно эффективны как по широте спектра действия, так и по уровню ингибирования бактериальных патогенов, особенно C.perfringens, и поэтому поиск новых еще более эффективных бактериоцинов является актуальным.
Известен штамм индуктор Lactococcus lactis NNRL В-30744, увеличивающий продукцию бактериоцина E50-52 штаммом-продуцентом Enterococcus faecium NRRLB-30746. Однако установлено, что этот штамм-индуктор может быть использован только для получения бактериоцина E50-52, и он не активен в сочетании с другими штаммами-продуцентами (патент США №7534904).
Известно также, что выход бактериоцина при совместном культивировании штамма продуцента и штамма индуктора дополнительно увеличивается, если в среду культивирования в определенное время добавляется сигнальный пептид (патент США №7534904). Так, для получения больших количеств бактериоцина E50-52, продуцируемого штаммом Enterococcus faecium NRRLB-30746, в присутствии штамма индуктора Lactococcus lactis NNRL В-30744 в среду культивирования на 2-м часу выращивания добавляли фракцию пептида LWP50-52, имеющего мол. вес. 3,1 кДа и pI 8,1. Эта фракция, обозначенная как сигнальный пептид, была эффективна только в отношении штамма-продуцента - Enterococcus faecium NRRLB-30746 и не могла быть использована для активации синтеза бактериоцинов у других штаммов-продуцентов (патент США №7534904).
Известен способ получения бактериоцина E50-52, который заключается в совместном выращивании в среде бруцелло-бульона штамма-продуцента Enterococcus faecium NRRLB-30746 и штамма-индуктора Lactococcus lactis NNRL В-30744, при добавлении на 2 часу выращивания культур сигнального пептида LWP50-52, имеющего мол. вес. 3,1 кДа и pI 8,1, с последующим сбором КЖ через 12 часов и центрифугированием для получения супернатанта и осадка клеток. С целью более полного сбора бактериоцина клеточный осадок на этапе центрифугирования смешивают с элюирующим раствором, который изготавливается из фосфатного буфера, содержащего 0,7% хлористого натрия. Суспензия перемешивается и инкубируется с последующим центрифугированием для удаления клеток, а бактериоцин из полученного супернатанта выделяется сначала с помощью хроматографии гидрофобного взаимодействия, а затем ионообменной хроматографии на Superose SP FF (патент США №7534904).
Однако этот способ может быть реализован только для получения бактериоцина E50-52, так как требует высокоспецифичных штамма-продуцента, штамма-индуктора, сигнального пептида и определенной последовательности и времени осуществления процедур на этапах получения, выделения и очистки.
Задачей настоящего изобретения является получение нового штамма-продуцента бактериоцина и бактериоцина, обладающего широким спектром действия, более высокой бактерицидной активностью, потенциально пригодного для устранения бактериальных патогенов в технологии производства продуктов питания вместо антибиотиков и хлорсодержащих препаратов.
Сущность изобретения
Поставленная задача решается тем, что предложен штамм Enterococcus faecium LVP1073 - продуцент бактериоцина Е1073 против бактериальных патогенов.
Предложен бактериоцин E1073 против бактериальных патогенов, состоящий из 34 аминокислот с мол. весом 3256 Да, изоэлектрическая точка pI 8.2, имеющий структурную формулу TSYVYGNGVKENIAGEVRKGWGSGVAWDVDWKLA,
где имеется общий для бактериоцинов класса 2 мотив YGNGV и наличие фрагмента WG, отстоящего от начала консенсуса на 15 аминокислот.
Предложен штамм Lactobacillus plantarum 1 LVP7, который является индуктором синтеза бактериоцина E1073.
Предложен сигнальный пептид СП1073 - регулятор синтеза бактериоцина E1073. Сигнальный пептид специфичен, выделен из среды культивирования штамма продуцента бактериоцина E.faecium LVP 1073, молекулярная масса этого пептида, определенная с помощью гель-фильтрации на смоле Superosa 12H/R, составляет 2,1 кДа, изоэлектрическая точка pI пептида равна 8.1.
Предложен способ получения бактериоцина E1073, включающий совместное культивирование на среде МРС бульон (de Man, Rogosa, Sharpe - MRS-broth, HiMedia, Laboratories Limited, India) штамма-продуцента E.faecium LVP 1073 и штамма индуктора - Lactobacillus plantarum 1 LVP7 при добавлении на 10 часу стадии выращивания культур сигнального пептида СП1073. Очистку активной пептидной фракции из бесклеточного супернатанта КЖ проводят в два этапа. На первом - очистку пептида проводят с помощью ионообменной хроматографии, используя смолу SP-Sepharose FF, на втором - с помощью хроматографии гидрофобного взаимодействия на смоле Octyl-Sepharose 4FF (Amersham Pharmacta Biotech, Швеция). Оба этапа хроматографии выполняли на приборе ACTA FPLC (Amersham Pharmacta Biotech, Швеция). Количество полученного бактериоцина в элюате оценивают спектрофотометрически по поглощению на 215 нм.
Штамм-продуцент бактериоцина Enterococcus faecium LVP 1073 и штамм-индуктор синтеза бактериоцина E1073 Lactobacillus plantarum 1 LVP7 депонированы в коллекции микроорганизмов Государственного научного центра прикладной микробиологии и биотехнологии (ГНЦ ПМБ) и имеют коллекционные номера В-5736 и В-5943, соответственно.
Штамм Enterococcus faecium (E. faecium) LVP 1073 выделяют из содержимого слепого отростка здорового взрослого бройлера.
Штамм Enterococcus faecium LVP 1073 - продуцент бактериоцина E1073 характеризуется следующими признаками.
Культурально-морфологические признаки.
Штамм представляет собой грамположительные неподвижные (в полужидком МРС агаре культура растет в пробирке строго по ходу укола) кокки диаметром 0,5 мкм, расположенные в мазках одиночно, по два или в виде групп. На чашках с МРС агаром через 24 ч роста при 37°C штамм образует округлой формы с ровными краями серовато-белые, блестящие, выпуклые с гладкой поверхностью колонии диаметром ~0,5 мм, через 48 ч роста диаметр колонии достигает 1 мм. Штамм хорошо растет на бруцелло-бульоне и бруцелло-агаре (HiMedia, India), на средах с гидролизатом рыбной муки (ГНЦ ПМБ, Россия). Оптимальный показатель pH среды для роста штамма - 6,5.
Биохимические признаки.
Штамм растет в аэробных, микроаэрофильных и анаэробных условиях при температуре 10 и 45 градусов, не растет при 50 градусах, на средах с 0,04% теллурита, с 0,1% раствором метиленового синего, не образует желтого пигмента и каталазы, гидролизует аргинин и гиппурат, не обладает гемолитической активностью, не образуют кислоты при расщеплении ксилозы, рамнозы, раффинозы и глицерина, образует кислоту из сахарозы, лактозы.
Антагонистическая активность.
Штамм проявляет in vitro выраженную антагонистическую активность против многих грамположительных и грамотрицательных патогенов, включая трех индикаторных штаммов: грамположительных спороформирующих клостридий (C.perfringens), грамотрицательных кампилобактерий (C.jejuni) и сальмонелл (S.Enteritidis 237).
Тинкториальные признаки.
Клетки штамма окрашиваются по Грамму положительно, хорошо окрашиваются метиленовой синью и основным фуксином.
Пример 1. Получение штамма Enterococcus faecium LVP 1073.
Штамм Enterococcus faecium (E.faecium) LVP 1073 выделяют из содержимого слепой кишки 42-дневного здорового бройлера по следующей схеме.
Приблизительно 5 г содержимого слепого отростка переносят в 10 мл стерильного физиологического раствора и полученную суспензию отстаивают при комнатной температуре в течение 15 мин. Надосадочную жидкость (0,1 мл) высевают на пластинки МРС агара (de Man, Rogosa, Sharpe - MRS-agar M641, HiMedia; Laboratories Limited, India), разлитого в чашки Петри, и посевы культивируют в течение 24 ч при 37°C в микроаэрофильных условиях (в эксикаторе в присутствии газа аргона). Среди выросших на МРС агаре колоний отбирают 10 изолятов, которые вновь культивируют на этой же среде при тех же условиях для накопления биомассы. После проверки выросших культур на чистоту (микроскопией мазков, окрашенных по Граму) у них изучают антагонистическую активность против индикаторных штаммов Clostridium perfringens (C.perfringens) АТСС3624, Campylobacter jejuni (C.jejuni) ATCC11168 и Salmonella Enteritidis 237 (S.Enteritidis 237). Для этого из культур изолятов готовят бактериальные суспензии в стерильном физиологическом растворе до концентрации ~1×109 микробных клеток (м.к.) (по Мак Фарланду) и засевают (0,1 мл) их сплошным газоном на пластинки МРС агара в чашках Петри.
После выращивания в течение 24 ч при 37°C из чашки с газоном исследуемого изолята стерильно вырезают блок диаметром 0,5 см и переносят его на свежезасеянную индикаторным штаммом в виде сплошного газона соответствующую питательную среду: для C.perfringens - на среду с яичным желтком на основе Perfringens Agar Base (OPSP) M579 (HiMedia), для C.jejuni - на кампилобакагар с 5% бараньей крови (HiMedia) и для S.Enteritidis 237 - на питательный агар, приготовленный на основе гидролизата рыбной муки (ГНЦ ПМБ, Россия). Культуру С.perfringens ATCC3624 выращивают в анаэробных условиях (N2 - 85%, CO2 - 15%) при 37°C, C.jejuni АТСС11168 - в микроаэрофильных условиях (N2 - 85%, CO2 - 10%, O2 - 5%) при 42°C, S.Enteritidis 237 - в аэробных условиях при 37°C. Через сутки роста на газонах всех трех индикаторных штаммов вокруг блока изолята №1073 наблюдают выраженную зону задержки роста бактерий: радиус прозрачной с четко ограниченными краями негативной зоны вокруг блока составляет 2-3 мм.
У изолята №1073, проявившего выраженную антагонистическую активность в отношении трех индикаторных штаммов, включающих как грамположительные (C.perfringens), так и грамотрицательные (C.jejuni, S.Enteritidis 237) микроорганизмы, изучают тинкториальные, морфологические, культуральные и биохимические свойства.
Изолят №1073 представляет из себя грамположительные неподвижные (в полужидком МРС агаре культура растет в пробирке строго по ходу укола) кокки диаметром 0,5 мкм, расположенные в мазках одиночно, по два или в виде групп. На пластинках с МРС агаром через 24 ч роста при 37°C изолят образует округлой формы с ровными краями серовато-белые, блестящие, выпуклые с гладкой поверхностью колонии диаметром ~0,5 мм, через 48 ч роста диаметр колонии достигает 1 мм. При выращивании на МРС бульоне культура вызывает равномерное помутнение по всему объему среды с образованием на дне пробирки осадка, легко разбивающегося при встряхивании.
Изолят №1073 хорошо растет на бруцелло-бульоне и бруцелло-агаре (HiMedia), на средах с гидролизатом рыбной муки (ГНЦ ПМБ) в микроаэрофильных условиях, в аэробных и анаэробных условиях - рост микроорганизма несколько слабее. Оптимальная pH среды для роста изолята - 6,5.
На МРС агаре с 5% бараньих эритроцитов через сутки роста изолята вокруг колоний зона гемолиза не образуется.
Биохимические свойства изолята №1073, изученные с помощью системы API 50 CHL (bioMerieux, Франция) для грамположительных палочек и системы EN-COCCUStest (Lachema, Чехия) для грамположительных кокков и соответствующих программ расшифровки данных, представлены в табл.1.
При определении чувствительности изолята №1073 к антибиотикам (с помощью диско-диффузионного метода по Keurby-Bauer) отмечают, что культура является чувствительной к ампициллину, карбенициллину, имипенему и меропинему, слабо чувствительной - к бензилпеницеллину, пефлоксацину, рифампицину, цефалотину, цефоперазону, цефотоксиму и цефтриаксону. Изолят устойчив к антибиотикам аминогликозидной группы, тетрациклинам, левомицетину, ко многим антибиотикам фторхинолонового и цефалоспоринового ряда, а также к макролидам.
Изолят хорошо переносит режим лиофильного высушивания и в лиофилизированном виде при температуре 0-(+4°C) сохраняется больше года. Для восстановления из лиофильно высушенного состояния и последующего размножения изолята используют МРС агар и МРС бульон (HiMedia).
Таким образом, на основании данных о морфологических, тинкториальных, культуральных, биохимических и некоторых физиологических свойств изолята №1073 в соответствии с Определителем бактерий Берджи под редакцией Хулта Дж., Крига Н., Снита П. и др. (2001) данная культура принадлежит к роду Enterococcus, виду Enterococcus faecium.
Пример 2. Определение способности штамма E.faecium LVP 1073 продуцировать бактериоцин E1073.
Качалочную колбу с 0,3 л МРС бульон (HiMedia) засевают 1,0 мл бактериальной взвеси односуточной агаровой культуры штамма E.faecium LVP 1073, содержащей ~1×109 м.к. (по Мак Фарланду), и посевы выращивают в термостатируемой качалке (130 об/мин) при 37°C в течение 24 ч. Спустя указанный срок к культуральной жидкости (КЖ) штамма, имеющей оптическую плотность (ОП540) ~0,55 единиц и pH - 3,8, добавляют лаурилсаркозинат натрия (ЛС) до конечной концентрации 0,02% и смесь инкубируют при комнатной температуре в течение 1,5 ч. Далее из КЖ берут аликвоту объемом 20 мл и центрифугируют ее при 10000 g в течение 10 мин при +4°C. Полученный супернатант подвергают гель-фильтрации на колонке с Superose 12НK 50 мл геля (стартовый буфер: 10 мМ KH2PO4, pH 7; скорость потока - 2,1 мл/мин) на хроматографе ACTA FPLC (Amersham Pharmacta Biotech, Швеция) и отбирают фракцию пептидов с молекулярной массой (мол. массой) ~3,4 кДа. Анализ фракций (мол. масса, концентрация белка при длине волны (λ) 215 нм) проводят, используя программу UNICORN 4.11 (Amersham Pharmacta Biotech, Швеция).
Выделенная фракция низкомолекулярных пептидов обладает антимикробной активностью против C.perfringens АТСС 3624, C.jejuni NCTC11168, S.Enteritidis 237 и Listeria monocytogenes: на месте нанесения на свежезасеянные газоны указанных культур 10 мкл пептидов образуется негативная зона роста индикаторного штамма диаметром ~20 мм.
Дальнейшее выделение активного чистого препарата бактериоцина осуществляют в два этапа. На первом этапе очистку пептида проводят с помощью ионной хроматографии на SP-Sepharose FF (Amersham Pharmacta Biotech, Швеция) (колонка ХК 16/30, 20 мл геля; стартовый буфер: 15 мМ TRIS HCl, 20 мM Na2HPO4, 0,1 M KH2PO4, pH 6,5; буфер для элюции: 0,1-0,9 М KH2PO4, pH 6,5; скорость потока - 10 мл/мин), на втором - с помощью хроматографии гидрофобного взаимодействия на Octyl-Sepharose 4FF (колонка XK 16/30, 20 мл геля; стартовый буфер: 0,6 M Na2SO4, 1.2 М K2HPO4, pH 7; буфер для элюции: 1.2-0.2 M K2HPO4, pH 7; скорость потока - 5.5 мл/мин). Оба этапа хроматографии выполняют на приборе ACTA FPLC (Amersham).
Экспериментальные данные по хроматографической очистке бактериоцина E1073 представлены в табл.2.
Как следует из данных таблицы, полученный после хроматографической очистки образец пептида обладает высокой активностью (39430 УЕ/мг белка) против C.perfringens ATCC3624.
Пример 3. Получение бактериоцина и продуктивность штамма Е. faecium LVP1073 при его культивировании в МРС бульоне.
Получение бактериоцина Е1073 проводят в 26 качалочных колбах, содержащих по 0,3 л среды 5% МРС-бульона (HiMedia). Каждую колбу со средой засевают 1,0 мл бактериальной суспензии односуточной агаровой культуры штамма Enterococcus faecium LVP 1073, содержащей ~109 микробных клеток (по Мак Фарланду). Выращивание посевов проводят в термостатируемой качалке (130 об/мин) при 37°C в течение 24 часов. После чего КЖ из всех колб собирают в одну емкость и добавляют в нее лаурилсаркозинат натрия (ЛС) до конечной концентрации 0,02% и инкубируют при комнатной температуре в течение 1,5 ч. После чего КЖ разливают в стаканы объемом 500 мл и центрифугируют (10000 g, 10 мин при +4°C). Бесклеточный супернатант из всех колб сливают в одну емкость, а осадок бактерий отбрасывают.
Полученный супернатант используют для выделения бактериоцинов двухэтапным методом.
Этап первый. Супернатант в объеме 7,8 л распределяют по 18 центрифужным стаканам и добавляют в каждый из них по 1 мл SP-Sepharose FF, уравновешенной 25 mM Na2HPO4, pH 5,2. Содержимое стаканов перемешивают, инкубируют при комнатной температуре в течение 1,5 ч и центрифугируют (10000 g, 10 мин при +4°C). Супернатант удаляют, а осадок дважды промывают 0,3 л буферного раствора (10 мM Na2HPO4, 15 мM KH2PO4, рН 4,5) и центрифугируют (10000 g, 10 мин при +4°C). К полученному осадку добавляют по 40 мл элюирующего буфера (10 мM TRIS HCl, 15 мM Na2HPO4, 0,2% NaCl, pH 4,5) и полученную суспензию инкубируют в течение 1,5 ч при комнатной температуре. После чего из суспензии путем центрифугирования (10000 g, 10 мин при +4°C) удаляют осадок, а супернатант используют для дальнейшей очистки по схеме этапа 2.
Этап второй. Супернатант (700 мл) разливают в два центрифужных стакана и в каждый добавляют по 5,7 мл Octyl-Sepharose FF, уравновешенной буфером (40 мM K2HPO4, pH 4,5). Взвесь перемешивают, инкубируют при комнатной температуре в течение 1,5 ч, затем центрифугируют (10000 g, 10 мин при +4°C). Супернатант удаляют, а осадок дважды промывают буфером (20 мM Na2HPO4, 40 mM K2HPO4, pH 4,5), используя для этого центрифугирование (10000 g, 10 мин при +4°C). После второй промывки к осадку Octyl-Sepharose FF добавляют по 125 мл элюирующего буфера (25 мM TRIS HCl, 15 мM K2HPO4, pH 4,5) и суспензию инкубируют 2,5 ч при комнатной температуре, а затем - в холодильнике в течение 17 ч. Далее из суспензии с помощью центрифугирования (10000 g, 10 мин при +4°C) удаляют осадок, а очищенный элюат (250 мл) собирают и определяют в нем концентрацию пептида по поглощению на 215 нм на хроматографе ACTA FPLC. Концентрация бактериоцина, по данным измерения, составляет 1,3 мг/мл элюата. Следовательно, в 250 мл элюата, который является конечным продуктом переработки 7,8 л КЖ, содержится 325 мг бактериоцина. Следовательно, выход бактериоцина E1073 с 1 л КЖ в этом опыте составляет 41,6 мг.
Выделенный и очищенный образец бактериоцина E1073 используют для изучения его физико-химических и биологических свойств.
Пример 4. Физико-химические и биологические свойства бактериоцина E1073.
У выделенного по примеру 3 образца бактериоцина E1073 изучают первичную аминокислотную последовательность, молекулярную массу, pI и другие свойства.
Первичную аминокислотную последовательность пептида определяют деградацией по Edman с использованием автоматического секвенатора 491cLC (Applied Biosystems, США), молекулярную массу - методом масспектрометрии с использованием Voyager-DERP (Perkin-Elmer, США) MALDI-TOF системы лазерной десорбционной ионизации в присутствии матрицы 2 - цианогидроксицинамиковой кислоты. Изоэлектрическую точку пептида определяют с помощью изоэлектрофокусировки. Результаты определения трех указанных параметров антимикробного пептида E1073 указаны в табл.3.
Как следует из данных таблицы, бактериоцин E1073 относится к катионным пептидам (pI 8,2) и имеет мол. массу 3256 Да. Он состоит из 34 аминокислот и в своем составе содержит консервативную последовательность YGNGV, характерную для класса 2а бактериоцинов, продуцируемых молочнокислыми бактериями (по классификации Klaenhammer, 1993).
В табл.4 представлены сравнительные данные физико-химических свойств энтероцинов E50-52 (прототип) и E1073.

Из представленных в таблице данных следует, что энтероцин E1073 является новым бактериоцином, содержащим консервативную последовательность YGNGV и не имеющим полной гомологии с энтероцином E50-52.
Антимикробную активность бактериоцина E1073 изучают путем определения минимальных подавляющих концентраций (МПК) этого пептида в отношении C.perfringens, выделенных от больных и павших от некротического энтерита бройлерных цыплят, а также других грамположительных и грамотрицательных патогенов человека и животных, в том числе патогенов, резистентных к антибиотикам.
МПК бактериоцина E1073 определяют методом серийных разведений препарата в плотной питательной среде Mueller Hinton Agar (М 173) производства HiMedia.
В качестве тестовых культур используют суспензии односуточных агаровых культур с оптической плотностью, соответствующей стандарту 0,5 по Мак Фарланду, разведенные в 10 раз (~107 КОЕ/мл). Полученные суспензии переносят в плашку для микротитрования и с помощью инокулятора наносят на поверхность питательной среды, в которую предварительно добавляют различные концентрации бактериоцинов.
Посевы инкубируют при 37°C в течение 24 ч в анаэробных условиях (для C.perfringens), в микроаэрофильных условиях (для C.jejuni) и в аэробных - для всех остальных патогенов. За МПК принимают концентрацию, вызывающую полное ингибирование видимого роста микроорганизмов.
Результаты исследований представлены в табл.4 и 5.
Как следует из данных табл.4 и 5, бактериоцин E1073 имеет широкий спектр антимикробного действия и высокий уровень активности против многих видов грамотрицательных и грамположительных патогенов, в том числе возбудителей пищевой инфекции, таких как Salmonella spp., C.jejuni и C.perfringens, Listeria monocytogenes, E.coli O157 H7, Staphylococcus aureus, бактерионосителями которых является бройлерная птица.
Бактериоцин E1073 устойчив к высокой температуре: он полностью сохраняет свою антимикробную активность против индикаторных штаммов после кипячения в течение 30 мин и автоклавирования при 0,5 атм в течение 20 мин.
Бактериоцин E1073 инактивируется под действием протеаз, но не лизоцима и липаз (табл.6). Для определения действия протеаз на бактериоцин к раствору пептида с концентрацией 0,5 мкг/мл добавляют ферменты в концентрации 100 ед./мл в TRIS-HCl буфере, pH 8,0 и инкубируют 4 ч при 37°C. В качестве контроля к бактериоцину добавляют TRIS-HCl буфер, pH 8,0. Через указанное время смесь титруют и проверяют ее активность спот-методом на штаммах C.perfringens ATCC3624, C.jejuni NCTC 11168 и S.Enteritidis 237.
Антимикробная активность бактериоцина E1073 проявляется в широком диапазоне pH (табл.7).
Для проведения лабораторных исследований, включая опыты на животных (птице), очищенный бактериоцин Е1073 используют в виде элюата, который содержит 25 mM TRIS HCl, 15 mM K2HPO4 и бактериоцин E1073 в количестве, соответствующем его содержанию в культуральной жидкости. Элюат используется либо в жидком виде, либо (после высушивания) в виде сухого порошка, разводимого в воде до концентрации, обеспечивающей целевую эффективность. Обычно концентрация бактериоцина в таком растворе доводится до 5 мг/мл.
Пример 5. Получение штамма Lactobacillus plantarum 1 LVP7 - индуктора синтеза бактериоцина E1073.
Штамм Lactobacillus plantarum 1 LVP7 - индуктор синтеза бактериоцина E1073 - выделен из здоровых бройлерных цыплят 14-28-дневного возраста и характеризуется следующими признаками.
Культурально-морфологические признаки.
Клетки штамма представляют собой грамположительные неподвижные палочки длиной до 1 мкм, расположенные в мазке в основном одиночно. На МРС агаре при 37°C после 24 ч роста образуют выпуклые серо-белого цвета с округлыми краями блестящие колонии величиной 1-1,5 мм в диаметре, через 48 ч их диаметр может увеличиться до 2-2,5 мм. Изолят хорошо растет в анаэробных условиях, хуже - в аэробных. При выращивании штамма на МРС бульоне через 24 ч отмечают равномерное помутнение среды с образованием осадка, хорошо разбивающегося при встряхивании.
Биохимические признаки.
Культура штамма сбраживает с образованием кислот следующие углеводы: L-арабинозу, рибозу, галактозу, глюкозу, фруктозу, маннозу, маннитол, сорбитол, N-ацетилглюкозамин, амигдалин, арбутин, эскулин, салицин, целлобиозу, мальтозу, лактозу, мелибиозу, сахарозу, трегалозу, мелецитозу, рафинозу, гентабиозу и глюконат.
Антагонистическая активность
Клетки штамма не проявляют антагонистической активности в отношении 20 исследованных штаммов лактобактерий-продуцентов бактериоцинов, а также не влияют на рост и развитие штамма E.faecium LVP 1073 - продуцента бактериоцина E1073.
Тинкториальные признаки.
Клетки штамма окрашиваются по Грамму положительно, хорошо окрашиваются метиленовой синью и основным фуксином.
Поиски штамма-индуктора синтеза бактериоцина E1073 проводят среди изолятов лактобактерий, выделенных от здоровых бройлерных цыплят 14-28-дневного возраста, обозначенных как №№7, 13, 32, 320, 405 и 1218-1. Для этого семь качалочных колб с 0,3 л 5% МРС бульона засевают 1,0 мл односуточной агаровой культуры штамма E.faecium LVP 1073, содержащей ~1×109 м.к. (по Мак Фарланду). В эти же колбы (кроме седьмой, контрольной) вносят по 1 мл взвеси односуточной агаровой культуры испытуемых изолятов лактобактерий (по одному изоляту в колбу) и посевы выращивают в термостатируемой качалке (130 об/мин) при 37°C в течение 24 ч. После указанного срока из КЖ колб центрифугированием (10000 g, 10 мин при +4°C) удаляют клетки, а из полученных супернатантов выделяют бактериоцин E1073, используя ионообменную хроматографию и хроматографию гидрофобного взаимодействия, как это описано в примере 3.
Концентрацию бактериоцина E1073 в образцах измеряют спектрофотометрически (215 нм), используя хроматограф ACTA FPLC.
В табл.8 представлены результаты влияния различных изолятов лактобацилл на синтез бактериоцина Е1073 штаммом-продуцентом.
Данные, представленные в таблице, свидетельствуют о том, что выращивание штамма-продуцента с изолятом №7 увеличивает накопление бактериоцина E1073 в среде культивирования в 2,2 раза. Культура изолята №7 была выбрана в качестве штамма-индуктора и идентифицирована до вида.
Клетки изолята №7 представляют собой грамположительные неподвижные (рост культуры в полужидком агаре происходит строго по уколу бактериологической петлей) палочки длиной до 1 мкм, расположенные в мазке в основном одиночно. На МРС агаре при 37°C после 24 ч роста образуют выпуклые серо-белого цвета с округлыми краями блестящие колонии величиной 1-1,5 мм в диаметре, через 48 ч их диаметр может увеличиться до 2-2,5 мм. Колонии легко снимаются со среды роста бактериологической петлей. На МРС бульоне через 24 ч роста отмечают равномерное помутнение среды с образованием осадка, хорошо разбивающегося при встряхивании. Изолят хорошо растет в анаэробных условиях, хуже - в аэробных.
Видовую принадлежность изолята №7 определяют с помощью набора биохимических тестов системы API 50 CHL (bioMerieux, Франция), предназначенной для идентификации грамположительных палочек и программного продукта для расшифровки данных, полученных с помощью этой системы (Version 4.0 bioMerieux, Франция). Культура изолята №7 сбраживает с образованием кислот следующие углеводы: L-арабинозу, рибозу, галактозу, глюкозу, фруктозу, маннозу, маннитол, сорбитол, N-ацетилглюкозамин, амигдалин, арбутин, эскулин, салицин, целлобиозу, мальтозу, лактозу, мелибиозу, сахарозу, трегалозу, мелецитозу, рафинозу, гентабиозу и глюконат. На основании указанных биохимических свойств и в соответствии с Определителем бактерий Берджи под редакцией Хулта Дж., Крига Н., Снита П. и др. (2001) культура изолята №7 с вероятностью 98,7% относится к виду Lactobacillus plantarum (L.plantarum), и далее он обозначен как штамм L.plantarum LVP7.
При определении чувствительности штамма L.plantarum 1 LVP7 к антибиотикам (с помощью диско-диффузионного метода Keurby-Bauer) культура оказалась чувствительной к имипенему, меропенему, кларитромицину и рокситромицину, слабо чувствительной - к азитромицину, ампициллину, клиндамицину, олеандомицину, эритромицину и рифампицину. Штамм устойчив к антибиотикам аминогликозидной группы, тетрациклинам, цефалоспоринам, фторхинолонам, левомицетину.
Штамм L.plantarum 1 LVP7 хорошо переносит режим лиофильного высушивания и в высушенном состоянии при температуре 0-(+4°C) сохраняется больше года. Для восстановления из лиофильно высушенного состояния и последующего размножения штамма используют МРС агар и МРС бульон (HiMedia).
Пример 6. Сигнальный пептид СП1073, его выделение и влияние на синтез бактериоцина E1073.
Выделение сигнального пептида проводят следующим образом: качалочную колбу с 0,3 л 5% МРС бульона (HiMedia) засевают 1,0 мл бактериальной взвеси односуточной агаровой культуры штамма E.faecium LVP 1073, содержащей ~1×109 микробных клеток (по Мак Фарланду), и посевы выращивают в течение 6 ч при 37°С в термостатируемой качалке при скорости вращения платформы 130 об/мин. Спустя указанный срок КЖ из колбы центрифугируют (10000 g, 10 мин) при +4°С, клетки отбрасывают, а в супернатант добавляют (NH4)2SO4 до 50% насыщения. Смесь инкубируют в течение 24 ч при +4°С.
Образовавшийся осадок отделяют центрифугированием (10000 g, 10 мин) и растворяют в минимальном объеме 10 mM TRIS-HCl буфера, pH 5.6. Полученный образец подвергают гель-фильтрации на колонке с 50 мл геля Superose 12H/R (стартовый буфер: 10 мM K2HPO4, pH 7; скорость потока - 2,1 мл/мин) на хроматографе ACTA FPLC и отбирают фракцию с молекулярной массой 2,1 кДа. Изоэлектрическая точка пептида по данным изоэлектрофокусирования составляет 8,1. Пептид обладает слабой антагонистической активностью против C.perfringens (~200 AE/мл).
У полученного образца пептида изучают способность индуцировать синтез бактериоцина E1073. Для этого 16 качалочных колб с 0,3 л 5% МРС бульона (HiMedia) засевают 1,0 мл односуточной агаровой культуры штамма E.faecium LVP 1073 (продуцент) и 1,0 мл односуточной агаровой культуры штамма Lactobacillus plantarum LVP7 (индуктор), содержащей ~1×109 м.к. (по Мак Фарланду). Посевы выращивают в термостатируемой качалке (130 об/мин) при 37°C в течение 24 ч.
В процессе выращивания микроорганизмов на 6, 8, 10 и 12 ч роста в первой, второй и третий ряд колб (по четыре колбы в ряду) добавляют 2,1 кДа пептид до конечной концентрации 0.1, 0.01 и 0.001 мкг/мл соответственно. В четвертый ряд колб (контрольный) пептид не добавляют.
Через 24 ч выращивания в КЖ каждой колбы добавляют ЛС до конечной концентрации 0,02% и инкубируют при комнатной температуре в течение 1,5 ч. После чего КЖ центрифугируют (10000 g, 10 мин), бактериальный осадок отбрасывают, а супернатант используют для выделения бактериоцина E1073.
Бактериоцин из супернатанта выделяют двухэтапным методом с использованием ионообменной хроматографии на SP-Sepharose FF и хроматографии гидрофобного взаимодействия на Octyl-Sepharose 4FF, как описано в примере 3.
Влияние 2,1 кДа пептида на выход бактериоцина E1073 в зависимости от времени его внесении в КЖ в процессе культивирования штаммов продуцента и индуктора представлены в табл.9.
Как следует из данных таблицы, добавление в КЖ в процессе ферментации штамма-продуцента 2,1 кДа пептида существенно увеличивает количество синтезируемого бактериоцина E1073. Наиболее высокий выход бактериоцина - 280 мг/л, при культивировании штамма-продуцента в течение 24 ч, был достигнут при внесении 2,1 кДа пептида на 10 час от начала процесса культивирования в концентрации 0,01 мкг/мл КЖ. Пептид, имеющий мол. массу 2,1 кДа, образующийся на 6 час культивирования штамма E.faecium LVP 1073 в среде 5% МРС бульоне (HiMedia) и обладающий способностью индуцировать синтез бактериоцина E1073, назвали сигнальным пептидом и обозначили как СП1073.
Препаративные количества бактериоцина E073, соответствующего параметрам, описанным в примере 4, необходимые для проведения лабораторных исследований, были получены способом, включающим культивирование штамма-продуцента (E.faecium LVP 1073) (по п.1) в присутствии штамма-индуктора (L.plantarum 1 LVP7) (по п.5), с добавлением сигнального пептида СП1073 на 10 час роста культур (по п.6) и последующим выращиванием культур до 24 часов на среде 5% МРС бульон, с последующей выделением и хроматографической очисткой бактериоцина E1073 в соответствии с примером 3.
Пример 7. Антимикробная эффективность у бройлерных цыплят, контаминированных возбудителями клостридиозной, кампилобактериозной и сальмонеллезной инфекций.
В опыте используют 16 коммерческих бройлеров 13-суточного возраста. Все бройлеры естественно инфицированы Campylobacter spp. Воспроизведение C.perfringens-инфекции осуществляют путем заражения цыплят смесью бульонных культур C.perfringens на фоне специальной диеты на 17, 18, 19 и 20 сутки.
Для воспроизведения сальмонеллезной инфекции на 17 сутки жизни цыплят инфицируют суточной агаровой культурой Salmonella Enteritidis 92rifr в дозе, равной ~1,57×107 м.к./особь (по Мак Фарланду).
Для обработки используют элюат, содержащий бактериоцин E1073, описанный в примере 4, разведенный в воде до концентрации 12,5 мг/л. Среднюю дозу бактериоцина, поглощенного каждым бройлером, рассчитывают по количеству потребленной и непотребленной птицей воды, содержащей бактериоцин, после каждых суток лечения.
После окончания эксперимента (на 24 день жизни) птицу забивают. Образцы из гомогената подвздошной кишки убитых бройлеров исследуют на наличие C.perfringens, содержимое слепых отростков - на присутствие Campylobacter spp. и Salmonella Enteritidis 92rifr. Для выделения сальмонелл используют агар Эндо (ГНЦ ПМБ), в который добавляют 50 мкг/мл рифампицина.
Результаты опыта по применению бактериоцина E1073 у инфицированных бройлеров приведены в табл.10.
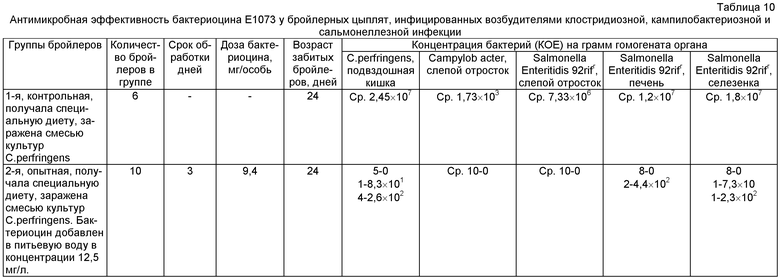
Как видно из результатов таблицы, при дозе бактериоцина, равной 9,4 мг/особь (трое суток обработки), у 50% бройлеров клостридии не выявлены, у 10% особей их концентрация снизилась на 6 порядков, а у 40% - на 5 порядков.
Очень высокий антимикробный эффект отмечен в условиях кампилобактериозной (100%) и сальмонеллезной инфекций. При средней концентрации сальмонелл в контрольной группе 7,33×106 - 1,8×107 КОЕ/г, в опытной группе бройлеров S.Enteritidis 92rifr не выявлена в слепой кишке у 100% особей, в печени и селезенке - у 80% особей. У 20% опытных бройлеров концентрация сальмонелл снизилась в органах на 5-6 порядков.
Промышленная применимость.
Задача настоящего изобретения решена тем, что предложен новый штамм Enterococcus faecium LVP 1073 - продуцент нового бактериоцина E1073, активного против бактериальных патогенов; предложен штамм Lactobacillus plantarum 1 LVP7 - индуктор синтеза бактериоцина E1073; штаммы Enterococcus faecium LVP 1073 и Lactobacillus plantarum 1 LVP7 депонированы в коллекции микроорганизмов под номерами B-5736 и B-5943, соответственно. Предложен специфичный сигнальный пептид - СП1073, активатор синтеза бактериоцина E1073, выделенный из среды культивирования штамма-продуцента бактериоцина E.faecium LVP 1073.
Предложен способ получения бактериоцина, заключающийся в совместном культивирования штамма-продуцента и штамма-индуктора в присутствии сигнального пептида на питательной среде низкой концентрации (5% МРС), что позволяет повысить продукцию бактериоцина, по сравнению с использованием только одного штамма-продуцента, в 6,7 раза (с 41,6 мг до 280 мг в 1 л КЖ). Очистку активной пептидной фракции из бесклеточного супернатанта КЖ проводят с помощью ионообменной хроматографии, используя смолу SP-Sepharose FF, и в последующем - хроматографию гидрофобного взаимодействия на смоле Octyl-Sepharose 4FF (Amersham Pharmacta Biotech, Швеция). Очищенный бактериоцин E1073 имеет молекулярную массу 3256 Да, состоит из 34 аминокислот и имеет ключевую последовательность YGNGV, которая подтверждает принадлежность его к бактериоцинам класса 2а. Его изоэлектрическая точка (pI) равна 8.2.
Бактериоцин Е1073 проявляет выраженную антагонистическую активность против многих грамположительных и грамотрицательных патогенов, включая грамположительные спороформирующие клостридии (C.perfringens), грамотрицательные кампилобактерии (C.jejuni) и сальмонеллы (S.Enteritidis).
Использование бактериоцина Е1073 для прижизненной предубойной обработки птицы будет способствовать получению тушек, свободных от патогенов и безопасных для человека, а также снижать содержание бактериальных патогенов в условиях, связанных с производством других экологически чистых продуктов питания.
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ ENTERОCOCCUS MUNDTII, ПРОДУЦИРУЮЩИЙ СУБСТАНЦИЮ ПЕПТИДНОЙ ПРИРОДЫ С АНТИЛИСТЕРИОЗНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2532227C1 |
| ШТАММ Bacillus lentus - ПРОДУЦЕНТ БАКТЕРИОЦИНОПОДОБНОЙ СУБСТАНЦИИ АНТИМИКРОБНОГО ДЕЙСТВИЯ И СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОЦИНОПОДОБНОЙ СУБСТАНЦИИ | 2013 |
|
RU2530552C1 |
| Штамм энтерококков Enterococcus faecium L-3 для лечения и профилактики бактериальных и вирусных инфекций с использованием изготовленных на его основе лечебно-профилактических средств и продуктов питания и способ культивирования штамма энтерококков Enterococcus faecium L-3 | 2022 |
|
RU2800359C1 |
| БАКТЕРИОЦИН ПРОТИВ ЛИСТЕРИЙ | 2001 |
|
RU2250267C2 |
| ШТАММ Lactobacillus fermentum Z, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПРОИЗВОДСТВА ПРОБИОТИЧЕСКИХ МОЛОЧНОКИСЛЫХ ПРОДУКТОВ | 2008 |
|
RU2412239C2 |
| Способ очистки мундтицина Р436 (КС) | 2021 |
|
RU2794803C1 |
| СМЕСЬ БАКТЕРИОЦИНОВ, ШТАММ STREPTOCOCCUS THERMOPHILUS - ПРОДУЦЕНТ БАКТЕРИОЦИНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2153505C2 |
| Штамм LастовасILLUS асIDорнILUS 17-продуцент бактериоцина а 17 | 1979 |
|
SU854981A1 |
| СПОСОБ ПОЛУЧЕНИЯ АУТОПРОБИОТИКА НА ОСНОВЕ ENTEROCUCCUS FAECIUM, ПРЕДСТАВИТЕЛЯ ИНДИГЕННОЙ МИКРОФЛОРЫ КИШЕЧНИКА ХОЗЯИНА | 2010 |
|
RU2460778C1 |
| Противовоспалительная фармацевтическая композиция на основе бактериальных штаммов | 2015 |
|
RU2616899C1 |
Изобретение относится к биотехнологии и может быть применено, в частности, при профилактике и лечении инфекционных заболеваний животных, особенно птицы. Штамм Enterococcus faecium LVP 1073 депонирован в коллекции микроорганизмов Государственного научного центра прикладной микробиологии и биотехнологии, коллекционный номер В-5736 - продуцент бактериоцина Е1073, активного против бактериальных патогенов. Штамм выделен из содержимого слепой кишки 42-дневного здорового бройлера. Полученный бактериоцин Е1073 относится к катионным пептидам (рI 8,2) и имеет м.м. 3256 Да, состоит из 34 аминокислот. Предложен штамм Lactobacillus plantarum 1 LVР7, депонирован в коллекции микроорганизмов Государственного научного центра прикладной микробиологии и биотехнологии, коллекционный номер В-5943 - индуктор синтеза бактериоцина Е1073. Предложен специфичный сигнальный пептид - СП 1073, регулятор синтеза бактериоцина Е1073, выделенный из среды культивирования штамма продуцента бактериоцина E.faecium LVP 1073. Изобретение обеспечивает проявление in vitro выраженной антагонистической активности против многих грамположительных и грамотрицательных патогенов, включая грамположительные спороформирующие клостридии (C.perfringens), грамотрицательные кампилобактерии (C.jejuni) и сальмонеллы (S.Enteritidis). Использование бактериоцина Е 1073 для прижизненной предубойной обработки птиц способствует получению тушек, свободных от патогенов и безопасных для человека. 5 н. и 1 з.п. ф-лы, 11 табл.
1. Штамм Enterococcus faecium LVP 1073 депонирован в коллекции микроорганизмов Государственного научного центра прикладной микробиологии и биотехнологии, коллекционный номер В-5736 - продуцент бактериоцина Е1073 против бактериальных патогенов.
2. Бактериоцин Е1073 против бактериальных патогенов, продуцируемый штаммом Enterococcus faecium LVP 1073 по п.1, имеющий аминокислотную последовательность TSYVYGNGVKENIAGEVRKGWGSGVAWDVDWKLA.
3. Штамм Lactobacillus plantarum 1 LVP7 депонирован в коллекции микроорганизмов Государственного научного центра прикладной микробиологии и биотехнологии, коллекционный номер В-5943 - индуктор синтеза бактериоцина Е1073 по п.2.
4. Сигнальный пептид СП1073, синтезированный штаммом Enterococcus faecium LVP 1073 по п.1 - регулятор синтеза бактериоцина Е1073 по п.2, имеющий мол. массу 2,1 кДа и pI 8,1.
5. Способ получения бактериоцина E1073, включающий совместное культивирование штамма продуцента бактериоцина и штамма индуктора, добавление сигнального пептида, с последующим выделением бактериоцина из бесклеточного супернатанта и с поверхности клеток продуцента и индуктора, очисткой пептидной фракции хроматографией гидрофобного взаимодействия, а затем ионообменной хроматографией на Superose SP FE, отличающийся тем, что проводят культивирование штамма Enterococcus faecium LVP 1073 в течение 24 ч на среде МРС бульон 5% при температуре 37±1°С совместно с штаммом индуктором Lactobacillus plantarum 1 LVP7, с добавлением сигнального пептида СП1073 на 10 час роста культур в приемлемой концентрации, а очистку пептидной фракции проводят последовательно, сначала с использованием ионообменной хроматографии на SP-Sepharose FF, а затем хроматографии гидрофобного взаимодействия на Octyl-Sepharose 4FF, с последующим выделением целевого продукта в виде элюата.
6. Способ по п.5, отличающийся тем, что элюат содержит 25 mM TRIS HCl, 15 mM K2HPO4 и бактериоцин Е1073 в количестве, соответствующем его содержанию в культуральной жидкости.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| US 2009004251 A1, 01.01.2009 | |||
| US 2006223161 A1, 05.10.2009 | |||
| US 7132102 B2, 14.07.2005 | |||
| GALVEZ A | |||
| et al, Bacteriocin-based strateries for food biopreservation | |||
| Int J Food Microbiol, 2007, nov 30; (1-2), p.51-70 | |||
| ЕГОРОВ Н.С., БАРАНОВА И.П | |||
| Бактериоцины | |||
| Образование, свойства, применение | |||
| Антибиотики и химиотерапия, 1999, №6, с.33-40. | |||
Авторы
Даты
2011-01-20—Публикация
2009-02-12—Подача