Изобретение относится к области микробиологии и медицины и касается получения пробиотического продукта, содержащего аутоштаммы Enlerococcus faecium, применяемого для профилактики и лечения кишечного дисбиоза.
В последние годы накоплен богатый опыт, касающийся применения пробиотиков при лечении различных нозологических форм [1, 2, 3, 4]. Опубликованы работы, описывающие успешное применение пробиотической терапии в гастроэнтерологии, пульмонологии, ревматологии, кардиологии и других разделах медицины. Подавляющее большинство работ посвящено применению пробиотиков, содержащих промышленные штаммы микроорганизмов [5, 6, 7, 8, 9].
Наряду с расширением сферы применения пробиотиков накапливаются данные о негативных проявлениях терапии препаратами или продуктами, содержащими промышленные штаммы микроорганизмов.
Микробы, выращенные искусственно, являются инородными для организма определенного человека и отторгаются вследствие биологической несовместимости. Биотехнологические пробиотики не имеют возможности внедряться внутрь биопленки кишечника и поэтому пребывают в нем транзиторно как микрофлора пищи [9]. Это признают производители пробиотиков, подтверждая, что их добавки не восполняют дефицит соответствующих содержимому пробиотика микроорганизмов, но стимулируют рост облигатной микрофлоры [10].
В настоящее время полагают, что оральный прием живых бактерий теоретически может быть ответственен за четыре типа побочных эффектов:
- развитие инфекционных процессов, обусловленных штаммами, входящими в состав пробиотиков;
- развитие метаболических расстройств;
- чрезмерная иммуностимуляция лимфатического аппарата кишечника;
- формирование новых клонов бактериальных штаммов за счет передачи генов, ответственных за экспрессию факторов патогенности.
Аутопробиотики лишены вышеперечисленных недостатков, так как они производятся на основе субстратов, полученных от макроорганизма, для которого они предназначены и обладают сродством к биопленке кишечника.
Известен способ получения аутоштаммов бифидо- и лактобактерий, включающий в себя этапы забора фекалий, выращивания бактерий и приготовления биомассы из них [11]. Однако в данной работе не проводится контроль приготовленной суспензии на активность бактерий и наличие бактериального загрязнения.
Известен способ получения биомассы аутоштамма лактобактерий, наиболее близкий к заявляемому изобретении [12]. В известном способе для получения аутоштаммов лактобактерий отбирают пробу нативного материала у конкретного человека и осуществляют ее посев на селективную питательную среду без разведения. После подтверждения принадлежности полученных микроорганизмов лактобактерий без четкой видовой идентификации производился повторный пассаж выделенных клеток на селективной питательной среде для выращивания чистой культуры.
Для сохранения активности клеток к полученной культуре добавлялся консервант на основе сахарозно-желатиновой среды. Однако реально, в соответствии с изложенной в патентной заявке процедурой выделить чистую культуру лактобактерий невозможно (лактобактерии включают более 11 различных родов). Предложенный в заявке протокол может позволить получить лишь набор бактериальных штаммов с непредсказуемыми последствиями для пациента.
В отличие от прототипа в настоящей патентной заявке предлагается выделение отдельных клонов энтерококков с последующим анализом каждого из выделенных клонов на наличие в их геноме нежелательных генетических детерминант [13], а также на отсутствие гемолитической активности на кровяном агаре и способность сбраживать молоко. Таким образом, аутопробиотик оказывается генетически и физиологически охарактеризован.
Другим важным отличием настоящей заявки от прототипа является второй этап работы, на котором для пациента с аутопробиотическим штаммом приготавливают пробиотический продукт, основой которого является закваска аутоштамма Enterococcus faecium.
Выбор Enterococcus faecium в качестве пробиотика обусловлен несколькими причинами [14]:
- опыт успешного использования энтерококков в качестве стартерных культур при приготовлении пищевых продуктов и в качестве пробиотиков;
- способность вырабатывать широкий спектр витаминов, в том числе являющихся ростовыми факторами для бифидобактерий и лактобацилл кишечника;
- штаммы Enterococcus faecium, в отличие от другого распространенного вида энтерококков Enterococcus faecalis, существенно реже содержат гены патогенности;
- выбранные апатогенные штаммы Enterococcus faecium наиболее отвечают стандартам генетической безопасности [15], в отличие от другого распространенного вида энтерококков Enterococcus faecalis, существенно реже содержат гены патогенности;
- устойчивость штаммов энтерококков к соляной кислоте (в желудке) и желчным кислотам (в двенадцатиперстной кишке);
- высокая технологичность штаммов энтерококков, устойчивость в широком диапазоне температур, устойчивость к высушиванию, высоким концентрациям солей;
- устойчивость к антибиотикам, в частности к сульфаниламидам, гентамицину и стрептомицину, что делает возможным назначение их на фоне антибактериальной терапии;
- способность ряда штаммов Enterococcus faecium вырабатывать мощные бактериоцины (энтероцин A и энтероцин B), что является важным для подавления избыточного роста условно-патогенной флоры у больных с дисбиозом.
Заявленный способ поясняется многочисленными примерами конкретных исследований, проведенных в реальных условиях и разных режимах на лабораторной базе НИИ Экспериментальной Медицины СЗО РАМН и клинической базе СПб. ГУЗ «Городская больница №26».
Примеры приготовления аутопробиотика на основе Enterococcus faecium
Новизна предлагаемого оригинального способа приготовления молочнокислой закваски заключается в том, что предлагаемый продукт получают из собственного (аутопробиотического) штамма Enterococcus faecium - обитателя желудочно-кишечного тракта конкретного пациента. Способ отличается тем, что после отбора характерных по морфологии колоний и перед непосредственно получением продукта осуществляют полимеразную цепную реакцию (ПЦР) с определением вида энтерококка и генетических детерминант патогенности, что предлагается впервые. Данный способ обеспечивает абсолютную безопасность готового продукта для человека. Способ отличается высокой скоростью получения готовой закваски (4-6 суток с момента взятия материала).
Для выделения индигенных энтерококков из фекалий для создания аутопробиотических молочнокислых заквасок необходимо:
1. Осуществить высев бактерий из фекалий пациента на селективные среды.
2. Идентифицировать выделенные штаммы до рода.
3. Осуществить ПЦР для определения вида энтерококка и возможного содержания факторов патогенности.
4. Произвести отбор клонов, удовлетворяющих требованиям генетической безопасности и физиологической функциональности.
5. Депонировать индивидуальные штаммы энтерококков в криохранилище.
6. Получить молочнокислую закваску.
Пример 1. Посев материала для выделения энтерококков
Для выделения аутопробиотических энтерококков из фекалий необходимо не менее 0,5 г материала (желательно - 5,0 г), при жидком стуле - слой не менее 1-2 см от дна посуды. Доставку необходимо осуществить не позднее 2 часов после отбора материала. Затем в стерильных условиях к 1 г материала добавить 9 мл стерильного фосфатного буфера (физиологический раствор хлорида натрия с добавлением фосфатов натрия двух- и однозамещенных, смешанных в пропорции, необходимой для создания pH 7,4).
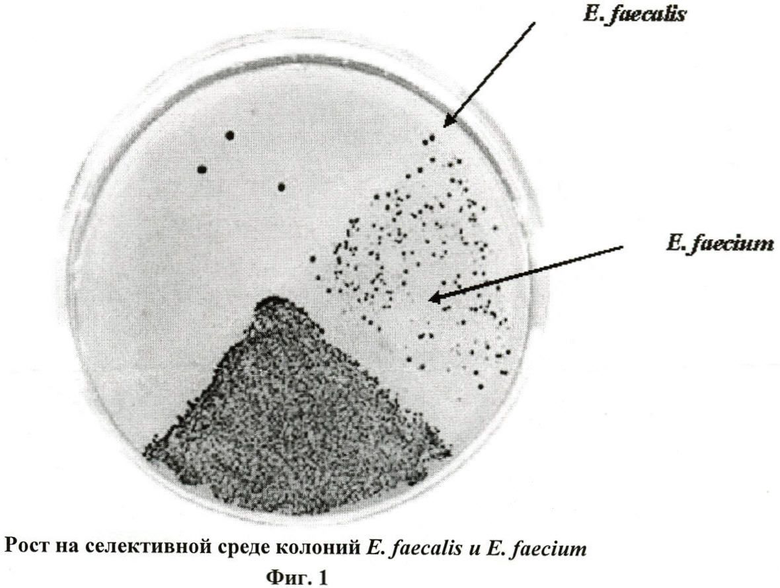
Суспензию фекалий в разведении 1:10 высевают в количестве 100 мкл на селективную среду для энтерококков (энтерококк-агар). Культивировать в течение 24-48 часов при температуре 37°C. На этой среде вырастают главным образом энтерококки, реже стафилококки. Кроме того, учитывая особенности культуральных свойств Enterococcus faecium и Enterococcus faecalis, можно проводить ориентировочную идентификацию энтерококков до вида. На Фиг.1 представлен рост колоний: Enterococcus faecalis чаще всего темные, бордового цвета, а колонии Enterococcus faecium сирене-розового цвета со светлым ободком.
Пример 2. Идентификация чистой культуры Enterococcus sp.
Идентификацию отдельных колоний осуществляют на основании не только морфологических, но и микроскопических свойств. Выбирают типичные для Enterococcus faecium три отдельные колонии (сирене-розового цвета со светло-розовым ободком) и отсевают их на новую чашку Петри с плотной средой МРС секторами с целью получения чистой культуры. Культивируют в течение 24 часов при 37°C. Микроскопируют препараты из чистых культур бактерий, окрашивая по методу Грама. При световой микроскопии Enterococcus faecium имеют округлую форму и располагаются в виде коротких цепочек с тенденциями к агрегации. Чистые культуры направляют на генетический анализ.
Пример 3. Уточнение видовой принадлежности и исследование на наличие факторов патогенности при помощи ПЦР
Для оценки молекулярно-генетических характеристик штаммов из индивидуальных колоний энтерококков экспресс-методом выделяют хромосомную ДНК, после чего производят ПЦР. Для предлагаемого экспресс-выделения ДНК чистую бактериальную культуру с чашки Петри (5-10 колоний) суспендируют в 50-100 мкл стерильной дистиллированной воды и кипятят 10 минут. Затем центрифугируют при 8000 об/мин. Надосадок, содержащий ДНК бактерии, используют для ПЦР (30 циклов при температуре отжига 57°C). Для генетического анализа с помощью ПЦР, с помощью компьютерной программы «BLAST» [16] были сконструированы уникальные праймеры для определения вида Enterococcus и на гены его патогенности (таблица 1), что позволяет для дальнейшего получения безопасного продукта выделять апатогенные штаммы.
Детекцию результатов ПЦР осуществляют с помощью электрофореза в 1% агарозном геле. Соответственно, для подготовки аутопробиотиков отбирают бактериальные клоны, относящиеся к Enterococcus faecium (продукт 658 нуклеотидные пары - далее - «нп») и не содержащие ни одного из перечисленных в таблице 1 генов патогенности.
Пример 4. Получение молочнокислой закваски
Три колонии, полученные на плотной МРС среде, одной и/или нескольких выбранных чистых культур Enterococcus faecium без генов патогенности высевают на 10 мл молока («Клевер, 1,5%, стерилизованное автоклавированием при 120°C в течение 20 мин) и инкубируют в течение 24-48 час при 37-42°C до заквашивания молока. Выбирают одну пробирку с более быстрым ростом культуры, определяя это по образованию сгустка в молоке. Культуру, обладающую необходимым набором свойств направляем в криохранилище для возможного использования в будущем. Полученные 10 мл закваски из отобранной культуры энтерококков используют как посевной материал для получения большего объема закваски. Для этого засевают 10 мл закваски на 1 литр прогретого при 37°C стерильного молока. Инкубируют в течение 24-48 час при 37-42°C до заквашивания молока. Проверку культуры на наличие контаминации проверяют высевом 100 мкл закваски на трипотозный агар ("Ferak", Германия), который растирают шпателем, инкубируют в течение 24 часов при 37°C. Для сохранения полученных штаммов отбирают по 2 пробирки по 1 мл полученной чистой закваски и хранят при -75°C до года.
После получения молочнокислой закваски продукт хранят до использования в холодильнике при 4°C не более 7 дней.
Безопасность полученного продукта была проверена в экспериментальном исследовании на животных и в клиническом исследовании в группе добровольцев (10 человек). При исследовании клинических и лабораторных параметров во время применения продукта негативных проявлений выявлено не было.
Клиническое исследование применения аутопробиотика на основе Enterococcus faecium
Пример 5. Экспериментальное применение аутопробиотика у крыс с индуцированным дисбиозом
Изучение эффективности и безопасности пробиотической терапии проводилось на 12 здоровых крысах-самцах линии Вистар с индуцированным дисбиозом. Крысы были рандомизированы на 3 группы.
Четырем крысам из первой группы вводилось 0,5 мл молочнокислой закваски, содержащей 5,5×108 КОЕ/мл Enterococcus faecium L5 (генетический дериват пробиотической культуры L3, имеющий гены устойчивости к эритромицину - «Ламинолакт», ООО «Авена», Россия, Патент РФ №2227039).
Крысы второй группы (4 крысы) получали молочнокислую закваску, содержащую 108 КОЕ/мл собственных Enterococcus faecium.
Четыре крысы третьей группы получали по 0,5 мл молока.
В ходе эксперимента осуществлялось наблюдение за аппетитом, весом, характером стула и поведением лабораторных животных, проводилось микробиологическое исследование фекалий на 1- и 8-й дни наблюдения. Перед использованием собственных штаммов энтерококков проводилось их генетическая идентификация и исследование на наличие факторов патогенности методом полимеразной цепной реакции (ПЦР).
При рассмотрении результатов исследования оказалось, что у крыс, получавших аутопробиотик, в более короткие сроки (на 3-е сутки) против крыс, получавших Enterococcus faecium L5 (на 5-е сутки) наступили нормализация веса и аппетита. В эти же сроки наблюдалась нормализация стула.
При анализе микробиологических данных было выявлено:
- достоверное увеличение количества лактобацилл в группе, получавших аутопробиотики (от 5,17±0,7 до 7,0±0,27 lg КОЕ) (p<0,01);
- значительное увеличение бифидобактерий в группе аутопробиотической терапии (с 4,0±0,89 до 6,0±0,26 lg КОЕ);
- уменьшение количества представителей условно-патогенной флоры как в группе, получавшей аутопробиотик, так и в группе, получавшей Enterococcus faecium L5.
Пример 6. Клиническое исследование безопасности применения аутопробиотика на основе Enterococcus faecium у добровольцев
Безопасность применения аутопробиотического продукта исследована на 10 здоровых добровольцах. В ходе исследования контролировались клинические показатели (аппетит, характер стула, наличие диспепсических расстройств, температура тела, общее самочувствие) и лабораторные данные (гематологические показатели, показатели, характеризующие функции печени, почек, поджелудочной железы). Проводился микробиологический контроль фекалий испытуемых.
Испытуемые получали молочнокислую закваску, содержащую 108 КОЕ/мл собственных энтерококков в 1 мл закваски, в дозе 100 мм/сутки - по 50 мл 2 раза в день в течение 10 дней.
В ходе проведения клинического исследования каких-либо негативных проявлений на фоне применения аутопробиотика с Enterococcus faecium выявлено не было. Все испытуемые отметили хорошие органолептические свойства (вкус, консистенцию, цвет) продукта.
Пример 7. Применения аутопробиотика на основе Enterococcus faecium в клинической практике
Эффективность применения заявляемого продукта исследована на группе пациентов, страдающих синдромом раздраженной толстой кишки (СРК). Обследованы 50 пациентов с СРК в возрасте от 22 до 55 лет.
С целью объективизации исследования пациенты методом случайной выборки были распределены в 2 группы:
- пациенты первой группы (25 человек) получали молочнокислую закваску, содержащую 108 КОЕ/мл собственных энтерококков {Enterococcus faecium) в 1 мл закваски, в дозе 100 мл/сутки - по 50 мл 2 раза в день в течение 10 дней);
- пациенты второй группы получали молочнокислую закваску, содержащую Enterococcus faecium L3, в титре 108 КОЕ/мл) в дозе 100 мл/сутки (по 50 мл 2 раза в день в течение 10 дней).
Клиническая оценка влияния пробиотической терапии на состояние пациентов с СРК проводилась на основании динамики выраженности таких характерных для СРК симптомов, как выраженность боли в животе, дискомфорт в эпигастральной области, метеоризма, характеристика стула по Бристольской шкале (БШ). Так же оценивалась сохранность аппетита, общее самочувствие по оценке пациентом.
При контрольном обследовании пациентов после курса лечения отмечалось значительное улучшение по всем клиническим показателям в обеих группах, что соответствует данным научных исследований [17-18]. В то же время в динамике некоторых показателей двух групп сравнения наблюдались достоверные различия. Так, в группе добровольцев, получавших аутопробиотик, достоверно менее выраженным был метеоризм (основной причиной которого является избыточный рост условно-патогенной флоры). Динамика этого показателя в группе аутопробиотика составила от 2,45±0,12 до 0,62±0,16 балла против 2,33±0,11 и 1,33±0,17 балла в группе получавших Enterococcus faecium 13. Так же на фоне применения заявляемого продукта значительно менее выраженными стали такие клинические проявления СРК, как боль в животе (0,41±0,15 против 0,87±0,15 балла в группе Enterococcus faecium L3), чувство тяжести в животе (0,37±1,14 против 0,79±1,17 балла).
При микробиологическом исследовании состояния кишечного микробиоценоза наблюдаемых пациентов было выявлено, что как после курса лечения молочнокислой закваски на основе штамма Enterococcus faecium L3, так и после лечения аутопробиотиком состояние микрофлоры достоверно улучшилось.
Более значимые изменения произошли после проведения курса аутопробиотической терапии:
1. Отмечается достоверное снижение количества условно-патогенных энтеробактерий с 0,87±0,38 до 0,12±0,12 (p=0,04).
2. Достоверно увеличилось количество бифидобактерий с 7,79±0,28 до 8,95±0,04 (p=0,0009).
3. Достоверно увеличилось количество лактобацилл с 7,83±0,21 до 8,95±0,04 (p=0,0007).
4. Достоверно увеличилось количество энтерококков с 4,91±0,11 до 5,83±0,20 (p=0,002).
5. Достоверно увеличилось количество E.Coli с 6,12±0,19 до 6,41±0,17 (p=0,005).
Как показывают результаты многочисленных апробаций заявленного способа, существенно сокращается время приготовления пробиотического продукта, полученного на основе аутоштаммов Enterococcus faecium, который, в сравнении с аналогичными биотехнологическими пробиотиками, является оригинальным, эффективным и безопасным средством для лечения дисбиоза любой этиологии.
Используемые источники информации
1. Бондаренко В.М., Чупринина Р.П., Аладышева Ж.И. и др. Пробиотики и механизмы их лечебного действия // Эксперим. клин, гастроэнтерол. 2004. №3. С.83-87.
2. Ручкина И.Н., Парфенов А.И., Осипов А.Г. Особенности комплексной терапии постинфекционного синдрома раздраженного кишечника // Гастроэнтерология Санкт-Петербурга. 2007. №1-2. С.М94.
3. Суворов А.Н. Применение пробиотиков для профилактики и лечения различных заболеваний. - Санкт-Петербург, 2004. - 32 с.
4. Collins M.D., Gibson G.R. Probiotics, prebiotics and synbiotics: approaches for modulating the microbial ecology of the gut // Am J Clin Nutr. 1999; 69: 1052-1057.
5. Бондаренко B.M. "Острова" патогенности бактерий // Журн. микробиол. 2001. №4. С.67-74.
6. Отраслевой Стандарт «Протокол ведения больных. Дисбактериоз кишечника» // ОСТ 91500.11.0004-2003, Приказ МЗ РФ №231 от 09.06.2003.
7. Петров Л.Н., Вербицкая Н.Б. и др. Бактериальные пробиотики: биотехнология, клиника, алгоритмы выбора. - Санкт-Петербург, 2008. - 136 с.
8. Kelly D., Conway S., Aminov R. Commensal gut bacteria: mechanism of immune modulation // Trends Immunol. 2005; 26: 326-333.
9. Boirivant M., Strober W. The mechanism of action of probiotics. Curr Opin Gastroenterol 2007; 23(6): 679-92.
10. Шендеров Б.А. «Медицинская микробная экология и функциональное питание», Том III, Москва, 2001 г.
11. Авторское Свидетельство СССР №1286212, опубликовано 30.01.87.
12. Патент РФ №2320355 C1, опубликовано 27.03.2008. «Способ получения биомассы аутоштамма лактобактерий жидкой «Лакти» (RU) - прототип.
13. Суворов А.Н., Захаренко С.М., Алехина Г.Г. Энтерококки как пробиотики выбора // Клин. питание (СПб.). 2003. №1. С.26-29.
14. Бондаренко В.М., Воробьев А.А. Дисбиозы и препараты с пробиотической функцией // Журн. микробиологии. 2004. №1. С.84-92.
15. ГОСТ 28566-90. Продукты пищевые. Метод выявления и определения количества энтерококков. Дата издания: 01.10.2005. Дата введения в действие: 01.07.1991. ВНИИ консервной и овощесушильной промышленности (ВНИИКОП). Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-гигиеническому надзору (контролю).
16. http://www.ncbi.nlm.nih.gov/BLAST.
17. Nobaek S, Johansson ML, Molin G, et al. Alteration of intestinal microflora is associated with reduction in abdominal bloating and pain in patients with irritable bowel syndrome. Am J Ga-stroenterol 2000; 95: 1231-38.
18. Pimentel M., Chow E.J., Lin H.C. Eradication of small intestinal overgrowth reduce symptoms of irritable bowel syndrome // Am J Gastronterol. 2000; 95: 3503-3506.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПЕРСОНИФИЦИРОВАННОГО АУТОПРОБИОТИЧЕСКОГО ПРОДУКТА И СПОСОБ ЛЕЧЕНИЯ СИНДРОМА РАЗДРАЖЕННОЙ КИШКИ С ИСПОЛЬЗОВАНИЕМ ЭТОГО ПРОДУКТА | 2013 |
|
RU2546253C2 |
| СПОСОБ ПРОФИЛАКТИКИ ПОСТИНФЕКЦИОННОГО СИНДРОМА РАЗДРАЖЕННОЙ КИШКИ | 2014 |
|
RU2553372C1 |
| Способ восстановления собственной кишечной микробиоты после антибиотикотерапии | 2021 |
|
RU2775887C1 |
| Способ лечения синдрома раздражённого кишечника | 2017 |
|
RU2661624C1 |
| СПОСОБ ЛЕЧЕНИЯ ФУНКЦИОНАЛЬНЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У ДЕТЕЙ | 2021 |
|
RU2766765C1 |
| Способ приготовления аутопробиотика на основе анаэробного консорциума бактерий | 2018 |
|
RU2734896C2 |
| Способ уменьшения выраженности немоторных симптомов у пациентов, страдающих болезнью Паркинсона | 2019 |
|
RU2734718C1 |
| Способ монотерапии гастрита, ассоциированного с инфекцией Helicobacter pylori | 2020 |
|
RU2758246C1 |
| СПОСОБ ТЕРАПИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА С ИСПОЛЬЗОВАНИЕМ АУТОПРОБИОТИКОВ | 2024 |
|
RU2839320C1 |
| ШТАММ Lactobacillus fermentum Z, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПРОИЗВОДСТВА ПРОБИОТИЧЕСКИХ МОЛОЧНОКИСЛЫХ ПРОДУКТОВ | 2008 |
|
RU2412239C2 |
Получают аутопробиотик на основе Enterococcus faecium выращиванием культуры в селективной питательной среде, идентификацией и отбором типичных для Enterococcus faecium колоний. Получают чистую культуру Enterococcus faecium, уточняют видовую принадлежность и содержание факторов патогенности, отбирают апатогенные клоны Enterococcus faecium и готовят из них молочнокислую закваску. Изобретение существенно сокращает время приготовления пробиотического продукта, полученного на основе аутоштаммов Enterococcus faecium, применение которого, в сравнении с аналогичными биотехнологическими пробиотиками, является эффективным и безопасным средством для лечения дисбиоза любой этиологии. 2 з.п. ф-лы, 1 ил., 1 табл., 7 пр.
1. Способ получения аутопробиотика на основе Enterococcus faecium, представителя индигенной микрофлоры кишечника хозяина, характеризующийся забором пробы нативного материала, посевом бактерий из фекалий пациента на селективную питательную среду и выращиванием культуры в селективной питательной среде, идентификацией и отбором типичных для Enterococcus faecium колоний, получением чистой культуры Enterococcus faecium и уточнением видовой принадлежности и содержания факторов патогенности методом полимеразной цепной реакции, отбором апатогенных клонов Enterococcus faecium, соответствующих стандартам генетической безопасности и физиологической функциональности, из которых готовят молочнокислую закваску.
2. Способ по п.1, отличающийся тем, что отобранные апатогенные клоны Enterococcus faecium депонируют в криохранилище при температуре не выше 75°С со сроком хранения не более 1 года.
3. Способ по п.1, отличающийся тем, что в качестве селективной питательной среды используют энтерококк-агар.
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ АУТОШТАММА ЛАКТОБАКТЕРИЙ ЖИДКОЙ "ЛАКТИ" | 2006 |
|
RU2320355C1 |
| СПОСОБ ПОЛУЧЕНИЯ АУТОПРОБИОТИКА, СОДЕРЖАЩЕГО ЖИВЫЕ БИФИДОБАКТЕРИИ И ЛАКТОБАЦИЛЛЫ | 1999 |
|
RU2139070C1 |
| КОМПОЗИЦИЯ ДЛЯ ОБОГАЩЕНИЯ ПОТРЕБЛЯЕМЫХ ПРОДУКТОВ ДЛИТЕЛЬНОГО ХРАНЕНИЯ И СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ | 2006 |
|
RU2329668C2 |
| СИМАНЕНКОВ В.И | |||
| и др | |||
| Опыт экспериментального и доклинического изучения аутопробиотиков | |||
| Материалы Всероссийской конференции гастроэнтерологов юго-западного региона, 2009, Ростов-на-Дону, 25-27 апреля, с.83-87 | |||
| VELD J.H., BOSSCHAERT M.A.R., SHORTT С | |||
| Health aspects of probiotics | |||
| Food Sci | |||
| Technol | |||
| Today | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
Авторы
Даты
2012-09-10—Публикация
2010-12-30—Подача