Область техники
Настоящее изобретение относится к композициям для создания покрытий и их использованию, например, для приготовления лекарственных форм для доставки лекарственных средств в толстый кишечник.
Уровень техники
Заболевания и патологические состояния толстого кишечника, например воспалительные заболевания толстой кишки, колоректальный рак, запор и инфекции, плохо поддаются лечению при помощи лекарственных средств для перорального введения, поскольку такие лекарства практически полностью абсорбируются в желудке или тонком кишечнике, а также при помощи лекарственных средств для ректального введения, поскольку такие средства редко достигают восходящих отделов толстого кишечника. Для преодоления указанных трудностей обычно применяют доставку лекарственных средств непосредственно в толстый кишечник. Любая система, которая специфически доставляет лекарственные средства непосредственно в толстый кишечник, имеет очевидные преимущества, поскольку позволяет уменьшить необходимую пероральную дозу и, соответственно, снизить побочное действие таких лекарственных средств, как, например, кортикостероиды.
Попадание вакцин, белков и лекарственных пептидов в системный кровоток при их пероральном введении также ограничено за счет их существенного разрушения в кислой среде желудка и ферментативного расщепления в тонком кишечнике. В противоположность этому, в толстом кишечнике существенно более низкая ферментативная активность и pH ближе к нейтральному, что позволяет указанным соединениям более эффективно достигать системного кровотока.
Доставка активных соединений в толстый кишечник может достигаться путем использования зависящих от времени систем, pH-зависимых систем или систем, основанных на ферментативной активности толстой кишки. Последние позволяют достичь высокой специфичности высвобождения лекарственного вещества в желаемом месте, поскольку они основаны на специфическом разрушении биодеградируемых полимеров микрофлорой толстой кишки. Такие биодеградируемые полимеры, главным образом полисахариды, могут быть частью оболочки или просто представлять собой материал, формирующий матрицу. Системы для покрытия обычно имеют более высокое содержание лекарственного вещества.
Широко известны композиции для покрытия на основе стекловидной или кристаллической амилозы. Считается, что стекловидная форма амилозы устойчива к расщеплению панкреатической α-амилазой, но при этом подвергается расщеплению ферментами толстого кишечника. Обычно такие композиции содержат водную дисперсию амилозы. Поскольку амилоза набухает при воздействии водной среды, такие композиции также обычно содержат вещество, контролирующее набухание амилозы. Обычно таким веществом является нерастворимый в воде полимер, такой как этилцеллюлоза.
Milojevic и соавт. (J. Control. Release, 38, 75-84, 1995) описывают комплексную методику экстракции амилозы из крахмала гладких семян гороха, при помощи которой в итоге получают комплекс амилоза-бутан-1-ол. Водную дисперсию этого комплекса амилозы затем смешивают с водной дисперсией этилцеллюлозы при высоких температурах (обычно 70°С) в различных весовых соотношениях. Такая температура необходима для растворения комплекса и получения раствора амилозы. Формирование пленки стекловидной или кристаллической амилозы зависит от скорости высыхания во время процесса образования покрытия.
В патенте США номер 6534549 раскрывается композиция для создания покрытий на основе амилозы, которая формируется путем смешивания водной дисперсии комплекса амилоза-бутан-1-ола с раствором этилцеллюлозы, растворенном в органическом растворителе, смешиваемым с водой, таким как этиллактат. В указанных дисперсиях соотношения амилозы и этилцеллюлозы находятся в пределах от 1:2 до 3:2, а система растворителя содержит, по крайней мере, 50% органического растворителя в весовом соотношении. В целом, данная методика получения композиции не требует высоких температур, температура может быть не выше 60°С и часто представляет собой температуру окружающей среды.
В патентной заявке США 2005/0220861 описывается использование композиции, включающей стекловидную амилозу, этилцеллюлозу и дибутилсебацинат для создания оболочки пилюль, содержащих натриевый метансульфобензоат преднизолона. Композицию получают путем нагревания водного или водно-спиртового раствора стекловидной амилозы, смешанного с водной дисперсией этилцеллюлозы, пластифицированной дибутилсебацинатом, с получением амилозы в аморфной форме. Хотя амилоза используется в различных композициях для создания покрытий, она должна применяться в стекловидной или аморфной форме, что требует длительного и комплексного процесса обработки. Остается необходимость получения композиций для создания покрытий, обеспечивающих специфическое высвобождение активного вещества в толстом кишечнике, которые при этом можно легко и быстро приготовить.
Сущность изобретения
Настоящее изобретение частично основано на открытии, что композиции для создания покрытий, содержащие крахмал, особенно подходят для доставки лекарственных и диагностических агентов в толстый кишечник. Крахмал специфическим образом расщепляется микрофлорой толстой кишки, что делает его идеальным агентом для доставки лекарственных средств непосредственно в толстый кишечник. Кроме того, в отличие от амилозы, крахмал не требует специальной обработки для придания ему стекловидной или аморфной формы. Для того чтобы избежать высвобождения активного агента из лекарственной формы ранее, чем она достигнет толстой кишки, композиции, заявленные в соответствии с настоящим изобретением, также включают агент, который способствует образованию пленки и контролирует набухание крахмала.
Соответственно, согласно одному своему аспекту настоящее изобретение относится к композициям для создания покрытий, содержащим водную среду и диспергированный в ней крахмал, а также формирующий пленку агент, который контролирует набухание крахмала при воздействии водной среды.
Согласно второму аспекту настоящее изобретение относится к лекарственной форме, покрытой композицией по изобретению.
Еще одним аспектом данного изобретения является способ лечения или диагностики заболевания или патологического состояния толстого кишечника, заключающийся во введении указанной лекарственной формы.
Настоящее изобретение также относится к способу получения композиций для создания покрытий, включающему смешивание водной среды, крахмала и формирующего пленку агента, контролирующего набухание крахмала в водной среде.
Настоящее изобретение также относится к способу лечения местных патологических процессов в толстой кишке, заключающемуся во введении заявленной лекарственной формы согласно изобретению. Например, к таким местным патологическим процессам относятся болезнь Крона, язвенный колит, колоректальный рак и амебиаз.
Композиция для создания покрытий в соответствии с настоящим изобретением обеспечивает специфичное место высвобождения лекарственного средства. Лекарственная форма в соответствии с настоящим изобретением может использоваться для доставки различных активных ингредиентов, предназначенных как для местного лечения заболеваний кишечника, так и для системного лечения, при этом указанные агенты, такие как белки, пептиды и вакцины, абсорбируются слизистой оболочкой толстого кишечника. Толщина покрытия может варьировать в зависимости от требуемого места доставки, лекарственный агент может высвобождаться и абсорбироваться в терминальном отделе тонкого кишечника либо в проксимальном, поперечном или терминальном отделе толстого кишечника. Лекарственная форма в соответствии с настоящим изобретением позволяет осуществлять контролируемое высвобождение одного или более активного ингредиента.
Краткое описание чертежей
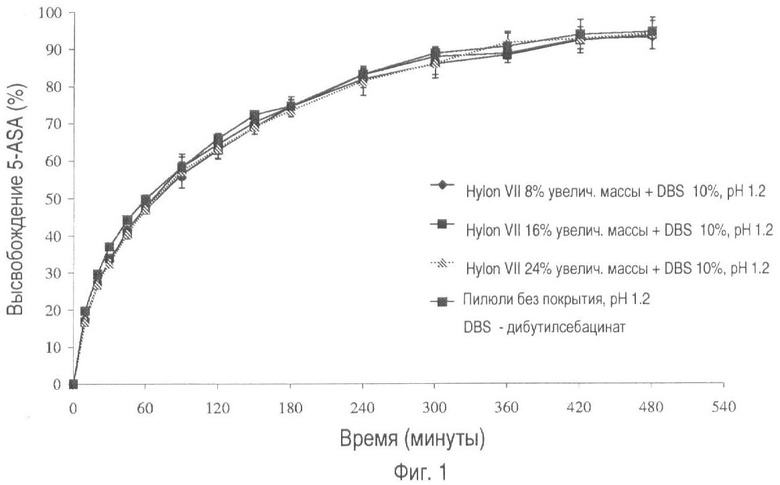
На фиг.1 представлено высвобождение лекарственного средства из пилюль, не имеющих покрытия, и пилюль, покрытых Hylon® VII (общее увеличение массы 8, 16 и 24%), пластифицированным 10% вес/вес дибутилсебацинатом при pH 1.2.
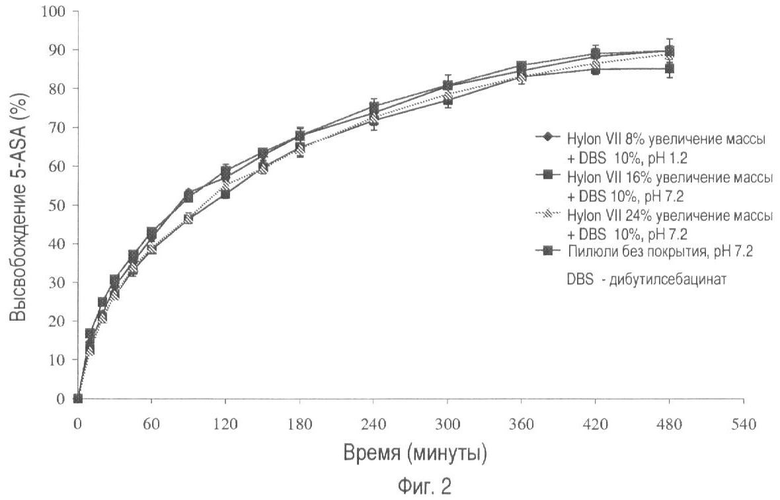
На фиг.2 представлено высвобождение лекарственного средства из пилюль, не имеющих покрытия, и пилюль, покрытых Hylon® VII (общее увеличение массы 8, 16 и 24%), пластифицированным 10% вес/вес дибутилсебацинатом при pH 7.2.
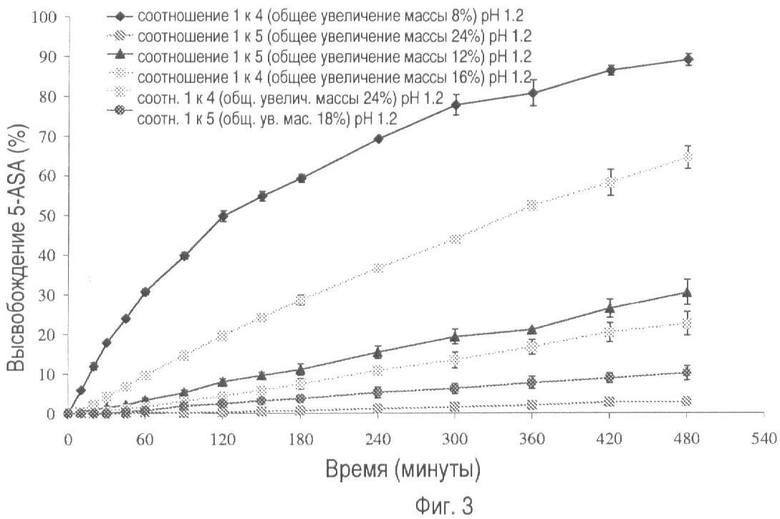
На фиг.3 представлено высвобождение лекарственного средства из пилюль, покрытых композицией, включающей Hylon® VII и Surelease®, в соотношениях 1:4 и 1:5 с различным увеличением массы покрытия при pH 1.2.
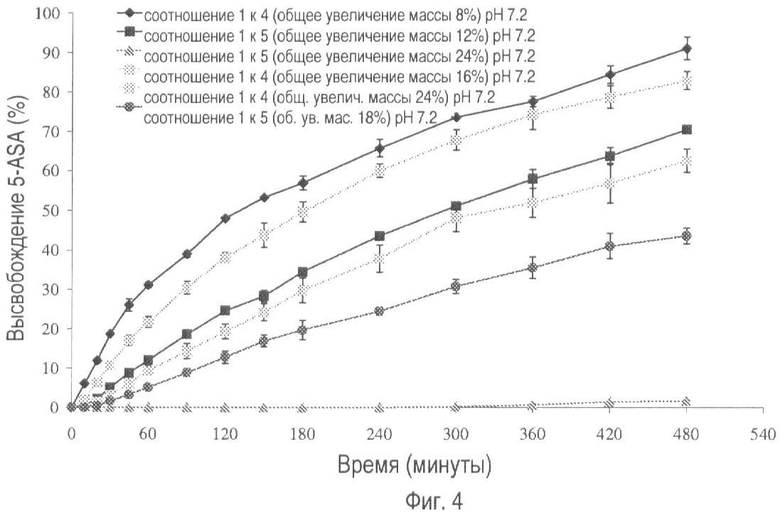
На фиг.4 представлено высвобождение лекарственного средства из пилюль, покрытых композицией, включающей Hylon® VII и Surelease®, в соотношениях 1:4 и 1:5 с различным увеличением массы покрытия при pH 7.2.
На фиг.5 представлено высвобождение лекарственного средства из пилюль, покрытых композицией, включающей Hylon® VII/Hylon® и Surelease®, в соотношении 1:5 (общее увеличение массы 24%) при pH 1.2 и pH 7.2.
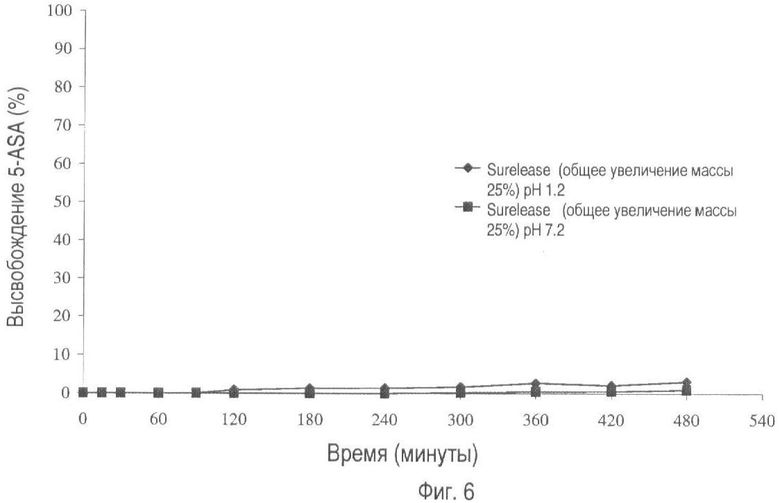
На фиг.6 представлено высвобождение лекарственного средства из пилюль, покрытых Surelease® (общее увеличение массы 25%), при pH 1.2 и pH 7.2.
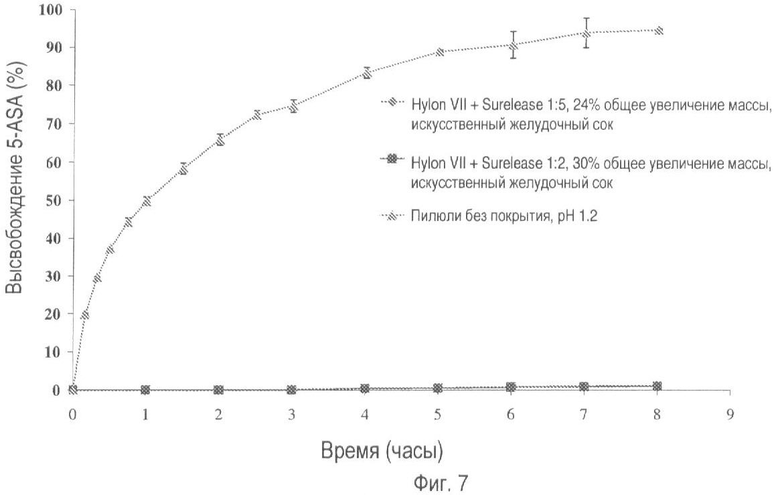
На фиг.7 представлено высвобождение лекарственного средства из пилюль, покрытых Hylon® VII и Surelease®, в соотношениях 1:2 и 1:5 (общее увеличение массы покрытия 30% и 24% соответственно) в искусственном желудочном соке.
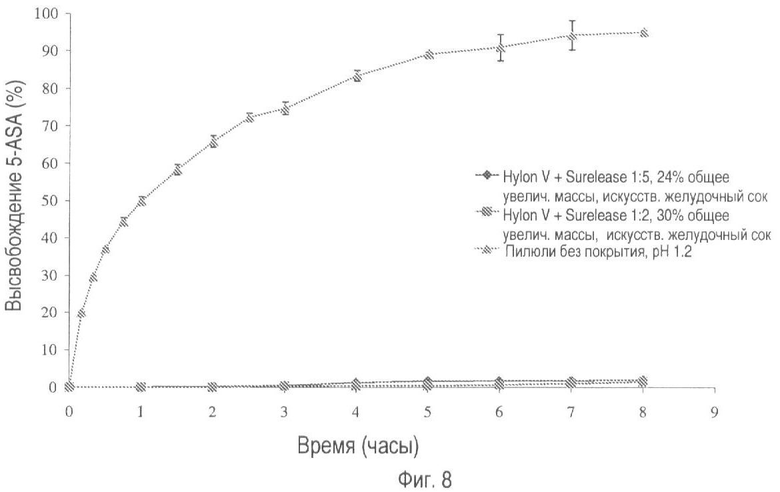
На фиг.8 представлено высвобождение лекарственного средства из пилюль, покрытых Hylon® V и Surelease®, в соотношениях 1:2 и 1:5 (общее увеличение массы покрытия 30% и 24% соответственно) в искусственном желудочном соке.
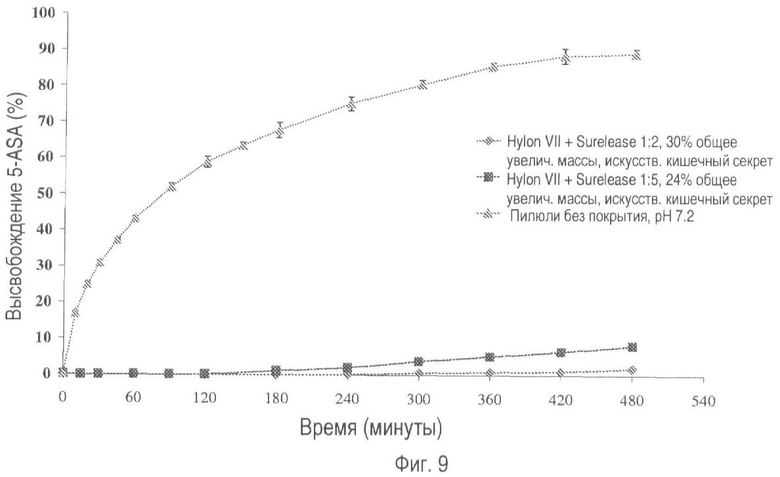
На фиг.9 представлено высвобождение лекарственного средства из пилюль, покрытых Hylon® VII и Surelease®, в соотношениях 1:2 и 1:5 (общее увеличение массы покрытия 30% и 24% соответственно) в искусственном кишечном секрете.
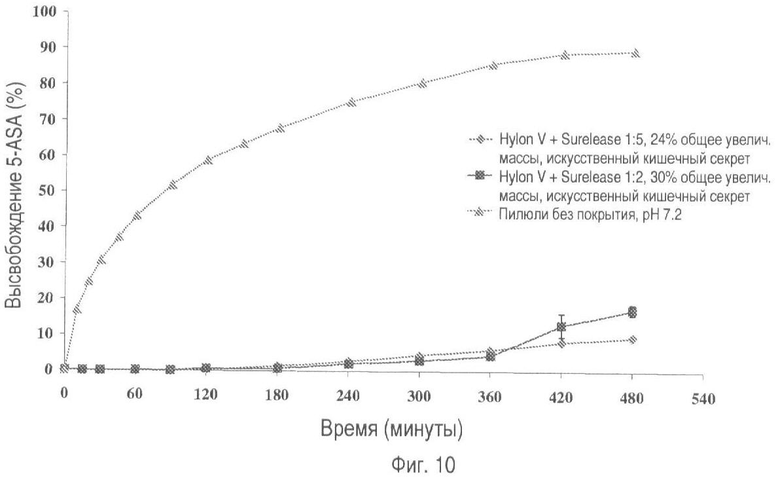
На фиг.10 представлено высвобождение лекарственного средства из пилюль, покрытых Hylon® V и Surelease®, в соотношениях 1:2 и 1:5 (общее увеличение массы покрытия 30% и 24% соответственно) в искусственном кишечном секрете.
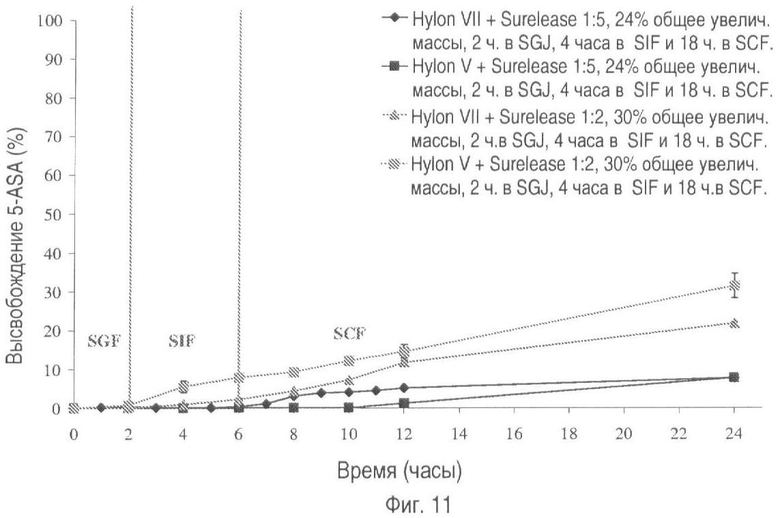
На фиг.11 представлено высвобождение лекарственного средства из пилюль, покрытых Hylon® VII/Hylon® V и Surelease®, в соотношениях 1:2 и 1:5 (общее увеличение массы покрытия 30% и 24% соответственно), в течение 2-х часов в искусственном желудочном соке (SGJ, от англ. Simulated Gastric Juice) с последующим высвобождением в течение 4-х часов в искусственном кишечном секрете (SIF, от англ. Simulated Intestinal Fluid) и в течение 18 часов в искусственном секрете толстого кишечника (SCF, от англ. Simulated Colonic Fluid).
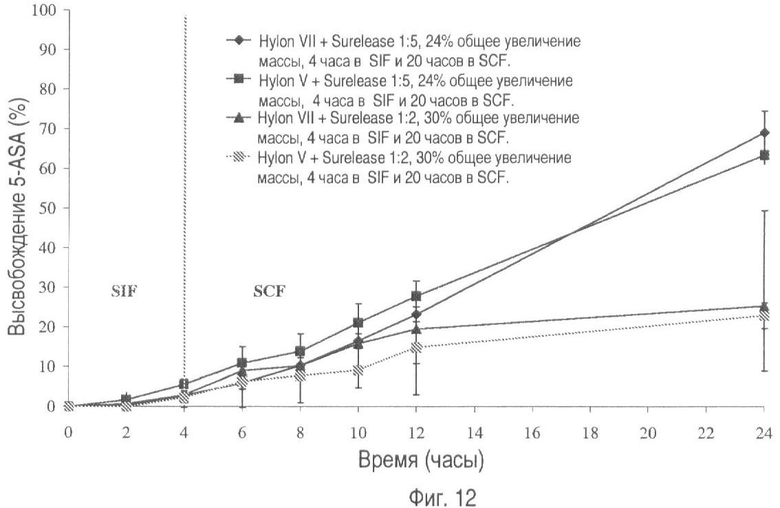
На фиг.12 представлено высвобождение лекарственного средства из пилюль, покрытых Hylon® VII или Hylon® V и Surelease®, в соотношениях 1:2 и 1:5 (общее увеличение массы покрытия 30% и 24% соответственно), в течение 4-х часов в искусственном кишечном секрете (SIF) с последующим высвобождением в течение 20 часов в искусственном секрете толстого кишечника.
Подробное описание изобретения
Композиция для создания покрытий в соответствии с настоящим изобретением включает водную среду и диспергированный в ней крахмал, а также формирующий пленку агент, который контролирует набухание крахмала в указанной водной среде.
Водной средой может быть любая подходящая среда, известная из области техники, возможно, она может быть представлена и неводной (например, органической) средой. Согласно определенному варианту осуществления данного изобретения средой является вода или смесь воды со спиртом (например, смесь воды и этанола).
В водной среде диспергирован крахмал. Термин "крахмал", используемый в контексте настоящего изобретения, относится к амилозе и амилопектину, содержащим углеводород. Могут использоваться крахмалы с различным соотношением амилоза: амилопектин. Крахмал может, например, содержать, приблизительно от 10 до 80% амилозы и, приблизительно, от 20 до 90% амилопектина. Предпочтительно использовать крахмал, который содержит, приблизительно, от 50 до 30% амилопектина. Также необходимо упомянуть крахмалы с высоким содержанием амилозы, то есть такие крахмалы, которые содержат относительно большое количество амилозы и небольшое количество амилопектина соответственно. Особым вниманием пользуются крахмалы, которые содержат, по крайней мере, 40% амилозы, в особенности, по крайней мере, 50% амилозы, предпочтительно, по крайней мере, 60% амилозы и еще более предпочтительно, по крайней мере, 70% амилозы. Примерами подходящих крахмалов являются Hylon® V (кукурузный крахмал, содержащий, приблизительно, 70% амилозы) и Hylon® VII (кукурузный крахмал, содержащий, приблизительно, 50% амилозы), оба продукта можно получить в национальной химической компании.
В общем, при воздействии водной среды происходит набухание крахмала, выраженное в различной степени. В том случае если крахмал подвергается излишнему набуханию, активный ингредиент может высвобождаться до того, как лекарственная форма достигнет толстого кишечника. Композиция для создания покрытий, заявленная в соответствии с настоящим изобретением, также содержит формирующий пленку агент, который контролирует набухание крахмала. Таким агентом обычно является агент, препятствующий набуханию крахмала, однако иногда бывают обстоятельства, требующие использования агента, усиливающего набухание крахмала. К подходящим агентам относятся вещества, которые полностью нерастворимы в воде. Особым вниманием пользуются полимеры, которые совершенно нерастворимы в воде, исключительным примером является этилцеллюлоза и полиметакрилаты с низкой проницаемостью (например, Eudragit® RS или аналогичные препараты). Агент, например этилцеллюлоза, может использоваться в форме дисперсии, в частности водной дисперсии.
Композиция также может включать пластификатор для того, чтобы усилить формирование покрытия, контролировать его проницаемость и улучшить механические свойства. Известно целое множество пластификаторов, примерами являются эфиры ди- и трикарбоновых кислот, такие как триэтилцитрат, глицеролтриацетат, ацетилтрибутилцитрат, трибутилцитрат, триацетин и дибутилсебацинат. Особого внимания требует дибутилсебацинат.
Композиция для создания покрытий может быть приготовлена путем простого смешивания водной среды, крахмала и формирующего пленку агента.
Композиция для создания покрытий в соответствии с настоящим изобретением может быть приготовлена, например, следующим образом. Сначала крахмал диспергируют в воде или другой водной среде с образованием дисперсии крахмала. Этот этап может осуществляться при температуре, варьирующей, приблизительно, от комнатной до, приблизительно, 100°С, например при температуре, приблизительно, от 75 до 85°С, в частности при температуре, приблизительно, 80°С. Полученную дисперсию оставляют охлаждаться, если это необходимо (например, приблизительно, до 60-70°С). Затем к дисперсии крахмала добавляют формирующий пленку агент. Этот этап может осуществляться путем добавления агента в дисперсной форме, например в форме водной дисперсии. Может использоваться дисперсия этилцеллюлозы в воде или смеси воды и этанола. Согласно одному варианту осуществления изобретения к дисперсии крахмала добавляют водную дисперсию, содержащую формирующий пленку агент и пластификатор. В этом случае может использоваться водная дисперсия, содержащая этилцеллюлозу и дибутилсебацинат. Необходимо упомянуть водные дисперсии, содержащие этилцеллюлозу, дибутилсебацинат и один или более стабилизатор (например, дисперсии Surelease® компании Colorcon).
Полученная композиция затем может применяться для создания покрытия фармацевтических или других (например, диагностических) лекарственных форм. Подходящие способы образования покрытий, в кипящем слое или дражированном котле, хорошо известны из области техники. Особым преимуществом настоящего изобретения является то, что покрытие после нанесения не требует дополнительной обработки.
На скорость высвобождения активного ингредиента из лекарственной формы также влияет толщина покрытия. В зависимости от растворимости активного ингредиента в лекарственной форме, при использовании более толстых покрытий замедляется его высвобождение. Более толстые покрытия также необходимы в случае использования хорошо растворимых активных материалов, чтобы получить лекарственную форму, обеспечивающую адекватный контроль высвобождения активного ингредиента в толстой кишке.
Подходящая толщина покрытия может достигаться стандартными способами, однако в качестве руководства необходимо уточнить, что толщина покрытия, приблизительно, от 10 до 60 мкм является предпочтительной, в частности от 20 до, приблизительно, 50 мкм. Во многих случаях толщина покрытия должна составлять, по крайней мере, 30 мкм. Отдельно необходимо упомянуть толщину покрытия, составляющую, приблизительно, от 30 до 60 мкм, например от 40 до 50 мкм. Толщина покрытия может быть оптимизирована для обеспечения специфического высвобождения активного ингредиента в желаемом отделе кишечного тракта. Изменяя толщину покрытия можно обеспечить поступление активных ингредиентов с различной степенью растворимости в толстый кишечник.
Толщина покрытия также может быть выражена через общее увеличение массы, то есть через процентное увеличение массы лекарственной формы после нанесения покрытия. Эта величина в норме составляет от 10 до 40%. В частности, после нанесения покрытия общее увеличение массы может составлять, приблизительно, от 15 до 40%, более предпочтительно, приблизительно, от 20 до 35%.
Профиль растворимости активного ингредиента также можно контролировать за счет изменения пропорционального соотношения компонентов в композиции для создания покрытия. В таком случае максимально уменьшается высвобождение лекарственного средства в верхних отделах желудочно-кишечного тракта и происходит в толстом кишечнике. Во многих случаях желательно, чтобы композиция содержала относительно небольшое количество крахмала и относительно большое количество формирующего пленку агента. Таким образом, например, соотношение крахмала и формирующего пленку агента может варьировать, приблизительно, от 1:1 до 1:6. Специфические соотношения составляют, приблизительно, от 1:2 до 1:5, например, приблизительно, от 1:4 до 1:5.
Желудочный сок, обладающий высокой кислотностью, может взаимодействовать с покрытием, что затрудняет переваривание крахмала. В этом случае желательно применить дополнительное, кишечное покрытие, которое препятствует растворению композиции в желудке. Может использоваться любое подходящее кишечное покрытие, известное из области техники. Особым предпочтением пользуются кишечные покрытия, которые растворяются при pH 5.5 или выше. Особого упоминания заслуживают кишечные покрытия, содержащие водную дисперсию сополимеров метакриловой кислоты и этилакрилата (например, Kollicoat MAE 30 DP).
Лекарственная форма, заявленная в соответствии с настоящим изобретением, обычно представляет собой твердую лекарственную форму для перорального применения. К подходящим лекарственным формам относятся пилюли, таблетки, капсулы, порошки, гранулы и экструдируемые формы. Пилюли могут быть сферической формы и иметь диаметр, приблизительно, от 0.1 мм до, приблизительно, 5.0 мм, например от 0.5 мм до 5.0 мм, в частности, приблизительно, от 0.5 мм до, приблизительно, 2.5 мм, более предпочтительно, от 0.8 мм до 1.5 мм.
Лекарственная форма может содержать один или более активный ингредиент. Термин "активный ингредиент", употребляемый в контексте настоящего изобретения, относится к пищевым компонентам, фармацевтическим препаратам и другим лекарственным, диагностическим агентам, электропроводящим агентам, без ограничений. Особого внимания требуют соединения или композиции, используемые в медицине и ветеринарии для лечебных и диагностических целей. К лекарственным агентам относятся фармацевтические препараты, вакцины, белки и лекарственные пептиды. Такие агенты могут абсорбироваться в толстом кишечнике или оказывать местное воздействие, что полезно для лечения местных патологических процессов. Необходимо упомянуть аминосалицилаты (например, бальсалазид, месалазин, олсалазин и сульфосалазин) и кортикостероиды (например, гидрокортизон, будезонид и преднизолон). Альтернативно, композиция может содержать один или более диагностический агент. К диагностическим агентам относятся, например, агенты, используемые для рентгенологических и МРТ-исследований. Новым подходом в диагностике является доставка потенциально аллергенных пищевых продуктов в толстый кишечник для установления характера аллергии. Каждый такой активный ингредиент обычно находится в ядре, покрытом композицией, заявленной в соответствии с настоящим изобретением.
Лекарственная форма, заявленная в соответствии с настоящим изобретением, может содержать активный ингредиент, покрытый крахмалом и агентом, контролирующим набухание крахмала, при этом набухание крахмала в верхних отделах желудочно-кишечного тракта функциональным образом контролируется и замедляется, что позволяет активному ингредиенту в нужных количествах высвобождаться в толстом кишечнике. Лекарственная форма обычно имеет покрытие, которое препятствует взаимодействию крахмала с секретами верхних отделов желудочно-кишечного тракта (предшествующих толстому кишечнику). Согласно одному варианту осуществления изобретения лекарственная форма содержит дополнительные растворители, наполнители и/или носители.
Настоящее изобретение имеет особое применение для получения лекарственных форм, которые содержат, например, пептиды, белки и молекулы нуклеиновых кислот, например олигонуклеотиды, например вакцины. Пероральная доставка белков, пептидов и молекул нуклеиновых кислот, например олигонуклеотидов, представляет определенную сложность из-за наличия биологических барьеров, ограничивающих абсорбцию белков и пептидов в желудочно-кишечном тракте, таких как вариабельность рН, ферментативное расщепление и мембранный поток. Таким образом, настоящее изобретение относится к композициям, которые доставляют активные ингредиенты непосредственно в толстый кишечник, секрет которого обладает меньшей протеолитической активностью по сравнению с секретом других отделов желудочно-кишечного тракта, и поэтому такие композиции могут применяться для доставки лекарственных средств на основе пептидов, белков или молекул нуклеиновых кислот. Таким образом, согласно одному варианту осуществления настоящего изобретения композиция содержит активный ингредиент, выбранный из группы, включающей пептиды, белки, молекулы нуклеиновых кислот, например олигонуклеотиды, и их комбинации.
Специфическим активным ингредиентом является 5-аминосалициловая кислота (5-ASA), лекарственное средство, которое применяется перорально для лечения заболеваний толстого кишечника. Если свободная 5-ASA вводится перорально, только незначительное количество лекарственного средства достигает толстой кишки, поскольку происходит его инактивация и/или абсорбция в желудке и тонкой кишке. Настоящее изобретение относится к лекарственной форме, содержащей 5-ASA, которая может вводиться перорально и обеспечивает отсроченное высвобождение необходимого количества активного ингредиента в толстом кишечнике. Обычно 5-ASA представлена в форме сферических пилюль, в которых она подходящим образом смешана с микрокристаллической целлюлозой, при необходимости к смеси может быть добавлено минимальное количество неорганического связывающего агента, такого как бентонит, но это не является обязательным.
Действующая доза каждого активного ингредиента в композиции может варьировать таким образом, чтобы достичь желаемого терапевтического ответа у пациента, с учетом лекарственной формы и способа ее введения. Выбор дозы будет зависеть от активности определенного соединения, пути его введения, тяжести заболевания, подлежащего лечению, и медицинского анамнеза пациента, которому проводится лечение. Однако специалисту в данной области очевидно, что стартовая доза соединения всегда ниже дозы, необходимой для достижения желаемого терапевтического эффекта, и во время лечения происходит постепенное увеличение дозы до тех пор, пока не будет достигнут нужный ответ.
Примерная доза активного ингредиента составляет, приблизительно, от 0.01 до, приблизительно, 500 мг на 1 кг массы тела пациента в день, при этом указанная доза может вводиться однократно или быть разделена на несколько приемов. В частности, доза активного ингредиента может составлять, приблизительно, от 0.1 до 250 мг/кг в день, например от 0.5 до 100 мг/кг в день. Подходящая доза может также варьировать, приблизительно, от 0.01 до 250 мг/кг в день, приблизительно, от 0.05 до 100 мг/кг в день, или, приблизительно, от 0.1 до 50 мг/кг в день. В данных пределах доза может составлять 0.05-0.5, 0.5-5 или 5-50 мг/кг в день. Для перорального введения композиции могут содержать от 1.0 до 1000 миллиграммов активного ингредиента, в частности 1.0, 5.0, 10.0, 15.0, 20.0, 25.0, 50.0, 75.0, 100.0, 150.0, 200.0, 250.0, 300.0, 400.0, 500.0, 600.0, 750.0, 800.0, 900.0 и 1000.0 миллиграммов активного ингредиента для симптоматического подбора дозы пациенту, получающему лечение. Лекарственная форма может вводиться от 1 до 4 раз в день, предпочтительно, один или два раза в день. Режим дозирования может быть изменен для достижения оптимального терапевтического ответа.
Необходимо учитывать, что каждый активный ингредиент может быть смешан с другим носителем, подходящим для определенного использования. Таким образом, лекарственная форма, в частности ее ядро, может также содержать один или более: а) наполнитель или разбавитель, такой как крахмал, лактоза, сахароза, глюкоза, маннитол и кремниевая кислота; б) связующий агент, такой как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; в) увлажнитель, такой как глицерол; г) дезинтегрирующий агент, включая неорганические соединения, такие как оксид железа, сульфат бария и карбонат кальция; д) агент, замедляющий образование раствора, например воск; е) усилитель абсорбции такой как четвертичные аммониевые соединения; ж) смачивающий агент, такой как цетиловый спирт и глицерола моностеарат; з) абсорбент, такой как каолин и бентонитовая глина; и) любрикант, такой как тальк, стеарат кальция, стеарат магния, твердый полиэтиленгликоль, лаурилсульфат натрия и их смеси. Лекарственная форма также может содержать буферный агент.
Настоящее изобретение также относится к использованию крахмала в производстве лекарственного средства или диагностической лекарственной формы для высвобождения активного ингредиента(ов) в толстом кишечнике.
Согласно одному варианту осуществления настоящего изобретения лекарственное средство представляет собой пептид, белок или молекулу нуклеиновой кислоты, например олигонуклеотид, или их комбинацию. Предпочтительно, лекарственное средство представляет собой активный ингредиент, который, как правило, разрушается в верхних отделах желудочно-кишечного тракта и не достигает толстого кишечника.
Согласно одному варианту осуществления изобретения лекарственное средство предназначено для лечения местных патологических процессов и заболеваний толстого кишечника. Например, таким местным заболеванием может быть болезнь Крона, язвенный колит, колоректальный рак или амебиаз.
Необходимо учитывать, что объектом настоящего изобретения (без ограничений указанными) являются фармацевтические и диагностические лекарственные формы, имеющие покрытие, содержащее крахмал, как описано выше, при этом крахмал не является стекловидным или аморфным, но является частично или полностью кристаллическим, например частично кристаллическим.
Кроме того, настоящее изобретение относится к способу защиты фармацевтической или диагностической лекарственной формы от воздействия ферментов верхних отделов желудочно-кишечного тракта, при этом такая лекарственная форма разрушается ферментами толстой кишки; указанный способ заключается в нанесении на лекарственную форму покрытия, содержащего крахмал.
Представленные ниже Примеры иллюстрируют настоящее изобретение.
Пример 1: Приготовление пилюль с покрытием
Приготовление пилюль с лекарственным средством
Пилюли, содержащие 50% опытного лекарственного средства 5-амииносалициловой кислоты (5-ASA), микрокристаллическую целлюлозу (Avicel® PH 101), получают при помощи способа экструзии-сфероидизации. 5-ASA, микрокристаллическую целлюлозу (50:50 в весовом соотношении) и дистиллированную воду по мере необходимости смешивают между собой с формированием сырой массы, которую затем подвергают экструзии и сфероидизации с образованием пилюль. Затем пилюли высушивают на пористом подносе при комнатной температуре в течение 48 часов и просеивают с получением пилюль размером от 1.00 до 1.40 мм.
Приготовление покрытий из крахмала
Hylon® VII диспергируют в воде и нагревают до 80±5°С. Полученную дисперсию пластифицируют 10% в весовом соотношении дибутилсебацинатом в соответствии с сухой массой крахмала. Различную толщину покрытия получают за счет изменения количества крахмала в покрывающей дисперсии.
Приготовление покрытий из крахмала и этилцеллюлозы
Крахмал Hylon® VII или Hylon® V диспергируют в воде при постоянном перемешивании и нагревают до 80±5°С. Полученную дисперсию охлаждают, после чего к ней при постоянном перемешивании добавляют дисперсию этилцеллюлозы (Surelease®) до тех пор, пока дисперсии полностью не перемешаются между собой. Различную толщину покрытия получают путем изменения количества Hylon® VII в покрывающей дисперсии. Получают дисперсии, содержащие 1 часть Hylon® VII/Hylon® V и 4 или 5 частей этилцеллюлозы (Surelease®) и пластифицированные 10% дибутилсебацинатом (в зависимости от сухой массы полимеров).
Приготовление покрытий из этилцеллюлозы
Дисперсии этилцеллюлозы получают на основе Surelease® при тех же условиях, как и дисперсии крахмала-этилцеллюлозы, путем смешивания компонентов с тем же количеством дистиллированной воды при 70°С.
Формирование покрытия пилюль
Для создания покрытия 5-ASA пилюль из дисперсий, описанных выше, применяют способ создания покрытий в "кипящем слое" по Wurster. Во время процесса образования покрытий дисперсии выдерживают при температуре 70°С. Устанавливают следующие параметры: объем партии 30 г, температура на входе 60°С, температура продукта 40-45°С, температура на выходе 40-45°С, скорость потока 0.7-0.8 мл/мин, диаметр выходного отверстия 1.00, давление при распылении 2.2-2.4 бар. Покрытые пилюли высушивают в закрытой сушилке в "кипящем слое" в течение 10 минут при 60°С. Дополнительной обработки полученного покрытия не требуется.
Пример 2: Исследование высвобождения лекарственного средства
Высвобождение 5-ASA из покрытых пилюль, полученных в Примере 1, измеряют при помощи диссолюционного прибора, имеющего лопасти, согласно способу фармакопеи США. Все исследования проводят трехкратно, в 900 мл растворяющей среды при температуре 37±1°С и скорости вращения лопастей прибора 100 оборотов в минуту. Используют следующую растворяющую среду: (а) 0.1 н. HCl (pH 1.2), (б) фосфатный буфер (pH 7.2), (в) искусственный желудочный сок, (г) искусственный кишечный секрет, (д) искусственный секрет толстого кишечника. Профили растворения представлены на фиг. 1-12.
Пилюли, покрытые крахмалом
На фиг.1 и 2 показан профиль растворения пилюль, покрытых крахмалом и пластификатором, при pH 1.2 и pH 7.2 соответственно. При указанных условиях из пилюль происходит высвобождение существенного количества лекарственного вещества в результате выраженного набухания крахмала в водном растворителе.
Пилюли, покрытые этилцеллюлозой
На фиг.6 показан профиль растворения пилюль, покрытых этилцеллюлозой. На чертеже показано, что пленка из этилцеллюлозы без содержания крахмала не пропускает лекарственное вещество.
Пилюли, покрытые крахмалом и этилцеллюлозой
На фиг.3 и 4 показан профиль растворения пилюль, покрытых крахмалом, этилцеллюлозой и пластификатором, при pH 1.2 и 7.2 соответственно. Оценивается также общее увеличение массы и влияние соотношения крахмал: этилцеллюлоза. С увеличением количества этилцеллюлозы по отношению к количеству крахмала происходит существенное уменьшение скорости растворения. Общее увеличение массы оказывает такой же эффект. Покрытие, в котором соотношение крахмал:этилцеллюлоза составляет 1:5, а общее увеличение массы - 24%, обеспечивает самую низкую скорость растворения лекарственного вещества при каждом изучаемом значении pH.
На фиг.5 представлен эффект использования крахмала с различным количеством амилозы.
Выбранные лекарственные формы также оценивают в искусственном желудочном соке (SGJ; В.Р. 2005., приложение XII-B-A187) и искусственном кишечном секрете (SIF), которые содержат пепсин и панкреатин соответственно. На фиг.7-10 показано, что в течение 8-часового периода тестирования было отмечено несущественное высвобождение лекарственного вещества.
Среду толстого кишечника моделируют при помощи α-амилазы Bacillus Licheniformis (концентрация α-амилазы варьировала от 50 Ед/мл до 500 Ед/мл) в фосфатном буфере при pH 7.2. В этом эксперименте пилюли выдерживали в искусственном желудочном соке (SGJ) в течение 2 часов, в искусственном кишечном секрете (SIJ) - 4 часа и в искусственном секрете толстого кишечника (SCF) - 18 часов либо пилюли выдерживали в течение 4-х часов в SIJ и затем в течение 20 часов в SCF, чтобы оценить влияние кислот на покрытие.
На фиг.11 показан эффект переноса определенной пилюли из SGF в SIF и затем в искусственный секрет толстого кишечника (SCF). Когда пилюли, покрытые Hylon® VII/Hylon® V и Surelease® в соотношении 1:5 (общее увеличение массы 24%), помещают в SGF и затем переносят в SIF, высвобождение лекарственного вещества ослабляется.
На фиг.12 показано, как изменяется профиль растворения, когда указанные лекарственные формы помещают в SIF, а затем на 20 часов в SCF. В этом случае высвобождение лекарственного вещества в SIF сравнимо с тем, что представлено на фиг.11, а это позволяет предположить, что между компонентами покрытия при более низком pH SGF происходят некие взаимодействия.
Таким образом, покрывающая дисперсия, содержащая 1 часть Hylon® VII/Hylon® V и 5 частей Surelease® с общим увеличением массы на 24%, ослабляет высвобождение лекарственного средства в искусственно созданных условиях среды желудка и тонкого кишечника. В присутствии ферментов толстого кишечника высвобождение 5-ASA было существенно более выраженным, что делает систему пригодной для доставки лекарственных средств непосредственно в толстый кишечник.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2646825C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2478372C2 |
| ПЕЛЛЕТЫ КОЛЕСТИРАМИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2775800C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ АЗИТРОМИЦИНА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 1995 |
|
RU2130311C1 |
| СОСТАВ С ВЫСВОБОЖДЕНИЕМ В ТОЛСТОМ КИШЕЧНИКЕ | 2003 |
|
RU2327446C2 |
| ПЕРОРАЛЬНЫЙ СОСТАВ ХОЛЕСТИРАМИНА И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2750944C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ АНТАГОНИСТОВ МЕТАБОТРОПНОГО ГЛУТАМАТНОГО РЕЦЕПТОРА 5 (MGLU5) | 2011 |
|
RU2602955C2 |
| СОСТАВ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ ДЛЯ СНИЖЕНИЯ ЧАСТОТЫ МОЧЕИСПУСКАНИЯ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2603471C2 |
| ПЕЛЛЕТЫ ХОЛЕСТИРАМИНА, ПЕРОРАЛЬНЫЕ КОМПОЗИЦИИ ХОЛЕСТИРАМИНА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2782016C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ПРОИЗВОДНЫХ 5-НИТРОИМИДАЗОЛА | 1995 |
|
RU2152212C1 |

Изобретение относится к композиции покрытия лекарственного средства для его доставки в толстый кишечник, которая содержит воду и диспергированный в ней крахмал, содержащий, по меньшей мере, 40% амилозы, а также формирующий пленку агент - нерастворимый в воде полимер, который контролирует набухание крахмала при воздействии указанной водной среды. Изобретение также относится к лекарственной форме для доставки в толстый кишечник, которая содержит активный агент и указанное покрытие. Раскрываются также способ получения композиции покрытия, включающий смешивание входящих в нее ингредиентов, а также способ лечения или диагностики заболеваний или патологических состояний толстого кишечника. Изобретение обеспечивает легкое и быстрое приготовление композиции с высвобождением активного вещества в толстом кишечнике. 6 н. и 19 з.п. ф-лы, 12 ил.
1. Композиция покрытия лекарственного средства для его доставки в толстый кишечник, содержащая воду и диспергированный в ней крахмал, содержащий по меньшей мере 40% амилозы, а также формирующий пленку агент, представляющий собой не растворимый в воде полимер, который контролирует набухание крахмала в водной среде.
2. Композиция по п.1, в которой крахмал содержит до 80% амилозы и приблизительно 20% амилопектина.
3. Композиция по п.1, в которой крахмал содержит приблизительно 80% амилозы.
4. Композиция по п.1, в которой крахмал содержит приблизительно от 50 до приблизительно 70% амилозы.
5. Композиция по п.1, в которой формирующий пленку агент ингибирует набухание крахмала в воде.
6. Композиция по п.1, в которой формирующий пленку агент представляет собой этилцеллюлозу.
7. Композиция по п.1, в которой соотношение крахмала и формирующего пленку агента составляет приблизительно от 1:1 до приблизительно 1:6.
8. Композиция по п.1, которая дополнительно содержит пластификатор.
9. Композиция по п.8, в которой пластификатором является дибутилсебацинат.
10. Лекарственная форма для доставки в толстый кишечник, покрытая композицией по любому из предшествующих пунктов.
11. Лекарственная форма по п.10, которая имеет ядро, включающее, по крайней мере, один активный ингредиент, при этом ядро покрыто указанной композицией.
12. Лекарственная форма для доставки в толстый кишечник, содержащая активный агент и покрытие, содержащее воду и диспергированный в ней крахмал, содержащий по меньшей мере 40% амилозы, а также формирующий пленку агент, представляющий собой не растворимый в воде полимер, который контролирует набухание крахмала в водной среде.
13. Лекарственная форма по любому из пп.10-12, у которой активный ингредиент представляет собой фармацевтический препарат, вакцину, белок или пептид.
14. Лекарственная форма по любому из пп.10-12, у которой активный ингредиент представляет собой диагностический агент.
15. Лекарственная форма по любому из пп.10-12, которая дополнительно имеет внешнее кишечное покрытие.
16. Лекарственная форма по любому из пп.10-12, у которой кишечное покрытие содержит сополимер, получаемый путем полимеризации мономеров, включающих метакриловую кислоту и этилакрилат.
17. Лекарственная форма по любому из пп.10-12, используемая для лечения или диагностики.
18. Лекарственная форма по п.17, предназначенная для лечения или диагностики заболеваний или патологических состояний толстого кишечника.
19. Лекарственная форма по любому из пп.10-12, которая представляет собой лекарственную форму с контролируемым высвобождением активного вещества.
20. Способ лечения или диагностики заболеваний или патологических состояний толстого кишечника, заключающийся во введении лекарственной формы по любому из пп.10-19.
21. Способ получения композиции по любому из пп.1-9, включающий смешивание воды, крахмала, содержащего по меньшей мере 40% амилозы, а также формирующего пленку агента, представляющего собой не растворимый в воде полимер, который контролирует набухание крахмала в водной среде.
22. Способ по п.21, который включает смешивание дисперсии, включающей крахмал, с дисперсией, содержащей формирующий пленку агент.
23. Способ по пп.21 и 22, при котором дисперсия, содержащая формирующий пленку агент, дополнительно содержит пластификатор.
24. Способ по п.21, который дополнительно включает покрытие указанной композицией лекарственной формы.
25. Применение лекарственной формы по любому из пп.10-19 для лечения или диагностики заболеваний или патологических состояний толстого кишечника.
| Гидразоны 2-метил-4- -фталазонов, проявляющие стерилизующие свойства по отношению к комнатной мухе | 1976 |
|
SU570606A1 |
| US 6703044, 09.03.2004 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Химическая энциклопедия | |||
| /Под ред | |||
| И.Л.Кнунянца | |||
| - М., 1990, т.2. | |||
Авторы
Даты
2012-01-20—Публикация
2007-07-20—Подача