Настоящее изобретение относится к лекарственной форме с отсроченным высвобождением с ядром, включающим лекарственное средство, и покрытие, обеспечивающим отсроченное высвобождение. В частности, изобретение относится к лекарственной форме с отсроченным высвобождением лекарственного средства для доставки в толстую кишку.
Направленная доставка лекарственных средств в толстую кишку может использоваться в качестве средства местной терапии или для системного лечения. Толстая кишка подвержена множеству заболеваний, включая воспалительное заболевание кишки, синдром раздраженной кишки, запор, диарею, инфекцию и карциному. При таких состояниях направленная доставка лекарственного средства в толстую кишку максимально увеличивает терапевтическую эффективность лечения. Толстую кишку также можно использовать как точку для введения лекарственных средств в большой круг кровообращения. Разрабатывались различные лекарственные формы для доставки лекарственного средства в толстую кишку, включая пролекарства, а также дозированные формы, при этом последние более популярны, поскольку однажды разработанная концепция может быть использована и с другими лекарственными средствами.
Бактериальную флору толстой кишки более высокого порядка также использовали для разработки дозированных форм доставки лекарственного средства в толстую кишку для применения в качестве носителей природных полисахаридных комплексов, которые являются субстратами для многочисленных ферментов бактерий, населяющих толстую кишку. Эти вещества способны неповрежденными пройти верхнюю область желудочно-кишечного тракта, но расщепляются на входе в толстую кишку. На данный момент изученные вещества включают аморфную амилозу, пектин, хитозан и галактоманнан.
Аморфная амилоза устойчива к расщеплению ферментами верхних отделов желудочно-кишечного тракта. Тем не менее она ферментируется в толстой кишке α-амилазными ферментами, продуцируемыми более чем половиной из 400 видов бактерий толстой кишки.
Основным преимуществом использования полисахаридов в этом подходе с бактериальными ферментами к доставке лекарственного средства в толстую кишку является то, что используемые вещества пригодны для употребления в пищу и, таким образом, безопасны для людей. Они обычно применяются в качестве покрытий или включаются в материал ядра в качестве матричного носителя, и их расщепление при входе в толстую кишку ферментами бактерий толстой кишки приводит к высвобождению лекарственного средства. Пример такой лекарственной формы, в которой используется амилозное покрытие, раскрыт в EP-A-0343993 (BTG International Limited).
Впрочем, основное ограничение при использовании таких природных веществ заключается в том, что они чрезмерно набухают в водных средах, что приводит к вымыванию лекарственного средства в верхних областях желудочно-кишечного тракта. Для преодоления этой проблемы их использовали в смеси с непроницаемыми веществами (например, аморфной амилозой, смешанной с нерастворимым в воде этилцеллюлозным полимером). Тем не менее, проблема таких модификаций/смесей - поиск подходящего баланса между гидрофобностью и гидрофильностью, который бы предотвратил несвоевременное высвобождение лекарственного средства в верхних областях желудочно-кишечного тракта и в то же время обеспечил доступ ферментов к полисахаридному субстрату и гарантировал адекватную скорость высвобождения лекарственного средства в толстой кишке.
Попытка решить проблему чрезмерного набухания амилозы раскрыта в EP-A-0502032 (British Technology Group Ltd). Там используют внешнее покрытие, включающее пленкообразующий целлюлозный или акрилатный полимерный материал, и аморфную амилозу для таблетки, включающей активное соединение. Один вариант выполнения изобретения представляет собой активное соединение, покрытое сначала внутренним амилозным слоем, а затем отдельным внешним слоем акрилатного или целлюлозного полимерного материала. Другим вариантом выполнения изобретения является внешнее покрытие, которое представляет собой смесь амилозы и целлюлозного или акрилатного полимера. Из этого источника ясно, что разложение целлюлозных материалов in vivo, по существу, не зависит от pH, и, предпочтительно, что это также верно для акрилатных материалов. Каждый пример, приведенный в указанном источнике, раскрывает независимый от рН целлюлозный или акрилатный полимер.
В статье в Journal of Controlled Release (Milojevic et al, 38, (1996), 75-84) сообщается о результатах исследований, касающихся включения ряда нерастворимых полимеров в амилозное покрытие для контроля набухания амилозы. Проводили оценку ряда сополимеров на основе целлюлозы и акрилата, и было установлено, что для контроля набухания наиболее эффективна коммерчески доступная этилцеллюлоза (Ethocel®). Другой исследуемый покрывающий монослой представлял собой смесь амилозы и двух pH-независимых акриловых полимеров, а именно Eudragit®RS и RL, но было установлено, что такое покрытие не дает таких эффективных результатов. Растворимое в зависимости от рН покрытие из Eudragit® L100 использовалось только в многослойной системе, включающей биологически активный компонент, с внутренним амилозным покрытием и внешним покрытием из Eudragit® L100.
Другая композиция покрытия на основе амилозы раскрыта в WO-A-99/21536 (BTG International Limited). Композиция покрытия включает смесь амилозы и водонерастворимого пленкообразующего полимера, образованного из водонерастворимого целлюлозного или акрилатного полимерного вещества. Как и в EP-A-0502032, ясно, что разложение целлюлозного материала in vivo, по существу, не зависит от pH, и, предпочтительно, что это также верно для акрилатных материалов. По-видимому, в описании PCT заявки содержится опечатка, поскольку там указывается, что предпочтительным типом акрилатного материала является “Eudragit L, разложение которого не зависит от pH”. Предполагается, что это относится к “Eudragit® RL”, разложение которого действительно не зависит от pH. Это не может относиться к Eudragit® L, поскольку разложение этого полимера зависит от pH.
В WO-A-99/25325 (BTG International Limited) также раскрывается обеспечивающее отсроченное высвобождение покрытия, включающее амилозу и (предпочтительно) этилцеллюлозу или, альтернативно, акрилатный полимер, разложение которого не зависит от pH. Композиция покрытия также включает пластификатор, а способ находит конкретное применение при приготовлении дозированных форм, включающих активные вещества, нестабильные при температурах выше 60°C, поскольку композицию получают при более низких температурах. Должно быть отмечено, что этот источник также содержит указанную выше опечатку, касающуюся Eudragit® L.
Авторы настоящего изобретения обращают внимание, что в лекарственных формах, раскрытых в источниках BTG, рассмотренных выше, используют покрытия из амилозы, а не из крахмала, и что замедленное высвобождение из лекарственных форм поддерживается в части кишечника.
В WO-A-03/068196 (Alizyme Theraputics Ltd) раскрывается покрытие, обеспечивающее конкретное отсроченное высвобождение для биологически активного компонента, преднизолона натрий метасульфобензоат, включающего стекловидную амилозу, этилцеллюлозу и дибутилсебакат.
Применение полисахаридов, отличных от аморфной амилозы, в обеспечивающем отсроченное высвобождение покрытии раскрыто в GB-A-2367002 (British Sugar PLC). Примеры включают гуаровую камедь, камедь карайи, трагантовую и ксантановую камеди. Микрочастицы таких полисахаридов распределены в водонерастворимой матрице пленкообразующего полимера, которая образована, например, из производного целлюлозы, акрилового полимера или лигнина.
В WO-A-01/76562 (Tampereen Patenttitoimisto Oy) раскрывается пероральная фармацевтическая лекарственная форма, содержащая лекарственное средство и хитозан (полисахарид, полученный из хитина) для контроля его высвобождения. Лекарственное средство и хитозан смешивают в однородную механическую сухую смесь, которую гранулируют и затем, при необходимости, таблетируют. Грануляция может быть выполнена с энтеросолюбильным полимером (таким как сополимер метакриловой кислоты), или на гранулы может быть нанесено пористое энтеросолюбильное покрытие.
В WO-A-2004/052339 (Salvona LLC) раскрывается pH-зависимая система высвобождения лекарственного средства, которая представляет собой сыпучий порошок твердых гидрофобных наносфер, включающих лекарственное средство, инкапсулированных в pH-чувствительные микросферы. Наносферы формируют из комбинации лекарственного средства с восковым материалом и образуют pH-чувствительную микросферу из pH-чувствительного полимера (такого как полимер Eudragit®) в комбинации с чувствительным к воде веществом, таким как полисахарид. Настоящая заявка, однако, предполагает, что очень малые размеры частиц, указанные в этом источнике, на практике не обеспечивают задержку высвобождения биологически активного ядра вне желудка или двенадцатиперстной кишки.
В статье в European Journal of Pharmaceutical Sciences (Akhgari et al, 28, March 2006, 307-314) сообщается о результатах исследований при использовании некоторых полиметакрилатных полимеров для контроля, inter alia, набухания инулина. Исследуемыми полиметакрилатными полимерами являлись Eudragit® RS, Eudragit® RL, 1:1 смесь Eudragit® RS и Eudragit® RL; Eudragit® FS и 1:1 смесь Eudragit® RS и Eudragit® S. В результатах было показано, что полимерные композиции, включающие полиметакрилаты, обеспечивающие замедленное высвобождение, (Eudragit® RS и Eudragit® RL, pH нечувствительные полимеры) с инулином, показали профили набухания, пригодные для использования в качестве покрытий для высвобождения в толстой кишке. Тем не менее, в других результатах было показано, что полимерные композиции, включающие инулин как с Eudragit® FS, так и с 1:1 смесью Eudragit® RS и Eudragit® S (pH зависимые полимеры), не подходили для использования в таком качестве из-за нежелательных профилей набухания.
В US-A-5422121 (Rohm GmbH) раскрывается пероральная дозированная форма, содержащая по меньшей мере один активный ингредиент, заключенный в покрывающий материал, включающий полисахарид, разлагающийся в толстой кишке. Покрывающий материал содержит пленкообразующий полимер в смеси с полисахаридом. Массовое соотношение полисахарида и пленкообразующего полимера составляло от 1:2 до 5:1, предпочтительно от 1:1 до 4:1. Примеры подходящих полисахаридов включают такие полисахариды, которые являются расщепляемыми гликозидными ферментами. Полисахариды, содержащие значительные количества предпочтительно приблизительно от 20 масс.% до 100 масс.% галактозных и маннозных остатков, являются подходящими, и наиболее предпочтительными являются камедь бобов рожкового дерева и гуаровая камедь. Предпочтительные пленкообразующие полимеры включают акрилатные pH-независимые полимеры (нерастворимые по всему ЖК тракту) и pH-зависимые (нерастворимые в желудочном соке, но растворимые в кишечном соке при pH 5,5 или выше). Указанный документ иллюстрирует применение смеси гуаровой камеди с любым из Eudragit RL 30 D (при соотношении 4:1), Eudragit® L 30 D (при соотношении 3:1) или Eudragit® S 100 (при соотношении 2,5:1) в качестве покрытий для таблеток.
Статья в European Journal of Pharmaceutical Sciences (Krogars et al, 17, (2002), 23-30) раскрывает применение Hylon™ VII (кукурузный крахмал c увеличенным содержанием амилозы (~70 масс.%), National Starch, Germany) в качестве пленочного покрытия для таблеток, содержащих лекарственное средство (теофиллин). Растворение таблеток в кислой среде было быстрым, с растворением более чем 75% лекарственного средства в течение 15 минут. Покрытие не содержало второго пленкообразующего полимера.
В соответствии с первым аспектом настоящего изобретения обеспечивается лекарственная форма с отсроченным высвобождением, включающая частицу с ядром и покрытием ядра, где ядро включает лекарственное средство, а покрытие включает смесь первого вещества, которое чувствительно к воздействию бактерий толстой кишки, и второго вещества, которое имеет порог растворимости при приблизительно pH 5 или выше, где первое вещество включает полисахарид, выбранный из группы, состоящей из крахмала, амилозы, амилопектина, хитозана, хондроитинсульфата, циклодекстрина, декстрана, пуллулана, каррагенана, склероглюкана, хитина, курдулана и левана.
Первое вещество включает полисахарид, предпочтительно содержащий множество глюкозных остатков. Предпочтительными полисахаридами являются крахмал, амилоза или амилопектин, наиболее предпочтительным - крахмал.
Неожиданно было установлено, что недостатки, заключающиеся в набухания веществ, чувствительных к воздействию бактерий толстой кишки, например амилозы, могут контролироваться pH-зависимым веществом, растворимым при pH 5 или выше. Кроме того, авторы настоящего изобретения неожиданно установили, что покрытия, содержащие большую долю амилопектина, также обеспечивают высвобождение лекарственного средства в толстой кишке из пероральной дозированной формы.
Другое техническое преимущество по настоящему изобретению (по сравнению, например, с лекарственной формой, раскрытой в WO-A-01/76562) заключается в том, что, по существу, отсутствует высвобождение лекарственного средства в течение продолжительного периода времени (то есть пока покрытие растворяется), с последующим относительно быстрым высвобождением лекарственного средства. Это является отличием по сравнению с гомогенными таблеткам, профиль высвобождения лекарственного средства из которых плавный с самого начала, а не отсроченный или пульсирующий.
Специалист в данной области способен определить, подвержен ли материал воздействию бактерий толстой кишки, с помощью методов, известных из уровня техники. Например, можно провести анализ заранее измеренного количества данного вещества, подвергнув его обработке ферментами бактерий из толстой кишки и измерив изменение массы вещества с течением времени.
Предпочтительным полисахаридом является крахмал. Крахмалы обычно получают из природных источников, таких как злаки, бобы и клубни. Подходящие крахмалы, используемые в настоящем изобретении, обычно представляют собой пищевые крахмалы и включают рисовый крахмал, пшеничный крахмал, кукурузный (или маисовый) крахмал, крахмал гороха, картофельный крахмал, крахмал батата, крахмал тапиоки, крахмал сорго, крахмал саго и крахмал из корней маранта. В примерах ниже показано применение кукурузного крахмала.
Фактически крахмал представляет собой смесь двух различных полисахаридов, а именно амилозы и амилопектина. Различные крахмалы могут иметь различные соотношения этих двух полисахаридов. Большинство природных (немодифицированных) кукурузных крахмалов содержат от приблизительно 20 масс.% до приблизительно 30 масс.% амилозы, а остальное по меньшей мере по существу составляет амилопектин. Крахмалы, пригодные для использования по настоящему изобретению, обычно содержат по меньшей мере 0,1 масс.%, например, по меньшей мере 10% или 15%, предпочтительно, по меньшей мере 35 масс.% амилозы. Крахмалы с высоким содержанием амилозы представляют собой крахмалы, содержащие по меньшей мере 50 масс.% амилозы. Особенно подходящие крахмалы содержат от приблизительно 65 масс.% до приблизительно 75 масс.%, например, приблизительно 70 масс.% амилозы.
Крахмалы, пригодные для использования в настоящем изобретении, могут содержать до 100% амилопектина, обычно от приблизительно 0,1 масс.% до приблизительно 99,9 масс.% амилопектина. Подходят также крахмалы с низким содержанием амилозы, то есть крахмалы, содержащие не более чем 50 масс.% амилозы и по меньшей мере 50 масс.% амилопектина, например до 75 масс.% амилопектина и даже до 99 масс.% амилопектина. Крахмал может быть, например, немодифицированным восковым кукурузным крахмалом. Он обычно включает приблизительно 100% амилопектина. Крахмал с низким содержанием амилозы, как ожидалось, не является подходящим, поскольку крахмал с низким содержанием амилозы обычно разрушается панкреатическими ферментами в тонкой кишке. Предпочтительные крахмалы содержат не более чем 50 масс.% амилопектина. Особенно подходящие крахмалы содержат от приблизительно 25 масс.% до приблизительно 35 масс.% амилопектина, например, приблизительно 30 масс.% амилопектина.
Специалист в данной области способен определить относительные доли амилозы и амилопектина в любом данном крахмале. Например, можно использовать спектроскопию в ближней инфракрасной области (“NIR”) для определения содержания амилозы и амилопектина в крахмале, используя калибровочные кривые, полученные посредством NIR для лабораторных смесей известных количеств этих двух компонентов. Кроме того, крахмал может быть гидролизован до глюкозы амилоглюкозидазами. Ряд реакций фосфорилирования и окисления, катализируемых ферментами, приводит к образованию восстановленного никотинамидадениндинуклеотидфосфата (“NADPH”). Количество полученного NADPH стехиометрично первоначальному содержанию глюкозы. Для этого исследования существуют тестовые наборы (например, R-Biopharm GmbH, Germany). Другой способ, который можно использовать, включает воздействие на покрытие бактериальных ферментов, например α-амилазы, для получения короткоцепочечных жирных кислот (“SCFA”), количество которых определяют газожидкостной хроматографией, используя капиллярную колонку.
Предпочтительные крахмалы содержат амилозу в стекловидной форме, хотя в соответствии с настоящим изобретением также может быть использована амилоза в аморфной форме.
Предпочтительными крахмалами являются «готовые» крахмалы, то есть такие крахмалы, которые не требуют обработки перед использованием в соответствии с настоящим изобретением. Примеры особенно подходящих крахмалов с высоким содержанием амилозы включают Hylon™ VII (National Starch, Germany) или Eurylon™ 7 (Roquette, Lestrem, France) или Amylogel 03003 (Cargill, Minneapolis, USA), каждый из перечисленных является примером кукурузного крахмала, содержащего приблизительно 70 масс.% амилозы.
Настоящее изобретение включает применение второго вещества с растворимостью, зависящей от pH. Второе вещество имеет “порог pH”, который представляет собой такое значение pH, ниже которого оно нерастворимо, а при этом значении или более оно растворимо. pH окружающей среды регулирует растворение второго вещества. Таким образом, второе вещество не растворяется (или по существу не растворяется) при рН ниже указанного порога. Как только pH окружающей среды достигнет (или превысит) порога pH, то второе вещество становится растворимым. "Нерастворимый" означает, что для 1 г второго вещества требуется более чем 10000 мл растворителя (окружающей среды) для растворения при данном pH. "Растворимый" означает, что для 1 г второго вещества требуется меньше чем 10000 мл, предпочтительно, меньше чем 5000 мл, более предпочтительно, меньше чем 1000 мл, наиболее предпочтительно, меньше чем 100 мл или 10 мл растворителя для растворения при данном pH. Предпочтительно, окружающая среда означает среду желудочно-кишечного тракта, такую как желудочный сок или кишечный сок. Альтернативно, окружающая среда может представлять собой среду, in vitro эквивалентную среде желудочно-кишечного тракта.
Нормальный pH желудочного сока обычно составляет от 1 до 3. Второе вещество нерастворимо при pH менее 5 и растворимо при pH приблизительно 5 или выше и, таким образом, обычно нерастворимо в желудочном соке. Такое вещество может быть названо "энтеросолюбильным" веществом.
Второе вещество растворимо при pH 5 или выше, например, в кишечном соке. pH кишечного сока постепенно увеличивается от приблизительно 6 в двенадцатиперстной кишке до приблизительно 7-8 в толстой кишке. Второе вещество предпочтительно нерастворимо ниже pH 6,5 (и растворимо при приблизительно pH 6,5 или выше) и, более предпочтительно, нерастворимо ниже pH 7 (и растворимо при приблизительно pH 7 или выше).
Порог pH, при котором вещество становится растворимым, может быть определен методом простого титрования, который известен специалисту в данной области из уровня техники.
Второе вещество обычно представляет собой пленкообразующее полимерное вещество, такое как акрилатный полимер, целлюлозный полимер или поливиниловый полимер. Примеры подходящих целлюлозных полимеров включают ацетатфталатцеллюлозы (“CAP”), тримеллитатацетатцеллюлозы (“CAT”) и сукцинатацетатгидроксипропилметилцеллюлозы. Примеры подходящих поливиниловых полимеров включают поливинилацетатфталат (“PVAP”).
Второе вещество предпочтительно представляет собой сополимер (мет)акриловой кислоты и C1-4-алкильного эфира (мет)акриловой кислоты, например, сополимер метакриловой кислоты и метилового эфира метакриловой кислоты. Такой полимер известен как поли(метакриловая кислота/метилметакрилат) сополимер. Подходящими примерами таких сополимеров являются обычно анионные и не обеспечивающие длительного высвобождения полиметакрилаты. Соотношение карбоксильных групп к метильным сложноэфирным группам (“соотношение кислота:эфир”) у этих сополимеров определяет pH, при котором сополимер растворим. Соотношение кислота:эфир может составлять от приблизительно 2:1 до приблизительно 1:3, например, приблизительно 1:1 или предпочтительно приблизительно 1:2. Молекулярная масса (“MW”) предпочтительных анионных сополимеров обычно составляет приблизительно от 120000 до 150000, предпочтительно приблизительно 135000.
Предпочтительные анионные поли(метакриловая кислота/метилметакрилат) сополимеры включают Eudragit® L (соотношение кислота:эфир приблизительно 1:1, молекулярная масса приблизительно 135000, порог pH приблизительно 6,0), Eudragit® S (соотношение кислота:эфир приблизительно 1:2, молекулярная масса приблизительно 135000, порог pH приблизительно 7), и Eudragit® FS (поли(метилакрилат/метилметакрилат/метакриловая кислота), соотношение кислота:эфир приблизительно 1:10, молекулярная масса приблизительно 220000, порог pH приблизительно 7).
Второе вещество может быть сополимером метакриловой кислоты и этилакрилата. Eudragit® L100-55 поли(метакриловая кислота/этилакрилат), соотношение кислота:эфир приблизительно 1:1, молекулярная масса приблизительно 250000, порог pH приблизительно 5,5 является подходящим. Сополимеры Eudragit® изготовлены и/или распространяются Degussa AG, Darmstadt, Germany.
Могут быть использованы подходящие смеси пленкообразующих полимерных веществ. Пример подходящей смеси может включать смесь, например, смесь 1:1, Eudragit® L и Eudragit® S. Однако предпочтительным является применение только конкретного пленкообразующего полимерного вещества, например, поли(метакриловая кислота/метилметакрилат).
Наиболее предпочтительным является применение только Eudragit® S в качестве второго вещества.
В предпочтительном варианте выполнения изобретения было обнаружено, что смесь двух подходящих полимеров в соответствующем отношении, применяемом в качестве пленочного покрытия на ядре, по меньшей мере минимизирует и может по существу исключить высвобождение лекарственного средства в желудке и тонкой кишке. Полагают, что последующее высвобождение лекарственного средства в толстой кишке обеспечивается совместным действием активных физиологических механизмов: то есть растворением второго вещества, в частности Eudragit® S, и ферментацией первого вещества, например, крахмала или амилозы.
Соотношение первого вещества и второго вещества обычно составляет менее чем 99:1 и может в некоторых случаях быть до 50:50. Соотношение обычно составляет до 35:65 и предпочтительно составляет от 15:85 до 35:65, например, от 15:85 до 30:70. Авторы настоящего изобретения установили, что соотношение первого вещества и второго вещества, составляющее от приблизительно 25:75 до приблизительно 35:65, например, приблизительно 30:70, является особенно подходящим для целевого высвобождения лекарственного средства в толстой кишке, в частности, если первое вещество представляет собой крахмал, а второе вещество представляет собой Eudragit® S. Смесь первых и вторых веществ предпочтительно является по существу однородной.
В случае необходимости обычные добавки, такие как пластификаторы для пленкообразования (например, триэтилцитрат) и вещества, препятствующие прилипанию (такие как глицерилмоностеарат), могут быть добавлены в количестве до 30% от общей массы полученной композиции полимерного покрывающего препарата.
Толщина покрытия частицы обычно составляет от приблизительно 10 мкм до приблизительно 150 мкм. Однако толщина конкретного покрытия будет зависеть от композиции покрытия. Например, толщина покрытия прямо пропорциональна количеству полисахарида в покрытии. Таким образом, в вариантах выполнения изобретения, где покрытие включает крахмал с высоким содержанием амилозы и Eudragit™ S при соотношении приблизительно 30:70, толщина покрытия может составлять от приблизительно 70 мкм до приблизительно 130 мкм, и предпочтительно от приблизительно 90 мкм до приблизительно 110 мкм. Толщина (в мкм) для данной композиции покрытия не зависит от размера ядра.
Толщину покрытия также можно измерять посредством “теоретического привеса” (“TWG”) покрытой лекарственной формы. TWG для настоящей лекарственной формы зависит от ряда факторов, включая композицию покрытия и размер ядра, которое будет покрыто. Например, в вариантах выполнения изобретения, где ядро представляет собой пеллету (например, с диаметром приблизительно 8 мм), а покрытие включает крахмал с высоким содержанием амилозы и Eudragit™ S (например, при соотношении приблизительно 30:70), то TWG обычно составляет от приблизительно 4% до приблизительно 12%, например, от приблизительно 5% до приблизительно 10%, предпочтительно от приблизительно 8% до приблизительно 9%. В вариантах выполнения изобретения, где ядро представляет собой пеллету (например, с диаметром приблизительно 1 мм), и с покрытием того же состава, TWG может составлять от приблизительно 15% до приблизительно 35%, например, от приблизительно 20% до приблизительно 30%, предпочтительно приблизительно 25%.
При указании того, что покрытие включает смесь первых и вторых веществ, подразумевается, что исключаются известная многослойная дозированная форма (раскрытая, например, в упомянутом выше Milojevic et al.), в которой активное ядро покрывается сначала внутренним слоем амилозы, а затем внешним слоем Eudragit® L100. В рамках настоящего изобретения такая многослойная дозированная форма не включает смесь крахмала и Eudragit® L100. Покрытие предпочтительно представляет собой единый слой смеси первого и второго вещества, предпочтительно в однородной смеси.
Тем не менее, лекарственная форма по настоящему изобретению может иметь дополнительный слой между активным ядром и слоем, включающим композицию, обеспечивающую отсроченное высвобождение по настоящему изобретению, и/или наружный слой, покрывающий слой композиции, обеспечивающей отсроченное высвобождение по настоящему изобретению. Например, если слой композиции, обеспечивающей отсроченное высвобождение, включает смесь Eudragit®L и крахмала, то предпочтительно нанесение наружного слоя покрывающего pH зависимого вещества с порогом pH приблизительно 7, например, предпочтительным может быть Eudragit® S. В предпочтительных вариантах выполнения изобретения покрытие, обеспечивающее отсроченное высвобождение, по настоящему изобретению наносится непосредственно на активное ядро, то есть дополнительный слой между этим покрытием и активным ядром отсутствует. Обеспечивающее отсроченное высвобождение покрытие по настоящему изобретению предпочтительно представляет собой внешнее покрытие лекарственной формы. Было установлено, что композиция с отсроченным высвобождением не требует дополнительного наружного слоя.
Композиция, предпочтительно образующая покрытие вокруг биологически активного компонента, наиболее предпочтительно представляет собой смесь крахмала и Eudragit® S. Обычно "биологически активный компонент" представляет собой ядро, включающее лекарственное средство.
Лекарственная форма включает по меньшей мере одну частицу с ядром и покрытием для ядра. Лекарственная форма может включать любую подходящую покрытую пероральную дозированную форму, включая капсулы, таблетки, мини-таблетки, пеллеты, гранулы и кристаллы.
Как правило, минимальный диаметр каждой частицы составляет по меньшей мере приблизительно 10-4 м, обычно по меньшей мере приблизительно 5x10-4 м и предпочтительно по меньшей мере приблизительно 10-3 м. Максимальный диаметр обычно составляет не больше чем 30 мм, обычно не больше чем 20 мм и, предпочтительно, не больше чем 10 мм. В предпочтительном варианте выполнения изобретения диаметр частицы составляет от приблизительно 0,2 мм до приблизительно 15 мм, предпочтительно от приблизительно 1 мм до приблизительно 4 мм (например, для пеллеты или мини-таблетки) или от приблизительно 6 мм до приблизительно 12 мм (например, для некоторых таблеток или капсул). Термин "диаметр" относится к наибольшему линейному размеру частицы.
Лекарственная форма может включать множество частиц для обеспечения одной дозы лекарственного средства (средств), в частности, в вариантах выполнения изобретения, где частица представляет собой "малую" частицу, например, с диаметром менее чем 5 мм. Предпочтительны мультидозовые лекарственные формы, включающие частицы с диаметром менее 3 мм.
Настоящее изобретение применимо в лекарственной форме с многофазным высвобождением лекарственного средства, включающей по меньшей мере два типа частиц, например покрытые пеллеты в одной дозированной форме, например в капсуле, в которой частицы одного типы отличаются от частиц другого типа покрытием. Покрытия могут отличать один тип от другого толщиной покрытия или композицией, например, количественным и/или качественным составом компонентов. В частности, лекарственные формы с многофазным высвобождением лекарственного средства применимы для больных с болезнью Крона, повреждающей различные области кишечного тракта.
"Ядро" обычно представляет собой твердое тело. Ядро может состоять только из лекарственного средства (лекарственных средств) или может представлять собой гранулы годного в пищу вещества, например сахара, покрытого слоем, включающим лекарственное средство (лекарственные средства). Впрочем, чаще ядро состоит из смеси лекарственного средства (лекарственных средств) с наполнителем или разбавителем, например лактозой или целлюлозным веществом, таким как микрокристаллическая целлюлоза, связующим веществом, например поливинилпирролидоном (“PVP”), дезинтегрантом, например Ac-Di-Sol™ (то есть натрийкроскармелозой), и/или смазывающим веществом, например стеаратом магния. Ядро может представлять собой спрессованный гранулят, включающий по меньшей мере некоторые из этих веществ.
Высвобождение из лекарственных форм по настоящему изобретению отсрочено до кишечного тракта и предпочтительно толстой кишки. Высвобождение из некоторых лекарственных форм также может быть длительным. При этом в предпочтительных лекарственных формах высвобождение является пульсирующим.
Лекарственную форму обычно относят к устойчивой в желудке, если менее чем 10 масс.% лекарственного средства высвободится в течение 2 часов в кислой среде. Лекарственные формы по настоящему изобретению обычно показывают гораздо меньше, чем 10 масс.% высвобождения лекарственного средства в кислой среде, и их можно считать устойчивыми в желудке. Как правило, высвобождение из лекарственных форм составляет меньше чем 1 масс.% лекарственного средства в кислой среде, и обычно не происходит по существу какого-либо высвобождения лекарственного средства в кислых средах. При использовании комбинации крахмала с акрилатным пленкообразующим веществом для формирования покрытия для ядра обычно высвобождается менее чем 5% лекарственного средства через более чем 5 часов в условиях моделирования желудка и тонкой кишки. При использовании комбинации крахмала с целлюлозным пленкообразующим веществом для покрытия для ядра обычно высвобождается меньше чем 10% лекарственного средства через более чем 5 часов в условиях моделирования желудка и тонкой кишки.
Время от начала воздействия до условий, подходящих для высвобождения лекарственного средства и начала высвобождения лекарственного средства, обозначается как "время задержки" (лаг-период). "Время задержки" зависит от ряда факторов, включая толщину и состав покрытия. Время задержки в условиях толстой кишки лекарственных форм по настоящему изобретению обычно составляет по меньшей мере 30 минут. В большей части вариантов выполнения изобретения по настоящему изобретению время задержки составляет от приблизительно 30 минут до приблизительно 3 часов и в предпочтительных лекарственных формах время задержки составляет предпочтительно от приблизительно 45 минут до приблизительно 2 часов.
Время между началом воздействия условий, подходящих для высвобождения лекарственного средства, и полным высвобождением лекарственного средства также зависит от ряда факторов, включающих композицию покрытия и природу лекарственного средства. В большинстве вариантов выполнения настоящего изобретения это время обычно составляет не больше чем 5 часов. В предпочтительных вариантах выполнения изобретения это время обычно составляет не больше чем 4 часа.
Например, в вариантах выполнения изобретения, в которых покрытие ядра таблетки толщиной от 8% до 9% TWG, где покрытие включает крахмал с высоким содержанием амилозы и Eudragit S (30:70), время между началом высвобождения и полным высвобождением может составлять меньше чем приблизительно 2 часа, предпочтительно меньше чем приблизительно 1,5 часа.
В предпочтительном варианте выполнения изобретения ядро представляет собой пеллету с диаметром приблизительно 1 мм. В другом варианте выполнения изобретения ядро представляет собой таблетку с диаметром приблизительно 8 мм. В обоих случаях покрытие предпочтительно представляет собой 30:70 смесь крахмала с высоким содержанием амилозы, например Eurylon™ 7, и акрилового полимера, например Eudragit™ S. В обоих предпочтительных вариантах выполнения изобретения толщина покрытия ядра составляет приблизительно 100 мкм, что составляет от приблизительно 8% до приблизительно 9% TWG для таблетки и от приблизительно 27% до приблизительно 32 масс.% для пеллеты.
Согласно второму аспекту настоящего изобретения обеспечивается лекарственная форма по первому аспекту для применения в способе лечения посредством терапии в теле человека или животного.
Ядро включает по меньшей мере одно лекарственное средство. В лекарственной форме обычно используют одно лекарственное средство в качестве основного терапевтически активного компонента. Тем не менее в одной лекарственной форме может быть введено более чем одно лекарственное средство.
Лекарственная форма по настоящему изобретению предназначена для применения широкого ряда лекарственных средств. Подходящие лекарственные средства включают таковые известные для кишечного введения, используемые в известных пероральных лекарственных формах с отсроченным высвобождением. В настоящем изобретении можно применять лекарственные средства с местным или системным действием.
Лекарственная форма по настоящему изобретению, в частности, применима для кишечного введения лекарственного средства, включающего по меньшей мере одну кислую группу, такую как карбоксильная группа. Такие лекарственные средства могут быть кислыми или цвиттерионными лекарственными средствами. Примером такого лекарственного средства является 5-аминосалициловая кислота (“5-ASA”).
Выбор лекарственного средства (лекарственных средств) в лекарственной форме очевидно зависит от состояния, которое лечат. В связи с этим лекарственная форма, в частности, применима при лечении IBD (включая болезнь Крона и неспецифический язвенный колит), IBS, запора, диареи, инфекции и рака, особенно рака толстой кишки или колоректального рака).
Для лечения или профилактики IBD лекарственная форма может включать по меньшей мере одно лекарственное средство, выбранное из группы, состоящей из противовоспалительных средств (например, 5-ASA), стероидов (например преднизолона, будезонида или флутиказона), иммуносупрессоров (например, азатиоприна, циклоспорина и метотрексата) и антибиотиков.
Для лечения или профилактики рака лекарственная форма может включать по меньшей мере одно противоопухолевое средство. Подходящие противоопухолевые средства включают фторурацил, метотрексат, дактиномицин, блеомицин, этопозид, таксол, винкристин, доксорубицин, цисплатин, даунорубицин, VP-16, ралтитрексед, оксалиплатин и их фармакологически приемлемые производные и соли. Для профилактики рака толстой кишки или колоректального рака, особенно у больных с колитом, лекарственная форма может включать противовоспалительное средство 5-ASA.
Для лечения или профилактики IBS, запора, диареи или инфекции лекарственная форма может включать по меньшей мере один активный компонент для лечения или профилактики этих состояний.
Фармакологически приемлемые производные и/или соли лекарственных средств также могут быть использованы в лекарственной форме. Примером подходящей соли преднизолона является преднизолон натрийсукцинат. Другим примером является пропионат флутиказона.
Настоящее изобретение, в котором используют 5-ASA, применимо как для лечения IBD (особенно неспецифического язвенного колита), так и для профилактики рака толстой кишки или колоректального рака (особенно у пациентов с колитом). Оно также может применяться для введения лекарственных средств в большой круг кровообращения через толстую кишку. Это имеет преимущество для лекарственных средств пептидов и белков, которые нестабильны в верхних отделах желудочно-кишечного тракта. Настоящее изобретение также может использоваться для колонотерапии.
В третьем аспекте изобретения обеспечивается способ направленной доставки лекарственного средства в толстую кишку, включающий введение пациенту лекарственной формы, определенной выше.
В четвертом аспекте изобретения обеспечивается применение лекарственной формы, определенной выше, в производстве медикамента для лечения или профилактики IBD (в частности, неспецифического язвенного колита), IBS, запора, диареи, инфекции и рака.
Также обеспечивается применение по меньшей мере одного лекарственного средства, выбранного из противовоспалительных средств и стероидов, при производстве медикамента, включающего лекарственную форму, определенную выше, для применения в лечении IBD. Кроме того, также обеспечивается применение по меньшей мере одного противоопухолевого средства при производстве медикамента, включающего лекарственную форму, определенную выше, для применения при лечении карциномы. Дополнительно, также обеспечивается применение 5-ASA при производстве медикамента, включающего лекарственную форму, определенную выше, для применения при профилактике рака толстой кишки или колоректального рака.
Согласно пятому аспекту настоящего изобретения обеспечивается способ лечения или профилактики IBD или карциномы, включающий введение пациенту терапевтического количества лекарственной формы, определенной выше.
Лекарственная форма обычно включает терапевтически эффективное количество лекарственного средства или каждого лекарственного средства, которое может составлять от приблизительно 0,01 масс.% до приблизительно 99 масс.% от общей массы лекарственной формы. Фактическая дозировка может быть определена специалистом в данной области на основании уровня техники. Впрочем, например, лекарственные формы с «низкой» дозой обычно включают не более чем приблизительно 20 масс.% лекарственного средства и предпочтительно включают от приблизительно 1 масс.% до приблизительно 10 масс.%, например, приблизительно 5 масс.% лекарственного средства. Лекарственные формы с «высокой» дозой обычно включают по меньшей мере 40 масс.% лекарственного средства и предпочтительно от приблизительно 45 масс.% до приблизительно 85 масс.%, например, приблизительно 50 масс.% или приблизительно 80 масс.%.
Согласно шестому аспекту настоящего изобретения обеспечивается способ получения лекарственной формы с отсроченным высвобождением согласно первому аспекту, где указанный способ включает:
формирование ядра, включающего по меньшей мере одно лекарственное средство, и
покрытие ядра полимерной покрывающей композицией, включающим смесь первого вещества, которое чувствительно к воздействию бактерий толстой кишки, и вторым веществом, которое имеет порог pH при приблизительно pH 5 или выше,
где первое вещество включает полисахарид, выбранный из группы, состоящей из крахмала, амилозы, амилопектина, хитозана, хондроитинсульфата, циклодекстрина, декстрана, пуллулана, каррагенана, склероглюкана, хитина, курдулана и левана. Предпочтительные полисахариды выделены выше. Предпочтительно покрытие на ядро наносят распылением указанного полимерного покрывающего состава.
В вариантах выполнения изобретения, в которых ядро формируют из прессованного гранулята, способ предпочтительно включает:
сухое смешивание лекарственного средства (лекарственных средств) с по меньшей мере одним наполнителем для получения сухой смеси,
влажную грануляцию по меньшей мере части указанной сухой смеси для получения влажного гранулята,
прессование по меньшей мере части указанного влажного гранулята для получения указанного ядра, и
нанесение покрытия распылением на указанное ядро полимерной покрывающей композиции для получения указанной лекарственной формы с отсроченным высвобождением. Предпочтительно использовать аппараты с псевдоожиженым слоем для нанесения на ядра покрытия из полимерного покрывающего состава для формирования частицы(частиц) лекарственной формы.
В предпочтительных вариантах выполнения изобретения способ включает:
приготовление водной дисперсии, включающей указанное первое вещество,
приготовление спиртового или водного раствора, включающего указанное второе вещество, и
добавление, предпочтительно по каплям, по меньшей мере части указанной водной дисперсии указанного первого вещества к по меньшей мере части указанного спиртового или водного раствора указанного второго вещества для получения указанного полимерного покрывающего состава.
Первое вещество обычно диспергируют в по меньшей мере одном спирте, предпочтительно C1-C6 спиртах, например метаноле, этаноле, пропан-1-оле, пропан-2-оле, бутан-1-оле, бутан-2-оле и их смесях, более конкретно, только в бутан-1-оле, а затем обычно добавляют воду при хорошем перемешивании. Полученную водную дисперсию обычно нагревают до кипения и затем охлаждают при перемешивании в течение ночи. Цель спирта(ов) сольватировать первое вещество для получения водной дисперсии. Альтернативно, вещество может быть диспергировано сразу в воде.
Второе вещество обычно растворяют в по меньшей мере одном растворителе, например, воде или органическом растворителе. Органический растворитель может представлять собой спирт, например метанол, этанол, пропан-2-ол, метилгликоль, бутилгликоль, ацетон, метилгликольацетат и их смеси, такой как ацетон и изопропиловый спирт (например, в соотношении приблизительно 4:6). Второе вещество предпочтительно растворяют в этаноле (предпочтительно от 85 до 98%) при перемешивании с высокой скоростью.
Полимерный покрывающий состав предпочтительно готовят добавлением по каплям соответствующего количества водной дисперсии к спиртовому раствору при быстром перемешивании. Дополнительный наполнитель(и), такой как пластификатор (например, триэтилцитрат) и/или смазывающее вещество (например, глицерилмоностеарат), обычно добавляют в состав при перемешивании.
Ряд предпочтительных вариантов выполнения настоящего изобретения далее будет описан с ссылками на фигуры, где:
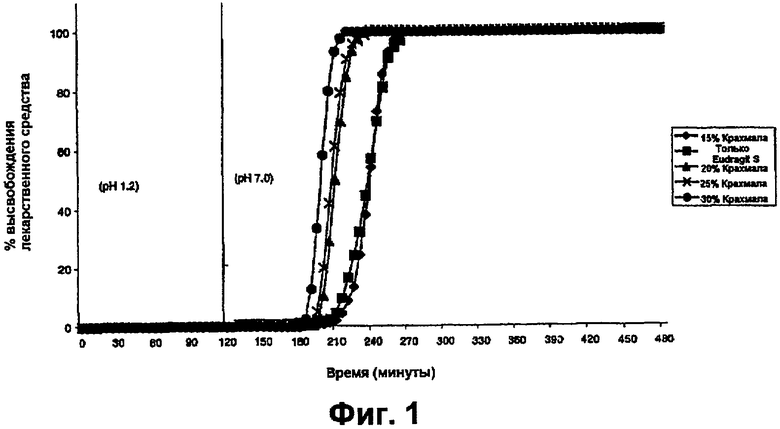
фиг.1 представляет собой график, на котором показаны профили растворения в буфере с pH 7,0 таблеток преднизолона со смешанным пленочным покрытием с 5% TWG и таблеток с покрытием Eudragit®S с 5% TWG,
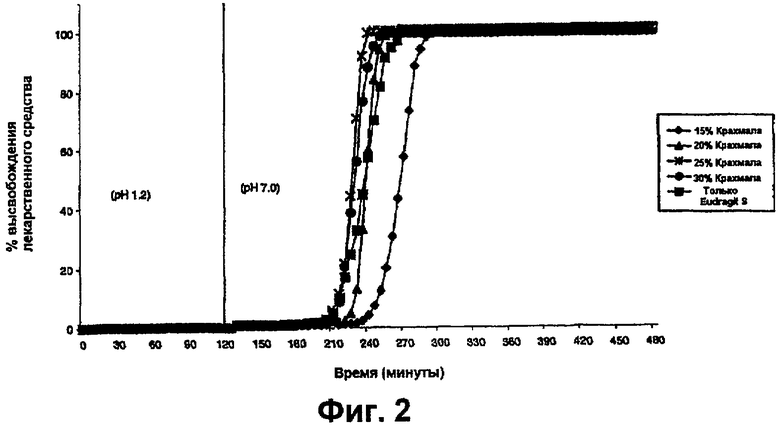
фиг.2 представляет собой график, на котором показаны профили растворения таблеток со смешанным пленочным покрытием, как на фиг.1, но с 6% TWG,
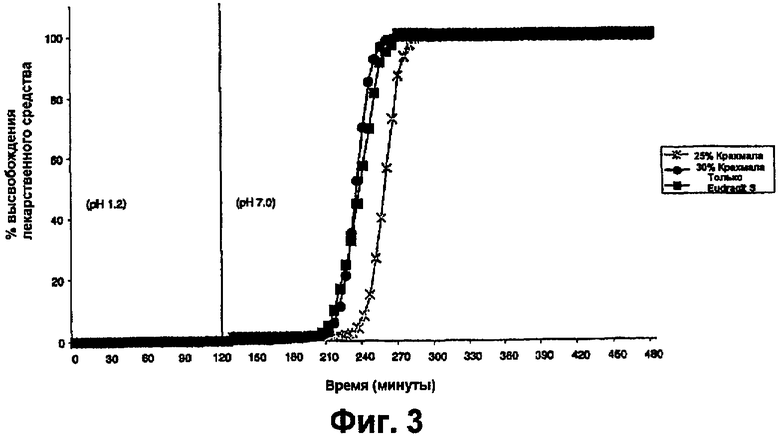
фиг.3 представляет собой график, на котором показаны профили растворения таблеток со смешанным пленочным покрытием, как на фиг.1, но с 7,4% TWG,
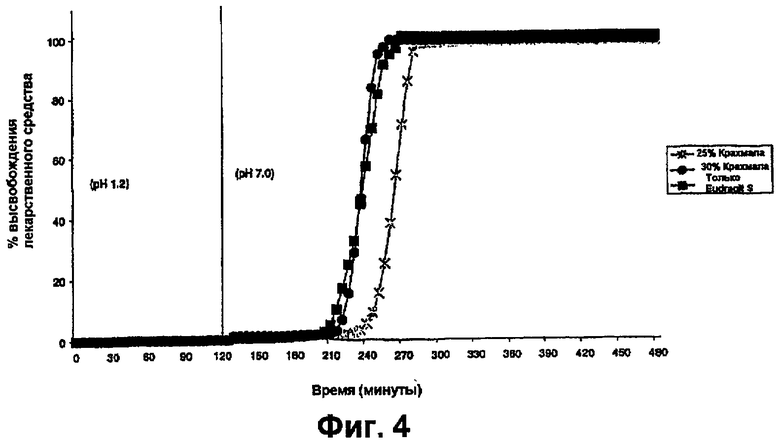
фиг.4 представляет собой график, на котором показаны профили растворения таблеток со смешанным пленочным покрытием, как на фиг.1, но с 8,3% TWG,
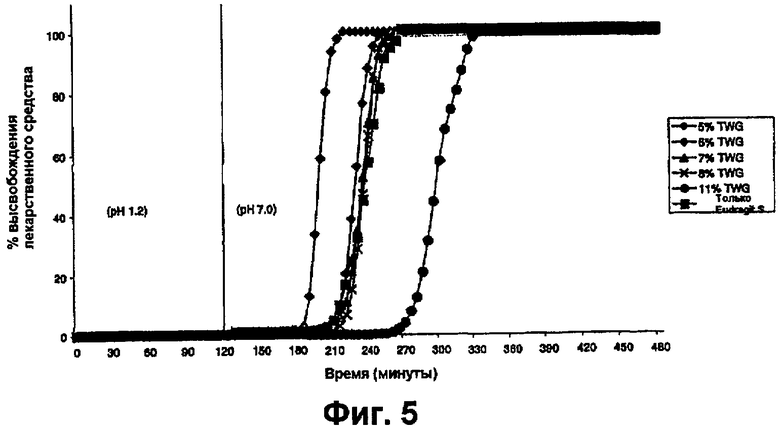
фиг.5 представляет собой график, на котором показаны профили растворения таблеток преднизолона с покрытием из 30% крахмала:70% Eudragit S с различными привесами полимера и таблетки с покрытием Eudragit® S с 5% TWG,
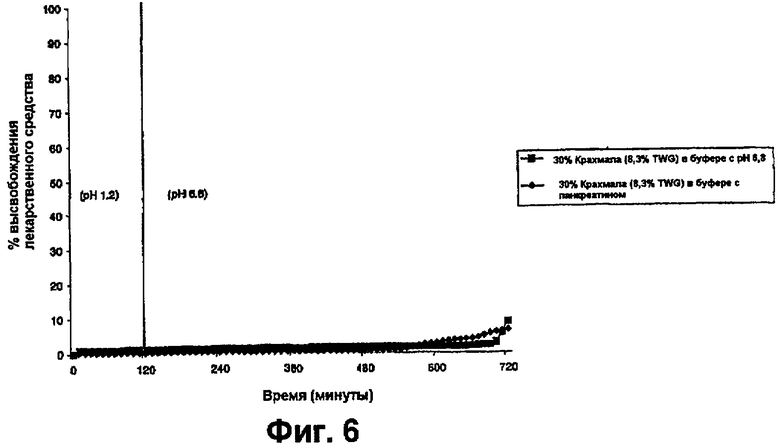
фиг.6 представляет собой график, на котором показан профиль растворения таблеток преднизолона, покрытых 30% крахмала: 70% Eudragit® S в буфере с pH 6,8, в присутствии и без панкреатина,
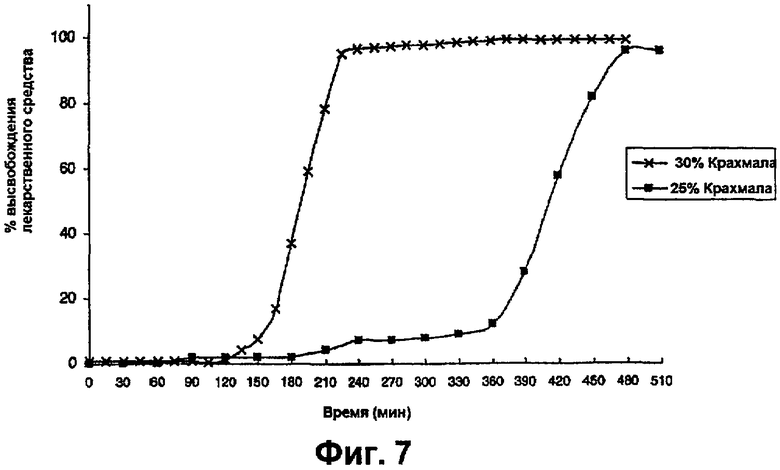
фиг.7 представляет собой график, на котором показано высвобождение лекарственного средства из таблеток преднизолона, покрытых с 8,3% TWG в буфере с pH 6,8, содержащем 50 ЕД/мл амилазы,
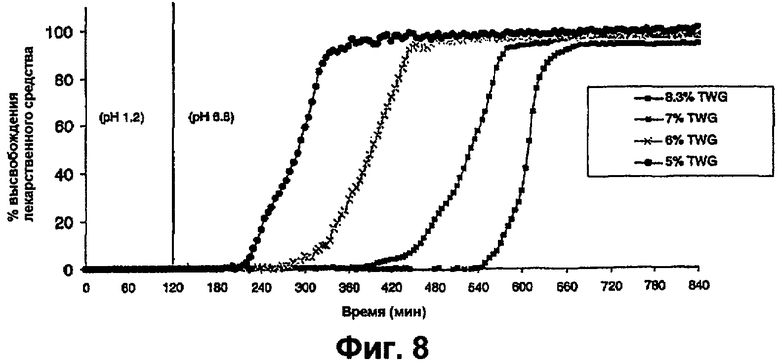
фиг.8 представляет собой график, на котором показан профиль растворения таблеток 5-ASA, покрытых 30% крахмала:70% Eudragit® S с 8,3% TWG в буфере с pH 6,8,
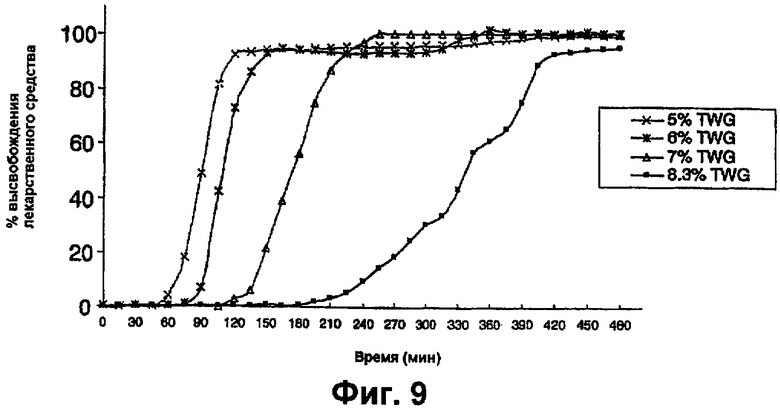
фиг.9 представляет собой график, на котором показаны профили растворения таблеток 5-ASA, покрытых 30% крахмала:70% Eudragit® S с различными привесами полимера при буфере с pH 6,8, содержащем 50 ЕД/мл амилазы,
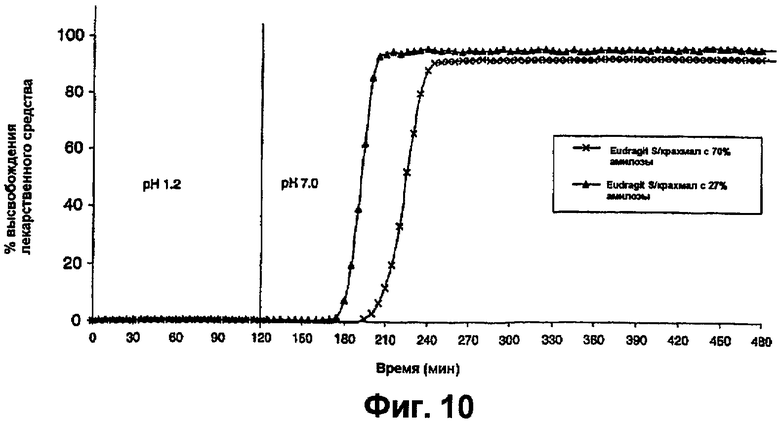
фиг.10 представляет собой график, на котором показаны профили растворения таблеток преднизолона, покрытых 70% Eudragit® S: 30 масс.% крахмала с 70 масс.% или 27 масс.% амилозы, в буфере с pH 7,
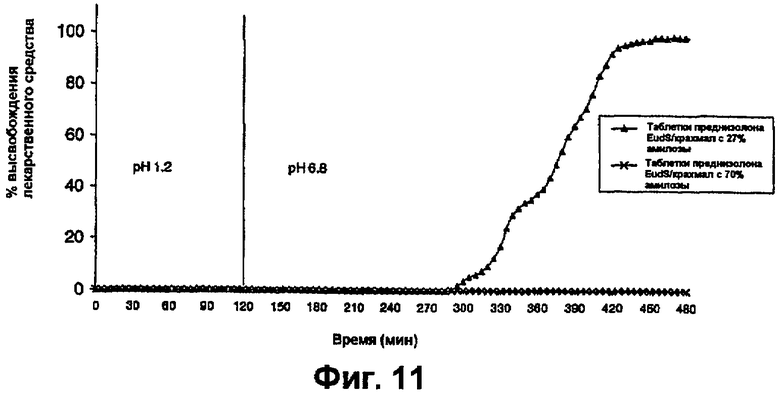
фиг.11 представляет собой график, на котором показаны профили растворения таблеток преднизолона, как на фиг.10, в буфере с pH 6,8,
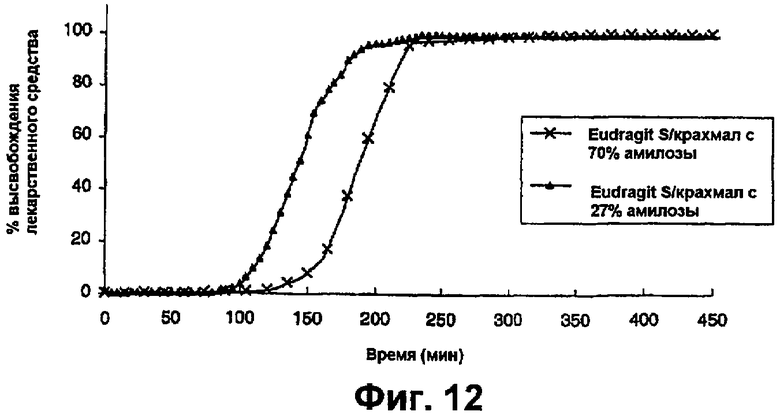
фиг.12 представляет собой график, на котором показаны профили растворения таблеток преднизолона, как на фиг.10, в буфере с pH 6,8, содержащем 50 ЕД/мл амилазы,
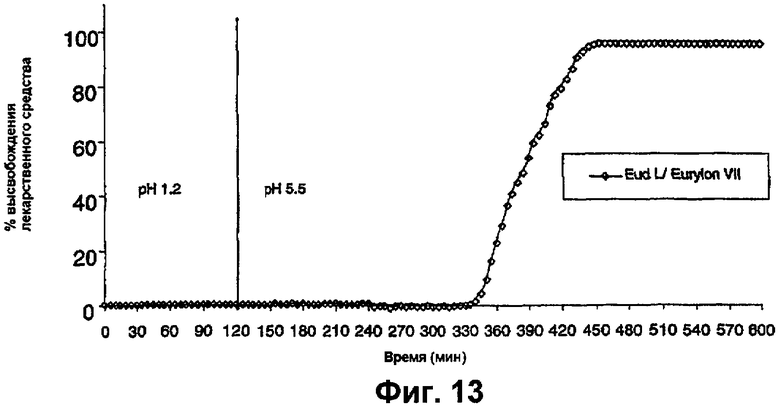
фиг.13 представляет собой график, на котором показан профиль растворения таблеток преднизолона, покрытых 70% Eudragit® L: 30% крахмала, с 8,3% TWG, в буфере с pH 5,5,
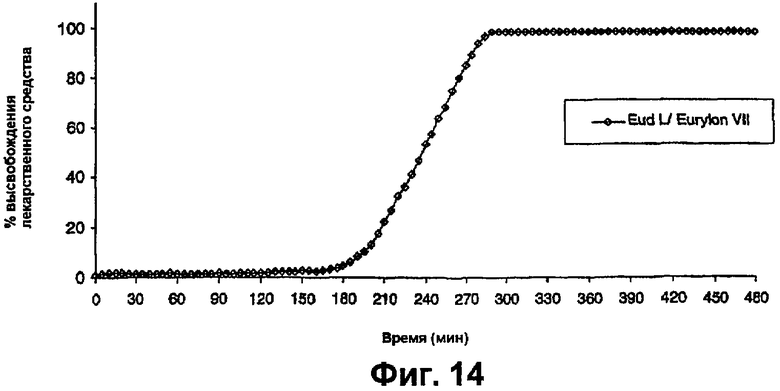
фиг.14 представляет собой график, на котором показан профиль растворения таблеток преднизолона, как на фиг.13, в буфере с pH 5,5, содержащем 50 ЕД/мл амилазы,
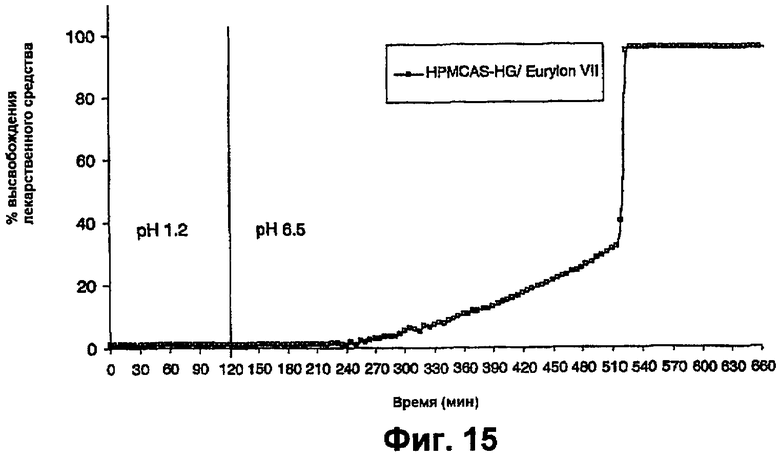
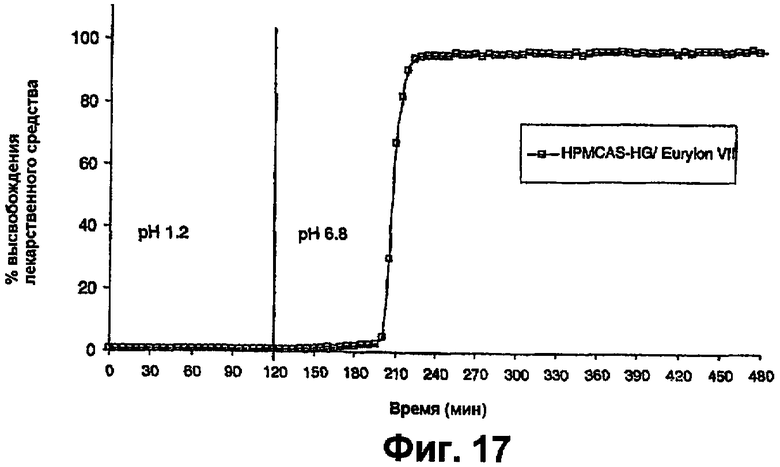
фиг.15 представляет собой график, на котором показан профиль растворения таблеток преднизолона, покрытых 70%-ым HPMCAS-HG: 30% крахмала, в буфере с pH 6,5,
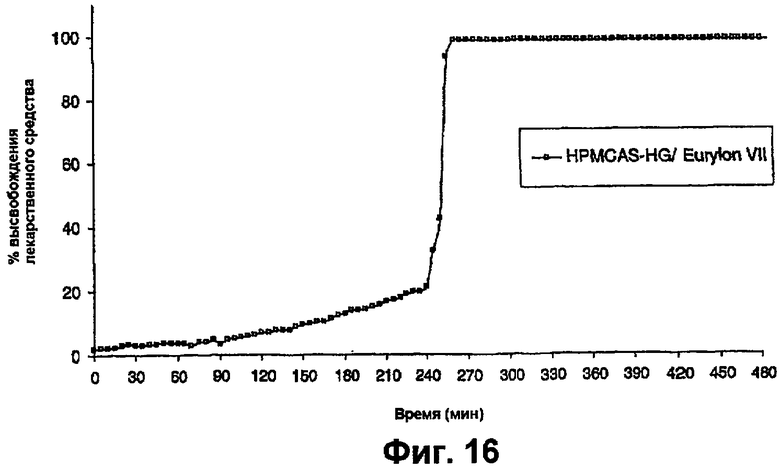
фиг.16 представляет собой график, на котором показан профиль растворения таблеток преднизолона, как на фиг.15, в буфере с pH 6,5, содержащем 50 ЕД/мл амилазы, и
фиг.17 представляет собой график, на котором показан профиль растворения таблеток преднизолона, как на фиг.15, в буфере с pH 6,8.
ПРИМЕР 1
Приготовление таблеток преднизолона
Таблетки преднизолона (масса 200 мг, диаметр 8 мм, стандартные двояковогнутые) готовили в соответствии со следующей формулой:
Преднизолон смешивали с наполнителями и затем проводили влажную грануляцию. Фракцию гранул размером 500-710 мкм прессовали на таблеточной машине с одним пуансоном (Manesty, UK).
Композиция водной дисперсии крахмала
Крахмал Eurylon™ 7 тщательно диспергировали в бутан-1-оле и затем добавляли воду при хорошем перемешивании. Затем полученную дисперсию нагревали до кипения и охлаждали при перемешивании в течение ночи. %-ное содержание сухого вещества в охлажденной дисперсии рассчитывали по массе полученной дисперсии (с учетом испарения при нагревании).
Композиция раствора Eudragit® S
Раствор Eudragit® S готовили растворением полимера Eudragit® S 100 в 96% этаноле при перемешивании с высокой скоростью. Содержание сухого полимерного вещества в конечном растворе составило 6%.
Смешанная крахмал-Eudragit® покрывающая дисперсия
Соответствующие количества дисперсии крахмала и раствора Eudragit® смешивали в требуемых соотношениях, определенных как сухое полимерное вещество. Крахмал постоянно добавляли к раствору Eudragit® по каплям при быстром перемешивании. Полученную дисперсию в течение двух часов перемешивали левым вращением перед добавлением наполнителей и затем еще два часа после добавления наполнителей. Добавленные наполнители:
Полученные смешанные полимерные покрывающие составы наносили в виде пленки на таблетки, используя аппарат с псевдоожиженным слоем для нанесения покрытий распылением. Толщину покрытия рассчитывали как % увеличения массы таблеток после покрытия (% TWG).
Параметры нанесения покрытия распылением
Исследование In Vitro
Дисперсию крахмала готовили из Eurylon 7, крахмала с высоким содержанием амилозы, и смешивали с раствором Eudragit® S в этаноле. Состав и способ получения покрывающей дисперсии были описаны выше. Готовили различные комбинации крахмал/Eudragit® S, содержащие 15%, 20%, 25%, 30% и 35% крахмала. Смешанные Eudragit®/крахмал покрывающие дисперсии наносили в виде пленки на таблетки преднизолона, приготовленные в соответствии с методикой, описанной выше. Готовили таблетки с покрытием разной толщины, рассчитанной по общему привесу полимера, а также определяли оптимальную толщину покрытия. Для порывающей смеси были получены хорошие результаты при пленках, содержащих вплоть до 30% крахмала.
Затем для таблеток, покрытых оболочкой, определяли высвобождение лекарственного средства in vitro в буферном растворе при различных рН. Оптимальное соотношение крахмал/Eudragit®S и привес покрытия прежде всего устанавливали при сравнении профиля растворения для обычных таблеток, покрытых Eudragit® S оболочкой.
Результаты показаны на фиг.1-7.
Крайне неожиданно было установлено, что такие таблетки, покрытые смешанной пленочной оболочкой, не высвобождали лекарственное средство при HCl pH 1,2, моделирующего желудочную среду (см. левую сторону графиков на фиг.1-6).
Также отсутствовало высвобождение лекарственного средства из всех таблеток, покрытых оболочкой, вплоть до 12 часов при pH 6,8, моделирующего среду в тонком кишечнике (см. фиг.6). В предыдущих исследованиях in vitro использовали смешанные продукты из амилозы/акрилатных полимеров на основе водонерастворимого Eudragit® RL и RS, которые показали неконтролируемое и быстрое высвобождение лекарственного средства в кислоте и буфере (Milojevic et al., 1996).
Профили высвобождения лекарственного средства из таблеток, покрытых оболочкой, в буферной среде с pH 7,0 показаны на фиг.1-5. На основе анализа профилей растворения было установлено, что таблетки, покрытые смесью 30% крахмал/Eudragit®, с толщиной покрытия, эквивалентной TWG 8,3%, являются оптимальными, и затем проводили исследования для оценки расщепления крахмального компонента пленки.
Таблетки исследовали в тесте растворения в буфере с pH 6,8, содержащем 50 ЕД(единиц)/мл α-амилазы, полученной из B.licheniformis (см. фиг.7). Тест на растворимость также выполняли в среде с панкреатином при pH 6,8 для оценки возможности расщепления крахмала панкреатической α-амилазой (см. фиг.6).
Результаты тестов на растворимость в присутствии ферментов показывают, что крахмальный компонент пленки не расщепляется в присутствии панкреатина (что предлагает стабильность в тонкой кишке), но через три часа наблюдали высвобождение лекарственного средства в присутствии α-амилазы из B. licheniformis. Эти результаты подтверждают, что смешанная пленка предотвращает высвобождение лекарственного средства в условиях, эквивалентных отделам верхнего желудочно-кишечного тракта, но расщепляется в присутствии бактериальных ферментов (при pH даже ниже, чем порог pH для растворения полимера Eudragit® S).
Исследование in vivo на здоровых добровольцах
После неожиданных положительных результатов в исследованиях in vitro таблеток, покрытых оболочкой пленки смеси крахмал/Eudragit®S, характеристики дозированной формы исследовали на здоровых людях. Таблетки метили изотопом индий-111 и вводили восьми здоровым мужчинам-добровольцам при трех различных условиях. За перемещением и местом распада таблетки в желудочно-кишечном тракте следили, используя гамма камеру.
Время и место распада этих таблеток со смешанной пленкой отмечены в Таблице 1. Результаты показывают неожиданно превосходную направленную доставку в толстую кишку с распадом таблетки преимущественно в толстой кишке.
Результаты исследований на здоровых добровольцах показывают, что крахмал и Eudragit®, смешанные в соотношении 30% крахмала и 70% Eudragit®S и нанесенные в виде покрытия на таблетки при приблизительно 8,3% TWG, способны предотвратить распад таблетки в желудке и тонкой кишке, но обеспечить распад в толстой кишке.
В таблице 1 показаны место и время распада таблеток, покрытых оболочкой из 30% крахмала и 70% Eudragit® S, у восьми здоровых добровольцев - мужчин при трех различных условиях.
Ключ к таблице 1:
"Натощак" - таблетку вводили натощак;
"Перед приемом пищи" - таблетку вводили натощак, но с приемом пищи через 30 минут после введения; и
"После еды" - таблетку вводили после завтрака.
“ICJ” - соединение тонкой и толстой кишки;
“AC” - восходящая ободочная кишка;
"HF" - правый изгиб ободочной кишки; и
“SF” - левый изгиб ободочной кишки.
(после еды)
(перед приемом пищи)
ПРИМЕР 2
Готовили таблетки (масса 200 мг, диаметр 8 мм, стандартные двояковогнутые), содержащие 5 масс.% 5-аминосалициловой кислоты вместо 5 масс.% преднизолона, и покрывали полимерной смесью, включающей 70% Eudragit® S:30% крахмал (Eurylon™ 7) с 5%, 6%, 7% и 8,3% TWG, в соответствии с методикой, приведенной в примере 1.
Для таблеток 5-ASA с различными привесами, составляющими 5, 6, 7 и 8,3%, затем проводили исследование высвобождения лекарственного средства in vitro в буфере с pH 6,8 в отсутствие α-амилазы. На фиг.8 показано, что для таблетки 5-ASA с покрытием 8,3% TWG отсутствовало высвобождением 5-ASA в течение 9 часов с почти полным высвобождением приблизительно после 11 часов.
Затем для каждой из таблеток 5-ASA с различными TWG проводили исследование высвобождения лекарственного средства in vitro в присутствии 50 ЕД/мл α-амилазы. На фиг.9 показано, что высвобождение лекарственного средства происходило гораздо быстрее для всех TWG в присутствии α-амилазы.
Таблетка 5-ASA с покрытием 7% TWG показывала время задержки в буфере с pH 6,8 (приблизительно 2 часа), подобное 5 масс.% таблетке преднизолона с покрытием 8,3% TWG. Не основываясь на какой-либо теории, этот результат можно объяснить тем, что 5-ASA проявляет кислые свойства, растворяясь в почти нейтральном буфере, таким образом уменьшая pH в пограничном слое ядра/полимера таблетки по отношению к окружающей среде и, следовательно, замедляя растворение полимерного покрытия.
ПРИМЕР 3
Готовили таблетки (масса 200 мг, диаметр 8 мм, стандартные двояковогнутые), содержащие 5 масс.% преднизолона, и покрывали полимерной смесью, включающей 70% Eudragit® S:30% крахмала с 8,3% TWG, в соответствии с методикой, приведенной в примере 1. Использовали как крахмал с высоким содержанием амилозы (Eurylon™ 7, ~70 масс.% амилозы), так и крахмал с низким содержанием амилозы (натуральный кукурузный крахмал, ~27 масс.% амилозы, Sigma, Poole, UK).
Затем для таблеток проводили исследование высвобождения лекарственного средства in vitro в буфере с pH 7, не содержащем амилазу, и затем в буфере с pH 6,8, содержащем 50 ЕД/мл α-амилаза и не содержащем амилазу.
На фиг.10 и 11 показано, что высвобождение лекарственного средства быстрее происходит при использовании крахмала с низким содержанием амилозы. На фиг.11 показано, что время задержки, составляющее приблизительно 2,5 часа в условиях тонкого кишечника для таблеток с крахмалом с низким содержанием амилозы, короче, чем время задержки для таблеток с крахмалом с высоким содержанием амилозы. Этот результат можно объяснить тем, что амилопектин имеет лучшую растворимость в воде, чем амилоза. Таким образом, чем больше доля амилопектина, тем быстрее покрытие растворяется в водном растворе. На фиг.12 показано, что высвобождение лекарственного средства по существу более быстрое в присутствии α-амилазы.
Для таблеток, имеющих покрытие с крахмалом, с низким содержанием амилозы также было показано (используя ту же методику, как для фиг.6) отсутствие расщепления в присутствии панкреатина в течение нескольких часов, что дополнительно подтверждает устойчивость системы с низким содержанием амилозы в тонкой кишке. Такая устойчивость является неожиданной, поскольку амилопектин является субстратом для панкреатической амилазы (присутствующей в панкреатине) и поэтому ожидалось расщепление покрытия и высвобождение лекарственного средства.
ПРИМЕР 4
Готовили таблетки (масса 200 мг, диаметр 8 мм, стандартные двояковогнутые), содержащие 5 масс.% преднизолона, и покрывали полимерной смесью, включающей 70% Eudragit® L:30% крахмала (Eurylon™ 7) с 8,3%, в соответствии с методикой, приведенной в примере 1.
Затем для таблеток проводили исследование высвобождения лекарственного средства in vitro в буфере с pH 5,5, сначала при отсутствии амилазы, а затем с 50 ЕД/мл α-амилазы.
На фиг.13 показано время задержки немного менее 4 часов в условиях тонкого кишечника. Тем не менее, в присутствии α-амилазы, время задержки составило приблизительно 3 часа (фиг.14). Результаты показывают, что эта покрывающая система может быть использована для высвобождения лекарственного средства в проксимальном тонком кишечнике.
ПРИМЕР 5
Готовили таблетки (масса 200 мг, диаметр 8 мм, стандартные двояковогнутые), содержащие 5 масс.% преднизолона и покрывали полимерной смесью, включающей 70% ацетатсукцинатгидроксипропилметилцеллюлозы (“HPMCAS”): 30% крахмала (Eurylon™ 7) с 8,3% TWG, в основном в соответствии с методикой, приведенной в примере 1. Использовали HPMCAS (ShinEtsu, Japan) со степенью грануляции HG с порогом pH 6,8. HPMCAS-HG растворяли в 90% этаноле и добавляли водную дисперсию крахмала.
Затем для таблеток проводили исследование высвобождения лекарственного средства in vitro в буфере с pH 6,5, сначала при отсутствии амилазы, а затем с 50 ЕД/мл α-амилазы. Затем дополнительно для таблеток проводили исследование высвобождения лекарственного средства in vitro в буфере с с pH 6,8 при отсутствии α-амилазы.
На фиг.15 показано, что покрытие имело тенденцию набухать ниже порога pH для HMPCAS-HG, что приводило к медленной диффузии лекарственного средства из лекарственной формы до растворения покрытия и импульсу высвобождения лекарственного средства. Время задержки до начала диффузии в буфере с pH 6,5 без α-амилазы составляло приблизительно 2 часа, которые достаточны для обеспечения замедления высвобождения до дистальной тонкой кишки. Диффузия продолжалась в течение приблизительно дополнительных 4,5 часов, приводя к почти 40% высвобождению лекарственного средства до импульсного высвобождения.
При наличии α-амилазы отсутствовало время задержки в буфере с pH 6,5, при этом наблюдали диффузию, начавшуюся сразу же, и высвобождение 20% лекарственного средства до начала импульса (фиг.16). Однако при pH 6,8 это диффузионное явление отсутствовало возможно вследствие более быстрого растворения системы (фиг.17).
Должно быть понятно, что изобретение не ограничено сведениями, описанными выше с указанием предпочтительных вариантов выполнения изобретения, и что могут быть выполнены различные модификации и варианты без отступления от сущности и объема изобретения, как определено в прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2646825C2 |
| КОМПОЗИЦИЯ ПОКРЫТИЯ, СОДЕРЖАЩАЯ КРАХМАЛ | 2007 |
|
RU2440104C2 |
| КОМПОЗИЦИИ С ЗАМЕДЛЕННЫМ (ПРОЛОНГИРОВАННЫМ) ВЫСВОБОЖДЕНИЕМ | 1990 |
|
RU2093148C1 |
| КОМПОЗИЦИЯ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 2003 |
|
RU2336865C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ПЕРОРАЛЬНОЙ ДОСТАВКИ АДСОРБЕНТОВ В КИШЕЧНИК | 2016 |
|
RU2681315C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ АЗИТРОМИЦИНА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 1995 |
|
RU2130311C1 |
| ФАРМАЦЕВТИЧЕСКАЯ ЛЕКАРСТВЕННАЯ ФОРМА, УСТОЙЧИВАЯ К ДЕЙСТВИЮ ЖЕЛУДОЧНОГО СОКА, ВКЛЮЧАЮЩАЯ N-(2-(2-ФТАЛИМИДОЭТОКСИ)АЦЕТИЛ)-L-АЛАНИЛ-D-ГЛУТАМИНОВУЮ КИСЛОТУ (LK 423) | 2005 |
|
RU2375047C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НА ОСНОВЕ БИСФОСФОНАТОВ | 2005 |
|
RU2359678C2 |
| ПЕЛЛЕТЫ ХОЛЕСТИРАМИНА, ПЕРОРАЛЬНЫЕ КОМПОЗИЦИИ ХОЛЕСТИРАМИНА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2782016C2 |
| СШИТЫЙ ВЫСОКОАМИЛОЗНЫЙ КРАХМАЛ ДЛЯ ИСПОЛЬЗОВАНИЯ В ФАРМАЦЕВТИЧЕСКИХ КОМПОЗИЦИЯХ С РЕГУЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2274443C2 |
Изобретение относится к лекарственной форме с отсроченным высвобождением для доставки лекарственного средства в толстую кишку. Лекарственная форма включает частицу с ядром и покрытием ядра, где ядро включает лекарственное средство и покрытие. Покрытие включает смесь чувствительного к воздействию бактерий толстой кишки вещества и пленкообразующего полимерного вещества, которое нерастворимо при рН менее 5 и растворимо при рН выше 5. В качестве чувствительного к воздействию бактерий толстой кишки вещества применяется крахмал, содержащий не более 75% амилозы. Изобретение также относится к способу получения указанной лекарственной формы, который заключается в формировании ядра и покрытии ядра покрывающей композиций, включающей смесь крахмала, содержащего не более 75% амилозы, и пленкообразующего полимерного вещества. Изобретение также относится к применению заявленной лекарственной формы для производства лекарственного препарата для лечения воспалительного заболевания кишки и карциномы, а также к способам лечения указанных заболеваний путем введения терапевтически эффективного количества заявленной лекарственной формы. 10 н. и 18 з.п. ф-лы, 17 ил., 1 табл., 5 пр.
1. Лекарственная форма с отсроченным высвобождением для доставки лекарственного средства в толстую кишку, включающая частицу с ядром и покрытием ядра, где ядро включает лекарственное средство и покрытие, включающее смесь первого вещества, которое чувствительно к воздействию бактерий толстой кишки, и второго вещества, которое представляет собой пленкообразующее полимерное вещество, имеющее порог рН при значении рН 5 или выше, где первое вещество представляет собой крахмал, содержащий не более 75% амилозы, где высвобождение лекарственного средства отсрочено до толстой кишки и где порог рН второго вещества представляет собой такой рН, ниже которого оно нерастворимо, а при таком или выше - растворимо.
2. Лекарственная форма по п.1, где полисахарид представляет собой крахмал, включающий по меньшей мере 35% амилозы.
3. Лекарственная форма по п.1 или 2, где второе вещество представляет собой пленкообразующий акрилатный полимер, имеющий порог рН при значении 5 или выше.
4. Лекарственная форма по п.1 или 2, где второе вещество представляет собой пленкообразующий анионный сополимер (мет)акриловой кислоты и C1-4 алкильного эфира (мет)акриловой кислоты, имеющий порог рН при значении 5 или выше.
5. Лекарственная форма по п.4, где второе вещество представляет собой анионный сополимер метакриловой кислоты и метилового эфира метакриловой кислоты, где отношение метакриловой кислоты к метиловому эфиру метакриловой кислоты составляет 1:2.
6. Лекарственная форма по п.1 или 2, где второе вещество представляет собой пленкообразующий целлюлозный полимер или пленкообразующий полимер на основе поливинила, каждый из которых имеет порог рН при значении рН 5 или выше.
7. Лекарственная форма по п.1 или 2, где соотношение первого вещества ко второму веществу составляет до 50:50.
8. Лекарственная форма по п.1 или 2, где соотношение первого вещества ко второму веществу составляет до 35:65.
9. Лекарственная форма по п.1 или 2, где минимальный диаметр частицы составляет по меньшей мере 5×10-4 м.
10. Лекарственная форма по п.1 или 2, где толщина покрытия, рассчитанная как теоретический привес ("TWG") покрытой лекарственной формы, составляет от 5 до 10%.
11. Лекарственная форма по п.1 или 2, где толщина покрытия, рассчитанная как теоретический привес ("TWG") покрытой лекарственной формы, составляет от 15 до 35%.
12. Лекарственная форма по п.1 или 2, где толщина покрытия составляет от 10 мкм до 150 мкм.
13. Лекарственная форма по п.1 или 2, где лекарственное средство включает по меньшей мере одну кислотную группу.
14. Лекарственная форма по п.1 или 2, где лекарственное средство представляет собой противовоспалительное средство.
15. Лекарственная форма по п.1 или 2, где лекарственное средство представляет собой стероид.
16. Лекарственная форма по п.1 или 2, где лекарственное средство представляет собой противоопухолевое средство.
17. Лекарственная форма по п.1 или 2, для применения в способе терапевтического лечения человека или животного.
18. Применение лекарственной формы по п.14 при производстве лекарственного препарата для лечения воспалительного заболевания кишки (IBD).
19. Применение лекарственной формы по п.15 при производстве лекарственного препарата для лечения IBD.
20. Применение лекарственной формы по п.16 при производстве лекарственного препарата для лечения карциномы.
21. Применение лекарственной формы по п.14, где противовоспалительное лекарственное средство представляет собой 5-аминосалициловую кислоту (5-ASA), при производстве лекарственного препарата для профилактики карциномы.
22. Способ лечения IBD, включающий введение пациенту терапевтически эффективного количества лекарственной формы по п.14.
23. Способ лечения IBD, включающий введение пациенту терапевтически эффективного количества лекарственной формы по п.15.
24. Способ лечения карциномы, включающий введение пациенту терапевтически эффективного количества лекарственной формы по п.16.
25. Способ предотвращения карциномы, включающий введение пациенту терапевтически эффективного количества лекарственной формы по п.1 или 2, где лекарственное средство представляет собой 5-ASA.
26. Способ получения лекарственной формы с отсроченным высвобождением по п.1, где указанный способ включает:
формирование ядра, включающего лекарственное средство, и
покрытие ядра полимерной покрывающей композицией, включающей смесь первого вещества, которое чувствительно к воздействию бактерий толстой кишки, и второго вещества, которое представляет собой пленкообразующее полимерное вещество, имеющее порог рН при значении рН 5 или выше,
где первое вещество представляет собой крахмал, содержащий не более 75% амилозы.
27. Способ по п.26, где ядро покрыто распылением указанной полимерной покрывающей композиции.
28. Способ по п.26, включающий:
приготовление водной дисперсии указанного первого вещества, приготовление спиртового или водного раствора указанного второго вещества, и добавление по меньшей мере части указанной водной дисперсии указанного первого вещества к по меньшей мере части спиртового или водного раствора указанного второго вещества для получения указанной полимерной покрывающей композиции.
| КОМПОЗИЦИИ С ЗАМЕДЛЕННЫМ (ПРОЛОНГИРОВАННЫМ) ВЫСВОБОЖДЕНИЕМ | 1990 |
|
RU2093148C1 |
| CHOURASIA MK | |||
| «Polysaccharides for colon targeted drug delivery» Drug delivery, vol.11, №2, 2004, стр.129-148, реферат | |||
| SINHA V.R | |||
| «Binders for colon specific drug delivery: An in vitro evaluation» International Journal of Pharmaceutics, Vol.249, №;1-2, 2002, стр 23-31, реферат | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2013-04-10—Публикация
2007-04-13—Подача