Данная заявка притязает на преимущества в соответствии с 35USC 119(e) предварительной заявки США №60/787775, поданной 31 марта 2006, и предварительной заявки США №60/871864, поданной 26 декабря, 2006, полные раскрытия которых включены здесь посредством отсылки.
Область техники, к которой относится изобретение
Данное изобретение относится к имплантатам для применения в назолакримальной дренажной системе или рядом с ней, с воплощениями, обеспечивающими канальцевые имплантаты, имплантаты слезного мешка, пробки для отверстий слезного канала и пробки для отверстий слезного канала со способностью к доставке лекарственного средства.
Уровень техники
Существует множество проблем для пациентов и врачей в области доставки лекарств к глазу. В частности, повторяющаяся природа лечения (множественные инъекции, режимы инсталляции множества глазных капель в день), связанные с ним затраты и отсутствие комплаентности пациента могут значительно осложнять эффективность экспонированного лечения, что приводит к снижению зрения и часто - к слепоте.
Комплаентность пациента в приеме медикаментов, например инсталляция глазных капель, может быть непостоянной, и в некоторых случаях пациенты могут не выполнять предписанный режим лечения. Отсутствие комплаентности может включать неспособность проводить инсталляцию капель, неэффективную технику (инсталляцию меньше необходимой), избыточное применение капель (приводящее к системным побочным эффектам) и применение непредписанных капель или неспособность следовать режиму лечения, требующему множества типов капель. Многие медикаменты требуют инсталляции пациентом до 4 раз в день.
В дополнение к комплаентности стоимость, по крайней мере, некоторых глазных капель возрастает, что приводит к тому, что некоторые пациенты с ограниченными доходами сталкиваются с выбором между приобретением основных предметов потребления и выполнением предписаний. Часто страховка не покрывает общую стоимость предписанных глазных капель или, в некоторых случаях, глазных капель, содержащих множество различных ингредиентов.
Далее, во многих случаях местно применяемые медикаменты имеют максимальное влияние на глаз в пределах примерно двух часов, после чего должны быть проведены дополнительные применения медикаментов для поддержания лечебной пользы. В дополнение, несовместимость режимов самостоятельного применения или поглощения может приводить к неоптимальному лечению. РСТ публикация WO 06/014434 (Lazar), включенная здесь в ссылку во всей полноте, может соответствовать этим и/или другим выпускам, связанным с глазными каплями.
Один перспективный подход к доставке глазных лекарств состоит в помещении имплантата, высвобождающего лекарство, в ткань рядом с глазом. Хотя этот подход несколько лучше по сравнению с глазными каплями, некоторые возможные проблемы этого подхода могут включать внедрение имплантата в желаемый участок ткани, удержание имплантата в желаемом участке ткани и поддерживаемое высвобождение лекарства на желаемом лечебном уровне в течение продолжительного периода времени. Например, при лечении глаукомы не выявленная и преждевременная потеря имплантата может приводить к отсутствию доставки лекарства, и у пациента возможны потенциальное уменьшение зрения и даже слепота.
В свете вышеизложенного желательно обеспечить усовершенствованные имплантаты для доставки лекарства, преодолевающие, по крайней мере, некоторые из вышеизложенных недостатков.
Раскрытие изобретения
Данное изобретение обеспечивает усовершенствованные имплантируемые устройства, системы и способы для вставления в отверстия слезного канала пациента. Во многих воплощениях имплантируемое устройство может надежно удерживаться в глазу так, что лечебный агент может доставляться в течение продолжительного периода времени.
В первом аспекте воплощения данного изобретения обеспечивают имплантат для вставки в отверстие слезного канала пациента. Имплантат включает лекарственную сердцевину, имеющую дистальный конец и проксимальный конец. Дистальный конец лекарственной сердцевины имеет поперечное сечение, пригодное для вставления в отверстие слезного канала. Лекарственная сердцевина включает лечебный агент, доставляемый в глаз. Оболочка располагается поверх части лекарственной сердцевины для определения, по крайней мере, одной экспонированной поверхности лекарственной сердцевины. По крайней мере, одна экспонированная поверхность лекарственной сердцевины может быть расположена рядом с проксимальным концом для контакта со слезой или жидкостью слезной пленки и высвобождать лечебный агент в лечебных уровнях в течение длительного периода, когда имплантат вставлен для применения.
Во многих воплощениях удерживающая структура присоединена к лекарственной сердцевине для удержания лекарственной сердцевины рядом и/или в отверстии слезного канала. Удерживающая структура может быть прикреплена к лекарственной сердцевине при посредстве оболочки. Удерживающая структура может включать гидрогель, приспособленный для расширения, когда удерживающую структуру помещают в отверстии слезного канала. Удерживающая структура может включать прикрепляющий элемент, имеющий аксиально ориентированную поверхность. Расширение гидрогеля может побуждать аксиально ориентированную поверхность удерживать гидрогель, когда гидрогель гидратирован. Прикрепляющий элемент может включать, по крайней мере, или что-то одно из выступа, кромки, ободка, или отверстие, проходящее через удерживающую структуру.
Во многих воплощениях удерживающая структура включает кромку рядом, по крайней мере, с одной экспонированной поверхностью для удержания поверхности рядом с отверстием слезного канала. Удерживающая структура может иметь размер, пригодный для установки, по крайней мере, частичной внутри просвета канальца. Удерживающая структура может расширяться между конфигурацией с малым сечением, пригодной для вставки, и конфигурацией с большим сечением для закрепления удерживающей структуры в полости, и удерживающая структура может быть прикреплена рядом с дистальным концом лекарственной сердцевины. В конкретных воплощениях удерживающая структура может скользить вдоль лекарственной сердцевины рядом с проксимальным концом, когда удерживающая структура расширяется из конфигурации с малым сечением до конфигурации с большим сечением. Длина удерживающей структуры вдоль лекарственной сердцевины может быть короче в конфигурации с большим сечением, чем в конфигурации с малым сечением.
В некоторых воплощениях удерживающая структура является эластично расширяемой. Малый профиль может иметь поперечное сечение не более чем примерно 0,2 мм, а большой профиль может иметь поперечное сечение не более чем примерно 2,0 мм. Удерживающая структура может включать трубчатое тело, имеющее ручки, разделенные щелями. Окклюзионный элемент может быть установлен на расширяемую и удерживающую структуру для подавления потока слезы. Удерживающая структура может располагаться, по крайней мере, частично над лекарственной сердцевиной. Окклюзионный элемент может подавлять поток слезы через полость и покрывать, по крайней мере, часть удерживающей структуры для защиты полости от удерживающей структуры.
Во многих воплощениях оболочка может включать слой, расположенный поверх лекарственной сердцевины для подавления высвобождения лечебного агента через слой. Лекарственная сердцевина может высвобождать лечебный агент на лечебных уровнях на протяжении периода времени, по крайней мере, одной недели, когда имплантат вставлен с поверхностью, экспонированной для слезы или жидкости слезной пленки. Лекарственная сердцевина может включать добавления агента, и агент является растворимым в лекарственной сердцевине для обеспечения продолжительного однородного уровня высвобождения, когда лекарственная сердцевина имплантирована.
В некоторых воплощениях окклюзионный элемент может подавлять поток слезы через просвет канальца. Например, окклюзионный элемент может иметь форму для блокирования потока слезы через просвет канальца.
Во многих воплощениях обеспечивается имплантат для вставления в отверстие слезного канала пациента. Имплантат включает лечебный агент и материал для удержания лечебного агента. Удерживающая структура располагается поверх, по крайней мере, части материала, и удерживающая структура является расширяемой из материала для удержания материала рядом с отверстием слезного канала.
Во многих воплощениях материал удерживает лечебный агент, по крайней мере, в одном резервуаре или матриксе. Окклюзионный элемент может поддерживаться удерживающей структурой. Удерживающая структура может быть расширяемой между конфигурацией с малым сечением, пригодной для вставки, и конфигурацией с большим сечением, для закрепления удерживающей структуры в полости, и окклюзионный элемент может расширяться с удерживающей структурой.
В другом аспекте воплощения данного изобретения обеспечивают способ лечения глаза лечебным агентом. Способ включает вставление удерживающей структуры и дистального конца лекарственной сердцевины имплантата в отверстие слезного канала. Лечебный агент доставляется из лекарственной сердцевины к глазу. Экспонированная поверхность лекарственной сердцевины ограничена рядом с проксимальным концом лекарственной сердцевины с оболочкой. Экспонированная поверхность может контактировать со слезой или жидкостью слезной пленки так, что лечебный агент мигрирует из экспонированной поверхности к глазу в течение продолжительного периода, в то время как лекарственная сердцевина удерживается рядом с отверстием слезного канала посредством удерживающей структуры.
Во многих воплощениях обеспечивается способ лечения глаза лечебным агентом. Способ включает вставление удерживающей структуры и дистального конца лекарственной сердцевины через отверстие слезного канала так, что лекарственная сердцевина удерживается рядом с отверстием слезного канала. Лекарственная сердцевина включает лечебный агент, доставляемый к глазу, и экспонированная поверхность лекарственной сердцевины расположена рядом с проксимальным концом лекарственной сердцевины. Экспонированная поверхность контактирует со слезой или жидкостью слезной пленки, и лечебный агент мигрирует из экспонированной поверхности к глазу в течение продолжительного периода, в то время как лекарственная сердцевина удерживается рядом с отверстием слезного канала.
Во многих воплощениях удерживающая структура расширяется из узкой профильной конфигурации до широкой профильной конфигурации. Удерживающая структура гидрируется при вставлении в отверстие слезного канала до расширения из узкой профильной конфигурации до широкой профильной конфигурации.
Во многих воплощениях обеспечивается способ лечения глаза лечебным агентом, где способ включает вставление удерживающей структуры через отверстие слезного канала в просвет канальца так, что лекарственная сердцевина закрепляется в полости с удерживающей структурой, и высвобождает эффективные количества лечебного агента в слезу или жидкость слезной пленки глаза. Лекарственная сердцевина удаляется из удерживающей структуры, в то время как удерживающая структура остается закрепленной в полости. Заменяемая лекарственная сердцевина присоединяется к удерживающей структуре, в то время как удерживающая структура остается закрепленной в полости. По крайней мере, одна экспонированная поверхность заменяемой лекарственной сердцевины высвобождает лечебный агент на лечебных уровнях на протяжении продолжительного периода.
Во многих воплощениях обеспечивается способ лечения глаза. Способ включает вставление дистального конца имплантата в отверстие слезного канала. Удерживающая структура имплантата расширяется так, чтобы подавить выталкивание имплантата. Расширение имплантата помогает сжать поток слезной жидкости через отверстие слезного канала. Лечебный агент доставляется из проксимального конца имплантата к слезной жидкости, прилегающей к глазу. Доставка лечебного агента подавлена дистально по отношению к проксимальному концу.
Во многих воплощениях доставка лечебного агента к слезе подавляется оболочкой, имеющей часть, экспонированнную в слезную жидкость. В конкретных воплощениях удерживающая структура может включать суперэластичный или обладающий памятью формы сплав. Удерживающая структура включает гидрогель и расширяется дистально от лекарственной сердцевины.
В другом аспекте многие воплощения данного изобретения обеспечивают имплантат для лечения глаза. Глаз имеет слезную жидкость и отверстие слезного канала. Имплантат включает лекарственную сердцевину, имеющую проксимальный конец, дистальный конец и поперечное сечение, пригодное для вставления в отверстие слезного канала. Оболочка располагается поверх лекарственной сердцевины дистально от проксимального конца. Набухающий материал расположен дистально от проксимального конца. Набухающий материал приспособлен для набухания после вставления в отверстие слезного канала для удержания лекарственной сердцевины и преграждения прохода слезе, находящейся в жидкостном контакте с лекарственной сердцевиной.
Во многих воплощениях крылья соединяются с оболочкой рядом с проксимальным концом лекарственной сердцевины. Крылья могут быть подогнаны по размеру так, чтобы оставаться вовне отверстия слезного канала, чтобы удерживать проксимальный конец лекарственной сердцевины рядом с отверстием слезного канала.
Во многих воплощениях обеспечивается имплантат для лечения глаза. Глаз имеет слезную жидкость и отверстие слезного канала. Имплантат включает лекарственную сердцевину, имеющую проксимальный конец, дистальный конец и поперечное сечение, пригодное для вставления в отверстие слезного канала. Манжета располагается поверх лекарственной сердцевины, по крайней мере, дистально от проксимального конца. Набухающий материал расположен дистально от проксимального конца и, по крайней мере, частично покрыт манжетой. Набухающий материал приспособлен для набухания после вставления в отверстие слезного канала для удержания лекарственной сердцевины и преграждения прохода слезе, находящейся в жидкостном контакте с лекарственной сердцевиной.
Во многих воплощениях манжета включает лепестки для удержания пробки для отверстия слезного канала при расширении набухающего материала.
Во многих воплощениях обеспечивается пробка для отверстия слезного канала для лечения глаза. Глаз имеет слезную жидкость и отверстие слезного канала. Пробка включает корпус пробки и лекарственную сердцевину внутри корпуса пробки. Лекарственная сердцевина включает смесь лечебного агента и матрикса. Поверхность сердцевины экспонирована для слезной жидкости для лечения глаза.
В конкретных воплощениях лекарственная сердцевина способна к упругому расширению для подгонки иглы, вставленной в нее, в то время как пробка вставляется в отверстие слезного канала глаза.
Во многих воплощениях обеспечивается пробка для отверстия слезного канала для лечения глаза. Глаз имеет слезную жидкость и отверстие слезного канала. Пробка включает расширяемый удерживающий элемент для расширения и соединения с отверстием слезного канала при расположении в глазу. Корпус соединяется с расширяемым удерживающим элементом и включает выступ для удаления удерживающего элемента из отверстия слезного канала.
Во многих воплощениях расширяемый удерживающий элемент включает набухающий материал, а корпус приспособлен для удержания набухающего материала, в то время как корпус удаляется. В конкретных воплощениях набухающий материал может включать гидрогель.
Краткое описание чертежей.
Фиг.1-1 и 1-2 показывают анатомические тканевые структуры глаза, пригодные для применения имплантантов, в соответствии с воплощениями данного изобретения;
фиг.1А показывает вид на поперечном срезе сверху имплантата для пролонгированного высвобождения для лечения оптического дефекта глаза в соответствии с воплощением данного изобретения;
фиг.1В показывает вид на поперечном срезе сбоку имплантата для пролонгированного высвобождения из фиг.1A;
фиг.1С показывает вид в перспективе имплантата для пролонгированного высвобождения со спиральной удерживающей структурой в соответствии с воплощением данного изобретения;
фиг.1D показывает вид в перспективе имплантата для пролонгированного высвобождения с удерживающей структурой, включающей распорки, в соответствии с воплощением данного изобретения;
фиг.1E показывает вид в перспективе имплантата для пролонгированного высвобождения с каркасной удерживающей структурой в соответствии с воплощением данного изобретения;
фиг.1F показывает вид в перспективе имплантата для пролонгированного высвобождения, включающего сердцевину и оболочку, в соответствии с воплощением данного изобретения;
фиг.1G схематически иллюстрирует имплантат для пролонгированного высвобождения, включающий удерживающий элемент, ограничивающий поток, сердцевину и оболочку, в соответствии с воплощением данного изобретения;
фиг.2А показывает вид на поперечном срезе имплантата для пролонгированного высвобождения с сердцевиной, включающей увеличенную экспонированную область поверхности в соответствии с воплощением данного изобретения;
фиг.2В показывает вид на поперечном срезе имплантата для пролонгированного высвобождения с сердцевиной, включающей увеличенную экспонированную область поверхности, в соответствии с воплощением данного изобретения;
фиг.2С и 2D показывают вид в перспективе и вид на поперечном срезе соответственно имплантата для пролонгированного высвобождения с сердцевиной, включающей уменьшенную экспонированную область поверхности, в соответствии с воплощением данного изобретения;
фиг.2Е показывает вид на поперечном срезе имплантата для пролонгированного высвобождения с сердцевиной, включающей увеличивающуюся экспонированную область поверхности с углублением и зубцом, в соответствии с воплощением данного изобретения;
фиг.2F показывает вид в перспективе имплантата для пролонгированного высвобождения, включающего сердцевину со складками, в соответствии с воплощением данного изобретения;
фиг.2G показывает вид в перспективе имплантата для пролонгированного высвобождения с сердцевиной, включающей канал с внутренней пористой поверхностью, в соответствии с воплощением данного изобретения;
фиг.2Н показывает вид в перспективе имплантата для пролонгированного высвобождения с сердцевиной, включающей пористые каналы для увеличения миграции лекарства, в соответствии с воплощением данного изобретения;
фиг.2I показывает вид в перспективе имплантата для пролонгированного высвобождения с выпуклой экспонированной поверхностью лекарственной сердцевины, в соответствии с воплощением данного изобретения;
фиг.2J показывает вид сбоку имплантата для пролонгированного высвобождения с сердцевиной, включающей экспонированную область поверхности с несколькими мягкими щеткоподобными деталями, отходящими от нее, в соответствии с воплощением данного изобретения;
фиг.2K показывает вид сбоку имплантата для пролонгированного высвобождения с лекарственной сердцевиной, включающей выпуклую экспонированную поверхность и удерживающую структуру, в соответствии с воплощением данного изобретения;
фиг.2L показывает вид сбоку имплантата для пролонгированного высвобождения с лекарственной сердцевиной, включающей вогнутую зазубренную поверхность для увеличения экспонированной области поверхности сердцевины, в соответствии с воплощением данного изобретения;
фиг.2М показывает вид сбоку имплантата для пролонгированного высвобождения с лекарственной сердцевиной, включающей вогнутую поверхность с каналом, образованным в ней для увеличения экспонированной области поверхности сердцевины, в соответствии с воплощением данного изобретения;
фиг.3A показывает имплантат с оболочкой с расширениями, которые прикрепляют оболочку и сердцевину с удерживающим элементом, в соответствии с воплощением данного изобретения;
фиг.3B показывает имплантат с удерживающим элементом с расширением, которое удерживает оболочку и сердцевину, в соответствии с воплощением данного изобретения;
фиг.4А и 4В показывает вид на поперечном срезе имплантата с удерживающей структурой, по длине короче в поперечной конфигурации с большим сечением, чем в поперечной конфигурации с малым сечением, в соответствии с воплощением данного изобретения;
фиг.5А показывает вставляющий инструмент для вставления имплантата в отверстие слезного канала с поршнем, который можно нажать, в соответствии с воплощением данного изобретения;
фиг.5В показывает вставляющий инструмент для вставления имплантата в отверстие слезного канала с поршнем, который можно передвинуть, в соответствии с воплощением данного изобретения;
фиг.6 показывает вставляющий инструмент для вставления имплантата в отверстие слезного канала с корпусом, который втягивается проксимально, в соответствии с воплощением данного изобретения;
фиг.7А-7С схематически иллюстрируют замену лекарственной сердцевины и оболочку, в соответствии с воплощением данного изобретения;
фиг.8А-8С показывают развертывание имплантата для пролонгированного высвобождения, в соответствии с воплощением данного изобретения;
фиг.9А показывает систему доставки лекарства с манжетой для поддержки лекарственной сердцевины и элементом удержания гидрогеля, в соответствии с воплощениями данного изобретения;
фиг.9В показывает систему доставки лекарства, как на фиг.9А, с гидратированным элементом удержания гидрогеля, в соответствии с воплощениями данного изобретения;
фиг.9С показывает систему доставки лекарства, как на фиг.9А, с манжетой, включающей силиконовый ворот для опоры на внешней части отверстия слезного канала, в соответствии с воплощениями данного изобретения;
фиг.9D показывает манжету системы доставки лекарства с заострением на дистальном конце канальца манжеты для облегчения вставления в отверстие слезного канала и с кромками для опоры на внешней части отверстия слезного канала в соответствии с воплощениями данного изобретения;
фиг.9Е показывает манжету системы доставки лекарства с ограничением на дистальном конце канальца манжеты для задержки элемента удержания гидрогеля в манжете в соответствии с воплощениями данного изобретения;
фиг.9F показывает систему доставки лекарства с элементом удержания гидрогеля во время вставления в просвет канальца в соответствии с воплощениями данного изобретения;
фиг.9G показывает систему доставки лекарства, как на фиг.9F с расширенным элементом удержания гидрогеля после вставления в просвет канальца в соответствии с воплощениями данного изобретения;
фиг.10A показывает вставку лекарственной сердцевины для применения с пробкой для отверстия слезного канала в соответствии с воплощениями данного изобретения;
фиг.10В показывает пробку для отверстия слезного канала, включающую внутреннюю полость цилиндрической формы, в соответствии с воплощениями данного изобретения;
фиг.10С показывает пробку для отверстия слезного канала, как на фиг.10В, с лекарственной сердцевиной, как на фиг.10A, вставленной в нее, в соответствии с воплощениями данного изобретения;
фиг.11 показывает систему доставки лекарства пробки для отверстия слезного канала, включающую лекарственную сердцевину и удерживающую структуру, которая включает манжету с крылышками, образованными на ней, в соответствии с воплощениями данного изобретения;
фиг.12А показывает удерживающую структуру, включающую манжету с лепестками и гидрогелем, в соответствии с воплощениями данного изобретения;
фиг.12В показывает удерживающую структуру, как на фиг.12А, с лепестками, направленными радиально наружу в ответ на гидратацию материала гидрогеля, в соответствии с воплощениями данного изобретения;
фиг.12С показывает удерживающую структуру, включающую манжету с лепестками и кольцевым гидрогелевым расширяющимся элементом, в соответствии с воплощениями данного изобретения;
фиг.12D показывает удерживающую структуру, как на 12С, включающую манжету с лепестками и кольцевым гидрогелевым расширяющимся элементом, в соответствии с воплощениями данного изобретения;
фиг.13 показывает устройство для доставки лекарства с гидрогелевой удерживающей структурой, включающей манжету с перекрестными отверстиями и запирающими лепестками и/или кромками для удержания гидрогеля на месте при расширении гидрогеля, в соответствии с воплощениями данного изобретения;
фиг.14А показывает пробку для отверстия слезного канала с лекарственной сердцевиной и удерживающими гребнями в соответствии с воплощениями данного изобретения; и
фиг.14В показывает пробку для отверстия слезного канала, как на 14А, с удерживающими гребнями, сложенными назад, для поддержки пробки, когда ее вставляют в просвет канальца.
Осуществление изобретения
Фиг.1-1 и 1-2 показывают анатомические тканевые структуры глаза 2, пригодные для вставления имплантатов, в соответствии с воплощением данного изобретения. Глаз 2 включает роговицу 4 и радужную оболочку 6. Склера окружает роговицу 4 и радужную оболочку 6 и имеет белый цвет. Конъюнктивальный слой 9 является по существу прозрачным и располагается поверх склеры 8. Линза хрусталика 5 расположена внутри глаза. Сетчатка 7 расположена рядом с задней стенкой глаза и является в целом чувствительной к свету. Сетчатка 7 включает центральное углубление 7F, которое обеспечивает высокую визуальную активность и цветовое зрение. Роговица 4 и хрусталик 5 преломляют свет до формирования изображения на центральном углублении 7F и сетчатке 7. Оптическая сила роговицы 4 и хрусталика 5 вносит вклад в формирование изображения на центральном углублении 7F и сетчатке 7. Относительное расположение роговицы 4, хрусталика 5 и центрального углубления 7F также важно для качества изображения. Например, если аксиальная длина глаза 2 от роговицы 4 до сетчатки 7F является большой, глаз 2 может быть близоруким. Также во время аккомодации хрусталик 5 движется по направлению к роговице 4 для обеспечения хорошего ближнего зрения для объектов, удаленных от глаза.
Анатомические тканевые структуры, показанные на фиг.1-1, также включают слезную систему, которая включает верхний каналец 10 и нижний каналец 12, вместе канальцы, и носослезный проток или мешок 14. Верхний и нижний канальцы заканчиваются в верхнем отверстии 11 и нижнем отверстии 13, также называемых апертурами слезного канала. Апертуры слезного канала расположены на небольшом возвышении на срединном конце края века в месте соединения 15 ресничной и слезной части рядом со срединным углом глазной щели. Апертуры слезного канала являются круглыми или слегка овальными отверстиями, окруженными соединительным кольцом ткани. Каждое из отверстий слезного канала 11, 13 ведет в вертикальную часть 10а, 12а соответствующего канальца перед поворотом в горизонтальном направлении для соединения с другим канальцем при входе в слезный мешок 14. Канальцы являются трубчатыми и выстланы многослойным чешуйчатым эпителием, окруженным эластичной тканью, что позволяет канальцу расширяться.
Фиг.1А показывает вид на поперечном срезе сверху имплантата для пролонгированного высвобождения 100 для лечения оптического дефекта глаза в соответствии с воплощением данного изобретения. Имплантат 100 включает лекарственную сердцевину 110. Лекарственная сердцевина 110 является имплантируемой структурой, которая удерживает лечебный агент. Лекарственная сердцевина 110 включает матрикс 170, который содержит включения 160 лечебного агента. Включения 160 часто включают концентрированную форму лечебного агента, например, кристаллическую форму лечебного агента, и лечебный агент может на протяжении времени растворяться в матриксе 170 лекарственной сердцевины 110. Матрикс 170 может включать силиконовый матрикс или тому подобный, и смесь лечебного агента внутри матрикса 170 может быть неоднородной. Во многих воплощениях неоднородная смесь включает часть силиконового матрикса, которая насыщена лечебным агентом, и часть включений, содержащую включения лечебного агента, так что неоднородная смесь включает многофазную неоднородную смесь. В некоторых воплощениях включения 160 включают капельки масла лечебного агента, например, масла Латанопроста. В некоторых воплощениях включения 160 могут включать частицы лечебного агента, например, твердые частицы Биматопроста в кристаллической форме. Во многих воплощениях матрикс 170 инкапсулирует включения 160, и включения 160 могут включать микрочастицы, имеющие размеры от примерно 1 мкм до примерно 100 мкм. Инкапсулированные включения растворяются в окружающем твердом матриксе, например силиконе, который инкапсулирует микрочастицы так, что матрикс 170 является по существу насыщенным лечебным агентом, в то время как лечебный агент высвобождается из сердцевины.
Лекарственная сердцевина 110 окружена оболочкой 120. Оболочка 120 может быть по существу непроницаемой для лечебного агента, так что лечебный агент часто высвобождается из экспонированной поверхности на конце лекарственной сердцевины 110, который не покрыт оболочкой 120. Удерживающая структура 130 соединена с лекарственной сердцевиной 110 и оболочкой 120. Удерживающая структура 130 приспособлена по форме для удержания имплантата в полой тканевой структуре, например, в отверстии канальца, как описано выше.
Окклюзионный элемент 140 расположен на удерживающей структуре 130 и вокруг нее. Окклюзионный элемент 140 является непроницаемым для потока слезы и сужает полую тканевую структуру и может также служить для защиты ткани тканевой структуры от удерживающей структуры 130 путем обеспечения более мягкой поверхности для сцепления с тканью. Оболочка 120 включает часть оболочки 150, которая соединяется с удерживающей структурой 130 для удержания оболочки 120 и лекарственной сердцевины 110. Часть оболочки 150 может включать стопор для ограничения движения оболочки 120 и лекарственной сердцевины 110. Во многих воплощениях часть оболочки 150 может быть сформирована с луковицеобразным наконечником 150В. Луковицеобразный наконечник может включать выпуклую круглую внешнюю часть, обеспечивающую атравматический вход при ведении в каналец. Во многих воплощениях часть оболочки 150В может составлять единое целое с окклюзионным элементом 140.
Фиг.1В показывает вид сбоку на поперечном срезе имплантата пролонгированного высвобождения из фиг.1А. Лекарственная сердцевина 110 является цилиндрической и показана с круговым поперечным сечением. Оболочка 120 включает кольцевую часть, расположенную на лекарственной сердцевине 110. Удерживающая структура 130 включает несколько продольных распорок 131. Продольные распорки 131 соединяются вместе рядом с концами удерживающей структуры. Хотя показаны продольные распорки, также могут применяться кольцевые распорки. Окклюзионный элемент 140 поддерживается и располагается поверх продольных распорок 131 удерживающей структуры 130 и может включать радиально расширяемую мембрану или тому подобное.
Фиг.1С показывает вид в перспективе имплантата для пролонгированного высвобождения 102 со спиральной удерживающей структурой 132 в соответствии с воплощением данного изобретения. Удерживающая структура 132 включает спираль и удерживает лекарственную сердцевину 112. Полость, например канал 112С, может проходить через лекарственную сердцевину 112 для обеспечения потока слезы через полость для доставки лечебного агента для назальных и системных приложений лечебного агента. В дополнение или в комбинации с каналом 112С удерживающая структура 132 и сердцевина 112 могут быть подогнаны по размеру для обеспечения потока слезы вокруг лекарственной сердцевины и оболочки, в то время как удерживающий элемент отдаляет ткань канальца лекарственной сердцевины. Лекарственная сердцевина 112 может быть частично закрыта. Оболочка включает первый компонент 122А, который покрывает первый конец лекарственной сердцевины 112, и второй компонент 122В, который покрывает второй конец лекарственной сердцевины. Окклюзионный элемент может быть помещен поверх удерживающей структуры, и/или удерживающая структура может быть покрыта погружением, как описано выше.
Фиг.1D показывает вид в перспективе имплантата для пролонгированного высвобождения 104 с удерживающей структурой 134, включающей распорки, в соответствии с воплощением данного изобретения. Удерживающая структура 134 включает продольные распорки и удерживает лекарственную сердцевину 114. Лекарственная сердцевина 114 покрыта оболочкой 124 поверх большей части лекарственной сердцевины 114. Лекарственная сердцевина высвобождает лечебный агент через экспонированный конец, а оболочка 124 является кольцевым поверх большей части лекарственной сердцевины, как описано выше. Окклюзионный элемент может быть помещен поверх удерживающей структуры, или удерживающая структура может быть покрыта погружением, как описано выше. Выступ может быть вставлен с инструментом, например крючком, петлей, швом или кольцом 124R, может продолжаться от оболочки 124 для обеспечения удаления лекарственной сердцевины и оболочки совместно, так, чтобы облегчить замену оболочки и лекарственной сердцевины, в то время как удерживающая структура остается имплантированной в канальце. В некоторых воплощениях выступ может быть вставлен с инструментом, включая крючок, петлю, шов или кольцо, может продолжаться от удерживающей структуры 134 для обеспечения удаления имплантата пролонгированного высвобождения путем удаления удерживающей структуры с выступом, лекарственной сердцевиной и оболочкой.
Фиг.1E показывает вид в перспективе имплантата для пролонгированного высвобождения 106 с каркасной удерживающей структурой 136 в соответствии с воплощением данного изобретения. Удерживающая структура 136 включает несколько соединенных нитей из металла и удерживает лекарственную сердцевину 116. Лекарственная сердцевина 116 покрыта оболочкой 126 поверх большей части лекарственной сердцевины 116. Лекарственная сердцевина высвобождает лечебный агент через экспонированный конец, а оболочка 126 является кольцевой поверх большей части лекарственной сердцевины, как описано выше. Окклюзионный элемент может быть помещен поверх удерживающей структуры, или удерживающая структура может быть покрыта погружением, как описано выше.
Фиг.1F показывает вид в перспективе имплантата для пролонгированного высвобождения, включающего сердцевину и оболочку, в соответствии с воплощением данного изобретения. Лекарственная сердцевина 118 покрыта оболочкой 128 поверх большей части лекарственной сердцевины 118. Лекарственная сердцевина высвобождает лечебный агент через экспонированный конец, а оболочка 128 является кольцевой поверх большей части лекарственной сердцевины, как описано выше. Скорость высвобождения лечебного агента контролируется площадью поверхности эксонированной лекарственной сердцевины и материалами, включенными внутри лекарственной сердцевины 118. Во многих воплощениях скорость элюции лечебного агента сильно и существенно связана с экспонированной площадью поверхности лекарственной сердцевины и слабо зависит от концентрации лекарства, находящегося во включениях в лекарственной сердцевине. Для циркулярно-экспонированных поверхностей скорость элюции сильно зависит от диаметра экспонированной поверхности, например, диаметра экспонированной поверхности лекарственной сердцевины рядом с концом цилиндрической лекарственной сердцевины. Так имплантат может быть вставлен в ткани глаза, например, ниже слоя конъюнктивальной ткани 9 глаза или над слоем ткани склеры 8, как показано на фиг.1F, или только частично внутри слоя ткани склеры, так чтобы не проходить сквозь ткань склеры. Нужно отметить, что лекарственная сердцевина 118 может применяться с любой из удерживающих структур и любым из окклюзионных элементов, как описано здесь.
В одном воплощении лекарственную сердцевину имплантируют между склерой 8 и конъюнктивой 9 без оболочки 128. В этом воплощении без оболочки физические характеристики лекарственной сердцевины могут быть отрегулированы, чтобы компенсировать повышение экспонированной площади лекарственной сердцевины, например, путем уменьшения концентрации растворенного лечебного агента в матриксе лекарственной сердцевины, как описано здесь.
Фиг.1G схематически иллюстрирует имплантат для пролонгированного высвобождения 180, включающий удерживающий элемент 186, ограничивающий поток, сердцевину 182 и оболочку 184 в соответствии с воплощением данного изобретения. Оболочка 184 может, по крайней мере, частично покрывать лекарственную сердцевину 182. Лекарственная сердцевина 182 может содержать частицы лечебного агента для обеспечения пролонгированного высвобождения лечебного агента. Лекарственная сердцевина 182 может включать выпуклую область поверхности 182А. Экспонированная выпуклая область поверхности 182А может обеспечивать увеличенную область поверхности для высвобождения лечебного агента. Окклюзионный элемент 188 может располагаться поверх удерживающей структуры 186, чтобы блокировать поток слезы через каналец. Во многих воплощениях удерживающая структура 186 может располагаться внутри окклюзионной структуры 188 для обеспечения окклюзионного элемента, интегрированного с удерживающей структурой. Ограничивающая поток удерживающая структура 186 и окклюзионный элемент 188 могут быть подогнаны по размеру, чтобы блокировать поток слезы через каналец.
Сердцевины и оболочки, описанные здесь, могут быть имплантированы в различные ткани различными путями. Многие из сердцевин и оболочек, описанных здесь, в частности структуры, описанные со ссылкой на фиг.2А-21, могут быть имплантированы отдельно как пробки для отверстия слезного канала. Альтернативно, многие из сердцевин и оболочек, описанных здесь, могут включать лекарственную сердцевину, оболочку, и/или тому подобное, для имплантации с удерживающими структурами и окклюзионными элементами, описанными здесь.
Фиг.2А показывает вид на поперечном срезе имплантата для пролонгированного высвобождения 200 с сердцевиной, включающей увеличенную экспонированную область поверхности, в соответствии с воплощением данного изобретения. Лекарственная сердцевина 210 покрыта оболочкой 220. Оболочка 220 включает отверстие 220А. Отверстие 220А имеет диаметр, который приближается к максимальному диаметру поперечного сечения лекарственной сердцевины 210. Лекарственная сердцевина 210 включает экспонированную поверхность 210Е, также называемую активной поверхностью. Экспонированная поверхность 210Е включает 3 поверхности: кольцевую поверхность 210А, цилиндрическую поверхность 210В и концевую поверхность 210С.Кольцевая поверхность 210А имеет внешний диаметр, который приближается к максимальному диаметру поперечного сечения сердцевины 210, и внутренний диаметр, который приближается к внешнему диаметру цилиндрической поверхности 210В. Концевая поверхность 210С имеет диаметр, который совпадает с диаметром цилиндрической поверхности 210В. Область экспонированной поверхности 210Е является суммой областей кольцевой поверхности 210А, цилиндрической поверхности 210В и концевой поверхности 210С.Область поверхности может быть увеличена по размеру области цилиндрической поверхности 210В, которая продолжается в продольном направлении вдоль оси сердцевины 210.
Фиг.2В показывает вид на поперечном срезе имплантата для пролонгированного высвобождения 202 с сердцевиной 212, включающей увеличенную экспонированную область поверхности 212А, в соответствии с воплощением данного изобретения. Оболочка 222 продолжается поверх сердцевины 212. Лечебный агент может высвобождаться из сердцевины, как описано выше. Экспонированная область поверхности 212А является примерно конической, может быть эллипсоидальной или сферической и проходит наружу от оболочки для увеличения экспонированной области лекарственной сердцевины 212.
Фиг.2С и 2D показывают вид в перспективе и вид на поперечном срезе соответственно имплантата для пролонгированного высвобождения 204 с лекарственной сердцевиной 214, включающей уменьшенную экспонированную область поверхности 214А, в соответствии с воплощением данного изобретения Лекарственная сердцевина 214 заключена внутри оболочки 224. Оболочка 22 включает кольцевую концевую часть 224А, которая определяет отверстие, через которое проходит лекарственная сердцевина 214. Лекарственная сердцевина 214 включает экспонированную поверхность 214А, которая высвобождает лечебный агент. Экспонированная поверхность 214А имеет диаметр 214D, который меньше максимального размера, например максимального диаметра поперек лекарственной сердцевины 214.
Фиг.2Е показывает вид на поперечном срезе имплантата для пролонгированного высвобождения 206 с сердцевиной 216, включающей увеличивающуюся экспонированную область поверхности 216А с углублением и зубцом в соответствии с воплощением данного изобретения. Зубец включает несколько направленных в разные стороны штифтов 216F для обеспечения увеличенной области поверхности экспонированной поверхности 216А. В дополнение к увеличенной области поверхности, обеспеченной зубцом, лекарственная сердцевина 216 может также включать зазубрину 216I. Зазубрина 216I может иметь форму перевернутого конуса. Сердцевина 216 покрыта оболочкой 226. Оболочка 226 открыта на одном конце для обеспечения экспонированной поверхности 216А на лекарственной сердцевине 216. Оболочка 226 также включает штифты и имеет вид зубцов, совпадающий с сердцевиной 216.
Фиг.2F показывает вид в перспективе имплантата для пролонгированного высвобождения 250, включающего сердцевину со складками, в соответствии с воплощением данного изобретения. Имплантат 250 включает сердцевину 260 и оболочку 270. Сердцевина 260 имеет экспонированную поверхность 260А на конце сердцевины, которая обеспечивает миграцию лекарства к окружающей слезе или жидкости слезной пленки. Сердцевина 260 также включает складки 260F. Складки 260F увеличивают область поверхности сердцевины, которая экспонирована для окружающей жидкости слезы или слезной пленки. С этим увеличением экспонированной области поверхности складки 260F повышают миграцию лечебного агента из сердцевины 260 в слезу или жидкость слезной пленки и нацеливают область лечения. Складки 260F образованы так, что канал 260С образован в сердцевине 260. Канал 260С соединяется с концом сердцевины на отверстии экспонированной поверхности 260А и обеспечивает миграцию лечебного агента. Так, общая экспонированная область поверхности сердцевины 260 включает экспонированную поверхность 260А, которая напрямую экспонирована для слезы или жидкости слезной пленки и поверхностей складок 260F, которые доступны для слезы или жидкости слезной пленки через соединение канала 260С с экспонированной поверхностью 260А и слезой или жидкостью слезной пленки.
Фиг.2G показывает вид в перспективе имплантата для пролонгированного высвобождения с сердцевиной, включающей канал с внутренней пористой поверхностью, в соответствии с воплощением данного изобретения. Имплантат 252 включает сердцевину 262 и оболочку 272. Сердцевина 262 имеет экспонированную поверхность 262А на конце сердцевины, которая обеспечивает миграцию лекарства к окружающей слезе или жидкости слезной пленки. Сердцевина 262 также включает канал 262С. Канал 262С увеличивает область поверхности канала с пористой внутренней поверхностью 262Р, образованной внутри канала напротив сердцевины. Канал 262С проходит до конца сердцевины рядом с экспонированной поверхностью 262А сердцевины. Область поверхности сердцевины, которая доступна для окружающей слезы или жидкости слезной пленки, может включать внутреннюю часть сердцевины 262, экспонированную для канала 262С. Это увеличение экспонированной области поверхности может повышать миграцию лечебного агента сердцевины 262 к слезе или жидкости слезной пленки и целевой области лечения. Так, общая экспонированная область поверхности сердцевины 262 может включать экспонированную поверхность 260А, которая прямо доступна для слезы или жидкости слезной пленки, и пористую внутреннюю поверхность 262Р, которая доступна для слезы или жидкости слезной пленки через соединение канала 262С с экспонированной поверхностью 262А и слезой или жидкостью слезной пленки.
Фиг.2Н показывает вид в перспективе имплантата для пролонгированного высвобождения 254 с сердцевиной 264, включающей каналы для увеличения миграции лекарства, в соответствии с воплощением данного изобретения. Имплантат 254 включает сердцевину 264 и оболочку 274. Экспонированная поверхность 264А расположена на конце сердцевины 264, хотя экспонированная поверхность может располагаться в других местах. Экспонированная поверхность 264А обеспечивает миграцию лекарства к окружающей слезе или жидкости слезной пленки. Сердцевина 264 также включает каналы 264С. Каналы 264 проходят до экспонированной поверхности 264. Каналы 264С достаточно велики, чтобы слеза или жидкость слезной пленки могла проникать в каналы, и таким образом увеличивают область поверхности сердцевины 264, которая находится в контакте со слезой или жидкостью слезной пленки. Область поверхности сердцевины, экспонированная для окружающей слезной жидкости или жидкости слезной пленки, включает внутренние поверхности 264Р сердцевины 262, которые определяют каналы 264С. С этим повышением экспонированной области поверхности каналы 264С увеличивают миграцию лечебного агента из сердцевины 264 в слезу или жидкость слезной пленки и целевую область лечения. Так, общая экспонированная область поверхности сердцевины 264 включает экспонированную поверхность 264А, которая прямо доступна для слезы или жидкости слезной пленки, и внутреннюю поверхность 264Р, которая доступна для слезы или жидкости слезной пленки через соединение каналов 262С с экспонированной поверхностью 264А и слезой или жидкостью слезной пленки.
Фиг.2I показывает вид в перспективе имплантата для пролонгированного высвобождения 256 с лекарственной сердцевиной 266, включающей выпуклую экспонированную поверхность 266А, в соответствии с воплощением данного изобретения. Лекарственная сердцевина 266 частично покрыта оболочкой 276, которая проходит, по крайней мере, частично поверх лекарственной сердцевины 266, определяя выпуклую экспонированную поверхность 266А. Оболочка 276 включает стволовую часть 276S. Выпуклая экспонированная поверхность 266А обеспечивает увеличенную экспонированную область поверхности над оболочкой. Область поперечного сечения выпуклой экспонированной области 266А больше, чем область поперечного сечения стволовой части 276S оболочки 276. В дополнение к большей области поперечного сечения выпуклая экспонированная поверхность 266А имеет большую область поверхности благодаря выпуклой форме, проходящей от сердцевины. Оболочка 276 включает несколько штифтов 276F, которые поддерживают лекарственную сердцевину 266 в оболочку и обеспечивают поддержку лекарственной сердцевины для удержания лекарственной сердцевины 266 на месте в оболочке 276. Штифты 276F направлены в разные стороны, чтобы обеспечить миграцию из сердцевины к слезе или жидкости слезной пленки между штифтами. Выступы 276Р проходят к оболочке 276. Выступы 276Р могут быть нажаты внутрь для извлечения лекарственной сердцевины 266 из оболочки 276. Лекарственная сердцевина 266 может быть заменена другой лекарственной сердцевиной спустя надлежащее время, например, после того как сердцевина 266 высвобождает большую часть лечебного агента.
Фиг.2J показывает вид сбоку имплантата для пролонгированного высвобождения 258 с сердцевиной 268, включающей экспонированную область поверхности с несколькими мягкими щеткоподобными деталями 268F, в соответствии с воплощением данного изобретения. Лекарственная сердцевина 268 частично покрыта оболочкой 28, которая проходит, по крайней мере, частично поверх лекарственной сердцевины 268, определяя экспонированную поверхность 268А. Оболочка 278 включает стволовую часть 278S. Мягкие щеткоподобные детали 268F проходят наружу от лекарственной сердцевины 268 и обеспечивают увеличенную экспонированную область поверхности для лекарственной сердцевины 268. Мягкие щеткоподобные детали 268F являются также мягкими и эластичными и легко отклоняются так, что эти детали не вызывают раздражения соседних тканей. Хотя лекарственная сердцевина может быть изготовлена из многих материалов, как объясняется выше, силикон является подходящим материалом для производства лекарственной сердцевины 268, включая мягкие щеткоподобные детали 268F. Экспонированная поверхность 268А лекарственной сердцевины 268 также включает зазубрину 268I, так что, по крайней мере, часть экспонированной поверхности 268А является вогнутой.
Фиг.2K показывает вид сбоку имплантата для пролонгированного высвобождения 259 с лекарственной сердцевиной 269, включающей выпуклую экспонированную поверхность 269А, в соответствии с воплощением данного изобретения. Лекарственная сердцевина 269 частично покрыта оболочкой 279, которая проходит, по крайней мере, частично над лекарственной сердцевиной 269, определяя выпуклую экспонированную поверхность 269А. Оболочка 279 включает стволовую часть 279S. Выпуклая экспонированная поверхность 269 обеспечивает увеличенную экспонированную область поверхности над оболочкой. Область поперечного сечения выпуклой экспонированной поверхности 269А больше, чем область поперечного сечения стволовой части 279S оболочки 279. В дополнение к большей области поперечного сечения выпуклая экспонированная поверхность 269А имеет большую область поверхности благодаря выпуклой форме, проходящей наружу от сердцевины. Удерживающая структура 289 может присоединяться к оболочке 279. Удерживающая структура 289 может включать любую из удерживающих структур, описанных здесь, например, спираль, включающую суперэластичный сплав с памятью формы, такой как Нитинол™. Удерживающая структура 289 может быть покрыта погружением, чтобы сделать удерживающую структуру 289 биосовместимой.
Фиг.2L показывает вид сбоку имплантата для пролонгированного высвобождения 230 с лекарственной сердцевиной 232, включающей вогнутую зазубренную поверхность 232А для увеличения экспонированной области поверхности сердцевины, в соответствии с воплощением данного изобретения. Оболочка 234 проходит, по крайней мере, частично над лекарственной сердцевиной 232. Вогнутая зазубренная поверхности 232А образована на экспонированном конце лекарственной сердцевины 232 для обеспечения увеличенной экспонированной области поверхности лекарственной сердцевины.
Фиг.2М показывает вид сбоку имплантата для пролонгированного высвобождения 240 с лекарственной сердцевиной 242, включающей вогнутую поверхность 242А с каналом 242С, образованным в ней для увеличения экспонированной области поверхности сердцевины, в соответствии с воплощением данного изобретения. Оболочка 244 проходит, по крайней мере, частично поверх лекарственной сердцевины 242. Вогнутая зазубренная поверхность 242А образована на экспонированном конце лекарственной сердцевины 232 для обеспечения увеличенной экспонированной области поверхности лекарственной сердцевины. Канал 242С образован на лекарственной сердцевине 242 для обеспечения увеличенной экспонированной области поверхности лекарственной сердцевины. Канал 242С может проходить к вогнутой зазубренной поверхности 242А так, что канал 242С обеспечивает увеличение области поверхности сердцевины, экспонированной для слезы или слезной пленки.
Фиг.3А показывает имплантат 310 с оболочкой 320 с расширениями 322 в соответствии с воплощением данного изобретения. Расширения 322 прикрепляют оболочку 320 к удерживающему элементу для удержания сердцевины рядом с отверстием слезного канала. Оболочка 320 проходит поверх сердцевины 330, определяя экспонированную поверхность 332 сердцевины 330. Расширения 322 могут быть эластичными и сцепляют удерживающий элемент и/или окклюзионный элемент для присоединения сердцевины оболочки к удерживающему элементу для удержания сердцевины рядом с отверстием слезного канала.
Фиг.3В показывает имплантат 350, включающий удерживающий элемент 380 с расширением 382, в соответствии с воплощением данного изобретения. Расширение 382 удерживает оболочку 360 и сердцевину 370. Оболочка 360 проходит поверх сердцевины 370, определяя экспонированную поверхность 372 сердцевины 370. Экспонированная поверхность 372 расположена рядом с проксимальным концом сердцевины 370. Расширение 382 проходит вниз для удержания сердцевины 370 и оболочки 370.
Фиг.4А и 4В показывают вид на поперечном срезе имплантата 400 с удерживающей структурой 430, которая по длине короче в поперечной конфигурации с большим сечением, чем в поперечной конфигурации с малым сечением, в соответствии с воплощением данного изобретения. Имплантат 400 включает дистальный конец 402 и проксимальный конец 404. Имплантат 400 включает лекарственную сердцевину 410 и оболочку 420. Оболочка 420, по крайней мере, частично покрывает лекарственную сердцевину 410 и определяет экспонированную поверхность 412 лекарственной сердцевины 410. Окклюзионный элемент 440 может быть прикреплен к удерживающей структуре 430 и поддерживаться ею. Окклюзионный элемент 440 может перемещаться удерживающей структурой 430, например, когда удерживающий элемент 430 расширяется из конфигурации с малым сечением до конфигурации с большим сечением. Во многих воплощениях удерживающая структура и окклюзионный элемент подогнаны по размеру, чтобы соответствовать диаметру канальца, например, чтобы совпадать с диаметром канальца или слегка превышать диаметр канальца, так чтобы закрыть поток жидкости через каналец и/или закрепиться в канальце.
Как показано на фиг.4А, удерживающая структура 430 и окклюзионный элемент 440 находятся в конфигурации с малым сечением. Такая конфигурация с малым сечением может наблюдаться, когда окклюзионный элемент и удерживающую структуру помещают на конец вставляющего инструмента и закрывают для развертывания. Удерживающий элемент 430 и окклюзионный элемент 440 проходят по всей длине оболочки 420 и лекарственной сердцевины 410. Удерживающий элемент 430 присоединяется к оболочке 420 рядом с дистальным концом 402. Во многих воплощениях удерживающая структура 430 и окклюзионный элемент 440 имеют диаметры, которые подогнаны по размеру, чтобы вставить вовнутрь и переместить в канальце в конфигурации с малым сечением, и удерживающая структура и окклюзионный элемент могут быть подогнаны по размеру, чтобы быть закрепленными внутри канальца при второй профильной конфигурации.
Как показано на фиг.4В, удерживающая структура 430 и окклюзионный элемент 440 находятся в конфигурации с большим сечением. Такая конфигурация с большим сечением может наблюдаться, когда окклюзионный элемент и удерживающая структура помещены в каналец. В конфигурации с большим сечением длина окклюзионного элемента 440 и удерживающей структуры 430 короче, чем в конфигурации с малым сечением, на расстояние 450. Проксимальный конец удерживающей структуры 430 и окклюзионного элемента 440 может передвигаться поверх оболочки 420, когда оболочка и удерживающая структура принимают конфигурацию с большим сечением, так что проксимальный конец лекарственной сердцевины 410 и оболочка 420 проходят от удерживающей структуры и окклюзионного элемента. В некоторых воплощениях оболочка короче лекарственной сердцевины 410 на расстояние 450 так, что большая часть лекарственной сердцевины доступна, в то время как удерживающая структура и окклюзионный элемент находятся в конфигурации с большим сечением в отличие от того, когда удерживающая структура и окклюзионный элемент находятся в конфигурации с малым сечением. В таких воплощениях удерживающая структура и окклюзионный элемент втягиваются, чтобы сделать экспонированной лекарственную сердцевину.
Фиг.5А-6 показывают воплощения инструментов, которые применяются для вставления многих из имплантатов, как описано здесь.
Фиг.5А показывает вставляющий инструмент 500 для вставления имплантата в отверстие слезного канала с поршнем 530, который можно нажать, в соответствии с воплощением данного изобретения. Вставляющий инструмент 500 включает расширитель 510, который может быть вставлен в отверстие слезного канала для предварительного расширения отверстия слезного канала перед вставкой имплантата. Имплантат 520 может быть предварительно загружен на инструмент 500 перед расширением отверстия слезного канала. Внутренняя проволока 540 может соединяться с имплантатом 520 для удержания имплантата. После предварительного расширения отверстия слезного канала расширителем 510 инструмент 500 может применяться для вставления имплантата 520 в отверстие слезного канала. В то время как имплантат 520 расположен в отверстии слезного канала, поршень 530 может быть нажат для вставления проволоки 540 и высвобождения имплантата 520 из инструмента 500. В некоторых воплощениях проволока 450 может включать заостренный наконечник иглы, который прокалывает имплантат 520. Имплантат 520 может включать лекарственную сердцевину из эластичного материала, например, силикона, так что материал лекарственной сердцевины сокращается, когда иглу удаляют.
Фиг.5В показывает вставляющий инструмент 550 для вставления имплантата 570 в отверстие слезного канала с поршнем, который можно передвинуть, в соответствии с воплощением данного изобретения. Вставляющий инструмент 550 включает расширитель 560 с конической секцией для расширения отверстия слезного канала. Имплантат 550 включает поршень 580, который можно передвинуть дистально, чтобы продвинуть имплантат 570 в полость. Ствол 590 соединен с поршнем 580, чтобы продвинуть имплантат 570 дистально, когда поршень 580 передвигают дистально. Когда отверстие слезного канала расширено расширителем 560, поршень 580 можно продвинуть дистально, чтобы поместить имплантат 570 в просвет канальца рядом с отверстием слезного канала. Во многих воплощениях можно нажать кнопку, чтобы дистально продвинуть имплантат в полость, например, кнопку, соединенную со стволом 590 промежуточным механизмом.
Фиг.6 показывает вставляющий инструмент 600 для вставления имплантата в отверстие слезного канала с оболочкой 610, который втягивает имплантат в просвет канальца до расположения, в соответствии с воплощением данного изобретения. По крайней мере, часть корпуса 610 сделана по форме для расширения отверстия слезного канала. Корпус 610 сделан по форме для удержания имплантата 620 в конфигурации с малым сечением. Вставляющий инструмент 600 включает кольцевую структуру 615, которая может включать часть корпуса 605 вставляющего инструмента 600. Оболочка 610 и кольцевая структура 615 созданы по форме для расширения отверстия слезного канала и часто включают проксимально наклоненные поверхности для расширения отверстия слезного канала. Имплантат 620, оболочка 610 и кольцевая структура 615 могут, по крайней мере, частично быть вставлены в отверстие слезного канала для размещения имплантата в просвет канальца. Кольцевая структура 615 расположена поверх оболочки 610 так, что оболочка 610 может быть втянута и продвинута под кольцевой структурой 615. Ограничитель 625 может быть соединен с корпусом 605, чтобы удержать имплантат 620 на желаемой глубине в просвете канальца, в то время как оболочку 610 втягивают проксимально, чтобы сделать экспонированным имплантат 620.
Как только имплантат 620 располагают в просвете канальца на желаемой глубине по отношению к отверстию слезного канала, оболочку 610 втягивают, чтобы сделать экспонированным имплантат 620 в желаемом месте в просвете канальца. Поршень 630 может применяться для втягивания оболочки 610. Ствол 640 механически объединяет оболочку 610 с поршнем 630. Так, втягивание поршня 630 в проксимальном направлении может втянуть оболочку 610 в проксимальном направлении, чтобы сделать экспонированным имплантат 620 в желаемом месте в просвете канальца. Имплантат 620 может быть любым из имплантатов, как описано здесь. Часто имплантат 620 включает эластичную деталь, которая проходит до конфигурации с большим сечением, когда оболочка 610 втянута. Во многих воплощениях вставляющий инструмент 600 может включать расширитель для расширения отверстия слезного канала перед вставлением имплантата, и расширитель может быть расположен на конце вставляющего инструмента, противоположном концу, несущему имплантат, как описано выше.
Фиг.7А-7С схематически иллюстрируют замену лекарственной сердцевины 710 и оболочки 720 в соответствии с воплощением данного изобретения. Имплантат 700 включает лекарственную сердцевину 710, оболочку 720 и удерживающую структуру 730. Имплантат 700 может включать окклюзионный элемент, поддерживаемый и передвигаемый удерживающей структурой 730. Часто удерживающая структура 730 может принимать первую конфигурацию с малым сечением перед имплантацией и вторую конфигурацию с большим сечением при имплантации. Удерживающая структура 730 показана в конфигурации с большим сечением и имплантирована в просвет канальца. Оболочка 720 включает расширение 725А и расширение 725В для прикрепления оболочки и лекарственной сердцевины к удерживающей структуре 730 так, что оболочка и лекарственная сердцевина удерживаются удерживающей структурой 730. Лекарственная сердцевина 710 и оболочка 720 могут удаляться совместно путем продвижения лекарственной сердцевины в проксимальном направлении, как показано стрелкой 730. Удерживающая структура 730 может оставаться имплантированной в ткани канальца после удаления лекарственной сердцевины 710 и оболочки 720, как показано на фиг.7 В. Сменная сердцевина 760 и сменная оболочка 770 могут быть вставлены совместно, как показано на фиг.7С. Такая замена может быть желательной после высвобождения лекарственной сердцевиной 710 эффективных количеств лечебного агента, так что запас лечебного агента в лекарственной сердцевине уменьшается, и скорость высвобождения лечебного агента приближается к минимуму эффективного уровня. Сменный корпус футляра 770 включает расширение 775А и расширение 775В. Сменная лекарственная сердцевина 760 и сменная оболочка 770 могут быть продвинуты дистально, как показано стрелкой 790, для вставления сменной лекарственной сердцевины 760 и сменной оболочки 770 в удерживающую структуру 730. Удерживающая структура 730 остается по существу в том же самом месте, в то время как сменную лекарственную сердцевину 760 и сменную оболочку вставляют в эластичную деталь 730.
Фиг.8А-8С показывают развертывание имплантата для пролонгированного высвобождения в соответствии с воплощением данного изобретения. Как показано на фиг.8А, развертывающий инструмент 810 вставляют в каналец 800 через отверстие слезного канала 800А. Имплантат пролонгированного высвобождения 820 загружают на конец развертывающего инструмента 810, и оболочка 812 покрывает имплантат пролонгированного высвобождения 820. Удерживающая структура 830 принимает конфигурацию с малым сечением, когда оболочку 812 располагают поверх удерживающей структуры 830. Как показано на фиг.8В, внешнюю оболочку 812 развертывающего инструмента 810 извлекают, чтобы сделать экспонированным удерживающую структуру 830 имплантата пролонгированного высвобождения 820. Экспонированная часть удерживающего элемента 830 принимает конфигурацию с большим сечением. Как показано на фиг.8С, развертывающий инструмент 810 удаляют, а имплантат пролонгированного высвобождения 820 имплантируют в каналец 800. Лекарственная сердцевина 840 прикреплена к удерживающей структуре 830 и удерживается в канальце. Внешняя оболочка 850 покрывает, по крайней мере, частично часть лекарственной сердцевины 840, а лекарственная сердцевина 840 высвобождает лечебный агент в слезную жидкость или слезную пленку рядом с отверстием слезного канала 800А канальца 800.
Фиг.9А показывает систему доставки лекарства 900 с манжетой 930 для поддержки лекарственной сердцевины 910 и элементом удержания гидрогеля 910 в соответствии с воплощениями данного изобретения. Во многих воплощениях ворот включает силикон. Лекарственная сердцевина включает матрикс с лечебным агентом и может иметь оболочку, как описано выше. Удерживающий гидрогель элемент 910 может быть помещен внутри манжеты 930, и при помещении в отверстие слезного канала удерживающий гидрогель элемент 910 расширяется, поскольку абсорбирует жидкость. Удерживающий элемент может включать много набухающих материалов. Манжета удерживает вставку лекарственной сердцевины и стержень гидрогеля вместе и предотвращает вытеснение гидрогелевой детали из собранной системы доставки лекарства. Так как гидрогель расширяется, силиконовая манжета слегка позволяет расшириться и в то же самое время образует плотное ограничение вокруг гидрогелевого элемента так, что предотвращает вытеснение гидрогеля из манжеты. На фиг.9А показана система доставки лекарства с элементом, удерживающим гидрогель в конфигурации перед вставкой с узким профилем для вставления через отверстие слезного канала в каналец. Гидрогель по существу не является гидратированным в узкой профильной конфигурации и имеет содержание воды меньше примерно 10%, например 1%.
Фиг.9В показывает систему доставки лекарства 900, как на фиг.9А, с гидратированным элементом удержания гидрогеля 910, в соответствии с воплощениями данного изобретения. Во вставленной конфигурации гидрогель гидратирован и расширен в канальце. Это расширение может тесно приспосабливаться ко многим размерам пациентов благодаря широкому диапазону расширения гидрогеля. Во многих воплощениях силиконовая манжета может принимать дополнительные формы, способствуя расположению в отверстии слезного канала. В расширенной конфигурации гидрогель может принимать уравновешенную концентрацию воды, например от примерно 50% до 9% воды.
Фиг.9С показывает систему доставки лекарства 950, как на фиг.9А, с манжетой 954, включающей силиконовый ворот 952 для опоры на внешней части отверстия слезного канала, в соответствии с воплощениями данного изобретения. Ворот может быть подогнан по размеру так, чтобы устройство не проникало слишком глубоко в отверстие слезного канала. Например, ворот может опираться на внешнюю часть отверстия слезного канала.
Фиг.9D показывает манжету 966 системы доставки лекарства 960 с заострением 962 на дистальном конце канальца манжеты для облегчения вставления в отверстие слезного канала и с кромками 964 для опоры на внешней части отверстия слезного канала в соответствии с воплощениями данного изобретения. Манжета может включать много кромок, например, 2 кромки, 4 кромки, 8 кромок или 16 кромок, которые могут быть подогнаны по размеру для опоры на внешнюю часть отверстия слезного канала.
Фиг.9Е показывает манжету 974 системы доставки лекарства 970 с ограничением 972 на дистальном конце канальца манжеты для задержки элемента удержания гидрогеля в манжете в соответствии с воплощениями данного изобретения. Ограничение 972 включает кромку для вставки гидрогеля, когда гидрогель расширяется. Ограничение 972 может также быть сформировано с петлями и другими выступами для вставления гидрогеля, когда гидрогель радиально расширяется от оси элемента, удерживающего гидрогель.
Фиг.9F показывает систему доставки лекарства 980 с элементом удержания гидрогеля 982 во время вставления в просвет канальца 984 в соответствии с воплощениями данного изобретения. Удерживающий элемент вставляют через отверстие слезного канала 986 в узкой профильной конфигурации. Удерживающий элемент включает по существу сухой гидрогель в узкой профильной конфигурации. Во многих воплощениях система доставки лекарства включает кромки на конце манжеты напротив удерживающего элемента, как описано выше, так что кромки опираются на внешнюю часть отверстия слезного канала, в то время как удерживающий элемент расширяется в просвете канальца.
Фиг.9G показывает систему доставки лекарства 980, как на фиг.9F, с расширенным элементом удержания гидрогеля 982 после вставления в просвет канальца в соответствии с воплощениями данного изобретения. Удерживающий гидрогель элемент расширяется для вставления манжеты и вызывает легкую эластичную деформацию эластичной силиконовой манжеты. Удерживающий гидрогель элемент побуждается к направлению вовне с достаточной силой, вызывающей легкую деформацию стенки просвета канальца 984.
Во многих воплощениях система доставки лекарства включает модульную систему, включающую лекарственную вставку и коммерчески экспонированную пробку для отверстия слезного канала, которая может вмещать лекарственную вставку. Лекарственная вставка может быть приспособлена для размещения внутри пробки для отверстия слезного канала и может удерживаться на месте посредством посадки с натяжением между внешним диаметром лекарственной вставки и внутренним диаметром полости силиконовой пробки. Собранная система может быть упакована, стерилизована и доставлена врачу в данной конфигурации.
Во многих воплощениях пробка для отверстия слезного канала для лечения сухого глаза включает набухающий материал, соединенный с корпусом манжеты без лекарственной сердцевины, например, многие из набухающих материалов и манжет описаны на фиг.9А-9G. В некоторых воплощениях сухой глаз можно лечить со многими пробками для отверстия слезного канала, как описано здесь, в которых сердцевина не включает лечебный агент, включенный здесь. Во многих воплощениях трубчатый корпус подогнан по размеру, чтобы закрывать отверстие слезного канала для лечения сухого глаза. В некоторых воплощениях корпус может быть меньше, чем отверстие слезного канала, так что набухший гидрогель может закрывать отверстие слезного канала. Корпус может включать выступ, включая кромку, обод, крыло или тому подобное, подобранные по размеру, чтобы оставаться на внешней части отверстия слезного канала, в то время как корпус расположен в отверстии слезного канала так, чтобы облегчать удаление корпуса пробки и удерживающей структуры из отверстия слезного канала, когда элемент, удерживающий гидрогель, набухает. Работы в связи с данным изобретением предполагают, что имеющиеся в настоящее время пробки для отверстия слезного канала, включающие гидрогель, может быть трудно удалить, поскольку гидрогель может изнашиваться, и структуры для удержания гидрогеля с корпусом, описанные здесь, могут облегчить удаление удерживающего набухший гидрогель элемента.
Фиг.10A показывает вставку лекарственной сердцевины 1010 для применения с пробкой для отверстия слезного канала в соответствии с воплощениями данного изобретения. Вставка лекарственной сердцевины может включать оболочку лекарства 1014, включающую полиимид и/или многие из материалов, которые по существу непроницаемы для лечебного агента, как описано выше. Лекарственная сердцевина может включать многие из форм, описанных выше, например, цилиндрического стержня. Цианоакрилатная пленка может применяться на одном конце вставки лекарственной сердцевины. Противоположный конец вставки лекарственной сердцевины доступен для обеспечения диффузии лечебного агента в слезу глаза, как описано выше. В конкретном воплощении вставка лекарственной сердцевины включает размер поперечного сечения, например, диаметр, примерно 0,3 мм. Длина вставки лекарственной сердцевины составляет примерно 0,9 мм.
Лекарственная вставка может включать тонкослойную полиимидную трубку с лекарственной сердцевиной, включающей Латанопрост, диспергированный в Nusil 8385 (MAF 970), твердом силиконе медицинского качества, служащем в качестве матрикса для доставки лекарства. Дистальный конец лекарственной вставки может быть заклеен заготовленной пленкой твердого Loctite 4305 - адгезивного средства медицинского качества. Поскольку лекарственная вставка может быть помещена внутри полости пробки для отверстия слезного канала, адгезивное средство Loctite 4305 может не вступать в контакт с тканью или слезной пленкой. Внутренний диаметр лекарственной вставки может составлять 0,32 мм, длина - 0,95 мм. В трех воплощениях концентрацию Латанопроста тестировали клинически: лекарственная сердцевина, содержащая 3,5; 7 или 14 мкг Латанопроста. Во многих воплощениях общая скорость элюции могла быть примерно 100 нг/сутки, лекарственная сердцевина могла включать 14 мкг Латанопроста, так что лекарство могло доставляться в течение примерно 120 суток. Общий вес лекарственной сердцевины, включая Латанопрост, мог составлять примерно 70 мкг. Вес лекарственной вставки, включая полиимидную манжету, мог составлять примерно 100 мкг.
Все материалы, применяемые в настоящее время в конструкции лекарственной вставки, являются материалами медицинского качества, которые прошли комплекс анализов безопасности/токсичности.
Во многих воплощениях лекарственная сердцевина может включать силикон. Латанопрост в желаемой концентрации может быть диспергирован в необработанном силиконе Nusil 8385, введенном в полиимидную манжету, и обработан при комнатной температуре. Этот метод может давать твердый силиконовый матрикс, включающий желаемую концентрацию Латанопроста.
Во многих воплощениях манжета может включать полиимид. Полиимидная манжета может вмещать лекарственную сердцевину так, чтобы обеспечивать структурную поддержку и барьер латеральной диффузии лекарства. Внутренний диаметр манжеты может быть 0,32 мм, а толщина стенки - 0,013 мм.
Фиг.10В показывает пробку 1020 для отверстия слезного канала, включающую внутреннюю полость 1022 цилиндрической формы, в соответствии с воплощениями данного изобретения. Полость 1022 подогнана по размеру для приема лекарственной вставки сердцевины 1010 с прилаживанием для трения. Пробка для отверстия слезного канала может включать многие коммерчески экспонированные пробки для отверстия слезного канала, например, пробку для отверстия слезного канала Medtronic, собирающую слезу, «Систему закупорки отверстия слезного канала Parasol», поставляемую Odyssey, Мемфис, Теннеси, и/или пробку Eagle Vision, поставляемую Eagle Vision, Мемфис, Теннеси. В некоторых воплощениях пробка для отверстия слезного канала включает сделанную на заказ пробку для отверстия слезного канала, например, сделанные по размеру индивидуальные пробки для отверстия слезного канала, выбранные соответственно измерениям у пациента. Во многих воплощениях пробка для отверстия слезного канала имеет длину примерно 2 мм и ширину примерно 1 мм.
Фиг.10С показывает пробку для отверстия слезного канала, как на фиг.10В, с лекарственной сердцевиной, как на фиг.10А, вставленной в нее, в соответствии с воплощениями данного изобретения. Во многих воплощениях вставление и удаление системы доставки лекарства может выполняться в сходной манере, как для других коммерчески экспонированных пробок отверстия слезного канала. Пробка может быть вставлена в отверстие слезного канала с применением пинцета или вставляющего инструмента, например, инструмента, как показано выше, с иглой, подобранной по размеру для вставления в сердцевину. При помещении в верхнее (или нижнее) отверстие слезного канала глаза проксимальный конец лекарственной сердцевины является экспонированным для слезной жидкости. Когда слеза приходит в контакт с экспонированной проксимальной поверхностью лекарственной сердцевины, лечебный агент, например. Латанопрост, медленно элюируется. Систему доставки лекарства можно удалить с помощью пинцета.
Фиг.11 показывает систему доставки лекарства пробки для отверстия слезного канала 1100, включающую лекарственную сердцевину 1140 и удерживающую структуру, которая включает манжету 1110 с крылышками 1112, образованными на ней, в соответствии с воплощениями данного изобретения. Во многих воплощениях удерживающая структура также включает элемент, удерживающий гидрогель 1120. Крылышки 1112 могут ограничивать проникновение устройства в отверстие слезного канала так, что крылышки опираются на внешнюю часть отверстия слезного канала, в то время как устройство удерживается элементом, удерживающим гидрогель 1120, в просвете канальца. Во многих воплощениях крылышки 1112 предотвращают миграцию проксимального конца пробки в дистальном направлении в просвете канальца. Крылышки 1112 могут помогать при удалении устройства. Колпачок 1150 может быть включен рядом с дистальным концом устройства для ограничения дистального расширения гидрогеля. Шов 1130 может проходить от проксимального конца к дистальному концу, чтобы удержать лекарственную сердцевину и элемент, удерживающий гидрогель, внутри манжеты 1110.
Фиг.12А показывает удерживающую структуру 1200, включающую манжету 1210 и гидрогель 1220, в соответствии с воплощениями данного изобретения. Удерживающая структура 1200 может комбинироваться с многими из лекарственных сердцевин, описанных выше. Манжета 1210 включает кольцевую оболочку, которая покрывает гидрогель 1220. Гидрогель 1220 может иметь цилиндрическую форму для установки внутри манжеты 1210. Когда гидрогель 1220 является сухим, удерживающая структура 1200 остается в узкой профильной конфигурации. Лепестки 1212 определяют отверстие в манжете 1210, позволяющее воде проникать в гидрогель 1220, когда манжета 1210 вставлена в отверстие слезного канала. В некоторых воплощениях манжета может также включать компонент гидрогеля, добавленный в силикон манжеты, так что манжета также расширяется для усиления удержания.
Фиг.12В показывает удерживающую структуру 1200, как на фиг.12А, с лепестками 1212, направленными радиально наружу в ответ на гидратацию материала гидрогеля, в соответствии с воплощениями данного изобретения. Когда вода проникает в манжету 1210, гидрогель 1220 расширяется, направляя лепестки 1212 радиально наружу. Удерживающая структура может касаться стенки просвета, для удержания устройства элюции лекарства в канальце. Так как гидрогель направляется наружу, гидрогель проходит в отверстия рядом с лепестками так, что гидрогель удерживается в манжете.
Фиг.12С показывает удерживающую структуру 1250, включающую манжету 1260 с лепестками 1262 и кольцевой гидрогелевой расширяющейся деталью 1270, в соответствии с воплощениями данного изобретения. Когда структура 1250 остается сухой, структура сохраняет узкую профильную конфигурацию. Лекарственная сердцевина может быть включена внутри кольцевой манжеты, как описано выше.
Фиг.12D показывает удерживающую структуру, как на фиг.12С, включающую манжету с лепестками и кольцевой гидрогелевой расширяющейся деталью, в соответствии с воплощениями данного изобретения. При гидратации кольцевой гидрогелевой расширяющейся детали 1270 кольцевая гидрогелевая расширяющаяся деталь направляется вовне против лепестков 1262, проталкивая лепестки наружу против стенки полости.
Фиг.13 показывает устройство для доставки лекарства 1300 с удерживающей структурой, включающей гидрогелевый удерживающий элемент 1330, манжету 1320 с перекрестными отверстиями 1322 и запирающими лепестками 1334 и/или кромками для удержания гидрогеля на месте при расширении гидрогеля, в соответствии с воплощениями данного изобретения. Устройство для доставки лекарства 1300 включает вкладыш лекарственной сердцевины 1310, как описано выше. Перекрестные отверстия 1322 позволяют воде проникать и гидратировать гидрогелевый удерживающий элемент 1330. Расширение гидрогелевого удерживающего элемента 1330 направляет некоторый гидрогель против манжеты 1320 и через перекрестные отверстия 1322 так, что гидрогелевый удерживающий элемент закрепляется в манжете 1320 в ответ на расширение гидрогеля. Запирающие лепестки 1334 увлекают гидрогелевый удерживающий элемент 1330, так что удерживающий элемент расширяется для закрепления гидрогелевого удерживающего элемента 1330 в манжете 1320 в ответ на расширение гидрогелевого удерживающего элемента.
Фиг.14А показывает пробку для отверстия слезного канала 1400 с лекарственной сердцевиной 1410 и удерживающими гребнями 1420 в соответствии с воплощениями данного изобретения. Удерживающие гребни 1420 могут включать эластичный материал, например силикон. Лекарственная сердцевина 1410 может включать многие из лекарственных сердцевин, описанных выше, а оболочка, как описано выше, может быть расположена поверх лекарственной сердцевины для определения экспонированной области, как описано выше.
Фиг.14В показывает пробку для отверстия слезного канала 1400, как на 14А, с удерживающими гребнями 1420, сложенными назад, для поддержки пробки 1400, когда ее вставляют в просвет канальца 1450. Удерживающие гребни 1420 наклоняются проксимально по направлению к отверстию слезного канала. Сложенные назад гребни 1420 могут вклинивать устройство в полость так, что предотвращают миграцию. В некоторых воплощениях пробка может включать манжету с крылышками, как описано выше.
Оболочка
Оболочка включает подходящие формы и материалы для контроля миграции лечебного агента из лекарственной сердцевины. Оболочка содержит сердцевину и может быть удобно установлена по отношению к сердцевине. Оболочка сделана из материала, по существу непроницаемого для лечебного агента так, что скорость миграции лечебного агента может в значительной степени контролироваться экспонированной областью поверхности лекарственной сердцевины, не покрытой оболочкой. Во многих воплощениях миграция лечебного агента через оболочку может составлять около одной десятой от миграции лечебного агента через экспонированную поверхность лекарственной сердцевины или меньше, часто составляя одну сотую или меньше. Другими словами, миграция лечебного агента через оболочку примерно на порядок меньше значения миграции лечебного агента через экспонированную поверхность лекарственной сердцевины. Пригодные материалы для оболочки включают полиимид, полиэтилена терефталат (далее «ПЭТ»). Оболочка имеет толщину, как определено из поверхности оболочки, прилежащей к сердцевине, до противоположной поверхности оболочки, удаленной от сердцевины, примерно от 0,00025" до 0,0015". Общий диаметр оболочки, проходящий поперек сердцевины, составляет примерно от 0,2 мм до 1,2 мм. Сердцевина может быть сформирована покрытием погружением сердцевины в материал оболочки. Альтернативно или в комбинации оболочка может включать трубку и сердцевину, введенную в оболочку, например, в виде жидкости или твердого вещества, способных скользить, введенных и/или вытолкнутых в трубку оболочки. Оболочка может также быть нанесена погружением вокруг сердцевины, например, нанесена погружением вокруг предварительно сформированной сердцевины.
Оболочка может быть обеспечена дополнительными чертами для облегчения клинического применения имплантата. Например, оболочка может принимать лекарственную сердцевину, которая является сменной, в то время как удерживающая структура и оболочка остаются имплантированными у пациента. Оболочка часто является жестко присоединенной к удерживающей структуре, как описано выше, и сердцевина является сменной, в то время как удерживающая структура удерживает оболочку. В конкретных воплощениях оболочка может быть обеспечена внешними выступами, прилагающими силу к оболочке при сдавливании и извлечении сердцевины из оболочки. Другая лекарственная сердцевина может быть помещена в оболочку. Во многих воплощениях оболочка и/или удерживающая структура могут иметь различительную характеристику, например различительный цвет, чтобы показать размещение, такое как размещение оболочки и/или удерживающей структуры в каналец или другую тканевую структуру организма, редко определяемое пациентом. Удерживающий элемент и/или оболочка могут включать, по крайней мере, одну метку для индикации глубины размещения в канальце, так что удерживающий элемент и/или оболочка могут быть расположены на желаемой глубине в канальце на основании, по крайней мере, одной метки.
Удерживающая структура
Удерживающая структура включает подходящий материал, который подобран по размеру и форме так, что имплантат может быть легко расположен в желаемом участке ткани, например в канальце. Удерживающая структура является механически развертываемой и типично расширяется до желаемой формы поперечного сечения, например, с удерживающей структурой, включающей суперэластичный сплав с памятью формы, такой как Нитинол™. В добавление к Нитинолу™ могут применяться другие материалы, например, эластичные металлы или полимеры, пластически деформируемые металлы или полимеры, полимеры с памятью формы и тому подобные, для обеспечения желаемого расширения. В некоторых воплощениях могут применяться способные принимать форму полимеры и покрытые волокна, поставляемые Biogeneral, Inc., Сан Диего, Калифорния. Многие металлы, такие как нержавеющие стали и сплавы без памяти формы, могут применяться и обеспечивать желаемое расширение. Эта способность к расширению позволяет устанавливать имплантат в полых тканевых структурах различного размера, например, в канальцах в диапазоне от 0,3 мм до 1,2 мм (т.е. один размер устанавливается во все). Хотя единичная удерживающая структура может быть изготовлена для установки в канальце от 0,3 до 1,2 мм в поперечнике, по желанию может применяться множество альтернативно выбранных удерживающих структур для установки в данном диапазоне, например, первая удерживающая структура для канальцев от 0,3 до примерно 0,9 мм и вторая удерживающая структура для канальцев от примерно 0,9 до 1,2 мм. Удерживающая структура имеет длину, подходящую для анатомической структуры, к которой прикрепляется удерживающая структура, например, длину примерно от 3 мм для удерживающей структуры, расположенной рядом с отверстием слезного канала. Для различных анатомических структур длина может быть подходящей для обеспечения адекватной удерживающей силы, например, подходящей является длина от 1 мм до 15 мм.
Хотя оболочка и лекарственная сердцевина присоединены к одному концу удерживающей структуры, как описано выше, во многих воплощениях другой конец удерживающей структуры не присоединен к лекарственной сердцевине и оболочке, так что удерживающая структура может скользить по оболочке и лекарственной сердцевине, в то время как удерживающая структура расширяется. Эта способность к скольжению на одном конце является желательной, поскольку удерживающая структура может сокращаться по длине, так как удерживающая структура расширяется в ширину для достижения желаемой ширины поперечного сечения. Однако нужно отметить, что многие воплощения могут применять оболочку, которая не скользит относительно сердцевины.
Во многих воплощениях удерживающая структура может быть извлечена из ткани. Выступ, например, крючок, петля, или кольцо может проходить от удерживающей структуры для облегчения удаления удерживающей структуры.
Во многих воплощениях оболочка и удерживающая структура могут включать две части.
Окклюзионный элемент
Окклюзионный элемент включает подходящий материал, который подобран по размеру и форме так, что имплантат может, по крайней мере, ингибировать, даже блокировать, поток жидкости через полую тканевую структуру, например слезную жидкость, через каналец. Указанный окклюзионный материал является тонкостенной мембраной из биосовместимого материала, например силикона, который может расширяться и сжиматься с удерживающей структурой. Окклюзионный элемент сформирован как отдельная тонкая трубка из материала, который скользит по концу удерживающей структуры и закреплен на одном конце удерживающей структуры, как описано выше. Альтернативно, окклюзионный элемент может быть сформирован покрытием погружением удерживающей структуры в биосовместимый полимер, например, силиконовый полимер. Толщина окклюзионного элемента может быть в диапазоне от примерно 0,01 мм до примерно 0,15 мм, и часто от примерно 0,05 мм до 0,1 мм.
Лечебные агенты
«Лечебный агент» может включать лекарство, которое может быть любым из следующих лекарств или их эквивалентов, производных или аналогов, вкладышей, средств против глаукомы (например, адренергических агонистов, адренергических антагонистов (бета-блокаторов), ингибиторов карбоангидразы (CAI, системных и местных), парасимпатомиметиков, простагландинов и гипотензивных липидов, и их комбинаций, может быть антимикробным агентом (например, антибиотиком, противовирусным, противопаразитарным, противогрибковым средством и т.д.), кортикостероидом или другим противовоспалительным средством (например, НПВС), деконгестантом (например, вазоконстриктором), агентом, предотвращающим или модифицирующим аллергический ответ (например, антигистаминным средством, ингибитором цитокинов, ингибитором лейкотриенов, ингибитором IgE, иммуномодулятором), стабилизатором тучных клеток, циклоплегиком или тому подобным. Примеры состояний, которые можно лечить с лечебным агентом(амии), включают, без ограничений, глаукому, пре- и постхирургическое лечение, синдром сухого глаза и аллергии. В некоторых воплощениях лечебный агент может быть любрикантом или сурфактантом, например любрикантом для лечения сухого глаза.
Примерные лечебные агенты включают без ограничения ингибиторы тромбина, антитромбогенные агенты, тромболитические агенты, фибринолитические агенты, ингибиторы спазма сосудов, вазодилятаторы, антигипертензивные агенты; антимикробные агенты, такие как антибиотики (такие как тетрациклин, хлортетрациклин, бацитрацин, неомицин, полимиксин, грамицидин, цефалексин, окситетрациклин, хлорамфеникол, рифампицин, ципрофлоксацин, тобрамицин, гентамицин, эритромицин, пенициллин, сульфонамиды, сульфадиазин, сульфацетамид, сульфаметизол, сульфизоксазол, нитрафуразон, натрия пропионат), противогрибковые средства (такие как амфотерицин В и миконазол), и противовирусные средства (такие как идоксуридин трифтортимидин, ацикловир, ганцикловир, интерферон); ингибиторы поверхностных гликопротеиновых рецепторов, антитромбоцитарные агенты, антимитотические средства, ингибиторы микротубул, антисекреторные агенты; активные ингибиторы, ингибиторы ремоделирования, антисмысловые нуклеотиды, антиметаболиты, антипролиферативные средства (включая ингибиторы ангиогенеза), противоопухолевые химиотерапевтические агенты, противовоспалительные агенты (такие как гидрокортизон, гидрокортизон ацетат, дексаметазон 21-фосфат, флюоцинолон, медризон, метилпреднизолон, преднизолон 21-фосфат, преднизолон ацетат, фторметалон, бетаметазон, триамцинолон, триамцинолон ацетонид), нестероидные противовоспалительные средства (НПВС) (такие как салицилат, индометацин, ибупрофен, диклофенак, флюбипрофен, пироксикам, наксопрен и набуметон). Такие противовоспалительные стероиды предполагаются для применения в методологии данного изобретения, включая триамцинолон ацетонид (родовое название) и кортикостероиды, которые включают, например, триамцинолон, дексаметазон, флюоционлон, кортизон, преднизолон, флюметолон и их производные противоаллергические средства (такие как натрия хромогликат, антазолин, метапирилин, хлорфенирамин, цетризин, пириламин, профенпиридамин); антипролиферативные агенты (такие как 1,3-цис-ретиноевая кислота, 5-фторурацил, таксол, рапамицин, митомицин С и цисплатин); деконгестанты (такие как фенилэфрин, нафазолин, тетрагидразолин); миотики и антихолинестеразные средства (такие как пилокарпин, салицилат, карбахол, ацетилхолин хлорид, физостигмин, эзерин, диизопропил фторфосфат, фосфолин-иод, демекариум бромид); антинеопластические средства (такие как кармустин, цисплатин, фторурацил); иммунологические лекарства (такие как вакцины и иммуностимуляторы); гормональные агенты (такие как эстрогены - эстрадиол, гестагенные средства, прогестерон, инсулин, кальцитонин, паратироидный гормон, рилизинг-фактор пептида и вазопрессина гипоталамуса), иммуносупрессивные агенты, антагонисты гормона роста, факторы роста (такие как эпидермальный фактор роста, фактор роста фибробластов; фактор роста, полученный из тромбоцитов, трансформирующий фактор роста-бета, соматотропин, фибронектин), ингибиторы ангиогенеза (такие как ангиостатин, анекортава ацетат, тромбоспондин, антитела к VEGF), агонисты дофамина, радиотерапевтические агенты, пептиды, белки, ферменты, компоненты экстрацеллюлярный матрикс, ингибиторы АХЭ, ловушки свободных радикалов, хелаторы, антиоксиданты, анти-полимеразы, агенты фотодинамической терапии, агенты генной терапии и другие лечебные агенты, такие как простагландины, антипростагландины, предшественники простагландинов, включая средства против глаукомы, включая бета-блокаторы, такие как Тимолол, бетаксолол, левобунолол, атенолол и аналоги простагландинов, такие как Биматопрост, травопрост, Латанопрост и т.д.; ингибиторы карбоангидразы, такие как ацетазоламид, дорзоламид, бринзоламид, метазоламид, дихлорофенамид, диамокс; и нейропротекторы, такие как любезол, нимодипин и родственные вещества; и парасимпатомиметики, такие как пилокарпин, карбахол, физостигмин и тому подобные.
Количество лекарства, связанного с доставляющим лекарство устройством, может зависеть от конкретного агента, желаемой лечебной пользы и времени, в течение которого устройство предназначается для доставки лечения. Поскольку устройства данного изобретения представлены в разнообразных формах, размерах и механизмах доставки, количество лекарства, связанного с устройством, зависит от конкретного заболевания или состояния, предназначенного для лечения, и дозировки и длительности, желаемых для достижения лечебного эффекта. В целом, количество лекарства - это, по крайней мере, количество лекарства, которое при высвобождении из устройства является эффективным для достижения желаемых физиологических или фармакологических, местных или системных эффектов.
Воплощения устройств для доставки лекарств настоящего изобретения могут быть приспособлены для обеспечения доставки лекарства с ежедневной скоростью, которая по существу ниже терапевтически эффективной формы лечения в виде капель, так что обеспечивают большой лечебный диапазон с широким резервом безопасности. Например, многие воплощения лечат глаз с лечебными уровнями в течение продолжительного периода, составляющими не более 5 или 10 процентов от ежедневной дозировки капель. Соответственно во время исходного болюса или периода вымывания от одного до трех суток, имплантата может элюировать лечебный агент со скоростью, которая существенно выше, чем уровни пролонгированного высвобождения, и значительно ниже, чем у формы ежедневной дозировки в виде капель. Например, со средним уровнем пролонгированного высвобождения 100 нг в сутки и начальной скоростью высвобождения от 1000 до 1500 нг в сутки количество начально высвобождаемого лекарства составляет меньше 2500 нг лекарства, которое может присутствовать в каплях лекарства, доставляемого в глаз. Применяются пролонгированные уровни высвобождения, которые существенно ниже количества лекарства в капле и/или каплях, применяемых ежедневно, что позволяет устройству высвобождать терапевтически полезные количества лекарства для достижения желаемой лечебной пользы с большим резервом безопасности, в то же время избегая неадекватного или избыточного количества лекарства в назначенном месте или участке.
Продолжительный период времени может означать относительно короткий период времени, например минуты или часы (как с применением анестетиков), дни или недели (как при использовании предоперационных и послеоперационных антибиотиков, стероидов, или НПВС и тому подобного), или больше (как в случае лечения глаукомы), например, месяцев или лет (на повторной основе применения устройства).
Например, лекарство, такое как Тимолола малеат, бета-1 и бета-2 (неспецифические) блокаторы адренергических рецепторов, может применяться в устройстве для высвобождения в течение продолжительного периода времени, такого как 3 месяца. Три месяца - это относительный обычный период времени между визитами к врачу для больных глаукомой, принимающих местное медикаментозное лечение средствами против глаукомы, хотя устройство может обеспечить лечение в течение более длительного или короткого периода. В течение трех месяцев, например, 0,25% концентрация Тимолола переносится от 2,5 до 5 мг/1000 мкл, типично составляя 2,5 мг/1000 мкл. Капли Тимолола для местного применения обычно находятся в диапазоне 40-60 мкл, типично составляя 50 мкл. Так, в капле может быть 0,08-0,15 мг, типично 0,125 мг Тимолола. Спустя 5 минут в газу остается примерно 8% (примерно 6-10%) капель, т.е. в это время доступно примерно 10 мкг лекарства. Тимолол может иметь биодоступность 30-50%, что означает, что в глазу доступно от 1,5 до 7,5 мкг, например, 4 мкг лекарства. Тимолол обычно применяют дважды в день, так что каждый день в глазу доступно 8 (или 3-15) мкг. Таким образом, доставляющее устройство может содержать от 270 до 1350 мкг, например, 720 мкг лекарства для 90 суток, или 3 месяцев, продолжительного высвобождения. Лекарство содержится внутри устройства и элюируется на основе полимера или концентрации лекарство/гидрогель. Лекарство может сходным образом содержаться в устройстве и элюироваться для олопатадина гидрохлорида (Патанол®) и других лекарств в манере, сходной с Тимололом.
Коммерчески экспонированные растворы Тимолола малеата поставляются в виде 0,25% и 0,5% препаратов, и минимальная дозировка может составлять 1 каплю дважды в сутки 0,25% раствора. 0,25% концентрация Тимолола эквивалентна 2,5 мг на 1000 мкл. Количество постоянно высвобождающегося Тимолола, высвобождающееся каждый день из лекарственной сердцевины, может составлять примерно от 3 до 15 мкг каждый день. Хотя постоянно высвобождающееся количество, высвобождаемое каждый день из устройства, может варьировать, доставка при пролонгированном высвобождении примерно 8 мкг в сутки может соответствовать примерно 3,2% от 0,250 мг Тимолола, вносимого с двумя каплями 0,25% раствора.
Например, в случае Латанопроста (Ксалатана), аналога простагландина F2α, это средство для лечения глаукомы имеет концентрации, составляющие примерно 1/10 от Тимолола. Таким образом, количество лекарства в имплантируемом устройстве, в зависимости от биодоступности, является значительно меньшим - примерно 20-135 мкг и обычно 50-100 мкг для Латанопроста и других аналогов простагландинов. Это также означает, что устройство может или быть меньше, чем требуется для доставки бета-блокаторов, или содержать больше лекарства для более длительного периода высвобождения.
Капли Ксалатана содержат около 2,5 мкг Латанопроста, в объеме капли 50 мкл. Таким образом, учитывая, что спустя 5 минут после инсталляции присутствует около 8% от 2,5 мкг, только примерно 200 нг лекарства остается в глазу. На основании клинических испытаний Латанопроста это количество является эффективным для понижения ВГД в течение, по крайней мере, 24 часов. Pfizer/Pharmacia провел несколько исследований дозозависимого ответа для поддержки заявки на разрешение к применению нового лекарственного средства для Ксалатана. Дозы Латанопроста находились в диапазоне от 12,5 мкг/мл до 115 мкг/мл. Было показано, что текущая доза Латанопроста, 50 мкг/мл, принимаемая один раз в сутки, является оптимальной. Однако даже более низкие дозы 12,5 мкг/мл четыре раза в сутки или 15 мкг/мл два раза в день соответственно дают примерно 60-75% снижение ВГД от дозы 50 мкг/мл четыре раза в день. На основании вышеуказанных предположений 12,5 мкг/мл концентрация обеспечивает 0,625 мкг Латанопроста в 50 мкл капель, что приводит примерно только к 20 нг (8%) лекарства, остающегося в глазу спустя 5 минут.
Во многих воплощениях концентрации Латанопроста составляют примерно 1/100 или 1 процент от Тимолола, и в конкретных воплощениях концентрации Латанопроста могут составлять 1/50 или 2% от Тимолола. Например, коммерчески экспонированные препараты растворов Латанопроста поставляют в концентрациях 0,005%, часто применяемых по одной капле в сутки. Во многих воплощениях терапевтически эффективная концентрация лекарства, высвобождаемая из устройства в сутки, может составлять примерно 1/100 от Тимолола, примерно от 30 до 150 нг/сутки, например, около 80 нг, учитывая вымывание слезой и биодоступность, сходные с Тимололом. Например, количество лекарства в имплантируемом устройстве может быть значительно ниже - примерно 1%-2% от Тимолола, например, 2,7-13,5 мкг, и может также быть около 3-20 мкг для Латанопроста и других аналогов простагландинов. Хотя количество пролонгированного высвобождения Латанопроста, высвобождаемого в сутки, может варьировать, пролонгированное высвобождение 80 нг в сутки соответствует примерно 3,2% от 2,5 мкг Латанопроста, применяемого в виде единичной капли 0,005% раствора.
Например, в случае Биматопроста (Люмигана), синтетического аналога простамидных простагландинов, это средство против глаукомы может иметь концентрации, составляющие 1/20 или меньше от Тимолола. Таким образом, количество лекарства, загруженного в увеличенное высвобождающее устройство для длительного высвобождения в течение 3-6 месяцев, в зависимости от биодоступности, может быть значительно меньше, примерно 5-30 мкг и типично 10-20 мкг - для Биматопроста и аналогов и производных. Во многих воплощениях имплантат может содержать больше лекарства для более длительного периода пролонгированного высвобождения, например, 20-40 мг для периода пролонгированного высвобождения от 6 до 12 месяцев с Биматопростом и его производными. Снижение концентрации лекарства также означает, что устройство может быть меньшим, чем требуется для доставки бета-блокатора.
Концентрации коммерчески экспонированных растворов Биматопроста составляют 0,03% по весу, часто доставляясь один раз в сутки. Хотя количество Биматопроста, высвобождаемого каждый день, при пролонгированном высвобождении может варьировать, пролонгированное высвобождение 300 нг в сутки может соответствовать примерно 2% от 15 мкг Биматопроста, применяемого в виде единичной капли 0,03% раствора. Работы, проведенные в связи с данным изобретением, позволили предположить, что даже при более низких дозах при пролонгированном высвобождения Биматопрост может обеспечивать, по крайней мере, некоторое уменьшение внутриглазного давления, например, 20-200 нг Биматопроста и ежедневные дозировки пролонгированного высвобождения от 0,2 до 2% от ежедневной дозировки капель.
Например, в случае Травопроста (Траватана) аналога простагландина F2α это средство для лечения глаукомы может иметь концентрации, составляющие 2% и меньше от концентрации Тимолола. Например, концентрации коммерчески экспонированных растворов составляют 0,004%, часто доставляясь 1 раз в сутки. Во многих воплощениях терапевтически эффективная концентрация лекарства, высвобождаемая из устройства в сутки, может составлять примерно 65 нг, учитывая вымывание слезой и биодоступность, сходные с Тимололом. Таким образом, количество лекарства в имплантируемом устройстве в зависимости от биодоступности может быть значительно ниже. Это также означает, что устройство может или быть меньше, чем требуется для доставки биоблокатора, или может содержать больше лекарства для более долгого периода высвобождения. Например, количество лекарства в имплантируемом устройстве может быть значительно меньше - примерно 1/100 от Тимолола, например, от 2,7 до 13,5 мкг, и типично примерно 3-20 мкг для Травопроста, Латанопроста и других аналогов простагландина F2α. Хотя количество пролонгированного высвобождения Латанопроста, высвобождаемое каждый день, может варьировать, пролонгированное высвобождение 65 нг в сутки соответствует примерно 3,2% от 2,0 мкг Травопроста, применяемого в виде единичной капли 0,004% раствора.
В некоторых воплощениях лечебный агент может включать кортикостероид, например, флуюцинолон ацетонид, для лечения целевой ткани глаза. В конкретных воплощениях флюоцинолон ацетонид может высвобождаться из канальца для доставки в сетчатку, как для лечения диабетической макулярной эдемы (ДМЭ).
В объем данного изобретения также включено то, как модифицировать или адаптировать устройство для доставки с высокой скоростью высвобождения, с низкой скоростью высвобождения, болюсного высвобождения, взрывного высвобождения или их комбинации. Болюс лекарства может высвобождаться путем формирования разрушаемого полимерного колпачка, который немедленно растворяется в слезе или слезной пленке. Поскольку полимерный колпачок приходит в контакт со слезой или слезной пленкой, свойство растворимости полимера позволяет колпачку разрушаться, и лекарство высвобождается из него. Взрывное высвобождение лекарства может осуществляться с применением полимера, который также разрушается в слезе или слезной пленке благодаря растворимости полимера. В этом примере лекарство и полимер могут наслаиваться по длине устройства так, что внешний слой полимера растворяется, и лекарство немедленно растворяется. Высокая или низкая скорость высвобождения лекарства может осуществляться за счет изменения растворимости разрушаемого слоя полимера, так что слой лекарства высвобождается быстро или медленно. Другие способы высвобождения лекарства могут достигаться посредством пористых мембран, растворимых гелей (таких как те, что применяются в обычных офтальмологических растворах), инкапсуляции микрочастиц лекарства, или инкапсуляцией наночастиц в зависимости от размера молекулы лекарства.
Лекарственная сердцевина
Лекарственная сердцевина включает лечебный агент и материалы для обеспечения существенного высвобождения лечебного агента. Лечебный агент мигрирует из лекарственной сердцевины к целевой ткани, например цилиарным мышцам глаза. Лечебный агент может по выбору быть только слегка растворимым в матриксе так, что только малое количество лечебного агента растворяется в матриксе и доступно для высвобождения из поверхности лекарственной сердцевины 110. Поскольку лечебный агент диффундирует из экспонированной поверхности сердцевины к слезе или слезной пленке, скорость миграции из сердцевины к слезе или слезной пленке может быть связана с концентрацией лечебного агента, растворенного в матриксе. В дополнение или в комбинации скорость миграции лечебного агента из сердцевины к слезе или слезной пленке может быть связана со свойствами матрикса, в котором растворен лечебный агент. В конкретных воплощениях скорость миграции от лекарственной сердцевины к слезе или слезной пленке может быть основана на формуле силикона. В некоторых воплощениях концентрация лечебного агента, растворенного в лекарственной сердцевине, может контролироваться для обеспечения желаемой скорости высвобождения лечебного агента. Лечебный агент, включенный в сердцевину, может включать жидкость, твердое вещество, твердый гель, твердые кристаллы, твердое аморфное вещество, твердые частицы, и/или растворенные формы лечебного агента. В предпочтительном воплощении лекарственная сердцевина включает силиконовый матрикс, содержащий лечебный агент. Лечебный агент может включать жидкие или твердые включения, например, жидкие капельки Латанопроста или твердые частицы Биматопроста, соответственно диспергированные в силиконовом матриксе.
Лекарственная сердцевина может включать один или больше биосовместимых материалов, способных обеспечивать пролонгированное высвобождение лечебного агента. Хотя выше описана лекарственная сердцевина по отношению к воплощению, включающему матрикс с по существу небиодеградируемым силиконовым матриксом с растворимыми включениями лекарства, расположенными здесь, лекарственная сердцевина может включать структуры, которые обеспечивают пролонгированное высвобождение лечебного агента, например, биодеградируемый матрикс, пористую лекарственную сердцевину, сердцевины для жидких лекарств и сердцевины для твердых лекарств. Матрикс, содержащий лечебный агент, может быть сформирован либо из биодеградируемых, либо из небиодегрдируемых полимеров. Небиодеградируемая лекарственная сердцевина может включать силикон, акрилаты, полиэтилены, полиуретан, гидрогель, полиэстер (например, ДАКРОН® от Du Pont de Nemours and Company, Вилмингтон, Делавэр), полипропилен, политетрафторэтилен (ПТФЭ), растяжимый ПТФЭ (рПТФЭ), полиэфир эфир кетон (ПЭЭК), нейлон, прессованный коллаген, полимерную губку, силиконовую резину, полиэтилен терефталат, полиэтилен ультравысокой молекулярной массы, поликарбонат уретан, полиуретан, полиимиды, нержавеющую сталь, сплав никеля и титана (например, Нитинол), титан, сплав кобальта и хрома (например, ELIGLOY® от Elgin Specially Metals, Элгин, Иллинойс; CONICHROME® от Carpenrter Metals Corp., Вайомиссинг, Пенсильвания). Биодеградируемая лекарственная сердцевина может включать один или более биодеградируемых полимеров, таких как белок, гидрогель, полигликолевая кислота (ПГК), полимолочная кислота (ПМК), поли(L-молочная) кислота (ПLМК), поли(L-гликолевая кислота) (ПLГК), полигликолид, поли-L-лактид, поли-L-лактид, поли(амино) кислоты, полидиоксанон, поликапролактон, полиглюконат, сополимеры полимолочной кислоты-полиэтиленоксида, модифицированная целлюлоза, коллаген, полиортоэфиры, полигидроксибутират, полиангидрид, полифосфоэфир, поли(альфа-гидрокси-кислота) и их комбинации. В некоторых воплощениях лекарственная сердцевина может включать, по крайней мере, один из полимеров гидрогеля.
Высвобождение лечебного агента на эффективных уровнях
Скорость высвобождения лечебного агента может быть связана с концентрацией лечебного агента, растворенного в лекарственной сердцевине. Во многих воплощениях лекарственная сердцевина включает нелечебные агенты, которые выбраны для обеспечения желаемой растворимости лечебного агента в лекарственной сердцевине. Нелечебный агент из лекарственной сердцевины может включать полимеры, желаемые здесь, и добавки. Полимеры из сердцевины могут быть выбраны для обеспечения желаемой растворимости лечебного агента в матриксе. Например, сердцевина может включать гидрогель, который может способствовать растворимости гидрофильного лечебного агента. В некоторых воплощениях в полимер могут быть добавлены функциональные группы для обеспечения желаемой растворимости лечебного агента в матриксе. Например, функциональные группы могут быть присоединены к силиконовому полимеру.
В некоторых воплощениях могут применяться добавки для контроля кинетики высвобождения лечебного агента. Например, добавки могут применяться для контроля концентрации лечебного агента путем увеличения или снижения растворимости лечебного агента в лекарственной сердцевине так, чтобы контролировать кинетику высвобождения лечебного агента. Растворимость может контролироваться путем обеспечения надлежащих молекул и/или веществ, повышающих и/или понижающих растворимость растворенной формы лечебного агента в матриксе. Растворимость растворенной формы лечебного агента может быть связана с гидрофобными и/или гидрофильными свойствами матрикса и лечебного агента. Например, сурфактанты, тинувин, соли и вода могут быть добавлены в матрикс и могут повышать растворимость гидрофильного лечебного агента в матриксе. В дополнение масла и гидрофобные молекулы могут быть добавлены в матрикс и могут повышать растворимость гидрофобного лечебного агента в матриксе.
Вместо или в дополнение к контролю скорости миграции на основании концентрации лечебного агента, растворенного в матриксе, область поверхности лекарственной сердцевины может также контролироваться для достижения желаемой скорости миграции лекарства из сердцевины к целевому участку. Например, большая экспонированная область поверхности сердцевины увеличивает скорость миграции лечебного агента из лекарственной сердцевины к целевому участку, а малая экспонированная область поверхности сердцевины снижает скорость миграции лечебного агента из лекарственной сердцевины к целевому участку. Экспонированная область поверхности лекарственной сердцевины может быть увеличена любым числом путей, например, путем любых зубцов экспонированной поверхности, пористой поверхности, имеющей экспонированные каналы, соединенные со слезой или слезной пленкой, зазубривания экспонированной поверхности, выступом экспонированной поверхности. Экспонированная поверхность может быть сделана пористой путем добавления солей, которые растворяются и покидают пористую полость, как только соли растворяются. Гидрогели также могут применяться и могут набухать до размера, обеспечивающего большую экспонированную область поверхности. Такие гидрогели могут также быть сделаны пористыми для дальнейшего увеличения скорости миграции лечебного агента.
Далее, может применяться имплантат, включающий способность к высвобождению двух или более лекарств в комбинации, такой как структура, раскрытая в Патенте США №4281654 (Shell). Например, в случае лечения глаукомы может быть желательно лечить пациента множеством простагландинов или простагландином и холинергическим агентом или адренергическим антагонистом (бета-блокатором), таким как Альфаган®, или простагландином и ингибитором карбоангидразы. В дополнение могут применяться импрегнированные лекарством сетки, такие как те, что раскрыты в Заявке на патент США №2002/0055701, или слои биоустойчивых полимеров, как описано в Заявке на патент США №2005/0129731. Некоторые полимерные процессы могут применяться для включения лекарства в устройства данного изобретения, такие как так называемые «самодоставляющиеся лекарства» или PolymerDrags (Polymerix Corporation, Пискатевей, Нью-Джерси), сконструированные для деградации только в терапевтически пригодные соединения и физиологически инертные связывающие молекулы, подробно описанные в Заявке на патент США №2005/0048121 (East), включенные здесь в ссылку во всей полноте. Такие доставляющие полимеры могут применяться в устройствах данного изобретения для обеспечения скорости высвобождения, равной скорости эрозии и деградации полимера, и являющейся постоянной в курсе лечения. Такие доставляющие полимеры могут применяться как покрытие устройств или в форме микросфер для депо вводимого лекарства (такого как резервуар данного изобретения). Дальнейшая технология доставляющий полимеров может также быть приспособлена для устройств данного изобретения, так как описано в Заявке на патент США №2004/0170685 (Carpenter) и технологий, экспонированных от Medivas (Сан Диего, Калифорния).
В конкретных воплощениях матрикс лекарственной сердцевины включает твердый материал, например, силикон, который инкапсулирует включения лекарства. Лекарство включает молекулы, которые являются нерастворимыми в воде и слабо растворимыми в инкапсулирующем матриксе лекарственной сердцевины. Включения, инкапсулированные лекарственной сердцевиной, могут быть микрочастицами, имеющими размеры от примерно 1 мкм до примерно 100 мкм в поперечнике. Включения лекарства могут включать кристаллы, например, кристаллы Биматопроста, и/или капельки масла, например, масла Латанопроста. Включения лекарства могут растворяться в твердом матриксе лекарственной сердцевины и по существу насыщать матрикс лекарственной сердцевины лекарством, например, растворением масла Латанопроста в твердом матриксе лекарственной сердцевины. Лекарство, растворенное в матриксе лекарственной сердцевины, транспортируется, часто посредством диффузии, от экспонированной поверхности лекарственной сердцевины в слезную пленку. Поскольку лекарственная сердцевина по существу насыщена лекарством, во многих воплощениях ограничивающим скорость этапом доставки лекарства является транспорт лекарства из поверхности матрикса лекарственной сердцевины, экспонированной для слезной пленки. Поскольку лекарственная сердцевина по существу насыщена лекарством, градиенты концентрации лекарства в матриксе являются минимальными и не вносят существенного вклада в скорость доставки лекарства. Поскольку область поверхности лекарственной сердцевины, экспонированная для слезной пленки, является почти постоянной, скорость транспорта лекарства из лекарственной сердцевины в слезную пленку может быть по существу постоянной. Работы в связи с данным изобретением позволили предположить, что растворимость лечебного агента в воде и молекулярная масса лекарства могут влиять на транспорт лекарства из твердого матрикса к слезе. Во многих воплощениях лечебный агент является почти нерастворимым в воде и имеет растворимость в воде примерно от 0,03% до 0,002% по весу, и молекулярную массу от примерно 400 грамм/моль до примерно 1200 грамм/моль.
Во многих воплощениях лечебный агент имеет очень низкую растворимость в воде, например от примерно 0,03% по весу до примерно 0,002% по весу, и молекулярную массу от примерно 400 грамм/моль (г/моль) до примерно 1200 г/моль, и является легко растворимым в органическом растворителе. Циклоспорин А (ЦсА) является твердым вещество с растворимостью в воде примерно 27,67 мкг/мл при 25°С, или примерно 0,0027% по весу, и молекулярной массой (м.м.) 1202,6 г/моль. Латанопрост (Ксалатан) является аналогом простагландина F2α, жидким маслом при комнатной температуре и имеет растворимость в воде 50 мкг/мл при 25°С, или примерно 0,005% по весу, и молекулярную массой 432,6 г/моль. Биматопрост (Люмиган) является синтетическим аналогом простамида, твердым веществом при комнатной температуре, растворимость в воде составляет 300 мкг/мл при 25°С, или 0,03% по весу, имеет молекулярную массу 415,6 г/моль.
Работы в связи с настоящим изобретением показывают, что естественно встречающиеся сурфактанты в слезной пленке, например, сурфактант D и фосфолипиды, могут влиять на транспорт лекарства, растворенного в твердом матриксе, от сердцевины к слезной пленке. Лекарственная сердцевина может быть приспособлена для ответа на сурфактант в слезной пленке для обеспечения пролонгированного высвобождения лекарства в слезную пленку на лечебном уровне. Например, эмпирические данные могут быть получены для популяции пациентов, например 10 пациентов, чьи слезы собирали и анализировали на содержание сурфактанта. Профили элюции собранных слез для лекарства, которое растворяли при расчете в воде, например, циклоспорина, можно было также измерить и сравнить с профилями элюции в буфере и сурфактанте, чтобы разработать модель сурфактанта слезы in vitro. Раствор сурфактанта in vitro, основанный на этих эмпирических данных, можно использовать для подведения лекарственной сердцевины в ответ на сурфактант в слезной пленке.
Лекарственные сердцевины также могут быть модифицированы для применения носителя везикул, таких как наночастицы или микрочастицы, в зависимости от размера доставляемой молекулы, такой как нановолоконные композиции со скрытой реактивностью для составных и нанотекстурированных поверхностей (Innovative Surface Technologies, LLC, Сан-Паул, Миннесота), наноструктурированного пористого силикона, известного как BioSilicon®, включая частицы микронного размера, мембраны, плетеные волокна или микроплетеные имплантируемые устройства (pSividia Limited, Великобритания) или белковые нанокэйдж системы, которые нацелены на избранные клетки для доставки лекарства (Chimeracore).
Во многих воплощениях лекарственная вставка включает тонкостенную полиимидную трубчатую оболочку с лекарственной сердцевиной, включающей Латанопрост, диспергированный в Nusil 6385 (MAF 970), твердом силиконе медицинского качества, служащем матриксом для доставки лекарства. Дистальный конец лекарственной вставки заклеен обработанной пленкой твердого адгезивного средства медицинского качества Loctite 4305. Лекарственная вставка может располагаться внутри полости пробки для отверстия слезного канала, а адгезивное средство Loctite 4305 не приходит в контакт ни с тканью, ни со слезной пленкой. Внутренний диаметр лекарственной вставки может составлять 0,32 мм; а длина может составлять 0,95 мм. Три концентрации Латанопроста в конечном лекарственном продукте можно тестировать клинически: лекарственная сердцевина может включать 3.5, 7 или 14 мкг Латанопроста, в процентах от весовых концентраций 5, 10 и 205 соответственно. Учитывая общую скорость элюции примерно 100 нг/сутки, лекарственная сердцевина, включающая 14 мкг Латанопроста, приспособлена для доставки лекарства в течение примерно, по крайней мере, 100 суток, например, 120 суток. Общий вес лекарственной сердцевины, включая Латанопрост, может быть ~70 мкг. Вес лекарственной вставки, включая полиимидную манжету, может составлять примерно 100 мкг.
Во многих воплощениях лекарственная сердцевина может элюировать с исходным повышением уровня лечебного агента с последующей постоянной элюцией лечебного агента. Во многих случаях количество лечебного агента, высвобождаемого ежедневно из сердцевины, может быть ниже лечебных уровней и тем не менее приносит пользу пациенту. Повышенный уровень элюируемого лечебного агента может давать остаточное количество лечебного агента и/или остаточный эффект лечебного агента, которые комбинируются в субтерапевтическим количеством лечебного агента для обеспечения облегчения у пациента. В воплощениях, где лечебный уровень составляет примерно 80 нг в день, прибор может доставлять около 100 нг в сутки в начальный период доставки. Дополнительные 20 нг, доставляемые в сутки, могут иметь благоприятный эффект, когда лечебный агент высвобождается на уровнях ниже лечебного уровня, например 60 нг в сутки. Так как количество доставляемого лекарства можно точно контролировать, начально повышенная доза не может давать осложнений и/или побочных реакций у пациента.
В то время как примерные воплощения описаны в деталях, в качестве примеров и для ясности понимания, специалисты в данной области техники могут понять, что можно применить разные модификации, адаптации и изменения. Поэтому объем данного изобретения ограничивается только приложенной формулой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СТРУКТУРЫ И КОМПОЗИЦИИ ДЛЯ НОСОСЛЕЗНОЙ СИСТЕМЫ | 2007 |
|
RU2413480C2 |
| ВКЛАДЫШИ В СЛЕЗНУЮ ТОЧКУ И СПОСОБЫ ДОСТАВКИ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2008 |
|
RU2459646C2 |
| ВНУТРИКАМЕРНЫЕ ИМПЛАНТАТЫ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ТЕРАПЕВТИЧЕСКОГО АГЕНТА | 2011 |
|
RU2565445C2 |
| ИНСТРУМЕНТЫ ДЛЯ ВСТАВЛЕНИЯ И ИЗВЛЕЧЕНИЯ ЛАКРИМАЛЬНЫХ ИМПЛАНТАТОВ | 2008 |
|
RU2482822C2 |
| СПОСОБ ЛЕЧЕНИЯ ПОВЫШЕННОГО ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ С ПОМОЩЬЮ ВНУТРИГЛАЗНОЙ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ | 2014 |
|
RU2664686C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА ВНУТРЬ ГЛАЗА | 2007 |
|
RU2440102C2 |
| ВНУТРИГЛАЗНЫЕ СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ЛЕЧЕНИЯ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2532333C2 |
| ЛЕКАРСТВЕННЫЕ ЯДРА ДЛЯ ЗАМЕДЛЕННОГО ВЫСВОБОЖДЕНИЯ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2008 |
|
RU2478366C2 |
| СНИЖЕНИЕ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ ПРИ ПОМОЩИ ВНУТРИКАМЕРНЫХ ИМПЛАНТАТОВ БИМАТОПРОСТА | 2011 |
|
RU2586298C2 |
| СПОСОБ ЛЕЧЕНИЯ АТРОФИЧЕСКОЙ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ | 2009 |
|
RU2521338C9 |
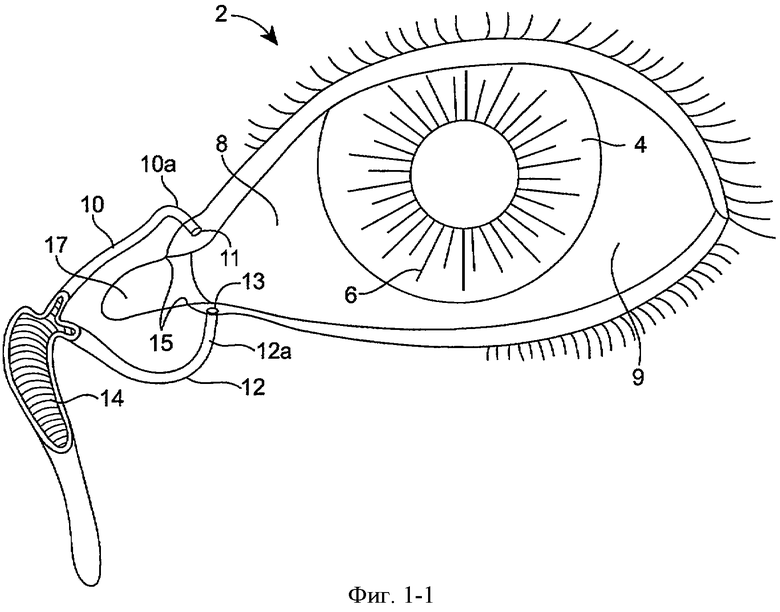
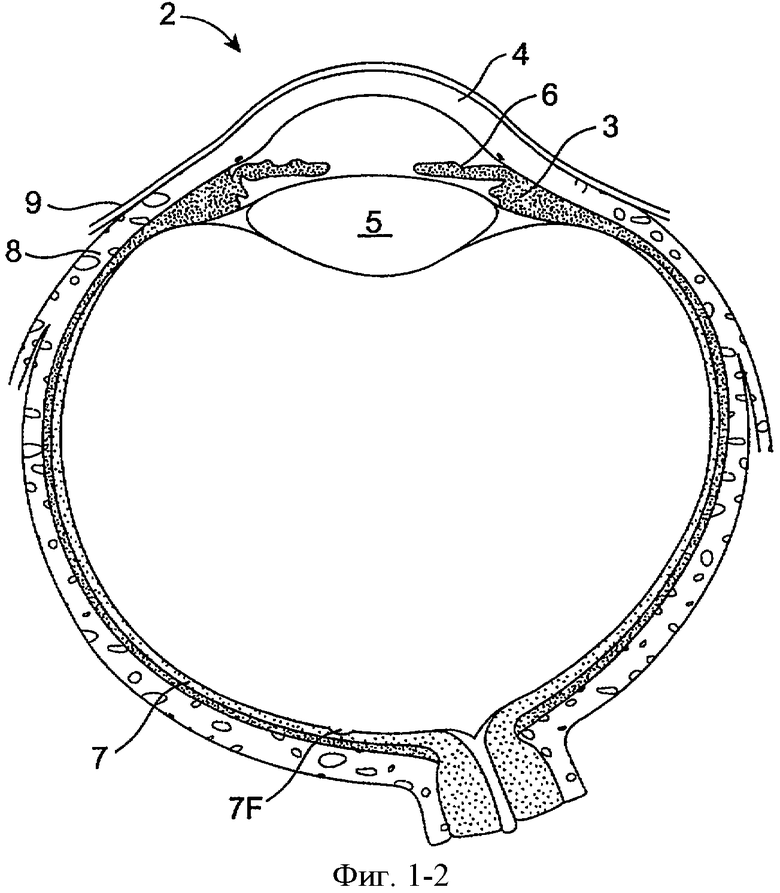
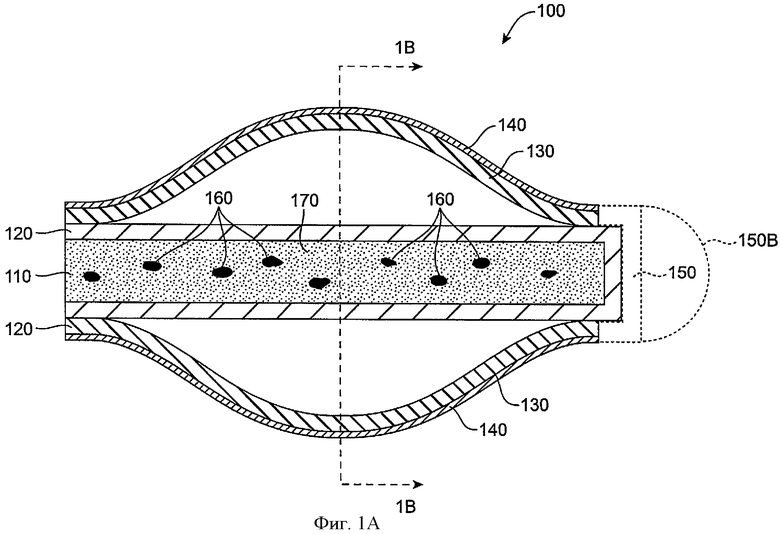
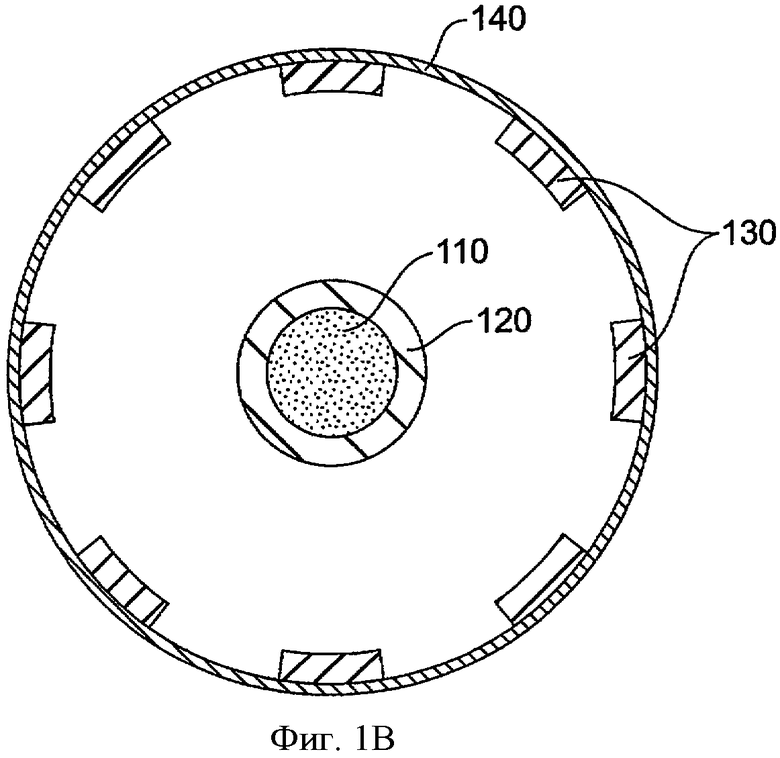
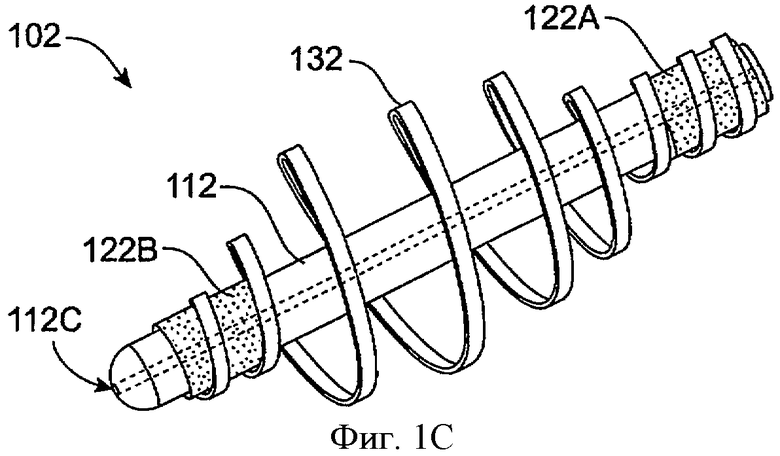
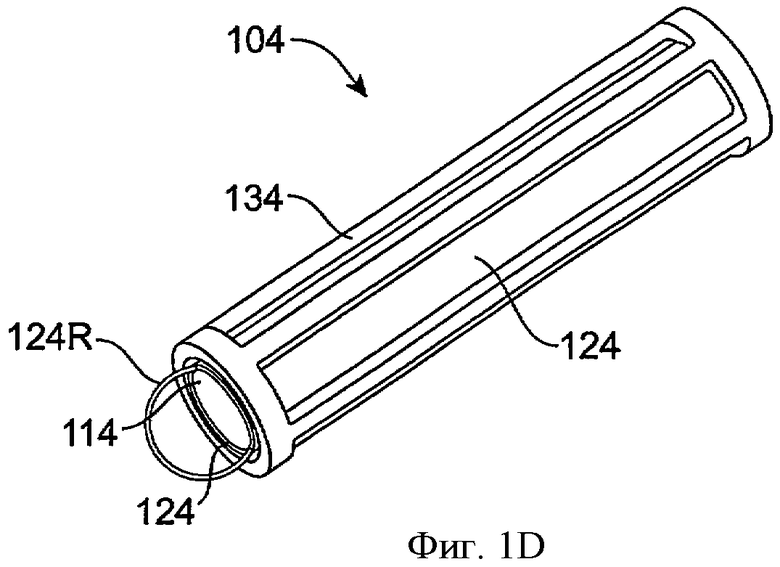
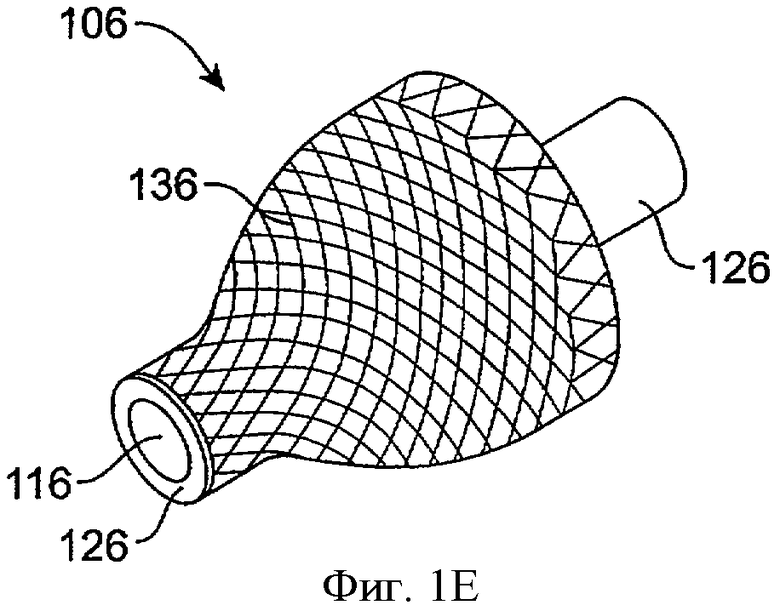
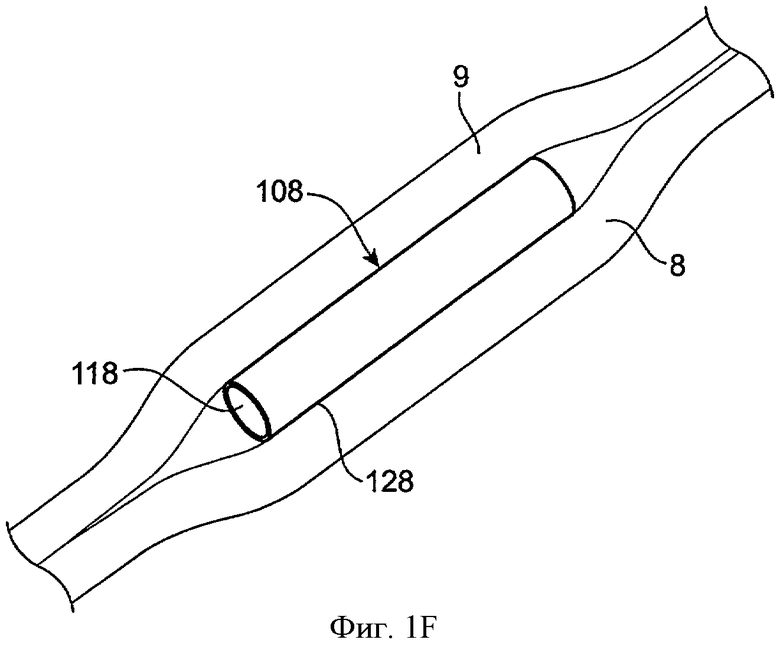
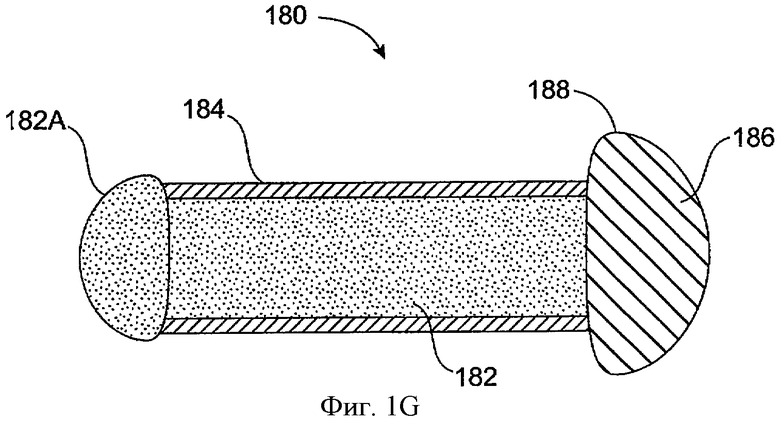
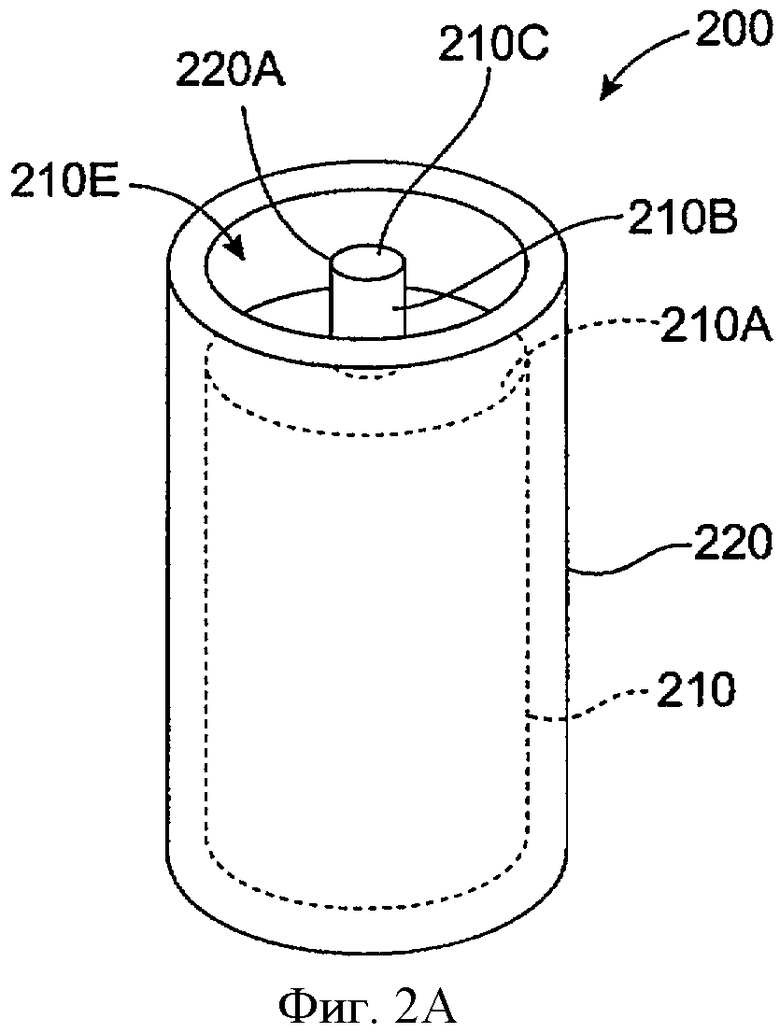
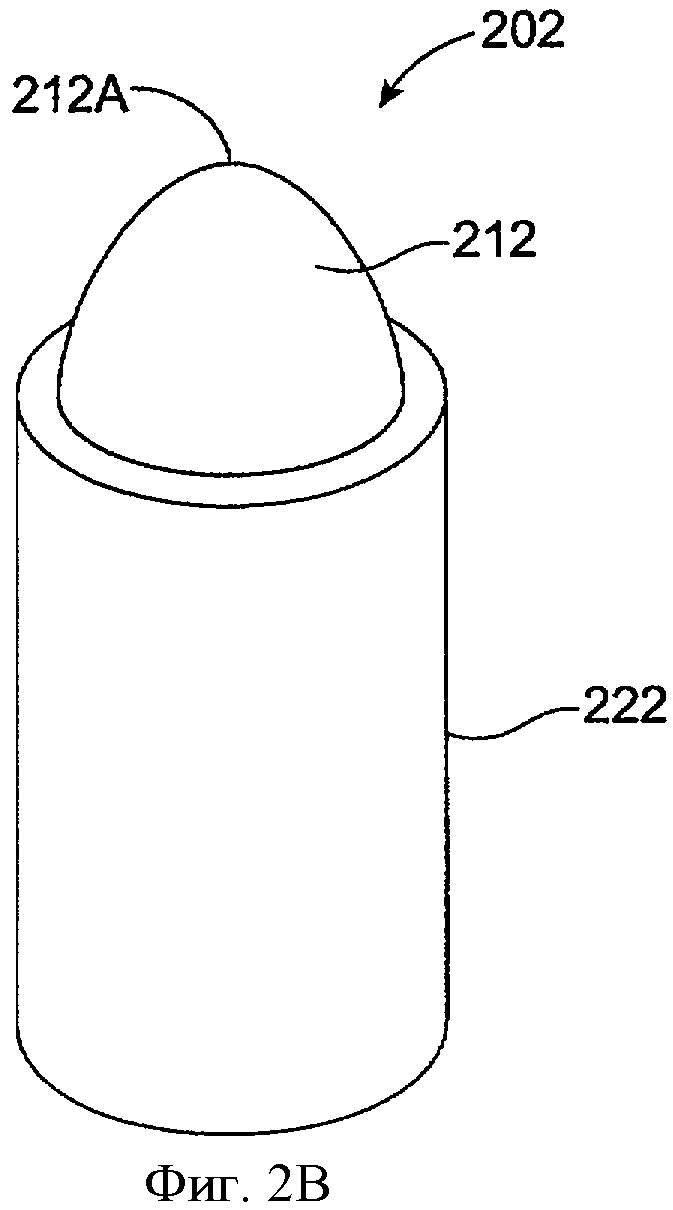
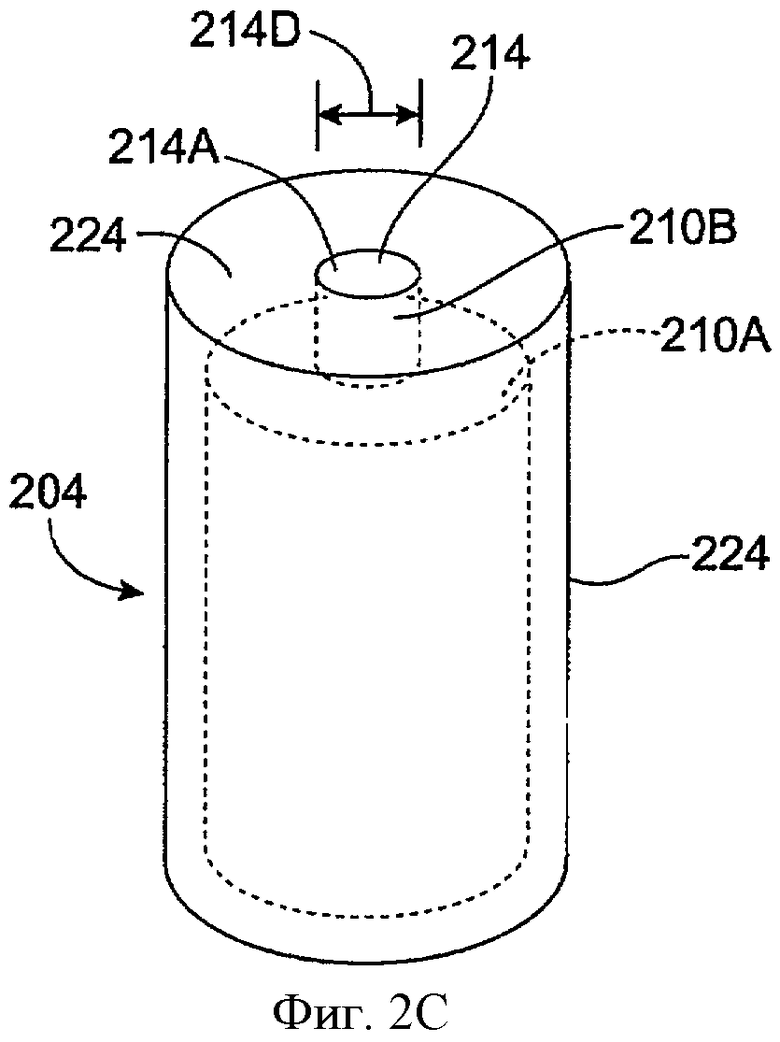
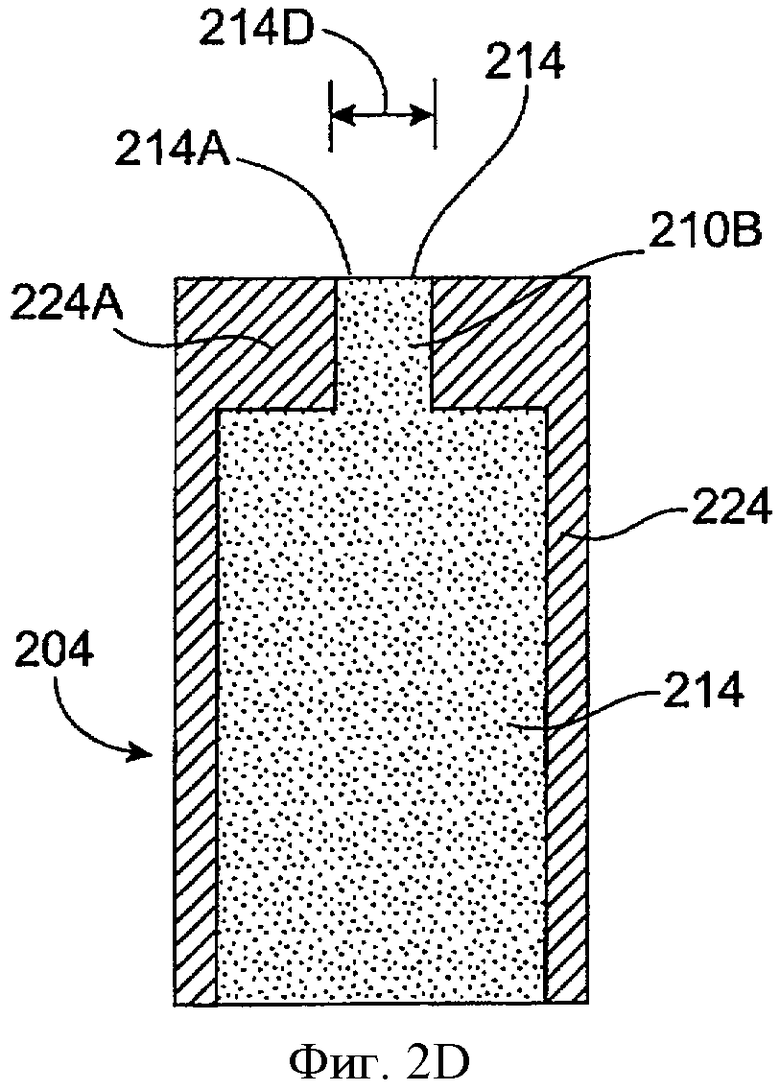
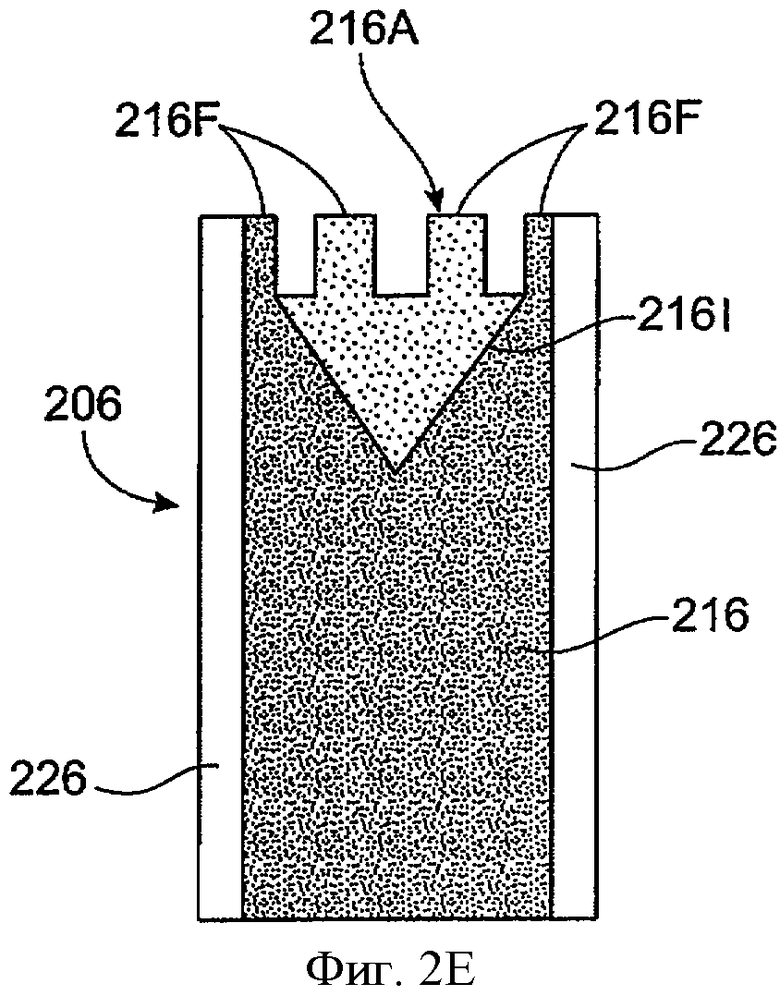
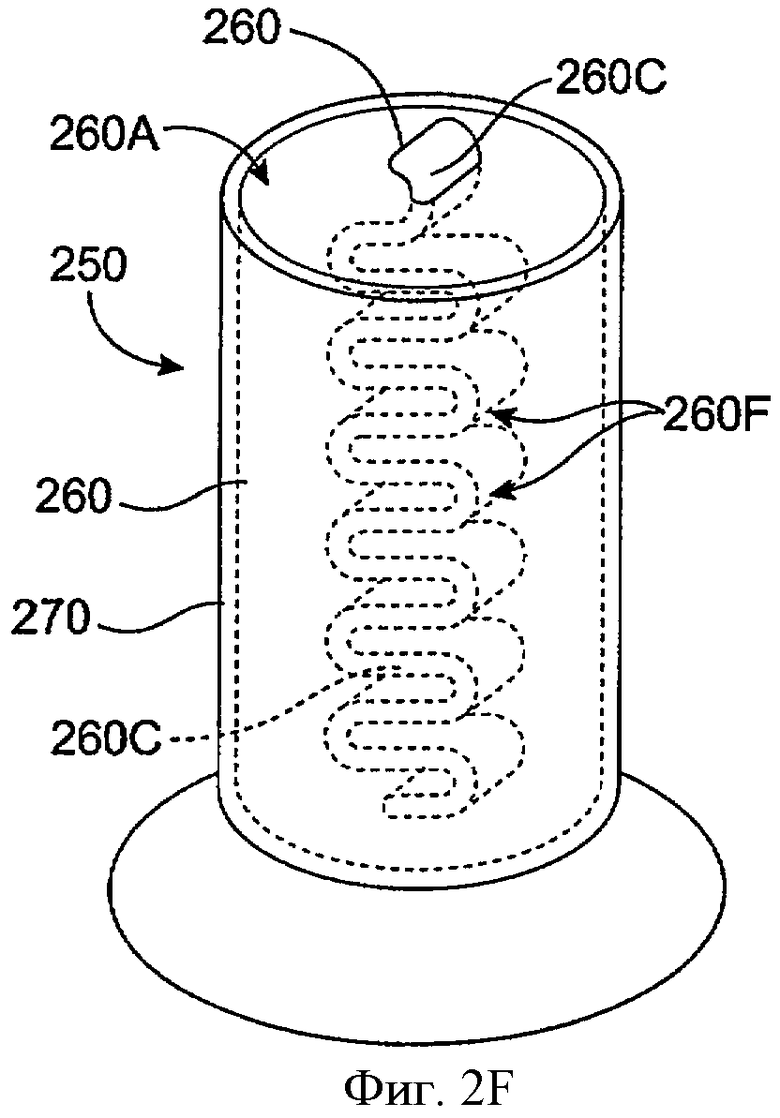
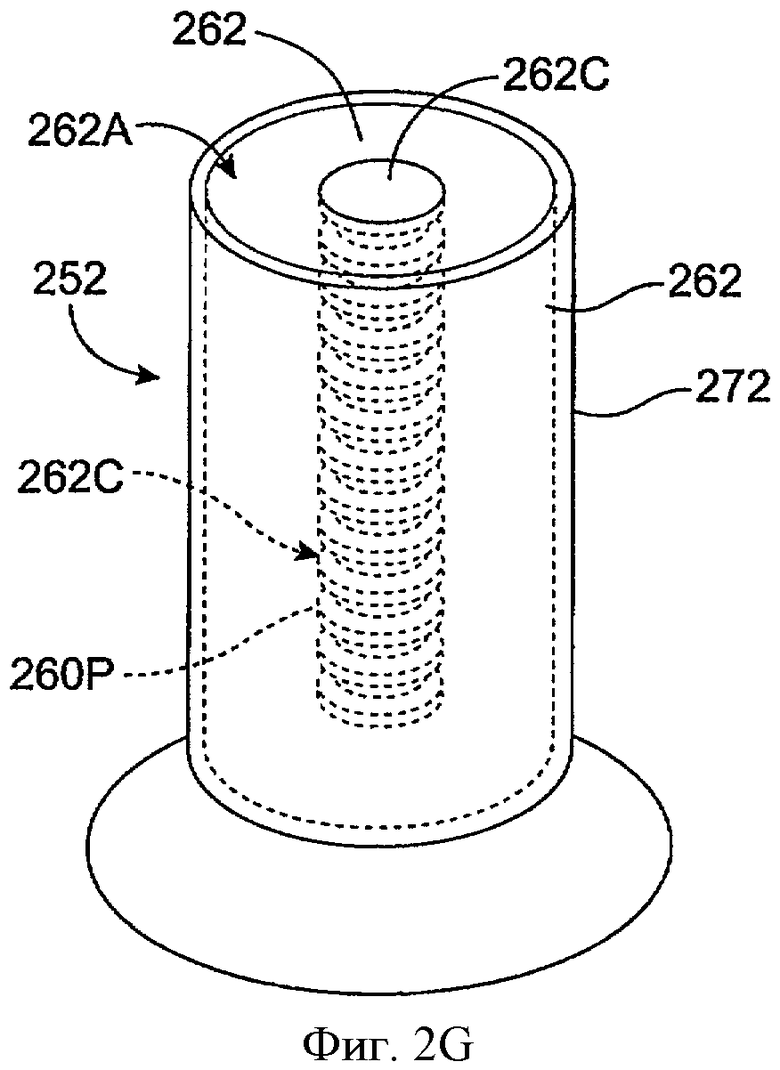
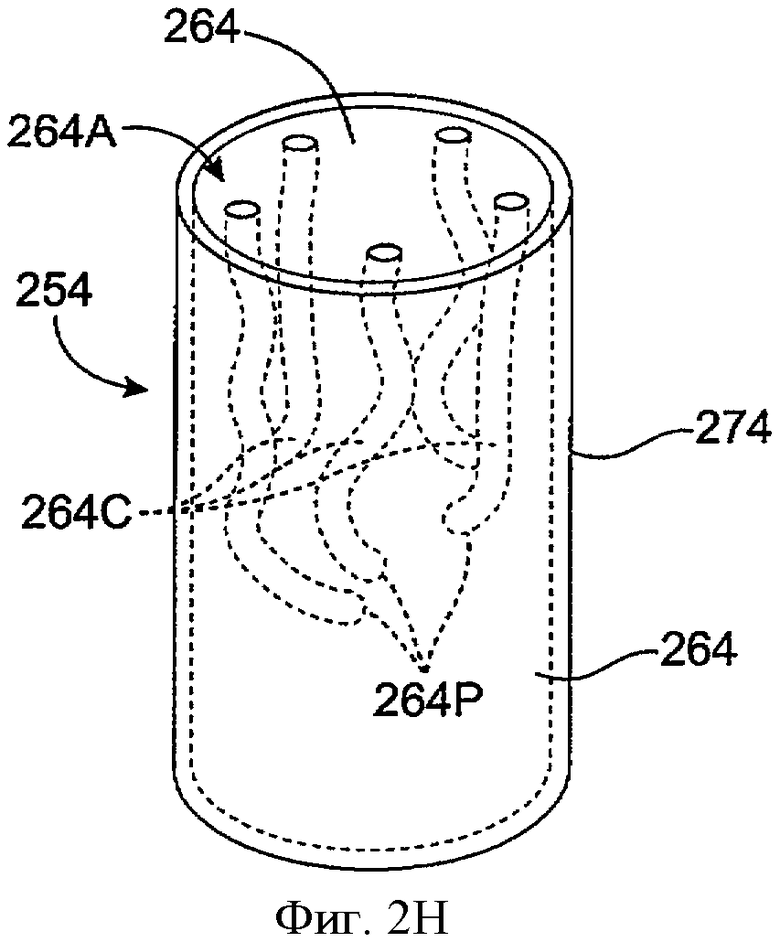
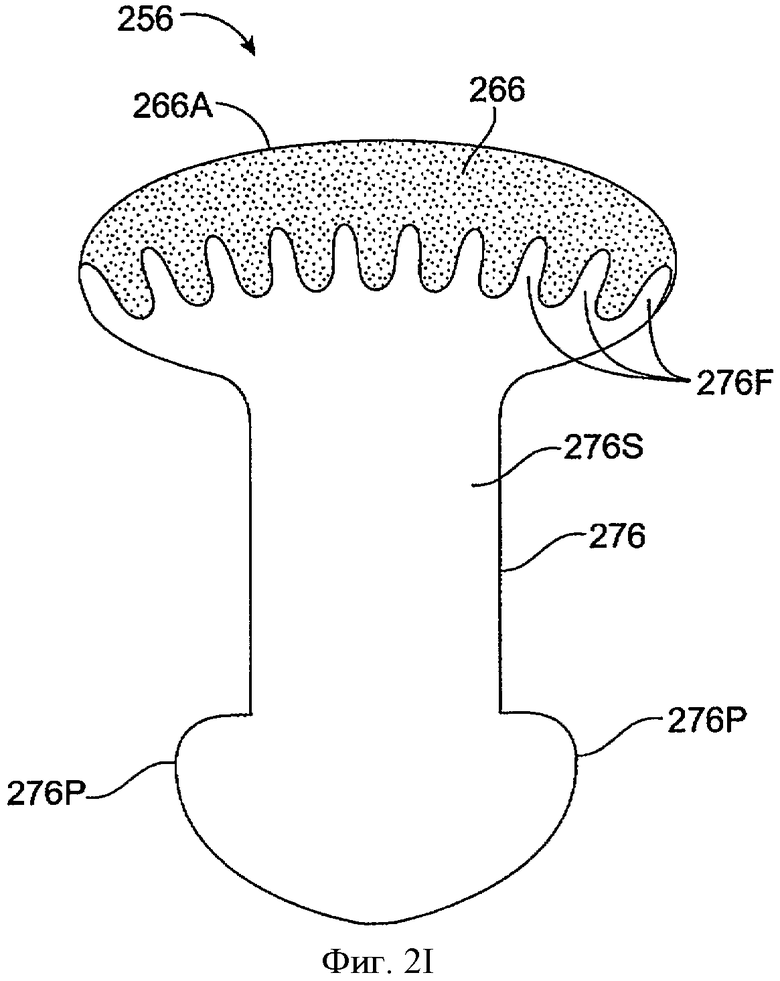
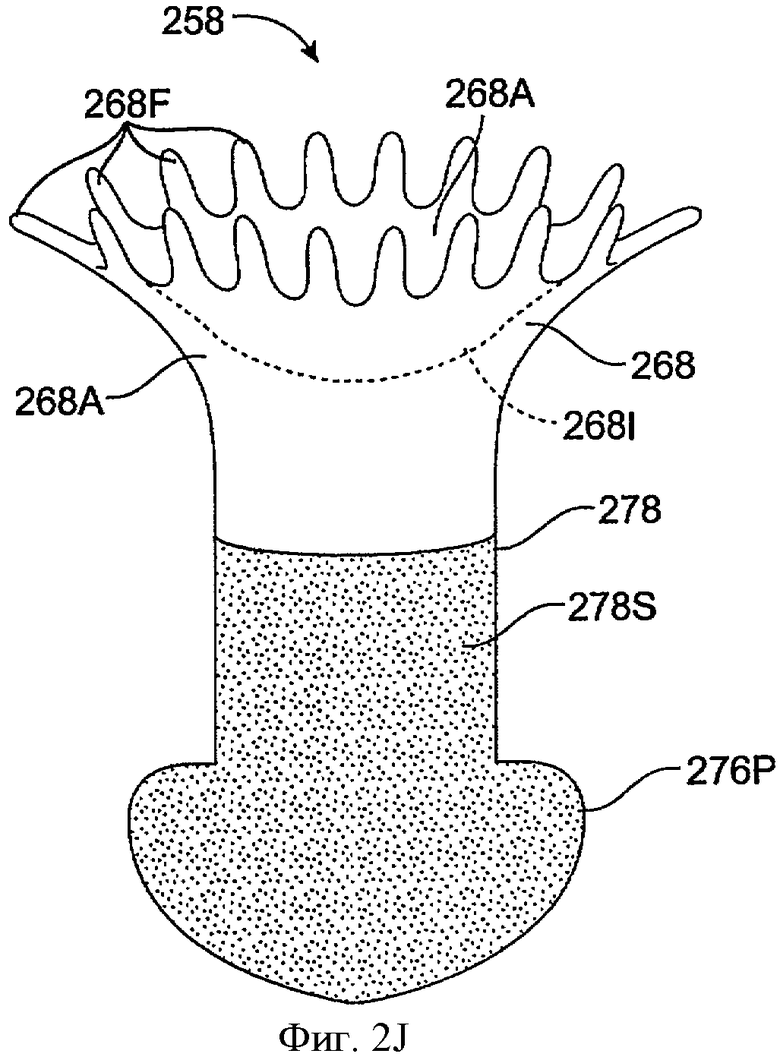
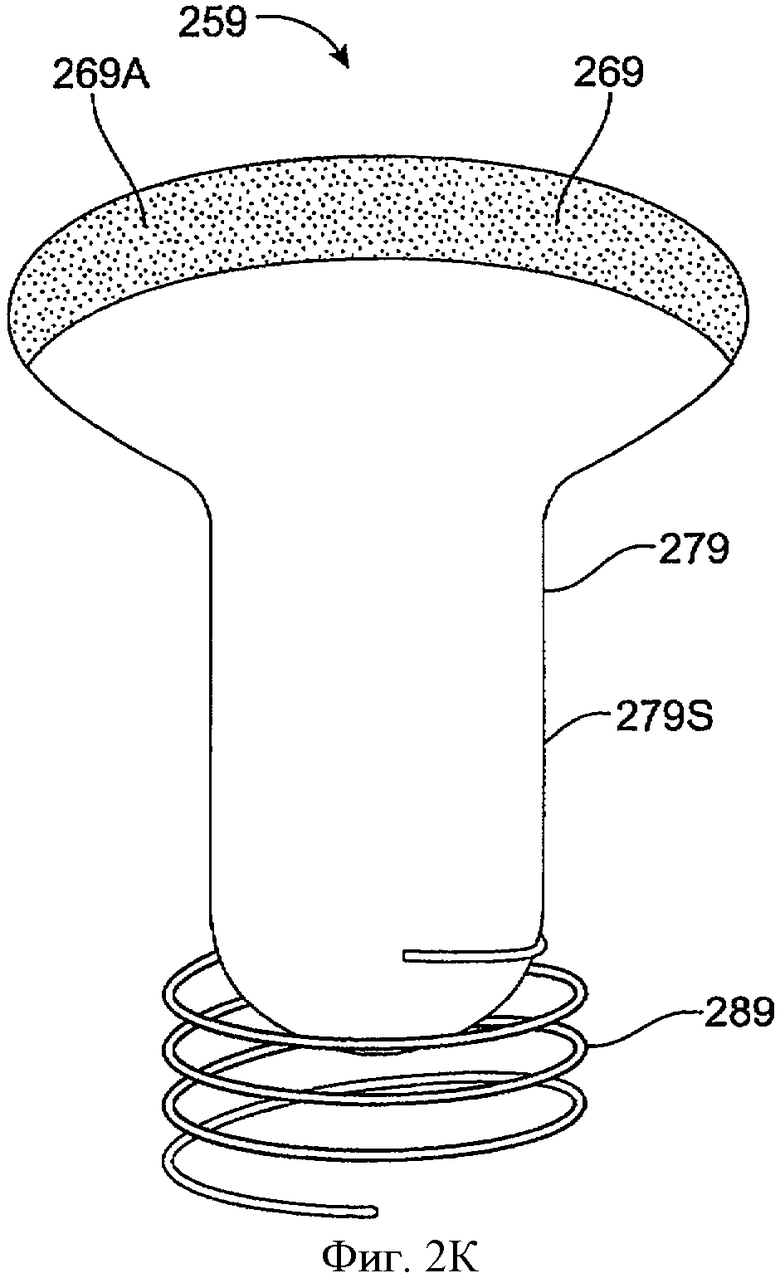
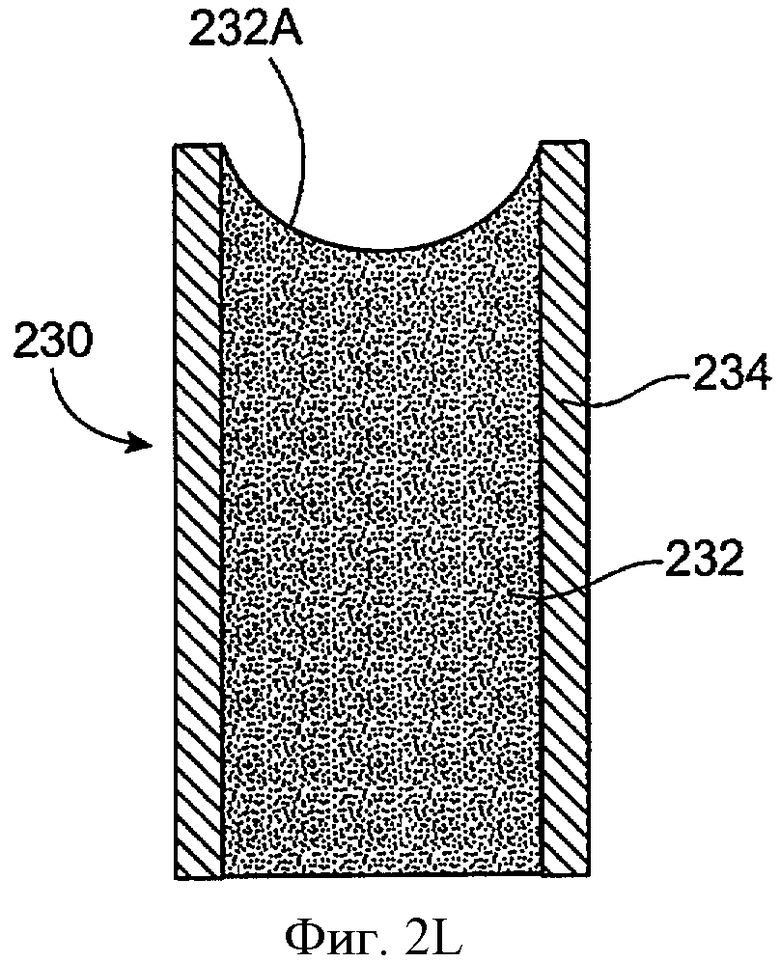
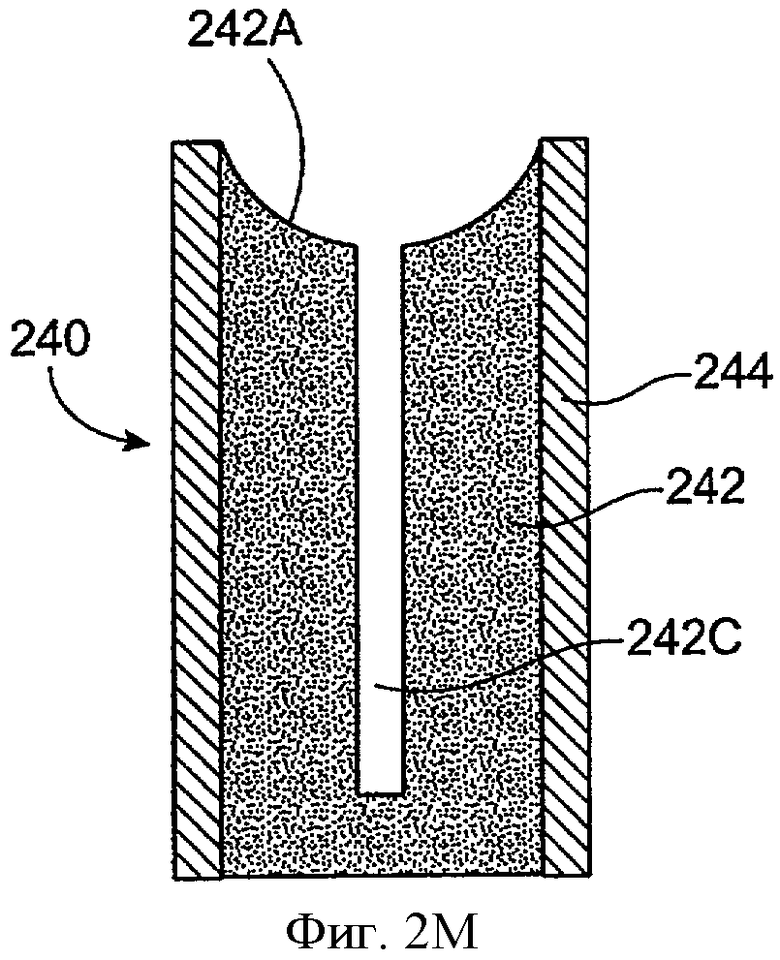
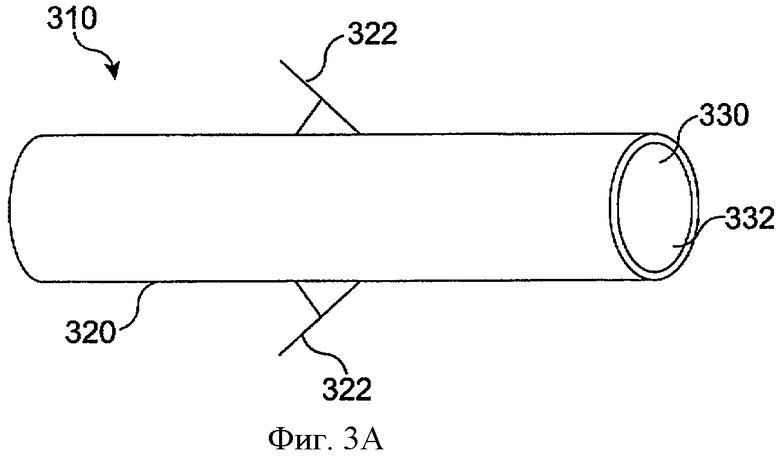
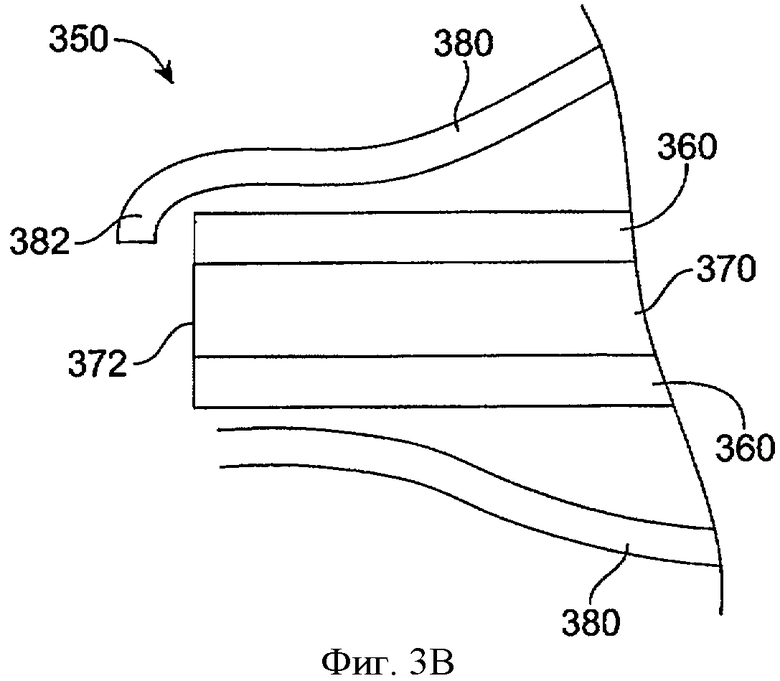
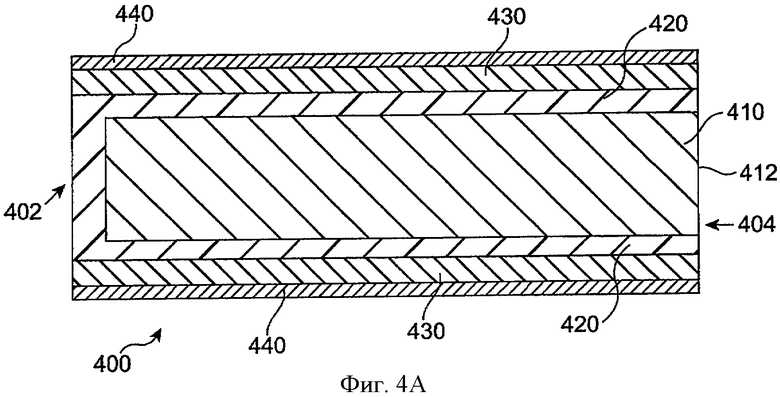
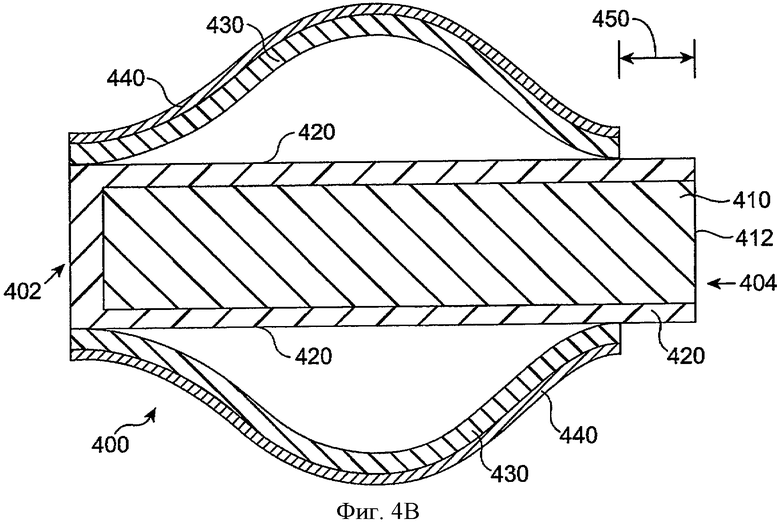
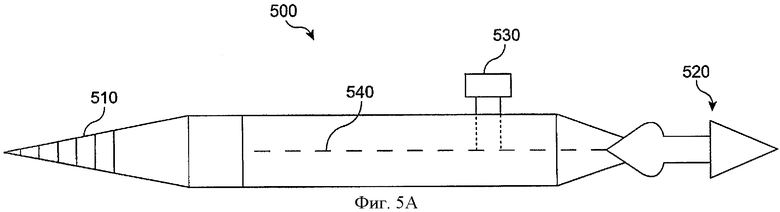
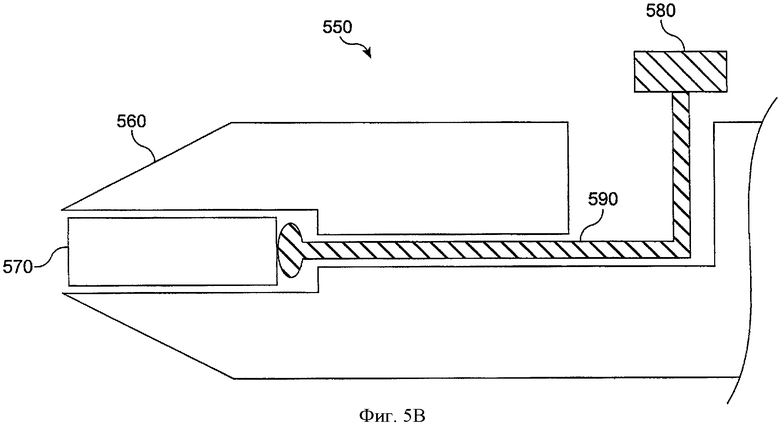
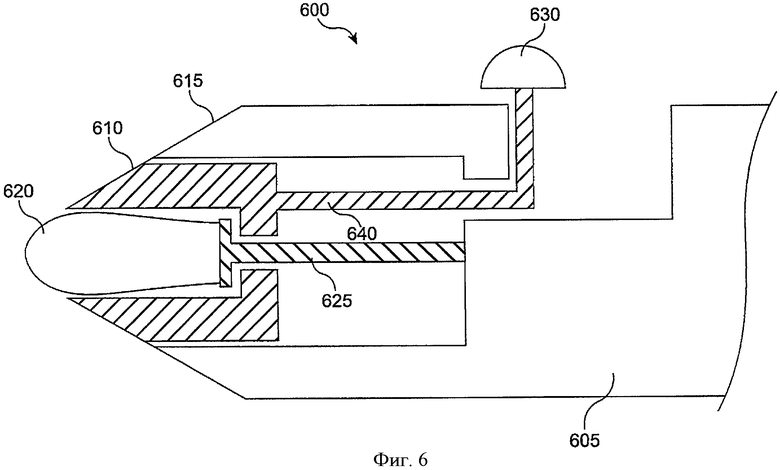
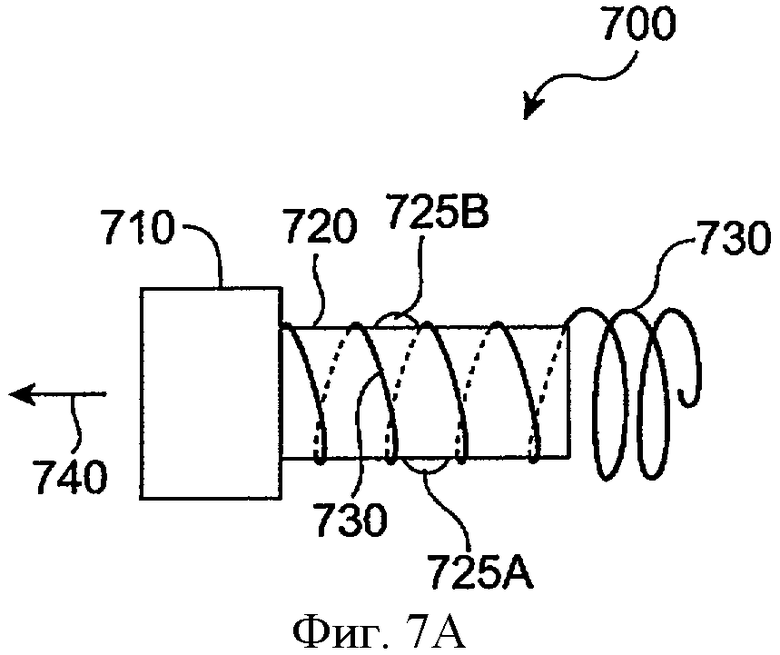
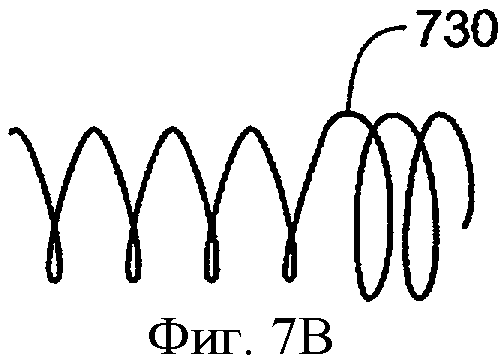
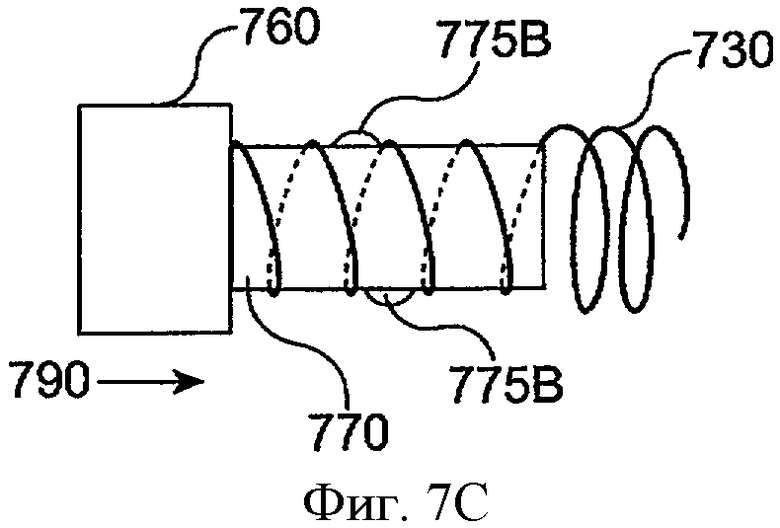
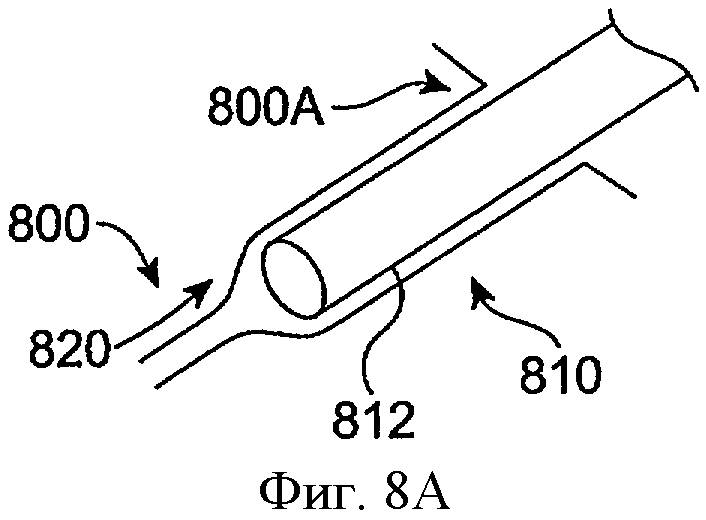
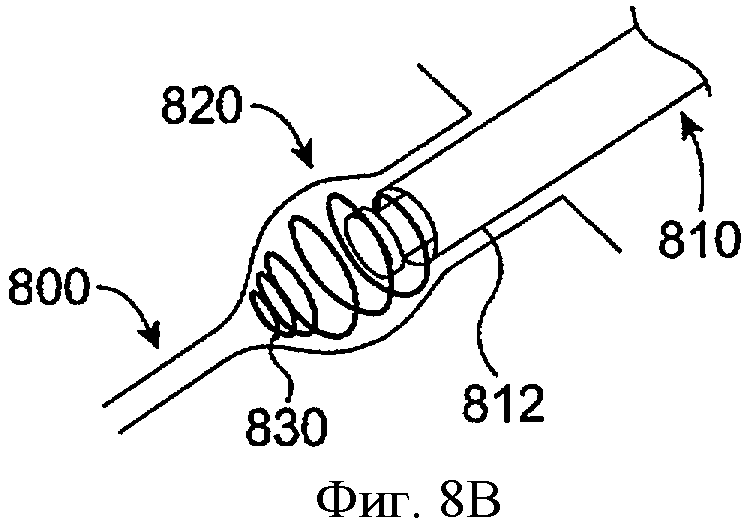
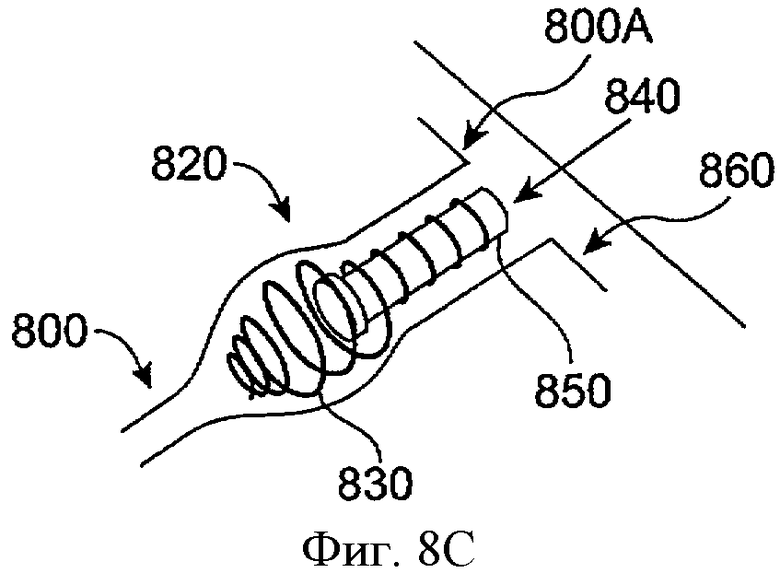
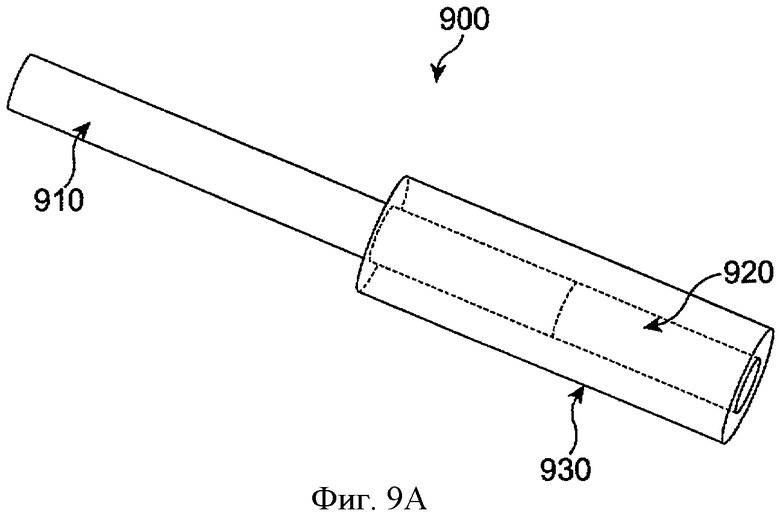
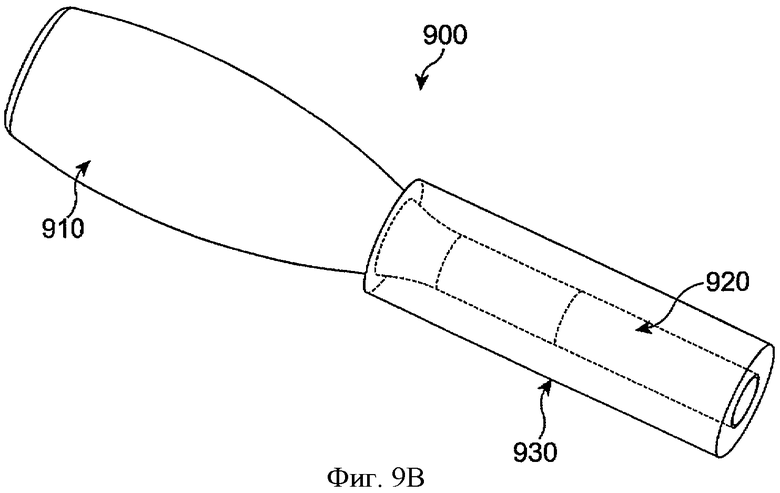
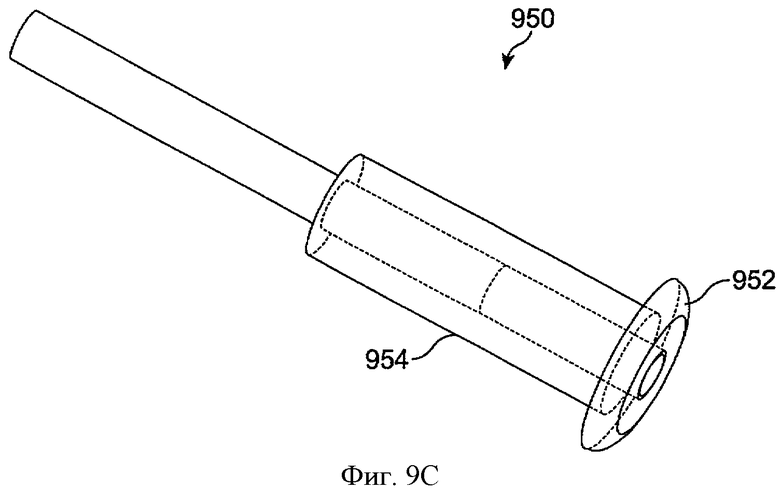
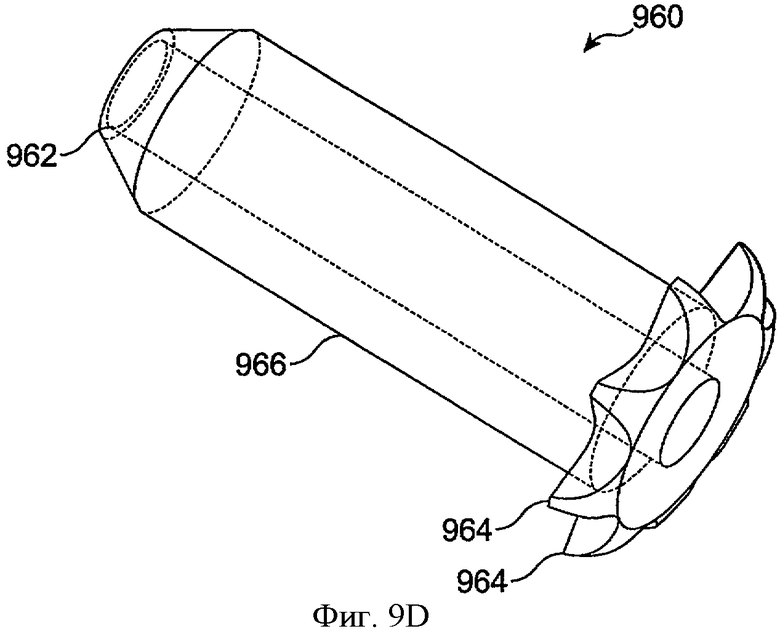
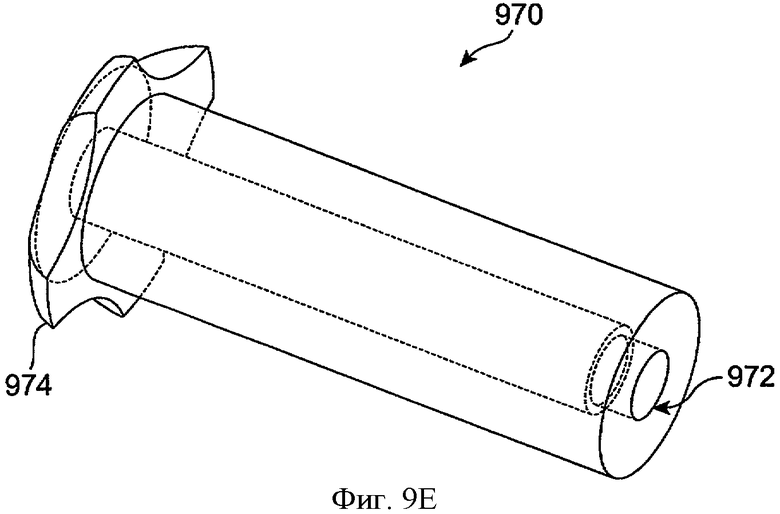
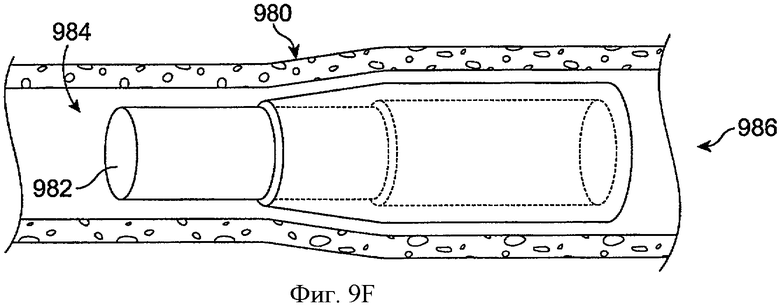
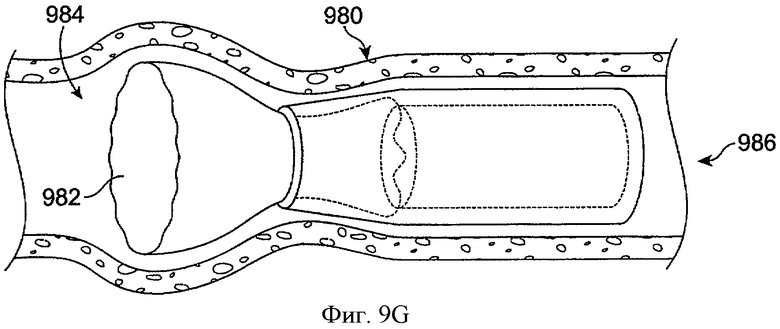
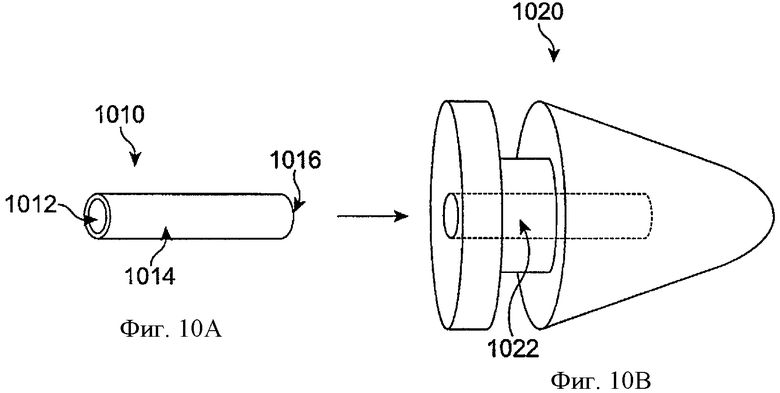
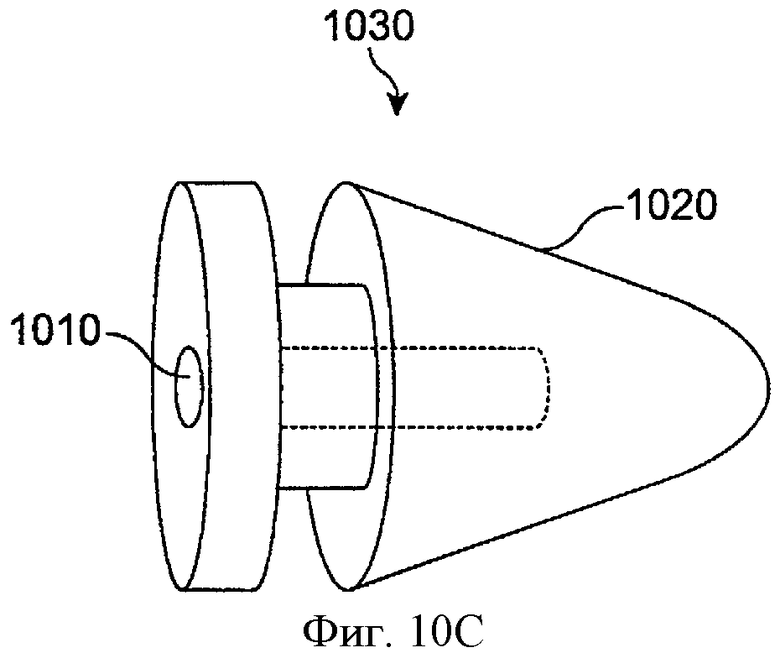
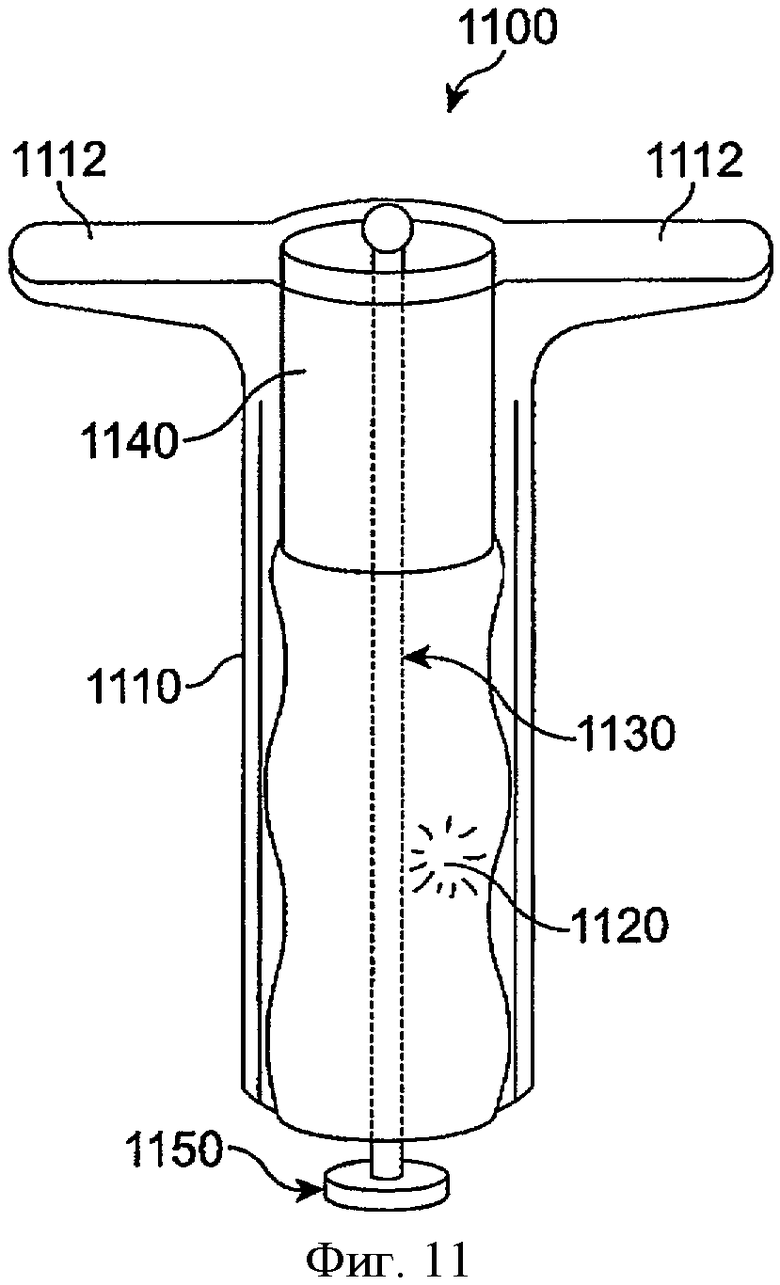
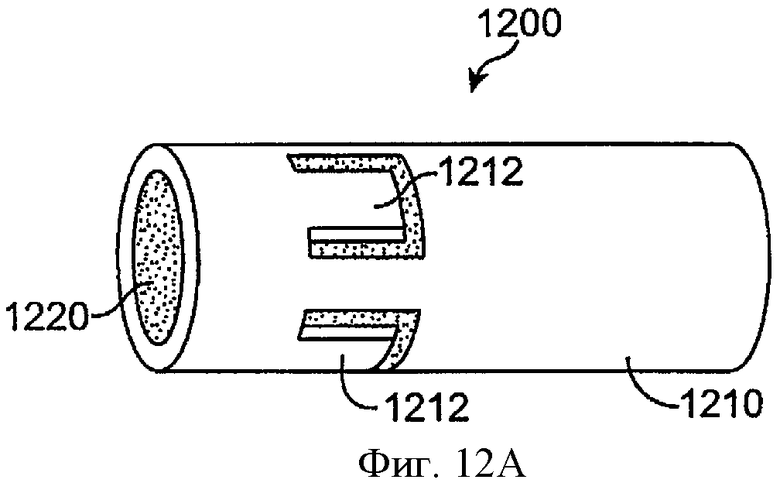
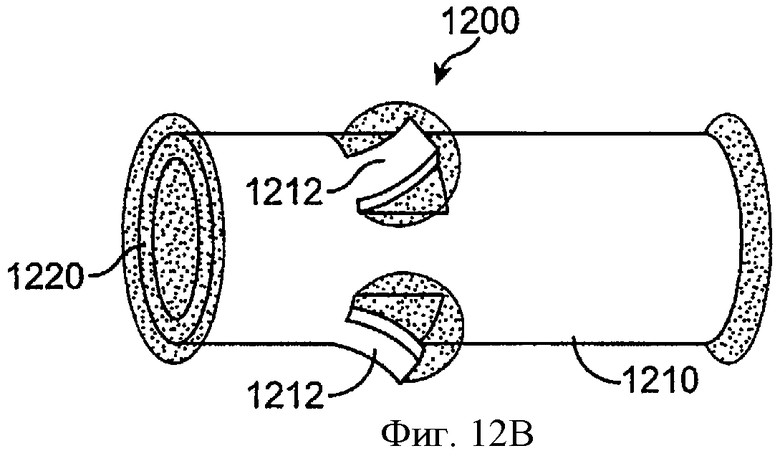
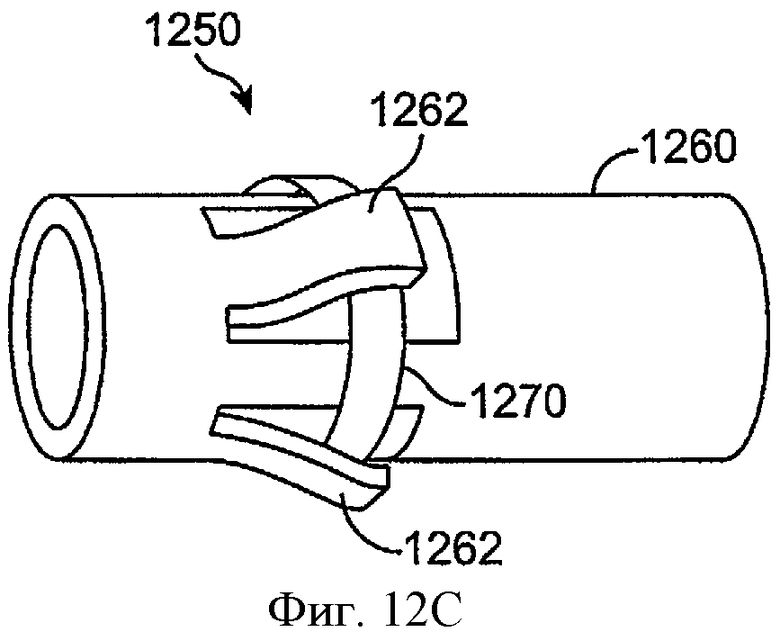
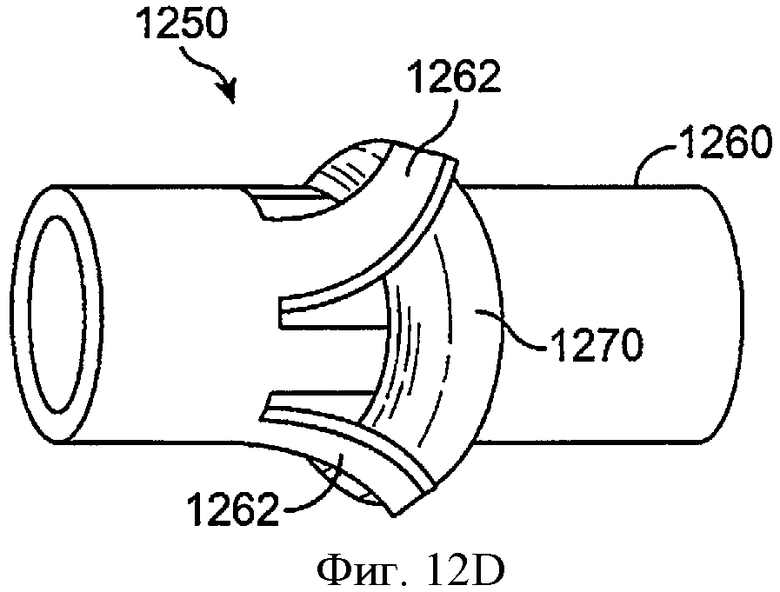
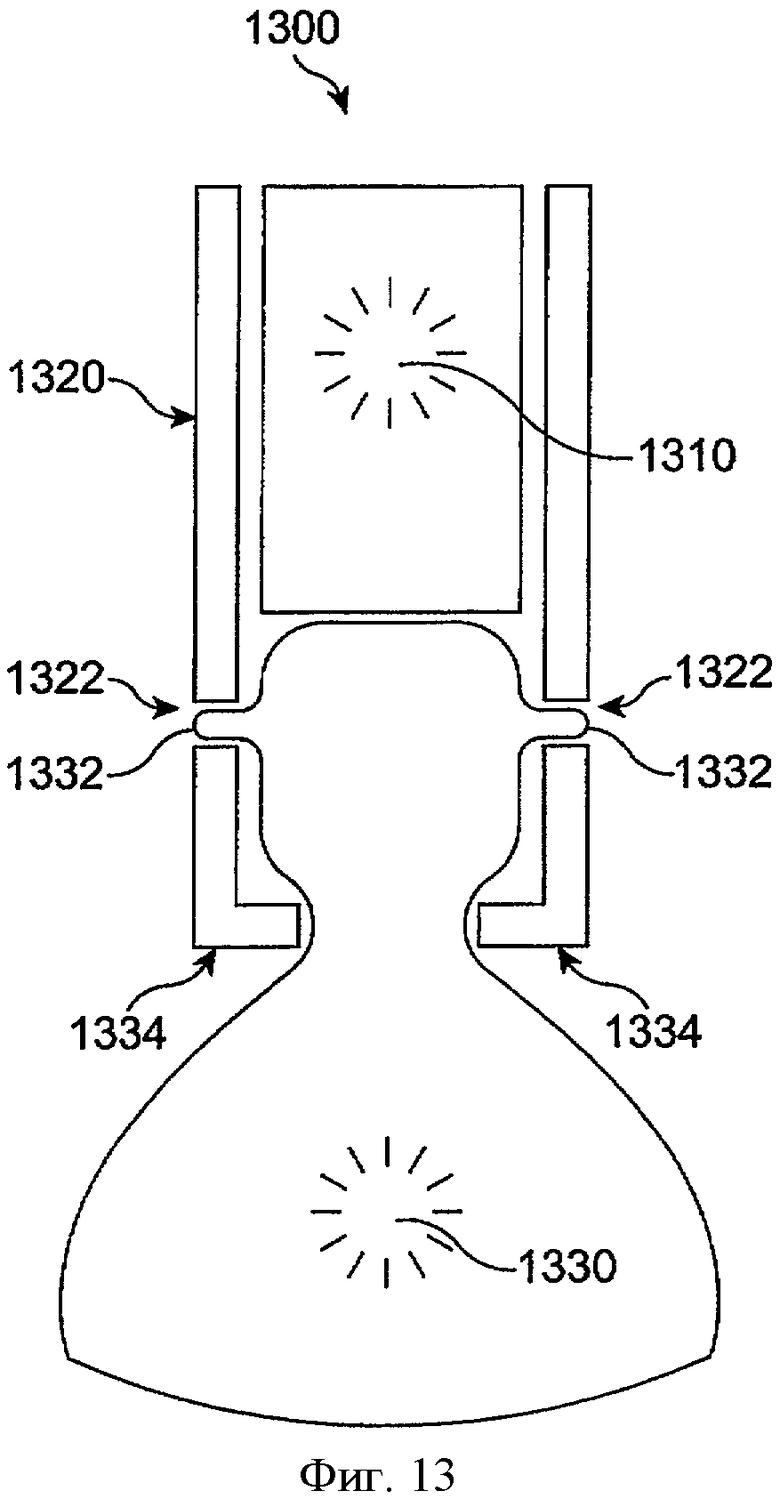
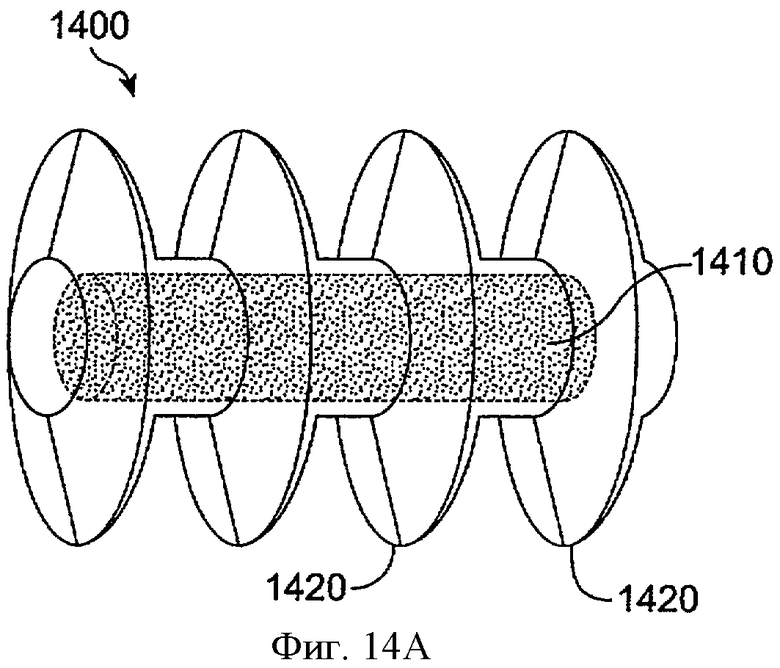
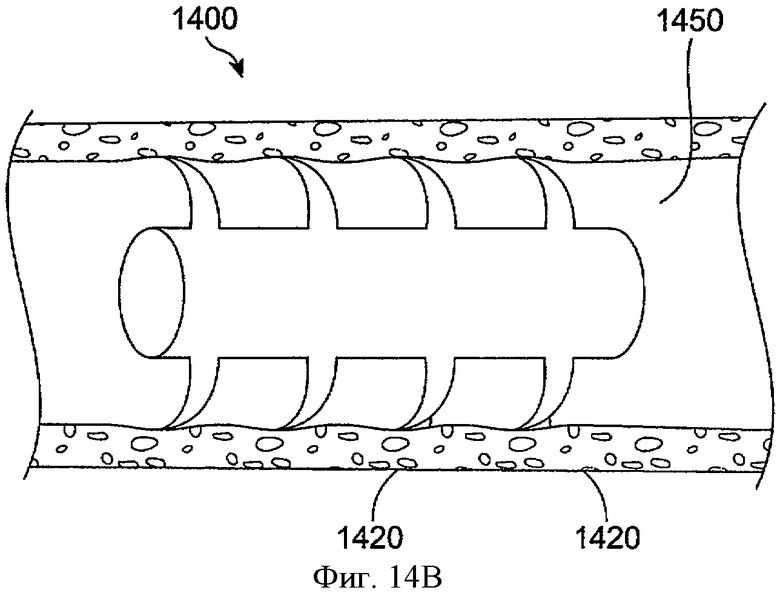
Изобретение относится к области медицинской техники, а именно к вариантам глазного имплантата, способам его производства, а также способам доставки лечебного агента в глаз. Имплантат в соответствии с первым вариантом осуществления включает лекарственную сердцевину, содержащую лечебный агент и имеющую проксимальный конец, дистальный конец и промежуточную часть между ними, а также удерживающую структуру, сцепленную с ней или располагающуюся вокруг части лекарственной сердцевины. Имплантат по второму варианту включает помимо лекарственной сердцевины с лечебным агентом манжету имплантата, простирающуюся вокруг лекарственной сердцевины от проксимального конца до дистального конца, и способный к набуханию в жидкости удерживающий элемент. Имплантат по третьему варианту дополнительно включает корпус имплантата, имеющий внутреннюю полость и удерживающую структуру, имеющую выступ; и оболочку из материала, непроницаемого для лечебного агента. Способ производства глазного имплантата в соответствии с первым вариантом осуществления заключается в получении лекарственной сердцевины и сцеплении или окружении части лекарственной сердцевины удерживающей структурой. Способ производства по второму варианту заключается в получении манжеты имплантата, размещении лекарственной сердцевины внутри проксимального конца манжеты имплантата и инкапсулировании способного к набуханию в жидкости удерживающего элемента. Способ доставки лечебного агента в глаз в соответствии с первым вариантом осуществления состоит в установке глазного имплантата в глазную полость и высвобождении лечебного агента из лекарственной сердцевины в глаз, при этом глазной имплантат представляет собой имплантат в соответствии с одним из трех вариантов осуществления. Согласно второму варианту способ доставки заключается в установке глазного имплантата в глазную полость, высвобождении эффективных количеств лечебного агента из лекарственной сердцевины в жидкость слезной пленки глаза, удалении лекарственной сердцевины из глазного имплантата и присоединении сменной лекарственной сердцевины к глазному имплантату. Использование изобретения позволяет обеспечить более надежное удержание имплантата в глазу. 7 н. и 13 з.п. ф-лы, 14 ил.
1. Глазной имплантат, вставляемый в глазную полость, где глазной имплантат включает
лекарственную сердцевину, включающую лечебный агент, доставляемый к глазу в течение пролонгированного периода времени, простирающуюся вдоль продольной оси, имеющую проксимальный конец, дистальный конец и промежуточную часть между ними; и
способную к расширению, не способную к набуханию в жидкости удерживающую структуру, сцепленную с или располагающуюся вокруг части лекарственной сердцевины, причем удерживающая структура сконфигурирована так, что, когда она имплантирована в глазную полость, удерживающая структура расширяется для смещения, по крайней мере, части удерживающей структуры, расположенной рядом с промежуточной частью или дистальным концом лекарственной сердцевины против, по крайней мере, части стенки глазной полости.
2. Глазной имплантат по п.1, где удерживающая структура расширяется из конфигурации с первым сечением, пригодной для вставления в глазную полость, до конфигурации со вторым сечением большего диаметра для смещения по крайней мере части удерживающей структуры против по крайней мере части стенки глазной полости.
3. Глазной имплантат по п.1, где удерживающая структура, способная к расширению вокруг проксимального конца лекарственной сердцевины, определяет меньший средний размер диаметра, чем средний размер диаметра удерживающей структуры, выступающей вокруг промежуточной части лекарственной сердцевины.
4. Глазной имплантат по п.1, где удерживающая структура включает по крайней мере одно из:
(a) трубчатого корпуса, включающего одну или более ручек, разделенных одной или более прорезями;
(b) эластичного металла или сплава с памятью формы или
(c) трехмерную каркасную или спиральную структуру в расширенном состоянии.
5. Глазной имплантат по п.1, где лекарственная сердцевина сконфигурирован так, чтобы частично или полностью ингибировать поток жидкости в глазную полость и через нее, причем глазная полость включает слезные канальцы.
6. Глазной имплантат по п.1, где лекарственная сердцевина включает оболочку, имеющую толщину от 0,00025 до 0,0015 дюймов, расположенную вокруг части лекарственной сердцевины для задания по крайней мере одной экспонированной поверхности лекарственной сердцевины, через которую осуществляется высвобождение лекарственного агента.
7. Глазной имплантат по п.1, включающий сжимаемый выступ, простирающийся по крайней мере частично от проксимального конца лекарственной сердцевины, где сжимаемый выступ сконфигурован так, чтобы находиться против или рядом с входом в глазную полость, когда лекарственная сердцевина имплантирована.
8. Глазной имплантат, вставляемый в глазную полость, где глазной имплантат включает:
лекарственную сердцевину, включающую лечебный агент, доставляемый в глаз в течение пролонгированного периода времени;
манжету имплантата, простирающуюся вокруг лекарственной сердцевины от проксимального конца до дистального конца и имеющую промежуточную часть между ними; и
способный к набуханию в жидкости удерживающий элемент, по крайней мере частично инкапсулированный промежуточной частью или дистальным концом манжеты имплантата, причем способный к набуханию в жидкости удерживающий элемент конфигурирован, чтобы расширяться при имплантации в глазную полость.
9. Глазной имплантат по п.8, где способный к набуханию в жидкости удерживающий элемент включает гидрогель.
10. Глазной имплантат по п.8, где способный к набуханию в жидкости удерживающий элемент при расширении подгоняется против манжеты имплантата и манжета имплантата удерживает способный к набуханию в жидкости удерживающий элемент.
11. Глазной имплантат по п.8, где способный к набуханию в жидкости удерживающий элемент расширяется дистально от дистального конца манжеты имплантата.
12. Глазной имплантат по п.8, где манжета имплантата включает одну или более пустот латеральной поверхности, подобранных по размеру так, чтобы позволить жидкости проникать в способный к набуханию в жидкости удерживающий элемент, но ингибировать расширение удерживающего элемента за периметр манжеты.
13. Глазной имплантат, вставляемый в глазную полость, включающий: корпус имплантата, включающий внутреннюю полость, где внутренняя полость простирается внутрь от проксимального конца корпуса, и удерживающую структуру, где удерживающая структура включает выступ, имеющий размер поперечного сечения больше, чем прилегающая часть корпуса имплантата;
лекарственную сердцевину, по крайней мере, частично расположенную во внутренней полости, где лекарственная сердцевина включает, по крайней мере, одну экспонированную поверхность, сконфигурованную так, чтобы обеспечить замедленное высвобождение лечебного агента; и
оболочку, сделанную из материала, по существу, не проницаемого для лечебного агента, расположенную поверх части лекарственной сердцевины для задания, по крайней мере, одной экспонированной поверхности лекарственной сердцевины.
14. Глазной имплантат по п.13, включающий выступ корпуса имплантата, простирающийся, по крайней мере, частично от проксимального конца корпуса имплантата или вокруг него и сконфигурированный так, чтобы находиться против отверстия глазной полости, когда он имплантирован.
15. Глазной имплантат по п.13, где лекарственная сердцевина является удаляемой из корпуса имплантата, в то время как удерживающая структура поддерживает в имплантированном положении корпус имплантата внутри глазной полости; и где сменная лекарственная сердцевина вставляется во внутреннюю полость, в то время как удерживающая структура поддерживает в имплантированном положении корпус имплантата внутри глазной полости.
16. Способ производства глазного имплантата, вставляемого в глазную полость, включающий:
получение лекарственной сердцевины, включающей лечебный агент, доставляемый в глаз в течение пролонгированного периода времени, простирающейся продольно и имеющей проксимальный конец, дистальный конец и промежуточную часть между ними; и
сцепление или окружение части лекарственной сердцевины, способной к расширению, не способной к набуханию в жидкости, удерживающей структурой, где удерживающая структура сконфигурирована так, что при имплантации в глазную полость удерживающая структура расширяется для смещения, по крайней мере, части удерживающей структуры, расположенной рядом с промежуточной частью или дистальным концом лекарственной сердцевины, против, по крайней мере, части стенки глазной полости.
17. Способ по п.16, где сцепление или окружение лекарственной сердцевины удерживающей структурой включает ограничение расширения удерживающей структуры от проксимального конца лекарственной сердцевины в меньшей степени, чем расширения удерживающей структуры от промежуточной части или дистального конца лекарственной сердцевины.
18. Способ производства глазного имплантата, вставляемого в глазную полость, включающий:
получение манжеты имплантата, простирающейся вокруг лекарственной сердцевины от проксимального конца к дистальному концу и имеющей промежуточную часть между ними;
размещение лекарственной сердцевины внутри проксимального конца манжеты имплантата, где лекарственная сердцевина включает лечебный агент, доставляемый в глаз на протяжении пролонгированного периода времени; и
по крайней мере, частичное инкапсулирование способного к набуханию в жидкости удерживающего элемента с применением промежуточной части или части дистального конца манжеты имплантата, так что способный к набуханию в жидкости удерживающий элемент может расширяться, будучи имплантированным в глазную полость.
19. Способ доставки лечебного агента в глаз, включающий:
вставление глазного имплантата в глазную полость, где глазной имплантат включает, по крайней мере, одно из:
(а) лекарственной сердцевины, включающей лечебный агент, простирающейся вдоль продольной оси, имеющей проксимальный конец, дистальный конец и промежуточную часть между ними; и
способной к расширению, не способной к набуханию в жидкости удерживающей структуры, сцепленной или расположенной вокруг лекарственной сердцевины, сконфигурированной так, что будучи имплантированной в глазную полость, удерживающая структура расширяется для смещения, по крайней мере, части удерживающей структуры, расположенной рядом с промежуточной частью или дистальным концом лекарственной сердцевины, против, по крайней мере, части стенки глазной полости;
(b) манжеты имплантата, простирающейся вокруг лекарственной сердцевины от проксимального конца к дистальному концу и имеющей промежуточную часть между ними;
лекарственной сердцевины, расположенной внутри проксимального конца манжеты имплантата; и
способного к набуханию в жидкости удерживающего элемента, по крайней мере, частично инкапсулированного промежуточной частью или дистальным концом манжеты имплантата, где способный к набуханию в жидкости удерживающий элемент сконфигурирован так, чтобы расширяться при имплантации в глазную полость; или
(c) корпуса имплантата, включающего внутреннюю полость, где внутренняя полость проходит внутрь от проксимального конца корпуса, и удерживающую структуру, где удерживающая структура включает выступ, имеющий поперечное сечение больше, чем прилегающая часть корпуса имплантата;
лекарственной сердцевины, по крайней мере, частично расположенной в внутренней полости, причем лекарственная сердцевина включает, по крайней мере, одну экспонированную поверхность, сконфигурированную для обеспечения замедленного высвобождения лечебного агента; и
оболочки, сделанной из материала, по существу, не проницаемого для лечебного агента, расположенной поверх части лекарственной сердцевины для задания, по крайней мере, одной экспонированной поверхности лекарственной сердцевины; и
высвобождение лечебного агента из лекарственной сердцевины в глаз.
20. Способ доставки лечебного агента в глаз, включающий:
вставление глазного имплантата, включающего удерживающую структуру и лекарственную сердцевину, в глазную полость, вставление удерживающей структуры через отверстие слезного канала в просвет канальца так, что лекарственная сердцевина является, по крайней мере, частично закрепленной в просвете с помощью удерживающей структуры;
высвобождение эффективных количеств лечебного агента из лекарственной сердцевины в жидкость слезной пленки глаза;
удаление лекарственной сердцевины из глазного имплантата, в то время как удерживающая структура остается закрепленной в просвете; и присоединение сменной лекарственной сердцевины к глазному имплантату, в то время как удерживающая структура остается закрепленной в просвете.
| US 2006020248 A1, 26.01.2006 | |||
| US 5283063 A, 01.02.1994 | |||
| US 2004254516 A1, 16.12.2004 | |||
| US 4959048 A, 25.09.1990 | |||
| Стиральная машина | 1989 |
|
SU1650824A1 |
| RU 96113117 A, 27.09.1998 | |||
| СИСТЕМА ПОДАЧИ ЛЕКАРСТВА | 1991 |
|
RU2099031C1 |
Авторы
Даты
2011-03-20—Публикация
2007-04-02—Подача