Изобретение относится к области медицины, а именно к трансплантологии, травматологии и ортопедии, и предназначено для получения тканеинженерного эквивалента кости с целью восполнения дефектов костной ткани.
Известен способ иммобилизации остеогенных стромальных стволовых клеток костного мозга (1), заключающийся в предварительной обработке имплантата, изготовленного из никелида титана, раствором коллагена и последующем нанесении на эту поверхность остеогенных стромальных стволовых клеток костного мозга. Однако в качестве имплантата используется нерезорбируемое изделие из никелида титана, не обладающего остеоиндуцирующими свойствами; предварительная обработка его поверхности представляет собой новый дополнительный этап, усложняющий всю процедуру изготовления и не гарантирующий полноценное совмещение с клетками, поддержание их жизнеспособности и способности к продуцированию компонентов костного матрикса.
Наиболее близким к заявляемому является способ изготовления имплантата для пластики дефектов костной ткани (2). Способ основан на самостоятельной (пассивной) иммобилизации клеток на поверхности губчатого носителя. Однако самостоятельная адгезия клеток приводит к тому, что большая их часть оказывается не иммобилизированной на поверхности, следовательно, имплантат получается обедненным клеточными элементами и не выполняет в костной ране роль индуктора остеогенеза. Эти недостатки устраняемы с помощью заявляемого способа.
Целью предлагаемого способа является простое по исполнению, полноценное совмещение всего количества остеогенных клеточных элементов и трехмерного материала-носителя, представляющего собой деминерализованный костный матрикс, с последующей подготовкой полученного тканеинженерного эквивалента кости к трансплантации в костную рану путем индукции направленной остеогенной дифференцировки составляющих его клеток.
Поставленная цель достигается тем, что используют клетки, которые перед процедурой совмещения помещают в гелевый носитель из природного коллагена с сохраненными телопептидами (3), обеспечивающими его полимеризацию, что необходимо при изготовлении заявленного изобретения, а затем, до полимеризации геля, этой композицией пропитывают резорбируемый макропористый материал-носитель, представляющий собой деминерализованный костный матрикс, из расчета 10 млн клеток на 1 см3 пористого носителя.
Признаками, отличающими заявляемый способ от прототипа, являются помещение иммобилизируемых клеток в гелевый носитель с последующей пропиткой этой композицией носителя совмещения до полимеризации геля.
На фигурах изображены:
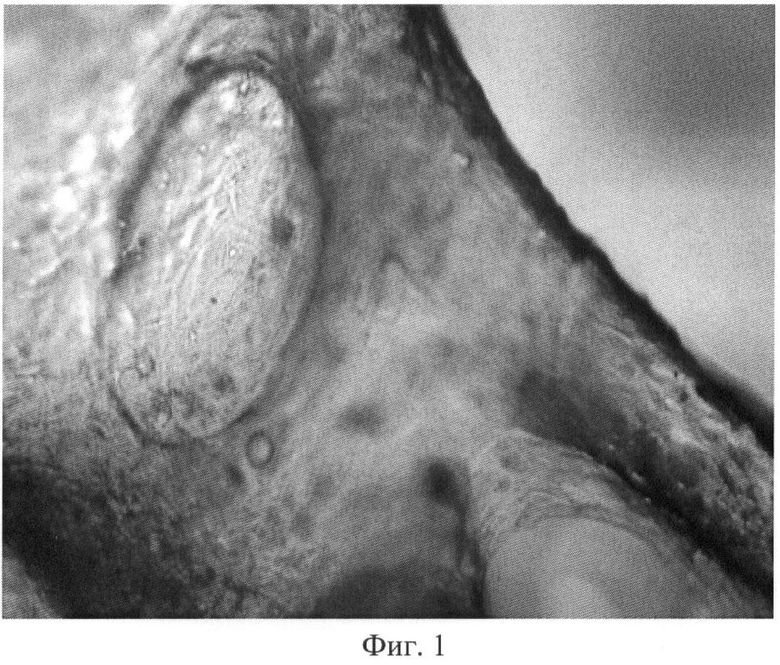
Фиг.1. Внешний вид готового изделия при увеличении ×30; клеточная культура полностью покрывает поверхность трехмерного материала-носителя - деминерализованного костного матрикса.
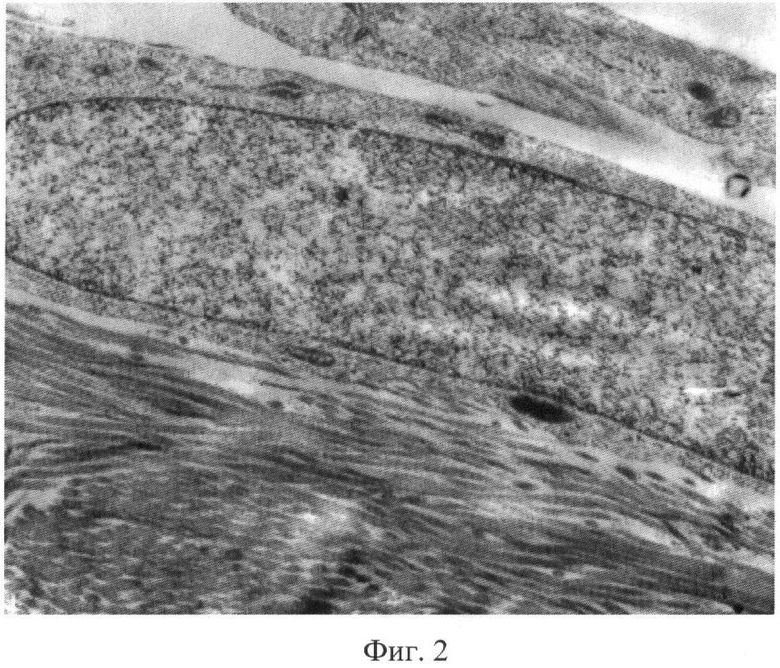
Фиг.2. Электроннограмма предифференцированной остеогенной клетки, содержащей богатое эухроматином ядро и плотно адгезированной к поверхности трехмерного материала-носителя, изготовленного из деминерализованного костного матрикса. Увеличение ×5000.
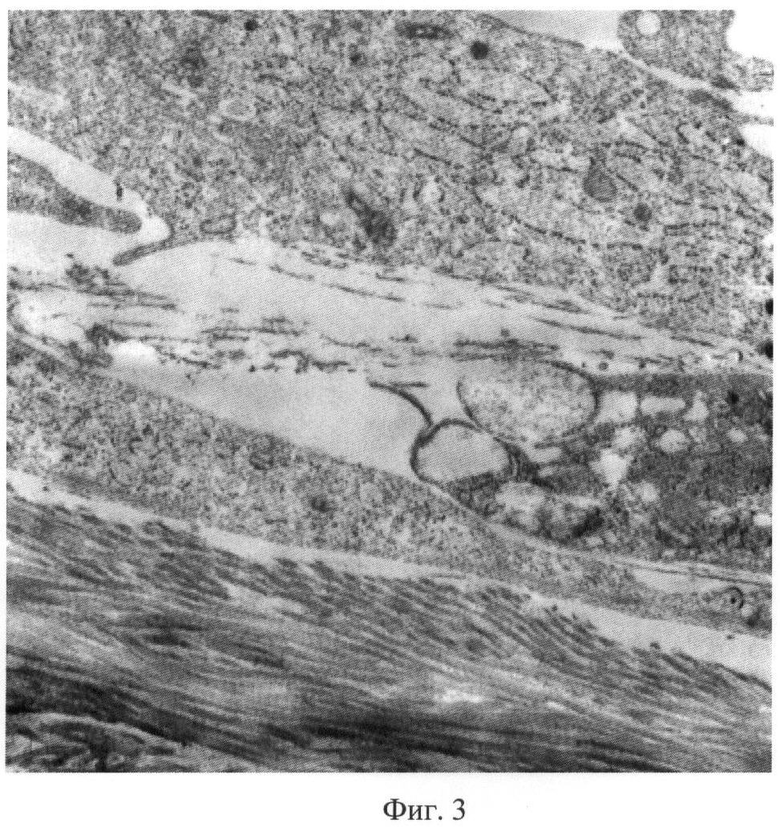
Фиг.3. Электроннограмма предифференцированных остеогенных клеток, расположенных на поверхности трехмерного материала-носителя, изготовленного из деминерализованного костного матрикса, и активно синтезирующих коллагеновые и неколлагеновые компоненты костного матрикса. Увеличение ×5000.
Предлагаемый способ осуществляется следующим образом.
На первом этапе производят эксплантацию тканей, содержащих клетки, обладающие остеогенным потенциалом - красный костный мозг. Далее фрагментируют ткани и подвергают ферментативной обработке раствором трипсина (0,05%; ICN, США) и версена (0,02%, Биолот, Россия) в соотношении 1:1. После этого полученную взвесь фильтруют через нейлоновый фильтр с диаметром отверстий 50 мкм.
Далее клеточную взвесь помещают в стерильный культуральный сосуд, заполненный смесью сред Dulbecco's MEM и F-12 в соотношении 3:1 (среды Dulbecco's MEM и F-12 производства ICN, США). Культивирование проводят в стерильных условиях в атмосфере, содержащей 5% CO2, при влажности - 95%. Через сутки проводят смену среды с одновременным удалением всех неадгезировавшихся клеток. Далее смену среды производят каждые трое суток. Процесс культивирования проводят до тех пор, пока не будет накоплено необходимое для изготовления тканеинженерного эквивалента кости количество клеток (из расчета 10 млн клеток на 1 см3 поверхности носителя, изготовленного из губчатого деминерализованного костного матрикса) (4). Кроме того, проводят иммунофенотипирование полученной культуры, тесты на наличие инфекционных агентов, криоконсервирование.
Далее полученные клетки, предназначенные для совмещения с носителем, ресуспендируют в ростовой среде и помещают в жидкий коллагеновый гель при температуре 0°С. Композицию перемешивают при помощи пастеровской пипетки до визуально определяемого равномерного распределения клеток в объеме геля.
Далее полученную жидкую композицию при комнатной температуре с помощью капилляра наносят на стерильный влажный трехмерный материал-носитель. В качестве носителя используют биорезорбируемый материал (деминерализованный костный матрикс), обладающий остеоиндуктивной активностью. После того, как жидкая композиция под действием силы тяжести и присасывающего эффекта эластичного носителя (деминерализованного костного матрикса) полностью пропитает носитель, изделие переносят в стерильную посуду и ставят в СО2-инкубатор, где при температуре 37°С в течение 20-30 мин происходит полимеризация коллагенового геля. Далее изделие заливают остеогенной средой для культивирования, которая состоит из смеси сред Dulbecco's MEM и F-12 в соотношении 3:1, сыворотки реципиента, 10-2 М β-глицерофосфата Na, 10-8 М дексаметазона, 20-4 М L-аскорбата и культивируют в течение 7 суток для предифференцировки клеток в остеогенном направлении. Контроль наличия в культуре инфекционных агентов и жизнеспособности клеток проводят визуально, под микроскопом, ежедневно. Если процедура выполнена правильно, то через сутки округлые клетки приобретают отростчатую или веретеновидную форму, равномерно покрывают все изделие.
Таким образом, к концу технологического периода формируется тканеинженерный эквивалент кости, содержащий жизнеспособные предифференцированные в остеогенном направлении клетки и резорбируемый остеоиндуцирующий трехмерный материал-носитель, представляющий собой деминерализованный костный матрикс. Готовое изделие может быть использовано в качестве биологического остеопластического аутогенного материала с целью замещения дефектов кости различного генеза.
Эффективность способа была подтверждена в модельном опыте на животных (кроликах).
Кроликам породы Шиншилла обоего пола весом 1,5-2 кг (n=30) формировали тотальный дефект большеберцовой кости протяженностью 2,0 см. Отломки фиксировали интрамедуллярно спицей Киршнера и дистрактором, препятствующим самостоятельному сближению отломков. После этого все животные были разделены на три группы (10 животных в каждой группе). У животных группы №1 (контроль) процесс консолидации происходил без дополнительных лечебных воздействий. Животным группы №2 (контроль) в область дефекта помещали только материал-носитель - деминерализованный костный матрикс. Животным группы №3 (опытная группа) пересаживали в область дефекта изготовленный из аутогенных клеток тканеинженерный эквивалент кости. Оценку результатов осуществляли методом динамического клинического наблюдения, а также при помощи рентгенологического исследования, компьютерной томографии, в том числе с 3D реконструкцией области дефекта и регенерации, гистологическим методом на сроках 15, 30, 60, 90 и 120 сут.
Установлено, что процессы репаративной регенерации в области костного дефекта у животных группы №3 в среднем на 30 суток опережали таковые у животных групп №1 и №2. Опороспособность конечности восстанавливалась полностью к 30 суткам, гипертрофический костный регенерат формировался на всем протяжении дефекта к этому сроку, его ремоделирование с формированием нативной структуры кости завершалось к 90-м суткам.
Таким образом, предлагаемый способ позволяет получить тканеинженерный эквивалент кости, включающий полноценное совмещение предифференцированных в условиях культивирования in vitro остеогенных клеток и трехмерного материала-носителя, изготовленного из деминерализованного костного матрикса, обладающего выраженным остеоиндуцирующим действием.
Литература
1. Останин А.А., Хейфец М.В., Сизиков М.Ю., Ступак В.В., Черных Е.Р. Способ иммобилизации остеогенных стромальных стволовых клеток костного мозга. Патент А2006106040 RU. 2007.09.10.
2. Попов В.А., Сиротинкин Н.В., Караев Р.Х., Чернявский Е.А., Макеев Б.Л. Способ изготовления имплантата для пластики дефектов костной ткани. Патент А2006104540 RU. 2007.08.27.
3. Кухарева Л.В., Парамонов Б.А., Шамолина И.И., Семенова Е.Г. Способ получения коллагена для лечения патологий тканей организма. Патент А2002107219 RU. 2003.11.20.
4. Николаенко Н.С., Цупкина Н.В., Пинаев Г.П., Гололобов В.Г., Иванов Д.Е., Деев Р.В. «Способ получения культуры остеогенных клеток кролика in vitro" - Сборник рационализаторских предложений и изобретений ВМедА, Санкт-Петербург, 2003.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНОГО ОСТЕОТРАНСПЛАНТАТА | 2014 |
|
RU2574942C1 |
| СПОСОБ СОЗДАНИЯ ПЕРСОНАЛИЗИРОВАННОГО ГЕН-АКТИВИРОВАННОГО ИМПЛАНТАТА ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2015 |
|
RU2597786C2 |
| КОМПОЗИЦИЯ - ОСТЕОИНДУКТОР И ОСТЕОКОНДУКТОР, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ, И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ - ОСТЕОИНДУКТОРА И ОСТЕОКОНДУКТОРА, ПРИ ЛЕЧЕНИИ КОСТНОЙ ПАТОЛОГИИ В СТОМАТОЛОГИИ И ЧЕЛЮСТНО-ЛИЦЕВОЙ ХИРУРГИИ | 2008 |
|
RU2383564C1 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| БИОТРАНСПЛАНТАТ НА ОСНОВЕ ПЕНОКЕРАМИЧЕСКИХ НОСИТЕЛЕЙ СИСТЕМЫ ОКСИД ЦИРКОНИЯ - ОКСИД АЛЮМИНИЯ И МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ВОССТАНОВЛЕНИЯ ПРОТЯЖЕННЫХ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2386453C1 |
| СПОСОБ СТЕРИЛИЗАЦИИ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ТРАНСПЛАНТАЦИИ | 2007 |
|
RU2362589C1 |
| ЛИОФИЛИЗИРОВАННЫЙ БИОЛОГИЧЕСКИЙ БИОДЕГРАДИРУЕМЫЙ МИНЕРАЛИЗОВАННЫЙ КОСТНОПЛАСТИЧЕСКИЙ МАТЕРИАЛ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2019 |
|
RU2722266C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ОБЪЕМА КОСТНОЙ ТКАНИ ПРИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ И ТРАВМАТИЧЕСКИХ ПВОРЕЖДЕНИЯХ КОСТЕЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2530622C2 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |
| КУЛЬТУРА КЛЕТОК, СОДЕРЖАЩАЯ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ ОСТЕОГЕНЕЗА, ИМПЛАНТАТ НА ЕЕ ОСНОВЕ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ВОССТАНОВЛЕНИЯ ЦЕЛОСТНОСТИ КОСТИ | 2003 |
|
RU2240135C1 |
Изобретение относится к медицине, а именно к трансплантологии, травматологии и ортопедии, и представляет собой способ совмещения культивированных остеогенных клеток и трехмерного материала-носителя путем иммобилизации клеток, обладающих остеогенным потенциалом, на поверхности материала-носителя, отличающийся тем, что перед совмещением клетки помещают в гелевый носитель из природного коллагена с сохраненными телопептидами, а затем, до полимеризации геля, полученной композицией пропитывают макропористый материал-носитель, представляющий собой деминерализованный костный матрикс, из расчета 10 млн клеток на 1 см3 пористого носителя. Изобретение обеспечивает получение тканеинженерного эквивалента кости, включающего полноценное совмещение предифференцированных в условиях культивирования in vitro остеогенных клеткок и трехмерного материала-носителя, изготовленного из деминерализованного костного матрикса, обладающего выраженным остеоиндуцирующим действием. 3 ил.
Способ совмещения культивированных остеогенных клеток и трехмерного материала-носителя путем иммобилизации клеток, обладающих остеогенным потенциалом, на поверхности материала-носителя, отличающийся тем, что перед совмещением клетки помещают в гелевый носитель из природного коллагена с сохраненными телопептидами, а затем, до полимеризации геля, полученной композицией пропитывают макропористый материал-носитель, представляющий собой деминерализованный костный матрикс, из расчета 10 млн клеток на 1 см3 пористого носителя.
| СПОСОБ ИЗГОТОВЛЕНИЯ ИМПЛАНТАТА ДЛЯ ПЛАСТИКИ ДЕФЕКТОВ КОСТНОЙ ТКАНИ | 2006 |
|
RU2335258C2 |
| Деев Р.В | |||
| и др | |||
| Результаты трансплантации культуры аутогенных стромальных клеток костного мозга в область краевого дефекта длинных трубчатых костей // Травматология и Ортопедия России, 2(44), 2007 | |||
| Нечаева Ю.В., Маклакова И.А | |||
| Биоматериалы для костной пластики | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Биоматериалы | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2011-03-27—Публикация
2008-12-22—Подача