Изобретение относится к области медицины, а именно к клеточным трансплантатам для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани.
В ряде случаев заболевания или пороки развития приводят к стойкой потере костной ткани в связи с развитием различных патологических процессов [Григорьян А.С., Топоркова А.В. Проблемы интеграции имплантатов в костную ткань (теоретические аспекты). - М.: Техносфера, 2007, - 130 с.].
Хирургическое лечение дефицита и дефектов костной ткани направлено на восстановление утраченных тканей в их оригинальной гистоархитектонике и функции. В настоящее время в широкой клинической практике распространены имплантационные материалы для направленной костной регенерации. Эффективность восстановления костной ткани в таком случае при хирургическом лечении главным образом зависит от свойств имплантационных материалов, которыми замещается дефект.
Известны материалы для имплантации в ткани на основе резорбируемых и нерезорбируемых остеоиндуктивных веществ, которые могут быть минерального или биологического происхождения. Так, известна имплантация в поднадкостничную область материалов на основе коллагена, содержащих костный порошок гидроксиапатитов, трикальций-фосфатов с применением лекарственных средств - гликозамингликанов [RU 2159101 C1, 25.03.99].
Известен биосовместимый материал для стоматологии, включающий неорганические соли, коллаген, сульфатированные гликозамингликаны и воду [RU 2155024 C1, 25.11.2000].
Также широко используются различные виды костных ауто-, алло- и ксенотрансплантатов. Известно использование различного вида культур клеток, чаще фибробластов, в качестве оптимизаторов раневого заживления в хирургической пародонтологии [Fang В, Song Y, Lin Q, Zhang Y, Cao Y, Zhao R C, Ma Y. Human adipose tissue-derived mesenchymal stromal cells as salvage therapy for treatment of severe refractory acute graft-vs.-host disease in two children. Pediatr Transplant. 2007 Nov; 11(7):814-7]. Известно имплантирование культуры постнатальных фибробластов, доставляемых в область костного дефекта на носителе - синтетическом гидроксиапатите или на твердой мозговой оболочке эмбриона человека [RU 2210352 C1, 20.08.2003].
Известно применение биологического протеза на основе коллагена для устранения дефекта костной ткани, причем в качестве основы используют гемостатическую коллагеновую губку, на которую наносят аутогенный костный мозг и пропитывают ее эстрогеном в дозе 0,5 мг/кг [RU 2055535 C1, 10.03.1996].
Недостатки указанных выше имплантатов обусловлены низкой эффективностью (ограниченные показания к применению), возможными побочными эффектами. Отмечается прямая зависимость эффективности таких имплантатов от типа дефекта, например костей свода черепа или длинных трубчатых костей, поскольку первые не способны к самостоятельной регенерации вообще, а стимуляция регенерации в последних возможна только при небольших дефектах, имеющих хотя бы 3 опорные стенки [Stosich M S, Mao J J. Adipose tissue engineering from human adult stem cells: clinical implications in plastic and reconstructive surgery. Plast Reconstr Surg. 2007 Jan; 119(1):71-83].
Использование аутотрансплантатов всегда сопровождается дополнительным операционным полем для его забора и не гарантирует приживаемость в трансплантационном ложе.
Известен материал на основе композиции, включающей фибробласты в составе гидроксиапатита [RU 2210352 C1, 20.08.2003]. Использование фибробластов позволяет повысить лечебный эффект за счет стимулирующей активности клеточного компонента, способствующего сокращению сроков заживления раневой поверхности, снижению выраженности постоперационной рецессии десны и обеспечению увеличения сроков ремиссии хронического заболевания. Однако использование гидроксиапатита в качестве носителя имеет недостатки, указанные выше, что обуславливает рецидив заболевания в значительном проценте случаев, а также сопровождается снижением прочности вновь образованной кости к механическим нагрузкам. Кроме того, клеточный компонент конструкции материала используется с недостаточной эффективностью, что обусловлено короткими сроками хранения данной композиции (3-4 суток) [Lendeckel S, Jödicke A, Christophis P, Heidinger K, Wolff J, Fraser J K, Hedrick M H, Berthold L, Howaldt H P. Autologous stem cells (adipose) and fibrin glue used to treat widespread traumatic calvarial defects: case report. J Craniomaxillofac Surg. 2004 Dec; 32(6):370-3]. Таким образом, такая конструкция материала не является оптимальной для поддержания клеток в жизнеспособном состоянии в течение длительного времени, что ограничивает ее широкое применение в клинической практике.
Известна биоинженерная конструкция для закрытия костных дефектов с восстановлением в них костной ткани [RU 2416434 С1, 20.04.2011], представляющая собой гибридный имплантат в виде пористой мембраны из политетрафторэтилена с многофункциональным биосовместимым нерезорбируемым покрытием (МБНП), легированным элементами M-Ca-P-C-O-N или M-Ca-C-O-N, где М - металл, выбранный из ряда Ti, Zr, Hf, Nb, Та, на поверхности которого пассированы аутогенные или аллогенные стромальные клетки, выделенные из жировой ткани или костного мозга. Недостатком является использование сыворотки крови животных для культивирования клеток, что может привести к иммунному ответу и опасности переноса инфекции.
Известен биотрансплантат для лечения дегенеративных и травматических заболеваний костной ткани челюстно-лицевой области [RU 2380105 С1, 27.01.2010], характеризующийся тем, что содержит аутологичные или донорские мультипотентные мезенхимальные стромальные клетки (ММСК) из костного мозга или жировой ткани взрослых доноров, которые распределены в фибриновом сгустке в концентрации 5-7 млн клеток в 1 мл, представляющем собой полимеризованную обогащенную тромбоцитами плазму крови пациента, и матрицу-носитель, имеющую в основе своей структуры коллаген-минеральный комплекс, идентичный по составу натуральному костному материалу, или биосовместимый полимер. Этот биотрансплантат выбран за прототип в части объекта «вещество». Недостатком является недостаточная эффективность восстановления костной ткани, а также существует риск инфицирования прионами и возникновения иммунного ответа у пациента из-за использования эмбриональной телячьей сыворотки в составе культуральной среды.
Известен способ получения биоинженерной конструкции, заключающийся в том, что выделяют стромальные клетки из жировой ткани или костного мозга реципиента, в том числе клетки-предшественники, способные дифференцироваться в остеогенном направлении, с последующим культивированием и получением клеточной популяции, которое включает последовательно: промывку ткани в солевом растворе с антибиотиками, измельчение ткани, инкубирование в растворе 0,1% коллагеназы при 37°С и постоянном перемешивании в течение 90 мин, ингибирование выделенного фермента добавлением 10%-ной фетальной телячьей сыворотки (ФТС), отделение зрелых адипоцитов центрифугированием при 300 g в течение 10 мин, отмывку полученного клеточного осадка от фермента в среде DMEM (Sigma), содержащей 10% ФТС, фильтрование полученной суспензии клеток через нейлоновый фильтр и ее отделение центрифугированием при 400 g в течение 30 мин при комнатной температуре, тройную отмывку полученной фракции мононуклеарных клеток в виде суспензии в среде DMEM, при этом культуры клеток культивируют до первого пассирования в среде DMEM, содержащей 20% сыворотки, затем в среде DMEM, содержащей 10% ФТС, после чего культуры СКЖТ пассируют на поверхность МБНП гибридного имплантата, представляющего собой пористую мембрану из политетрафторэтилена с размерами пор 200-500 мкм, при этом МБНП легировано элементами M-Ca-P-C-O-N или M-Ca-C-O-N, где М - металл, выбранный из ряда Ti, Zr, Hf, Nb, Та, через 24 ч после пассирования поверхности МБНП среду культивирования меняют на остеогенную и проводят остеогенную стимуляцию с использованием следующего состава: среда DMEM, 10% ФТС, 0,01 мкМ 1,25-дигидроксивитамин D3 (Sigma), 50 мкМ аскорбат-2-фосфат (Sigma), 10 мМ b-глицерофосфат (Sigma), при смене среды каждые 3 суток, затем клетки культивируют в индукционной среде в течение 14 дней, после чего полученную биоинженерную конструкцию используют по назначению [RU 2416434 С1, 20.04.2011].
Известен способ получения биотрансплантата для лечения дегенеративных и травматических заболеваний костной ткани челюстно-лицевой области [RU 2380105 С1, 27.01.2010]. Получают обогащенную тромбоцитами плазму крови пациента и клеточную культуру. Источником ММСК может служить костный мозг, полученный у взрослого донора, в том числе для аутологичной трансплантации, также для получения ММСК используют жировую ткань, полученную у взрослых доноров путем липоаспирации по стандартной методике. Если выделение клеток производят не из аспиратов (костный мозг, липоаспират), а из плотных тканей, например тимуса, орган предварительно измельчают и ферментативно дезагрегируют. Суспензию фильтруют через мелкоячеистое сито из нержавеющей стали. Клеточную суспензию (аспират) разводят 1:1 солевым раствором Хэнкса, центрифугируют в режиме 1,500 × g 10 минут и ресуспендируют в ростовой среде DMEM/F12, содержащей 15% эмбриональной телячьей сыворотки, селектированной для выращивания клеток в низкой плотности, 2 мМ глутамина. Суспензию клеток высевают на пластиковые чашки Петри с диаметром 100 мм. Плотность посева первичной клеточной суспензии составляет 1-20 миллионов мононуклеарных клеток на 1 см2 в зависимости от источника выделения. Через 1 сутки не прикрепившиеся клетки удаляют, ростовую среду заменяют. Культуры инкубируют при 37°С в атмосфере 5% СО2. Через 6 дней наблюдают рост гетерогенных клеточных популяций. По достижении культурой 50% конфлуентности монослой трипсинизируют и пересевают на новые чашки с плотностью 10-30 клеток на 1 см в ростовой среде, дополнительно содержащей 10 мкг/мл трансферрина, 1 мкг/мл инсулина, 10 нг/мл фактора роста фибробластов - 2 и 8 ЕД/мл гепарина. Через 7-10 дней отбирают плотные колонии мелких клеток (диаметром 7-10 мкм) с большим количеством митозов. Отобранные колонии рассевают в новые чашки с плотностью 20 клеток/см и выращивают до состояния преконфлуентности. Замену среды производят через каждые 2 дня. Последующие пассажи производят в том же режиме.
Способ осуществляется следующим образом.
1. Создание суспензии клеточной культуры и аутоплазмы. ММСК, предназначенные для приготовления трансплантата, предварительно ферментативно дезагрегируют трипсином и вносят из расчета 5-7 млн клеток на 1 мл обогащенной тромбоцитами плазмы. Суспензию клеток в аутогенной плазме, обогащенной тромбоцитами, получают путем простого смешивания клеточной взвеси и собственно плазмы, а при необходимости с добавлением всех дополнительных компонентов при тщательном перемешивании.
2. Подготовка матрицы-носителя. Матрикс в виде блоков, стружки или крошки материала на основе коллаген-минерального комплекса или биосовместимых полимеров (например, полилактиды, полигликолиды, полигидроксиалканаты и им подобные, а также их сочетания) отмывают раствором Хэнкса с цефазолином (1 г/л). В емкости, предназначенной для изготовления трансплантата, размещают блок, крошку или стружку заданного размера и объема и еще не застывшую плазму, содержащую ММСК. Суспензию клеток в аутоплазме перемешивают с материалом. Затем по каплям добавляют раствор тромбина 50 Ед/мл на 10% растворе хлорида кальция до загустевания. Процесс полимеризации происходит при температуре 37°С в течение 30-40 минут. В дальнейшем полученную тканеинженерную конструкцию в виде биотрансплантата с застывшим фибриновым сгустком культивируют при 37°С в течение от 3 до 30 суток в остеогенной культуральной среде, которая может содержать преднизолон, витамин С, дексаметазон, витамин D (в виде различных изомеров) в зависимости от клинических задач. Таким образом, продолжительность всего технологического процесса изготовления комплекса составляет от 3 до 30 суток. Полученный на этом этапе трансплантат может быть подвержен хранению при температуре 26-37°С в атмосфере воздуха, содержащего 2-7% СО2, и насыщающей влажности в течение 3 недель.
Задачей настоящего изобретения является повышение эффективности восстановления дефицита костной ткани.
Технический результат изобретения заключается в обеспечении активного ангиогенеза с формированием мелких капилляров, средних и крупных зрелых сосудов в молодой костной ткани наряду с сохранением ее остеоиндуктивных свойств; исключении опасности иммунного ответа и переноса инфекции из-за использования эмбриональной телячьей сыворотки; сокращении сроков восстановления костной ткани.
Технический результат в части объекта «вещество» достигается за счет использования смеси ММСК, культивированных в стандартных условиях, и ММСК, дифференцированных в остеогенном направлении, взятых в соотношении 1:1 и в количестве 107 клеток на 1 г веса матрицы-носителя.
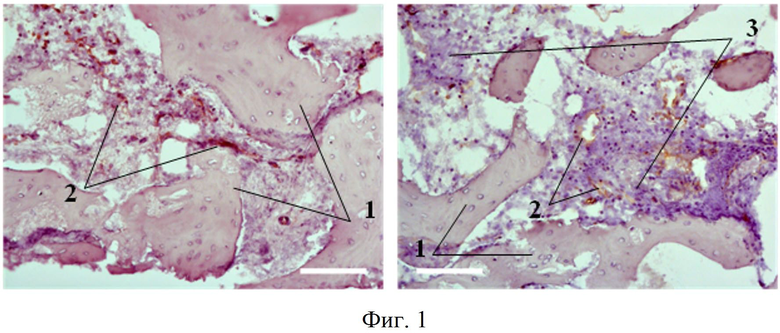
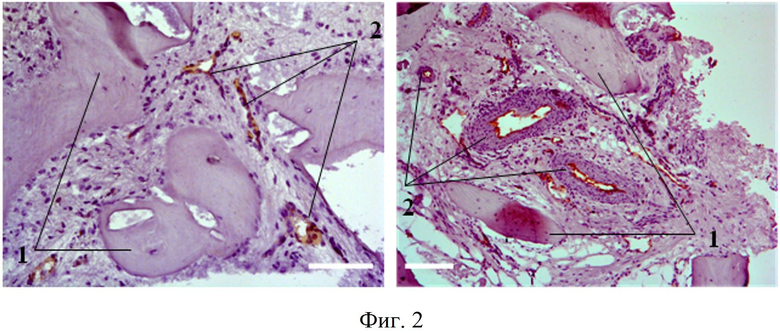
Как показала клиническая стоматологическая практика, использование биотрансплантатов (тканеинженерных конструкций), в состав которых входят ММСК, дифференцированные в остеогенном направлении, не удовлетворяет специалистов в плане качественных показателей сформированной молодой кости, а именно показателей ангиогенеза. Поскольку из данных литературы и по результатам собственных исследований авторов известно, что ММСК обладают высоким регенеративных потенциалом, в первую очередь, за счет их способности оказывать паракринный эффект на окружающие клетки, то есть за счет продукции этими клетками факторов роста, цитокинов и трофических факторов, то представлялось необходимым использовать ММСК, культивированные в стандартных условиях и обладающие вышеперечисленными свойствами, в качестве составляющей биотрансплантата. Также для повышения эффективности формирования костной ткани в его составе были использованы ММСК, дифференцированные в остеогенном направлении. Использование комбинации клеток в составе биотрансплантата позволяет параллельно решить две основные задачи при регенерации костной ткани: обеспечение трофики за счет формирования сосудов и капилляров (ММСК, культивированные в стандартных условиях) и формирование минерализованной костной ткани на месте костного дефекта (ММСК, дифференцированные в остеогенном направлении). На фиг.1 и фиг.2: 1 - вновь сформированные костные трабекулы, 2 - сосудистые структуры (коричневое окрашивание), а 3 - грануляционная ткань, свидетельствующая о воспалении. Отмечается значительное формирование костных балок и зрелых, состоящих из 3-х оболочек кровеносных сосудов.
Данные проведенных нами клинических исследований с последующим гистологическим анализом свидетельствуют о том, что использование такой комбинации достоверно увеличивает содержание формирующейся костной ткани и образование крупных кровеносных сосудов по сравнению с тканеинженерными конструкциями на основе ММСК, культивированных в стандартных условиях.
Для оценки характеристик вновь сформированной костной ткани была проведена морфометрическая оценка площади костной ткани на случайных гистологических срезах, окрашенных гематоксилином (n=270). Препараты фотографировали при помощи микроскопа Axiovert 40 (Zeiss, Германия), цветной цифровой камеры AxioCam MRC (Zeiss, Германия) и программы AxioVision 4.6. Морфометрический анализ проводили с использованием программы MetaMorph 7.1.0.0 (Universal Imaging Corporation, США).
В результате морфометрического анализа формирования костной ткани (таблица 1) при использовании биотрансплантатов на матрице-носителе «КоллапанГ» было показано, что использование смеси клеток ММСК, культивированных в стандартных условиях (AdvanceSTEMTM (HyClone)/ Antibiotic/Antimycotic Solution 100x (HyClone) с добавлением 10% аутологичной сыворотки крови пациента), с клетками ММСК, дифференцированными в остеогенном направлении в среде AdvanceSTEMTM (HyClone)/Antibiotic/Antimycotic Solution 100x (HyClone) и 10% аутологичной сыворотки крови пациента с добавлением аскорбиновой кислоты и дексаметазона, и взятых в соотношении 1:1 в количестве 107 клеток на 1 г веса матрицы-носителя, достоверно увеличивает содержание формирующейся костной ткани по сравнению с использованием тканеинженерных конструкций на основе ММСК, культивированных в стандартных условиях (AdvanceSTEMTM (HyClone)/ Antibiotic/Antimycotic Solution 100x (HyClone) и 10% аутологичной сыворотки крови пациента).
Таблица 1
*p<0.05
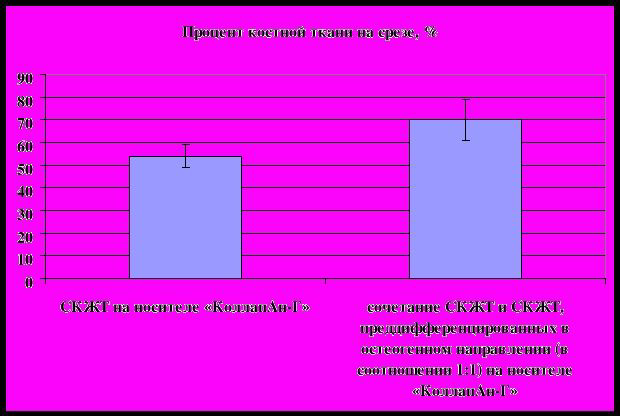
Был проведен подсчет сосудов и статистический анализ (таблица 2). Количество и размер сосудов и капилляров оценивали на случайных гистологических срезах, иммуногистохимически окрашенных антителами к маркеру эндотелиальных клеток CD31. Подсчет сосудов проводили, используя программу MetaMorph 5.0 (Universal Imaging) и Adobe PhotoShop (Adobe Systems). Плотность сосудов подсчитывали на срезах в 4-5 полях зрения (площадь поля зрения 1.107 мм2) на 3 случайных срезах для каждого образца биопсии при увеличении 100х. При этом все сосуды были разделены на 3 группы: капилляры (CD31-положительные образования без просвета или длиной менее 20 мкм), сосуды среднего диаметра (CD31-положительные образования длиной от 20 до 40 мкм), крупные сосуды (диаметром более 40 мкм); количество сосудов в каждой группе считали отдельно. Статистический анализ данных проводился с использованием программы Statistica 6.0, применялся непараметрический критерий Манна-Уитни.
Таблица 2
*p<0.01
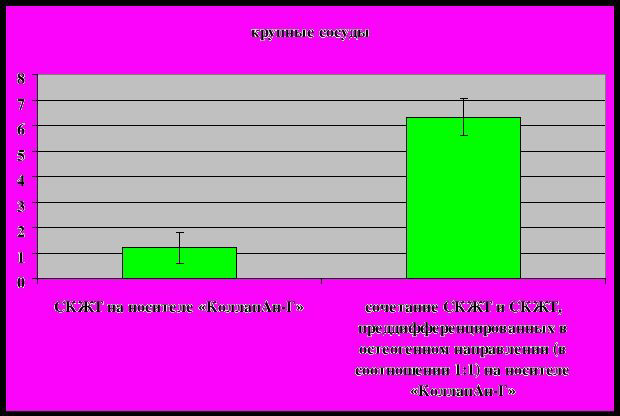
Подсчет вновь формирующихся крупных сосудов показал, что в результате использования смеси ММСК, культивированных в стандартных условиях, и ММСК, дифференцированных в остеогенном направлении, на матрице-носителе «КоллапАн-Г» достоверно увеличивается количество крупных сосудов по сравнению с использованием биотрансплантата на основе ММСК, культивированных в стандартных условиях, в сочетании с «КоллапАн-Г». Из полученных результатов можно сделать вывод о том, что использование тканеинженерной конструкции на основе смеси ММСК, взятых в соотношении 1:1 в количестве 107 клеток на 1 г веса матрицы-носителя - «КоллапАн-Г» достоверно является оптимальным с точки зрения стимуляции ангиогенеза.
Экспериментальные данные, полученные авторами, свидетельствуют о том, что соотношение мультипотентных мезенхимальных стромальных клеток, культивированных в стандартных условиях, и мультипотентных мезенхимальных стромальных клеток, дифференцированных в остеогенном направлении, 1:1 и количество клеток 107 на 1 г веса матрицы-носителя являются оптимальными с точки зрения стимулирования общих процессов регенерации и формирования кровеносных сосудов и образования молодой минерализованной кости уже через 3 месяца после трансплантации тканеинженерной конструкции.
Из описания примеров в способе-прототипе следует, что биотрансплантат устанавливают через некий промежуток времени (точные даты не указываются, а называются только месяца, поэтому можно предположить, что через месяц) после проведения КТ, которое делают через 3 месяца после введения биотрансплантата в область дефекта. Гистологическое исследование вновь сформированной костной ткани проводят при установке имплантата, т.е. еще через месяц (таким образом, проходит примерно 4 месяца с момента трансплантации тканеинженерной конструкции до установки имплантата). При этом КТ не является достаточно достоверным методом исследования, а гистологическое исследование считается «золотым стандартом». Результаты гистологического исследования молодой костной ткани, сформированной с использованием предлагаемой в настоящем исследовании тканеинженерной конструкции, трансплантация которой проводится через 3 месяца после ее введения, показывают её готовность для установки имплантата, что зафиксировано в историях болезней. Таким образом, сроки восстановления дефекта в настоящем изобретении, по сравнению со способом-прототипом сокращаются на месяц, что обусловлено присутствием в предлагаемом биотрасплантате ММСК, культивированных в стандартных условиях, которые за счет паракринной активности стимулируют регенерацию, формирование кровеносных сосудов и трофику.
Технический результат в части объекта «способ» достигается за счет того, что подготавливают аутологичную сыворотку крови пациента, после центрифугирования суспензию клеток высаживают в количестве 1×105 клеток на чашку Петри в стандартную среду культивирования AdvanceSTEM TM /Antibiotic/Antimycotic Solution 100x c добавлением 10% аутологичной сыворотки крови пациента; после первого пассажа клетки снимают с подложки и разделяют на 2 равные части: одну часть ММСК продолжают культивировать в стандартных условиях, а другую - дифференцируют в остеогенном направлении в течение 2 недель, затем клетки снимают с подложек и смешивают в соотношении 1:1; после чего их смешивают с матрицей-носителем в количестве 107 клеток на 1 г веса матрицы-носителя и инкубируют в течение суток при 37°С в атмосфере 5% СО2.
Сочетание основной питательной среды AdvanceSTEMTM (HyClone)/ Antibiotic/Antimycotic Solution 100x (HyClone) и 10% аутологичной сыворотки крови пациента при культивировании ММСК обеспечивает: а) более высокую пролиферативную активность клеток в культуре без отрицательного влияния на уровень апоптоза; б) получение культуры с лучшими, по сравнению с использованием среды DMEM + AC, показателями сохранения мультипотентных свойств, в частности, обладающей значительно более высоким потенциалом в плане индукции остеогенной дифференцировки и способности клеток к пролиферации в этих условиях (Пат. №2418855 РФ, опубл. 20.05.2011г.).
Использование среды AdvanceSTEMTM (HyClone)/ Antibiotic/Antimycotic Solution 100x (HyClone) и 10% аутологичной сыворотки крови пациента при культивировании ММСК исключает опасность инфицирования, в отличие от прототипа, в котором используется ростовая среда DMEM/F12, содержащая 15% эмбриональной телячьей сыворотки.
Суспензию клеток высаживают в количестве 1×105 клеток, так как это количество является оптимальным для пролифирации клеток в культуре.
ММСК разделяют на 2 равные части, для того, чтобы одну часть клеток культивировать в стандартных условиях, а другую часть - дифференцировать в остеогенном направлении.
ММСК, смешанные с матрицей-носителем, инкубируют в течение суток при 37°С в атмосфере 5% СО2, так как при данных условиях обеспечивается высокая степень адгезии клеток к матрице-носителю.
Описание чертежей, поясняющих изобретение
Фиг.1 - декальцинированные криосрезы биопсий, полученные после введения тканеинженерной конструкции на основе ММСК и «КоллапАн-Г». Иммуногистохимическое окрашивание антителами CD31, выявляющими сосуды; препараты докрашены гематоксилином, эозином. Масштабный отрезок 100µm.
Фиг. 2 - декальцинированные криосрезы биопсий, полученных после введения тканеинженерной конструкции на основе сочетания ММСК, культивированных в стандартных условиях, и ММСК, дифференцированных в остеогенном направлении (в соотношении 1:1), на носителе «КоллапАн-Г» Иммуногистохимическое окрашивание антителами CD31; препараты докрашены гематоксилином, эозином. Масштабный отрезок 100µm.
Способ осуществляется следующим образом.
Для приготовления аутологичной сыворотки крови пациента проводят забор крови в количестве 80 мл в пробирки с гелем для получения сыворотки крови (например, фирмы Vacuette # 455071 BD, США); при формировании кровяного сгустка пробирки с кровью центрифугируют при 400 rcf в течение 10 минут; сыворотку (желтый супернатант) отбирают в пробирку и фильтруют последовательно через фильтры 0,45 микрон и 0,22 микрона; одновременно жировую ткань, предназначенную для выделения ММСК, измельчают сосудистыми ножницами до консистенции суспензии мелких кусочков размером не более нескольких кубических миллиметров и ферментативно дезагрегируют, смешивая с растворами ферментов, например коллагеназы I типа (например, фирмы Worthington Biochemical, США) и диспазы (например, фирмы Invitrogen Corporation, Германия) при соотношении объема ткани (в мл) к объему ферментативного раствора (в мл) 1:2. После инкубации в лизирующем буфере для эритроцитов, фильтрации через нейлоновые мембраны с размером пор 40 микрон и центрифугирования суспензию клеток высаживают в количестве 1×105 клеток на чашку Петри диаметром 100 мм в стандартную среду культивирования AdvanceSTEMTM /Antibiotic/Antimycotic Solution 100x (фирма-производитель HyClone) c добавлением 10% аутологичной сыворотки крови пациента и выращивают в СО2 инкубаторе (5% СО2) при 37°C до первого пассажа. После чего ММСК снимают с подложки и разделяют на 2 равные части: одну часть клеток продолжают культивировать в стандартных условиях (AdvanceSTEMTM /Antibiotic /Antimycotic Solution 100x /10% аутологичной сыворотки крови пациента), а другую часть дифференцируют в остеогенном направлении за счет добавления в стандартную среду культивирования разрешенных Минздравсоцразвития РФ к розничной продаже в аптеках препататов: аскорбиновой кислоты в концентрации 50мг/л, регистрац. номер: Р N002218/01 от 18.03.2008 и Дексаметазона в концентрации 0.1мк/моль: П N012237/02 от 04.08.2006. Культивирование осуществляют в конфлюентном монослое в течение 2 недель, меняя среду на свежую каждые 3 дня. Затем все ММСК снимают с подложек и смешивают в соотношении 1:1. Перед использованием матрицу-носитель (коллаген-минеральный носитель, например гранулы «КоллапАн-Г») смачивают в небольшом объеме среды AdvanceSTEMTM. В емкости, предназначенной для изготовления биотрансплантата, клетки смешивают с матрицей-носителем в количестве 107 клеток на 1 г веса матрицы-носителя и инкубируют в течение суток при 37°С в атмосфере 5% СО2. Продолжительность всего технологического процесса изготовления биотрансплантата составляет от 20 до 30 суток. Полученный трансплантат должен быть использован в течение 4-8 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНОГО ОСТЕОТРАНСПЛАНТАТА | 2014 |
|
RU2574942C1 |
| СРЕДА КУЛЬТИВИРОВАНИЯ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ КУЛЬТИВИРОВАНИЯ ЭТИХ КЛЕТОК С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2418855C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| Тканеинженерная конструкция для восполнения объема костной ткани челюстно-лицевой области | 2019 |
|
RU2729365C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ КОСТНОЙ ТКАНИ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2008 |
|
RU2380105C1 |
| Тканебиоинженерная конструкция для восполнения объема костной ткани челюстных костей | 2022 |
|
RU2809154C1 |
| БИОТРАНСПЛАНТАТ НА ОСНОВЕ ПЕНОКЕРАМИЧЕСКИХ НОСИТЕЛЕЙ СИСТЕМЫ ОКСИД ЦИРКОНИЯ - ОКСИД АЛЮМИНИЯ И МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ВОССТАНОВЛЕНИЯ ПРОТЯЖЕННЫХ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2386453C1 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ КОСТНЫХ ДЕФЕКТОВ ТРУБЧАТЫХ КОСТЕЙ КРИТИЧЕСКОЙ ВЕЛИЧИНЫ | 2013 |
|
RU2545993C2 |
Изобретение относится к области медицины, а именно к клеточной трансплантологии для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани. Биотрансплантат содержит смесь аутологичных мультипотентных мезенхимальных стромальных клеток, культивированных в стандартных условиях, и мультипотентных мезенхимальных стромальных клеток, дифференцированных в остеогенном направлении, взятых в массовом соотношении 1:1 и в количестве 107 клеток на 1 г веса матрицы-носителя, имеющей в основе своей структуры коллаген-минеральный комплекс, идентичный по составу натуральному костному материалу. Способ получения биотрансплантата основан на применении среды культивирования AdvanceSTEMTM/Antibiotic/Antimycotic Solution 100x c добавлением 10% аутологичной сыворотки крови пациента. Технический результат изобретения заключается в обеспечении активного ангиогенеза с формированием мелких капилляров, средних и крупных зрелых сосудов в молодой костной ткани наряду с сохранением её остеоиндуктивных свойств; исключении опасности иммунного ответа и переноса инфекции из-за использования эмбриональной телячьей сыворотки; сокращении сроков восстановления костной ткани и ее васкуляризации. 2 н.п. ф-лы, 2 ил., 2 табл.
1. Биотрансплантат для восстановления объема костной ткани при дегенеративных заболеваниях и травматических повреждениях костей, содержащий аутологичные мультипотентные мезенхимальные стромальные клетки пациента и матрицу-носитель, имеющую в основе своей структуры коллаген-минеральный комплекс, идентичный по составу натуральному костному материалу, отличающийся тем, что содержит смесь мультипотентных мезенхимальных стромальных клеток (ММСК), культивированных в стандартных условиях, и мультипотентных мезенхимальных стромальных клеток, дифференцированных в остеогенном направлении, взятых в соотношении 1:1 и в количестве 107 клеток на 1 г веса матрицы-носителя.
2. Способ получения биотрансплантата для восстановления объема костной ткани при дегенеративных заболеваниях и травматических повреждениях костей по п.1, заключающийся в том, что подготавливают жировую ткань, полученную у пациента, измельчают, ферментативно дезагрегируют; полученную суспензию фильтруют, центрифугируют и ресуспендируют в культуральной среде; суспензию ММСК высевают на чашки Петри диаметром 100мм, инкубируют при 37°С в атмосфере 5% СО2 до первого пассажа, дифференцируют в остеогенной культуральной среде с добавлением аскорбиновой кислоты и Дексаметазона; культивирование осуществляют в конфлюентном монослое в течение 2 недель, меняя среду на свежую каждые 3 дня; матрицу-носитель, представляющую собой коллаген-минеральный комплекс, размягчают и перемешивают с суспензией клеток, отличающийся тем, что подготавливают аутологичную сыворотку крови пациента, после центрифугирования суспензию клеток высаживают в количестве 1×105 клеток на чашку Петри в стандартную среду культивирования AdvanceSTEMTM /Antibiotic/Antimycotic Solution 100x c добавлением 10% аутологичной сыворотки крови пациента; после первого пассажа клетки снимают с подложки и разделяют на 2 равные части: одну часть ММСК продолжают культивировать в стандартных условиях, а другую - дифференцируют в остеогенном направлении в течение 2 недель, затем клетки снимают с подложек и смешивают в соотношении 1:1; после чего их смешивают с матрицей-носителем в количестве 107 клеток на 1 г веса матрицы-носителя и инкубируют в течение суток при 37°С в атмосфере 5% СО2.
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ КОСТНОЙ ТКАНИ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2008 |
|
RU2380105C1 |
| БИОТРАНСПЛАНТАТ НА ОСНОВЕ ПЕНОКЕРАМИЧЕСКИХ НОСИТЕЛЕЙ СИСТЕМЫ ОКСИД ЦИРКОНИЯ - ОКСИД АЛЮМИНИЯ И МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ВОССТАНОВЛЕНИЯ ПРОТЯЖЕННЫХ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2386453C1 |
| Способ контроля выравнивания пленки в аэрофотоаппаратах | 1956 |
|
SU106528A1 |
Авторы
Даты
2014-10-10—Публикация
2012-03-01—Подача