Настоящее изобретение относится к области биотехнологии, а именно к технологии создания тканей, органов, тканеинженерных конструкций. Также настоящее изобретение относится к области медицины, а именно к биотрансплантатам для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани.
В ряде случаев заболевания или пороки развития приводят к потере костной ткани в связи с развитием различных патологических процессов [Григорьян А.С., Топоркова А.В. Проблемы интеграции имплантатов в костную ткань (теоретические аспекты). М.:Техносфера, 2007, 130 с.]. Хирургическое лечение дефицита и дефектов костной ткани направлено на восстановление утраченных тканей в их оригинальной гистоархитектонике и функции. В настоящее время, в широкой клинической практике распространены имплантационные материалы для направленной костной регенерации. Эффективность восстановления костной ткани в таком случае при хирургическом лечении, главным образом, зависит от свойств имплантационных материалов, которыми замещается дефект.
Известны материалы для имплантации в ткани на основе резорбируемых и нерезорбируемых остеоиндуктивных веществ, которые могут быть минерального или биологического происхождения. Так, известна имплантация в поднадкостничную область материалов на основе коллагена, содержащих костный порошок гидроксиапатитов, трикальцийфосфатов с применением лекарственных средств гликозаминогликанов [RU 2159101 С1, 25.03.99].
Известен биосовместимый материал для стоматологии, включающий неорганические соли, коллаген, сульфатированные гликозаминогликаны и воду [RU 2155024 С1, 25.11.2000].
Также широко используются различные виды костных ауто-, алло- и ксенотрансплантатов. Известно использование различного вида культур клеток, чаще фибробластов, в качестве оптимизаторов раневого заживления в хирургической пародонтологии [Fang В, Song Y, Lin Q, Zhang Y, Cao Y, Zhao R C, Ma Y. Human adipose tissue derived mesenchymal stromal cells as salvage therapy for treatment of severe refractory acute grafts vs. host disease in two children. Pediatr Transplant. 2007 Nov; 11(7):8147].
Ближайшим аналогом заявленного изобретения является биотрансплантат для восстановления объема костной ткани при дегенеративных заболеваниях и травматических повреждениях костей [RU 2530622]. Изобретение характеризуется тем, что содержит аутологичные мультипотентные мезенхимальные стромальные клетки пациента и матрицу-носитель, имеющую в основе своей структуры коллаген-минеральный комплекс, идентичный по составу натуральному костному материалу, отличающийся тем, что содержит смесь мультипотентных мезенхимальных стромальных клеток (ММСК), культивированных в стандартных условиях, и мультипотентных мезенхимальных стромальных клеток, дифференцированных в остеогенном направлении, взятых в соотношении 1:1 и в количестве 107 клеток на 1 г веса матрицы-носителя. В аспекте способа получения, данное изобретение характеризуется тем, что подготавливают жировую ткань, полученную у пациента, измельчают, ферментативно дезагрегируют; полученную суспензию фильтруют, центрифугируют и ресуспендируют в культуральной среде; суспензию ММСК высевают на чашки Петри диаметром 100 мм, инкубируют при 37°С в атмосфере 5% СО2 до первого пассажа, дифференцируют в остеогенной культуральной среде с добавлением аскорбиновой кислоты и Дексаметазона; культивирование осуществляют в конфлюентном монослое в течение 2 недель, меняя среду на свежую каждые 3 дня; матрицу-носитель, представляющую собой коллаген-минеральный комплекс, размягчают и перемешивают с суспензией клеток, отличающийся тем, что подготавливают аутологичную сыворотку крови пациента, после центрифугирования суспензию клеток высаживают в количестве 1×105 клеток на чашку Петри в стандартную среду культивирования AdvanceSTEMTM/Antibiotic/Antimycotic Solution 100х с добавлением 10% аутологичной сыворотки крови пациента; после первого пассажа клетки снимают с подложки и разделяют на 2 равные части: одну часть ММСК продолжают культивировать в стандартных условиях, а другую дифференцируют в остеогенном направлении в течение 2 недель, затем клетки снимают с подложек и смешивают в соотношении 1:1; после чего их смешивают с матрицей-носителем в количестве 107 клеток на 1 г веса матрицы-носителя и инкубируют в течение суток при 37°С в атмосфере 5% СО2.
Недостатком данного изобретения является низкая эффективность регенерации поврежденных тканей, обусловленная низким уровнем ангиогенеза и, как следствие, остеогенеза мультипотентных мезенхимальных стромальных клеток, находящихся в составе биотрансплантата. Причиной этого является низкая плотность заселения биотрансплантата клетками, культивированными в виде монослоя.
Таким образом, задачей заявленного изобретения является повышение уровня ангиогенеза мультипотентных мезенхимальных стромальных клеток, а также повышение эффективности регенерации поврежденных тканей при использовании биотрансплантатов для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани, содержащих мультипотентные мезенхимальные стромальные клетки и матрицу-носитель в виде биокомпозиционного материала.
Решение поставленной задачи обеспечивается тем, что клеточная культура для создания тканей, органов, тканеинженерных конструкций содержит мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов, а также тем, что биотрансплантат для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани содержит мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов и матрицу-носитель в виде биокомпозиционного материала.
Мультипотентные мезенхимальные стромальные клетки (ММСК) - мультипотентные стволовые клетки, способные дифференцироваться в остеобласты (клетки костной ткани), хондроциты (хрящевые клетки) и адипоциты (жировые клетки) [Pittenger et al., 1999; Caplan, 1991]. Данные клетки претерпевают ассиметричное деление, в результате которого одна дочерняя клетка переходит на новую ступень дифференцировки, а вторая - остается копией материнской клетки и сохраняет способность к самообновлению. После рождения и на протяжении всей жизни ММСК остаются клеточным резервом, участвующим в физиологическом обновлении тканей и патологической репарации, и присутствуют в костном мозге, жировой ткани, пульпе зуба. Во многих работах в области тканевой инженерии такие клетки были использованы в качестве источника клеток, обеспечивающих начало процесса регенерации. Первое успешное выделение ММСК костного мозга относится к 1970 году [Friedenstein et al., 1970]. В основе выделения авторы использовали принцип адгезии клеток к пластику, в данный момент наиболее точной методикой является выделение с помощью проточного цитофлуориметра или магнитного сортинга на основании экспрессии определенных поверхностных антигенов [Lee et al., 2006; Smith et al., 2004]. Фенотипически ММСК отличаются отсутствием экспрессии маркеров гемопоэтических клеток: CD34, CD45, CD14, glycophorin А и CD133. Также в ММСК отсутствует секреция МНС II, Т-клеточных костимулирующих факторов (В7-1, В7-2, CD40, CD40L), рецепторов к матриксу (CD65L, CD65P), к факторам роста (CD120A, TGFbIIR), маркеров предшественников остеогенных клеток - STRO-1, щелочная фосфатаза, остеонектин, остеокальцин. ММСК идентифицируются по экспрессии Thy-1 (CD90), CD105, VCAM-1, CD44. Также ММСК экспрессируют CD29, CD51 (интегрины) и характерные для МСК SH2, SH3. Характерными для ММСК являются виментин, фибронектин, коллаген I и III, VI типов и т.н. osteoblast-speciflc factor. Таким образом, ММСК могут служить привлекательным источником клеток для тканевой инженерии и при регенерации костной ткани [Мао, 2005].
Комитет по мезенхимальным и стромальным стволовым клеткам Международного общества клеточной терапии установил следующие стандартные критерии ММСК для научных и доклинических исследований:
1. Клетки должны обладать адгезией к стандартному пластику для культивирования in vitro при стандартных условиях культивирования.
2. Более 95% клеточной популяции должны демонстрировать экспрессию специфических поверхностных маркеров: CD105, CD73, CD90, но не CD45, CD34, CD14 или CD11b, CD79a или CD19 и HLA class II (положительная экспрессия данных маркеров допустима в количестве менее 2%).
3. Клетки должны обладать способностью к дифференцировке по остеогенному, хондрогенному и адипогенному пути.
Способность клеток к адгезии к стандартному пластику является важным свойством ММСК и уравнивает уникальные субпопуляции ММСК, так как характерна для всех их типов. Протоколы, в которых описывали ММСК, не обладающие адгезией к пластику, предлагали использование очень специфических условий культивирования. В таких случаях требуется культивирование клеток в стандартных условиях, чтобы доказать их принадлежность к популяции ММСК.
Определение экспрессии поверхностных антигенов - быстрый и точный способ идентифицировать клеточную популяцию. Для идентификации ММСК предлагают исследовать экспрессию следующих маркеров: CD105 - эндоглин, распознается MAb SH2; CD 73 - 5' нуклеотидаза, распознается MAb SH3 или SH4, и CD90, известного также как Thy-1. Чтобы не получить гетерогенную популяцию клеток, стоит проверить их на предмет экспрессии маркеров гемопоэтического ряда клеток: CD45, CD34, CD14 или CD11b, CD79a или CD19 и HLA class II (последний может экспрессироваться только при обработке культуры ММСК интерфероном-γ).
Наиболее уникальным свойством ММСК является способность к дифференцировке в трех направлениях: остеогенном, хондрогенном и адипогенном. Таким образом, клетки должны демонстрировать in vitro дифференцировку при культивировании их в стандартных условиях для дифференцировки по одному из этих путей. Дифференцировка в остеобласты может быть продемонстрирована с помощью окраски клеток ализариновым красным или по методу ван Косса. Адипогенная дифференцировка может быть показана окрашиванием Oil Red О. Дифференцировка в хондробласты может быть продемонстрирована с помощью окрашивания альциановым синим, или с помощью антител к коллагену II типа [Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Dominici, M. et al. Cytotherapy, Volume 8, Issue 4, 315-317].
Адгезивная культура мультипотентных мезенхимальных стромальных клеток представляет собой клетки, растущие двумерным монослоем на плоской поверхности. Такая культура обладает низким уровнем стабильности по той причине, что клетки, прикрепленные к подложке или матрице, контактируют с другими клетками с образованием межклеточных контактов только в одной плоскости. При длительном культивировании в монослое мультипотентные мезенхимальные стромальные клетки теряют одно из важнейших свойств - эпителио-мезенхимную пластичность [Сабурина И.Н. Эпителио-мезенхимальная пластичность мультипотентных мезенхимальных стромальных клеток в норме и патологии (экспериментальное исследование). Диссертация на соискание степени д.б.н. 2010. М. 195 с], что приводит к снижению эффективности ангиогенеза и, как следствие, остеогенеза мультипотентных мезенхимальных стромальных клеток, находящихся в составе биотрансплантата. Это, в свою очередь, приводит к снижению эффективности регенерации поврежденных тканей при использовании биотрансплантатов, содержащих мультипотентные мезенхимальные стромальные клетки для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани.
Органы и ткани имеют трехмерную клеточную организацию, в рамках которой клетки образуют сложные комплексы контактов с другими клетками и внеклеточным матриксом, формируя уникальное микроокружение. Подобные структуры могут быть получены в виде клеточных сфероидов. Наличие сформированных контактов и элементов внеклеточного матрикса, а также высокая плотность клеток в сфероидах приближает их к нативным тканям. Этим и обусловлена повышенная стабильность мультипотентных мезенхимальных стромальных клеток, культивированных в виде сфероидов, по сравнению с двухмерными клеточными культурами. Культивирование мультипотентных мезенхимальных стромальных клеток в виде сфероидов поддерживает их эпителио-мезенхимную пластичность. Это, в свою очередь, повышает эффективность ангиогенеза и, как следствие, остеогенеза мультипотентных мезенхимальных стромальных клеток, находящихся в составе биотрансплантата. Повышается эффективность регенерации поврежденных тканей при использовании биотрансплантатов, содержащих мультипотентные мезенхимальные стромальные клетки для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани.
Как вариант осуществления изобретения, мультипотентные мезенхимальные стромальные клетки могут быть культивированы в виде сфероидов со средним размером 50 - 200 мкм.
Как вариант осуществления изобретения, мультипотентные мезенхимальные стромальные клетки могут быть культивированы в виде сфероидов с гладкой поверхностью.
Как вариант осуществления изобретения, мультипотентные мезенхимальные стромальные клетки на поверхности сфероидов могут находиться в виде эпителиального фенотипа.
Настоящее изобретение также обеспечивает способ получения клеточной культуры для создания тканей, органов, тканеинженерных конструкций, содержащей мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов, который включает в себя следующие стадии:
- изолирование фрагмента ткани донора,
- перенос фрагмента ткани донора в среду, содержащую культуральную среду, аминокислоту и антибиотик, механическое измельчение фрагмента ткани донора с получением гомогената,
- инкубирование полученного гомогената в растворе протеолитических ферментов при 37°С до момента получения клеточной суспензии,
- добавление питательной среды, содержащей культуральную среду, аминокислоту, антибиотик, сыворотку крови,
- центрифугирование клеточной суспензии до момента полного осаждения клеток,
- удаление супернатанта,
- ресуспендирование выделенных клеток в питательной среде, содержащей культуральную среду, аминокислоту, антибиотик, сыворотку крови,
- культивирование выделенных клеток в монослойной культуре при 37°С в среде 5% СО2 как минимум 2 пассажа,
- дезагрегация монослоя,
- культивирование в неадгезивных условиях клеток как минимум 2-го пассажа в концентрации от 1×106 кл/мл до 5×106 кл/мл в питательной среде, содержащей культуральную среду, аминокислоту, антибиотик, сыворотку крови, фактор индукции ангиогенеза с получением клеточной культуры, содержащей мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов.
Как вариант осуществления изобретения, культивирование клеток в питательной среде, содержащей культуральную среду, аминокислоту, антибиотик, сыворотку крови, фактор индукции ангиогенеза осуществляется до момента образования гладкой поверхности сфероидов.
Как вариант осуществления изобретения, в качестве ткани донора используется жировая ткань.
Как вариант осуществления изобретения, в качестве ткани донора используется ткань пупочного канатика.
Как вариант осуществления изобретения, в качестве ткани донора используется ткань костного мозга.
Как вариант осуществления изобретения, в качестве культуральной среды используется среда DMEM.
Как вариант осуществления изобретения, в качестве культуральной среды используется среда F12.
Как вариант осуществления изобретения, в качестве культуральной среды используется смесь культуральной среды DMEM и культуральной среды F12 в соотношении 1 к 1 по объему.
Как вариант осуществления изобретения, в качестве культуральной среды используется смесь культуральной среды DMEM и культуральной среды F12 в соотношении 2 к 1 по объему.
Как вариант осуществления изобретения, в качестве культуральной среды используется среда α-МЕМ.
Как вариант осуществления изобретения, в качестве аминокислоты используется L-глутамин.
Как вариант осуществления изобретения, в качестве антибиотика используется гентамицин.
Как вариант осуществления изобретения, в качестве антибиотика используется смесь пенициллина со стрептомицином.
Как вариант осуществления изобретения, в качестве антибиотика используется амфотерицин В.
Как вариант осуществления изобретения, в качестве раствора протеолитических ферментов используется раствор коллагеназы первого типа и диспазы.
Как вариант осуществления изобретения, в качестве раствора протеолитических ферментов используется раствор коллагеназы первого типа.
Как вариант осуществления изобретения, в качестве раствора протеолитических ферментов используется раствор диспазы.
Как вариант осуществления изобретения, в качестве раствора протеолитических ферментов используется раствор трипсина.
Как вариант осуществления изобретения, в качестве раствора протеолитических ферментов используется раствор коллагеназы второго типа и диспазы.
Как вариант осуществления изобретения, в качестве раствора протеолитических ферментов используется раствор коллагеназы второго типа.
Как вариант осуществления изобретения, в качестве сыворотки крови используется эмбриональная телячья сыворотка.
Как вариант осуществления изобретения, в качестве сыворотки крови используется аутологичная сыворотка крови пациента.
Как вариант осуществления изобретения, в качестве фактора индукции ангиогенеза используется фактор роста эндотелия сосудов.
Как вариант осуществления изобретения, в качестве фактора индукции ангиогенеза используется кондиционированная среда от эндотелиальных клеток вены пупочного канатика.
Как вариант осуществления изобретения, в качестве фактора индукции ангиогенеза используется основной фактор роста фибробластов.
Настоящее изобретение также обеспечивает способ получения биотранплантата для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани, который включает в себя следующие стадии:
- стерилизация матрицы-носителя в виде биокомпозиционного материала,
- нанесение клеточной культуры, содержащей мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов, на поверхность матрицы-носителя в виде биокомпозиционного материала,
- инкубирование биокомпозиционного материала с нанесенной на его поверхность клеточной культурой, содержащей мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов, не менее 1 суток с получением биотрансплантата.
На фиг. 1 представлена фотография среза фрагмента нижней челюсти животного опытной группы на 21-ые сутки после остеоабразии и трансплантации биотрансплантата.
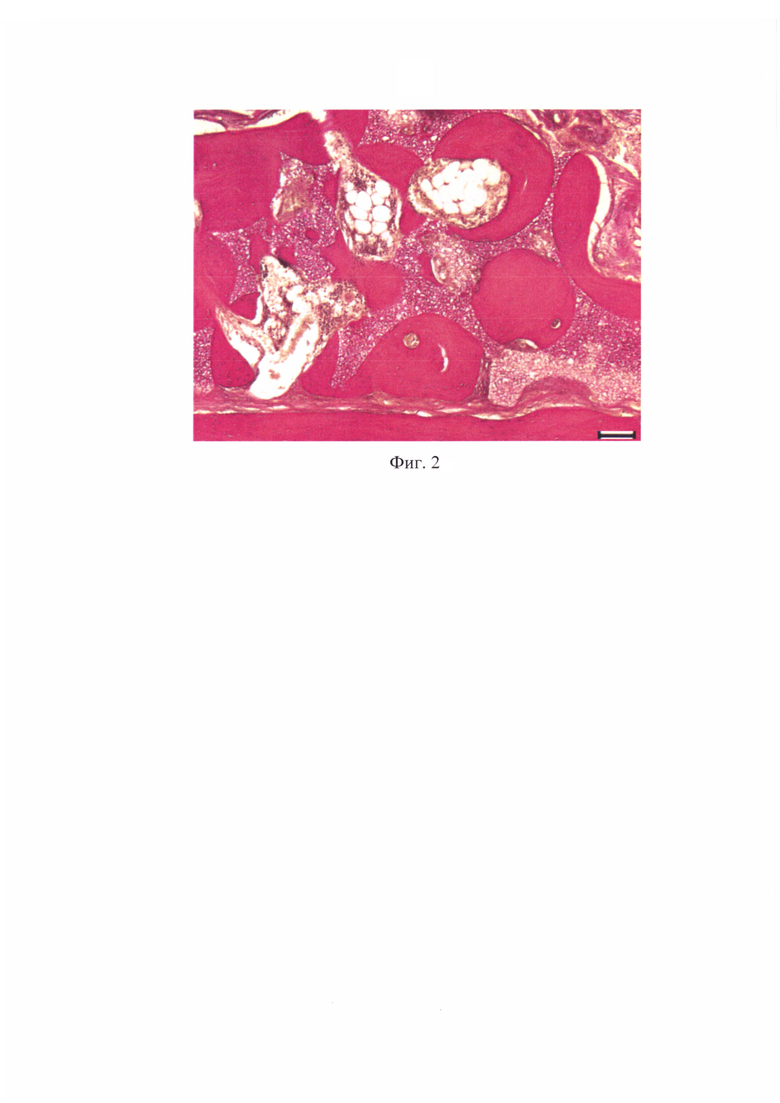
На фиг. 2 представлена фотография среза фрагмента нижней челюсти животного опытной группы на 120-е сутки после остеоабразии и трансплантации биотрансплантата.
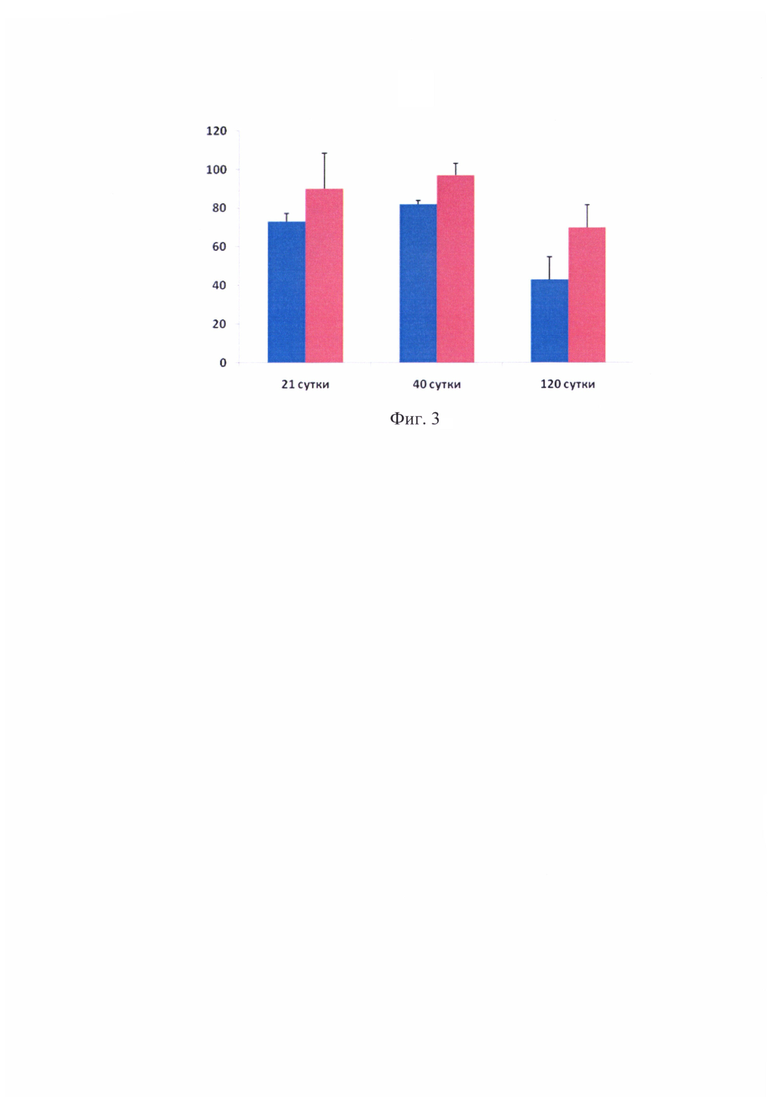
На фиг. 3 приведена диаграмма динамики изменения количества сосудов после трансплантации в группе положительного контроля (синий) и в опытной группе (красный) на разных сроках исследования.
Настоящее изобретение проиллюстрировано далее посредством следующих примеров.
Пример 1. Получение клеточной культуры для создания тканей, органов, а также тканеинженерных конструкций, содержащей мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов.
Выделение и монослойное культивирование аутологичных клеток.
Для выделения клеток стромально-сосудистой фракции у животных в процессе операции брали фрагменты ткани подкожного жира из области нижней части живота и выделяли по стандартному протоколу. Для этого, под общей анестезией рассекали кожу, отделяли гиподерму от мышц брюшной стенки, отрезали фрагмент подкожного жира и помещали его в среду для культивирования клеток, кожу зашивали. Полученную ткань в стерильных условиях измельчали, получив суспензию мелких фрагментов проводили их инкубацию в растворах коллагеназы 1-го типа (0,07%) и диспазы (0,025%) в течение 30 минут. После окончания инкубации в раствор с ферментами и тканью добавляли полную среду культивирования и центрифугировали в течение 5 мин при 1000 об/мин. Затем, слив супернатант, полученный осадок ресуспендировали в полной среде и пропускали через нейлоновый фильтр, для того чтобы избавиться от крупных фрагментов ткани. Полученную суспензию клеток помещали на чашки Петри и культивировали в течение 10 дней. Среду меняли каждые 3 дня, рассев осуществляли на 4-й и 8-й дни после выделения. Полная среда культивирования имеет следующий состав: DMEM/F12 с глутамином (ПанЭко), 1% пенициллин-стрептомицин (ПанЭко), 10% FCS (Fetal Calf Serum).
Получение клеточных сфероидов.
Из охарактеризованных монослойных 2D культур 4-ого пассажа получали 3D культуры - клеточные сфероиды с использованием специальных агарозных планшетов с лунками (Microtissue, США), посевная концентрация клеток составила 3×106 кл/мл. Агарозные планшеты помещали в 12-луночный культуральный планшет и культивировали в течение 7 суток в стандартных условиях (37°С, 5%СО2) в полной ростовой среде вышеуказанного состава с добавлением фактора роста эндотелия сосудов VEGF (10 нг/мл) для стимуляции эндотелиальных предшественников.
Характеристика полученных сфероидов. Получение полутонких срезов.
Сфероиды, зафиксированные в 3% растворе глутарового альдегида на фосфатно-солевом буфере (рН=7,4), дофиксировали 2 часа с помощью 1% OsO4 на фосфатно-солевом буфере (рН=7,4). Отмывали от фиксатора в растворе фосфатно-солевого буфера (рН=7,4), проводили по ряду восходящих спиртов: 50° (2 смены по 5 мин), 70° (ночь при +4°С), 96° (4 смены по 20 мин); обезвоживали в пропилен оксиде (5 мин), переносили в смеси пропилен оксид:аралдит 1:1 (60 мин), чистый аралдит (60 мин) и инкубировали в чистой смоле при +60°С до полной полимеризации. Полученные блоки серийно резали на ультратоме Leica ЕМ UC6 (Leica, Германия) (толщина среза 1 мкм). Срезы окрашивали 15 мин смесью толуидинового синего с бурой. При необходимости проводили дифференцировку окрашенных препаратов в воде и фоторегистрировали в видимом световом диапазоне под микроскопом Axiovert 25 (Carl Zeiss, Германия) с помощью цифровой камеры AxioCam HRC (Carl Zeiss, Германия).
Характеристика полученных сфероидов. Проточная цитофлуориметрия.
Полученные сфероиды ферментировали с применением 0.25% раствора трипсина для получения суспензии отдельных клеток. Полученную суспензию инкубировали с антителами к CD11b, CD14, CD19, CD29, CD31, CD45, CD90 и CD105 (Beckman Coulter). Анализ экспрессии проводили на проточном цитофлуориметре FC500 (Beckman Coulter, США) с помощью программного обеспечения СХР System.
Иммуноцитохимическое окрашивание
Для проведения иммуноцитохимического анализа сфероиды фиксировали в 4%-ном растворе параформальдегида (20 мин, 4°С), отмывали от фиксатора в растворе фосфатного-солевого буфера (рН=7,4; 3 смены по 5 минут) и инкубировали в течение ночи при 4°С с первичными антителами к маркерам эндотелиальных клеток CD31, Flk-1, vWF, VEGF. Затем сфероиды тщательно отмывали в растворе фосфатного-солевого буфера (рН=7,4) и инкубировали 1 час в темноте со вторичными антителами, конъюгированными с флуоресцентными метками. Ядра на препаратах докрашивали красителем бис-бензимид (Hoechst 33258, Serva). Препараты анализировали под лазерным сканирующим конфокальным микроскопом Olympus Fluoview FV10I (Olympus, Япония).
Результаты
Наблюдение за процессом формирования сфероидов при помощи прижизненной цейтраферной съемки показало, что уже в первые часы клетки формировали рыхлую структуру, которая в дальнейшем компактизировалась, и к седьмым суткам формировался плотный компактный сфероид с гладкой поверхностью. Гистологический анализ показал, что поверхность сфероидов представлена плотно упакованными уплощенными клетками, центральная зона состояла из рыхло расположенных клеток полигональной формы.
Проточная цитофлуориметрия показала, что клетки в составе сфероидов сохраняли экспрессию характерных для ММСК маркеров, в то же время повышалось количество CD34+ клеток - эндотелиальных прогениторов. Иммуноцитохимический анализ показал, что добавление в культуральную среду фактора роста эндотелия сосудов (VEGF) стимулировало появление в сфероидах ММСК, экспрессирующих маркеры эндотелиальных клеток: CD31, Flk-1, vWF, VEGF. При помещении индуцированных фактором роста эндотелия сосудов (VEGF) сфероидов в гель эндотелиальные прогениторные клетки формировали тубулоподобные ветвящиеся структуры, что доказывает ангиогенный потенциал полученных сфероидов. Таким образом, культивирование сфероидов в присутствии фактора роста эндотелия сосудов (VEGF) способствует поддержанию и активации популяции эндотелиальных прогениторов.
В результате была получена и охарактеризована клеточная культура для создания тканей, органов, а также тканеинженерных конструкций, содержащая мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов.
Пример 2. Получение биотрансплантата для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани, содержащего клеточную культуру для создания тканей, органов, а также тканеинженерных конструкций, состоящую из мультипотентных мезенхимальных стромальных клеток, культивированных в виде сфероидов.
Для получения биоинженерной конструкции брали микропористый каркас из силикатной матрицы, в которой диспергирована биоактивная фаза (гидроксиапатит) в сочетании с трехкальциевым фосфатом Са3(PO4)2 в форме блоков неправильной формы размером примерно 0.5×0.5 см. Блоки помещали по два в каждую лунку четырехлуночного стерильного планшета и насыщали сфероидами по 250 сфероидов на блок в 150 мкл среды. Планшет помещали в инкубатор на 30 мин для обеспечения адгезии сфероидов к матрице. Через 40 мин в каждую лунку осторожно добавляли полную ростовую среду, пока она не покроет края матрицы со сфероидами, биотрансплантат использовали через 3 суток после заселения.
Для получения биоинженерных конструкций использован стерильный ячеистый биосовместимый остеокондуктивный апатитосиликатный композиционный материал с пористостью 60%, размером пор 50-500 мкм, по минеральному составу близкий к минеральному матриксу губчатой костной ткани. Материал имеет микропористый каркас из силикатной основы, в которой диспергирована биоактивная фаза - гидроксиапатит Са10(PO4)6(ОН)2 или гидроксиапатит в сочетании с трехкальциевым фосфатом Са3(PO4)2.
Исследование показало, что используемый материал не цитотоксичен, адгезивен и не влияет на пролиферативную активность клеток. При заселении матрицы сфероидами к 7 суткам наблюдали лишь единичные выселившиеся клетки. На самой матрице, как на поверхности, так и в порах, к 7 суткам формировался плотный слой клеток, которые экспрессировали остеопонтин и остеокальцин - маркеры остеогенной дифференцировки. При заселении матрицы сфероидами наблюдали также появление тубулоподобных структур.
В результате был получен биотрансплантат для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани, содержащий клеточную культуру для создания тканей, органов, а также тканеинженерных конструкций, состоящую из мультипотентных мезенхимальных стромальных клеток, культивированных в виде сфероидов.
Пример 3. Исследование эффективности биотрансплантата для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани, содержащего клеточную культуру для создания тканей, органов, а также тканеинженерных конструкций, состоящую из мультипотентных мезенхимальных стромальных клеток, культивированных в виде сфероидов.
Используемый в исследовании биотрансплантат
Используемый в исследовании биотрансплантат представляет собой биокомпозиционный материал, содержащий в своей матрице мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов с гладкой поверхностью и средним размером ~100 мкм.
Экспериментальные группы для трансплантации биоинженерной конструкции.
Исследование выполнено на 36 самцах крыс линии Sprague Dawley в возрасте 3-4 месяцев со средним весом 400 гр. Животных разделили на 3 группы: в первой группе (опытная группа) проводили пересадку биотрансплантата, содержащего мультипотентные мезенхимальные стромальные клетки, культивированные в виде сфероидов, и матрицу-носитель в виде биокомпозиционного материала (12 животных). Во второй группе (положительный контроль) проводили пересадку биотрансплантата на основе матрицы - носителя в виде биокомпозиционного материала, содержащего смесь мультипотентных мезенхимальных стромальных клеток, культивированных в стандартных условиях, и мультипотентных мезенхимальных стромальных клеток, дифференцированных в остеогенном направлении. Клетки взяты в соотношении 1:1 и в количестве 107 клеток на 1 г веса матрицы-носителя (12 животных). При этом клетки в составе биоинженерной конструкции культивированы в виде монослоя. В третьей группе (отрицательный контроль) проводили операцию по остеоабразии передней поверхности нижней челюсти без применения биотрансплантатов (12 животных).
Для определения влияния используемого биотрансплантата, аутологичные образцы, соответствующие номеру экспериментального животного, пересаживали в область угла нижней челюсти, также поступали при имплантации образцов в группе положительного контроля. Для контроля вклада собственных клеток надкостницы, закрывающей костную ткань нижней челюсти, в процесс репаративного остеогенеза проводили операцию остеоабразии без внесения биотрансплантатов (отрицательный контроль). Животных выводили из эксперимента помещением в СО2-камеру. Образцы фиксировались в 10% нейтральном формалине на 7, 21, 40 и 120 сутки. Для каждой экспериментальной группы на одну временную точку приходилось по три животных.
Операции по остеоабразии передней поверхности нижней челюсти и имплантации образцов.
Под общим наркозом рассекали кожу в области левой щеки, отсепаровывали мышцу, обнажали поверхность угла нижней челюсти, скальпелем проводили абразию данной поверхности вплоть до глубины 0,1-0,2 мм. Поверхность санировали стерильным марлевым тампоном, потом аккуратно прижимая соответствующий аутологичный образец пинцетом, фиксировали его к челюсти посредством титановой проволоки, рану обрабатывали антибиотиком и послойно ушивали.
Гистологический анализ фрагментов нижней челюсти после трансплантации биоинженерной конструкции или матрицы.
Зафиксированный в 10% нейтральном формалине фрагмент нижней челюсти с трансплантированным материалом подвергали декальцификации в Трилоне Б по общепринятой методике [Саркисова, Перова, 1996]. После декальцификации из каждого образца вырезали фрагмент ткани с участком имплантата толщиной примерно 5 мм, помещали его в одноразовую кассету и подвергали обработке в автомате для гистологической обработки тканей (STP 120, MICROM INTERNATIONAL GmbH, Германия). Производили заливку в парафин и формирование блоков с использованием станции для заливки в парафин, нарезали срезы толщиной 5 мкм, которые окрашивали гематоксилин-эозином и пикрофуксином по Ван-Гизону по стандартным методикам [Саркисова, Перова, 1996].
Результаты
В опытной группе, а также в группе положительного контроля на 7 сутки после травматического повреждения контакт биокомпозиционного материала с поверхностью кости нижней челюсти животного отсутствовал, в области дефекта уже не было выявлено гематомы, но присутствовали признаки воспалительной реакции. Во всех случаях в области остеобразии над костной поверхностью в области воспалительного инфильтрата на поверхности кости были отмечены признаки репаративного остеогенеза. Различия между опытной и контрольными группами в скорости репаративных процессов, то есть в динамике увеличения доли костной части регенерата и уменьшения доли рыхлой соединительной ткани на данном этапе не зафиксированы.
В группе отрицательного контроля признаков регенерации костной ткани не обнаружено.
На 21 сутки эксперимента в опытной группе, а также в группе положительного контроля отмечена высокая активность репаративных процессов. Между костной поверхностью нижней челюсти и остеопластическим материалом сформировалась тонкая прослойка волокнистой соединительной ткани, представляющая собой тяжи коллагеновых волокон.
В опытной группе на 21 сутки признаки остеогенеза отмечены в двух независимых областях: на поверхности кости и в ячейках матрицы, расположенных в отдалении от костной поверхности, ближе к мышечному пласту (фиг. 1а). Между костной поверхностью нижней челюсти и биотрансплантатом на 21 сутки формировалась прослойка волокнистой соединительной ткани, в которой было много сосудов различного диаметра (фиг. 1б), а также умеренное количество лимфоцитов. В прилежащих к мышечной ткани ячейках отмечена высокая плотность заполнения коллагеновыми волокнами.
В группе положительного контроля в некоторых ячейках матрицы было отмечено формирование костной ткани, источниками развития которой являлись края дефекта, содержащие элементы периоста, эндоста.
В группе отрицательного контроля признаков регенерации костной ткани не обнаружено.
На 40 сутки после пересадки у животных опытной группы в центральных ячейках матрицы отмечено большое количество кровеносных сосудов различного диаметра, а также много коллагеновых волокон, местами формирующих массивные тяжи коллагена. В ячейках со стороны мышечной ткани отмечено формирование плотной волокнистой соединительной ткани, большое количество незрелых клеток.
На 40 сутки после пересадки у животных группы положительного контроля между остеопластическим материалом и костной поверхностью нижней челюсти сформировалась прослойка из волокнистой ткани, пронизанная кровеносными сосудами. В области плотного контакта пластины с костной поверхностью нижней челюсти отмечены многочисленные среднего размера костные бугорки и гребешки, а также оссификация (кальцинирование) материала между ячейками. В ячейках, контактирующих с костной поверхностью, отмечена хорошо сформированная новообразованная костная ткань. Большинство ячеек матрицы заполнены кровеносными сосудами различного диаметра, в отдельных ячейках, преимущественно центральной локализации в пластине, отмечено небольшое количество жировой ткани.
В группе отрицательного контроля на 40 сутки после операции признаков регенерации костной ткани не обнаружено.
На 120 сутки после пересадки у животных опытной группы шло активное замещение биотрансплантата сформированной и функционально активной новообразованной костной тканью: костная часть регенерата состояла из ретикулофиброзной и компактной кости (фиг. 2). Ретикулофиброзная кость была образована массивными костными трабекулами с узкими щелевидными межтрабекулярными пространствами, заполненными соединительной тканью или костным мозгом. Между матрицей и костной поверхностью нижней челюсти сформировалась прослойка из волокнистой соединительной ткани, пронизанная кровеносными сосудами.
На 120 сутки после пересадки у животных группы положительного контроля между остеопластическим материалом и костной поверхностью нижней челюсти сформировалась прослойка из волокнистой соединительной ткани, пронизанная кровеносными сосудами. Репаративные процессы кости на этих сроках наблюдения можно охарактеризовать как перестройку ретикулофиброзной (незрелой кости) в компактную (зрелую). Скорость репаративных процессов снизилась, на первый план выступали процессы минерализации и ремоделирования костной ткани в соответствии с функциональной нагрузкой костного органа.
В группе отрицательного контроля на 120 сутки практически не шел остеогенез, в большей степени сохранялись участки рыхлой соединительной ткани.
При иммуногистохимическом окрашивании срезов в опытной группе на 21, 40 и 120 сутки на всех трех сроках после трансплантации была зафиксирована экспрессия маркера зрелого сосудистого русла - фактора Фон Виллебранда и синтезируемого зрелыми остеоцитами и участвующего в минерализации костной ткани остеокальцина. В большинстве случаев, остеокальцин - позитивные клетки локализовались внутри ячеек носителя, вследствие чего предполагается, что остеокальцин экспрессировали клетки сфероидов, ранее заселенных на матрицу. На всех трех сроках исследования интенсивность синтеза остеокальцина в группе после пересадки заявленного биотрансплантата была выше по сравнению с группой положительного контроля.
Дополнительно на гистологических препаратах после трансплантации в опытной группе, а также в группе положительного контроля был произведен подсчет сосудов. Результаты приведены на фиг. 3. Количество крупных, мелких и средних сосудов достоверно выше в опытной группе, на поздних сроках происходит значительное уменьшение количества сосудов в обеих группах, однако в опытной группе данный феномен менее выражен.
Выводы.
Полученные данные, свидетельствуют о выраженном положительном влиянии клеточных сфероидов в биотрансплантате на репаративный остеогенез после абразии костной ткани за счет значимого улучшения кровоснабжения биотрансплантата. Инициацию репаративного остеогенеза на границе «трансплантат-кость» обеспечивали именно клеточные взаимодействия между привнесенными с биотрансплантатом клеточными сфероидами и реципиентным ложем.
Исходя из вышеуказанных результатов, можно сделать вывод о повышении уровня ангиогенеза мультипотентных мезенхимальных стромальных клеток, а также о повышении эффективности регенерации поврежденных тканей при использовании биотрансплантата, содержащего клеточную культуру, состоящую из мультипотентных мезенхимальных стромальных клеток, культивированных в виде сфероидов.
Список использованной литературы:
1. Zuk Р.А., Zhu М., Mizuno Н., Huang J.I., Futrell W.J., Katz A.J., Benhaim P., Lorenz H.P., Hedrick M.H. Multilineage cells from human adipose tissue: implications for cell-based therapies. // Tissue Eng. - 2001. - V. 7. - P. 211-226.
2. Rehman J., Traktuev D., Li J., Merfeld-Clauss S., Temm-Grove C.J., Bovenkerk J.E., Pell C.L., Johnstone B.H., Considine R.V., March K.L. Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells. // Circulation. - 2004. V. 109. - №10. - P. 1292-1298.
3. Микроскопическая техника Руководство для врачей и лаборантов под ред. Д.С. Саркисова и Ю.Л. Перова, Москва «Медицина» 1996, 542 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2017 |
|
RU2675930C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ОБЪЕМА КОСТНОЙ ТКАНИ ПРИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ И ТРАВМАТИЧЕСКИХ ПВОРЕЖДЕНИЯХ КОСТЕЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2530622C2 |
| Тканеинженерная конструкция для восполнения объема костной ткани челюстно-лицевой области | 2019 |
|
RU2729365C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ КОСТНОЙ ТКАНИ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2008 |
|
RU2380105C1 |
| Тканебиоинженерная конструкция для восполнения объема костной ткани челюстных костей | 2022 |
|
RU2809154C1 |
| БИОТРАНСПЛАНТАТ НА ОСНОВЕ ПЕНОКЕРАМИЧЕСКИХ НОСИТЕЛЕЙ СИСТЕМЫ ОКСИД ЦИРКОНИЯ - ОКСИД АЛЮМИНИЯ И МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК КОСТНОГО МОЗГА ЧЕЛОВЕКА ДЛЯ ВОССТАНОВЛЕНИЯ ПРОТЯЖЕННЫХ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2008 |
|
RU2386453C1 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ХРЯЩЕВОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301677C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНОГО ОСТЕОТРАНСПЛАНТАТА | 2014 |
|
RU2574942C1 |
| Способ трансплантации биокомпозитных сфероидов для обеспечения возможности восстановления целостности кости при дефектах, размеры которых превышают критические | 2020 |
|
RU2744756C1 |

Изобретение относится к области биотехнологии, а именно к клеточному сфероиду для создания костных тканей и тканеинженерных конструкций, используемых для восполнения костных дефектов, и биотрансплантату для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани. Клеточный сфероид, характеризующийся тем, что включает мультипотентные мезенхимальные стромальные клетки, индуцированные в ангиогенном направлении, помещен в полную ростовую среду, имеет сферическую форму, диаметр 50-200 мкм, гладкую поверхность. Способ получения биотрансплантата включает нанесение указанного клеточного сфероида на поверхность стерильной матрицы-носителя в виде биокомпозиционного материала и инкубирование не менее 1 суток. Изобретение позволяет повысить эффективность регенерации поврежденных тканей. 3 н. и 5 з.п. ф-лы, 3 ил., 3 пр.
1. Клеточный сфероид для создания костных тканей и тканеинженерных конструкций, используемых для восполнения костных дефектов, характеризующийся тем, что включает мультипотентные мезенхимальные стромальные клетки, индуцированные в ангиогенном направлении, помещен в полную ростовую среду, имеет сферическую форму, диаметр 50-200 мкм, гладкую поверхность.
2. Клеточный сфероид по п. 1, отличающийся тем, что мультипотентные мезенхимальные стромальные клетки являются аутологичными клетками.
3. Клеточный сфероид по п. 1, отличающийся тем, что мультипотентные мезенхимальные стромальные клетки находятся в виде эпителиального фенотипа.
4. Клеточный сфероид по п. 1, отличающийся тем, что мультипотентные мезенхимальные стромальные клетки индуцированы в ангиогенном направлении посредством фактора роста эндотелия сосудов.
5. Клеточный сфероид по п. 1, отличающийся тем, что мультипотентные мезенхимальные стромальные клетки индуцированы в ангиогенном направлении посредством кондиционированной среды от эндотелиальных клеток вены пупочного канатика.
6. Клеточный сфероид по п. 1, отличающийся тем, что мультипотентные мезенхимальные стромальные клетки индуцированы в ангиогенном направлении посредством основного фактора роста фибробластов.
7. Биотрансплантат для регенерации костной ткани при хирургическом лечении деструктивных, дегенеративно-дистрофических, травматических или врожденных поражений костной ткани, содержащий по меньшей мере один клеточный сфероид по п. 1 и матрицу-носитель в виде биокомпозиционного материала.
8. Способ получения биотранплантата по п. 7, включающий в себя следующие стадии:
- нанесение по меньшей мере одного сфероида по п. 1 на поверхность стерильной матрицы-носителя в виде биокомпозиционного материала,
- инкубирование биокомпозиционного материала с нанесенным на его поверхность клеточным сфероидом по п. 1 не менее 1 суток с получением биотрансплантата по п. 7.
| Cesarz Z | |||
| et al | |||
| "Spheroid Culture of Mesenchymal Stem Cells", Stem Cell Int | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ВОССТАНОВЛЕНИЯ ОБЪЕМА КОСТНОЙ ТКАНИ ПРИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ И ТРАВМАТИЧЕСКИХ ПВОРЕЖДЕНИЯХ КОСТЕЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2530622C2 |
| Т-КЛЕТКИ С ТРАНСДУЦИРОВАННЫМ В НИХ АНТИГЕНОМ, ПРИМЕНЯЕМЫЕ В КАЧЕСТВЕ СИСТЕМЫ ДОСТАВКИ АНТИГЕНОВ | 2003 |
|
RU2330884C2 |
| ОЖУХАРОВА И.В | |||
| УСТРОЙСТВО ДЛЯ ИЗМЕНЕНИЯ ВЕЛИЧИНЫ УСИЛЕНИЯ КАТОДНОГО РЕЛЕ В КАТОДНЫХ МУЗЫКАЛЬНЫХ ПРИБОРАХ | 1922 |
|
SU612A1 |
| Цитология | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| EDMONSON R | |||
| et al | |||
| "Three-Dimensional Cell Culture Systems and Their | |||
Авторы
Даты
2020-05-19—Публикация
2018-12-12—Подача