ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композиции с фиксированной дозой фитата и цинка в синергических соотношениях, предназначенной для применения в лечении кристаллизации гидроксиапатита.
Кроме того, изобретение относится к применению указанной композиции для изготовления лекарственного средства для лечения, профилактики и/или предупреждения кристаллизации гидроксиапатита у людей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Как правило, любой процесс патологической кристаллизации является следствием дисбаланса между тремя группами факторов: перенасыщением, промоторами (усилителями) кристаллизации (в основном, гетерогенными инициаторами зарождения центров кристаллизации) и репрессорами кристаллизации (ингибиторами кристаллизации и клеточными механизмами защиты).
Система является перенасыщенной растворенным веществом, если она содержит его в количествах, превышающих количество, устанавливаемое его произведением растворимости. Это является, таким образом, термодинамическим фактором и исключительно вопросом кинетики (то есть зависит от времени) будет то, что в конечном итоге образуется соответствующее твердое вещество.
Промоторы или гетерогенные инициаторы представляют собой вещества, которые способствуют образованию кристалла, снижая индукционный период за счет предотвращения стадии гомогенного зарождения центров кристаллизации. Таким образом, они выступают в роли кинетических факторов
Ингибиторы кристаллизации представляют собой вещества, тормозящие или предотвращающие рост кристаллов. Они могут действовать на уровне зарождения кристаллов (путем адсорбции на образующихся гомогенных или гетерогенных ядрах), на стадии роста кристаллов (путем адсорбции на поверхностях образующихся кристаллов) либо участвовать в обоих процессах одновременно Вследствие этого они также относятся к кинетическим факторам
Как известно, миоинозитгексафосфат (фитат) является наиболее эффективным ингибитором роста солей кальция, он воздействует на гетерогенное зарождение кристаллов оксалата кальция, на рост кристаллов оксалата кальция и на гомогенное и гетерогенное зарождение кристаллов фосфата кальция. Фитат вместе с пирофосфатом оказывает ингибирующее действие как на кристаллизацию брушита, так и на кристаллизацию гидроксиапатита. Оба эти соединения представляют собой две из форм, в которые может кристаллизоваться фосфат кальция, при этом последний является основным компонентом патологического обызвествления сосудов.
В последнее время показано, что фитат присутствует во всех органах, тканях и биологических жидкостях млекопитающих, и среди них - человека. Кроме того, показано, что значительное количество внеклеточного фитата, обнаруженного в органах, тканях и жидкостях млекопитающих, имеет пищевое происхождение и не является результатом эндогенного синтеза, тогда как внутриклеточный фитат (обнаруженный в значительно более низких концентрациях), возможно, образуется внутри клетки. Таким образом, уровни фитата в организме напрямую связаны с его внешним поступлением либо через прием с пищей, либо путем местного применения.
Плазма крови всегда перенасыщена фосфатом кальция вследствие величин концентрации фосфата, кальция и величины ее рН. Фактически кальцификацию зачастую обнаруживают в сердечно-сосудистой системе, она снижает подвижность кровеносных сосудов и способствует тромбозу и разрыву артерий. Когда такие процессы кальцификации появляются в сердечных клапанах, они связаны с различными расстройствами, которые, если их не лечить, могут привести к сердечной недостаточности и смерти.
Известны различные факторы риска, связанные с развитием кальцификации в коронарных артериях, к ним относятся заболевание почек, пожилой возраст, высокие уровни холестерина в плазме (уменьшение холестерина, связанного с липопротеинами высокой плотности, и увеличение холестерина, связанного с липопротеинами низкой плотности), ожирение и высокие уровни триглицеридов, цитотоксичные агенты (привычка к курению) и бактериальные инфекции
Следует учитывать, что появление сердечно-сосудистой кальцификации может начаться уже во второй декаде жизни и что коронарные кальцификации поражают 50% людей в возрасте от 40 до 49 лет и 80% людей в возрасте от 60 до 69 лет.
Точный механизм образования сосудистой кальцификации включает в себя различные стадии, хотя в большинстве случаев необходимо первичное существование поражения, выступающего в роли индуктора (гетерогенного инициатора) кальцификации (фосфата кальция, главным образом, в форме гидроксиапатита). Дальнейшее развитие кальцификации будет зависеть от баланса остальных факторов (перенасыщения, ингибиторов кристаллизации, клеточных модуляторов кальцификации).
Важным фактором предотвращения развития сердечно-сосудистой кальцификации является, таким образом, наличие ингибиторов кристаллизации. В недавно опубликованном документе показано профилактическое действие фитата на развитие сердечно-сосудистой кальцификации при местном применении фитата (см. PCT/IB2004/003588).
В другой области гидроксиапатит также аккумулируется в преддверии рта в результате обызвествления зубного налета. Зубной налет представляет собой налет на зубах, который не может быть удален водой под давлением или простым споласкиванием рта. Чистка щеткой помогает предотвратить быстрое накопление таких отложений, однако даже регулярной чистки щеткой недостаточно для того, чтобы удалить все осаждения, налипающие на зубы. Налет, прилипающий к поверхности зуба, может кальцифицироваться (кальцифицированный зубной налет) с образованием зубного камня или конкремента. Таким образом, налет является предшественником конкремента. Однако, в отличие от конкремента, налет может образовываться на любой части поверхности зуба, в частности на десневом крае. Вследствие этого присутствие налета на зубах, помимо того, что это неэстетично, может быть предшественником развития гингивита и парадонтоза. Существует прямая зависимость между количеством бактериального налета и степенью тяжести гингивита
Камень или конкремент представляет собой кальцифицированные отложения на зубах, образующиеся в результате обызвествления налета, процесса, который начинается в течение 24 - 72 часов и для завершения которого требуется в среднем 12 дней. Он состоит из органических и неорганических веществ с составом, очень сходным с составом других патологических кальцификаций, обнаруженных в организме (почечно-каменная болезнь, кальциноз кожи и так далее):
- органические вещества: в основном поступают из микроорганизмов (бактерий, грибов и так далее), которые соединяются друг с другом, образуя колонии; хотя они также могут поступать и из остатков пищи, остающихся в полости рта;
- неорганические вещества: в большинстве своем состоят из кальция и ортофосфата, присутствующих в слюне, расположенных в виде кристаллической решетки, называемой гидроксиапатит (ГАП).
Образование зубного камня протекает в два этапа. На первом этапе на зубе осаждается бактериальный налет, состоящий из живых и мертвых бактерий в окружении гелеобразного внеклеточного вещества, полученного из бактерий и слюны. На втором этапе указанный налет подвергается процессу обызвествления с образованием зубного камня. Сначала на и внутри внеклеточного вещества зубного налета начинает осаждаться аморфный фосфат кальция, который становится достаточно плотным для того, чтобы агрегат противостоял деформированию, и в итоге превращается в кристаллический ГАП. Аморфный сульфат кальция, хотя и относящийся к ГАП, отличается от него по своей кристаллической структуре, морфологии частиц и стехиометрии.
Ингибирование образования ГАП изучают посредством воздействия ингибиторов, веществ, усиливающих экскрецию, эффективных супрессоров ионов кальция и магния и/или хелатирующих агентов. Для этих целей используют дегидратированные полифосфаты, такие как растворимые в воде гексаметафосфаты, триполифосфаты, пирофосфаты и тому подобное.
Обнаружен ряд патентных документов (US 3488419; US 4215105; US 4515772), в которых используются или делаются ссылки на использование и действие таких полифосфатов, предлагаемых на сегодняшний день в составе композиций для ухода за полостью рта. Однако, как раскрыто в патентном документе US 4627977, дегидратированные полифосфаты с неразветвленной цепью в значительной степени гидролизуются в ротовой полости и/или в слюне под действием ферментов слюны (фосфатаз) до ортофосфатов, не проявляющих никакого ингибирующего действия по отношению к образованию ГАП; и хотя указанный гидролиз ослабляется при совместном использовании таких полифосфатов с фторидом (как раскрыто в патентном документе US 48084109), а также с фторид-ионом, образующим часть поликарбоксилатного полимера в патентном документе US-A-4627977, эффективная терапия для ингибирования гидроксиапатита до сих пор не найдена.
С другой стороны, в патентном документе US 5300289 описаны антимикробные композиции для ухода за полостью рта с фитатом. Описанные оральные композиции содержат фитиновую кислоту или ее фармацевтически приемлемую соль, катионное антимикробное соединение и агент, улучшающий совместимость, для контроля зубного камня, зубного налета, гингивита, периодонтита и/или неприятного запаха изо рта. В частности, описана композиция, включающая в себя: (1) от 0,001 до 10 масс.% одного или более соединений, содержащих C-O-P-связи, где соединение, содержащее C-O-P-связь, представляет собой гексакис(дигидрофосфат) миоинозита, пентакис(дигидрофосфат) миоинозита, тетракис(дигидрофосфат) миоинозита или их физиологически приемлемую соль; (2) от 0,001 до 10 масс.% одного или более катионных антимикробных соединений; (3) от 0,1 до 20 масс.% одного или более агентов, улучшающих совместимость. В качестве катионного антимикробного соединения раскрыт список из 10 возможных соединений. Агент, улучшающий совместимость, выбран из кислот и их солей со щелочными или щелочноземельными металлами, либо их смесей. Кроме того, раскрыто, что присутствие иона металла, выбранного из стронция, магния, олова, цинка, кальция или их смесей, в указанной выше композиции не приводит к осаждению фитиновой кислоты из композиции в растворе и, таким образом, добавление их в указанную выше композицию будет способствовать подавлению неприятного запаха изо рта. Молярное соотношение между указанным ионом металла и фитиновой кислотой в пероральной композиции может составлять от 4:1 до 1:4, предпочтительно от 3:1 до 1:3 и еще более предпочтительно 1:1.
Кроме того, фитат в действительности уже использовался в композициях для ухода за полостью рта. Так, в патентных документах US 4259316 и US 4335102 фитат используется в сочетании с соединением олова (II). Однако образование комплексов между фитатом и оловом является неэффективным для ингибирования формирования зубного камня.
Кроме того, в патентном документе US 3934002 фитат используют в сочетании с бис-бигуанидом в качестве средства против образования зубного налета и противокариесного агента. Однако эти два соединения взаимодействуют друг с другом, а потому они не могут быть равномерно распределены в объеме оральной композиции, причем они даже образуют две хорошо видимые фазы.
Разработано значительное количество композиций, включающих в себя различные комбинации средств против образования зубного налета и средств против воспаления десен возможно вместе с другими соединениями, такими как, например, средства против образования зубного камня, назначением которых является исключение бактериальной этиологии и факторов риска.
Однако до сих пор не существует приемлемого лечения, которое бы давало возможность ингибирования кристаллизации гидроксиапатита с хорошими результатами.
РАСКРЫТИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Проблема, которую предстоит решить с помощью настоящего изобретения, может быть сформулирована как альтернативный способ ингибирования кристаллизации гидроксиапатита у людей с неожиданными эффектами, в частности, на рост зубных камней и на кальцифицирование гидроксиапатита в артериях, венах, сердце, головном мозге, легких и коже.
Данное решение основано на композиции с фиксированной дозой фитата и цинка с синергическим действием по отношению к ингибированию кристаллизации гидроксиапатита. Комбинация фитата и цинка не описана в качестве синергической смеси, используемой против кристаллизации гидроксиапатита, также отсутствует какое-либо объяснение синергического действия между фитатом и цинком, приводящего к увеличенному ингибирующему воздействию фитата на кристаллизацию гидроксиапатита.
Определения
В контексте настоящего изобретения термины «фитат» или
«миоинозитгексафосфат» означают молекулу, отвечающую формуле
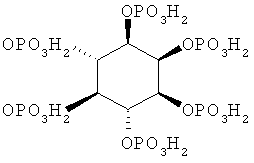
и ее соответствующие соли, включающие, но не ограничивающиеся солями натрия, калия, магния или кальция-магния.
В контексте настоящего изобретения «ингибитор кристаллизации» означает вещество, способное уменьшать либо предотвращать обызвествление.
К числу наиболее известных видов обызвествления относятся сердечно-сосудистое и щечно-зубное обызвествление либо обызвествление в других частях организма, главным образом, кальцификация, вследствие их действия удлинение периода индукции кристаллизации
В контексте настоящего изобретения «сердечно-сосудистое обызвествление» означает любой твердый конкремент на стенках кровеносного сосуда или другой части сердца.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Основной задачей настоящего изобретения является ингибирование образования гидроксиапатита. Указанная соль образует отложения в организме, которые, в основном, могут быть предотвращены или уменьшены при помощи фитата, имеющегося в организме. Однако в случае, если дело обстоит иначе, на данный момент не существует композиции, смеси или лечения, которые бы эффективно обеспечивали внешнее ингибирование гидроксиапатитного обызвествления.
Настоящее изобретение представляет композицию фитата и Zn2+ для лечения, предотвращения и/или профилактики образования гидроксиапатита в сердечно-сосудистой системе и щечно-зубной полости. Аналогичным образом настоящее изобретение представляет композицию фитата и Zn2+ для лечения, предотвращения и/или профилактики образования гидроксиапатита в суставах, молочных железах, почках, головном мозге, легких и коже, поскольку ингибирование кристаллизации соли в мягких тканях зависит от концентрации ингибитора, которая может быть достигнута в указанной ткани. Концентрации фитата в мягких тканях являются аналогичными (а в головном мозге превышают в 10 раз), так что в этих мягких тканях достигается тот же эффект, что и в тканях сердечно-сосудистой системы.
В частности, авторами настоящего изобретения установлено, что присутствие цинка в композиции фитата и цинка приводит к увеличению ингибирующего воздействия на кристаллизацию самого фитата (в то время как отдельно взятый цинк не обладает ингибирующим действием на кристаллизацию гидроксиапатита). Цинк адсорбируется на образующемся ядре кристаллизации или кристалле растущего гидроксиапатита. Так как сродство фитата к цинку превышает сродство к кальцию, адсорбция цинка на гидроксиапатите будет увеличивать сродство фитата к образующемуся ядру кристаллизации или растущему кристаллу, усиливая его ингибирующее воздействие на кристаллизацию.
Неожиданно было установлено, что композиция фитата и цинка в молярном соотношении, превышающем 4:1, приводит к увеличению ингибирующего воздействия фитата на кристаллизацию приблизительно на 40%, хотя всегда зависит от индукционного периода и молярного соотношения фитат/цинк.
Предпочтительно молярное отношение 5:1 по истечении 10 минут индукционного периода кристаллизации приводит к увеличению ингибирующего действия фитата на кристаллизацию приблизительно на 50% (см. Фиг.2).
Согласно настоящему изобретению синергическое действие композиции фитата и
Zn2+ на кристаллизацию гидроксиапатита будет показано, в частности, в Примерах 1 и 2, приведенных ниже.
Далее также будет доказано, что композиция фитата и цинка ингибирует развитие отложений гидроксиапатита на фрагментах аортального клапана человека, имплантированных крысам линии Wistar, что является удивительным. Авторами настоящего изобретения обнаружено синергическое действие композиции фитата и Zn2+, в частности, при пероральном применении, ингибирующее развитие кальциноза тканей сердечно-сосудистой системы с очень хорошими результатами (см. Пример 3).
Авторами настоящего изобретения также было изучено влияние композиции фитата и Zn2+ согласно настоящему изобретению на образование гидроксиапатита в щечно-зубной полости у пациента, подвергнутого различным типам лечения (см. Примеры 4 и 5). Целью в данном случае является увеличение ингибирующей способности слюны против кристаллизации солей кальция и предотвращение осложнений при образовании кальциевого биообызвествления за счет использования оральной композиции, включающей композицию фитата и Zn2+. Основанием для использования жидкости для полоскания рта, содержащей фитат и Zn2+, является снижение риска образования гидроксиапатитового биообызвествления, и это базируется на следующих фактах:
(1) фитат представляет собой достаточно эффективный ингибитор гомогенного и гетерогенного образования центров кристаллизации и роста кристаллов гидроксиапатита и других фосфатов кальция. Результатом этого действия является ингибирование кристаллизации гидроксиапатита, при этом предотвращается рост микрочастиц фосфата кальция, прилипающих к зубам;
(2) фитат обнаружен в слюне человека, причем его концентрация варьируется в зависимости от питания человека;
(3) у некоторых людей с дефицитом фитата в слюне могут обнаруживаться подъязычные гидроксиапатитовые камни;
(4) достоинством фитата является то, что это природный продукт, имеющийся в слюне человека и являющийся более устойчивым к действию слюнных фосфатаз, чем другие линейные полифосфаты;
(5) синергическая композиция фитата и Zn2+ показывает более значимые результаты in vitro при ингибировании кристаллизации гидроксиапатита, чем один фитат.
Вследствие этого любая фармацевтическая форма независимо от того, является ли она жидкостью для полоскания рта, витаминной добавкой или другой формой введения, содержащая синергическую композицию фитата и Zn2+ в соответствии с настоящим изобретением, включена в объем изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
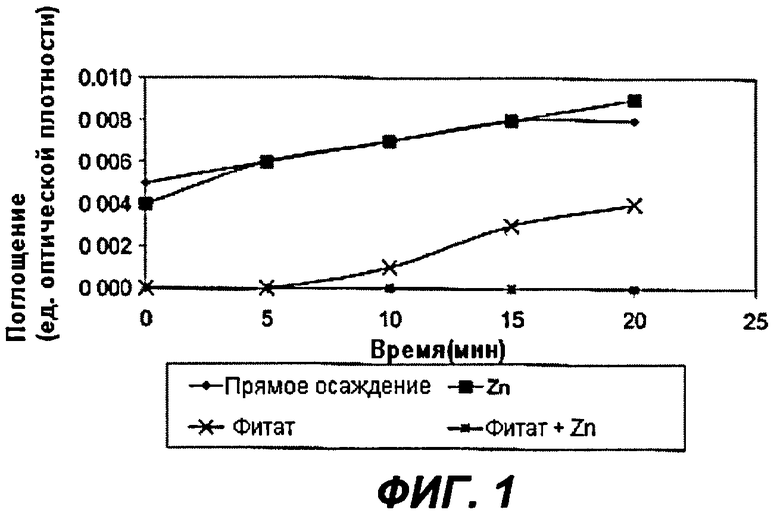
На Фиг.1 показано влияние in vitro комплекса фитата и Zn2+ на гидроксиапатит.
На Фиг.1 - первая кривая соответствует прямому осаждению в отсутствии фитата или Zn2+. Вторая кривая (Zn2+) соответствует осаждению гидроксиапатита в присутствии 0,038 мкМ Zn2+. Как можно видеть, никакого ингибирующего действия незафиксировано. Третья кривая (фитат) соответствует осаждению гидроксиапатита в присутствии 0,38 мкМ фитата. Показано значительное ингибирующее действие на кристаллизацию. И наконец, четвертая кривая
(фитат+Zn2+) соответствует осаждению в присутствии 0,38 мкМ фитата и 0,038 мкМ Zn2+ (молярное отношение фитат/Zn, 10:1). Можно видеть, что осаждение гидроксиапатита ингибируется практически полностью. Более того, это не аддитивное действие, а синергическое, поскольку сам по себе Zn не показал какого-либо ингибирующего воздействия.
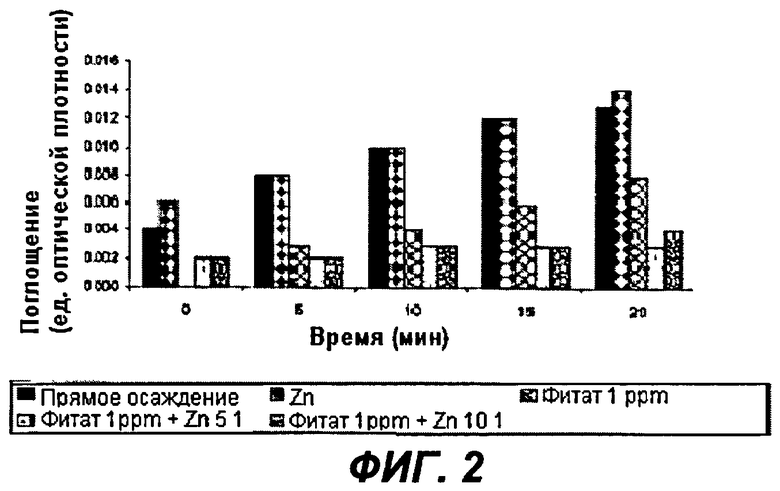
На Фиг.2 показано действие композиции фитата и Zn2+ на гидроксиапатит in vitro.
На Фиг.2 - первая серия соответствует прямому осаждению без использования фитата и Zn2+. Вторая серия соответствует осаждению гидроксиапатита в присутствии 0,3 мкМ Zn2+. Как можно видеть, никакого ингибирующего действия не отмечено. Третья серия соответствует осаждению гидроксиапатита в присутствии 1,5 мкМ фитата. Зафиксировано значительное ингибирующее действие на кристаллизацию.
И наконец, показаны две серии с использованием 1,5 мкМ фитата при двух различных концентрациях цинка Zn2+: 0,3 мкМ (молярное отношение фитат/Zn, 5:1) и 0,15 мкМ (молярное отношение фитат/Zn, 10:1). Можно видеть, что существует синергическое действие между фитатом и Zn2+, поскольку сам по себе Zn не показал какого-либо ингибирующего воздействия.
На Фиг.3 показано действие композиции фитата и Zn2+ на гидроксиапатит, образующийся в аортальных клапанах, имплантированных крысам серии Wistar. Показано также статистически значимое снижение степени кальциноза в клапанах в группе, принимавшей пищу, содержащую композицию фитат + Zn2+, по сравнению с контрольной группой, принимавшей пищу без фитата.
ПРИМЕРЫ
Настоящее изобретение дополнительно проиллюстрировано следующими примерами, не ограничивающими его объем.
Пример 1
Система in vitro была предназначена для изучения кинетики осаждения гидроксиапатита. Применяли систему, в которой использовались следующие экспериментальные условия: [фосфат] = 1,5 мкМ, [Са2+] = 60 мг/л, рН 7,5. Кинетику осаждения гидроксиапатита измеряли при помощи спектрофотометра Shimadzu (UV-120-02), используя пластиковые кюветы емкостью 3 мл и регистрируя поглощение каждые 5 минут при длине волны 550 нм. Результаты представлены на Фиг.1. Можно было наблюдать, что осаждение гидроксиапатита полностью ингибировалось в случае использования синергической композиции фитат-Zn при молярном отношении 10:1.
Пример 2
При работе с той же системой, что и в Примере 1, использовали следующие экспериментальные условия: [фосфат] = 2,5 мкМ, [Са2+] = 60 мг/л, рН 7,5. Кинетику осаждения гидроксиапатита измеряли при помощи спектрофотометра Shimadzu (UV-120-02), используя пластиковые кюветы емкостью 3 мл и регистрируя поглощение каждые 5 минут при длине волны 550 нм. Результаты представлены на Фиг.2. Можно было наблюдать, что между фитатом и Zn2+ существует синергическое действие, поскольку сам по себе цинк не проявлял какого-либо ингибирующего воздействия.
Пример 3
Двенадцать крыс-самцов линии Wistar весом приблизительно 250 г (из лаборатории Harlan Iberica s.I, Барселона, Испания) акклиматизировали в течение 7 дней в собственном виварии, в котором температура и влажность составляли 21±1°C и 60±5%, соответственно, с циклами свет:темнота длительностью 12:12 часов. Крыс размещали в клетках из органического стекла по две крысы в клетке и обеспечивали едой и питьем ad limitum (неограниченно).
После периода акклиматизации животных произвольно разделяли на 2 группы по 6 крыс: контрольную группу, обработанную только Zn2+, которую кормили рационом AIN-76A (синтетический рацион, лишенный фитата и содержащий 0,003% Zn2+), и группу, обработанную тем же рационом, но с добавлением 1% фитата в форме кальциево-магниевой соли (соотношение фитат: Zn2+ = 30:1). Через 16 дней каждому животному в брюшной отдел имплантировали по 2 фрагмента некальцифицированного аортального клапана человека. Лечение рационом продолжалось в течение еще 30 дней после имплантации. По истечении этого времени отбирали образцы мочи с интервалами в 24 часа для определения фитата, после чего животных анестезировали пентобарбиталом (50 мг/кг, интраперитонеально), клапаны извлекали и сушили
Поверхность и внутреннюю часть некоторых из имплантированных пластинок изучали при помощи электронного сканирующего микроскопа и сравнивали с фрагментами неимплантированного клапана. Были получены следующие результаты: а) поверхность неимплантированного фрагмента клапана, на которой не было видно никакой кальцификации; b) поверхность фрагмента клапана, имплантированного в течение 30 дней контрольной группе крыс, на которой был виден слой фосфата кальция с аспидной гидроксиапатитовой структурой; с) внутренняя часть фрагмента клапана, имплантированного в течение 30 дней контрольной группе крыс, на которой была видна кальцификация фосфатом кальция
Затем проводили кислотный гидролиз пластин, используя смесь кислот HNO3:HClO4, 1:1, и определяли общее количество кальция при помощи атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (ICP-AES). Результаты, выраженные в массовых % кальция во фрагменте, представлены на Фиг.3.
Операции, использованные в этом эксперименте, проводили в соответствии с Директивой 86/609/ЕЕС о защите животных, используемых для экспериментальных и научных целей, при этом официальное разрешение на проведение опыта было запрошено в Комитете по этике Университета Балеарских островов.
Уровни фитата в моче в конце исследования были статистически ниже в контрольной группе (0,08+/-0,03 мг/л), чем в обработанной группе (1,22+/-0,24 мг/л). Имплантация данных фрагментов клапанов приводила к росту кальцификаций фосфата кальция (гидроксиапатита) на поверхности внутренней стороны клапана. Было получено статистически значимое снижение степени кальцификации аортального клапана, имплантированного группе, обработанной фитатом + Zn2+, по сравнению с контрольной группой (см. Фиг.3), что подтверждает, что фитат плазмы способен ингибировать рост кальцификаций гидроксиапатита, образующихся в аортальных клапанах человека, имплантированных крысам линии Wistar.
Пример 4
Сначала было решено оценить влияние фитата на образование гидроксиапатита в щечно-зубной полости. Пациента подвергали двум различным типам лечения в течение одной недели (Таблица 1) с двумя ежедневными применениями 10 мл одной или второй жидкости для полоскания рта. Проводили качественную оценку минерализованных отложений в щечно-зубной полости, при этом было отмечено значительное визуальное уменьшение зубного камня или зубного конкремента.
Пример 5
После этого использовали жидкость для полоскания рта с меньшим содержанием фитата в сочетании с Zn2+, количественно оценивая спустя 15 дней отложения гидроксиапатита в щечно-зубной полости. Пациента подвергали двум различным типам лечения в течение двух недель (Таблица 2), дважды в день используя по 20 мл одной или второй жидкости. Делали количественную оценку минерализованных отложений в щечно-зубной полости, механически собирая отложения налета и зубного камня у пациента и фильтруя их на фильтре в стоматологической клинике, затем растворяли гидроксиапатит, присутствующий в отложениях, при помощи 1М раствора HCl и определяли кальций и фосфор с помощью атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (Optima 5300DV). В минерализованных отложениях было обнаружено уменьшение фосфора на 95,1% и кальция на 88,3%.
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕ СОДЕРЖАЩИЕ ФОСФАТОВ КОМПОЗИЦИИ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА НА ОСНОВЕ АНТИБАКТЕРИАЛЬНОГО АГЕНТА ИЗ МАГНОЛИИ | 2010 |
|
RU2533220C2 |
| Композиция зубной пасты | 2022 |
|
RU2814286C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЙ И ГИГИЕНИЧЕСКОЙ ОБРАБОТКИ ЗУБОВ, ДЕСЕН И ЯЗЫКА | 2009 |
|
RU2400211C1 |
| КОМПОЗИЦИЯ ДЛЯ РЕГУЛЯЦИИ МИКРОЭЛЕМЕНТНОГО ОБМЕНА В ПОЛОСТИ РТА | 2019 |
|
RU2722306C1 |
| КОМПОЗИЦИЯ ДЛЯ ОРАЛЬНОГО ВВЕДЕНИЯ, ПРЕДОТВРАЩАЮЩАЯ ОБРАЗОВАНИЕ КАМНЕЙ | 1991 |
|
RU2092162C1 |
| КОМПОЗИЦИИ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА, СОДЕРЖАЩИЕ ЦИНК И ФИТАТ | 2006 |
|
RU2395271C2 |
| ПРОДУКТЫ ДЛЯ УХОДА ЗА ПОЛОСТЬЮ РТА, СОДЕРЖАЩИЕ ЧЕТЫРЕХОСНОВНЫЙ ХЛОРИД ЦИНКА И ТРИМЕТИЛГЛИЦИН | 2012 |
|
RU2634269C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ СТОМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2630612C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ФОСФАТ ЦИНКА | 2017 |
|
RU2750199C2 |
| КОМПОЗИЦИЯ ДЛЯ ЧИСТКИ ЗУБОВ, СОДЕРЖАЩАЯ ОКСИД ЦИНКА И ЦИТРАТ ЦИНКА | 2014 |
|
RU2649804C1 |
Изобретение относится к композиции с фиксированной дозой фитата и цинка в виде катиона Zn2+ для изготовления лекарственного средства для лечения обызвествления, образовавшегося в результате кристаллизации гидроксиапатита, в частности для профилактики и/или предотвращения кристалллизации гидроксиапатита у людей. Показан синергизм действия компонентов композиции за счет того, что цинк адсорбируется на образующемся ядре кристаллизации гидроксиапатита, это увеличивает сродство фитата к растущему кристаллу, усиливая его ингибирующее действие на кристаллизацию. 10 з.п. ф-лы, 3 ил., 2 табл.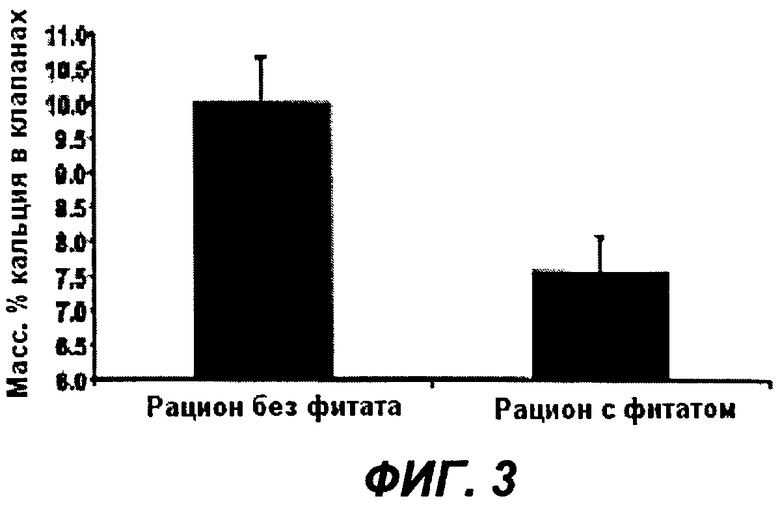
1. Применение композиции с фиксированной дозой фитата и цинка в виде катиона Zn2+ для изготовления лекарственного средства для лечения обызвествления, образовавшегося в результате кристаллизации гидроксиапатита.
2. Применение по п.1, отличающееся тем, что указанная композиция имеет молярное отношение между фитатом и цинком, превышающее 4:1.
3. Применение по п.1, отличающееся тем, что указанная композиция имеет молярное отношение между фитатом и цинком, равное 5:1.
4. Применение по п.1, отличающееся тем, что указанная композиция имеет молярное отношение между фитатом и цинком, превышающее 5:1.
5. Применение по любому из предшествующих пунктов для изготовления лекарственного средства для лечения, профилактики и/или предупреждения зубных камней.
6. Применение по любому из пп.1-4 для изготовления лекарственного средства для лечения, профилактики и/или предупреждения кальциноза сердечно-сосудистой системы.
7. Применение по п.6, отличающееся тем, что указанный кальциноз имеет место в артерии, вене и/или в сердце.
8. Применение по любому из пп.1-4 для изготовления лекарственного средства для лечения, профилактики и/или предупреждения кальциноза головного мозга.
9. Применение по любому из пп.1-4 для изготовления лекарственного средства для лечения, профилактики и/или предупреждения кальциноза легкого.
10. Применение по любому из пп.1-4 для изготовления лекарственного средства для лечения, профилактики и/или предупреждения кальциноза кожи.
11. Применение по любому из пп.1-4, отличающееся тем, что указанное лекарственное средство имеет форму жидкости для полоскания рта.
| Grases F et al | |||
| Phytate (Myo-inositol hexakisphosphate) inhibits cardiovascular calcifications in rats | |||
| Front Biosci | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Найдено из базы данных PubMed Grases F et al | |||
| Study of a myo-inositol hexaphosphate-based cream to prevent dystrophic calcinosis cutis | |||
| Br J Dermatol. | |||
Авторы
Даты
2011-04-10—Публикация
2007-02-14—Подача