Предпосылки создания изобретения
Объектом изобретения является выявление новых соединений, обладающих ценными свойствами, в особенности тех, которые могут применяться для получения лекарственных средств.
Настоящее изобретение относится к соединениям, которые принимают участие в ингибировании, регуляции и/или модуляции HSP90, кроме того, к фармацевтическим композициям, которые содержат эти соединения, и к применению соединений для лечения заболеваний, в которых задействованы HSP90.
Правильная укладка и конформация белков в клетках обеспечивается молекулярными шаперонами и является чрезвычайно важной для регуляции равновесия между синтезом и распадом белков. Шапероны являются важными для регуляции многих главных функций в клетках, таких как, например, пролиферация клеток и апоптоз (Jolly и Morimoto, 2000; Smith и др., 1998; Smith, 2001).
Белки теплового шока (HSP)
Клетки в ткани реагируют на внешние стрессы, такие как, например, нагревание, гипоксия, окислительный стресс или токсические вещества, такие как тяжелые металлы или спирты, путем активации многих шаперонов, которые известны под термином "белки теплового шока" (HSP).
Активация белков HSP в клетках при повреждении, инициируемая такими стрессовыми факторами, ускоряет восстановление физиологического состояния и приводит к стресс-толерантному состоянию в клетке. Дополнительно к первоначально открытому защитному механизму по отношению к внешнему стрессу, опосредуемому HSP, в дальнейшем также были описаны другие важные функции шаперонов для конкретных HSP в нормальных условиях без стресса. Таким образом, различные HSP регулируют, например, правильную укладку, внутриклеточную локализацию и функцию или регулируемый распад многих биологически важных белков в клетках.
HSP образуют семейство генов с отдельными генными продуктами, с помощью которых различается клеточная экспрессия, функция и локализация в различных клетках. Наименование и классификация в пределах этого семейства основывается на их молекулярном весе, например HSP27, HSP70 и HSP90.
Причиной некоторых заболеваний человека является неправильная укладка белков (см. обзор, например, Tytell и др., 2001; Smith и др., 1998). Следовательно, в таких случаях будет являться пригодным развитие терапевтических подходов, основывающихся на механизме шаперон-зависимой укладки белков. Например, некорректная укладка белков приводит к агрегации белков с нейродегенеративной прогрессией в случае болезни Альцгеймера, прионных заболеваний или синдрома Хантингтона. Неправильная укладка белков также может приводить к потере функции дикого типа, вследствие чего может происходить неправильная регуляции молекулярной и физиологической функции.
HSP также приписывают важное значение в опухолевых заболеваниях. Получены данные, указывающие на то, что, например, экспрессия определенных HSP коррелирует со стадией прогрессии опухолей (Martin и др., 2000; Conroy и др., 1996; Kawanishi и др., 1999; Jameel и др., 1992; Hoang и др., 2000; Lebeau и др., 1991).
Тот факт, что HSP90 задействованы во многих центральных онкогенных путях передачи сигналов в клетках и определенные естественные продукты, обладающие противораковым действием, нацелены на HSP90, привел к появлению концепции, что ингибирование функционирования HSP90 должно быть целесообразным при лечении опухолевых заболеваний. В настоящее время клиническое исследование проходит ингибитор HSP90, 17-аллиламино-17-деметоксигельданамицин (17AAG), производное гельданамицина.
HSP90
HSP90 составляет около 1-2% общей массы белков в клетке. Обычно он находится в виде димера в клетке и связан со многими белками, так называемыми ко-шаперонами (см., например, Pratt, 1997). HSP90 является чрезвычайно важным для жизнеспособности клеток (Young и др., 2001) и играет решающую роль в ответной реакции на клеточный стресс путем взаимодействия со многими белками, нативная укладка которых модифицирована вследствие внешнего стресса, такого как, например, тепловой шок, для восстановления исходной укладки или предотвращения агрегации белков (Smith и др., 1998).
Получены также данные, указывающие на то, что HSP90 является важным в качестве буфера против действия мутаций, предположительно, путем коррекции некорректной укладки белков, вызванной мутацией (Rutherford и Lindquist, 1998).
Дополнительно, HSP90 также является регуляторно важным. В физиологических условиях HSP90, вместе с его гомологом в эндоплазматическом ретикулуме GRP94, принимает участие в клеточном равновесии для обеспечения стабильности конформации и созревания различных взаимосвязанных с ними ключевых белков. Их можно разделить на три группы: рецепторы стероидных гормонов, Ser/Thr или тирозин киназы (например, ERBB2, RAF-1, CDK4 и LCK) и совокупность различных белков, таких как, например, мутированный р53 или каталитическая субъединица теломеразы hTPET. Каждый из этих белков является существенно важным для регуляции физиологических и биохимических процессов в клетках. Фиксированное семейство HSP90 у людей состоит из четырех генов, цитозольная HSP90α, индуцибельная изоформа HSP90β (Hickey и др., 1989), GRP94 в эндоплазматическом ретикулуме (Argon и др., 1999) и HSP75/TRAP1 в митохондриальном матриксе (Felts и др., 2000). Предполагают, что все представители этого семейства имеют сходный образ действия, однако, в зависимости от их локализации в клетке, связываются с различными взаимосвязанными с ними белками. Например, ERBB2 является специфическим взаимосвязанным белком для GRP94 (Argon и др., 1999), в то время как обнаружено, что рецептор 1 типа фактора некроза опухоли (TNFR1) или белок ретинобластомы (Rb) являются взаимосвязанными с TRAP1 (Song и др., 1995; Сhen и др., 1996).
HSP90 вовлечен в различные комплексные взаимодействия с большим количеством взаимосвязанных с ним белков и регуляторных белков (Smith, 2001). Несмотря на то, что точные молекулярные данные до сих пор еще не установлены, с помощью биохимических опытов и исследования путем кристаллографического анализа с помощью рентгеновских лучей в последние годы повысили возможность расшифровки деталей функционирования шаперонов HSP90 (Prodromou и др., 1997; Stebbins и др., 1997). Следовательно, HSP90 представляет собой АТФ-зависимый молекулярный шаперон (Prodromou и др, 1997), с димеризацией, которая является важной для гидролиза АТФ. Связывание АТФ приводит к образованию тороидальной димерной структуры, в которой два N-концевых домена вступают в тесный контакт друг с другом и действуют в качестве переключателя конформации (Prodromou и Pearl, 2000).
Известные ингибиторы HSP90
Первым открытым классом ингибиторов HSP90 были бензохиноновые анзамицины с соединениями гербимицина А и гельданамицина. Первоначально для них была идентифицирована реверсия злокачественного фенотипа в фибробластах, которая индуцируется трансформацией с v-Src онкогеном (Uehara и др., 1985).
Позже было показано сильное противоопухолевое действие в условиях in vitro (Schulte и др., 1998) и на животных моделях в условиях in vivo (Supko и др., 1995).
Затем при проведении иммунной преципитации и исследований на аффинных матрицах было показано, что в основной механизм действия гельданамицина задействовано связывание с HSP90 (Whitesell и др., 1994; Schulte и Neckers, 1998). Дополнительно при проведении кристаллографического анализа с помощью рентгеновских лучей было показано, что гельданамицин конкурирует за АТФ-связывающий сайт и ингибирует внутреннюю АТФ-азную активность HSP90 (Prodromou и др., 1997; Panaretou и др., 1998). Это предотвращает образование мультимерного HSP90 комплекса, который функционирует в качестве шаперона для взаимосвязанных с ним белков. Вследствие этого взаимосвязанные с ним белки распадаются путем убиквитин-протеасомного механизма.
Производное гельданамицина, 17-аллиламино-17-деметоксигельданамицин (17AAG), проявляет неизмененные свойства при ингибировании HSP90, деградации взаимосвязанных с ним белков и противоопухолевой активностью в клеточных культурах и на моделях ксенотрансплантированных опухолей у мышей (Schulte и др. 1998; Kelland и др. 1999), но обладает значительно сниженной цитотоксичностью на печень по сравнению с гельданамицином (Page и др., 1997). В настоящее время 17AAG проходит фазу 1/11 клинических исследований.
Радикикол, макроциклический антибиотик, также вызывает ревизию v-Src и v-Ha-Ras-индуцированного злокачественного фенотипа фибробластов (Kwon и др., 1992; Zhao и др., 1995). Радикикол разрушает большое количество сигнальных белков в результате ингибирования HSP90 (Schulte и др., 1998). С помощью кристаллографического анализа с помощью рентгеновских лучей было показано, что радикикол также связывается с N-концевым доменом HSP90 и ингибирует внутреннюю АТФ-азную активность (Roe и др., 1998).
Как известно, антибиотики кумаринового типа связываются с АТФ-связывающимся сайтом HSP90 гомолога ДНК-гиразы у бактерий. Кумарин, новобиоцин, связывается с карбокситерминальным концом HSP90, то есть с другим сайтом в HSP90, чем бензохинон-анзамицины и радикикол, которые связываются с N-терминальным концом HSP90 (Marcu и др., 2000b).
Ингибирование HSP90 новобиоцином приводит к распаду большого количества Н8Р90-зависимых сигнальных белков (Marcu и др., 2000а).
Распад сигнальных белков, например ERBB2, показан с применением PU3, ингибитора HSP90, который является производным пуринов. PU3 вызывает остановку клеточного цикла и дифференциацию клеточных линий рака молочной железы (Chiosis и др., 2001).
HSP90 в качестве терапевтической цели
Вследствие участия HSP90 в регуляции большого количества путей передачи сигналов, которые являются чрезвычайно важными для фенотипа опухоли, и открытия, что определенные природные продукты проявляют их биологическое действие путем ингибирования активности HSP90, HSP90 в настоящее время исследуется в качестве новой цели для развития противоопухолевого терапевтического средства (Neckers и др., 1999).
Основным механизмом действия гельданамицина, 17AAG и радикикола является ингибирование связывание АТФ с АТФ-связывающим сайтом в N-терминальном конце белка и результирующие ингибирование внутренней АТФ-азной активности HSP90 (см., например, Prodromou и др., 1997; Stebbins и др., 1997; Panaretou и др., 1998). Ингибирование АТФ-азной активности HSP90 предотвращает пополнение ко-шаперонами и способствует образованию HSP90 гетерокомплекса, который вызывает распад взаимосвязанных с ним белков с помощью убиквитин-протеасомного механизма (см., например, Neckers и др., 1999; Kelland и др., 1999). Лечение опухолевых клеток с помощью ингибиторов HSP90 приводит к селективному распаду важных белков, обладающих чрезвычайной значимостью при таких процессах, как пролиферация клеток, регуляция клеточного цикла и апоптоз. Это зачастую проявляется нарушением регуляции в опухолях (см., например, Hostein и др., 2001).
Благоприятным логическим обоснованием развития ингибитора HSP90 является тот факт, что можно достичь эффективного противоопухолевого действия путем одновременного распада множества белков, которые связаны с трансформированным фенотипом.
Более подробно, настоящее изобретение относится к соединениям, которые ингибируют, регулируют и/или модулируют HSP90, к композициям, которые содержат эти соединения, и к способам их применения для лечения HSP90-индуцированных заболеваний, таких как опухолевые заболевания, вирусные заболевания, такие как, например, гепатит В (Waxman, 2002); иммуносупрессия в трансплантантах (Bijlmakers, 2000. и Yorgin, 2000); заболевания, индуцированные воспалением (Bucci, 2000), такие как ревматоидний артрит, астма, рассеянный склероз, диабет I типа, красная волчанка, псориаз и воспалительное заболевание кишечника; фиброзно-кистозная дегенерация (Fuller, 2000); заболевания, связанные с ангиогенезом (Hur, 2002, и Kurebayashi, 2001), такие как, например, диабетическая ретинопатия, гемангиома, эндометриоз и опухолевый ангиогенез; инфекционные заболевания; аутоиммунные заболевания; ишемия; стимуляция регенерации нервов (Rosen и др., WO 02/09696; Degranco и др., WO 99/51223; Gold, US 6210974 Bl); фиброгенетические заболевания, такие как, например, склеродерма, болезнь Вагнера, системная волчанка, цирроз печени, келоидное образование, интерстициальный нефрит и фиброз легких (Strehlow, WO 02/02123).
Изобретение также относится к применению соединений в соответствии с изобретением для защиты нормальных клеток от токсичности, вызванной химиотерапией, и к применению при заболеваниях, основной причиной которых является неправильная укладка или агрегация белков, таких как, например, почесуха, болезнь Якоба-Крейтцфельдта, Хантингтона или Альцгеймера (Sittler, Hum. Mol. Genet., 10, 1307, 2001; Tratzelt и др., Рrос.Nat. Acad. Sci., 92, 2944, 1995; Winklhofer и др., J. Biol. Chem., 276, 45160, 2001). В заявке WO 01/72779 описаны пуриновые соединения и их применение для лечения GRP94 (гомолога или паралога НSР90)-индуцированных заболеваний, таких как опухолевые заболевания, где злокачественная ткань включает саркому или карциному, выбранную из группы, включающей фибросаркому, злокачественную миксому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиальную эндотелиому, мезотелиому, саркому Юинга, лейосаркому, рабдомиосаркому, рак ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточный рак, базально-клеточный рак, аденокарциному, рак протока потовой железы, рак клеток сальной железы, папиллярный рак, папиллярные аденокарциномы, цистаденокарциномы, рак костного мозга, бронхогенный рак, почечно-клеточный рак, печеночно-клеточную аденому, рак желчного протока, хориокарциному, сперматоцитому, эмбриональную карциному, опухоль Вильма, рак шейки матки, рак яичек, рак легких, мелкоклеточный рак легких, рак мочевого пузыря, эпителиальный рак, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому, лейкоз, лимфому, множественную миелому, макроглобулинемию Вальденстрема и болезнь тяжелых цепей.
A.Kamal и др. в Trends in Molecular Medicine, том 10, №6, июнь 2004, описали терапевтические и диагностические применения активации HSP90, в частности, для лечения заболеваний центральной нервной системы и сердечно-сосудистых заболеваний.
Следовательно, является желательным идентифицировать небольшие соединения, которые специфически ингибируют, регулируют и/или модулируют HSP90, и это является задачей настоящего изобретения.
Было обнаружено, что соединения формулы I и их соли обладают чрезвычайно ценными фармакологическими свойствами, а также хорошей переносимостью. В частности, они обладают ингибирующими свойствами по отношению к HSP90.
Следовательно, настоящее изобретение относится к соединениям формулы I в качестве лекарственных средств и/или активных компонентов лекарственных средств для лечения и/или профилактики указанных заболеваний и к применению соединений формулы I для получения лекарственного средства для лечения и/или профилактики указанных заболеваний, а также к способу лечения указанных заболеваний, который включает введение одного или более соединений формулы I пациенту, который нуждается в таком введении.
Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как, приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков; кролики; лошади; коровы, собаки, коты и т.д. Животные модели представляют интерес для экспериментальных исследований, поскольку они обеспечивают модель для лечения заболевания человека.
Уровень техники
Другие производные пиридотиофена описаны в качестве ингибиторов HSP90 в WO 2005/034950 и в WO 2005/021552.
В заявке WO 2005/00300 А1 описаны производные триазола в качестве ингибиторов HSP90.
В заявке WO 00/53169 описано ингибирование HSP90 кумарином или производным кумарина.
В заявке WO 03/041643 А2 описаны производные зеараланола, которые ингибируют HSP90.
Производные пиразола, которые ингибируют HSP90, замещенные ароматическим радикалом в 3-м или 5-м положении, описаны в заявках WO 2004/050087 А1 и WO 2004/056782 А1.
В заявке WO 03/055860 А1 описаны 3,4-диарилпиразолы в качестве ингибиторов HSP90.
Производные пурина, обладающие ингибирующими свойствами по отношению к HSP90, описаны в заявке WO 02/36075 А2.
В заявке WO 01/72779 описаны пуриновые соединения и их применение для лечения GRP94 (гомолога или паралога HSP90)-индуцированных заболеваний, таких как опухолевые заболевания, где злокачественная ткань включает саркому или карциному, выбранную из группы, включающей фибросаркому, злокачественную миксому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиальную эндотелиому, мезотелиому, саркому Юинга, лейосаркому, рабдомиосаркому, рак ободочной кишки, рак поджелудочной железы, рак молочной железы, рак яичников, рак предстательной железы, плоскоклеточный рак, базально-клеточный рак, аденокарциному, рак протока потовой железы, рак клеток сальной железы, папиллярный рак, папиллярные аденокарциномы, цистаденокарциномы, рак костного мозга, бронхогенный рак, почечно-клеточный рак, печеночно-клеточную аденому, рак желчного протока, хориокарциному, сперматоцитому, эмбриональную карциному, опухоль Вильма, рак шейки матки, рак яичек, рак легких, мелкоклеточный рак легких, рак мочевого пузыря, эпителиальный рак, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, невриному слухового нерва, олигодендроглиому, менингиому, меланому, нейробластому, ретинобластому, лейкоз, лимфому, множественную миелому, макроглобулинемию Вальденстрема и болезнь тяжелых цепей.
Кроме того, в WO 01/72779 описано применение указанных соединений для лечения вирусных заболеваний, где вирусный патоген выбран из группы, включающей гепатит типа А, гепатит типа В, гепатит типа С, грипп, ветряную оспу, аденовирус, вирус простого герпеса I типа (HSV-I), вирус простого герпеса II типа (HSV-II), чуму крупного рогатого скота, риновирус, эховирус, ротавирус, респираторно-синцитиальный вирус (RSV), папилломавирус, паповавирус, цитомегаловирус, эхиновирус, арбовирус, хунтавирус, коксаки-вирус, вирус паротита, вирус кори, вирус краснухи, вирус полиомиелита, вирус иммунодефицита человека I типа (HIV-I) и вирус иммунодефицита человека II типа (HIV-II).
Кроме того, в WO 01/72779 описано применение указанных соединений для модуляции GRP94, где модуляции биологической активности GRP94 вызывают иммунную реакцию у особи, транспортирование белка из эндоплазматического ретикулума, восстановление после гипоксического/аноксического стресса, восстановление после недостаточного питания, восстановление после теплового стресса или их комбинации, и/или где заболевание представляет собой тип злокачественного новообразования, инфекционное заболевание, расстройство, связанное с нарушенным транспортом белка из эндоплазматического ретикулума, расстройство, связанное с ишемией/реперфузией или их комбинации, где расстройство, связанное с ишемией/реперфузией, представляет собой последствие остановки сердца, асистолию и отсроченную аритмию желудочков, операцию на сердце, операцию сердечно-легочного шунтирования, пересадку органа, травму спинного мозга, травму головы, удар, тромбоэмболический удар, геморрагический удар, спазм сосудов головного мозга, гипотонию, гипогликемию, эпилептическое состояние, эпилептический припадок, тревогу, шизофрению, нейродегенеративное расстройство, болезнь Альцгеймера, болезнь Хантингтона, боковой амиотрофический склероз (ALS) или неонатальный стресс.
В завершение, в WO 01/72779 описано применение эффективного количества белкового модулятора GRP94 для приготовления лекарственного средства для изменения последующей клеточной реакции на ишемическое состояние в участке ткани особи путем обработки клеток в участке ткани белковым модулятором GRP94 для такого повышения активности GRP94 в клетках, чтобы изменялась последующая реакция клеток на ишемическое состояние, где последующее ишемическое состояние предпочтительно представляет собой последствие остановки сердца, асистолию и отсроченную аритмию желудочков, операцию на сердце, операцию сердечно-легочного шунтирования, пересадку органа, травму спинного мозга, травму головы, удар, тромбоэмболический удар, геморрагический удар, спазм сосудов головного мозга, гипотонию, гипогликемию, эпилептическое состояние, эпилептический припадок, тревогу, шизофрению, нейродегенеративное расстройство, болезнь Альцгеймера, болезнь Хантингтона, боковой амиотрофический склероз (ALS) или неонатальный стресс, или где участок ткани представляет собой донорскую ткань для трансплантации.
Сущность изобретения
Изобретение относится к соединениям формулы I
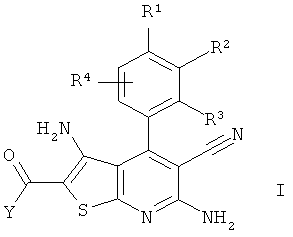
в которой Y представляет собой ОН, ОА, SH, SA, NH2, NHA, NAA′ или NHR5,
R1 представляет собой Hal, ОН, ОА, SH, SA, H или А,
R2, R3 каждый, независимо друг от друга, представляет собой -NHCO-(X)s-Q, -CONH-(X)s-Q, -CONA-(X)s-Q, -NH(CO)NH-(X)s-Q, -NH(CO)O-(X)s-Q, - NHSO2-(X)s-Q, -SO2NH-(X)s-Q, -SO2NA-(X)s-Q, -(X)s-Q или H, где,
если R2≠H, то R3=H или Cl,
или если R3≠H, то R2=H или Cl,
R4 представляет собой Н, Hal, CN, NO2, А, ОН, ОА, SH, SA, (СН2)nCOOH, (CH2)nCOOA, CONH2, CONHA, CONAA′, NH2, NHA, NAA′, NHCOOA, NHCONH2, NHCONHA, SOA, SO2A, SO2NH2, SO2NHA и/или SO2NAA′,
два смежных радикала, выбранных из группы R1, R2, R3, R4,
вместе также представляют собой метилендиокси или этилендиокси,
R5 представляет собой -(CH2)0-Het1, -(CH2)o-NH2, -(CH2)o-NHA или -(CH2)o-NA2,
А, А′ каждый, независимо друг от друга, представляет собой неразветвленный или разветвленный алкил, содержащий 1-10 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F, Cl и/или Br,
Alk или циклический алкил, содержащий 3-7 атомов углерода, А и А′ вместе также представляют собой алкиленовую цепь, содержащую 2, 3, 4, 5 или 6 атомов углерода, в которой одна или две СН2-группы могут быть заменены О, S, SO, SO2, NH, NA и/или N-СООА,
Alk представляет собой алкенил, содержащий 2-6 атомов углерода,
Х представляет собой неразветвленный или разветвленный С1-С10 алкилен или С2-С10 алкенилен, каждый из которых незамещен или одно-, дву-, три- или тетразамещен А, ОА, ОН, SH, SA, Hal, NO2, CN, Ar, OAr, COOH, COOA, CHO, C(=O)A, C(=O)Ar, SO2A, CONH2, SO2NH2, CONHA, CONAA′, SO2NHA, SO2NAA′, NH2, NHA, NAA′, OCONH2, OCONHA, OCONAA′, NHCOA, NHCOOA, NACOOA, NHSO2OA, NASO2OA, NHCONH2, NACONH2, NHCONHA, NACONHA, NHCONAA′, NACONAA′ и/или =O и в котором одна, две или три группы С могут быть заменены О, S, SO, SO2, NHCO, NACO, CONH, CONA, SO2NH, SO2NA, NHSO2, NASO2 и/или NH группами,
Q представляет собой Н, Carb, Ar или Het,
Carb представляет собой циклоалкил, содержащий 3-7 атомов углерода, или циклоалкенил, содержащий 3-7 атомов углерода, каждый из которых незамещен или одно-, дву-, три-, тетра- или пентазамещен А, ОА, ОН, SH, SA, Hal, NO2, CN, (CH2)nAr′, (СН2)nCOOH, (СН2)nCOOA, CHO, СОА, SO2A, CONH2, SO2NH2, CONHA, CONAA′, SO2NHA, SO2NAA′, NH2, NHA, NAA′, OCONH2, OCONHA, OCONAA′, NHCOA, NHCOOA, NACOOA, NHSO2OA, NASO2OA, NHCONH2, NACONH2, NHCONHA, NACONHA, NHCONAA′ и/или NACONAA′,
Ar представляет собой фенил, нафтил или бифенил, каждый из которых незамещен или одно-, дву-, три-, тетра- или пентазамещен А, ОА, ОН, SH, SA, Hal, NO2, CN, (CH2)nAr′, (CH2)nCOOH, (CH2)nCOOA, СНО, СОА, SO2A, CONH2, SO2NH2, CONHA, CONAA′, SO2NHA, SO2NAA′, NH2, NHA, NAA1, OCONH2, OCONHA, OCONAA′, NHCOA, NHCOOA, NACOOA, NHSO2OA, NASO2OA, NHCONH2, NACONH2, NHCONHA, NACONHA, NHCONAA′, NACONAA′, NHCO(CH2)nNH2 и/или -O-(CH2)o-Het1,
Ar′ представляет собой фенил, нафтил или бифенил, каждый из которых незамещен или одно-, дву- или тризамещен А, ОА, ОН, SH, SA, Hal, NO2, CN, (СН2)nфенилом, (СН2)nCOOH, (СН2)nCOOA, СНО, СОА, SO2A, CONH2, SO2NH2, CONHA, CONAA′, SO2NHA, SO2NAA′, NH2, NHA, NAA′, OCONH2, OCONHA, OCONAA′, NHCOA, NHCOOA, NACOOA, NHSO2OA, NASO2OA, NHCONH2, NACONH2, NHCONHA, NACONHA, NHCONAA′ и/или NACONAA′,
Het представляет собой моно- или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 4 атомов N, О и/или S, который может быть одно-, дву- или тризамещен А, ОА, ОН, SH, SA, Hal, NO2, CN, (CH2)nAr′, (CH2)nCOOH, (СН2)nCOOA, СНО, СОА, SO2A, CONH2, SO2NH2, CONHA, CONAA′, SO2NHA, SO2NAA′, NH2. NHA, NAA′, OCONH2, OCONHA, OCONAA′, NHCOA, NHCOOA, NACOOA, NHSO2OA, NASO2OA, NHCONH2, NACONH2, NHCONHA, NACONHA, NHCONAA′, NACONAA′, SO2A, =S, =NH, =NA и/или =O (карбонильным кислородом),
Het1 представляет собой моноциклический насыщенный гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двузамещен А, ОА, ОН, Hal и/или =O (карбонильным кислородом),
Hal представляет собой F, Cl, Br или I,
n представляет собой 0, 1, 2, 3 или 4,
о представляет собой 1, 2, 3 или 4,
s представляет собой 0 или 1,
и к их фармацевтически пригодным производным, солям, сольватам, таутомерам и стереоизомерам, включая их смеси во всех соотношениях.
Изобретение также относится к соединениям формулы I и их солям и к способу получения соединений формулы I в соответствии с пунктами 1-14 и их фармацевтически пригодных производных, сольватов, солей, таутомеров и стереоизомеров, который характеризуется тем, что
а) соединение формулы II
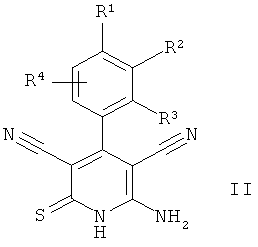
в которой R1, R2 и R3 имеют значения, указанные в пункте 1,
подвергают реакции с соединением формулы III
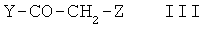
в которой Y имеет значение, указанное в пункте 1, и
Z представляет собой Cl, Br, I или свободную или реакционноспособную функционально модифицированную ОН-группу,
или
б) в котором один или несколько радикалов R1, R2, R3, R4 и/или Y в соединении формулы I превращают в один или несколько радикалов R1, R2, R3, R4 и/или Y, например, путем
i) восстановления нитрогруппы до аминогруппы,
ii) гидролиза сложноэфирной группы до карбоксильной группы,
iii) превращения аминогруппы в алкилированный амин путем восстановительного аминирования,
iv) алкилирования и/или ацилирования гидроксильной и/или аминогруппы
и/или основание или кислоту формулы I превращают в одну из его солей.
Изобретение также относится к гидратам и сольватам этих соединений. Под сольватами соединений подразумевают аддукты молекул инертного растворителя на соединениях, которые образуются благодаря их силе взаимного притяжения. Сольваты представляют собой, например, моно- или дигидраты или алкоголяты.
Соединения формулы I в соответствии с изобретением также могут существовать в таутомерных формах. Формула I охватывает все такие таутомерные формы.
Под фармацевтически пригодными производными подразумевают, например, соли соединений в соответствии с изобретением, а также так называемые пролекарства соединений.
Под производными пролекарств подразумевают соединения формулы I, которые являются модифицированными алкильной или ацильной группами, сахарами или олигопептидами и которые быстро расщепляются в организме с образованием активных соединений в соответствии с изобретением.
Это понятие также включает производные биоразлагаемых полимеров соединений в соответствии с изобретением, как описано, например, в Int. J. Pharm. 115, 61-67 (1995).
Выражение "эффективное количество" обозначает количество лекарственного средства или фармацевтического активного компонента, которое вызывает биологическую или медицинскую ответную реакцию, которую предполагает или стремится получить, например, исследователь или лечащий врач в ткани, системе, животном или человеке.
Дополнительно выражение "терапевтически эффективное количество" обозначает то количество, которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества:
улучшение лечения, излечение, предотвращение или элиминацию заболевания, картины заболевания, болезненного состояния, жалобы, расстройства или побочных действий, или также уменьшение прогрессирования заболевания, жалобы или расстройства.
Выражение "терапевтически эффективное количество" также охватывает количества, которые эффективны для повышения нормальной физиологической функции.
Изобретение также относится к смесям соединений формулы I в соответствии с изобретением, например к смесям двух диастереомеров, например, в соотношении
1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений.
Для всех радикалов, которые встречаются более одного раза, их значения являются независимыми друг от друга.
При упоминании выше и ниже, радикалы и параметры R1, R2, R3, R4 и Y имеют значения, указанные для формулы I, если специально не указано иначе.
А или А′ предпочтительно представляет собой алкил, который является неразветвленным (линейным) или разветвленным и имеет 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода. А или А′ более предпочтительно представляет собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2-триметилпропил. А или А′ наиболее предпочтительно представляет собой алкил, содержащий 1, 2, 3, 4, 5 или 6 атомов углерода, предпочтительно этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил, кроме того, также фторметил, дифторметил или бромметил.
А или А′ также представляет собой циклоалкил. Циклоалкил предпочтительно представляет собой циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
А или А′ также представляет собой Alk. Alk представляет собой алкенил, содержащий 2-6 атомов углерода, такой как, например, винил или пропенил.
Циклоалкилалкилен представляет собой, например, циклогексилметил, циклогексилэтил, циклопентилметил или циклопентилэтил.
С1-С10 алкилен предпочтительно представляет собой метилен, этилен, пропилен, бутилен, пентилен, гексилен, гептилен, октилен, нонилен или децилен, изопропилен, изобутилен, втор-бутилен, 1-, 2- или 3-метилбутилен, 1,1-, 1,2- или 2,2-диметилпропилен, 1-этилпропилен, 1-, 2-, 3- или 4-метилпентилен, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутилен, 1- или 2-этилбутилен, 1-этил-1-метилпропилен, 1-этил-2-метилпропилен, 1,1,2- или 1,2,2-триметилпропилен, более предпочтительно метилен, этилен, пропилен, бутилен, пентилен или гексилен.
Алкенилен представляет собой углеводородную цепь, содержащую 2-10 атомов углерода, имеющую 2 две свободные валентности и содержащую по меньшей мере одну двойную связь.
Ас представляет собой ацетил, Bzl представляет собой бензил, Ms представляет собой -SO2CH3.
Y предпочтительно представляет собой амино; NHA предпочтительно метиламино; NAA′ предпочтительно диметиламино или диэтиламино; NHR5 предпочтительно -NH-(CH2)o-NA2, такой как, например, 2-диметиламиноэтиламино, или -NH-(CH2)o-Het1, такой как, например, 2-(морфолин-4-ил)этиламино.
Y более предпочтительно представляет собой NH2.
R1 предпочтительно представляет собой Н, ОН или ОА, такой как, например, метокси.
R2, R3 предпочтительно каждый, независимо друг от друга, представляет собой -NHCO-(X)s-Q, -CONH-(X)s-Q, -NH(CO)NH-(X)s-Q, -NH(CO)O-(X)s-Q, -(X)s-Q или Н, где,
если R2≠Н, то R3=Н или Cl, или
если R3≠H, то R2=H или Cl.
R4 предпочтительно представляет собой H или Hal, более предпочтительно Н.
X предпочтительно представляет собой неразветвленный или разветвленный С1-С10 алкилен, который незамещен или одно-, дву-, три- или тетразамещен ОА, ОН, Hal, COOH, CONH2, NH2 и/или NHCOOA и в котором одна, две или три группы С могут быть заменены О, NHCO, CONH, SO2NH, NHSO2 и/или NH-группами.
Ar представляет собой, например, фенил, о-, м- или п-толил, о-, м- или п-этилфенил, о-, м- или п-пропилфенил, о-, м- или п-изопропилфенил, о-, м- или п-трет-бутилфенил, о-, м- или п-гидроксифенил, о-, м- или п-нитрофенил, о-, м- или п-аминофенил, о-, м- или п-(N-метиламино)фенил, о-, м- или п-(N-метиламинокарбонил)фенил, о-, м- или п-ацетамидофенил, о-, м- или п-метоксифенил, о-, м- или п-этоксифенил, о-, м- или п-этоксикарбонилфенил, о-, м- или п-(N,N-диметиламино)фенил, о-, м- или п-(N,N-диметиламинокарбонил)фенил, о-, м- или п-(N-этиламино)фенил, о-, м- или п-(N,N-диэтиламино)фенил, о-, м- или п-фторфенил, о-, м- или п-бромфенил, о-, м- или п-хлорфенил, о-, м- или п-(метилсульфонамидо)фенил, о-, м- или п-(метилсульфонил)фенил, о-, -м- или п-цианофенил, о-, м- или п-уреидофенил, о-, м- или п-формилфенил, о-, м- или п-ацетилфенил, о-, м- или п-аминосульфонилфенил, о-, м- или п-карбоксифенил, о-, -м или п-карбоксиметилфенил, о-, м- или п-карбоксиметоксифенил, более предпочтительно 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дифторфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дихлорфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дибромфенил, 2,4- или 2,5-динитрофенил, 2,5- или 3,4-диметоксифенил, 3-нитро-4-хлорфенил, 3-амино-4-хлор-, 2-амино-3-хлор-, 2-амино-4-хлор-, 2-амино-5-хлор- или 2-амино-6-хлорфенил, 2-нитро-4-N,N-диметиламино- или 3-нитpo-4-N,N-диметиламинофенил, 2,3-диаминофенил, 2,3,4-, 2,3,5-, 2,3,6-, 2,4,6- или 3,4,5- трихлорфенил, 2,4,6-триметоксифенил, 2-гидрокси-3,5-дихлорфенил, n-йодфенил, 3,6-дихлор-4-аминофенил, 4-фтор-3-хлорфенил, 2-фтор-4-бромфенил, 2,5-дифтор-4-бромфенил, 3-бром-6-метоксифенил, 3-хлор-6-метоксифенил, 3-хлор-4-ацетамидофенил, 3-фтор-4-метоксифенил, 3-амино-6-метилфенил, 3-хлор-4-ацетамидофенил или 2,5-диметил-4-хлорфенил.
Ar предпочтительно представляет собой фенил, который незамещен или одно-, дву-, три-, тетра- или пентазамещен A, Hal, OA, (СН2)nCOOH, (СН2)nCOOA, NHCO(CH2)nNH2 и/или -O-(CH2)o-Het1.
Ar более предпочтительно представляет собой фенил, который незамещен или одно- или двузамещен A, Hal, (СН2)nCOOH, (СН2)nCOOA, NHCO(CH2)nNH2 и/или-O-(СН2)o-Het1.
Ar′ предпочтительно представляет собой, например, фенил, который незамещен или одно-, дву- или тризамещен Hal.
Независимо от дальнейших замещений Het представляет собой, например, 2- или 3-фурил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, 1-, 2, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, более предпочтительно 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -3- или 5-ил, 1- или 5-тетразолил, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил, 1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3- или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 3- или 4-пиридазинил, пиразинил, 1-, 2-, 3-, 4-, 5-, 6- или 7-индолил, 4- или 5-изоиндолил, 1-, 2-, 4- или 5-бензимидазолил, 1-, 2-, 3-, 4-, 5-, 6- или 7-индазолил, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-, 4-, 5-, 6- или 7-бензизоксазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил, 2-, 4-, 5-, 6- или 7-бензизотиазолил, 4-, 5-, 6- или 7-бенз-2,1,3-оксадиазолил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 5-, 6-, 7- или 8-хиназолинил, 5- или 6-хиноксалинил, 2-, 3-, 5-, 6-, 7- или 8-2Н-бензо-1,4-оксазинил, более предпочтительно 1,3-бенздиоксол-5-ил, 1,4-бенздиоксан-6-ил, 2,1,3-бензотиадиазол-4- или -5-ил или 2,1,3-бензоксадиазол-5-ил.
Гетероциклические радикалы также могут быть частично или полностью гидрированы.
Het также может представлять собой, например, 2,3-дигидро-2-, -3-, -4- или -5-фурил, 2,5-дигидро-2-, -3-, -4- или 5-фурил, тетрагидро-2- или -3-фурил, 1,3-диоксолан-4-ил, тетрагидро-2- или -3-тиенил, 2,3-дигидро-1-, -2-, -3-, -4- или -5-пирролил, 2,5-дигидро-1-, -2-, -3-, -4- или -5-пирролил, 1-, 2- или 3-пирролидинил, тетрагидро-1-, -2- или -4-имидазолил, 2,3-дигидро-1-, -2-, -3-, -4- или -5-пиразолил, тетрагидро-1-, -3- или -4-пиразолил, 1,4-дигидро-1-, -2-, -3- или -4-пиридил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5- или-6- пиридил, 1-, 2-, 3- или 4-пиперидинил, 2-, 3- или 4-морфолинил, тетрагидро-2-, -3- или -4-пиранил, 1,4-диоксанил, 1,3-диоксан-2-, -4- или -5-ил, гексагидро-1-, -3- или -4-пиридазинил, гексагидро-1-, -2-, -4- или -5-пиримидинил, 1-, 2- или 3-пиперазинил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- или -8-хинолил, 1,2,3,4-тетрагидро-1-, -2-, -3-, -4-, -5-, -6-, -7- или -8-изохинолил, 2-, 3-, 5-, 6-, 7- или 8-3,4-дигидро-2Н-бензо-1,4-оксазинил, более предпочтительно 2,3-метилендиоксифенил, 3,4-метилендиоксифенил, 2,3-этилендиоксифенил, 3,4-этилендиоксифенил, 3,4-(дифторметилендиокси)фенил, 2,3-дигидробензофуран-5- или 6-ил, 2,3-(2-оксометилендиокси)фенил или также 3,4-дигидро-2Н-1,5-бенздиоксепин-6- или -7-ил, более предпочтительно 2,3-дигидробензофуранил или 2,3-дигидро-2-оксофуранил.
Het предпочтительно представляет собой моно- или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 4 атомов N, О и/или S, который может быть одно-, дву- или тризамещен А, ОА, Hal и/или =O (карбонильным кислородом).
Het более предпочтительно представляет собой моно- или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двузамещен А и/или =O (карбонильным кислородом), где А предпочтительно представляет собой метил, этил, пропил, бутил, пентил, гексил, изопропил или трифторметил.
В дальнейшем варианте осуществления изобретения Het более предпочтительно представляет собой пиперидин, пиперазин, пирролидин, пиридин, пиррол, индол, индазол, морфолин или изоксазол, каждый из которых незамещен или одно- или двузамещен А и/или =O, где А предпочтительно представляет собой метил, этил, пропил, бутил, пентил, гексил, изопропил или трифторметил.
Het1 предпочтительно представляет собой моноциклический насыщенный гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двузамещен А и/или =O (карбонильным кислородом), наиболее предпочтительным является 4-метилпиперазинил.
Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут встречаться в разных стереоизомерных формах. Формула I охватывает все эти формы.
Таким образом, изобретение относится, в частности, к соединениям формулы I, в которой по меньшей мере один из указанных радикалов имеет одно из предпочтительных значений, указанных выше. Некоторые предпочтительные группы соединений могут быть представлены следующими подформулами Ia-Im, которые соответствуют формуле I и в которых значения радикалов существенно не отличаются от значений, приведенных для формулы I, но в которых
в Ia Y представляет собой NH2 или NHR5;
в Ib R1 представляет собой Н, ОН или ОА;
в Ic R2, R3 каждый, независимо друг от друга, представляет собой -NHCO-(X)s-Q, -CONH-(X)s-Q, -NH(CO)NH-(X)s-Q, -NH(CO)O-(X)s-Q, -(X)s-Q или Н,
где, если R2≠Н, то R3=Н или Cl, или
если R3≠Н, то R2=Н или Cl;
в Id R4 представляет собой Н или Hal;
в Ie R5 представляет собой -(CH2)o-Het1 или -(CH2)o-NA2;
в If X представляет собой неразветвленный или разветвленный C1-С10 алкилен, который незамещен или одно-, дву-, три- или тетразамещен ОА, ОН, Hal, COOH, CONH2, NH2 и/или NHCOOA и в котором одна, две или три группы С могут быть заменены О, NHCO, CONH, SO2NH, NHSO2 и/или NH группами;
в Ig Q представляет собой Н, Ar или Het;
в Ih Ar представляет собой фенил, который незамещен или одно-, дву-, три-, тетра- или пентазамещен A, Hal, OA, (СН2)nCOOH, (СН2)nCOOA, NHCO(CH2)nNH2 и/или -O-(СН2)о-Het1;
в Ii Het представляет собой моно- или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 4 атомов N, О и/или S, который может быть одно-, дву- или тризамещен A, OA, Hal и/или =O (карбонильным кислородом);
в Ij Het представляет собой моно- или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двузамещен А и/или =O (карбонильным кислородом);
в Ik Het1 представляет собой моноциклический насыщенный гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двузамещен А и/или =O (карбонильным кислородом);
в Il А представляет собой неразветвленный или разветвленный алкил, содержащий 1-6 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F и/или Cl;
в Im Y представляет собой NH2 или NHR5,
R1 представляет собой Н, ОН или OA,
R2, R3 каждый, независимо друг от друга, представляет собой -NHCO-(X)s-Q, -CONH-(X)s-Q, -NH(CO)NH-(X)s-Q, -NH(CO)O-(X)s-Q, -(X)s-Q или Н,
где, если R2≠Н, то R3=Н или Cl, или
если R3≠Н, то R2=Н или Cl;
R4 представляет собой Н или Hal,
R5 представляет собой -(CH2)o-Het1 или -(CH2)o-NA2;
Х представляет собой неразветвленный или разветвленный C1-С10алкилен, который незамещен или одно-, дву-, три- или тетразамещен OA, ОН, Hal, COOH, CONH2, NH2 и/или NHCOOA и в котором одна, две или три группы С могут быть заменены О, NHCO, CONH, SO2NH, NHSO2 и/или NH-группами,
Q представляет собой Н, Ar или Het,
Ar представляет собой фенил, который незамещен или одно-, дву-, три-, тетра- или пентазамещен A, Hal, OA, (СН2)nCOOH, (СН2)nCOOA, NHCO(CH2)nNH2 и/или -O-(CH2)o-Het1,
Het представляет собой моно- или бициклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 4 атомов N, О и/или S, который может быть одно-, дву- или тризамещен A, OA, Hal и/или =O (карбонильным кислородом),
Het1 представляет собой моноциклический насыщенный гетероцикл, содержащий от 1 до 2 атомов N и/или О, который может быть одно- или двузамещен А и/или =O (карбонильным кислородом),
А представляет собой неразветвленный или разветвленный алкил, содержащий 1-6 атомов углерода, в котором 1-5 атомов водорода могут быть заменены F и/или Cl,
Hal представляет собой F, Cl, Br или I,
n представляет собой 0, 1, 2, 3 или 4,
о представляет собой 1, 2, 3 или 4,
s представляет собой 0 или 1;
и их фармацевтически пригодные производные, сольваты, соли, таутомеры и стереоизомеры, включая их смеси во всех соотношениях.
Соединения формулы I предпочтительно выбирают из группы "А35", "А36", "А37" и "А38".
Соединения в соответствии с изобретением, а также исходные вещества для их получения могут, кроме того, быть получены при помощи методов, известных per se, как описано в литературе (например, в стандартных работах, таких как Houben-Weyl, Methoden der organischen Chemie [Методы органической химии], Georg-Thieme-Verlag, Штутгарт), в соответствии с условиями реакций, которые известны и приемлемы для указанных реакций. Также при этом можно применять разнообразные модификации, которые известные per se, но о которых здесь подробно не упоминается.
При необходимости исходные вещества также могут образовываться in situ таким образом, что они не выделяются из реакционной смеси, но затем они непосредственно преобразуются в соединения в соответствии с изобретением.
Исходные соединения, как правило, являются известными. Однако, если они являются новыми, то они могут быть получены методами, известными per se.
Соединения формулы I предпочтительно могут быть получены путем взаимодействия соединения формулы II с соединением формулы III. Соединения формул II и III, как правило, являются известными. Однако, если они являются новыми, то они могут быть получены методами, известными per se.
В соединениях формулы III Z предпочтительно представляет собой Cl, Br, I или реакционноспособную модифицированную ОН-группу, такую как алкилсульфонилокси, содержащий 1-6 атомов углерода (предпочтительно метилсульфонилокси) или арилсульфонилокси, содержащий 6-10 атомов углерода (предпочтительно фенил- или п-толилсульфонилокси). Z более предпочтительно представляет собой Cl.
Реакцию осуществляют с помощью способов, известных специалисту в данной области техники.
Реакцию предпочтительно осуществляют в щелочных условиях. Подходящими основаниями предпочтительно являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочноземельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этанолят калия и пропанолят натрия, и различные органические основания, такие как пиридин или диэтаноламин.
Обычно реакцию осуществляют в подходящем инертном растворителе.
Примерами подходящих инертных растворителей являются углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2-дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленгликольмонометиловый или моноэтиловый эфир или этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод, карбоновые кислоты, такие как муравьиная кислота или уксусная кислота, нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей.
Растворителем более предпочтительно является, например, вода и/или тетрагидрофуран.
В зависимости от применяемых условий продолжительность реакции находится в интервале от нескольких минут до 14 дней, и температура реакции находится в интервале приблизительно от -30 до 140°С, обычно в интервале от -10 до 130°С, в частности от приблизительно 30 до приблизительно 125°С.
Кроме того, представляется возможным превращать соединение формулы I в другое соединение формулы I путем превращения одного или нескольких радикалов R1, R2, R3, R4 и/или Y в один или несколько радикалов R', R2, R3, R4 и/или Y, например путем восстановления нитрогрупп до аминогрупп, например путем гидрирования на никеле Ренея или Pd/угле в инертном растворителе, таком как метанол или этанол, и/или
превращения сложноэфирной группы в карбоксильную группу и/или превращения аминогруппы в алкилированный амин путем восстановительного аминирования и/или
эстерификации карбоксильных групп путем взаимодействия со спиртами и/или превращения хлорангидридов кислот в амид кислоты путем реакции с амином и/или
алкилирования гидроксильной группы, например, с помощью алкилгалогенида.
Кроме того, свободные аминогруппы могут быть ацилированы подходящим образом с помощью хлорангидрида или ангидрида кислоты или алкилированы с помощью незамещенного или замещенного алкилгалогенида, благоприятно в инертном растворителе, таком как дихлорметан или ТГФ, и/или в присутствии основания, такого как триэтиламин или пиридин, при температуре в интервале от -60 до +30°С.
Соединения формулы I также могут быть получены их выделением в свободном состоянии из их функциональных производных путем сольволиза, в частности гидролиза, или путем гидрогенолиза.
Предпочтительными исходными веществами для сольволиза или гидрогенолиза являются те, которые содержат соответствующие защищенные амино и/или гидроксильные группы вместо одной или больше свободных амино и/или гидроксильных групп, предпочтительно те, которые несут амино-защитную группу вместо атома водорода, связанного с атомом азота, например те, которые соответствуют формуле I, но несут NHR′ группу (в которой R′ представляет собой амино-защитную группу, например ВОС или CBZ) вместо NH2-группы.
Кроме того, предпочтительными являются исходные вещества, которые несут гидроксил-защитную группу вместо атома водорода гидроксильной группы, например те, которые соответствуют формуле I, но содержат R″O-фенильную группу (в которой R″ представляет собой гидроксил-защитную группу) вместо гидроксифенильной группы.
Также существует возможность присутствия в молекуле исходного вещества множества - одинаковых или различных - защищенных амино и/или гидроксильных групп. Если присутствующие защитные группы отличаются друг от друга, то во многих случаях они могут быть отщеплены селективно.
Понятие "амино-защитная группа" в общем известно и относится к группам, которые являются подходящими для защиты (блокирования) аминогруппы от химических реакций, но которые легко удаляются после того, как желательная химическая реакция была проведена в другой части молекулы. Типичными такими группами являются, в частности, незамещенная или замещенная ацильная группа, арильная группа, аралкоксиметильная группа или аралкильная группа. Так как амино-защитные группы удаляют после желательной реакции (или последовательности реакций), то их тип и размер не являются, кроме того, критическими; однако предпочтение отдается тем, которые имеют 1-20, в особенности 1-8, атомов углерода. Понятие "ацильная группа" следует понимать в самом широком смысле в связи с настоящим способом. Оно включает ацильные группы, производные от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфоновых кислот и, в частности, алкоксикарбонильные, арилоксикарбонильные и особенно аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропионил и бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил и толил; арилоксиалканоил, такой как РОА; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, ВОС и 2-йодэтоксикарбонил; аралкоксикарбонил, такой как CBZ ("карбобензокси"), 4-метоксибензилоксикарбонил и FMOC; арилсульфонил, такой как Mtr, Pbf или Pmc.
Предпочтительными амино-защитными группами являются ВОС и Mtr, кроме того, CBZ, Fmoc, бензил и ацетил.
Понятие "гидроксил-защитная группа" также в общем известно и относится к группам, которые являются подходящими для защиты гидроксильной группы от химических реакций, но которые легко удаляются после того, как желательная химическая реакция была проведена в другой части молекулы. Типичными такими группами являются указанные выше незамещенные или замещенные арильная, аралкильная или ацильная группы, кроме того, также алкильные группы. Природа и размер гидроксил-защитных групп не являются критическими, так как их удаляют после желательной химической реакции или последовательности реакций; предпочтение отдается группам, которые имеют 1-20, в особенности 1-10, атомов углерода. Примерами гидроксил-защитных групп являются, в числе других, бензил, n-нитробензоил, п-толуолсульфонил, трет-бутил и ацетил, где бензил и трет-бутил являются особенно предпочтительными. Группы СООН предпочтительно защищены в виде их трет-бутиловых эфиров.
Соединения формулы I выделяют в свободном состоянии из их функциональных производных - в зависимости от используемых защитных групп, - например, применяя сильные кислоты, преимущественно применяя ТФУ или перхлорную кислоту, но также используют другие сильные неорганические кислоты, такие как соляная кислота или серная кислота, сильные органические карбоновые кислоты, такие как трихлоруксусная кислота, или сульфоновые кислоты, такие как бензол- или п-толуолсульфоновая кислота. Присутствие дополнительного инертного растворителя допускается, но не всегда необходимо. Приемлемыми инертными растворителями предпочтительно являются органические, например карбоновые кислоты, такие как уксусная кислота, простые эфиры, такие как тетрагидрофуран или диоксан, амиды, такие как ДМФА, галогенированные углеводороды, такие как дихлорметан, кроме того, также спирты, такие как метанол, этанол или изопропанол, и вода. Также приемлемыми являются смеси указанных выше растворителей. ТФУ предпочтительно используют в избытке без добавления другого растворителя, и перхлорную кислоту предпочтительно используют в виде смеси уксусной кислоты и 70% перхлорной кислоты в соотношении 9:1. Температура реакций для осуществления расщепления предпочтительно находится в интервале между приблизительно 0 и приблизительно 50°С, предпочтительно между 15 и 30°С (комнатная температура).
ВОС, OBut, Pbf, Pmc и Mtr группы могут, например, предпочтительно быть отщеплены при использовании ТФУ в дихлорметане или используя приблизительно 3-5 н. HCl в диоксане при 15-30°С, и FMOC группа может быть отщеплена, используя приблизительно 5-50% раствор диметиламина, диэтиламина или пиперидина в ДМФА при 15-30°С.
Фармацевтические соли и другие формы
Соединения, раскрытые в изобретении, могут использоваться в своей заключительной, несолевой форме. С другой стороны, настоящее изобретение также относится к применению таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые формы солей соединений формулы I готовят, главным образом, при использовании традиционных способов. В случае, если соединение формулы I содержит группу карбоновой кислоты, то его приемлемая соль может быть образована с помощью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Примерами таких оснований являются гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочноземельных металлов такие, как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этанолят калия и пропанолят натрия, а также различные органические основания, такие как пиперидин, диэтаноламин и N-метилглутамин. Сюда также включены соли алюминия соединений формулы I. Для некоторых соединений формулы I соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например гидрогалогенидами, такими, как гидрохлорид, гидробромид или гидройодид; другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат или фосфат, и др.; и алкил- и моноарилсульфонатами, такими, как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами, их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и др. Таким образом, фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают следующие соли, но не ограничиваясь только ими: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, йодид, изотионат, изобутират, лактат, лактобионат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат, фталат.
Кроме того, оснòвные соли соединений в соответствии с изобретением включают, но не ограничиваясь только ими, соли алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные; соли щелочных металлов натрия и калия и соли щелочноземельных металлов кальция и магния. Соли соединений формулы I, которые имеют происхождение от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваясь только ими, соли первичных, вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины, циклические амины и основные ионообменные смолы, например аргинин, бетаин, кофеин, хлорпрокаин, холин, N,N′-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин).
Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как С1-С4-алкилгалогениды, например метил-, этил-, изопропил-трет-бутилхлориды, бромиды и йодиды; ди-С1-С4-алкилсульфаты, например диметил-, диэтил- и диамилсульфаты; С10-С18-алкилгалогениды, например децил-, додецил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил-С1-С4-алкилгалогениды, например, бензилхлорид и фенетилбромид.
Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением.
Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваясь только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия, стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин.
Кислотно-аддитивные соли оснòвных соединений формулы I получают путем приведения в контакт формы свободных оснований с достаточным количеством желаемой кислоты для получения соли традиционным способом. Свободное основание можно регенерировать путем приведения в контакт формы соли с основанием и выделения свободного основания традиционным способом. Формы свободного основания в некоторой степени отличаются от своих соответствующих форм солей своими определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных оснований для целей настоящего изобретения.
Как было указано, фармацевтически приемлемые соли присоединения основания соединений формулы I образуются с металлами или аминами, такими как щелочные металлы и щелочноземельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N′-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин.
Соли присоединения основания кислых соединений в соответствии с изобретением получают путем приведения в контакт формы свободной кислоты с достаточным количеством желаемого основания для получения соли традиционным способом. Форма свободной кислоты может быть регенерирована путем приведения в контакт формы соли с кислотой и выделения формы свободной кислоты известным способом. Формы свободной кислоты в некоторой степени отличаются от своих соответствующих форм солей определенными физическими свойствами, такими как растворимость в полярных растворителях, однако во всем остальном соли являются эквивалентными своим соответствующим формам свободных кислот для целей настоящего изобретения.
Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает составные соли. Примеры типичных составных форм солей включают, но не ограничиваясь только ими, битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид.
В свете описанного выше можно увидеть, что выражение «фармацевтически приемлемая соль» в контексте данной заявки предназначено для обозначения активного компонента, который включает соединение формулы I в форме своей соли, особенно в том случае, если указанная форма соли обеспечивает указанному активному компоненту улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного компонента или другой солью указанного активного компонента, которые использовались ранее. Фармацевтически приемлемая форма соли активного компонента может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному компоненту, которым он ранее не обладал, а также может даже положительно влиять на фармакодинамику указанного активного компонента в отношении его терапевтической активности в организме.
Соединения формулы I в соответствии с изобретением могут быть хиральными благодаря их молекулярной структуре и соответственно могут встречаться в различных энантиомерных формах. Поэтому они могут существовать в рацемической или в оптически активной форме.
Так как фармацевтическая активность рацематов или стереоизомеров соединений формулы I может отличаться, то может являться желательным использование энантиомеров. В этих случаях конечный продукт или даже промежуточные продукты могут быть разделены на энантиомерные соединения химическими или физическими способами, известными специалисту в данной области техники, или даже использоваться как таковые в синтезе.
В случае рацемических аминов диастереомеры выделяют из смеси реакцией с оптически активным разделяющим агентом. Примерами подходящих разделяющих агентов являются оптически активные кислоты, такие как R- и S- формы винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты, подходящих N-защищенных аминокислот (например, N-бензоилпролина или N-бензолсульфонилпролина), или различные оптически активные камфорсульфоновые кислоты. Также предпочтительным является хроматографическое разделение энантиомеров с помощью оптически активного разделяющего агента (например, динитробензоилфенилглицина, триацетата целлюлозы или других производных углеводородов или хирально модифицированных полимеров метакрилата, иммобилизированных на силикагеле). Подходящими для этой цели элюентами являются водные или спиртовые смеси растворителей, такие как, например, гексан/изопропанол/ацетонитрил, например, в отношении 82:15:3.
Изобретение также относится к применению соединений и/или их физиологически приемлемых солей для приготовления лекарственного средства (фармацевтической композиции), в частности, при помощи нехимических методов. Они могут быть превращены в подходящую дозированную форму совместно с по меньшей мере одним твердым, жидким и/или полужидким наполнителем или вспомогательным веществом и, при необходимости, в комбинации с одним или несколькими другими активными компонентами.
Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные производные, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и, необязательно, наполнители и/или вспомогательные вещества.
Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Такая единица может включать, например, от 0,1 мг до 3 г, предпочтительно от 1 мг до 700 мг, более предпочтительно от 5 мг до 100 мг, соединения в соответствии с изобретением в зависимости от болезненного состояния подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного компонента на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше, или соответствующую порцию их активного компонента. Лекарственные средства этого типа также могут быть получены способом, который хорошо известен в области фармацевтики.
Лекарственные препараты могут адаптироваться для введения при помощи любого подходящего способа, например, путем перорального (включая буккальное или подъязычное), ректального, назального, местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие препараты могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например, путем объединения активного компонента с наполнителем(ями) или вспомогательным(ыми) веществом(ами).
Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевых пен или пенистых пищевых продуктов; жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле.
Так, например, в случае перорального введения в виде таблетки или капсулы, активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем, измельченным аналогичным способом, таким как, например, пищевой углеводород, такой как, например, крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель.
Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполняют ею желатиновые капсулы определенной формы. Перед заполнением капсул к порошковой смеси можно добавлять скользящие и смазывающие вещества, такие как, например, высоко дисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия.
Дополнительно, если это является желательным или необходимым, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими связующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза, подсластители, приготовленные из кукурузы, естественные и синтетические резины, такие как, например, аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваясь только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием, как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин, усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания со связующим, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ, и прессования ее через сито. В качестве альтернативы грануляции порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы, которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты, стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами.
Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичного спиртового наполнителя. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичном наполнителе. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например, этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара или сахарин, или другие искусственные заменители сахара и т.п.
Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п.
Соединения формулы I и их соли, сольваты и физиологически функциональные производные также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например, холестерин, стеариламин или фосфатидилхолины.
Соединения формулы I и их соли, сольваты и физиологически функциональные производные также могут доставляться с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливающих носителей лекарственных средств. Такими полимерами могут являться поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизина, замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидроксипиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей,
Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде независимых пластырей для удлиненного, тесного контакта с эпидермисом реципиента. Таким образом, например, активный компонент может доставляться из пластыря путем ионофореза, как в общем описано в Pharmaceutical Research, 3(6), 318 (1986).
Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спрееев, аэрозолей или масел.
Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активный компонент может применяться с парафиновым или смешивающимся с водой мазевым основанием. Альтернативно для получения крема активный компонент может быть приготовлен с основой для крема типа масло-в-воде или основой вода-в-масле.
Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, предпочтительно в водном растворителе.
Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта.
Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм.
Лекарственные препараты, адаптированные для интраназального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 микрон, который вводится путем вдыхания, то есть путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде интраназального аэрозоля или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или в масле.
Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффляторами.
Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей.
Лекарственные препараты, адаптированные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средство поддерживается изотоническим по отношению к крови реципиента, подвергаемого лечению, и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду, для инъекций.
Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток.
Также является очевидным, что дополнительно к предпочтительным вышеописанным составляющим, лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы.
Терапевтически эффективное количество соединения формулы I зависит от многих факторов, включая, например, возраст и вес человека или животного, определенное состояние, которое необходимо лечить, и его тяжесть, природу лекарственного средства и способ введения, и в конечном счете оно может быть определено лечащим врачом или ветеринаром. Тем не менее эффективное количество соединения в соответствии с изобретением, как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, причем это количество может вводиться в виде отдельной дозы один раз в день или обычно в виде циклов частичных доз (таких как, например, два, три, четыре, пять или шесть раз) в день, таким образом, что общая суточная доза является аналогичной. Эффективное количество его соли или сольвата или физиологически функционального производного может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также предполагается, что подобные дозы пригодны для лечения других состояний, указанных в настоящей заявке.
Кроме того, изобретение относится к лекарственным средствам, которые содержат по меньшей мере одно соединение формулы I и/или его фармацевтически пригодные производные, сольваты и стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере один дополнительный активный компонент лекарственного средства.
Дополнительными активными компонентами лекарственных средств предпочтительно являются химиотерапевтические средства, в особенности те, которые ингибируют ангиогенез и, следовательно, ингибируют рост и распространение опухолевых клеток; предпочтительными согласно настоящему изобретению являются ингибиторы рецептора VEGF, включая робозимы и антисмысловые молекулы, которые направлены на рецепторы VEGF, и ангиостатин и эндостатин.
Примерами противораковых средств, которые могут применяться в комбинации с соединениями согласно настоящему изобретению, обычно являются алкилирующие средства, антиметаболиты; эпидофиллотоксин; противораковый фермент; ингибитор топоизомеры; прокарбазин; митоксантрон или координационные комплексы платины.
Противораковые средства предпочтительно выбирают из следующих классов: антрациклины, лекарственные средства барвинка, митомицины, блеомицины, цитотоксические нуклеозиды, эпотилоны, дискормолиды, птеридины, диинены и подофиллотоксины.
Более предпочтительными в указанных классах являются, например, карминомицин, даунорубицин, аминоптерин, метотрексат, метоптерин, дихлорметотрексат, митомицин С, порфиромицин, 5-фторурацил, 5-фтордезоксиуридин монофосфат, цитарабин, 5-азацитидин, тиогуанин, азатиоприн, аденозин, пентостатин, эритрогидроксинониладенин, кладрибин, 6-меркаптопурин, гемцитабин, цитоарабинозид, подофиллотоксин или производные подофиллотоксина, такие как, например, этопозид, этопозид фосфат или тенипозид, мельфалан, винбластин, винорелбин, винкристин, лейрозидин, виндезин, лейрозин, децетаксел и паклитаксел. Другие предпочтительные противораковые средства выбирают из группы, включающей дискормолид, эпотилон D, эстрамустин, карбоплатин, цисплатин, оксалиплатин, циклофосфамид, блеомицин, гемцитабин, ифосфамид, мельфалан, гексаметилмеламин, тиотепа, идатрексат, триметрексат, дакарбазин, L-аспарагиназа, камптотецин, СРТ-11, топотекан, арабинозилцитозин, бикалутамид, флутамид, лейпролид, производные пиридобензоиндола, интерфероны и интерлейкины.
Дополнительными активными компонентами лекарственных средств предпочтительно являются антибиотики. Предпочтительные антибиотики выбирают из группы, включающей дактиномицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, блеомицин, пликамицин, митомицин.
Дополнительными активными компонентами лекарственных средств предпочтительно являются ингибиторы ферментов. Предпочтительные ингибиторы ферментов выбирают из группы, включающей ингибиторы деацетилазы гистонов (например, субероиланилид гидроксамовой кислоты [SAHA]) и ингибиторы тирозинкиназы (например, ZD 1839 [Iressa]).
Дополнительными активными компонентами лекарственных средств предпочтительно являются ингибиторы ядерного экспорта. Ингибиторы ядерного экспорта предотвращают выход биополимеров (например, РНК) из клеточного ядра. Предпочтительные ингибиторы ядерного экспорта выбирают из группы, включающей каллистатин, лептомицин В, ратйядон.
Дополнительными активными компонентами лекарственных средств предпочтительно являются ингибиторы ядерного экспорта. Ингибиторы ядерного экспорта предотвращают выход биополимеров (например, РНК) из клеточного ядра. Предпочтительные ингибиторы ядерного экспорта выбирают из группы, включающей каллистатин, лептомицин В, ратйядон.
Дополнительными активными компонентами лекарственных средств предпочтительно являются иммунодепрессанты. Предпочтительные иммунодепрессанты выбирают из группы, включающей рапамицин, CCI-779 (Wyeth), RAD001 (Novartis), AP23573 (Ariad Pharmaceuticals).
Изобретение также относится к комплекту (набору), состоящему из отдельных пакетов
(а) эффективного количества соединения формулы I и/или его фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и
(б) эффективного количества дополнительного активного компонента лекарственного средства.
Комплект включает подходящие емкости, такие как коробки, индивидуальные бутылки, пакеты или ампулы. Комплект может включать, например, отдельные ампулы, каждая из которых содержит эффективное количество соединения формулы I и/или его фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, и эффективное количество дополнительного активного компонента лекарственного средства в растворенной или лиофиллизированной форме.
Применение
Соединения согласно настоящему изобретению пригодны в качестве фармацевтически активных компонентов для млекопитающих, в особенности для людей, для лечения заболеваний, в которые вовлечен HSP90.
Следовательно, изобретение относится к применению соединений формулы I и их фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения заболеваний, на которые влияет ингибирование, регуляция и/или модуляция HSP90.
Предпочтительным является применение соединений формулы I и их фармацевтически пригодных производных, сольватов и стереоизомеров, включая их смеси во всех соотношениях, для приготовления лекарственного средства для лечения опухолевых заболеваний, например фибросаркомы, злокачественной миксомы, липосаркомы, хондросаркомы, остеогенной саркомы, хордомы, ангиосаркомы, эндотелиосаркомы, лимфангиосаркомы, лимфангиоэндотелиосаркомы, синовиальной эндотелиомы, мезотелиомы, саркомы Юинга, лейосаркомы, рабдомиосаркомы, рака ободочной кишки, рака поджелудочной железы, рака молочной железы, рака яичников, рака предстательной железы, плоскоклеточного рака, базально-клеточного рака, аденокарциномы, рака протока потовой железы, рака клеток сальной железы, папиллярного рака, папиллярных аденокарцином, цистаденокарцином, рака костного мозга, бронхогенного рака, почечно-клеточного рака, печеночно-клеточной аденомы, рака желчного протока, хориокарциномы, сперматоцитомы, эмбриональной карциномы, опухоли Вильма, рака шейки матки, рака яичек, рака легких, мелкоклеточного рака легких, рака мочевого пузыря, эпителиального рака, глиомы, астроцитомы, медуллобластомы, краниофарингиомы, эпендимомы, пинеаломы, гемангиобластомы, невриномы слухового нерва, олигодендроглиомы, менингиомы, меланомы, нейробластомы, ретинобластомы, лейкоза, лимфомы, множественной миеломы, макроглобулинемии Вальденстрема и болезни тяжелых цепей; вирусных заболеваний, где вирусный патоген выбран из группы, включающей гепатит типа А, гепатит типа В, гепатит типа С, грипп, ветряную оспу, аденовирус, вирус простого герпеса I типа (HSV-I), вирус простого герпеса II типа (HSV-II), чуму крупного рогатого скота, риновирус, эховирус, ротавирус, респираторно-синцитиальный вирус (RSV), папилломавирус, паповавирус, цитомегаловирус, эхиновирус, арбовирус, хунтавирус, коксаки-вирус, вирус паротита, вирус кори, вирус краснухи, вирус полиомиелита, вирус иммунодефицита человека I типа (HIV-I) и вирус иммунодефицита человека II типа (HIV-II); для иммуносупрессии в трансплантантах; заболеваний, индуцированных воспалением, таких как ревматоидний артрит, астма, рассеянный склероз, диабет I типа, красная волчанка, псориаз и воспалительное заболевание кишечника; фиброзно-кистозной дегенерации; заболеваний, связанных с ангиогенезом, таких как, например, диабетическая ретинопатия, гемангиома, эндометриоз, опухолевый ангиогенез; инфекционных заболеваний; аутоиммунных заболеваний; ишемии; стимуляции регенерации нервов; фиброгенетических заболеваний, таких как, например, склеродерма, болезнь Вагнера, системная волчанка, цирроз печени, келоидное образование, интерстициальный нефрит и фиброз легких.
Соединения формулы I могут ингибировать, в частности, рост злокачественного новообразования, опухолевых клеток и опухолевых метастазов, и поэтому пригодны для лечения опухолей.
Кроме того, настоящее изобретение относится к применению соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для защиты нормальных клеток от токсичности, вызванной химиотерапией, и для лечения заболеваний, основной причиной которых является неправильная укладка или агрегация белков, таких как, например, почесуха, болезнь Якоба-Крейтцфельдта, Хантингтона или Альцгеймера.
Изобретение также относится к применению соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения заболеваний центральной нервной системы, сердечно-сосудистой системы и кахексии.
В дальнейшем варианте осуществления изобретение также относится к применению соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для модуляции HSP90, где модуляции биологической активности HSP90 вызывают иммунную реакцию у особи, транспортирование белка из эндоплазматического ретикулума, восстановление после гипоксического/аноксического стресса, восстановление после недостаточного питания, восстановление после теплового стресса или их комбинации, и/или где заболевание представляет собой тип злокачественного новообразования, инфекционное заболевание, расстройство, связанное с нарушенным транспортом белка из эндоплазматического ретикулума, расстройство, связанное с ишемией/реперфузией, или их комбинации, где расстройство, связанное с ишемией/реперфузией, представляет собой последствие остановки сердца, асистолию и отсроченную аритмию желудочков, операцию на сердце, операцию сердечно-легочного шунтирования, пересадку органа, травму спинного мозга, травму головы, удар, тромбоэмболический удар, геморрагический удар, спазм сосудов головного мозга, гипотонию, гипогликемию, эпилептическое состояние, эпилептический припадок, тревогу, шизофрению, нейродегенеративное расстройство, болезнь Альцгеймера, болезнь Хантингтона, боковой амиотрофический склероз (ALS) или неонатальный стресс.
В дальнейшем варианте осуществления изобретение также относится к применению соединений формулы I и/или их физиологически приемлемых солей и сольватов для приготовления лекарственного средства для лечения ишемии вследствие остановки сердца, асистолии и отсроченной аритмии желудочков, операции на сердце, операции сердечно-легочного шунтирования, пересадки органа, травмы спинного мозга, травмы головы, удара, тромбоэмболического удара, геморрагического удара, спазма сосудов головного мозга, гипотонии, гипогликемии, эпилептического состояния, эпилептического припадка, тревоги, шизофрении, нейродегенеративного расстройства, болезни Альцгеймера, болезни Хантингтона, бокового амиотрофического склероза (ALS) или неонатального стресса.
Способ тестирования для определения действия ингибиторов HSP90
Связывание гельданамицина или 17-аллиламино-17-деметоксигельданамицина (17AAG) с HSP90 и его конкурентное ингибирование можно использовать для определения ингибирующего действия соединений в соответствии с изобретением (Carreras и др. 2003, Chiosis и др. 2002).
В конкретном случае, используют тест связывания радиоактивно меченного лиганда на фильтре. Радиоактивно меченный лиганд, используемый в этом тесте, представляет собой меченный тритием 17-аллиламиногельданамицин, [3H]17AAG. Этот тест связывания на фильтре обеспечивает целевой поиск ингибиторов, которые интерферируют с АТФ-связывающим сайтом.
Материалы
Рекомбинатный HSP90α человека (экспрессируемый Е.coli, чистота 95%);
[3H]17AAG (17-аллиламиногельданамицин, [аллиламино-2,3- 3Н. Удельная активность 1,11×1012 Бк/ммоль (Moravek, MT-1717);
HEPES фильтрующий буфер (50 мМ HEPES, рН 7,0; 5 мМ MgCl2, БСА 0,01%) Multiscreen FB (1 мкм) фильтровальный планшет (Millipore, MAFBNOB 50).
Способ
Сначала микротитровальные фильтровальные планшеты на 96 лунок орошали и покрывали 0,1% полиэтиленимином.
Исследование осуществляли в следующих условиях:
Температура реакции 22°С
Время реакции 30 мин, встряхивание при 800 об/мин
Тестируемый объем 50 мкл
Конечные концентрации:
50 мМ HEPES HCl, рН 7,0; 5 мМ MgCl2; 0,01% (мас./об.) БСА
HSP90: 1,5 мкг/исследование
[3Н]17AAG: 0,08 мкМ.
После окончания реакции супернатант в фильтровальном планшете удаляли путем отсасывания с помощью вакуумной установки (Multiscreen Separation System, Millipore) и фильтр промывали два раза.
Затем фильтровальные планшеты измеряли на бета-счетчике (Microbeta, Wallac) со сцинтиллятором (Microscint 20, Packard).
"% контроля" определяли на основе значений "импульсы в минуту" и из них рассчитывали IC-50 значения соединения.
При указании выше и ниже вся температура приведена в градусах Цельсия (°С). В нижеприведенных примерах обычная "обработка" обозначает, что при необходимости добавляют воду, рН устанавливают, при необходимости, на значение от 2 до 10, в зависимости от состава конечного продукта, смесь экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу высушивают над сульфатом натрия и выпаривают, продукт очищают при помощи хроматографии на силикагеле и/или кристаллизации. Rf значения на силикагеле; элюент: этилацетат/метанол 9:1.
Условия ЖХ-МС
HP 1100 серии Hewlett Packard System, имеющие следующие характеристики: источник ионов: электрораспыление (положительный режим); сканирование: 100-1000 m/e; напряжение фрагментации 60 В; температура газа 300°С, DAD: 220 нм.
Скорость потока 2,4 мл/мин. Используемый разделитель уменьшал скорость потока для МС до 0,75 мл/мин, после DAD.
Колонка: Chromolith SpeedROD RP-18e 50-4,6
Растворитель: LiChrosolv качества от Merck KGaA
Растворитель А: H2O (0,01% ТФУ)
Растворитель В: ACN (0,008% ТФУ)
Градиент:
20% В → 100% В: от 0 мин до 2,8 мин.
100% В: от 2,8 мин до 3,3 мин.
100% В → 20% В: от 3,3 мин до 4 мин.
Время удерживания Rf [мин] и данные ММ М+Н+, указанные в последующих примерах, представляли собой измеренные результаты ЖХ-МС анализов.
Пример 1
Общая схема реакций для получения соединений формулы I, в которых R2 представляет собой ацилированную аминогруппу:
Получение 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-трифторметилбензоиламино)фенил]тиено[2,3b]пиридина ("А1")
1.1 10,9 г цианотиоацетамида и 9 мл 4-метилморфолина добавляли к раствору 10 г 4-метокси-3-нитробензальдегида в 100 мл этанола и смесь перемешивали при комнатной температуре в течение 48 часов. Добавляли 10% HCl до рН 5 и смесь перемешивали дополнительно в течение 16 часов. Осажденное вещество отделяли, промывали этанолом и н-гептаном и высушивали, получая 9,6 г 6-амино-3,5-дициано-4-(4-метокси-3-нитрофенил)-2-тиоксо-1,2-дигидропиридина ("1")
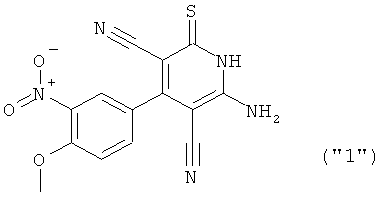 .
.
1.2 Один эквивалент KОН в воде добавляли к раствору 30,7 г "1" в 100 мл ДМФА. Затем добавляли 8,8 г 2-хлорацетамида и смесь перемешивали дополнительно в течение часа. Добавляли дополнительный эквивалент КОН в воде и смесь перемешивали при комнатной температуре в течение 16 часов, затем при 100°С дополнительно в течение часа. Смесь разводили равным количеством воды, осажденное вещество отделяли, промывали водой и высушивали, получая 17 г 2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-нитрофенил)тиено[2,3-b]пиридина ("2").
1.3 1,8 "2" в 100 мл ДМФА гидрировали согласно стандартным методам, используя 5% Pd/C (56% воды) в качестве катализатора. После отделения катализатора и удаления растворителя получали 2-аминокарбонил-3,6-диамино-5-циано-4-(3-амино-4-метоксифенил)тиено[2,3-b]пиридина ("3") в количественном выходе.
1Н ЯМР 250 МГц, ДМСО-В6) δ 15,00 (b), 7,62 (d, 1H), 7,51 (d, 1H), 7,48 (d, 1H), 4,06 (s, 3H).
1.4 47 мкл 4-метилморфолина добавляли к раствору 45 мкл 3-(трифторметил)бензоилхлорида и 48 мг гидрата 1-гидроксибензотриазола в 1 мл ДМФА и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 100 мг "3" и смесь перемешивали дополнительно в течение 16 часов. Смесь перемешивали в 10 мл воды, осажденное вещество отделяли, промывали водой и очищали путем хроматографии (флэш-хроматография с обращенной фазой; Isco Companion®), получая 24 мг "A1", M+H+ 527,50
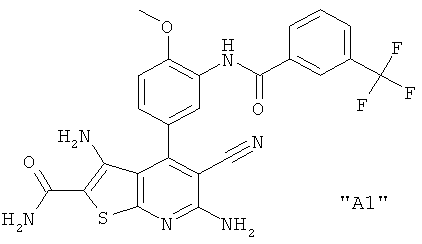 .
.
При осуществлении аналогичной реакции "3" с
ацетилхлоридом,
трифторацетилхлоридом,
хлоридом сложного метилового эфира глутаровой кислоты,
хлоридом 1H-пиридин-2-он-4-карбоновой кислоты,
4-метоксикарбонилбензоилхлоридом,
метилхлоркарбонилметоксиацетатом,
3-трифторметилфенилсульфонилхлоридом
получали соединения
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-ацетамидофенил)тиено[2,3-b]пиридин ("А2"), M+H+ 397,43;
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-трифтор-ацетамидофенил)тиено[2,3-b]пиридин ("A3"), M+H+ 451,40;
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-метокси-карбонилбутириламино)фенил]тиено[2,3-b]пиридин ("А4а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(1Н-пиридин-2-он-4-карбониламино)фенил]тиено[2,3-b]пиридин ("А5"), М+Н+ 476,49;
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-метокси-карбонилбензоиламино)фенил]тиено[2,3-b]пиридин ("А6а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-метоксикарбонилметоксиацетамидо)фенил]тиено[2,3-b]пиридин ("А7а");
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-трифторметилфенилсульфонамидо)фенил]тиено[2,3-b]пиридин ("А9"), М+Н+ 563,55.
Пример 2
При гидролизе сложного эфира в стандартных условиях
"А4а" получали соединение 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-карбоксибутриламино)фенил]тиено[2,3-b]пиридин ("А4"), M+H+ 469,49;
"А6а" получали соединение 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-карбоксибензоиламино)фенил]тиено[2,3-b]пиридин ("А6"), 10 М+H+ 503,51;
"А7а" получали соединение 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-карбоксиметоксиацетамидо)фенил]тиено[2,3-b]пиридин ("А7"), М+H+ 471,46.
Пример 3
82 мг гидрохлорида N-(3-диметиламинопропил)-N-этилкарбодиимида (DAPECI) и 47 мкл 4-метилморфолина добавляли к раствору 55 мг ВОС-глицина (ВОС-Gly-OH) и 48 мг гидрата 1-гидроксибензотриазола в 1 мл ДМФА и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 100 мг "3" и смесь перемешивали дополнительно в течение 16 часов. Смесь перемешивали в 10 мл воды, осажденное вещество отделяли и промывали водой, получая 2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-[(трет-бутилоксикарбонил)амино]ацетамидо}фенил)тиено[2,3-b]пиридин ("А 10"),
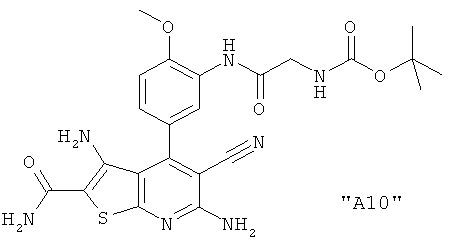
При осуществлении аналогичной реакции ″3″ с
BOC-β-Ala-OH (ВОС-β-аланином),
BOC-GABA-OH (ВОСγ-аминомасляной кислотой),
1H-индол-7-карбоновой кислотой,
BOC-His-OH (ВОС-гистидином),
BOC-Asn-OH (ВОС-аспарагином),
N-(2-карбамоилацетил)глицином,
1H-индазол-7-карбоновой кислотой,
ВОС-Ser(O-трет-бутил)-ОН (ВОС-(S)-серин-трет-бутиловым эфиром)
получали соединения
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{3-[(трет-бутил-оксикарбонил)амино]пропиониламино}фенил)тиено[2,3-b]пиридин ("A11"), M+H+ 526,59;
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{4-[(трет-бутил-оксикарбонил)амино]бутириламино}фенил)тиено[2,3-b]пиридин ("А 12"), М+Н+ 540,61;
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(индол-7-ил-карбониламино)фенил]тиено[2,3-b]пиридин ("А13"), M+H+ 498,54;
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-[(трет-бутилоксикарбонил)амино]-3-(1H-имидазол-4-ил)пропиониламино}фенил)тиено[2,3-b]пиридин ("А14а"),
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-[(трет-бутилоксикарбонил)амино]-3-аминокарбонилпропиониламино}фенил)тиено[2,3-b]пиридин ("А15а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-[2-(2-карбамоилацетиламино)ацетиламино]фенил]тиено[2,3-b]пиридин ("А16"), M+H+ 497,51;
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(индазол-7-илкарбониламино)фенил]тиено[2,3-b]пиридин ("А17"), М+H+ 499,52;
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-[(трет-бутилоксикарбонил)амино]-3-(трет-бутилокси)пропиониламино}фенил)тиено[2,3-b]пиридин ("А18а").
Пример 4
При удалении ВОС защитных групп из
"А11",
"А12",
"А14а",
"А15а",
"А18а"
и расщеплении трет-бутилового эфира в HCl/диоксане получали соединения
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-амино-пропиониламино)фенил]тиено[2,3-b]пиридин ("А21"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-амино-бутириламино)фенил]тиено[2,3-b]пиридин ("А22"), М+H+ 440,50;
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-{4-метокси-3-[2-амино-3-(1H-имидазол-4-ил)пропиониламино]фенил}тиено[2,3-b]пиридин ("А14")
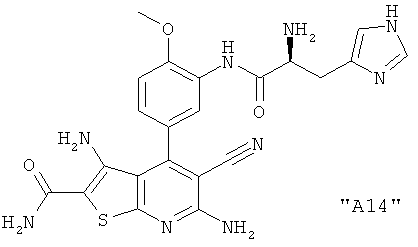
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-амино-3-аминокарбонилпропиониламино}фенил)тиено[2,3-b]пиридин ("А15"),
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-амино-3-гидроксипропиониламино)фенил]тиено[2,3-b]пиридин ("А18").
Пример 5
При осуществлении реакции 2-аминокарбонил-3,6-диамино-5-циано-4-(2-амино-4-метоксифенил)тиено[2,3-b]пиридина ("3а") с 3-трифторметилфенилизоцианатом в стандартных условиях получали соединение 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-(3-трифторметилфенилуреидо)фенил]тиено[2,3-b]пиридин ("А22").
Пример 6
При осуществлении реакции 2-аминокарбонил-3,6-диамино-5-циано-4-(2-амино-4-метоксифенил)тиено[2,3-b]пиридина ("3а") аналогично примеру 1 с бензоилхлоридом,
3-карбамоилпропионовой кислотой,
N-(фенилсульфонил)глицином
получали соединения
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-2-бензоиламино-фенил)тиено[2,3-b]пиридин ("А8"), M+H+ 459,50;
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-(3-карбамоилпропиониламино)фенил]тиено[2,3-b]пиридин ("А19"), М+H+ 454,48;
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-[2-(фенил-сульфонил)ацетиламино]фенил]тиено[2,3-b]пиридин ("А20"), М+Н+ 552,60.
Пример 7
Получение 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-[2-(3-этилуреидо)этилкарбамоил]фенил]тиено[2,3-b]пиридина ("А23")
7.1 Схема реакции для получения предшественника "А23а"
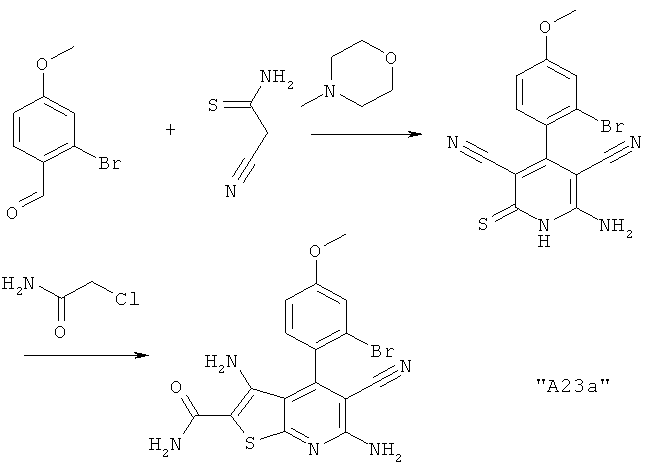
7.2 Смесь "A23a", "A23b"
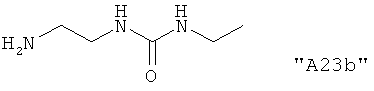 ,
,
ацетата палладия (II) (47% Pd), 1,8-диаазабицикло[5,4,0]ундец-7-ена, ТГФ и гексакарбонила молибдена облучали микроволнами в течение 1 часа при 120°С. При осуществлении обычной обработки получали
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-[2-(3-этил-уреидо)этилкарбамоил]фенил]тиено[2,3-b]пиридин ("А23"), M+H+ 497,55
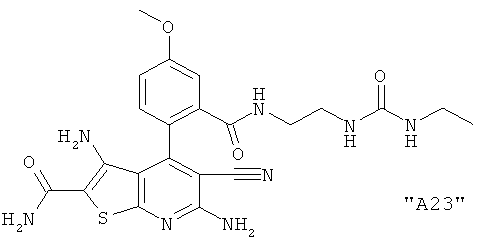 .
.
При осуществлении реакции
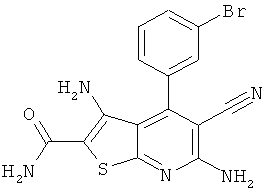
с 7-аминоиндазолом в присутствии Мо(СО)6 и Pd(OAc)2 аналогично примеру 7,2 получали соединение
2-аминокарбонил-3,6-диамино-5-циано-4-[3-(индазол-7-илкарбамоил)фенил]тиено[2,3-b]пиридин ("А24"), M+H+ 469,50
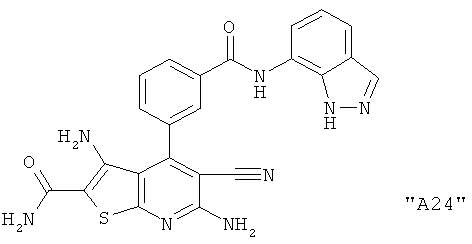 .
.
При осуществлении реакции
с 4-аминобутирамидом в присутствии Мо(СО)6 и Pd(OAc)2 аналогично примеру 7,2 получали соединение
2-аминокарбонил-3,6-диамино-5-циано-4-[5-хлор-3-(3-карбамоил-пропилкарбамоил)фенил]тиено[2,3-b]пиридин ("А25"), M+H+472,93
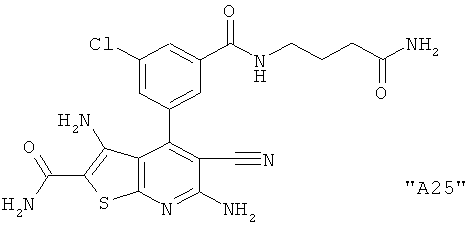 .
.
Пример 8
PdCl2(dppf) добавляли к бромиду 3-фторбензилцинка (0,5 М в ТГФ) и смесь перемешивали при комнатной температуре в течение 5 минут в атмосфере аргона. Затем по каплям добавляли раствор "А26а"
в ТГФ и смесь перемешивали при 45°С дополнительно в течение 30 минут, затем при 65°С в течение 1 часа. Смесь охлаждали, вливали в насыщенный NH4Cl раствор и подвергали обычной обработке, получая 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-фторбензил)фенил]тиено[2,3-b]пиридин ("А26"), M+H+ 448,49
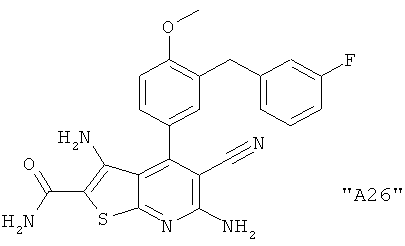
Пример 9
9.1 Смесь "А27а"
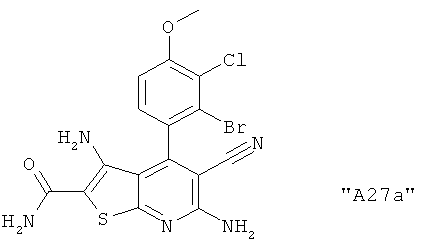 ,
,
2-винилпиридина, триэтиламина, ацетата палладия (III) (47% Pd), три-о-толил-фосфина и ацетонитрила облучали микроволнами при 160°С в течение 30 минут. К реакционной смеси добавляли толуол, который несколько раз экстрагировали водой. Органическую фазу высушивали и упаривали. Продукт очищали путем хроматографии (ISCO/40 г колонка; петролейный эфир/этилацетат: 4/1 до 1/1), получая "A27b"
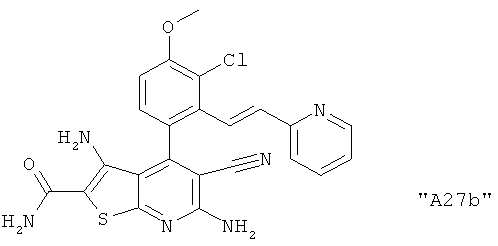 ,
,
9.2 Смесь "A27b", 5% Pd/C (56% воды) и ТГФ гидрировали в течение 16 часов под давлением 1,4 бар при комнатной температуре в аппарате BÜCHI, удаляли катализатор и удаляли растворитель, получая 2-аминокарбонил-3,6-диамино-5-циано-4-{3-хлор-4-метокси-2-[2-(пиридин-2-ил)этил]фенил}тиено[2,3-b]пиридин ("А27"), M+H+ 497,96
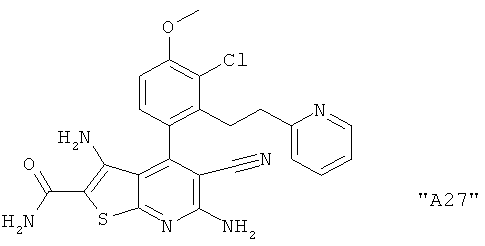
При осуществлении реакции "А26а" с метилакрилатом аналогично примеру 9.1 получали соединение "А28а"
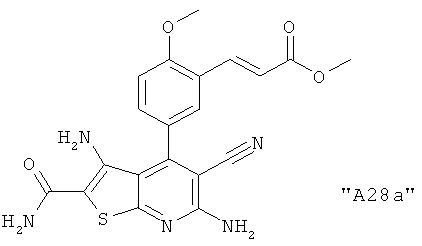
и при его гидрировании аналогично примеру 9.2 и расщеплении сложного эфира получали соединение
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-карбоксиэтил)фенил]тиено[2,3-b]пиридин ("А28"), M+H+ 412,44
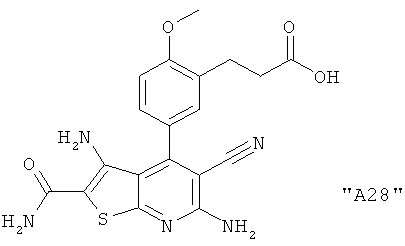 .
.
Пример 10
Смесь "А26а", "А29а"
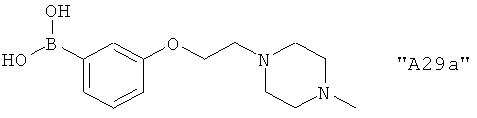 ,
,
пропанола, ацетата палладия(II), трифенилфосфина, раствора карбоната натрия и воды нагревали в течение 16 часов в атмосфере N2 и в колбе с обратным холодильником в реакции Сузуки. Смесь охлаждали, подвергали обычной обработке, получая соединение
2-аминокарбонил-3,6-диамино-5-циано-4-{4-метокси-3-[2-(4-метилпиперазин-1-ил)этокси]фенил}тиено[2,3-b]пиридин ("А29"), M+H+ 558,68
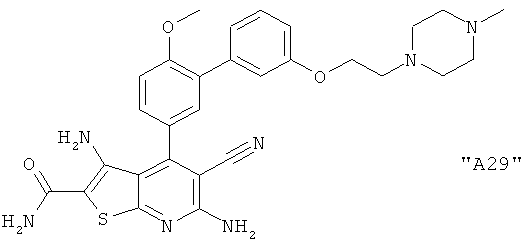
Пример 11
При осуществлении реакции "А30а"
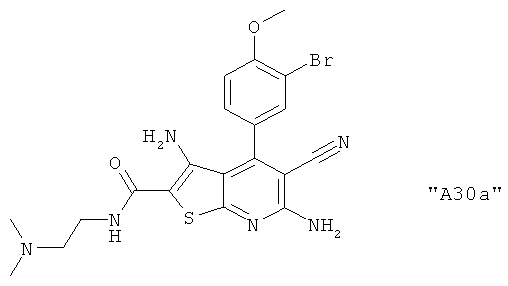
с "A30b"
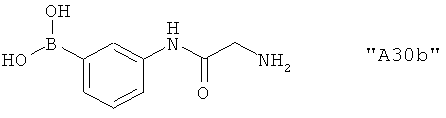
аналогично примеру 10 получали соединение 2-аминокарбонил-3,6-диамино-5-циано-4-{4-метокси-3-[3-(2-аминоацетиламино)фенил]фенил}тиено[2,3-b]пиридин ("А30"), M+H+ 559,66
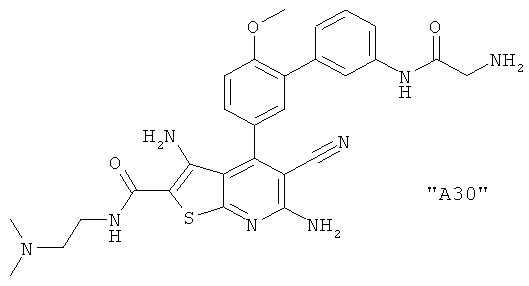
Пример 12
При осуществлении реакции "A31a"
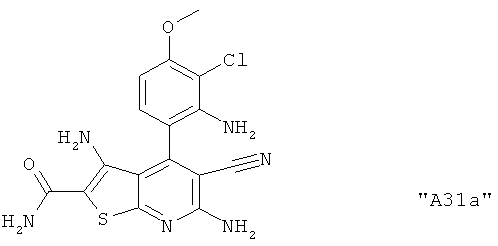
с хлоридом метилового эфира глутаровой кислоты аналогично примеру 1 получали соединение "A31b"
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-хлор-2-(4-метоксикарбонилбутириламино)фенил]тиено[2,3-b]пиридин ("A31b").
При расщеплении его сложного эфира получали 2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-хлор-2-(4-карбоксибутириламино)фенил]тиено[2,3-b]пиридин ("A31"), М+Н+ 503,94
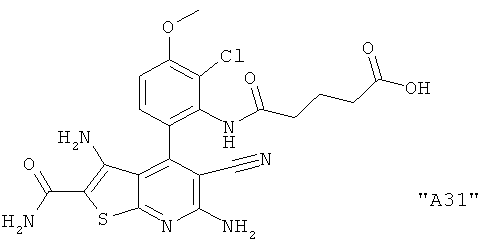 .
.
Пример 13
При осуществлении реакции "А32а"
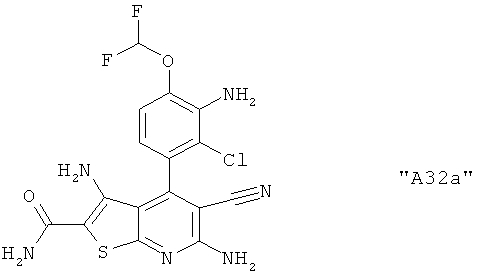
c ″A32b″
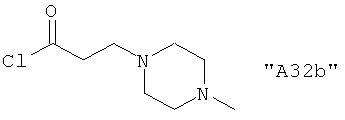
аналогично примеру 1 получали соединение "А32" 2-аминокарбонил-3,6-диамино-5-циано-4-{2-хлор-4-дифторметокси-3-[3-(4-метилпиперазин-1-ил)пропиониламино]фенил}тиено[2,3-b]пиридин ("А32"), М+Н+ 580,03
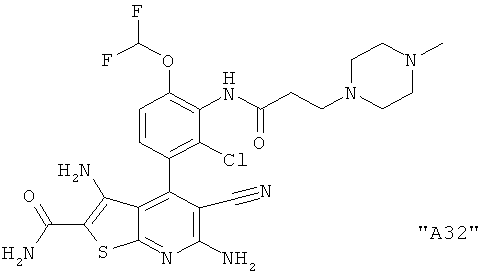
Пример 14
При осуществлении реакции "А33а"
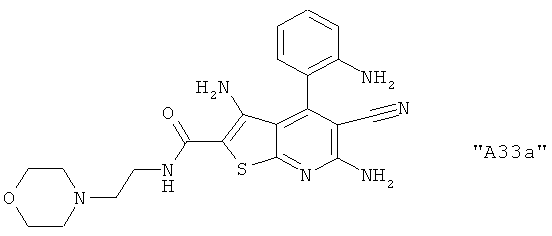
с хлоридом метилового эфира глутаровой кислоты аналогично примеру 1 получали соединение "A33b"
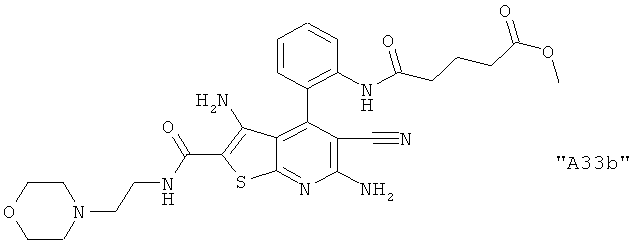
При расщеплении его сложного эфира получали 2-(2-морфолин-4-илэтилкарбамоил)-3,6-диамино-5-циано-4-[2-(4-карбоксибутириламино)фенил]тиено[2,3-b]пиридин ("А33"), М+Н+ 552,63.
Пример 15
При осуществлении реакции "А34а"
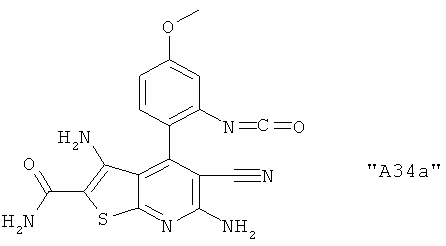
с бензиловым спиртом в стандартных условиях получали соединение 2-аминокарбонил-3,6-диамино-5-циано-4-[2-(бензилоксикарбониламино)фенил]тиено[2,3-b]пиридин ("А34"), М+H+ 489,53 ("А34")
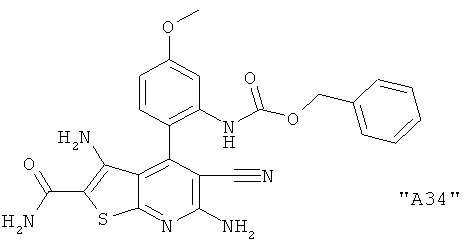 .
.
Пример 16
Следующие соединения получали аналогично Получению "А1":
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-трифтор-метилбензоиламино)фенил]тиено[2,3-b]пиридин ("А35"),
1Н ЯМР 250 МГц, ДМСО-d6) δ 9,99 (b), 8,16 (d, 1H), 7,92 (d, 2H), 7,37 (d, 2H), 7,02 (s, 1H), 5,90 (s, 1H), 3,96 (s, 3H);
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-трифтор-метилбензоиламино)фенил]тиено[2,3-b]пиридин ("А36").
Соединения
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(пиридин-4-ил-карбониламино)фенил]тиено[2,3-b]пиридин ("А37"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(проп-2-ил-карбониламино)фенил]тиено[2,3-b]пиридин ("А38"),
получали аналогично Получению "А 17".
Фармакологические данные
Сродство к рецепторам показано в таблице 1.
Нижеприведенные примеры относятся к фармацевтическим композициям.
Пример А: флаконы для инъекций
рН раствора 100 г активного компонента в соответствии с изобретением и 5 г Na2HPO4 в 3 л бидистиллированной воды устанавливали на 6,5, используя 2 н. соляную кислоту, стерилизовали фильтрацией, переносили во флаконы для инъекций, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждый флакон для инъекций содержит 5 мг активного компонента.
Пример Б: суппозитории
Смесь 20 г активного компонента в соответствии с изобретением расплавляли с 100 г соевого лецитина и 1400 г какаового масла, разливали в пресс-формы и охлаждали. Каждый суппозиторий содержит 20 мг активного компонента.
Пример В: раствор
Раствор приготавливали с 1 г активного компонента в соответствии с изобретением, 9,38 г NaH2PO4·2 H2O, 28,48 г Na2HPO4·12 H2O и 0,1 г бензалконийхлорида в 940 мл бидистиллированной воды. рН раствора устанавливали на 6,8, объем раствора доводили до 1 л и стерилизовали путем облучения. Этот раствор может использоваться в форме глазных капель.
Пример Г: мазь
500 мг активного компонента в соответствии с изобретением смешивали с 99,5 г
вазелина в асептических условиях.
Пример Д: таблетки
Смесь 1 кг активного компонента в соответствии с изобретением, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния спрессовывали для получения таблеток обычным способом таким образом, чтобы каждая таблетка содержала 10 мг активного компонента.
Пример Е: драже
Таблетки спрессовывали аналогично примеру Д и затем покрывали обычным способом покрытием из сахарозы, картофельного крахмала, талька, трагаканта и красителя.
Пример Ж: капсулы
2 кг активного компонента в соответствии с изобретением помещали в твердые желатиновые капсулы обычным способом таким образом, чтобы каждая капсула содержала 20 мг активного компонента.
Пример З: ампулы
Раствор 1 кг активного компонента в соответствии с изобретением в 60 л бидистиллированной воды стерилизовали фильтрацией, переносили в ампулы, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждая ампула содержит 10 мг активного компонента.
Источники ирформации







| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТРИАЗОЛА | 2006 |
|
RU2416605C2 |
| ПРОИЗВОДНЫЕ ФУРО[3,2-В]- И ТИЕНО[3,2-В]ПИРИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ TBK1 И IKKε | 2013 |
|
RU2622034C2 |
| ПРОИЗВОДНЫЕ 2-АМИНО-4-ФЕНИЛХИНАЗОЛИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ HSP90 МОДУЛЯТОРОВ | 2006 |
|
RU2421449C2 |
| 2-КАРБОКСАМИД ЦИКЛОАМИНО ПРОИЗВОДНЫЕ МОЧЕВИНЫ В КОМБИНАЦИИ С ИНГИБИТОРАМИ Hsp90 ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2624493C2 |
| Ингибиторы рецептора эпидермального фактора роста | 2018 |
|
RU2786524C2 |
| Ингибиторы рецептора эпидермального фактора роста | 2022 |
|
RU2821531C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ПРОИЗВОДНЫЕ ПИРИДО [4,3-d]ПИРИМИДИНА В КАЧЕСТВЕ ИНГИБИТОРА HSP90 И ИНГИБИТОРА HER2 | 2009 |
|
RU2532375C2 |
| ГИДРАЗОНО-МАЛОНИТРИЛЫ | 2002 |
|
RU2302412C2 |
| СПОСОБЫ И МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2788174C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИЗОИНДОЛОВ, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ, В ЧАСТНОСТИ В КАЧЕСТВЕ ИНГИБИТОРОВ АКТИВНОСТИ БЕЛКА-ШАПЕРОНА Hsp90 | 2006 |
|
RU2375361C2 |
Изобретение относится к конкретным производным тиенопиридина и к их фармацевтически пригодным солям, которые указаны в пункте 1 формулы. Изобретение также относится к лекарственным средствам на основе указанных соединений, являющихся ингибиторами HSP90. Технический результат - получены новые соединения и лекарственные средства на их основе, которые могут применяться для лечения заболеваний, на которые влияет ингибирование, регуляция и/или модуляция HSP90. 3 н.п. ф-лы, 1 табл.
1. Соединения, выбранные из группы, включающей
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-трифторметил бензоиламино)фенил]тиено[2,3-b]пиридин ("А1"),
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-ацетамидофенил)тиено[2,3-b]пиридин ("А2"),
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-трифтор-ацетамидо фенил)тиено[2,3-b]пиридин ("A3"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-метоксикарбонилбутириламино)фенил]тиено[2,3-b]пиридин ("А4а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(1Н-пиридин-2-он-4-карбониламино)фенил]тиено[2,3-b]пиридин("А5"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-метоксикарбонил бензоиламино)фенил]тиено[2,3-b]пиридин ("А6а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-метоксикарбонил метоксиацетамидо)фенил]тиено[2,3-b]пиридин ("А7а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-трифторметилфенилсульфонамидо)фенил]тиено[2,3-b]пиридин ("А9"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-карбоксибутириламино)фенил]тиено[2,3-b]пиридин ("А4"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-карбоксибензоил амино)фенил]тиено[2,3-b]пиридин ("A6"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-карбоксиметокси ацетамидо)фенил]тиено[2,3-b]пиридин ("А7"),
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-[(трет-бутилоксикарбонил)амино]ацетамидо}фенил)тиено[2,3-b]пиридин ("А10"),
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{3-[(трет-бутилоксикарбонил)амино]пропиониламино}фенил)тиено[2,3-b]пиридин ("А11"),
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{4-[(трет-бутилоксикарбонил)амино]бутириламино}фенил)тиено[2,3-b]пиридин ("А12"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(индол-7-илкарбониламино)фенил]тиено[2,3-b]пиридин ("А13"),
(S)-2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-3-{2-[(трет-бутилоксикарбонил)амино]-3-аминокарбонилпропиониламино}-фенил)тиено[2,3-b]пиридин ("А15а"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-[2-(2-карбамоилацетиламино)ацетиламино]фенил]тиено[2,3-b]пиридин ("А16"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(индазол-7-илкарбониламино)фенил]тиено[2,3-b]пиридин ("А17"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-амино-бутириламино)фенил]тиено[2,3-b]пиридин ("А22"),
2-аминокарбонил-3,6-диамино-5-циано-4-(4-метокси-2-бензоил-аминофенил)тиено[2,3-b]пиридин ("А8"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-(3-карбамоил пропиониламино)фенил]тиено[2,3-b]пиридин ("А19"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-[2-(фенил сульфонил)ацетиламино]фенил]тиено[2,3-b]пиридин ("А20"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-2-[2-(3-этилуреидо) этилкарбамоил]фенил]тиено[2,3-b]пиридин ("А23"),
2-аминокарбонил-3,6-диамино-5-циано-4-[3-(индазол-7-илкарбамоил)фенил]тиено[2,3-b]пиридин ("А24"),
2-аминокарбонил-3,6-диамино-5-циано-4-[5-хлор-3-(3-карбамоилпропилкарбамоил)фенил]тиено[2,3-b]пиридин ("А25"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(3-фторбензил)фенил]тиено[2,3-b]пиридин ("А26"),
2-аминокарбонил-3,6-диамино-5-циано-4-{3-хлор-4-метокси-2-[2-(пиридин-2-ил)этил]фенил}тиено[2,3-b]пиридин ("А27"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-карбоксиэтил)фенил]тиено[2,3-b]пиридин ("А28"),
2-аминокарбонил-3,6-диамино-5-циано-4-{4-метокси-3-[2-(4-метилпиперазин-1-ил)этокси]фенил}тиено[2,3-b]пиридин ("А29"),
2-аминокарбонил-3,6-диамино-5-циано-4-{4-метокси-3-[3-(2-аминоацетиламино)фенил]фенил}тиено[2,3-b]пиридин ("А30"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-хлор-2-(4-карбоксибутириламино)фенил]тиено[2,3-b]пиридин ("A31"),
2-аминокарбонил-3,6-диамино-5-циано-4-{2-хлор-4-дифтор-метокси-3-[3-(4-метилпиперазин-1-ил)пропиониламино]фенил}тиено-[2,3-b]пиридин ("А32"),
2-(2-морфолин-4-илэтилкарбамоил)-3,6-диамино-5-циано-4-[2-(4-карбоксибутириламино)фенил]тиено[2,3-b]пиридин ("А33"),
2-аминокарбонил-3,6-диамино-5-циано-4-[2-(бензилоксикарбониламино)фенил]тиено[2,3-b]пиридин ("А34"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(4-трифторметилбензоиламино)фенил]тиено[2,3-b]пиридин ("А35"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(2-трифторметилбензоиламино)фенил]тиено[2,3-b]пиридин ("А36"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(пиридин-4-илкарбониламино)фенил]тиено[2,3-b]пиридин ("А37"),
2-аминокарбонил-3,6-диамино-5-циано-4-[4-метокси-3-(проп-2-илкарбониламино)фенил]тиено[2,3-b]пиридин ("A38"),
и их фармацевтически пригодные соли.
2. Лекарственные средства, обладающие ингибирующим действием в отношении HSP90, содержащие по меньшей мере одно соединение по п.1 и/или его фармацевтически пригодную соль, и необязательно наполнители и/или вспомогательные вещества.
3. Применение соединений по п.1 и их фармацевтически пригодных солей для приготовления лекарственного средства, предназначенного для лечения и/или профилактики заболеваний, на которые влияет ингибирование, регуляция и/или модуляция HSP90.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ДЬЯЧЕНКО В.Д | |||
| и др | |||
| Журнал органической химии, т.33, вып.7, 1997, стр.1084-1087 | |||
| WO 2005021552 А1, 10.03.2005 | |||
| RU 97109827 А, 20.07.1999. | |||
Авторы
Даты
2011-04-10—Публикация
2006-05-11—Подача