Изобретение относится к области медицины, конкретно к способам получения полипептидов, обладающих выраженным анальгетическим действием.
Известно, что ядовитые морские кишечнополостные актинии, являются богатейшим источником биологически активных соединений полипептидной природы, выполняющих алломональную и экологическую роль в морских биоценозах. К настоящему времени из них выделено более четырех десятков соединений, которые принадлежат к различным функциональным группам белков и полипептидов и взаимодействуют с высокой селективностью с различными мишенями, в том числе с болевыми рецеторами [Diochot S., Baron A., Rash L.D., Deval E., Escoubas P., Scarzello S., Salinas M., Lazdunski M. A new sea anemone peptide, APETx2, inhibits ASIC3, a major acid-sensitive channel in sensory neurons // The EMBO Journal 2004, V.23, P.1516-1525; Shiomi К. Novel peptide toxins recently isolated from sea anemones, Toxicon (2009), doi: 10.1016 / j. toxicon. 2009.02.031].
Заявителем совместно с Институтом биоорганической химии РАН им. академиков М.М.Шемякина и Ю.А.Овчинникова впервые был выделен из актинии Heteractis crispa полипептид АРНС1, имеющий структуру ингибитора протеиназ семейства BPTI/Кунитц-типа и обладающий значительной анальгетической активностью in vivo [Andreev Y.A., Kozlov S.A., Koshelev S.G., Ivanova E.A., Monastyrnaya М.М., Kozlovskaya E.P., Grishin E.V. Analgesic compound from sea anemone Heteractis crispa is the first polypeptide inhibitor of vanilloid receptor 1 (TRPV1) // J. Biol. Chem. 2008, V.283, P.23914-23921]. Авторами было показано, что анальгетический эффект полипептида АРНС1, а также полученной на его основе рекомбинантной формы полипептида связан с модулированием (частичным блокированием) болевого ваниллоидного рецептора TRPV1, одного из важнейших интеграторов болевых и воспалительных стимулов и одну из перспективных терапевтических мишеней в лечении болевых состояний.
Аминокислотная последовательность полипептида из актинии Heteractis crispa и получение его рекомбинантной формы были запатентованы, поскольку он является первым полипептидом направленного действия на болевой рецептор TRPV1, перспективным для использования в медицине [RU 2368621 С1, 27.09.2009].
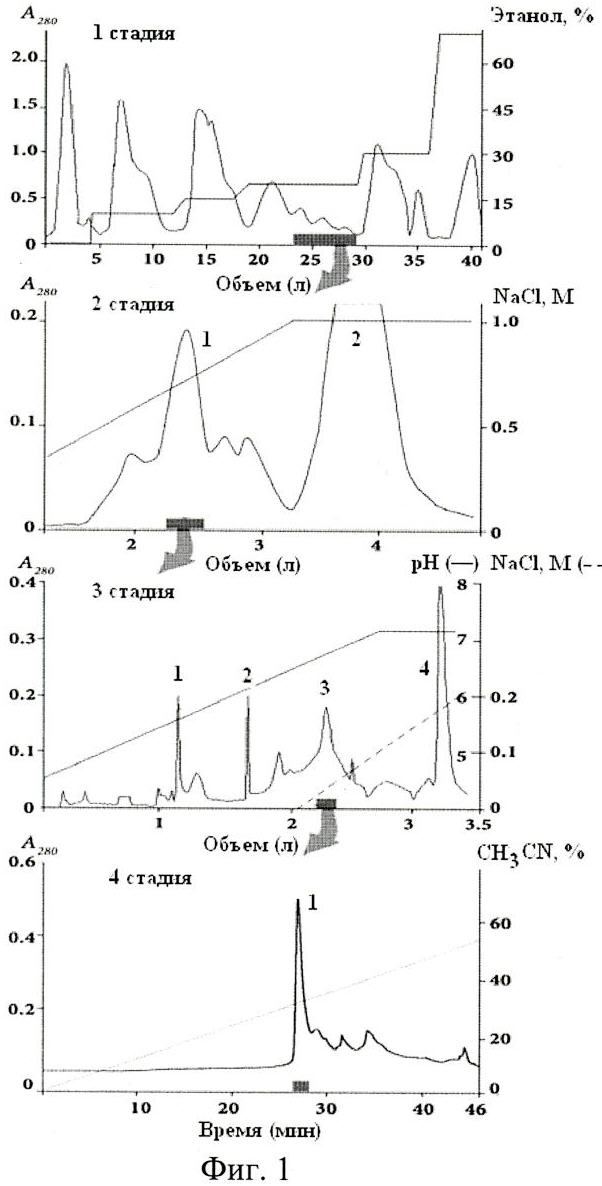
Способ выделения ингибитора болевого рецептора TRPV1 включает следующие стадии: экстракцию полипептидов 70%-ным водным этанолом; гидрофобную хроматографию полипептидов на полихроме-1 в ступенчатом градиенте этанола от 10 до 70%; катионообменную хроматографию на Bio-Rex 70 в линейном градиенте концентрации NaCl от 0 до 0,5 М (в 5 мМ аммоний-ацетатном буферном растворе, рН 4,5); катионообменную хроматографию на SP-Sephadex C-25 в линейном градиенте рН от 4,5 до 7,3 (в 5 мМ аммоний-ацетатном буферном растворе) и градиенте концентрации NaCl от 0 до 0,2 М; а также обращенно-фазовую ВЭЖХ активной фракции полипептидов на колонке Jupiter C5 в линейном градиенте концентрации ацетонитрила от 5 до 60% в присутствии 0,1% ТФУ.
Длительность этого способа составляет 158 ч, выход целевого продукта - 0,025% от суммарного белка в экстракте.
К недостаткам способа-прототипа относятся его длительность, трудоемкость и низкий выход целевого продукта.
Задачей изобретения является усовершенствование известного способа получения полипептида актинии Heteractis crispa, обладающего анальгетическим действием.
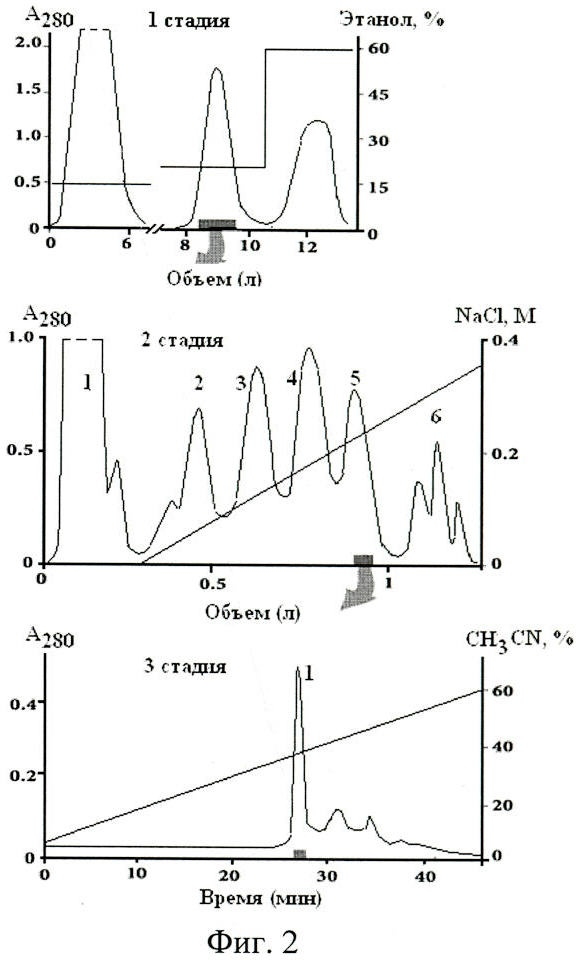
Поставленная задача решена тем, что в известном способе получения полипептида из актинии Heteractis crispa, обладающего анальгетическим действием, включающем гомогенизацию актинии, экстракцию активной фракции полипептидов 70% водным этанолом и последующую хроматографическую очистку целевого продукта, согласно изобретению очистку активной фракции осуществляют на полихроме-1 в статическом варианте элюцией балластных белков 15%-ным водным этанолом; фракции полипептидов, проявляющих анальгетический эффект на тепловой модели, элюируют 20%-ным этанолом. Затем полученную фракцию полипептидов очищают хроматографией на Cellulose СМ-32 в линейном градиенте концентрации NaCl от 0 до 0,5 М в 0,01 М аммоний-ацетатном буферном растворе (pH 6.0). Далее фракцию, проявляющую выраженный анальгетический эффект на тепловой модели, подвергают ВЭЖХ на обращенной фазе Nucleosil C18, уравновешенной 5%-ным ацетонитрилом в 0,1%-ном водном растворе трифторуксусной кислоты (pH 2.2), элюируя конечный активный полипептид-анальгетик в линейном градиенте концентрации ацетонитрила (5-60%) в 0,1%-ном водном растворе трифторуксусной кислоты.
Технический результат, обеспечиваемый изобретением, заключается в увеличении выхода целевого продукта, в упрощении способа его выделения, что снижает трудозатраты на его очистку и тем самым снижает себестоимость целевого продукта.
Низкая эффективность выделения анальгетического полипептида по способу-прототипу обусловлена использованием гидрофобной хроматографии в колоночном варианте и ионообменной хроматографии на смолах Bio-Rex 70 и SP-Sephadex C25. Высокая обменная емкость этих смол (3,3 мэкв/мл у Bio-Rex 70 и 2,3±0,3 мэкв/мл у SP-Sephadex C25) обусловливает многоточечное связывание с ними элюируемых белков и, как следствие, их неудовлетворительное разрешение. Низкий выход целевого продукта связан, по-видимому, также со значительными гидрофобными взаимодействиями и образованием водородных связей аминокислотных остатков элюируемых белков с материалом матриц, что приводило к заметной сорбции белков актинии носителями Bio-Rex 70 и SP-Sephadex C25.
Использование в заявляемом способе Cellulose CM-32 в предлагаемых условиях выделения позволило устранить вышеперечисленные недостатки, как следует из сравнительных данных, приведенных в таблице. Преимущество предлагаемого приема выделения не является очевидным, т.к. невозможно заранее предсказать поведение белков при хроматографировании на этом носителе ввиду многокомпонентности экстракта актинии, содержащего помимо полипептида-анальгетика массу балластных белков.
Так, например, ранее сочетание смол Bio-Rex 70 и SP-Sephadex C25 было успешно использовано заявителем для выделения нескольких нейротоксинов из актинии Radianthus macrodactylus (в настоящее время этот вид актинии называется Heteractis crispa), причем после хроматографии на SP-Sephadex C25 белковые фракции, содержавшие нейротоксины, элюировались с очень хорошим разрешением и, практически, в индивидуальном состоянии [Зыкова Т.А., Винокуров Л.М., Козловская Э.П., Еляков Г.Б. Аминокислотная последовательность нейротоксина III из актинии Radianthus macrodactylus // Биоорган, химия 1985. Т.11, С.302-310]. В то же время применение Bio-Rex 70 и SP-Sephadex C25 для ионообменной хроматографии белковых фракций в способе-прототипе оказалось менее эффективным (фиг.1, стадии 2 и 3).
Применение гидрофобной хроматографии в статическом варианте (на воронке Шотта), предложенное в заявляемом способе, значительно уменьшило как время элюции белков (фиг.2, 1 стадия), так и их возможную денатурацию, связанную с гидрофобными взаимодействиями белковых глобул с материалом матрицы.
Предлагаемый способ осуществляют следующим образом.
Актинии Heteractis crispa гомогенизируют и экстрагируют активную фракцию полипептидов 70%-ным этанолом в течение 12 часов при 4°С, затем супернатант отделяют центрифугированием, после чего этанол упаривают. Полученный прозрачный раствор (20 мг/мл белка по Лоури) наносят на фильтровальную воронку Шотта с полихромом-1 (14×8 см), уравновешенным дистиллированной водой. Элюцию балластных белков и полипептидов осуществляют 15%-ным этанолом, фракцию полипептидов, проявляющих анальгетический эффект на тепловой модели, элюируют 20%-ным этанолом. Полученную фракцию полипептидов хроматографируют на колонке с ионообменной смолой Cellulose CM-32. Элюцию полипептидов, проявляющих анальгетический эффект на тепловой модели, осуществляют в линейной градиенте концентрации NaCl от 0 до 0,5 М в рабочем буферном растворе. Фракции, проявляющие анальгетический эффект на тепловой модели, объединяют и используют для дальнейшей очистки с помощью обращенно-фазовой ВЭЖХ.
Данные по выходу и времени хроматографии на каждой стадии выделения полипептидных фракций представлены в таблице.
Из представленной таблицы видно, что длительность заявляемого способа составляет 31 ч - это в 5 раз меньше длительности способа-прототипа (158 ч). Выход целевого продукта - 0,3% от суммарного белка в экстракте, что в 12 раз превышает его выход по способу прототипу (0,025%).
На фиг.1 представлены стадии выделения анальгетического полипептида из Heteractis crispa по способу-прототипу.
На фиг.2 представлены стадии выделения анальгетического полипептида из Heteractis crispa по заявляемому способу.
Стрелками показаны объединенные фракции полипептидов, проявляющих анальгетический эффект на модели тепловой стимуляции боли. Скорость элюции полипептидов на колонке с полихромом-1 - 1,2 л/ч, на воронке Шотта с полихромом-1 - 5 л/ч; на Bio-Rex 70 - 22 мл/ч мин; на SP-Sephadex С-25 - 70 мл/ч; на Cellulose СМ-32 - 24 мл/ч.
Изобретение иллюстрируется примером конкретного выполнения.
Пример. 5 кг актинии Heteractis crispa, свежевыловленной или хранящейся в замороженном состоянии, измельчают и экстрагируют активную фракцию полипептидов 70%-ным этанолом в течение 12 часов при 4°С при соотношении ткань: этанол 1:3, затем супернатант отделяют центрифугированием при 3000×g в течение 0,5 ч, после чего этанол упаривают. Полученный прозрачный раствор (1 л, 20 мг/мл белка по Лоури) наносят на воронку Шотта с полихромом-1 (14×8 см), уравновешенным дистиллированной водой. Элюцию балластных белков и полипептидов осуществляют 15%-ным этанолом (6 л). Затем фракцию активных полипептидов элюируют 20%-ным этанолом (1,5 л) со скоростью элюции 500 мл/5 мин. После упаривания и концентрирования на полихроме-1 полипептиды хроматографируют на колонке (2,5×50 см) с Cellulose CM-32 (Whatman, Англия), уравновешенной 0,01 М аммоний-ацетатным буферным раствором, рН 5,14. Элюцию полипептидов осуществляют в линейном градиенте концентрации NaCl от 0 до 0,5 М в рабочем буферном растворе по 1 л каждого. Фракции, проявляющие выраженный анальгетический эффект на тепловой модели, объединяют и используют для обращенно-фазовой ВЭЖХ на колонке Nucleosil С18, уравновешенной 5%-ным ацетонитрилом в 0,1%-ном водном растворе ТФУ. Элюцию проводят линейным градиентом концентрации ацетонитрила (5-60%) в 0,1%-ном водном растворе ТФУ. Целевой продукт элюируется с колонки 40% ацетонитрилом с выходом 0,3% от суммарного белка в экстракте актинии.
Препарат полипептида, полученный предлагаемым способом, является индивидуальным соединением. Его гомогенность доказана методами SDS-электрофореза в 15%-ном ПААГ (полиакриламидном геле) и МАЛДИ-ТОФ-МС (матричной лазерной десорбционно-ионизационной времяпролетной масс-спектрометрией).
Для подтверждения идентичности полученного полипептида-анальгетика анальгетику-прототипу определена его аминокислотная последовательность методом деградации по Эдману на автоматическом секвенаторе Procise 492 (Applied Biosystems, США). Предварительно дисульфидные связи были восстановлены дитиотреитолом, после чего полипептид был актилирован 4-винилпиридином для защиты образовавшихся сульфгидрильных групп. Модифицированный полипептид (фракция, соответствующая восстановлению всех дисульфидных связей) был выделен из реакционной смеси с помощью обращенно-фазовой ВЭЖХ на колонке Nucleosil C18 и затем подвергнут трипсинолизу (гидролиз пептидных связей по остаткам лизина и аргинина).
В результате разделения продуктов гидролиза с помощью обращенно-фазовой ВЭЖХ было выделено 7 триптических пептидов, секвенирование которых позволило установить их последовательность (GSICLEPK, VVGPCTAYFR, VVGPCTAYFRR, FYFDSETGK, CTVFIYGGCEGNGNNFETLR, ACR, AICRA). Сравнение последовательностей полученных триптических пептидов с аминокислотной последовательностью анальгетика-прототипа показало полную идентичность полипептидов:
GSICLEPKVVGPCTAYFRRFYFDSETGKCTVFIYGGCEGNGNNFETLRACRAICRA
Молекула ингибитора состоит из 56 аминокислотных остатков, его точная молекулярная масса равна 6187 Да, что хорошо согласуется с данными масс-спектрометрического анализа.
Анальгетический эффект, проявляемый белковыми фракциями на стадиях гидрофобной и ионообменной хроматографии, а также конечного продукта, определяют на экспериментальных животных (мышах) в биологическом тесте теплового стимулирования боли по отдергиванию лапки (измеряют увеличение времени, прошедшего с момента погружения лапки в горячую воду (50°С) до момента ее отдергивания).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИПЕПТИД АКТИНИИ, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 2009 |
|
RU2404245C1 |
| ПОЛИПЕПТИД АКТИНИИ, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 2008 |
|
RU2368621C1 |
| ПОЛИПЕПТИД ИЗ МОРСКОЙ АНЕМОНЫ HETERACtis crispa, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 2012 |
|
RU2475497C1 |
| Полипептид из морской анемоны Heteractis magnifica, ингибирующий α-амилазы млекопитающих, и его применение в качестве ингибитора α-амилаз млекопитающих, а также средства для лечения и/или профилактики постпрандиальной гипергликемии, коррекции лишнего веса и ожирения | 2022 |
|
RU2796823C1 |
| Рекомбинантная плазмидная ДНК pSMT3_HCRG21, кодирующая гибридный белок SMT3-HCRG21, штамм бактерий Escherichia coli BL21(DE3)/pSMT3_HCRG21 - продуцент анальгетического пептида HCRG21 и способ получения рекомбинантного анальгетического пептида HCRG21 | 2022 |
|
RU2798545C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЛКОВЫХ ИНГИБИТОРОВ ГЛЮКАНАЗ | 1999 |
|
RU2162708C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ СПОСОБНОСТЬЮ ПО ОТНОШЕНИЮ К ОБРАТНОЙ ТРАНСКРИПТАЗЕ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2006 |
|
RU2314818C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОВОИНГИБИТОРА | 1997 |
|
RU2129438C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pMSIN4, КОДИРУЮЩАЯ ГИБРИДНЫЙ ПОЛИПЕПТИД - ПРЕДШЕСТВЕННИК ИНСУЛИНА ЧЕЛОВЕКА, ШТАММ BL21(DE3)/pMSIN4-ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНСУЛИНА ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИНСУЛИНА ЧЕЛОВЕКА | 2011 |
|
RU2447149C1 |
| Способ получения пептида, модулирующего активность пуринергических рецепторов | 2019 |
|
RU2714114C1 |
Изобретение относится к области биотехнологии, конкретно к способам получения полипептидов, обладающих выраженным анальгетическим действием. Способ включает гомогенизацию актинии Heteractis crispa, этанольную экстракцию полипептидов, гидрофобную хроматографию на полихроме-1, последующую очистку целевого продукта ионообменной хроматографией и обращенно-фазовой ВЭЖХ. Гидрофобную хроматографию на полихроме-1 осуществляют в статическом варианте, а ионообменную хроматографию осуществляют на Cellulose СМ-32. Изобретение позволяет увеличить выход целевого продукта в 12 раз. 2 ил., 1 табл.
Способ получения полипептида из актинии Heteractis crispa, обладающего анальгетическим действием, включающий гомогенизацию актинии, экстракцию активной фракции полипептидов 70%-ным водным этанолом и последующую хроматографическую очистку целевого продукта, отличающийся тем, что очистку активной фракции осуществляют на полихроме-1 в статическом варианте элюцией балластных белков 15%-ным водным этанолом, фракции полипептидов, проявляющих анальгетический эффект на модели тепловой стимуляции боли, элюируют 20%-ным этанолом, затем полученную фракцию полипептидов очищают хроматографией на Cellulose CM-32 в линейном градиенте концентрации NaCl от 0 до 0,5 М в 0,01 М аммоний-ацетатном буферном растворе рН 6,0, далее фракцию, проявляющую выраженный анальгетический эффект на модели тепловой стимуляции боли, подвергают ВЭЖХ на обращенной фазе Nucleosil С18, уравновешенной 5%-ным ацетонитрилом в 0,1%-ном водном растворе трифторуксусной кислоты рН 2,2, элюируя конечный активный полипептид-анальгетик в линейном градиенте концентрации ацетонитрила 5-60% в 0,1%-ном водном растворе трифторуксусной кислоты.
| ПОЛИПЕПТИД АКТИНИИ, ОБЛАДАЮЩИЙ АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 2008 |
|
RU2368621C1 |
| ИЛЬИНА А.Р | |||
| и др.: «Актинопорины из актинии японского моря Oulactis orientalis: выделение и частичная характеристика» | |||
| Биоорганическая химия, 2005, Т.31, №1, стр.39-48. | |||
Авторы
Даты
2011-04-10—Публикация
2009-11-30—Подача