Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям, которые связываются с нейронными никотиновыми ацетилхолиновыми рецепторами и модулируют их активность, к способам получения этих соединений, к фармацевтическим композициям, содержащим эти соединения, и к способам применения этих соединений для лечения разнообразных состояний и расстройств, включая те, которые связаны с дисфункцией центральной нервной системы (CNS).
Уровень техники
Терапевтический потенциал соединений, которые нацелены на нейронные никотиновые рецепторы (NNR), известные также как никотиновые ацетилхолиновые рецепторы (nAChR), является объектом нескольких недавних обзоров. См., Breining et al., Ann. Rep. Med. Chem. 40:3 (2005), Hogg and Bertrand, Curr. Drug Targets: CNS Neurol. Disord. 3:123 (2004), Suto and Zacharias, Expert Opin. Ther. Targets 8:61 (2004), Dani et al., Bioorg. Med. Chem. Lett. 14:1837 (2004), Bencherif and Schmitt, Curr. Drug Targets: CNS Neurol. Disord. 1:349 (2002), каждая из них включается сюда в виде ссылки по отношению к данной концепции. К показаниям, по которым лиганды NNR предлагаются в качестве терапевтических средств, относятся когнитивные расстройства и дисфункции, включая болезнь Альцгеймера, расстройство дефицита внимания и шизофрению. См. Newhouse et al., Curr. Opin. Pharmacol. 4:36 (2004), Levin and Rozvani, Curr. Drug Targets: CNS Neurol. Disord. 1:423 (2002), Graham et al., Curr. Drug Targets: CNS Neurol. Disord. 1:387 (2002), Ripoll et al., Curr. Med. Res. Opin. 20(7):1057 (2004), и McEvoy and Allen, Curr. Drug Targets: CNS Neurol. Disord. 1:433 (2002)); боль и воспаление (Decker et al., Curr. Top. Med. Chem. 4(3):369 (2004), Vincler, Expert Opin. Invest. Drugs 14(10):1191 (2005), Jain, Curr. Opin. Inv. Drugs 5:76 (2004), Miao et al., Neuroscience 123:777 (2004)); депрессия и страх (Shytle et al., Mol. Psychiatry 7:525 (2002), Damaj et al., Mol. Pharmacol. 66:675 (2004), Shytle et al., Depress. Anxiety 16:89 (2002)); нейродегенерация (O'Neill et al. Curr. Drug Targets: CNS Neurol. Disord. 1:399 (2002), Takata et al., J. Pharmacol. Exp. Ther. 306:772 (2003), Marrero et al., J. Pharmacol. Exp. Ther. 309:16 (2004)); болезнь Паркинсона (Jonnala and Buccafusco, J. Neurosci. Res. 66:565 (2001)); зависимость (Dwoskin and Crooks, Biochem. Pharmacol. 63:89 (2002), Coe et al., Bioorg. Med. Chem. Lett. 15(22):4889 (2005)); ожирение (Li et al., Curr. Top. Med. Chem. 3:899 (2003)) и синдром Туретта (Sacco et al., J. Psychopharmacol. 18(4):457 (2004), Young et al., Clin. Ther. 23(4):532 (2001); каждая из них включается сюда в виде ссылки по отношению к данной концепции.
Ограничение по использованию некоторых никотиновых соединений заключается в том, что оно связано с различными нежелательными побочными воздействиями, например, за счет стимуляции мышц и ганглионарных рецепторов. Было бы желательно предоставление соединений, композиций и способов предотвращения и/или лечения различных состояний или расстройств (например, расстройств CNS), включая облегчение симптомов этих расстройств, где соединения демонстрируют фармакологическое воздействие на никотиновые рецепторы с преимущественным воздействием (например, на функционирование CNS), но без значительных побочных воздействий, связанных с этим. Кроме того, было бы в высшей степени желательным получение соединений, композиций и способов, которые воздействуют на функции CNS без значительного воздействия на те подтипы рецепторов, которые имеют принципиальную возможность вызывать нежелательные побочные воздействия (например, заметную активность в сердечно-сосудистых активных центрах и в активных центрах скелетных мышц). Настоящее изобретение предусматривает такие соединения, композиции и способы.
Сущность изобретения
Настоящее изобретение включает соединение формулы 1:

или его фармацевтически приемлемую соль;
где изображенная пунктирной линией связь обозначает либо одинарную, либо двойную связь;
n равно 0 или 1;
X представляет собой -ORI, -NRIIRIII, -NRIIORIII или -RIV, когда n равно 0, и
X представляет собой -NRIIRIII, -NRIIORIII или -RIV, когда n равно 1;
где каждый из RI и RIV по отдельности представляет собой алкил, циклоалкил, замещенный алкил, замещенный циклоалкил, алкенил, циклоалкенил, замещенный алкенил, замещенный циклоалкенил, гетероциклил, замещенный гетероциклил, арил, гетероарил, замещенный арил, замещенный гетероарил, арилалкил, гетероарилалкил, замещенный арилалкил или замещенный гетероарилалкил;
каждый из RII и RIII по отдельности представляет собой водород, алкил, циклоалкил, замещенный алкил, замещенный циклоалкил, алкенил, циклоалкенил, замещенный алкенил, замещенный циклоалкенил, гетероциклил, замещенный гетероциклил, арил, гетероарил, замещенный арил, замещенный гетероарил, арилалкил, гетероарилалкил, замещенный арилалкил или замещенный гетероарилалкил;
или RII и RIII вместе могут быть объединены с атомами, к которым они присоединены, с образованием трех-восьмичленного кольца;
где термин «замещенный» относится к наличию одного или нескольких остатков алкила, циклоалкила, алкенила, циклоалкенила, гетероциклила, арила, гетероарила, галогена, -OR', -NRaRb, галогеналкила, -CN, -NO2, -C=CRa, -SRa, -N3, -C(=O)NRaRb, -NRaC(=O)Rb, -C(=O)Ra, -C(=O)ORa, -OC(=O)Ra, -OC(=O)NRaRb, -NRaC(=O)ORb, -SO2Ra, -SO2NRaRb, или -NRaSO2Rb, где каждый из Ra и Rb по отдельности представляет собой водород, алкил, циклоалкил, гетероциклил, арил или арилалкил.
Один из вариантов осуществления настоящего изобретения включает соединения по настоящему изобретению в выделенной форме.
Один из вариантов осуществления настоящего изобретения включает соединение, где n равно 0. Дополнительный вариант осуществления включает соединение, где X представляет собой -ORI и RI представляет собой алкил, алкил, замещенный галогеном, циклоалкил или гетероциклил, алкенил, алкинил, циклоалкил, циклоалкенил, гетероциклил, арил или арилалкил. Дополнительный вариант осуществления включает соединение, где X представляет собой -NRIIRIII, RII представляет собой водород или алкил и RIII представляет собой водород, алкил, алкил, замещенный галогеном, алкил, замещенный NH2, алкенил, алкинил, циклоалкил, гетероциклил, арил, арил, замещенный галогеном, гетероарил или арилалкил. Дополнительный вариант осуществления включает соединение, где X представляет собой -NRIIORIII, RII представляет собой водород или алкил и RIII представляет собой алкил. Дополнительный вариант осуществления включает соединение, где X представляет собой -RIV и RIV представляет собой алкил, алкил, замещенный галогеном, алкенил, циклоалкил, гетероциклил, арил, арил, замещенный галогеном, гетероарил или гетероарил, замещенный галогеном, циано или алкилом.
Один из вариантов осуществления настоящего изобретения включает соединение, где n равно 1. Дополнительный вариант осуществления включает соединение, где X представляет собой -ORI и RI представляет собой алкил, алкил, замещенный галогеном, циклоалкил или гетероциклил, алкенил, алкинил, циклоалкил, циклоалкенил, гетероциклил, арил или арилалкил. Дополнительный вариант осуществления включает соединение, где X представляет собой -NRIIRIII, RII представляет собой водород или алкил и RIII представляет собой водород, алкил, алкил, замещенный галогеном, алкил, замещенный алкокси, алкил, замещенный NH2, алкенил, алкинил, циклоалкил, арил, арил, замещенный галогеном, гетероарил или арилалкил. Дополнительный вариант осуществления включает соединение, где X представляет собой -RIV и RIV представляет собой алкил, алкил, замещенный галогеном, алкенил, циклоалкил, гетероциклил, арил, арил, замещенный галогеном, гетероарил или гетероарил, замещенный галогеном, циано или алкилом.
Один из вариантов осуществления настоящего изобретения включает применение соединения в соответствии с настоящим изобретением для получения лекарственного средства для лечения расстройств центральной нервной системы.
Один из вариантов осуществления настоящего изобретения включает способ лечения или предотвращения расстройств центральной нервной системы, включающий введение соединения по настоящему изобретению. Дополнительный вариант осуществления включает способ, где расстройство выбирают из группы, состоящей из возрастного ослабления памяти, легкого ослабления когнитивной функции, предстарческой деменции, ранней болезни Альцгеймера, старческой деменции, слабоумия типа Альцгеймера, деменции с тельцами Леви, сосудистой деменции, болезни Альцгеймера, инсульта, комплекса слабоумия при СПИДе, расстройства дефицита внимания, расстройства дефицита внимания с гиперактивностью, дислексии, шизофрении, шизофреноформного расстройства и шизоаффективного расстройства.
Один из вариантов осуществления настоящего изобретения включает фармацевтическую композицию, содержащую соединение по настоящему изобретению и один или несколько фармацевтически приемлемых разбавителей, наполнителей, или инертных носителей. Дополнительный вариант осуществления включает фармацевтическую композицию для лечения или предотвращения расстройств центральной нервной системы.
Один из вариантов осуществления настоящего изобретения включает соединение, выбранное из:
1-(3-азабицикло[3.3.0]окт-7-ил)-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-фтор-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-метокси-1-этанон,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-изопропокси-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-1-пропанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-1-бутанона,
транс-1-(3-азабицикло[3.3.0]окт-7-ил)-2-бутен-1-она,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-метил-1-пропанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2,2-диметил-1-пропанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-1-пентанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-метил-1-бутанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-3-метил-1-бутанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-3,3-диметил-1-бутанона,
циклопропил(3-азабицикло[3.3.0]окт-7-ил)метанона,
циклобутил(3-азабицикло[3.3.0]окт-7-ил)метанона,
циклопентил(3-азабицикло[3.3.0]окт-7-ил)метанона,
циклогексил(3-азабицикло[3.3.0]окт-7-ил)метанона,
тетрагидропиран-4-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
4-фторфенил(3-азабицикло[3.3.0]окт-7-ил)метанона,
фуран-2-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
фуран-2-ил(3-азабицикло[3.3.0]окт-6-ен-7-ил)метанона,
3-бромфуран-2-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
3-цианофуран-2-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
5-метил-2-фуранил(3-азабицикло[3.3.0]окт-7-ил)метанона,
пиридин-4-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
(2-(гидроксиметил)-1-пирролидинил)(3-азабицикло[3.3.0]окт-7-ил)метанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-фтор-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-бром-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-метокси-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-изопропокси-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-пропанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-бутанона,
транс-1-(3-азабицикло[3.3.1]нон-7-ил)-2-бутен-1-она,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-метил-1-пропанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2,2-диметил-1-пропанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-пентанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-метил-1-бутанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-3-метил-1-бутанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-3,3-диметил-1-бутанона,
циклопропил(3-азабицикло[3.3.1]нон-7-ил)метанона,
циклобутил(3-азабицикло[3.3.1]нон-7-ил)метанона,
циклопентил(3-азабицикло[3.3.1]нон-7-ил)метанона,
циклогексил(3-азабицикло[3.3.1]нон-7-ил)метанона,
тетрагидропиран-4-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
4-фторфенил(3-азабицикло[3.3.1]нон-7-ил)метанона,
фуран-2-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
3-бромфуран-2-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
3-цианофуран-2-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
5-метил-2-фуранил(3-азабицикло[3.3.1]нон-7-ил)метанона,
пиридин-4-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
метил 3-азабицикло[3.3.0]октан-7-карбоксилата,
метил 3-азабицикло[3.3.0]окт-6-ен-7-карбоксилата,
этил 3-азабицикло[3.3.0]октан-7-карбоксилата,
изопропил 3-азабицикло[3.3.0]октан-7-карбоксилата,
2,2-диметилпропил 3-азабицикло[3.3.0]октан-7-карбоксилата,
2-фторэтил 3-азабицикло[3.3.0]октан-7-карбоксилата,
1-фторпроп-2-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклопропилметил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклобутил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклопентил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклогексил 3-азабицикло[3.3.0]октан-7-карбоксилата,
пент-4-ен-2-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
пент-4-ин-2-ил 3-азабицикло[3.3.0.]октан-7-карбоксилата,
циклопент-3-ен-1-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
(тетрагидрофуран-3-ил)метил 3-азабицикло[3.3.0]октан-7-карбоксилата,
тетрагидрофуран-3-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
тетрагидропиран-4-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
(фуран-3-ил)метил 3-азабицикло[3.3.0]октан-7-карбоксилата,
бензил 3-азабицикло[3.3.0]октан-7-карбоксилата,
3-азабицикло[3.3.0]октан-7-карбоксамида,
N-аллил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(2-фуранилметил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-метил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-этил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(2-метоксиэтил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N,N-диметил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N,N-диметил-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамида,
N-изопропил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-циклопропил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-циклобутил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-циклопентил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-метил-N-метокси-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-метил-N-метокси-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамида,
N-метил-N-пропаргил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-фенил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(4-фторфенил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(пиридин-3-ил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-бензил-3-азабицикло[3.3.0]октан-7-карбоксамида,
(3-азабицикло[3.3.0]окт-7-ил)(2,3,6-тригидро-пиридин-1-ил)метанона,
(3-азабицикло[3.3.0]окт-7-ил)(2,6-метил-морфолин-1-ил)метанона,
(3-азабицикло[3.3.0]окт-6-ен-7-ил)(2,6-диметилморфолин-1-ил)метанона,
(3-азабицикло[3.3.0]окт-7-ил)(1-оксазинан-2-ил)метанона,
3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-этил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-метоксиэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N,N-диметил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-изопропил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-циклопропил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-циклобутил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-циклопентил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-метил-N-метокси-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-метил-N-пропаргил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-фенил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(4-фторфенил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(пиридин-3-ил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-бензил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-аминоэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-трет-бутил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-пропил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-аллил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-фторфенил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-втор-бутил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(циклопропилметил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-фторэтил)-3-азабицикло[3.3,1]нонан-7-карбоксамида,
N-(2,2,2-трифторэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(3-фторпропил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(3-циклопентенил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
(3-азабицикло[3.3.1]нон-7-ил)(2,3,6-тригидро-пиридин-1-ил)метанона,
(3-азабицикло[3.3.1]нон-7-ил)(2,6-метил-морфолин-1-ил)метанона,
(3-азабицикло[3.3.1]нон-7-ил)(1-оксазинан-2-ил)метанона,
4-морфолинил(3-азабицикло[3.3.1]нон-7-ил)метанона,
или его фармацевтически приемлемую соль.
Один из вариантов осуществления настоящего изобретения включает соединение, выбранное из описанных выше соединений, в выделенной форме.
Один из вариантов осуществления настоящего изобретения включает способ лечения или предотвращения расстройств центральной нервной системы, включающий введение соединений, выбранных из указанных выше. Один из вариантов осуществления настоящего изобретения включает способ лечения или предотвращения расстройств центральной нервной системы, включающий введение соли выбранного соединения. В таких вариантах осуществления, другой вариант осуществления включает способ, где расстройство выбирают из группы, состоящей из возрастного ослабления памяти, легкого ослабления когнитивной функции, предстарческой деменции, ранней болезни Альцгеймера, старческой деменции, деменции типа Альцгеймера, деменции с тельцами Леви, сосудистой деменции, болезни Альцгеймера, инсульта, комплекса слабоумия при СПИДе, расстройства дефицита внимания, расстройства дефицита внимания с гиперактивностью, дислексии, шизофрении, дефицита когнитивной функции при шизофрении, когнитивной дисфункции при шизофрении, шизофреноформного расстройства и шизоаффективного расстройства. В другом варианте осуществления, расстройство выбирают из группы, состоящей из деменции типа Альцгеймера от легкой до средней степени, расстройства дефицита внимания, легкого ослабления когнитивной функции и возрастного ослабления памяти.
Один из вариантов осуществления настоящего изобретения включает соединение, представляющее собой метил 3-азабицикло[3.3.0]октан-7-карбоксилат, в виде фармацевтически приемлемой соли.
Один из вариантов осуществления настоящего изобретения включает соединение, представляющее собой N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамид или его фармацевтически приемлемую соль.
Настоящее изобретение включает все сочетания аспектов и вариантов осуществления.
Настоящее изобретение относится к амидным соединениям, которые могут образовываться из определенных гетероарилкарбоновых кислот и определенных диазабициклоалканов. Эти амидные соединения (гетероарилкарбоксамиды) связываются с высоким сродством с нейронными никотиновыми рецепторами подтипа α4β2, принадлежащими к центральной нервной системе (CNS), и демонстрируют селективность по отношению к подтипу α4β2 по сравнению с подтипом α7 NNR, также принадлежащими к CNS.
Настоящее изобретение также относится к фармацевтически приемлемым солям, полученным из этих амидных соединений, и к их фармацевтическим композициям, которые могут использоваться для лечения и/или предотвращения разнообразных состояний или расстройств, в частности расстройств, характеризующихся дисфункцией никотиновой холинергической нейротрансмиссией или дегенерацией никотиновых холинергических нейронов.
Настоящее изобретение также относится к способам лечения или предотвращения расстройств, таких как расстройства CNS, а также к лечению определенных состояний, а именно, к облегчению боли и воспаления. Способы включают введение субъекту терапевтически эффективного количества соединений, включая соли, или фармацевтических композиций, содержащих такие соединения. Кроме того, предусматривается способ лечения расстройств, выбранных из группы, состоящей из возрастного ослабления памяти, легкого ослабления когнитивной функции, предстарческой деменции, ранней болезни Альцгеймера, старческой деменции, слабоумия типа Альцгеймера, деменции с тельцами Леви, сосудистой деменции, болезни Альцгеймера, инсульта, комплекса слабоумия при СПИДе, расстройства дефицита внимания, расстройства дефицита внимания с гиперактивностью, дислексии, шизофрении, когнитивной дисфункции при шизофрении, шизофреноформного расстройства и шизоаффективного расстройства. Кроме того, предусматривается еще способ лечения расстройств, выбранных из группы, состоящей из лечения деменции типа Альцгеймера, от легкой до средней степени, расстройства дефицита внимания, легкого ослабления когнитивной функции, возрастного ослабления памяти и когнитивной дисфункции при шизофрении.
Фармацевтические композиции содержат соединение по настоящему изобретению, которое, когда используется в эффективных количествах, взаимодействует с релевантными активными центрами никотиновых рецепторов субъекта, и, следовательно, действует в качестве терапевтического агента для лечения и предотвращения разнообразных состояний и расстройств. Фармацевтические композиции обеспечивают полезное терапевтическое воздействие на индивидуумов, страдающих от таких расстройств и демонстрирующих клинические проявления таких расстройств, при этом соединения в таких композициях, когда их используют в эффективных количествах, могут (i) демонстрировать никотиновое фармакологическое воздействие на релевантные активные центры никотиновых рецепторов (например, действовать как фармакологические агонисты для активирования никотиновых рецепторов) и/или (ii) вызывать секрецию нейротрансмиттеров, и следовательно, предотвращать и ослаблять симптомы, вызываемые этими заболеваниями. В дополнение к этому, соединения потенциально способны (i) увеличивать количества никотиновых холинергических рецепторов мозга пациента, (ii) проявлять нейропротекторные воздействия, и/или (iii) когда они используются в эффективных количествах, не вызывать заметных отрицательных побочных воздействий (например, значительного увеличения давления крови и ускорения сердечного ритма, значительного отрицательного воздействия на желудочно-кишечный тракт и значительного воздействия на скелетные мышцы).
Упомянутые выше и другие аспекты настоящего изобретения поясняются подробно в подробном описании и примерах, приведенных ниже.
Краткое описание чертежей
Фиг.1 представляет собой график, показывающий результаты исследования распознавания новых объектов у крыс, которым вводили перорально соединение A, метил 3-азабицикло[3.3.0]октан-7-карбоксилат. Результаты показаны как функция коэффициента распознавания (%) в зависимости от дозы (мг/кг).
Фиг.2 представляет собой график, показывающий результаты исследования распознавания новых объектов у крыс, которым вводили перорально соединение B, N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамид. Результаты показаны как функция коэффициента распознавания (%) в зависимости от дозы (мг/кг).
Подробное описание
Селективные к подтипу соединения, фармацевтические композиции, содержащие эти соединения, способы получения соединений и способы лечения и/или предотвращения с использованием соединения, описаны подробно ниже.
Следующие определения предназначены для пояснения, но не для ограничения определяемых терминов. Если термин, используемый здесь, не является конкретно определенным, такой термин не должен считаться неопределенным. Скорее, эти термины используются в пределах их принятых значений.
Как здесь используется, термин "алкил" относится к углеводороду с прямой или разветвленной цепью, имеющему один-двенадцать атомов углерода, предпочтительно, один-шесть, которые могут быть необязательно замещенными, как здесь дополнительно описывается, при этом допускаются различные уровни замещения. Примеры "алкила", как здесь используется, включают, но не ограничиваясь этим, метил, этил, пропил, изопропил, изобутил, н-бутил, трет-бутил, изопентил и н-пентил.
Как используется в этом описании, предпочтительное количество атомов, таких как атомы углерода, будет представлено, например, фразой "Cx-Cy алкил", которая относится к алкильной группе, как здесь определено, содержащей указанное количество атомов углерода. Сходная терминология будет применяться для других предпочтительных терминов, а также диапазонов. Один из вариантов осуществления настоящего изобретения включает так называемые 'низшие' алкильные цепи из одного-шести атомов углерода. Таким образом, C1-C6 алкил представляет собой низшую алкильную цепь, как описано выше.
Как здесь используется, термин "алкенил" относится к алифатическому углеводороду с прямой или разветвленной цепью, имеющему два-двенадцать атомов углерода, предпочтительно, два-шесть, и содержащему одну или несколько двойных связей углерод-углерод, который может быть необязательно замещенным, как здесь дополнительно описывается, при этом допускаются различные уровни замещения. Примеры "алкенила", как здесь используется, включают, но не ограничиваясь этим, этенил, пропенил, бутенил и тому подобное.
Как здесь используется, термин "алкинил" относится к алифатическому углеводороду с прямой или разветвленной цепью, имеющему два-двенадцать атомов углерода, предпочтительно, два-шесть, и содержащему одну или несколько тройных связей углерод-углерод, который может быть необязательно замещенным, как здесь дополнительно описывается, при этом допускаются различные уровни замещения. Примеры "алкинила", как здесь используется, включают, но не ограничиваясь этим, винил, аллил и пропаргил.
Как здесь используется, термин "циклоалкил" относится к частично или полностью насыщенному, необязательно замещенному, неароматическому, трех-двенадцатичленному, моноциклическому, бициклическому или соединенному мостиками углеводородному кольцу, при этом допускаются различные уровни замещения. Примерные "циклоалкильные" группы, как здесь используется, включают, но не ограничиваясь этим, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, а также кольца, содержащие один или несколько уровней ненасыщенности, но недостаточных для образования ароматических соединений, такие как циклопропенил, циклобутенил, циклопентенил, циклогексенил и циклогептенил.
Как здесь используется, термин "гетероцикл" или "гетероциклил" относится к необязательно замещенной моно- или полициклической кольцевой системе, необязательно содержащей один или несколько уровней ненасыщенности, а также содержащей один или несколько гетероатомов, которые могут быть необязательно замещенными, как здесь дополнительно описывается, при этом допускаются различные уровни замещения. Примеры гетероатомов включают атомы азота, кислорода или серы, включая N-оксиды, оксиды серы и диоксиды. Предпочтительно, кольцо является трех-двенадцатичленным и является либо полностью насыщенным, либо имеет один или несколько уровней ненасыщенности. Такие кольца могут быть необязательно конденсированными с одним или несколькими другими гетероциклильными кольцами (с кольцом) или с циклоалкильным кольцом (кольцами). Примеры "гетероциклильных" групп, как здесь используется, включают, но не ограничиваясь этим, тетрагидрофуранил, пиранил, тетрагидропиранил, 1,4-диоксанил, 1,3-диоксанил, пиперидинил, пирролидинил, морфолинил, оксазинанил, пиперизинил, тетрагидротиопиранил и тетрагидротиофенил.
Как здесь используется, термин "арил" относится к одновалентному бензольному кольцу или к конденсированной бензольной кольцевой системе, которая может быть необязательно замещенной, как здесь дополнительно описывается, при этом допускаются различные уровни замещения. Примеры "арильных" групп, как здесь используется, включают, но не ограничиваясь этим, фенил, 2-нафтил, 1-нафтил, антрацен и фенантрен. Предпочтительно, арил представляет собой фенил или нафтил.
Как здесь используется, конденсированная бензольная кольцевая система, охватываемая термином "арил", включает конденсированные полициклические углеводороды, а именно такие, где циклический углеводород с количеством некумулятивных двойных связей, меньшим, чем максимальное, например, где насыщенное углеводородное кольцо (циклоалкил, такой как циклопентильное кольцо) является конденсированным с ароматическим кольцом (арил, такие как бензол кольцо), с образованием, например, таких групп, как инданил и аценафталенил, а также включает такие группы, в качестве неограничивающих примеров, как дигидронафталин и гексагидроциклопентациклооктен.
Как здесь используется, термин "арилалкил" относится к "арильной" группе, как здесь определено, присоединенной через двухвалентный алкиленовый мостик. В качестве одного из примеров, термин включает бензил.
Как здесь используется, термин "гетероарил" относится к моноциклическому пяти-семичленному ароматическому кольцу или к конденсированной бициклической ароматической кольцевой системе, содержащей два таких ароматических кольца, которые могут быть необязательно замещенными, как здесь дополнительно описывается, при этом допускаются различные уровни замещения. Эти гетероарильные кольца содержат один или несколько атомов азота, серы и/или кислорода, где N-оксиды, оксиды серы и диоксиды являются допустимыми заменителями гетероатомов. Примеры "гетероарильных" групп, как здесь используется, включают, но не ограничиваясь этим, фуранил, тиофенил или тиенил, пирролил, имидазолил, паразолил, триазолил, тетразолил, тиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, изотиазолил, пиридинил, пиридазинил, пиразинил, пиримидинил, хинолинил, изохинолинил, бензофуранил, бензодиоксолил, бензотиофенил, индолил, индолинил, индазол, бензимидизолил, индолизинил, имидазопиридинил, пуринил, пиразолопиридинил и пиразолопиримидинил.
В настоящем описании, если не утверждается иного, термины "гало" и "галоген" могут представлять собой фтор, йод, хлор или бром.
Как будет понятно из описания, количество и природа заместителей в кольце в соединениях по настоящему изобретению будет выбираться так, чтобы предотвратить стерически нежелательные сочетания.
Наименования определенных соединений по настоящему изобретению генерируются с помощью компьютерного программного обеспечения (ACDLabs 8.0/Name(IUPAC)).
Примеры соответствующих фармацевтически приемлемых солей включают соли присоединения неорганических кислот, такие как хлорид, бромид, сульфат, фосфат и нитрат; соли присоединения органических кислот, такие как ацетат, галактарат, пропионат, сукцинат, лактат, гликолят, малат, тартрат, цитрат, малеат, фумарат, метансульфонат, п-толуолсульфонат и аскорбат; соли с кислой аминокислотой, такие как аспартат и глутамат; соли щелочных металлов, такие как соль натрия и соль калия; соли щелочноземельных металлов, такие как соль магния и соль кальция; соль аммония; соли органических оснований, такие как триметиламиновая соль, триэтиламиновая соль, пиридиновая соль, пиколиновая соль, дициклогексиламиновая соль и N,N'-дибензилэтилендиаминовая соль; и соли основных аминокислот, такие как лизиновая соль и аргининовая соль. Соли могут в некоторых случаях представлять собой гидраты или этанольные сольваты. Репрезентативные соли получают, как описано в патентах США № 5597919, Dull et al., 5616716, Dull et al., и 5663356, Ruecroft, et al.
Как будет понятно специалисту в данной области, соединения по настоящему изобретению могут существовать в сольватированной, например, гидратированной, а также в несольватированных формах. Кроме того, соединения могут существовать как кристаллы, полученные с помощью совместной кристаллизации. Настоящее изобретение охватывает все такие формы.
Во избежание сомнений, настоящее изобретение относится к любой солевой форме, как рассмотрено выше, и в явном виде, к любому из конкретных соединений, рассмотренных здесь, в форме любой из солей, рассмотренных выше. В дополнение к этому, как отмечено, настоящее изобретение включает сольваты соединений, описанных здесь, включая такие сочетания, как сольваты солей. Как отмечено, соединения по настоящему изобретению могут существовать в сольватированной, например, гидратированной, а также в несольватированной форме и настоящее изобретение охватывает все такие формы.
Как здесь описано, настоящее изобретение включает соединение по настоящему изобретению в выделенной форме. Как здесь используется, фраза "в выделенной форме" предусматривает, что соединение по существу не содержит других соединений, включая побочные продукты, примеси и реагенты синтеза. Как здесь используется, фраза "по существу не содержит" должна интерпретироваться как очищенный приблизительно на 95% от таких описываемых других компонентов.
Как здесь используется, "агонист" представляет собой вещество, которое стимулирует его связывание с партнером, как правило, с рецептором. Стимулирование определяется в контексте конкретного анализа или может быть очевидным в литературе из настоящего обсуждения, что происходит сравнение с фактором или веществом, которые приняты как "агонист" или "антагонист" для конкретного партнера по связыванию при сходных по существу обстоятельствах, как понятно специалистам в данной области. Стимулирование может быть определено по отношению к увеличению конкретного воздействия или функции, которое вызывается посредством взаимодействия агониста или частичного агониста с партнером по связыванию и может включать аллостерические воздействия.
Как здесь используется, "антагонист" представляет собой вещество, которое ингибирует действие своего партнера по связыванию, как правило, рецептор. Ингибирование определяется в контексте конкретного анализа или может быть очевидным из литературы из настоящего описания, что происходит сравнение с фактором или веществом, которое принято в качестве "агониста" или "антагониста" для конкретного партнера по связыванию по существу при сходных обстоятельствах, как очевидно специалистам в данной области. Ингибирование может быть определено по отношению к уменьшению конкретного воздействия или функции, которая вызывается посредством взаимодействия антагониста с партнером по связыванию, и может включать аллостерические воздействия.
Как здесь используется, "частичный агонист" представляет собой вещество, которое обеспечивает уровень стимулирования своего партнера по связыванию, который является промежуточным между уровнями полного или абсолютного антагониста и агониста, определенными с помощью любых принятых стандартов для активности агониста. Будет видно, что стимулирование, а следовательно, ингибирование определяется по существу для любого вещества или категории веществ, которые должны определяться как агонисты, антагонисты или частичные агонисты.
Как здесь используется, "собственная активность" или "эффективность" относится к некоторой мере биологической эффективности комплекса с партнером по связыванию. Относительно фармакологии рецептора, контекст, в котором должна определяться исходная активность или эффективность, будет зависеть от контекста комплекса с партнером по связыванию (например, рецептор/лиганд) и рассмотрения активности, важной для конкретного биологического результата. Например, в некоторых обстоятельствах, исходная активность может изменяться в зависимости от конкретной вовлеченной системы вторичных мессенджеров. См. Hoyer, D. and Boddeke, H., Trends Pharmacol. Sci. 14(7):270-5 (1993). Когда такие контекстуально специфичные оценки важны и как именно они могут быть важны в контексте настоящего изобретения, будет очевидно специалисту в данной области.
Как здесь используется, модулирование рецептора включает агонизм, частичный агонизм, антагонизм, частичный антагонизм или обратный агонизм рецептора.
Как здесь используется, нейротрансмиттеры, высвобождение которых опосредуется соединениями, описанными здесь, включают, но не ограничиваясь этим, ацетилхолин, допамин, норепинефрин, серотонин и глутамат, и соединения, описанные здесь, функционируют как модуляторы для подтипа α4β2 NNR CNS.
Как будет понятно специалистам в данной области, соединения по настоящему изобретению являются хиральными. Настоящее изобретение включает все стереоизомерные формы (например, энантиомерные или диастереомерные формы) таких соединений и их смеси. Таким образом, рамки настоящего изобретения включают смеси стереоизомеров, а также очищенные энантиомеры или энантиомерно/диастереомерно обогащенные смеси. Также включенными в рамки настоящего изобретения являются индивидуальные изомеры соединений, представленные формулами по настоящему изобретению, а также любые полностью или частично уравновешенные их смеси. Настоящее изобретение также включает индивидуальные изомеры соединений, представленных формулами выше, как смеси с их изомерами, в которых один или несколько хиральных центров инвертированы.
Репрезентативные соединения по настоящему изобретению включают те, которые конкретно иллюстрируются и идентифицируются. Во избежание сомнений, настоящее изобретение относится к любому из конкретных соединений, описанных здесь.
Получение соединения
Соединения по настоящему изобретению могут быть получены с использованием разнообразных методик синтеза. Обычно, они могут быть получены посредством дериватизации защищенной азабициклической карбоновой кислоты (то есть такой, в которой аминовая функциональная группа сделана химически неактивной с помощью соответствующей дериватизации). Имеются многочисленные способы получения азабициклических карбоновых кислот, используемых при получении соединений по настоящему изобретению.
Способы синтеза соответствующих 3-азабицикло[3.3.0]октановых промежуточных соединений являются разнообразными. Например, Flynn et al., Tetrahedron 53(1):1-20 (1996), предусматривают два подхода к соответствующей функционализации 3-азабицикло[3.3.0]октанов. Этот источник включается сюда в виде ссылки относительно концепций синтеза. Первый подход включает катализируемую палладием [3+2] реакцию циклоприсоединения 2-триметилсилилметил-2-пропен-1-ил ацетата к диметилмалеату. Полученный сложный диэфир омыляют, обрабатывают уксусным ангидридом и подвергают пиролизу, с получением конденсированного циклического ангидрида, тетрагидро-5-метилен-1H-циклопента[c]фуран-1,3(3aH)-диона. Обработка аммиаком с последующей циклизацией ацетилхлоридом дает имид, тетрагидро-5-метилен-1H-циклопента[c]пиррол-1,3(2H,2aH)-дион. Восстановление литий-алюмогидридом и защита свободного амина ди-трет-бутилдикарбонатом дает 7-метилен-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан. Возможны дальнейшие преобразования с использованием этого метиленового соединения. Например, озонолиз 7-метилен-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октана будет давать 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-он. Альтернативно, обработка 7-метилен-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октана бораном, а затем водным основным раствором перекиси водорода, будет давать 7-(гидроксиметил)-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан. Окисление этого спирта с помощью любого способа из числа известных специалистам в области органического синтеза, будет генерировать 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновую кислоту, ключевое промежуточное соединение для синтеза соединений по настоящему изобретению.
Во втором подходе Flynn et al. (Tetrahedron 53(1):1-20 (1996)) используют протокол Посона-Ханда для генерирования соответствующим образом функционализованного 3-азабицикло[3.3.0]октана. Такой источник включается сюда в виде ссылки по отношению к такой концепции синтеза. В этом подходе, циклизация комплекса N-boc-аллилпропаргиламингексакарбонилдикобальта (Becker and Flynn, Tetrahedron 49:5047-5054 (1993)), дает рассмотренный выше 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-он в одну стадию. Такой источник включается сюда в виде ссылки по отношению к такой концепции синтеза. Последующее преобразование кетона в его енолтрифлат (с использованием, например, литий гексаметилдисилазида и N-(5-хлорпиридин-2-ил)-бис-трифторметансульфинамида), с последующим катализируемым палладием карбометоксилированием (например, Peterson et al., J. Med. Chem. 37:275-286 (1994)), будет давать метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоксилат. Такой источник включается сюда в виде ссылки по отношению к такой концепции синтеза. Соединение может быть в дальнейшем преобразовано в ключевые промежуточные соединения для синтеза соединений по настоящему изобретению. Например, гидрирование будет давать соответствующий алкан, метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксилат. Удаление трет-бутоксикарбонильной защитной группы (кислотные условия) дает затем метил 3-азабицикло[3.3.0]октан-7-карбоксилат. Альтернативно, метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоксилат может быть гидролизован в водном растворе слабого основания, с получением соответствующей карбоновой кислоты, 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоновой кислоты, другого ключевого промежуточного соединения для синтеза соединений по настоящему изобретению.
Другой подход к конструированию 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-она излагается в PCT WO 04/016604, Dart et al. Такой источник включается сюда в виде ссылки по отношению к такой концепции синтеза. При этом подходе, цис-тетрагидрофталимид восстанавливают до соответствующего амина с помощью гидрида лития-алюминия и амин впоследствии защищают с помощью реакции с ди-трет-бутилдикарбонатом. Затем алкен подвергают окислительному расщеплению (периодат натрия и каталитический рутений (IV) оксид-гидрат), с получением цис-1-(трет-бутоксикарбонил)-3,4-бис(карбоксиметил)пирролидина. Нагревание с уксусным ангидридом и ацетатом натрия дает 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-он.
Способы конструирования 3-азабицикло[3.3.0]октанов могут быть различными. Другой путь к получению 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты описывается Flynn and Zabrowski, J. Org. Chem. 55:3673-3674 (1990) и Flynn et al. в Tetrahedron Lett., 33(48):7281-82 (1992). Такие источники включаются сюда в виде ссылок по отношению к такой концепции синтеза. В этом способе, диэтилаллилмалонат сначала йодируют, с получением диэтил 2-йод-2-аллилмалоната. Последующая реакция малоната с N-(трет-бутоксикарбонил)аллиламином и бис(трибутилоловом), с последующим нагреванием в триэтиламине, дает диэтил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7,7-дикарбоксилат. Кислотный гидролиз, с самопроизвольным декарбоксилированием и последующей повторной защитой амина с помощью ди-трет-бутилдикарбоната, дает 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновую кислоту, ключевое промежуточное соединение для синтеза соединений по настоящему изобретению.
Другой способ циклизации с помощью алкенов для получения 3-азабицикло[3.3.0]октанов описывается Minakata et al., в Heterocycles, 60:289-98 (2003), в нем осуществляется тандемная циклизация диэтил 2,2-диаллилмалоната с использованием хлорамина-T и нитрата серебра. Такой источник включается сюда в виде ссылки по отношению к такой концепции синтеза. Полученный диэтил 3-тозил-3-азабицикло[3.3.0]октан-7,7-дикарбоксилат может быть гидролизован в водном растворе кислоты, с получением 3-тозил-3-азабицикло[3.3.0]октан-7-карбоновой кислоты, которая могла бы использоваться для получения соединения по настоящему изобретению.
Способы синтеза производных 3-азабицикло[3.3.1]нонана, пригодных для получения соединений по настоящему изобретению, могут быть различными. Speckamp et al., Tetrahedron 27:3143-56 (1971) и Stetter and Reinartz, Chem. Ber. 105(9):2773-2779 (1972) описывают конденсацию различных N-защищенных-4-пиперидонпирролидинэнаминов либо с этил α-бромметакрилатом, либо соответствующим β,β'-дибромизобутиратом, с получением этил N-защищенных 3-аза-9-оксо-бицикло[3.3.1]нонан-7-карбоксилатов. Такие источники включаются сюда в виде ссылок по отношению к такой концепции синтеза. Последующее деоксигенирование 9-положения карбонила через соответствующие гидразоны или замещенные гидразоны (способы известны специалистам в области органического синтеза) дает этил N-защищенные-3-азабицикло[3.3.1]нонан-7-карбоксилаты. Гидролиз сложного эфира дает N-защищенные-3-азабицикло[3.3.1]нонан-7-карбоновые кислоты, ключевые промежуточные соединения для синтеза соединений по настоящему изобретению.
Способы присоединения и удаления трет-бутоксикарбонила и других аминозащитных групп хорошо известны специалистам в данной области и описываются дополнительно в T. W. Greene and P.G. M. Wuts, Protective Groups in Organic Synthesis, 3rd Edition, John Wiley & Sons, New York (1999), этот источник включается сюда в виде ссылки по отношению к такой концепции синтеза.
Преобразование азабициклических карбоновых кислот в соединения по настоящему изобретению может осуществляться с помощью разнообразных средств, все они известны специалистам в области органического синтеза. Таким образом, N-защищенные 3-азабицикло[3.3.0]октан-7-карбоновые кислоты с кислотно-стабильными N-защитными группами могут преобразовываться непосредственно в соответствующие сложные эфиры путем реакции со спиртом в присутствии сильной кислоты. Альтернативно, N-защищенная 3-азабицикло[3.3.0]октан-7-карбоновая кислота может взаимодействовать со спиртом в присутствии конденсирующего (дегидратирующего) реагента, такого как дициклогексикарбодиимид (DCC), с получением соответствующего сложного эфира. Эта последняя реакция может использоваться в присутствии кислотно-чувствительных N-защитных групп. Другие способы синтеза сложных эфиров, такие как те, которые используют соответствующий хлорангидрид или смешанный сульфоновый ангидрид в качестве промежуточного соединения, известны специалистам в данной области. Многие из этих реакций также могут применяться для преобразования азабициклоалкенкарбоновых кислот в сложные эфиры.
Способы преобразования азабициклических карбоновых кислот в соответствующие амиды также являются многочисленными. Например, N-защищенные 3-азабицикло[3.3.0]октан-7-карбоновые кислоты и N-защищенные 3-азабицикло[3.3.1]нонан-7-карбоновые кислоты могут непосредственно связываться с разнообразными аминами, с использованием конденсирующих агентов, таких как те, которые разработаны для пептидного синтеза. Такие реагенты включают N,N'-дициклогексилкарбодиимид (DCC), (бензотриазол-1-илокси)трис(диметиламино)фосфоний гексафторфосфат (BOP), (бензотриазол-1-илокси)трипирролидинофосфоний гексафторфосфат (PyBOP), O-(бензотриазол-1-ил)-N,N,N',N'-бис(тетраметилен)уроний гексафторфосфат (HBPyU), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (HBTU), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборат (TBTU) и (1-этил-3-(3-диметиламинопропил)карбодиимид) (EDCI) с 1-гидроксибензотриазолом (HOBt). Другие конденсирующие агенты хорошо известны специалистам в данной области (см., например, Kiso and Yajima, Peptides, pp.39-91, Academic Press, San Diego, CA (1995)). Такой источник включается сюда в виде ссылки по отношению к такой концепции синтеза. В некоторых случаях эти реагенты являются коммерчески доступными, как модификации на полимерных носителях, которые сильно облегчают выделение продуктов конденсации. Пример такого реагента представляет собой N,N'-дициклогексилкарбодиимид (PS-DCC), связанный с полистиролом.
Способы преобразования азабициклических карбоновых кислот в соответствующие амиды могут быть различными. Таким образом, соответствующие защищенные азабициклоалканкарбоновые кислоты могут преобразовываться в соответствующие их хлорангидриды (с использованием, например, оксалилхлорида). Реакция хлорангидрида с первичным или вторичным амином, в присутствии соответствующего основания (часто, третичного амина), будет давать амид. Эта и множество других упомянутых выше реакций могут также применяться для преобразования азабициклоалкенкарбоновых кислот в амиды.
Способы преобразования азабициклических карбоновых кислот в соответствующие кетоны являются многочисленными. Таким образом, N-защищенные 3-азабицикло[3.3.0]октан-7-карбоновые кислоты и N-защищенные 3-азабицикло[3.3.1]нонан-7-карбоновые кислоты могут преобразовываться в кетоновые производные через хлорангидриды (уже описанные), при этом хлорангидрид взаимодействует с реагентом на основе литий диалкилкупрата или диалкилкадмия. Альтернативно, карбоновая кислота может преобразовываться в ее N-метил-N-метоксиамид (как описано выше), который легко взаимодействует с литийорганическими реагентами и реагентами Гриньяра, с получением кетонов. Множество упомянутых выше реакций могут также применяться для преобразования азабициклоалкенкарбоновых кислот в амиды. Определенные кетоны могут также быть получены с помощью реакции хлорангидридов с триметилсилилдиазометаном. Она дает соответствующие α-диазокетоны, которые могут преобразовываться в разнообразные производные (например, α-бромкетоны).
Специалисту в области органического синтеза будет понятно, что имеется множество средств для получения соединений по настоящему изобретению, которые метят радиоизотопом, соответствующим различным диагностическим применениям. Например, конденсация 11C-амина либо с хлорангидридом N-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты, либо с хлорангидридом N-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоновой кислоты, с использованием способов, описанных выше, и последующим удалением трет-бутоксикарбонильной группы, будет давать соединение, соответствующее применению в позитронной эмиссионной томографии.
Способы лечения
Как здесь используется, термины "предотвращение" или "профилактика" включают любую степень уменьшения развития или замедления наступления заболевания, расстройства или состояния. Термин включает осуществление защитного воздействия против конкретного заболевания, расстройства или состояния, а также облегчение рецидива заболевания, расстройства или состояния. Таким образом, в другом аспекте, настоящее изобретение предусматривает способ лечения субъекта, имеющего развивающееся или существующее рецидивирующее расстройство, опосредуемое NNR или nAChR, или риск его возникновения. Соединения и фармацевтические композиции по настоящему изобретению могут использоваться для достижения полезного терапевтического или профилактического воздействия, например, у субъекта с дисфункцией CNS.
Как отмечено выше, соединения по настоящему изобретению представляют собой модуляторы подтипа α4β2 NNR, характерного для CNS, и могут использоваться для предотвращения или лечения различных состояний или расстройств, включая состояния и расстройства CNS, у субъектов, которые имеют такие состояния или расстройства или склонны к ним, с помощью модулей α4β2 NNR. Соединения имеют способность к селективному связыванию с α4β2 NNR и демонстрируют никотиновое фармакологическое воздействие, например, действуя в качестве агонистов, частичных агонистов, антагонистов, как описано. Например, соединения по настоящему изобретению, когда вводятся в эффективных количествах пациентам, нуждающимся в этом, обеспечивают некоторый уровень предотвращения развития расстройств CNS, а именно, обеспечивая защитное воздействие, облегчение симптомов расстройств CNS или облегчение рецидивов расстройств CNS, или их сочетание.
Соединения по настоящему изобретению могут использоваться для лечения или предотвращения тех типов состояний и расстройств, для которых другие типы никотиновых соединений предлагаются или, как показано, являются пригодными для использования в качестве терапевтических препаратов. См., например, источники, перечисленные ранее выше, а также Williams et al., Drug News Perspec. 7(4):205 (1994), Arneric et al., CNS Drug Rev. 1(1):1-26 (1995), Arneric et al., Exp. Opin. Invest. Drugs 5(1):79-100 (1996), Bencherif et al., J. Pharmacol. Exp. Ther. 279:1413 (1996), Lippiello et al., J. Pharmacol. Exp. Ther. 279:1422 (1996), Damaj et al., J. Pharmacol. Exp. Ther. 291:390 (1999); Chiari et al., Anesthesiology 91: 1447 (1999), Lavand'homme и Eisenbach, Anesthesiology 91:1455 (1999), Holladay et al., J. Med Chem. 40(28):4169-94 (1997), Bannon et al., Science 279:77 (1998), PCT WO 94/08992, PCT WO 96/31475, PCT WO 96/40682 и патенты США №№ 5583140, Bencherif et al. 5597919, Dull et al., 5604231, Smith et al. и 5852041, Cosford et al., описания которых включаются сюда в виде ссылок по отношению к такой терапевтической концепции.
Соединения и их фармацевтические композиции являются пригодными для лечения или предотвращения разнообразных расстройств CNS, включая нейродегенеративные расстройства, нейропсихиатрические расстройства, неврологические расстройства и зависимости. Соединения и их фармацевтические композиции могут использоваться для лечения или предотвращения когнитивных дефицитов и дисфункций, возрастных и иных; расстройств внимания и деменций, включая те, которые вызываются инфекционными агентами или метаболическими нарушениями; для обеспечения нейропротекторного действия; для лечения конвульсий и множественных церебральных инфарктов; для лечения расстройств настроения, навязчивых состояний и зависимого поведения; для обеспечения анальгезии; для контроля воспалений, таких как те, которые опосредуются цитокинами и ядерным фактором каппа B; для лечения воспалительных расстройств; для обеспечения облегчения боли и для лечения инфекции, в качестве антиинфекционных агентов для лечения бактериальных, грибковых и вирусных инфекций. Среди расстройств, заболеваний и состояний, для лечения или предотвращения которых могут использоваться эти соединения и фармацевтические композиции по настоящему изобретению, находятся: возрастное ослабление памяти (AAMI), легкое ослабление когнитивной функции (MCI), возрастное ухудшение когнитивной функции (ARCD), предстарческая деменция, ранняя болезнь Альцгеймера, старческая деменция, слабоумие типа Альцгеймера, болезнь Альцгеймера, ослабление когнитивных функций, не связанное со слабоумием (CIND), деменция с тельцами Леви, ВИЧ-слабоумие, комплекс слабоумия при СПИДе, сосудистая деменция, синдром Дауна, травма головы, травматическое повреждение мозга (TBI), боксерское слабоумие, болезнь Кройцфельда-Якоба и прионное заболевание, инсульт, ишемия, расстройство дефицита внимания, расстройство дефицита внимания с гиперактивностью, дислексия, шизофрения, шизофреноформное расстройство, шизоаффективное расстройство, когнитивная дисфункция при шизофрении, дефицит когнитивной функции при шизофрении, Паркинсонизм, включая болезнь Паркинсона, постэнцефалитический паркинсонизм, паркинсонизм-слабоумие Gaum, фронтотемпоральное слабоумие типа Паркинсона (FTDP), болезнь Пика, болезнь Нимана-Пика, болезнь Хантингтона, хорея Хантингтона, тардивная дискинезия, гиперкинезия, прогрессивный супрануклеарный паралич, прогрессивный супрануклеарный парез, синдром беспокойных ног, болезнь Кройцфельда-Якоба, множественный склероз, амиотропный латеральный склероз (ALS), заболевания моторных нейронов (MND), множественная системная атрофия (MSA), кортикобазальная дегенерация, синдром Жюльена-Барра (GBS) и хроническая воспалительная демиелинирующая полиневропатия (CIDP), эпилепсия, аутосомальная доминантная ночная лобная эпилепсия, мания, страх, депрессия, предменструальная дисфория, паническое расстройство, булимия, анорексия, нарколепсия, избыточная дневная сонливость, биполярное расстройство, расстройство общего беспокойства, обсессивно-компульсивное расстройство, вспышки гнева, оппозиционное расстройство неповиновения, синдром Туретта, аутизм, лекарственная и алкогольная зависимость, табачная зависимость, ожирение, кахексия, псориаз, волчанка, острый холангит, афтозный стоматит, язвы, астма, язвенный колит, воспалительное заболевание желудка, болезнь Крона, спастическая дистония, диарея, запор, паучит, вирусный пневмонит, артрит, включая, ревматоидный артрит и остеартрит, эндотоксемия, сепсис, атеросклероз, идиопатический пульмонарный фиброз, острая боль, хроническая боль, невропатии, недержание мочи, диабет и неоплазии.
Ослабление или дисфункции когнитивных функций могут быть связаны с психиатрическими расстройствами или состояниями, такими как шизофрения и другие психотические расстройства (включая, но не ограничиваясь этим, психотическое расстройство, шизофреноформное расстройство, шизоаффективное расстройство, бредовое расстройство, краткое психотическое расстройство, разделенное психотическое расстройство и психотические расстройства, вызываемые общим состоянием здоровья), деменции и другие когнитивные расстройства (включая, но не ограничиваясь этим, легкое ослабление когнитивной функции, предстарческую деменцию, болезнь Альцгеймера, старческую деменцию, слабоумие типа Альцгеймера, возрастное ослабление памяти, деменцию с тельцами Леви, сосудистую деменцию, комплекс слабоумия при СПИДе, дислексию, паркинсонизм, включая болезнь Паркинсона, ослабление когнитивных функций и слабоумие при болезни Паркинсона, ослабление когнитивных функций при множественном склерозе, ослабление когнитивных функций, вызываемое травматическим повреждением мозга, деменции, вызываемые другими общими медицинскими состояниями), тревожное расстройство (включая, но не ограничиваясь этим, паническое расстройство без агорафобии, паническое расстройство с агорафобией, агорафобию без истории панических расстройств, специфическую фобию, социальную фобию, обсессивно-компульсивное расстройство, расстройство посттравматического стресса, расстройство острого стресса, генерализованное тревожное расстройство и генерализованное тревожное расстройство беспокойства, вызываемое общим состоянием здоровья), расстройства настроения (включая, но не ограничиваясь этим, большое депрессивное расстройство, дистимическое расстройство, биполярную депрессию, биполярную манию, биполярное расстройство I, депрессию, связанную с маниакальными, депрессивными или смешанными эпизодами, биполярное расстройство II, циклотимическое расстройство и расстройства настроения, вызываемые общим состоянием здоровья), расстройства сна (включая, но не ограничиваясь этим, расстройства диссомнии, первичную инсомнию, первичную гиперсомнию, нарколепсию, расстройство парасомнии, расстройство ночных кошмаров, расстройство террора сна и расстройство сомнамбулизма), умственная отсталость, расстройства обучаемости, расстройство двигательных способностей, расстройства общения, общее расстройство развития, расстройства поведения с дефицитом внимания и с деструктивным поведением, расстройства дефицита внимания, расстройства дефицита внимания с гиперактивностью, расстройства кормления и питания у младенцев, детей или взрослых, расстройства тика, расстройства экскреции, расстройства, связанные с веществами (включая, но не ограничиваясь этим, зависимость от веществ, злоупотребление веществами, интоксикацию веществами, прекращение потребления веществ, расстройства, связанные с алкоголем, амфетаминовые расстройства или расстройства, связанные с амфетаминоподобными веществами, расстройства, связанные с кофеином, расстройства, связанные с коноплей, расстройства, связанные с кокаином, расстройства, связанные с галлюциногенами, расстройства, связанные с вдыхаемыми веществами, расстройства, связанные с никотином, расстройства, связанные с опиоидами, расстройства, связанные с фенциклидином или с веществами, подобными фенциклидину, и расстройства, связанные с седативными, гипнотическими или анксиолитическими средствами), расстройства личности (включая, но не ограничиваясь этим, обсессивно-компульсивное расстройство личности и расстройства контроля над возбуждением).
Упомянутые выше состояния и расстройства определены, например, в American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision, Washington, DC, American Psychiatric Association, 2000. Это руководство может также упоминаться относительно более подробных деталей симптомов и диагностических признаков, связанных с использованием, злоупотреблением и зависимостью от веществ, и включается сюда в виде ссылки по отношению к ним.
Предпочтительно, лечение или предотвращение заболеваний, расстройств и состояний осуществляется без заметных отрицательных побочных воздействий, включая, например, значительное увеличение кровяного давления и ускорение сердечного ритма, без значительных отрицательных воздействий на желудочно-кишечный тракт и значительных воздействий на скелетные мышцы.
Соединения по настоящему изобретению, когда используются в эффективных количествах, могут модулировать активность α4β2 NNR без заметных взаимодействий с никотиновыми подтипами, которые характерны для ганглий человека, как демонстрирует отсутствие у них способности вызывать никотиновую функцию в хромаффиновой ткани надпочечников или в скелетных мышцах, как демонстрирует отсутствие у них способности вызывать никотиновую функцию в препаратах клеток, экспрессирующих никотиновые рецепторы типа мышечных. Таким образом, эти соединения способны к лечению или предотвращению заболеваний, расстройств и состояний, не вызывая значительной активности на ганглионарных и нейромышечных активных центрах, связанной с их побочными воздействиями. Таким образом, введение соединений, как предполагается, создает терапевтическое окно, в котором обеспечивается лечение определенных заболеваний, расстройств и состояний и устраняются определенные побочные воздействия. То есть эффективные дозы соединений являются достаточными для обеспечения желательных воздействий на заболевание, расстройство или состояние, но являются недостаточными, а именно не находятся на достаточно высоком уровне, чтобы создавать нежелательные побочные воздействия.
Таким образом, настоящее изобретение предусматривает использование соединений по настоящему изобретению или их фармацевтически приемлемых солей для использования в терапии, таких как любой вид терапии из тех, которые описаны выше.
Еще в одном аспекте настоящее изобретение предусматривает применение соединений по настоящему изобретению или их фармацевтически приемлемых солей для получения лекарственного средства для лечения расстройств CNS, таких как расстройство, заболевание или состояние, описанное выше.
В дополнительном аспекте настоящее изобретение предусматривает применение соединений по настоящему изобретению или их фармацевтически приемлемых солей для получения лекарственного средства для лечения от легкой до средней степени деменции типа Альцгеймера, расстройства дефицита внимания, легкого ослабления когнитивной функции, возрастного ослабления памяти и когнитивной дисфункции при шизофрении.
Диагностические применения
Соединения могут использоваться в диагностических композициях, таких как зонды, в частности, когда они модифицируются путем введения соответствующих меток. Зонды могут использоваться, например, для определения относительного количества и/или функции конкретных рецепторов, в частности подтипа рецептора α4β2. Для этой цели соединения по настоящему изобретению наиболее предпочтительно метят радиоактивным изотопным остатком, таким как 11C, 18F, 76Br, 123I или 125I.
Введенные соединения могут детектироваться с использованием известных способов детектирования, соответствующих используемой метке. Примеры способов детектирования включают позитронную эмиссионную томографию (PET) и однофотонную эмиссионную компьютерную томографию (SPECT). Радиоактивные метки, описанные выше, являются пригодными для использования при получении изображений с помощью PET (например, 11C, 18F или 76Br) и SPECT (например, 123I), с половинными временами жизни примерно 20,4 минут для 11C, примерно 109 минут для 18F, примерно 13 часов для 123I и примерно 16 часов для 76Br. Высокие удельные активности являются желательными для визуализации выбранных подтипов рецепторов при ненасыщающих концентрациях. Введенные дозы, как правило, находятся ниже токсичного диапазона и обеспечивают высокую контрастность изображения. Соединения, как ожидается, будут давать возможность для введения при нетоксичных уровнях. Определение дозы осуществляют способом, известным специалистам в области получения радиоактивных изображений. См., например, патент США № 5969144, London et al.
Соединения могут вводиться с использованием известных методик. См., например, патент США № 5969144, London et al, который включается сюда в виде ссылки по отношению к таким методикам. Соединения могут вводиться в препарате композиции, который содержит другие ингредиенты, такие как те типы ингредиентов, которые являются пригодными для использования при приготовлении диагностической композиции. Соединения, пригодные для использования в соответствии с осуществлением настоящего изобретения, наиболее предпочтительно используются в форме с высокой чистотой. См. патент США № 5853696, Elmalch et al.
После того как соединения вводят субъекту (например, человеку), присутствие этого соединения внутри субъекта может отображаться и количественно определяться с помощью соответствующих методик для индикации присутствия, количества и функциональности выбранных подтипов никотиновых холинергических рецепторов. В дополнение к людям, соединения могут также вводиться животным, таким как мыши, крысы, собаки и обезьяны. Получение изображений SPECT и PET может осуществляться с использованием любых соответствующих методик и устройств. См. Villemagne et al., В: Arneric et al. (Eds.) Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities, 235-250 (1998), и патент США № 5853696, Elmalch et al., относительно описания репрезентативных методик визуализации; каждый из этих источников включается сюда в виде ссылки по отношению к такой концепции.
Радиоактивно меченные соединения связываются с высоким сродством с селективными подтипами nAChR (например, α4β2) и предпочтительно демонстрируют пренебрежимо малое неспецифичное связывание с другими подтипами никотиновых холинергических рецепторов (например, с теми подтипами рецепторов, которые связаны с мышцами и ганглиями). Как таковые, соединения могут использоваться в качестве агентов для неинвазивной визуализации подтипов никотиновых холинергических рецепторов в организме субъекта, в частности в мозгу, для диагностики разнообразных заболеваний и расстройств CNS.
В одном из аспектов, диагностические композиции могут использоваться в способе диагностирования заболевания у субъекта, такого как человек. Способ включает введение этому пациенту детектируемо меченного соединения, как здесь описывается, и детектирование связывания этого соединения с выбранными подтипами никотиновых рецепторов (например, с подтипом рецептора α4β2). Специалисты в области использования диагностических инструментов, таких как PET и SPECT, могут использовать радиоактивно меченные соединения, описываемые здесь, для диагностирования разнообразных состояний и расстройств, включая состояния и расстройства, связанные с дисфункцией центральной и автономной нервной системы. Такие расстройства включают разнообразные заболевания и расстройства CNS, включая болезнь Альцгеймера, болезнь Паркинсона и шизофрению. Эти и другие репрезентативные заболевания и расстройства могут оцениваться, как те, которые приведены здесь, так и те, которые приведены в патенте США № 5952339, Bencherif et al., который включается сюда в виде ссылки во всей полноте.
В другом аспекте, диагностические композиции могут использоваться в способе для мониторинга подтипов селективных никотиновых рецепторов у субъекта, такого как человек. Способ включает введение детектируемо меченного соединения, как здесь описывается, этому пациенту и детектирование связывания этого соединения с выбранными подтипами никотиновых рецепторов (например, с подтипом рецептора α4β2).
Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению содержат соединение по настоящему изобретению, которое, когда используется в эффективных количествах, взаимодействует с релевантными активными центрами никотиновых рецепторов субъекта и действует в качестве терапевтического агента для лечения и предотвращения большого разнообразия состояний и расстройств. Фармацевтические композиции обеспечивают терапевтический выигрыш для индивидуума, страдающего от подвергаемых воздействию расстройств или демонстрирующего клинические проявления подвергаемых воздействию расстройств, при этом соединения в таких композициях, когда используются в эффективных количествах, могут: (i) демонстрировать никотиновое фармакологическое воздействие и воздействовать на релевантные активные центры никотиновых рецепторов, например, действуя как фармакологические агонисты активирования никотиновых рецепторов; или (ii) вызывать секрецию нейротрансмиттера, и, следовательно, предотвращать и ослаблять симптомы, вызванные этими заболеваниями.
Соединения по настоящему изобретению имеют принципиальную возможность для (i) увеличения количества никотиновых холинергических рецепторов мозга субъекта при необходимости в них; (ii) демонстрации нейропротекторного воздействия, и (iii) когда используются в эффективном количестве, для отсутствия появления заметных отрицательных побочных воздействий, например значительного увеличения кровяного давления и ускорения сердечного ритма, значительного отрицательного воздействия на желудочно-кишечный тракт или значительного воздействия на скелетные мышцы.
Кроме того, настоящее изобретение предусматривает фармацевтические композиции, которые включают эффективные количества соединений формулы по настоящему изобретению и их солей и сольватов, и один или несколько фармацевтически приемлемых носителей, разбавителей или наполнителей. Соединения формулы по настоящему изобретению, включая их соли и сольваты, являются такими, как здесь описывается. Носитель (носители), разбавитель (разбавители) или наполнитель (наполнители) должны быть приемлемыми, в том смысле, что должны быть совместимыми с другими ингредиентами композиции и не вредными для того, кто принимает фармацевтическую композицию.
В соответствии с другим аспектом настоящего изобретения также предусматривается способ получения фармацевтической композиции, включающий смешивание соединения формулы по настоящему изобретению, включая его соль, сольват или пролекарство, с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями.
Способы, которыми соединения вводятся, могут быть различными. Композиции предпочтительно вводятся перорально (например, в жидкой форме, в растворителе, таком как водная или неводная жидкость, или в твердом носителе). Предпочтительные композиции для перорального введения включают пилюли, таблетки, капсулы, каплеты, сиропы и растворы, включая твердые желатиновые капсулы и капсулы с высвобождением, распределенным по времени. Композиции могут приготавливаться в стандартной лекарственной форме или во множестве доз или в разделяемых стандартных дозах. Предпочтительные композиции находятся в жидкой или в полутвердой форме.
Могут использоваться композиции, содержащие жидкий фармацевтически инертный носитель, такой как вода или другие фармацевтически совместимые жидкости, или полутвердые продукты. Использование таких жидкостей и полутвердых продуктов хорошо известно специалистам в данной области.
Композиции могут также вводиться посредством инъекции, то есть внутривенно, внутримышечно, подкожно, внутрибрюшинно, внутриартериально, интратекально и интрацеребровентрикулярно. Внутривенное введение представляет собой предпочтительный способ инъекции. Соответствующие носители для инъекций хорошо известны специалистам в данной области и содержат 5% растворы декстрозы, солевой раствор и фосфатный буферный солевой раствор. Соединения могут также вводиться путем вливания или инъекции (например, как суспензия или как эмульсия в фармацевтически приемлемой жидкости или смеси жидкостей).
Препараты могут также вводиться с использованием других средств, например ректального введения. Препараты, пригодные для использования для ректального введения, такие как суппозитории, хорошо известны специалистам в данной области. Соединения могут также вводиться с помощью ингаляции (например, в форме аэрозоля, либо назально, либо с использованием изделий для доставки типа, представленного в патенте США № 4922901, Brooks et al., описание которого включается сюда во всей его полноте); местным образом (например, в форме лосьона); трансдермально (например, с использованием трансдермального пластыря, с использованием технологии, которая является коммерчески доступной от Novartis и Alza Corporation, или с помощью инъекции порошка) или с помощью буккального или интраназального поглощения. Хотя является возможным введение соединения в форме исходного активного вещества, является предпочтительным представление каждого соединения в форме фармацевтической композиции или препарата для рационального и эффективного введения.
Примерные способы введения таких соединений будут очевидны специалистам в данной области. Полезность этих препаратов может зависеть от конкретной используемой композиции и от конкретного субъекта, получающего лечение. Например, композиции могут вводиться в форме таблеток, твердых желатиновых капсул или как капсулы с высвобождением, распределенным по времени. Эти препараты могут содержать жидкий носитель, который может быть масляным, водным, эмульсифицированным или содержать определенные растворители, соответствующие способу введения.
Введение фармацевтических композиций, описанных здесь, может быть чередующимся или осуществляться при постепенно изменяющейся, непрерывной, постоянной или контролируемой пропорции теплокровным животным, (например, млекопитающим, таким как мышь, крыса, кошка, кролик, собака, свинья, корова или обезьяна); но преимущественно, они предпочтительно вводятся человеческим существам. В дополнение к этому, время дня и количество введений в день, когда вводятся фармацевтические композиции, могут изменяться.
Соответствующая доза соединения представляет собой количество, эффективное для предотвращения появления симптомов расстройства или для лечения некоторых симптомов расстройства, от которого страдает пациент. Под "эффективным количеством", "терапевтическим количеством" или "эффективной дозой" подразумевается количество, достаточное, чтобы вызвать желаемое фармакологическое или терапевтическое воздействие, таким образом, приводя к эффективному предотвращению или лечению расстройства. Таким образом, при лечении расстройств CNS, эффективное количество соединения представляет собой количество, достаточное для прохождения гепатоэнцефалического барьера субъекта, чтобы связываться с релевантными активными центрами рецепторов в мозгу субъекта, и для модулирования активности релевантных подтипов никотиновых рецепторов (например, для модулирования секреции нейротрансмиттеров, таким образом, приводя к эффективному предотвращению или лечению расстройства). Предотвращение расстройства проявляется в замедлении наступления симптомов расстройства. Лечение расстройства проявляется в уменьшении симптомов, вызванных расстройством, или в облечении повторного появления симптомов расстройства.
Эффективная доза может изменяться в зависимости от таких факторов, как состояние пациента, тяжесть симптомов расстройства и способ, которым вводится фармацевтическая композиция. Для пациентов людей, эффективная доза типичного соединения, как правило, требует введения соединения в количестве, достаточном для модулирования релевантных для заболевания рецепторов, чтобы воздействовать на высвобождение нейротрансмиттера (например, допамина), но количество должно быть недостаточным, чтобы вызвать воздействие на скелетные мышцы и ганглии до какой-либо значительной степени. Эффективная доза соединений будет, разумеется, отличаться от пациента к пациенту, но, как правило, включает количества, начинающиеся там, где осуществляются воздействия на CNS или другие желаемые терапевтические воздействия, но не превышающие количеств, где наблюдаются мышечные и ганглионарные воздействия.
Как правило, для введения эффективной дозы, соединения требуют введения в количестве, меньшем чем 5 мг/кг массы пациента. Часто соединения могут вводиться в количестве от меньше примерно чем 1 мг/кг массы пациента до меньше примерно, чем 100 мкг/кг массы пациента, а иногда примерно между 10 мкг/кг и меньше чем 100 мкг/кг массы пациента. Упомянутые выше эффективные дозы, как правило, представляют собой такое количество, которое вводится как отдельная доза или как одна или несколько доз, которые вводятся в течение периода в 24 часа. Для пациента человека, эффективная доза соединений может потребовать введения соединения в количестве, по меньшей мере, примерно 1, но не более примерно чем 1000, часто не более примерно чем 500 мг/24 час/пациент.
Композиции, пригодные для использования при диагностике, могут использоваться, как описано в патентах США № 5853696, Elmalch et al., и 5969144, London et al., содержание которых тем самым включается в виде ссылок. Соединения также могут вводиться в препарат композиции, который содержит другие ингредиенты, такие как те типы ингредиентов, которые пригодны для использования при приготовлении диагностических композиций.
Настоящее изобретение также охватывает комбинированную терапию для лечения или предотвращения расстройства, опосредуемого NNR или nAChR, у субъекта. Комбинированная терапия включает введение субъекту терапевтически или профилактически эффективного количества соединения по настоящему изобретению и одного или нескольких других терапевтических средств, включая проведение химиотерапии, радиационной терапии, генной терапии или иммунотерапии.
В одном из вариантов осуществления настоящего изобретения, соединение по настоящему изобретению может вводиться в сочетании с другими терапевтическими соединениями. В частности, соединение по настоящему изобретению может преимущественно использоваться в сочетании с другими лигандами NNR (такими как варениклин), антиоксидантами (такими как агенты, поглощающие свободные радикалы), антибактериальными агентами (такими как пенициллиновые антибиотики), противовирусными агентами (такими как аналоги нуклеозидов, подобные зидовудину и ацикловиру), антикоагулянтами (такими как варфарин), противовоспалительными агентами (такими как NSAID), антипиретиками, анальгетиками, анестетиками (такими, как используются в хирургии), ингибиторами ацетилхолинстеразы (такими как донепезил и галантамин), антипсихотическими средствами (такими как галоперидол, клозапин, оланзапин и кветиапин), иммунодепрессантами (такими как циклоспорин и метотрексат), нейропротекторными агентами, стероидами (такими как стероидные гормоны), кортикостероидами (такими как дексаметазон, предизон и гидрокортизон), витаминами, минералами, нутрицевтиками, антидепрессантами (такими как имипрамин, флуоксетин, пароксетин, эскиталопрам, сертралин, венлафаксин и дулоксетин), анксиолитиками (такими как алпразолам и буспирон), противосудорожными средствами (такими как фенитоин и габапентин), вазодилаторами (такими как празосин и силденафил), стабилизаторами настроения (такими как валпроат и арипипразол), противораковыми лекарственными средствами (такими как антипролиферативные агенты), антигипертоническими агентами (такими как атенолол, клонидин, амлопидин, верапамил и олмезартан), лаксативами, размягчителями стула, диуретиками (такими как фуроземид), спазмолитиками (такими как дицикломин), антидискинетическими агентами и противоязвенными лекарственными средствами (такими как эзомепразол).
Соединения по настоящему изобретению могут использоваться сами по себе или в сочетании с другими терапевтическими агентами, включающими другие соединения по настоящему изобретению. Такое сочетание фармацевтически активных агентов может вводиться вместе или по отдельности, и когда они вводятся по отдельности, введение может осуществляться одновременно или последовательно, в любом порядке. Количества соединений или агентов и относительный временной график введения будут выбираться для достижения желаемого терапевтического воздействия. Введение в сочетании соединений формулы по настоящему изобретению, включая их соли или сольваты, с другими лечебными агентами может осуществляться в сочетании посредством одновременного введения в: (1) стандартной дозированной фармацевтической композиции, содержащей оба соединения; или (2) в отдельных фармацевтических композициях, каждая из которых содержит одно из соединений. Альтернативно, сочетание может вводиться по отдельности последовательным образом, когда один лечебный агент вводится первым, а другой вторым, или наоборот. Такое последовательное введение может быть близким по времени или отдаленным по времени. Соединения по настоящему изобретению могут использоваться при лечении разнообразных расстройств и состояний, и, как таковые, соединения по настоящему изобретению могут использоваться в сочетании с разнообразными другими соответствующими терапевтическими агентами, пригодными для использования при лечении и/или профилактике этих расстройств или состояний.
Следующие далее примеры приводятся для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие его. В этих примерах, все части и проценты являются массовыми, если не утверждается иного.
Список сокращений:
Следующие далее определения для сокращений, используемые здесь, предназначены для пояснения, но не ограничения определяемых терминов. Если конкретное сокращение, используемое здесь, не является определенным конкретно, сокращенный термин не должен считаться неопределенным. Скорее, сокращения используются в пределах их принятых значений в данной области.
ТГФ (тетрагидрофуран)
DIPEA (диизопропилэтиламин)
ДМФ (диметилформамид)
HBTU (O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат)
DMAP (4-N,N-диметиламинопиридин)
CMA 90 (хлороформ:метанол:водный раствор гидроксида аммония (90:9:1))
DCC (N,N'-дициклогексилкарбодиимид)
PS-DCC (связанный с полистиролом N,N'-дициклогексилкарбодиимид)
HOBt (1-гидроксибензотриазол)
TFA (трифторуксусная кислота)
ВЭЖХ (высокоэффективная жидкостная хроматография)
MLA (метилликаконитин)
NOR (распознавание нового объекта)
ND (не определен)
Биологические анализы
Пример 1
Связывание радиоактивно меченных лигандов на nAChRs CNS
Подтип α4β2 nAChR
Крыс (самки, Sprague-Dawley), массой 150-250 г, содержат при 12-час цикле свет/темнота и обеспечивают свободный доступ к воде и корму, поставляемому PMI Nutrition International, Inc. Животных анестезируют с помощью 70% CO2, затем обезглавливают. Мозги удаляют и помещают на платформу со льдом. Кору головного мозга удаляют и помещают в 20 объемов (масс:объем) препаративного буфера (137 мМ NaCl, 10,7 мМ KCl, 5,8 мМ KH2PO4, 8 мМ Na2HPO4, 20 мМ HEPES (свободная кислота), 5 мМ йодацетамида, 1,6 мМ EDTA, pH 7,4); добавляют PMSF, растворенный в метаноле до конечной концентрации 100 мкМ, и суспензию гомогенизируют с помощью Polytron. Гомогенат центрифугируют при 18000×g в течение 20 мин при 4°C и полученный осадок повторно суспендируют в 20 объемах воды со льдом. После 60 мин инкубирования на льду, новый осадок собирают посредством центрифугирования при 18000×g в течение 20 мин при 4°C. Конечный осадок повторно суспендируют в 10 объемах буфера и хранят при -20°C. В день анализа, ткани размораживают, центрифугируют при 18000×g в течение 20 мин, а затем повторно суспендируют в PBS (фосфатный буферный солевой раствор Дульбекко, 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pH 7,4) со льдом до конечной концентрации приблизительно 4 мг белка/мл. Белок определяют способом Lowry et al., J. Biol. Chem. 193:265 (1951), с использованием бычьего сывороточного альбумина как стандарта.
Связывание [3H]никотина измеряют с использованием способов модификации Romano et al., Science 210:647 (1980) и Marks et al., Mol. Pharmacol. 30:427 (1986). [3H]Никотин (удельная активность = 81,5 Кюри/ммоль) получают от NEN Research Products. Связывание [3H]никотина измеряют с использованием 3-час инкубирования при 4°C. Инкубирование осуществляют в 48-луночных микротитровальных планшетах, и они содержат примерно 400 мкг белка на лунку в конечном объеме инкубирования 300 мкл. Буфер для инкубирования представляет собой PBS, и конечная концентрация [3H]никотина равна 5 нМ. Реакцию связывания прекращают посредством фильтрования белка, содержащего связанный лиганд, на стекловолоконных фильтрах (GF/B, Brandel) с использованием Brandel Tissue Harvester при 4°C. Фильтры пропитывают в деионизованной воде, содержащей 0,33% полиэтиленимина, для уменьшения неспецифичного связывания. Каждый фильтр промывают буфером со льдом (3×1 мл). Неспецифичное связывание определяют посредством включения 10 мкМ нерадиоактивного L-никотина (Acros Organics) в выбранные лунки.
Ингибирование связывания [3H]никотина исследуемыми соединениями определяют, помещая семь различных концентраций исследуемого соединения в выбранные лунки. Каждую концентрацию воспроизводят по три раза. Значения IC50 оценивают как концентрацию соединения, которая ингибирует 50 процентов специфичного связывания [3H]никотина. Константы ингибирования (значения Ki), выраженные в нМ, вычисляют из значений IC50 с использованием способа Cheng et al., Biochem. Pharmacol. 22:3099 (1973).
Подтип nAChR α7
Крыс (самки, Sprague-Dawley), массой 150-250 г, содержат при 12-час цикле свет/темнота и обеспечивают свободный доступ к воде и корму, поставляемому PMI Nutrition International, Inc. Животных анестезируют с помощью 70% CO2, затем обезглавливают. Мозги удаляют и помещают на платформу со льдом. Гиппокамп удаляют и помещают в 10 объемов (масс:объем) препаративного буфера (137 мМ NaCl, 10,7 мМ KCl, 5,8 мМ KH2PO4, 8 мМ Na2HPO4, 20 мМ HEPES (свободная кислота), 5 мМ йодацетамида, 1,6 мМ EDTA, pH 7,4); добавляют PMSF, растворенный в метаноле до конечной концентрации 100 мкМ, и суспензию гомогенизируют с помощью Polytron. Гомогенат центрифугируют при 18000×g в течение 20 мин при 4°C и полученный осадок повторно суспендируют в 10 объемах воды со льдом. После 60 мин инкубирования на льду, новый осадок собирают посредством центрифугирования при 18000×g в течение 20 мин при 4°C. Конечный осадок повторно суспендируют в 10 объемах буфера и хранят при -20°C. В день анализа ткани размораживают, центрифугируют при 18000×g в течение 20 мин, а затем повторно суспендируют в PBS (фосфатный буферный солевой раствор Дульбекко, 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pH 7,4) со льдом до конечной концентрации приблизительно 2 мг белка/мл. Белок определяют способом Lowry et al., J. Biol. Chem. 193:265 (1951), с использованием бычьего сывороточного альбумина как стандарта.
Связывание [3H]MLA измеряют с использованием модификации способов Davies et al., Neuropharmacol. 38:679 (1999). [3H]MLA (удельная активность = 25-35 Кюри/ммоль) получают от Tocris. Связывание [3H]MLA определяют с использованием 2-час инкубирования при 21°C. Инкубирование осуществляют в 48-луночных микротитровальных планшетах, и они содержат примерно 200 мкг белка на лунку при конечном объеме инкубирования 300 мкл. Буфер для инкубирования представляет собой PBS, и конечная концентрация [3H]MLA равна 5 нМ. Реакцию связывания прекращают посредством фильтрования белка, содержащего связанный лиганд, на стекловолоконных фильтрах (GF/B, Brandel) с использованием Brandel Tissue Harvester при комнатной температуре. Фильтры пропитывают в деионизованной воде, содержащей 0,33% полиэтиленимина, для уменьшения неспецифичного связывания. Каждый фильтр промывают PBS (3×1 мл) при комнатной температуре. Неспецифичное связывание определяют посредством включения 50 мкМ нерадиоактивного MLA в выбранные лунки.
Ингибирование связывания [3H]MLA исследуемыми соединениями определяют, помещая семь различных концентраций исследуемого соединения в выбранные лунки. Каждую концентрацию воспроизводят по три раза. Значения IC50 оценивают как концентрацию соединения, которая ингибирует 50 процентов специфичного связывания [3H]MLA. Константы ингибирования (значения Ki), выраженные в нМ, вычисляют из значений IC50 с использованием способа Cheng et al., Biochem. Pharmacol. 22:3099-3108 (1973).
Пример 2
Определение высвобождения допамина
Высвобождение допамина измеряют с использованием стриатальных синаптосом, полученных из мозга крысы, в соответствии с процедурами, представленными Rapier et al., J. Neurochem. 54:937 (1990). Крыс (самки, Sprague-Dawley) массой 150-250 г содержат при 12-час цикле свет/темнота и предоставляют свободный доступ к воде и корму, поставляемому PMI Nutrition International, Inc. Животных анестезируют с помощью 70% CO2, затем обезглавливают. Мозги быстро удаляют и полосатые тела иссекают. Стриатальные ткани от каждой из 2 крыс собирают вместе и гомогенизируют в 0,32 M растворе сахарозы со льдом (5 мл), содержащем 5 мМ HEPES, pH 7,4, с использованием стекла/стеклянного гомогенизатора. Затем ткани центрифугируют при 1000×g в течение 10 мин. Осадок удаляют и супернатант центрифугируют при 12000×g в течение 20 мин. Полученный осадок повторно суспендируют в перфузионном буфере, содержащем ингибиторы моноаминоксидазы (128 мМ NaCl, 1,2 мМ KH2PO4, 2,4 мМ KCl, 3,2 мМ CaCl2, 1,2 мМ MgSO4, 25 мМ HEPES, 1 мМ аскорбиновой кислоты, 0,02 мМ паргилина в хлороводородной кислоте и 10 мМ глюкозы, pH 7,4) и центрифугируют в течение 15 мин при 25000×g. Конечный осадок повторно суспендируют в перфузионном буфере (1,4 мл) для немедленного использования.
Синаптосомальную суспензию инкубируют в течение 10 мин при 37°C для восстановления метаболической активности. [3H]Допамин ([3H]DA, удельная активность = 28,0 Кюри/ммоль, NEN Research Products) добавляют при конечной концентрации 0,1 мкМ и суспензию инкубируют при 37°C в течение еще 10 мин. Аликвоты тканей (50 мкл) и перфузионного буфера (100 мкл) загружают в перфузионные камеры от Brandel Suprafusion System (series 2500, Gaithersburg, MD). Перфузионный буфер (комнатная температура) закачивают в камеры при скорости 3 мл/мин в течение периода промывки в 8 мин. Исследуемое соединение (10 мкМ) или никотин (10 мкМ) затем вводят в перфузионный поток в течение 40 сек. Фракции (по 12 сек каждая) непрерывно отбирают из каждой камеры в течение эксперимента для регистрации фонового высвобождения и пика высвобождения, вызываемого агонистом, и для повторного восстановления фонового уровня после введения агониста. Перфузат собирают непосредственно в сцинтилляционные флаконы, в которые добавляют сцинтилляционную жидкость. Высвобождаемый [3H]DA количественно определяют с помощью счета сцинтилляций. Для каждой камеры, интегральная площадь пика нормируется на его фоновый уровень.
Высвобождение выражают как процент от высвобождения, полученного с помощью такой же концентрации L-никотина. При каждом анализе, каждое исследуемое соединение воспроизводят с использованием 2-3 камер; повторения усредняют. Когда это необходимо, определяют кривые доза-реакция для исследуемого соединения. Максимальное активирование для индивидуального соединения (Emax) определяют как процент от максимального активирования, вызываемого L-никотином. Концентрация соединения, вызывающая половинное максимальное активирование (EC50) потока конкретных ионов, также определяется.
Пример 3
Селективность по отношению к периферическим nAChRs
Взаимодействие на мышечном подтипе nAChR человека
Активирование nAChRs мышечного типа устанавливают на клональной линии человека TE671/RD, которую получают из эмбриональной рабдомиосаркомы (Stratton et al., Carcinogen 10: 899 (1989)). Эти клетки экспрессируют рецепторы, которые имеют фармакологические (Lukas, J. Pharmacol. Exp. Ther. 251:175 (1989)), электрофизиологические (Oswald et al., Neurosci. Lett. 96:207 (1989)) и молекулярно-биологические профили (Luther et al., J. Neurosci. 9:1082 (1989)), сходные с nAChR мышечного типа.
Клетки TE671/RD поддерживают в фазе пролиферативного роста в соответствии с обычными протоколами (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991), и Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991)). Клетки культивируют в среде Игла, модифицированной Дульбекко (Gibco/BRL), с 10% сыворотки лошади/BRL), 5% фетальной бычьей сыворотки (HyClone, Logan UT), 1 мМ пирувата натрия, 4 мМ L-глутамина и 50000 единиц пенициллина-стрептомицина (Irvine Scientific). Когда клетки становятся конфлюэнтными на 80%, их помещают на 12-луночные полистироловые планшеты (Costar). Эксперименты осуществляют, когда клетки достигают 100% конфлюэнтности.
Функционирование никотиновых ацетилхолиновых рецепторов (nAChR) анализируют с использованием выведения 86Rb+ в соответствии со способом, описанным Lukas et al., Anal. Biochem. 175:212 (1988). В день эксперимента, среду роста осторожно удаляют из лунок и в каждую лунку добавляют среду роста, содержащую 86хлорид рубидия (106 мкКюри/мл). Клетки инкубируют при 37°C в течение минимум 3 час. После периода нагружения, избыток 86Rb+ удаляют и клетки промывают дважды не содержащим метки фосфатным буферным солевым раствором Дульбекко (138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pH 7,4), с осторожностью, чтобы не повредить клетки. Затем, клетки экспонируют либо для 100 мкМ исследуемого соединения, 100 мкМ L-никотина (Acros Organics), либо для одного только буфера в течение 4 мин. После периода экспонирования, супернатант, содержащий высвобождаемый 86Rb+, удаляют и переносят в сцинтилляционные флаконы. Добавляют сцинтилляционную жидкость и высвобождаемую радиоактивность измеряют с помощью счета сцинтилляций в жидкости.
В каждом анализе, каждая точка воспроизводится 2 раза, с усреднением. Количество высвобождаемого 86Rb+ сравнивают как с положительным контролем (100 мкМ L-никотина), так и с отрицательным контролем (буфер сам по себе), для определения процента высвобождения по отношению к L-никотину.
Когда это необходимо, определяют кривые доза-реакция для исследуемого соединения. Максимальное активирование для индивидуального соединения (Emax) определяют как процент от максимального активирования, вызываемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию (EC50) для конкретного потока ионов.
Взаимодействия на ганглионарном подтипе nAChR крысы
Активирование ганглионарных nAChRs крыс устанавливают на клональной линии феохромоцитомы PC12, которая представляет собой непрерывную клональную линию клеток, происходящих от нервных гребешков, полученных из опухоли мозгового вещества надпочечников крыс. Эти клетки экспрессируют nAChR, подобные ганглионарным (см. Whiting et al., Nature 327:515 (1987); Lukas, J. Pharmacol. Exp. Ther. 251:175 (1989); Whiting et al., Mol. Brain Res. 10:61 (1990)).
Клетки PC12 крыс поддерживают в фазе пролиферативного роста в соответствии с обычными протоколами (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991), и Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991)). Клетки культивируют в среде Игла, модифицированной Дульбекко (Gibco/BRL), с 10% сыворотки лошади (Gibco/BRL), 5% фетальной бычьей сыворотки (HyClone, Logan UT), 1 мМ пирувата натрия, 4 мМ L-глутамина и 50000 единиц пенициллина-стрептомицина (Irvine Scientific). Когда клетки становятся конфлюэнтными на 80%, их помещают в 12-луночные планшеты Nunc (Nunclon) и покрывают 0,03% поли-L-лизина (Sigma, растворяют в 100 мМ борной кислоты). Эксперименты осуществляют, когда клетки достигают 80% конфлюэнтности.
Функционирование никотиновых ацетилхолиновых рецепторов (nAChR) анализируют с использованием выведения 86Rb+ в соответствии со способом, описанным Lukas et al., Anal. Biochem. 175:212 (1988). В день эксперимента, среду роста осторожно удаляют из лунок и в каждую лунку добавляют среду роста, содержащую 86хлорид рубидия (106 мкКюри/мл). Клетки инкубируют при 37°C в течение минимум 3 час. После периода нагружения, избыток 86Rb+ удаляют и клетки промывают дважды не содержащим метки фосфатным буферным солевым раствором Дульбекко (138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pH 7,4), с осторожностью, чтобы не повредить клетки. Затем, клетки экспонируют либо для 100 мкМ исследуемого соединения, 100 мкМ никотина, либо для одного только буфера в течение 4 мин. После периода экспонирования, супернатант, содержащий высвобождаемый 86Rb+, удаляют и переносят в сцинтилляционные флаконы. Добавляют сцинтилляционную жидкость и высвобождаемую радиоактивность измеряют с помощью счета сцинтилляций в жидкости.
В каждом анализе, каждая точка воспроизводится 2 раза, с усреднением. Количество высвобождаемого 86Rb+ сравнивают как с положительным контролем (100 мкМ никотина), так и с отрицательным контролем (буфер сам по себе) для определения процента высвобождения по отношению к L-никотину.
Когда это необходимо, определяют кривые доза-реакция для исследуемого соединения. Максимальное активирование для индивидуального соединения (Emax) определяют как процент от максимального активирования, вызываемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию (EC50) для конкретного потока ионов.
Взаимодействие на ганглионарном подтипе nAChR человека
Линия клеток SH-SY5Y представляет собой непрерывную линию, полученную с помощью последовательного субклонирования родительской линии клеток SK-N-SH, которую сначала получают от периферической нейробластомы человека. Клетки SH-SY5Y экспрессируют nAChR, подобные ганглионарным (Lukas et al., Mol. Cell. Neurosci. 4:1 (1993)).
Клетки человека SH-SY5Y поддерживают в фазе пролиферативного роста в соответствии с рутинными протоколами (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991), и Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991)). Клетки культивируют в среде Игла, модифицированной Дульбекко (Gibco/BRL), с 10% сыворотки лошади (Gibco/BRL), 5% фетальной бычьей сыворотки (HyClone, Logan UT), 1 мМ пирувата натрия, 4 мМ L-глутамина и 50000 единиц пенициллина-стрептомицина (Irvine Scientific). Когда клетки становятся конфлюэнтными на 80%, их помещают в 12-луночные полистироловые планшеты (Costar). Эксперименты осуществляют, когда клетки достигают 100% конфлюэнтности.
Функционирование никотиновых ацетилхолиновых рецепторов (nAChR) анализируют с использованием выведения 86Rb+ в соответствии со способом, описанным Lukas et al., Anal. Biochem. 175:212 (1988). В день эксперимента, среду роста осторожно удаляют из лунок и в каждую лунку добавляют среду роста, содержащую 86хлорид рубидия (106 мкКюри/мл). Клетки инкубируют при 37°C в течение минимум 3 час. После периода нагружения, избыток 86Rb+ удаляют и клетки промывают дважды не содержащим метки фосфатным буферным солевым раствором Дульбекко (138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pH 7,4), с осторожностью, чтобы не повредить клетки. Затем клетки экспонируют либо для 100 мкМ исследуемого соединения, 100 мкМ никотина, либо для одного только буфера в течение 4 мин. После периода экспонирования, супернатант, содержащий высвобождаемый 86Rb+, удаляют и переносят в сцинтилляционные флаконы. Добавляют сцинтилляционную жидкость и высвобождаемую радиоактивность измеряют с помощью счета сцинтилляций в жидкости.
В каждом анализе, каждая точка воспроизводится 2 раза, с усреднением. Количество высвобождаемого 86Rb+ сравнивают как с положительным контролем (100 мкМ никотина), так и с отрицательным контролем (буфер сам по себе) для определения процента высвобождения по отношению к L-никотину.
Когда это необходимо, определяют кривые доза-реакция для исследуемого соединения. Максимальное активирование для индивидуального соединения (Emax) определяют как процент от максимального активирования, вызываемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию (EC50) для конкретного потока ионов.
Пример 4
Определение связывания на неникотиновых рецепторах
Мускаринововый подтип M3
Клональную линию TE671/RD человека, полученную из эмбриональной рабдомиосаркомы (Stratton et al., Carcinogen 10:899 (1989)), используют для определения связывания с подтипом мускаринового рецептора M3. Как показано с помощью фармакологических (Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991), и Lukas, J. Pharmacol. Exp. Ther. 251:175 (1989)), электрофизиологических (Oswald et al., Neurosci. Lett. 96:207 (1989)) и молекулярно-биологических исследований (Luther et al., J. Neurosci. 9:1082 (1989)), эти клетки экспрессируют никотиновые рецепторы, подобные мышечным. Клетки TE671/RD поддерживают в фазе пролиферативного роста в соответствии с рутинными протоколами (Bencherif et al., Mol. Cell. Neurosci. 2:52 (1991), и Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991)). Их выращивают до конфлюэнтности на 20-150-мм обработанных планшетах для культур тканей. Затем среды удаляют и клетки соскребают с использованием 80 мл PBS (фосфатный буферный солевой раствор Дульбекко, 138 мМ NaCl, 2,67 мМ KCl, 1,47 мМ KH2PO4, 8,1 мМ Na2HPO4, 0,9 мМ CaCl2, 0,5 мМ MgCl2, Invitrogen/Gibco, pH 7,4), а затем центрифугируют при 1000 об/мин в течение 10 мин. Супернатант затем отсасывают и осадок хранят при -20°C до использования.
В день анализа, осадок оттаивают, повторно суспендируют в PBS и центрифугируют при 18000×g в течение 20 мин, затем повторно суспендируют в PBS до конечной концентрации приблизительно 4 мг белка/мл и гомогенизируют с помощью Polytron. Белок определяют способом Lowry et al., J. Biol. Chem. 193:265 (1951), с использованием бычьего сывороточного альбумина как стандарта.
Связывание [3H]QNB измеряют с использованием модификации способов Bencherif et al., J. Pharmacol. Exp. Ther. 257:946 (1991). [3H]QNB (удельная активность = 30-60 Кюри/ммоль) получают от NEN Research Products. Связывание [3H]QNB измеряют с использованием 3-час инкубирования при 4°C. Инкубирование осуществляют в 48-луночных микротитровальных планшетах, и они содержат примерно 400 мкг белка на лунку при конечном объеме инкубирования 300 мкл. Буфер для инкубирования представляет собой PBS, и конечная концентрация [3H]QNB равна 1 нМ. Реакцию связывания завершают посредством фильтрования белка, содержащего связанный лиганд, на стекловолоконных фильтрах (GF/B, Brandel) с использованием Brandel Tissue Harvester при 4°C. Фильтры предварительно пропитывают в деионизованной воде, содержащей 0,33% полиэтиленимина, для уменьшения неспецифичного связывания. Каждый фильтр промывают буфером со льдом (3×1 мл). Неспецифичное связывание определяют посредством включения 10 мкМ нерадиоактивного атропина в выбранные лунки.
Ингибирование связывания [3H]QNB исследуемыми соединениями определяют, помещая семь различных концентраций исследуемого соединения в выбранных лунках. Каждую концентрацию воспроизводят по три раза. Значения IC50 оценивают как концентрацию соединения, которая ингибирует 50 процентов специфичного связывания [3H]QNB. Константы ингибирования (значения Ki), выраженные в нМ, вычисляют из значений IC50 с использованием способа Cheng et al., Biochem. Pharmacol. 22:3099 (1973).
Примеры синтеза
Следующие далее примеры синтеза приводятся для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие его. В этих примерах все части и проценты являются массовыми, если не утверждается иного. Если не утверждается иного, все реагенты и растворители используют, как получено из коммерческих источников, и все реакции осуществляют в атмосфере азота.
Пример 5
Синтез 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты
Промежуточное соединение, 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновую кислоту, синтезируют с использованием следующих процедур.
Диэтил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7,7-дикарбоксилат:
Следуя способу Flynn и Zabrowski, J. Org. Chem. 55:3673-3674 (1990), этот источник включается сюда в виде ссылки по отношению к такой концепции синтеза, диэтилаллилмалонат (18,0 г, 90,0 ммоль) растворяют в тетрагидрофуране (ТГФ) (50 мл). Гидрид натрия (11,5 г, 288 ммоль, 60% дисперсия в масле) добавляют к реакционной смеси. После 30 мин перемешивания при температуре окружающей среды, добавляют раствор N-йодсукцинимида (21,9 г, 97,2 ммоль) в ТГФ (100 мл) и реакционную смесь перемешивают в темноте при температуре окружающей среды в течение 15 мин. Реакционную смесь выливают на 100 г силикагеля. Содержимое разбавляют 400 мл эфира и перемешивают с помощью стеклянной палочки. Затем содержимое фильтруют через слой силикагеля (100 г) в воронке со спеченным фильтром. Силикагель промывают эфиром (4×400 мл). Объединенные фильтраты концентрируют с помощью роторного испарителя, с получением диэтил 2-аллил-2-йодмалоната в виде желтоватой оранжевой жидкости, которую используют непосредственно в следующей реакции.
Диэтил 2-аллил-2-йодмалонат и N-(трет-бутоксикарбонил)аллиламин (20,8 г, 132 ммоль) растворяют в бензоле (300 мл). Бис(трибутилолово) (3,6 мл, 7,1 ммоль) добавляют к реакционной смеси и реакционную смесь облучают с помощью лампы дневного света (GE, 275 W) в течение 35 мин. Источник света удаляют, добавляют к реакционной смеси диизопропилэтиламин (100 мл) и смесь нагревают с обратным холодильником в течение ночи. Реакционную смесь охлаждают до температуры окружающей среды, промывают водой (200 мл), сушат (безводный сульфат натрия), концентрируют (на роторном испарителе) и очищают с помощью колоночной хроматографии на силикагеле, с получением 13,0 г (40,6% от диэтилаллилмалоната) диэтил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7,7-дикарбоксилата в виде масла.
3-(трет-Бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновая кислота:
К диэтил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7,7-дикарбоксилату (10,5 г, 29,5 ммоль) добавляют воду (25 мл) и концентрированную (12 н.) хлороводородную кислоту (75 мл). Смесь нагревают с обратным холодильником в течение 8 час. Летучие продукты выпаривают и остаток растворяют в воде (10 мл) и pH раствора доводят до pH 8 с помощью 10% водного раствора бикарбоната натрия. Добавляют ди-трет-бутилдикарбонат (8,5 г, 39 ммоль) в трет-бутаноле (60 мл) и реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Добавляют к реакционной смеси этилацетат (100 мл) и доводят pH раствора до pH 3 с помощью 2M водного раствора хлороводородной кислоты. Водный слой экстрагируют этилацетатом (200 мл). Органический слой промывают водой (2×200 мл) и насыщенным раствором соли (100 мл), сушат (безводный сульфат натрия), концентрируют (на роторном испарителе) и очищают с помощью колоночной хроматографии на силикагеле, с получением 5,1 г 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты в виде белого твердого продукта (1H ЯМР (CDCl3, 300 МГц): δ 3,59-3,40 (м, 2H), 3,36-3,05 (м, 2H), 3,02-2,76 (м, 2H), 2,65-2,60 (м, 1H), 2,24-2,04 (м, 2H), 1,85-1,66 (м, 2H), 1,46 (с, 9H); МС (m/z): 256 (М+1), 200 (М+1-56)).
Пример 6
Синтез N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида
К смеси 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты (0,930 г, 3,65 ммоль), N,O-диметилгидроксиламина гидрохлорида (0,71 г, 7,3 ммоль) и диизопропилэтиламина (DIPEA) (3,24 мл, 18,3 ммоль) в N,N-диметилформамиде (ДМФ) (50 мл) добавляют O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (HBTU) (2,07 г, 5,48 ммоль) и смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия (100 мл) и экстрагируют этилацетатом (100 мл). Органический слой промывают водой (200 мл), сушат над безводным сульфатом натрия, концентрируют с помощью роторного испарителя и очищают с помощью колоночной флэш-хроматографии на силикагеле, с получением 0,94 г (выход 86%) N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида в виде масла (1H ЯМР (CDCl3, 300 МГц): δ 3,69 (с, 3H), 3,6-3,42 (м, 2H), 3,36-3,05 (м, 3H), 3,18 (с, 3H), 2,82-2,57 (м, 2H), 2,08-2,02 (м, 2H), 1,82-1,65 (м, 2H), 1,46 (д, 9H); МС (m/z: 299 (М+1), 243 (М+1-56)).
Пример 7
Кетоновые производные 3-азабицикло[3.3.0]октан-7-карбоновой кислоты
Способ A: Определенные ацильные (кетоновые) аналоги 3-азабицикло[3.3.0]октана могут быть получены из 3-азабицикло[3.3.0]октан-7-карбоновой кислоты, посредством реакции производного N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида с арил- и алкиллитиевым реагентами. Следующая далее процедура является иллюстративной.
2-Фуранил(3-азабицикло[3.3.0]окт-7-ил)метанонтрифторацетат:
Раствор 2-бромфурана (0,295 г, 2,00 ммоль) в ТГФ (15 мл) при -78°C обрабатывают раствором н-бутиллития (н-BuLi) (2,5 M раствор в гексане, 0,85 мл, 2,1 ммоль) и смесь перемешивают в течение 1 часа. Добавляют раствор N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида (0,60 г, 2,0 ммоль) в ТГФ (3 мл) и смесь нагревают до температуры окружающей среды в течение 8 час. Реакцию гасят водой (0,5 мл), разбавляют этилацетатом (20 мл), сушат над безводным сульфатом натрия и концентрируют. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в градиенте гексана, с получением образцов транс-изомера (ацильная группа в транс-положении по отношению к пирролидиновому кольцу) (0,12 г, элюируется первым), цис-изомера (ацильная группа в цис-положении по отношению к пирролидиновому кольцу) (0,17 г, элюируется вторым) и смеси изомеров (0,1 г), с получением общего выхода 62%. С выделенных образцов снимают защиту и преобразуют их в трифторацетатные соли с помощью реакции с трифторуксусной кислотой (TFA) в дихлорметане (5 мл), с последующей очисткой с помощью ВЭЖХ с использованием ацетонитрила и 0,05% водного раствора TFA в качестве подвижной фазы, с получением транс-2-фуранил(3-азабицикло[3.3.0]окт-7-ил)метанон трифторацетата (0,065 г), цис-2-фуранил(3-азабицикло[3.3.0]окт-7-ил)метанон трифторацетата (0,106 г) и смеси цис- и транс-изомеров (0,075 г) (1H ЯМР транс-изомера (CD3OD, 300 МГц): δ 7,81 (дд, J=1,71, 0,73 Гц, 1H), 7,43 (дд, J=3,42, 0,73 Гц, 1H), 6,66 (дд, J=3,66, 1,71 Гц, 1H), 3,89-3,78 (м, 1H), 3,58-3,47 (м, 2H), 3,28-2,95 (м, 4H), 2,19-2,10 (м, 2H), 1,94-1,85 (м, 2H); МС (m/z): 206 (М+1); 1H ЯМР цис-изомера (CD3OD, 300 МГц): δ 7,81 (дд, J=1,71, 0,73 Гц, 1H), 7,43 (дд, J=3,66, 0,73 Гц, 1H), 6,66 (дд, J=3,66, 1,71 Гц, 1H), 3,83-3,72 (м, 1H), 3,39-3,32 (м, 2H), 3,25-3,19 (м, 2H), 3,07-2,98 (м, 2H), 2,39-2,28 (м, 2H), 1,81-1,70 (м, 2H); МС (m/z): 206 (М+1)).
Процедуры, сходные с указанными выше, используют для получения разнообразных ацильных (кетоновых) производных, включая соединения в таблице 1. В некоторых случаях, цис/транс-изомеры разделяются хроматографически, а в других нет.
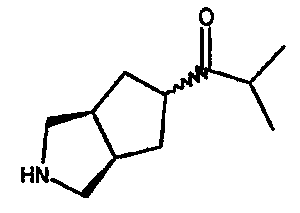

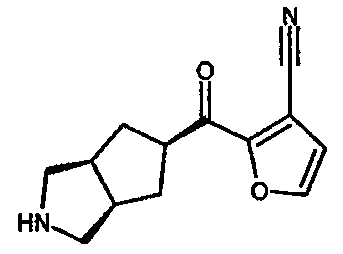
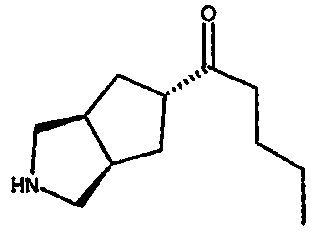
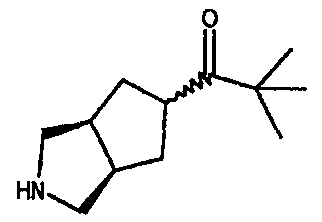

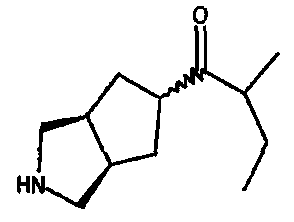
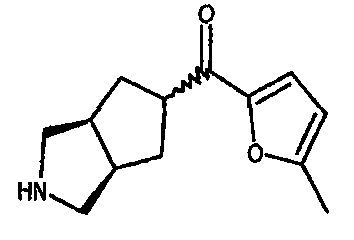
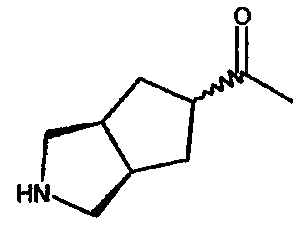
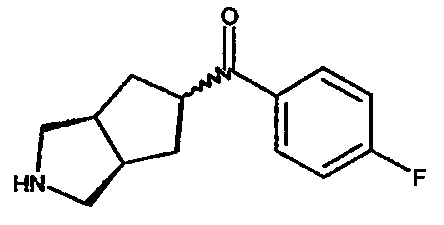
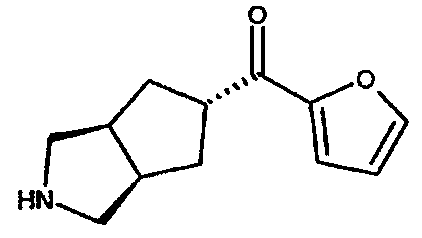

Способ B: Некоторые другие ацильные (кетоновые) производные могут быть получены с помощью реакции N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида с алкилмагний галогенидными реагентами (реагенты Гриньяра). Следующая далее процедура является иллюстративной.
Циклопропил(3-азабицикло[3.3.0]окт-7-ил)метанон трифторацетат:
К раствору N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида (0,20 г, 0,67 ммоль) в ТГФ (4,0 мл) при 0°C добавляют раствор циклопропилмагний бромида (0,50 M раствор в эфире, 5,4 мл, 2,7 ммоль) и реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Реакцию гасят 2% водным раствором уксусной кислоты (10 мл) и водную фазу экстрагируют этилацетатом (20 мл). Органические экстракты сушат (безводный сульфат натрия), концентрируют и очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом в градиенте гексана, с получением двух чистых цис- (элюируется позже) и транс- (элюируется раньше) изомеров (0,06 г и 0,07 г, соответственно) (общий выход 69%). С выделенных изомеров снимают защиту и преобразуют их в трифторацетатные соли с помощью реакции с трифторуксусной кислотой в дихлорметане (5 мл), с последующей очисткой с помощью ВЭЖХ с использованием ацетонитрила и 0,05% водного раствора TFA в качестве подвижной фазы, с получением транс-циклопропил(3-азабицикло[3.3.0]окт-7-ил)метанона трифторацетата (0,026 г), цис-циклопропил(3-азабицикло[3.3.0]окт-7-ил)метанона трифторацетата (0,023 г) в виде масел (1H ЯМР транс-изомера (CD3OD, 300 МГц): δ 3,59-3,40 (м, 2H), 3,37-3,29 (м, 1H), 3,02-2,90 (м, 4H), 2,16-2,03 (м, 3H), 1,87-1,80 (м, 2H), 0,96-0,91 (м, 4H); МС (m/z): 180 (М+1); 1H ЯМР цис-изомера (CD3OD, 300 МГц): δ 3,38-3,21 (м, 3H), 3,18-3,14 (м, 2H), 3,04-2,94 (м, 2H), 2,38-2,23 (м, 2H), 2,15-2,07 (м, 1H), 1,72-1,61 (м, 2H), 0,97-0,91 (м, 4H); МС (m/z): 180 (М+1)).
Процедуры, сходные с указанными выше, используют для получения разнообразных ацильных (кетоновых) производных, включая соединения в таблице 2. Как правило, цис/транс-изомеры не разделяются.
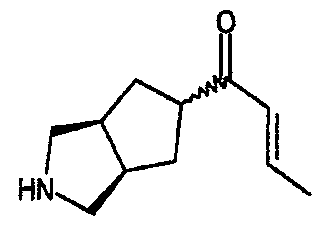

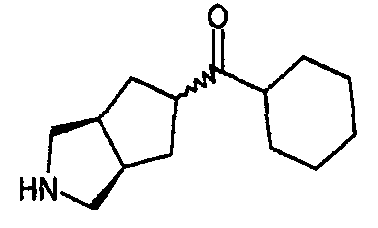
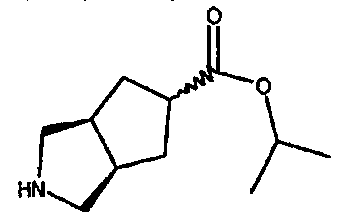
Способ C: Определенные ацильные (кетоновые) производные могут быть получены с помощью реакции хлорангидрида 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты с триметилсилилдиазометаноном, с последующими преобразованиями. Следующие далее процедуры являются иллюстративными.
1-(3-(трет-Бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанон:
К раствору 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты (0,580 г, 2,27 ммоль) в дихлорметане (10 мл) добавляют оксалилхлорид (1,45 г, 11,4 ммоль) и каплю ДМФ. Реакционную смесь перемешивают при температуре окружающей среды в течение 2 час. Летучие продукты выпаривают и хлорангидрид растворяют в эфире-ацетонитриле (20 мл, 9:1). Добавляют раствор триметилсилилдиазометана (2,0 M раствор в гексане, 3,5 мл, 7,0 ммоль) и реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь концентрируют в вакууме и полученное желтое масло растворяют в эфире (20 мл). Водный раствор бромоводородной кислоты (47%, 1,0 мл) быстро добавляют с энергичным перемешиванием. Через 1 мин реакцию гасят твердым бикарбонатом натрия (1,0 г) и смесь перемешивают в течение 15 мин. Реакционную смесь фильтруют, фильтрат концентрируют и очищают с помощью колоночной хроматографии на силикагеле, элюируя 20-30% этилацетатом в гексане, с получением 0,54 г (выход 74%) 1-(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанона, в виде масла (смесь цис/транс) (1H ЯМР (CDCl3, 300 МГц): δ 3,94 и 3,92 (с, 2H), 3,58-3,10 (м, 5H), 2,82-2,63 (м, 2H), 2,23-2,00 (м, 2H), 1,84-1,62 (м, 2H), 1,45 и 1,44 (с, 9H). МС (m/z): 332 (М+H), 334 (М+H+2)).
1-(3-Азабицикло[3.3.0]окт-7-ил)-2-фтор-1-этанон трифторацетат:
Смесь 1-(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанона (0,126 г, 0,380 ммоль), фторида калия (0,067 г, 1,15 ммоль) и 18-краун-6 (0,050 г, 0,19 ммоль) в бензоле (10 мл) нагревают с обратным холодильником в течение ночи. Смесь фильтруют, фильтрат концентрируют и очищают с помощью колоночной хроматографии на силикагеле, элюируя 20-30% этилацетатом в гексане, с получением цис-изомера (0,022 г), транс изомера (0,030 г) и смеси цис/транс 1-(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-фтор-1-этанона (0,040 г) в виде масла. С выделенных изомеров снимают защиту и преобразуют их в трифторацетатные соли с помощью реакции с трифторуксусной кислотой в дихлорметане (5 мл) (температура окружающей среды, 1 час). Растворитель выпаривают и продукты сушат в вакууме, с получением 1-(3-азабицикло[3.3.0]окт-7-ил)-2-фтор-1-этанон трифторацетата в виде цис- и транс-изомеров (0,025 г и 0,032 г, соответственно) (1H ЯМР транс-изомера (CD3OD, 300 МГц): δ 5,08 (с, 1H), 4,93 (с, 1H), 3,37-3,29 (м, 2H), 3,24-3,16 (м, 3H), 3,00-2,95 (м, 2H), 2,34-2,22 (м, 2H), 1,69-1,58 (м, 2H); МС (m/z): 172 (М+1); 1H-ЯМР цис-изомера (CD3OD, 300 МГц): δ 5,13 (с, 1H), 4,98 (с, 1H), 3,60-3,52 (м, 2H), 3,78-3,67 (м, 2H), 3,12-2,96 (м, 3H), 2,38-2,15 (м, 2H), 1,91-1,64 (м, 2H); МС (m/z): 172 (М+1)).
Цис-изомер демонстрирует значения Ki для α4β2 крысы и человека 6,8 нМ и 6,3 нМ соответственно и не проходит HTS для α7. Транс-изомер демонстрирует значение Ki для α4β2 крысы и человека 154 нМ и 176 нМ соответственно и демонстрирует значение Ki для α7>10000 нМ.
1-(3-Азабицикло[3.3.0]окт-7-ил)-2-метокси-1-этанон трифторацетат:
Смесь 1-(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанона (0,126 г, 0,360 ммоль), трифторметансульфоната серебра (0,10 г, 0,39 ммоль) и карбоната серебра (0,10 г, 0,36 ммоль) в метаноле (4,0 мл) перемешивают в темноте в течение 2 дней при температуре окружающей среды. Реакционную смесь фильтруют, фильтрат концентрируют и очищают с помощью колоночной хроматографии на силикагеле, элюируя 30-40% этилацетатом в гексане, с получением 0,062 г (выход 61%) 1-(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-метокси-1-этанона в виде масла. Его растворяют в дихлорметане (2,0 мл), обрабатывают TFA (0,5 мл) и перемешивают при температуре окружающей среды в течение 2 час. Летучие продукты выпаривают и остаток сушат в вакууме, с получением 0,045 г 1-(3-азабицикло[3.3.0]окт-7-ил)-2-метокси-1-этанон трифторацетата, в виде беловатого твердого продукта (смесь цис- и транс-изомеров) (1H ЯМР (CD3OD, 300 МГц): δ 4,17 (с, 2H), 3,39 (с, 3H), 3,36-3,30 (м, 2H), 3,19-3,12 (м, 3H), 3,00-2,91 (м, 2H), 2,30-2,20 (м, 2H), 1,64-1,75 (м, 2H); МС (m/z): 184 (М+1)).
Это вещество демонстрирует значения Ki для α4β2 крысы и человека 32 нМ и 31 нМ соответственно и не проходит HTS для α7.
1-(3-Азабицикло[3.3.0]окт-7-ил)-2-изопропокси-1-этанон трифторацетат:
1-(3-Азабицикло[3.3.0]окт-7-ил)-2-изопропокси-1-этанон трифторацетат приготавливают из 1-(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанона (0,087 г, 0,27 ммоль) и изопропанола в соответствии с процедурой, описанной выше для приготовления 1-(3-азабицикло[3.3.0]окт-7-ил)-2-метокси-1-этанон трифторацетата, с получением смеси цис- и транс-изомеров (1H ЯМР (CD3OD, 300 МГц): δ 4,21 и 4,20 (с, 2H), 3,64 (гептет, J=6,1 Гц) 1H), 3,54-3,42 (м, 1H), 3,24-3,15 (м, 2H), 2,98-2,90 (м, 4H), 2,37-2,22 и 2,06-1,99 (м, 2H), 1,82-1,75 и 1,65-1,54 (м, 2H), 1,18 (д, J=6,1 Гц, 6H); МС (m/z): 212 (М+1)).
Это вещество демонстрирует значения Ki для α4β2 крысы и человека 427 нМ и 261 нМ соответственно и не проходит HTS для α7.
Пример 8
Сложноэфирные производные 3-азабицикло[3.3.0]октан-7-карбоновой кислоты
Способ A: Определенные сложноэфирные производные 3-азабицикло[3.3.0]октан-7-карбоновой кислоты могут быть получены непосредственно из N-защищенной кислоты, с использованием конденсирующих агентов, таких как дициклогексилкарбодиимид (DCC). Следующая далее процедура является иллюстративной. Трифторацетатная соль 2,2,2-трифторэтил 3-азабицикло[3.3.0]октан-7-карбоксилата:
Смесь 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоновой кислоты (0,150 г, 0,588 ммоль), 2,2,2-трифторэтанола (0,118 г, 1,18 ммоль), 4-N,N-диметиламинопиридина (DMAP) (0,143 г, 1,18 ммоль) и дициклогексилкарбодиимида на полимерном носителе (PS-DCC) (0,8 г, загружают 3,2 ммоль/г) в дихлорметане (20 мл) перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь фильтруют и фильтрат концентрируют. Остаток очищают с помощью ВЭЖХ с использованием ацетонитрила и 0,05% водного раствора TFA в качестве подвижной фазы, с получением 0,053 г (выход 27%) 2,2,2-трифторэтил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксилата в виде масла. (1H ЯМР (CDCl3, 300 МГц): δ 4,48 (кв, J=8,30 Гц, 2H), 3,58-3,46 (м, 2H), 3,26-2,92 (м, 4H), 2,82-2,63 (м, 1H), 2,28-2,07 (м, 2H), 1,84-1,65 (м, 2H), 1,45 (с, 9H); МС (m/z): 338 (М+1), 282 (М+1-56)).
2,2,2-Трифторэтил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксилат растворяют в дихлорметане (5,0 мл), обрабатывают TFA (2,0 мл), и реакционную смесь перемешивают при температуре окружающей среды в течение 1 час. Растворитель выпаривают и сырой продукт очищают с помощью ВЭЖХ, с использованием ацетонитрила и 0,05% TFA в воде в качестве подвижной фазы, с получением 0,023 г трифторацетатной соли 2,2,2-трифторэтил 3-азабицикло[3.3.0]октан-7-карбоксилата (как смесь цис/транс-изомеров) в виде масла (1H ЯМР (CD3OD, 300 МГц): δ 4,62 (кв, J=8,79 Гц, 2H), 3,64-3,42 (м, 1H), 3,3,38-3,32 (м, 1H), 3,22-3,05 (м, 2H), 3,02-2,95 (м, 3H), 2,42-2,07 (м, 2H), 1,96-1,63 (м, 2H); МС (m/z): 238 (М+1)).
Процедуры, сходные с указанными выше, используют для получения разнообразных сложноэфирных производных, включая соединения в таблице 3. Как правило, цис/транс-изомеры не разделяются.

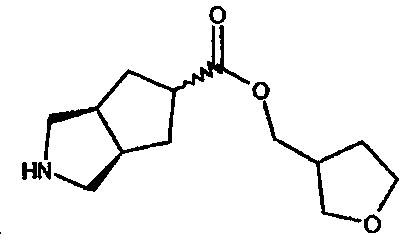

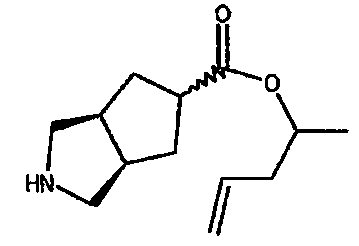
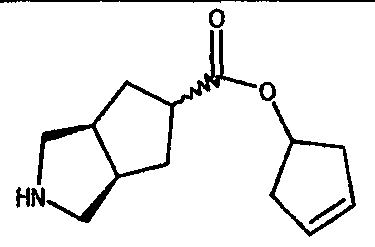
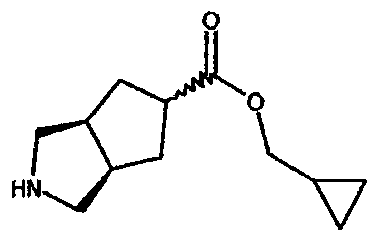


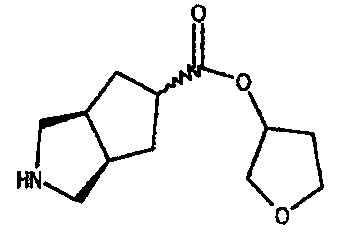

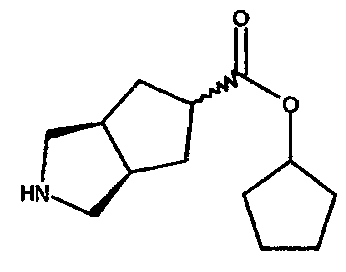
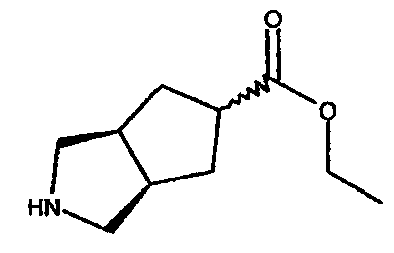
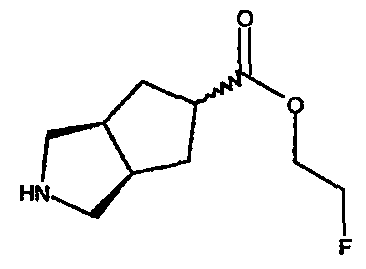

Способ B: метиловый эфир 3-азабицикло[3.3.0]октан-7-карбоновой кислоты получают с помощью различных процедур, которые следуют далее.
Гидрохлоридная соль метил 3-азабицикло[3.3.0]октан-7-карбоксилата:
К раствору 3-(трет-бутоксикарбонил)-3-азабицикло-[3.3.0]октан-7-карбоновой кислоты (0,15 г, 0,59 ммоль) в метаноле (5 мл) при 0°C добавляют раствор триметилсилилдиазометана (~4,0 мл, 2 M раствор в гексане), пока не исчезнет желтый цвет. Через 5 мин добавляют каплю уксусной кислоты и реакционную смесь концентрируют с получением масла (0,152 г). Этот сложный эфир растворяют в этилацетате (4,0 мл) и добавляют 4 M раствор хлороводородной кислоты в 1,4-диоксане (1,0 мл). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Полученный твердый продукт собирают посредством фильтрования, промывают этилацетатом (10 мл) и сушат в вакууме, с получением 0,11 г (выход 91%) гидрохлоридной соли метил 3-азабицикло[3.3.0]октан-7-карбоксилата (как цис/транс смесь), в виде белого рыхлого твердого продукта (1H ЯМР (CD3OD, 300 МГц): δ 3,74 (с, 3H), 3,57-3,32 (м, 2H), 3,222-3,16 (м, 2H), 3,05-2,88 (м, 3H), 2,38-2,03 (м, 2H), 1,83-1,61 (м, 2H); МС (m/z): 170 (М+1)).
Это вещество демонстрирует значения Ki для α4β2 крысы и человека 20 нМ и 8 нМ, соответственно, и значение Ki для α7 >10000 нМ.
Пример 9
Амидные производные 3-азабицикло[3.3.0]октан-7-карбоновой кислоты
Определенные амидные производные 3-азабицикло[3.3.0]октан-7-карбоновой кислоты могут быть получены с помощью хлорангидрида. Следующая далее процедура является иллюстративной.
N-(2,2,2-Трифторэтил)-3-азабицикло[3.3.0]октан-7-карбоксамид трифторацетат:
К раствору 3-(трет-бутоксикарбонил)-3-азабицикло- [3.3.0]октан-7-карбоновой кислоты (0,100 г, 0,392 ммоль) в дихлорметане (5 мл) добавляют оксалилхлорид (0,250 г, 1,96 ммоль) и каплю ДМФ и смесь перемешивают при температуре окружающей среды в течение 2 час. Растворитель выпаривают и остаток (хлорангидрид) сушат в вакууме. К хлорангидриду в ацетонитриле (5 мл) добавляют DIPEA (0,200 мл, 1,15 ммоль) и 2,2,2-трифторэтиламин (0,080 г, 0,081 ммоль) и смесь перемешивают в течение ночи при температуре окружающей среды. Растворитель выпаривают и сырой амид очищают с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом в градиенте гексана, с получением 0,075 г N-(2,2,2-трифторэтил)-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-карбоксамида (смесь цис- и транс-изомеров) в виде масла. Большую часть этого образца (0,065 г, 0,19 ммоль) растворяют в дихлорметане (3 мл) объединяют с TFA (2 мл) и перемешивают при температуре окружающей среды в течение 1 час. Растворитель выпаривают и остаток очищают с помощью ВЭЖХ, с использованием ацетонитрила и 0,05% водного раствора TFA в качестве мобильной фазы, с получением 0,050 г N-(2,2,2-трифторэтил)-3-азабицикло[3.3.0]октан-7-карбоксамид трифторацетата (как смеси цис- и транс-изомеров), в виде масла (1H ЯМР (CD3OD, 300 МГц): δ 3,93 (кв, J=9,28 Гц, 2H), 3,38-3,21 (м, 4H), 3,02-2,80 (м, 3H), 2,32-2,22 (м, 2H), 1,74-1,62 (м, 2H); МС (m/z): 238 (М+1)).
Это вещество демонстрирует значение Ki для α4β2 человека 261 нМ и не проходит HTS для α7.
Процедуры, сходные с указанными выше, используют для получения разнообразных амидных производных, включая соединения в таблице 4. В некоторых случаях цис- и транс-изомеры разделяются хроматографически, а во многих случаях, нет.
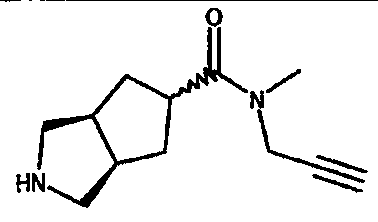
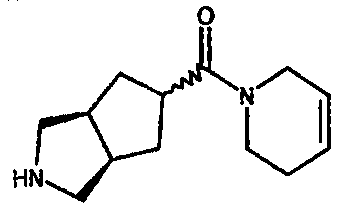
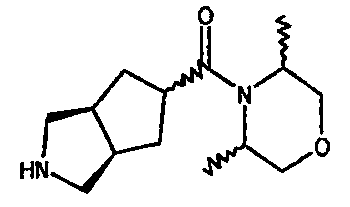

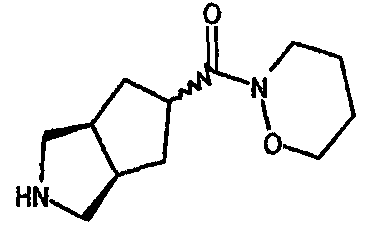
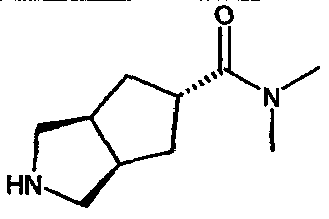


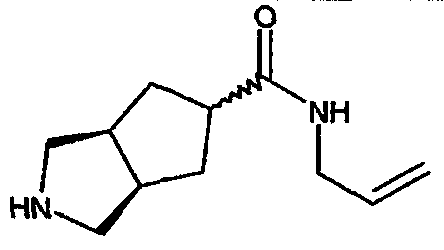
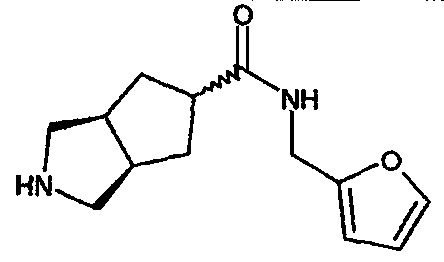

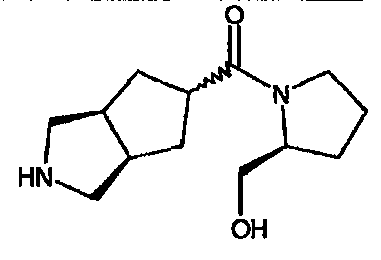
Пример 10
Производные 3-азабицикло[3.3.0]окт-6-ен-7-карбоновой кислоты
Определенные ненасыщенные аналоги 3-азабицикло[3.3.0]октан-7-карбоновой кислоты, а именно сложноэфирные, амидные и кетоновые производные 3-азабицикло[3.3.0]окт-6-ен-7-карбоновой кислоты, могут быть получены с использованием методик, которые иллюстрируются в следующих далее процедурах.
Метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоксилат:
К раствору 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]октан-7-она (4,08 г, 18,1 ммоль) (доступного, как описано Dart et al. в PCT WO 04/016604) в ТГФ (50 мл) при -78°C добавляют раствор литийгексаметилдисилазида (1,00 M раствор в ТГФ, 21,8 мл, 21,8 ммоль) и реакционную смесь перемешивают в течение 45 мин при -78°C. Добавляют раствор N-(5-хлорпиридин-2-ил)-бис-трифторметансульфонимида (8,53 г, 21,8 ммоль) в ТГФ (10 мл) и реакционную смесь нагревают до температуры окружающей среды в течение 1,5 час. Растворитель выпаривают и продукт очищают на колонке для флэш-хроматографии на силикагеле, элюируя 20-30% этилацетатом в гексане, с получением 6,3 г 3-(трет-бутоксикарбонил)-7-(трифторметилсульфонил)-3-азабицикло[3.3.0]окт-6-ена в виде масла. Его объединяют с палладий ацетатом (0,20 г, 0,88 ммоль), трифенилфосфином (0,46 г, 1,8 ммоль) и триэтиламином (4,94 мл, 35,3 ммоль) в ДМФ-метаноле (120 мл, 3:2) и барботируют через раствор газообразную моноокись углерода в течение 15 мин. Реакционную смесь перемешивают в атмосфере моноокиси углерода в течение 20 час при температуре окружающей среды. К реакционной смеси добавляют эфир (300 мл) и смесь промывают водой (500 мл), а затем 10% водным раствором хлорида натрия (200 мл). Органический слой сушат (безводный сульфат натрия), концентрируют (на роторном испарителе) и очищают с помощью колоночной хроматографии на силикагеле, элюируя 10-20% этилацетатом в гексане, с получением 3,5 г (выход 72%) метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]-окт-6-ен-7-карбоксилата в виде масла (1H ЯМР (CDCl3, 300 МГц): δ 6,60 (ушир.с, 1H), 3,74 (с, 1H), 3,74-3,61 (м, 1H), 3,58-3,41 (м, 3H), 3,08-2,85 (м, 2H), 2,82-2,74 (м, 1H), 2,50-2,44 (м, 1H), 1,43 (с, 9H); МС (m/z): 268 (М+1), 212 (М+1-56)).
Гидрохлоридная соль метил 3-азабицикло[3.3.0]-окт-6-ен-7-карбоксилата:
К раствору метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]-окт-6-ен-7-карбоксилата (0,095 г, 0,36,ммоль) в этилацетате (2 мл) добавляют 4 M раствор хлороводородной кислоты в 1,4-диоксане (2,0 мл), реакционную смесь перемешивают при температуре окружающей среды в течение 2 час. Добавляют эфир (20 мл), полученный твердый продукт собирают с помощью фильтрования и сушат в вакууме, с получением 0,055 (выход 77%) метил 3-азабицикло[3.3.0]окт-6-ен-7-карбоксилата гидрохлорида в виде белого твердого продукта (1H ЯМР (CD3OD, 300 МГц): δ 6,59 (ушир.с, 1H), 3,80-3,74 (м, 1H), 3,74 (с, 3H), 3,52-3,40 (м, 2H), 3,38-3,30 (м, 1H), 3,24-3,18 (м, 1H), 3,12-3,04 (м, 1H), 3,00-2,88 (м, 1H), 2,61-2,50 (м, 1H); МС (m/z): 168 (М+1)).
Это вещество демонстрирует значения Ki для α4β2 крыс и человека 5 нМ и 2 нМ, соответственно и не проходит HTS для α7.
3-(трет-Бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоновая кислота:
К раствору метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]-окт-6-ен-7-карбоксилата (0,350 г, 1,31 ммоль) в ТГФ-метаноле (6,0 мл, 1:1) добавляют раствор гидроксида лития (0,100 г в 1 мл воды, 3,94 ммоль) и реакционную смесь перемешивают при температуре окружающей среды в течение 3 час. Растворитель выпаривают, остаток подкисляют до pH 4 1M водным раствором хлороводородной кислоты и экстрагируют этилацетатом (50 мл). Органический слой промывают водой (50 мл) и насыщенным раствором соли (50 мл), сушат (безводный сульфат натрия) и концентрируют, с получением 0,31 г (выход 92%) 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]-окт-6-ен-7-карбоновой кислоты в виде белого твердого продукта (1H ЯМР (CDCl3, 300 МГц): δ 6,76 (ушир.с, 1H), 3,76-3,62 (м, 1H), 3,58-3,42 (м, 2H), 3,11-2,94 (м, 2H), 2,84-2,67 (м, 1H), 2,46-2,23 (м, 1H), 1,42 (с, 9H). МС (m/z): 254 (М+1), 198 (М+1-56)).
N-Метокси-N-метил-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамид трифторацетат:
К раствору 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоновой кислоты (0,080 г, 0,32 ммоль) в дихлорметане (3,0 мл) добавляют оксалилхлорид (0,20 г, 1,6 ммоль), а затем каплю ДМФ. После перемешивания в течение 1 час, реакционную смесь концентрируют в вакууме и оставшийся хлорангидрид растворяют в ацетонитриле (3,0 мл). Добавляют DIPEA (0,17 мл, 0,96 ммоль) и N,O-диметилгидроксиламин гидрохлорид (0,042 г, 0,43 ммоль) и реакционную смесь перемешивают при температуре окружающей среды в течение 1 час. Растворитель выпаривают и остаток очищают с помощью колоночной хроматографии на силикагеле, элюируя 80-90% этилацетатом в гексане, с получением 0,078 г (выход 82%) N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамида в виде масла. Его растворяют в дихлорметане (3,0 мл), обрабатывают TFA (2,0 мл) и перемешивают при температуре окружающей среды в течение 1 час. Летучие продукты выпаривают и остаток сушат в вакууме, с получением 0,07 г N-метокси-N-метил-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамид трифторацетата в виде масла (1H ЯМР (CD3OD, 300 МГц): δ 6,29 (ушир.с, 1H), 3,80-3,89 (м, 1H), 3,88 (с, 3H), 3,54-3,41 (м, 2H), 3,38-3,30 (м, 1H), 3,26 (с, 3H), 3,22-3,03 (м, 3H), 2,66-2,59 (м, 1H); МС (m/z): 197 (М+1)).
Некоторые другие амидные производные 3-азабицикло[3.3.0]окт-6-ен-7-карбоновой кислоты получают с использованием упомянутых выше процедур. Таблица 5 перечисляет некоторые из этих производных.
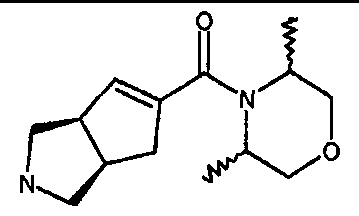

2-Фуранил(3-азабицикло[3.3.0]окт-6-ен-7-ил)метанон трифторацетат:
К раствору 2-бромфурана (0,11 г, 0,74 ммоль) в ТГФ (3 мл) при -78°C добавляют раствор н-BuLi (2,5 M раствор в гексане, 0,30 мл, 0,75 ммоль) и смесь перемешивают в течение 1 час. Добавляют раствор N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамида (0,20 г, 0,65 ммоль) в ТГФ (2 мл) и смесь нагревают до температуры окружающей среды в течение 8 час. Реакцию гасят водой (0,2 мл), разбавляют этилацетатом (20 мл), сушат над безводным сульфатом натрия и концентрируют с помощью роторного испарителя. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, с получением 0,10 г 2-фуранил(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-ил)метанона и 0,06 г извлеченного исходного материала. Образец 2-фуранил(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.0]окт-6-ен-7-ил)метанона (0,050 г, 0,16 ммоль) растворяют в дихлорметане (3 мл), обрабатывают TFA (2,0 мл) и перемешивают при температуре окружающей среды в течение 1 час. Летучие продукты выпаривают и продукт сушат в вакууме, с получением 0,047 г 2-фуранил(3-азабицикло[3.3.0]окт-6-ен-7-ил)метанона трифторацетата (1H ЯМР (CD3OD, 300 МГц): δ 7,81-7,80 (м, 1H), 7,38-7,36 (м, 1H), 6,91-6,88 (м, 1H), 6,65 (дд, J=3,66, 1,71 Гц), 3,95-3,86 (м, 1H), 3,56-3,40 (м, 3H), 3,27-3,16 (м, 1H), 3,14-3,02 (м, 2H), 2,77-2,68 (м, 1H); МС (m/z): 204 (М+1)).
Это вещество демонстрирует значения Ki для α4β2 крысы и человека 8 нМ и 2 нМ соответственно и не проходит HTS для α7.
Пример 11
Синтез 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоновой кислоты
Ключевое промежуточное соединение, 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоновую кислоту, синтезируют с использованием следующих процедур, адаптированных из Speckamp et al., Tetrahedron 27:3143-56 (1971). Этот источник включается сюда в виде ссылки по отношению к такой концепции синтеза.
Метил 3-(трет-бутоксикарбонил)-9-оксо-3-азабицикло[3.3.1]нонан-7-карбоксилат:
К раствору трет-бутил 4-оксопиперидин-1-карбоксилата (15,2 г, 76,3 ммоль) в бензоле (200 мл) добавляют пирролидин (13,9 г, 195 ммоль). Полученный раствор нагревают с обратным холодильником с ловушкой Дина-Старка в течение 16 час. После удаления растворителя с помощью роторного испарителя, остаток сушат в высоком вакууме и повторно растворяют в безводном ацетонитриле (200 мл). Этот раствор объединяют с триэтиламином (17,3 г, 170 ммоль) и поддерживают, нагревая с обратным холодильником, когда добавляют по каплям метил 3-бром-2-(бромметил)пропаноат (20 г, 77 ммоль). Реакционную смесь дополнительно нагревают с обратным холодильником в течение 4 час, охлаждают до температуры окружающей среды, разбавляют водой (200 мл) и перемешивают при температуре окружающей среды в течение 16 час. Летучие растворители удаляют с помощью роторного испарителя и остаток распределяют между хлороформом и водой (по 200 мл каждого). Водный слой экстрагируют хлороформом (2×100 мл). Объединенные органические экстракты сушат над безводным сульфатом натрия и концентрируют с помощью роторного испарителя. Остаток очищают с помощью флэш-хроматографии, с использованием этилацетата в градиенте гексана, с получением 15,8 г (69,8% выход) метил 3-(трет-бутоксикарбонил)-9-оксо-3-азабицикло[3.3.1]нонан-7-карбоксилата в виде бесцветного сиропа (1H ЯМР (CDCl3): δ 4,43-4,2 (м, 2H), 3,7 (с, 3H), 3,12-3,0 (м, 2H), 2,55-2,43 (м, 2H), 2,41-2,35 (м, 4H), 1,52 (с, 9H); ЖХ-МС (MH+): 298).
Метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоксилат:
К раствору метил 3-(трет-бутоксикарбонил)-9-оксо-3-азабицикло[3.3.1]нонан-7-карбоксилата (14,76 г, 49,63 ммоль) в безводном ТГФ (250 мл) добавляют тозилгидразин (11,1 г, 59,6 ммоль) и смесь перемешивают в течение 2 час при температуре окружающей среды. Реакционную смесь нагревают до 65°C, добавляют цианоборгидрид натрия (12,5 г, 198 ммоль) и смесь перемешивают в течение 16 час при 65°C. Реакционную смесь охлаждают до температуры окружающей среды и концентрируют с помощью роторного испарителя. Остаток очищают с помощью флэш-хроматографии на силикагеле, с использованием этилацетата в градиенте гексана, с получением 8,71 г (выход 61,9%) метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоксилата в виде бесцветного твердого продукта (1H ЯМР (CDCl3): δ 3,97-3,8 (м, 2H), 3,65 (с, 3H), 2,85-2,75 (м, 2H), 2,57-2,47 (м, 1H), 2,38-2,20 (м, 2H), 2,0-1,7 (м, 4H), 1,68-1,60 (м, 1H), 1,52-1,41 (м, 1H), 1,41 (с, 9H); ЖХ-МС (MH+): 284).
3-(трет-Бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоновая кислота:
Метил 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоксилат (1,62 г, 5,72 ммоль) растворяют в смеси ТГФ/вода/метанол 2:1:2 (25 мл) и добавляют литий гидроксид моногидрат (0,721 г, 17,2 ммоль). Реакционную смесь перемешивают при 30°C в течение 16 час. Летучие растворители удаляют с помощью роторного испарителя и остаток подкисляют 2 н. хлороводородной кислотой и экстрагируют этилацетатом (2×50 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют в вакууме, с получением 1,53 г (выход сырого продукта 100%) 3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоновой кислоты в виде бесцветного твердого продукта (1H ЯМР (CDCl3): δ 3,95-3,8 (м, 2H), 2,85-2,75 (м, 2H), 2,60-2,47 (м, 1H), 2,20-2,12 (м, 2H), 2,0-1,85 (м, 4H), 1,60-1,70 (м, 2H), 1,41 (с, 9H); (ЖХ-МС (MH+): 270).
Пример 12
Амидные производные 3-азабицикло[3.3.1]нонан-7-карбоновой кислоты
Определенные производные амида 3-азабицикло[3.3.1]нонан-7-карбоновой кислоты могут быть получены с помощью хлорангидрида. Следующая далее процедура является иллюстративной.
N-Метил-3-азабицикло[3.3.1]нонан-7-карбоксамид трифторацетат:
3-(трет-Бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоновую кислоту (0,10 г, 0,37 ммоль) растворяют в безводном дихлорметане (3 мл) и обрабатывают оксалилхлоридом (0,23 г, 1,9 ммоль). После перемешивания реакционной смеси в течение 1 часа при температуре окружающей среды, реакционную смесь концентрируют при пониженном давлении и остаток сушат в высоком вакууме. Остаток растворяют в безводном ТГФ (5 мл), раствор обрабатывают 0,92 мл метиламина (2M раствор в ТГФ) и перемешивают в течение 3 часов. Реакционную смесь концентрируют в вакууме и остаток очищают с помощью ВЭЖХ, с получением 24 мг бесцветного сиропа. Его растворяют в смеси безводного дихлорметана и TFA (1 мл) 1:1. После перемешивания в течение 1 часа при температуре окружающей среды, реакционную смесь концентрируют и остаток сушат в высоком вакууме, с получением 23 мг (общий выход 20%) N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамида трифторацетата в виде бесцветного сиропа (1H ЯМР (CD3OD): δ 3,26-3,08 (м, 4H), 2,84-2,78 (м, 1H), 2,95 (с, 3H), 2,34-2,18 (м, 4H), 1,85-1,60 (м, 4H); ЖХ-MC (MH+): 182,9). Это вещество демонстрирует значения Ki для α4β2 крысы и человека 6 нМ и 2 нМ соответственно и значение Ki для α7 >10000 нМ. Процедуры, сходные с указанными выше, используют для получения разнообразных амидных производных, включая соединения в таблице 6.
m/z (M+H)
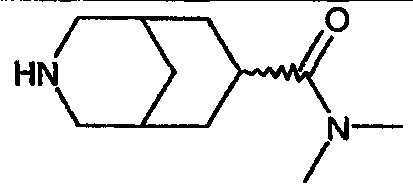
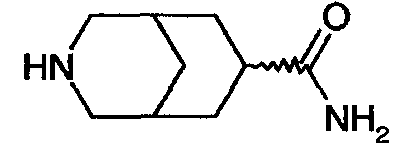
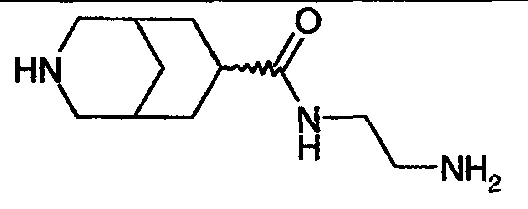
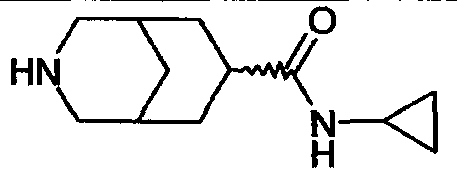
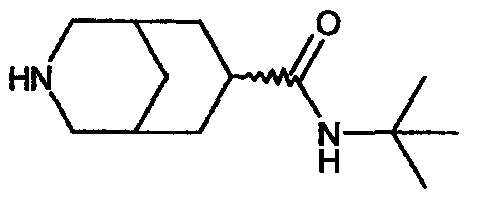
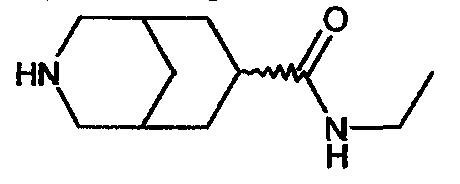
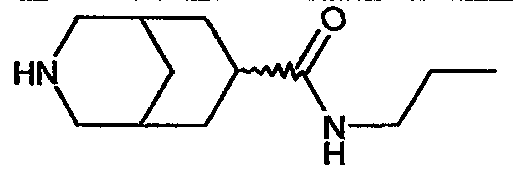

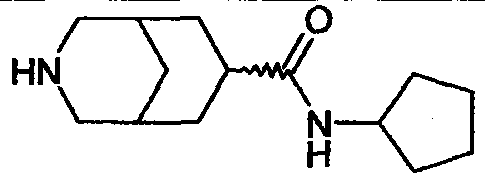
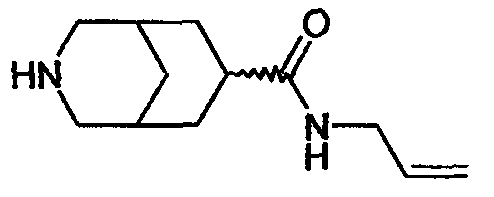

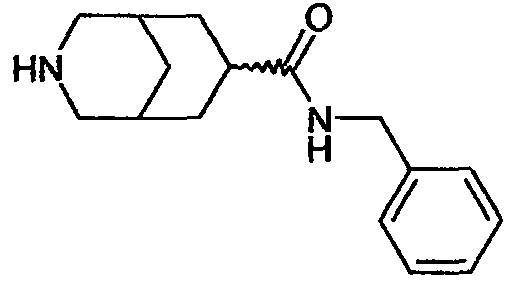
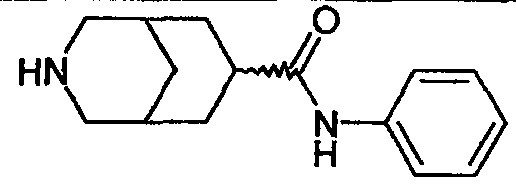
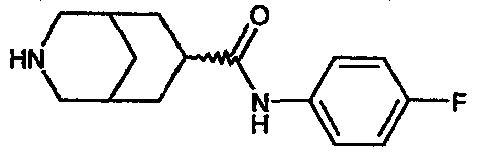
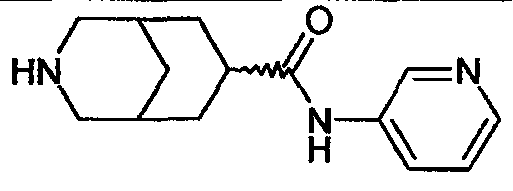
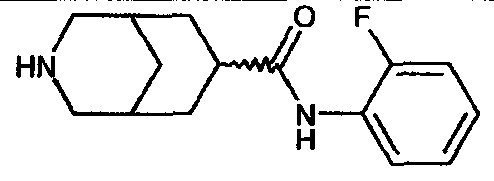

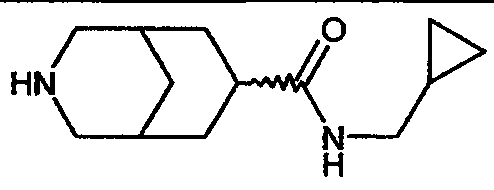



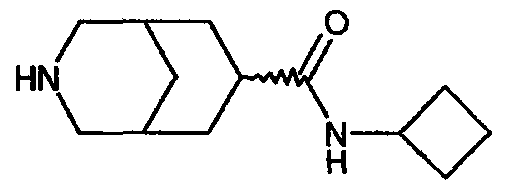

Пример 13
Кетоновые производные 3-азабицикло[3.3.1]нонан-7-карбоновой кислоты
Определенные ацильные (кетоновые) производные 3-азабицикло[3.3.1]нонан-7-карбоновой кислоты могут быть получены посредством реакции N-метокси-N-метил-3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоксамида с реагентами на основе арил- и алкиллития. Следующая далее процедура является иллюстративной.
2-Фуранил(3-азабицикло[3.3.1]нон-7-ил)метанон трифторацетат:
К суспензии N,O-диметилгидроксиламина гидрохлорида (0,068 г, 0,70 ммоль) в безводном ТГФ (3 мл) добавляют триметилалюминий (2,0 M раствор в толуоле, 0,35 мл, 0,70 ммоль) при -10°C. После перемешивания в течение 10 мин при -10°C, добавляют раствор метил (3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нонан-7-карбоксилата (0,100 г, 0,353 ммоль) в ТГФ (1 мл). Реакционную смесь нагревают до температуры окружающей среды и перемешивают в течение 1 часа. Затем реакционную смесь охлаждают до -70°C и обрабатывают свежеприготовленным раствором 2-фураниллития в ТГФ (5 мл) (Примечание: 2-фураниллитий приготавливают посредством обработки фурана (0,24 г, 3,5 ммоль) н-BuLi (2,5 M раствор в ТГФ, 1,4 мл, 3,5 ммоль) при -78°C). Реакционную смесь нагревают до температуры окружающей среды в течение 1 часа и гасят насыщенным водным раствором хлорида аммония (5 мл). Летучие продукты удаляют в вакууме и остаток перетирают с этилацетатом (2×10 мл). Объединенные органические экстракты сушат над безводным сульфатом натрия, концентрируют при пониженном давлении и очищают с помощью ВЭЖХ, с получением 2-фуранил(3-(трет-бутоксикарбонил)-3-азабицикло[3.3.1]нон-7-ил)метанона (0,018 г, выход 16%). Часть этого вещества (4,5 мг, 14 мкмоль) растворяют в смеси безводного дихлорметана и TFA 1:1. После перемешивания в течение 1 часа при температуре окружающей среды, летучие продукты выпаривают и полученный остаток сушат в высоком вакууме, с получением 3,2 мг (выход 68%) 2-фуранил(3-азабицикло[3.3.1]нон-7-ил)метанон трифторацетата в виде бледно-желтого масла. (1H ЯМР (CD3OD): δ 7,68 (с, 1H), 6,75 (д, J=2,68 Гц, 1H), 6,58 (м, 1H), 4,16-4,11 (м, 1H), 3,52-3,14 (м, 3H), 2,64-2,57 (м, 1H), 2,25-1,87 (м, 8H) (ЖХ/МС (MH+): 220).
Процедуры, сходные с указанными выше, используют для получения разнообразных ацильных (кетоновых) производных, включая соединения в таблице 7.


Пример 14
Обобщенные результаты для связывания рецепторов
Соединения таблиц 1-7, репрезентативные для настоящего изобретения, демонстрируют константы ингибирования (значения Ki) для подтипа α4β2 (крысы или человека или для обоих) в диапазоне от 1 нМ до 2000 нМ. Самая большая часть этих соединений демонстрирует значения Ki для подтипа α4β2 (крысы или человека, или для обоих) меньше чем 500 нМ, и многие демонстрируют значения Ki меньше чем 100 нМ. Соединения в таблицах 1-7 часто не могут удовлетворить критериям высокопроизводительного скрининга (HTS) для генерирования значений Ki для подтипа α7. В тех случаях, где критерии HTS для подтипа α7 удовлетворяются, значения Ki, определенные впоследствии для подтипа α7, больше чем 10 мкМ (>10000 нМ). Как правило, эти же самые соединения демонстрируют относительно малую функциональную активность либо для мышечных подтипов человека, либо для ганглионарных подтипов человека, за исключением соединений в таблице 5. Однако даже ненасыщенные аналоги являются, как правило, более сильнодействующими для подтипа α4β2, чем для мышечных или ганглионарных подтипов.
Примечание "HTS осуществить не удалось", как здесь используется для связывания подтипа α7, означает, что соединение не может ингибировать при концентрации 5 мкМ связывание 5 нМ 3H-MLA (метилликаконитина), по меньшей мере, на 50%.
Определенные иллюстрируемые соединения оцениваются для исследования NOR (распознавания новых объектов). Оно иллюстрирует эффективность и сильнодействие соединений по настоящему изобретению при лечении дефицита когнитивной способности, расстройств внимания и деменций и принципиальную возможность применения этих соединений для терапии человека.
Фиг.1 показывает, что соединение A, метил 3-азабицикло[3.3.0]октан-7-карбоксилат, является активным при исследовании NOR (перорально, для крыс) при дозе 0,1 мг/кг. Результаты показаны как функция коэффициента распознавания (%) в зависимости от дозы (мг/кг).
Фиг.2 показывает, что соединение B, N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамид, является активным при исследовании NOR (перорально, для крыс) при дозе 1 мг/кг. Результаты показаны как функция коэффициента распознавания (%) в зависимости от дозы (мг/кг).
Исследуемые соединения используют в свободной или солевой форме.
Конкретные наблюдаемые фармакологические реакции могут изменяться в соответствии с конкретным выбранным активным соединением и в зависимости от него или от того, присутствуют ли фармацевтические носители, а также от типа препарата и используемого режима введения, и такие ожидаемые вариации или различия в результатах предполагаются в соответствии с осуществлением настоящего изобретения.
Хотя здесь иллюстрируются и описываются подробно конкретные варианты осуществления настоящего изобретения, настоящее изобретение не ограничивается ими. Приведенные выше подробные описания предусматриваются как иллюстрации настоящего изобретения и не должны рассматриваться как представляющие собой какое-либо ограничение настоящего изобретения. Модификации будут очевидны специалистам в данной области, и все модификации, которые не отклоняются от духа настоящего изобретения, как предполагается, включаются в рамки прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИДЫ ДИАЗАБИЦИКЛОАЛКАНОВ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ АЦЕТИЛХОЛИНОВОГО ПОДТИПА НИКОТИНОВЫХ РЕЦЕПТОРОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 2007 |
|
RU2448969C2 |
| АМИДЫ ДИАЗАБИЦИКЛОАЛКАНОВ, СЕЛЕКТИВНЫЕ В ОТНОШЕНИИ АЦЕТИЛХОЛИНОВОГО ПОДТИПА НИКОТИНОВЫХ РЕЦЕПТОРОВ | 2007 |
|
RU2517693C2 |
| ОКСАДИАЗОЛЫ В КАЧЕСТВЕ АГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 И/ИЛИ M4 | 2019 |
|
RU2817018C2 |
| 2-АМИНОБЕНЗОКСАЗОЛКАРБОКСАМИДЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-НТ3 | 2007 |
|
RU2448105C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2531588C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2018 |
|
RU2767857C2 |
| СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2006 |
|
RU2446171C2 |
| ЛЕЧЕНИЕ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2017 |
|
RU2765868C2 |
| КОНДЕНСИРОВАННОЕ ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ АМИНОПИРРОЛИДИНА | 2007 |
|
RU2443698C2 |
| АМИДЫ КОНДЕНСИРОВАННОГО ПИПЕРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ ИОННЫХ КАНАЛОВ | 2014 |
|
RU2741810C2 |
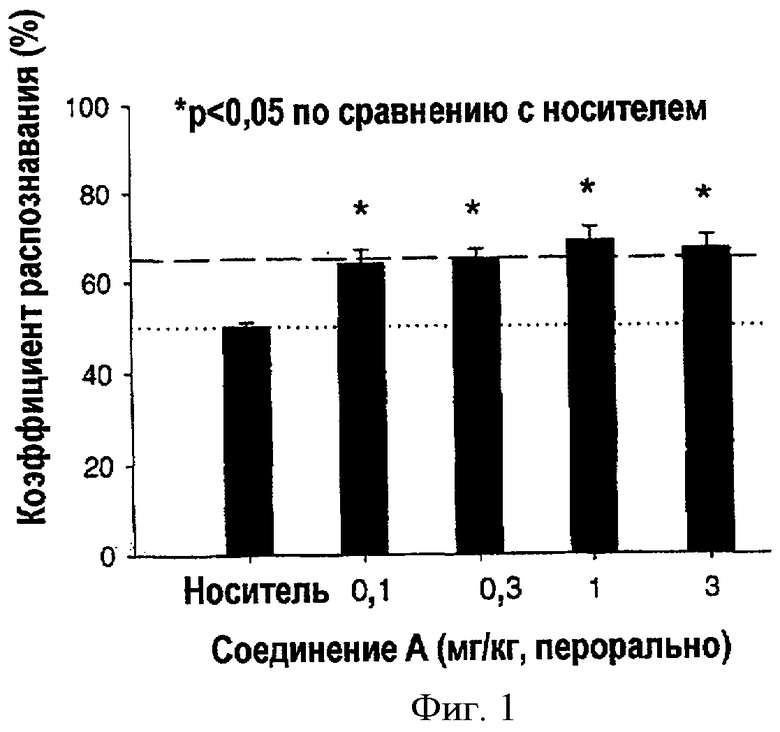

Изобретение относится к новым соединениям, представляющим собой метил 3-азабицикло[3.3.0]октан-7-карбоксилат, N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамид, N-пропил-3-азабицикло[3.3.1]нонан-7-карбоксамид, или к их фармацевтически приемлемым солям. Изобретение также относится к соединениям, выбранным из группы, к фармацевтической композиции, к способам лечения или предотвращения расстройств центральной нервной системы, а также к применению соединения по любому из пп.1-4. Технический результат - получение новых биологически активных соединений, обладающих активностью в отношении нейронных никотиновых ацетилхолиновых рецепторов. 8 н. и 3 з.п. формулы, 7 табл., 2 ил.
1. Соединение, выбранное из:
1-(3-азабицикло[3.3.0]окт-7-ил)-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-фтор-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-бром-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-метокси-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-изопропокси-1-этанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-1-пропанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-1-бутанона,
транс-1-(3-азабицикло[3.3.0]окт-7-ил)-2-бутен-1-она,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-метил-1-пропанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2,2-диметил-1-пропанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-1-пентанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-2-метил-1-бутанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-3-метил-1-бутанона,
1-(3-азабицикло[3.3.0]окт-7-ил)-3,3-диметил-1-бутанона,
циклопропил(3-азабицикло[3.3.0]окт-7-ил)метанона,
циклобутил(3-азабицикло[3.3.0]окт-7-ил)метанона,
циклопентил(3-азабицикло[3.3.0]окт-7-ил)метанона,
циклогексил(3-азабицикло[3.3.0]окт-7-ил)метанона,
тетрагидропиран-4-ил(3-азабицикло [3.3.0]окт-7-ил)метанона,
4-фторфенил(3-азабицикло[3.3.0]окт-7-ил)метанона,
фуран-2-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
фуран-2-ил(3-азабицикло[3.3.0]окт-6-ен-7-ил)метанона,
3-бромфуран-2-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
3-цианофуран-2-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
5-метил-2-фуранил(3-азабицикло[3.3.0]окт-7-ил)метанона,
пиридин-4-ил(3-азабицикло[3.3.0]окт-7-ил)метанона,
(2-(гидроксиметил)-1-пирролидинил)(3-азабицикло[3.3.0]окт-7-ил)метанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-фтор-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-бром-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-метокси-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-изопропокси-1-этанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-пропанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-бутанона,
транс-1-(3-азабицикло[3.3.1]нон-7-ил)-2-бутен-1-она,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-метил-1-пропанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2,2-диметил-1-пропанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-1-пентанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-2-метил-1-бутанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-3-метил-1-бутанона,
1-(3-азабицикло[3.3.1]нон-7-ил)-3,3-диметил-1-бутанона,
циклопропил(3-азабицикло[3.3.1]нон-7-ил)метанона,
циклобутил(3-азабицикло[3.3.1]нон-7-ил)метанона,
циклопентил(3-азабицикло[3.3.1]нон-7-ил)метанона,
циклогексил(3-азабицикло[3.3.1]нон-7-ил)метанона,
тетрагидропиран-4-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
4-фторфенил(3-азабицикло[3.3.1]нон-7-ил)метанона,
фуран-2-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
3-бромфуран-2-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
3-цианофуран-2-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
5-метил-2-фуранил(3-азабицикло[3.3.1]нон-7-ил)метанона,
пиридин-4-ил(3-азабицикло[3.3.1]нон-7-ил)метанона,
метил 3-азабицикло[3.3.0]октан-7-карбоксилата,
метил 3-азабицикло[3.3.0]окт-6-ен-7-карбоксилата,
этил 3-азабицикло[3.3.0]октан-7-карбоксилата,
изопропил 3-азабицикло[3.3.0]октан-7-карбоксилата,
2,2-диметилпропил 3-азабицикло[3.3.0]октан-7-карбоксилата,
2-фторэтил 3-азабицикло[3.3.0]октан-7-карбоксилата,
1-фторпроп-2-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклопропилметил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклобутил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклопентил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклогексил 3-азабицикло[3.3.0]октан-7-карбоксилата,
пент-4-ен-2-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
пент-4-ин-2-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
циклопент-3-ен-1-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
(тетрагидрофуран-3-ил)метил 3-азабицикло[3.3,0]октан-7-карбоксилата,
тетрагидрофуран-3-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
тетрагидропиран-4-ил 3-азабицикло[3.3.0]октан-7-карбоксилата,
(фуран-3-ил)метил 3-азабицикло[3.3.0]октан-7-карбоксилата,
бензил 3-азабицикло[3.3.0]октан-7-карбоксилата,
3-азабицикло[3.3.0]октан-7-карбоксамида,
N-аллил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(2-фуранилметил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-метил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-этил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(2-метоксиэтил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N,N-диметил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N,N-диметил-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамида,
N-изопропил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-циклопропил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-циклобутил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-циклопентил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-метил-N-метокси-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-метил-N-метокси-3-азабицикло[3.3.0]окт-6-ен-7-карбоксамида,
N-метил-N-пропаргил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-фенил-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(4-фторфенил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-(пиридин-3-ил)-3-азабицикло[3.3.0]октан-7-карбоксамида,
N-бензил-3-азабицикло[3.3.0]октан-7-карбоксамида,
(3-азабицикло[3.3.0]окт-7-ил)(2,3,6-тригидро-пиридин-1-ил)метанона,
(3-азабицикло[3.3.0]окт-7-ил)(2,6-метилморфолин-1-ил)метанона,
(3-азабицикло[3.3.0]окт-6-ен-7-ил)(2,6-диметилморфолин-1-ил)метанона,
(3-азабицикло[3.3.0]окт-7-ил)(1-оксазинан-2-ил)метанона,
3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-этил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-метоксиэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N,N-диметил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-изопропил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-циклопропил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-циклобутил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-циклопентил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-метил-N-метокси-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-метил-N-пропаргил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-фенил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(4-фторфенил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(пиридин-3-ил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-бензил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-аминоэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-трет-бутил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-пропил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-аллил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-фторфенил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-втор-бутил-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(циклопропилметил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2-фторэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(2,2,2-трифторэтил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(3-фторпропил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
N-(3-циклопентенил)-3-азабицикло[3.3.1]нонан-7-карбоксамида,
(3-азабицикло[3.3.1]нон-7-ил)(2,3,6-тригидро-пиридин-1-ил)метанона,
(3-азабицикло[3.3.1]нон-7-ил)(2,6-метил-морфолин-1-ил)метанона,
(3-азабицикло[3.3.1]нон-7-ил)(1-оксазинан-2-ил)метанона,
4-морфолинил(3-азабицикло[3.3.1]нон-7-ил)метанона,
или его фармацевтически приемлемая соль.
2. Соединение, представляющее собой метил 3-азабицикло[3.3.0]октан-7-карбоксилат, в виде фармацевтически приемлемой соли.
3. Соединение, представляющее собой N-метил-3-азабицикло[3.3.1]нонан-7-карбоксамид, или его фармацевтически приемлемая соль.
4. Соединение, представляющее собой N-пропил-3-азабицикло[3.3.1]нонан-7-карбоксамид, или его фармацевтически приемлемая соль.
5. Фармацевтическая композиция, обладающая активностью в отношении нейронных никотиновых ацетилхолиновых рецепторов, содержащая соединение по любому из пп.1-4 и один или несколько фармацевтически приемлемых разбавителей, наполнителей или инертных носителей.
6. Фармацевтическая композиция по п.5 для лечения или предотвращения расстройств центральной нервной системы.
7. Способ лечения или предотвращения расстройств центральной нервной системы, включающий введение соединения по любому из пп.1-4.
8. Способ лечения или предотвращения расстройств центральной нервной системы, включающий введение соли соединения по любому из пп.1-4.
9. Способ по п.7 или 8, в котором расстройство выбирают из группы, состоящей из возрастного ослабления памяти, легкого ослабления когнитивной функции, предстарческой деменции, ранней болезни Альцгеймера, старческой деменции, деменции типа Альцгеймера, деменции с тельцами Леви, сосудистой деменции, болезни Альцгеймера, инсульта, комплекса слабоумия при СПИДе, расстройства дефицита внимания, расстройства дефицита внимания с гиперактивностью, дислексии, шизофрении, дефицита когнитивной функции при шизофрении, когнитивной дисфункции при шизофрении, шизофреноформного расстройства и шизоаффективного расстройства.
10. Способ по п.9, в котором расстройство выбирают из группы, состоящей из деменции типа Альцгеймера от легкой до средней степени, расстройства дефицита внимания, легкого ослабления когнитивной функции и возрастного ослабления памяти.
11. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения расстройств центральной нервной системы.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ПРОИЗВОДНЫЕ N-ЗАМЕЩЕННЫХ 3-АЗАБИЦИКЛО [3.2.0]ГЕПТАНОВ И ИХ СОЛИ С ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫМИ КИСЛОТАМИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2163604C2 |
Авторы
Даты
2011-05-10—Публикация
2008-03-27—Подача