Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-аминокислоты, принадлежащей к семейству глутамата, с использованием бактерии семейства Enterobacteriaceae, модифицированной таким образом, что активность глутаминсинтетазы в указанной бактерии увеличена.
Описание предшествующего уровня техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов. Обычно микроорганизмы модифицируют для увеличения продукции L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, включая трансформацию микроорганизмов рекомбинантной ДНК (см., например, патент США 4278765). Другие методы увеличения продукции включают повышение активности ферментов, вовлеченных в биосинтез аминокислот, и/или уменьшение чувствительности целевого фермента к ингибированию по типу обратной связи продуцируемой L-аминокислотой (см., например, международную заявку WO 95/16042 или патенты США 4346170; 5661012 и 6040160).
Превращение глутамата в глутамин с участием глутаминсинтетазы (GS-glutamine synthetase) приводит к образованию донора азота для первой стадии биосинтеза многих аминокислот, пуринов, пиримидинов и аминосахаров. Исследовано превращение β-глутамата в β-глутамин архебактериальной и бактериальной глутаминсинтетазами. GS Methanohalophilus portucalensis (часитично очищенная) способна катализировать амидирование этого субстрата со скоростью, в 7 раз более низкой, чем скорость, полученная для α-глутамата. Рекомбинантная GS из архебактерий Methanococcus jannaschii и Archaeoglobus fulgidus была значительно более избирательна к α-глутамату, чем к β-глутамату в качестве субстрата. Все архебактериальные ферменты были намного менее селективны, чем две бактериальных GS (из Escherichia coli и Bacillus subtilis), специфическая активность которых по отношению к β-глутамату была значительно меньше, чем по отношению к α-изомеру (Robinson P. et al., Applied and Environmental Microbiology; 67(10), 4458-63(2001)).
Кинетику изменения интенсивности флуоресценции белка, связанной с реакциями неаденилированной глутаминсинтетазы Е.coli [L-глутамат: аммонийлигаза (АДФ-образующая), ЕС 6.3.1.2] с ее субстратами, изучали с использованием метода быстрой реакции. Было установлено, что синтез глутамина осуществляется поэтапно. В процессе катализа наблюдали два флуориметрически различимых промежуточных продукта (Rhee S.G. and Chock Р.В., Proc. Natl. Acad. Sci. USA; 73(2):476-80(1976)).
Разработаны два метода, позволяющие провести очень быструю очистку глутаминсинтетазы из разнообразных бактерий. Первый метод, основанный на дифференциальном осаждении, зависит от связи GS с ДНК в клеточных экстрактах. Второй метод, основанный на методе С.Gross et al. (J. Bacteriol. 128:382-389, 1976) для очистки РНК-полимеразы путем ПЭГ(полиэтиленгликоль) осаждения, позволил получить большой выход GS как из малого, так и большого количества клеток. ПЭГ-методику использовали для очистки GS из Klebsiella aerogenes, K. pneumoniae, Е.coli, Salmonella typhimurium, Rhizobium sp. штамм 32H1, R. meliloti, Azotobacter vinelandii, Pseudomonas putida, Caulobacter crescentus и Rhodopseudomonas capsulate (Streicher S.L. and Tyler В., J. Bacteriol.; 142(1):69-78(1980)).
Продемонстрировано, что неаденилированная Mn-форма глутаминсинтетазы из Е.coli катализирует ранее не известный АМФ-зависимый (обратимый) синтез пирофосфата и L-глутамата из ортофосфата и L-глутамина (Whitley E.J. Jr. and Ginsburg A., J Biol Chem.; 255(22):10663-70(1980)).
Глутаминсинтетазу E.coli инактивировали с использованием неферментной окислительной системы со смешанными функциями, состоящей из аскорбата, O2 и Fe(III). Частичная инактивация GS этой системой приводит к образованию гибридных молекул GS (додекамеров), состоящих из активных и неактивных субъединиц. Взаимодействия субъединиц в таких гибридных молекулах слабее, чем в нативном ферменте. Взаимодействия гетерологичных субъединиц в таких гибридных молекулах не влияют на сродство активных субъединиц к глутамату (Nakamura K., Stadtman E.R., Proc. Natl. Acad. Sci. USA; 81(7):2011-5(1984)).
Регуляция глутаминсинтетазы в Е.coli путем обратимых циклов является прототипом сигнальной трансдукции каскадом ферментов. Известно, что такие каскады ферментов демонстрируют ультрачувствительный ответ на первичные стимулы и действуют как системы сигнальной интеграции. Продемонстрировано, что аденилирование GS глутамином в качестве сигнала не чувствительно к общим концентрациям GS, уридилилтрансферазы/ уридилилпереносящего фермента, регуляторного белка PII и аденилилтрансферазы/ аденилил-переносящего фермента. Такой сильный ответ аденилирования GS также наблюдали при изменениях в параметрах системы. Многочисленные анализы показали, что сильный сверхчувствительный ответ бициклического каскада связан с аллостерическими взаимодействиями глутамина и 2-кетоглутарата, бифункциональностью конвертерных ферментов и закрытостью бициклической каскадной структуры. По результатам количественного определения уровня системы GS бициклического каскада было сделано заключение о том, что такой сильный ответ может помогать клетке в адаптации к различным условиям с обеспечением углеродом и азотом (Mutalik V.K. et al., J. Biol. Chem.; 278(29):26327-32(2003)).
После цикла замораживания-оттаивания с последующей обработкой клеток Е.coli неионным детергентом, Lubrol WX, клетки становятся проницаемыми для небольших молекул, но не для цитозольных белков. Суспензии ставших проницаемыми после такой обработки клеток могут быть непосредственно проанализированы стандартными методами как по внутриклеточным уровням глутаминсинтетазы, так и по состоянию аденилирования. Было продемонстрировано, что клетки, обработанные Lubrol, можно использовать для исследования регуляции аденилирования глутаминсинтетазы in situ (Mura U., Stadtman E.R., J. Biol. Chem.; 256(24):13014-21(1981)).
Внутриклеточная протеолитическая деградация глутаминсинтетазы в E.coli имеет место на двух различных стадиях. На первой стадии окислительная система со смешанными функциями модифицирует глутаминсинтетазу. Модифицированный фермент, каталитически неактивный, становится чувствительным к протеолизу. На второй стадии протеаза, специфичная к модифицированному ферменту, катализирует реальную протеолитическую деградацию (Levine R.L., J. Biol. Chem.; 258(19):11823-7(1983)).
Раскрыт способ получения L-глутамина путем культивирования коринеформной бактерии, способной к продукции L-глутамина и модифицированной таким образом, что внутриклеточная активность глутаминсинтетазы в модифицированной бактерии увеличена, предпочтительно далее модифицированной таким образом, что внутриклеточная активность глутаматдегидрогеназы в модифицированной бактерии увеличена, в питательной среде для синтеза и накапливания L-глутамина в культуральной жидкости и выделения L-глутамина (ЕР 1229121 А2).
В настоящее время нет сообщений, описывающих использование увеличения активности глутаминсинтетазы для увеличения продукции L-аминокислоты, принадлежащей к семейству глутамата.
Описание изобретения
Цели настоящего изобретения включают повышение продуктивности штаммов-продуцентов L-аминокислоты, принадлежащей к семейству глутамата, и предоставление способа получения L-аминокислоты, принадлежащей к семейству глутамата, с использованием этих штаммов.
Вышеуказанные цели были достигнуты благодаря обнаружению того факта, что увеличение активности глутаминсинтетазы может вести к увеличению продукции L-аминокислот, принадлежащих к семейству глутамата, таких как L-глутамин, L-пролин, L-аргинин, орнитин и цитруллин.
Настоящее изобретение предоставляет бактерию семейства Enterobacteriaceae, обладающую способностью к повышенной продукции аминокислот, принадлежащих к семейству глутамата, таких как L-глутамин, L-пролин, L-аргинин, орнитин и цитруллин.
Целью настоящего изобретения является предоставление принадлежащей к семейству Enterobacteriaceae бактерии-продуцента L-аминокислоты, принадлежащей к семейству глутамата, модифицированной таким образом, что активность глутаминсинтетазы в указанной бактерии увеличена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой указанная активность увеличена за счет усиления экспрессии гена glnA.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой экспрессия указанного гена glnA усилена за счет увеличения числа копий гена или модификации последовательности, контролирующей экспрессию гена, в результате которой экспрессия гена усиливается.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная бактерия принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная бактерия принадлежит к роду Pantoea.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная L-аминокислота, принадлежащая к семейству глутамата, выбрана из группы, состоящей из L-глутамина, L-пролина, L-аргинина, орнитина и цитруллина.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, принадлежащей к семейству глутамата, L-треонина или L-валина, включающего:
- выращивание описанной выше бактерии в питательной среде,
- выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная L-аминокислота, принадлежащая к семейству глутамата, выбрана из группы, состоящей из L-глутамина, L-пролина, L-аргинина, орнитина и цитруллина.
Настоящее изобретение подробно описано ниже.
Наилучший способ осуществления настоящего изобретения
1. Бактерия согласно настоящему изобретению.
Бактерия, согласно настоящему изобретению, - это принадлежащая к семейству Enterobacteriaceae бактерия-продуцент L-аминокислоты, принадлежащей к семейству глутамата, модифицированная таким образом, что активность глутаминсинтетазы в указанной бактерии увеличена.
Согласно настоящему изобретению «бактерия-продуцент L-аминокислоты» означает бактерию, обладающую способностью к продукции и выделению L-аминокислоты в питательную среду, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде.
Используемый здесь термин «бактерия-продуцент L-аминокислоты» также означает бактерию, которая способна к продукции и вызывает накопление L-аминокислоты, принадлежащей к семейству глутамата, в ферментационной среде в количествах, больших по сравнению с природным или родительским штаммом Е.coli, таким как штамм Е.coli K-12, и предпочтительно означает, что указанный микроорганизм способен накапливать в среде целевую L-аминокислоту в количестве не менее, чем 0.5 г/л, более предпочтительно - не менее чем 1.0 г/л.
Термин «L-аминокислота, принадлежащая к семейству глутамата» включает в себя L-глутамин, L-пролин, L-аргинин, орнитин и цитруллин.
Семейство Enterobacteriaceae включает в себя бактерии, принадлежащие к родам Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и т.д. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к семейству Enterobacteriaceae в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnology Information) (http://\vww.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=l&srchmode=l&unlock). Предпочтительна бактерия, принадлежащая к роду Escherichia или Pantoea.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Термин «бактерия, принадлежащая к роду Pantoea» означает, что бактерия относится к роду Pantoea в соответствии с классификацией, известной специалисту в области микробиологии. Недавно несколько видов Enterobacter agglomerans были классифицированы как Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или подобные им, на основе анализа нуклеотидной последовательности 16S рРНК и т.д. (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Термин "бактерия модифицирована таким образом, что активность глутаминсинтетазы в указанной бактерии увеличена" означает, что бактерия модифицирована таким образом, что активность глутаминсинтетазы в модифицированной бактерии выше, чем в немодифицированной. Термин "усиление экспрессии гена glnA" означает, что экспрессия гена выше, чем в немодифицированном штамме, например в штамме дикого типа. Примеры таких модификаций включают увеличение числа копий экспрессируемого гена в клетке, увеличение уровня экспрессии гена и т.д.
Количество копий экспрессируемого гена определяют, например, путем рестрикции хромосомной ДНК с последующим блоттингом по Саузерну с использованием зонда, сконструированного на основе последовательности гена, флуоресцентной гибридизации in situ (FISH), и т.п. Уровень экспрессии гена можно определить различными известными методами, включая блоттинг по Нозерну, количественную ОТ-ПЦР, и т.п. Количество кодируемого геном белка может быть определено с использованием известных методов, включая электрофорез в SDS-ПААГ с последующим иммуноблоттингом (Вестерн-блоттинг) и т.п..
Ген glnA (синонимы: ECK3863, b3870) кодирует глутаминсинтетазу (синоним В3870). Ген glnA (нуклеотиды, комплементарные нуклеотидам с 4054648 по 4056057 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16131710) расположен между геном glnL и геном typA на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена glnA и аминокислотная последовательность GlnA, кодируемого геном glnA, приведены в Перечне последовательностей под номерами 1 (SEQ ID NO:1) и 2 (SEQ ID NO:2) соответственно.
Поскольку у представителей различных родов или штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, понятие гена glnA не ограничивается геном, последовательность которого приведена в Перечне последовательностей под номером SEQ ID NO:1, но также может включать и гены, гомологичные SEQ ID NO:1, кодирующие вариант белка GlnA.
Термин "вариант белка", используемый в настоящем изобретении, означает белок с изменениями в последовательности, будь то делеции, вставки, добавления или замены аминокислот. Число изменений в варианте белка зависит от положения или типа аминокислотного остатка в третичной структуре белка. Оно может быть от 1 до 30, предпочтительно от 1 до 15, более предпочтительно - от 1 до 5 в SEQ ID NO:2. Данные изменения в вариантах могут иметь место в областях, не критичных для функции белка. Данные изменения возможны потому, что некоторые аминокислоты имеют высокую гомологию друг другу, поэтому такие изменения не влияют на третичную структуру или активность. Следовательно, вариант белка, кодируемого геном glnA, может иметь гомологию не менее 80%, предпочтительно не менее 90%, и наиболее предпочтительно - не менее 95%, по отношению к полной аминокислотной последовательности, приведенной в SEQ ID NO.2, при условии сохранения активности глутаминсинтетазы.
Гомология между двумя аминокислотыми последовательностями может быть определена с использованием известных методов, например, компьютерной программы BLAST 2.0, которая считает три параметра: число аминокислот, идентичность и сходство.
Кроме того, ген ydbK может быть вариантом, который гибридизуется в жестких условиях с нуклеотидной последовательностью, приведенной в Перечне последовательностей под номером SEQ ID NO:1, или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, при условии, что до инактивации он кодирует функциональный белок YdbK. «Жесткие условия» включают такие условия, при которых специфические гибриды, например гибриды с гомологией не менее 60%, предпочтительно - не менее 70%, более предпочтительно - не менее 80%, еще более предпочтительно - не менее 90%, и наиболее предпочтительно - не менее 95%, образуются, а неспецифические гибриды, например гибриды с меньшей гомологией, чем указано выше, не образуются. Практическим примером жестких условий является однократная или многократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°C. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+ (Amersham) при строгих условиях - 15 минут. Предпочтительна двух- трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, в данном конкретном случае она может быть около 100-1000 п.н.
Далее раскрывается способ увеличения активности глутаминсинтетазы.
При использовании гена Escherichia coli ген, кодирующий глутаминсинтетазу, можно получить методом ПЦР (полимеразная цепная реакция; White, T.J. et al., Trends Genet. 5, 185 (1989)) с использованием праймеров, сконструированных на основании нуклеотидной последовательности SEQ ID NO:1. Ген, кодирующий глутаматдегидрогеназу из других организмов также можно получить методом ПЦР из библиотек хромосомной или геномной ДНК с использованием в качестве праймеров олигонуклеотидов, сконструированных на основании известных последовательностей гена бактерии или гена бактерии другого рода, или методом гибридизации с использованием в качестве зонда олигонуклеотида, сконструированного на основании последовательности. Хромосомная ДНК может быть получена из бактерии, служащей в качестве донора ДНК, методом Saito and Miura (см. Н. Saito and K. Miura, Biochem. Biophys. Acta, 72, 619 (1963), Experiment Manual for Biotechnology, edited by The Society for Biotechnology, Japan, p.97-98, Baifukan Co, Ltd., 1992) и т.п..
Затем конструируют рекомбинантную ДНК путем лигирования гена, амплифицированного с использованием ПЦР, с векторной ДНК, способной функционировать в бактерии-хозяине. Примеры векторов, способных функционировать в бактерии-хозяине, включают векторы, автономно реплицирующиеся в бактерии-хозяине. Примеры вектора, автономно реплицирующегося в Escherichia coli, включают pUC19, pUC18, pHSG299, pHSG399, pHSG398, pACYC184, (pHSG и pACYC доступны в Takara Bio Inc.), RSF1010 (Gene vol. 75(2), p.271-288, 1989), pBR322, pMW219, pMW119 (pMW доступен в Nippon Gene Co, Ltd.), pSTV28, and pSTV29 (Takara Bio Inc.). Также может быть использована фаговая векторная ДНК.
Для лигирования гена в вышеупомянутый вектор обрабатывают вектор рестриктазой, соответствующей сайту узнавания в концевой области фрагмента ДНК, содержащего ген. Лигирование обычно проводят с использованием лигазы, такой как Т4-ДНК-лигаза. Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook, J, Fritsch, E.F, and Maniatis, T, "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989) и т.п.
Приготовленную таким образом рекомбинантную ДНК вводят в бактерию в соответствии с традиционным методом трансформации. Примеры метода включают электропорацию (Gliesche, C.G, Can. J. Microbiol., 43, 2, 197-201 (1997)). Возможно также увеличить проникающую способность ДНК путем обработки реципиентных клеток хлоридом кальция, как это описано для Escherichia coli K-12 (Mandel, М. and Higa, A, J. Mol. Biol, 53, 159 (1970), и ввести ДНК в компетентную клетку, приготовленную из клетки в стадии пролиферации, как это описано для Bacillus subtilis (Duncan, С.Н, Wilson, G.A and Young, F.E, Gene, 1, 153 (1977)).
Увеличение числа копий гена также может быть достигнуто путем введения множества копий гена, кодирующего глутаминсинтетазу, в хромосомную ДНК бактерии. Для введения множества копий гена в бактериальную хромосому выполняется гомологичная рекомбинация с использованием в качестве целевых последовательностей, присутствующих в хромосоме во множестве копий. Такими последовательностями с множеством копий в хромосомной ДНК могут быть повторяющиеся ДНК или инвертированные повторы на концах транспонируемых элементов. С другой стороны, как раскрыто в заявке JP 2-109985 А, множество копий гена можно ввести в хромосомную ДНК путем вставки гена в транспозон и его перенос, с тем чтобы множество копий гена были интегрированы в хромосомную ДНК. Интеграцию этих генов в хромосому можно подтвердить методом гибридизации по Саузерну с использованием в качестве зонда части гена.
Кроме того, экспрессию гена можно усилить, как описано в международной заявке WO 00/18935, путем замены регулирующей экспрессию последовательности, такой как промотор, гена на хромосомной ДНК или гена на плазмиде более сильным промотором, амплификации регулятора, усиливающего экспрессию, или делеции, или ослабления регулятора, ослабляющего экспрессию гена. Примеры известных сильных промоторов включают lac промотор, trp промотор, trc промотор, tac промотор, PR или PL промоторы фага λ и tet промотор.
С другой стороны, действие промотора может быть усилено, например, введением в промотор нуклеотидной замены. Примеры метода увеличения силы промотора и примеры сильных промоторов описаны Goldstein et al. (Prokaryotic promoters in biotechnology. Biotechnol. Annu. Rev., 1995, 1, 105-128) or the like. Кроме того, известно, что несколько нуклеотидов в области между сайтом связывания рибосомы (ribosome binding site - RBS) и стартовым кодоном, особенно в последовательности непосредственно перед стартовым кодоном, существенно влияет на эффективность трансляции. Следовательно, можно модифицировать эту последовательность.
Кроме того, для увеличения активности глутаминсинтетазы можно ввести в ген мутацию, приводящую к увеличению ферментативной активности. Примеры такой мутации включают мутацию в последовательности промотора с целью увеличения уровня транскрипции гена, кодирующего глутаминсинтетазу, и мутацию в кодирующей области этого гена с целью увеличения специфической активности глутаминсинтетазы.
Поскольку L-глутамин является предшественником в биосинтезе цитруллина, L-аргинина, орнитина и L-пролина, увеличение активности глутаминсинтетазы приводит к увеличеню продукции всех указанных аминокислот.
Активность глутаминсинтетазы можно определить, например, как описано Robinson P. et al. (Applied and Environmental Microbiology; 67(10), 4458-63(2001), Bender et al., J. Bacterid.; 129(2), 1001-9(1977)).
Бактерия-продуцент L-аминокислоты
В качестве бактерии согласно настоящему изобретению, модифицированной таким образом, что экспрессия гена glnA усилена (с целью увеличения активности глутаминсинтетазы), может быть использована бактерия, способная к продукции L-аминокислоты, принадлежащей к семейству глутамата.
Бактерия согласно настоящему изобретению может быть получена путем усиления экспрессии гена glnA в бактерии, уже обладающей способностью к продукции L-аминокислоты, принадлежащей к семейству глутамата. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания бактерии, в которой экспрессия гена glnA уже усилена, способности к продукции L-аминокислоты, принадлежащей к семейству глутамата.
Бактерия-продуцент L-пролина
Примеры бактерий-продуцентов L-пролина, используемых в качестве родительского штамма согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli 702ilvA (ВКПМ В-8012), дефицитного по гену ilvA и способного к продукции L-пролина (Европейский патент ЕР 1172433). Бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-пролина. Предпочтительно примеры таких генов для бактерий-продуцентов L-пролина, включают ген ргоВ, кодирующий глутаматкиназу с десенсибилизированной регуляцией L-пролином по типу обратной связи (патент Германии 3127361). Кроме того, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, экскретирующие L-аминокислоту из бактериальной клетки. Примерами таких генов являются гены b2682 и b2683 (ygaZH гены) (Европейская патентная заявка ЕР 1239041А2).
Примеры бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-пролина, включают следующие штаммы Е.coli: NRRL В-12403 и NRRL В-12404 (патент Великобритании GB 2075056), ВКПМ В-8012 (патентная заявка РФ 2000124295), плазмидные мутанты, описанные в патенте Германии DE 3127361, плазмидные мутанты, описанные у Bloom F.R. et al. (The 15th Miami winter symposium, 1983, p.34), и подобные им.
Бактерия-продуцент L-аргинина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli 237 (ВКПМ В-7925) (патентная заявка США 2002/058315 А1) и его производные, содержащие мутантную N-ацетилглутаматсинтазу (патентная заявка РФ 2001112869), штамм Е.coli 382 (ВКПМ В-7926) (Европейская патентная заявка ЕР1170358А1), штамм-продуцент аргинина, в который введен ген argA, кодирующий N-ацетилглутаматсинтетазу (Европейская патентная заявка ЕР1170361А1), и подобные им.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина согласно настоящему изобретению, также включают в себя штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-аргинина. Примеры ферментов биосинтеза L-аргинина, включают N-ацетилглутамилфосфатредуктазу (argC), орнитинацетилтрансферазу (argJ), N-ацетилглутаматкиназу (argB), ацетилорнитинтрансаминазу (argD), орнитинкарбамоилтрансферазу (argF), синтетазу аргининсукциниловой кислоты (argG), лиазу аргининсукциниловой кислоты (argH), и карбамоилфосфатсинтетазу (carAB).
Бактерия-продуцент цитруллина
Примеры родительских штаммов, используемых для получения бактерии-продуцента цитруллина согласно настоящему изобретению, включают в себя, но не ограничиваются ими, штаммы, принадлежащие к роду Escherichia, такие как мутантные по N-ацетилглутаматсинтазе штаммы Е.coli 237/pMADS11, 237/pMADS12 и 237/pMADS13 (RU2215783, ЕР1170361B1, US6790647B2).
Также бактерию-продуцент цитруллина можно легко получить из любой бактерии-продуцента аргинина, например из штамма Е.coli 382 (ВКПМ В-7926), путем инактивации аргининсукцинатсинтазы, кодируемой геном argG.
Фраза "инактивация аргининсукцинатсинтазы" означает, что бактерия модифицирована таким образом, что модифицированная бактерия содержит неактивную аргининсукцинатсинтазу или также она может означать, что бактерия не способна синтезировать аргининсукцинатсинтазу. Инактивация аргининсукцинатсинтазы может быть осуществлена путем инактивации гена argG.
Фраза "инактивация гена argG" означает, что модифицированный ген кодирует полностью нефункциональный белок. Также возможно, что область модифицированной ДНК не способна к естественной экспрессии гена из-за делеции части гена или всего гена, сдвига рамки считывания гена, введения миссенс/нонсенс мутации(-ий) или модификации прилегающих к гену областей, включая последовательности, контролирующие экспрессию гена, такие как промотор, энхансер, аттенюатор, сайт связывания рибосомы и т.д..
Наличие или отсутствие гена argG на хромосоме бактерии может быть определено хорошо известными методами, включая ПЦР, блоттинг по Саузерну и т.п. Кроме того, уровень экспрессии гена можно оценить определением количества транскрибируемой с гена РНК с использованием различных известных методов, включая блоттинг по Нозерну, количественную ОТ-ПЦР и т.п. Количество белка, кодируемого геном argG, можно определить известными методами, включая электрофорез в SDS-ПААГ с последующим иммуноблоттингом (Вестерн-блоттинг) и т.д.
Экспрессия гена argG может быть ослаблена введением в ген на хромосоме такой мутации, что внуктриклеточная активность кодируемого геном белка уменьшена по сравнению с таковой в немодифицированном штамме. Такой мутацией гена может быть замена одного или более оснований для аминокислотной замены в кодируемом геном белке («миссенс»-мутация), введение стоп-кодона («нонсенс»-мутация), делеция одного или более оснований для сдвига рамки считывания, вставка гена устойчивости к антибиотику или делеция гена или его части (Qiu, Z. and Goodman, M.F., J. Biol. Chem., 272, 8611-8617 (1997); Kwon, D. H. et al., J. Antimicrob. Chemother., 46, 793-796 (2000)). Экспрессия гена argG также может быть ослаблена путем модификации экспрессии регуляторных последовательостей, таких как промотор, последовательность Shine-Dalgarno (SD) и т.д. (заявка РСТ WO 95/34672; Carrier, Т.А. and Keasling, J.D., Biotechnol. Prog. 15, 58-64 (1999)).
Например, следующие методы могут применяться для введения мутаций путем генной рекомбинации. Конструируется мутантный ген, кодирующий мутантный белок со сниженной активностью, и бактерия для ее модификации трансформируется фрагментом ДНК, содержащим мутантный ген. Затем нативный ген на хромосоме замещается гомологичной рекомбинацией мутантным геном, отбирается полученный штамм. Такое замещение гена с использованием гомологичной рекомбинации может быть проведено методом с использованием линейной ДНК, известным как "Red-зависимая интеграция" или "интеграция посредством Red-системы" (Datsenko, K.A., Wanner, B.L., Proc.Natl.Acad.Sci.USA, 97, 12, 6640-6645(2000), заявка РСТ WO 2005/010175) или методом с использованием плазмиды, репликация которой чувствительна к температуре (патент США 6303383 или патентная заявка Японии JP 05-007491 А). Далее, введение сайт-специфической мутации путем замещения гена с использованием вышеупомянутой гомологичной рекомбинации может также быть осуществлено с использованием плазмиды с пониженной способностью к репликации в клетке хозяина.
Экспрессия гена также может быть ослаблена вставкой транспозона или IS фактора в кодирующую область гена (патент США 5175107) или традиционными методами, такими как мутагенез с использованием УФ излучения или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин).
Бактерия-продуцент орнитина
Бактерия-продуцент орнитина может быть легко получена из любой бактерии-продуцента аргинина, например штамма Е.coli 382 (ВКПМ В-7926), путем инактивации орнитинкарбамоилтрансферазы, кодируемой генами argF и argI. Методы для инактивации орнитинкарбамоилтрансферазы описаны выше.
2. Способ согласно настоящему изобретению.
Способом согласно настоящему изобретению является способ получения L-аминокислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-аминокислоты в питательной среде и выделения L-аминокислоты из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка L-аминокислоты из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. В качестве источника углерода используют этанол. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°C, предпочтительно в пределах от 30 до 38°C. рН среды поддерживают в пределах от 5 до 9, предпочтительно - от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной среде.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и/или кристаллизации.
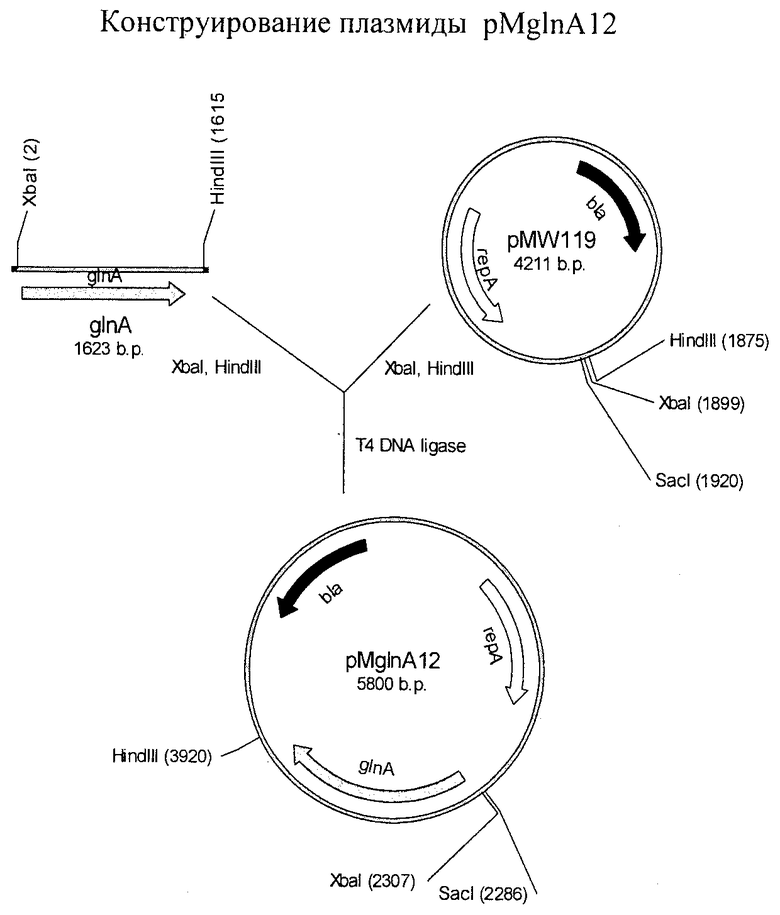
Краткое описание чертежа
На чертеже показано конструирование плазмиды pMglnA12.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Конструирование штамма с усиленной экспрессией гена glnA.
На первой стадии фрагмент ДНК, содержащий ген glnA, получили методом ПЦР с использованием праймеров P1 (SEQ ID NO:3) и Р2 (SEQ ID NO:4) и хромосомной ДНК Е.coli MG1655(ATCC 700926) в качестве матрицы. Полученный продукт ПЦР размером ≈1,6 т.п.н. очищали в агарозном геле и затем клонировали по сайтам XbaI и HindIII в плазмиде pMW119. Таким образом была получена плазмида pMglnA12 (см. чертеж). Для подтверждения экспрессии гена glnA в штамме, содержащем плазмиду pMglnA12, компетентные клетки штамма НВ101 (АТСС 33694) трансформировали плазмидой pMglnA12 и плазмидой pMW119 (в качестве контроля). Определяли активность глутаминсинтетазы в штаммах HB101/pMW119 и HB101/pMglnA12. Результаты представлены в Таблице 1. Как следует из Таблицы 1, активность глутаминсинтетазы в штамме HB101/pMglnA12 была значительно выше, чем в штамме HB101/pMW119.
Пример 2. Продукция L-аргинина штаммом Е.coli 382/pMRlnA12
Для анализа влияния увеличения активности глутаминсинтетазы на продукцию L-аргинина штамм-продуцент L-аргинина Е.coli 382 трансформировали плазмидой pMglnA12 с целью получения штамма 382/pMglnA12. Штамм 382 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-ый Дорожный проезд, 1) 10 апреля 2000 года с инвентарным номером ВКПМ В-7926, затем 18 мая 2001 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора.
Оба штамма, 382 и 382/pMglnA12, выращивали с перемешиванием при 37°C в течение 18 часов в 3 мл питательного бульона, по 0.3 мл полученных культур вносили в 2 мл ферментационной среды в пробирки размером 20×200 мм, и культуры выращивали при 32°C в течение 48 часов на роторной качалке.
После выращивания количество накопленного в среде L-аргинина определяли с помощью бумажной хроматографии, при этом использовали следующий состав подвижной фазы: бутанол:уксусная кислота:вода=4:1:1 (v/v). Раствор нингидрина (2%) в ацетоне использовали для визуализации. Пятно, содержащее L-аргинин, вырезали; L-аргинин элюировали 0.5% водным раствором CdCl2, после чего количество L-аргинина определяли спектрофотометрическим методом при длине волны 540 нм. Результаты десяти независимых пробирочных ферментации представлены в Таблице 2. Как следует из Таблицы 2, 382/pMglnA12 накапливал большее количество L-аргинина, чем 382.
Состав использованной ферментационной среды, г/л:
Глюкозу и сульфат магния стерилизовали раздельно. СаСО3 стерилизовали сухим жаром при 180°C в течение 2 часов. рН доводили до 7.0.
Пример 3. Продукция L-пролина штаммом Е.coli 702ilvA/pMglnA12.
Для оценки влияния увеличения активности глутаминсинтетазы на продукцию L-пролина штамм-продуцент L-пролина Е.coli 702ilvA может быть трансформирован плазмидой pMglnA12 с получением штамма 702ilvA/pMglnA12. Штамм 702ilvA депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 117545, Москва, 1ый Дорожный проезд, 1) с инвентарным номером ВКПМ В-8012, затем 18 мая 2001 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора.
Оба штамма, Е.coli, 702ilvA и 702ilvA/pMglnA12, могут быть выращены в течение 18-24 часов при температуре 37°C на чашках с L-агаром. Далее, одна петля клеток может быть перенесена в пробирки, содержащие 2 мл ферментационной среды. Ферментационная среда содержит глюкозу - 60 г/л, сульфат аммония - 25 г/л, KH2PO4 - 2 г/л, MgSO4 - 1 г/л, тиамин - 0.1 мг/мл, L-изолейцин - 70 мкг/мл и мел - 25 г/л, значение рН доводят до 7.2. Глюкозу и мел стерилизуют отдельно. Выращивание может производиться при 30°C в течение 3 дней с перемешиванием. После выращивания количество полученного L-пролина может быть определено с помощью бумажной хроматографии (состав подвижной фазы: бутанол-уксусная кислота-вода=4:1:1) с последующим окрашиванием нингидрином (1% раствор в ацетоне) и дальнейшим элюированием полученных соединений в 50% этаноле с 0.5% CdCl2.
Пример 4. Продукция цитруллина штаммом Е.coli 382ΔargG/pMglnA12
Для оценки влияния увеличения активности глутаминсинтетазы на продукцию цитруллина штамм-продуцент цитруллина Е.coli 382ΔargG может быть трансформирован плазмидой pMglnA12 с целью получения штамма 382ΔargG/pMglnA12. Штамм 382ΔargG может быть получен в результате делеции гена argG на хромосоме штамма 382 (ВКПМ В-7926) с использованием метода, предложенного Datsenko, K.A. and Wanner, B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97(12), 6640-6645), называемого "Red-зависимая интеграция". В соответствии с этой процедурой могут быть сконструированы ПЦР-праймеры, гомологичные как области, прилегающей к гену argG, так и гену, отвечающему за устойчивость к антибиотику. В качестве матрицы в ПЦР может быть использована плазмидa pMWl 18-attL-Cm-attR (WO 05/010175).
Оба штамма Е.coli, 382ΔargG и 382ΔargG/pMglnA12, могут быть выращены с перемешиванием при 37°C в течение 18 часов в 3 мл питательной среды, и 0.3 мл полученных культур могут быть перенесены в 2 мл ферментационной среды в пробирках 20×200-мм и могут быть культивированы при 32°C в течение 48 часов на роторной качалке.
После выращивания количество полученного цитруллина может быть определено с помощью бумажной хроматографии с использованием подвижной фазы следующего состава: бутанол-уксусная кислота-вода - 4:1:1. Последующее окрашивание может быть выполнено нингидрином (2% раствор в ацетоне). Содержащее цитруллин пятно может быть вырезано, цитруллин может быть элюирован с использованием 0.5% водного раствора CdCl2, и количество цитруллина может быть определено спектрофотометрически при длине волны 540 нм.
Возможный состав ферментационной среды, г/л:
Глюкозу и сульфат магния стерилизуют отдельно. СаСО3 стерилизуют сухим жаром при 180°C в течение 2 часов. Значение рН доводят до 7.0.
Пример 5. Продукция орнитина штаммом Е.coli 382ΔargFΔargI/pMglnA12
Для оценки влияния увеличения активности глутаминсинтетазы на продукцию орнитина штамм-продуцент орнитина Е.coli 382ΔargFΔargI может быть трансформирован плазмидой pMglnA12 с целью получения штамма 382ΔargFΔargI/pMglnA12. Штамм 382ΔargFΔargI может быть получен в результате последовательных делеций генов argF и argI на хромосоме штамма 382 (ВКПМ В-7926) с использованием метода, предложенного Datsenko, K.А. and Wanner, B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97(12), 6640-6645), называемого "Red-зависимая интеграция". В соответствии с этой процедурой могут быть сконструированы две пары ПЦР-праймеров, гомологичных как областям, прилегающим к генам argF и argI, так и гену, отвечающему за устойчивость к антибиотику. В качестве матрицы в ПЦР может быть использована плазмида pMW118-attL-Cm-attR (WO 05/010175).
Оба штамма Е.coli, 382ΔargFΔargI и 382ΔargFΔargI/pMglnA12, могут быть выращены с перемешиванием при 37°C в течение 18 часов в 3 мл питательной среды, и 0.3 мл полученных культур могут быть перенесены в 2 мл ферментационной среды в пробирках 20×200-мм и могут быть культивированы при 32°C в течение 48 часов на роторной качалке.
После выращивания количество полученного орнитина может быть определено с помощью бумажной хроматографии с использованием подвижной фазы следующего состава: бутанол-уксусная кислота-вода=4:1:1. Последующее окрашивание может быть выполнено нингидрином (2% раствор в ацетоне). Содержащее цитруллин пятно может быть вырезано, цитруллин может быть элюирован с использованием 0.5% водного раствора CdCl2, и количество цитруллина может быть определено спектрофотометрически при длине волны 540 нм.
Возможный состав ферментационной среды, г/л:
Глюкозу и сульфат магния стерилизуют отдельно. СаСО3 стерилизуют сухим жаром при 180°C в течение 2 часов. Значение рН доводят до 7.0.
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
Изобретение относится к биотехнологии. Способ получения L-аминокислоты, принадлежащей к семейству глутамата, с использованием бактерии, принадлежащей к роду Escherichia, которая модифицирована таким образом, что активность глутаминсинтетазы в указанной бактерии увеличена. Изобретение позволяет получить L-аминокислоту с высокой степенью эффективности. 2 н. и 2 з.п. ф-лы, 1 ил., 2 табл.
1. Бактерия, принадлежащая к роду Escherichia, - продуцент L-аминокислоты, принадлежащей к семейству глутамата и выбранной из группы, состоящей из L-глутамина, L-пролина, L-аргинина, L-орнитина и L-цитруллина, модифицированная таким образом, что активность глутаминсинтетазы в указанной бактерии увеличена.
2. Бактерия по п.1, отличающаяся тем, что указанная активность увеличена за счет усиления экспрессии гена glnA.
3. Бактерия по п.2, отличающаяся тем, что экспрессия указанного гена glnA усилена за счет увеличения числа копий гена или модификации последовательности, контролирующей экспрессию гена, в результате которой экспрессия гена усиливается.
4. Способ получения L-аминокислоты, принадлежащей к семейству глутамата и выбранной из группы, состоящей из L-глутамина, L-пролина, L-аргинина, L-орнитина и L-цитруллина, включающий:
- выращивание бактерии по п.1 в питательной среде и
- выделение указанной L-аминокислоты из культуральной жидкости.
| Корпус судна | 1984 |
|
SU1229121A1 |
| US 2005255567 A1, 17.11.2005 | |||
| US 2003148474 A1, 07.08.2003 | |||
| МУТАНТНАЯ ГЛУТАМИНСИНТЕТАЗА, ФРАГМЕНТ ДНК, ШТАММ ESCHERICHIA COLI - ПРОДУЦЕНТ L-ГЛУТАМИНА И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ | 2001 |
|
RU2230114C2 |
Авторы
Даты
2011-06-10—Публикация
2009-01-23—Подача