Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 5,6-дигидро-4H-бензо[f]пирроло[1,2-α] [1,4] диазепин-6-она.
Изобретение относится к разработке способа получения производных 5,6-дигидро-4H-бензо[f]пирроло[1,2-α][1,4]диазепин-6-она общей формулы 1, которые могут найти применение как вещества, обладающие высокой биологической активностью.

Известно, что пирроло[1,2-α][1,4]бензодиазепины влияют на центральную нервную систему [G.W.Н.Cheeseman and S.G.Greenberg, Chem. Ind. (London), 1974, 916-917; b) F.Corelli, S.Massa, G.C.Pantaleoni, G.Palumbo and D.Fanini, Farmaco, 1984, 39, 707-717; A.Mai, R.Di Santo, S.Massa, M.Artico, G.C.Pantaleoni, R.Giorgi, M.F.Coppolino and A.Barracchini, Eur. J. Med. Chem., 1995, 30, 593-601], проявляя седативные [S.Massa, F.Corelli, M.Artico, A.Mai, R.Silvestri, G.C.Pantaleoni, G.Palumbo, D.Fanini and R.Giorgi Farmaco, 1989, 44, 109-123], антиконвульсантные, миорелаксантые [Т.Hara, Y.Kayama, Т.Mori, К.Itoh, H.Fujimori, Т.Sunami, Y.Hashimoto and S.Ishimoto, J.Med. Chem., 1978, 21, 263-268; S.Massa, M.Artico, A.Mai, F.Corelli, M.Botta, A.Tafi, G.C.Pantaleoni, R.Giorgi, M.F.Coppolino, A.Cagnotto and M.Skorupska, J. Med. Chem., 1992, 35, 4533-4541] и психотропные свойства [E.G.Glamkowski and Y.Chiang, J.Heterocycl. Chem., 1987, 24, 1599-1604; S.Massa, M.Artico, A.Mai, F.Corelli, G.C.Pantaleoni, R.Giorgi, D.Ottaviani and A.Cagnotto, Farmaco, 1990, 45, 1265-1281]. Кроме того, производные пирроло[1,2-α][1,4]бензодиазепина показали противовоспалительную [F.Corelli, S.Massa, G.Stefancich, G.Ortenzi, M.Artico, G.C.Pantaleoni, G.Palumbo, D.Fanini and R.Giorgi, Eur. J. Med. Chem. - Chim. Ther., 1986, 21, 445-449], анальгетическую [S.Saito, H.Umemiya, Y.Suga, M.Sato and N.Kawashima, WO Pat., 2003, WO 2003095427; Chem. Abstr., 139, 395821] и фунгицидную активность [Т.Gilkerson, R.J.Nash, J.F.E.Van Gestel and L.Meerpoel, WO Pat., 2002, WO 2002034752; Chem. Abstr., 136, 340708; b) L.Meerpoel, J.Van Gestel, F.Van Gerven, F.Woestenborghs, P.Marichal, V.Sipido, G.Terence R., Nash, D.Corens and R.D.Richards, Bioorg. Med. Chem. Lett., 2005, 15, 3453-3458].
В настоящее время известны методы синтеза пирроло[1,2-α][1,4]бензодиазепинов, основанные на использовании 1-[2-(аминометил)фенил]пирролов, которые вводят в кислотно-катализируемую конденсацию с альдегидами, протекающую аналогично реакции Пикте-Шпенглера [a) S.Raines, S.Y.Chai and F.P.Palopoli, J.Heterocycl. Chem., 1976, 13, 711-716; b) G.W.H.Cheeseman and S.G.Greenberg, J. Heterocycl. Chem., 1979, 16, 241-244; c) S.Massa, A.Mai, M.Artico, F.Corelli and M. Botta, Tetrahedron, 1989, 45, 2763-2772; d) S.Massa, A.Mai and M.Artico, Synth. Commun., 1990, 20, 3537-3545; e) S.Vega and M.S.Gil, J.Heterocycl. Chem., 1991, 28, 945-950] или подвергают ацилированию с последующей циклизацией при действии POCl3 (реакция Бишлера-Напиральски) [a) S.Vomero, R.Giuliano, М.Artico and G.Stefancich, Farmaco, 1980, 35, 110-119; b) S.Massa, A.Mai, R.Di Santo and M.Artico, J.Heterocycl. Chem., 1993, 30, 897-903; d) F.Esser, K.-H.Pook, A.Carpy and J.-M. Leger, Synthesis, 1994, 77-82; e) S.Massa, R.Di Santo, R.Costi and M.Artico, J. Heterocycl. Chem., 1993, 30, 749-753]. Ароматическая аминометильная группа также может нуклеофильно атаковать карбонильную функцию в положении 2 пиррольного кольца с образованием диазепинового фрагмента [a) G.De Martino, М.Scalzo, S.Massa, R.Giuliano and M.Artico, Farmaco, 1972, 27, 980-989; b) S.Rault, M.Cugnon de Sevricourt M. and M.Robba, Compt. Rend. Acad. Sc., 1978, 287C, 117-120]. Вместо аминометильной группы в данных реакциях использовали также соответствующие имины [I.Rault, S.Rault and М.Robba, Tetrahedron Lett., 1993, 34, 1929-1930; b) I.Rault, M.-P.Foloppe, S.Rault and M.Robba Heterocycles 1993, 36, 2059-2066], оксимы [E.E.Garcia, J.G.Riley and R.I.Fryer, J. Org. Chem., 1968, 33, 1359-1363] и амиды [a) M.Boulouard, S.Rault, A.Alsaidi, P.Dallemagne and M.Robba, J. Heterocycl. Chem., 1995, 32, 1719-1724; b) M.Boulouard, S.Rault, P.Dallemagne, A.Alsaidi and M.Robba, J. Heterocycl. Chem., 1996, 33, 87-91].
К основным недостаткам описанных методов относится либо применение труднодоступных реагентов, либо многостадийность процесса, что снижает суммарный выход целевого продукта.
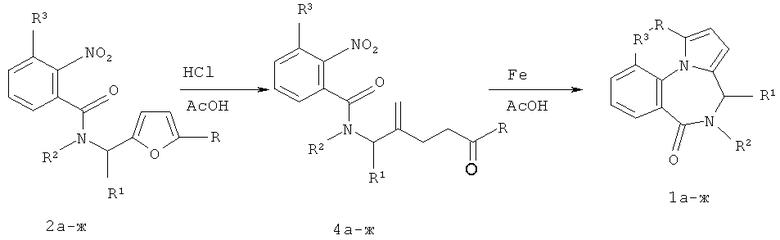
Известен способ получения производных пирроло[1,2-α][1,4]диазепина, аннелированного с ароматическим и гетероароматическим кольцом [патент РФ №2323939 Способ получения производных пирроло[1,2-α][1,4]диазепина // Бутин А.В., Строганова Т.А., Василии В.К., Крапивин Г.Д., Неволина Т.А.]. В основе этого метода лежит кислотно-катализируемая рециклизация фуранового кольца фурфуриламидов ароматических или гетероароматических карбоновых кислот, содержащих в орто-положении аминогруппу, которая позволяет одновременно формировать как диазепиновый, так и пиррольный цикл.
В частности, для получения 1-метил-5,6-дигидро-4H-бензо[f]пирроло[1,2-α][1,4]-диазепин-6-она 1а в качестве исходного соединения использовали 5-метилфурфуриламид 2-аминобензойной кислоты 3а, который получали из 5-метилфурфуриламида 2-нитробензойной кислоты 2а при восстановлении гидразин гидратом в присутствии никеля Ренея. При проведении реакции рециклизации в уксусной кислоте в присутствии конц. соляной кислоты при 60-70°C в течение 10-15 минут выход целевого продукта составлял 47% [патент РФ №2323939 Способ получения производных пирроло[1,2-α][1,4]диазепина // Бутин А.В., Строганова Т.А., Василии В.К., Крапивин Г.Д., Неволина Т.А.].
Основным недостатком этого способа является невозможность получения производных 5,6-дигидро-4H-бензо[f]пирроло[1,2-α][1,4]диазепин-6-она 1, содержащих заместители R1, R2 или R=t-Bu, а также низкий выход 1, содержащих заместитель R3.

Так, проведение реакции рециклизации фурфуриламида 3ж (R3=Me) в этих условиях приводит к значительному уменьшению выхода пирролобензодиазепина 1ж до 11%. При использовании в качестве субстрата N-фурфуриламидов 3б-е образование соответствующих целевых продуктов не наблюдалось.
Задача изобретения - разработка нового способа получения производных 5,6-дигидро-4H-бензо[f]пирроло[1,2-α][1,4]диазепин-6-она 1, содержащих различные заместители R, R1, R2, R3.
Техническим результатом является обеспечение одновременного формирования пиррольного и диазепинового колец и повышение выхода конечных продуктов за счет изменения последовательности реакций и условий их проведения.
Технический результат достигается тем, что в способе получения производных 5,6-дигидро-4H-бензо [f]пирроло [1,2-α] [1,4] диазепин-6-она 1, включающем формирование пирролодиазепинового каркаса в результате реакции восстановления нитрогруппы N-(2,5-диоксоалкил)-2-нитробензамидов 4, реакцию доводят до кипения в уксусной кислоте в присутствии железа и выдерживают 60 минут при комнатной температуре.

Исходные производные N-(2,5-диоксоалкил)-2-нитробензамида 4 (таблица 1) были получены из 2-(2-нитрофенилкарбоксамидометил)фуранов 2 в результате кислотно-катализируемой реакции раскрытия фуранового цикла [A.V.Butin, S.K.Smirnov, F.A.Tsiunchik, M.G.Uchuskin and I.V.Trushkov, Synthesis, 2008, №18, 2943-2952; T.A.Stroganova, A.V.Butin, V.K.Vasilin, T.A.Nevolina and G.D.Krapivin, Synlett, 2007, 1106-1108].
Экспериментально было установлено, что оптимальным условием для одновременного формирования пирролодиазепинового каркаса является доведение реакции до кипения в уксусной кислоте в присутствии железа и выдерживание при комнатной температуре 60 минут. В этом случае удается не только повысить выходы соединений 1а, ж до 81 и 80% соответственно, но и получать производные 5,6-дигидро-4H-бензо [f]пирроло[1,2-α] [1,4]диазепин-6-она с различными заместителями R, R1, R2, R3.
Полученный технический результат позволяет расширить ряд производных 5,6-дигидро-4H-бензо[f]пирроло[1,2-α] [1,4]диазепин-6-она.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Индивидуальность и строение синтезированных соединений 1 подтверждены данными 1Н, 13C ЯМР-спектроскопии и элементного анализа (таблица 2).





Примеры осуществления заявляемого способа получения 1-метил-5,6-дигидро-4H-бензо[f]пирроло[1,2-α] [1,4]-диазепин-6-она 1а:
Пример 1
1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-α][1,4]-диазепин-6-он (1а)
К раствору соединения (4а) (1 г, 3.6 ммоль) в ледяной уксусной кислоте (20 мл) добавляют железо (3 г) и доводят до кипения, затем выдерживают 60 мин при комнатной температуре. Реакционную смесь выливают в воду (100 мл) и нейтрализуют гидрокарбонатом натрия до pH~7. Выпавший осадок отфильтровывают и тщательно промывают горячим этилацетатом (5×30 мл), не смешивая с маточным раствором. Объединенные органические вытяжки сушат и упаривают досуха при пониженном давлении; остаток растворяют в смеси этилацетат-петролейный эфир (1:2) и пропускают через слой силикагеля. Очищенный раствор упаривают при пониженном давлении до 1/3 исходного объема и оставляют кристаллизоваться. Выход 81% (0.62 г).
Тпл=235-236°C.
Найдено для C13H12N2O, %: C, 73.52; H, 5.45; N, 13.19.
Вычислено: C, 73.57; H, 5.70; N, 13.20.
Спектр 1Н ЯМР (CDCl3), (δ, м. д. и КССВ, J, Гц): 2.30 (с, 3H, Me), 4.09 (д, 3J=6.0 Гц, 2H, CH2), 5.98-6.02 (м, 2H, HPyr), 7.26 (дд, 3J=8.1 Гц, 4J=1.2 Гц, 1H, HAr), 7.38 (ддд, 3J=7.5 Гц, 3J=7.8 Гц, 4J=1.2 Гц, 1H, HAr), 7.54 (ддд, 3J=7.5 Гц, 3J=8.1 Гц, 4J=1.5 Гц, 1H, HAr), 7.92 (уш.т, 3J=6.0 Гц, 1H, NH), 7.95 (дд, 3J=7.8 Гц, 4J=1.5 Гц, 1H, HAr).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 14.0, 38.0, 104.9, 109.5, 124.9, 126.2, 129.4 (2С), 131.2, 131.4, 132.7, 135.8, 170.7.
Пример 2
К раствору соединения (4а) (1 г, 3.6 ммоль) в ледяной уксусной кислоте (20 мл) добавляют железо (1 г) и выдерживают 60 часов при комнатной температуре. Реакционную смесь выливают в воду (100 мл) и нейтрализуют гидрокарбонатом натрия до pH~7. Выпавший осадок отфильтровывают и тщательно промывают горячим этилацетатом (5×30 мл), не смешивая с маточным раствором. Объединенные органические вытяжки сушат и упаривают досуха при пониженном давлении; остаток растворяют в смеси этилацетат-петролейный эфир (1:2) и пропускают через слой силикагеля. Очищенный раствор упаривают при пониженном давлении до 1/3 исходного объема и оставляют кристаллизоваться. Выход 70% (0.53 г).
Пример 3
К раствору соединения (4а) (1 г, 3.6 ммоль) в ледяной уксусной кислоте (20 мл) добавляют железо (3 г) и выдерживают 48 часов при комнатной температуре. Реакционную смесь выливают в воду (100 мл) и нейтрализуют гидрокарбонатом натрия до pH~7. Выпавший осадок отфильтровывают и тщательно промывают горячим этилацетатом (5x30 мл), не смешивая с маточным раствором. Объединенные органические вытяжки сушат и упаривают досуха при пониженном давлении; остаток растворяют в смеси этилацетат-петролейный эфир (1:2) и пропускают через слой силикагеля. Очищенный раствор упаривают при пониженном давлении до 1/3 исходного объема и оставляют кристаллизоваться. Выход 75% (0.57 г).
Пример 4
К раствору соединения (4а) (1 г, 3.6 ммоль) в ледяной уксусной кислоте (20 мл) добавляют железо (5 г) и выдерживают 48 часов при комнатной температуре. Реакционную смесь выливают в воду (100 мл) и нейтрализуют гидрокарбонатом натрия до pH~7. Выпавший осадок отфильтровывают и тщательно промывают горячим этилацетатом (5×30 мл), не смешивая с маточным раствором. Объединенные органические вытяжки сушат и упаривают досуха при пониженном давлении; остаток растворяют в смеси этилацетат-петролейный эфир (1:2) и пропускают через слой силикагеля. Очищенный раствор упаривают при пониженном давлении до 1/3 исходного объема и оставляют кристаллизоваться. Выход 75% (0.57 г).
Пример 5
К раствору соединения (4а) (1 г, 3.6 ммоль) в ледяной уксусной кислоте (20 мл) добавляют железо (1 г) и кипятят 60 мин. Реакционную смесь выливают в воду (100 мл) и нейтрализуют гидрокарбонатом натрия до pH~7. Выпавший осадок отфильтровывают и тщательно промывают горячим этилацетатом (5x30 мл), не смешивая с маточным раствором. Объединенные органические вытяжки сушат и упаривают досуха при пониженном давлении; остаток растворяют в смеси этилацетат-петролейный эфир (1:2) и пропускают через слой силикагеля. Очищенный раствор упаривают при пониженном давлении до 1/3 исходного объема и оставляют кристаллизоваться. Выход 65% (0.49 г).
Пример 6
К раствору соединения (4а) (1 г, 3.6 ммоль) в ледяной уксусной кислоте (20 мл) добавляют железо (3 г) и кипятят 30 минут. Реакционную смесь выливают в воду (100 мл) и нейтрализуют гидрокарбонатом натрия до pH~7. Выпавший осадок отфильтровывают и тщательно промывают горячим этилацетатом (5×30 мл), не смешивая с маточным раствором. Объединенные органические вытяжки сушат и упаривают досуха при пониженном давлении; остаток растворяют в смеси этилацетат-петролейный эфир (1:2) и пропускают через слой силикагеля. Очищенный раствор упаривают при пониженном давлении до 1/3 исходного объема и оставляют кристаллизоваться. Выход 76% (0.58 г).
Как следует из приведенных примеров, проведение реакции при комнатной температуре с использованием различных количеств железа вызывает увеличение продолжительности процесса от 48 до 60 часов.
Кипячение реакционной смеси с 1 г железа в течение 60 минут приводит к большему осмолению реакционной смеси и, как следствие, к снижению выхода целевого продукта. Меньшее осмоление и увеличение выхода пирролобензадиазепина наблюдалось при кипячении реакционной смеси в течение 20-30 минут с использованием 3 г железа. Оптимальным вариантом является использование железа в количестве 3 г, доведение реакционной смеси до кипения и выдерживание 60 минут при комнатной температуре. Именно в этом случае выход 1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-α][1,4]-диазепин-6-он (1а) достигает 81%.
Заявляемым способом получен ряд производных 5,6-дигидро-4H-бензо[f]пирроло[1,2-α][1,4]диазепин-6-она 1 а-ж.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 10-МЕТИЛ-6, 7-ДИГИДРО-5Н-ПИРРОЛО[1, 2-а][1, 5]БЕНЗОДИАЗЕПИНА | 2015 |
|
RU2603344C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО[1,2-а][1,4]ДИАЗЕПИНА | 2006 |
|
RU2323939C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 7-АЛКИЛ-2,3-ДИГИДРО-1Н-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИН-4(5Н)-ОНА | 2017 |
|
RU2659390C1 |
| ТРИЦИКЛИЧЕСКИЕ ДИАЗЕПИНОВЫЕ АНТАГОНИСТЫ ВАЗОПРЕССИНА И АНТАГОНИСТЫ ОКСИТОЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2126006C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,6-ДИГИДРО-7Н-ПИРРОЛО[1,2-d][1,4] БЕНЗОДИАЗЕПИН-6-ОНА | 2011 |
|
RU2455289C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ДИАЛКИЛАМИНОПИРРОЛО[1,2-АЛЬФА][1,4]БЕНЗОДИАЗЕПИНА | 2012 |
|
RU2518102C1 |
| ПРИМЕНЕНИЕ 1-МЕТИЛ-5-(4-ХЛОРФЕНИЛ)-4,5-ДИГИДРО-6H-ПИРРОЛО[1,2-a][1,4]БЕНЗОДИАЗЕПИН-6-ОНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2809148C1 |
| ПРИМЕНЕНИЕ 10-МЕТИЛ-6,7-ДИГИДРО-5H-ПИРИДО[2,3-b]-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2803600C1 |
| КОНЪЮГАТЫ И МАЛЫЕ МОЛЕКУЛЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С РЕЦЕПТОРОМ CD16а | 2013 |
|
RU2519546C1 |
| Способ получения производных пирроло[2,1-a]изохинолинов | 2017 |
|
RU2656225C1 |
Описывается способ получения производных 5,6-дигидро-4Н-бензо[f]пирроло[1,2-α][1,4]диазепин-6-она 1, включающий формирование пирролодиазепинового каркаса в результате реакции восстановления нитрогруппы N-(2,5-диоксоалкил)-2-нитробензамидов 4 в уксусной кислоте в присутствии железа при доведении реакции до кипения и выдерживании 60 минут при комнатной температуре.
 Изобретение позволяет обеспечивать одновременное формирование пиррольного и диазепинового колец и повышение выхода конечных продуктов за счет изменения последовательности реакций и условий их проведения. 2 табл.
Изобретение позволяет обеспечивать одновременное формирование пиррольного и диазепинового колец и повышение выхода конечных продуктов за счет изменения последовательности реакций и условий их проведения. 2 табл.
Способ получения производных 5,6-дигидро-4Н-бензо[f]пирроло[1,2-α][1,4]диазепин-6-она общей формулы 1,

характеризующийся тем, что формирование пирролодиазепинового каркаса происходит в результате проведения реакции восстановления нитрогруппы N-(2,5-диоксоалкил)-2-нитробензамидов 4 в уксусной кислоте в присутствии железа, реакцию доводят до кипения и выдерживают 60 мин при комнатной температуре.
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО[1,2-а][1,4]ДИАЗЕПИНА | 2006 |
|
RU2323939C1 |
| Stetter Hermann et al | |||
| Preparation of bi- and tricyclic pyrrole systems | |||
| Liebigs Annalen der Chemie, 1980, 5, 703-714 (German). | |||
Авторы
Даты
2011-07-27—Публикация
2010-01-11—Подача