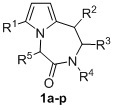
Изобретение относится к области органической химии − синтезу гетероциклических соединений, производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она.
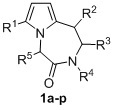
Изобретение относится к разработке способа получения производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она общей формулы 1, которые могут найти применение как вещества, обладающие потенциальной биологической активностью широкого спектра действия.
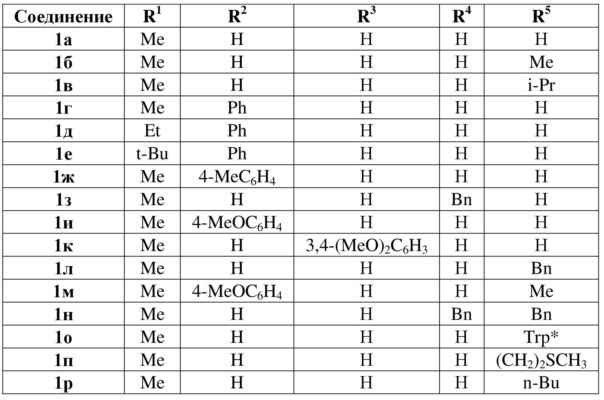
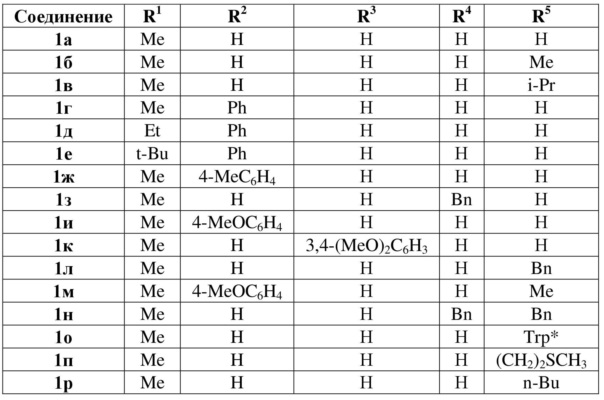
* Trp = (1H-индол-3-ил)метил
В настоящее время производные 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она являются малоизученными объектами, что связано в первую очередь с отсутствием общих эффективных методов синтеза данного класса соединений. Прогнозирование биологической активности (методом QSAR) показало, что представители этого класса способны проявлять ингибирующую активность в отношении киназы 3 гликогенсинтазы и циклинзависимой киназы 2, то есть являются перспективными агентами при лечении диабета, рака, болезни Альцгеймера [N. Dessalew, P.V. Bharatam, Eur. J. Med. Chem., 2007, 42, 1014–1027]. Интерес к производным 2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепина как потенциальным лекарственным средствам следует также из того, что их близкие структурные аналоги – пирроло[1,2-а][1,4]диазепины – проявляют широкий спектр физиологической активности. В частности, они влияют на центральную нервную систему, оказывая антидепрессантное и анксиолитическое действие [G.V. Mokrov, А.М. Likhosherstov, V.I. Poseva, G.M. Molodavkin, V.P. Lezina, T.A. Gudasheva, T.A. Voronina, Pharm. Chem. J., 2013, 9, 464–469], проявляют антиагрегантную активность [B.C. Askew, C.J. McIntyre, C.A. Hunt, D.A. Claremon, R.J. Gould, R.J. Lynch, D.J. Armstrong, Bioorg. Med. Chem. Lett., 1995, 5, 475–480], а также могут использоваться для лечения демиелинизации [H. Peng, Z. Xin, L. Zhang, L. Sun, G. Kumaravel, WO 2014/152725, 2014].
В литературе описано три подхода к синтезу производных пирроло[1,2-d][1,4]диазепинов. Первый подход основан на использовании исходных соединений с уже готовым пиррольным циклом. Так, N-[2-(пиррол-1-ил)этил]-N-(триазол-4-ил)метилсульфамиды при кипячении в дихлорэтане в присутствии родиевого катализатора с последующей обработкой цианоборгидридом натрия превращаются в 1-(аминометил)пирроло[1,2-d][1,4]диазепины [J.-M. Yang, C.-Z. Zhu, X.-Y. Tang, M. Shi, Angew. Chem., 2014, 53, 5142–5146]. Замещенные пирроло[1,2-d][1,4]диазепины образуются в результате катализируемой комплексом Au(I) внутримолекулярной реакции Фриделя-Крафтса N-[2-(пиррол-1-ил)этил]-N-(алк-2,3-диенил)сульфамидов [L.-Y. Mei, Y. Wei, X.-Y. Tang, M. Shi, J. Am. Chem. Soc., 2015, 137, 8131–8137], инициируемой (CF3SO2)2O спироциклизации N-[2-(пиррол-1-ил)этил]-N-алкилникотинамидов [H. Brice, J. Clayden, Chem. Commun., 2009, 1964-1966], гидразинолиза этиловых эфиров [2-(2-фталимидоэтил)пиррол-1-ил]ацетатов [H. Stetter, P. Lappe, Liebigs Ann. Chem., 1980, 5, 703–714].
В основе второго подхода лежит использование соединений, содержащих диазепиновый цикл, к которому надстраивается пиррольный фрагмент. В частности, производные пирроло[1,2-d][1,4]диазепина получают взаимодействием метил-(Z)-1,4-диазепан-5-илиденэтаноата с β-нитростиролом [H. Fujioka, K. Murai, O. Kubo, Y. Ohba, Y. Kita, Org. Lett., 2007, 9, 1687 – 1690].
Наиболее близким к заявляемому методу синтеза является третий подход, который заключается в одновременном формировании пиррольного и диазепинового циклов. Так, замещенные пирроло[1,2-d][1,4]диазепины получают внутримолекулярной циклизацией по методу Пааля-Кнорра соответствующих амино-1,4-дикарбонильных соединений [H.S. Iden, W.D. Lubell, Org. Lett., 2006, 8, 3425–3428].
К недостаткам перечисленных методов следует отнести труднодоступность исходных соединений, специфичные реакционные условия и многостадийность процесса.
В основе заявляемого способа получения производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она 1 лежит кислотно-катализируемая реакция рециклизации фуранов, содержащих аминогруппу, с одновременным формированием пирролодиазепинового каркаса [А.В. Бутин, Т.А. Неволина, В.А. Щербинин, патент РФ 2455289, 2012; В.А. Щербинин, Т.А. Неволина, П.М. Шпунтов, А.В. Бутин, патент РФ 2490271, 2013; A.V. Butin, T.A. Nevolina, V.A. Shcherbinin, I.V. Trushkov, D.A. Cheshkov, G.D. Krapivin, Org. Biomol. Chem., 2010, 8, 3316–3327; V.A. Shcherbinin, T.A. Nevolina, A.V. Butin, J. Heterocycl. Chem., 2011, 46, 1542–1544; I.V. Trushkov, T.A. Nevolina, V.A. Shcherbinin, L.N. Sorotskaya, A.V. Butin, Tetrahedron Lett., 2013, 54, 3974–3976].
Задача изобретения – разработка нового эффективного метода синтеза производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она 1 из замещенных 2-(фуран-2-ил)этиламинов и различных альфа-аминокислот, позволяющего получать целевые бициклические соединения, содержащие разнообразные заместители в диазепиновом и пиррольном циклах, с целью поиска наиболее перспективных объектов для фармакологии, медицины и ветеринарии.
Техническим результатом является создание простого и эффективного метода синтеза производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она 1, основанного на использовании доступных 2-(фуран-2-ил)этиламинов и альфа-аминокислот, позволяющего проводить все стадии процесса в однореакторном режиме и получать целевые продукты с хорошими выходами, а также варьировать заместители в диазепиновом и пиррольном циклах.
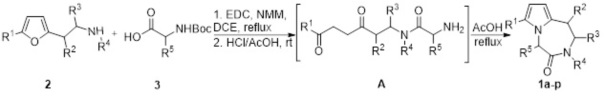
Технический результат достигается осуществлением последовательных превращений, выполненных в однореакторном режиме. Первоначальная стадия заключается в ацилировании 2-(фуран-2-ил)этиламинов 2 замещенными аминокислотами 3 в присутствии 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и N-метилморфолина (NMM) при кипячении в 1,2-дихлорэтане (DCE) с образованием амидов, которые в результате дальнейшего гидролиза в уксусной кислоте в присутствии соляной кислоты превращаются в соответствующие амино-1,4-дикетоны, циклизующиеся по внутримолекулярной реакции Пааля-Кнорра при кипячении в уксусной кислоте в течение 30 минут в целевые 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-оны 1.
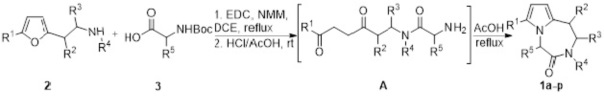
Полученный технический результат позволяет получать целевые продукты 1а-р с хорошими выходами в однореакторном режиме без выделения промежуточных продуктов, что значительно экономит реагенты и растворители, минимизирует протекание побочных процессов и образование отходов. Метод имеет широкие границы применимости вследствие легкой доступности исходных компонентов и возможности широкого варьирования заместителей в исходных соединениях.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
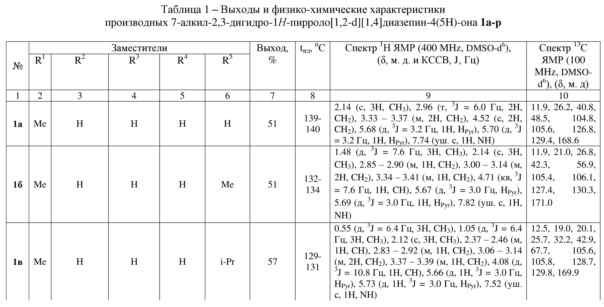
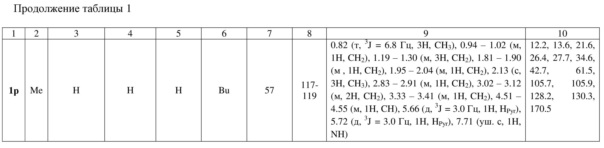
Индивидуальность и строение синтезированных соединений 1а-р подтверждены данными 1Н, 13С ЯМР – спектроскопии (таблица 1).
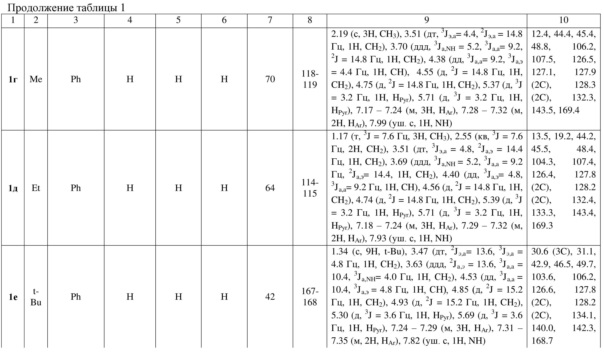
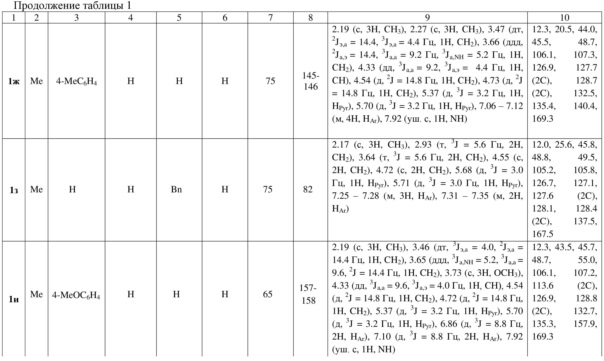
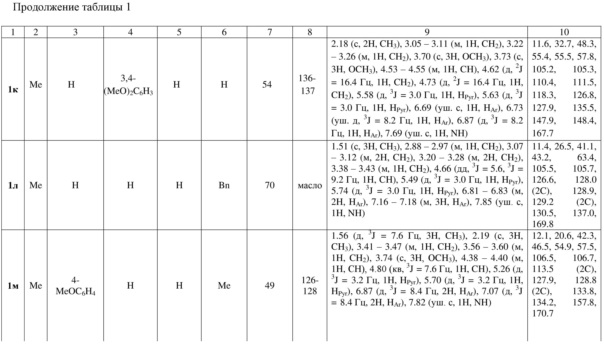
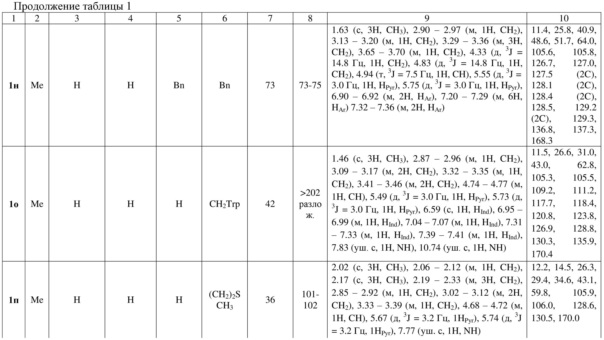
Примеры осуществления заявляемого способа получения 5-бензил-7-метил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5Н)-она (1л):
Пример 1.
К раствору аминокислоты 3л (3.0 ммоль, 796 мг) в абсолютном 1,2-дихлорэтане (7 мл) добавляют 2-(5-метилфуран-2-ил)этиламин 2л (3.1 ммоль, 0.394 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (3.3 ммоль, 633 мг) и N-метилморфолин (3.3 ммоль, 0.363 мл). Реакционную смесь кипятят в течение 5 часов (ТСХ контроль). После окончания реакции растворитель упаривают досуха при пониженном давлении, к остатку добавляют AcOH (30.2 мл) и HCl (3.4 мл) с соотношением (9:1) соответственно и перемешивают при комнатной температуре в течение 17 часов (контроль ТСХ). Затем к раствору присыпают Na2CO3 (54.6 ммоль, 5789 мг) и кипятят в течение 15 минут. Растворитель упаривают досуха при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки Macherey-Nagel (фракция 40-63 мкм) элюент этилацетат – петролейный эфир 1:15 (постепенно увеличивая концентрацию этилацетата). Продукт получают в виде светлого масла. Выход 55% (419 мг).
Спектр 1Н ЯМР (400 МГц, ДМСО-d6), (δ, м. д. и КССВ, J, Гц): 1.51 (с, 3H, CH3), 2.88 – 2.97 (м, 1H, CH2), 3.07 – 3.12 (м, 2H, CH2), 3.20 – 3.28 (м, 2H, СH2), 3.38 – 3.43 (м, 1H, CH2), 4.66 (дд, 3J = 5.6, 3J = 9.2 Гц, 1H, CH), 5.49 (д, 3J = 3.0 Гц, 1H, HPyr), 5.74 (д, 3J = 3.0 Гц, 1H, HPyr), 6.81 – 6.83 (м, 2H, HAr), 7.16 – 7.18 (м, 3H, HAr), 7.85 (уш. с, 1H, NH). Спектр 13C ЯМР (ДМСО-d6), (δ, м. д.): 11.4, 26.5, 41.1, 43.2, 63.4, 105.5, 105.7, 126.6, 128.0 (2C), 128.9, 129.2 (2C), 130.5, 137.0, 169.8.
Пример 2.
К раствору аминокислоты 3л (3.0 ммоль, 796 мг) в абсолютном 1,2-дихлорэтане (7 мл) добавляют 2-(5-метилфуран-2-ил)этиламин 2л (3.1 ммоль, 0.394 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (3.3 ммоль, 633 мг) и N-метилморфолин (3.3 ммоль, 0.363 мл). Реакционную смесь кипятят в течение 5 часов (ТСХ контроль). После окончания реакции растворитель упаривают досуха при пониженном давлении, к остатку добавляют AcOH (30.2 мл) и HCl (3.4 мл) с соотношением (9:1) соответственно и перемешивают при комнатной температуре в течение 17 часов (контроль ТСХ). Затем к раствору присыпают Na2CO3 (54.6 ммоль, 5789 мг) и кипятят в течение 30 минут. Растворитель упаривают досуха при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки Macherey-Nagel (фракция 40-63 мкм) элюент этилацетат – петролейный эфир 1:15 (постепенно увеличивая концентрацию этилацетата). Продукт получают в виде светлого масла. Выход 70% (533 мг).
Пример 3.
К раствору аминокислоты 3л (3.0 ммоль, 796 мг) в абсолютном 1,2-дихлорэтане (7 мл) добавляют 2-(5-метилфуран-2-ил)этиламин 2л (3.1 ммоль, 0.394 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (3.3 ммоль, 633 мг) и N-метилморфолин (3.3 ммоль, 0.363 мл). Реакционную смесь кипятят в течение 5 часов (ТСХ контроль). После окончания реакции растворитель упаривают досуха при пониженном давлении, к остатку добавляют AcOH (30.2 мл) и HCl (3.4 мл) с соотношением (9:1) соответственно и перемешивают при комнатной температуре в течение 17 часов (контроль ТСХ). Затем к раствору присыпают Na2CO3 (54.6 ммоль, 5789 мг) и кипятят в течение 60 минут. Растворитель упаривают досуха при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки Macherey-Nagel (фракция 40-63 мкм) элюент этилацетат – петролейный эфир 1:15 (постепенно увеличивая концентрацию этилацетата). Продукт получают в виде светлого масла. Выход 32% (246 мг).
Пример 4.
К раствору аминокислоты 3л (3.0 ммоль, 796 мг) в абсолютном 1,2-дихлорэтане (7 мл) добавляют 2-(5-метилфуран-2-ил)этиламин 2л (3.1 ммоль, 0.394 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (3.3 ммоль, 633 мг) и N-метилморфолин (3.3 ммоль, 0.363 мл). Реакционную смесь кипятят в течение 5 часов (ТСХ контроль). После окончания реакции растворитель упаривают досуха при пониженном давлении, к остатку добавляют AcOH (30.2 мл) и HCl (3.4 мл) с соотношением (9:1) соответственно и перемешивают при комнатной температуре в течение 17 часов (контроль ТСХ). Затем к раствору присыпают Na2CO3 (54.6 ммоль, 5789 мг) и нагревают реакционную смесь при 80°С в течение 30 минут. Растворитель упаривают досуха при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки Macherey-Nagel (фракция 40-63 мкм) элюент этилацетат – петролейный эфир 1:15 (постепенно увеличивая концентрацию этилацетата). Продукт получают в виде светлого масла. Выход 58% (442 мг).
Пример 5.
К раствору аминокислоты 3л (3.0 ммоль, 796 мг) в абсолютном 1,2-дихлорэтане (7 мл) добавляют 2-(5-метилфуран-2-ил)этиламин 2л (3.1 ммоль, 0.394 мл), 1-этил-3-(3-диметиламинопропил)карбодиимид (3.3 ммоль, 633 мг) и N-метилморфолин (3.3 ммоль, 0.363 мл). Реакционную смесь кипятят в течение 5 часов (ТСХ контроль). После окончания реакции растворитель упаривают досуха при пониженном давлении, к остатку добавляют AcOH (30.2 мл) и HCl (3.4 мл) с соотношением (9:1) соответственно и перемешивают при комнатной температуре в течение 17 часов (контроль ТСХ). Затем к раствору присыпают Na2CO3 (54.6 ммоль, 5789 мг) и нагревают реакционную смесь при 80°С в течение 60 минут. Растворитель упаривают досуха при пониженном давлении. Целевой продукт выделяют методом колоночной хроматографии на силикагеле марки Macherey-Nagel (фракция 40-63 мкм) элюент этилацетат – петролейный эфир 1:15 (постепенно увеличивая концентрацию этилацетата). Продукт получают в виде светлого масла. Выход 49% (373 мг).
В таблице 2 приведены данные о влиянии времени и температуры заключительной стадии циклизации амино-1,4-дикетона на выход целевого 5-бензил-7-метил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5Н)-она (1л) (примеры 1-5).
Таблица 2 – Влияние времени и температуры заключительной стадии на выход 5-бензил-7-метил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5Н)-она (1л)
Как видно из таблицы 2, 5-бензил-7-метил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5Н)-он (1л) с наибольшим выходом был получен при кипячении раствора амино-1,4-дикетона в уксусной кислоте в течение 30 минут. Более длительное кипячение приводит к осмолению реакционной смеси, что сопровождается значительным снижением выхода целевого продукта 1л, а кратковременное кипячение приводит к неполной конверсии промежуточного амино-1,4-дикетона и, как следствие, выход продукта 1л снижается до 55%. Проведение реакции циклизации амино-1,4-дикетона при 80°С также не позволяет получить целевой продукт 1л с более высоким выходом. Таким образом, оптимальным условием проведения ключевой стадии циклизации амино-1,4-дикетона в синтезе 5-бензил-7-метил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5Н)-она является кипячение раствора амино-1,4-дикетона в уксусной кислоте в течение 30 минут, выход в данном случае составляет 70%.
Заявляемым способом (пример 2) получен ряд производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она 1a-р с выходами 36-75%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ 5-[(1H-ИНДОЛ-3-ИЛ)МЕТИЛ]-7-МЕТИЛ-2,3-ДИГИДРО-1H-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИН-4(5H)-ОНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2803571C1 |
| ПРИМЕНЕНИЕ 5-ИЗОПРОПИЛ-7-МЕТИЛ-2,3-ДИГИДРО-1H-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИН-4(5H)-ОНА В КАЧЕСТВЕ АНТИБАКТЕРИАЛЬНОГО СРЕДСТВА В ОТНОШЕНИИ ГРАМПОЛОЖИТЕЛЬНЫХ МИКРООРГАНИЗМОВ | 2022 |
|
RU2784439C1 |
| ПРИМЕНЕНИЕ 7-МЕТИЛ-5-[4-(ТРИФТОРМЕТИЛ)ФЕНИЛ]-1,2,4,5-ТЕТРАГИДРО-3H-ПИРРОЛО[1,2-a][1,4]ДИАЗЕПИН-3-ОНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2808981C1 |
| ПРИМЕНЕНИЕ 5-(4-МЕТОКСИФЕНИЛ)-7-МЕТИЛ-1,2,4,5-ТЕТРАГИДРО-3H-ПИРРОЛО[1,2-a][1,4]ДИАЗЕПИН-3-ОНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2810715C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 10-МЕТИЛ-6, 7-ДИГИДРО-5Н-ПИРРОЛО[1, 2-а][1, 5]БЕНЗОДИАЗЕПИНА | 2015 |
|
RU2603344C1 |
| ПРИМЕНЕНИЕ 4,6-ДИМЕТИЛ-1,2-ДИГИДРОПИРРОЛО[1,2-a]ПИРАЗИН-3(4H)-ОНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2806191C1 |
| ПРИМЕНЕНИЕ 10-МЕТИЛ-6,7-ДИГИДРО-5H-ПИРИДО[2,3-b]-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИНА В КАЧЕСТВЕ ПРОТИВОГРИБКОВОГО СРЕДСТВА В ОТНОШЕНИИ ДРОЖЖЕВЫХ ГРИБОВ | 2023 |
|
RU2803600C1 |
| ТРИЦИКЛИЧЕСКИЕ ДИАЗЕПИНОВЫЕ АНТАГОНИСТЫ ВАЗОПРЕССИНА И АНТАГОНИСТЫ ОКСИТОЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2126006C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИРРОЛО[1,2-а][1,4]ДИАЗЕПИНА | 2006 |
|
RU2323939C1 |
| Применение 10-метил-2-(трифторметил)-6,7-дигидро-5Н-бензо[b]пирроло[1,2-d][1,4]диазепина в качестве антибактериального средства в отношении грамположительных микроорганизмов | 2021 |
|
RU2771019C1 |
Изобретение относится к способу получения производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она формулы 1, которые могут найти применение как вещества, обладающие потенциальной биологической активностью широкого спектра действия. Технический результат: разработан новый способ получения производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она 1, основанный на одновременном формировании двух циклов пирролодиазепинового каркаса в результате последовательной обработки смеси альфа-аминокислот и 2-(фуран-2-ил)этиламинов 1-этил-3-(3-диметиламинопропил)карбодиимидом и N-метилморфолином при кипячении в 1,2-дихлорэтане, затем смесью соляной и уксусной кислот при комнатной температуре и дальнейшей циклизации по методу Пааля-Кнорра при кипячении в уксусной кислоте в течение 30 минут. Способ позволяет синтезировать производные 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она 1 с высокими выходами. 2 табл., 5 пр.
1
Способ получения производных 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-она общей формулы 1,
* Trp = (1H-индол-3-ил)метил.
характеризующийся тем, что целевые 7-алкил-2,3-дигидро-1Н-пирроло[1,2-d][1,4]диазепин-4(5H)-оны образуются в результате последовательной обработки смеси альфа-аминокислот и 2-(фуран-2-ил)этиламинов 1-этил-3-(3-диметиламинопропил)карбодиимидом и N-метилморфолином при кипячении в 1,2-дихлорэтане, затем смесью соляной и уксусной кислот при комнатной температуре и дальнейшей циклизации по реакции Пааля-Кнорра при кипячении в уксусной кислоте в течение 30 минут.
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,2-ДИГИДРОПИРРОЛО[1,2-a]ПИРАЗИН-3(4Н)-ОНА | 2012 |
|
RU2490271C1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| A | |||
| ShcherbininT | |||
| A | |||
| NevolinaA | |||
| V | |||
| Butin, Chemistry of Heterocyclic Compounds, 46, 12, 1542-1544, 12.03.2011. | |||
Авторы
Даты
2018-07-02—Публикация
2017-11-03—Подача