Изобретение относится к области органической химии - синтезу гетероциклических соединений, содержащих пирроло[1,2-а][1,4]диазепиновый фрагмент, аннелированный с ароматическим и гетероароматическим кольцом.
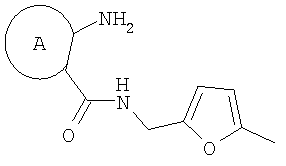
Изобретение относится к разработке способа получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1

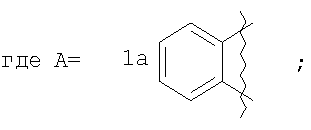


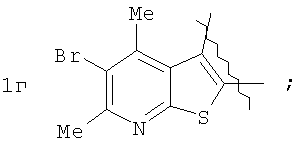

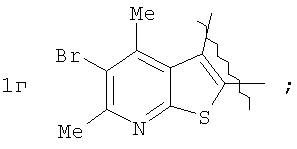
которые могут найти применение как вещества, обладающие потенциальной активностью в отношении ЦНС [Mai, A.; Di Santo, R.; Massa, S.; Artico, M.; Pantaleoni, G.C.; Giorgi, R.; Coppolino, M.F.; Barracchini, A. Eur. J. Med. Chem., 1995, 30, 593], проявляющие потенциальное анальгезирующее и антибактериальное [Ivashchenko, A.V.; Vvedensky, V.Yu.; Ilyn, A.P.; Kysel, V.M.; Khvat, A.V.; Kuzovkova, Yu.A.; Kutepov, S.A.; Dmitrieva, I.G.; Zolotarev, D.A.; Tkachenko, S.Ye.; Okun, I.M.; Kravchenko, D.V.; Kobak, V.V.; Trifilenkov, A.S.; Mishunina, Yu.S.; Loseva, M.V.; Rizhova, E.A.; Parchinsky, V.Z.; Tsirulnikov, S. A.; Kyselev, A.S. Pat. WO 2005105805 (2005)] и противогрибковое [Meerpoel, L.; Van Gestel, J.; Van Gerven, F.; Woestenborghs, F.; Marichal, P.; Sipido, V.; Gilkerson, Т.; Nash, R.; Corens, D.; Richards, R. D. Bioorg. Med. Chem. Lett, 2005, 75(14), 3453] действие.
В настоящее время среди существующих методов образования пирроло[1,2-а][1,4]диазепинового каркаса широко известен подход, в котором замыкание диазепинового цикла происходит при готовом пиррольном ядре. Производные пирролодиазепина синтезированы на основе 1-(2-аминометилфенил)-1Н-пиррола в условиях реакции Бишлера-Напиральского [Massa, S.; Di Santo, R.; Costi, R.; Artico, M. J. Heterocyclic Chem., 1993, 30, 749;], внутримолекулярным алкилированием пиррольного ядра N-ацилиминиевыми ионами [Othman, M; Pigeon, P.; Netchitailo, P.; Daich, A.; Decroix, B. Heterocycles, 2000, 52, 273;], в результате взаимодействия с карбонильными соединениями [Rault, I.; Rault, S.; Robba, M. Heterocycles, 1994, 38, 811].
Примером использования других производных 1-арилпиррола для получения пирролодиазепиновой системы является синтез пирроло[1,2-а][1,4]диазепинового фрагмента на основе бифункционального 1-(2-карбоксиарил)пирролкарбальдегида в условиях реакции Ugi [Ilyn, A.P.; Trifilenkov, A.S.; Kuzovkova, Ju. A.; Kutepov, S.A.; Nikitin, A.V.; Ivachtchenko, A.V. J. Org Chem. 2005, 70, 1478].
К основным недостаткам аналогов можно отнести применение труднодоступных реагентов, а также многостадийность процесса, что снижает суммарный выход целевого продукта. Кроме того, большинство известных методов пригодны для получения производных пирролодиазепина, аннелированных с бензольным кольцом, тогда как способы синтеза пирролодиазепинов, конденсированных с гетероциклическими системами, немногочисленны.
Наиболее близким к заявляемому среди известных методов синтеза является метод, в котором для формирования пирролодиазепиновой структуры используется производное фурана [Hara, Т.; Kayama, Y.; Mori, Т.; Itoh, К.; Fujimori, H.; Sunami, Т.; Hashimoto, Y.; Ishimoto, S. J. Med. Chem., 1978, 27(3), 263].

Ключевыми реакциями этой стратегии являются: а) образование пиррольного ядра как результат рециклизации производного фурана при взаимодействии промежуточных продуктов раскрытия фуранового кольца - тетрагидрофурана А или 1,4-дикетона В - с аминогруппой ароматического кетона и б) формирование диазепинового кольца в ходе внутримолекулярной циклизации продукта гидрогенолиза полученного фталимида С.
К существенным недостаткам этого метода можно отнести его многостадийность, поскольку метод включает последовательные стадии получения замещенных пирролов и их циклизации в пирролодиазепиновую структуру, и, как следствие, невысокие суммарные выходы конечных продуктов (25-38%).
Техническим результатом является обеспечение одновременного формирования пиррольного и диазепинового колец и повышение выхода конечных продуктов за счет уменьшения количества стадий процесса.
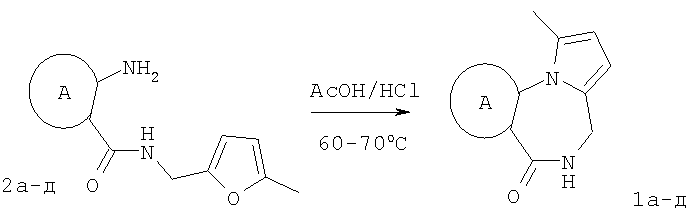
Технический результат достигается тем, что в способе получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1





5-метилфурфуриламид общей формулы 2, где А имеет указанные выше значения, выдерживают при температуре 60-70°С в смеси ледяной уксусной и концентрированной соляной кислот при объемном соотношении 1:0,15 в течение 10-15 мин.
Применение производных фурана для синтеза различных гетероциклов известно [Butin, A.V.; Stroganova, T.A.; Abaev, V.T; Gutnov, A.V. Targets in Heterocyclic systems: Chemistry and Properties, 2001, 5, 131], однако какие-либо сведения о внутримолекулярных рециклизациях фурановых соединений, приводящих к образованию пирролодиазепиновой системы, в литературе отсутствуют.
Отличием предлагаемого способа получения производных пирроло[1,2-а][1,4]диазепина (1) является использование в качестве исходного соединения производных 5-метилфурфуриламидов 2-аминобензойных или 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот, фурановый цикл которых выступает в роли скрытого 1,4-дикарбонильного соединения, участвующего в образовании двух гетероциклических колец - диазепинового и пиррольного.

Выбор в качестве растворителя уксусной кислоты объясняется хорошей растворимостью в ней исходных веществ, что позволяет добиться полной конверсии исходных фурфуриламидов в производные пирроло[1,2-а][1,4]диазепина в течение непродолжительного времени и тем самым за счет сокращения длительности реакции избежать сильного осмоления реакционной массы и повысить суммарный выход целевых продуктов.
На основании полученных экспериментальных данных установлено, что оптимальным является проведение реакции при 60-70°С, поскольку в этом случае выходы производных пирроло[1,2-а][1,4]-диазепина достигают 47-65%, а длительность процесса составляет 10-15 мин.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
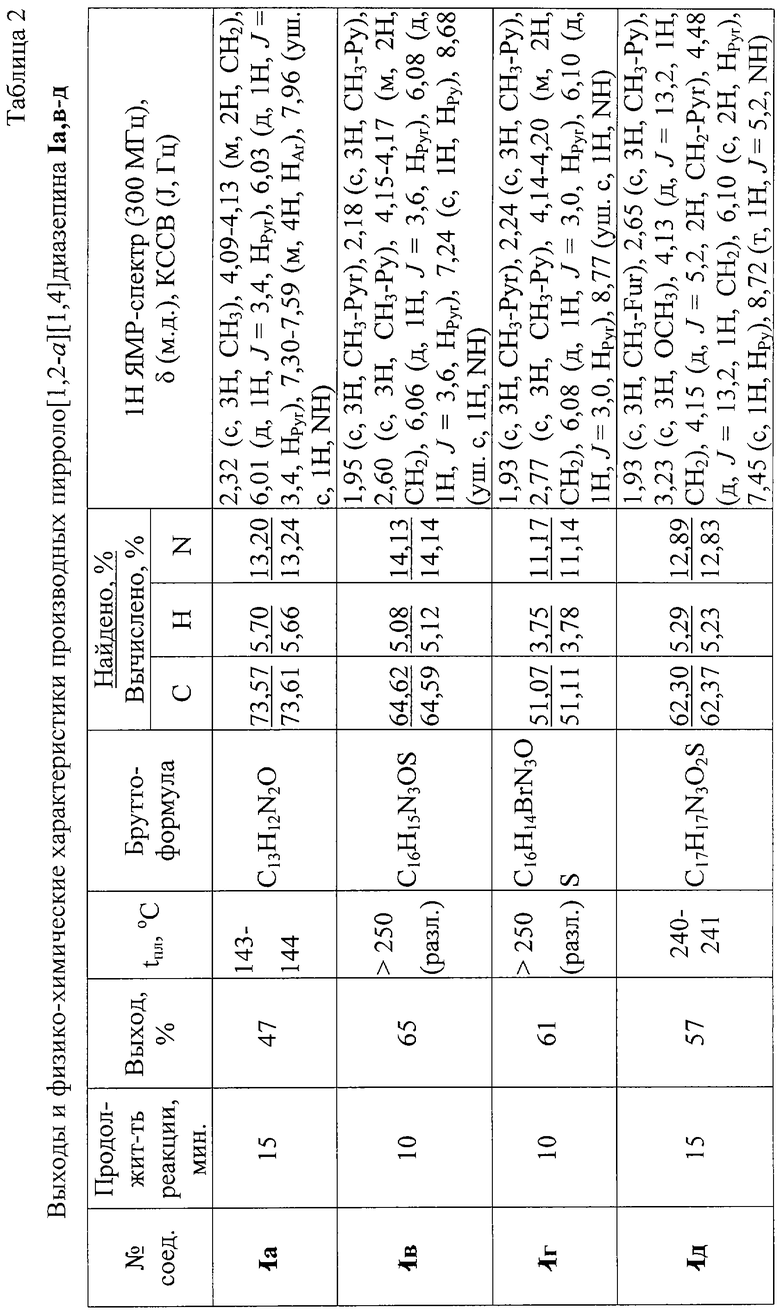
Индивидуальность и строение синтезированных соединений 1 подтверждены данными 1Н ЯМР-спектроскопии и элементного анализа.
Ниже приведены примеры осуществления заявляемого способа получения производных пирроло[1,2-а][1,4]диазепина (1).
Исходные фурфуриламиды бензойных кислот получены последовательным ацилированием 5-метилфурфуриламина хлорангидридами 2-нитробензойных кислот и восстановлением продуктов ацилирования гидразин гидратом в присутствии никеля Ренея по методикам, аналогичным приведенным в [Титце Л., Айхер Т. Препаративная органическая химия: Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории: Пер. с нем. - М.: Мир, 2004. - 704 с]. 5-Метилфурфуриламиды 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот синтезированы с выходами 80-87% реакцией пиридинтионов с 5-метилфурфуриламидом хлоруксусной кислоты в условиях реакции Торпа-Циглера по методу, аналогичному представленному в работе [Кайгородова Е.А., Конюшкин Л.Д., Михайличенко С.Н., Василин В.К., Кульневич В.Г., Химия гетероцикл. соедин., 1996, 10, 1432].
Физико-химические характеристики фурфуриламидов бензойных и 3-аминотиено[2,3-b]пиридин-2-карбоновых кислот приведены в таблице 1.
°С
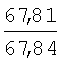
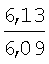


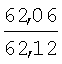
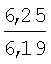



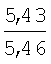


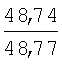
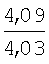

°С

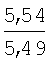

Пример 1.
8,9-Диметокси-1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-а][1,4]-диазепин-6-он (1б)
Смесь N-(5-метилфурфурил)амида 2-амино-4,5-диметоксибензойной кислоты (2 ммоль), ледяной уксусной кислоты (10 мл) и конц. соляной кислоты (1,5 мл) выдерживают при температуре 40-50°С 40 мин до полного расходования исходного вещества (контроль ТСХ). После окончания реакции реакционную смесь выливают в ледяную воду (100 мл), нейтрализуют NaHCO3 до рН˜7. Выпавший кристаллический осадок отделяют фильтрацией, сушат на воздухе. Горячий раствор полученного продукта в смеси этилацетат/петролейный эфир (в объемном соотношении 4:1) пропускают через слой силикагеля и оставляют для кристаллизации, получая соединение 1б в виде прозрачных бесцветных кристаллов с выходом 42%. Тпл. 195-196°С. 1Н NMR (300 MHz, CDCl3): δ=2,34 (с, 3Н, СН3), 3,93 (с, 3Н, ОСН3), 3,96 (с, 3Н, ОСН3), 4,18-4,13 (м, 2Н, СН2), 5,99 (д, 1H, J=3,2, НPyr), 6,22 (д, 1H, J=3,2, НPyr), 6,77 (с, 1Н, 3-НAr), 7,01 (уш.с, 1H, NH), 7,44 (с, 1Н, 6-НAr).
Вычислено для C15Hi6N2O3: С 66,16, Н 5,92, N 10,29.
Найдено: С 66,10, Н 5,99, N 10,23.
Пример 2.
8,9-Диметокси-1-метил-5,6-дигидро-4H-бензо[f]пирроло[1,2-a][1,4]-диазепин-6-он (1б) получают аналогично, проводя реакцию при температуре 60-70°С. Длительность реакции в этом случае составляет 15 мин (контроль ТСХ), выход продукта реакции 53%.
Пример 3.
8,9-Диметокси-1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-а][1,4]-диазепин-6-он (1б) получают аналогично, проводя реакцию при температуре 80-90°С. Продолжительность реакции составляет 10 мин (контроль ТСХ), выход продукта реакции 48%.
Пример 4.
8,9-Диметокси-1-метил-5,6-дигидро-4Н-бензо[а]пирроло[1,2-а][1,4]-диазепин-6-он (1б) получают аналогично, проводя реакцию при кипячении реакционной смеси. Продолжительность реакции составляет 5 мин (контроль ТСХ), выход продукта реакции 40%.
Как следует из приведенных примеров, понижение температуры реакции вызывает увеличение продолжительности процесса, что приводит к большему осмолению реакционной смеси и, как следствие, к снижению выхода целевого продукта. Сильное осмоление и уменьшение выхода пирролодиазепина наблюдались также при попытке рециклизации 5-метилфурфуриламида 2-аминовератровой кислоты при 80-90°С (Пример 3) и при кипячении реакционной смеси (Пример 4). Таким образом, оптимальным вариантом является проведение реакции при 60-70°С, поскольку в этом случае выход 8,9-диметокси-1-метил-5,6-дигидро-4Н-бензо[f]пирроло[1,2-а][1,4]-диазепин-6-она (1б) достигает 53%, а длительность процесса составляет 15 мин.
Заявляемым способом получен ряд производных пирроло[1,2-a][1,4]диазепина (1a, в-д), для которых в таблице 2 приведены длительность реакции, выходы, температуры плавления и спектральные характеристики.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,6-ДИГИДРО-7Н-ПИРРОЛО[1,2-d][1,4] БЕНЗОДИАЗЕПИН-6-ОНА | 2011 |
|
RU2455289C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,2-ДИГИДРОПИРРОЛО[1,2-a]ПИРАЗИН-3(4Н)-ОНА | 2012 |
|
RU2490271C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5,6-ДИГИДРО-4H-БЕНЗО[f]ПИРРОЛО[1,2-α][1,4]ДИАЗЕПИН-6-ОНА | 2010 |
|
RU2425037C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 10-МЕТИЛ-6, 7-ДИГИДРО-5Н-ПИРРОЛО[1, 2-а][1, 5]БЕНЗОДИАЗЕПИНА | 2015 |
|
RU2603344C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3,5-ДИГИДРО-1,11-ДИМЕТИЛФУРО[2`,3`:3,4]ЦИКЛОГЕПТА[C]ИЗОХИНОЛИН-5-ОНА | 2005 |
|
RU2282632C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-МЕТИЛ-5-(5-МЕТИЛ-2-ФУРИЛ)-4,10-ДИГИДРО-3H-ПИРИДАЗИНО[1,6-b]ИЗОХИНОЛИН-10-ОНА (ВАРИАНТЫ) | 2006 |
|
RU2310653C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ДИАЛКИЛАМИНОПИРРОЛО[1,2-АЛЬФА][1,4]БЕНЗОДИАЗЕПИНА | 2012 |
|
RU2518102C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 7-АЛКИЛ-2,3-ДИГИДРО-1Н-ПИРРОЛО[1,2-d][1,4]ДИАЗЕПИН-4(5Н)-ОНА | 2017 |
|
RU2659390C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,11-ДИАЛКИЛ-3,5-ДИГИДРОФУРО[2',3':3,4]ЦИКЛОГЕПТА[C]ИЗОХРОМЕНОВ | 2005 |
|
RU2282633C9 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-АЦЕТИЛ-4-ГИДРОКСИ-2-МЕТИЛ-5-(5-МЕТИЛФУР-2-ИЛ)-1Н-БЕНЗО[g]ИНДОЛА | 2008 |
|
RU2368611C9 |
Изобретение относится к области органической химии - синтезу гетероциклических соединений, содержащих пирроло[1,2-а][1,4]диазепиновый фрагмент, аннелированный с ароматическим и гетероароматическим кольцом. Описывается способ получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1

где А=
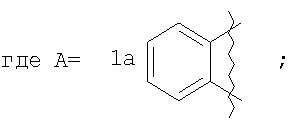




которые могут найти применение как вещества, обладающие потенциальной активностью в отношении ЦНС, проявляющие потенциальное анальгезирующее, антибактериальное и противогрибковое действие.
Способ заключается в рециклизации фуранового кольца 5-метил-фурфуриламидов общей формулы 2,

где А имеет указанные выше значения, при выдерживании при температуре 60-70°С в смеси ледяной уксусной и концентрированной соляной кислот при объемном соотношении 1:0,15 в течение 10-15 минут. Это позволяет обеспечить одновременное формирование пиррольного и диазепинового колец и повысить выходы конечных продуктов за счет уменьшения количества стадий процесса. 2 табл.
Способ получения производных пирроло[1,2-а][1,4]диазепина общей формулы 1

А=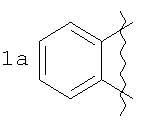




заключающийся в том, что 5-метилфурфуриламид общей формулы 2

где А имеет указанные выше значения, выдерживают при температуре 60-70°С в смеси ледяной уксусной и концентрированной соляной кислот при объемном соотношении 1:0,15 в течение 10-15 мин.
| Hara Т., Kayama Y, Mori at all | |||
| J | |||
| Med | |||
| Chemistry, 1978, 21 (3) p.263 | |||
| Jlyn A.P., Trifilenkov A.S., Kuzovkova Ju | |||
| A | |||
| at al | |||
| J | |||
| Org | |||
| Chemistry, 2005, 70, 1478 | |||
| ТРИЦИКЛИЧЕСКИЕ ДИАЗЕПИНОВЫЕ АНТАГОНИСТЫ ВАЗОПРЕССИНА И АНТАГОНИСТЫ ОКСИТОЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1994 |
|
RU2126006C1 |
Авторы
Даты
2008-05-10—Публикация
2006-10-16—Подача