Настоящее изобретение относится к способам обнаружения заражения млекопитающих туберкулезными микобактериями (Mycobacterium tuberculosis) in vitro и к способам различения in vitro млекопитающих, инфицированных Mycobacterium tuberculosis, у которых заболевание явно выражено (активная форма), и инфицированных млекопитающих, которые не имеют симптомов туберкулеза (латентная форма), а также к способу различения in vitro млекопитающих с активной формой туберкулеза и млекопитающих, не инфицированных М. tuberculosis или имеющих латентную форму туберкулеза.
Настоящее изобретение также относится к наборам для обнаружения и распознавания инфицированных млекопитающих с выраженными симптомами туберкулеза по сравнению с инфицированными млекопитающими, у которых заболевание еще не развилось, и к набору для распознавания млекопитающих, имеющих активную форму туберкулеза, по сравнению с млекопитающими, не инфицированными М. tuberculosis или имеющими туберкулез в латентной форме.
Туберкулез (ТВ) представляет собой бактериальное заболевание, которое поражает главным образом легкие (туберкулез легких); также могут быть поражены другие части тела, в частности лимфатические узлы, плевра (плевральная полость), суставы, кости, мочеполовая система, оболочка мозга, брюшина, желудочно-кишечный тракт, центральная нервная система, надпочечные железы или околосердечная сумка (внелегочная форма туберкулеза).
Туберкулез передается воздушным путем, посредством контакта с бактериями, находящимися в слюне и легочной мокроте млекопитающего - носителя заболевания (например, при кашле или чихании), или путем контакта с поврежденными тканями. Симптомами туберкулеза являются лихорадка, ночное потоотделение, утомляемость, потеря веса, потеря аппетита и постоянный кашель.
В 2004 году туберкулез все еще представлял значительную проблему для здравоохранения, поскольку более двух миллионов летальных исходов в мире было результатом заболевания туберкулезом, и треть населения в мире заражена возбудителем туберкулеза, Mycobacterium tuberculosis, известным в повседневной жизни как бацилла Коха или KB (Koch's bacillus, KB). Таким образом, туберкулез является второй по значимости причиной смертности от инфекционных заболеваний, сразу после инфекции, вызванной вирусом иммунодефицита человека (1). По этой причине, наряду с Всемирной организацией здравоохранения, Европейское сообщество также считает исследования в этой области приоритетными.
Были определены три главные задачи:
а) предупреждение заболевания путем создания вакцины, которая обеспечит лучшую защиту, чем существующая в настоящее время вакцина, BCG (Bacillus of Calmette and Guerin, бацилла Кальмета-Герена);
б) улучшение средств быстрого диагностирования заболевания туберкулезом; и
в) обнаружение более быстрых способов лечения, которые облегчают назначение лекарств и, таким образом, позволяют избежать возникновения штаммов бактерий с множественной устойчивостью.
Неудовлетворительное обнаружение новых случаев заболевания туберкулезом считают главной причиной увеличения числа случаев заболевания туберкулезом в мире (2). Исследование под микроскопом и выращивание бактерий из мокроты признаны в качестве двух надежных путей диагностики легочного туберкулеза. Однако результаты выращивания культуры микобактерий могут быть интерпретированы только после 6-8 недель, и развивающиеся страны не всегда имеют доступ к инфраструктуре, которая требуется для такой методики, что существенно ограничивает полезность культивирования в качестве первостепенного диагностического теста (3). Обнаружение кислотоустойчивых бацилл в мокроте, таким образом, остается наиболее практичным тестом для быстрого диагностирования легочного туберкулеза, но идентификация, к сожалению, является положительной только в 50%-60% случаев легочного туберкулеза отчасти из-за того, что фактически необходимо 5000-10000 бацилл на мкл мокроты для того, чтобы тест дал положительный результат (3). Диагностирование легочного туберкулеза является еще более трудным у детей, которые, в силу своего возраста, редко отхаркивают мокроту и у которых обычно собирают желудочный сок. Однако прямое исследование таких проб является положительным менее чем у 20% детей, у которых доказано наличие туберкулеза, что гораздо ниже, чем результаты, полученные у взрослых (4). Наконец, диагностирование внелегочной формы туберкулеза, который встречается гораздо чаще у детей, чем у взрослых, до сих пор является трудной задачей. Оно часто базируется, главным образом, на анатомо-патологическом исследовании биопсий. Обычным гистологическим признаком наличия туберкулеза является присутствие гранулем совместно с казеозным некрозом. Гранулема образуется из гистоцитов, эпителиальных клеток и/или гигантских клеток типа клеток Лангерганса. Тем не менее, как образцы из лимфатических ганглий, так и легочные образцы при постановке диагноза могут быть интерпретированы, как соответствующие инфекционным (вызванным не туберкулезными микобактериями, грибковой природы, и т.д.) или не инфекционным заболеваниям (саркоидоз, гранулематоз Вегенера и т.д.) (5). Чтобы подтвердить туберкулез в качестве диагноза, должно быть проведено гистологическое исследование с помощью применения специальных красителей, в частности с помощью окрашивания по методу Циля-Нильсена, при котором используют спирто-кислотоустойчивые свойства туберкулезных микобактерий. Тем не менее, чтобы получить положительный результат при окрашивании по методу Циля-Нильсена, содержание микроорганизмов должно составлять 106 на миллиметр ткани (6).
В конечном итоге, диагноз до сих пор часто основан на наборе клинических или радиологических данных и на результатах тестирования кожи на гиперчувствительность замедленного типа к туберкулину (очищенные производные протеина, (очищенное производное белка, purified protein derivative, PPD)). Однако указанный тест не позволяет легко различать лиц, зараженных Mycobacterium tuberculosis, и тех, которые вакцинированы BCG, а перекрестные реакции с микобактериями окружающей среды делают его специфичность недостаточной. Такой тест, который базируется на проявлении клеточного иммунитета, также имеет малую чувствительность у лиц с иммунодефицитом. В конечном итоге, хотя указанный тест позволяет идентифицировать лиц, инфицированных Mycobacterium tuberculosis среди не вакцинированного населения, он, к сожалению, не помогает дифференцировать лиц, имеющих скрытую форму туберкулеза (бессимптомную), от лиц с активной формой заболевания. Фактически только у 5%-10% лиц, инфицированных Mycobacterium tuberculosis, болезнь развивается, в то время как остальные, даже будучи инфицированными, защищены от заболевания (7). Таким образом, применение на практике указанного теста чрезвычайно ограничено.
Совсем недавно появились молекулярно-биологические методы обнаружения наличия Mycobacterium tuberculosis с использованием способа ПЦР (полимеразная цепная реакция). Такие способы являются чувствительными (95%), но в особенности это справедливо для образцов мокроты, для которых прямое исследование дает положительный результат. В отличие от других методик, данный способ имеет высокую специфичность (98%), которая позволяет отличить Mycobacterium tuberculosis от других микобактерий. Однако способ является дорогим, что ограничивает его применение.
Таким образом, разработка новых способов быстрого диагностирования туберкулеза является делом крайней необходимости. Один из возможных подходов состоит в использовании различий между иммунными реакциями, которые могут существовать между неинфицированными пациентами и инфицированными лицами в зависимости от того, имеют они или нет активную форму заболевания. Различные тесты, которые основаны на изучении индуцированной с помощью микобактериальных антигенов секреции IFN-γ в циркулирующих лимфоцитах, уже были описаны в литературе (8). Анализ секреции IFN-γ, индуцированной с помощью туберкулина, сложной смеси микобактериальных антигенов, тем не менее, имеет те же ограничения, что и при использовании для кожного теста. Фактически, будут реагировать все сенсибилизированные лица как имеющие, так и не имеющие заболевание и лица, сенсибилизированные к антигенам, присутствующим в некоторых атипичных микобактериях, или в BCG. Преимущество этого теста по сравнению с кожным тестированием заключается в том, что анализ реакции лимфоцитов параллельно с положительным контролем (фитогемагглютинина) позволяет обнаружить пациентов, которые не реагируют на PPD по причине острого иммунодефицита. Позднее были изолированы специфичные антигены для Mycobacterium tuberculosis, которые использовали при тестах по секреции IFN-γ in vitro, и специфичность указанного тестирования была, очевидно, гораздо лучшей. По существу, можно использовать антигены ESAT-6 и CFPIO, однако следует указать, что дифференциация, получаемая с помощью этих антигенов, между больными или здоровыми, но инфицированными пациентами все еще далека от совершенства (9).
Исследование иммунных реакций у человека в отношении "связывающего гепарин гемагглютина" (heparin binding haemagglutin, HBHA) показывает превосходные возможности различения больных, и здоровых, и инфицированных индивидуумов. HBHA представляет собой адгезивную молекулу, которая экспрессируется на поверхности бактерий и входит в состав микобактериального комплекса, но не на поверхности непатогенных бактерий, в частности М. smegmatis (10). Этот белок секретирует Mycobacterium tuberculosis, и он отвечает за распространение инфекции (11). HBHA имеет метилированную С-концевую область, которая экспонирована на поверхности клетки, в то время как неметилированная N-концевая область заякорена в клеточной стенке микобактерии (12). Метилирование важно не только для стимулирования иммунных реакций у человека, но также для стимулирования защитной иммунной реакции у мышей (13). Было показано, что индуцированная секреция IFN-γ в циркулирующих лимфоцитах путем стимуляции HBHA in vitro отличается в зависимости от того, имели ли лица, инфицированные туберкулезными микобактериями, выраженную форму заболевания, или нет (14). В то время как IFN-γ выделяется периферическими лимфоцитами у большинства здоровых пациентов в ответ на HBHA, только небольшое количество туберкулезных пациентов реагируют на этот антиген путем выделения IFN-γ. Однако различия между этими двумя группами лиц на основе этих предварительных результатов оказались недостаточными для проведения диагностического теста.
Задачей настоящего изобретения является обеспечение способов обнаружения у млекопитающих инфекции Mycobacterium tuberculosis in vitro.
Задачей настоящего изобретения также является обеспечение способов различения in vitro млекопитающих, инфицированных туберкулезными микобактериями, у которых заболевание выражено, и инфицированных млекопитающих, у которых туберкулез не развился, способа идентификации in vitro пациентов с латентной формой ТВ среди здорового населения и способа различения in vitro млекопитающих с активной формой туберкулеза, в отличие от млекопитающих, не инфицированных Mycobacterium tuberculosis или имеющих латентную форму туберкулеза.
Кроме этого, задачей настоящего изобретения является обеспечение наборов, которые включают все компоненты, необходимые для определения инфекции, вызванной Mycobacterium tuberculosis, и с помощью которых можно отличить инфицированных пациентов, у которых заболевание выражено (активная форма туберкулеза), и инфицированных пациентов, у которых заболевание протекает без симптомов (латентная форма туберкулеза), и набор для различения млекопитающих с активной формой туберкулеза, и млекопитающих, не инфицированных Mycobacterium tuberculosis или имеющих латентную форму туберкулеза.
Настоящее изобретение также относится к применению НВНА в его нативной или рекомбинантной форме в тесте для определения инфекции Mycobacterium tuberculosis и для различения пациентов, которые имеют латентную форму туберкулеза и пациентов, у которых присутствуют все симптомы туберкулеза и развилось заболевание.
Настоящее изобретение направлено на решение этих и других задачи, как станет понятно из последующего краткого описания и подробного описания с предпочтительными примерами реализации настоящего изобретения, а также из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение описывает способ обнаружения и различения in vitro млекопитающего, которое имеет латентную форму туберкулеза, и млекопитающего с активной формой туберкулеза, при этом указанный способ включает: а) получение биологического образца от указанного млекопитающего; б) измерение количества антител (IgG), направленных против двух различных форм белка НВНА, которые присутствуют в указанном биологическом образце; и в) сравнение титров антител, полученных для двух указанных форм белка НВНА, при этом относительные количества антител против указанных двух различных форм у млекопитающего, которое имеет латентную форму туберкулеза, отличаются от указанного относительного количества у млекопитающего, которое имеет активную форму туберкулеза.
Настоящее изобретение также охватывает набор для обнаружения и различения млекопитающего с латентной формой туберкулеза и млекопитающего с активной формой туберкулеза, причем указанный набор содержит
две различные формы НВНА, выбранные из группы, включающей: а) нативный НВНА и рекомбинантный НВНА, или б) rНВНАΔС - фрагмент и метилированный С-концевой фрагмент НВНА;
реагенты, требуемые для создания среды для осуществления иммунологической реакции между содержащимися в биологическом образце антителами от упомянутого млекопитающего и указанными различными формами НВНА, и
реагенты, позволяющие обнаружить иммунологические комплексы, образующиеся в ходе указанной иммунологической реакции.
Настоящее изобретение также относится к способу обнаружения и различения in vitro млекопитающего с латентной формой туберкулеза и млекопитающего с активной формой туберкулеза, или идентификации млекопитающего, которое имеет латентную форму туберкулеза среди здоровой популяции, при этом указанный способ включает:
а) получение биологического образца от указанного млекопитающего;
б) приведение указанного биологического образца независимым образом в контакт с нативной формой НВНА и ESAT-6;
в) измерение величины НВНА-специфической секреции IFN-γ и ESAT-6 - специфической секреции IFN-γ; и
г) расчет отношения между величиной НВНА-специфической секреции IFN-γ и величиной ESAT-6 - специфической секреции IFN-γ, при котором указанное отношение, полученное для млекопитающего с латентной формой туберкулеза, больше, чем указанное отношение, полученное для млекопитающего с активной формой туберкулеза, или полученное для млекопитающего, не инфицированного Mycobacterium tuberculosis.
Настоящее изобретение также относится к набору для обнаружения и различения млекопитающего, которое имеет латентную форму туберкулеза, и млекопитающего с активной формой туберкулеза, или для идентификации млекопитающего с латентной формой туберкулеза среди здоровой популяции, причем указанный набор содержит
нативную форму НВНА и ESAT-6,
реагенты, требуемые для создания среды для осуществления независимым образом взаимодействия клеток биологического образца от упомянутого млекопитающего с нативным НВНА и ESAT-6, и
реагенты для обнаружения секреции IFN-γ, следующей за указанным взаимодействием.
Настоящее изобретение также относится к способу обнаружения и различения in vitro млекопитающего с активной формой туберкулеза и млекопитающего, не инфицированного Mycobacterium tuberculosis, или млекопитающего, которое имеет скрытую (латентную) форму туберкулеза; при этом указанный способ включает:
а) получение биологического образца из очага локальной инфекции указанного млекопитающего;
б) приведение в контакт упомянутого биологического образца с нативной или рекомбинантной формой НВНА; и
в) измерение влияния указанного контакта на НВНА-специфическую секрецию IFN-γ, при котором влияние на НВНА-специфическую секрецию IFN-γ больше у млекопитающих с активной формой туберкулеза по сравнению с млекопитающим, которое не инфицировано Mycobacterium tuberculosis, или млекопитающим, которое имеет латентную форму туберкулеза.
В настоящем изобретении также описан набор для обнаружения и различения млекопитающего с активной формой туберкулеза и млекопитающего, не инфицированного Mycobacterium tuberculosis или имеющего латентную форму туберкулеза, причем указанный набор содержит
нативную или рекомбинантную форму НВНА,
реагенты, требуемые для создания подходящей среды для осуществления взаимодействия клеток биологического образца от указанного млекопитающего с НВНА, и
реагенты, которые позволяют обнаружить IFN-γ после указанного взаимодействия.
ПОДРОБНОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показано содержание (титр) НВНА-специфического IgG у пациентов, больных туберкулезом (ТВ), и у лиц с латентной формой туберкулеза (PI). Прямоугольники показывают 25-й и 75-й процентили. Вертикальные линии показывают максимальные значения. Между указанными двумя популяциями не наблюдается существенных различий (р>0.05).
На Фигурах 2(А,Б) показаны для сравнения титр nНВНА-специфического IgG и rНВНА-специфического IgG у пациентов, больных туберкулезом (ТВ), и у лиц со скрытой (латентной) формой туберкулеза (PI).
Фигура 2А иллюстрирует, что у пациентов со скрытой формой туберкулеза IgG распознает нативную метилированную форму НВНА лучше, чем рекомбинантную форму (rНВНА) (р=0,0015), в то время как у пациентов, больных туберкулезом (Фигура 2Б), это различие незначительно (р>0.05).
Фигуры 3(А,Б) показывают титр rНВНАΔС-специфического IgG в сравнении с титром IgG, специфичного к С-концевому фрагменту НВНА (С-пептиду у пациентов, больных туберкулезом (ТВ), и у пациентов с латентной формой туберкулеза (PI)).
На Фигуре 3А показано, что туберкулезные пациенты имеют IgG, который предпочтительно распознает усеченную рекомбинантную форму (rНВНАΔС), в то время как IgG пациентов с латентной формой туберкулеза практически не распознает эту форму (р=0.0052). В противоположность этому, на Фигуре 3Б, IgG у туберкулезных больных не распознает С-пептидный фрагмент в отличие от пациентов с латентной формой туберкулеза (р=0.0478).
На Фигуре 4 показана секреция IFN-γ в ответ на nНВНА у контрольных пациентов (ctrl; n=12), у пациентов с непродолжительной латентной формой туберкулеза (<5 лет) (PI; n=38) и у туберкулезных больных (ТВ; n=46). Значения медиан соответственно составляют 10 пг/мл, 2040 пг/мл и 16 пг/мл.** р<0.001.
На Фигуре 5 показана секреция IFN-γ в ответ на ESAT-6 у пациентов с латентной формой туберкулеза (PI) и туберкулезных пациентов (ТВ). У пациентов с латентной формой туберкулеза уровень специфической ESAT-6-индуцированной секреции IFN-γ существенно ниже, чем у туберкулезных пациентов. Значения медиан составляют 42.50 пг/мл IFN-γ для ESAT-6 у РI-пациентов и 4072 пг/мл IFN-γ у ТВ-пациентов (р=0.02).
На Фигуре 6 представлены значения отношения nHBHA/ESAT-6 у больных туберкулезом пациентов и у пациентов с латентной формой туберкулеза. Значения медиан соответственно составляют 0.1 пг/мл и 146.2 пг/мл. Это отношение значительно отличается у пациентов с латентной формой туберкулеза (р=0.001) и представляет хороший критерий различения инфицированных пациентов с развившейся болезнью и инфицированных, но не больных пациентов (без наличия симптомов).
На Фигуре 7 показано влияние блокирующих антител против трансформирующего фактора роста бета-1, -2, -3 (transforming growth factor beta, TGFβ), на секрецию IFN-γ в ответ на nНВНА мононуклеарами периферической крови (peripheral blood mononuclear cells, PBMC) у больных туберкулезом пациентов. IFN-γ анализировали в супернатанте культуральной среды. Парный тест (Вилкоксон - р=0.0161; n=15 пар).
На Фигуре 8 показано сравнение между секрецией IFN-γ в ответ на nНВНА и на PPD мононуклеарами плевральной жидкости, отобранной у пациентов с плевральным выпотом туберкулезного или иного происхождения. IFN-γ анализировали в супернатанте среды для культивирования. Горизонтальные линии показывают средние значения.
Фигура 9 иллюстрирует то, что количество CD3+CD4+ Т лимфоцитов из PBMC (PBMC nНВНА) по сравнению с количеством плевральных CD3+CD4+ Т лимфоцитов (лимфо-плевральный nНВНА) и которые содержат внутрицитоплазмический IFN-γ, как следствие действия nНВНА, выраженное в процентах от клеток, вырабатывающих IFN-γ, после стимуляции НВНА в течение 16 часов, меньше, чем процент клеток, вырабатывающих IFN-γ без стимуляции НВНА у больных туберкулезом пациентов (n=7). Значения соответственно равны 0.04% и 1.23% (р=0.0156; Вилкоксон).
На Фигуре 10 представлены относительные количества CD3+CD4+ Т лимфоцитов, которые содержат внутрицитоплазмический IFN-γ после воздействия nНВНА в случае плеврального туберкулеза (n=7; медиана = 1.23%) и в случае плевральных выпотов нетуберкулезного происхождения (n=2; медиана = 0.18%).
На Фигурах 11(А,Б) показаны относительные количества CD3+CD4+ (Фигура 11А) и CD3+CD8+ (Фигура 11Б) Т лимфоцитов, содержащих внутрицитоплазматический IFN-γ в ответ на стимуляцию с помощью nНВНА.
На Фигуре показаны количества альвеолярных лимфатических клеток (альвеолы) из жидкости бронхо-альвеолярного лаважа или мононуклеаров периферической крови (кровь). Жидкость бронхо-альвеолярного лаважа получали или от пациентов с легочным туберкулезом (ТВ) или от контрольных пациентов с легочным поражением нетуберкулезного происхождения.
На Фигуре 12 показаны кривые ROC, которые позволяют различать пациентов с латентной формой ТВ и лиц из контрольной группы от nНВНА-специфической секрецией IFN-γ - (А), различать пациентов с латентной формой ТВ и активной формой ТВ от nНВНА-специфической секреции IFN-γ (Б) и различать латентную форму ТВ и активную форму ТВ от PPD-специфической секреции IFN-γ (В).
В отношении чертежей, описанных выше:
NS означает, что различия незначительны,
* означает, что различия значительны в диапазоне 0.01<р<0.05, и
** означает, что различия весьма значительны с р<0.01.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ СПОСОБОВ РЕАЛИЗАЦИИ
Используемый в контексте настоящего изобретения термин "млекопитающее" обозначает любых теплокровных животных, имеющих волосяной покров или покрытых шерстью, которые выкармливают грудью своих детенышей и вынашивают живых детенышей. Термин "млекопитающее" БЕЗ ОГРАНИЧЕНИЯ включает человека, слонов, свиней, собак, кошек, крупный рогатый скот, оленей, обезьян и т.д.
Хотя Mycobacterium tuberculosis инфицируют главным образом организм человека, другие млекопитающие могут быть также поражены этим бактериальным заболеванием. Случаи заражения туберкулезом млекопитающего, отличного от человека, известны под названием "обратный зооноз", т.к. Mycobacterium tuberculosis может передаваться от человека к животному.
Аббревиатура "НВНА" означает "heparin binding haemagglutinin ahesin, адгезин гемагглютинина, связывающий гепарин" и представляет собой поверхностный белок, участвующий в процессе адгезии с эпителиальными клетками (номера в базе Genbank AF074390 и ААС26052.1). Идентификация НВНА - протеина в его нативной форме - была описана Menzozzi et al. (J Exp Med 184; 993-1001 (1996)). НВНА представляет собой 199 аминокислотный белок, С-концевая часть которого обогащена лизином и содержит участок связывания гепарина. Этот белок требуется при внелегочной диссеминации Mycobacterium tuberculosis (Pethe et al., Nature 412: 190-194 (2001)).
Рекомбинантная форма НВНА (rНВНА) описана во французской патентной заявке FR-A-01/14953, в которой сообщается, что в отличие от нативного НВНА - белка (nНВНА), рекомбинантный белок НВНА не метилирован по остаткам лизина в С-концевой части.
Фрагмент rНВНАΔС описан у Pethe et al. (2000, Journal of Biological Chemistry 275 (19): 14273-14280). Этот фрагмент получают из рекомбинантной формы НВНА, для чего удаляют аминокислоты 161-199. Метилированный С-концевой фрагмент содержит аминокислоты с 161 по 199 в следующей последовательности:
ККААР АККААР АККААР AKKAAAKKAPAKKAAAKKVTQK (SEQ Е) NO: 1.)
Содержание всех указанных выше источников полностью включено в настоящее описание посредством ссылки.
В соответствии с контекстом настоящего изобретения, аббревиатура "РВМС" означает "мононуклеары периферической крови". РВМС, описанные в настоящем изобретении, можно получить любым способом, известным из литературы; в соответствии с одним из вариантов реализации настоящего изобретения, РВМС получают с помощью градиента плотности из проб венозной крови с использованием раствора, который содержит примерно 9.1% (м/об.) диатриазоата натрия и примерно 5.7% полисахарида. Указанный раствор имеет градиент плотности примерно 1.077±0.001 г/мл и осмотическое давление 280±15 мОсм. Этот раствор имеет торговое наименование Lymphoprep™.
Термины "латентный (скрытый) туберкулез" или "латентная форма (инфекции) Mycobacterium tuberculosis" или "латентная форма туберкулеза" используют в настоящей заявке взаимозаменяемым образом, и они означают, что млекопитающее инфицировано бактериями комплекса Mycobacterium tuberculosis, но не имеет симптомов болезни, т.е. у него не развиваются симптомы туберкулеза. Кроме того, указанное инфицированное млекопитающее не может передавать туберкулез другим млекопитающим, так как в мокроте не присутствуют инфекционные туберкулезные бактерии. Другими словами, млекопитающее инфицировано, но заболевание у него не развивается.
Различные формы туберкулеза классифицируют следующим образом:
ТВО: отсутствует контакт с туберкулезным агентом; отсутствует инфицирование;
ТВI: контакт с Mycobacterium tuberculosis, степень инфицирования неизвестна;
ТВ2: инфицирование туберкулезным агентом, отсутствуют симптомы развития заболевания (положительная реакция на туберкулин при кожном тестировании: положительный PPD);
ТВ3: активная форма туберкулеза, полностью диагностируемая;
ТВ4: клинически неактивная форма туберкулеза, соответствующим образом пролеченная или в стадии ремиссии; и
ТВ5: предположение на туберкулез, в ходе диагноза ("исключить" ТВ).
Выражение "здоровая популяция", в соответствии с контекстом настоящего изобретения, относится к лицам, у которых нет симптомов развития туберкулеза, вне зависимости от наличия инфекции, т.е. не инфицированных (ТВ0) или инфицированных, но здоровых (латентный туберкулез; ТВ2).
Способы и наборы, описанные в контексте настоящего изобретения, помогают различать форму ТВ3 и формы ТВ2; форму ТВ2 и формы ТВ0; и форму ТВ3 и формы ТВ0 в указанной выше классификации.
Аббревиатура PPD означает " очищенное производное туберкулина, tuberculin protein-purified derivative". Туберкулез обычно диагностируют с помощью теста, который включает внутрикожное введение PPD. Результат этого теста рассматривают как положительный на туберкулез, если реакция кожи в месте воздействия PPD превышает определенный размер, например 10 мм или более.
Термин "биологический образец", как определено в настоящем изобретении, охватывает образцы из дыхательных путей и из других локализаций. "Образцы из дыхательных путей" включают бронхиальные выделения, бронхо-альвеолярные лаважи (broncho-alveolar lavages, BAL), лаваж желудка и мокроту. Примеры образцов не из дыхательных путей, которые могут быть использованы в способах реализации настоящего изобретения, включают образцы выпотов, в частности, плевральной, абдоминальной и суставной жидкостей, цереброспинальной жидкости, спинно-мозговой жидкости, синовиальной жидкости, брюшинной (перитонеальной) жидкости, перикардиальной жидкости и других жидкостей организма; биопсии лимфатических узлов, трансбронхиальных, плевральных и печеночных биопсий, медуллярных и поясничных пункций, образы мочи или крови (РВМС или мононуклеары периферической крови), гнойные выделений и т.д.
Термин "из очага инфекции" включает любой биологический образец, отобранный из места, пораженного туберкулезной инфекцией, и охватывает все упомянутые выше и другие биологические образцы.
Способы согласно настоящему изобретению позволяют, с одной стороны, обнаружить in vitro иммунную реакцию у зараженного млекопитающего на белок НВНА Mycobacterium tuberculosis, что является признаком инфицирования указанным патогенным агентом, а с другой стороны, различать in vitro, возможно дополнительно к существующим способам диагностики, скрытую форму и активную форму туберкулеза, другими словами, соответственно не инфекционную и инфекционную форму заболевания.
Настоящее изобретение относится к способу обнаружения и различения in vitro млекопитающего, которое имеет латентную форму туберкулеза, и млекопитающего с активной формой туберкулеза, при этом указанный способ включает:
а) получение биологического образца от указанного млекопитающего;
б) измерение количества антител (IgG), направленных против двух различных форм белка НВНА, которые присутствуют в указанном биологическом образце; и
в) сравнение титров антител, полученных для двух форм белка НВНА, при этом относительные количества антител, полученных против указанных двух различных форм у млекопитающего с латентной формой туберкулеза отличаются от указанного относительного количества у млекопитающего с активной формой туберкулеза.
На основании биологического образца от млекопитающего и с использованием характеристик иммунных реакций, направленных против белка НВНА туберкулезных микобактерий, которые являются специфическими для различных форм туберкулеза (активной в сравнении с латентной), указанный способ позволяет распознавать инфицированных млекопитающих, которые больны, и тех, которые не являются больными. Таким образом, млекопитающие, которые имеют латентную форму туберкулеза, и млекопитающие с активной формой туберкулеза имеют иммунные реакции, в частности гуморальные иммунные реакции, которые различны в отношении белка НВНА.
Антитела, в частности, иммуноглобулины G (IgG), которые происходят от млекопитающих с латентной формой туберкулеза и от млекопитающих с активной формой туберкулеза, распознают различные участки белка НВНА. Таким образом, можно корректировать структуру белка НВНА с получением отдельных форм НВНА и распознавать различные формы туберкулеза. Термин "отдельная форма НВНА" означает любое изменение (модификацию) в структуре белка НВНА в отношении количества (удаление или добавление) и/или природы его аминокислотных остатков (замещение аминокислот, которые имеют одинаковый или различный размер, заряд, стерическое несоответствие), и/или любую посттранскрипционную модификацию, в частности ацетилирование, амидирование, биотинилирование, карбоксилирование, гидроксилирование, метилирование, фосфорилирование, или сульфатирование, или добавление остатков липидов (изопренилирование, пальмитинирование и миристинирование), глицидов (гликозилирование) или полипептидов (убиквитинирование). В контексте настоящего изобретения, две формы называют отличными (отдельными), когда их антитела от млекопитающих, которые имеют латентную форму и антитела от млекопитающих с активной формой туберкулеза, распознают указанные две формы различным образом.
Титрование, т.е. определение количества антител (серологическое тестирование), распознающих каждую форму НВНА, выполняют независимым образом с применением любой методики, которая известна специалистам в данной области, в частности, прямым или непрямым способом ELISA (твердофазный иммунно-ферментный анализ) или с помощью радиоиммунологического анализа (RIA), в которых антитела, которые содержаться в биологическом образце, приводят в контакт с отдельными формами НВНА. "Независимым образом" означает, что часть образца приводят во взаимодействие с одной из форм белка НВНА, а другую часть образца приводят в контакт со второй формой белка НВНА. Контактирование между антителами, присутствующими в образце, и формами НВНА, которое позволяет им взаимодействовать, и обнаружение указанного взаимодействия осуществляют при соответствующих условиях, известных специалистам в данной области. Так, в качестве примера, можно изменить следующее: методику нанесения антигена (НВНА) на подложку, разведение биологического образца, концентрации отдельных форм НВНА, температуру и время контактирования и, если потребуется, происхождение и концентрацию вторичных антител, также как и параметры, позволяющие обнаруживать взаимодействие, в частности, уменьшение фонового шума, выбор способа мечения (радиоактивная метка, флуорохромы), или время накопления детектируемого сигнала.
В одном из примеров протокола ELISA отдельные формы НВНА разводят в подходящем буфере (нанесение) в концентрации в пределах от 1 до 10 мкг/мл и выдерживают (50-200 мкл) в лунках микропланшетов в течение 1-6 часов при комнатной температуре (room temperature, RT) или в течение ночи при 4°С. Обычно используемые буферные растворы представляют собой раствор карбоната натрия - 50 мМ, рН 6.9; 20 мМ трис-HCL рН 8.5 или 10 мМ PBS, рН 7.2-7.4. Планшет затем промывают раствором для отмывки (200-300 мкл), содержащим 0.1 М PBS или TBS, рН 7.4, с добавлением детергента, такого как Triton или Tween 20 (конечная концентрация 0.01%-0.05%). Затем наносят насыщающий (блокирующий) раствор (200-300 мкл), такой как PBS, содержащий сухое обезжиренное молоко, казеин или желатин, чтобы блокировать неспецифическое взаимодействие, в течение 30-60 минут при 37°С или при комнатной температуре, затем избыток удаляют с помощью многократных промываний. Растворенный (1/10-1/1000) биологический образец (100-200 мкл) выдерживают в течение от 30 минут до 2 часов при 37°С или при комнатной температуре или в течение ночи при 4°С, с последующим многократным отмыванием. Вторичные антитела (примерно 100 мкл), растворенные в блокирующем растворе, затем добавляют на время от 30 минут до 2 часов при комнатной температуре или при 37°С. Избыток удаляют посредством многократных промываний. Если необходимо, субстрат (100 мкл) добавляют на 1-5 минут в темноте при комнатной температуре, с последующим нанесением stop-раствора.
Результаты титрования позволяют сравнивать два значения, полученные для двух отдельных форм для одного и того же млекопитающего. Такое сравнение, выполненное одновременно для одного или более млекопитающих, которые имеют латентную форму туберкулеза, и для одного или более млекопитающих с активной формой туберкулеза, дает существенно различные результаты из-за специфического характера иммунной реакции, которая происходит у инфицированных млекопитающих.
Как было показано ранее во французском патенте (FR-A-01/14953), нативная форма НВНА (nНВНА) метилирована по лизиновым остаткам С-концевой области белка. В противоположность этому, рекомбинантный белок НВНА (rНВНА) имеет другую степень метилирования, так как он не подвергается таким посттрансляционным модификациям.
Применение нативных или рекомбинантных форм таким образом показало, что биологические образцы от млекопитающих с активной формой туберкулеза содержат соизмеримые количества антител, направленных против нативной и рекомбинантной форм, что показывает, что у таких млекопитающих антитела распознают один и тот же участок белка (N-концевую область). В противоположность, в биологических образцах от млекопитающих, которые имеют латентную форму туберкулеза, имеют титр антител, направленных против нативной формы, выше, чем титр антител, направленных против рекомбинантной формы, что показывает, что у этих млекопитающих антитела предпочтительным образом распознают метилированную нативную форму. Таким образом, эти результаты позволяют распознать латентную и активную формы туберкулеза путем сравнения количеств (титров) антител, направленных против нативной и рекомбинантной форм НВНА.
Две другие индивидуальные формы НВНА, используемые в контексте настоящего изобретения - это фрагмент rНВНАΔС, который представляет собой N-концевую область белка (аминокислоты 1-160), и метилированный С-концевой фрагмент. Сравнение титров антител, полученных из биологических образцов, показало, что у млекопитающих с латентной формой туберкулеза наблюдается преобладание антител, распознающих метилированный С-концевой фрагмент, в то время как у млекопитающих с активной формой туберкулеза преобладают антитела, распознающие rНВНАΔС-фрагмент.
Такой способ сравнения относительных количеств (титров) антител можно применить к любому биологическому образцу, содержащему IgG. Еще в одном аспекте настоящего изобретения, указанный способ осуществляют с образцами крови.
Настоящее изобретение также обеспечивает набор для обнаружения и различения млекопитающего, которое имеет латентную форму туберкулеза, и млекопитающего с активной формой; причем указанный набор включает:
- две отдельные формы НВНА, как определено выше, с одной стороны, нативный НВНА и рекомбинантный НВНА и, с другой стороны, rНВНАΔС-фрагмент и метилированный С-концевой фрагмент НВНА;
- реагенты для создания подходящей среды для осуществления иммунологической реакции между антителами, которые содержатся в биологическом образце от указанного млекопитающего, и отдельные формы НВНА; упомянутые реагенты включают все соединения, необходимые для осуществления взаимодействия между антителом и отдельными формами НВНА, также как и любое соединение, которое усиливает или улучшает указанные взаимодействия или делает их более специфическими;
- реагенты, позволяющие обнаружить иммунологические комплексы, образованные в ходе упомянутой иммунологической реакции. Указанные реагенты включают любое соединение, которое помогает обнаружить или выявить реакцию между антителом и отдельными формами НВНА, упомянутыми выше. Указанные реагенты включают вторичные антитела, возможно радиоактивно омеченные или конъюгированные с флуорохромами, также как любую молекулу, которая помогает усилить или изменить сигнал обнаружения.
Набор может дополнительно содержать одну или более эталонную ткань или биологический образец, которые можно использовать в качестве отрицательного контроля (образец, взятый у неинфицированного животного; стадия ТВ0) или в качестве положительного контроля (стадии ТВ2 и/или ТВ3).
Традиционные методы, основанные на НВНА-специфической секреции IFN-γ, на сегодняшний день кажутся достаточными как для определения пациентов с латентной формой ТВ среди здоровой популяции, так и для обнаружения различий между пациентами с латентной и активной формами ТВ, как показано на кривых ROC Фигуры 12. Однако эти способы можно значительно улучшить, принимая во внимание ESAT-6-специфическую секрецию IFN-γ. Таким образом, настоящее изобретение описывает альтернативный указанным традиционным подходам способ, который основан как на НВНА-специфической, так и ESAT-6-специфической секреции IFN-γ.
Настоящее изобретение относится ко второму способу in vitro обнаружения и различения млекопитающего с латентной формой туберкулеза и млекопитающего с активной формой туберкулеза или для идентификации млекопитающего с латентной формой туберкулеза среди здоровой популяции; при этом указанный способ включает:
а) получение биологического образца от указанного млекопитающего;
б) приведение упомянутого биологического образца независимым образом в контакт с нативной формой НВНА и с ESАТ-6 в условиях, при которых возможна секреция IFN-γ;
в) измерение значения НВНА-специфической секреции IFN-γ и ESAT-6-специфической секреции IFN-γ;
г) вычисление отношения между значениями НВНА-специфической секреции IFN-γ и ESAT-6 специфической секреции IFN-γ,
при этом указанное отношение, полученное для млекопитающего с латентной формой туберкулеза, выше, чем отношение, полученное для млекопитающего с активной формой туберкулеза или полученное для млекопитающего, не инфицированного М. tuberculosis.
На стадии а) биологические образцы получают как у здоровой популяции, т.е. у индивидуумов, у которых нет симптомов туберкулеза, так и у индивидуумов, инфицированных М. tuberculosis. Целью способа, в отношении здоровой популяции, является определение индивидуумов, инфицированных М. tuberculosis, но у которых нет симптомов заболевания (латентный ТВ), среди индивидуумов, не имеющих симптомов туберкулеза. В противоположность этому, задачей указанного способа в отношении группы инфицированных индивидуумов является выявление различий между пациентами, имеющими активную форму туберкулеза, и пациентами с латентной формой туберкулеза. Указанный способ включает приведение независимым образом биологического образца в контакт с нативной формой НВНА и в контакт с ESAT-6 (early secreted antigen target 6). Выражение "независимым образом" означает, что пробу приводят в контакт с НВНА и отдельно в пространстве в контакт с ESAT-6. Добавление этих двух молекул к биологическому образцу стимулирует клетки, присутствующие в указанном образце, и приводит к секреции цитокинов, в частности IFN-γ.
Приведение указанного образца в контакт с НВНА и ESAT-6 осуществляют при условиях, при которых возможна секреция IFN-γ. Таким образом, выбор среды, рН и температуры среды, в которой осуществляют контакт, продолжительность контакта, разбавление биологического образца, концентрации белков НВНА могут быть изменены специалистами в данной области в зависимости от происхождения образца.
Секрецию IFN-γ измеряют любым методом, известным специалистам в данной области, например ELISA, ELISPOT, методом проточной цитометрии (FACS), количественной RT-PCR после приведения в контакт образца с НВНА, при этом секретируемый IFN-γ соответственно называют НВНА-специфическим IFN-γ, и после приведения образца в контакт с ESAT-6, при этом секретируемый IFN-γ соответственно называют ESAT-6 - специфическим IFN-γ. Для специалистов очевидны возможные модификации способа, касающиеся параметров, которые помогают обнаруживать IFN-γ секрецию, в частности, в отношении антител, способов их мечения и условий взаимодействия. Условия ELISA выбирают аналогичные описанным выше с тем отличием, что вместо белков, отличных от НВНА, буферный раствор содержит антитело против IFN-γ. Также используют вторичное антитело, направленное против IFN-γ.
Расчет отношения между НВНА-специфическим IFN-γ и ESAT-6- специфическим IFN-γ позволяет отличить латентную форму туберкулеза от активной формы туберкулеза. Таким образом, у млекопитающих с латентной формой туберкулеза получают очень высокое отношение, больше чем 1, больше 50, больше 100, больше 200 или больше 300. Таким образом, отношение в пределах 100-400 подтверждает наличие латентной формы туберкулеза. В противоположность этому, у млекопитающих с активной формой туберкулеза или у не инфицированных М. tuberculosis млекопитающих указанное отношение очень низкое и меньше чем 1, меньше 0.75 или меньше 0.5. Таким образом, соотношение, равное нулю или меньшее чем 0.5, подтверждает или то, что пациент с активной формой ТВ находится в группе пациентов, инфицированных М. tuberculosis (например, имеющих положительный результат теста на туберкулин), или и то, что пациент, не инфицированный М. tuberculosis, находится среди здоровой популяции (с отсутствующими симптомами туберкулеза).
Указанный второй способ осуществляют с использованием любых биологических образцов, обычно используемых при диагностировании туберкулеза, в частности бронхиальных выделений, бронхо-альвеолярных лаважей (broncho-alveolar lavages, BAL), желудочных лаважей и мокроты, образцов жидкостей из выпотов, в частности, плевральных, абдоминальных и суставных жидкостей, цереброспинальных жидкостей, спинно-мозговых жидкостей, синовиальных жидкостей, брюшинных жидкостей, перикардиальных жидкостей и других флюидов тела, биопсий лимфатических узлов, трансбронхиальных биопсий, плевральных и печеночных биопсий, медуллярных и поясничных пункций, проб мочи или крови, гнойных выделений. В одном из вариантов реализации настоящего изобретения указанный способ осуществляют с использованием лимфоцитов, полученных из образцов крови любым способом, известным специалистам в данной области. Еще в одном способе РВМС экстрагируют из периферической крови.
Еще в одном способе реализации, после получения биологического образца и перед приведением указанного образца в контакт способ, описанный выше, включает дополнительную стадию поддержания биологического образца в культуре. Условия культивирования адаптируют соответственно природе биологического образца.
Настоящее изобретение также относится к набору для обнаружения и различения млекопитающего, которое имеет латентную форму туберкулеза, и млекопитающего с активной формой туберкулеза, или для идентификации млекопитающих с латентной формой туберкулеза среди здоровой популяции, указанный набор содержит:
- нативную форму НВНА и ESAT-6;
- реагенты, требуемые для создания среды для приведения независимым образом в контакт клеток, представленных в биологическом образце, взятом у указанного млекопитающего, с нативной формой НВНА и ESAT-6; указанные реагенты включают те, которые описаны выше для предыдущего набора;
- реагенты для обнаружения следующей за контактом секреции IFN-γ. Секретированный IFN-γ измеряют, используя любую известную методику и первичные антитела, специфичные для IFN-γ, возможно меченые, или вторичные антитела, возможно меченые, способные распознавать первичные антитела, которые можно включить в набор, также и любую молекулу, которая помогает усилить или модулировать сигнал обнаружения.
Факультативно, указанный набор может также содержать один или более вид референтной биологической ткани или образца, которую(ый) можно использовать в качестве негативного контроля (образец, взятый у неинфицированного млекопитающего; стадия ТВ0) или в качестве положительного контроля (стадии ТВ2 и/или ТВ3).
Еще в одном варианте набор содержит среду для культивирования и любое соединение, участвующее в выращивании указанного образца, перед приведением в контакт с нативными НВНА или ESAT-6.
Настоящее изобретение также относится к третьему способу обнаружения и различения in vitro млекопитающего с активной формой туберкулеза и млекопитающего, не инфицированного М. tuberculosis, или млекопитающего, которое имеет латентную форму туберкулеза; указанный способ включает:
а) получение биологического образца из очага локальной инфекции от упомянутого млекопитающего;
б) приведение в контакт указанного биологического образца с нативной или рекомбинантной формой НВНА при соответствующих условиях, позволяющих оказывать влияние на IFN-γ;
в) измерение влияния контакта на НВНА-специфический IFN-γ, при котором влияние на НВНА-специфический IFN-γ выше у млекопитающего с активной формой туберкулеза, чем у млекопитающего, не инфицированного М. Tuberculosis, или млекопитающего, которое имеет скрытую (латентную) форму туберкулеза.
В соответствии с контекстом настоящего изобретения, выражение "очаг локальной инфекции" включает любую локализацию, в которой (устойчиво) присутствуют патогенные М. tuberculosis и где возникло инфекционное заболевание. Это определение, таким образом, включает легкие, лимфатические узлы, плевру (плевральную полость), суставы, кости, мочеполовой тракт, оболочку мозга, брюшную полость, желудочно-кишечный тракт, центральную нервную систему, надпочечные железы или околосердечную сумку. В этом способе, все исключают образцы крови, включая РВМС.
Указанный способ включает приведение биологического образца в контакт с нативной или рекомбинантной формой НВНА, что приводит к стимуляции клеток упомянутого образца. Выражение "рекомбинантная форма НВНА", используемое в указанном третьем способе, означает полную неметилированную форму НВНА, в частности, очищенную из Е. coli штамма (BL21 (DE3) (рЕТ-НВНА).
Затем определяют влияние указанной стимуляции на IFN-γ. Термин "влияние на IFN-γ" означает любое изменение, касающееся экспрессии IFN-γ, как на транскрипционном (mRNA), так и на трансляционном (белковом) уровне, в отношении деградации IFN-γ, созревания (в частности, гликозилирования) или секреции.
Образец, полученный из очага локальной инфекции, приводят в контакт с НВНА при условиях, которые являются подходящими для оказания влияния на IFN-γ, указанные условия специалисты в данной области могут изменять, в частности, в отношении выбора среды (в которой осуществляют взаимодействие), рН и температуры среды для контакта, продолжительности контакта, разведения биологического образца и концентрации белка НВНА.
В одном из способов реализации настоящего изобретения, количество секретируемого IFN-γ измеряют, используя любую известную методику для измерения количества соединения, в частности, ELISA, ELISPOT, проточную цитометрию (FACS) или количественную RT-PCR.
Количество НВНА-специфического IFN-γ, секретируемого биологическим образцом, полученным от млекопитающего, с активной формой туберкулеза, больше чем 1000, больше чем 2000 пг/мл, больше чем 5000 пг/мл или больше чем 10000 пг/мл. Таким образом, количество в пределах от 5000 до 45000 пг/мл, или в пределах от 10000 до 45000 пг/мл указывает на активную форму туберкулеза. Напротив, количество НВНА-специфического IFN-γ, секретируемого биологическим образцом, которое имеет нулевую величину или меньше чем 100, 400 или 1000 пг/мл подтверждает отсутствие заражения М. tuberculosis или наличие латентной формы туберкулеза.
Еще в одном способе реализации настоящего изобретения количественное соотношение числа клеток, положительных по сигналу от IFN-γ специфичной метки, количественно определяют по разнице между процентом клеток, экспрессирующих IFN-γ после стимуляции НВНА в течение 16 часов и процентом клеток, вырабатывающих IFN-γ без стимулирования (самопроизвольная секреция). Такой расчет осуществляют на клетках биологического образца, предназначенных для количественного анализа, в частности лимфоцитах, CD4+ клетках, или любой другой субпопуляции лимфоцитов. Мечение выполняют любым известным способом для внутриклеточного мечения соединения, в котором можно использовать агенты для увеличения проницаемости мембраны (пермеабилизации), такие как сапонин (0.01%-0.1%), тритон (0.1%), дигитонин и/или агенты для фиксации клеток, в частности, 2% параформальдегид, или антитела, возможно с радиоактивной меткой или конъюгированые с флуорохромами.
После контакта образца с НВНА к образцу добавляют Брефелдин А (10 мкг/мл) на 3-5 часов при 37°С, или при комнатной температуре, чтобы блокировать любую секрецию из клеток, содержащихся в указанном образце. Затем клетки фиксируют с помощью агентов фиксации, в частности тех, которые описаны выше, в течение 15-30 минут при 4°С, затем пермеабилизуют с помощью агентов для увеличения проницаемости мембран, в частности, с помощью тех, которые описаны выше, в течение 15-30 минут при комнатной температуре в темноте. Первичные и вторичные антитела разбавляют пермеабилизующим раствором (10 мг/мл) и добавляют для инкубации в течение 15-30 минут при 4°С. Поверхностные антигены, в частности, CD4 или CD8 метят или до фиксации с помощью фиксирующего агента, к которому они чувствительны, или те из них, которые устойчивы к фиксации - после пермеабилизации. Меченые клетки затем анализируют с помощью проточной цитометрии.
Таким образом, пропорция клеток, полученных из биологического образца, полученного от млекопитающего, с активной формой туберкулеза, составляет больше чем 0.3%, больше чем 0.5%, больше чем 0.75% или больше чем 1%. Можно получить величины 5%, 10% и до 15%. В противоположность, пропорция клеток, полученных из биологического образца от млекопитающего, не инфицированного М. tuberculosis, или которые имеют латентную форму туберкулеза, имеет значение ноль или менее чем 0.2%-0.3%.
Указанный способ помогает выявить наличие активной формы туберкулеза у млекопитающих. В противоположность, низкий уровень секреции IFN-γ или небольшое количество внутрицитоплазмического IFN-γ порядка величин, указанных выше, указывает на отсутствие активной формы туберкулеза, и может быть интерпретировано как отсутствие заражения М. tuberculosis или как латентная форма туберкулеза.
В указанный способ факультативно входит этап культивирования указанного биологического образца после получения биологического образца и до приведения его в контакт с образцом.
В одном из вариантов реализации настоящего изобретения биологический образец выбирают из группы, включающей: бронхиальное выделение, бронхо-альвеолярный лаваж (broncho-alveolar lavages, BAL), желудочный лаваж, мокроту, образец жидкостей из выпотов, в частности, плевральной, абдоминальной и суставной жидкости, цереброспинальной жидкости, спинно-мозговой жидкости, синовиальной жидкостей, брюшинной жидкости, перикардиальной жидкости, биопсии лимфатических узлов, трансбронхиальной биопсии, плевральной и печеночной биопсии, медуллярной и поясничной пункции, пробы мочи и гнойного выделения.
Еще в одном способе реализации настоящего изобретения, клетки, используемые в указанном способе, представляют собой Т-лимфоциты, в частности, CD3+ CD4+ Т-лимфоциты.
Изобретение также относится к набору для обнаружения и различения млекопитающего, имеющего активную форму туберкулеза, и млекопитающего, не инфицированного М. tuberculosis, или которое имеет латентную форму туберкулеза, указанный набор включает:
- нативную или рекомбинантную форму НВНА;
- реагенты для создания среды, подходящей для приведения в контакт клеток, присутствующих в биологическом образце от указанного млекопитающего, с нативной или рекомбинантной формой НВНА; указанные реагенты включают те, которые описаны выше в отношении предыдущих наборов;
- реагенты, позволяющие обнаружить IFN-γ после указанного контакта. Количество секретируемого или внутрицитоплазматического IFN-γ измеряют с помощью любого известного способа. В указанном наборе могут быть обеспечены первичные антитела, специфические для IFN-γ, которые могут быть помечены, вторичные антитела, которые могут быть помечены и которые способны распознавать указанные первичные антитела и любую молекулу, которая амплифицирует или модулирует детектируемый сигнал.
Набор может также содержать один или более образец референтной ткани или биологический образец, который может быть использован в качестве контролях: образец, взятый у не инфицированного млекопитающих (стадия ТВ0), образец стадии ТВ2 и/или образец стадии ТВ3.
В одном из вариантов реализации, набор содержит культуральную среду и любое соединение, которое используют при культивировании указанного образца перед приведением в контакт с НВНА.
Следующие примеры приведены, чтобы проиллюстрировать настоящее изобретение, и никоим образом не ограничивают область охвата настоящего изобретения.
ПРИМЕРЫ
Пример 1: Происхождение образцов крови
Образцы крови были получены у туберкулезных пациентов и у пациентов с латентным туберкулезом после получения их согласия. Туберкулезные пациенты были отобраны на основании положительного результата прямого обследования и/или на основании положительного результата при культивировании на М. tuberculosis. Все пациенты были включены в исследование в течение первых трех недель лечения. Пациенты, с латентной формой туберкулеза, были отобраны на основе положительного результата теста на гиперчувствительность на туберкулин замедленного типа (диаметр отвердения более 18 мм на время постановки диагноза). Активную форму туберкулеза исключали на основании обычных рентгеновских снимков грудной клетки. Все пациенты были серонегативными на ВИЧ, и ни один пациент ранее не получал лечения с применением иммунодепрессантов. Все пациенты на момент включения в исследование проживали в Европе.
Пример 2: Другие образцы
Жидкость бронхоальвеолярного лаважа (Broncho-alveolar lavage, BAL) отобирали с помощью фиброскопии после введения около 200 мл физиологического раствора. Взятый объем затем центрифугировали (приблизительно до 10 мл).
Плевральную, суставную, брюшинную, спинно-мозговую и другие жидкости собирали в стерильные шприцы и центрифугировали сразу же по доставке их в лабораторию.
Для ганглиев или других исследованных масс выполняли хирургическое иссечение. По прибытии в лабораторию отобранных анатомических фрагментов, их измельчали и выдерживали в среде для культивирования, чтобы обеспечить постепенный вход клеток из ткани.
Пример 3: Антигены
Нативную форму НВНА (nНВНА) выделяли из М. bovis BCG с помощью хроматографии на гепарин-сефарозе, после чего следовала жидкостная хроматография высокого давления (high pressure fluid chromatography, HPLC), как уже было описано (14). HPLC - хроматограмма и SDS-PAGE анализ после окрашивания с помощью Кумасси синего показали, что препараты не имели никакого загрязнения белками. С помощью газовой хроматографии не обнаружили никаких следов гликолипидов. ЛАЛ-тест (limulus test) показал, что содержание липополисахаридов было меньше чем 10 пг/мл.
Неметилированную рекомбинантную форму (rНВНА) выделяли из штамма E. соli (BL21(DE3)(pET-HBHA). Степень метилирования рекомбинантного белка сравнивали со степенью метелирования нативного белка, который был описан во французском патенте FR-A-01/14953. Усеченную рекомбинантную форму С-концевого фрагмента (rНВНАΔС) выделяли из штамма Е. coli (BL21(DE3)(pET-rНВНАΔС). Указанная усеченная форма rНВНАΔС была описана у Pethe et al. (2000 Journal of Biological Chemistry 275(19): 14273-14280, включенный в настоящее описание посредством ссылки) и ее получают из рекомбинантного белка НВНА, с помощью делеции амиокислот 161-199.
Выделенный С-концевой пептид, синтезированный путем взаимодействия с предварительно метилированными аминокислотами, соответствует аминокислотам с 161 по 199 НВНА-белка и имеет следующую последовательность:
KKAAPAKKAAPAKKAAPAKKAAAKKAPAKKAAAKKVTQK (SEQ ID NO: 1) (12, 13). Pethe et al. (Proc Natl Acad Sci 2002; 99: 10759-10764) и Temmerman et al. (Nat. Med. 2004 Sep, 10(9): 935-941) включены в настоящее изобретение посредством ссылки.
Пример 4: Обнаружение НВНА-специфичного IgG
Для обнаружения IgG против nНВНА, rНВНА, rНВНАΔС и С-пептида (изолированный С-концевой пептид) использовали ELISA. Более подробно, 96-луночные полистирольные планшеты (Maxisorp Nunc) инкубировали в течение ночи при 4°C с 50 мкл/лунку раствора 1.5 мкг/л антигена, растворенного в PBS (nНВНА, rНВНА, rНВНАΔС или С-пептид). Планшеты промывали три раза PBS-Tween 20 (0.05%) и насыщали с помощью 1% раствора казеина в PBS в течение 1 ч при 37°С. После промывания в лунки при взбалтывании помещали сыворотку от пациентов, разбавленную раствором PBS-Tween 20 (0.05%) (разбавление 1:50-1:12800), на 30 мин при комнатной температуре. Использовали вторичные антитела IgG козы против человека, соединенные с биотином, разбавленные в 250 раз в PBS-Tween 20 (0.05%) (биотинилированный IgG козы - против человека, Southern Biotechnologies Associates, Birmingham, USA 2040-08). Вторичные антитела выявляли с помощью раствора пероксидазы 50 мкл/лунку (конъюгат экстравидин-пероксидаза - Е2886 - Sigma), разведение 1:1000 (0.5% казеин). После промывки добавляли 50 мкл раствора субстрата (0.1 мг/мл 3,3',5,5'-тетраметилбензидина и 1 мкл/мл 30% перекиси водорода в 0.1 М цитрате натрия, рН 5) 10-30 минут в темноте. Реакцию останавливали с помощью добавления 25 мкл/лунку соляной кислоты (2 ммоль/лТитр антител выражали как последнее разбавление сыворотки, при котором наблюдали положительную реакцию в отношении пула негативных сывороток).
Пример 5: Секреция гамма интерферона мононуклеарами периферической крови (РВМС) в ответ на nHBHA/ESAT-6 (ELISA)
РВМС получали с помощью градиента плотности, при центрифугировании образцов периферической крови (lymphoprep - Nycomed Pharma). Указанные РВМС ресуспендировали в концентрации 2×106 клеток/мл в среде для культивирования (полная RPMI: RPMI 1640 (BioWhittaker), к которой добавляли 40 мкг/мл гентамицина, 50 мкмоль 2 - меркаптоэтанола, 1X не основных аминокислот (Life Technologies) и10% фетальной сыворотки коров (foetal calf serum, FCS)). Клетки стимулировали с помощью 2 мкг/мл nНВНА и параллельно с помощью 5 мкг/мл раннего секретируемого антигена мишени 6 (early secreted antigen target 6, ESAT-6) (Statens Serum Institut, Denmark) в течение 96 часов в атмосфере 5% СO2 при 37°С. В некоторых опытах добавляли блокирующие антитела в концентрации 5 мкг/мл: анти-TGF-β 1,2,3 (мышиная IgGl, R&D System), и результаты получены в присутствии контрольных антител (мышиный lgGl; R&D System). Кондиционированную среду собирали после 4 дней выращивания культуры для измерения количества секретрированного IFN-γ, с помощью ELISA (IFN-γ Cytoset, Biosource).
Пример 6: Местная реакция гамма интерферона
Пример 6а: Биологические жидкости и анатомические части
Анализируемые биологические жидкости представляли собой плевральные, суставные и брюшинные жидкости. Анализируемые анатомические части представляли собой биопсии, полученные из ганглиев, или из различных подозрительных масс. Выделение содержащих ядра элементов из биологических жидкостей осуществляли с помощью первичной фильтрации (ячеистый сетчатый фильтр, нейлон 100 мкм Falcon® 352360), за которой следовало центрифугирование при 2300 об/мин в течение 15 минут. Красные глобулы, присутствующие в осадках клеток, при необходимости лизировали. Клетки затем ресуспендировали в полной среде RPMI. Содержащие ядра элементы из анатомических проб изолировали путем измельчения и инкубации в течение ночи в полной среде RPMI при 37°С и в атмосфере 5% СO2. Отбирали супернатанты, и указанные части промывали для сбора любых клеток, которые были доступны. Указанные супернатанты затем центрифугировали при 2300 об/мин в течение 15 минут. Красные глобулы при необходимости лизировали. Клеточные остатки ресуспендировали в полной среде RPMI.
Пример 6б: Стимуляция антигенами
Когда число изолированных клеток было достаточным (плевральные жидкости), их стимулировали in vitro тем же способом, что и РВМС, и концентрацию секретируемого IFN-γ измеряли в культуральных супернатантах после 96 часов стимуляции in vitro с помощью НВНА. В отношении РВМС, анализ синтеза IFN-γ этими клетками можно также осуществить с помощью проточной цитометрии после короткой лабораторной стимуляции НВНА, как описано ниже для бронхо-альвеолярных жидкостей, суставных или брюшинных жидкостей, ганглиев и т.д. Изолированные клетки (2×106/мл) стимулировали in vitro с помощью НВНА в концентрации 10 мкг/мл в течение периода времени 16-18 часов. Секрецию указанного цитокина клетками затем блокировали с помощью инкубации в присутствии Брефелдина А в течение 4 часов (10 мкг/мл-Брефелдин А - Sigma), и присутствие IFN-γ в клетках анализировали с помощью проточной цитометрии после мечения клеток. После фиксации клеток их пермеабилизовали (Fix и Perm; Набор для пермеабилизации - Caltag Laboratories), отмывали, затем инкубировали в темноте в течение 30 мин в присутствии антител, конъюгированных флуорохромами (анти-СD3 PerСР, анти-СD4 АРС, анти-IFN-γ РЕ, все полученные от Becton, Dickinson). Процентное отношение положительных клеток затем анализировали с помощью проточного цитометра FACSCalibur, изначально анализируя лимфоциты по их размеру и гранулярности, а затем выделяли различные субпопуляции лимфоцитов как функцию экспрессии поверхностных маркеров.
Пример 7: Статистический анализ
Для непарных данных выполняли не параметрический U тест Манна-Уитни или не параметрический тест Крускал-Уоллиса, после чего проводили послетестовый анализ с использованием тестов Данна. Парные данные анализировали с помощью теста Вилкоксона или Фридмана.
Анализ получения операционных характеристик (receiver operating characteristic, ROC): Каждая точка на кривой (Фигура 12) относится к определенной паре значений чувствительности и специфичности, рассчитанная в соответствии со значениями, приведенными в таблицах 1, 2 или 3. Полная кривая (и особенно площадь под ней) дает общее представление об исследовании в целом. Хорошие кривые лежат ближе к левому верхнему углу, в то время как в худшем варианте получают диагональную линию (пунктирная линия).
Общая площадь под кривой ROC является мерой достоверности диагностического теста, так как она отражает выполнение исследования на всех возможных уровнях отсечки. Указанная площадь лежит в интервале [0.5-1] и чем больше площадь, тем выше достоверность теста. Точность теста классифицируют в соответствии с площадью под кривой следующим образом: [0.9-1]: превосходно; [0.8-0.9]: хорошо; [0.7-0.8]: удовлетворительно; [0.6-0.7]: недостаточно и [0.5-0.6]: неудовлетворительно.
Используют следующие определения:
- Чувствительность: вероятность наличия положительного результата теста среди пациентов, имеющих положительный диагноз: действительно положительный (true positive, TP);
- Специфичность: вероятность наличия отрицательного результата теста среди пациентов, которые имеют отрицательный диагноз: действительно отрицательный (true negative, TN);
- (1 - специфичность): вероятность наличия положительного результата теста среди пациентов, имеющих отрицательный диагноз: ошибочный положительный (false positive, FP);
- (1 - чувствительность): вероятность наличия отрицательного результата теста среди пациентов, которые имеют положительный диагноз: ошибочный отрицательный (false negative, FN).
Тест ROC позволяет найти оптимальное значение уровня отсечки, для которого чувствительность и специфичность имеют высокие значения.
РЕЗУЛЬТАТЫ
1. Гуморальный ответ
nHBHA-специфических IgG обнаруживали в сыворотке примерно у 40% пациентов, инфицированных Mycobacterium tuberculosis, в любом случае были ли они здоровы (первично зараженные пациенты или пациенты с латентной формой) или они были больны туберкулезом (активная форма). Титры антител, измеренные у этих двух групп пациентов, не отличались друг от друга (Фигура 1).
Тем не менее, сравнение титров антител, направленных против нативной метилированной формы НВНА (nНВНА), с теми титрами антител, которые направлены против неметилированной рекомбинантной формы (rНВНА), позволило выдвинуть гипотезу, что указанные антитела различаются в зависимости от того, были ли пациенты, инфицированные туберкулезными микобактериями, больны (активная форма) или нет (латентная форма). Как можно видеть на Фигуре 2, титры антител против nНВНА IgG были значимо выше, чем титры антител против rНВНА IgG (р=0.0015) у первично инфицированных пациентов (Фигура 2А), в то время как разница не была значимой у туберкулезных пациентов (Фигура 2Б). Затем мы проанализировали антитела IgG, направленные, с одной стороны, против усеченной рекомбинантной формы НВНА, состоящей только из N-концевого фрагмента молекулы (rНВНАΔС), а с другой стороны, те, которые направлены против метилированного С-концевого пептида.
Данные результаты, показанные на Фигуре 3, указывают, что IgG против НВНА, присутствующие в сыворотке у туберкулезных пациентов, распознают rНВНАΔС (Фигура 3А), в то время как антитела у первично инфицированных пациентов распознают метилированный С-концевой пептид (Фигура 3Б). На основании типа антитела, присутствующего в сыворотке у пациентов, инфицированных Mycobacterium tuberculosis, их можно классифицировать на две группы, первично инфицированных или больных, в зависимости от того, были ли IgG направлены против не метилированной N-концевой части НВНА или против метилированной С-концевой части.
2. Секреция IFN-γ циркулирующими лимфоцитами
а. Ранее мы показывали, что уровень секреции IFN-γ в ответ на нативную форму НВНА мононуклеарами периферической крови (РВМС) значимо выше у первично инфицированных пациентов, чем у туберкулезных пациентов. Полученные различия были, тем не менее, незначительны для использования в диагностических целях. Увеличение числа тестируемых пациентов позволило провести выборку среди первично инфицированных пациентов, тех, для которых предполагаемый срок заражения был меньше чем пять лет. Результаты, приведенные на Фигуре 4, указывают на то, что различия между двумя указанными группами несколько больше, но все еще не достаточны.
б. Чтобы лучше оценить потенциальную уровень IFN-γ секреции, вызванной нативной НВНА для диагностирования латентной инфекции Mycobacterium tuberculosis, был произведен ROC тест (получение операционных кривых), чтобы определить концентрацию IFN-γ (оптимальный уровень отсечения), который дает наилучшее значение пары чувствительность/специфичность для решения поставленной задачи.
1) Постановка диагноза пациентам с латентной формой ТВ среди здоровой популяции (отличие между пациентами с латентной формой ТВ и не инфицированными лицами)
Так как лица, которые имеют латентную форму ТВ (IP), не больны, но представляют потенциальный источник распространения бацилл Коха, исследование должно обеспечить выявление таких лиц среди здоровой популяции. Поэтому кривые ROC строили на основе уровня секреции (концентрации) IFN-γ, вызванной контактом с НВНА, и секретируемого РВМС у контрольных пациентов (не инфицированных Mycobacterium tuberculosis - n=14) и у лиц, которые имели латентную форму ТВ (n=46), выявленных на основании результатов положительной внутрикожной реакции на туберкулин PPD, которая является рекомендуемым диагностическим критерием (таблица 1).
Таблица 1: значение nHBHA-специфической секреции INF-γ у пациентов с летальной формой ТВ и контрольных (здоровых) лиц
В этом эксперименте "положительный" и "отрицательный" результаты у испытуемых определяют следующим образом:
- ТР: вероятность наличия положительного результата (выше оптимального уровня отсечения) среди пациентов, имеющих положительную внутрикожную реакцию на туберкулин;
- FP: вероятность наличия отрицательного результата (ниже оптимального уровня отсечения) среди пациентов, которые имеют отрицательную внутрикожную реакцию на туберкулин;
- FN: вероятность наличия положительного результата (выше оптимального уровня отсечения) среди пациентов, имеющих отрицательную внутрикожную реакцию на туберкулин;
- TN: вероятность наличия отрицательного результата (ниже оптимального уровня отсечения) среди пациентов, которые имеют положительную внутрикожную реакцию на туберкулин;
кривая ROC, показанная ниже на Фигуре 12А, является превосходной, так как площадь под кривой составляет 0.95 (95% устойчивый интервал: 0.90-1.00; Р<0.0001). Для концентрации IFN-γ более чем 110 пг/мл (оптимальный уровень отсечения) - чувствительность теста для постановки диагноза на латентный ТВ составляет 89.13% (CI95: 76.43-96.38), специфичность 100% (CI95: 76.84-100).
Стоит упомянуть, что контрольными в этом тесте ROC являются лица, которые не были вакцинированы против туберкулеза (BCG). Возможное влияние вакцинации BCG было ранее исследовано и опубликовано в 2002 (Masungi et al. J. Inf. Dis. 2002; 185: 513-20). Эти предварительные эксперименты показали, что циркулирующие лимфоциты у 15 BCG-вакцинированных лиц (BCG-вакцинированные более чем 10 лет перед отбором крови) не выделяют IFN-γ в ответ на НВНА, но делают это в ответ на PPD.
Тем не менее, так как исследование касается выявления ТВ среди здорового взрослого населения и в большинстве стран вакцинацию проводят в детском возрасте, представляется необходимым тестировать лица, вакцинированные более чем 10 лет. Из этих лиц у 5 наблюдается положительная внутрикожная реакция на туберкулин и у 3 сомнительные результаты. Более того, циркулирующие лимфоциты у 10 из этих здоровых BCG-вакцинированных лиц выделяли IFN-γ в ответ на PPD.
В заключение, оказывается, что BCG-вакцинация не нарушает предполагаемую заинтересованность в способе постановки диагноза для выявления пациентов с латентной формой ТВ среди здоровой популяции, основанном на in vitro IFN-γ индукции с помощью НВНА.
2) Диагностическая разница между пациентами с латентной формой ТВ и активной формой ТВ
Когда пациент имеет клиническую историю, совместимую с туберкулезом, и его или ее внутрикожная реакция на туберкулин дает положительный результат, важно отличить туберкулез от другого заболевания, которое может присутствовать у пациента, у которого также есть скрытая форма ТВ. Таким образом, тест должен определять пациентов с латентной формой ТВ среди пациентов, зараженных Mycobacterium tuberculosis. Таким образом, получили кривые ROC на основе концентраций IFN-γ, индуцированного с помощью НВНА и секретированного РВМС, с одной стороны, у пациентов, которые имели латентную форму ТВ, определенных на основе результатов внутрикожной реакции на туберкулин, которая является необходимой диагностической рекомендацией (n=46), и, с другой стороны, у пациентов с запущенной активной формой ТВ (n=50).
(Таблица 2)
Таблица 2: Величина nHBHA-специфического IFN-γ у пациентов с латентной и активной формами ТВ
В этом эксперименте положительный и отрицательный результаты для испытуемых определяли следующим образом:
- ТР: вероятность наличия положительного результата (выше оптимального уровня отсечения) среди пациентов, имеющих симптомы туберкулеза;
- FP: вероятность наличия отрицательного результата (ниже оптимального уровня отсечения) среди пациентов, которые не имеют симптомов туберкулеза;
- FN: вероятность наличия позитивного результата (выше оптимального уровня отсечения) среди пациентов, не имеющих симптомов туберкулеза;
- TN: вероятность наличия отрицательного результата (ниже оптимального уровня отсечения) среди пациентов, которые имеют симптомы туберкулеза.
Полученная кривая ROC (Фигура 12Б) является хорошей, так как она образует площадь под кривой 0.855 (IC95: 0.777-0.932). Для порога IFN-γ концентрации, составляющего 480 пг/мл (оптимальное отсечение), чувствительность к тесту при постановке диагноза на скрытый ТВ составляет 76.09% (CI95: 61.23-87.41) со специфичностью 82% (CI95: 68.56-91.42).
Следует упомянуть, что результаты для кривой ROC являются существенно хуже, когда рассматривают концентрации PPD-индуцированного IFN-γ, секретируемого РВМС-клетками. Эта кривая (Фигура 12 В), рассчитанная на основе результатов, полученных для 31 пациента с латентной формой ТВ и 47 пациентов с активной формой ТВ (таблица 3), имеет площадь под кривой только 0.73 (CI95: 0.62-0.84).
Таблица 3: Количество PPD-специфичного IFN-γ у пациентов с активным и латентным ТБ
Поэтому, ввиду вышеуказанных результатов оказывается, что секреция IFN-γ, индуцированная с помощью НВНА, позволяет отличить пациентов с латентной формой ТВ от лиц, не зараженных Mycobacterium tuberculosis, и от пациентов с активной формой ТВ, что невозможно сделать с помощью других традиционных способов исследования как на основе теста внутрикожной реакции на туберкулин, так и на основе секреции IFN-γ, индуцированной с помощью PPD или с помощью ESAT-6. Это происходит, по-видимому, главным образом, благодаря лучшему клиническому отбору пациентов.
в. В литературе сообщается, что у туберкулезных пациентов в ответ на ESAT-6 секретируется IFN-γ, в противоположность первично инфицированным пациентам, но различие недостаточно хорошее, как показано на Фигуре 5.
г. Мы покажем, что расчет отношения между величиной nНВНА-специфической секреции IFN-γ и величиной секреции, индуцированной с помощью ESAT-6, может стать превосходным способом для различения первично инфицированных пациентов, которые не больны, и пациентов, больных туберкулезом (р=0.0003; n=8) (Фигура 6). Действительно, отношение составляет примерно 0.1 пг/мл для пациентов с активной формой ТВ, тогда как такое отношение составляет примерно 146.2 пг/мл для пациентов с латентной формой ТВ, и интервалы значений не перекрываются.
Эти выводы также применяют для идентификации пациентов с латентной формой ТВ среди здорового населения, так как у пациентов, не инфицированных Mycobacterium tuberculosis, в ответ на ESAT-6 не вырабатывается IFN-γ или вырабатывается в очень низких концентрациях (данные не показаны).
Добавлением антитела, блокирующего анти-TGF-β, можно во многих случаях продемонстрировать, что отсутствие периферической секреции IFN-γ в ответ на стимуляцию лимфоцитов с помощью НВНА очевидно происходит из-за заражения Mycobacterium tuberculosis больных пациентов, а не из-за отсутствия инфекции. Как показано на Фигуре 7, в присутствии анти-TGF-β секреция IFN-γ РВМС-клетками у туберкулезных пациентов значительно увеличивается (р=0.01). Этого не наблюдается у первично инфицированных пациентов.
3. Местная секреция IFN-γ в ответ на nНВНА
У туберкулезных пациентов, в противоположность к отсутствию секреции IFN-γ РВМС-клетками в ответ на nНВНА, стимуляция клеток, взятых из очагов локальной инфекции, в частности плевральных, альвеолярных, брюшинных и суставных жидкостей, позволяет наблюдать за основной реакцией IFN-γ в ответ на стимуляцию с помощью nНВНА или rНВНА в противоположность контрольным пациентам, не зараженным Mycobacterium tuberculosis, но представляющим клинические или радиологические признаки, которые сходны с туберкулезом. Когда объем местного образца позволяет осуществить выделение достаточного числа лимфоцитов, эти клетки стимулируют с помощью нативной формы НВНА, и количество IFN-γ, присутствующего в среде для культивирования, измеряют с помощью ELISA.
Результаты, показанные на Фигуре 8, демонстрируют, что концентрация IFN-γ, выделенного плевральными клетками после стимуляции с помощью НВНА, гораздо выше, чем концентрация, выделенная клетками контрольных, первично инфицированных или других пациентов. Различение туберкулезных и контрольных пациентов происходит гораздо хуже, если для стимуляции плевральных клеток in vitro используют другой антиген, в частности, PPD (Фигура 8).
Синтез НВНА-индуцированного IFN-γ плевральными клетками пациентов с плевральными выпотами туберкулезного происхождения можно также продемонстрировать с помощью анализа лимфоцитов с применением проточной цитометрии. Эта методика позволяет провести измерение процентного содержания лимфоцитов, которые содержат внутриклеточный IFN-γ и в которых индуцировали синтез путем краткой стимуляции in vitro с помощью НВНА. Эта методика имеет то преимущество, что является чрезвычайно быстрой, стимуляцию НВНА проводят в течение ночи, тем больше оснований сказать, что результат можно обеспечить через 24 часа. Результаты, показанные на Фигурах 9 и 10, демонстрируют, что большая часть CD4+ лимфоцитов из плевральной жидкости содержит IFN-γ после стимуляции НВНА, в то время как этого не происходит в случае с плевральными клетками из выпотов, которые не имеют туберкулезного происхождения, т.е. лица не заражены Mycobacterium tuberculosis (Фигура 10). Исследование секреции IFN-γ, вызванной НВНА, можно упростить путем ограничения анализа только лимфоцитами, выбранными на основании их размера и гранулярности.
В случае легочного туберкулеза (без плевральных выпотов) диагноз можно поставить с помощью изучения лимфоцитов из бронхо-альвеолярного лаважа. На самом деле, после короткой стимуляции in vitro с помощью НВНА (в течение ночи) большая часть местных CD4+ лимфоцитов (из местных очагов инфекции) содержит внутриклеточный IFN-γ, в противоположность лимфоцитам у контрольных пациентов (Фигура 11). Различение туберкулезных и не туберкулезных пациентов происходит лучше, когда в качестве мишени выбирают предпочтительно местные CD4+ клетки, а не местные CD8+ клетки (Фигура 11), и анализ можно также ограничить только лимфоцитами.
При заболевании туберкулезом суставов высокое процентное отношение лимфоцитов, выделенных из эффузии (положительный результат KB культивирования на выпоте), синтезируют IFN-γ после краткой стимуляции НВНА in vitro, в противоположность местным лимфоцитам, взятым у группы контрольных лиц, имеющих эффузию не туберкулезного происхождения (таблица 4).
И наконец, в случае с перитонитом туберкулезного происхождения, 31% лимфоцитов, присутствующих в этой жидкости, содержит внутриклеточный IFN-γ после короткой стимуляции НВНА in vitro. В одном из случаев поражения желез туберкулезного происхождения, 1.8% лимфоцитов отреагировали на НВНА синтезом IFN-γ, который позволил еще раз диагностировать заболевание туберкулезного происхождения менее чем через 24 часа.
Таблица 4: Процент CD4+ CD3+ Т-лимфоцитов, которые содержат IFN-γ после стимуляции nHABA лимфоцитов из очага туберкулезной инфекции по соотношению к контрольным пациентам; «-» без стимуляции; «Nd» - не определяется; «KB+» - положительный результат на бациллы Коха.
Список Литературы
1. Frieden T.R., Sterling T.R., Munsiff S.S. et al. Lancet 2003; 362: 887-99.
2. Maher D., Chalet P., Spinaci S. et al. Treatment of tuberculosis: guidelines for national programmes. 2nd ed. Geneva: W.H.O. 1997.
3. Siddiqi К., Lambert MX., Walley J. The Lancet Infect. Dis. 2003; 3: 288-296.
4. Strumpf L, Tsang A., Syre J. Am. Rev. Respir. Dis. 1979; 119: 599-602.
5. Travis W. et al. Mycobacterial pneumonias. B: West King D, ed. Non-Neoplastic Disorders of the Lower Respiratory Tract, 1st ed. Washington DC: AFIP; 2002: 579-87.
6. Hruban RH, Hutchins GM. Mycobacterial infections. B: Dail DH, Hammar SP, eds. Pulmonary pathology, 2nd ed. New York: Springier Verlag; 1994: 331-50.
7. Kaufmann SH.: Nat. Rev. Immunol. 201; 1: 20-30.
8. Converse PJ, Jones SL, Astemborski J et al. J. Infect. Dis. 1997; 176: 144-50.
9. Andersen P., Munk M.E., Pollock J.M. et al. The Lancet 2000; 356: 1099-1104.
10. Pethe К. Ouech V., Daffe M. et al. Mol. Microbiol. 2001; 39: 89-99.
11. Pethe К., Alonso S., Biet F. et al. Nature 2001; 412: 190-194.
12. Pethe К., Bifani P., Drobecq H. et al. Proc. Natl Acad. Sci 2002; 99: 10759-10764.
13. Temmerman S., Pethe К., Parra M. et al. submitted.
14. Masungi C, Temmerman S., Van Vooren J.P. et al. J. Infect. Dis. 2002; 185: 513-520.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ АКТИВНОСТИ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ У ДЕТЕЙ И ПОДРОСТКОВ | 2015 |
|
RU2586279C1 |
| ПОЛИАНТИГЕННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ И ВСПОМОГАТЕЛЬНОГО ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2019 |
|
RU2724896C1 |
| СПОСОБ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА ЛЕГКИХ | 2012 |
|
RU2503005C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pTSE6, КОДИРУЮЩАЯ ГИБРИДНЫЙ ПОЛИПЕПТИД GST-ESAT-6 СО СВОЙСТВАМИ ВИДОСПЕЦИФИЧНОГО МИКОБАКТЕРИАЛЬНОГО АНТИГЕНА ESAT-6, РЕКОМБИНАНТНЫЙ ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГИБРИДНОГО ПОЛИПЕПТИДА GST-ESAT-6 И РЕКОМБИНАНТНЫЙ ПОЛИПЕПТИД GST-ESAT-6 | 2004 |
|
RU2282661C2 |
| Способ прогнозирования развития туберкулеза у здоровых лиц | 2018 |
|
RU2707571C1 |
| СПОСОБ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА И ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА И ЛАТЕНТНОЙ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ | 2014 |
|
RU2576833C1 |
| СПОСОБ ДИАГНОСТИКИ ТУБЕРКУЛЕЗНОГО ИНФИЦИРОВАНИЯ | 2012 |
|
RU2503006C1 |
| СПОСОБ ИММУНОЛОГИЧЕСКОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ У ДЕТЕЙ И ПОДРОСТКОВ С ЛАТЕНТНОЙ ИНФЕКЦИЕЙ | 2020 |
|
RU2726789C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ СПЕЦИФИЧЕСКОГО ВОСПАЛЕНИЯ ПРИ НАЛИЧИИ МИНИМАЛЬНЫХ ТУБЕРКУЛЕЗНЫХ ИЗМЕНЕНИЙ У ДЕТЕЙ И ПОДРОСТКОВ | 2019 |
|
RU2728943C1 |
| БИОМАРКЕРЫ ДЛЯ ТУБЕРКУЛЕЗА | 2014 |
|
RU2697549C2 |
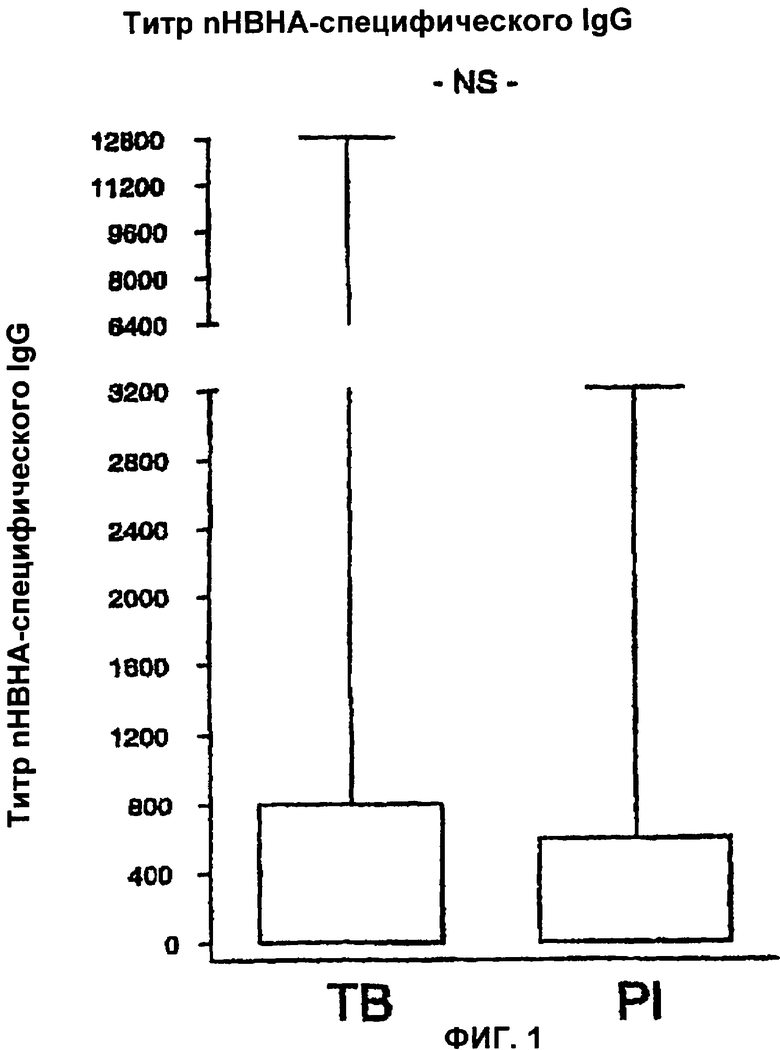
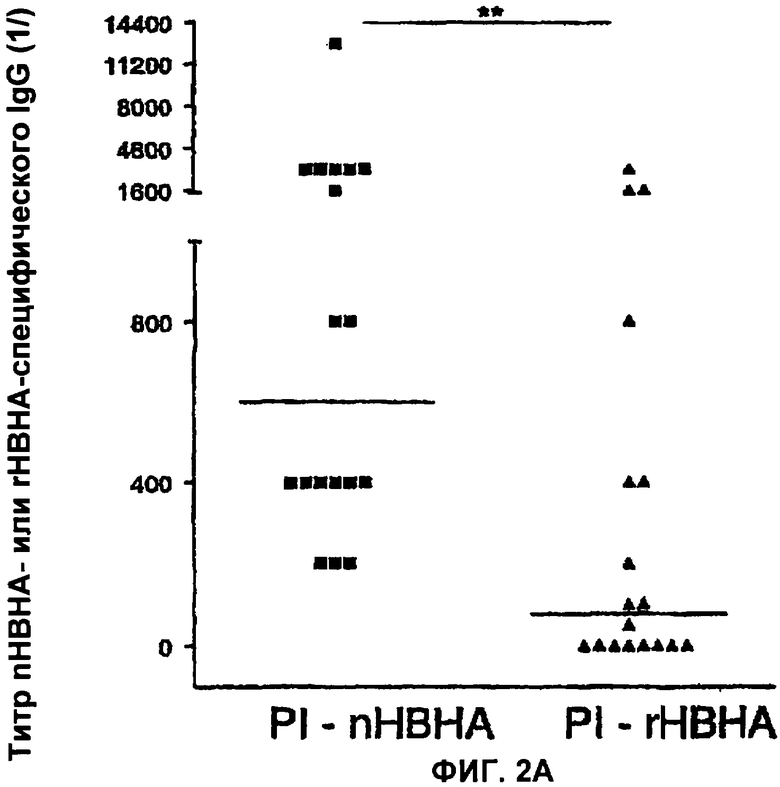
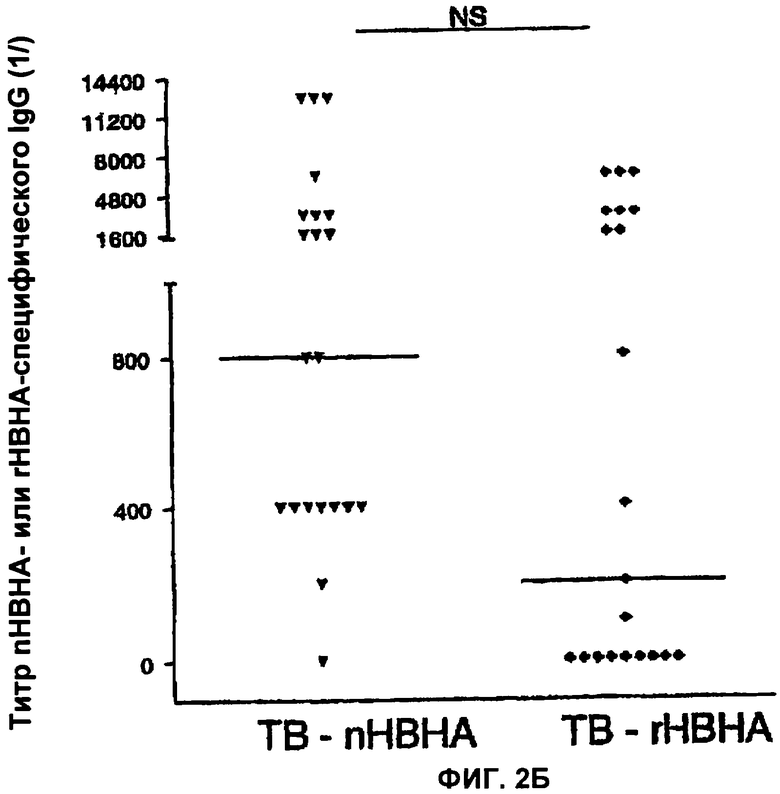
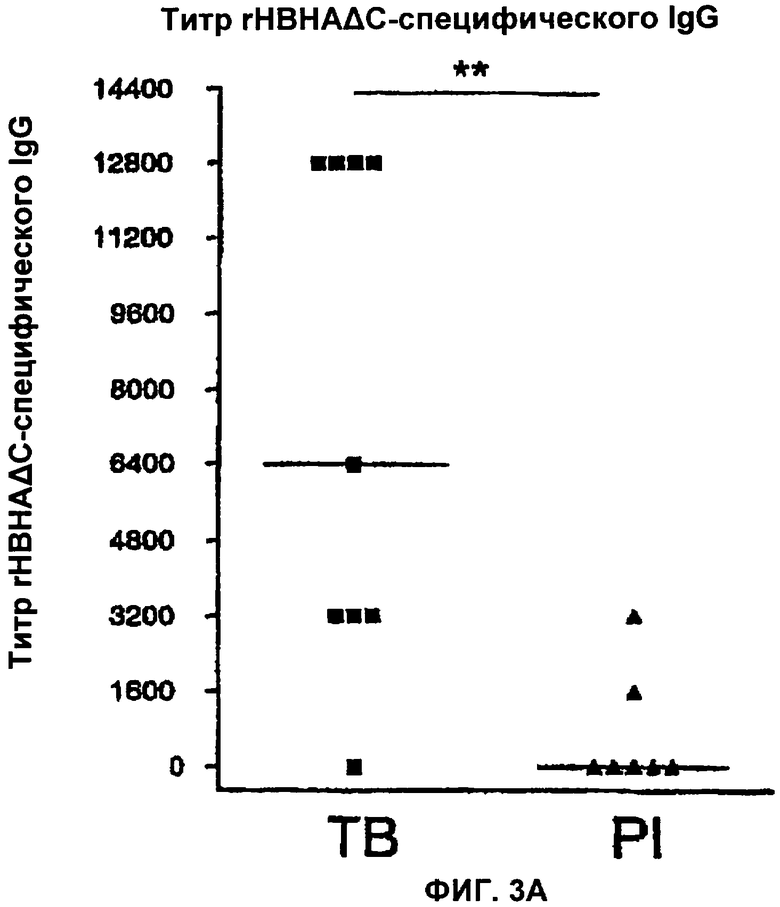
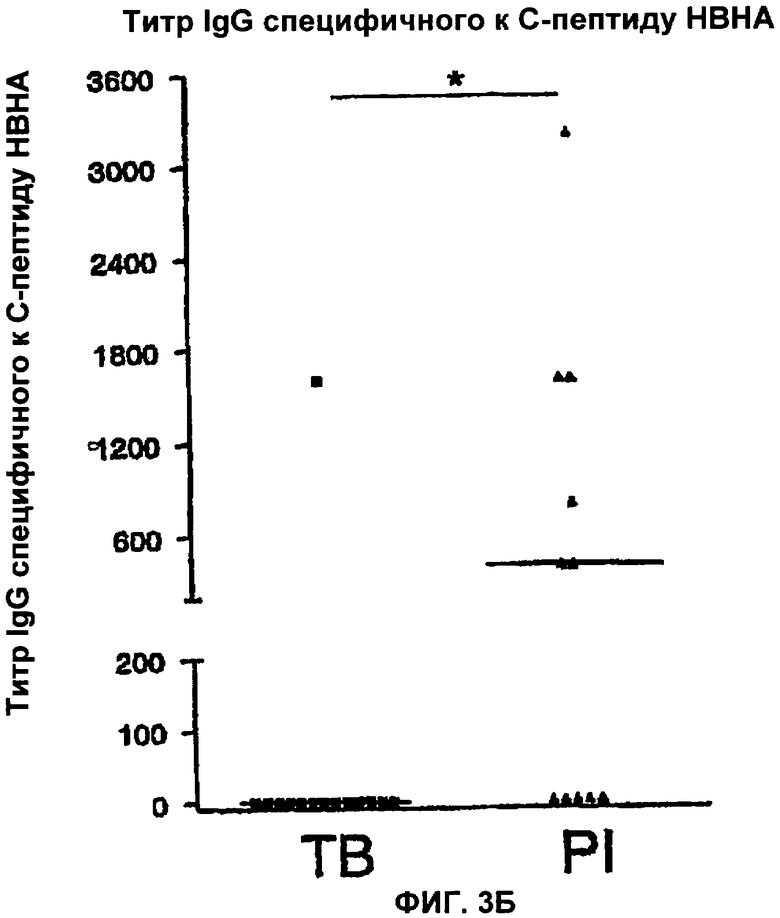
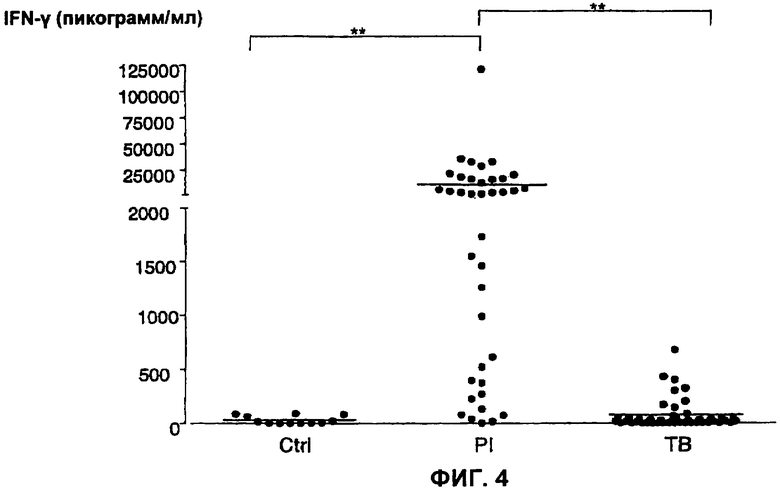
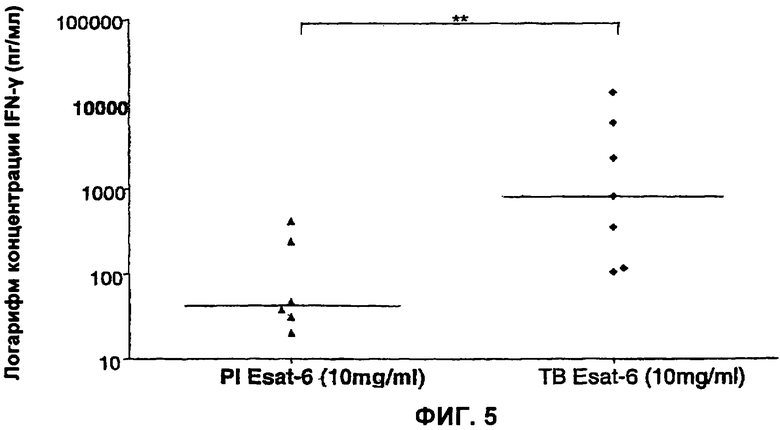
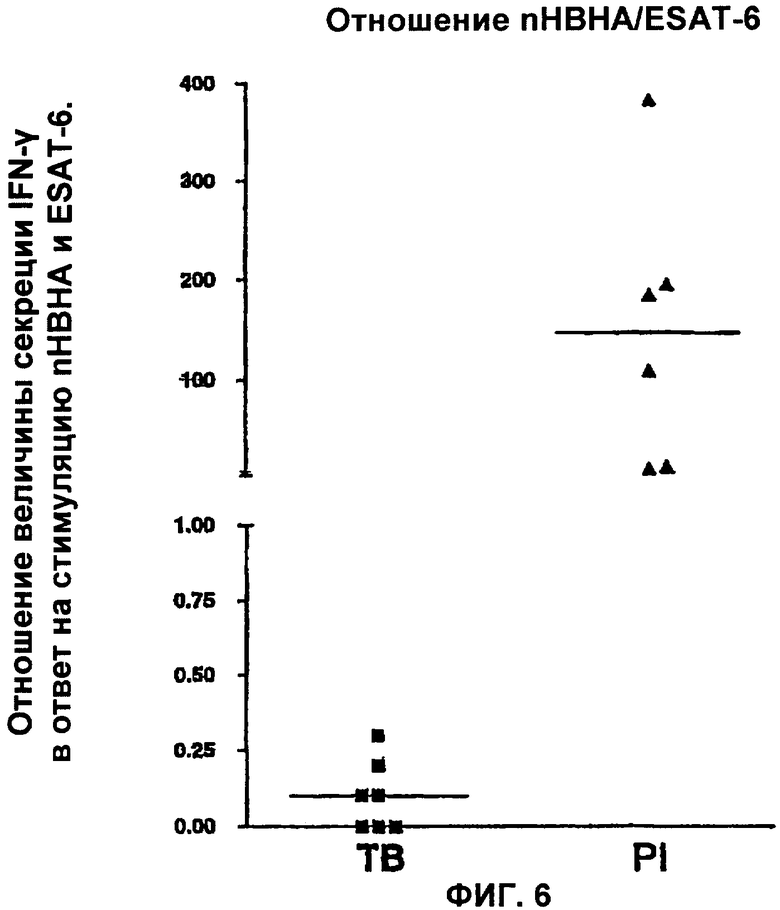
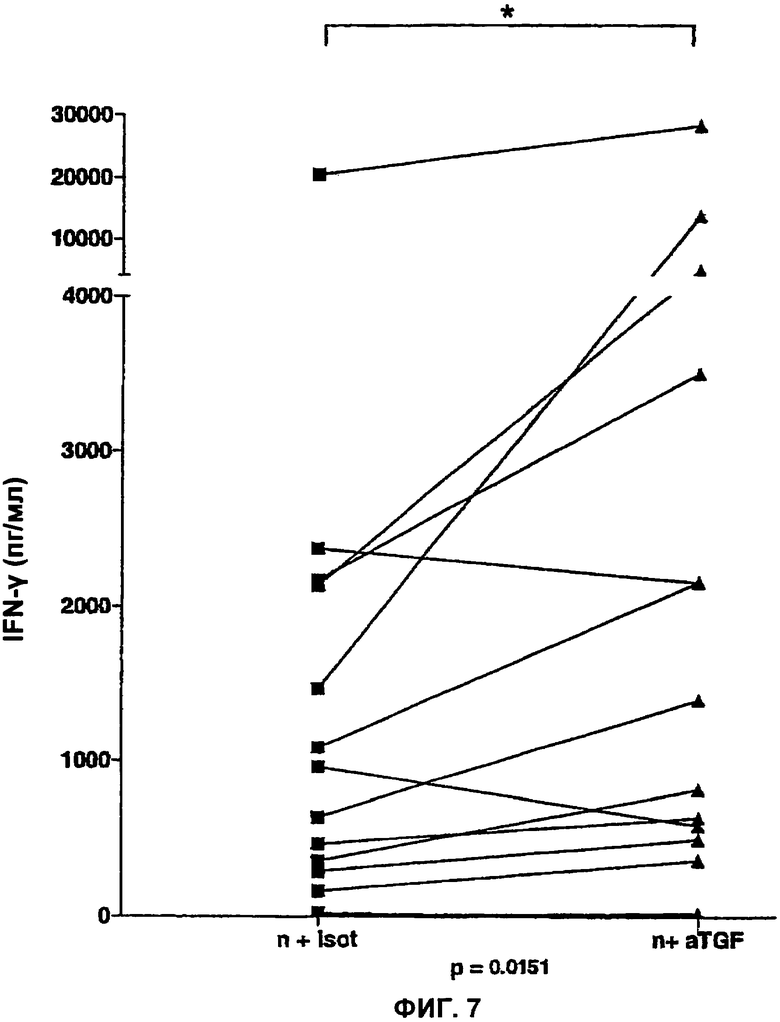
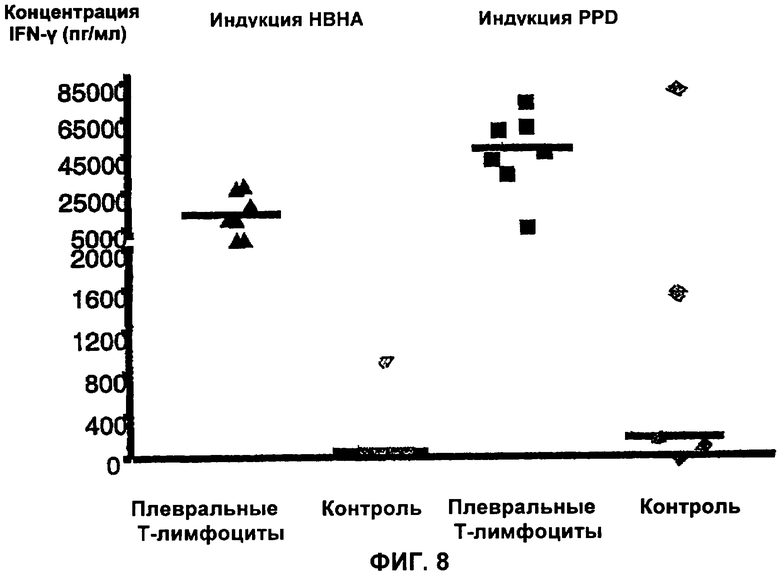
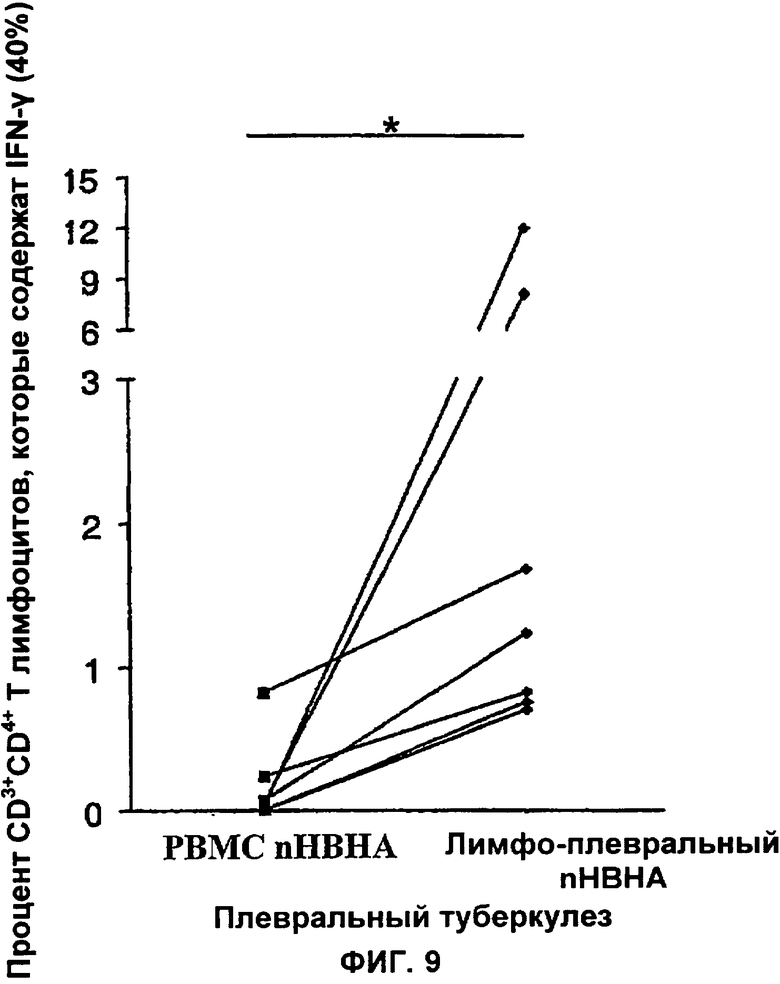

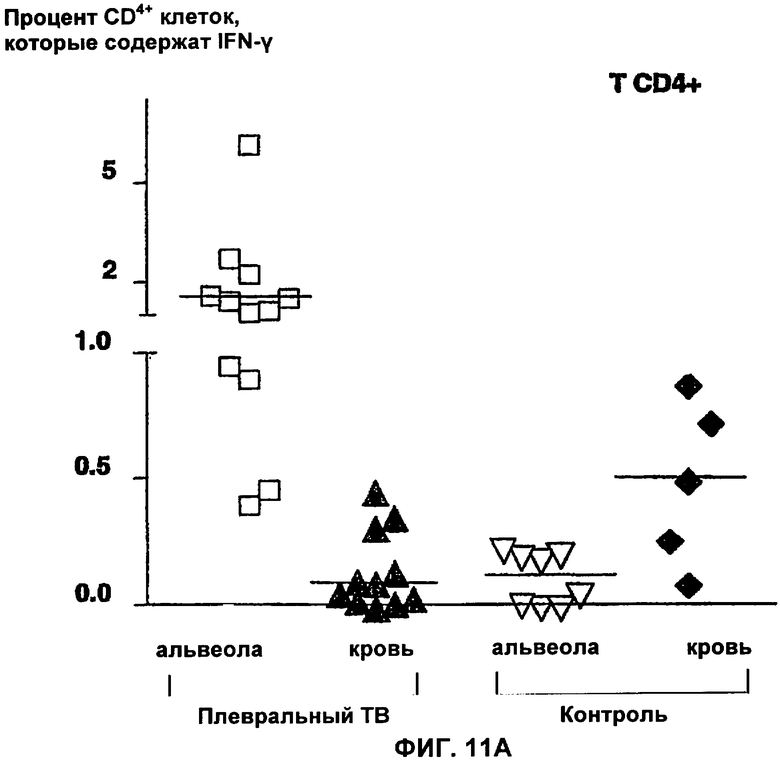
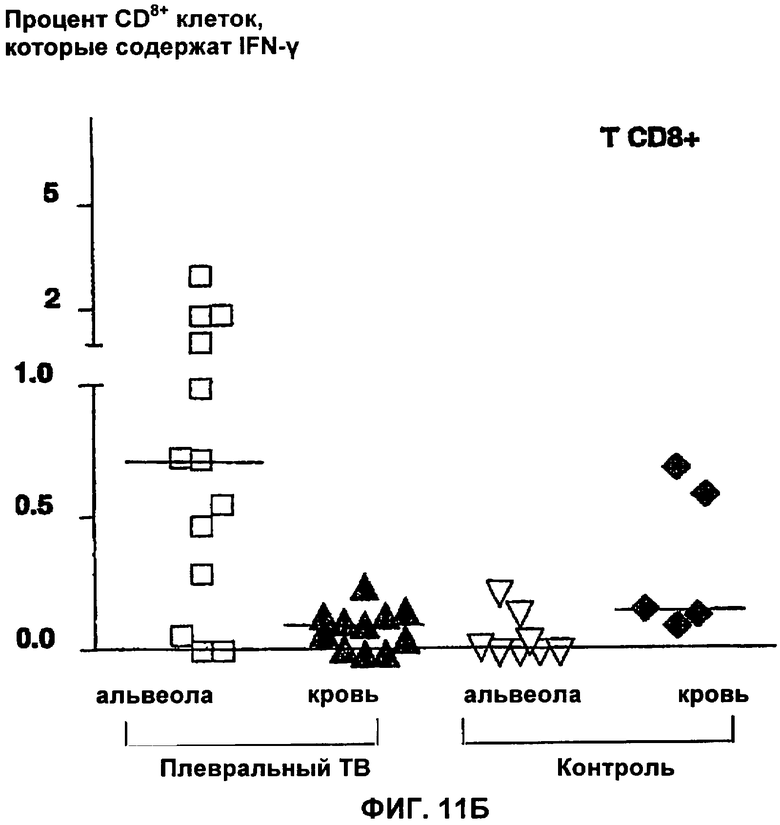
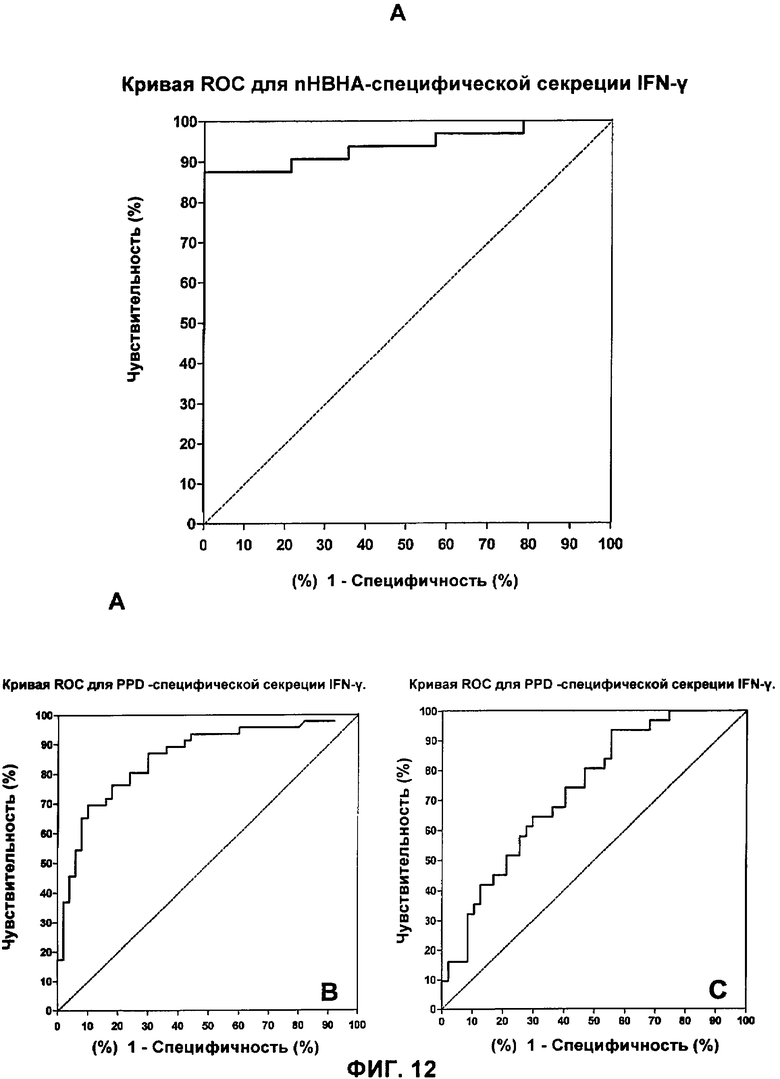
Настоящее изобретение относится к способам обнаружения in vitro заражения млекопитающих Mycobacterium tuberculosis и способам дифференциации in vitro млекопитающего, инфицированного Mycobacterium tuberculosis, которое имеет скрытую форму туберкулеза, и млекопитающего с активной формой туберкулеза, и способу дифференциации млекопитающего, которое имеет активную форму туберкулеза, и млекопитающего, не инфицированного Mycobacterium tuberculosis, или млекопитающего, которое имеет латентную форму туберкулеза. Настоящее изобретение также относится к наборам для обнаружения и дифференциации инфицированного млекопитающего, которое имеет симптомы туберкулеза, и инфицированным млекопитающим без признаков развития заболевания, и к набору для различения млекопитающего, которое имеет активную форму туберкулеза, и млекопитающего, не инфицированного Mycobacterium tuberculosis, или млекопитающего, которое имеет латентную форму туберкулеза. Использование способов и наборов по настоящему изобретению позволяет обнаружить in vitro зараженных млекопитающих с активной и латентной формами туберкулеза. 8 н. и 21 з.п. ф-лы, 4 табл., 15 ил.
1. Способ обнаружения и дифференциации in vitro млекопитающего, которое имеет скрытую форму туберкулеза, и млекопитающего с активной формой туберкулеза, при этом указанный способ включает
а) получение биологического образца от указанного млекопитающего;
б) приведение указанного биологического образца независимым образом в контакт с двумя различными формами белка НВНА в условиях, при которых возможно взаимодействие антител с белком НВНА, причем две указанные различные формы белка НВНА представляют собой (1) нативную форму белка НВНА, содержащую 199 аминокислот и (2) рекомбинантную неметилированную форму белка НВНА, содержащую 199 аминокислот, при этом указанные антитела (IgG), представляют собой антитела, направленные против указанных двух различных форм белка НВНА;
в) измерение количества указанных антител в указанном биологическом образце;
г) сравнение титров антител, полученных для указанных двух различных форм белка НВНА,
при этом отсутствие значимых различий в количестве антител, направленных против указанной нативной формы НВНА и количестве антител, направленных против указанной рекомбинантной формы НВНА указывают на наличие у млекопитающего активной формы туберкулеза;
тогда как значимо большее количество антител, направленных против указанной нативной формы НВНА по сравнению с количеством антител, направленных против указанной рекомбинантной формы НВНА указывает на наличие у млекопитающего латентной формы туберкулеза.
2. Способ по п.1, отличающийся тем, что биологический образец представляет собой сыворотку крови.
3. Способ обнаружения и дифференциации in vitro млекопитающего, которое имеет скрытую форму туберкулеза, и млекопитающего с активной формой туберкулеза, при этом указанный способ включает
а) получение биологического образца от указанного млекопитающего;
б) приведение указанного биологического образца независимым образом в контакт с двумя различными формами белка НВНА в условиях, при которых возможно взаимодействие антител с белком НВНА, причем две указанные различные формы белка НВНА представляют собой фрагмент rНВНАΔС, который состоит из остатков аминокислот 1-160 рекомбинантного белка НВНА и метилированный С-концевой фрагмент, который состоит из остатков аминокислот 161-199 нативного белка НВНА, при этом указанные антитела (IgG) представляют собой антитела, направленные против указанных двух различных форм белка НВНА;
в) измерение количества указанных антител в указанном биологическом образце;
г) сравнение титров антител, полученных для указанных двух различных форм белка НВНА,
при этом количество антител, направленных против метилированного С-концевого фрагмента белка НВНА, которое значимо больше, чем количество антител, направленных против фрагмента rНВНАΔС белка НВНА, указывает на наличие у млекопитающего латентной формы туберкулеза;
тогда как количество антител, направленных против фрагмента rНВНАΔС белка НВНА, которое значимо больше, чем количество антител, направленных против метилированного С-концевого фрагмента белка НВНА указывает на наличие у млекопитающего активной формы туберкулеза.
4. Способ по п.3, отличающийся тем, что биологический образец представляет собой сыворотку крови.
5. Набор для обнаружения и дифференциации млекопитающего, которое имеет латентную форму туберкулеза и млекопитающего, с активной формой туберкулеза, причем указанный набор содержит:
- нативную форму белка НВНА, содержащую 199 аминокислот и рекомбинантную неметилированную форму белка НВНА, содержащую 199 аминокислот;
- реагенты, требуемые для создания среды для осуществления иммунологической реакции между антителами, которые содержатся в биологическом образце от указанного млекопитающего и указанных различных форм НВНА; и
- реагенты, позволяющие обнаружить иммунологические комплексы, образованные в ходе указанной иммунологической реакции;
6. Набор по п.5, отличающийся тем, что дополнительно включает по меньшей мере один контрольный образец ткани или биологический образец.
7. Набор для обнаружения и дифференциации млекопитающего, которое имеет латентную форму туберкулеза и млекопитающего, с активной формой туберкулеза, причем указанный набор содержит:
- фрагмент rНВНАΔС, который состоит из остатков аминокислот 1-160 рекомбинантного белка НВНА и метилированный С-концевой фрагмент, который состоит из остатков аминокислот 161-199 нативного белка НВНА,
- реагенты, требуемые для создания среды для осуществления иммунологической реакции между антителами, которые содержатся в биологическом образце от указанного млекопитающего и указанных различных форм НВНА и
- реагенты, позволяющие обнаружить иммунологические комплексы, образованные в ходе указанной иммунологической реакции.
8. Набор по п.7, отличающийся тем, что дополнительно включает по меньшей мере один контрольный образец ткани или биологический образец.
9. Способ обнаружения и дифференциации in vitro млекопитающего, которое имеет латентную форму туберкулеза, и млекопитающего с активной формой туберкулеза, или выявления млекопитающего, которое имеет латентную форму туберкулеза среди здоровой популяции, причем указанный способ включает:
а) получение биологического образца от указанного млекопитающего;
б) приведение клеток, которые присутствуют в указанном биологическом образце, независимым образом в контакт с нативной формой НВНА и с ESAT-6 в условиях, при которых возможна секреция IFN-γ;
в) измерение уровней НВНА-специфической секреции IFN-γ и ESAT-6-специфической секреции IFN-γ; и
г) вычисление отношения между уровнями НВНА-специфической секреции IFN-γ и ESAT-6-специфической секреции IFN-γ, причем отношение величин секреции меньше 1, характерно для млекопитающего, которое имеет активную форму туберкулеза, в то время как отношение величин секреции больше 1 характерно для млекопитающего, которое имеет латентную форму туберкулеза.
10. Способ по п.9, отличающийся тем, что указанное отношение величин секреции, полученное для клеток, которые присутствуют в указанном образце от млекопитающего, которое имеет латентную форму туберкулеза находится в интервале 100-400.
11. Способ по п.9, отличающийся тем, что указанное отношение величин секреции, полученное для клеток, которые присутствуют в указанном образце от млекопитающего, которое имеет активную форму туберкулеза меньше, чем 0.5.
12. Способ по любому из пп.9-11, отличающийся тем, что указанный биологический образец выбирают из группы, включающей: бронхиальное выделение, бронхо-альвеолярный лаваж (BAL), желудочный лаваж, мокроту, образец выпотов, в частности, плевральной, абдоминальной и суставной жидкости, цереброспинальной жидкости, спинно-мозговой жидкости, синовиальной жидкости, брюшинной жидкости, перикардиальной жидкости и другой жидкости тела, биопсию лимфатических узлов, трансбронхиальную биопсию, плевральную и печеночную биопсию, медуллярную и поясничную пункцию, пробу мочи или крови и гнойное выделение.
13. Способ по любому из пп.9-11, отличающийся тем, что стадия б) включает приведение нативной формы НВНА и ESAT-6 независимым образом в контакт с РВМС.
14. Способ по любому из пп.9-11, включающий перед стадией б) дополнительную стадию поддержания клеток, которые присутствуют в указанном биологическом образце в культуре.
15. Набор для обнаружения и дифференциации млекопитающего, которое имеет латентную форму туберкулеза и млекопитающего, с активной формой туберкулеза, или для идентификации млекопитающего, которое имеет латентную форму туберкулеза среди здоровой популяции; указанный набор содержит:
- нативные формы НВНА и ESAT-6;
- реагенты для создания среды для осуществления независимым образом контакта клеток, присутствующих в биологическом образце от указанного млекопитающего с нативными формами НВНА и ESAT-6; и
- реагенты для обнаружения секреции IFN-γ, следующей за контактом.
16. Набор по п.15, отличающийся тем, что дополнительно содержит по меньшей мере один контрольный образец ткани или биологический образец.
17. Набор по любому из пп.15 или 16, отличающийся тем, что дополнительно содержит среду для культивирования биологического образца.
18. Способ для обнаружения и дифференциации in vitro млекопитающего, которое имеет активную форму туберкулеза, и млекопитающего, не инфицированного Mycobacterium tuberculosis, или млекопитающего, которое имеет латентную форму туберкулеза; указанный способ включает:
а) получение биологического образца из очага локальной инфекции у указанного млекопитающего;
б) приведение клеток, которые содержатся в указанном биологическом образце в контакт с нативной формой белка НВНА, содержащей 199 аминокислот или рекомбинантной неметилированной формой белка НВНА, содержащей 199 аминокислот, в условиях, при которых достигается влияние на IFN-γ;
в) определение статуса указанного млекопитающего посредством:
в1) измерения количества IFN-γ, секретированного после контакта клеток с указанными указанной нативной формой белка НВНА или указанной рекомбинантной формой белка НВНА, причем количество секретированного НВНА-специфического IFN-γ больше, чем 1000 пг/мл характерно для млекопитающего, которое имеет активную форму туберкулеза, а количество секретированного НВНА-специфического IFN-γ меньше, чем 1000 пг/мл характерно для млекопитающего, которое не инфицировано Mycobacterium tuberculosis или млекопитающего с латентной формой туберкулеза, или
в2) подсчета относительного количества клеток, у которых IFN-γ присутствует в цитоплазме после осуществления контакта указанных клеток с НВНА в составе популяции или суб-популяции лимфоцитов, причем относительное количество клеток, в которых IFN-γ присутствует в цитоплазме больше, чем 0.3% характерно для млекопитающего с активной формой туберкулеза, а указанное относительное количество клеток, в которых IFN-γ присутствует в цитоплазме меньше, чем 0.3% характерно для млекопитающего, которое не инфицировано М. tuberculosis или млекопитающего с латентной формой туберкулеза.
19. Способ по п.18, отличающийся тем, что количество НВНА-специфического IFN-γ, секретированного клетками, которые присутствуют в указанном биологическом образце от млекопитающего с активной формой туберкулеза, больше, чем 5000 пг/мл.
20. Способ по п.18, отличающийся тем, что количество НВНА-специфического IFN-γ, секретированного клетками, которые присутствуют в указанном биологическом образце от млекопитающего, не инфицированного Mycobacterium tuberculosis, или млекопитающего, которое имеет латентную форму туберкулеза, меньше, чем 100 пг/мл.
21. Способ по п.18, отличающийся тем, что указанная доля клеток биологического образца от млекопитающего с активной формой туберкулеза больше, чем 0.5%.
22. Способ по любому из пп.18-21, включающий перед стадией б) дополнительную стадию поддержания указанного биологического образца в культуре.
23. Способ по любому из пп.18-22, отличающийся тем, что указанный биологический образец выбирают из группы, включающей: бронхиальное выделение, бронхо-альвеолярный лаваж (BAL), желудочный лаваж, мокроту, образец выпотов, в частности, плевральной, абдоминальной и суставной жидкости, цереброспинальной жидкости, спинно-мозговой жидкости, синовиальной жидкости, брюшинной жидкости, перикардиальной жидкости и другой жидкости тела, биопсию лимфатических узлов, трансбронхиальную биопсию, плевральную и печеночную биопсию, медуллярную и поясничную пункцию, образец мочи или крови и гнойное выделение.
24. Способ по любому из пп.18-21, отличающийся тем, что клетки представляют собой CD3+ CD4+ Т-лимфоциты.
25. Набор для обнаружения дифференциации млекопитающего, которое имеет активную форму туберкулеза, и млекопитающего, не инфицированного Mycobacterium tuberculosis, или млекопитающего, которое имеет латентную форму туберкулеза, указанный набор содержит:
- нативную форму белка НВНА, содержащую 199 аминокислот, или рекомбинантную неметилированную форму белка НВНА, содержащую 199 аминокислот;
- реагенты для создания подходящей среды для приведения клеток, присутствующих в указанном биологическом образце от указанного млекопитающего в контакт с НВНА;
- реагенты для обнаружения IFN-γ после указанного контакта.
26. Набор по п.25, отличающийся тем, что дополнительно содержит по меньшей мере один контрольный образец ткани или биологический образец.
27. Набор по любому из пп.25 или 26, отличающийся тем, что дополнительно содержит среду для культивирования биологического образца.
28. Набор по любому из пп.25 или 27, отличающийся тем, что реагенты для обнаружения позволяют количественно определять секрецию IFN-γ.
29. Набор по любому из пп.25 или 27, отличающийся тем, что реагенты для обнаружения позволяют определять количество внутрицитоплазматического INF-γ.
| СПОСОБ ДИАГНОСТИКИ ОГРАНИЧЕННЫХ ФОРМ ТУБЕРКУЛЕЗА ЛЕГКИХ | 1997 |
|
RU2143699C1 |
| RU 22119547 C2, 20.12.2003 | |||
| PETHE K | |||
| et al., Mycobacterial heparin-binding hemagglutinin and laminin-binding protein share antigenic methyllysines that confer resistance to proteolysis // PNAS, 2002, V.99, No 16, P.10759-10764 | |||
| MASUNGI C | |||
| et al., Differetial Т and В cell responses against Mycobacterium tuberculosis | |||
Авторы
Даты
2011-08-10—Публикация
2005-06-30—Подача