Изобретение относится к области медицины и может быть использовано для диагностики, контроля лечения и прогноза сосудистой патологии, для повышения эффективности лечения сосудистой патологии и снижения количества терапевтических осложнений, снижения себестоимости лечения больных за счет своевременной и достоверной диагностики.
В настоящее время широко распространено мнение, что диагностика и средства диагностики суть одно и то же. Достаточно приобрести тепловизор, направить на объект контроля, получить хорошие термограммы - и контроль проведен. Однако необходимо понять, что результаты измерений - всего лишь поле информационного сигнала с кожи пациента. По анализу характеристик поля возможно определить лишь участки с той или иной степенью отклонения. Однако невозможно определить количественные показатели внутренней патологии.
Для определения количественных показателей необходимо не просто поле измерений, а проведение диагностики по специальной методике контроля, т.е. необходимо поставить в соответствие аномалии поля поверхности с конкретными внутренними нарушениями функционирования внутренних органов. При этом этап регистрации информационного поля на поверхности кожного покрова является лишь одним из многих.
К настоящему времени накоплен большой опыт применения термографии в диагностической медицине. В работах отечественных и зарубежных ученых показаны широкие возможности метода в комплексной диагностике заболеваний, приведены достаточно надежные критерии для выявления многих болезней. Такие методы дают возможность определить отсутствие или наличие нарушения регионарного кровообращения, степень его выраженности, в большинстве случаев установить причину патологии и т.п.
Живой организм непрерывно расходует на поддержание жизненно важных функций энергию, которая появляется в результате окислительных процессов, происходящих в организме. Организм способен поддерживать температуру на постоянном уровне независимо от температуры окружающей среды. Температура внутренних органов у таких организмов находится в пределах от 37 до 38°С. Данная температура способствует метаболическим процессам, поддерживает функционирование ферментов, определяет физико-химические процессы. В различных частях тела температура неодинакова и определяется расположением органа, степенью кровоснабжения, функциональной активностью, температурой внешней среды. Основное количество тепла вырабатывается во внутренних органах, но при физической работе положение изменяется в связи с усилением метаболических процессов в мышцах: температура сокращающихся мышц повышается на 7°C. Температура тела генетически детерминирована и способна изменяться в известных пределах [Макаров В.А., Судаков К.В., 1983; Fujishima H. et al., 1994; Khizhnyak E.P. et al., 1994; Hussley D.L. et al., 1995; Gersing E. et al., 1995].
Тепловая энергия постоянно вырабатывается в организме и зависит от интенсивности метаболических процессов и состояния кровообращения.
За 40 последних лет метод диагностики заболеваний по анализу температурных полей - термолокационое зондирование - проявил себя как метод функционального исследования, который позволяет получать сведения, необходимые для выявления различной патологии. Термолокационное зондирование, в т.ч. термография - практически единственный способ эффективной оценки продукции и переноса тепла в тканях. Путем анализа распределения тепла на поверхности тела человека можно констатировать наличие патологических изменений, происходящих во внутренних органах, и оценивать их динамику под влиянием лечения [Morgan P.D. et al., 1995; Parada M.A. et al., 1995; Sherman R.A. et al., 1995; Varon M. et al., 1995; Veo S. et al., 1995].
Среди имеющихся методов инструментального исследования термолокационое зондрование занимает особое место, так как помогает выявить соотношение между выраженностью клинических проявлений заболевания и температурой кожных покровов. Этот метод открывает новые широкие возможности в диагностике различных заболеваний человека.
Одна из первых попыток применения этого метода в медицине была осуществлена в 1925 г. немецким ученым М.Черни. В 1956 г. канадский хирург Р.Лауссон обследовал молочные железы больных раком этого органа и получил определенную тепловую картину, отличающуюся от таковой у здоровых лиц. Это открытие положило начало медицинской практике. Первые термографические исследования в нашей стране выполнены на отечественном аппарате М.М.Мирошниковым и М.А.Собакиным в 1962 г. [Розенфельд Л.Г., 1988].
Б.В.Петровский и др. (1966), А.Г.Выховская (1966), Т.П.Макаренко (1970), G.Biasi и др. (1994), M.E.Weiss и др. (1994) определили диагностические возможности метода при различных заболеваниях.
Термолокационное зондирование относится к категории исследований, которые расширяют возможности анализа биологических процессов, происходящих в органах и тканях организма. Короткая история метода дает возможность определить его место в диагностике многих заболеваний организма человека, прежде всего в их ранней стадии, когда еще отсутствуют болезненные симптомы. В этом немалую и роль играет применение вычислительной техники, позволяющей проводить анализ информационных полей.
Заявленный способ отличается от других методов исследования своей физиологичностью, количественной характеристикой, возможностью применения у ослабленных больных. Он дает хорошие результаты при использовании с целью раннего выявления многих заболеваний, особенно на первом этапе диагностики в амбулаторно-поликлинической практике, а также при проведении профилактических осмотров и наблюдении за диспансерной группой больных.
В настоящее время только с помощью данного метода можно легко определить сосудистою патологию, нарушение кровообращения в нижних конечностях, особенно на ранних стадиях его развития и т.п. Аналогично диагностируются и другие заболевания: тромбофлебиты, посттромбофлебитический синдром и др. Все воспалительные заболевания организма, включая острую хирургическую патологию органов брюшной полости, являются идеальной областью для диагностики с помощью термолокационного зондирования. Динамичное наблюдение за этой категорией больных позволяет оценить эффективность лечения и выявить возможные послеоперационные осложнения.
Интенсивное развитие метод термолокационного зондирования в медицине получил, когда к нему стали подходить с мерками функционального метода, т.е. исследовать реакцию динамики изменения температурных полей в ответ на различные провоцирующие нагрузки.
В настоящее время в России и за рубежом отсутствуют объективные, достоверные методы диагностики сосудистой патологии в клинике нервных болезней.
Все существующие методы направлены на качественный анализ температурных полей кожного покрова пациента. Диагноз базируется на опыте врача. При этом отсутствуют методы, позволяющие по видеоизображению температурного поля определять причины образования аномальных участков - предположительные причины заболеваний тех или иных внутренних органов человека. При такой постановке процесса диагностирования достоверность диагноза, как сказано выше, будет определяться исключительно опытом врача, а роль компьютерной тепловизионной системы сводится к «большому дорогому термометру».
С учетом существующей приборной базы и созданного Российскими учеными математического аппарата и программно-методического обеспечения (в т.ч. биологических объектов) созданы все необходимые предпосылки для перехода методов диагностики на качественно новый практический уровень.
Из уровня техники известны способы и устройства для диагностики заболеваний по анализу температурных полей кожи человека. К ним относятся:
1. SU 1748820 Способ определения состояния кровообращения верхних конечностей (03.11.1989).
2. RU 2094037 Способ экспресс-диагностики патологии внутренних органов (27.10.1997).
3. RU 2088137 Способ экспресс-диагностики патологии внутренних органов (27.08.1997).
4. RU 2085110 Способ диагностики хронической окклюзии бедренной артерии в гунтеровом канале (27.07.1997).
5. RU 2077257 Способ дифференциональной диагностики врожденных ангиодисплазий конечностей (20.04.1997).
6. RU 2043074 Способ ранней диагностики опухолевых заболеваний молочной железы (10.09.1995).
7. RU 2168931 Способ экспресс-диагностики нарушений нейроэндокринной регуляции отделов гипоталамо-гипофизарно-гонадной системы (20.06.2001).
8. RU 2143220 Способ термографической диагностики окклюзионных заболеваний артерий (27.12.1999).
9. RU 2066976 Способ экспресс-диагностики группы риска патологии внутренних органов (27.09.1996).
10. RU 2123670 Способ диагностики ишемического поражения головного мозга у недоношенных детей (12.20.1998).
11. RU 2018263 Способ определения реактивности кровеносных сосудов (30.08.1994).
12. RU 2115360 Способ диагностики ишемической болезни сердца (20.07.1998).
13. RU 2145791 Способ определения термореактивности кожи (27.02.2000).
Недостатки приведенных способов диагностики общие для всех и очевидны:
- диагностическое заключение о заболевании производится на основании сравнения реального распределения температурного поля на поверхности кожи человека с некоторым идеальным распределением, которое априори принимается за распределение на здоровом человеке. Количество «идеальных» распределений может быть достаточно большим, что определяется физиологическими и анатомическими особенностями людей. Поэтому данные методы являются в большой степени субъективными, а достоверность диагностического заключения практически полностью определяется квалификацией и опытом работы врача, осуществляющего обследование и диагностику,
- каждый метод диагностики является строго индивидуальным и направлен на диагностику своего специфического заболевания, т.к. формирование диагностического заключения определяется архивом (базой) идеальных термограмм здорового человека,
- методы не позволяют «заглянуть внутрь» человека и достоверно определить причину температурной аномалии (заключение осуществляется только на основе существующего архива термограмм), что снижает вероятность назначения правильного лечения заболевания,
- некоторые одинаковые аномалии образуются вследствие различных заболеваний, т.е. некоторые различные внутренние заболевания дают одинаковые аномалии, и существующий способ не позволяет их распознавать.
Наиболее близким к заявляемому способу является способ диагностики заболеваний, описанный в книге: Зеновко Г.И. Термография в медицине. - М., Медицина, 1998, 168 с.
В отличие от рассмотренных выше методов он включает специальные функциональные нагрузки на организм, усиливающие контраст температурного поля кожной поверхности от диагностируемого заболевания (изменение температуры между различными областями поверхности), регистрацию распределения температурного поля по поверхности и сравнение зарегистрированного распределения с некоторым эталонным распределением. По результатам анализа отличий двух распределений формируется диагностическое заключение.
Все остальные недостатки, описанные выше, присущи и этому способу.
В последнее десятилетие произошел принципиально качественный скачок в развитии метода диагностики объектов по температурным полям. Это связано с появлением принципиально новых методов тепловой дефектометрии (или тепловой томографии), позволяющих по анализу динамических и статических температурных полей поверхности объекта определять характеристики внутренних тепловых источников, образовавших поверхностные температурные аномалии.
В свете изложенного возникает необходимость создания достоверного метода диагностики, контроля лечения и прогноза сосудистой патологии в клинике нервных болезней путем неинвазивного термолокационого зондирования.
Это позволит решать следующие задачи:
1 - диагностика распространенности и глубины поражения при различных патологических состояниях;
2 - контроль эффективности проводимой патогенетической терапии;
3 - прогноз течения и возможности рецидивирования заболевания;
4 - создание и клиническая апробация методики объективной тепловизионной (неинвазивной) диагностики, контроля лечения и прогноза сосудистой патологии в клинике нервных болезней;
5 - диагностика заболеваний, связанных с нарушением мозгового кровообращения - с достоверностью не менее 0,85-0,95;
6 - распознавания заболеваний органов по анализу аномалий полей поверхности кожного покрова на основе:
- статистического анализа клинической картины распространения температурных полей и т.п.;
- возможности осуществления диспансерного комплексного обследования с применением в различных возрастных группах и группах риска развития нарушения мозгового кровообращения.
Таким образом, появится возможность решения актуальных для практики задач повышения качества жизни людей, страдающих вышеназванными заболеваниями.
Технический результат, который достигается в результате использования настоящего изобретения, состоит в
- повышении объективности оценки распространенности заболевания,
- повышении эффективности лечения,
- повышении эффективности подбора лекарств,
- обеспечении контроля за ремиссией заболевания и разработке прогнозов рецидивов заболевания,
- удешевлении дифференциальной диагностики заболевания и формирования оценки эффективности терапии за счет индивидуального подбора лекарственных средств,
- уменьшении сроков выздоровления или наступления ремиссии заболевания.
Технический результат достигается за счет того, что в способе диагностики сосудистой патологии путем термолокационного зондирования, включающем регистрацию температурного поля кожного покрова человека, сравнение температурного поля кожного покрова человека, сравнение зарегистрированных термограмм с эталонными и определении патологии по обнаружению аномалий температурного поля,
- регистрируют температурное поле Тан(х,у) кожного покрова, имеющее минимальные температурные аномалии Δхдmin, Δудmin, которое принимается за аномальное,
- определяют пространственное разрешение для регистрации температурного поля, исходя из обнаружения минимальных по размеру температурных аномалий Δа, определяемых размерами минимальной температурной аномалии:

где Δхдmin, Δудmin - геометрические размеры минимальной температурной аномалии кожного покрова,
- температурное поле To(x,y,t) кожного покрова регистрируют до введения лекарственных препаратов, которое принимается за безаномальное температурное поле в отсутствие патологии,
- определяют критерий минимальной аномальности Δmin следующим образом:

- вводят в кровяное русло лекарственный препарат, способствующий сосудорасширяющему эффекту и увеличению скорости кровотока, за счет чего в течение определенного времени Δτиз=(0…τиз) увеличивают температуру кожной поверхности,
- определяют допустимый максимальный временной период регистрации (τизм) на период повышения температуры вследствие введения препарата,
- измеряют время запаздывания (Δτзап), представляющее интервал времени достижения максимального температурного контраста на поверхности кожи, начиная от момента введения препарата,
- во временном интервале (Δτконтр), включающем время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени (τизм), которое определяется заранее исходя из характеристик скорости измерения температурного поля - Тизм(х,у,t),
- сравнивают измеренные значения температурных полей кожной поверхности до и после введения лекарственных препаратов, производя суммирование по координатам поверхности и по времени:

где
Nx - количество точек суммирования по координате х,
Ny - количество точек суммирования по координате у,
Nt - количество точек суммирования по времени t,
- формируют предварительное диагностическое заключение следующим образом:
 ,
,
- по результатам проведенных измерений определяют границы участков поверхности кожи L(х,у), в области которых имеется патология кровотока, решая уравнение:

где
 - среднее значение температурного профиля,
- среднее значение температурного профиля,
 - среднее значение температуры,
- среднее значение температуры,
Nx, Ny, Nt - количество точек для суммирования, соответственно, по координате, х, y, t,
Dуч - характерный размер исследуемого участка кожной поверхности,
Dуч =(Хн-Хк) или (Ун-Ук)=max,
L(x,y) - контур области температурной аномалии,
(х,у) - координаты контура области,
Нконстр - толщина исследуемого объекта от внутренней патологии до поверхности кожного покрова,
(Хн-Хк) или (Ун-Ук) - координаты границы аномального участка,
- при наличии патологии кровотока формируют окончательное диагностическое заключение путем сравнения динамических температурных аномалий с рассчитанными температурными аномалиями и определяют характеристики внутренних температурных источников: температуру, глубину залегания, геометрические размеры, которые вызвали зарегистрированные динамические температурные аномалии на кожной поверхности,

где F - функционал невязки (квадрат величины среднеквадратичного отклонения),
δ - величина критерия невязки - точность определения параметров внутренней патологии,
Тр - рассчитанная величина температурного поля посредством адекватной математической модели, описывающий процесс распределения теплового поля в исследуемой подкожной области,
Θ - вектор характеристик внутренней патологии.
Технический результат усиливается за счет того, что геометрические размеры минимальной температурной аномалии Δхдmin, Δудmin определяют следующим образом:
- измеряют размеры всех температурных аномалий, содержащихся на поверхности кожного покрова, выявленных в результате предварительной регистрации температурного поля: Δхдi, Δудi,
- определяют размеры минимальной аномалии Δхдmin, Δудmin, решая систему уравнений:

где δ - вероятность того, что (Δхдi, Δудi)≥(Δхдmin, Δудmin)
p(ΔXi) - функция распределения величин Δхдi, Δудi,
Δхдi, Δудi - размеры всех температурных аномалий, содержащихся на поверхности кожного покрова по двум поверхностным координатам x и у.
Временной интервал проведения измерений температуры определяют путем измерения времени тепловой инерции τин, измеряя время прохождения теплового фронта от внутренней патологии до поверхности кожи.
Оптимальный интервал последовательного измерения температуры τизм на поверхности кожи определяют путем решения уравнения
 .
.
где f(T) - плотность распределения длительности во времени информационного сигнала,
τ - временной интервал измерения,
Р - вероятность пропуска информационного сигнала,
Т0 - временная разрешающая способность измерительных датчиков,
η - параметр.
Температурное поле регистрируют путем тепловизионного обследования поверхности кожного покрова с учетом его физиологических и анатомических особенностей и заболевания. Возможно выявление немых зон, не реагирующих на медикаментозное воздействие (склеротические изменения, стеноз, опухоль).
Сущность заявленного способа диагностики и возможность достижения технического результата будет раскрыта далее со ссылками на сопровождающие чертежи, на которых представлено:
Фиг.1. Анатомия сонной артерии.
Фиг.2. Гистограмма распределения размеров аномальных участков в области участка поверхности кожи сонной артерии.
Фиг.3. Функциональная схема программно-аппаратной реализации термолокационного зондирования.
Фиг.4. График времени измерения и контроля.
Фиг.5. Схема методики вычислительной диагностики аномалий кровотока.
Фиг.6. Изображение 10-узлового тетраэдра.
Фиг.7. Пространство параметров hm µl zk.
Фиг.8. Диагностируемая композитная пластина.
Фиг.9. Чертеж пластины с двумя расслоениями круглой формы.
Фиг.10. Геометрическая модель пластины с двумя дефектами круглой формы.
Фиг.11. Температурное поле поверхности пластины с дефектами, полученное с термографа.
Фиг.12. Температурное поле исследуемого участка пластины (повернуто на 90° относительно фиг.11).
Фиг.13. Система контуров для исследуемой области с дефектом в 3D.
Фиг.14. Система контуров для исследуемой области с дефектом (вид сверху).
Фиг.15. Конечно-элементная расчетная сетка: ортографическая проекция (а) и вид сверху (б).
Фиг.16. Поле возможных дефектов (в плане).
Фиг.17. Решения HD для поля возможных дефектов толщиной 0.5 мм.
Фиг.18. Распознанный «оптимальный» возможный дефект.
Фиг.19. Геометрическая модель половины пластины с распознанным дефектом.
Фиг.20. Структурная схема алгоритма модуля подготовки исходных данных.
Фиг.21. Структурная схема алгоритма работы программного комплекса.
Фиг.22. Структурная схема комплекса программно-аппаратных средств.
Фиг.23. Функциональная схема программно-аппаратных средств.
Фиг.24. Пример синтеза послойного распределения температурного поля при использовании метода активного термолокационого зондирования (неинвазивного) в соответствии с заявляемым способом диагностики, контроля лечения и прогноза сосудистой патологии в клинике внутренних болезней.
Фиг.25. Термограммы, полученные в результате экспериментальных исследований пациентов.
Заявленный способ осуществляется следующим образом.
Несмотря на то, что в качестве примера далее рассмотрена диагностика инклюзии сонной артерии (фиг.1), очевидно, что заявленный способ может быть применен для диагностики иных сосудистых патологий и других сосудов.
30% инсультов связано с патологией внутренней сонной артерии, которые не диагностируются у 70% у больных старше 40 лет с проявлениями атеросклероза (повышение АД, уровня холестерина и т.д.), процент инвалидности и смерти доходит до АД, уровня холестерина и т.д.), процент инвалидности и смерти доходит до 40% от общего числа перенесших инсульт.
Роль диагностики патологий сонной артерии заключается в локальной диагностике, увеличении скорости начала специфической терапии для исключения оперативного лечения, профилактическом проведении оперативного лечения (ангеопластика), бужирования внутренней сонной артерии, ускорении проведения оперативного лечения для больных с развивающемся инсультом, вызванным данной патологией внутренней сонной артерией.
В настоящее время диагноз стеноза внутренней сонной артерии ставится только после клинических проявлений инсульта. Заявленный способ обеспечивает диагностику на раннем этапе развития заболевания.
Согласно изобретению регистрируют температурное поле Тан(х,у) кожного покрова в шейной области, которое принимается за аномальное, имеющее минимальные дефекты (температурные аномалии на поверхности кожного покрова) Δхдmin, Δудmin.
На основании статистического анализа распределения аномалий температурного поля (на фиг.2 в качестве примера приведена гистограмма распределения размеров аномальных участков) определяют размеры минимальной аномалии (температурные аномалии на поверхности кожного покрова) Δхдmin, Δудmin путем решения системы уравнений:

где δ - вероятность того, что (Δхдi, Δудi)≥(Δхдmin, Δудmin);
р(ΔXi) - функция распределения величин Δхдi, Δудi.
На основании (Δхдmin, Δудmin) определяют пространственное разрешение аппаратуры (Δа), необходимое для регистрации температурного поля без потери пространственной информации, следующим образом:

где Δхдmin, Δудmin - геометрические размеры минимальной аномалии контролируемого объекта.
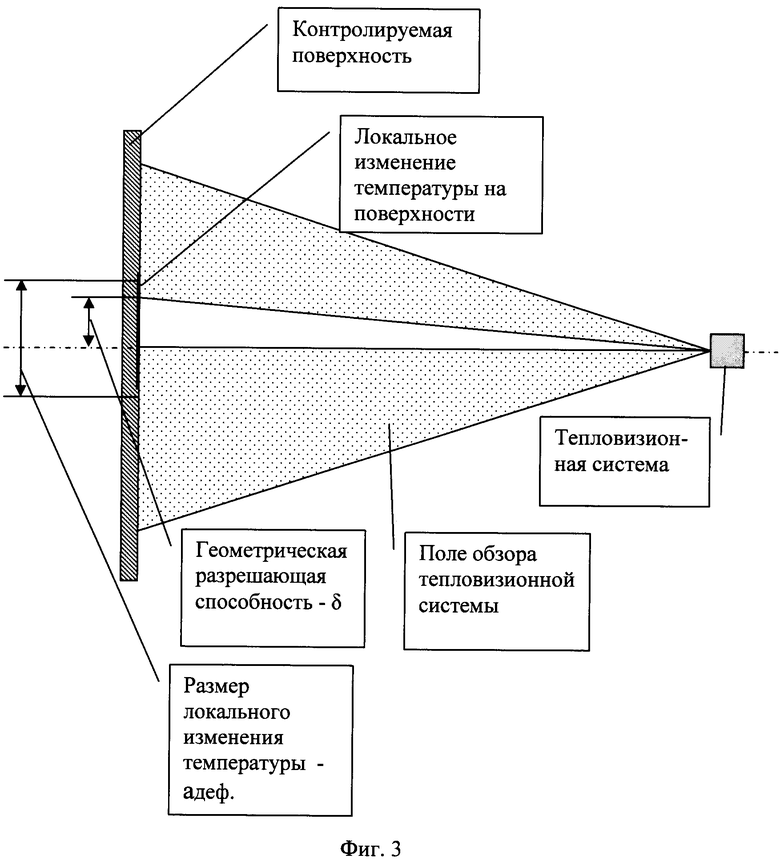
Определяют режимы регистрации температурного поля тепловизионной аппаратурой (на фиг.3 приведена геометрическая схема термолокационного зондирования).
Тепловизионную систему размещают перед контролируемой поверхностью на расстоянии, обеспечивающем:
- во-первых, одновременное наблюдение максимальной площади контролируемой поверхности с учетом поля обзора тепловизионной системы,
- во-вторых, достоверную регистрацию минимального по размерам локального участка изменения температуры (возможного дефектного участка) поверхности контролируемой поверхности.
При этих условиях расстояние от тепловизионной системы до контролируемой поверхности определяется следующим образом:
S≥Aдеф/(2Ntg(γ/2)),
где S - расстояние от тепловизионной системы до зоны контроля,
Адеф - характерный размер участка с локальным изменением температуры (дефектный участок),
N - коэффициент, определяющий достоверность регистрации локального участка (обычно на практике принимают N=3-10),
γ - угол мгновенного линейного поля зрения оптической системы тепловизионного прибора 6 (угловая разрешающая способность. Обычно, на практике, γ=5-10 угл. мин),
tg - тригонометрическая функция «тангенс».
Определяют оптимальный (или допустимый максимальный) временной период регистрации (τизм) на период повышения температуры вследствие введения препарата, исходя из скорости ее изменения.
В случае дискретного во времени наблюдения, т.е. когда температурное поле измеряется через определенный интервал времени (τизм=τ), появляется опасность пропустить (не обнаружить) аномалию, присущую патологии, если величина τ слишком велика. С другой стороны, при резком уменьшении τ появляется избыточная информация, и возникают трудности, связанные с ограниченными возможностями ЭВМ при обработке больших массивов информации в реальном времени.
Таким образом, возникает задача выбора такого «компромиссного» значения величины τ, чтобы, во-первых, обеспечить достаточную степень надежности при обнаружении аномалий, а во-вторых, не загружать ЭВМ избыточной информацией.
Поэтому решают задачу оптимального выбора интервала контроля при заданном значении вероятности Р необнаружения аномалий, т.е. задача о нахождении максимально возможного значения τ при заданной величине Р при длительности аномалии - Т:
Вероятность Р того, что дефект не будет обнаружен, определяется равенством:
 .
.
где f(T) - плотность распределения длительности во времени информационного сигнала,
τ - временной интервал измерения,
Р - вероятность пропуска информационного сигнала,
Т0 - временная разрешающая способность измерительных датчиков,
η - параметр.
Решая данное равенство, определяют необходимый интервал (период) регистрации температурного поля (τизм).
Регистрируют температурное поле T0(x,y,t) кожного покрова до введения лекарственных препаратов, которое принимается за безаномальное - температурное поле в отсутствие патологии.
Определяют критерий минимальной аномальности Δmin следующим образом:

В кровь вводятся лекарственные препараты, например, никотиновую кислоту, витамин РР, продигиозан (внутримышечно), селективные препараты - группы нитратов (нитросорбит и др.), которые способствуют сосудорасширяющему эффекту и изменению скорости кровотока, что в течение определенного времени Δτиз=(0…τиз) увеличивает температуру кожной поверхности и температурные контрасты температурных аномалий на поверхности кожного покрова, т.е. увеличивают процесс нестационарности температурного поля.
Повышение температуры тела при назначении медикаментозных средств относится к осложнениям терапии. Однако эти проявления носят транзитный характер и легко купируются назначением жаропонижающих, антигистаминных средств.
Основной эффект повышения температуры тела связан с высвобождением биологически активных медиаторов (гистамин, серотинин и др., витаминно подобный эффект РР, никотиновая кислота), что способствует сосудорасширяющему эффекту и увеличению скорости кровотока. Это приводит к повышению температуры тела более чем на 2°С.
Важным является селективное повышение температуры, т.е. увеличение скорости кровотока в определенных органах, тканях, очагах инфекции, метастатических поражениях, местонахождения атеросклеротических бляшек и др.
Под действием лекарственных препаратов происходит увеличение кровотока.
Далее определяют оптимальный (или допустимый максимальный) временной период регистрации (τизм) на период повышения температуры вследствие введения препарата.
Измеряют время оптимального запаздывания (Δτзап) - интервал времени достижения максимального температурного контраста на поверхности кожи, начиная от момента приема препарата, определяемое характеристиками подкожного пространства.
Оптимальное время запаздывания измеряют следующим образом.
На поверхности кожи с временным периодом (τизм) фиксируют в течение времени одновременно значения температуры на качественной (Ткач) и «дефектной» (Т∂) области. Далее измеряют зависимость модуля разности этих температур от времени:  и фиксируют максимальное значение модуля этой разности.
и фиксируют максимальное значение модуля этой разности.
Время запаздывания будет равно времени, при котором достигается наибольшее значение  . Т.е.
. Т.е.
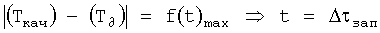 .
.
Далее определяют временной интервал измерения (Δτконтр) температурного поля поверхности кожи, включающий оптимальное время запаздывания (оптимальное время контроля). Как правило, исходя из практического опыта, временной интервал (длительность) проведения многократных измерений определяется следующим образом:
f(t)=0,5x f(t)max⇒Δτконтр
На фиг.4 в качестве примера приведен график, иллюстрирующий времена измерения и контроля.
Во временном интервале (Δτконтр), включающем оптимальное время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени (τизм), которое определяют заранее исходя из характеристик скорости измерения температурного поля - Тизм(х,у,t).
Сравнивают измеренные значения температурных полей кожной поверхности до и после введения лекарственных препаратов, например, следующим образом:

где суммирование ведется по координатам поверхности и по времени,
Nx - количество точек суммирования по координате x,
Ny - количество точек суммирования по координате у,
Nt - количество точек суммирования по времени t.
На основании сравнения формируют предварительное диагностическое заключение следующим образом:

По результатам проведенных измерений определяют границы участков поверхности кожи L(x,y), в области которых имеется патология кровотока, т.е. выполняется условие:

т.е. определяют контуры температурных аномалий на поверхности кожи при наличии патологий кровотока,
где L(x,y) - контур области температурной аномалии,
(х,у) - координаты контура области,
Нконстр - толщина исследуемого объекта от внутренней патологии до поверхности кожного покрова,
Dуч - характерный размер исследуемого участка кожной поверхности.
При наличии патологии кровотока в соответствии с предварительным диагностическим заключением на основе проведенных исследований формируют окончательное диагностическое заключение следующим образом.
Динамические температурные аномалии сравнивают с рассчитанными температурными аномалиями (например, методом невязки) на основе адекватной математической модели и определяют характеристики внутренних температурных источников (температуры, глубина залегания, геометрические размеры и др.), которые вызвали зарегистрированные температурные динамические температурные аномалии на кожной поверхности,

где F - функционал невязки (квадрат величины среднеквадратичного отклонения),
δ - величина критерия невязки - точность определения параметров внутренней патологии,
Тр - рассчитанная величина температурного поля посредством адекватной математической модели, описывающей процесс распределения теплового поля в исследуемой подкожной области,
Θ - вектор характеристик внутренней патологии,
Таким образом, решается задача неинвазивной термолокации (тепловой томографии).
Предпосылками для разработки методики по определению реальных трехмерных геометрических характеристик патологий (дефектов) являются значительные успехи в развитии теории и практики теплового неразрушающего контроля (работы О.Н.Будадина [1], В.П.Вавилова), теории распознавания образов и работы с цифровыми изображениями (работы Ю.И. Журавлева, Я.А. Фурмана [2], И.А. Биргера, Д. Терзополоуса, А.Розенфельда [3]), численного моделирования процессов теплопередачи в различных элементах конструкций, в том числе композитных (работы Зенкевича О., Кутателадзе С.С [4], Зарубина B.C., Димитриенко Ю.И.).
Основной идеей предлагаемой в настоящей статье методики распознавания трехмерных дефектов [5-7] является определение максимальной меры схожести имеющегося температурного поля поверхности диагностируемого объекта с температурным полем поверхности трехмерной модели, полученным путем численного моделирования трехмерной задачи теплопроводности [8] (численным моделированием условий теплового контроля). При этом сама трехмерная модель объекта контроля в начальный момент исследования предполагает отсутствие дефектов.
Разработанная методика вычислительной диагностики трехмерных дефектов состоит из следующих методик распознавания: 1) плоскостных геометрических параметров дефектов (методика распознавания контуров дефектов), решающей задачу приближенного нахождения с заданной точностью формы дефектов и их положение в плоскости; 2) трехмерных дефектов в элементах конструкций, в том числе из композитных материалов, основанной на численном решении трехмерной задачи теплопроводности и решении задачи распознавания дефекта, имеющего максимальную схожесть с реальным.
Общая схема методики вычислительной диагностики аномалий кровотока (дефектов) на основе теплового неразрушающего контроля представлена на фиг.5.
Рассмотрим алгоритм работы методики распознавания плоскостных геометрических параметров.
Имеется видеоизображение теплового поля (тепловизионное изображение) поверхности исследуемого объекта, представленное в виде двухмерной матрицы, элементами которой являются значения температуры. Данная матрица температур является входными данными алгоритма выделения контуров (реализованы отслеживающие алгоритмы «жука» и Розельфельда [3, 9-10]), который преобразует данную матрицу в систему замкнутых контуров [2].
Размеры каждого контура оцениваются относительно площади контролируемой поверхности, и осуществляется определение их геометрических центров. Далее производится построение контурного «скелета», образуемого геометрическими центрами контуров смежных уровней и показывающего количество предполагаемых дефектов и изменение их формы по толщине исследуемого объекта контроля.
Производится распознавание формы контуров (рассматривается пара контуров смежных уровней) на основе теории контурного анализа [2]. Определяются оценки масштаба и ориентации [2].
Производится фильтрация контуров нижних уровней и шумовых контуров верхних уровней.
Оставшиеся контуры характеризуют форму дефектов на плоскости и могут быть использованы как начальное приближение для методики распознавания трехмерных дефектов.
Рассмотрим метод распознавания трехмерных патологий (дефектов).
Данный метод основан на многократном решении задачи нестационарной теплопроводности для трехмерных анизотропных тел с неоднородностями и автоматическом анализе и определении формы трехмерных патологий.
Пусть Ω - область изменения пространственных переменных по геометрии, ∑=∂Ω - граница Ω. Для рассматриваемой задачи нестационарной теплопроводности с учетом отсутствия массовых источников тепла полную систему уравнений можно записать следующим образом:

где ρ - плотность; М, M1 - материальные точки области Ω; сν - теплоемкость; Λ - симметричный тензор теплопроводности;  - градиент температуры; θ0 - температура по всему телу в момент времени t=0 (начальные условия); θd - температура на поверхности тела (граничное условие первого рода); р - тепловая нагрузка; α - коэффициент теплоотдачи; θc - температура среды, в которую происходит конвективный теплообмен; σ0 - постоянная Стефана-Больцмана; ε - поглощательная способность поверхности дефекта.
- градиент температуры; θ0 - температура по всему телу в момент времени t=0 (начальные условия); θd - температура на поверхности тела (граничное условие первого рода); р - тепловая нагрузка; α - коэффициент теплоотдачи; θc - температура среды, в которую происходит конвективный теплообмен; σ0 - постоянная Стефана-Больцмана; ε - поглощательная способность поверхности дефекта.
Решение данной системы уравнений производится методом конечных элементов, где в качестве конечного элемента выбран 10-узловой тетраэдр (фиг.6). Разрешающая система дифференциальных уравнений нестационарной задачи теплопроводности решается методом Кранка-Николсона-Галёркина.
Рассмотрим метод распознавания трехмерных патологий (дефектов)
На момент начала работы данной задачи уже определенными являются геометрические плоскостные характеристики дефектов, а именно центры тяжести тепловых пятен дефектов и контура, приближенно описывающие форму дефекта в плане. Имеется геометрическая модель без дефектов объекта исследования. Также имеется температурное поле, полученное с термографа и спроецированное на поверхность геометрической модели объекта исследования. Известны тепловые характеристики объекта исследования и условия получения изображения с термографа.
Алгоритм решения данной задачи (алгоритм «выращивания») имеет следующий вид:
1) Производят построение регулярной конечно-элементной сетки.
2) На основе имеющегося масштабируемого плоскостного описания дефекта (ориентированного плоского контура), толщины дефекта hm и глубины залегания zk производят определение набора попадающих в описывающий контур конечных элементов. Данный набор конечных элементов имеет название «возможного» дефекта Di и характеризуется параметрами толщины hm, глубины залегания zk от поверхности съема информации и масштабом контура дефекта µl. Набор всех «возможных» дефектов в модели объекта контроля образует пространство параметров hm µl zk (фиг.7).
3) Производят решение нестационарной задачи теплопроводности для набора «возможных» дефектов Di, имеющих минимальные значения параметров hm, µl, zk. Данный набор «возможных» дефектов Di является основанием для наложении текущей маски размеров 3×3×3 на пространство параметров hm µl zk. Производят решение нестационарной задачи теплопроводности для выбранных «возможных» дефектов. Для полученного набора решений производится комплексная оценка меры схожести двух изображений по следующей формуле:  где θ(x1,x2)числ.реш - решение с поверхности, полученное путем численного решения нестационарной задачи теплопроводности; θ(x1,х2)эксперим - поступившее на вход температурное поле поверхности объекта контроля. Из рассматриваемой маски параметров hm, µl, zk определяется «возможный» дефект, имеющий максимальную меру схожести
где θ(x1,x2)числ.реш - решение с поверхности, полученное путем численного решения нестационарной задачи теплопроводности; θ(x1,х2)эксперим - поступившее на вход температурное поле поверхности объекта контроля. Из рассматриваемой маски параметров hm, µl, zk определяется «возможный» дефект, имеющий максимальную меру схожести  . Если данный дефект не является центральным, то центр маски смещается на данные координаты hm, µl, zk и производится дополнительное определение «возможных» дефектов, решение нестационарной задачи теплопроводности и анализ решений. Если дефект является центральным, то данный дефект является результатом распознавания.
. Если данный дефект не является центральным, то центр маски смещается на данные координаты hm, µl, zk и производится дополнительное определение «возможных» дефектов, решение нестационарной задачи теплопроводности и анализ решений. Если дефект является центральным, то данный дефект является результатом распознавания.
Рассмотрим программно-математический комплекс для распознавания трехмерных дефектов.
Метод неинвазивного термолокационного зондирования (тепловой дефектометрии, тепловой томографии), включающий распознавание плоскостных геометрических параметров дефектов и распознавание трехмерных дефектов, лег в основу разработанного программно-математического комплекса «TSHCSS». Данный программно-математический комплекс полностью основывается на собственных разработках авторов и реализован в Microsoft Visual Studio. В качестве исходной информации в программно-математическом комплексе используются файлы тепловизионных изображений и файлы с трехмерной геометрией объектов контроля, остальные параметры задачи диагностики дефектов вводятся через удобный диалоговый интерфейс.
Далее приводятся результаты экспериментальных исследований способа диагностики сосудистой патологии путем неинвазивного термолокационного зондирования
Пример 1.
Экспериментальные исследования метода термолокационного зондирования для диагностики качества многослойного объекта из низкотеплопроводного материала с неоднородностями типа нарушения сплошности
Решение данной задачи необходимо для достоверного исследования погрешности разработанного метода. Это связано с тем, что в таких материалах возможно создание эталонных нарушений сплошности - нарушений сплошности с заранее известными теплофизическими и геометрическими характеристиками. Далее осуществляя тепрмолокационное зондирование и сравнивая результаты зондирования с известными характеристиками несплошности, определяются погрешности контроля.
В биологических объектах контроля эталонные нарушения сплошности создать практически невозможно.
Рассмотрим применение разработанной методики диагностики трехмерных дефектов на примере теплового контроля пластины из стеклопластика размером 250×70 мм и толщиной 9 мм. На основу пластины толщиной в 7 мм нанесен второй слой стеклопластика толщиной 2 мм, между слоями созданы два воздушных расслоения (дефекта) круглой формы, диаметром 25 мм (фиг.8-10).
Тепловой контроль композитного элемента проводился при следующих условиях: температура окружающей среды 294.5 К; нагрев части тыльной поверхности производился строительным феном DWT с тепловым потоком в 800 Вт/м2 в течение 50 с. Далее производился съем термографического изображения (фиг.11) фронтальной поверхности портативным компьютерным термографом "Иртис-2000".
Применив методику распознавания плоскостных геометрических параметров к левой части (см. фиг.11) данного термографического изображения пластины (фиг.12), получим следующую систему контуров (фиг.13-14) с контурами верхних уровней близкими по форме к окружности. Следовательно, окружность будет являться начальной формой для методики распознавания трехмерных дефектов.
Для рассматриваемого элемента диагностируемой композитной пластины произведем построение конечно-элементной сетки (фиг.15). Размеры исследуемой области: 0.056×0.052×0.009 м. Шаг сетки (квадрата) по осям XY составляет 2 мм, что достаточно грубо. Шаг по z составляет 0.5 мм, что тоже достаточно грубо. Общее число конечных элементов в сетке - 78000. Данная сетка является грубой по отношению к форме искомого дефекта. Такое заглубление конечно-элементной сетки сделано намеренно, чтобы продемонстрировать эффективность разработанной методики.
Тогда в плане поле возможных дефектов с учетом построенной конечно-элементной сетки примет вид (фиг.16). Высота дефектов поля возможных дефектов будет варьироваться с учетом выбранного при построении конечно-элементной сетки шага (0.5 мм) от 0.5 до 8 мм. Глубина залегания от фронтальной поверхности (поверхности съема термографического изображения) будет варьироваться от 0.5 до 8.5 мм.
Получим численное решение задачи распознавания для пластины, имеющей в виде дефекта сплошную среду - воздух со следующими тепловыми характеристиками: теплопроводность λD=0.0285 Вт/(м·К), плотность ρD=1.17 кг·м3, теплоемкость сνD=950 Дж/(кг·К). Нагрев тыльной поверхности пластины согласно физическому эксперименту будем производить тепловым потоком Q, равным 800 Вт/м2, в течение 50 с в виде 25 итераций по 2 с. На фронтальной грани происходит конвективный теплообмен раций по 2 с. На фронтальной грани происходит конвективный теплообмен со следующими характеристиками: коэффициент конвективного теплообмена α=125.6 Вт/(м2·K), температура θc=294.5 К.
Материалом композитной пластины является стеклопластик со следующими характеристиками: компоненты тензора теплопроводности λ11=λ12=0.4, λ33=0-35 Вт/(м·К); плотность 1590 кг·м3; теплоемкость 1004 Дж/(кг·К).
Согласно разработанной методике распознавания трехмерных дефектов оценка меры схожести двух изображений производится путем сравнения относительной (процентной) невязки  . В табл.1 и 2 представлены значения схожести изображений дефектов с толщиной, равной 0.5 и 1 мм. На фиг.17 представлены изображения поля относительной невязки HD решений возможных дефектов с толщиной 0.5 мм.
. В табл.1 и 2 представлены значения схожести изображений дефектов с толщиной, равной 0.5 и 1 мм. На фиг.17 представлены изображения поля относительной невязки HD решений возможных дефектов с толщиной 0.5 мм.


Таким образом, производится оптимальный выбор между двумя возможными дефектами (оптимальными в табл.1 и 2):
«Оптимальным» возможным дефектом и наиболее близким к реальному является дефект толщиной 0.5 мм с описывающим радиусом 14.5 мм и глубиной залегания 2.5 мм (фиг.18.), имеющий процентную невязку 0.001433.
Произведем оценку формы полученного дефекта. Площадь поверхности дефекта в плане равна 572 мм2. Тогда верхняя оценка радиуса дефекта-окружности равна Rв=13.49 мм, а нижняя оценка радиуса дефекта-окружности Rн=12.46 мм.
Применение разработанной методики распознавания формы трехмерных дефектов также показывает, что контур, описывающий данный дефект, имеет максимальную меру схожести с окружностью оценку масштаба  и относится к классу расслоений.
и относится к классу расслоений.
Таким образом, результатом применения разработанного численного решения задач диагностики тепловым методом контроля является распознанный дефект (фиг.19), имеющий форму цилиндра и следующие геометрические характеристики (табл.3).
Фиг.19. Геометрическая модель половины пластины с распознанным дефектом
Отметим, что результаты численного решения, приведенные в табл.3, можно уточнить, произведя дополнительно несколько решений задачи теплопроводности для пластины с более мелкими КЭ (например, по толщине брать hкэ=0.1 мм, а в плоскости XY сторону образующего квадрата брать 0.4 мм) или для пластины с пустотелым дефектом, варьируя при этом толщиной дефекта.
Произведем оценку вычислительной эффективности разработанной методики распознавания дефектов. Общее количество возможных дефектов для построенной КЭ сетки равно 1360. Для нахождения оптимального дефекта сделано 60 решений, что составляет 4.4%. В то же время для данной КЭ сетки, содержащей 78624 КЭ, общее количество возможных решений имеет порядок 3·104. Отношение сделанных 60 решений к общему количеству возможных решений составляет менее 0.2%.
Пример 2.
Экспериментальные исследования метода термолокационного зондирования для диагностики патологии сонной артерии
Комплекс программно-аппаратных средств, на котором проводились экспериментальные исследования, содержит следующие блоки:
- блок подготовки исходных данных (БПИД) - служит для модельного описания процесса функционирования объекта контроля и его теплового контроля, получает информацию из известных данных и данных инструментальных замеров, реализован на базе программного обеспечения разработанной физико-математической модели и входящих в состав комплекса вспомогательных аппаратных средств, алгоритм работы блока приведен на фиг.20;
- блок обнаружения патологий /дефектов (БОД) - служит для локализации патологических участков, получает информацию от тепловизионной аппаратуры контроля, реализован на базе программного обеспечения «IRTIS»;
- блок определения характеристик патологий/дефектов (БОХД) - служит для определения характеристик патологий, реализован на базе программного обеспечения разработанной физико-математической модели и программы «IRTIS»;
- блок экспорта результатов (БЭР) - служит для обновления баз данных, сохранения полученных результатов и вывода на печать.
На фиг.20 и 21 приведены структурные схемы алгоритмического обеспечения.
На фиг.24. приведен пример синтеза послойного распределения температурного поля при использовании метода активного термолокационого зондирования (неинвазивного) в соответствии с заявляемым способом диагностики, контроля лечения и прогноза сосудистой патологии в клинике внутренних болезней
На фиг.25 приведены в качестве примера термограммы, полученные в результате экспериментальных исследований пациентов, здоровых и перенесших заболевания.
Экспериментальные исследования показали, что предлагаемый способ диагностики, контроля лечения и прогноза сосудистой патологии в клинике внутренних болезней методом активного термолокационого зондирования (неинвазивного) обеспечивает:
1 - неинвазивную диагностику распространенности и глубины поражения при различных патологических состояниях;
2 - контроль эффективности проводимой патогенетической терапии;
3 - формирование прогноза течения и возможности рецидивирования заболевания.
4 - создание и клиническую апробацию методики объективной тепловизионной (неинвазивной) диагностики, контроля лечения и прогноза сосудистой патологии в клинике нервных болезней.
5 - диагностику заболеваний, связанных с нарушением мозгового кровообращения - с достоверностью не менее 0,85-0,95,
6 - распознавание заболеваний органов по анализу аномалий полей поверхности кожного покрова на основе статистического анализа клинической картины распространения температурных полей и т.п.,
7 - возможность осуществления диспансерного комплексного обследования с применением в различных возрастных группах и группах риска развития нарушения мозгового кровообращения.
Заявляемый способ термолокационного зондирования (неинвазивного) медицинской диагностики является инвариантным по отношению к техническим средствам.
Предлагаемый способ позволяет изменять комплектацию аппаратурой в разных модификациях в зависимости от заявки пользователей.
Изобретение имеет следующие преимущества:
1. Обеспечивается диагностика распространенности и глубины поражения при различных патологических состояниях.
2. Осуществляется контроль эффективности проводимой патогенетической терапии.
3. Формируется прогноз течения и возможности рецидивирования заболевания.
4. Создается и клинически апробируется методика объективной тепловизионной (неинвазивной) диагностики, контроля лечения и прогноза сосудистой патологии в клинике нервных болезней.
5. Осуществляется диагностика заболеваний, связанных с нарушением мозгового кровообращения - с достоверностью не менее 0,85-0,95.
6. Осуществляется распознавание заболеваний органов по анализу аномалий полей поверхности кожного покрова на основе:
- специального компьютерного анализа клинической картины распространения температурных полей и т.п.
- осуществления диспансерного комплексного обследования с применением метода активного термолокационого зондирования (неинвазивного) в различных возрастных группах и группах риска развития нарушения мозгового кровообращения для контроля лечения и прогноза сосудистой патологии.
7. Обеспечивает повышение уровня здоровья и качества жизни населения (по критерию снижения времени заболевания и времени лечения) на 60-80%.
8. Удешевляет дифференциальную диагностику заболеваний и формирование оценки эффективности терапии за счет индивидуального подбора лекарственных средств на 15-25%.
9. Уменьшает сроки выздоровления или наступления ремиссии заболевания на 10-15%.
10. Обеспечивает контроль за ремиссией заболевания и разработку прогнозов рецидивов заболевания.
ЛИТЕРАТУРА
1. Тепловой неразрушающий контроль изделий / О.Н.Будадин, А.И.Потапов, В.И.Колганов, Т.Е.Троицкий-Марков, Е.В.Абрамова. - М.: Наука, 2002.
2. Фурман Я.А. Введение в контурный анализ; приложения к обработке изображений и сигналов. - М.: ФИЗМАТЛИТ, 2003.
3. Розенфельд А. Распознавание и обработка изображений. - М.: Мир, 1987.
4. Кутателадзе С.С. Основы теории теплообмена. - М.: Атомиздат, 1979.
5. Николаев А.А. Метод распознавания трехмерных дефектов типа трещин и расслоений в конструкциях // 18-я Международная конференция по компьютерной графике и зрению ГрафикКон' 2008: Труды Конференции. - М.: Изд-во МГУ, 2008. - С.308.
6. Николаев А.А. Методика вычислительной диагностики трехмерных дефектов в композитных элементах конструкций на основе теплового неразрушающего контроля // Тезисы докладов 8-й Международной конференции «Неразрушающий контроль и техническая диагностика в промышленности», Москва, 18-20 марта 2009. - М: ИД «Спектр», 2009. - С.70-71.
7. Николаев А.А. Распознавание неоднородностей, определение их геометрических характеристик и построение 3D геометрических моделей в задачах неразрушающего контроля // Математические методы распознавания образов: Сборник докладов 13-й Всероссийской конференции. - М.: МАКС Пресс, 2007. - С.506-508.
8. Николаев А.А. Разработка программно-математического обеспечения для решения трехмерных задач нестационарной теплопроводности с учетом переизлучения для анизотропных тел с дефектами // Тезисы докладов Третьей международной научно-технической конференции «Информационно-математические технологии в экономике, технике и образовании 2008». - Екатеринбург: Изд-во УГТУ-УПИ, 2008. - С.242-243.
9. Дуда Р., Харт П. Распознавание образов и анализ сцен. - М.: Мир, 1976.
10. Klette R., Rosenfeld A. Digital geometry. Geometric methods for digital picture analysis. - San Francisco, CA: Morgan Kaufmann, 2004.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ОРТОПЕДИЧЕСКОЙ КОРРЕКЦИИ СТОПЫ | 2007 |
|
RU2357705C2 |
| СПОСОБ ТЕПЛОВОГО КОНТРОЛЯ СОПРОТИВЛЕНИЯ ТЕПЛОПЕРЕДАЧЕ МНОГОСЛОЙНОЙ КОНСТРУКЦИИ В НЕСТАЦИОНАРНЫХ УСЛОВИЯХ ТЕПЛОПЕРЕДАЧИ | 2009 |
|
RU2420730C2 |
| СПОСОБ ТЕПЛОВОГО КОНТРОЛЯ НАДЕЖНОСТИ КОНСТРУКЦИЙ ИЗ ПОЛИМЕРНЫХ КОМПОЗИЦИОННЫХ МАТЕРИАЛОВ ПО АНАЛИЗУ ВНУТРЕННИХ НАПРЯЖЕНИЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2506575C1 |
| СПОСОБ КОНТРОЛЯ КАЧЕСТВА КОМПОЗИТНЫХ БРОНЕВЫХ ПРЕГРАД И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2016 |
|
RU2623700C1 |
| СПОСОБ ИНТЕЛЛЕКТУАЛЬНОГО ЭНЕРГОСБЕРЕЖЕНИЯ НА ОСНОВЕ ИНСТРУМЕНТАЛЬНОГО МНОГОПАРАМЕТРОВОГО МОНИТОРИНГОВОГО ЭНЕРГЕТИЧЕСКОГО АУДИТА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2011 |
|
RU2516203C2 |
| СПОСОБ ТЕПЛОВОГО НЕРАЗРУШАЮЩЕГО КОНТРОЛЯ ТЕПЛОТЕХНИЧЕСКИХ ХАРАКТЕРИСТИК МНОГОСЛОЙНЫХ КОНСТРУКЦИЙ В НЕСТАЦИОНАРНЫХ УСЛОВИЯХ ТЕПЛОПЕРЕДАЧИ | 2009 |
|
RU2403562C1 |
| Устройство теплового контроля качества композитных броневых преград | 2015 |
|
RU2608491C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТЕМПЕРАТУРОПРОВОДНОСТИ ОПТИЧЕСКИ ПРОЗРАЧНЫХ МАТЕРИАЛОВ | 2019 |
|
RU2725695C1 |
| СПОСОБ ТЕПЛОВОГО КОНТРОЛЯ ОСТАТОЧНЫХ НАПРЯЖЕНИЙ И ДЕФЕКТОВ КОНСТРУКЦИЙ | 2007 |
|
RU2383009C2 |
| СПОСОБ ДИАГНОСТИКИ ЭКСПЛУАТАЦИОННОГО СОСТОЯНИЯ ФУРМЕННОЙ ИЛИ ОПАСНОЙ ЗОНЫ ПИРОМЕТАЛЛУРГИЧЕСКОГО АГРЕГАТА | 2007 |
|
RU2366936C2 |























Изобретение относится к области медицины и может быть использовано для диагностики, контроля лечения и прогноза сосудистой патологии. Регистрируют температурное поле кожного покрова, имеющее минимальные температурные аномалии, и принимают его за аномальное. Определяют пространственное разрешение для регистрации температурного поля, исходя из обнаружения минимальных по размеру температурных аномалий, определяемых размерами минимальной температурной аномалии. Регистрируют температурное поле кожного покрова до введения лекарственных препаратов, которое принимают за безаномальное в отсутствии патологии. Определяют критерий минимальной аномальности. Вводят в кровяное русло сосудорасширяющий лекарственный препарат. Определяют допустимый максимальный временной период регистрации на период повышения температуры. Измеряют время запаздывания как интервал времени достижения максимального температурного контраста, начиная от момента введения препарата. Во временном интервале, включающем время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени, которое определяют, исходя из характеристик скорости измерения температурного поля. Сравнивают измеренные значения температурных полей поверхности кожи до и после введения лекарственных препаратов, производя суммирование по координатам поверхности и по времени. По результатам проведенных измерений определяют границы участков поверхности кожи, в области которых имеется патология кровотока. При наличии патологии кровотока формируют диагностическое заключение путем сравнения динамических температурных аномалий с рассчитанными температурными аномалиями и определяют характеристики внутренних температурных источников: температуру, глубину залегания, геометрические размеры, которые вызвали зарегистрированные динамические температурные аномалии на кожной поверхности. Способ повышает достоверность диагностики сосудистой патологии. 4 з.п. ф-лы, 5 табл., 25 ил.
1. Способ диагностики сосудистой патологии путем термолокационного зондирования, включающий регистрацию температурного поля кожного покрова человека, сравнение зарегистрированных термограмм с эталонными и определение патологии по обнаружению аномалий температурного поля, отличающийся тем, что:
- регистрируют температурное поле Тан(х, у) кожного покрова, имеющее минимальные температурные аномалии Δхдmin, Δyдmin, которое принимают за аномальное,
- определяют пространственное разрешение для регистрации температурного поля, исходя из обнаружения минимальных по размеру температурных аномалий Δа, определяемых размерами минимальной температурной аномалии:

где Δхдmin, Δyдmin - геометрические размеры минимальной температурной аномалии кожного покрова,
- регистрируют температурное поле То(х, у, t) кожного покрова до введения лекарственных препаратов, которое принимают за безаномальное температурное поле в отсутствии патологии,
- определяют критерий минимальной аномальности Δmin следующим образом:
 ,
,
- вводят в кровяное русло лекарственный препарат, способствующий сосудорасширяющему эффекту, за счет чего в течение определенного времени Δτиз=(0…τиз) увеличивают температуру поверхности кожи,
- определяют допустимый максимальный временной период регистрации (τизм) на период повышения температуры вследствие введения препарата,
- измеряют время запаздывания (Δτзап), представляющее интервал времени достижения максимального температурного контраста на поверхности кожи, начиная от момента введения препарата,
- во временном интервале (Δτконтр), включающем время запаздывания, осуществляют динамическую регистрацию температурного поля кожного покрова с интервалом времени (τизм), которое определяют заранее, исходя из характеристик скорости измерения температурного поля - Тизм(х, у, t),
- сравнивают измеренные значения температурных полей поверхности кожи до и после введения лекарственных препаратов, производя суммирование по координатам поверхности и по времени:

где Nx - количество точек суммирования по координате х,
Ny - количество точек суммирования по координате у,
Nt - количество точек суммирования по времени t,
- формируют предварительное диагностическое заключение следующим образом:

- по результатам проведенных измерений определяют границы участков поверхности кожи L(x, у), в области которых имеется патология кровотока,
- при наличии патологии кровотока формируют окончательное диагностическое заключение путем сравнения динамических температурных аномалий с рассчитанными температурными аномалиями и определяют характеристики внутренних температурных источников: температуру, глубину залегания, геометрические размеры, которые вызвали зарегистрированные динамические температурные аномалии на кожной поверхности:

где F - функционал невязки (квадрат величины среднеквадратичного отклонения),
δ - величина критерия невязки - точность определения параметров внутренней патологии,
Тр - рассчитанная величина температурного поля посредством адекватной математической модели, описывающей процесс распределения теплового поля в исследуемой подкожной области,
Θ - вектор характеристик внутренней патологии.
2. Способ по п.1, отличающийся тем, что геометрические размеры минимальной температурной аномалии Δхдmin, Δудmin определяют следующим образом:
- измеряют размеры всех температурных аномалий, содержащихся на поверхности кожного покрова, выявленных в результате предварительной регистрации температурного поля: Δхдi, Δудi,
- определяют размеры минимальной аномалии Δхдmin, Δудmin, решая систему уравнений:

где δ - вероятность того, что (Δхдi, Δудi)≥(Δxдmin, Δудmin),
p(ΔXi) - функция распределения величин Δхдi, Δудi,
Δхдi, Δудi - размеры всех температурных аномалий, содержащихся на поверхности кожного покрова по двум поверхностным координатам x и у.
3. Способ по п.1, отличающийся тем, что временной интервал проведения измерений температуры определяют путем измерения времени тепловой инерции τин, измеряя время прохождения теплового фронта от внутренней патологии до поверхности кожи.
4. Способ по п.1, отличающийся тем, что оптимальный интервал последовательного измерения температуры τизм на поверхности кожи определяют путем решения уравнения

где f(T) - плотность распределения длительности во времени информационного сигнала,
τ - временной интервал измерения,
Р - вероятность пропуска информационного сигнала,
Т0 - временная разрешающая способность измерительных датчиков,
η - параметр.
5. Способ по п.1, отличающийся тем, что температурное поле регистрируют путем тепловизионного обследования поверхности кожного покрова.
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ГРУППЫ РИСКА ПАТОЛОГИИ ВНУТРЕННИХ ОРГАНОВ | 1989 |
|
RU2066976C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ПАТОЛОГИИ ВНУТРЕННИХ ОРГАНОВ | 1993 |
|
RU2094037C1 |
| US 7558618 B1, 07.07.2009 | |||
| ХИЖНЯК Л.Н | |||
| Диагностика и контроль эффективности лечения заболеваний сосудов нижних конечностей с использованием матричных термовизионных систем | |||
| Автореф | |||
| дисс | |||
| - Тула, 2006, с.7-22 | |||
| BAGAVATHIAPPAN S | |||
| et al | |||
| Infrared thermal imaging for detection of peripheral vascular disorders | |||
| J Med Phys | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
Авторы
Даты
2011-09-10—Публикация
2009-12-25—Подача