Изобретение относится к медицине, а именно к офтальмологии и клеточным технологиям, и может быть использовано для получения биоптата роговицы для последующего получения из него культуры клеток роговицы двух видов (эпителиальных прогениторов роговицы и кератоцитов) и созданных на их основе клеточных конструкций, пригодных для трансплантации.
Из уровня техники известно, что роговица - передняя прозрачная часть фиброзной оболочки глаза человека имеет 5 слоев:
1. 5-6-слойный эпителий.
2. Боуменова мембрана.
3. Строма.
4. Десцеметова мембрана.
5. Однослойный эндотелий.
Место перехода ее в склеру называется лимб и имеет форму полупрозрачного кольца шириной до 1 мм [1]. Место контакта роговичного и конъюнктивального эпителиев находится в зоне крипт Вогта лимба. [2] При этом слой стромы роговицы переходит в склеру (непрозрачную фиброзную оболочку) под конъюнктивой дистальнее зоны крипт Вогта в лимбе [1].
Толщина эпителия роговицы в центре по данным одних авторов [3] составляет от 48,8 мкм до 58 мкм, по данным других авторов [4] - от 43,5 мкм до 53,7 мкм. Толщина нормальной роговицы по данным разных авторов колеблется от 520 мкм до 570 мкм в центре и от 630 мкм до 670 мкм на периферии [5, 6]. Некоторые авторы указывают, что центральная толщина роговицы составляет от 531,9 мкм до 594,1 мкм [4]. Согласно данным конфокальной микроскопии, средняя плотность кератоцитов выше в передней строме (10% толщины) [7].
Известно, что регенерация роговичного эпителия обеспечивается размножением базальных эпителиальных прогениторов в криптах Вогта зоны лимба и их последовательной центрипетальной миграцией по боуменовой мембране от периферии роговицы с постепенным перемещением в супрабазальные слои [8].
Кератоциты - роговичные фибробласты, основной тип клеток стромы роговицы. Они находятся между коллагеновыми фибриллами и формируют непрерывную связанную клеточную сеть. В нормальных условиях кератоциты во взрослой роговице - это неподвижные клетки. Однако при травме близлежащие кератоциты дифференцируются в активно синтезирующие матрикс клетки и восстанавливают поврежденный участок стромы [9].
Экспериментальными исследованиями было доказано, что для длительного культивирования и размножения различных типов эпителиальных клеток необходимо наличие питательной среды либо субстрата, присутствие фибробластов, а также достаточное количество факторов роста и цитокинов [10, 11].
Известно, что при получении биотрансплантатов эпителиальных прогениторов роговицы в качестве фидерного слоя могут быть использованы:
- 3Т3 система [12],
- амниотическая мембрана [13],
- фибриновый клей [14],
- плазма, бедная тромбоцитами (platelet poor plasma (PPP) [15].
Известно проведение биопсии роговицы площадью 1-2 мм2 в различных областях роговицы (что соответствует линейным размерам эксплантата 1×1 мм или 1×2 мм) для получения культуры эпителиальных прогенеторов [16].
Известно также получение культуры эпителиальных прогениторов роговицы путем биопсии в области лимба с получением биоптата размерами 1-2 мм [17].
Недостатком обоих вышеуказанных способов является то, что в результате последующего культивирования была получена монокультура эпителиальных прогениторов роговицы.
В источнике информации [18] содержатся сведения о проведении биопсии роговицы с целью аутотрансплантации участка лимба. При этом трансплантат в лимбальной зоне вырезают на глубину 150 мкм. Основным отличием от предлагаемого способа является то, что биопсия проводилась не для получения биоптата с целью культивирования клеток, а для его пересадки.
Наиболее близким является биопсия роговицы для использования биоптата с целью культивирования клеток эпителия роговицы. Биопсия проводилась в области лимба на глубину 300 мкм [19]. Далее в процессе культивирования в качестве подложки (фидерный слой) использовалась амниотическая мембрана "Флексамер".
Данный способ позволяет культивировать клетки эпителия роговицы из полученного биоптата, однако глубина забора (300 мкм) при выполнении процедуры может оказаться достаточной, чтобы повредить шлеммов канал, отвечающий за гидродинамику глаза. Такое повреждение может оказаться фатальным для глаза.
Задачей изобретения является усовершенствование способа биопсии роговицы.
Технический результат, который будет достигнут от использования изобретения, заключается в повышении эффективности проведения операции и возможности получения из биоптата роговицы культуры клеток двух видов - эпителиальных прогениторов роговицы и кератоцитов.
Технический результат достигается тем, что в способе биопсии роговицы, включающем иссечение поверхностных слоев ткани и забор участка роговой оболочки в области лимба, предварительно проводят измерения роговицы, а иссечение поверхностных слоев ткани осуществляют в зоне лимба на глубину, рассчитанную по формуле:
H=0,1L+0,9K,
где Н - глубина иссечения поверхностных слоев ткани, мкм,
L - толщина роговицы, мкм,
К - толщина эпителия роговицы, мкм.
Иссечение поверхностных слоев ткани в области лимба делают в форме квадрата размером 1×1 мм либо в форме круга диаметром 1,0-1,5 мм.
Сущность изобретения заключается в получение биоптата, на основе которого могут быть получены клетки роговицы двух видов, способных к делению. Это кератоциты - клетки стромы и эпителиальные прогениторы роговицы (местные стволовые клетки, за счет которых обновляется эпителий в течение всей жизни). В дальнейшем эти клетки можно разделить или культивировать совместно для получения различных пригодных для трансплантации клеточных конструкций на их основе. В случае получения биотрансплантатов эпителиальных прогениторов роговицы роль федерального слоя будут выполнять кератоциты пациента - роговичные фибробласты.
Предварительное измерение роговицы перед иссечением поверхностных слоев ткани в зоне лимба на глубину, рассчитанную по формуле: Н=0,1L+0,9К (где Н - глубина иссечения поверхностных слоев ткани, мкм, L - толщина роговицы, мкм, K - толщина эпителия роговицы, мкм) в форме квадрата размером 1×1 мм либо в форме круга диаметром 1,0-1,5 мм, обеспечивает минимальную инвазивность процедуры, возможность получения клеток роговицы двух видов, отсутствие влияния на архитектонику роговицы, позволяет определить оптимальное количество получаемого биоптата (полученных клеток будет достаточно для их дальнейшего культивирования, а проведение биопсии окажет минимальное влияние на роговицу).
Из анализа научно-технической и патентной литературы заявленной совокупности приемов, приводящих к повышению эффективности без травматизации проведения операции и возможности получения клеток роговицы двух видов, нами не выявлено, что позволяет сделать вывод о соответствии заявляемого технического решения критериям «новизна» и «изобретательский уровень».
Изобретение осуществляется следующим образом.
Предварительно проводят измерения роговицы.
Расчет толщины роговицы и эпителия (мкм) проводят, используя роговичный томограф (например, SOCT Anterius, SOCT Copernicus & Anterior Segment Module, SOCT Copernicus HR & Anterior Segment Module).
Целесообразно проводить все измерения на одном приборе.
Затем рассчитывают глубины вреза кератома в зоне лимба по формуле.
Учитывая строение роговицы и особенность распределения кератоцитов по строме, формулу для расчета глубины вреза кератома можно представить в следующем виде:
Н=0,1L+0,9K, где:
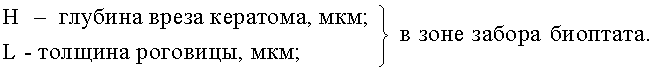
K - толщина эпителия роговицы, мкм.
Биопсию роговицы проводят в условиях специально оборудованного кабинета или в операционной.
Предварительно пациенту выполняют местную анестезию путем экспозиции анестетика или субтеноновую анестезию.
Определяют место забора участка роговой оболочки в области лимба.
Затем выставляют на кератоме необходимую глубину вреза, рассчитанную по формуле.
Путем легкого нажима лезвием кератома проводят иссечение поверхностных слоев ткани в виде прорезанного квадрата размером 1×1 мм или круга диаметром 1,0-1,5 мм.
Далее подрезают основание биоптата.
Полученный биоптат роговицы незамедлительно помещают в транспортировочную среду в микропробирку, после чего однократно закапывают антибактериальные или антисептические капли. Затем пациент продолжает применять рекомендованные капли 6 раз в день в течение 5-7 дней, до полной эпителизации места забора.
Примеры конкретного выполнения способа биопсии.
Пример 1. Пациент Черемискина В. Ф., правый глаз, 71 год.
Пахиметрия на SOCT Copernicus & Anterior Segment Module показала, что толщина роговицы в области забора (L) составила 703 мкм, а толщина эпителия в области забора (K) - 52 мкм. Таким образом, глубина вреза кератома (Н), рассчитанная по формуле:
Н=0,1L+0,9K=0,1·703+0,9·52=70,3+46,8=117,1 с учетом округления составила 120 мкм, а иссечение поверхностных слоев ткани осуществляли в виде прорезанного квадрата размером 1×1 мм.
Эпителизация места биопсии наблюдалась на 3 день.
Пример 2. Пациент Чехомова У.Р., левый глаз, 84 года.
Пахиметрия на SOCT Copernicus & Anterior Segment Module показала, что толщина роговицы в области забора (L) составила 660 мкм, а толщина эпителия в области забора (K) - 48 мкм. Таким образом, глубина вреза кератома (Н), рассчитанная по формуле:
H=0,1L+0,9K
Н=0,1·660+0,9·48=66+43,2=109,2 с учетом округления составила 110 мкм, а иссечение поверхностных слоев ткани осуществляли в виде прорезанного круга диаметром 1,0-1,5 мм.
Эпителизация места биописии наблюдалась на 4 день.
Изобретение позволяет повысить эффективность проведения биопсии путем повышения точности проводимых специалистом манипуляций в процессе ее выполнения за счет предварительных измерений роговицы и расчета глубины вреза.
На основе выделенных биоптатов получают смешанную культуру клеток роговицы, которые необходимы для создания различных тканеинженерных конструкций.
Источники информации
1. Сомов Е.Е. Клиническая офтальмология / Е.Е.Сомов. - М.: МЕДпресс-информ, 2005. - 25-29 с.
2. Lavker R.M., Tseng S.С., Sun Т.Т. Corneal epithelial stem cells at the limbus: looking at some old problems from a new angle. Exp Eye Res. 2004 Mar; 78(3):433-46.
3. Reinstein D.Z., Archer T.J., Gobbe M. et al. Epithelial thickness in the normal cornea: three - dimensional display with artemis very high-frequency digital ultrasound. J Refract Surg. 2008; 24: 571-581.
4. Patel S., McLaren J., Hodge D. et al. Normal human keratocyte density and comeal thickness measurement by using confocal microscopy in vivo. Invest Ophthalmol Vis Sci. 2001; 42: 333-339.
5. Liesegang T.A., Weingeist Т.A. et al. «External Disease and cornea» // Basic and clinical science course 1998-1999; American Academy of Ophthalmology, 1998, San Francisco, USA, p.32.
6. Nema H.V. «Textbook of ophthalmology» // Jaypee Brothers Medical Publishers, 1987, New Delhi, India, p.41.
7. Аветисов С.Э., Егорова Г.Б. Возможности конфокальной микроскопии. (Предварительное сообщение). Клиническая офтальмология. 2006, т.7, №2, с.45-50.
8. Grueterich M., Espana E.M., Tseng S.С. Ex vivo expansion of limbal epithelial stem cell: amniotic membrane serving as a stem cell niche. Survey of Ophthalmol. 2003; 48:631-646.
9. Cionni R.J., Katakami С., Lavrich J.B. et al. Collagen metabolism following corneal laceration in rabbits. Curr Eye Res 1986; 5:549-558.
10. Green H., Kehinde О., Thomas J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proc Natl Acad Sci USA. 1979 Nov; 76(11):5665-5668.
11. Rochat A., Kobayashi K., Barrandon Y. Location of stem cells of human hair follicles by clonal analysis. Cell. 1994 Mar 25; 76 (6): 1063-1073.
12. Sun Т.Т., Green H. Cultured epithelial cells of cornea, conjunctiva and skin: absence of marked intrinsic divergence of their differentiated states. Nature. 1977 Oct6; 269(5628):489-93.
13. Meller D., Pires R.T.F., Tseng S.C.G. Ex vivo preservation and expansion of human limbal epithelial stem cells on amniotic membrane cultures. Br J Ophthalmol 2002; 86:463-471.
14. Rama P., Bonini S., Lambiase A. et al. Autologous fibrin-cultured limbal stem cells permanently restore the corneal surface of patients with total limbal stem cell deficiency. Transplantation. 2001; 72:1478-1485.
15. Luengo Gimeno F., Lavigne V., Gatto S. et al. One-year follow-up of epithelial corneal cell sheet allografts mounted on platelet poor plasma in rabbits. Mol Vis. 2009 Dec 15; 15:2771-2779.
16. Pellegrini G., Golisano O., Paterna P. et al. Location and clonal analysis of stem cells and their differentiated progeny in the human ocular surface. J Cell Biol. 1999; 145:769-782.
17. Tsai R.J.F., Li L.M., Chen J.K. Reconstruction of damaged corneas by transplantation of autologous limbal epithelial cells. N Engl J Med. 2000; 343: 86-93.
18. Dua H.S., Azuara-Blanco A. Autologous limbal transplantation in patients with unilateral corneal stem cell deficiency. Br J Ophthalmol 2000; 84: 273-278.
19. Волова Л.Т., Золотарев А.В., Россинская В.В., Милюдин Е.С., Ахмерова Ю.M. Метод получения культуры клеток роговичного эпителия, фиксированного на поверхности силиковысушенной амниотической мембраны. Материалы научно-практической конференции «Регенеративная медицина и трансплантация тканей в офтальмологии», 2005. с.14-15.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОТРАНСПЛАНТАТА ДЛЯ РОГОВИЦЫ | 2011 |
|
RU2505303C2 |
| Способ реконструкции эпителиального слоя роговицы при одностороннем синдроме лимбальной недостаточности путем получения лимбальных стволовых клеток при помощи низкоэнергетического высокочастотного фемтосекундного лазера LDV Z8 | 2022 |
|
RU2806509C1 |
| Способ реконструкции эпителиального слоя роговицы при синдроме лимбальной недостаточности у пациентов с истонченной роговицей | 2021 |
|
RU2766166C1 |
| Способ хирургического лечения дефектов роговицы при лимбально-клеточной недостаточности | 2022 |
|
RU2793525C1 |
| Способ проведения сквозной кератопластики после реконструкции глазной поверхности у пациентов с синдромом лимбальной недостаточности | 2024 |
|
RU2828698C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОРГАНО-ТИПИЧЕСКОЙ КОНСЕРВАЦИИ АЛЛОГЕННОГО ЛИМБАЛЬНОГО ТРАНСПЛАНТАТА | 2011 |
|
RU2475218C1 |
| Способ лечения лимбальной недостаточности с помощью трансплантации культивированных стволовых клеток в интрастромальные роговичные тоннели | 2023 |
|
RU2814630C1 |
| Способ восстановления эпителиального слоя роговицы при одностороннем синдроме лимбальной недостаточности | 2020 |
|
RU2741411C1 |
| Способ получения лимбальных стволовых клеток в коллагеновом гидрогеле | 2023 |
|
RU2809076C1 |
| Способ лечения глубоких дефектов роговицы | 2015 |
|
RU2609253C1 |
Изобретение относится к медицине, а именно к офтальмологии и клеточным технологиям, и может быть использовано для получения биоптата роговицы для последующего получения из него культуры клеток роговицы двух видов - эпителиальных прогениторов роговицы и кератоцитов. Проводят предварительное измерение роговицы. Осуществляют иссечение поверхностных слоев ткани и забор участка роговой оболочки в области лимба. Причем иссечение поверхностных слоев ткани осуществляют в зоне лимба на глубину, рассчитанную по формуле: H=0,1L+0,9K, где Н - глубина иссечения поверхностных слоев ткани, мкм, L - толщина роговицы, мкм, K - толщина эпителия роговицы, мкм. Иссечение поверхностных слоев ткани в области лимба делают в форме квадрата размером 1×1 мм или в форме круга диаметром 1,0-1,5 мм. Способ позволяет обеспечить минимальную инвазивность процедуры, отсутствие влияния на архитектонику роговицы. На основе выделенных биоптатов получают смешанную культуру клеток роговицы, которые необходимы для создания различных тканеинженерных конструкций. 2 з.п.ф-лы.
1. Способ биопсии роговицы, включающий иссечение поверхностных слоев ткани и забор участка роговой оболочки в области лимба, отличающийся тем, что предварительно проводят измерения роговицы, а иссечение поверхностных слоев ткани осуществляют в области лимба на глубину, рассчитанную по формуле: H=0,1L+0,9K, где Н - глубина иссечения поверхностных слоев ткани, мкм, L - толщина роговицы, мкм, K - толщина эпителия роговицы, мкм.
2. Способ по п.1, отличающийся тем, что иссечение поверхностных слоев ткани в области лимба делают в форме квадрата размером 1×1 мм.
3. Способ по п.1, отличающийся тем, что иссечение поверхностных слоев ткани в области лимба делают в форме круга диаметром 1,0-1,5 мм.
| ВОЛОВА Л.Т | |||
| и др | |||
| Метод получения культуры клеток роговичного эпителия, фиксированного на поверхности силиковысушенной амниотической мембраны | |||
| Материалы НПК «Регенеративная медицина и трансплантация тканей в офтальмологии» | |||
| - М., 2005, с.14-15 | |||
| 2000 |
|
RU2177284C1 | |
| Прибор для определения элементов прямоугольных треугольников | 1930 |
|
SU21469A1 |
| Siganos C.S | |||
| Stem-cell transplantation | |||
Авторы
Даты
2011-09-20—Публикация
2010-07-19—Подача