Изобретение относится к области биотехнологии и медицины и может быть использовано для ускорения заживления дефектов роговицы, а так же для восстановления эпителия роговицы при различных повреждениях, сопровождающихся частичной или полной утратой эпителиальных прогениторов (лимбальных стволовых клеток) роговицы.
Роговица - передняя фиброзная оболочка глаза, состоящая из 5 слоев. Она представляет собой оптически активную среду, обеспечивающую поступление света к световоспринимающему аппарату - сетчатке. При этом прозрачность роговицы зависит от многих факторов, в том числе от сохранности на ее внешней поверхности специфического многослойного неороговевающего эпителия [1]. Его прижизненная регенерация, как физиологическая так и репаративная, обеспечивается стволовыми клетками - эпителиальными прогениторами, локализованными в криптах Вогта зоны лимба [2].
В зависимости от объема поражения лимба, развивается частичная или полная утрата эпителиальных прогениторов роговицы. Это приводит к замещению прозрачного эпителия на непрозрачный конъюнктивальный, что уменьшает светопроницаемость роговицы и резко снижает зрение [3].
В настоящее время перспективной методикой лечения подобных патологических состояний является трансплантация культивированных ех vivo эпителиальных прогениторов роговицы на матрице. При пересадке происходит восстановление популяции утраченных стволовых клеток, за счет чего восстанавливается эпителий роговицы. Это увеличивает прозрачность роговицы и улучшает остроту зрения поврежденного глаза [4].
Трансплантация культивированных клеток предусматривает применение носителя (матрицы) для их фиксации на роговице и оптимизации процесса миграции и встраивания клеток в области повреждения. Первоначально в качестве матрицы использовалась человеческая амниотическая мембрана, обладающая противовоспалительным и антиапоптотическим эффектами за счет факторов роста, цитокинов, металлопротеиназ, антимикробных факторов, присутствующих в амнионе [5-7]. Однако процесс получения такой матрицы в обязательном порядке предусматривает как ее тестирование на инфекционную безопасность, так и особые условия хранения и транспортировки (при - 70°С), что обуславливает целесообразность продолжения поиска оптимального носителя.
Известна методика получения биотрансплантата эпителиальных прогениторов роговицы, где в качестве носителя (матрицы) используется мягкая контактная линза [8]. Однако использование данного носителя осложняется тем, что любая мягкая контактная линза имеет ту или иную степень подвижности (от 0,2 мм) на роговице при моргании. Соответственно, применение биотрансплантата на основе такого носителя сопровождается его регулярным смещением и приводит к разрыву формирующихся межклеточных контактов. Так же в процессе ношения биотрансплантат может быть легко утрачен за счет особенностей удержания контактных линз на поверхности роговицы. Таким образом, применение биотрансплантата на основе мягких контактных линз может привести к нивелированию миграции и встраивания эпителиальных прогениторов роговицы в области повреждения.
В экспериментальных исследованиях [9; 10] было показано, что для культивирования эпителиальных клеток (любого происхождения, в том числе и эпителиальных прогениторов роговицы), необходимо наличие фидерного слоя. Он не только является источником питательных веществ, но и обеспечивает их транспорт в направлении вышележащих слоев клеток. В большинстве известных исследований [11, 12] для культивирования эпителиальных прогениторов роговицы человека в качестве фидерного слоя использовалась клеточная линия эмбриональных мышиных фибробластов. При культивировании на таком фидерном слое эпителиальные прогениторы тесно ассоциированы и сохраняют прочную связь с мышиными фибробластами при механической и ферментативной обработке, что приводит к адсорбции ксеногенных белков и белок-содержащих высокомолекулярных гликозаминогликанов на мембранах культивируемых прогениторов. Кроме того было показано, что использование фидерного слоя на основе клеточной линии эмбриональных мышиных фибробластов провоцирует иммунный ответ и гибель культивированных клеток при трансплантации за счет содержания сиаловой кислоты Neu5Gc, против которой у людей имеются циркулирующие антитела [13].
Таким образом, применение фидерного слоя на основе клеточной линии эмбриональных мышиных фибробластов для получения биотрансплантата для роговицы повышает его иммуногенность и может привести к нивелированию встраивания эпителиальных прогениторов роговицы в области повреждения.
Помимо необходимости наличия носителя и фидерного слоя особые требования предъявляются к морфологической структуре биотрансплантата, которая определяет результативность применения биотрансплантата эпителиальных прогениторов роговицы. Наиболее эффективными оказались биотрансплантаты, содержащие на носителе (матрице) многослойные клеточные пласты прогениторов с большим количеством десмосомальных межклеточных соединений и относительно меньшим интерцеллюлярным пространством. Испытание таких биотрансплантатов продемонстрировало их большую эффективность по сравнению с биотрансплантатами, содержащими однослойные клеточные пласты [14].
Известен биотрансплантат, полученный на матрице с применением аллогенных эпителиальных прогениторов роговицы в концентрации 4×104 клеток/см2 [15]. Он содержит клеточный носитель (матрицу) в виде пленки на основе бедной тромбоцитами плазмы; фидерный (промежуточный) слой на основе клеточной линии эмбриональных мышиных фибробластов и эпителиальные прогениторы роговицы. Данный биотрансплантат способствует восстановлению роговичного эпителия и может быть перспективным для лечения двухсторонних поражений роговицы. Однако его создание затратно, так как требует дополнительных расходов на получение пленки из обедненной тромбоцитами плазмы, на фидерный слой на основе клеточной линии эмбриональных мышиных фибробластов и на синтетические факторы роста. Кроме того, технология получения биотрансплантата отличается многоэтапностью, а использование фидерного слоя на основе клеточной линии эмбриональных мышиных фибробластов усиливает его иммуногенность.
Наиболее близким техническим решением к заявляемому, является способ реконструкции человеческого роговичного эпителия in vitro [16]. Он включает подбор и наращивание эпителиальных прогениторов, способных к регенерации in vitro; получение прозрачной биодеградируемой фибриновой подложки, обеспечивающей рост эпителиальных прогениторов и подготовку культуры эпителиальных прогениторов роговицы на биодеградируемой фибриновой подложке в виде диска, сопоставимой по размеру с роговицей. Подбор эпителиальных прогениторов происходит на основе клонального анализа и использования специфических генетических маркеров, таких как keratin 19, keratin 12, keratin 3, protein p63. Биодеградируемая фибриновая подложка создается на основе двухкомпонентного фибринового клея, Tissucol® (Baxter-Immuno, Vienna, Austria), который модифицируется путем добавления хлоридов натрия и кальция для соллюбилизации тромбина и фибриногена. Это обеспечивает прозрачность и эластичность получаемой подложки. Для создания биотрансплантата на фибриновую подложку наносят клеточную линию эмбриональных мышиных фибробластов, прошедших 10-ти кратное деление. Затем сверху наносят эпителиальные прогениторы из расчета от 2,5×104 до 1×105 клеток на см2. Далее этот комплекс культивируется в среде DMEM, содержащей культуральную концентрацию антибиотиков при 5% СО2 и 37°С в течение срока, необходимого для получения биотрансплантата.
Рассматриваемый в качестве прототипа способ позволяет получать биотрансплантат эпителиальных прогениторов роговицы на матрице из модифицированной фибриновой подложки. Его морфологическое строение отличается тем, что, в матрице из фибрина "утопают" клетки фидерного слоя - эмбриональные мышиные фибробласты, а сверху расположены отдельные эпителиальные прогениторы. Биотрансплантат может быть использован для заживления дефектов роговицы, связанных с частичной или полной утратой ее эпителиальных прогениторов.
Процесс получения такого биотрансплантата состоит из четырех основных этапов, включающих этапы получения матрицы, ее модификации, подбора клеток и культивирования. Используемый фидерный слой на основе клеточной линии эмбриональных мышиных фибробластов усиливает иммуногенность биотрансплантата и увеличивает себестоимость его получения. Отсутствует система контроля морфологической структуры биотрансплантата, как в процессе культивирования, так и перед трансплантацией, что снижает терапевтический эффект его применения.
Задачей изобретения является разработка новой технологии получения биотрансплантата для роговицы.
Технический результат, который будет достигнут от использования заявляемого изобретения, заключается в снижении себестоимости и иммуногенности биотрансплантата, в приближении морфологического строения биотрансплантата к строению роговицы человека и возможности контроля его морфологической структуры как в процессе культивирования, так и перед трансплантацией.
Технический результат достигается тем, что в способе получения биотрансплантата для роговицы, включающем нанесение на матрицу клеток роговицы с последующим культивированием, в качестве клеток роговицы используют аутогенную смешанную культуру клеток с содержанием эпителиальных прогениторов роговицы не менее 15% и роговичных фибробластов не более 85%, а в качестве матрицы используют полимерную пленку из немодифицированной наноструктурированной гиалуроновой кислоты.
Сущность изобретения заключается в нанесении аутогенной смешанной культуры клеток роговицы на матрицу из немодифицированной наноструктуриновой гиалуроновой кислоты.
Использование в качестве матрицы пленки из немодифицированной наноструктурированной гиалуроновой кислоты возможно за счет ее устойчивой пространственной нанокаркасной конструкции. Данная конструкция не требует ксеногенного (клеточной линии эмбриональных мышиных фибробластов) или аллогенного фидерных слоев, так как он формируется из аутогенных кератоцитов (роговичных фибробластов), обладающих высоким сродством к матрице из немодифицированной наноструктурированной гиалуроновой кислоты.
В данной матрице отсутствуют катализаторы или их примеси. Ее наноструктура обеспечивает пластичность и относительно свободную диффузию кислорода. Применение такого биоматериала в качестве носителя клеток (матрицы) позволяет уменьшить себестоимость и упростить технологию производства.
Использование аутогенной смешанной культуры клеток роговицы с содержанием эпителиальных прогениторов не менее 15% и кератоцитов (роговичных фибробластов) не более 85% и дальнейшее культивирование на матрице обеспечивает получение многослойных роговичных эпителиальных пластов с плотными межклеточными соединениями. При этом отсутствует необходимость в дополнительном использовании фидерных слоев и дорогостоящих синтетических факторов роста.
Применение такой совокупности признаков для получения биотрансплантата уменьшает его себестоимость за счет использования более дешевых исходных материалов, сокращения сроков и упрощения технологии его получения, а за счет содержания аутогенной смешанной культуры клеток роговицы снижается иммуногенность биотрансплантата, приближая морфологическое строение такого биотрансплантата к строению роговицы человека и обеспечивая возможность контроля его морфологической структуры как в процессе культивирования, так и перед трансплантацией.
Из анализа научно-технической и патентной литературы заявляемой совокупности признаков при получения биотрансплантата, приводящих к значительному снижению себестоимости и иммуногенности, а так же позволяющих получать морфологическую структуру, аналогичную роговице человека по строению и позволяющих осуществлять ее контроль как в процессе культивирования, так и перед трансплантацией нами не выявлено, что позволяет сделать вывод о соответствии заявляемого технического решения критериям «новизна» и «изобретательский уровень».
Изобретение осуществляется следующим образом.
В качестве матрицы используют биоматериал из немодифицированной наноструктурированной гиалуроновой кислоты. В качестве клеток роговицы используют аутогенную смешанную культуру клеток с содержанием эпителиальных прогениторов роговицы не менее 15% и кератоцитов (роговичных фибробластов) не более 85%.
Биоматериал из немодифицированной наноструктурированной гиалуроновой кислоты в виде пленок закрепляют на поверхности стерильных безадгезивных чашек Петри и инкубируют при 5% CO2 и 37°С в среде DMEM, содержащей культуральную концентрацию антибиотиков.
По истечении 24 часов из чашек Петри микродозатором удаляют инкубационную среду, а на биоматериал наносят суспензию клеток из расчета 105 клеток на см2 поверхности матрицы. Культивируют по стандартной методике в среде DMEM, содержащей культуральную концентрацию антибиотиков, с 10%-ной эмбриональной телячьей сывороткой при 5% CO2 и 37°С со сменой среды и витальным контролем каждые три дня в течение 9-15 дней до получения на поверхности биоматериала следующей морфологической структуры:
1) все три слоя биотрансплантата: матрица, кератоциты, эпителиальные прогениторы имеют непрерывающийся контакт, то есть биотрансплантат - монолитный,
2) эпителиальные прогениторы составляют многослойную структуру из 2-4 слоев клеток,
3) эпителиальные прогениторы в многослойной структуре плотно прилегают друг к другу.
В случае несоответствия описанным критериям, культивирование продолжают до их достижения.
Вышеперечисленные морфологические свойства биотрансплантата оценивались по стандартной методике с использованием световой микроскопии и окраской гематоксилин-эозином. Для этого образец биотрансплантата фиксировали в 10-% нейтральном формалине с проводкой по спиртам и заливали в парафиновые блоки. Срезы толщиной 5 мкм окрашивали гематоксилин-эозином и оценивали при помощи световой микроскопии на микроскопе Leica DM 2500.
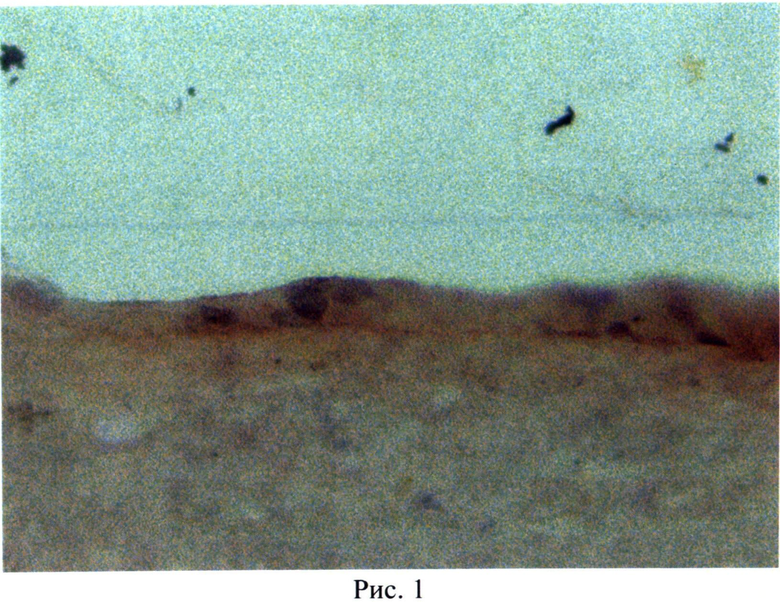
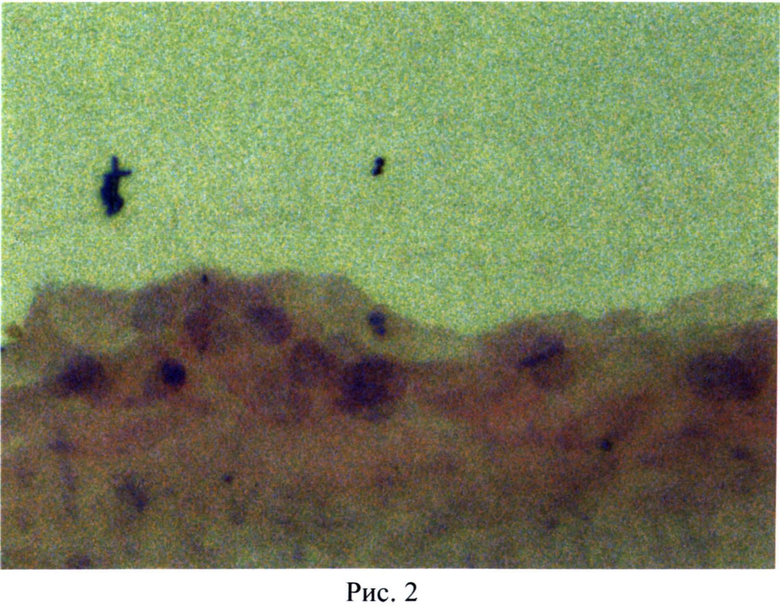
По описанной методике получен монолитный биотрансплантат, в котором эпителиальные прогениторы плотно прилегают друг к другу и составляют многослойную структуру из 2-3-х слоев клеток (рис.1), местами в комплексе с базальной мембраной (рис.2), чего не достигается по прототипу.
Сравнительные данные свойств биотрансплантатов, полученных по изобретению и прототипу приведены в таблице.
Как видно из таблицы, заявляемое изобретение по сравнению с прототипом позволяет сократить сроки получения на 5-8 дней, снизить себестоимость технологии получения в 3,3 раза, осуществить процесс его получения двустадийно, снизить иммуногенность в 10-20 раз, а также производить контроль морфологического строения биотрансплантата в любой момент.
Таким образом, изобретение позволяет получать аутогенные монолитные клеточные конструкции, аналогичные по строению роговице человека, состоящие из многослойных эпителиальных пластов с плотными межклеточными контактами в комплексе с матрицей при отсутствии фидерных слоев.
Список литературы:
1. Сомов Е.Е. Клиническая офтальмология / Е.Е. Сомов. - М.: МЕДпресс-информ, 2005. - 25-27 с.
2. Grueterich М., Espana Е.М., Tseng S.С. Ex vivo expansion of limbal epithelial stem cell: amniotic membrane serving as a stem cell niche. Survey of Ophthalmol. 2003; 48:631-646.
3. Dua H., King A., and Joseph A. A new classification of ocular surface bums. Br J Ophthalmol 2001; 85:1379-1383.
4. Pellegrini G., Rama P., Mavilio F., De Luca М. Epithelial stem cells in corneal regeneration and epidermal gene therapy. J Pathol. 2009; 217:217-228.
5. Koizumi N., Fullwood N.J., Bairaktaris G., et al. Cultivation of corneal epithelial cells on intact and denuded human amniotic membrane. Invest Ophthalmol Vis Sci 2000; 41:2506-2513.
6. Kleelan J.A., Groome N.P., Mitchell М.D. Regulation of activen-A production by human amnion, deciduas and placenta in vitro by pro-inflammatory cytokines. Placenta 1998; 19:429-434.
7. Kubo M., Sonoda Y., Muramatsu R., Usui M. Immunogenicity of human amniotic membrane in experimental xenotransplantation. Invest Ophthalmol Vis Sci 2001; 42:1539-1546.
8. Di Girolano N., Chui J., Wakefield D. et al. Cultured human ocular surface epithelium on therapeutic contact lenses. Br J Ophthalmol 2007; 91:459-464.
9. Green H., Kehinde O., Thomas J. Growth of cultured human epidermal cells into multiple epithelia suitable for grafting. Proc Natl Acad Sci USA. 1979; 76:5665-5668.
10. Rochat A., Kobayashi K., Barrandon Y. Location of stem cells of human hair follicles by clonal analysis. Cell. 1994; 25; 76(6):1063-1073.
11. Koizumi N., Inatomi Т., Suzuki Т., Sotozono C., Kinoshita S. Cultivated corneal epithelial stem cell transplantation in ocular surface disorders. Ophthalmology. 2001; 108:1569-1574.
12. Tsai R.J. F., Li L-M., Chen J-K. Reconstruction of damaged corneas by transplantation of autologous limbal epithelial cells. N Engl J Med. 2000; 343:86-93.
13. Martin M.J., Muotri A., Gage F. et al. Human embryonic stem cells express an immunogenic nonhuman sialic acid. Nat Med. 2005; 1:228-232.
14. Koizumi N., Cooper L.J., Fullwood N.J. et al. An evaluation of cultivated corneal limbal epithelial cells, using cell-suspension culture. Invest Ophthalmol Vis Sci 2002; 43:2114-2121.
15. Luengo Gimeno F., Lavigne V., Gatto S., Croxatto J.O., Correa L., Gallo J.E. One-year follow-up of epithelial corneal cell sheet allografts mounted on platelet poor plasma in rabbits. - Molecular Vision 2009; 2771-2779.
16. Патент US 6610538, НКИ 435/368, опубл. 02.06.2003.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ БИОПСИИ РОГОВИЦЫ | 2010 |
|
RU2428959C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ОРГАНО-ТИПИЧЕСКОЙ КОНСЕРВАЦИИ АЛЛОГЕННОГО ЛИМБАЛЬНОГО ТРАНСПЛАНТАТА | 2011 |
|
RU2475218C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ХРЯЩЕВОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301677C1 |
| МАТРИЦА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК | 2014 |
|
RU2571215C2 |
| Способ лечения глубоких дефектов роговицы | 2015 |
|
RU2609253C1 |
| Способ хирургического лечения дефектов роговицы при лимбально-клеточной недостаточности | 2022 |
|
RU2793525C1 |
| Способ получения лимбальных стволовых клеток в коллагеновом гидрогеле | 2023 |
|
RU2809076C1 |
| Способ изготовления биотрансплантата, биотрансплантат для устранения рецессий десны и восстановления утраченного десной объема, способ устранения рецессий десны и восстановления утраченного десной объема | 2018 |
|
RU2700510C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПАРОДОНТА | 2009 |
|
RU2418571C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ОТЕКА РОГОВИЦЫ И ДРУГИХ ПРОЯВЛЕНИЙ РАННЕЙ БУЛЛЕЗНОЙ КЕРАТОПАТИИ | 2008 |
|
RU2357743C1 |
Изобретение относится к фармацевтической промышленности, а именно к способу получения биотрансплантата для роговицы. Способ получения биотрансплантата для роговицы, включающий нанесение на матрицу, представляющую собой полимерную пленку из немодифицированной наноструктурированной гиалуроновой кислоты, клеток роговицы, в качестве которых используют аутогенную смешанную культуру клеток с содержанием эпителиальных прогениторов роговицы и роговичных фибробластов, взятых в определенном соотношении с последующим культивированием на среде, содержащей культуральную концентрацию антибиотиков. Использование вышеописанного способа приводит к сокращению времени культивирования до 9-12 дней и обеспечению дополнительной пролонгированной поддержки миграции и пролиферации клеток биотрансплантата. 2 ил., 1 табл.
Способ получения биотрансплантата для роговицы, включающий нанесение на матрицу, представляющую собой полимерную пленку из немодифицированной гиалуроновой кислоты, клеток роговицы, в качестве которых используют аутогенную смешанную культуру клеток с содержанием эпителиальных прогениторов роговицы не менее 15% и роговичных фибробластов не более 85% с последующим культивированием в среде DMEM, отличающийся тем, что в качестве матрицы используют полимерную пленку из немодифицированной наноструктурированной гиалуроновой кислоты, а культивирование проводят в течение 9-12 дней в среде DMEM, содержащей культуральную концентрацию антибиотиков.
| Адельшина Л.Р., Рахматуллин P.P., Барышева Е.С., Гильмутдинова И.Р., Епифанова А.А | |||
| КЛЕТОЧНАЯ БИОСОВМЕСТИМОСТЬ ПЛАСТИЧЕСКОГО МАТЕРИАЛА «ГИАМАТРИКС» // Современные наукоемкие технологии | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| US 6610538 В2, 26.08.2003 | |||
| Автоматический перекладчик | 1971 |
|
SU572364A2 |
| KR 9613974 В1, 10.10.1996. | |||
Авторы
Даты
2014-01-27—Публикация
2011-09-13—Подача