Изобретение относится к биотехнологии и сельскому хозяйству, в частности к способам приготовления посевного мицелия базидиомицетов, используемых для получения плодовых тел.
Известен способ получения зернового посевного мицелия, включающий подготовку субстрата путем смешивания зерна с водой, удаление избытка воды, внесение добавок, стерилизацию с последующим встряхиванием, при этом зерно помещают в емкость с горловиной, после смешивания с водой зерно выдерживают в течение суток, а после удаления избытка воды его инкубируют в течение следующих суток и перед стерилизацией горловину емкости закрывают алюминиевой фольгой, стерилизуют при 121°C и давлении 1 атм в течение 2,0-2,5 ч. Затем зерно инокулируют мицелием и инкубируют в течение 10 суток, а затем перетаривают в пакеты (Патент РФ №2101914, 20.01.1998).
Недостатком описанного способа является длительность процесса приготовления посевного мицелия, трудоемкий процесс подготовки зернового субстрата. Кроме того, используется большая норма ввода маточного мицелия на зерновом носителе в инокулируемый лигноцеллюлозный субстрат (1,5-3,0%).
Известен способ получения посевного мицелия базидиомицетов, предусматривающий приготовление стерильной жидкой питательной среды, содержащей, г/л воды: пшеничную муку - 10-40, картофельный отвар - 50-200 и стимулятор роста, в качестве которого используют суточную культуру бактерий Azospirillum. Приготовленную питательную среду засевают базидиомицетом, культивируют при 26°C в течение 3-х дней, а затем в полученную мицелиальную биомассу вносят суспензию бактерий Azospirillum из расчета 10 мл суспензии на 200 мл среды и затем осуществляют совместное культивирование базидиомицета и вышеуказанных бактерий в течение 14 дней (Патент РФ №2249614, 21.03.2003).
Недостатком описанного способа является длительность процесса приготовления посевного мицелия (17 дней) и его трудоемкость, поскольку необходимо дополнительно готовить питательную среду для бактерий и осуществлять их культивирование и подсев бактерий в среду, используемую для приготовления посевного мицелия.
Наиболее близким к заявляемому является способ получения посевного мицелия съедобных грибов, включающий приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, дигидрофосфат калия и сульфат магния, засев приготовленной среды и культивирование базидиомицета. При этом в среду дополнительно вносят стимулятор роста - арахидоновую кислоту в количестве 1,0-5,0×10-5 г/л воды (Патент РФ №2430155, 27.09.2011 г. - прототип).
Недостатком описанного способа является формирование мицелием плотных образований - пеллет, что не позволяет осуществить равномерное внесение мицелия в лигноцеллюлозный субстрат, например, методом пневматического распыления. Добавление стимулятора роста приводит к удорожанию получаемой продукции. Кроме того, полученный посевной мицелий не имеет стабильного агрегатного состояния, что приводит к его седиментации, фракционированию на твердую и жидкую фракции.
Техническим результатом заявленного способа является ускорение процесса приготовления посевного мицелия, увеличения срока хранения без снижения его жизнеспособности, формирование мицелия без образования плотных структур - пеллет, а также стабилизация агрегатного состояния, что позволяет осуществлять инокуляцию лигноцеллюлозных субстратов методом пневматического распыления.
Технический результат достигается тем, что в способе приготовления жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов, включающий приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, дигидрофосфат калия и сульфат магния, засев чистой культурой гриба и его культивирование, причем в качестве гриба используют представителей рода вешенка, в качестве источника углерода используют фруктозу в количестве 1-3% от массы среды, культивирование осуществляют в течение 5-7 суток, при температуре 26-28°C с перемешиванием со скоростью 100-140 об/мин в мин, затем добавляют глицерин до 24-26% по объему.
Заявленный способ приготовления маточного мицелия базидиомицета отличается иным источником углерода и введением дополнительно стабилизатора агрегатного состояния - глицерина, обеспечивая гомогенный рост мицелиальной биомассы без образования плотных образований - пеллет, стабильное агрегатное состояние без разделения суспензии на фракции, более длительный срок хранения без снижения жизнеспособности, сокращение производственного цикла культивирования вешенки.
Эти отличия позволяют сделать вывод о соответствии заявляемых технических решений критерию «новизна».
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение поставленной задачи и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Способ осуществлялся следующим образом. Готовили жидкую питательную среду в следующих соотношениях компонентов, мас.%: кукурузный экстракт - 2; фруктоза - 1-3; калия дигидрофосфат - 0,2; магний сернокислый - 0,03; кальция хлорид - 0,08; вода - остальное, при этом проводят термическую стерилизацию при температуре 110°C, после охлаждения до температуры 25°C вносят чистую культуру базидиомицета в количестве 0,5% от массы состава и осуществляют культивирование в течение 5-7 суток при температуре 26-28°C с перемешиванием со скоростью 100-140 об/мин, затем добавляют глицерин до 24-26% по объему.
Из культивируемых базидиальных грибов целесообразно использовать грибы ботанического рода Pleurotus, например, Pleurotus eringii (DC.:Fr.) Quel., Pleurotus djamor (Rumphius ex Fries) Boedjin, Pleurotus ostreatus (Jacg.:Fr.) Kumm., Pleurotus saju-cajor (Fries) Singer.
К факторам, обуславливающим получение жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов, относится процентное содержание компонентов источника углеводов - фруктозы.
При этом содержание фруктозы в питательной среде должно составлять 1-3% от общей массы компонентов. Если внести в композицию меньше 1% фруктозы, то не будет обеспечен углеводный состав питательной среды, что приведет к снижению концентрации образующейся мицелиальной массы. Если внести более 3%, то это приведет к накоплению мицелия с тонкой клеточной стенкой и лизису мицелиальной биомассы, поэтому нет необходимости вводить больше этого компонента. Для того чтобы была получена гомогенная биомасса заданного параметра содержание фруктозы в питательной среде должно составлять 2% от общей массы.
Эффективность процесса получения жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов с заданными свойствами обеспечивается путем культивирования продуцента на питательной среде в течение 5-7 суток, при температуре 26-28°C с перемешиванием со скоростью 100-140 об/мин.
Если время культивирования базидиомицета составит менее 5 суток, то количество мицелиальной биомассы будет низкое, что снизит сроки хранения препарата, а кроме того, низкое содержание биомассы диктует увеличение засевной дозы гриба при получении плодовых тел. Если время культивирования базидиомицета составит более 7 суток, то увеличивает время технологического процесса, а кроме того, количество биомассы продуцента увеличится незначительно. Таким образом, оптимальным временем культивирования базидиомицета является 6 суток.
Температурой культивирования базидиомицета является интервал 26-28°C. Если температуру снизить ниже 26°C, то рост гриба будет медленный, биосинтез будет снижен, и он не достигнет необходимого количества биомассы за 6 суток ферментации. Если температура культивирования окажется выше 28°C, то рост базидиомицета также будет снижаться, а ее дальнейшее повышение может привести к гибели гриба. Поэтому для достижения необходимой биомассы гриба оптимальной температурой культивирования является температура 27°C.
Если скорость перемешивания питательной среды при культивировании базидиомицета составит менее 100 об/мин, то из-за низкого содержания в среде кислорода количество мицелиальной биомассы будет низкое, в составе питательной среды будут не израсходованы элементы питания, а кроме того, низкое содержание биомассы диктует увеличение засевной дозы гриба при получении плодовых тел. Если скорость перемешивания питательной среды при культивировании базидиомицета составит более 140 об/мин, то количество биомассы продуцента увеличится незначительно, приведет к частичному повреждению мицелия и перерасходу энергоносителей. Таким образом, оптимальной скоростью перемешивания питательной среды при культивировании базидиомицета является 120 об/мин.
По окончании культивирования в питательную среду, содержащую биомассу гриба базидиомицета, дополнительно вносится стабилизатор агрегатного состояния - глицерин.
Содержание глицерина должно составлять 24-26% от общей массы полученной композиции. Если в композиции будет меньше 24% глицерина от общей массы, то не обеспечивается стабильность агрегатного состояния - происходит разделение жидкой фазы и мицелиальной биомассы, что не позволяет осуществлять инокуляцию лигноцеллюлозных субстратов методом пневматического распыления. Если в композиции будет больше 26% глицерина от общей массы, то это приведет к удорожанию, снизит относительное содержание мицелиальной биомассы и не приведет к увеличению ее эффективности при использовании, поэтому нет необходимости вводить больше этого компонента. Для достижения оптимального агрегатного состояния количество глицерина в смеси должно составлять 25% от общей массы.
Пример конкретного осуществления способа приготовления жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов в ООО МИП «Биоориджин», г. Краснодара Краснодарского края.
Получение мицелия базидиомицета проводили в производственной лаборатории на примере получения мицелиальной массы вешенки Pleurotus ostreatus в несколько этапов. На первом этапе проводили приготовление питательной среды. Для этого в стеклянную емкость, содержащую 3600 мл водопроводной воды, вносили минеральные соли в следующих количествах:
Затем в этот же объем вводили источники азота и углеводов:
После полного растворения питательных веществ в воде с помощью 0,1 М раствор соляной кислоты либо гидроксида натрия устанавливали pH питательной среды в диапазоне 6,5-7,0. Для этого к среде добавляют. Далее питательную среду разливали в восемь штук 1-литровых колб по 450 мл питательной среды, закрывали ватно-марлевыми пробками и стерилизовали при 110°C атм в течение 30 минут. После снижения температуры среды до 27°C в асептических условиях (ламинар-боксе) вносили чистую культуру вешенки Pleurotus ostreatus в виде мицелиальной суспензии в количестве 2,25 мл.
На втором этапе колбы с инокулированной средой помещали на ротационные качалки, где осуществляли культивирование при 120 об/мин и температуре 27°C. Через шесть суток культивирования в среде накапливалась гомогенная мицелиальная биомасса, культивирование прекращали. В асептических условиях в среду добавляли стабилизатор агрегатного состояния - глицерин в количестве 150 мл на колбу, содержащую 450 мл среды.
Получаемая при этом культуральная жидкость содержала мицелиальную массу гриба Pleurotus ostreatus, равномерно распределенную по всему объему среды, причем без сформированных плотных мицелиальных структур - пеллет. Объем полученного жидкого продукта составил 3594 мл, который в дальнейшем использовался при получении плодовых тел гриба как маточный мицелий.
Промышленная эффективность предлагаемого способа приготовления жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов иллюстрируется следующими примерами.
Пример 1. Готовят стерильную питательную среду следующего состава в соотношениях компонентов, мас.%: кукурузный экстракт - 2; фруктоза - 2; калия дигидрофосфат - 0,2; магний сернокислый - 0,03; кальция хлорид - 0,08; вода - остальное, при этом проводят термическую стерилизацию при температуре 110°C, после охлаждения до температуры 25°C вносят чистую культуру базидиомицета Pleurotus ostreatus в количестве 0,5% от массы состава и осуществляют культивирование в течение 6 суток при температуре 27°C с перемешиванием со скоростью 120 об/мин, затем добавляют глицерин до 25% по объему. По результатам культивирования получали в жидкой культуре однородный концентрированный маточный мицелий, не содержащий пеллет.
Готовили лигноцеллюлозный субстрат для культивирования грибов Pleurotus ostreatus, содержащий смесь измельченной пшеничной соломы и лузги подсолнечника в соотношении 1:1. Субстрат увлажняли и пастеризовали острым паром при температуре 80°C в течение двух часов, после чего субстрат выдерживали при температуре 40°C в течение 8 часов (стадия ферментации). Конечная влажность готового субстрата 65%.
Приготовленный маточный мицелий базидиомицета Pleurotus ostreatus методом пневматического распыления наносили на приготовленный лигноцеллюлозный субстрат. Фасовали субстрат в полиэтиленовые пакеты с массой готового блока 10 кг. Инкубировали блоки при температуре 25°C, относительной влажности воздуха 65%. Полное обрастание субстрата мицелием завершалось на седьмые сутки.
По истечении пятнадцати суток влажность в камере увеличивали до 85%, температуру снижали до 22°C. Кратность притока свежего воздуха в камеру - десятикратная.
Плодоношение начиналось на 19-е сутки. Продуктивность плодовых тел Pleurotus ostreatus за две волны плодоношения составила 32% от массы влажного субстрата. Таким образом, основную продуктивность получают за две волны плодоношения, а не за три, то есть производственный цикл на 14 суток короче, чем с использованием посевного мицелия, приготовленного известным способом по RU 2430155 C1, 27.09.2011.
Пример 2. Получение мицелия и его применение для выращивания плодовых тел проводили по примеру 1 с применением в качестве засевного материала чистой культуры базидиомицета Pleurotus eringii.
Пример 3. Получение мицелия и его применение для выращивания плодовых тел проводили по примеру 1 с применением в качестве засевного материала чистой культуры базидиомицета Pleurotus djamor.
Пример 4. Получение мицелия и его применение для выращивания плодовых тел проводили по примеру 1 с применением в качестве засевного материала чистой культуры базидиомицета Pleurotus saju-cajor.
Результаты экспериментов представлены в таблице 1.
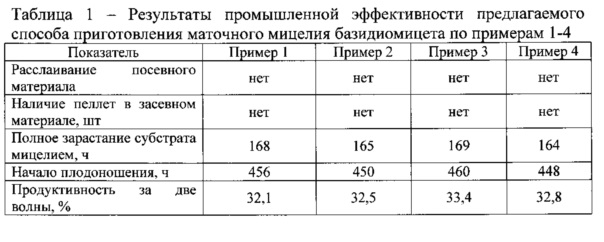
Анализируя данные из примеров 1-4 и их результаты, показанные в таблице 1, позволяют утверждать, что вне зависимости от используемого штамма рода Pleurotus по заявляемому способу получаемый посевной материал характеризуется стабильным агрегатным состоянием, не расслаивается, в нем отсутствуют пеллеты, что делает возможным его механизированное внесение в субстрат при засеве блоков. Кроме того, быстрее происходит обрастание твердого субстрата, раньше начинается плодоношение и высокая продуктивность в первые две волны.
Пример 5. Полученный в примерах 1-4 и по прототипу посевной мицелий для проверки сроков хранения и изменение его качеств во время хранения колбы с жидкофазным мицелием хранили в холодильной камере при температуре 4°C. Результаты исследований показаны в таблице 2.
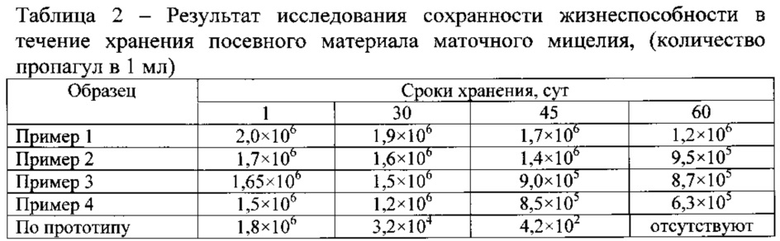
Из таблицы 2 видно, что жидкофазный мицелий, произведенный по примерам 1-4 изобретения, хранится при температуре 4°C в течение 60 суток. При этом у мицелия, воспроизведенного по прототипу, снижалась жизнеспособность на 2 порядка после 30 суток хранения, а на 60-е сутки - был не жизнеспособен.
Таким образом, применение способа приготовления жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов позволяет получить жидкофазный маточный мицелий с более длительным сроком хранения без потери жизнеспособности, получаемый мицелий не формирует плотных мицелиальных структур - пеллет, мицелий имеет стабильное агрегатное состояние, сокращается период производственного цикла.
| название | год | авторы | номер документа |
|---|---|---|---|
| Культивирование посевного мицелия гриба Pleurotus ostreatus (вешенки обыкновенной) c использованием сырой пивной дробины - отхода пивоваренной промышленности | 2019 |
|
RU2732832C1 |
| ПОСЕВНОЙ МИЦЕЛИЙ БАЗИДИОМИЦЕТА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2009 |
|
RU2430155C1 |
| ШТАММ ГРИБА Pleurotus ostreatus (Fr.) Kumm ВКМ F-3889D ДЛЯ ПОЛУЧЕНИЯ ПЛОДОВЫХ ТЕЛ ШЛЯПОЧНЫХ ПЛАСТИНЧАТЫХ ГРИБОВ | 2007 |
|
RU2351644C1 |
| Способ получения белковой кормовой биомассы | 2015 |
|
RU2670526C2 |
| ПОСЕВНОЙ МИЦЕЛИЙ БАЗИДИОМИЦЕТА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2009 |
|
RU2409658C1 |
| Субстрат для выращивания посевного мицелия съедобного гриба вешенки обыкновенной (Pleurotus ostreatus) | 2021 |
|
RU2771673C1 |
| СПОСОБ ТВЕРДОФАЗНОГО КУЛЬТИВИРОВАНИЯ ВЫСШИХ БАЗИДИАЛЬНЫХ ГРИБОВ | 1992 |
|
RU2096450C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО МИЦЕЛИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В ОБОГАЩЕНИИ БЕЛКОМ КОРМОВ ДЛЯ ЖИВОТНЫХ | 2011 |
|
RU2498558C2 |
| СПОСОБ ВЫРАЩИВАНИЯ СЪЕДОБНЫХ ГРИБОВ ИЗ РОДА PLEUROTUS | 2009 |
|
RU2442823C2 |
| Питательная среда для глубинного культивирования мицелия базидиальных грибов | 2015 |
|
RU2621870C1 |
Изобретение относится к области биотехнологии и сельского хозяйства. Способ включает приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, калия дигидрофосфат и магния сульфат, засев чистой культурой гриба и его культивирование. При этом в качестве гриба используют представителей рода вешенка. В качестве источника углерода используют фруктозу в количестве 1-3% от массы среды. Культивирование осуществляют в течение 5-7 суток при температуре 26-28°С с перемешиванием со скоростью 100-140 об/мин. Затем добавляют глицерин до 24-26% по объему. Способ позволяет ускорить процесс приготовления посевного мицелия, увеличить срок хранения без снижения его жизнеспособности, формировать мицелий без образования плотных структур и стабилизировать агрегатное состояние. 2 табл., 5 пр.
Способ приготовления жидкофазной формы маточного мицелия для получения плодовых тел шляпочных пластинчатых грибов, включающий приготовление стерильной жидкой питательной среды, содержащей источник углерода, азота, калия дигидрофосфат и магния сульфат, засев чистой культурой гриба и его культивирование, отличающийся тем, что в качестве гриба используют представителей рода вешенка, в качестве источника углерода используют фруктозу в количестве 1-3% от массы среды, культивирование осуществляют в течение 5-7 суток при температуре 26-28°С с перемешиванием со скоростью 100-140 об/мин, затем добавляют глицерин до 24-26% по объему.
| ПОСЕВНОЙ МИЦЕЛИЙ БАЗИДИОМИЦЕТА И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2009 |
|
RU2430155C1 |
| CN 102550294 A, 11.07.2012 | |||
| Способ получения хлористого водорода и окиси магния из шестиводного хлористого магния | 1925 |
|
SU7869A1 |
| СПОСОБ ПРОРАЩИВАНИЯ БАЗИДИОСПОР ВЫСШИХ ГРИБОВ | 2001 |
|
RU2188537C1 |
Авторы
Даты
2017-02-14—Публикация
2015-09-22—Подача