ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к новому антигену, ассоциированному с раком, а также к способам и композициям для лечения и выявления рака.
УРОВЕНЬ ТЕХНИКИ
В 2000 году во всем мире от рака страдали приблизительно 22 миллиона человек, и этим видом заболеваний были обусловлены 6,2 миллиона случаев смерти. Каждый год возникает более 10 миллионов новых случаев, и ожидают, что в следующие 15 лет эта предполагаемая величина возрастет на 50% (WHO, World Cancer Report. Bernard W. Stewart and Paul Kleihues, eds. IARC Press, Lyon, 2003). Существующие в настоящее время варианты лечения рака ограничены инвазивным хирургическим вмешательством, лучевой терапией и химиотерапией, и все из них вызывают возможные тяжелые побочные эффекты, неспецифическую токсичность и/или травматические изменения телесного облика и/или качества жизни. Рак может становиться устойчивым к химиотерапии, уменьшая возможности выбора дальнейшего лечения и вероятность благоприятного исхода. Для некоторых видов рака прогноз хуже, чем для других, а некоторые практически всегда смертельны. Кроме того, некоторые виды рака при сравнительно высоком уровне эффективности лечения остаются основной причиной смерти вследствие высокой частоты заболевания ими.
Одной из причин недостаточности существующих в настоящее время вариантов лечения рака является отсутствие у них избирательности в отношении пораженных тканей и клеток. Хирургическое иссечение, по-видимому, всегда связано с удалением нормальной ткани для "большей безопасности", что может повышать заболеваемость и риск осложнений. Кроме того, всегда удаляют определенную часть здоровой ткани, которая может быть рассеяна между опухолевыми клетками и которая теоретически может поддерживать или восстанавливать функционирование пораженного органа или ткани. Облучение и химиотерапия вследствие их неспецифического действия приводят к гибели или повреждают множество здоровых клеток. Это может приводить к тяжелым побочным эффектам, таким как тяжелая тошнота, потеря массы и снижение выносливости, потеря волос и т.д., а также повышение риска развития в дальнейшем вторичного рака. Лечение с более высокой избирательностью в отношении раковых клеток оставит нормальные клетки без повреждений, что тем самым улучшит исход, профиль побочных эффектов и качество жизни.
Избирательность лечения рака можно улучшать с применением нацеливающих молекул, которые специфичны для раковых клеток и которые не встречаются в нормальных клетках. Эти молекулы можно затем использовать в качестве мишени в диагностике или терапии на основе антител или для лекарственных средств, способных изменять их функцию.
Немногое, что известно о белке Scratch, было получено на основе схематической трансляции и анализа получаемой гипотетической последовательности белка. Было открыто, что экспрессия мРНК Scratch (Scrt) млекопитающих ограничена головным мозгом, спинным мозгом и вновь дифференцирующимися постмитотическими нейронами, что позволяет предположить возможную роль в нейронной дифференцировке. Ген Scratch млекопитающих, относящийся к человеку, был картирован на q24.3 (хромосома 8) Nakakura et al. 2001a, PNAS vol. 98 p. 4010-4015 и Nakakura et al. 2001. Mol. Brain. Res. Vol. 95 p. 162-166.
Scratch млекопитающих обладает доменом SNAG, общим для других белков "цинковые пальцы", таких как SNAI1, SNAI2, SNAI3, GFII и GFIIB. Хотя в довольно большом количестве лабораторий работают с доменами SNAG (Battle E et al. 2000. Nat. Cell Biol, Vol. 2:84-89; Kataoka H et al., 2000. Nucleic Acids Res. Vol. 28:626-633; Grimes HL et al. 1996. Mol. Cell. Biol. Vol. 16:6263-6272; Hemavathy K et al. 2000. Mol. Cell. Biol. Vol: 20:5087-5095), и хотя со сверхэкспрессией гена Scrt связана локомоторная функциональность у улитки, наличие белка как такового до сих пор показано не было. На основе гипотетической белковой последовательности белок Scratch должен иметь домены "цинковых пальцев" и домен SNAG, ответственный за функционирование в подавлении транскрипции. Последовательность указывает на то, что получаемый белок является внутриядерным, и действительно, было открыто, что экспрессия рекомбинантного Scratch млекопитающих ограничена ядром трансфицированных клеток (Nakakura et al. 2001a, PNAS vol. 98, p. 4010-4015).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторами настоящего изобретения был выявлен новый белок, ассоциированный с раком. Соответственно, изобретение относится к новому антигену, ассоциированному с раком, который можно использовать в лечении и диагностике рака. В частности, антиген ассоциирован с глиобластомой, меланомой, раком молочной железы, раком легких, раком яичника, лимфомой, раком толстой кишки, раками желудка и/или раком предстательной железы.
Новый антиген представляет собой вариант Scratch млекопитающих. Вариант содержит трансмембранный домен, отсутствующий у Scratch дикого типа, и в результате белок согласно изобретению поддается выявлению на поверхности клеток. Соответственно, изобретение относится к выделенному белку, содержащему ассоциированный с раком вариант Scratch млекопитающих, который экспрессируется на поверхности раковых клеток. В одном из вариантов осуществления изобретения ассоциированный с раком вариант Scratch млекопитающих содержит аминокислотную последовательность, обозначенную SEQ ID NO:1, или ее вариант, или аминокислотную последовательность, обозначенную SEQ ID NO:2, или ее вариант.
В другом аспекте изобретение относится к выделенному белку, содержащему аминокислотную последовательность SEQ ID NO:1 или ее вариант, или аминокислотную последовательность SEQ ID NO:2 или ее вариант.
Также изобретение относится к выделенным последовательностям нуклеиновых кислот, кодирующим выделенный белок согласно изобретению, рекомбинантным векторам экспрессии, содержащим последовательности нуклеиновых кислот согласно изобретению, и к клеткам-хозяевам, содержащим рекомбинантные векторы экспрессии согласно изобретению.
В другом своем аспекте изобретение относится к способу выявления или мониторинга рака у индивида, у которого выявлен рак или предполагается его наличие, где способ включает в себя выявление выделенного белка согласно изобретению на клетке в образце, где рак диагностируют при выявлении на клетке выделенного белка.
Кроме того, изобретение относится к способам выявления или мониторинга рака у индивида, у которого обнаруживают или предполагают наличие рака, где способ включает в себя выявление экспрессии ассоциированного с раком варианта Scratch млекопитающих в клетке в образце, где рак диагностируют при выявлении в клетке экспрессии ассоциированного с раком варианта Scratch млекопитающих.
В другом аспекте изобретение относится к способу лечения или профилактики рака у индивида посредством регуляции функции или экспрессии Scratch млекопитающих в раковой клетке.
Также изобретение относится к фармацевтическим композициям, содержащим эффективное количество выделенных белков согласно изобретению, выделенных последовательностей нуклеиновых кислот согласно изобретению и/или рекомбинантных векторов экспрессии согласно изобретению.
В другом аспекте изобретение относится к применению выделенных белков согласно изобретению, выделенных последовательностей нуклеиновых кислот согласно изобретению и/или рекомбинантных векторов экспрессии согласно изобретению для индуцирования иммунной реакции у индивида.
В другом аспекте изобретение относится к применению выделенных белков согласно изобретению, выделенных последовательностей нуклеиновых кислот согласно изобретению и/или рекомбинантных векторов экспрессии согласно изобретению для лечения или профилактики рака.
Кроме того, изобретение относится к способам лечения или профилактики рака у индивида, включающим в себя введение индивиду или в клетку индивида эффективного количества выделенных белков согласно изобретению, выделенных последовательностей нуклеиновых кислот согласно изобретению и/или рекомбинантных векторов экспрессии согласно изобретению.
Также изобретение относится к способам индукции иммунной реакции у индивида против выделенного белка согласно изобретению, где способы включают в себя введение индивиду или в клетку индивида эффективного количества выделенных белков согласно изобретению, выделенных последовательностей нуклеиновых кислот согласно изобретению и/или рекомбинантных векторов экспрессии согласно изобретению.
В другом аспекте изобретение относится к способу выявления или мониторинга рака у индивида, где способ включает в себя следующие стадии:
(1) контактирование тестируемого образца, получаемого у указанного индивида, со связывающим белком, который специфически связывается с антигеном на раковой клетке, для получения комплекса связывающий белок-антиген;
(2) измерение количества комплекса связывающий белок-антиген в тестируемом образце; и
(3) сравнение количества комплекса связывающий белок-антиген в тестируемом образце с контролем.
Другие особенности и преимущества настоящего изобретения будут очевидны из следующего ниже подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, хотя и указывают на предпочтительные варианты осуществления изобретения, однако предназначены только для иллюстрации, поскольку из этого подробного описания специалистам в данной области будут очевидны различные изменения и модификации, входящие в сущность и объем изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Далее изобретение описано в связи со следующими чертежами:
На фиг.1 представлены структуры гликанов, вовлеченные в связывание VB3-011 с белком согласно изобретению. Хондроитинсульфат A, также известный как хондроитин-4-сульфат (вследствие наличия молекулы сульфата в положении 4), представляет собой линейную молекулу из повторяющихся D-галактозамина и глюкуроновой кислоты (A). Когда две такие молекулы CSA сшивают посредством 2-6-альфа-связи, гликановый компонент образуется в компонент, который распознается гемагглютинином (HA) (B).
На фиг.2 представлено схематическое отображение фиксирования реагента HA. На первой стадии повышают специфичность HA блокированием эпитопов против HA/белок-G-сефарозы. На второй стадии его фиксируют посредством белка-G-сефарозы, одновременно блокируя любую неспецифичность, которая возникает вследствие стадии связывания с антителом против IgG. Стадия 3, реакция с этаноламином, обеспечивает то, что, кроме эпитопа HA, все остальные реакционноспособные аминогруппы блокируются, что тем самым повышает специфичность в отношении HA.
На фиг.3 представлены результаты основанной на применении лектина очистке белка согласно изобретению, выявляемого посредством VB3-011. Лектины Con-A и WGA выводили неспецифические белки, тогда как HA выводил только один белок, присутствующий в положительной и отсутствующий в отрицательной линии клеток (фиг.3A). При очистке с применением HA для U87MG, U118MG и A375 наблюдают одну полосу, тогда как для Panc-1 и Daudi не наблюдают поддающихся выявлению полос (фиг.3B).
На фиг.4 представлена потеря гликанового остатка вследствие разрушения при комнатной температуре. Как правило, для IP с реагентом HA наблюдают полосу 50 кДа, но когда позволяют выдерживаться при комнатной температуре в течение часа перед разделением на SDS-PAGE, это приводит к разрушению гликанового остатка, что тем самым приводит к выявлению присутствия полосы белка, не содержащего гликановый участок антигена, на уровне 36 кДа.
На фиг.5 представлено наличие одной-единственной области белка в очищенном комплексе антигена, при величине молекулярной массы - 36 кДа и pI=9,7. На ней представлен профиль вестерн-блота при 2D-PAGE, полученный при очистке с антигеном VB3-011. Соответствующую область из геля использовали для определения ID.
На фиг.6 и SEQ ID NO:3 представлено полное картирование полученных пептидов и информация по последовательностям молекулы Scratch млекопитающих дикого типа, уникальный идентификатор №gi|13775236. Подчеркнутые аминокислоты представляют собой последовательности аминокислот, выявленные в анализе MS.
На фиг.7 и SEQ ID NO:4 представлена информация по последовательности, полученной для gi|15928387 из MDA-MB-435S, и сравнение последовательностей в BLAST для полученной из 435S последовательности и Scrt. MDA-MD-435S отражает присутствие усеченного варианта Scratch, т.е. белка gi|15928387 17,823 кДа, при гомологии 100% с последовательностями 185-366 из молекулы Scratch млекопитающих дикого типа.
На фиг.8 представлены сканограммы TOF-MS для пептидов, полученных из клеточной линии A-375, для выявления присутствия всех ионов пептидов в образце. Сто сканирований при 1200-1400 В в диапазоне 100-1200 а.е.м. с применением статического наноспрея привели к получению значительного количества пептидов, из которых при анализе ID определили белок Scratch млекопитающих. На фиг.8A представлена сканограмма TOF-MS со всеми многозарядными ионами пептидов, а на фиг.8B представлена развертка спектра с однозарядными ионами пептидов.
На фиг.9 представлены сканограммы TOF-MS для пептидов, полученных из клеточной линии U87MG, для выявления присутствия всех ионов пептидов в образце. Триста сканирований при 1200-1400 В в диапазоне 100-1200 а.е.м. с применением статического наноспрея привели к получению значительного количества пептидов, из которых при анализе ID определили белок Scratch млекопитающих. На фиг.9A представлена сканограмма TOF-MS со всеми многозарядными ионами пептидов, а на фиг.9B представлена развертка спектра с однозарядными ионами пептидов.
На фиг.10 представлены сканограммы TOF-MS для пептидов, полученных из клеточной линии U118MG, для выявления присутствия всех ионов пептидов в образце. Двадцать семь сканирований при 1200-1400 В в диапазоне 100-1200 а.е.м. с применением статического наноспрея привели к получению значительного количества пептидов, из которых при анализе ID определили белок Scratch млекопитающих. На фиг.10A представлена сканограмма TOF-MS со всеми многозарядными ионами пептидов, а на фиг.10B представлена развертка спектра с однозарядными ионами пептидов.
На фиг.11 и SEQ ID NO:1 представлена информация по последовательностям пептидов, полученных при масс-спектрометрическом анализе, как указано в таблице 2. При внутригелевом расщеплении трипсином было суммарно выделено 18 пептидов, и полнота охвата данных по белку составила 67%. Подчеркнутые последовательности представляют собой полученные пептидные последовательности. Выделенный цветом пептид включает в себя новые последовательности. Конкретно, последовательности, выделенные жирным шрифтом, представляют собой новые последовательности, а последовательности, выделенные курсивом, представляют собой точные совпадения со Scratch млекопитающих.
На фиг.12 представлены результаты масс-фингерпринтинга пептидов для пептидов, полученных из антигена VB3-011Ag. Значимой считали балльную оценку для белка, превышающую 77. Единственные выявленные значимые ID белков указывали на один антиген, известный как Scratch млекопитающих, с балльной оценкой 149.
На фиг.13 представлено, что выявленный антиген, Scratch млекопитающих, имеет значимую балльную оценку 149. Вследствие особенностей сервера с базой данных и сходства/гомологии ассоциированных пептидов все изоформы этого белка были отмечены как искомое совпадение. Фрагментация посредством MS/MS и отождествление пептидов подтверждают, что антиген представляет собой Scratch млекопитающих.
На фиг.14 представлена ионная фрагментация MS/MS нейтрального пептида Mr. 2402.978172, что выглядит как трехзарядная молекула (802.00000, 3+). Пептидная последовательность точно соответствует пептиду из Scratch.
На фиг.15 представлена ионная фрагментация MS/MS нейтрального пептида Mr. 2134.985448, что выглядит как двухзарядная молекула (1068.500000, 2+). Фланкирующие участки полученного пептида точно совпадают с пептидом из Scratch; однако для остальной части последовательности наблюдают не более чем 40% гомологию.
На фиг.16 представлены типичные примеры фотографий иммуногистохимического окрашивания с применением VB3-011 для ткани нейробластомы (A-C) и ткани меланомы (D-F). Срезы тканей представляют собой следующее: (A) - нейробластома на ранних стадиях (стадии I, II, III без амплификации N-myc), 3+; (B) - нейробластома на стадии IV без амплификации N-myc, 2+; (C) - нейробластома на стадии IV с амплификацией N-myc, 3+. (D) - меланома на ранних стадиях (стадии I-III), 3+; (E) - меланома на стадии IV, 3+; (F) - метастазирующая опухоль, 3+. Все фотографии представлены при 400X увеличении.
На фиг.17 и SEQ ID NO:5 и 3 представлена карта рестрикции Scratch-1.
На фиг.18 представлена цитотоксичность VB6-011 in vitro в анализе MTS для VB6-011 с антиген-положительными клетками MB-435S (незаштрихованный круг) и антиген-отрицательными клетками Panc-1 (черный круг). Клетки высевали по 1000 клеток на лунку, инкубировали вместе с очищенными белками Fab-де-буганин. Через 5 суток инкубации оценивали жизнеспособность клеток и определяли IC50.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
(A) Определения
Термин "клетка" включает одну клетку, а также множество или популяцию клеток. Введение средства (такого как ассоциированный с раком белок) в клетку включает введение как in vitro, так и in vivo.
В рамках настоящей заявки термин "вводимый системно" означает, что иммуноконъюгат и/или другое противораковое терапевтическое средство можно вводить системно таким удобным способом, как посредством инъекции (подкожной, внутривенной, внутримышечной и т.д.), оральным введением, ингаляцией, трансдермальным введением или местным введением (например, крем или мазь для наружного применения и т.д.), введением суппозиториев или с применением имплантата. Имплантат может быть из пористого, непористого или гелеобразного вещества, включая мембраны, такие как силастиковые мембраны, или волокна. Как правило, суппозитории содержат активные ингредиенты в диапазоне от 0,5% до 10% мас.
Термин "аминокислота" включает все природные аминокислоты, а также модифицированные аминокислоты.
В рамках настоящей заявки подразумевают, что термин "антитело" включает моноклональные антитела, поликлональные антитела и химерные антитела. Антитело можно получать из рекомбинантных источников и/или получать в трансгенных животных. В рамках настоящей заявки подразумевают, что термин "фрагмент антитела" включает Fab, Fab', F(ab')2, scFv, dsFv, ds-scFv, димеры, миниантитела, димеры антител и их полимеры, а также биспецифические фрагменты антител. Антитела можно разделять на фрагменты с применением общепринятых способов. Например, фрагменты F(ab')2 можно получать, обрабатывая антитело пепсином. Получаемый фрагмент F(ab')2 можно обрабатывать, восстанавливая дисульфидные мостики, для получения фрагментов Fab'. Расщепление папаином может приводить к образованию фрагментов Fab. Fab, Fab' и F(ab')2, scFv, dsFv, ds-scFv, димеры, миниантитела, димеры антител, биспецифические фрагменты антител и другие фрагменты можно также синтезировать рекомбинантными способами.
Под "по меньшей мере умеренно жесткими условиями гибридизации" подразумевают, что выбраны условия, которые способствуют избирательной гибридизации двух комплементарных молекул нуклеиновых кислот в растворе. Гибридизация может происходить с полноразмерной или с частичной последовательностью молекулы нуклеиновой кислоты. Как правило, длина гибридизующегося участка составляет по меньшей мере 15 (например, 20, 25, 30, 40 или 50) нуклеотидов. Специалисты в данной области понимают, что стабильность дуплекса нуклеиновых кислот, или гибридов, определяется величиной Tm, которая в содержащих натрий буферах является функцией концентрации ионов натрия и температуры (Tm=81,5°C-16,6 (Log10[Na+])+0,41(%(G+C)-600/л), или сходное уравнение). Соответственно, параметры для условий отмывки, определяющие стабильность гибрида, представляют собой концентрацию ионов натрия и температуру. При выявлении сходных, но не одинаковых молекул в случае известной молекулы нуклеиновой кислоты можно допустить, что несоответствие величиной 1% приводит приблизительно к снижению Tm на 1°C, например, если ищут молекулы нуклеиновых кислот, совпадающие на >95%, температуру конечной промывки снижают приблизительно на 5°C. На основе этих расчетов специалисты в данной области способны легко выбрать надлежащие условия гибридизации. В предпочтительных вариантах осуществления выбирают жесткие условия гибридизации. Например, для достижения строгой гибридизации можно использовать следующие условия: гибридизация в 5× хлорид натрия/цитрат натрия (SSC)/5× раствор Денхардта/1,0% SDS при Tm - 5°C на основе указанного выше уравнения, с последующей промывкой в 0,2× SSC 0,1% SDS при 60°C. Умеренно жесткие условия гибридизации включают стадию в себя промывки в 3× SSC при 42°C. Однако понимают, что эквивалентную строгость условий можно достигать с применением альтернативных буферов, солей и температур. Дополнительное руководство относительно условий гибридизации можно найти в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y., 2002 и в Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, 2001.
Здесь термин "связывающий белок" относится к белкам, специфически связывающимся с другим веществом, таким как ассоциированный с раком антиген согласно изобретению. В одном из вариантов осуществления связывающие белки представляют собой антитела или фрагменты антител.
Под "биологически совместимой формой, приемлемой для введения in vivo" подразумевают форму подлежащего введению вещества, для которой терапевтические эффекты превосходят какие-либо токсические эффекты.
Здесь термины "ассоциированный с раком вариант Scratch млекопитающих", "ассоциированный с раком антиген согласно изобретению", "ассоциированный с опухолью антиген согласно изобретению" или "выделенный белок согласно изобретению" относятся к новому варианту Scratch млекопитающих, экспрессирующемуся на поверхности раковых клеток, или к его варианту, который также экспрессируется на поверхности раковых клеток. В одном из вариантов осуществления новый ассоциированный с раком антиген содержит по меньшей мере один трансмембранный домен. В конкретных вариантах осуществления ассоциированный с раком антиген из Scratch млекопитающих представляет собой выделенный белок, содержащий аминокислотную последовательность, которая обозначена SEQ ID NO:1, или выделенный белок, содержащий аминокислотную последовательность, которая обозначена SEQ ID NO:2.
Термин "раковая клетка" включает раковые или образующие опухоль клетки, трансформированные клетки или клетку, которая подвержена развитию в раковую или образующую опухоль клетку.
Здесь термин "консервативная аминокислотная замена" относится к замене, при которой один остаток аминокислоты заменен другим аминокислотным остатком без устранения желаемых свойств белка.
Здесь термин "контроль" относится к образцу от индивида или группы индивидов, для которых известно наличие рака или отсутствие рака.
Здесь термин "система с контролируемым высвобождением" обозначает иммуноконъюгат и/или другое противораковое терапевтическое средство согласно изобретению, которое можно вводить контролируемым способом. Например, посредством микропомпы можно доставлять контролируемые дозы непосредственно в область опухоли, тем самым точно регулируя время действия и концентрацию фармацевтической композиции (см., например, Goodson, 1984, in Medical Applications of Controlled Release, vol. 2, pp.115-138).
Термин "производное пептида" относится к пептиду, содержащему один или несколько остатков, химически дериватизированных в результате реакции функциональной боковой группы. Например, такие дериватизированные молекулы включают те молекулы, в которых свободные аминогруппы были дериватизированы с образованием амингидрохлоридов, п-толуолсульфониловых групп, карбобензоксигрупп, т-бутилоксикарбонильных групп, хлорацетильных групп или формильных групп. Свободные карбоксильные группы можно дериватизировать, получая соли, метиловые и этиловые сложные эфиры или другие виды сложных эфиров или гидразидов. Свободные гидроксильные группы можно дериватизировать, получая O-ацил- или O-алкилпроизводные. Имидазольный азот в гистидине можно дериватизировать, получая N-имбензилгистидин. Также к производным относятся те пептиды, которые содержат одно или несколько природных производных аминокислот, относящихся к двадцати обычным аминокислотам. Например, 4-гидроксипролин может быть заменен пролином; 5-гидроксилизин может быть заменен лизином; 3-метилгистидин может быть заменен гистидином; гомосерин может быть заменен серином; и орнитин может быть заменен лизином.
Выражение "выявление или мониторинг рака" относится к способу или процессу определения наличия или отсутствия у индивида рака, распространенности рака, тяжести рака и/или степени тяжести рака.
Здесь термин "прямое введение" означает, что противораковое терапевтическое средство можно вводить, без ограничений, внутрь опухоли, внутрисосудисто и в пространство около опухоли. Например, противораковое терапевтическое средство можно вводить одной или несколькими прямыми инъекциями в опухоль, постоянной или периодической перфузией опухоли, введением депо противоракового терапевтического средства, введением в опухоль системы с замедленным высвобождением, введением в опухоль препарата с замедленным высвобождением и/или непосредственным введением в опухоль. Под способом введения "в опухоль" подразумевают введение противоракового терапевтического средства в область опухоли или в кровеносный сосуд, или лимфатический сосуд, который практически непосредственно входит в область опухоли.
Здесь выражение "эффективное количество" означает количество, которое является эффективным при дозах и в течение периодов времени, необходимых для достижения желаемого результата. Эффективные количества терапевтического средства могут различаться в соответствии с такими факторами как состояние заболевания, возраст, пол, масса животного. Схему введения доз можно изменять, обеспечивая оптимальную терапевтическую реакцию. Например, ежесуточно можно вводить несколько разделенных доз, или дозу можно пропорционально снижать в соответствии с потребностями терапевтической ситуации.
Здесь термины "запуск иммунной реакции" или "индукция иммунной реакции" означают инициацию, индуцирование, приведение к, усиление, улучшение или увеличение какой-либо реакции иммунной системы, например, гуморальной или клеточно-опосредуемой. Индукцию или усиление иммунной реакции можно оценивать с применением анализов, которые известны специалистам в данной области, включая, но ими не ограничиваясь, анализы с антителами (например, анализ ELISA), анализы антигенспецифической цитотоксичности и продуцирование цитокинов (например, анализы ELISPOT). Предпочтительно, выделенные белки, последовательности нуклеиновых кислот или экспрессирующие рекомбинантные векторы согласно изобретению, а также способ согласно настоящему изобретению вызывают или усиливают клеточную иммунную реакцию, более предпочтительно, T-клеточную реакцию.
Здесь термин "антитело против VB3-011" относится к антителу с вариабельной областью из антитела, описанного в WO 97/044461, для которого было показано специфическое связывание с множеством раковых клеток и отсутствие значительного связывания с нормальной тканью или клетками.
Здесь термин "выделенные последовательности нуклеиновых кислот" относится к нуклеиновой кислоте, практически не содержащей клеточного материала или культуральной среды при получении способами рекомбинантной ДНК или не содержащей химических предшественников или других химических веществ при химическом синтезе. Также выделенная нуклеиновая кислота практически не содержит последовательностей, которые в природе фланкируют нуклеиновую кислоту (т.е. последовательности, расположенные на 5'- и 3'-концевых участках нуклеиновой кислоты), из которой получают нуклеиновую кислоту. Подразумевают, что термин "нуклеиновая кислота" включает ДНК и РНК и может относиться к двухцепочечным или одноцепочечным веществам.
Термин "выделенные белки" относится к белку, практически не содержащему клеточного материала или культуральной среды при получении способами рекомбинантной ДНК или не содержащему химических предшественников или других химических веществ при химическом синтезе. Он включает новый ассоциированный с раком антиген согласно изобретению.
"Scratch млекопитающих" (gi|13775236; gi|46397014; gi|13129535) представляет собой белок, кодируемый геном, который был картирован на q24.3 хромосомы 8 человека. Из анализа гипотетической последовательности белка на основе схематической трансляции Scratch млекопитающих содержит 5 доменов "цинковых пальцев" и домен SNAG. Предполагают, что он представляет собой внутриядерный белок. Гипотетическая последовательность белка представлена в SEQ ID NO:3.
В рамках настоящей заявки термин "последовательность нуклеиновой кислоты" относится к последовательности нуклеозидных или нуклеотидных мономеров, состоящих из природных оснований, сахаров и межсахарных (каркасных) связей. Также термин включает модифицированные или замещенные последовательности, которые содержат не встречающиеся в природе мономеры или их участки. Последовательности нуклеиновых кислот согласно настоящему изобретению могут представлять собой последовательности дезоксирибонуклеиновых кислот (ДНК) или последовательности рибонуклеиновых кислот (РНК) и могут включать природные основания, в том числе аденин, гуанин, цитозин, тимидин и урацил. Также последовательности могут содержать модифицированные основания. Примеры таких модифицированных оснований включают аза- и деазааденин, -гуанин, -цитозин, -тимидин и -урацил; а также ксантин и гипоксантин.
Здесь термин "образец" относится к любому образцу жидкости, клетки или ткани от индивида, которого можно диагностировать на предмет рака.
Здесь термин "совпадение последовательностей" относится к проценту совпадения последовательностей для двух последовательностей полипептидов. Для определения процента совпадения для двух последовательностей полипептидов выравнивают аминокислотные последовательности таких двух последовательностей, предпочтительно, с применением алгоритма Clustal W (Thompson, JD, Higgins DG, Gibson TJ, 1994, Nucleic Acids Res. 22 (22):4673-4680) вместе с матрицей для количественного подсчета BLOSUM 62 (Henikoff S. and Henikoff J. G., 1992, Proc. Natl. Acad. Sci. USA 89:10915-10919), а также штрафом для создания разрыва, составляющим 10, и штрафом для удлинения разрыва, составляющим 0,1, так, что наивысший порядок совпадения достигается для двух последовательностей при включении в выравнивание по меньшей мере 50% общей длины одной из последовательностей. Другие способы, которые можно использовать для выравнивания последовательностей, представляют собой способ выравнивания Needleman и Wunsch (J. Mol. Biol., 1970, 48:443), как переработано Smith и Waterman (Adv. Appl. Math., 1981, 2:482), так, что наивысший порядок совпадения достигается для двух последовательностей и число одинаковых аминокислот определяют для двух последовательностей. В данной области широко известны другие способы вычисления процента совпадения двух аминокислотных последовательностей, и они включают, например, способы, которые описаны Carillo and Lipton (SIAM J. Applied Math., 1988, 48:1073), и способы, описанные в Computational Molecular Biology, Lesk, e.d. Oxford University Press, New York, 1988, Biocomputing: Informatics and Genomics Projects. Как правило, для таких вычислений используют компьютерные программы. Компьютерные программы, которые можно использовать с этой целью, включают в себя, но ими не ограничиваются, GCG (Devereux et al., Nucleic Acids Res., 1984, 12:387) BLASTP, BLASTN и FASTA (Altschul et al., J. Molec. Biol., 1990:215:403).
Здесь термин "индивид" относится к любому представителю царства животных, предпочтительно - млекопитающему, более предпочтительно - человеку. В предпочтительном варианте осуществления у индивида предполагают наличие рака.
Здесь выражение "лечение или профилактика рака" относится к ингибированию воспроизведения раковых клеток, предотвращению трансформации клетки в образующую рак клетку, ингибированию распространения рака (метастазирования), ингибированию роста опухоли, снижению числа раковых клеток или роста опухоли, снижению степени злокачественности рака (например, повышению дифференцировки) или улучшению ассоциированных с раком симптомов.
Здесь термин "вариант" включает модификации или химические эквиваленты аминокислотных и нуклеотидных последовательностей согласно настоящему изобретению, выполняющих практически тем же образом практически ту же функцию, что и молекулы белков или нуклеиновых кислот согласно изобретению. Например, варианты белков согласно изобретению включают без ограничений консервативные аминокислотные замены. Также варианты белков согласно изобретению включают дополнения и делеции в отношении белков согласно изобретению. Кроме того, различные пептиды и различные нуклеотидные последовательности включают их аналоги и производные. Вариант ассоциированного с раком антигена согласно изобретению означает последовательность белка, экспрессирующегося на раковых клетках, но не на обычных клетках.
(B) Новый ассоциированный с раком антиген
Изобретение относится к новому ассоциированному с раком антигену, экспрессирующемуся на поверхности раковых клеток и не экспрессирующемуся в значительной степени на поверхности обычных клеток. Новый ассоциированный с раком антиген представляет собой вариант Scratch млекопитающих. Он содержит трансмембранный домен, не присутствующий в Scratch млекопитающих. Последовательность трансмембранного домена представлена в SEQ ID NO:2. Последовательность ассоциированного с раком варианта представлена в SEQ ID NO:1.
В одном из вариантов осуществления изобретение относится к выделенному белку, содержащему аминокислотную последовательность, которая обозначена SEQ ID NO:1, или ее вариант. В другом варианте осуществления изобретение относится к выделенному белку, содержащему аминокислотную последовательность, которая обозначена SEQ ID NO:2, или ее вариант.
Новый ассоциированный с раком антиген представляет собой вариант Scratch млекопитающих, экспрессирующийся на поверхности раковых клеток. Соответственно, изобретение относится к выделенному белку, содержащему ассоциированный с раком вариант Scratch млекопитающих, где ассоциированный с раком вариант Scratch млекопитающих экспрессируется на поверхности раковых клеток. В одном из вариантов осуществления ассоциированный с раком вариант Scratch млекопитающих содержит аминокислотную последовательность, обозначенную SEQ ID NO:1. В другом варианте осуществления ассоциированный с раком вариант Scratch млекопитающих содержит аминокислотную последовательность, обозначенную SEQ ID NO:2.
Специалист в данной области понимает, что изобретение включает варианты аминокислотных последовательностей SEQ ID NO:1-2, где такие варианты также представляют собой ассоциированные с раком антигены. Варианты включают химические эквиваленты последовательностей, описанных в настоящем изобретении. Такие эквиваленты включают белки, выполняющие практически тем же образом практически ту же функцию, что и описанные в настоящей заявке конкретные белки. Например, эквиваленты включают без ограничений консервативные аминокислотные замены.
В одном из вариантов осуществления варианты аминокислотных последовательностей выделенных белков согласно изобретению совпадают с последовательностью SEQ ID NO:1 или 2 по меньшей мере на 50%, предпочтительно - по меньшей мере на 60%, более предпочтительно - по меньшей мере на 70%, наиболее предпочтительно - по меньшей мере на 80%, а еще более предпочтительно - по меньшей мере на 90%.
Также изобретение относится к выделенной последовательности нуклеиновой кислоты, кодирующей выделенные белки согласно изобретению. В одном из вариантов осуществления выделенная нуклеиновая кислота обладает последовательностью, представленной в SEQ ID NO:6. Кроме того, изобретение относится к вариантам выделенных последовательностей нуклеиновых кислот, кодирующих выделенные белки согласно изобретению. Например, варианты включают нуклеотидные последовательности, гибридизующиеся с последовательностями нуклеиновых кислот, которые кодируют выделенные белки согласно изобретению, при по меньшей мере умеренно жестких условиях гибридизации. Варианты последовательностей нуклеиновых кислот кодируют белок, который представляет собой ассоциированный с раком антиген.
Изобретение относится к применению выделенных белков или ассоциированных с раком антигенов и соответствующих последовательностей нуклеиновых кислот.Например, применение выделенных белков согласно изобретению для получения связывающих белков и иммуноконъюгатов, которые можно применять для лечения или профилактики рака или которые можно использовать для выявления или мониторинга рака у индивида. Соответственно, изобретение относится к применению выделенных белков и последовательностей нуклеиновых кислот согласно изобретению для лечения или профилактики рака и для получения лекарственного средства для лечения или профилактики рака или для диагностики рака.
(C) Фармацевтические композиции, способы и варианты применения нового ассоциированного с раком антигена
Изобретение относится к новому ассоциированному с раком антигену, экспрессирующемуся на поверхности раковых клеток и не экспрессирующемуся в значительной степени на поверхности обычных клеток. Таким образом, новый ассоциированный с раком антиген можно использовать в терапии для лечения и профилактики рака, включая применение выделенных белков согласно изобретению для вызова иммунной реакции in vivo. Кроме того, изобретение относится к способам диагностики рака, включающим выявление нового ассоциированного с раком антигена.
Рак может представлять собой любой рак, при котором на поверхности раковых клеток экспрессируется ассоциированный с раком антиген согласно изобретению. В одном из вариантов осуществления изобретения рак включает без ограничений рак желудка, рак толстой кишки, рак предстательной железы, а также рак шейки матки, рак матки, рак яичника, рак поджелудочной железы, рак почек, рак печени, рак головы и шеи, плоскоклеточную карциному, желудочно-кишечный рак, рак молочной железы (такой как карцинома, протоковый, дольковый и рак соска), рак легких, неходжкинскую лимфому, множественную миелому, лейкоз (такой как острый лимфолейкоз, хронический лимфолейкоз, острый миелогенный лейкоз и хронический миелогенный лейкоз), рак головного мозга, нейробластому, саркому, рак прямой кишки, рак мочевого пузыря, рак поджелудочной железы, рак эндометрия, плазмоцитому, лимфому и меланому. В предпочтительном варианте осуществления рак включает без ограничений глиобластому, меланому, рак молочной железы, рак легких, рак яичника, лимфому, рак толстой кишки, раки желудка и/или рак предстательной железы.
(i) Фармацевтические композиции
В одном из аспектов изобретение относится к фармацевтической композиции, содержащей эффективное количество выделенного белка согласно изобретению в смеси с приемлемым разбавителем или носителем. В другом аспекте изобретение относится к фармацевтической композиции, содержащей эффективное количество выделенной нуклеиновой кислоты согласно изобретению в смеси с приемлемым разбавителем или носителем. В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей эффективное количество экспрессирующего рекомбинантного вектора согласно изобретению в смеси с приемлемым разбавителем или носителем.
Например, фармацевтические композиции согласно изобретению можно использовать для лечения или профилактики рака. Кроме того, фармацевтические композиции можно использовать для вызова у индивида иммунной реакции против выделенного белка согласно изобретению.
Описанные в настоящей заявке композиции можно получать способами, известными для получения фармацевтически приемлемых композиций, которые можно вводить индивидам, таким образом, что эффективное количество активного вещества сочетают в смеси с фармацевтически приемлемым носителем. Приемлемые носители описаны, например, в Remington's Pharmaceutical Sciences (Remington's Pharmaceutical Sciences, 20th ed., Mack Publishing Company, Easton, Pa., USA, 2000). Основываясь на этом, композиции включают в себя, но ими не ограничиваются, растворы веществ в сочетании с одним или несколькими фармацевтически приемлемыми носителями или разбавителями и содержатся в забуференных растворах с приемлемой величиной pH и изоосмотичностью в отношении физиологических жидкостей.
Иммуногенность можно значительно улучшать, если иммунизирующие средства (т.е. выделенный белок согласно изобретению и/или кодирующие его последовательности нуклеиновых кислот, и/или рекомбинантные векторы экспрессии) и/или композицию совместно иммунизировать вместе с адъювантом. Как правило, адъюванты используют в виде 0,05-1,0-процентного раствора в забуференном фосфатом физиологическом растворе. Адъюванты повышают иммуногенность иммуногена, но не обязательно являются иммуногенными сами по себе. Адъюванты могут действовать, удерживая иммуноген в области поблизости от участка введения для создания эффекта депо, способствуя замедленному, длительному высвобождению иммуногена в клетки иммунной системы. Также адъюванты могут привлекать клетки иммунной системы к депо иммуногена и стимулировать такие клетки для вызова иммунной реакции. Как таковые, варианты осуществления этого изобретения включают фармацевтические композиции, дополнительно содержащие адъюванты.
Адъюванты использовали в течение многих лет для улучшения иммунных реакций организма-хозяина, например, в ответ на вакцины. Как правило, природные адъюванты (такие как липополисахариды) представляют собой компоненты убитых или ослабленных бактерий, используемых в качестве вакцин. Внешние адъюванты представляют собой иммуномодуляторы, которые, как правило, нековалентно связывают с антигенами и составляют для усиления иммунных реакций организма-хозяина. Таким образом, были выявлены адъюванты, усиливающие иммунную реакцию на антигены, доставляемые парентеральным способом. Однако некоторые из этих адъювантов являются токсичными и могут вызывать нежелательные побочные эффекты, что делает их неприемлемыми для применения для человека и многих животных. Действительно, только гидроксид алюминия и фосфат алюминия (вместе обычно называемые как алюминиевые квасцы) общепринято используют в качестве адъювантов для вакцин для человека и ветеринарных вакцин. Эффективность алюминиевых квасцов в усилении реакции антител на дифтерийный и столбнячный анатоксины хорошо известна. Тем не менее, она имеет ограничения. Например, алюминиевые квасцы неэффективны для вакцинации против гриппа и неустойчиво вызывают опосредуемую клетками иммунную реакцию с другими иммуногенами. Антитела, образование которых вызывается антигенами с адъювантом в виде алюминиевых квасцов, у мыши в основном представляют собой изотип IgG1, который может быть неоптимальным для защиты с применением определенных средств для вакцинирования.
Возможные иммунные реакции на иммуногены может вызывать широкий диапазон внешних адъювантов. Эти адъюванты включают сапонин в комплексе с антигенами мембранных белков (иммуностимулирующие комплексы), плюроновые полимеры вместе с минеральным маслом, убитые микобактерии и минеральное масло, полный адъювант Фрейнда, бактериальные продукты, такие как дипептид мурамила (MDP) и липополисахарид (LPS), а также липид A и липосомы.
В одном из аспектов этого изобретения адъюванты, эффективные для любого описанного в настоящей заявке варианта осуществления изобретения, являются следующими. Адъюванты для парентеральной иммунизации включают соединения алюминия (такие как гидроксид алюминия, фосфат алюминия и гидрофосфат алюминия). Антиген можно осаждать вместе с или адсорбировать на соединении алюминия в соответствии с общепринятыми протоколами. Также для парентерального введения можно использовать другие адъюванты, такие как RIBI (ImmunoChem, Hamilton, MT).
Адъюванты для иммунизации через слизистую оболочку включают бактериальные токсины (например, холерный токсин (CT), термолабильный токсин E. coli (LT), токсин A Clostridium difficile и коклюшный токсин (PT) или их сочетания, субъединицы, анатоксины или мутантные формы). Например, можно использовать очищенный препарат субъединицы B природного холерного токсина (CTB). Также приемлемы фрагменты, гомологи, производные и продукты слияния с какими-либо из этих токсинов при условии, что они сохраняют активность адъювантов. Предпочтительно используют мутантную форму, обладающую сниженной токсичностью. Были описаны приемлемые мутанты (например, в WO 95/17211 (мутант Arg-7-Lys CT), WO 96/6627 (мутант Arg-192-Gly LT) и в WO 95/34323 (мутант Arg-9-Lys и Glu-129-Gly PT)). Дополнительные мутанты LT, которые можно использовать в способах и композициях согласно изобретению, включают, например, мутанты Ser-63-Lys, Ala-69-Gly, Glu-110-Asp и Glu-112-Asp. Также для введения через слизистую оболочку можно использовать другие адъюванты (такие как бактериальный монофосфориллипид A (MPLA) из различных источников (например, E. coli, Salmonella minnesota, Salmonella typhimurium или Shigella flexneri, сапонины или микросферы полилактидгликолида (PLGA)).
Адъюванты, эффективные и для иммунизации через слизистую оболочку, и для парентеральной иммунизации, включают полифосфазен (например, WO 95/2415), DC-chol (3 b-(N-(N',N'-диметиламинометан)карбамоил)холестерин (например, патент США №5283185 и WO 96/14831), а также QS-21 (например, WO 88/9336).
Индивида можно иммунизировать с применением фармацевтической композиции, содержащей выделенный белок согласно изобретению, выделенную последовательность нуклеиновой кислоты согласно изобретению и/или экспрессирующий рекомбинантный вектор согласно изобретению, посредством любого общепринятого способа, как известно специалисту в данной области. Например, это может включать иммунизацию через слизистую оболочку (например, глаза, полости носа, желудка, легких, кишечника, прямой кишки, влагалища или мочевыводящих путей), посредством парентерального способа (например, подкожно, внутрикожно, внутримышечно, внутривенно или внутрибрюшинно) или внутрь узлов. Предпочтительные способы зависят от выбора иммуногена, как понятно специалисту в данной области. Введение можно осуществлять разовой дозой или многократно через интервалы времени. Соответствующие дозы зависят от различных параметров, которые очевидны специалистам в данной области, например, от иммуногена как такового (т.е. пептид в сравнении с нуклеиновой кислотой (и более конкретно, их вид), способа введения и состояния животного, подлежащего вакцинированию (масса, возраст и т.п.)
Специалист в данной области понимает, что для введения индивидам фармацевтические композиции можно составлять в биологически совместимой форме, приемлемой для введения in vivo. Вещества можно вводить живым организмам, в том числе человеку и животным. Введение терапевтически активного количества фармацевтических композиций согласно настоящему изобретению обозначают как количество, которое является эффективным при дозах и в течение периодов времени, необходимых для достижения желаемого результата. Например, терапевтически активное количество вещества может различаться в зависимости от таких факторов, как состояние заболевания, возраст, пол и масса индивида, а также способность рекомбинантного белка согласно изобретению вызывать у индивида желаемую реакцию. Схему введения доз можно изменять для обеспечения оптимальной терапевтической реакции. Например, ежесуточно можно вводить несколько разделенных доз или дозу можно пропорционально снижать в соответствии с потребностями терапевтической ситуации.
Фармацевтическую композицию согласно изобретению можно вводить системно. Фармацевтический препарат можно вводить непосредственно в раковый участок. В зависимости от способа введения фармацевтическую композицию можно покрывать веществом для защиты композиции от воздействия ферментов, кислот и других природных условий, которые могут инактивировать соединение.
Согласно одному из аспектов настоящего изобретения фармацевтическую композицию доставляют индивиду прямым введением. Изобретение относится к фармацевтической композиции, вводимой в количестве, которое по меньшей мере достаточно для достижения результата, и, если необходимо, композиция содержит фармацевтически приемлемый носитель.
Согласно другому аспекту фармацевтическую композицию можно вводить in vitro. Например, у индивида с раком можно извлекать лимфоциты и стимулировать in vitro посредством композиции, а затем вводить инфузией обратно индивиду.
Также изобретение относится к способам снижения риска послеоперационных осложнений, где способы включают введение эффективного количества фармацевтической композиции согласно изобретению перед, в течение или после хирургического вмешательства для лечения рака.
Фармацевтические композиции включают без ограничений лиофилизированные порошки или водные или безводные стерильные растворы или суспензии для инъекции, которые могут дополнительно содержать антиоксиданты, буферные вещества, бактериостатические вещества и растворы, придающие композициям значительную совместимость с тканями или кровью предполагаемого реципиента. Другие компоненты, которые могут присутствовать в таких композициях, включают, например, воду, поверхностно-активные вещества (такие как Tween), спирты, многоатомные спирты, глицерин и растительные масла. Получаемые для немедленного применения растворы и суспензии можно получать из стерильных порошков, гранул, таблеток или концентрированных растворов или суспензий. Фармацевтические композиции согласно изобретению можно предоставлять, например, но не в качестве ограничений, в виде лиофилизированного порошка, который восстанавливают с применением стерильной воды или солевого раствора перед введением индивиду.
Фармацевтические композиции согласно изобретению могут содержать фармацевтически приемлемый носитель. Эффективные фармацевтически приемлемые носители включают практически химически инертные и нетоксичные композиции, не препятствующие эффективности биологического действия фармацевтической композиции. Примеры приемлемых фармацевтических носителей включают в себя, но ими не ограничиваются, воду, солевые растворы, растворы глицерина, этанол, хлорид N-(1(2,3-диолеилокси)пропил)N,N,N-триметиламмония (DOTMA), диолеилфосфатидилэтаноламин (DOPE) и липосомы. Такие композиции должны содержать терапевтически эффективное количество соединения вместе с приемлемым количеством носителя таким образом, чтобы обеспечить форму для прямого введения индивиду.
Композиция может находиться в виде фармацевтически приемлемой соли, которая включает в себя без ограничений соли, образованные с применением свободных аминогрупп, например соли, которые получают из соляной, фосфорной, уксусной, щавелевой, виннокаменной кислот и т.д., а также соли, образованные с применением свободных карбоксильных групп, например, соли, которые получают из натрия, калия, аммония, кальция, гидроксидов железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
В различных вариантах осуществления изобретения фармацевтическую композицию непосредственно вводят системно или прямо в область опухоли(ей).
Фармацевтические композиции можно использовать в способах лечения животных, в том числе млекопитающих, предпочтительно человека, имеющих рак. Доза и тип подлежащей введению фармацевтической композиции зависит от множества факторов, которые можно легко регистрировать у человека. Такие факторы включают этиологию и тяжесть (степень и стадию) рака.
Клинический результат вариантов лечения рака с применением фармацевтических композиций согласно изобретению легко заметен специалисту в данной области, например терапевту. Например, значимыми показателями эффективности лечения могут служить общепринятые медицинские тесты для определения клинических маркеров рака. Такие тесты могут включать без ограничений физикальное обследование, функциональные шкалы, маркеры заболевания, ЭКГ в 12 отведениях, измерения опухоли, биопсию ткани, цитоскопию, цитологию, наибольший диаметр из измерений опухоли, радиографию, получение цифрового изображения опухоли, показатели жизнедеятельности, массу, регистрацию неблагоприятных событий, оценку инфекционных эпизодов, оценку сопутствующих лекарственных средств, оценку болевых ощущений, химию крови или сыворотки, анализ мочи, сканирование посредством CT и фармакокинетический анализ. Кроме того, синергические эффекты сочетанной терапии, включающей фармацевтические композиции согласно изобретению и другое противораковое терапевтическое средство, можно определять сравнительными исследованиями с пациентами, подвергающимися монотерапии.
В другом варианте осуществления изобретение относится к набору для лечения или профилактики рака, включающему эффективное количество фармацевтической композиции согласно изобретению, а также руководство для ее применения для лечения рака.
При большинстве утвержденных вариантов лечения рака противораковую терапию используют в сочетании с другими вариантами лечения рака. Соответственно, изобретение относится к способу профилактики или лечения рака с применением фармацевтических композиций согласно изобретению в сочетании по меньшей мере с одним дополнительным вариантом лечения рака. Другую противораковую терапию можно проводить до, перекрываясь во времени с, одновременно и/или после введения фармацевтической композиции согласно изобретению. При одновременном введении фармацевтическую композицию согласно изобретению и другое противораковое терапевтическое средство можно вводить в едином препарате или в раздельных препаратах, и, если раздельно, то, необязательно, посредством различных способов введения. Сочетание одной или нескольких фармацевтических композиций согласно изобретению и одного или нескольких других вариантов лечения рака может действовать синергически, противодействуя опухоли или раку. Другие варианты лечения рака включают без ограничений лучевую терапию и другие противораковые терапевтические средства. Эти другие противораковые терапевтические средства могут включать без ограничений 2,2',2''трихлортриэтиламин, 6-азауридин, 6-диазо-5-оксо-L-норлейцин, 6-меркаптопурин, ацегларон, аклациномицины, актиномицин, алтретамин, аминоглютетимид, амсакрин, анастрозол, анцитабин, ангиогениновый антисмысловой олигонуклеотид, антрамицин, азацитидин, азасерин, азиридин, батимастар, антисмысловой олигонуклеотид для bcl-2, бензодепу, бикалутамид, бисантрен, блеомицин, бусерелин, бусульфан, кактиномицин, калустерон, карбоплатин, карбоквон, карминомицин, кармофур, кармустин, карубицин, карзинофилин, хлорамбуцил, хлорнафазин, ацетат хлормадинона, хлорзотоцин, хромомицины, цисплатин, кладрибин, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, дефосфамид, демеколцин, деноптерин, деторубицин, диазиквон, доцетаксел, доксифлуридин, доксорубицин, дролоксифен, дромостанолон, эдатрексат, эфломитин, ацетат эллиптиния, эмитефур, эноцитабун, эпирубицин, эпитиостанол, эзорубицин, эстрамустин, этоглюцид, этопозид, фадрозол, фенретинид, флоксуридин, флударабин, фторурацил, флутамид, фолиновую кислоту, форместан, фосфестрол, фотемустин, нитрат галлия, гемцитабин, гозерелин, гексестрол, гидроксимочевину, идарубицин, ифосфамид, импросульфан, интерферон-альфа, интерферон-бета, интерферон-гамма, интерлейкин-2, L-аспарагиназу, лентинан, летрозол, леупролид, ломустин, лонидамин, манномустин, марцелломицин, меклоретамин, гидрохлорид меклоретаминоксида, медроксипрогестерон, ацетат мегестрола, меленгестрол, мелфалан, меногарил, мепитиостан, метотрексат, метуредепу, мибоплатин, милтефозин, митобронитол, митогуазон, митолактол, митомицины, митотан, митоксантрон, мопидамол, микофеноловую кислоту, нилутамид, нимустин, нитрацин, ногаламицин, новембихин, оливомицины, оксалиплатин, паклитаксел, пентостатин, пепломицин, перфосфамид, фенамет, фенестерин, пипоброман, пипосульфан, пирарубицин, пиритрексим, пликамицин, 2-этилгидразид подофиллиновой кислоты, фосфат полиэстрадиола, порфимер натрия, порфиромицин, преднимустин, прокабазин, пропагерманий, PSK, птероптерин, пуромицин, келамицин, ранимустин, разоксан, родорубицин, рохинимекс, сизофикан, собузоксан, спирогерманий, стрептонигрин, стрептозоцин, тамоксифен, таксотер, тегафур, темозоломид, тенипозид, тенузоновую кислоту, тестолакон, тиамиприн, тиогуанин, тиотепу, томудекс, топотекан, торемифен, триазиквон, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид, трилостан, триметрексат, трипторелин, трофосфамид, тронтекан, туберцидин, убенимекс, иприт урацила, уредепу, уретан, винбластин, винкристин, зиностатин и зорубицин, арабинозид цитозина, гемтузумаб, тиотепу, циклофосфамид, противометаболические средства (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, флударабин, гемцитабин, дакарбазин, темозоамид), гексаметилмеламин, LYSODREN, аналоги нуклеозидов, растительные алкалоиды (например, таксол, паклитаксел, камптотецин, топотекан, иринотекан (CAMPTOSAR, CPT-11), винкристин, алкалоиды барвинка, такие как винбластин), подофиллотоксин, эпиподофиллотоксин, VP-16 (этопозид), цитохалазин B, грамицидин D, бромид этидия, эметин, антрациклины (например, даунорубицин), липосомальный доксорубицин, дигидроксиантрациндион, митрамицин, актиномицин D, альдеслейкин, аллутамин, биаомицин, капецитабин, карбоплаин, хлорабусин, цикларабин, даклиномицин, флоксуридин, ацетат леупролида, левамизол, ломуслин, меркаптопурин, месну, митоланк, пегаспергазу, пентослатин, пикамицин, ритуксимаб, кэмпас-1, страплозоцин, третиноин, антисмысловой олигонуклеотид для VEGF, виндезин и винорелбин. Также настоящее изобретение относится к композициям, содержащим одно или несколько противораковых терапевтических средств (например, FLAG, CHOP). FLAG содержит флударабин, арабинозид цитозина (Ara-C) и G-CSF. CHOP содержит циклофосфамид, винкристин, доксорубицин и преднизон. Для полного списка известных в данной области противораковых терапевтических средств см., например, последние издания The Merck Index and the Physician's Desk Reference.
Также фармацевтические композиции для сочетанной терапии могут включать без ограничений антибиотики (например, дактиномицин, блеомицин, митрамицин, антрамицин), аспарагиназу, бациллу Герена, дифтерийный токсин, прокаин, тетракаин, лидокаин, пропранолол, противомитотические средства, абрин, рицин A, экзотоксин Pseudomonas, фактор роста нервов, тромбоцитарный фактор роста, тканевой активатор плазминогена, противогистаминные вещества, средства против тошноты и т.д.
Действительно, введение эффективного количества фармацевтической композиции согласно изобретению пациенту при необходимости такого лечения может приводить к сниженным дозам другого противоракового терапевтического средства, обладающим клинически значимой эффективностью. Такую эффективность сниженной дозы другого противоракового терапевтического средства можно не наблюдать при отсутствии введения вместе с фармацевтическими композициями согласно изобретению. Соответственно, настоящее изобретение относится к способам лечения опухоли или рака, включающим введение сниженной дозы одного или нескольких других противораковых терапевтических средств.
Кроме того, сочетанная терапия, включающая введение фармацевтической композиции согласно изобретению пациенту при необходимости такого лечения, может обеспечивать относительно короткое время лечения в сравнении с продолжительностью или количеством циклов общепринятых схем лечения. Соответственно, настоящее изобретение относится к способам лечения опухоли или рака, включающим введение одного или нескольких других противораковых терапевтических средств в течение относительно короткого времени и/или при меньшем числе циклов лечения.
Таким образом, согласно настоящему изобретению варианты сочетанной терапии, включающие фармацевтическую композицию согласно изобретению и другое противораковое терапевтическое средство, могут снижать токсичность (т.е. побочные эффекты) общего противоракового лечения. Например, сниженную токсичность в сравнении с монотерапией или другой сочетанной терапией можно наблюдать в случае доставки уменьшенной дозы фармацевтической композиции согласно изобретению и/или другого противоракового терапевтического средства и/или в случае уменьшения продолжительности цикла (т.е. периода разового введения или периода серий таких введений), и/или в случае снижения числа циклов.
Соответственно, изобретение относится к фармацевтической композиции согласно изобретению, дополнительно содержащей одно или несколько добавочных противораковых терапевтических средств, необязательно, в фармацевтически приемлемом носителе.
Также настоящее изобретение относится к набору, содержащему эффективное количество фармацевтической композиции согласно изобретению, необязательно, в сочетании с одним или несколькими другими противораковыми терапевтическими средствами, вместе с инструкциями по ее применению для лечения рака.
Как указано выше, сочетанная терапия вместе с фармацевтической композицией согласно изобретению может повысить чувствительность рака или опухоли к введению дополнительного противоракового терапевтического средства. Соответственно, настоящее изобретение относится к вариантам сочетанной терапии для профилактики, лечения и/или предотвращения повторного развития рака, где варианты включают введение эффективного количества фармацевтической композиции согласно изобретению перед, после или одновременно со сниженной дозой противоракового терапевтического средства. Например, первоначальное лечение с применением фармацевтической композиции согласно изобретению может повышать чувствительность рака или опухоли к последующей стимуляции дозой противоракового терапевтического средства. Величина этой дозы близка к или меньше нижнего предела диапазона доз, общепринятых при введении противоракового терапевтического средства по отдельности или в отсутствии фармацевтической композиции согласно изобретению. При одновременном введении фармацевтическую композицию согласно изобретению можно вводить отдельно от противоракового терапевтического средства и, необязательно, другим способом введения.
В альтернативном варианте осуществления введение дополнительного противоракового терапевтического средства может повышать чувствительность рака или опухоли к фармацевтической композиции согласно изобретению. В таком варианте осуществления дополнительное противораковое терапевтическое средство можно вводить перед введением фармацевтической композиции согласно изобретению.
В одном из вариантов осуществления дополнительное противораковое терапевтическое средство содержит цисплатин, например PLATINOL или PLATINOL-AQ (Bristol Myers), в дозе, находящейся в диапазоне приблизительно от 5 до 10, от 11 до 20, от 21 до 40 или от 41 до 75 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит карбоплатин, например PARAPLATIN (Bristol Myers), в дозе, находящейся в диапазоне приблизительно от 2 до 3, от 4 до 8, от 9 до 16, от 17 до 35 или от 36 до 75 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит циклофосфамид, например CYTOXAN (Bristol Myers Squibb), в дозе, находящейся в диапазоне приблизительно от 0,25 до 0,5, 0,6 до 0,9, 1 до 2, 3 до 5, 6 до 10, 11 до 20 или от 21 до 40 мг/кг/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит цитарабин, например CYTOSAR-U (Pharmacia & Upjohn), в дозе, находящейся в диапазоне приблизительно от 0,5 до 1, от 2 до 4, от 5 до 10, от 11 до 25, от 26 до 50 или от 51 до 100 мг/м2/цикл. В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит липосому с цитарабином, например DEPOCYT (Chiron Corp.), в дозе, находящейся в диапазоне приблизительно от 5 до 50 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит дакарбазин, например DTIC или DTICDOME (Bayer Corp.), в дозе, находящейся в диапазоне приблизительно от 15 до 250 мг/м2/цикл или в диапазоне приблизительно от 0,2 до 2 мг/кг/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит допотекан, например HYCAMTIN (SmithKline Beecham), в дозе, находящейся в диапазоне приблизительно от 0,1 до 0,2, от 0,3 до 0,4, от 0,5 до 0,8 или от 0,9 до 1,5 мг/м2/цикл. В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит иринотекан, например CAMPTOSAR (Pharmacia & Upjohn), в дозе, находящейся в диапазоне приблизительно от 5 до 9, от 10 до 25 или от 26 до 50 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит флударабин, например, FLUDARA (Berlex Laboratories), в дозе, находящейся в диапазоне приблизительно от 2,5 до 5, от 6 до 10, от 11 до 15 или от 16 до 25 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит арабинозид цитозина (Ara-C), в дозе, находящейся в диапазоне приблизительно от 200 до 2000 мг/м2/цикл, от 300 до 1000 мг/м2/цикл, от 400 до 800 мг/м2/цикл или от 500 до 700 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит доцетаксел, например TAXOTERE (Rhone Poulenc Rorer), в дозе, находящейся в диапазоне приблизительно от 6 до 10, от 11 до 30 или от 31 до 60 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит паклитаксел, например TAXOL (Bristol Myers Squibb), в дозе, находящейся в диапазоне приблизительно от 10 до 20, от 21 до 40, от 41 до 70 или от 71 до 135 мг/кг/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит 5-фторурацил в дозе, находящейся в диапазоне приблизительно от 0,5 до 5 мг/кг/цикл, от 1 до 4 мг/кг/цикл или 2-3 мг/кг/цикл. В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит доксорубицин, например ADRIAMYCIN (Pharmacia & Upjohn), DOXIL (Alza), RUBEX (Bristol Myers Squibb), в дозе, находящейся в диапазоне приблизительно от 2 до 4, от 5 до 8, от 9 до 15, от 16 до 30 или от 31 до 60 мг/кг/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит этопозид, например VEPESID (Pharmacia & Upjohn), в дозе, находящейся в диапазоне приблизительно от 3,5 до 7, от 8 до 15, от 16 до 25 или от 26 до 50 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит винбластин, например VELBAN (Eli Lilly), в дозе, находящейся в диапазоне приблизительно от 0,3 до 0,5, от 0,6 до 0,9, от 1 до 2 или от 3 до 3,6 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит винкристин, например ONCOVIN (Eli Lilly), в дозе, находящейся в диапазоне приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6 или 0,7 мг/м2/цикл.
В другом варианте осуществления дополнительное противораковое терапевтическое средство содержит метотрексат в дозе, находящейся в диапазоне приблизительно от 0,2 до 0,9, от 1 до 5, от 6 до 10 или от 11 до 20 мг/м2/цикл.
В другом варианте осуществления фармацевтическую композицию согласно изобретению вводят в сочетании по меньшей мере с одним другим иммунотерапевтическим средством, включающим без ограничений ритуксан, ритуксимаб, кэмпас-1, гемтузумаб и трастузумаб.
В другом варианте осуществления фармацевтическую композицию согласно изобретению вводят в сочетании с одним или несколькими противоангиогенными средствами, включающими без ограничений ангиостатин, талидомид, крингл 5, эндостатин, серпин (ингибитор сериновых протеаз), антитромбин, N-концевые 29 кДа и C-концевые 40 кДа протеолитические фрагменты фибронектина, протеолитический фрагмент пролактина 16 кДа, протеолитический фрагмент тромбоцитарного фактора-4 7,8 кДа, пептид из 13 аминокислот, соответствующий фрагменту тромбоцитарного фактора-4 (Maione et al., 1991, Cancer Res. 51:2077-2083), пептид из 14 аминокислот, соответствующий фрагменту коллагена I (Tolsma et al., 1993, J. Cell Biol. 122:497-511), пептид из 19 аминокислот, соответствующий фрагменту тромбоспондина I (Tolsma et al., 1993, J. Cell Biol. 122:497-511), пептид из 20 аминокислот, соответствующий фрагменту SPARC (Sage et al., 1995, J. Cell. Biochem. 57:1329-1334), а также их вариант, включающий их фармацевтически приемлемую соль.
В другом варианте осуществления фармацевтическую композицию согласно изобретению используют в сочетании со схемой лучевой терапии. Также терапия может включать хирургическое вмешательство и/или химиотерапию. Например, фармацевтическую композицию согласно изобретению можно вводить в сочетании с лучевой терапией и цисплатином (платинол), фторурацилом (5-FU, адруцил), карбоплатином (параплатин) и/или паклитакселом (таксол). Лечение с применением фармацевтической композиции согласно изобретению может позволять применять облучение в более низких дозах и/или применять лучевую терапию менее часто, что может, например, снижать частоту возникновения тяжелой боли в горле, затрудняющей функцию глотания, что может теоретически приводить к нежелательной потере массы или дегидратации.
В другом варианте осуществления фармацевтическую композицию вводят в сочетании с одним или несколькими цитокинами, включающими без ограничений лимфокин, факторы некроза опухолей, цитокин, подобный фактору некроза опухолей, лимфотоксин, интерферон, макрофагальный воспалительный белок, гранулоцитарно-макрофагальный колониестимулирующий фактор, интерлейкин (включая без ограничений интерлейкин-1, интерлейкин-2, интерлейкин-6, интерлейкин-12, интерлейкин-15, интерлейкин-18) и их вариант, в том числе их фармацевтически приемлемую соль.
В еще одном варианте осуществления фармацевтическую композицию согласно изобретению вводят в сочетании с противораковой вакциной или биологическими средствами, включающими без ограничений аутологичные клетки или ткани, неаутологичные клетки или ткани, карциноэмбриональный антиген, альфа-фетопротеин, хорионический гонадотропин человека, живые вакцины BCG, комплексы микобактериальная клеточная стенка-ДНК, белки меланоцитной линии, а также мутантные, опухолеспецифические антигены.
В другом варианте осуществления фармацевтическую композицию используют совместно с гормональной терапией. Гормональные терапевтические средства включают без ограничений гормональный агонист, гормональный антагонист (например, флутамид, тамоксифен, ацетат леупролида (LUPRON)), а также стероид (например, дексаметазон, ретиноид, бетаметазон, кортизол, кортизон, преднизон, дегидротестостерон, глюкокортикоид, минералокортикоид, эстроген, тестостерон, прогестин).
В еще одном варианте осуществления фармацевтическую композицию используют совместно со схемой генной терапии для лечения или профилактики рака.
Таким образом, сочетанная терапия может повышать чувствительность рака или опухоли к вводимой фармацевтической композиции согласно изобретению и/или дополнительному противораковому терапевтическому средству. Такой способ обеспечивает возможность более коротких циклов лечения, тем самым уменьшая токсические события. Продолжительность цикла может различаться в зависимости от конкретного используемого противоракового терапевтического средства. Также изобретение относится к непрерывному или периодическому введению, или к суточным дозам, разделенным для нескольких отдельных введений. Надлежащая продолжительность цикла для конкретного противоракового терапевтического средства оценивается специалистом в данной области, а изобретение включает непрерывную оценку оптимальных схем лечения для каждого противоракового терапевтического средства. В данной области известны конкретные руководства для специалиста в данной области. См., например, Therasse et al., 2000, "New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada", J Natl Cancer Inst. Feb 2; 92(3):205-16.
Подразумевают, что фармацевтическую композицию согласно изобретению можно вводить любым приемлемым способом, таким как инъекция, пероральное введение, ингаляция, трансдермальное или внутриопухолевое введение, тогда как любое другое противораковое терапевтическое средство можно доставлять пациенту тем же самым или другим способом введения. Кроме того, в случае предполагаемого введения индивиду множества противораковых терапевтических средств, фармацевтическую композицию согласно изобретению и одно или несколько других противораковых терапевтических средств можно доставлять одним способом, а другие противораковые терапевтические средства можно доставлять другим способом введения.
Также изобретение относится к наборам, содержащим эффективное количество фармацевтической композиции согласно изобретению, необязательно, в сочетании с одним или несколькими другими противораковыми терапевтическими средствами, вместе с инструкциями для ее применения.
(ii) Способы диагностики
Новый ассоциированный с раком антиген экспрессируется на раковых клетках и в значительной степени не экспрессируется на обычных клетках, поэтому выявление нового ассоциированного с раком антигена можно использовать в качестве способа диагностики рака.
В одном из вариантов осуществления изобретение относится к способу выявления или мониторинга рака у индивида, который имеет рак или у которого предполагают наличие рака, где способ включает выявление ассоциированного с раком варианта Scratch млекопитающих на клетке в образце, где рак диагностируют, если на клетке выявляют ассоциированный с раком вариант Scratch млекопитающих.
В одном из вариантов осуществления изобретение относится к способу выявления у индивида раковых клеток, где способ включает в себя
(a) получение образца от индивида;
(b) регистрацию в образце уровня ассоциированного с раком антигена; и
(c) сравнение уровня ассоциированного с раком антигена в образце с контрольным образцом, где повышенные в сравнении с контролем уровни ассоциированного с раком антигена указывают на наличие рака у индивида.
Выражение "регистрация уровня ассоциированного с раком антигена" включает выявление уровней ассоциированного с раком антигена, а также регистрацию уровней молекул нуклеиновых кислот, кодирующих ассоциированный с раком антиген. Примеры способов выявления белков и нуклеиновых кислот более подробно описаны ниже.
Предпочтительно ассоциированный с раком антиген содержит последовательность, представленную в SEQ ID NO:2, более предпочтительно - в SEQ ID NO:1.
Термин "образец" может относиться к любому образцу, содержащему раковые клетки, которые подлежат выявлению, включая, но ими не ограничиваясь, биологические жидкости (в том числе кровь, сыворотку, асцитную жидкость), экстракты тканей, свежеполученные клетки и лизаты клеток, которые инкубировали в клеточных культурах.
Термин "контрольный образец" включает любой образец, который можно использовать для установления исходного или нормального уровня и который может включать в себя образцы тканей, получаемые от здоровых индивидов, или образцы, воспроизводящие физиологическую жидкость. Также контрольный образец может представлять собой образец от индивида, получаемый в другой момент времени, например до противораковой терапии.
Способ согласно изобретению можно использовать в диагностике и определении стадии рака. Также изобретение можно использовать для мониторинга прогрессирования рака и наблюдения, эффективен ли конкретный вариант лечения или нет. В частности, способ можно использовать для подтверждения отсутствия или устранения всей опухолевой ткани после хирургического вмешательства, противораковой химиотерапии и/или лучевой терапии. Кроме того, способы можно использовать для наблюдения противораковой химиотерапии и повторного возникновения опухоли.
В одном из вариантов осуществления изобретение относится к способу мониторинга прогрессирования рака у индивида, где способ включает в себя
(a) получение образца от индивида;
(b) определение в образце уровня экспрессии ассоциированного с раком антигена;
(c) повторение стадий (a) и (b) в более поздний момент времени и сравнение результата на стадии (b) с результатом на стадии (c), где разница в уровне экспрессии ассоциированного с раком антигена показательна в отношении прогрессирования рака у индивида.
В частности, повышенные уровни ассоциированного с раком антигена в более поздний момент времени могут указывать на то, что рак прогрессирует и что лечение (если используется) не эффективно. В отличие от этого, сниженные уровни ассоциированного с раком антигена в более поздний момент времени могут указывать на то, что рак регрессирует и что лечение (если используется) является эффективным.
Для выявления на клетке ассоциированного с раком варианта Scratch млекопитающих можно использовать множество способов. Например, в иммуноанализах для выявления экспрессии ассоциированного с раком варианта Scratch млекопитающих на поверхности клеток можно использовать связывающие белки, такие как антитела, которые связывают вариант Scratch млекопитающих, ассоциированный с раком. Специалист в данной области понимает, что для выявления и/или количественного определения экспрессии ассоциированного с раком варианта Scratch млекопитающих на поверхности клеток можно использовать множество способов, включая, без ограничений, вестерн-блоттинг, иммунопреципитацию с последующим SDS-PAGE, иммуноцитохимию, FACS, белковые чипы и т.п.
Способы выявления молекул нуклеиновых кислот
В одном из вариантов осуществления способы согласно изобретению включают выявление молекул нуклеиновых кислот, кодирующих ассоциированный с раком антиген. Специалист в данной области может конструировать нуклеотидные зонды для применения в выявлении последовательностей нуклеиновых кислот, кодирующих ассоциированный с раком антиген, в образцах. Приемлемые зонды можно получать на основе последовательности нуклеиновой кислоты, представленной в SEQ ID NO:6 или SEQ ID NO:25. Приемлемые зонды включают молекулы нуклеиновых кислот на основе последовательностей нуклеиновых кислот, кодирующих по меньшей мере 5 последовательных аминокислот из участков ассоциированного с раком антигена, предпочтительно, они содержат от 15 до 30 нуклеотидов. Нуклеотидный зонд можно метить поддающимся выявлению веществом, таким как радиоактивная метка, обеспечивающая надлежащий сигнал и обладающая достаточным временем полужизни, например 32P, 3H, 14C или т.п. Другие поддающиеся выявлению вещества, которые можно использовать, включают антигены, распознаваемые специфическим меченым антителом, флуоресцентные соединения, ферменты, антитела, специфичные в отношении меченого антигена, и люминесцентные соединения. Надлежащую метку можно выбирать в соответствии со скоростью гибридизации и связыванием зонда с нуклеотидом, подлежащим выявлению, а также количеством нуклеотида, доступного для гибридизации. Меченые зонды можно гибридизовать с нуклеиновыми кислотами на твердых носителях, таких как нитроцеллюлозные фильтры или найлоновые мембраны, как в целом описано в Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual (2nd ed.). Зонды для нуклеиновых кислот можно использовать для выявления генов, предпочтительно в клетках человека, которые кодируют ассоциированный с раком антиген. Также нуклеотидные зонды могут быть эффективны в диагностике нарушений, включающих ассоциированный с раком антиген, в наблюдении прогрессирования таких нарушений или в наблюдении терапевтического лечения. В одном из вариантов осуществления зонды используют в диагностике и наблюдении прогрессирования рака, предпочтительно гинекологического рака.
Зонд можно использовать в способах гибридизации для выявления генов, кодирующих ассоциированный с раком антиген. Как правило, способы включают контактирование и инкубирование нуклеиновых кислот (например, рекомбинантных молекул ДНК, клонированных генов), получаемых из образца от индивида или из другого клеточного источника, вместе с зондом в условиях, способствующих специфическому отжигу зондов с комплементарными последовательностями в нуклеиновых кислотах. После инкубации устраняют неотжегшиеся нуклеиновые кислоты и регистрируют наличие нуклеиновых кислот, гибридизовавшихся с зондом, если такое происходит.
Выявление молекул нуклеиновых кислот может включать амплификацию специфических последовательностей генов с применением такого способа амплификации, как полимеразная цепная реакция (ПЦР), с последующим анализом амплифицированных молекул с применением способов, которые известны специалистам в данной области. Приемлемые праймеры могут быть сконструированы специалистом в данной области обычным способом.
Описанные в настоящей заявке способы гибридизации и амплификации можно использовать для качественного и количественного анализа аспектов экспрессии генов, кодирующих ассоциированный с раком антиген. Например, можно выделять РНК из клеточного типа или ткани, для которых известна экспрессия гена, кодирующего ассоциированный с раком антиген, и тестировать с применением гибридизации (например, общепринятых анализов нозерн-блоттинга) или способов ПЦР, известных в данной области. Праймеры и зонды можно использовать в указанных выше способах in situ, т.е. непосредственно в срезах ткани (зафиксированных и/или замороженных) из исследуемой ткани, которую получают посредством биопсии или иссечения.
Соответственно, настоящее изобретение относится к способу выявления у индивида раковых клеток, включающему:
(a) предоставление образца от индивида;
(b) выделение из образца молекул нуклеиновых кислот, кодирующих ассоциированный с раком антиген или его участок;
(c) амплификацию выделенных молекул нуклеиновых кислот с применением полимеразной цепной реакции;
(d) определение наличия молекул нуклеиновых кислот, кодирующих ассоциированный с раком антиген; и
(e) сравнение уровня молекул нуклеиновых кислот, кодирующих ассоциированный с раком антиген, в образце с контрольным образцом, где повышенные в сравнении с контролем уровни молекул нуклеиновых кислот, кодирующих ассоциированный с раком антиген, указывают на наличие у индивида рака.
В предпочтительном варианте осуществления молекулы нуклеиновых кислот кодируют ассоциированный с раком антиген, содержащий SEQ ID NO:2, более предпочтительно - SEQ ID NO:1. В конкретном варианте осуществления молекула нуклеиновой кислоты содержит последовательность, представленную в SEQ ID NO:6, или ее отличительный фрагмент. В другом варианте осуществления молекула нуклеиновой кислоты содержит последовательность, представленную в SEQ ID NO:25 (кодирующую трансмембранный фрагмент, который представлен в SEQ ID NO:2), или ее отличительный фрагмент.
Описанные в настоящей заявке способы согласно изобретению также можно осуществлять с применением микрочипов, таких как олигонуклеотидные чипы, чипы для кДНК, чипы для геномной ДНК или чипы для тканей. Предпочтительно, чипы представляют собой микрочипы для тканей.
В предпочтительном примере для выявления экспрессии в клетке ассоциированного с раком варианта Scratch млекопитающих используют продукт экспрессии РНК, кодирующий ассоциированный с раком вариант Scratch млекопитающих. Специалист в данной области понимает, что продукт экспрессии РНК можно выявлять или количественно оценивать посредством регистрации мРНК, кодирующей ассоциированный с раком вариант Scratch млекопитающих или его фрагмент, или регистрацией олигонуклеотидов, кДНК, ДНК, РНК, продуктов ПЦР, синтетической ДНК, синтетической РНК или других сочетаний природных или модифицированных нуклеотидов, которые специфически и/или избирательно гибридизуются с мРНК, кодирующей ассоциированный с раком вариант Scratch млекопитающих или его фрагмент.
Можно использовать множество способов для выявления и/или количественного определения экспрессии в клетке РНК ассоциированного с раком варианта Scratch млекопитающих, включая RT-ПЦР, анализы с защитой от нуклеаз, например анализы с защитой от рибонуклеазы и анализы с нуклеазой S1, а также нозерн-блоттинг и т.п.
В конкретном варианте осуществления авторами изобретения были получены праймеры для ПЦР, посредством которых амплифицировали вариант Scratch и Scratch дикого типа (SEQ ID NO:26) или только вариант Scratch (SEQ ID NO:27), как описано в примере 4. Применение таких праймеров позволяет различать вариант Scratch и Scratch дикого типа.
Также авторами изобретения было определено, что последовательность Scratch млекопитающих дикого типа содержит у нуклеотида 118 участок рестрикции KpnI, который не присутствует в варианте, ассоциированном с раком. Таким образом, для тестирования экспрессии варианта при раке амплифицированный продукт ПЦР можно расщеплять посредством фермента рестрикции KpnI с последующим электрофорезом в геле. Если тестируемые клетки экспрессируют Scratch млекопитающих дикого типа, то выявляют 2 фрагмента из 67 п.о. и 93 п.о. Если клетки экспрессируют ассоциированный с раком вариант, то размер продукта ПЦР является таким же, как у нерасщепляемого контрольного образца.
Соответственно, настоящее изобретение относится к способу выявления раковых клеток или мониторинга рака у индивида, который имеет рак или у которого предполагают наличие рака, где способ включает
(a) предоставление образца от индивида;
(b) выделение из образца молекул нуклеиновых кислот, кодирующих Scratch дикого типа или ассоциированный с раком вариант Scratch;
(c) расщепление молекул нуклеиновых кислот посредством фермента рестрикции KpnI; и
(d) определение размера расщепленных молекул нуклеиновых кислот, где наличие нерасщепленных молекул нуклеиновых кислот указывает на наличие у индивида рака.
Способы выявления ассоциированного с раком антигена
В другом варианте осуществления способы согласно изобретению включают выявление ассоциированного с раком антигена. В одном из вариантов осуществления ассоциированный с раком антиген выявляют с применением антител, специфически связывающихся с антигеном, ассоциированным с раком. Антитела против ассоциированного с раком антигена можно получать с применением известных в данной области способов.
Антитела, специфически реагирующие с ассоциированным с раком антигеном, или производные, такие как конъюгаты ферментов или меченые производные, можно использовать для выявления ассоциированного с раком антигена в различных образцах (например, биологических материалах). Их можно использовать в качестве диагностических или прогностических реагентов, а также их можно использовать для выявления патологий уровня экспрессии белка или патологий структуры и/или патологий, связанных с временным, тканевым, клеточным или субклеточным расположением антигена, ассоциированного с раком. Для оценки или наблюдения эффективности конкретных вариантов лечения можно также использовать иммуноанализы in vitro. Также антитела согласно изобретению можно использовать in vitro для определения уровня экспрессии гена, кодирующего ассоциированный с раком антиген, в клетках, которые генетически сконструированы для продукции ассоциированного с раком антигена.
Антитела можно использовать в любом из известных иммуноанализов, основанных на связывающем взаимодействии антигенной детерминанты антигена, ассоциированного с раком, и антител. Примеры таких анализов представляют собой радиоиммуноанализы, иммуноферментные анализы (например, ELISA), иммунофлуоресценция, иммунопреципитация, агглютинация с применением латекса, гемагглютинация и гистохимические тесты. Антитела можно использовать для выявления и количественного определения ассоциированного с раком антигена в образце для выявления роли антигена в раке и для диагностики рака.
В частности, антитела согласно изобретению можно использовать в иммуногистохимических анализах, например, на клеточном и субклеточном уровнях, для выявления ассоциированного с раком антигена, для определения его местоположения в конкретных клетках и тканях, и в конкретных субклеточных областях, а также для количественного определения уровня экспрессии.
Для выявления ассоциированного с раком антигена можно использовать цитохимические способы, которые известны в данной области для определения местоположения антигенов с применением световой и электронной микроскопии. Как правило, антитело согласно изобретению можно метить поддающимся выявлению веществом, а местоположения ассоциированного с раком антигена можно определять в тканях и клетках на основе присутствия поддающегося выявлению вещества. Примеры поддающихся выявлению веществ включают в себя, но ими не ограничиваются, следующее: радиоизотопы (например, 3H, 14C, 35S, 125I, 131I), флуоресцентные метки (например, FITC, родамин, лантанидные люминофоры), люминесцентные метки, такие как люминол; ферментные метки (например, пероксидаза хрена, бета-галактозидаза, люцифераза, щелочная фосфатаза, ацетилхолинэстераза), биотинильные группы (которые можно выявлять посредством меченого авидина, например стрептавидина, содержащего флуоресцентный маркер или обладающего ферментативной активностью, которую можно выявить оптическими или калориметрическими способами), предварительно определенные полипептидные эпитопы, распознаваемые вторичным репортером (например, парные последовательности лейциновых застежек, участки связывания для вторичных антител, домены связывания металлов, эпитопные метки). В некоторых вариантах осуществления метки присоединяют через спейсерные участки различной длины для уменьшения возможного стерического препятствия. Также антитела можно связывать с электроноплотными веществами, такими как ферритин или коллоидное золото, изображение которых легко получают электронной микроскопией.
Антитело или образец можно фиксировать на носителе или твердой подложке, способной фиксировать клетки, антитела и т.д. Например, носитель или подложка могут представлять собой нитроцеллюлозу или стекло, полиакриламиды, габбро и магнетит. Вещество носителя может иметь любую возможную конфигурацию, включая шарообразную (например, гранула), цилиндрическую (например, внутренняя поверхность пробирки или лунки или внешняя поверхность зонда) или плоскую (например, пластина, индикаторная полоска). Также можно использовать косвенные способы, в которых первичную реакцию антиген-антитело усиливают введением второго антитела, специфичного для антитела, которое реакционноспособно в отношении ассоциированного с раком антигена. Например, если антитело, специфичное в отношении ассоциированного с раком антигена, представляет собой антитело IgG кролика, то второе антитело может являться козьим антителом против гамма-глобулина кролика, меченным поддающимся выявлению веществом, как описано в настоящей заявке.
Если в качестве регистрируемого вещества используют радиоактивную метку, то местоположение ассоциированного с раком антигена можно определять радиоавтографией. Результаты радиоавтографии можно количественно оценивать, определяя плотность частиц в радиоавтограммах с применением различных оптических способов или посредством подсчета зерен.
Меченые антитела против ассоциированного с раком антигена можно использовать в определении расположения опухолевой ткани у индивида в ходе хирургического вмешательства, т.е. получая изображения. Как правило, в вариантах применения in vivo антитела метят радиоактивными метками (например, йод-123, йод-125, йод-131, галлий-67, технеций-99 и индий-111). Препараты меченых антител можно вводить индивиду внутривенно в соответствующем носителе в период времени от нескольких часов до четырех суток перед получением изображения ткани. В течение этого периода несвязавшиеся фракции удаляются из индивида, а единственно остающиеся антитела представляют собой антитела, ассоциированные с опухолевой тканью. Присутствие изотопа регистрируют с применением приемлемой гамма-камеры. Меченую ткань можно соотносить с известными маркерами в исследуемом организме для выявления местоположения опухоли для хирургического вмешательства.
Соответственно, в другом варианте осуществления настоящее изобретение относится к способу выявления рака у индивида, включающему в себя
(a) получение образца от индивида;
(b) приведение образца в контакт с антителом, которое связывается с антигеном, ассоциированным с раком;
(c) определение в образце уровня ассоциированного с раком антигена; и
(d) сравнение уровня ассоциированного с раком антигена в образце с контрольным образцом, где повышенные в сравнении с контролем уровни ассоциированного с раком антигена указывают на наличие у индивида рака.
(iii) Способы лечения
Как указано выше, новый ассоциированный с раком антиген присутствует на раковых клетках, но практически не присутствует на обычных клетках. Таким образом, новый ассоциированный с раком антиген можно использовать в терапевтических способах для профилактики и лечения рака. Кроме того, новый ассоциированный с раком антиген или его фрагменты можно использовать для того, чтобы вызвать иммунную реакцию in vivo, например, в вакцине, или in vitro.
В одном из вариантов осуществления изобретение относится к применению выделенного белка согласно изобретению или его фрагмента в получении лекарственного средства для лечения или профилактики рака. В другом варианте осуществления изобретение относится к применению выделенного белка согласно изобретению или его фрагмента для лечения или профилактики рака. В еще одном варианте осуществления изобретение относится к применению выделенного белка согласно изобретению или его фрагмента в получении лекарственного средства для индуцирования иммунной реакции. В другом варианте осуществления изобретение относится к применению выделенного белка согласно изобретению или его фрагмента для индукции иммунной реакции.
Также изобретение относится к применению выделенной последовательности нуклеиновой кислоты согласно изобретению в получении лекарственного средства для лечения или профилактики рака. Кроме того, изобретение относится к применению выделенной последовательности нуклеиновой кислоты согласно изобретению для лечения или профилактики рака. Кроме того, изобретение относится к применению выделенной последовательности нуклеиновой кислоты согласно изобретению в получении лекарственного средства для индуцирования иммунной реакции. Кроме того, изобретение относится к применению выделенной последовательности нуклеиновой кислоты согласно изобретению для индуцирования иммунной реакции.
В другом варианте осуществления изобретение относится к применению экспрессирующего рекомбинантного вектора согласно изобретению в получении лекарственного средства для лечения или профилактики рака. В другом варианте осуществления изобретение относится к применению экспрессирующего рекомбинантного вектора согласно изобретению для лечения или профилактики рака. Кроме того, изобретение относится к применению экспрессирующего рекомбинантного вектора согласно изобретению в получении лекарственного средства для индуцирования иммунной реакции у индивида. В другом варианте осуществления изобретение относится к применению экспрессирующего рекомбинантного вектора согласно изобретению для индуцирования иммунной реакции у индивида.
В еще одном варианте осуществления изобретение относится к способу лечения или профилактики рака, включающему в себя введение индивиду или в клетку индивида эффективного количества выделенного белка согласно изобретению или его фрагмента, в случае необходимости. Кроме того, изобретение относится к способу лечения или профилактики рака, включающему введение индивиду или в клетку эффективного количества выделенной последовательности нуклеиновой кислоты согласно изобретению при необходимости этого. Кроме того, изобретение относится к способу лечения или профилактики рака, включающему введение индивиду или в клетку эффективного количества экспрессирующего рекомбинантного вектора согласно изобретению при необходимости этого.
В другом варианте осуществления изобретение относится к способу индукции у индивида иммунной реакции против выделенного белка согласно изобретению, где способ включает введение индивиду или в клетку эффективного количества выделенного белка согласно изобретению или его фрагмента при необходимости этого. Кроме того, изобретение относится к способу индукции у индивида иммунной реакции против выделенного белка согласно изобретению, где способ включает введение индивиду или в клетку эффективного количества выделенной последовательности нуклеиновой кислоты согласно изобретению при необходимости этого. Кроме того, изобретение относится к способу индукции у индивида иммунной реакции против выделенного белка согласно изобретению, где способ включает введение индивиду или в клетку эффективного количества экспрессирующего рекомбинантного вектора согласно изобретению при необходимости этого.
Указанные выше способы включают введение выделенного белка согласно изобретению in vivo и in vitro. В случае вариантов применения in vitro белок можно применять для стимуляции лимфоцитов, получаемых у пациента, которые затем возвращают инфузией индивиду для вызова иммунной реакции против раковых клеток, экспрессирующих ассоциированный с раком антиген.
В другом аспекте изобретение относится к способу лечения или профилактики рака у индивида посредством регуляции активности или экспрессии ассоциированного с раком варианта Scratch млекопитающих на или в раковой клетке.
В одном из вариантов осуществления изобретения способ лечения или профилактики рака у индивида включает предотвращение или снижение функционирования ассоциированного с раком варианта млекопитающих. В одном из вариантов осуществления изобретения для предотвращения или снижения функционирования ассоциированного с раком варианта Scratch млекопитающих используют связывающий белок согласно изобретению.
В другом варианте осуществления изобретения функционирование ассоциированного с раком варианта Scratch млекопитающих предотвращают или снижают ослаблением или предотвращением экспрессии ассоциированного с раком варианта Scratch млекопитающих в клетке.
Для предотвращения или снижения экспрессии ассоциированного с раком варианта Scratch млекопитающих в клетке можно использовать общепринятые способы, включая применение антисмысловых молекул, трехспиральных молекул или молекул рибозимов, реагирующих с транскриптами гена ассоциированного с раком варианта Scratch млекопитающих.
Например, общепринятые способы можно использовать для получения антисмысловых молекул нуклеиновых кислот, т.е. молекул, комплементарных смысловой нуклеиновой кислоте, которая кодирует интересующий пептид, например, комплементарных кодирующей цепи двухцепочечной молекулы кДНК или комплементарных последовательности мРНК. Соответственно, антисмысловая нуклеиновая кислота может образовывать водородные связи со смысловой нуклеиновой кислотой. Антисмысловая нуклеиновая кислота может быть комплементарна всей кодирующей цепи или только ее участку, например, всей или части области, кодирующей белок (или открытой рамки считывания). Антисмысловая молекула нуклеиновой кислоты может являться антисмысловой в отношении всей или части некодирующей области кодирующей цепи из нуклеотидной последовательности, которая кодирует интересующий полипептид. Некодирующие области (("5'- и 3'-нетранслируемые области") представляют собой 5'- и 3'-последовательности, которые фланкируют кодирующую область и не транслируются в аминокислоты.
Например, антисмысловой олигонуклеотид может иметь длину приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 нуклеотидов или более. Антисмысловую нуклеиновую кислоту согласно изобретению можно конструировать с применением реакций химического синтеза и ферментативного лигирования, применяя известные в данной области способы. Например, антисмысловую нуклеиновую кислоту (например, антисмысловой олигонуклеотид) можно химически синтезировать с применением природных нуклеотидов или различным образом модифицированных нуклеотидов, которые сконструированы для повышения биологической стабильности молекул или для увеличения физической стабильности дуплекса, формируемого антисмысловой и смысловой нуклеиновыми кислотами, например, можно использовать фосфортиоатные производные и замещенные акридином нуклеотиды. Примеры модифицированных нуклеотидов, которые можно использовать для получения антисмысловой нуклеиновой кислоты, включают 5-фторурацил, 5-бромурацил, 5-хлорурацил, 5-йодурацил, гипоксантин, ксантин, 4-ацетилцитозин, 5-(карбоксигидроксиметил)урацил, 5-карбоксиметиламинометил-2-тиоуридин, 5-карбоксиметиламинометилурацил, дигидроурацил, бета-D-галактозилквеуозин, инозин, N6-изопентениладенин, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-аденин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеуозин, 5'-метоксикарбоксиметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусную кислоту (v), вибутоксозин, псевдоурацил, квеуозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, сложный метиловый эфир урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусную кислоту (v), 5-метил-2-тиоурацил, 3-(3-амино-3-N-2-карбоксипропил)урацил, (acp3)w и 2,6-диаминопурин. Альтернативно, антисмысловую нуклеиновую кислоту можно получать биологически с применением вектора экспрессии, в который субклонировали нуклеиновую кислоту в антисмысловом направлении (т.е. РНК, транскрибируемая со вставленной нуклеиновой кислоты, имеет антисмысловое направление в отношении интересующей нуклеиновой кислоты-мишени).
Антисмысловые молекулы нуклеиновых кислот вводят индивиду или получают in situ таким образом, что они гибридизуются или связываются с клеточной мРНК, кодирующей интересующий полипептид, тем самым ингибируя экспрессию, например, в результате ингибирования транскрипции и/или трансляции. Гибридизация может осуществляться в результате обычной комплементарности нуклеотидов, приводящей к образованию стабильного дуплекса или, например, в случае антисмысловой молекулы нуклеиновой кислоты, которая связывается с дуплексами ДНК, в результате специфических взаимодействий в большой бороздке двойной спирали. Пример способа введения антисмысловых молекул нуклеиновых кислот согласно изобретению включает прямую инъекцию в участок ткани. Альтернативно, антисмысловые молекулы нуклеиновых кислот можно модифицировать для нацеливания на выбранные клетки, а затем вводить системно. Например, в случае системного введения антисмысловые молекулы можно модифицировать таким образом, чтобы они специфически связывались с рецепторами или антигенами, экспрессируемыми на выбранной клетке, например T-клетке или клетке головного мозга, например, посредством связывания антисмысловых молекул нуклеиновых кислот с пептидами или антителами, которые связываются с рецепторами или антигенами клеточной поверхности. Также антисмысловые молекулы нуклеиновых кислот можно доставлять к клеткам с применением векторов, например, описанных ниже векторов для генной терапии. Для достижения достаточных внутриклеточных концентраций антисмысловых молекул предпочтительны конструкты векторов, в которых антисмысловую молекулу нуклеиновой кислоты помещают под контроль сильного промотора pol II или pol III.
Интересующая антисмысловая молекула нуклеиновой кислоты может представлять собой α-аномер молекулы нуклеиновой кислоты. α-аномер молекулы нуклеиновой кислоты образует с комплементарной РНК специфические двухцепочечные гибриды, в которых, в отличие от обычных α-единиц, цепи направлены параллельно друг другу (Gautier et al., 1987, Nucleic Acids Res. 15:6625-6641). Также антисмысловая молекула нуклеиновой кислоты может содержать 2'-o-метилрибонуклеотид (Inoue et al., 1987, Nucleic Acids Res. 15:6131-6148) или химерный аналог РНК-ДНК (Inoue et al., 1987, FEBS Lett. 215:327-330).
Рибозимы представляют собой каталитические молекулы РНК с рибонуклеазной активностью, способные расщеплять одноцепочечную нуклеиновую кислоту, такую как мРНК, для которой у них есть комплементарный участок, и их также можно получать с применением общепринятых способов. Таким образом, рибозимы (например, рибозимы со структурой "головка молотка" (описанные в Haseloff and Gerlach, 1988, Nature 334:585-591)) можно использовать для каталитического расщепления транскриптов мРНК, тем самым ингибируя трансляцию белка, кодируемого мРНК. Рибозим, обладающий специфичностью в отношении молекулы нуклеиновой кислоты, которая кодирует интересующий полипептид, можно конструировать на основе нуклеотидной последовательности кДНК, кодирующей ассоциированный с раком вариант Scratch млекопитающих. Например, можно конструировать производное РНК L-19 IVS Tetrahymena, в котором нуклеотидная последовательность активного участка комплементарна нуклеотидной последовательности, подлежащей расщеплению в Cech et al. патент США №4987071; и Cech et al. патент США №5116742. Альтернативно, мРНК, кодирующую интересующий полипептид, можно использовать для выбора из совокупности молекул РНК каталитической РНК, обладающей специфической рибонуклеазной активностью. См., например, Bartel and Szostak, 1993, Science 261:1411-1418.
Трехспиральные структуры также можно получать с применением хорошо известных способов. Например, экспрессию интересующего полипептида можно ингибировать посредством приведения нуклеотидных последовательностей, комплементарных регуляторному участку гена, который кодирует полипептид, (например, промотору и/или энхансеру), к формированию трехспиральных структур, препятствующих транскрипции гена в клетках-мишенях. В целом, см. Helene, 1991, Anticancer Drug Des. 6(6):569-84; Helene, 1992, Ann. N.Y. Acad. Sci. 660:27-36; и Maher, 1992, Bioassays 14(12):807-15.
В различных вариантах осуществления композиции нуклеиновых кислот можно модифицировать в области основания, области сахара или фосфатного каркаса для улучшения, например, стабильности, гибридизации или растворимости молекулы. Например, каркас нуклеиновых кислот из фосфата дезоксирибозы можно модифицировать для получения пептидных нуклеиновых кислот (см. Hyrup et al., 1996, Bioorganic & Medicinal Chemistry 4(1):5-23). В рамках настоящей заявки термины "пептидные нуклеиновые кислоты" или "PNA" относятся к воспроизводящим нуклеиновые кислоты веществам, например воспроизводящим ДНК веществам, в которых каркас из фосфата дезоксирибозы заменен псевдопептидным каркасом и сохранены только четыре природных нуклеиновых основания. Было показано, что нейтральный каркас PNA обеспечивает возможность специфической гибридизации с ДНК и РНК в условиях низкой ионной силы. Синтез олигомеров PNA можно проводить с применением общепринятых схем твердофазного синтеза пептидов, как описано в Hyrup et al., 1996, выше; Perry-O'Keefe et al., 1996, Proc. Natl. Acad. Sci. USA 93:14670-675.
Например, PNA можно модифицировать, например, для повышения их стабильности или захвата клетками, посредством присоединения к PNA липофильных или других вспомогательных групп, посредством образования химер PNA-ДНК или с применением липосом или других известных в данной области способов доставки лекарственных средств. Например, можно получать химеры PNA-ДНК, которые могут сочетать предпочтительные свойства PNA и ДНК. Такие химеры позволяют распознающим ДНК ферментам, например РНКазе H и ДНК-полимеразам, взаимодействовать с участком ДНК, тогда как участок PNA обеспечивает высокую аффинность связывания и специфичность. Химеры PNA-ДНК можно связывать с применением линкеров соответствующей длины, выбираемых в соответствии с укладкой оснований, числом связей между нуклеиновыми основаниями и направлением (Hyrup, 1996, выше). Синтез химер PNA-ДНК можно проводить, как описано в Hyrup, 1996, выше, и Finn et al., 1996, Nucleic Acids Res. 24(17):3357-63. Например, цепь ДНК можно синтезировать на носителе с применением общепринятых химических способов связывания с фосфорамидитом и модифицированных аналогов нуклеозидов. Для связи PNA и 5'-концевого участка ДНК можно использовать такие соединения, как 5'-(4-метокситритил)амино-5'-дезокситимидинфосфорамидит (Mag et al., 1989, Nucleic Acids Res. 17:5973-88). Затем мономеры PNA связывают пошаговым образом для получения химерной молекулы с 5'-участком PNA и 3'-участком ДНК (Finn et al., 1996, Nucleic Acids Res. 24(17):3357-63). Альтернативно, химерные молекулы можно синтезировать с применением 5'-участка ДНК и 3'-участка PNA (Petersen et al., 1995, Bioorganic Med. Chem. Lett. 5:1119-1124).
В других вариантах осуществления олигонуклеотид может включать другие присоединенные группы, такие как пептиды (например, для мечения рецепторов клеток-хозяев in vivo) или средства, способствующие транспорту через клеточную мембрану (см., например, Letsinger et al., 1989, Proc. Natl. Acad. Sci. USA 86:6553-6556; Lemaitre et al., 1987, Proc. Natl. Acad. Sci. USA 84:648-652; международную публикацию № WO 88/09810) или гематоэнцефалический барьер (см., например, международную публикацию № WO 89/10134). Кроме того, олигонуклеотиды можно модифицировать с применением запускаемых гибридизацией расщепляющих средств (см., например, van der Krol et al., 1988, Bio/Techniques 6:958-976) или интеркалирующих средств (см., например, Zon, 1988, Pharm. Res. 5:539-549). С этой целью олигонуклеотид можно конъюгировать с другой молекулой, например пептидом, запускаемым гибридизацией сшивающим средством, транспортирующим средством, запускаемым гибридизацией расщепляющим средством и т.д.
В другом аспекте изобретение относится к способу выявления соединений, способных регулировать экспрессию или активность ассоциированного с раком варианта Scratch млекопитающих, что можно использовать для профилактики или лечения рака. В одном из вариантов осуществления изобретения способ выявления соединения на предмет способности к профилактике или лечению рака включает стадии:
(a) контактирования с тестируемым соединением клетки, экспрессирующей ассоциированный с раком вариант Scratch млекопитающих; и
(b) определения экспрессии или функционирования ассоциированного с раком варианта Scratch млекопитающих; а также
(c) сравнения экспрессии или функционирования ассоциированного с раком варианта Scratch млекопитающих с контролем, где снижение в сравнении с контролем экспрессии или функционирования ассоциированного с раком варианта Scratch млекопитающих указывает на соединение, эффективное для профилактики или лечения рака.
(D) Связывающие белки
В другом аспекте изобретение относится к связывающему белку, предпочтительно, антителу или фрагменту антитела, который связывает выделенные белки согласно изобретению. Как правило, в настоящей заявке такой связывающий белок называют "связывающим белком согласно изобретению" или, предпочтительно, "антителом или фрагментом антитела согласно изобретению".
В одном из вариантов осуществления изобретение относится к связывающему белку, специфичному в отношении ассоциированного с раком варианта Scratch млекопитающих. В другом предпочтительном варианте осуществления ассоциированный с раком вариант Scratch млекопитающих содержит аминокислотную последовательность, обозначенную SEQ ID NO:1, или ее вариант, или аминокислотную последовательность, обозначенную SEQ ID NO:2, или ее вариант.В другом варианте осуществления связывающие белки связываются с выделенным белком, который содержит последовательность аминокислот, обозначенную SEQ ID NO:1, или ее вариант, или аминокислотную последовательность, обозначенную SEQ ID NO:2, или ее вариант.
В определенных вариантах осуществления антитело или фрагмент антитела содержит всю или часть константной области тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgAI, IgA2, IgE, IgM или IgD. Кроме того, антитело или фрагмент антитела могут содержать всю или часть константной области легкой цепи-каппа или константной области легкой цепи-лямбда.
Выделенные белки согласно изобретению можно использовать для получения моноклональных или поликлональных антител. Для получения антител можно использовать общепринятые способы. Например, см. Goding, J. W., Monoclonal Antibodies: Principles and Practice, 2nd Ed., Academic Press, London, 1986.
Специфичные антитела или фрагменты антител, реакционноспособные в отношении конкретных антигенов или молекул, таких как антигены или молекулы на раковой клетке, можно также получать скринингом библиотек экспрессии, кодирующих гены иммуноглобулинов или их участки, которые экспрессируются в бактериях вместе с компонентами клеточной поверхности. Например, полные фрагменты Fab, области VH и области FV можно экспрессировать в бактериях с применением фаговых библиотек экспрессии (см., например, Ward et al., Nature 341:544-546 (1989); Huse et al., Science 246:1275-1281 (1989); и McCafferty et al., Nature 348:552-554 (1990)).
Также изобретение относится к композициям, содержащим связывающие белки согласно изобретению, предпочтительно, антитела и фрагменты антител, вместе с фармацевтически приемлемым эксципиентом, носителем, буферным веществом или стабилизатором.
Кроме того, связывающие белки согласно изобретению можно использовать в диагностике рака.
В предпочтительном варианте осуществления связывающие белки представляют собой антитела или фрагменты антител, которые связываются с ассоциированными с раком вариантами Scratch млекопитающих, экспрессирующимися на поверхности раковых клеток, предпочтительно, с выделенным белком, который содержит любую из аминокислотных последовательностей SEQ ID NO:1 или 2. Кроме того, раковые клетки можно оценивать для определения их чувствительности к способам лечения согласно изобретению, например, посредством получения образца раковых клеток и определения способности образца связываться со связывающими белками согласно изобретению, предпочтительно, с антителами или фрагментами антител.
Соответственно, настоящее изобретение относится к способам, средствам и наборам для диагностики, которые можно использовать сами по себе или до, в ходе или после терапевтического способа согласно изобретению для определения, присутствуют или нет раковые клетки, экспрессирующие антиген и способные связываться со связывающими белками согласно изобретению, предпочтительно, с антителами и фрагментами антител.
В одном из вариантов осуществления изобретение относится к способу выявления или мониторинга рака у индивида, включающему стадии:
(1) контактирования тестируемого образца, получаемого у указанного индивида, со связывающим белком, который специфически связывается с антигеном на раковый клетке, образуя комплекс связывающий белок-антиген;
(2) измерения количества комплекса связывающий белок-антиген в тестируемом образце; и
(3) сравнения количества комплекса связывающий белок-антиген в тестируемом образце с контролем.
В одном из вариантов осуществления антиген представляет собой ассоциированный с раком вариант Scratch млекопитающих, предпочтительно выделенный белок, содержащий любую из аминокислотных последовательностей SEQ ID NO:1-2.
Кроме того, изобретение относится к набору для выявления или мониторинга рака, включающему любой из связывающих белков согласно изобретению, которые связываются с антигеном на раковой клетке, а также инструкции по его применению.
Для применения в вариантах диагностического применения связывающие белки согласно изобретению, предпочтительно антитела или фрагменты антител, можно метить поддающимся выявлению маркером, таким как рентгеноконтрастное вещество или радиоизотоп, например 3H, 14C, 32P, 35S, 123I, 125I, 131I; флуоресцентное (флуорофор) или хемилюминесцентное (хромофор) соединение, например изотиоцианат флуоресцеина, родамин или люциферин; фермент, например щелочная фосфатаза, бета-галактозидаза или пероксидаза хрена; средство для получения изображения; или ион металла. Как описано выше, в данной области известны способы присоединения метки к связывающему белку, такому как антитело или фрагмент антитела.
В другом аспекте изобретение относится к способу выявления или мониторинга рака у индивида, включающему стадии:
(1) измерения количества антител согласно изобретению в тестируемом образце, получаемом у указанного индивида; и
(2) сравнения количества антител согласно изобретению в тестируемом образце с контролем.
В одном из вариантов осуществления количество антител согласно изобретению определяют измерением в тестируемом образце количества антител согласно изобретению, например, посредством ELISA. В другом варианте осуществления количество антител согласно изобретению определяют измерением в тестируемом образце уровней экспрессии нуклеиновых кислот, кодирующих антитела согласно изобретению, например, посредством RT-ПЦР.
(E) Получение белков согласно изобретению
Специалист в данной области понимает, что белки согласно изобретению, такие как новый ассоциированный с раком антиген, связывающие белки, предпочтительно антитела и фрагменты антител, можно получать любым из нескольких способов, однако наиболее предпочтительно получение с применением рекомбинантных способов.
Соответственно, молекулы нуклеиновых кислот согласно настоящему изобретению можно известным способом включать в соответствующие векторы экспрессии, обеспечивающие достаточную экспрессию белков согласно изобретению. Возможные векторы экспрессии включают в себя, но ими не ограничиваются, космиды, плазмиды или модифицированные вирусы (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы) при условии, что вектор совместим с используемой клеткой-хозяином. Векторы экспрессии являются "приемлемыми для трансформации клетки-хозяина", что означает, что векторы экспрессии содержат молекулу нуклеиновой кислоты согласно изобретению и функционально связанные с молекулой нуклеиновой кислоты регуляторные последовательности, выбранные на основе клеток-хозяев, которые используют для экспрессии. Подразумевают, что функционально связанный означает то, что нуклеиновая кислота связана с регуляторными последовательностями способом, который обеспечивает возможность экспрессии нуклеиновой кислоты.
Таким образом, изобретение относится к рекомбинантному вектору экспрессии согласно изобретению, содержащему молекулу нуклеиновой кислоты согласно изобретению или ее фрагмент, а также необходимые регуляторные последовательности для транскрипции и трансляции вставленной последовательности для белка.
Приемлемые регуляторные последовательности можно получать из множества источников, в том числе генов бактерий, грибов, вирусов, млекопитающих или насекомых (например, см. регуляторные последовательности, описанные в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990)). Выбор соответствующих регуляторных последовательностей зависит от клетки-хозяина, которую выбирают, как описано ниже, и выбор может быть легко осуществлен специалистом в данной области. Примеры таких регуляторных последовательностей включают: транскрипционный промотор или энхансер или последовательность, связывающую РНК-полимеразу, последовательность, связывающую рибосомы, включая сигнальную последовательность инициации трансляции. Кроме того, в зависимости от выбранной клетки-хозяина и используемого вектора в вектор экспрессии можно включать другие последовательности, такие как участок инициации репликации, дополнительные участки расщепления ДНК, энхансеры и последовательности, придающие способность к индуцированию транскрипции.
Также рекомбинантные векторы экспрессии согласно изобретению могут содержать селектируемый ген-маркер, способствующий селекции клеток-хозяев, которые трансформированы или трансфицированы рекомбинантной молекулой согласно изобретению. Примерами селектируемых генов-маркеров являются гены, кодирующие такой белок, как G418 и гигромицин, придающие устойчивость к определенным лекарственным средствам, β-галактозидаза, хлорамфениколацетилтрансфераза, люцифераза светляка или иммуноглобулин или его участок, такой как участок Fc иммуноглобулина, предпочтительно IgG. Транскрипцию селектируемого гена-маркера можно регистрировать посредством изменений концентрации селектируемого маркера-белка, такого как β-галактозидаза, хлорамфениколацетилтрансфераза или люцифераза светляка. Если селектируемый ген-маркер кодирует белок, придающий устойчивость к антибиотику, например, устойчивость к неомицину, то трансформированные клетки можно отбирать с применением G418. Клетки, включившие селектируемый ген-маркер, выживают, тогда как другие клетки погибают. Это делает возможным визуализацию и анализ на предмет экспрессии рекомбинантных векторов экспрессии согласно изобретению, и, в частности, определение эффекта мутации на экспрессию и фенотип. Понимают, что селектируемые маркеры можно вводить в отдельный от интересующей нуклеиновой кислоты вектор.
Также рекомбинантные векторы экспрессии могут содержать гены, кодирующие слитую молекулу, обеспечивающую повышенную экспрессию рекомбинантного белка; повышенную растворимость рекомбинантного белка; и способствующую очистке рекомбинантного белка-мишени, действуя в качестве лиганда при аффинной очистке. Например, в рекомбинантный белок-мишень можно добавлять участок для протеолитического расщепления для обеспечения выделения рекомбинантного белка из слитой молекулы после очистки слитого белка. Общепринятые слитые векторы экспрессии включают pGEX (Amrad Corp., Melbourne, Australia), pMal (New England Biolabs, Beverly, MA) и pRIT5 (Pharmacia, Piscataway, NJ), в которых с рекомбинантным белком слиты глутатион-S-трансфераза (GST), белок, связывающий мальтозу E, или белок A соответственно.
Рекомбинантные векторы экспрессии можно вводить в клетки-хозяева для получения трансформированной клетки-хозяина. Подразумевают, что термины "трансформированный посредством", "трансфицированный посредством", "трансформация" и "трансфекция" относятся к введению в клетку нуклеиновой кислоты (например, вектора) одним из множества возможных способов, которые известны в данной области. В рамках настоящей заявки подразумевают, что термин "трансформированная клетка-хозяин" также включает способные к гликозилированию клетки, которые были трансформированы рекомбинантным вектором экспрессии согласно изобретению. Прокариотические клетки можно трансформировать нуклеиновой кислотой с применением, например, электропорации или трансформации, опосредуемой хлоридом кальция. Например, нуклеиновую кислоту можно вводить в клетки млекопитающих такими общепринятыми способами, как совместное осаждение фосфатом кальция или хлоридом кальция, трансфекция, опосредуемая DEAE-декстраном, применение липофектина, электропорация или микроинъекция. Приемлемые способы трансформации и трансфекции клеток-хозяев можно найти в Sambrook et al. (Molecular Cloning: A Laboratory Manual, 3rd Edition, Cold Spring Harbor Laboratory Press, 2001) и других лабораторных руководствах.
Приемлемые клетки-хозяева включают широкое множество эукариотических клеток-хозяев и прокариотических клеток. Например, белки согласно изобретению можно экспрессировать в дрожжевых клетках или клетках млекопитающих. Другие приемлемые клетки-хозяева можно найти в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990). Кроме того, белки согласно изобретению можно экспрессировать в прокариотических клетках, таких как Escherichia coli (Zhang et al., Science 303(5656):371-3 (2004)). Кроме того, можно использовать систему экспрессии на основе Pseudomonas, например Pseudomonas fluorescens (публикация патентной заявки США № США 2005/0186666, Schneider, Jane C et al).
Клетки-хозяева дрожжей и грибов, приемлемые для осуществления настоящего изобретения, включают в себя, но ими не ограничиваются Saccharomyces cerevisiae, род Pichia или Kluyveromyces, а также различные виды из рода Aspergillus. Примеры векторов для экспрессии в дрожжах S. cerevisiae включают pYepSec1 (Baldari. et al., Embo J. 6:229-234 (1987)), pMFa (Kurjan and Herskowitz, Cell 30:933-943 (1982)), pJRY88 (Schultz et al., Gene 54:113-123 (1987)) и pYES2 (Invitrogen Corporation, San Diego, CA). Схемы трансформации дрожжей и грибов хорошо известны специалистам в данной области (см. Hinnen et al., Proc. Natl. Acad. Sci. USA 75:1929 (1978); Itoh et al., J. Bacteriology 153:163 (1983) и Cullen et al. (BiolTechnology 5:369 (1987)).
Клетки млекопитающих, приемлемые для осуществления настоящего изобретения, включают наряду с прочими: клетки COS (например, ATCC № CRL 1650 или 1651), BHK (например, ATCC № CRL 6281), CHO (ATCC № CCL 61), HeLa (например, ATCC № CCL 2), 293 (ATCC №1573) и NS-1. Как правило, приемлемые векторы экспрессии для управляемой экспрессии в клетках млекопитающих содержат промотор (например, получаемый из вирусного материала, такого как вирус полиомы, аденовирус 2, цитомегаловирус и вирус обезьяны 40), а также другие последовательности для контроля транскрипции и трансляции. Примеры векторов экспрессии для млекопитающих включают pCDM8 (Seed, B., Nature 329:840 (1987)) и pMT2PC (Kaufman et al., EMBO J. 6:187-195 (1987)).
Учитывая представленные в настоящей заявке указания, могут быть также легко достигнуты промоторы, терминаторы и способы введения векторов экспрессии соответствующего типа в клетки растений, птиц и насекомых. Например, в одном из вариантов осуществления белки согласно изобретению можно экспрессировать в клетках растений (см. Sinkar et al., J. Biosci (Bangalore) 11:47-58 (1987), в котором рассмотрено применение векторов Agrobacterium rhizogenes; также см. Zambryski et al., Genetic Engineering, Principles and Methods, Hollaender and Setlow (eds.), Vol.VI, pp.253-278, Plenum Press, New York (1984), в котором описано применение векторов экспрессии для растительных клеток, включая, наряду с прочими, PAPS2022, PAPS2023 и PAPS2034).
Клетки насекомых, приемлемые для осуществления настоящего изобретения, включают клетки и линии клеток из видов Bombyx, Trichoplusia или Spodotera. Бакуловирусные векторы, доступные для экспрессии белков в культивируемых клетках насекомых (клетки SF 9), включают серии pAc (Smith et al., Mol. Cell Biol. 3:2156-2165 (1983)) и серии pVL (Luckow, V.A., and Summers, M. D., Virology 170:31-39 (1989)). Некоторые системы экспрессии бакуловирус-клетка насекомых, приемлемые для экспрессии рекомбинантных белков согласно изобретению, описаны в PCT/US/02442.
Альтернативно, белки согласно изобретению можно также экспрессировать в трансгенных животных, не относящихся к человеку, таких как мышь, крысы, кролики, овцы и свиньи (Hammer et al. Nature 315:680-683 (1985); Palmiter et al. Science 222:809-814 (1983); Brinster et al. Proc. Natl. Acad. Sci. USA 82:4438-4442 (1985); Palmiter and Brinster Cell 41:343-345 (1985) и патент США №4736866).
Также белки согласно изобретению можно получать химическим синтезом с применением способов, хорошо известных в химии белков, таких как твердофазный синтез (Merrifield, J. Am. Chem. Assoc. 85:2149-2154 (1964); Frische et al., J. Pept. Sci. 2(4): 212-22 (1996)) или синтез в гомогенном растворе (Houbenweyl, Methods of Organic Chemistry, ed. E. Wansch, Vol.15 I and II, Thieme, Stuttgart (1987)).
N-концевые или C-концевые слитые белки, содержащие белки согласно изобретению, которые конъюгированы с другими молекулами, такими как белки, можно получать посредством слияния с применением рекомбинантных способов. Получаемые в результате слитые белки содержат белок согласно изобретению, слитый с выбранным белком или белком-маркером, как описано в настоящей заявке. Также рекомбинантный белок согласно изобретению можно известными способами конъюгировать с другими белками. Например, белки можно связывать с применением гетеробифункциональных, содержащих тиольную группу линкеров, как описано в WO 90/10457, N-сукцинимидил-3-(2-пиридилдитиопропионата) или N-сукцинимидил-5-тиоацетата. Примеры белков, которые можно использовать для получения слитых белков или конъюгатов, включают связывающие клетки белки, такие как иммуноглобулины, гормоны, факторы роста, лектины, инсулин, липопротеин низкой плотности, глюкагон, эндорфины, трансферрин, бомбезин, асиалогликопротеин, глутатион-S-трансферазу (GST), гемагглютинин (HA) и усеченный myc.
Соответственно, изобретение относится к рекомбинантному вектору экспрессии, содержащему последовательности нуклеиновых кислот, кодирующие белки согласно изобретению, такие как выделенные белки согласно изобретению. Кроме того, изобретение относится к клетке-хозяину, содержащей экспрессирующий рекомбинантный вектор согласно изобретению.
Следующие ниже неограничивающие примеры иллюстрируют настоящее изобретение.
ПРИМЕРЫ
Пример 1: выделение и определение ассоциированного с раком Scratch
СХЕМА ЭКСПЕРИМЕНТА
В исследовании были применены линия клеток меланомы (A-375), линии клеток глиомы (U118MG и U87MG), линия клеток рака молочной железы (MDA-MB 435S), линия клеток поджелудочной железы, (PANC-1) и линия T-клеток (Daudi) (таблица 1). Эти клеточные линии были выбраны на основе результатов анализа профиля опухолевых клеток с применением проточной цитометрии.
Рост и поддержание линий опухолевых клеток
Линии клеток для исследования покупали в ATCC и культивировали в соответствии с руководством и рекомендациями ATCC. Клетки снимали при степени смыкания монослоя 90% при жизнеспособности >90%.
Предварительная характеризация антигена, связывающегося с VB3-011
Данные предварительной характеризации получали из экспериментов, разработанных для оценки применимости основанного на применении геля способа посредством дот-блот анализов; а также из экспериментов, проводимых для определения природы эпитопа, связанного с антигенами.
По данным из этих экспериментов антиген VB3-011 был отнесен к "не поддающимся блоттингу" антигенам с гликановой модификацией, т.е. вовлеченный в связывание с B3-011 эпитоп на антигене был гликозилирован.
Обогащение и очистка антигена VB3-011
По предварительным данным из исследования пригодности для блоттинга было определено, что в случае VB3-011 наилучшим способом получения антигена является способ очистки на основе применения лектина.
В подробных экспериментах было выявлено, что гликановая модификация затрагивает растворимую форму CS (хондроитинсульфат); два из них (CSB и CSE) имеют ограниченное распределение в тканях. Как таковая, гликановая модификация может быть присуща CSA и, в меньшей степени, гиалуроновой кислоте.
Хондроитинсульфат A (CSA) состоит из линейных повторяющихся звеньев, содержащих D-галактозамин и D-глюкуроновую кислоту. Аминогруппа галактозаминов в основном звене хондроитинсульфат A является ацетилированной, образуя N-ацетилгалактозамин; в положении 4 N-ацетилгалактозамина реакцией этерификации присоединена сульфатная группа (фиг.1A) (Sugahara K et al. 1988. J. Biol. Chem. Vol.263:10168-10174; Sugahara K et al. 1991. Eur. J. Biochem. Vol.202:805-811; Prydz K and Dalen KT. 2000. J. Cell Sci. Vol.113:193-205). Когда эти линейные повторяющиеся звенья сшиты (α 2-6) в точках ветвления у C2 во второй и C6 в первой углеродных цепях таким образом, что одно звено гликана представляет собой более чем одну присутствующую линейную цепь CSA, за исключением сульфатирования, то эта структура сходна с гликан-Neu5Ac(α2->6)Gal(β1->4)глюкуронатом, распознаваемым посредством HA (фиг.1B).
Две или более молекул CSA, сшитые вместе, сходны с гликан-Neu5Ac(α2->6)Gal(β1->4)глюкуронатом, распознаваемым гемагглютинином. Azumi et al. (1991) было показано, что активность гемагглютинина, выделенного из гемоцитов асцидии Halocynthia roretzi, ингибировалась гепарином, хондроитинсульфатом и липополисахаридом (LPS), но не моно- и дисахаридами, такими как N-ацетилгалактозамин, галактоза и мелибиоза. Для гемагглютинина наблюдали способность связывать гепарин, хондроитинсульфат и LPS, как показано хроматографией с применением гепарин-сефарозы и экспериментами с центрифугированием, соответственно (Ajit Varki et al. eds. 1999. Essentials of Glycobiology). Сходным образом было показано, что гемагглютинин из микобактерии связывается с гепарансульфатом, а гемагглютинин из Hemophilius influenzae связывается с CSA посредством дополнительной связи α 2-6 (Azumi K et al. A1991. Dev. Comp. Immunol. Vol.15(1-2):9-16; Menozzi FD et al. I1996. J. Exp.Med., Vol.184(3):993-1001). Гепарансульфат и хондроитинсульфат A различаются в эпимеризации C5. Таким образом, новый реагент, обеспечивающий очистку на основе лектина, получали следующим образом. Рекомбинантный HA фиксировали на антителе против HA посредством связывания с диметилпимелимидатом (DMP) таким образом, что при применении в качестве средства IP HA распознает CSA, связанный с антигеном на клеточной поверхности. Препараты мембран очищали аффинным способом с применением зафиксированного HA и элюаты подвергали анализу SDS-PAGE и WB, а затем исследовали с применением антитела против VB3-011.
Очистка на основе лектина
Получали рекомбинантную молекулу HA, специфически связывающуюся с гликан-Neu5Ac(α2->6)Gal(β1->4)глюкуронатом, чтобы связывать ее с антителом против HA в течение 2 часов при комнатной температуре в устройстве для встряхивания с последующим связыванием комплекса HA-антитело против HA с белок-G-сефарозой. После этого проводили стадию центрифугирования для удаления несвязавшейся фракции. Затем зафиксированный комплекс сшивали с применением диметилпимелимидата (DMP), для которого известна сшивка близко расположенных белков. Избыточное или непримененное сшивающее средство и несвязавшееся вещество удаляли посредством короткой стадии центрифугирования. Неспецифические аминогруппы, которые могли возникать как побочный продукт стадии сшивки, нейтрализовали с применением триэтаноламина в течение двух часов при комнатной температуре. Получаемый таким образом реагент на основе лектина тщательно промывали посредством PBS и хранили при 2-8°C в PBS, содержащем 0,05% NaN3. Кроме реагента HA, в качестве реагентов для аффинной очистки для определения более хорошего выделения антигена также использовали Con-A-агарозу и WGA-агарозу.
Для очистки на основе лектина использовали как минимум 500 мкг мембранного белка. Первой стадией очистки антигена до добавления реагента являлась стадия предварительной очистки с применением только белок-G-сефарозы. Суммарно в качестве осаждающего средства в смеси использовали 15-20 мкл реагента. Смеси антиген-лектин встряхивали в течение ночи при 4°C с применением буферных условий, воспроизводящих физиологические условия. Тщательно следили, чтобы на каждой стадии процесса выделения антигена использовались ингибиторы протеаз.
Комплексы антиген-лектин центрифугировали, промывали лизирующим буфером RIP-A и элюировали с применением 0,2 М глицина pH 2,5. Супернатанты, представляющие собой несвязавшиеся фракции, хранили для тестирования белков, которые не были выделены посредством аффинной очистки. Очистки на основе лектина проводили для двух клеточных линий глиомы (U118MG и U87MG), одной линии клеток меланомы (A-375), одной линии эпителиальных клеток (MDA-MB-435S) и двух отрицательных клеточных линий (Panc-1; и Daudi).
Анализ на основе геля и вестерн-блоттинг
1D-PAGE: очищенные белки подвергали воздействию восстанавливающих условий для получения образца, а затем анализировали с применением SDS-PAGE/вестерн-блоттинга. При применении восстанавливающих условий выделенные антигены обрабатывали в течение 15 минут при 65°C буфером для образцов, содержащим 1% β-меркаптоэтанол. Получаемые блоты исследовали с применением VB3-011, и соответствующие вторичные антитела конъюгировали с HRP для получения изображения очищенных белков посредством хемилюминесценции.
2D-PAGE: Очищенные белки разделяли с применением двухмерного гель-электрофореза для устранения какого-либо "стэкинг"-эффекта белков, который может возникать при анализе 1D-PAGE. При 2D-гель-электрофорезе белки в первом направлении разделяются в соответствии с их изоэлектрическими точками (pI), а во втором направлении разделяются на основе их молекулярных масс. Разделенные таким способом белки переносили на нитроцеллюлозные мембраны, выдерживали в течение ночи и обрабатывали, как в случае 1D-PAGE. Вестерн-блоты анализировали с применением VB3-011, а изображение реагирующих белков получали посредством хемилюминесценции.
Выделение пептидов и антиген ID
Выделение пептидов из находящихся в гелях и растворах продуктов расщепления трипсином: расщепление трипсином проводили с применением трипсина, имеющего степень чистоты для секвенирования, в 20-часовом процессе выделения пептидов, приводящем в результате к выделению пептидов, которые анализировали на QSTAR Pulsar-I (ESI-qTOF-MS/MS), оборудованном наноисточником с рабочей объемной скоростью потока 20-50 нл/мин. Пептиды ионизировали и выявляли в виде двух-, трех- или четырехзарядных молекул, которые затем очищали до их соответствующих масс. Если было возможно, проводили также секвенирование выявленных белков de novo. Для обеспечения того, что антиген являлся искомым антигеном, пептиды выделяли и из положительной, и из отрицательной клеточной линии. Массы пептидов, получаемые из масс-спектра, использовали непосредственно для выявления антигена в соответствии с балльными оценками MOWSE, получаемыми из баз данных по белкам, которые доступны через поисковый сервер MASCOT. Пептиды выделяли из пластин геля и из раствора (U118MG, U87MG, A-375, 435S) и подвергали их анализу MS.
РЕЗУЛЬТАТЫ
Фиксация реагента HA
Рекомбинантная молекула HA не является антителом и поэтому не связывается непосредственно, как участник фиксации, с белок-G-сефарозой. Для обеспечения того, чтобы эта молекула могла быть функциональной в процессах очистки антигена, HA связывали с антителом против HA, которое специфично связывается с HA, и молекулу последовательным образом фиксировали с применением белок-G-сефарозы. Это не только фиксирует комплекс, но и блокирует любое неспецифическое взаимодействие, которое может происходить в результате присутствия антитела против HA, как схематично показано на фиг.2. Затем зафиксированный комплекс HA-антитело против HA стабилизировали с применением диметилпимелимидата, сшивающего средства, которое поддерживает пространственную близость различных реагирующих веществ. Конечный комплекс в ходе процесса приводил к образованию нескольких реакционноспособных аминов, отличных от реакционноспособного связывающего участка на молекуле HA. Эти реакционноспособные группы блокировали на постоянной основе с применением 1 М триэтаноламина, обеспечивая таким образом максимальное воздействие на реакционноспособный участок на молекуле HA.
Очистка с применением лектина
Все реакции очистки проводили с применением предварительно очищенных белков. Для минимизации неспецифичности и повышения стабильности сходных комплексов антиген-антитело использовали более длительные периоды инкубации. В исследовании использовали шесть клеточных линий (A-375, U118MG, U87MG, MDA-MB-435S, Panc-1 и Daudi) Перед разделением выделенных антигенов на SDS-PAGE к образцам препаратов применяли восстанавливающие условия. Вестерн-блоты анализировали с применением VB3-011 для обеспечения того, что очищенный антиген является родственным участником связывания для VB3-011.
Анализ 1D-PAGE/вестерн-блоттинг
В случае применения реагента HA, после разделения на 1D-PAGE в восстанавливающих условиях для антиген-положительной линии клеток (A-375) выявляли только одну специфическую полосу на уровне ~50 кДа (фиг.3A), которая отсутствовала для отрицательной линии клеток (Panc-1). Для лектинов Con-A и WGA наблюдали неспецифические взаимодействия, указывающие на то, что гликан, присутствующий на антигене VB3-011, являлся гликаном, распознаваемым HA. Для линии клеток глиомы (U118MG и U87MG) также наблюдали единственную полосу на уровне ~50 кДа при очистке с применением реагента HA (фиг.3B). Если образцам позволяли выдерживаться при комнатной температуре в течение 1 часа перед их разделением на SDS-PAGE, то для антиген-положительной линии клеток (A-375, U118MG и U87MG) наблюдали преобладающую полосу на уровне ~36 кДа и слабо выраженную полосу 50 кДа (фиг.4).
Анализ 2D-PAGE
Для определения изоэлектрических точек (pI) и оценки возможности "стэкинг"-эффекта белков при анализе 1D-PAGE очищенные посредством HA антигены разделяли с применением двухмерного электрофореза в полиакриламидном геле (2D-PAGE), где разделение в первом направлении происходит на основе pI, а во втором направлении происходит на основе молекулярной массы. Затем гели переносили на нитроцеллюлозные мембраны и подвергали общепринятому процессу вестерн-блоттинга. Поскольку количества, необходимые для выявления белков в геле 2D, в ~4 раза выше, чем необходимые для геля 1D, то для одного анализа 2D-PAGE собирали совокупность очищенных антигенов из 4 отдельных реакций. Для анализа вестерн-блоттинга два отдельных геля обрабатывали одновременно для обеспечения того, что белки, выявляемые на окрашенных Кумасси гелях, являются теми же самыми, которые наблюдали на вестерн-блотах. 2D-вестерн-блоты анализировали с применением VB3-011 и регистрировали посредством ECL (хемилюминесценции). Как можно видеть на фиг.5, была выявлена одна единственная область на уровне ~36 кДа/pI=9,7±0,2.
Выделение пептидов и анализ белков
Для очистки антигена(ов), специфически связывающегося с VB3-011, использовали мембраны A-375, U87MG и U118 MG. Как показано на фиг.3A и 3B, для всех трех линий клеток наблюдали полосу ~50 кДа. Полосы белков вырезали из окрашенных Кумасси гелей и использовали расщепление в геле для выделения пептидов для анализа MS.
Белки из полосы в 1D-геле и из 2D-областей расщепляли трипсином для извлечения их из геля и анализировали в системе обращенно-фазовой LC-MS/MS. Идентификацию белков проводили с применением анализа базы данных посредством биоинформатических способов. Исходные данные включали белки, полученные, как указано в спектрах TOF-MS, данные по фрагментации из MS/MS и список предполагаемых белков, включая примеси, которые не совпадают с pI или молекулярной массой выделенного белка. Для проведения анализа спектры MS/MS подвергали исследованию непосредственно на поисковых серверах Mascot, доступных на www.Matrixscience.com.
Масс-спектральный анализ
Пептиды получали двумя способами:
- Все пептиды, выделенные и восстановленные до их надлежащих масс, использовали непосредственно на стадии масс-фингерпринтинга пептидов для получения ID для белка.
- Пептиды, которые находились в избытке и были в достаточной степени ионизированы, отбирали для дальнейшей ионной фрагментации посредством MS/MS, где ионы 'y' и 'b' использовали для установления дедуктивным способом их первичной структуры. Затем эти последовательности подвергали поиску на предмет гомологии в базе данных белков для ID белков.
В системе LC-MS/MS пептиды ионизировали и регистрировали в виде двух-, трех- или четырехзарядных молекул в отличие от регистрации в виде однозарядных при ионизации с применением матрицы, например, при MALDI. После этого на стадии восстановления массы очищали различно заряженные пептиды до их соответствующих масс. Затем эти массы пептидов непосредственно анализировали на предмет ID антигена с применением поискового сервера Mascot на основе "Matrix Science". Полученные из масс-спектров массы пептидов непосредственно использовали для выявления антигена в соответствии с балльными оценками MOWSE, получаемыми из баз данных по белкам, которые доступны через такие поисковые серверы, как MASCOT, SEQUEST и Prospector. Для всех случаев идентификации белков использовали и выбирали QSTAR-pulsar-I, поскольку он включает самые последние добавления в базу данных по белкам от Pepsea и совместим с MASCOT.
Анализ 2D-области
Область белка, вырезанную из 2D-геля, идентифицировали как Scratch. Величина pI и молекулярная масса четко совпадали со Scratch млекопитающих. Суммарно были получены данные для 37% последовательности при 15 совпадающих пептидах, где каждый пептид обладает 100% гомологией с исходным белком (см. фиг.6).
Анализ полосы 50 кДа, очищенной из клеточных линий глиомы и меланомы
Данные, полученные из масс-спектров для всех трех линий клеток (U87MG, U118MG и A375), указывают на Scratch млекопитающих как на антиген, связывающийся с VB3-011. Из всех подвергшихся скринингу клеточных линий наивысшие совпадения по балльным оценкам наблюдали для клеточных линий глиомы (U87MG и U118MG). Для клеточной линии меланомы A-375 также наблюдали сверхэкспрессию антигена. Кроме указанных выше клеточных линий, линии эпителиальных клеток, такие как MDA-MB-435S, PC-3, A-549 и CFPAC-1, также скринировали тем же способом, за исключением MDA-MB-435S, для которой наблюдали наличие усеченного варианта Scratch, т.е. белка 17,823 кДа gi|15928387, при гомологии 100% с последовательностями 158-366 из исходной молекулы Scratch. См. фиг.7 (SEQ ID NO:4). Препараты мембран из каждой из этих клеточных линий использовали для аффинной очистки антигена VB3-011 с применением реагента HA. Для остальных линий эпителиальных клеток поддающихся выявлению белков не наблюдали.
Сканограммы TOF-MS получали ручным способом и способом IDA для получения максимального числа пептидов для значимого ID. См. фиг.8-10.
Список полученных пептидов и их картированные положения относительно последовательности из Scratch млекопитающих таковы, как указано на фиг.11 (SEQ ID NO:1) и таблице 2 (SEQ ID NO:2 и 7-24). Все представленные пептиды были получены секвенированием de novo.
Фрагментация MS/MS пептида 2402.1206 и 2134.9614
Для этих целей использовали импульсную насадку для наноспрея, установленную на наноисточнике. Энергия столкновения составляла 48 В, экранирующий газ и газ CAD поддерживали при 25 и 6 соответственно, а образцу позволяли проходить цикл в течение 1,667 минут (100 циклов) для достижения стабильной масс-ионной фрагментации. Фрагментация MS/MS двух из пептидов (2402.978172 - 802.00000, 3+; 2134.985448 - 1068.500000, 2+) приводила к фрагментам ионов, представленным на фиг.14 и 15. Тогда как один из пептидов, 'PELATAAGGYINGDAAVSEGYAADAF' (SEQ ID NO:7) из пептидной совокупности масс 2402.97812, картирован с величиной 100% в отношении последовательности из Scratch, для пептида RFLAAFLAAAGPFGFALGPSSV (SEQ ID NO:2) из пептидной совокупности масс 2134.985448 наблюдали 100% гомологию для фланкирующих последовательностей, но не для последовательности, расположенной в середине, что указывает на выявление новой последовательности. Наличие этой последовательности ответственно за единственный трансмембранный домен, доступный в белке. Доступная в базе данных последовательность Scratch млекопитающих является результатом схематической трансляции и не содержит каких-либо трансмембранных доменов в последовательности. Для полученной последовательности белка наблюдали 67% гомологию с белком Scratch млекопитающих, доступным в базе данных, и присутствие этой последовательности на клеточной поверхности заметно вследствие наличия трансмембранного домена. Остальные пептиды, полученные из спектров, четко совпадали с последовательностями из Scratch млекопитающих и поэтому были отобраны как основные искомые совпадения. Данные по ионной фрагментации дополнительно подтвердили идентификацию новой формы Scratch как родственного антигена для VB3-011.
На фиг.12 и 13 представлена идентификация Scratch млекопитающих как антигена.
ОБСУЖДЕНИЕ
VB3-011, моноклональное антитело против IgG, получали из лимфоцитов периферической крови (PBL), выделенных у пациента с диагнозом астроцитома степени II, с применением запатентованных платформенных способов HybridomicsTM и ImmunoMineTM Viventia (см. WO 97/044461). Антитело обладает реакционной способностью в отношении множества других линий клеток, каждая из которых представляет различные показатели рака. Несмотря на это проявление реакционной способности в отношении широкого типа опухолевых клеток, для VB3-011 наблюдают ограниченное связывание с обычной тканью. Антиген VB3-011 был отнесен к "не поддающемуся блоттингу" антигену с гликановой модификацией, присущей CSA.
Поскольку молекулы CSA характеризуются структурами (1-4)GlcNAc/глюкуронат, то они также сходны с лектин-Neu5Ac(α2->6)Gal(β1->4)глюкуронатом, распознаваемым гемагглютинином (HA). Новый реагент, обеспечивающий очистку на основе лектина, был получен с применением в качестве средства для очистки рекомбинантного HA, зафиксированного на антителе против HA. Препараты мембран очищали аффинным способом с применением зафиксированного HA и элюаты подвергали анализу SDS-PAGE и WB с последующим анализом посредством антитела против VB3-011. VB3-011 приводил к выявлению белка ~50 кДа в 1D-PAGE, который затем разделяли в анализе 2D-PAGE до полосы ~36 кДа. Анализ LC-MS/MS областей 1D и 2D привел к идентификации Scratch млекопитающих как антигена с молекулярной массой 36 кДа (~50 кДа, наблюдаемой при анализе 1D-PAGE посредством WB), тем самым приписывая остаток наличию гликан-4-сульфат-Neu5Ac(α2->6)Gal(β1->4)глюкуроната. Выявление на 2D-PAGE области 36 кДа совпало с характеризующими Scratch млекопитающих молекулярной массой и изоэлектрической точкой [(pI), т.е. 9,7±0,2].
Последовательности белков, полученные секвенированием de novo из анализов ионной фрагментации MS/MS, приводили к 67% охвату данных, где 16 из 17 пептидов обладали 100% гомологией с последовательностью Scratch млекопитающих, найденной в базе данных (gi|13775236). Для пептида RFLAAFLAAAGPFGFALGPSSV (SEQ ID NO:2) из пептидной совокупности масс 2134.985448 наблюдали 100% гомологию для фланкирующих последовательностей, но не для последовательности, расположенной в середине, что указывает на выявление новой последовательности. Наличие этой последовательности ответственно за единственный трансмембранный домен, доступный в белке, и приводит к расположению Scratch на поверхности клетки, а не в цитозоле. Это является первым сообщением, в котором Scratch млекопитающих представлен как опухолевый антиген на поверхности клеток.
Пример 2: связанная с опухолью экспрессия Scratch
Специфичное в отношении Scratch млекопитающих антитело тестировали на предмет специфичности к опухоли с применением фиксируемого формалином HD TMA. См. таблицу 3 для обычных тканей и таблицу 4 для опухолеспецифичного мембранного связывания. Антиген Scratch на мембране обычной ткани не выявляли. Однако для множества опухолевых тканей было выявлено значительное положительное окрашивание мембран.
Пример 3: местоположение Scratch как средство диагностики рака
Патологическое расположение белка Scratch как показатель рака:
Белок Scratch дикого типа имеет ограниченный характер экспрессии внутри ядра клеток, как описано Nakakura et al., 2001. Однако в случае опухолевых типов тканей и раковых типов клеток авторами изобретения была выявлена экспрессия на мембране и в цитоплазме клеток. Патологическая экспрессия белка Scratch и его вариантов на мембране и в цитоплазме раковых клеток может быть выявлена с применением известных в данной области способов, таких как проточная цитометрия, иммуногистохимия, вестерн-блоттинг мембранных фракций клеток. Это изменение расположения можно использовать в качестве диагностического показателя рака.
Экспрессия различных белков Scratch на мембране была выявлена с применением проточной цитометрии и вестерн-блоттинга мембранных фракций из раковых типов клеток, таких как U-87Mg, A375, MDA-MB-435S, U118-MG. Это представлено в таблице 1 и на фиг.3, 4 и 15.
Пример 4: выявление мРНК варианта как показатель рака
Способ RT-ПЦР для точной регистрации мРНК варианта Scratch млекопитающих, содержащего трансмембранный домен: матричную РНК выделяют из различных типов опухолевых клеток и синтезируют первую цепь комплементарной ДНК (кДНК) с применением фермента обратной транскриптазы и олиго-dT праймера. Затем кДНК используют для теста на предмет экспрессии мРНК Scratch дикого типа и возможных вариантов, и, конкретно, трансмембранного мутанта посредством ПЦР с применением следующих праймеров:
5'-праймер 1: для дикого типа и варианта (соответствует нуклеотидам от 51 до 82)
5'-GCC GAC CTG GAG AGC GCC TAC GGA CGC GCC (SEQ ID NO:26)
5'-праймер 2: для трансмембранного варианта (соответствует нуклеотидам от 76 до 105)
5'-CGC GCC CGC TTX1 TTX2 GCX3 GCX3 TTX1 TTX2 GCX3 (SEQ ID NO:27)
где X1 представляет собой T или C, X2 представляет собой A или G, а X3 представляет собой A, G, C или T
3'-праймер: (соответствует нуклеотидам от 183 до 210)
5'-TGC GTA CAT GGG CTC CGG CGA CGG CCC (SEQ ID NO:28)
Реакция ПЦР включала объем реакционной смеси 50 мкл, содержащий:
Условия циклов для ПЦР: 94°C в течение 1 минуты, 62°C в течение 1 минуты и 72°C в течение 30 секунд для суммарно 30 циклов с последующим заключительным удлинением в течение 10 минут при 72°C.
При электрофорезе в 1% агарозном геле выявляют, что в случае наличия трансмембранного мутанта для реакций с применением праймера 1 присутствует интересующая полоса 159 п.о., а для реакций с применением праймера 2-140 п.о.
В анализе последовательности Scratch млекопитающих дикого типа был выявлен участок расщепления для KpnI (положение 118), который не присутствует в варианте. Таким образом, для тестирования, экспрессируется ли вариантная форма в опухолевых клетках, амплифицированный продукт ПЦР расщепляют ферментом рестрикции KpnI с последующим электрофорезом в 1,5% агарозном геле. Если опухолевые клетки экспрессируют Scratch млекопитающих дикого типа, то под источником света УФ выявляют два фрагмента 67 и 92 п.о. В отличие от этого, если опухолевые клетки экспрессируют вариант Scratch с отсутствием участка KpnI, то размер фрагмента ПЦР совпадает с нерасщепленным контролем. При применении праймеров, специфичных в отношении трансмембранного участка варианта Scratch млекопитающих (праймер №2), фрагмент ПЦР выявляют только в образцах, которые содержат вариант с трансмембранным доменом, тем самым устанавливая специфический вариант.
Пример 5: выявление последовательности геномной ДНК как показатель рака
Было выявлено, что ген, кодирующий относящийся к человеку Scratch млекопитающих, расположен на хромосоме 8 q24.3 и состоит из 2 экзонов. Последовательность гена для ассоциированного с раком, соединенного с мембраной варианта Scratch можно легко определять с применением известных в данной области способов секвенирования генов, таких как экзон-специфическая амплификация посредством ПЦР или прямое секвенирование ДНК, которое начинают с праймеров для известной последовательности.
Если последовательность мутантного гена известна, то для оценки пациентов можно использовать диагностические тесты на основе выявления последовательности. Можно получать чипы для ДНК посредством присоединения олигонуклеотидов, соответствующих смысловой и антисмысловой последовательностям дикого типа и мутантного гена. Геномную ДНК можно выделять из периферической цельной крови или из опухолевых тканей. Затем интересующий ген амплифицируют с применением ПЦР вместе с праймерами, соответствующими последовательности дикого типа и предполагаемым мутациям и меченными соответствующим зондом (как правило, флуоресцентным). Затем ДНК гибридизуют с олигонуклеотидами на чипе и определяют профиль флуоресценции с применением считывающего устройства для флуоресценции. Посредством сравнения профиля флуоресценции с картой известных положений олигонуклеотидных последовательностей можно определять последовательность гена пациента как относящуюся к дикому типу или мутанту. (Cooper et al. 2004). Чипы для обычных мутаций в гене p53 (Affymetrix), наряду с прочими, уже являются коммерчески доступными, и также доступны учреждения по конструированию чипов на заказ.
Пример 6: вариант ассоциированного с раком Scratch как мишень для иммунотоксинов
VB6-011 представляет собой иммуноконъюгат модифицированного конъюгата буганина с антителом, специфически распознающим белок Scratch млекопитающих на поверхности опухолевых клеток. Обработка клеток, которые экспрессируют вариант Scratch, содержащий трансмембранный домен на клеточной поверхности, приводит к специфичному поглощению иммуноконъюгата и последующей гибели клеток.
Цитотоксичность белков VB6-011
Цитотоксичность VB6-011 измеряли посредством анализа MTS. Вкратце, антиген-положительные и антиген-отрицательные клетки высевали при 1000 клеток на лунку и инкубировали в течение 3 часов при 37°C. После этого к клеткам добавляли VB6-011 и де-буганин в различных концентрациях и определяли через 5 суток жизнеспособность клеток.
Антиген-отрицательные и -положительные линии клеток инкубировали вместе с VB6-011 в различных концентрациях от 1 нМ до 1 мМ. Через 5 суток инкубации рассчитанная величина IC50 для VB6-011 составила 350 нМ (Фиг.18) (таблица 5). В отличие от этого, для антиген-отрицательных клеток определить IC50 было невозможно.
Хотя настоящее изобретение было описано в отношении того, что в настоящее время считают предпочтительными примерами, следует понимать, что изобретение не ограничено описанными примерами. Наоборот, подразумевают, что изобретение включает различные модификации и эквивалентные схемы, входящие в сущность и объем прилагаемой формулы изобретения.
Все публикации, патенты и патентные заявки включены сюда полностью в качестве ссылки в такой же степени, как если бы каждая публикация, патент или патентная заявка была конкретно и индивидуально указана для включения в качестве ссылки в полном объеме.
Таблица 1: повышение средней величины флуоресценции для VB3-011 в сравнении с совпадающим по изотипу контролем для каждой линии клеток, используемой в исследовании.
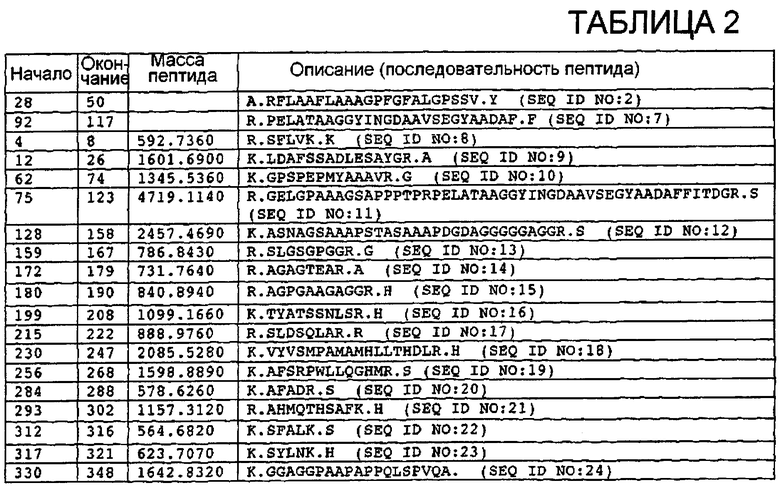
Таблица 2: список пептидов вместе с их соответствующими рассчитанными массами, полученными после стадии восстановления, как указано в приведенной выше таблице.








| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ SEZ6 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2691698C2 |
| СВЯЗАННЫЙ С РАКОМ ТОЛСТОГО КИШЕЧНИКА ГЕН ТОМ34 | 2006 |
|
RU2526196C2 |
| ИДЕНТИФИКАЦИЯ ОПУХОЛЕАССОЦИИРОВАННЫХ АНТИГЕНОВ ДЛЯ ДИАГНОСТИКИ И ТЕРАПИИ | 2013 |
|
RU2644686C2 |
| СВЯЗАННЫЙ С РАКОМ ТОЛСТОГО КИШЕЧНИКА ГЕН ТОМ34 | 2006 |
|
RU2449020C2 |
| АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ДИАГНОСТИКИ РАКА | 2013 |
|
RU2661772C2 |
| КОМПОЗИЦИИ И СПОСОБЫ НАПРАВЛЕННОГО УСТРАНЕНИЯ МУТАЦИОННОГО УСКОЛЬЗАНИЯ В НАПРАВЛЕННОЙ ТЕРАПИИ РАКА | 2008 |
|
RU2505313C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР С КОСТИМУЛИРУЮЩИМ ДОМЕНОМ 4-1BB | 2020 |
|
RU2830540C2 |
| АНТИТЕЛА, НЕЙТРАЛИЗУЮЩИЕ ИНТЕГРИН ανβ8 | 2011 |
|
RU2565539C2 |
| ПРОСТАТОАССОЦИИРОВАННЫЕ АНТИГЕНЫ И ИММУНОТЕРАПЕВТИЧЕСКИЕ СХЕМЫ НА ОСНОВЕ ВАКЦИН | 2013 |
|
RU2609651C2 |
| НОВЫЕ ПРОНИКАЮЩИЕ В КЛЕТКУ ПЕПТИДЫ | 2013 |
|
RU2670488C2 |














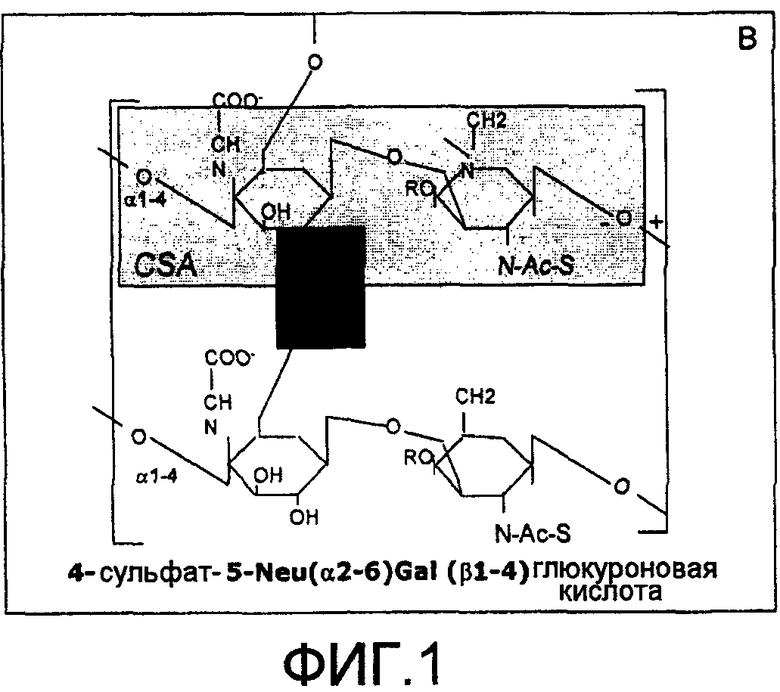
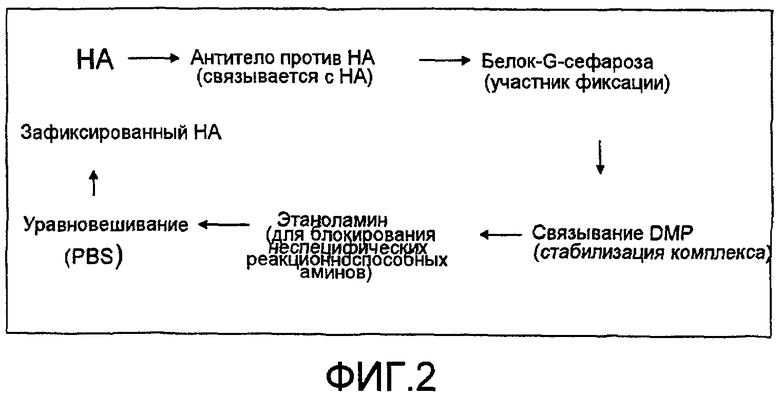
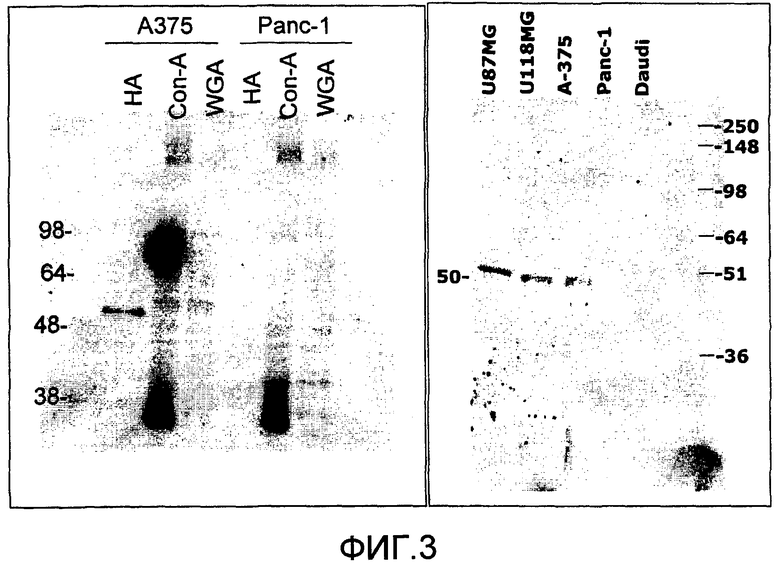
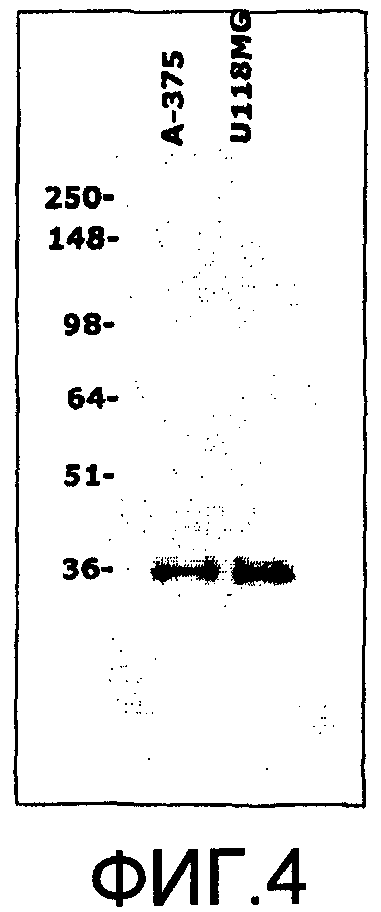




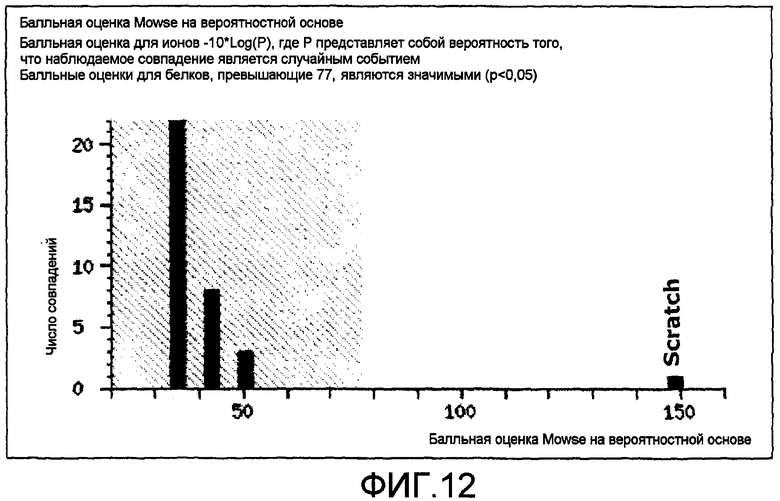
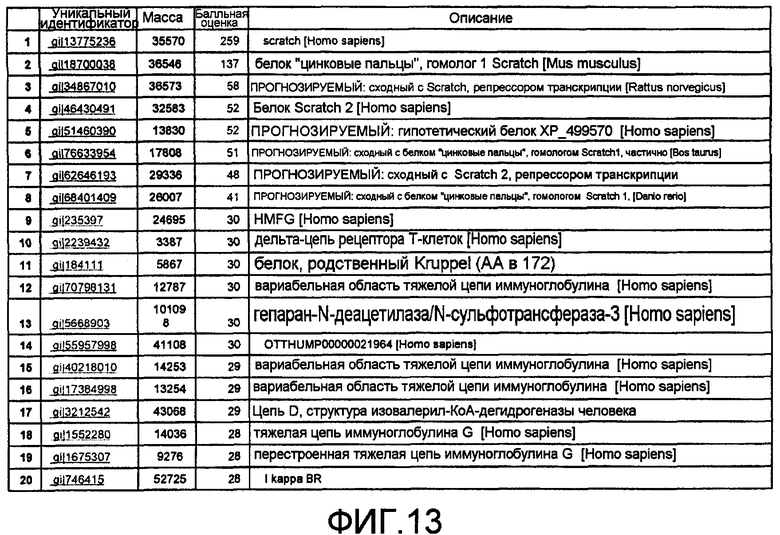
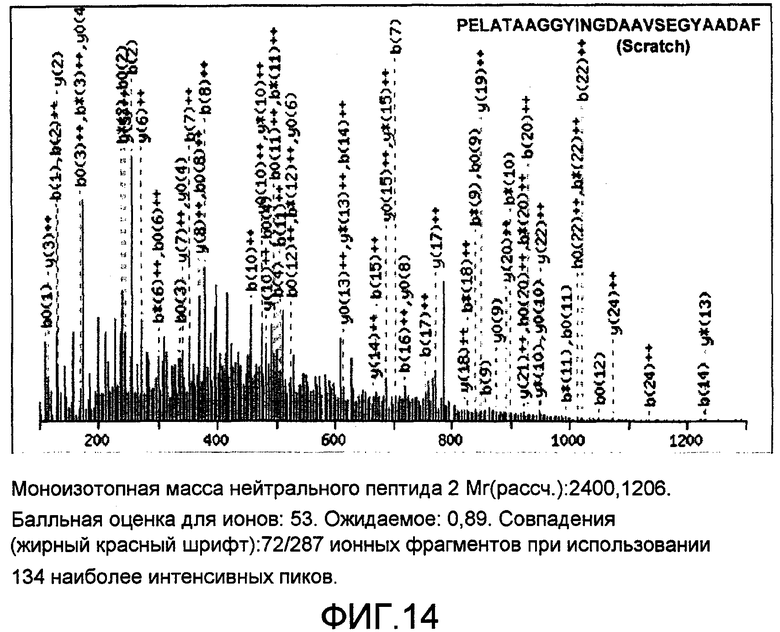
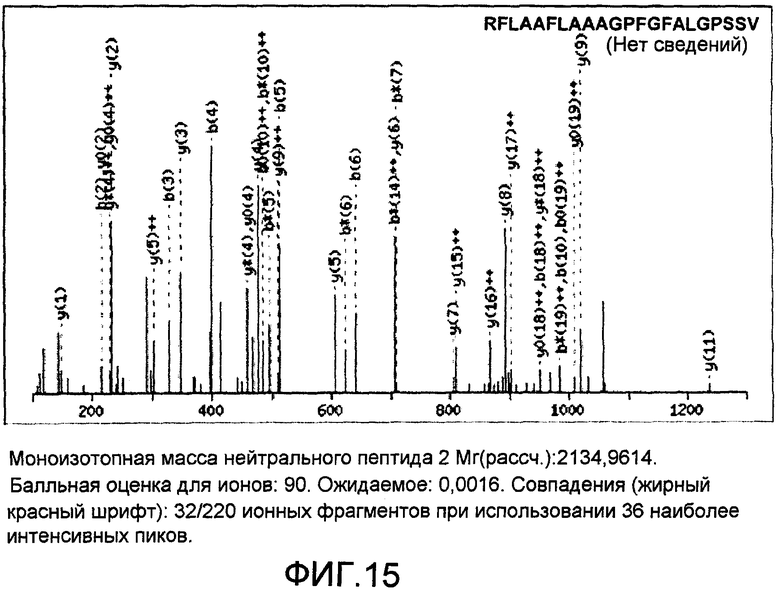
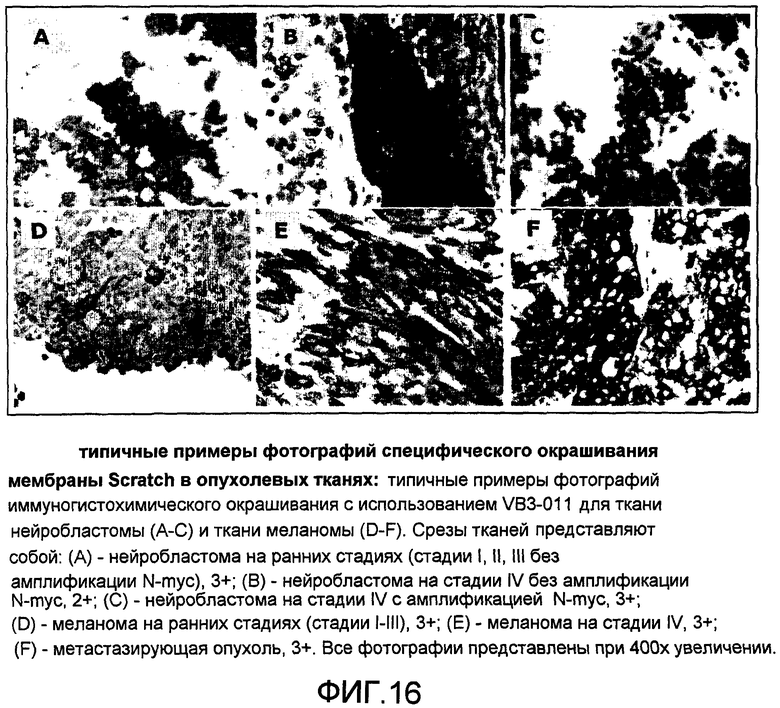


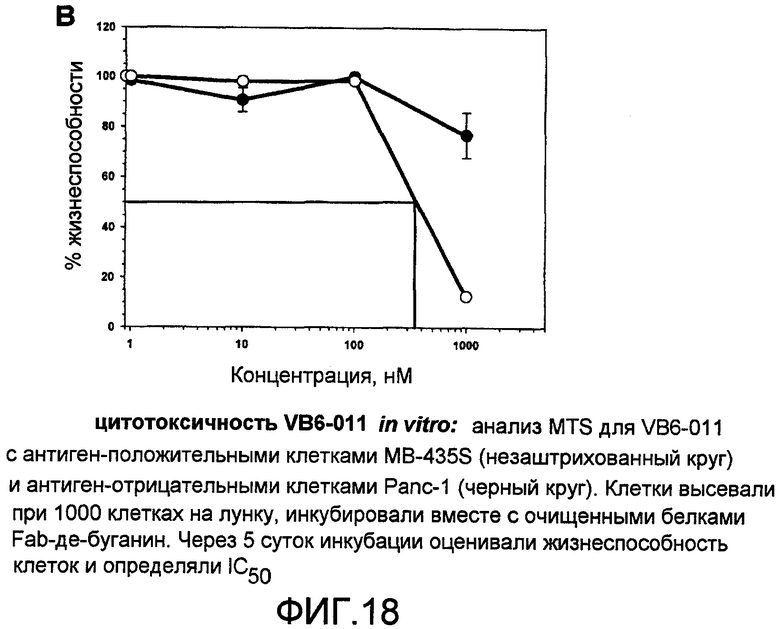
Изобретение относится к биотехнологии. Описан выделенный белок-маркер рака, содержащий ассоциированный с раком вариант Scratch млекопитающих, где ассоциированный с раком вариант Scratch млекопитающих содержит трансмембранный домен и экспрессируется на поверхности раковых клеток. Также изобретение относится к диагностическим и терапевтическим способам и наборам. Изобретение может быть использовано для лечения и диагностики рака. 14 н. и 9 з.п. ф-лы, 18 ил., 5 табл.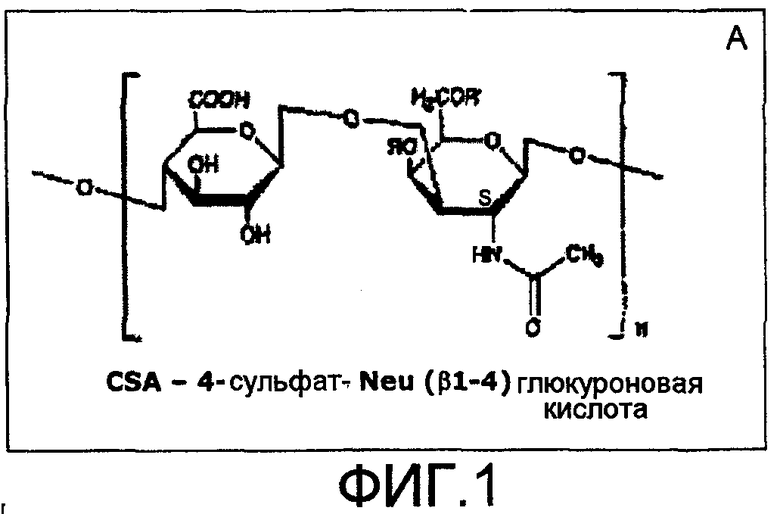
1. Выделенный белок-маркер рака, содержащий ассоциированный с раком вариант Scratch млекопитающих, где ассоциированный с раком вариант Scratch млекопитающих содержит трансмембранный домен и аминокислотную последовательность, как представлено в SEQ ID NO:2, или ее вариант и экспрессируется на поверхности раковых клеток.
2. Выделенный белок по п.1, где ассоциированный с раком вариант Scratch млекопитающих содержит аминокислотную последовательность, как представлено в SEQ ID NO:1, или ее вариант.
3. Выделенная последовательность нуклеиновой кислоты, кодирующая выделенный белок по п.1 или 2 или его фрагмент.
4. Выделенная последовательность нуклеиновой кислоты по п.3, которая содержит последовательность, представленную в SEQ ID NO:6, или ее фрагмент.
5. Выделенная последовательность нуклеиновой кислоты по п.4, которая содержит последовательность, представленную в SEQ ID NO:25, или ее фрагмент.
6. Экспрессирующий рекомбинантный вектор, содержащий последовательность нуклеиновой кислоты по любому из пп.3-5.
7. Клетка-хозяин, способная экспрессировать экзогенный генетический материал, содержащая экспрессирующий рекомбинантный вектор по п.6.
8. Способ выявления раковых клеток или мониторинга рака у индивида, у которого рак обнаружен или у которого предполагают наличие рака, где способ включает в себя выявление белка по п.1 или 2 или его фрагмента на клетке в образце, где показателем рака является выявление указанного белка на клетке.
9. Способ по п.8, включающий в себя
(a) получение образца от индивида;
(b) приведение образца в контакт с антителом, которое связывается с белком;
(c) определение в образце уровня белка; и
(а) сравнение уровня в образце с контрольным образцом, где повышенные в сравнении с контролем уровни белка указывают на наличие у индивида рака.
10. Способ выявления раковых клеток или мониторинга рака у индивида, у которого рак обнаружен или у которого предполагают наличие рака, где способ включает в себя выявление последовательности нуклеиновой кислоты по любому из пп.3-5 или ее фрагмента в образце, где показателем рака является выявление указанной последовательности нуклеиновой кислоты.
11. Способ по п.10, включающий в себя
(a) получение образца от индивида;
(b) экстрагирование молекул нуклеиновых кислот по любому из пп.3-5 из указанного образца;
(c) амплификацию экстрагированных молекул нуклеиновых кислот с применением полимеразной цепной реакции;
(d) определение наличия молекул указанных нуклеиновых кислот, кодирующих указанный белок; и
(e) сравнение уровня последовательности указанной нуклеиновой кислоты в образце с контрольным образцом, где повышенные в сравнении с контролем уровни последовательности указанной нуклеиновой кислоты указывают на наличие у индивида рака.
12. Способ по п.11, где молекулы указанной нуклеиновой кислоты амплифицируют с применением праймера, имеющего последовательность, которая представлена в SEQ ID NO:27.
13. Способ выявления раковых клеток или мониторинга рака у индивида, у которого рак обнаружен или у которого предполагают наличие рака, где способ включает в себя
(a) получение образца от индивида;
(b) экстрагирование из образца молекул нуклеиновых кислот, кодирующих Scratch дикого типа или ассоциированный с раком вариант Scratch;
(c) расщепление молекул нуклеиновых кислот ферментом рестрикции KpnI; и
(d) определение размера расщепленных молекул нуклеиновых кислот, где наличие нерасщепленных молекул нуклеиновых кислот указывает на присутствие последовательности нуклеиновой кислоты, кодирующей ассоциированный с раком вариант Scratch по любому из пп.3-5, что указывает на наличие у индивида предрасположенности к развитию рака.
14. Фармацевтическая композиция для индуцирования иммунной реакции, содержащая эффективное количество выделенного белка по п.1 или 2 или его фрагмента в смеси с приемлемым разбавителем или носителем.
15. Фармацевтическая композиция по п.14, дополнительно содержащая адъювант.
16. Фармацевтическая композиция для индуцирования иммунной реакции, содержащая эффективное количество выделенной последовательности нуклеиновой кислоты по любому из пп.3-5 в смеси с приемлемым разбавителем или носителем.
17. Фармацевтическая композиция по п.16, дополнительно содержащая адъювант.
18. Фармацевтическая композиция для индуцирования иммунной реакции, содержащая эффективное количество экспрессирующего рекомбинантного вектора по п.6 в смеси с приемлемым разбавителем или носителем.
19. Фармацевтическая композиция по п.18, дополнительно содержащая адъювант.
20. Применение выделенного белка по п.1 или 2 или его фрагмента для индуцирования иммунной реакции.
21. Применение выделенной последовательности нуклеиновой кислоты по любому из пп.3-5 для индуцирования иммунной реакции у индивида.
22. Применение экспрессирующего рекомбинантного вектора по п.6 для индуцирования иммунной реакции у индивида.
23. Способ идентификации соединений на предмет их способности к профилактике или лечению рака, где способ включает в себя стадии
(a) приведения клетки, экспрессирующей выделенный белок по п.1 или 2 в контакт с тестируемым соединением;
(b) определения экспрессии или функции выделенного белка; и
(c) сравнения экспрессии или функции выделенного белка с контролем, где снижение в сравнении с контролем экспрессии или функции выделенного белка указывает на соединение, эффективное для профилактики или лечения рака.
| NAKAKURA Е.K | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| АНТИТЕЛА К АНТИГЕНУ ЭПИТЕЛИАЛЬНЫХ ОПУХОЛЕЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ЧЕЛОВЕКА, РОДСТВЕННОМУ АЛЬФА 6 БЕТА 4 ИНТЕГРИНУ | 2000 |
|
RU2266298C2 |
Авторы
Даты
2011-11-10—Публикация
2006-12-21—Подача