Перекрестные ссылки на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США с серийным номером 61/603203, поданной 24 февраля 2012 г., которая включена в настоящий документ посредством ссылки во всей своей полноте.
Перечень последовательностей
Настоящая заявка содержит перечень последовательностей, который был подан в формате ASCII при помощи EFS-Web и включен в данный документ при помощи ссылки во всей его полноте. Указанная ASCII-копия, созданная 19 февраля 2013 года, называется 11200.0014-00304 и имеет размер 450013 байт.
Область изобретения
Данная заявка, в общем, относится к новым соединениям, композициям и способам их применения для диагностики, профилактики, лечения или уменьшения интенсивности пролиферативных расстройств и любого их развития, повторного проявления, рецидива или метастазирования. В широком аспекте настоящее изобретение относится к применению модуляторов для связанного с припадком гомолога 6 (SEZ6), в том числе антител против SEZ6 и слитых конструкций, для лечения, диагностики или профилактики неопластических расстройств. Выбранные варианты осуществления настоящего изобретения относятся к применению таких модуляторов SEZ6, в том числе конъюгатов антитела и лекарственного средства, для иммунотерапевтического лечения злокачественных новообразований, предпочтительно, предусматривающего снижение частоты клеток, вызывающих развитие опухоли.
Уровень техники
Дифференцировка стволовых клеток и клеток-предшественников и пролиферация клеток являются нормальными постоянно протекающими процессами, которые действуют в интересах поддержания роста ткани в ходе органогенеза и замены клеток, а также восстановления большинства тканей на протяжении жизни всех живых организмов. В норме события клеточной дифференцировки и пролиферации регулируются многочисленными факторами и сигналами, которые, как правило, находятся в равновесии для поддержания решений о судьбе клетки и структуры ткани. Таким образом, в значительной степени именно это регулируемое микроокружение обеспечивает регуляцию деления клеток и развитие ткани, причем сигналы образуются должным образом исходя из потребностей организма. В связи с этим пролиферация и дифференцировка клеток обычно протекает только по мере необходимости для замены поврежденных или гибнущих клеток или в течение роста. К сожалению, нарушение пролиферации и/или дифференцировки клеток может являться результатом множества факторов, в том числе, например, недостатка или избытка различных сигнальных химических веществ, наличия измененного микроокружения, генетических мутаций или некоторых комбинаций. В случае, если нормальная клеточная пролиферация и/или дифференцировка повреждена или тем или иным образом нарушена, то это может привести к различным заболеваниям или расстройствам, включая пролиферативные расстройства, такие как злокачественные новообразования.
Обычные средства лечения злокачественного новообразования включают химиотерапию, лучевую терапию, хирургическое вмешательство, иммунотерапию (например, модификаторы биологического ответа, вакцины или терапевтические средства направленного действия) или их комбинации. К сожалению, определенные формы рака не отвечают или в минимальной степени отвечают на такие средства лечения. Например, в опухолях некоторых пациентов имеются генные мутации, которые делают их нечувствительными, несмотря на общую эффективность выбранных терапевтических средств. Более того, в зависимости от типа злокачественного новообразования и формы, которую он принимает, некоторые доступные средства для лечения, такие как хирургическое вмешательство, могут не быть осуществимыми альтернативными вариантами. Ограничения, присущие терапевтическим средствам современных стандартов лечения, особенно очевидны при попытке проведения лечения пациентов, которые ранее получали лечение и впоследствии имели рецидивы. В таких случаях неудачные схемы лечения и возникающее в связи с этим ухудшение состояния пациента могут способствовать возникновению опухолей, не поддающихся лечению, которые часто ведут себя как агрессивное заболевание, которое в конечном итоге оказывается неизлечимым. Несмотря на значительные усовершенствования диагностики и лечения злокачественного новообразования в течение многих лет, общая частота выживания в случае большинства солидных опухолей в значительной мере осталась неизменной вследствие неспособности существующих терапевтических средств предупредить рецидив, повторное возникновение опухоли и метастазов. Таким образом, остается потребность в разработке более направленных и эффективных терапевтических средств для лечения пролиферативных расстройств.
Краткое описание изобретения
Эти и другие цели решает настоящее изобретение, которое в широком смысле, относится к способам, соединениям, композициям и изделиям, которые можно использовать для лечения SEZ6-ассоциированных расстройств (например, пролиферативных расстройств или неопластических нарушений). С этой целью настоящее изобретение относится к новым модуляторам связанного с припадком гомолога 6 (или SEZ6), которые эффективно нацеливаются на опухолевые клетки и/или раковые стволовые клетки, и которые можно использовать для лечения пациентов, страдающих широким спектром злокачественных новообразований. Как будет более подробно обсуждаться в данном документе, существует по меньшей мере две природные изоформы или варианты SEZ6, и описанные модуляторы могут содержать или избирательно связываться с одной изоформой, или с другой, или как с одной, так и с другой. Более того, в некоторых вариантах осуществления описанные модуляторы SEZ6 также могут взаимодействовать с одним или несколькими представителями семейства SEZ (например, SEZ6L или SEZ6L2), или в других вариантах осуществления могут быть получены и отобраны так, чтобы они исключительно связывались или взаимодействовали с одной или несколькими изоформами SEZ6. В любом случае модуляторы могут включать любое соединение, которое распознает, конкурирует, выступает в роли агониста, выступает в роли антагониста, взаимодействует, связывается или соединяется с полипептидом или геном SEZ6 (или с его фрагментом) и модулирует, корректирует, изменяет, регулирует, меняет или модифицирует влияние белка SEZ6 на один или несколько физиологически важных путей. Таким образом, в широком смысле настоящее изобретение в общем направлено на выделенные SEZ6 модуляторы и их применения. В предпочтительных вариантах осуществления настоящее изобретение более конкретно направлено на выделенные SEZ6 модуляторы, включающие антитела (т.е. антитела, которые с точки зрения иммунологии, предпочтительно, связываются, реагируют с или ассоциируют по меньшей мере с одной изоформой SEZ6), которые в особенно предпочтительных вариантах осуществления ассоциированы или конъюгированы с одним или несколькими цитотоксическими средствами. Более того, как подробно обсуждается ниже, такие модуляторы можно применять для получения фармацевтических композиций, пригодных для профилактики, диагностики или лечения пролиферативных расстройств.
В выбранных вариантах осуществления настоящего изобретения SEZ6 модуляторы могут включать полипептид SEZ6 или его фрагменты, либо в выделенной форме, либо слитый или ассоциированный с другими частями (например, Fc-SEZ6, PEG-SEZ6 или SEZ6, соединенный с нацеливающей частью). В других выбранных вариантах осуществления модуляторы SEZ6 могут включать антагонисты SEZ6, которые для целей настоящей заявки могут подразумевать любую конструкцию или соединение, которое распознает, конкурирует, взаимодействует, связывается или ассоциирует с SEZ6 и приводит к нейтрализации, приводит к устранению, снижает, сенсибилизирует, приводит к перепрограммированию, ингибирует или обеспечивает контроль роста неопластических клеток, в том числе клеток, вызывающих развитие опухоли. В предпочтительных вариантах осуществления SEZ6 модуляторы по настоящему изобретению включают антитела против SEZ6 или их фрагменты или производные, которые, как было неожиданно обнаружено, обеспечивают "сайленсинг", приводят к нейтрализации, снижают, уменьшают, приводят к сокращению количества, приводят к уменьшению количества, приводят к снижению количества, приводят к перепрограммированию, приводят к устранению или иным образом ингибируют способность клеток, вызывающих развитие опухоли, размножаться, сохраняться, распространяться, пролиферировать или иным образом обеспечивать выживание, повторное проявление, регенерацию и/или метастазирование неопластических клеток. В особенно предпочтительных вариантах осуществления антитела или иммунореактивные фрагменты могут быть ассоциированы или конъюгированы с одним или несколькими противораковыми средствами (например, цитотоксическим средством).
Что касается таких модуляторов, следует понимать, что совместимые антитела могут находиться в любой из ряда форм, в том числе, например, поликлональные и моноклональные антитела, химерные, CDR-привитые, гуманизированные и человеческие антитела, и иммунореактивные фрагменты, и/или варианты каждого из упомянутого выше. Предпочтительные варианты осуществления будут относится к антителам, которые являются относительно неиммуногенными, например, гуманизированные или полностью человеческие конструкции. Разумеется, с учетом настоящего раскрытия специалисты в данной области техники могут легко выявить одну или несколько определяющих комплементарность областей (CDR), ассоциированных с вариабельными областями тяжелой и легкой цепи модуляторов на основе антитела против SEZ6, и использовать эти CDR для создания или получения химерных, гуманизированных или CDR-привитых антител без излишнего экспериментирования. Соответственно, в определенных предпочтительных вариантах осуществления SEZ6 модулятор включает антитело, которое содержит одну или несколько CDR, как определено на фиг. 10A и 10B, и получено из мышиных вариабельных областей легкой (фиг. 10A) или тяжелой (фиг. 10B) непрерывной цепи (SEQ ID NO:20-169), приведенных в них. Такие CDR-привитые вариабельные области, содержащие человеческую каркасную структуру и ее варианты, также показаны на фиг. 10, содержащей SEQ ID NO:170-199. В предпочтительных вариантах осуществления эти антитела будут включать моноклональные антитела и в еще более предпочтительных вариантах осуществления будут включать химерные, CDR-привитые или гуманизированные антитела.
Иллюстративные последовательности нуклеиновой кислоты, кодирующие каждую из аминокислотных последовательностей, приведенных на фиг. 10A и 10B, прилагаются к данному документу в перечне последовательностей и содержат SEQ ID NO:220-399. В связи с этим, следует понимать, что настоящее изобретение дополнительно относится к молекулам нуклеиновой кислоты (и связанные конструкции, векторы и клетки-хозяева), кодирующим раскрытые аминокислотные последовательности вариабельной области антитела, в том числе те, которые приведены в прилагаемом перечне последовательностей.
Более конкретно, в выбранных вариантах осуществления совместимые SEZ6 модуляторы могут включать антитело с вариабельной областью легкой цепи и вариабельной областью тяжелой цепи, причем указанная вариабельная область легкой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40, SEQ ID NO:42, SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:48, SEQ ID NO:50, SEQ ID NO:52, SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104, SEQ ID NO:106, SEQ ID NO:108, SEQ ID NO:110, SEQ ID NO:112, SEQ ID NO:114, SEQ ID NO:116, SEQ ID NO:118, SEQ ID NO:120, SEQ ID NO:122, SEQ ID NO:124, SEQ ID NO:126, SEQ ID NO:128, SEQ ID NO:130, SEQ ID NO:132, SEQ ID NO:134, SEQ ID NO:136, SEQ ID NO:138, SEQ ID NO:140, SEQ ID NO:142, SEQ ID NO:144, SEQ ID NO:146, SEQ ID NO:148, SEQ ID NO:150, SEQ ID NO:152, SEQ ID NO:154, SEQ ID NO:156, SEQ ID NO:158, SEQ ID NO:160, SEQ ID NO:162, SEQ ID NO:164, SEQ ID NO:166 и SEQ ID NO:168, и при этом указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33, SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43, SEQ ID NO:45, SEQ ID NO:47, SEQ ID NO:49, SEQ ID NO:51, SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103, SEQ ID NO:105, SEQ ID NO:107, SEQ ID NO:109, SEQ ID NO:111, SEQ ID NO:113, SEQ ID NO:115, SEQ ID NO:117, SEQ ID NO:119, SEQ ID NO:121, SEQ ID NO:123, SEQ ID NO:125, SEQ ID NO:127, SEQ ID NO:129, SEQ ID NO:131, SEQ ID NO:133, SEQ ID NO:135, SEQ ID NO:137, SEQ ID NO:139, SEQ ID NO:141, SEQ ID NO:143, SEQ ID NO:145, SEQ ID NO:147, SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:153, SEQ ID NO:155, SEQ ID NO:157, SEQ ID NO:159, SEQ ID NO:161, SEQ ID NO:163, SEQ ID NO:165, SEQ ID NO:167 и SEQ ID NO:169. В других предпочтительных вариантах осуществления выбранные модуляторы будут содержать вариабельные области тяжелой и легкой цепи, которые имеют 65, 70, 75 или 80% идентичность с вышеупомянутыми мышиными последовательностями. В других вариантах осуществления модуляторы будут содержать вариабельные области тяжелой и легкой цепи, которые имеют 85, 90 или даже 95% идентичность с раскрытыми мышиными последовательностями.
Разумеется, с учетом настоящего раскрытия специалисты в данной области техники могут легко выявить CDR, ассоциированные с каждой из вышеупомянутых вариабельных областей тяжелой и легкой цепи, и применять эти CDR для разработки или получения химерных, гуманизированных или CDR-привитых антител без излишнего экспериментирования. В связи с этим, в определенных вариантах осуществления настоящее изобретение относится к антителам к SEZ6, содержащим одну или несколько CDR из последовательности вариабельной области, показанной на фиг. 10A или фиг. 10B. В предпочтительных вариантах осуществления эти антитела будут включать моноклональные антитела и в еще более предпочтительных вариантах осуществления будут включать химерные, CDR-привитые или гуманизированные антитела. Как обсуждается подробнее ниже следующие варианты осуществления будут предусматривать такие антитела, конъюгированные или ассоциированные с одним или несколькими цитотоксическими средствами.
Другой аспект настоящего изобретения относится к модуляторам, полученным или происходящим из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200.
Другие совместимые варианты осуществления настоящего изобретения будут предусматривать CDR-привитые или гуманизированные SEZ6 модуляторы hSC17.16, hSC17.17, hSC17.24, hSC17.28, SC17.34, hSC17.46, SC17.151, SC17.155, SC17.156, SC17.161 и SC17.200. Следующие варианты осуществления направлены на SEZ6 модулятор, включающий гуманизированное антитело, где указанное гуманизированное антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, причем указанная вариабельная область легкой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:170, SEQ ID NO:172, SEQ ID NO:174, SEQ ID NO:176, SEQ ID NO:178, SEQ ID NO:180, SEQ ID NO:182, SEQ ID NO:184, SEQ ID NO:186, SEQ ID NO:188 и SEQ ID NO:190, и при этом указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:171, SEQ ID NO:173, SEQ ID NO:175, SEQ ID NO:177, SEQ ID NO:179 и SEQ ID NO:181, SEQ ID NO:183, SEQ ID NO:185, SEQ ID NO:187, SEQ ID NO:189 и SEQ ID NO:191. Кроме того, определенные гуманизированные варианты вариабельных областей легкой (SEQ ID NO:192) и тяжелой (SEQ ID NO:193, SEQ ID NO:194, SEQ ID NO:195, SEQ ID NO:196, SEQ ID NO:197, SEQ ID NO:198 и SEQ ID NO:199) цепи представлены согласно изложенному в настоящем документе. Более того, как описано непосредственно выше, последовательности нуклеиновой кислоты, кодирующие иллюстративные гуманизированные вариабельные области тяжелой и легкой цепи, приведены в прилагаемом перечне последовательностей в виде SEQ ID NO:370-399.
Кроме вышеупомянутых аспектов, другие предпочтительные варианты осуществления настоящего изобретения будут предусматривать SEZ6 модуляторы, ассоциированные или конъюгированные с одним или несколькими лекарственными средствами для получения конъюгатов модуляторов, которые могут быть особенно эффективными при лечении пролиферативных расстройств (сами по себе или в комбинации с другими фармацевтически активными средствами). В более общем смысле, если модуляторы по настоящему изобретению были получены и выбраны, они могут быть связаны, слиты, конъюгированы (например, ковалентно или нековалентно) или иным образом ассоциированы с фармацевтически активными частями или частями, обеспечивающими диагностику, или биологически совместимыми модификаторами. Используемые в данном документе выражения “конъюгат”, или “конъюгат модулятора”, или “конъюгат антитела” будут применяться в широком смысле и подразумевать любую биологически активную или поддающуюся обнаружению молекулу или лекарственное средство, ассоциированное с раскрытыми модуляторами независимо от способа ассоциации. В связи с этим следует понимать, что эти конъюгаты, в дополнение к раскрытым модуляторам, могут содержать пептиды, полипептиды, белки, пролекарства, которые метаболизируются до активного средства in vivo, полимеры, молекулы нуклеиновой кислоты, малые молекулы, связывающие средства, миметики, синтетические лекарственные средства, неорганические молекулы, органические молекулы и радиоактивные изотопы. Более того, как указано выше, выбранный конъюгат может быть ковалентно или нековалентно ассоциирован или связан с модулятором и характеризоваться различными стехиометрическими молярными соотношениями, в зависимости, по меньшей мере частично, от способа, применяемого для осуществления конъюгирования.
Особенно предпочтительные аспекты настоящего изобретения будут подразумевать конъюгаты модулятора на основе антитела или конъюгаты антитело-лекарственное средство, которые можно применять для диагностики и/или лечения пролиферативных расстройств. Эти конъюгаты могут быть представлены формулой M-[L-D]n, где M обозначает раскрытый модулятор или часть для связывания мишени, L представляет собой необязательный линкер или линкерную группу, D представляет собой совместимое лекарственное средство или пролекарство, и n представляет собой целое число от приблизительно 1 до приблизительно 20. Следует понимать, что если иное не определено контекстом, выражения “конъюгат антитело-лекарственное средство” или “ADC” или формула M-[L-D]n, как подразумевается, охватывает конъюгаты, содержащие как терапевтические части, так и части, обеспечивающие диагностику. В этих вариантах осуществления соединения на основе конъюгата антитело-лекарственное средство, как правило, будут содержать антитело к SEZ6 в качестве группы модулятора (M), терапевтическую часть или часть, обеспечивающую диагностику (D) и необязательно линкер (L), который соединяет лекарственное средство и средство связывания с антигеном. В предпочтительном варианте осуществления антитело представляет собой mAb к SEZ6, содержащее по меньшей мере одну CDR из вариабельных областей тяжелой и легкой цепи, как описано выше.
Как указано выше, один аспект настоящего изобретения может предусматривать неожиданную ассоциацию полипептидов SEZ6 с раковыми стволовыми клетками. Таким образом, в определенных других вариантах осуществления настоящее изобретение будет предусматривать SEZ6 модулятор, который при введении индивиду снижает частоту клеток, вызывающих развитие опухоли. Предпочтительно, снижение частоты будут определять при помощи in vitro или in vivo анализа в предельном разведении. В особенно предпочтительных вариантах осуществления такой анализ можно проводить при помощи in vivo анализа в предельном разведении, предусматривающего трансплантацию живых человеческих опухолевых клеток мыши с ослабленным иммунитетом. В альтернативном случае, анализ в предельном разведении можно проводить при помощи in vitro анализа в предельном разведении, предусматривающего осаждение при предельном разведении живых человеческих опухолевых клеток в условиях, способствующих образованию колоний in vitro. В любом случае, анализ, вычисление или количественная оценка снижения частоты, предпочтительно, будут предусматривать применение статистических методик распределения Пуассона для обеспечения точного расчета. Следует понимать, что несмотря на то, что эти способы количественной оценки являются предпочтительными, другую менее трудоемкую методику, такую как проточная цитометрия или иммуногистохимия, также можно применять для обеспечения требуемых значений и, соответственно, как в явной форме предполагается, они находятся в пределах объема настоящего изобретения. В таких случаях снижение частоты можно определять при помощи проточного цитометрического анализа или иммуногистохимического выявления поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли.
В связи с этим, другой предпочтительный вариант осуществления настоящего изобретения предусматривает способ лечения SEZ6-ассоциированного расстройства, включающий введение терапевтически эффективного количества SEZ6 модулятора индивиду, нуждающемуся в этом, тем самым снижая частоту клеток, вызывающих развитие опухоли. Предпочтительно, SEZ6-ассоциированное расстройство включает неопластическое расстройство. И в этом случае, снижение частоты клеток, вызывающих развитие опухоли, предпочтительно, будут определять при помощи in vitro или in vivo анализа в предельном разведении.
В связи с этим следует понимать, что настоящее изобретение основывается, по меньшей мере частично, на обнаружении того, что SEZ6 иммуногены ассоциированы с клетками, обеспечивающими поддержание опухоли (т.е. раковыми стволовыми клетками), которые связаны с этиологией различных видов неоплазии. Более конкретно, настоящая заявка демонстрирует, что введение различных иллюстративных SEZ6 модуляторов может преобразовывать, снижать, приводить к сокращению, ингибировать или приводить к устранению передачи онкогенного сигнала, обеспечиваемого клетками, вызывающими развитие опухоли (т.е. снижать частоту клеток, вызывающих развитие опухоли). Это снижение передачи сигнала, будь то путем сокращения количества, нейтрализации, снижения, устранения, перепрограммирования или "сайленсинга" клеток, вызывающих развитие опухоли, или путем модификации морфологии опухолевых клеток (например, индуцированная дифференцировка, нарушение ниши), в свою очередь обеспечивает более эффективное лечение SEZ6-ассоциированных расстройств путем ингибирования образования опухоли, поддержания, развития и/или метастазирования и повторного проявления опухоли.
Кроме вышеупомянутой ассоциации с раковыми стволовыми клетками, есть сведения, что изоформы SEZ6 могут быть связаны с ростом, повторным проявлением или метастатическим потенциалом опухолей, характеризующихся нейроэндокринными свойствами. Для целей настоящего изобретения такие опухоли будут включать нейроэндокринные опухоли и псевдонейроэндокринные опухоли. Воздействие на пролиферацию таких опухолеродных клеток при помощи новых SEZ6 модуляторов, описанных в данном документе, следовательно, может приводить к уменьшению интенсивности или лечению расстройства при помощи более чем одного механизма (т.е. снижения количества клеток, вызывающих развитие опухоли, и нарушения передачи сигнала в онкогенном пути) с обеспечением аддитивного или синергического эффектов. В других предпочтительных вариантах осуществления можно использовать интернализацию в клетку SEZ6 с поверхности клетки для доставки противоракового средства, опосредованного модулятором. В связи с этим следует понимать, что настоящее изобретение не ограничивается любым конкретным механизмом действия, но, скорее, охватывает применение раскрытых модуляторов в широком смысле для лечения SEZ6-ассоциированных расстройств (в том числе различных неоплазий).
Таким образом, в других вариантах осуществления настоящее изобретение будет предусматривать применение раскрытых модуляторов для лечения опухолей, имеющих нейроэндокринные свойства, у индивида, нуждающегося в этом. Разумеется, такие же модуляторы можно применять для профилактики, прогнозирования, диагностики, терагностики, ингибирования или поддерживающей терапии этих же опухолей.
В других сферах, с которыми связано настоящее изобретение, используется способность раскрытых модуляторов приводить к потенциальному нарушению онкогенных путей, при этом одновременно обеспечивать "сайленсинг" клеток, вызывающих развитие опухоли. Такие SEZ6 модуляторы с несколькими активностями (например, SEZ6 антагонисты) могут оказаться особенно эффективными при применении в комбинации со стандартными противораковыми средствами или циторедуктивными средствами. Соответственно, предпочтительные варианты осуществления настоящего изобретения предусматривают применение раскрытых модуляторов в качестве противометастатических средств для поддерживающей терапии после первоначальных средств для лечения. В дополнение, два или более SEZ6 антагониста (например, антитела, которые специфически связываются с двумя дискретными эпитопами на SEZ6) можно применять в комбинации в соответствии с настоящим описанием. Более того, как довольно подробно обсуждается ниже, SEZ6 модуляторы по настоящему изобретению можно применять в конъюгированном или неконъюгированном состоянии и необязательно в качестве сенсибилизирующего средства в комбинации с рядом химических или биологических противораковых средств.
Соответственно, другой предпочтительный вариант осуществления настоящего изобретения предусматривает способ сенсибилизации опухоли у индивида для лечения противораковым средством, включающий этап введения SEZ6 модулятора указанному индивиду. Другие варианты осуществления предусматривают способ снижения метастазирования или повторного проявления опухоли после лечения, включающий введение SEZ6 модулятора индивиду, нуждающемуся в этом. В особенно предпочтительном аспекте настоящего изобретения SEZ6 модулятор будет специфически приводить в результате к снижению частоты клеток, вызывающих развитие опухоли, как определено при помощи in vitro или in vivo анализа в предельном разведении.
В более общем смысле предпочтительные варианты осуществления настоящего изобретения предусматривают способ лечения SEZ6-ассоциированного расстройства у индивида, нуждающегося в этом, включающий этап введения индивиду SEZ6 модулятора. В особенно предпочтительных вариантах осуществления SEZ6 модулятор будет ассоциирован (например, конъюгирован) с противораковым средством. В других вариантах осуществления SEZ6 модулятор будет интернализоваться после ассоциирования или связывания с SEZ6 на поверхности клетки или вблизи поверхности клетки. Более того, полезные аспекты настоящего изобретения, в том числе любое нарушение путей передачи сигнала и дополнительные преимущества, могут быть достигнуты, если опухолевая ткань индивида характеризуется повышенными уровнями SEZ6 или сниженными или пониженными уровнями SEZ6 по сравнению с нормальной прилегающей тканью. Особенно предпочтительные варианты осуществления будут предусматривать лечение расстройств, характеризующихся повышенными уровнями SEZ6 на опухолеродных клетках по сравнению с нормальной тканью или клетками, не относящимися к опухолеродным.
В следующем аспекте настоящее изобретение будет предусматривать способ лечения индивида, страдающего от неопластического расстройства, включающий этап введения терапевтически эффективного количества по меньшей мере одного интернализирующего SEZ6 модулятора. Предпочтительные варианты осуществления будут предусматривать введение интернализирующих модуляторов на основе антитела, причем в других определенных вариантах осуществления интернализирующие модуляторы на основе антитела конъюгированы или ассоциированы с цитотоксическим средством.
Другие варианты осуществления направлены на способ лечения индивида, страдающего от SEZ6-ассоциированного расстройства, включающий этап введения терапевтически эффективного количества по меньшей мере одного понижающего SEZ6 модулятора.
В следующем варианте осуществления настоящее изобретение предоставляет способы поддерживающей терапии, где раскрытые эффекторы или модуляторы вводят на протяжении периода времени после первоначальной процедуры (например, химиотерапевтическое средство, излучение или хирургическая операция), предназначенной для удаления по меньшей мере участка опухолевой массы. При таких терапевтических схемах можно осуществлять введение на протяжении недель, месяцев или даже лет, причем SEZ6 модуляторы могут оказывать профилактическое действие с ингибированием метастазирования и/или повторного проявления опухоли. В других вариантах осуществления раскрытые модуляторы можно вводить во взаимосвязи с известными циторедуктивными схемами для профилактики или замедления метастазирования, поддержания или повторного проявления опухоли.
Далее принимается во внимание, что SEZ6 модуляторы по настоящему изобретению могут быть образованы и выбраны для реагирования с известной изоформой(ами) SEZ6 или одной изоформой белка или, напротив, они могут предусматривать модулятор для всех SEZ6, который вступает в реакцию или соединяется по меньшей мере с одним дополнительным представителем семейства SEZ6 (например, SEZ6L или SEZ6L2 и их изоформами) в дополнение к SEZ6. Более конкретно, как раскрыто в настоящем документе, предпочтительные модуляторы, например, антитела, можно получать и выбирать так, что они вступают в реакцию с доменами (или их эпитопами), которыми характеризуются только SEZ6, или с доменами, которые являются по меньшей мере в некоторой степени консервативными среди двух или более представителей семейства SEZ6.
В следующих предпочтительных вариантах осуществления модуляторы будут соединяться или связываться со специфическим эпитопом, участком, мотивом или доменом SEZ6. Как будет довольно подробно обсуждаться ниже, обе изоформы SEZ6 содержат одинаковую внеклеточную область (см. фиг. 1E), содержащую по меньшей мере N-концевой домен, два чередующихся Sushi и CUB домена и три дополнительных тандемных повтора Sushi домена. Кроме того, белок SEZ6 содержит трансмембранный домен и цитоплазматический домен. Следовательно, в определенных вариантах осуществления модуляторы будут связываться или ассоциироваться с N-концевым доменом SEZ6 (т.e. аминокислотами 1-335 в зрелом белке) или с эпитопом в нем. Другие аспекты настоящего изобретения предусматривают модуляторы, которые ассоциируют или связываются со специфическим эпитопом, расположенным в определенном Sushi домене SEZ6. В связи с этим определенный модулятор может ассоциироваться или связываться с эпитопом, расположенным в Sushi домене 1 (аминокислоты 336-395), Sushi домене 2 (аминокислоты 511-572), Sushi домене 3 (аминокислоты 690-748), Sushi домене 4 (аминокислоты 750-813) или Sushi домене 5 (аминокислоты 817-878). Другие аспекты настоящего изобретения предусматривают модуляторы, которые ассоциируют или связываются со специфическим эпитопом, расположенным в определенном CUB-подобном домене SEZ6. В этом отношении конкретный модулятор может ассоциироваться или связываться с эпитопом, расположенным в CUB домене 1 (аминокислоты 397-508) или CUB домене 2 (аминокислоты 574-685). Разумеется, следует понимать, что каждый из вышеупомянутых доменов может содержать более одного эпитопа и может быть ассоциирован с более чем одной секцией.
Что касается “секций” модулятора или антитела, следует понимать, что антиген SEZ6 можно анализировать или картировать при помощи конкурентного связывания антител с применением методик, принятых в данной области техники, для определения специфических секций, расположенных на всем протяжении белка. В то время как это более подробно обсуждается в данном документе и показано в примерах 9 и 10 ниже, два антитела (одно из которых можно назвать “эталонное антитело,” “определяющее секцию антитело” или “определяющее антитело”) могут считаться находящимися в одной и той же секции, если они конкурируют друг с другом за связывание с целевым антигеном. В таких случаях эпитопы для испытуемых антител могут быть одинаковыми, фактически одинаковыми или быть достаточно близкими (либо в линейном смысле, где они разделены несколькими аминокислотами, либо конформационно), так что связывание обоих антител ингибируется или предотвращается стерическими или электростатическими взаимодействиями. Эти определенные секции, как правило, могут быть ассоциированы с определенными доменами SEZ6 (например, эталонное антитело будет связываться с эпитопом, который находится в специфическом домене), хотя корреляция не всегда является точной (например, в домене может быть более одной секции или секция может определяться конформационно и содержать более одного домена). Следует понимать, что специалисты в данной области техники могут легко определить взаимосвязь между доменами SEZ6 и эмпирически определенными секциями.
Что касается настоящего изобретения, анализ конкурентного связывания при помощи методик, принятых в данной области техники (например, ELISA, поверхностный плазмонный резонанс или интерферометрия биослоя), позволил определить по меньшей мере семь отличающихся секций, каждая из которых, как было обнаружено, содержит ряд модуляторов на основе антитела. Для настоящего раскрытия семь секций назвали секции A-F и секция U. Секции A-F являются уникальными секциями, и антитела, содержащиеся в каждой из этих секций, конкурируют друг с другом за связывание с белком SEZ6. Секция U содержит антитела, который не конкурируют с антителами в секциях A-F, но могут конкурировать за связывание друг с другом. Таким образом, в выбранных вариантах осуществления настоящее изобретение будет предусматривать модулятор, относящийся к секции, выбранной из группы, состоящей из секции A, секции B, секции C, секции D, секции E, секции F и секции U. В других вариантах осуществления настоящее изобретение предусматривает модулятор, относящийся к секции, определенной эталонным антителом, выбранным из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200. В других вариантах осуществления настоящее изобретение будет предусматривать модуляторы из секции A, модуляторы из секции B, модуляторы из секции C, модуляторы из секции D, модуляторы из секции E, модуляторы из секции F или модуляторы из секции U. Другие предпочтительные варианты осуществления будут предусматривать модулятор на основе эталонного антитело и любое антитело, которое конкурирует с эталонным антителом.
Выражение “конкурировать” или “конкурирующее антитело”, используемое в контексте раскрытых модуляторов, означает конкуренцию за связывание между антителами, как определено при помощи анализа, в котором эталонное антитело или иммунологически функциональный фрагмент фактически предотвращает или ингибирует (например, более 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или 90%) специфическое связывание тестового антитела с общим антигеном. Совместимые способы для определения этой конкуренции включают методики, известные из уровня техники, такие как, например, интерферометрия биослоя, поверхностный плазмонный резонанс, проточная цитометрия, конкурентный ELISA и т.д.
В выбранном варианте осуществления настоящее изобретение предусматривает модулятор для всех SEZ6, который ассоциируется с SEZ6 и по меньшей мере с одним другим представителем семейства SEZ6 (например, с SEZ6L или SEZ6L2). В других выбранных вариантах осуществления настоящее изобретение предусматривает SEZ6 модулятор, который иммуноспецифически ассоциирует с одной или несколькими изоформами SEZ6, но не ассоциирует иммуноспецифически с любым другим представителем семейства SEZ6. В других вариантах осуществления настоящее изобретение предусматривает способ лечения индивида, нуждающегося в этом, включающий введение терапевтически эффективного количества модулятора для всех SEZ6. Другие варианты осуществления предусматривают способ лечения индивида, нуждающегося в этом, включающий введение терапевтически эффективного количества SEZ6 модулятора, который иммуноспецифически ассоциирует с одной или несколькими изоформами SEZ6, но не ассоциирует иммуноспецифически с любым другим представителем семейства SEZ6.
Помимо терапевтические применений, обсуждаемых выше, также следует понимать, что модуляторы по настоящему изобретению можно применять для выявления, диагностики или классификации связанных с SEZ6 расстройств и, в частности, пролиферативных расстройств. В некоторых вариантах осуществления модулятор можно вводить индивиду и осуществлять выявление или мониторинг in vivo. Специалисты в данной области техники поймут, что эти модуляторы могут быть мечеными или ассоциированными с маркерами или репортерами, раскрытыми ниже, и их можно выявлять при помощи любой из ряда стандартных методик (например, MRI, сканирования при помощи CAT, сканирования при помощи PET и т.д.).
Таким образом, в некоторых вариантах осуществления настоящее изобретение будет предусматривать способ диагностики, выявления или мониторинга SEZ6-ассоциированного расстройства in vivo у индивида, нуждающегося в этом, включающий этап введения SEZ6 модулятора.
В других случаях модуляторы можно применять в условиях диагностики in vitro при помощи методик, принятых в данной области техники. В связи с этим, предпочтительный вариант осуществления предусматривает способ диагностики пролиферативного расстройства у индивида, нуждающегося в этом, включающий этапы:
a. получение образца ткани от указанного индивида;
b. приведение в контакт образца ткани по меньшей мере с одним SEZ6 модулятором и
c. выявление или количественная оценка SEZ6 модулятора, ассоциированного с образцом.
Эти способы можно легко определять в связи с настоящей заявкой и можно легко осуществлять при помощи общедоступной коммерческой технологии, например, автоматические планшет-ридеры, специально разработанные репортерные системы и т.д. В выбранных вариантах осуществления SEZ6 модулятор будет ассоциироваться с клетками, обеспечивающими поддержание опухоли, присутствующими в образце. В других предпочтительных вариантах осуществления этап выявления или количественной оценки будет предусматривать снижение частоты клеток, вызывающих развитие опухоли, и их выявление. Более того, может быть проведен анализ предельного разведения, как упоминается выше, и, предпочтительно, будут применяться статистические методики распределения Пуассона для обеспечения тщательного учета, касающегося снижения частоты.
Подобным образом, настоящее изобретение также предусматривает наборы или устройства и связанные способы, которые являются пригодными для диагностики и мониторинга SEZ6-ассоциированных расстройств, таких как рак. С этой целью настоящее изобретение, предпочтительно, предусматривает изделие, пригодное для выявления, диагностики или лечения SEZ6-ассоциированных расстройств, содержащее емкость, содержащую SEZ6 модулятор, и инструктивные материалы для применения указанного SEZ6 модулятора для лечения или диагностики SEZ6-ассоциированного расстройства. В выбранных вариантах осуществления устройства и связанные способы будут предусматривать этап приведения в контакт по меньшей мере с одной циркулирующей опухолевой клеткой.
В других предпочтительных вариантах осуществления настоящего изобретения также используются свойства раскрытых модуляторов в качестве инструмента, пригодного для идентификации, характеристики, выделения, разделения или обогащения популяций или субпопуляций клеток, вызывающих развитие опухоли, посредством способов, таких как проточный цитометрический анализ, в том числе сортировка клеток с активированной флуоресценцией (FACS) или лазерное разделение.
В связи с этим другой предпочтительный вариант осуществления настоящего изобретения направлен на способ идентификации, выделения, разделения или обогащения популяции клеток, вызывающих развитие опухоли, включающий этап приведения в контакт указанных клеток, вызывающих развитие опухоли, с SEZ6 модулятором.
Вышеизложенное представляет собой краткое описание и, таким образом, предусматривает, при необходимости, упрощения, обобщения и опускание подробностей; следовательно, специалисты в данной области техники поймут, что краткое описание является только иллюстративным и не предназначено для какого-либо ограничения. Другие аспекты, свойства и преимущества способов, композиций и/или устройств, и/или других объектов, описанных в данном документе, будут очевидны из описания, приведенного в данном документе. Краткое описание дано для того, чтобы в упрощенной форме представить выбор концепций, которые дополнительно описаны ниже в подробном описании. Это краткое описание не предназначено для идентификации ключевых признаков или существенных признаков заявленного объекта, а также не предназначено для использования в качестве помощи при определении объема заявленного объекта.
Краткое описание графических материалов
На фиг. 1A-1E показаны различные изображения SEZ6, в том числе последовательности нуклеиновой кислоты или аминокислотные последовательности, принадлежащие SEZ6 модуляторам, описанным в настоящем документе. На фиг. 1A и 1B (SEQ ID NO:1 и 2) изображены последовательность мРНК полной длины, содержащей открытые рамки считывания (ORF) (подчеркнутые), кодирующие варианты SEZ6 1 и 2, соответственно. На фиг. 1C и 1D (SEQ ID NO:3 и 4) представлены соответствующие аминокислотные последовательности ORF, отмеченных на фиг. 1A и 1B, соответственно, с отдельными подчеркнутыми аминокислотными остатками, указывающими на прогнозируемый трансмембранный домен для каждой изоформы белка, и подчеркнутыми двойной линией аминокислотными остатками, указывающими на сигнальный пептид; на фиг. 1E изображено выравнивание двух изоформ белка (SEQ ID NO:3 и 4) для иллюстрирования отличий последовательностей на цитоплазматическом конце каждой изоформы с подчеркнутыми остатками, указывающими на отличия между двумя последовательностями; а на фиг. 1F показано схематическое представление внеклеточной области белка SEZ6, иллюстрирующее расположение различных доменов.
На фиг. 2A-2C показано представление в виде таблицы процентной идентичности на белковом уровне между ближайшими изоформами белков SEZ6 человека и белками SEZ6 макака-резуса, макака-крабоеда, мыши и крысы (фиг. 2A); табличный перечень различных номеров доступа кДНК или белковых последовательностей для каждой из описанных изоформ семейства генов SEZ6 (фиг. 2B) и процентная идентичность на белковом уровне между самыми длинными изоформами белков SEZ6, SEZ6L и SEZ6L2 человека (фиг. 2C).
На фиг. 3A-3C показаны различные представления последовательностей нуклеиновых кислот или аминокислот, связанных с продуцированием иммуногенов или клеточными линиями, используемыми для образования или определения характеристик SEZ6 модуляторов, описанных в настоящем документе. Для SEZ6 человека специфичный клон кДНК (фиг. 3A; SEQ ID NO:5), кодирующий окончательно зрелый белок SEZ6 человека (фиг. 3B; SEQ ID NO:6), конструировали из коммерческого клона кДНК (BC146292; SEQ ID NO:7) с известными отличиями (фиг. 3C) от эталонной последовательности из базы данных, NP_849191 (SEQ ID NO:3) для белка SEZ6.
На фиг. 4A и 4B представлена кДНК (фиг. 4A; SEQ ID NO:8), используемая для экспрессии конструкции Fc-SEZ6 в клетках CHO-S и получения белкового иммуногена (фиг. 4B; SEQ ID NO:9), содержащего ECD SEZ6 человека, слитого с Fc-доменом IgG2 человека, в которой подчеркнутые последовательности соответствуют Fc-домену IgG2 человека, подчеркнутые двойной линией последовательности соответствуют сигнальному пептиду IgK, а выделенные жирным шрифтом аминокислоты соответствуют остаткам, внесенным сайтами рестрикции, используемыми для клонирования фрагмента hSCRx17.
На фиг. 5A-5J показаны различные представления последовательностей нуклеиновых кислот или аминокислот, связанных с продуцированием иммуногенов или клеточными линиями, используемыми для образования или определения характеристик SEZ6 модуляторов, описанных в настоящем документе, где подчеркнутые последовательности означают ECD белка для специфичного SEZ6 или члена семейства SEZ6, которые проиллюстрированы, и фигуры содержат последовательности кДНК для конструкций, кодирующих зрелый SEZ6 мыши (фиг. 5A, SEQ ID NO:10), зрелый SEZ6 крысы (фиг. 5C, SEQ ID NO:12), зрелый SEZ6 макака-крабоеда (фиг. 5E, SEQ ID NO:14), зрелый ECD белка SEZ6L человека (фиг. 5G, SEQ ID NO:16), или зрелый ECD белка SEZ6L2 человека (фиг. 5I, SEQ ID NO:18), или соответствующие белки, кодируемые такими кДНК-конструкциями, т.е. зрелый SEZ6 мыши (фиг. 5B, SEQ ID NO:11), зрелый SEZ6 крысы (фиг. 5D, SEQ ID NO:13), зрелый SEZ6 макака-крабоеда (фиг. 5F, SEQ ID NO:15), зрелый ECD белка SEZ6L человека (фиг. 5H, SEQ ID NO:17) или зрелый ECD белка SEZ6L2 человека (фиг. 5J, SEQ ID NO:19).
На фиг. 6A и 6B изображены уровни экспрессии мРНК различных генов, как определено при помощи секвенирования полного транскриптома (SOLiD) мРНК, полученной из субпопуляций опухолевых клеток или нормальных тканей. На фиг. 6A показано представление в виде таблице генов, ассоциированных с опухолями, обладающими нейроэндокринными признаками; а на фиг. 6B показано графическое представление экспрессии мРНК SEZ6 в нормальных тканях и нескольких опухолях из нетрадиционных ксенотрансплантатных моделей (NTX), полученных от больных раком легкого.
На фиг. 7A-7F изображены уровни экспресии мРНК, анализируемые с использованием микропанели. На фиг. 7A показано графическое представление неконтролируемой кластеризации профилей, полученных при помощи микропанелей, для 46 опухолевых линий и двух нормальных тканей; фиг. 7B и 7C являются представлениями в виде таблицы нормализованных значений интенсивности, соответствующих относительным уровням экспрессии выбранных генов, связанных с нейроэндокринными фенотипами (фиг. 7B) или сигнальным путем Notch (фиг. 7C), где незакрашенные ячейки и относительно низкие значения обозначают незначительную экспрессию - отсутствие экспрессии, а более темные ячейки и относительно высокие значения обозначают более высокие уровни экспрессии; фиг. 7D является графическим представлением, демонстрирующим относительные уровни экспрессии мРНК HES6 в различных опухолях и контрольных тканях, как измерено при помощи qRT-PCR; фиг. 7E является представлением в виде таблицы нормализованных значений интенсивности, соответствующих относительным уровням экспрессии выбранных генов, указывающих на нейрогенез, коммитирование нейронов или дифференцировку в направлении нейрональной судьбы, при этом незакрашенные ячейки указывают на небольшую экспрессию вплоть до отсутствия, а более темные ячейки указывают на более высокие уровни экспрессии; и фиг. 7F является графическим представлением нормализованных значений интенсивности, соответствующих относительной экспрессии SEZ6 в различных опухолевых линиях из NTX.
Фиг. 8A и 8B являются графическими представлениями, демонстрирующими относительные уровни экспрессии мРНК-транскриптов SEZ6, как измерено с помощью RT-PCR в ряде образцов РНК, выделенных из нормальных тканей или объема нейроэндокринных опухолей из NTX (фиг. 8A) и ряда других опухолей из NTX (фиг. 8B).
Фиг. 9A и 9B являются графическими представлениями, демонстрирующими абсолютные (фиг. 9A) или нормализованные (фиг. 9B) уровни экспрессии мРНК SEZ6 человека, как измерено при помощи RT-PCR в образцах целых опухолей (серая точка) или соответствующей нормальной прилегающей ткани (NAT; белая точка) от пациентов с одним из восемнадцати типов солидной опухоли.
На фиг. 10A и 10B представлены в форме таблицы непрерывные аминокислотные последовательности вариабельных областей тяжелой и легкой цепей ряда мышиных и гуманизированных иллюстративных SEZ6 модуляторов, выделенных, клонированных и сконструированных, как описывается в примерах в настоящем документе.
На фиг. 11 изложены различные характеристики иллюстративных модуляторов по настоящему изобретению. На фиг. 11A показаны биохимические и иммунологические свойства иллюстративных SEZ6 модуляторов, представленные в формате таблицы; а на фиг. 11B представлена корреляция между доменом, с которым связывается антитело, и эффективностью антитела в in vitro киллинг-анализе.
На фиг. 12A и 12B показано выявление экспрессии SEZ6. На фиг. 12A показана экспрессия SEZ6 в клетках HEK-293T, сконструированных для сверхэкспрессии белка SEZ6 человека (h293T-HuSEZ6) с использованием антитела против SEZ6 SC17.33; на фиг. 12B показана относительная экспрессия белка SEZ6 человека в различных лизатах опухолей из NTX и нормальных тканей, измеренная с помощью электрохемилюминисцентного анализа.
На фиг. 13A и 13B показано выявление с помощью проточной цитометрии экспрессии белка SEZ6 в клетках опухоли из NTX с использованием различных антител против SEZ6 (фиг. 13A); тогда как на фиг. 13B показана усиленная экспрессия белка SEZ6 в CSC по сравнению с субпопуляциями NTG с использованием различных антител против SEZ6 (фиг. 13B).
На фиг. 14A и 14B показано, что CSC, экспрессирующие SEZ6, проявляют повышенную онкогенность по сравнению с CSC, которые не экспрессируют SEZ6. На фиг. 14A представлена контурная диаграмма, демонстрирующая сортировку с помощью FACS клеток опухоли легкого (LU37) на основании экспрессии CD324 (маркера CSC) и SEZ6; на фиг. 14B показано графическое представление роста опухолевых клеток, которые являются либо CD324+SEZ6+ (черные кружочки), либо CD324+SEZ6- (белые кружочки) после имплантации мышам с ослабленным иммунитетом. Опухолевые клетки, экспрессирующие и CD324, и SEZ6, проявляют повышенную онкогенность.
На фиг. 15A и 15B показаны, соответственно, представления в виде таблицы и графика, иллюстрирующие, что раскрытые модуляторы могут быть эффективно использованы как нацеливающие части для направления цитотоксической нагрузки в клетки, сконструированные для экспрессии SEZ6 (фиг. 15A), и опухоли легкого из NTX (LU80, LU37 и LU100), выращиваемые in vitro (фиг. 15B), при этом снижение нормализованных относительных единиц люминесценции (RLU) указывает на цитолиз клеток вследствие интернализации сапонинового токсина.
На фиг. 16 показано представление в виде таблицы результатов иммуногистохимии, демонстрирующих экспрессию SEZ6 на различных опухолях из NTX.
На фиг. 17A и 17B изображена способность конъюгированных мышиных антител против SEZ6 замедлять in vitro и in vivo рост опухолевых клеток из NTX. На фиг. 17A показаны результаты in vitro килинг-анализа с использованием ADC к SEZ6 на клетках HEK293, свехрэкпрессирующих SEZ6; тогда как на фиг. 17B показан эффект ADC к SEZ6 в отношении in vivo роста опухолей SCLC (LU86) и LCNEC (LU50).
На фиг. 18A и 18B показана способность конъюгированных гуманизированных антител против SEZ6 замедлять in vivo рост четырех опухолей SCLC (LU80, LU64, LU111 и LU117) и обеспечивать длительную ремиссию у иммунодефицитных мышей.
Подробное описание изобретения
I. Введение
Хотя настоящее изобретение может быть воплощено во многих различных формах, в данном документе раскрыты его конкретные иллюстративные варианты осуществления, которые иллюстрируют принципы настоящего изобретения. Особо следует отметить, что настоящее изобретение не ограничивается проиллюстрированными конкретными вариантами осуществления. Более того, любые заглавия разделов, используемые в настоящем документе, приведены только для организационных целей, и их не следует толковать как ограничивающие описанный объект. В конечном итоге, для целей настоящего раскрытия все номера доступа для идентификации последовательностей можно найти в базе данных эталонных последовательностей NCBI (RefSeq) и/или в архивной базе данных последовательностей GenBank® NCBI, если не указано иное.
Как упоминалось ранее, было обнаружено, что экспрессия SEZ6 ассоциирована с неопластическим ростом и пролиферативными расстройствами, особенно в случае опухолей с нейроэндокринными свойствами, и что SEZ6 и его варианты или изоформы являются пригодными опухолевыми маркерами, которые можно использовать при лечении связанных с ними заболеваний. Более того, как показано в настоящей заявке, было обнаружено, что маркеры или детерминанты SEZ6, такие как белок SEZ6 клеточной поверхности. ассоциированы с раковыми стволовыми клетками (также известными как клетки, обеспечивающие поддержание опухоли), и их можно эффективно использовать для их устранения или "сайленсинга". Способность избирательно снижать количество или устранять раковые стволовые клетки (например, путем применения конъюгированных SEZ6 модуляторов) является особенно неожиданной в связи с тем, что эти клетки, как известно, обычно являются устойчивыми ко многим традиционно применяемым средствам для лечения. Другими словами, эффективность традиционных, а также более современных, направленных способов лечения часто ограничена по причине существования и/или появления устойчивых раковых стволовых клеток, которые способны поддерживать рак даже несмотря на такие различные способы лечения. Кроме того, детерминанты, ассоциированные с раковыми стволовыми клетками, часто являются плохими терапевтическими мишенями вследствие низкой или неустойчивой экспрессии, потери ассоциации с опухолеродной клеткой или отсутствия на клеточной поверхности. Резкий контраст со сведениям из предшествующего уровня техники заключается в том, что раскрытые в настоящей заявке соединения и способы обеспечивают эффективное преодоление этой свойственной устойчивости и обеспечивают специфическое устранение, сокращение количества, "сайленсинг" или стимулируют дифференцировку этих раковых стволовых клеток, тем самым нивелируется их способность поддерживать или повторно индуцировать соответствующий рост опухоли.
Более конкретно, было обнаружено, что SEZ6 модуляторы, например, раскрытые в данном документе, преимущественно можно применять при прогнозировании, диагностике, терагностике, лечении и/или профилактики пролиферативных расстройств (например, неоплластических расстройств) у индивидов, нуждающихся в этом. Следовательно, в то время как предпочтительные варианты осуществления настоящего изобретения будут подробно обсуждаться ниже, особенно в связи с конкретными доменами, областями или эпитопами или в контексте раковых стволовых клеток или опухолей, имеющих нейроэндокринные свойства, и их взаимодействий с раскрытыми модуляторами, специалисты в данной области техники поймут, что объем настоящего изобретения не ограничивается этими иллюстративными вариантами осуществления. Скорее, наиболее расширенные варианты осуществления настоящего изобретения и прилагаемая формула изобретения в широком смысле и в явной форме направлены на SEZ6 модуляторы (в том числе на конъюгированные модуляторы) и их применение при прогнозировании, диагностике, терагностике, лечении или профилактики ряда SEZ6-ассоциированных или опосредованных расстройств, в том числе неопластических расстройств или расстройств, связанных с пролиферацией клеток, независимо от любого конкретного механизма действия или опухоли, клеточного или молекулярного компонента, на который оказывается специфическое воздействие.
С этой целью, и как продемонстрировано в настоящей заявке, было обнаружено, что раскрытые SEZ6 модуляторы можно эффективно использовать для нацеливания на пролиферативные или опухолеродные клетки и их устранения или выведения из строя иным образом, а также лечения SEZ6-ассоциированных расстройств (например, неоплазии). Используемое в данном документе выражение “SEZ6-ассоциированное расстройство” будет подразумевать любое расстройство или заболевание (в том числе пролиферативные расстройства), которое оценивают, диагностируют, выявляют или обнаруживают при помощи фенотипического или генотипического отклонения от нормы генетических компонентов или экспрессии SEZ6 в течение заболевания или расстройства или в связи с его этиологией. В связи с этим фенотипическое отклонение от нормы или детерминанта SEZ6, например, может предусматривать повышенные или пониженные уровни экспрессии белка SEZ6, аномальную экспрессию белка SEZ6 в некоторых определяемых популяциях клеток или аномальную экспрессию белка SEZ6 в несоответствующей фазе или стадии клеточного цикла. Разумеется, следует понимать, что сходные паттерны экспрессии генотипических детерминант (например, уровни транскрипции мРНК) SEZ6 также можно применять для классификации или выявления SEZ6-ассоциированных расстройств.
Используемое в данном документе выражение “детерминанта” или “детерминанта SEZ6” будет означать любой выявляемый признак, свойство, маркер или фактор, который ассоциирован так, что его можно идентифицировать, или специфически обнаруживается в определенной клетке или на клетке, в популяции клеток или ткани, включая идентифицированные в клетке или на клетке, ткани или популяции клеток, пораженной SEZ6-ассоциированным заболеванием или расстройством. В выбранных предпочтительных вариантах осуществления SEZ6 модуляторы могут ассоциироваться, связываться или вступать в реакцию непосредственно с детерминантой SEZ6 (например, белок SEZ6 клеточной поверхности или мРНК SEZ6) и, следовательно, приводить к уменьшению интенсивности расстройства. В более общем смысле детерминанты могут быть морфологическими, функциональными или биохимическими по своей природе и могут быть генотипическими или фенотипическими. В других предпочтительных вариантах осуществления детерминанта представляет собой антиген или генетический компонент клеточной поверхности, который различным образом или, предпочтительно, экспрессируется (или не экспрессируется) специфическими типами клеток (например, раковыми стволовыми клетками) или клетками в определенных условиях (например, на специфических стадиях клеточного цикла или клетками в определенной нише). В других предпочтительных вариантах осуществления детерминанта может предусматривать ген или генетический объект, регуляция которого осуществляется по-разному (с увеличением или снижением экспрессии) в специфической клетке или дискретной популяции клеток, ген, который различным образом модифицирован в том, что касается его физической структуры и химического состава, или белок или набор белков, физически ассоциированные с геном, который характеризуется различными химическими модификациями. Детерминанты, предусмотренные в данном документе, как специально предполагается, являются положительными или отрицательными, и клетку, субпопуляцию клеток или ткань (например, опухоли) можно обозначать по их присутствию (положительные) или отсутствию (отрицательные).
Подобным образом, “SEZ6 модуляторы” по настоящему изобретению в широком смысле предусматривают любое соединение, которое распознает, вступает в реакцию, конкурирует, выступает в роли антагониста, взаимодействует, связывается, выступает в роли агониста или соединяется с вариантом или изоформой SEZ6 (или ео специфическими доменами, областями или эпитопами) или его генетическим компонентом. При помощи этих взаимодействий SEZ6 модуляторы преимущественно могут устранять, снижать или приводить к уменьшению частоты, активности, повторного проявления, метастазирования или подвижности опухолеродных клеток (например, клеток, обеспечивающих поддержание опухоли, или раковых стволовых клеток). Иллюстративные модуляторы, раскрытые в данном документе, включают нуклеотиды, олигонуклеотиды, полинуклеотиды, пептиды или полипептиды. В определенных предпочтительных вариантах осуществления выбранные модуляторы будут включать антитела против изоформы белка SEZ6 или их иммунореактивные фрагменты или производные. Эти антитела могут быть антагонистическими или агонистическими по своей природе и необязательно могут быть конъюгированными или ассоциированными с терапевтическими или диагностическими средствами. Более того, эти антитела или фрагменты антител могут содержать истощающие, нейтрализующие или интернализирующие антитела. В других вариантах осуществления модуляторы согласно настоящему изобретению будут представлять собой конструкцию на основе SEZ6, содержащую изоформу SEZ6 или ее реакционноспособный фрагмент. Следует понимать, что эти конструкции могут включать слитые белки и могут предусматривать реакционноспособные домены из других полипептидов, таких как иммуноглобулины или модификаторы биологического ответа. В других аспектах SEZ6 модулятор будет включать фрагмент нуклеиновой кислоты (например, miRNA, siRNA, shRNA, антисмысловые конструкции и т.д.), которые оказывают требуемые эффекты на геномном уровне. Другие модуляторы, совместимые с настоящим описанием, будут подробно обсуждаться ниже.
В более общем смысле SEZ6 модуляторы по настоящему изобретению в широком смысле предусматривают любое соединение, которое распознает, вступает в реакцию, конкурирует, выступает в роли антагониста, взаимодействует, связывается, выступает в роли агониста или соединяется с детерминантой SEZ6 (генотипической или фенотипической), в том числе белком SEZ6 клеточной поверхности. Независимо от того, какая форма модулятора выбрана в конечном итоге, он, предпочтительно, будет находиться в выделенном и очищенном состоянии до введения индивиду. В связи с этим выражение “выделенный SEZ6 модулятор” или “выделенное антитело к SEZ6” следует толковать в широком смысле, и в соответствии со стандартной фармацевтической практикой оно означает любой препарат или композицию, содержащую модулятор, находящийся в состоянии, при котором он фактически не содержит нежелательные примеси (биологические или иные). Более того, эти препараты можно очищать и составлять, как требуется, при помощи различных методик, принятых в данной области техники. Разумеется, следует понимать, что эти “выделенные” препараты можно намеренно составлять или объединять с инертными или активными ингредиентами, как требуется, для улучшения коммерческих, производственных или терапевтических аспектов конечного продукта и получения фармацевтических композиций. В более широком смысле те же самые общие соображения можно применять к “выделенной” изоформе или варианту SEZ6 или “выделенной” нуклеиновой кислоте, кодирующей его.
Кроме того, было обнаружено, что модуляторы, взаимодействующие, соединяющиеся или связывающиеся с конкретными доменами, мотивами или эпитопами SEZ6 являются особенно эффективными при устранении опухолеродных клеток, и/или "сайленсинге" или ослаблении раковой стволовой клетки, что оказывает влияние на рост или размножение опухоли. Другими словами, в то время как модуляторы, которые вступают в реакцию или соединяются с доменами, которые являются близкими к клеточной поверхности (например, одним из Sushi или CUB-подобных доменов), являются эффективными при сокращении количества или нейтрализации опухолеродных клеток, было обнаружено, что модуляторы, которые соединяются или связываются с доменами, мотивами или областями, которые являются относительно более удаленными от поверхности клетки, также являются эффективными при устранении, нейтрализации, сокращении количества или "сайленсинге" опухолеродных клеток. Это особенно относится к конъюгированным модуляторам, таким как, например, конъюгаты на основе антитела против SEZ6 и лекарственного средства, содержащие цитотоксическое средство.
В то время как настоящее изобретение в явной форме предполагает применение любого SEZ6 модулятора при лечении любого расстройства, связанного с SEZ6, в том числе неоплазии любого типа, в особенно предпочтительных вариантах осуществления раскрытые модуляторы можно применять для профилактики, лечения или диагностики опухолей, имеющих нейроэндокринные свойства (генотипические или фенотипические), в том числе нейроэндокринных опухолей. Истинные или “канонические нейроэндокринные опухоли” (NET) происходят из диффузно рассеянной эндокринной системы и, как правило, являются очень быстрорастущими. Нейроэндокринные опухоли наблюдаются в почке, мочеполовом тракте (мочевой пузырь, предстательная железа, яичник, шейка матки и эндометрий), желудочно-кишечном тракте (желудок, толстая кишка), щитовидной железе (медуллярный рак щитовидной железы) и легком (мелкоклеточная карцинома легких и крупноклеточная нейроэндокринная карцинома). Более того, раскрытые модуляторы преимущественно можно применять для лечения, профилактики или диагностики псевдонейроэндокринных опухолей (pNET), которые генотипически или фенотипически имитируют, содержат, имеют сходство или характеризуются общими признаками с каноническими нейроэндокринными опухолями. “Псевдонейроэндокринные опухоли” представляют собой опухоли, которые происходят из клеток диффузной нейроэндокринной системы или из клеток, в которых каскад нейроэндокринной дифференцировки был ошибочно повторно активирован в ходе онкогенного процесса. Такие pNET обычно имеют определенные общие генотипические, фенотипические или биохимические характеристики с обычными нейроэндокринными опухолями, в том числе способность образовывать разновидности биологически активных аминов, нейротрансмиттеров и пептидных гормонов. Соответственно, для целей настоящего изобретения фразы “опухоли, имеющие нейроэндокринные свойства” или “опухоли, характеризующиеся нейроэндокринными свойствами”, как подразумевается, будут охватывать как нейроэндокринные опухоли, так и псевдонейроэндокринные опухоли, если иное не определено контекстом.
Помимо ассоциации с опухолями, в общем обсуждаемыми выше, также есть признаки фенотипической или генотипической ассоциации между выбранными клетками, вызывающими развитие опухоли (TIC), и детерминантами SEZ6. В связи с этим, выбранные TIC (например, раковые стволовые клетки) могут экспрессировать повышенные уровни белков SEZ6 по сравнению с нормальной тканью и клетками, не относящимися к опухолеродным (NTG), которые вместе составляют большую часть солидной опухоли. Таким образом, детерминанты SEZ6 могут содержать маркер, ассоциированный с опухолью (или антиген, или иммуноген), и раскрытые модуляторы могут обеспечивать эффективные средства для выявления и подавления TIC и ассоциированной неоплазии благодаря измененным уровням белков на клеточной поверхности или в опухолевом микроокружении. Соответственно, SEZ6 модуляторы, в том числе иммунореактивные антагонисты и антитела, которые соединяются, связываются или вступают в реакцию с белками, могут эффективно снижать частоту клеток, вызывающих развитие опухоли, и могут быть пригодными при устранении, сокращении количества, выведении из строя, снижении количества, стимулировании дифференцировки, или предотвращении иным образом, или ограничении способности этих клеток, вызывающих развитие опухоли, находиться в состоянии покоя и/или продолжать подпитывать рост опухоли, метастазирование или повторное проявление у пациента. В связи с этим специалисты в данной области техники поймут, что настоящее изобретение дополнительно предусматривает SEZ6 модуляторы и их применение в снижении частоты клеток, вызывающих развитие опухоли.
II. Физиология SEZ6
SEZ6 (также известный как связанный с припадком гомолог 6) представляет собой трансмембранный белок I типа, первоначально клонированный из клеток, полученных из коры головного мозга мыши, обработанной вызывающим судороги пентилентетразолом (Shimizu-Nishikawa, 1995; PMID: 7723619). Типичные ортологи белка SEZ6 включают без ограничения белок человека (NP_849191; NP_001092105), шимпанзе (XP_511368, NP_001139913), мыши (NP_067261) и крысы (NP_001099224). У человека ген SEZ6 состоит из 17 экзонов протяженностью 51,1 т.п.о., расположенных на хромосоме 17q11.2. Альтернативные акцепторные сайты сплайсинга, отделенные только 16 парами оснований, в пределах последнего экзона дают два процессированных транскрипта, один длиной около 4210 оснований (NM_178860; фиг. 1A) и один длиной около 4194 оснований (NM_001098635, фиг. 1B). Первый транскрипт кодирует белок из 994 аминокислот (NP_849191; фиг. 1С), в то время как второй кодирует белок из 993 аминокислот (NP_001092105; фиг. 1D). Эти две изоформы белка SEZ6 обладают 100% общей идентичностью по их внеклеточным доменам и их трансмембранным доменам, отличающимся только конечными десятью аминокислотными остатками (фиг. 1E). Сообщалось, что третий сплайс-вариант образует секретируемую форму SEZ6 (Shimizu-Nishikawa, 1995; PMID: 7723619), однако он не был включен в ассоциированные RefSeq в странице ввода в базе данных Gene NCBI. Модуляторы по настоящему изобретению могут связываться с любым из сплайс-вариантов.
Биологическое соответствие изоформ является неясным, хотя одно исследование предполагало противоположные действия в отношении мембранных и растворимых белков, когда их экспрессия восстанавливается в нейронах от мышей, нокаутных по SEZ6 мыши (Gunnersen et al. 2007, PMID: 18031681). Межвидовая идентичность белковых последовательностей для белков SEZ6 приведена на фиг. 2A. В геноме человека существует два близкородственных гена, подобный связанному с припадком гомологу 6 (SEZ6L) и подобный связанному с припадком гомологу 6-2 (SEZ6L2), каждый из которых имеет несколько сплайс-вариантов, кодирующих несколько изоформ (фиг. 2B). Значения процентной идентичности для самого длинного белка каждого из представителей семейства SEZ6-подобных белков у человека показаны на фиг. 2C. Для целей настоящей заявки взятые вместе SEZ6, SEZ6L и SEZ6L2, в том числе их различные изоформы, будут называться семейством SEZ6. SEZ6 модуляторы по настоящему изобретению включают модуляторы, которые являются специфичными для каждого из SEZ6, SEZ6L или SEZ6L2. В качестве альтернативы, модуляторы по настоящему изобретению могут перекрестно реагировать с SEZ6 и с одним или обоими из SEZ6L и/или SEZ6L2.
Зрелый белок SEZ6 состоит из серии структурных доменов: цитоплазматического домена, трансмембранного домена и внеклеточного домена, содержащего уникальный N-концевой домен, за которым следуют два чередующихся Sushi и CUB-подобных домена, а также три дополнительных тандемных повтора Sushi домена. Существуют две изоформы антигена SEZ6, отличающиеся только крайними карбокси-концевыми цитоплазматическими доменами.
На фиг. 1F показано схематическое представление внеклеточной области белка SEZ6, иллюстрирующее общее расположение Sushi и CUB доменов и N-концевого домена. Как правило понимают, что домены находятся приблизительно в положении аминокислотных остатков 336-395 (Sushi домен 1), 397-508 (CUB домен 1), 511-572 (Sushi домен 2), 574-685 (CUB домен 2), 690-748 (Sushi домен 3), 750-813 (Sushi домен 4), 817-878 (Sushi домен 5), при этом N-концевой домен находится приблизительно в положении аминокислотных остатков 1-335 и смещение состава в сторону богатых пролином остатков приблизительно в положении аминокислотных остатков 71-169.
Sushi повторы подобны коротким консенсусным повторам, обнаруженным в других регуляторных белках комплемента человека (т.e. в сайтах связывания комплемента C3b/C4b). CUB-подобные домены подобны CUB доменам, обнаруженным в других белках для связывания комплемента у млекопитающих, которые ассоциированы с широким диапазоном белков, которые участвуют в ряде биологических процессов, отличных от активации комплемента, в том числе без ограничения структурировании, аксональном наведении, воспаление и подавление опухоли (Bork and Beckman, 1993, PMID: 8510165). И Sushi, и CUB домены обеспечивают функцию SEZ6, включающую связывание других белков внеклеточно. Белки, содержащие CUB домены, также связаны с клеточными путями передачи сигнала, и в соответствии с этой функцией C-концевые цитоплазматические домены SEZ6 содержат мотив Asn-Pro-Thr-Tyr (SEQ ID NO:403), который является потенциальной мишенью для фосфорилирования членами семейства Src тирозинкиназы. Если это так, то это возможно связывает SEZ6 с клеточным путем передачи сигнала, ведущей к активации Ras, что позволяет предположить, что SEZ6 может представлять собой нейротрофический рецептор.
Следует отметить, что используемые в настоящем документе термины “зрелый белок” или “зрелый полипептид” относятся к форме(ам) продуцируемого белка SEZ6 без сигнального пептида из 19 аминокислот, который может быть отщеплен перед экспрессией на клеточной поверхности. Если не указано иное, нумерация аминокислот SEZ6 (для доменов, областей, эпитопов и т.п.) будет в контексте зрелого белка без лидерной последовательности.
SEZ6 выявляется с помощью RT-PCR на низких уровнях в почке, печени, сердце, легком и тимусе грызунов, тем не менее сильную экспрессию белка наблюдали только в головном мозге, а на значительном уровне экспрессируется в семеннике (Herbst and Nicklin, 1997, PMID: 9073173). При помощи поликлональной сыворотки к SEZ6 экспрессию белка выявляли на 13 день развития переднего мозга мыши. Сильное окрашивание выявляли в постмитотических, созревающих нейронах развивающейся кортикальной пластинки и субпластинки. Такое окрашивание уменьшается во взрослом головном мозге, в котором экспрессию SEZ6 можно выявлять в других областях головного мозга, ассоциированных с существующей морфологической пластичностью, таких как гиппокамп, мозжечок и обонятельная луковица, а также в нейронах сетчатки и спинного мозга (Gunnersen et al., 2007, PMID: 18031681). Самые плотные сигналы обнаруживают в областях с наибольшей концентрацией тел нейронов. Несмотря на широко распространенную экспрессию SEZ6 в сетчатке в отсутствие SEZ6 ретинальная функция не изменялась (Gunnersen et al., 2009, PMID: 19662096). Паттерн окрашивания SEZ6 тесно связан с появлением неокортикальных слоев и гиппокампа, и это предполагает роль этого гена во время развития, специфичную в отношении переднего мозга. Было обнаружено, что SEZ6 человека и мыши по-разному экспрессируются в высокоспецифичных областях неокортекса (Gunnersen et al., 2007, выше).
Мутации в гене SEZ6 человека были связаны с фебрильной судорогой (FS), конвульсией, ассоциированной с повышением температуры тела и наиболее общим типом припадка у детей (Yu et al., 2007, PMID: 17086543). FS может быть классифицирована как простая или сложная в зависимости от длительности, повторяемости и участка тела, пораженного припадком. В группе китайцев не обнаруживали мутации в SEZ6 у 15 здоровых контрольных индивидуумов, но обнаруживали мутации у 21 из 60 пациентов с FS, при этом наиболее общим типом мутаций являлись гетерозиготные, цитозиновые вставки (мутация со сдвигом рамки) в положении 1435 кДНК. Возникновение мутации было значительно выше у пациентов с комплексной FS и у пациентов с положительным семейным анамнезом. Поскольку существует 80% вероятность, что у детей с комплексной FS буду наблюдаться припадки в пожилом возрасте, авторы предполагают, что скрининг мутаций в SEZ6 может быть необходим для прогнозирования повторного проявления FS или развития эпилепсии (Yu et al., 2007, выше). Последние исследования поставили под сомнение частотность, релевантность и способность этого исследования обладать адекватной эффективностью для обеспечения достоверности причинно-следственной связи, но подтвердили, что SEZ6 может быть одним геном из многих, которые могут играть роль в расстройствах с припадками (Mulley et al., 2011, PMID: 21785725).
Специфические молекулярные функции SEZ6 остаются неясными. Как обсуждалось выше, анализ структурных модулей белка, идентифицируемых с помощью анализа гомологии и последовательности, подтверждают вероятную роль в передаче сигнала, межклеточной коммуникации и развитии нервов. Дендритное ветвление нейронов и межнейрональные связи, образующие сети передачи сигнала, которые составляют схему мозга, возникают и определяются собственными молекулярными программами в нейроне, а также внешними сигналами. Процесс дендритного роста у пирамидальных нейронов, главных нейронов переднего мозга млекопитающих, дает нейроны с особенной морфологией - тело пирамидальной клетки и два четко выраженных сложных дендритных дерева: одно появляется из апекса, а другое из основания тела клетки. Gunnersen et al. (2007, выше) показали, что у SEZ6-нулевых мышей наблюдается избыток коротких дендритов в дендритных деревьях этих нейронов, но не наблюдается увеличения общего дендритного поля, диапазона нейронов, с которыми данный нейрон связан. Восстановление экспрессии связанных с мембраной изоформ SEZ6 в нокаутных нейронах приводит к антиразветвляющему эффекту. В поведенческих тестах у SEZ6-нулевых мышей проявляются специфические исследовательские, двигательные и когнитивные дефициты. Эти данные подтверждают, что SEZ6 важен для достижения необходимого баланса между удлинением и ветвлением дендритов в ходе образования сложного дендритного дерева при развитии.
Вместе вышеупомянутые исследования убедительно показывают, что белок SEZ6 важен в контексте развития нервной системы и, вероятно, играет некоторую роль в межклеточной коммуникации и передаче сигнала. В опухолях обычно наблюдается неадекватная реактивация путей передачи сигнала, связанных с развитием, или дисрегуляция нормальных путей передачи сигнала (Harris et al., 2012). Одним набором опухолей, обладающих признаками, указывающими на частичную реактивацию программ, связанных с развитием, являются опухоли с нейроэндокринными фенотипами (Yao 2008; PMID: 18565894), в которых экспрессируются и/или секретируются различные гормональные и эндокринные маркеры, и экспрессируются различные нейронные маркеры, указывающие на нейрогенез, нейрональное коммитирование или дифференцировку в направлении нейрональной судьбы. Опухоли с нейроэндокринными признаками редко возникают в широком диапазоне первичных участков, и при этом их исчерпывающая классификация остается проблематичной (Yao; PMID: 18565894; Klimstra 2010; PMID: 20664470; Klöppel, 2011; PMID: 22005112), их можно классифицировать на четыре главных типа: карциноиды низкой степени злокачественности, высокодифференцированные нейроэндокринные опухоли низкой степени злокачественности со злокачественным поведением, опухоли со смешанными нейроэндокринными и эпителиальными признаками и низкодифференцированные нейроэндокринные карциномы высокой степени злокачественности. Из этих классификаций низкодифференцированные нейроэндокринные карциномы, которые включают мелкоклеточный рак легкого (SCLC) и подтипы рака легкого, не относящегося к мелкоклеточному (NSCLC), являются типами рака с неблагоприятным прогнозом. Предполагается, что SCLC является бронхогенным по происхождению, при этом частично возникает из нейроэндокринных клеток легких (Galluzzo and Bocchetta, 2011; PMID: 21504320). Независимо от клеточного источника происхождения этих опухолей, совершенно ясно, что они показывают низкодифференцированный эндокринный фенотип, часто являются высокопролиферативными и агрессивными и часто сверхэкспрессируют нейронные белки. Полученное в результате повышение маркеров нейронной экспрессии в этих опухолях, которые в противном случае, в первую очередь, могут быть ограничены нервной системой или показывают ограниченную экспрессию при развитии, образцом которых может быть SEZ6, таким образом, может стать уникальной терапевтической мишенью для опухолей с нейроэндокринным фенотипом.
III. Раковые стволовые клетки
Как упоминалось выше, было обнаружено, что аномальная экспрессия SEZ6 (генотипическая и/или фенотипическая) ассоциирована с различными субпопуляциями опухолеродных клеток. В связи с этим настоящее изобретение предоставляет SEZ6 модуляторы, которые могут быть особенно пригодными для нацеливания на такие клетки и, в особенности, клетки, обеспечивающие поддержание опухоли, что, таким образом, обеспечивает лечение, контроль течения или профилактики неопластических расстройств. Таким образом, в предпочтительных вариантах осуществления модуляторы детерминант SEZ6 (фенотипических или генотипических) преимущественно можно применять для снижения частоты клеток, вызывающих развитие опухоли, в соответствии с настоящим описанием и, таким образом, обеспечения лечения или контроля течения пролиферативных расстройств.
Для целей настоящей заявки выражение “клетки, вызывающие развитие опухоли” (TIC) охватывает как “клетки, обеспечивающие поддержание опухоли” (TPC; т.е. раковые стволовые клетки или CSC), так и “опухолевые клетки-предшественницы” с высокой способностью к пролиферации (названные TProg), которые, как правило, вместе составляют уникальную субпопуляцию (т.е. 0,1-40%) объема опухоли или массы. Для целей настоящего раскрытия выражения “клетки, обеспечивающие поддержание опухоли” и “раковые стволовые клетки” или “неоплластические стволовые клетки” являются эквивалентными и их можно применять в данном документе взаимозаменяемо. TPC отличаются от TProg тем, что TPC могут полностью воспроизводить композицию опухолевых клеток, существующих в опухоли, и имеют неограниченную способность к самообновлению, как продемонстрировано при помощи последовательной трансплантации (два или более пассажей на мышах) низких количеств выделенных клеток, в то время как TProg не будут проявлять неограниченную способность к самообновлению.
Специалисты в данной области техники поймут, что сортировка клеток с активированной флуоресценцией (FACS) с использованием соответствующих поверхностных клеточных маркеров является надежным способом для выделения высокообогащенных субпопуляций раковых стволовых клеток (например, > 99,5% чистота) по причине, по меньшей мере частично, ее способности различать одиночные клетки и скопления клеток (т.е. дублеты и т.д.). При помощи этих методик было показано, что если низкие количества высокоочищенных клеток TProg трансплантируют мышам с ослабленным иммунитетом, они могут подпитывать рост опухоли в первичном трансплантате. Однако, в отличие от очищенных субпопуляций TPC, опухоли, полученные из TProg, не полностью отражают исходную опухоль по фенотипической клеточной гетерогенности и очевидно неспособны повторно вызывать последовательное образование опухоли в последующих трансплантатах. Напротив, субпопуляции TPC полностью восстанавливают клеточную гетерогенность исходной опухоли и могут эффективно вызывать образование опухолей при последовательном выделении и трансплантации. Таким образом, специалисты в данной области техники поймут, что определяющее различие между TPC и TProg, несмотря на то, что и те, и другие могут приводить к образованию опухоли в первичных трансплантатах, заключается в уникальной способности TPC постоянно подпитывать гетерогенный рост опухоли при последовательной трансплантации при низких количествах клеток. Другие общепринятые подходы для характеристики TPC связаны с морфологией и исследованием маркеров на клеточной поверхности, профиля транскрипции и реакции на лекарственное средство, несмотря на то, что экспрессия маркера может изменяться при условиях культивирования и при пересеве клеточных линий in vitro.
Соответственно, для целей настоящего изобретения клетки, обеспечивающие поддержание опухоли, подобные нормальным стволовым клеткам, которые обеспечивают поддержание клеточной иерархии в нормальной ткани, предпочтительно, определяют по их способности к самообновлению в течение неопределенного периода времени, при этом сохраняется способность к мультилинейной дифференцировке. Клетки, обеспечивающие поддержание опухоли, таким образом способны к образованию как опухолеродных потомков (т.е. клеток, вызывающих развитие опухоли: TPC и TProg), так и потомков, не относящихся к опухолеродным (NTG). Используемое в данном документе выражение “клетка, не относящаяся к опухолеродным” (NTG) относится к опухолевой клетке, которая происходит от клетки, вызывающей развитие опухоли, но сама не имеет способности к самообновлению или образованию гетерогенных линий опухолевых клеток, которые составляют опухоль. В условиях эксперимента клетки NTG неспособны к воспроизводимому образованию опухолей у мышей, даже в случае трансплантации при избыточных количествах клеток.
Как указано, TProg также относятся к категории клеток, вызывающих развитие опухоли (или TIC) по причине их ограниченной способности к образованию опухолей у мышей. TProg являются потомками TPC и, как правило, способны к конечному числу клеточных делений, не приводящих к самообновлению. Более того, клетки TProg дополнительно можно разделить на ранние опухолевые клетки-предшественники (ETP) и поздние опухолевые клетки-предшественники (LTP), которые можно различать по фенотипу (например, маркерам на клеточной поверхности) и различной способности к воспроизведению строения опухолевых клеток. Несмотря на формальные различия, как ETP, так и LTP функционально отличаются от TPC тем, что они, как правило, обладают меньшей способностью к последовательному восстановлению опухолей в случае трансплантации при низких количествах клеток и, как правило, не отражают гетерогенность исходной опухоли. Несмотря на вышеизложенные особенности, также было продемонстрировано, что различные популяции TProg в редких случаях могут приобретать способность к самообновлению, которая в норме свойственна стволовым клеткам, и сами по себе становиться TPC (или CSC). В любом случае оба типа клеток, вызывающих развитие опухоли, вероятно, представлены в типичной опухолевой массе одного пациента и подвергаются лечению при помощи модуляторов, раскрытых в данном документе. Другими словами, раскрытые композиции, как правило, являются эффективными в снижении частоты или изменении чувствительности к химиотерапии таких SEZ6-положительных клеток, вызывающих развитие опухоли, независимо от конкретного варианта осуществления или смеси, представленной в опухоли.
В контексте настоящего изобретения, TPC являются в большей степени опухолеродными, относительно в большей степени скрытыми и часто в большей степени устойчивыми к химиотерапии, чем TProg (как ETP, так и LTP), клетки NTG и проникающие в опухоль клетки, не происходящие от TPC (например, фибробласты/строма, эндотелиальные и гемопоэтические клетки), которые составляют объем опухоли. При условии, что традиционные терапевтические средства и режимы, по большей части, были разработаны как для уменьшения объема опухоли, так и для атаки на быстро пролиферирующие клетки, TPC, вероятно, являются в большей степени устойчивыми к традиционным терапевтическим средствам и режимам, чем более быстро пролиферирующие TProg и другие популяции из объема опухолевых клеток. Кроме того, в TPC зачастую экспрессируются другие характерные признаки, что делает их относительно устойчивыми к химиотерапии при помощи традиционных терапевтических средств, такие как повышенная экспрессия транспортеров, обеспечивающих множественную лекарственную устойчивость, улучшенные механизмы репарации ДНК и антиапоптотические белки. Эти свойства, каждое из которых вносит вклад в толерантность TPC к лекарственным средствам, являются ключевой причиной неспособности стандартных режимов лечения, принятых в онкологии, обеспечивать долговременный положительный эффект у большинства пациентов с неоплазиями на поздней стадии; т.е. неспособность в достаточной степени обеспечивать нацеливание и ликвидацию тех клеток, которые подпитывают продолжающийся рост и повторное проявление опухоли (т.е. TPC или CSC).
В отличие от многих средств для лечения из предшествующего уровня техники, новые композиции по настоящему изобретению при введении индивиду, предпочтительно, приводят к снижению частоты клеток, вызывающих развитие опухоли, независимо от формы или специфической мишени (например, генетический материал, слитую конструкцию на основе антитела против SEZ6 или лиганда) выбранного модулятора. Как отмечено выше, снижение частоты клеток, вызывающих развитие опухоли, может происходить в результате a) устранения, сокращения количества, сенсибилизации, "сайленсинга" или ингибирования клеток, вызывающих развитие опухоли; b) контроля роста, распространения или повторного проявления клеток, вызывающих развитие опухоли; c) препятствования образованию, размножению, поддержанию или пролиферации клеток, вызывающих развитие опухоли, или d) затруднения выживания, регенерации и/или метастазирование опухолеродных клеток иным образом. В некоторых вариантах осуществления снижение частоты клеток, вызывающих развитие опухоли, происходит в результате изменения одного или нескольких физиологических путей. Изменение пути, либо путем снижения количества или устранения клеток, вызывающих развитие опухоли, либо модификации их потенциала (например, индуцированная дифференцировка, нарушение ниши) или иное нарушение их способности влиять на окружающую среду опухоли или другие клетки, в свою очередь, обеспечивает более эффективное лечение SEZ6-ассоциированных расстройств путем ингибирования образования опухоли, поддержания опухоли и/или метастазирования и повторного проявления.
Среди принятых в данной области способов, которые можно использовать для оценки такого снижения частоты клеток, вызывающих развитие опухоли, анализ предельного разведения, либо in vitro, либо in vivo, предпочтительно, с последующим учетом с использованием статистических методик распределения Пуассона или оценки частоты предварительно определенных характерных явлений, таких как способность образовывать опухоли in vivo или отсутствие таковой. Тогда как такой анализ предельного разведения предусматривает предпочтительные способы расчета снижения частоты клеток, вызывающих развитие опухоли, также можно использовать другие, менее трудоемкие способы для эффективного определения желаемых значений, хотя и слегка менее точные, которые являются полностью совместимыми с изложенным в настоящем документе. Таким образом, как будет понятно специалистам в данной области техники, также можно определить снижение значений частоты посредством хорошо известной проточной цитометрии или иммуногистохимических методов. Что касается всех вышеупомянутых способов, см., например, Dylla et al. 2008, PMID: 18560594 & Hoey et al. 2009, PMID: 19664991; каждая из которых включена в данный документ при помощи ссылки во всей полноте и, в частности, применительно к раскрытым способам.
Что касается анализа в предельном разведении, in vitro учет частоты клеток, вызывающих развитие опухоли, можно осуществлять путем осаждения либо фракционированных, либо нефракционированных человеческих опухолевых клеток (например, из обработанных и необработанных опухолей, соответственно) в условиях роста in vitro, которые способствуют образованию колоний. Таким образом, клетки, образующие колонии, можно учесть путем простого подсчета и характеристики колоний или при помощи анализа, заключающегося, например, в осаждении человеческих опухолевых клеток в планшетах при серийных разведениях и оценке каждой лунки либо как положительной, либо как отрицательной по образованию колоний по меньшей мере через 10 дней после посева. In vivo эксперименты или анализы предельного разведения, которые, как правило, являются более аккуратными в отношении их способности определять частоту клеток, вызывающих развитие опухоли, охватывают трансплантацию опухолевых клеток человека либо из необработанных контрольных, либо из обработанных популяций, например, мышам с ослабленным иммунитетом, при серийных разведениях, а затем учет каждой мыши, либо как положительную, либо как отрицательную по образованию опухоли по меньшей мере через 60 дней после трансплантации. Получение значений частоты клеток при помощи анализа в предельном разведении in vitro или in vivo, предпочтительно, осуществляют путем применения статистических методик распределения Пуассона при известной частоте положительных и отрицательных событий, таким образом, получают частоту событий, соответствующих определению положительного события; в этом случае, образованию колонии или опухоли, соответственно.
Что касается способов, совместимых с настоящим изобретением, которые можно применять для подсчета частоты клеток, вызывающих развитие опухоли, наиболее общепринятые способы предусматривают методики количественного определения при помощи проточной цитометрии и методики иммуногистохимического окрашивания. Хотя они не являются настолько точными, как методики анализа в предельном разведении, описанные непосредственно выше, эти методики являются намного менее трудоемкими и обеспечивают достоверные значения за относительно короткий временной интервал. Таким образом, следует понимать, что специалист в данной области техники может применять определение профиля маркеров клеточной поверхности с помощью проточной цитометрии с использованием одного или нескольких антител или реагентов, которые связываются с принятыми в данной области техники белками клеточной поверхности, известными для обогащения клеток, вызывающих развитие опухоли (например, потенциально совместимые маркеры, изложенные в заявке РСТ 2012/031280, которая включена в данный документ во всей своей полноте), и, таким образом, измерять уровни TIC из различных образцов. Согласно еще одному совместимому способу специалист в данной области техники может учитывать частоту TIC in situ (например, в тканевом срезе) при помощи иммуногистохимии с использованием одного или нескольких антител или реагентов, которые способны связываться с белками клеточной поверхности, которые, как предполагается, демаркируют эти клетки.
Специалистам в данной области будет понятно, что многочисленные маркеры (или их отсутствие) были ассоциированы с различными популяциями раковых стволовых клеток и применялись для выделения или характеристики субпопуляций опухолевых клеток. В связи с этим, иллюстративные маркеры раковых стволовых клеток включают OCT4, Nanog, STAT3, EPCAM, CD24, CD34, NB84, TrkA, GD2, CD133, CD20, CD56, CD29, B7H3, CD46, трансферриновый рецептор, JAM3, карбоксипептидазу M, ADAM9, онкостатин M, Lgr5, Lgr6, CD324, CD325, нестин, Sox1, Bmi-1, eed, easyh1, easyh2, mf2, yy1, smarcA3, smarckA5, smarcD3, smarcE1, mllt3, FZD1, FZD2, FZD3, FZD4, FZD6, FZD7, FZD8, FZD9, FZD10, WNT2, WNT2B, WNT3, WNT5A, WNT10B, WNT16, AXIN1, BCL9, MYC, (TCF4) SLC7A8, IL1RAP, TEM8, TMPRSS4, MUC16, GPRC5B, SLC6A14, SLC4A11, PPAP2C, CAV1, CAV2, PTPN3, EPHA1, EPHA2, SLC1A1, CX3CL1, ADORA2A, MPZL1, FLJ10052, C4.4A, EDG3, RARRES1, TMEPAI, PTS, CEACAM6, NID2, STEAP, ABCA3, CRIM1, IL1R1, OPN3, DAF, MUC1, MCP, CPD, NMA, ADAM9, GJA1, SLC19A2, ABCA1, PCDH7, ADCY9, SLC39A1, NPC1, ENPP1, N33, GPNMB, LY6E, CELSR1, LRP3, C20orf52, TMEPAI, FLVCR, PCDHA10, GPR54, TGFBR3, SEMA4B, PCDHB2, ABCG2, CD166, AFP, BMP-4, β-катенин, CD2, CD3, CD9, CD14, CD31, CD38, CD44, CD45, CD74, CD90, CXCR4, декорин, EGFR, CD105, CD64, CD16, CD16a, CD16b, GLI1, GLI2, CD49b и CD49f. См., например, Schulenburg et al., 2010, PMID: 20185329, патентный документ США № 7632678 и патентные документы США №№ 2007/0292414, 2008/0175870, 2010/0275280, 2010/0162416 и 2011/0020221, каждый из которых включен в данный документ при помощи ссылки. Кроме того, будет понятно, что каждый из вышеупомянутых маркеров также можно использовать как вторичный целевой антиген в контексте биспецифических или мультиспецифических антител по настоящему изобретению.
Подобным образом, неограничивающие примеры фенотипов клеточной поверхности, ассоциированных с раковыми стволовыми клетками определенных типов опухолей, включают в себя CD44hiCD24low, ALDH+, CD133+, CD123+, CD34+CD38−, CD44+CD24−, CD46hiCD324+CD66c−, CD133+CD34+CD10−CD19−, CD138−CD34−CD19+, CD133+RC2+, CD44+α2 β1hiCD133+, CD44+CD24+ESA+, CD271+, ABCB5+, а также другие фенотипы поверхности раковых стволовых клеток, которые известны из уровня техники. См., например, Schulenburg et al., 2010, выше, Visvader et al., 2008, PMID: 18784658, патентный документ США № 2008/0138313, каждый из которых включен в данный документ во всей своей полноте при помощи ссылки. Специалистам в данной области будет понятно, что маркерные фенотипы, такие как проиллюстрированные непосредственно выше, могут быть использованы в сочетании со стандартными анализами при помощи проточной цитометрии и методик сортировки клеток для характеристики, выделения, очистки или обогащения клеток TIC и/или TPC или клеточных популяций для последующего анализа. Представляющие интерес для настоящего изобретения CD46, CD324 и необязательно CD66c экспрессируются либо при высоком уровне, либо гетерогенно на поверхности многих человеческих опухолевых клеток рака ободочной и прямой кишки (“CR”), рака молочной железы (“BR”), рака легкого, не относящегося к мелкоклеточному (NSCLC), мелкоклеточного рака легкого (SCLC), рака поджелудочной железы (“PA”), меланомы (“Mel”), рака яичника (“OV”) и рака головы и шеи (“HN”), независимо от того, были ли анализируемые образцы опухоли первичными образцами от пациентов с опухолью или опухолями из NTX, полученными от пациентов.
С использованием любого из вышеупомянутых способов и выбранных маркеров, известных из уровня техники, можно количественно оценивать снижение частоты TIC (или TPC среди них), обеспеченной раскрытыми SEZ6 модуляторами (в том числе конъюгированными с цитотоксическими средствами) согласно изложенному в настоящем документе. В некоторых случаях соединения по настоящему изобретению могут снижать частоту TIC или TPC (с помощью ряда отмеченных выше механизмов, в том числе устранения, индуцированной дифференцировки, нарушения ниши, "сайленсинга" и т.п.) на 10%, 15%, 20%, 25%, 30% или даже на 35%. В других вариантах осуществления снижение частоты TIC или TPC может составлять приблизительно 40%, 45%, 50%, 55%, 60% или 65%. В определенных вариантах осуществления раскрытые соединения могут снижать частоту TIC или TPC на 70%, 75%, 80%, 85%, 90% или даже 95%. Конечно, будет понятно, что какое-либо снижение частоты TIC или TPC, вероятно, приводит в результате к соответствующему снижению онкогенности, персистентности, повторного проявления и агрессивности неоплазии.
IV. SEZ6 модуляторы
В любом случае, настоящее изобретение направлено на применение SEZ6 модуляторов, в том числе антагонистов SEZ6, для диагностики, терагностики, лечения и/или профилактики различных расстройств, в том числе любых SEZ6-ассоциированных злокачественных новообразований. Раскрытые модуляторы можно применять отдельно или в сочетании с широким спектром противораковых соединений, таких как химиотерапевтические или иммунотерапевтические средства (например, терапевтические антитела) или модификаторы биологического ответа. В других выбранных вариантах осуществления два или более дискретных SEZ6 модуляторов можно применять в комбинации для обеспечения усиленных антинеопластических эффектов или можно применять для получения мультиспецифических конструкций.
В определенных вариантах осуществления SEZ6 модуляторы по настоящему изобретению будут включать нуклеотиды, олигонуклеотиды, полинуклеотиды, пептиды или полипептиды. Более конкретно, иллюстративные модуляторы по настоящему изобретению могут включать антитела и их антигенсвязывающие фрагменты или производные, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, антисмысловые конструкции, siRNA, miRNA, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, регуляторные последовательности транскрипции и трансляции и т.п. В определенных вариантах осуществления модуляторы будут включать растворимый SEZ6 (sSEZ6) или его форму, вариант, производное или фрагмент, в том числе, например, слитые конструкции на основе SEZ6 (например, SEZ6-Fc, SEZ6-нацеливающая часть и т.д.) или конъюгаты на основе SEZ6 (например, SEZ6-PEG, SEZ6-цитотоксическое средство, SEZ6-brm и т.д.). Также следует отметить, что в других вариантах осуществления SEZ6 модуляторы включают антитела или их иммунореакционноспособные фрагменты или производные. В особенно предпочтительных вариантах осуществления модуляторы по настоящему изобретению будут включать нейтрализующие антитела или их производные или фрагменты. В других вариантах осуществления SEZ6 модуляторы могут включать интернализирующие антитела или их фрагменты. В других вариантах осуществления SEZ6 модуляторы могут включать истощающие антитела или их фрагменты. Более того, что касается вышеупомянутых слитых конструкций, эти модуляторы на основе антитела могут быть конъюгированы, связаны или иным образом ассоциированы с выбранными цитотоксическими средствами, полимерами, модификаторами биологического ответа (BRM) или т.п. для обеспечения иммунотерапевтических средств направленного действия с различными (и необязательно несколькими) механизмами действия. Как упоминалось выше, такими антителами могут быть антителами ко всем SEZ6, которые ассоциируются с двумя или более членами семейства SEZ6 (например, SEZ6 и SEZ6L, как показано на фиг. 11A), или иммуноспецифичные антитела, которые селективно реагируют с одной или обеими изоформами SEZ6. В других предпочтительных вариантах осуществления модуляторы могут действовать на генном уровне и могут предусматривать соединения, такие как антисмысловые конструкции, siRNA, miRNA и т.п., которые взаимодействуют или ассоциируются с генотипическим компонентом детерминанты SEZ6.
Кроме того, следует понимать, что раскрытые SEZ6 модуляторы могут приводить к сокращению количества, "сайленсингу", нейтрализации, устранению или ингибированию роста, размножения или выживания опухолевых клеток, в том числе TPC, и/или ассоциированной неоплазии посредством ряда механизмов, в том числе агонистического воздействия или антагонистического воздействия, на выбранные пути или устранения специфических клеток в зависимости, например, от формы SEZ6 модулятора, любой ассоциированной нагрузки или дозирования и способа доставки. Таким образом, в то время как предпочтительные варианты осуществления, раскрытые в данном документе, направлены на ингибирование или "сайленсинг" специфических субпопуляций опухолевых клеток, например, клеток, обеспечивающих поддержание опухоли, или на модуляторы, которые взаимодействуют со специфическим эпитопом или доменом, следует подчеркнуть, что эти варианты осуществления являются только иллюстративными и не являются ограничивающими в каком-либо смысле. Скорее, как изложено в прилагаемой формуле изобретения, настоящее изобретение в широком смысле направлено на SEZ6 модуляторы и их применение при лечении, контроле течения или профилактике различных SEZ6-ассоциированных расстройств, независимо от любого конкретного механизма, участка связывания или целевой популяции опухолевых клеток.
Независимо от выбранной формы модулятора, следует понимать, что выбранное соединение может быть антагонистическим по своей природе. Используемое в данном документе выражение “антагонист” относится к молекуле, способной к нейтрализации, блокированию, ингибированию, уничтожению, снижению или препятствованию активностям конкретной или определенной мишени (например, SEZ6), в том числе связыванию рецепторов с лигандами или взаимодействию ферментов с субстратами. В связи с этим следует понимать, что антагонисты SEZ6 по настоящему изобретению могут предусматривать любой лиганд, полипептид, пептид, слитый белок, антитело или его иммунологически активный фрагмент или производное, которое распознает, вступает в реакцию, связывается, объединяется, конкурирует, ассоциирует или иным образом взаимодействует с белком SEZ6 или его фрагментом и приводит к устранению, "сайленсингу", снижению, ингибированию, затруднению, сдерживанию или контролю роста клеток, вызывающих развитие опухоли, или других неопластических клеток, в том числе клеток основного объема опухоли или клеток NTG. Соответствующие антагонисты могут дополнительно включать низкомолекулярные ингибиторы, аптамеры, антисмысловые конструкции, siRNA, miRNA и т.п., молекулы рецептора или лиганда и их производные, которые распознают или ассоциируют с генотипической или фенотипической детерминантой SEZ6, что, таким образом, приводит к изменению паттернов экспрессии или предотвращению ее связывания или взаимодействия с субстратом, рецептором или лигандом.
Используемое в данном документе выражение “антагонист” относится к молекуле, способной к нейтрализации, блокированию, ингибированию, уничтожению, снижению или препятствованию активностям конкретного или определенного белка, в том числе к связыванию рецепторов с лигандами или взаимодействию ферментов с субстратами. Более конкретно, антагонисты по настоящему изобретению могут включать антитела и их антигенсвязывающие фрагменты или производные, белки, пептиды, гликопротеины, гликопептиды, гликолипиды, полисахариды, олигосахариды, нуклеиновые кислоты, антисмысловые конструкции, siRNA, miRNA, биоорганические молекулы, пептидомиметики, фармакологические средства и их метаболиты, регуляторные последовательности транскрипции и трансляции и т.п. Антагонисты также могут включать низкомолекулярные ингибиторы, слитые белки, рецепторные молекулы и производные, которые специфично связываются с белком, тем самым предотвращая его связывание с его субстратом-мишенью, антагонистические варианты белка, антисмысловые молекулы, направленные на белок, аптамеры РНК и рибозимы против белка.
Используемые в данном документе и применяемые к двум или более молекулам или соединениям, выражения “распознает” или “ассоциируется” будет подразумевать реакцию, связывание, специфическое связывание, комбинацию, взаимодействие, соединение, связь, объединение, слияние, воссоединение или присоединение, ковалентное или нековалентное, молекул, где одна молекула оказывает влияние на другую молекулу.
Более того, как продемонстрировано в примерах в данном документе (например, см. фиг. 11), некоторые модуляторы SEZ6 человека в некоторых случаях могут перекрестно реагировать с SEZ6 из видов, отличающихся от человека (например, крысы или яванского макака). В других случаях иллюстративные модуляторы могут быть специфичными в отношении одной или нескольких изоформ SEZ6 человека и не будут характеризоваться способностью перекрестно реагировать с ортологами SEZ6 из других видов. Разумеется, в сочетании с изложенным в данном документе эти варианты осуществления могут предусматривать антитела ко всем SEZ6, которые ассоциируют с двумя или более членами семейства SEZ6 из одного вида, или антитела, которые ассоциируются с единственным SEZ6.
В любом случае и как будет более подробно обсуждаться ниже, специалисты в данной области техники поймут, что раскрытые модуляторы можно применять в конъюгированной или неконъюгированной форме. Другими словами, модулятор может быть ассоциирован или конъюгирован (например, ковалентно или нековалентно) с фармацевтически активными соединениями, модификаторами биологического ответа, противораковыми средствами, цитотоксическими или цитостатическими средствами, частями, обеспечивающими диагностику, или биологически совместимыми модификаторами. В связи с этим следует понимать, что эти конъюгаты могут содержать пептиды, полипептиды, белки, слитые белки, молекулы нуклеиновой кислоты, малые молекулы, миметики, синтетические лекарственные средства, неорганические молекулы, органические молекулы и радиоактивные изотопы. Более того, как указано в данном документе, выбранный конъюгат может быть ковалентно или нековалентно связан с SEZ6 модулятором при различных молярных соотношениях в зависимости, по меньшей мере частично, от способа, применяемого для осуществления конъюгирования.
V. Получение и обеспечение модуляторов
A. Модуляторы на основе антитела
1. Обзор
Как упоминалось ранее, особенно предпочтительные варианты осуществления в соответствии с настоящим изобретением предусматривают SEZ6 модуляторы в форме антител, которые преимущественно ассоциируются с одной или несколькими изоформами SEZ6 (и необязательно могут перекрестно реагировать с другими членами семейства SEZ6). Специалисты в данной области техники оценят хорошо разработанную базу знаний по антителам, такую как изложенную, например, в Abbas et al., Cellular and Molecular Immunology, 6th ed., W.B. Saunders Company (2010), или Murphey et al., Janeway’s Immunobiology, 8th ed., Garland Science (2011), каждая из которых включена в данный документ при помощи ссылки во всей своей полноте.
Выражение "антитело" предназначено охватывать поликлональные антитела, мультиклональные антитела, моноклональные антитела, химерные антитела, гуманизированные и приматизированные антитела, человеческие антитела, рекомбинантно полученные антитела, интраантитела, мультиспецифические антитела, биспецифические антитела, моновалентные антитела, мультивалентные антитела, антиидиотипические антитела, синтетические антитела, в том числе мутеины и их варианты; фрагменты антител, такие как Fab-фрагменты, F(ab')-фрагменты, одноцепочечные FvFc, одноцепочечные Fv; и их производные, в том числе Fc-слияния и другие модификации, а также любую другую иммунологически активную молекулу, при условии что они проявляют желаемую биологическую активность (т.e. ассоциацию или связывание с антигеном). Более того, выражение предусматривает все классы антител (т.e. IgA, IgD, IgE, IgG и IgM) и все изотипы (т.e. IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2), а также их варианты, если в контексте не указано иное. Константные домены тяжелой цепи, которые соответствуют различным классам антител, обозначаются соответствующей строчной греческой буквой α, δ, ε, γ и μ, соответственно. Легкие цепи антител от каких-либо видов позвоночных могут быть отнесены к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов.
В то время как все такие антитела попадают в объем настоящего изобретения, предпочтительные варианты осуществления, предусматривающие IgG класс иммуноглобулина, будут обсуждаться подробно в данном документе исключительно в целях иллюстрации. Будет понятно, что такое раскрытие, однако, всего лишь демонстрирует иллюстративные композиции и способы осуществления настоящего изобретения и не ограничивает каким-либо образом объем настоящего изобретения или приложенную формулу изобретения.
Хорошо известно, что вариабельные домены частей как легкой (VL), так и тяжелой (VH) цепи определяют распознавание антигена и специфичность, а константные домены легкой цепи (CL) и тяжелой цепи (CH1, CH2 или CH3) обеспечивают и регулируют важные биологические свойства, такие как секреция, трансплацентарная мобильность, период полувыведения из кровотока, связывание комплемента и т.п.
"Вариабельная" область содержит гипервариабельные участки, которые обнаруживают себя в трех сегментах, обычно называемых определяющими комплементарность областями (CDR), в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов, фланкирующих CDR, называются каркасными областями (FR). Например, у встречающихся в природе антител в форме мономерного иммуноглобулина G (IgG) шесть CDR, присутствующих на каждом плече “Y”, представляют собой короткие, несмежные последовательности аминокислот, которые специально располагаются для образования связывающего антиген сайта, поскольку антитело принимает свою трехмерную конфигурацию в водной среде. Таким образом, каждое встречающееся в природе антитело IgG содержит два идентичных сайта связывания, проксимальных по отношению к амино-концу каждого плеча Y.
Будет понятно, что специалист в данной области техники сможет легко идентифицировать положение CDR с использованием стандартных методик. Также специалистам в данной области техники известна система нумерации, описанная в Kabat et al. (1991, NIH Publication 91-3242, National Technical Information Service, Springfield, Va.). При этом Kabat et al. определяют систему нумерации для последовательностей вариабельного домена, которая является применимой для любого антитела. Специалист в данной области техники сможет однозначно применить эту систему "нумерации по Kabat" к любой последовательности вариабельного домена без использования каких-либо экспериментальных данных кроме самой последовательности. Если не указано иное, ссылки на нумерацию конкретных положений аминокислотных остатков в антителе согласуются с системой нумерации по Kabat.
Таким образом, согласно Kabat в VH остатки 31-35 содержат CDR1, остатки 50-65 составляют CDR2, а 95-102 содержат CDR3, тогда как в VL остатки 24-34 представляют собой CDR1, 50-56 содержат CDR2, а 89-97 составляют CDR3. Для контекста в VH FR1 соответствует домену вариабельной области, охватывающему аминокислоты 1-30; FR2 соответствует домену вариабельной области, охватывающему аминокислоты 36-49; FR3 соответствует домену вариабельной области, охватывающему аминокислоты 66-94, и FR4 соответствует домену вариабельной области от аминокислоты 103 до конца вариабельной области. FR для легкой цепи подобным образом отделяются каждой из CDR вариабельной области легкой цепи.
Следует отметить, что CDR варьируют в значительной степени от антитела к антителу (и по определению не будут проявлять гомологию с консенсусными последовательностями по Kabat). Кроме того, идентичность определенных отдельных остатков под любым приведенным по Kabat номером сайта может варьировать от цепи антитела против цепи антитела из-за межвидовой или аллельной дивергенции. Альтернативная нумерация изложена в Chothia et al., J. Mol. Biol. 196:901-917 (1987), и в MacCallum et al., J. Mol. Biol. 262:732-745 (1996), хотя по Kabat границы FR отделяются соответствующими концами CDR, как описано выше. См. также Chothia et al., Nature 342, pp. 877-883 (1989), и S. Dubel, ed., Handbook of Therapeutic Antibodies, 3rd ed., WILEY-VCH Verlag GmbH and Co. (2007), где определения включают перекрывание или подмножества аминокислотных остатков при сравнении их между собой. Каждая из вышеупомянутых ссылок включена в данный документ при помощи ссылки во всей своей полноте, и аминокислотные остатки, которые содержат области связывания или CDR, определенные каждой из вышеупомянутых ссылок, приведены для сравнения ниже.
2Нумерация остатков соответствует нумерации Chothia et al., выше.
3Нумерация остатков соответствует нумерации MacCallum et al., выше.
В контексте настоящего изобретения будет понятно, что любые из раскрытых CDR легкой и тяжелой цепи, происходящих от аминокислотных последовательностей вариабельной области мыши, изложенных на фиг. 10A или фиг. 10B, могут быть объединены или перегруппированы для обеспечения оптимизированных антител против SEZ6 (например, гуманизированных, CDR-привитых или химерных к hSEZ6) согласно существующим методикам. Другими словами, одна или несколько из CDR, происходящих от аминокислотных последовательностей вариабельной области легкой цепи, изложенных на фиг. 10A (SEQ ID NO:20-168, четные числа) или от аминокислотных последовательностей вариабельной области тяжелой цепи, изложенных на фиг. 10B (SEQ ID NO:21-169, нечетные номера), могут быть включены в SEZ6 модулятор и в особенно предпочтительных вариантах осуществления в CDR-привитое или гуманизированное антитело, которое иммуноспецифично ассоциируется с одной или несколькими изоформами SEZ6. Примеры аминокислотных последовательностей вариабельной области легкой (SEQ ID NO:170-192, четные числа) и тяжелой (SEQ ID NO:171-193, нечетные числа и 194-199) цепи таких гуманизированных модуляторов также изложены на фиг. 10A и 10B.
Следует отметить, что hSC17.200vL1 (SEQ ID NO:192) представляет собой вариант гуманизированной конструкции легкой цепи hSC17.200 (SEQ ID NO:190), hSC17.155vH1 - vH6 (SEQ ID NO:193-198) представляют собой варианты конструкции тяжелой цепи hSC.155 (SEQ ID NO:184), которая происходит из SC17.90 (SEQ ID NO:127), и что hSC161vH1 (SEQ ID NO:199) представляет собой вариант конструкции тяжелой цепи hSC17.161 (SEQ ID NO:189). Как будет обсуждаться более подробно ниже, эти варианты конструировали и тестировали для оптимизации одного или нескольких биохимических свойств исходного антитела.
Совместно эти новые аминокислотные последовательности описывают семьдесят пять мышиных и одиннадцать гуманизированных иллюстративных модуляторов (вместе с сообщенными вариантами) в соответствии с настоящим изобретением. Более того, соответствующие аминокислотные последовательности каждого из семидесяти пяти иллюстративных мышиных модуляторов и одиннадцати гуманизированных модуляторов и варианты, изложенные на фиг. 10A и 10B, включены в перечень последовательностей настоящей заявки (SEQ ID NO:220-399).
На фиг. 10A и 10B аннотированные CDR определены с использованием нумерации по Chothia. Однако, как обсуждается в данном документе и продемонстрировано в примере 8 ниже, специалист в данной области техники сможет легко определить, идентифицировать, получить и/или пронумеровать CDR, как определено по Kabat et al., Chothia et al. или MacCallum et al., для каждой соответствующей последовательности тяжелой и легкой цепи, приведенной на фиг. 10A или фиг. 10B. Соответственно, каждая из предметных CDR и антитела, содержащие CDR, определенные с помощью всех этих нумераций, однозначно включены в объем настоящего изобретения. Более широко, выражения “аминокислотный остаток CDR вариабельной области” или проще “CDR” включает аминокислоты в CDR, идентифицированные с использованием любого способа, основанного на последовательности или структуре, как изложено выше.
2. Получение модулятора на основе антитела
a. Поликлональные антитела
Получение поликлональных антител у различных животных-хозяев, в том числе кроликов, мышей, крыс и т.д. хорошо известно из уровня техники. В некоторых вариантах осуществления сыворотку, содержащую поликлональные антитела против SEZ6, получают путем отбора крови или умерщвления животного. Сыворотку можно применять для исследовательских целей в форме, полученной от животного, или, в альтернативном случае, антитела против SEZ6 могут быть частично или полностью очищены с получением фракций иммуноглобулина или препаратов гомогенных антител.
Вкратце, выбранное животное иммунизируют иммуногеном SEZ6 (например, растворимым SEZ6 или sSEZ6), который, например, может включать выбранные изоформы, домены и/или пептиды, или живые клетки или препараты клеток, экспрессирующие SEZ6 или их иммунореактивные фрагменты. Известные из уровня техники адъюванты, которые можно применять для увеличения иммунного ответа, в зависимости от инокулированных видов, включают без ограничения адъювант Фрейнда (полный и неполный), минеральные гели, например, гидроксид алюминия, поверхностно-активные вещества, например, лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, разновидности гемоцианина фиссуреллы, динитрофенол и потенциально пригодные адъюванты для человека, например, BCG (бациллу Кальмета-Герена) и Corynebacterium parvum. Эти адъюванты могут защищать антиген от быстрого диспергирования путем его изолирования в местном депо, или они могут содержать вещества, которые стимулируют у хозяина секрецию факторов, которые являются хемотаксическими для макрофагов и других компонентов иммунной системы. Предпочтительно, схема иммунизации будет предусматривать два или более введений выбранного иммуногена, разнесенных в течение заранее заданного периода времени.
Аминокислотную последовательность белка SEZ6, как показано на фиг. 1C или 1D, можно анализировать для того, чтобы выбрать специфические области белка SEZ6 для получения антител. Например, анализы с определением гидрофобности и гидрофильности аминокислотной последовательности SEZ6 применяют для обнаружения гидрофильных областей в структуре SEZ6. Области белка SEZ6, которые характеризуются иммуногенной структурой, а также другие области и домены, можно легко обнаружить с применением различных других способов, известных в уровне техники, например, анализ Чоу-Фасмана, Гарнье-Робсона, Кайт-Дулиттла, Эйзенберга, Карплюса-Шульца или Джеймсона-Вольфа. Средние профили жесткости можно получить с применением способа из Bhaskaran R., Ponnuswamy P. K., 1988, Int. J. Pept. Protein Res. 32:242-255. Профили бета-изгибов можно получить с применением способа из Deleage, G., Roux B., 1987, Protein Engineering 1:289-294. Таким образом, каждая область, домен или мотив SEZ6, обнаруженный при помощи этих программ или способов, находится в пределах объема настоящего изобретения, и их можно выделить или сконструировать для получения иммуногенов, обеспечивающих получение модуляторов, имеющих требуемые свойства. Предпочтительные способы получения антител против SEZ6 далее проиллюстрированы при помощи примеров, предоставленных в данном документе. Способы получения белка или полипептида для применения в качестве иммуногена хорошо известны из уровня техники. Также хорошо известными из уровня техники являются способы получения иммуногенных конъюгатов белка с носителем, таким как BSA, KLH или другой белок-носитель. В некоторых случаях применяют непосредственное конъюгирование, например, с применением карбодиимидных реагентов; в других случаях эффективными являются связывающие реагенты. Введение иммуногена SEZ6 часто осуществляют путем инъекции на протяжении подходящего периода времени и с применением подходящего адъюванта, как предполагается в уровне техники. В ходе выполнения схемы иммунизации можно отбирать титры антител, как описано в примерах ниже, с определением достаточности образования антител.
b. Моноклональные антитела
В дополнение, настоящее изобретение предполагает применение моноклональных антител. Как известно из уровня техники, выражение "моноклональное антитело" (или mAb) относится к антителу, полученному из популяции фактически гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных мутаций (например, мутаций встречающихся в природе), которые могут присутствовать в незначительных количествах. В определенных вариантах осуществления, такое моноклональное антитело предусматривает антитело, содержащее полипептидную последовательность, которая связывается или ассоциирует с антигеном, причем антигенсвязывающая полипептидная последовательность была получена при помощи способа, который включает выбор одной целевой связывающей полипептидной последовательности из множества полипептидных последовательностей.
В более общем смысле и как проиллюстрировано в примере 6 в данном документе, моноклональные антитела можно получать при помощи широкого спектра методик, известных из уровня техники, в том числе гибридомы, методик рекомбинантных ДНК, технологий фагового дисплея, трансгенных животных (например, XenoMouse®) или их определенной комбинации. Например, моноклональные антитела можно получать при помощи гибридомы и биохимических и генноинженерных методик, принятых в данной области техники, таких как более подробно описанные в An, Zhigiang (ed.) Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley and Sons, 1st ed. 2009; Shire et al. (eds.) Current Trends in Monoclonal Antibody Development and Manufacturing, Springer Science+Business Media LLC, 1st ed. 2010; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. 1988; Hammerling, et al., в Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), каждая из которых включена в данный документ при помощи ссылки во всей своей полноте. Следует понимать, что выбранная связывающая последовательность далее может быть изменена, например, для улучшения аффинности по отношению к мишени, для гуманизации целевой связывающей последовательности, для улучшения ее образования в условиях клеточной культуры, для снижения ее иммуногенности in vivo, для создания мультиспецифического антитела и т.д., и что антитело, содержащее измененную последовательность для связывания мишени также является антителом по настоящему изобретению.
c. Химерные антитела
В другом варианте осуществления антитело по настоящему изобретению может включать химерные антитела, полученные из ковалентно соединенных сегментов белка по меньшей мере от двух различных видов или типов антител. Как известно из уровня техники, выражение "химерные" антитела направлено на конструкции, в которых участок тяжелой и/или легкой цепи является идентичным или гомологичным соответствующим последовательностям в антителах, полученных от определенного вида или принадлежащих к определенному классу или подклассу антител, в то время как остальная часть цепи(цепей) является идентичной или гомологичной соответствующей последовательности в антителах, полученных от другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патентный документ США № 4816567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)).
В одном варианте осуществления химерное антитело в соответствии со сведениями, изложенными в данном документе, может содержать аминокислотные последовательности VH и VL мыши и константные области, полученные от человека. В других совместимых вариантах осуществления химерное антитело по настоящему изобретению может предусматривать гуманизированное антитело, описанное ниже. В другом варианте осуществления так называемое "CDR-привитое" антитело содержит одну или несколько CDR от определенных видов или принадлежащих к определенному классу или подклассу антител, в то время как остальная часть цепи(цепей) антитела является идентичной или гомологичной соответствующей последовательности в антителах, полученных от другого вида или принадлежащих к другому классу или подклассу антител. Для применения у человека выбранные CDR грызунов могут быть привиты на человеческое антитело с заменой одной или нескольких встречающихся в природе вариабельных областей или CDR человеческого антитела. Эти конструкции, как правило, имеют преимущества, заключающиеся в обеспечении полностью модуляторных функций (например, CDC (комплементзависимая цитотоксичность), ADCC (антителозависимая клеточноопосредованная цитотоксичность) и т.д.), при этом со снижением нежелательных иммунных ответов на антитело у индивида.
d. Гуманизированные антитела
"Гуманизированное" антитело является подобным CDR-привитому антителу. Используемые в данном документе "гуманизированные" формы антител, не относящихся к человеческим (например, мышиные) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из одного или нескольких иммуноглобулинов, не относящихся к человеческим. В одном варианте осуществления гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное или акцепторное антитело), в котором остатки из CDR реципиента заменены остатками из CDR видов, отличающихся от человека (донорное антитело), таких как мышь, крыса, кролик или примат, отличающийся от человека, которое имеет требуемую специфичность, аффинность и/или способность. В определенных предпочтительных вариантах осуществления остатки в одной или нескольких FR в вариабельном домене человеческого иммуноглобулина заменены соответствующими остатками, отличающимися от человеческих, из донорного антитела с тем, чтобы способствовать сохранению соответствующей пространственной конфигурации привитых CDR и тем самым улучшать аффинность. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорном антителе, например, для дополнительного улучшения свойств антитела.
CDR-привитие и гуманизированные антитела описаны, например, в патентах США №№ 6180370 и 5693762. Гуманизированное антитело необязательно также может содержать по меньшей мере участок Fc иммуноглобулина, обычно человеческого иммуноглобулина. Что касается дополнительных подробностей, см., например, Jones et al., Nature 321:522-525 (1986) и патенты США №№ 6982321 и 7087409. Другой способ, который называется "гуманизирование", описан, например, в патентном документе США № 2005/0008625. Дополнительно, антитело, отличающиеся от человеческого, также можно модифицировать посредством специфической делеции человеческих T-клеточных эпитопов или "деиммунизации" при помощи способов, раскрытых в WO 98/52976 и WO 00/34317. Каждая из вышеупомянутых ссылок включена в данный документ во всей своей полноте.
Гуманизированные антитела также могут быть сконструированы при помощи общепринятых методик молекулярной биологии, таких как выделение, манипуляция и экспрессия последовательностей нуклеиновой кислоты, которые кодируют все или часть вариабельных областей иммуноглобулина по меньшей мере из одной тяжелой или легкой цепи. В дополнение к источникам таких нуклеиновых кислот, указанным выше, доступны человеческие последовательности зародышевого типа, как раскрыто, например, в Tomlinson, I. A. et al. (1992) J. Mol. Biol. 227:776-798; Cook, G. P. et al. (1995) Immunol. Today 16: 237-242; Chothia, D. et al. (1992) J. Mol. Biol. 227:799-817; и Tomlinson et al. (1995) EMBO J 14:4628-4638. Каталог V-BASE (VBASE2 - Retter et al., Nucleic Acid Res. 33; 671-674, 2005) предоставляет всеобъемлющий каталог последовательностей вариабельных областей человеческого иммуноглобулина (составленный Tomlinson, I. A. et al. MRC Центр белковой инженерии, Кембридж, Великобритания). Также можно применять консенсусные человеческие FR, например, описанные в патентном документе США № 6300064.
В выбранных вариантах осуществления, и как подробно описано в примере 8 ниже, по меньшей мере 60%, 65%, 70%, 75% или 80% аминокислотных остатков вариабельной области тяжелой или легкой цепи гуманизированного антитела будут соответствовать аминокислотным остаткам последовательностей реципиентной FR и CDR. В других вариантах осуществления по меньшей мере 85% или 90% остатков вариабельной области гуманизированного антитела будут соответствовать остаткам последовательностей реципиентной FR и CDR. В дополнительном предпочтительном варианте осуществления более 95% остатков вариабельной области гуманизированного антитела будут соответствовать остаткам последовательностей реципиентной FR и CDR.
e. Человеческие антитела
В другом варианте осуществления антитела могут включать полностью человеческие антитела. Выражение "человеческое антитело" относится к антителу, которое имеет аминокислотную последовательность, которая соответствует аминокислотной последовательности антитела, образуемого у человека, и/или которое было получено при помощи любой из методик для получения человеческих антител.
Человеческие антитела можно получать при помощи различных методик, известных из уровня техники. Одна методика представляет собой фаговый дисплей, при котором библиотеку (предпочтительно, человеческих) антител синтезируют на фагах, библиотеку подвергают скринингу при помощи антигена, представляющего интерес, или его антителосвязывающего участка и выделяют фаг, связывающий антиген, из которого можно получить иммунореактивные фрагменты. Способы получения и скрининга таких библиотек хорошо известны из уровня техники, и наборы для получения библиотек на фаговых дисплеях являются коммерчески доступными (например, Recombinant Phage Antibody System от Pharmacia, № в каталоге 27-9400-01 и набор для фагового дисплея SurfZAP™ от Stratagene, № в каталоге 240612). Также существуют другие способы и реактивы, которые можно применять при создании и скрининге дисплейных библиотек антител (см., например, патентный документ США № 5223409; публикации PCT №№ WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; и Barbas et al., Proc. Natl. Acad. Sci. USA 88:7978-7982 (1991)).
В одном варианте осуществления рекомбинантные человеческие антитела можно выделять при помощи скрининга рекомбинантной комбинаторной библиотеки антител, полученной как описано выше. В одном варианте осуществления библиотека представляет собой библиотеку scFv на фаговом дисплее, полученную при помощи кДНК VL и VH человека, полученных из мРНК, выделенных из B-клеток.
Антитела, полученные при помощи интактных библиотек (либо природные, либо синтетические) могут иметь умеренную аффинность (Ka приблизительно от 106 до 107 M-1), но созревание аффинности также можно имитировать in vitro при помощи конструирования и повторного отбора из вторичных библиотек, как описано в уровне техники. Например, мутацию можно внедрять случайным образом in vitro с применением склонной к ошибкам полимеразы (сообщалось в Leung et al., Technique, 1: 11-15 (1989)). Дополнительно, созревание аффинности можно осуществлять путем случайного мутирования одной или нескольких CDR, например, при помощи PCR с праймерами, содержащими случайную последовательность, перекрывающую CDR, представляющую интерес, в выбранных отдельных клонах Fv и скрининга на предмет клонов с более высокой аффинностью. В патентном документе WO 9607754 описан способ индукции мутагенеза в CDR легкой цепи иммуноглобулина для создания библиотеки генов легкой цепи. Другой эффективный подход заключается в рекомбинации доменов VH или VL, отобранных при помощи фагового дисплея, со спектром встречающихся в природе вариантов домена V, полученных от неиммунизированных доноров, и скрининге на предмет более высокой аффинности в ходе нескольких этапов повторного шаффлинга цепи, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Эта методика обеспечивает получение антител и фрагментов антител при константе диссоциации KD (koff/kon) приблизительно 10-9 M или менее.
В других вариантах осуществления можно осуществлять подобные действия с использованием библиотек, содержащих эукариотические клетки (например, дрожжи), которые экспрессируют на своей поверхности партнеры связывания. См., например, патентный документ США № 7700302 и патентный документ США № 12/404059. В одном варианте осуществления человеческое антитело выбрано из фаговой библиотеки, причем эта фаговая библиотека экспрессирует человеческие антитела (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. Proc. Natl. Acad. Sci. USA 95:6157-6162 (1998). В других вариантах осуществления человеческие партнеры связывания можно выделять из комбинаторных библиотек антител, полученных в эукариотических клетках, таких как дрожжи. См., например, патентный документ США № 7700302. Эти методики преимущественно обеспечивают скрининг больших количеств кандидатных модуляторов и предусматривают относительно легкую манипуляцию с кандидатными последовательностями (например, при помощи созревания аффинности или рекомбинантного шаффлинга).
Человеческие антитела также можно получить путем введения локусов человеческого иммуноглобулина трансгенным животным, например, мышам, у которых эндогенные гены иммуноглобулина были частично или полностью инактивированы и были введены гены человеческого иммуноглобулина. После иммунизации наблюдают образование человеческих антител, которое имеет близкое сходство с наблюдаемым у человека во всех отношениях, включая перестройку генов, сборку и спектр антител. Этот подход описан, например, в патентных документах США №№ 5545807; 5545806; 5569825; 5625126; 5633425; 5661016 и патентных документах США №№ 6075181 и 6150584 при рассмотрении технологии XenoMouse®; и Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995). В альтернативном случае, человеческое антитело можно получить при помощи иммортализации человеческих B-лимфоцитов, продуцирующих антитело, направленное против целевого антигена (такие B-лимфоциты можно получать от индивидов, страдающих от неопластического расстройства, или они могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol, 147 (1):86-95 (1991); и патентный документ США № 5750373.
3. Дополнительная обработка
Независимо от способа получения, клетки, продуцирующие модулятор (например, гибридомы, колонии дрожжей и т.д.) можно отобрать, клонировать и подвергнуть дополнительному скринингу на предмет требуемых характеристик, в том числе, например, устойчивый рост, высокий уровень продукции антител и, как более подробно обсуждается ниже, требуемых характеристик антитела. Гибридомы можно размножать in vivo в сингенных животных, в животных, у которых отсутствует иммунная система, например, "голые мыши", или в клеточной культуре in vitro. Способы отбора, клонирования и размножения гибридом и/или колоний, каждая из которых продуцирует отдельный вид антитела, хорошо известны специалисту в данной области техники.
B. Получение рекомбинантных модуляторов
1. Обзор
Если источником является усовершенствованная ДНК, кодирующая требуемые SEZ6, модуляторы могут быть легко выделены и секвенированы с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Выделенные и субклонированные клетки гибридомы (или фаг или колонии дрожжевого происхождения) могут служить предпочтительным источником такой ДНК, если модулятор представляет собой антитело. При необходимости нуклеиновая кислота далее может быть обработана, как описано в данном документе, для создания средств, в том числе слитых белков или химерных, гуманизированных, или полностью человеческих антител. Более конкретно, выделенную ДНК (которая может быть модифицирована) можно использовать для клонирования последовательностей константных и вариабельных областей для получения антител.
Соответственно, в иллюстративных вариантах осуществления антитела могут быть получены рекомбинантно с использованием обычных методик (таких как изложенные в Al-Rubeai; An, and Shire et. al. выше, и Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002)), в которых выделенные и субклонированные клетки гибридомы (или фаг или колонии дрожжевого происхождения) служат предпочтительным источником молекул нуклеиновой кислоты.
Используемое в данном документе выражение "молекула нуклеиновой кислоты" предназначено включать в себя молекулы ДНК и молекулы РНК и их искусственные варианты (например, пептидо-нуклеиновые кислоты), либо однонитевые, либо двухнитевые. Нуклеиновые кислоты могут кодировать одну или обе цепи антитела в соответствии с настоящим изобретением или его фрагмент или производное. Молекулы нуклеиновой кислоты в соответствии с настоящим изобретением также включают в себя полинуклеотиды, соответствующие для применения в качестве гибридизационных зондов, ПЦР-праймеров или праймеров для секвенирования, для идентификации, анализа, мутации или амплификации полинуклеотида, кодирующего полипептид; антисмысловые нуклеиновые кислоты для ингибирования экспрессии полинуклеотида, а также комплементарные последовательности. Нуклеиновые кислоты могут иметь любую длину. Они могут иметь длину, например, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 750, 1000, 1500, 3000, 5000 или более нуклеотидов и/или могут содержать одну или несколько дополнительных последовательностей, например, регуляторных последовательностей, и/или могут быть частью более крупной нуклеиновой кислоты, например, вектора. Следует иметь в виду, что такие последовательности нуклеиновой кислоты далее могут быть обработаны для создания модуляторов, в том числе химерных, гуманизированных или полностью человеческих антител. Более конкретно, выделенные молекулы нуклеиновой кислоты (которые могут быть модифицированы) можно использовать для клонирования последовательностей константных и вариабельных областей для получения антител, как описано в патентном документе США № 7709611.
Выражение “выделенная нуклеиновая кислота” означает, что нуклеиновую кислоту (i) амплифицировали in vitro, например, с помощью полимеразной цепной реакции (PCR), (ii) получали рекомбинантным путем при помощи клонирования, (iii) очищали, например, путем расщепления и гель-электрофоретического фракционирования, или (iv) синтезировали, например, путем химического синтеза. Выделенной нуклеиновой кислотой является нуклеиновая кислота, которая доступна для манипуляции при помощи методик рекомбинантной ДНК.
Если источник нуклеиновой кислоты, кодирующей требуемую иммунореактивную часть антитела, производят или получают с помощью технологии фагового дисплея, дрожжевой библиотеки, гибридомной технологии или синтеза, то следует понимать, что настоящее изобретение охватывает молекулы и последовательности нуклеиновой кислоты, кодирующие антитела или их антигенсвязывающие фрагменты или производные. Кроме того, настоящее изобретение относится к векторам и клеткам-хозяевам, содержащим такие молекулы нуклеиновой кислоты.
2. Гибридизация и идентичность последовательностей
Как указано, настоящее изобретение, кроме того, относится к нуклеиновым кислотам, которые гибридизируются с другими нуклеиновыми кислотами при определенных условиях гибридизации. Более конкретно, настоящее изобретение охватывает молекулы нуклеиновой кислоты, которые гибридизируются при умеренных или жестких условиях гибридизации (например, определенных ниже), с молекулами нуклеиновой кислоты в соответствии с настоящим изобретением. Способы гибридизации нуклеиновых кислот хорошо известны из уровня техники. Хорошо известно, что умеренно жесткие условия гибридизации предусматривают раствор для предварительной отмывки, содержащий 5x хлорид натрия/цитрат натрия (SSC), 0,5% SDS, 1,0 мМ EDTA (pH 8,0), буфер для гибридизации с приблизительно 50% формамидом, 6xSSC, и температуру гибридизации 55°C (или другие подобные растворы для гибридизации, например, содержащие приблизительно 50% формамида, при температуре гибридизации 42°C) и условия отмывки 60°C, в 0,5xSSC, 0,1% SDS. Для сравнения, гибридизация при очень жестких условиях гибридизации предусматривает отмывку с 6xSSC при 45°C, за которой следует одна или несколько отмывок в 0,1xSSC, 0,2% SDS при 68°C. Кроме того, специалист в данной области техники может управлять условиями гибридизации и/или отмывки для увеличения или снижения жесткости гибридизации с тем, чтобы нуклеиновые кислоты, содержащие нуклеотидные последовательности, которые по меньшей мере на 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% идентичны друг с другом, как правило, продолжали гибридизироваться друг с другом.
Настоящее изобретение также предусматривает молекулы нуклеиновой кислоты, которые “в значительной степени идентичны” описанным молекулам нуклеиновой кислоты. В одном варианте осуществления выражение в значительной степени идентичный в отношении последовательности нуклеиновой кислоты означает, как можно интерпретировать, что последовательность молекул нуклеиновой кислоты, характеризуется по меньшей мере приблизительно 65%, 70%, 75%, 80%, 85% или 90% идентичностью последовательности. В других вариантах осуществления молекулы нуклеиновой кислоты характеризуются 95% или 98% идентичностью последовательности с эталонной последовательностью нуклеиновой кислоты.
Основные параметры, которые влияют на выбор условий гибридизации, и руководство для разработки подходящих условий изложены, например, в Sambrook, Fritsch, and Maniatis (1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., chapters 9 and 11; и Current Protocols in Molecular Biology, 1995, Ausubel et al., eds., John Wiley & Sons, Inc., sections 2.10 and 6.3-6.4), и могут быть легко определены специалистами в данной области техники исходя из, например, длины и/или нуклеотидного состава нуклеиновой кислоты.
Сходство последовательностей для полипептидов, которое также называют идентичностью последовательностей, обычно измеряют при помощи программного обеспечения для анализа последовательностей. Программное обеспечение для анализа белков находит сходные последовательности при помощи мер сходства, заданных применительно к различным заменам, делециям и другим модификациям, в том числе консервативным аминокислотным заменам. Например, инструмент для анализа последовательностей GCG (Accelrys Software Inc.) содержит программы, такие как “GAP” и “BEST-FIT”, которые можно применять с параметрами по умолчанию для определения гомологии последовательности или идентичности последовательности между близкородственными полипептидами, например, гомологичными полипептидами от различных видов организмов, или между белком дикого типа и его мутеином. (См., например, GCG версии 6.1 или Durbin et. Al., Biological Sequence Analysis: Probabilistic models of proteins and nucleic acids., Cambridge Press (1998)).
Полипептидные последовательности также можно сравнивать при помощи FASTA с применением параметров по умолчанию или рекомендуемых параметров, программы в GCG версии 6.1. FASTA (например, FASTA2 и FASTA3) предоставляет выравнивания и процентную идентичность последовательности областей наилучшего перекрывания между запрашиваемой и найденной последовательностями (Pearson (2000) выше). Другим предпочтительным алгоритмом для сравнения последовательности настоящего изобретения с базой данных, содержащей большое количество последовательностей от различных организмов, является компьютерная программа BLAST, в особенности blastp или tblastn, с применением параметров по умолчанию. См., например, Altschul et al. (1990) J. Mol. Biol. 215: 403 410, и Altschul et al. (1997) Nucleic Acids Res. 25:3389 402, каждая из которых включена в данный документ при помощи ссылки.
В связи с этим настоящее изобретение также предусматривает молекулы нуклеиновой кислоты, которые кодируют полипептиды, которые являются "в значительной степени идентичными" по отношению к полипептидным последовательностям вариабельной области антитела (например, или к донорной вариабельной области легкой или тяжелой цепи, к акцепторной вариабельной области легкой или тяжелой цепи, или к полученной гуманизированной конструкции). Применительно к таким полипептидам, выражение “значительная идентичность” или “в значительной степени идентичный” означает, что две пептидные последовательности, в случае оптимального выравнивания, например, при помощи программ GAP или BEST-FIT с применением штрафа за открытие гэпа по умолчанию, имеют по меньшей мере 60% или 65% идентичность последовательности, предпочтительно, по меньшей мере 70%, 75%, 80%, 85% или 90% идентичность последовательности, даже более предпочтительно, по меньшей мере 93%, 95%, 98% или 99% идентичность последовательности. Предпочтительно, положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. “Консервативная аминокислотная замена” является заменой, при которой аминокислотный остаток заменен другим аминокислотным остатком, имеющим боковую цепь (группа R) со сходными химическими свойствами (например, заряд или гидрофобность). В общем, консервативная аминокислотная замена фактически не будет изменять функциональные свойства белка. В случаях, если две или более аминокислотные последовательности отличаются друг от друга консервативными заменами, процентная идентичность последовательности или степень сходства могут быть увеличены с тем, чтобы внести поправку на консервативную природу замены.
3. Экспрессия
Различные способы рекомбинантной экспрессии, т.е. образование РНК или РНК и белка/пептида, хорошо известны, как изложено, например, в Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif.; Sambrook et al., Molecular Cloning-A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., (2000); и Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. и John Wiley & Sons, Inc., (дополненная на протяжении 2006).
Некоторые выражения, представляющие интерес, включают "регуляторную последовательность экспрессии", которая предусматривает промоторы, сайты связывания рибосом, энхансеры и другие регуляторные элементы, которые регулируют транскрипцию гена или трансляцию мРНК. Как хорошо известно, "промотор" или "промоторная область" относится к последовательности нуклеиновой кислоты, которая, как правило, расположена выше (5') по отношению к последовательности нуклеиновой кислоты, которая экспрессируется и контролирует экспрессию последовательности при помощи обеспечения сайта распознавания и связывания для РНК-полимеразы.
Иллюстративные промоторы, которые являются совместимыми в соответствии с настоящим изобретением, включают промоторы для полимеразы SP6, T3 и T7, человеческий промотор РНК U6, промотор CMV и их искусственные гибридные промоторы (например, CMV), где часть или части являются слитыми с частью или частями промоторов генов других клеточных белков, таких как, например, человеческий GAPDH (глицеральдегид-3-фосфатдегидрогеназа), и при этом включающие или не включающие дополнительный(дополнительные) интрон(интроны).
В определенных вариантах осуществления молекула нуклеиновой кислоты может присутствовать в векторе, при необходимости, с промотором, который регулирует экспрессию нуклеиновой кислоты. Хорошо известное выражение "вектор" предусматривает любую промежуточную среду для нуклеиновой кислоты, которая дает возможность вводить указанную нуклеиновую кислоту, например, в прокариотические и/или эукариотические клетки и, при необходимости, обеспечивать интеграцию в геном. Способы трансформации клеток млекопитающих хорошо известны из уровня техники. См., например, патентные документы США №№ 4399216, 4912040, 4740461 и 4959455. Векторы могут включать в себя нуклеотидную последовательность, кодирующую антитело по настоящему изобретению (например, полное антитело, тяжелую или легкую цепь антитела, VH или VL антитела или их участок, или CDR тяжелой или легкой цепи, одноцепочечный Fv или их фрагменты или варианты), функционально связанную с промотором (см., например, публикацию PCT WO 86/05807; публикацию PCT WO 89/01036 и патент США № 5122464).
Ряд систем хозяин-вектор экспрессии являются коммерчески доступными, и при этом многие являются совместимыми с изложенным в данном документе и их можно применять для экспрессии модуляторов по настоящему изобретению. Такие системы предусматривают без ограничения микроорганизмы, например, бактерии (например, E. coli, B. subtilis, стрептомицеты), трансформированные рекомбинантными векторами экспрессии на основе ДНК бактериофага, плазмидной ДНК или космидной ДНК, содержащими последовательности, кодирующие модулятор; дрожжи (например, Saccharomyces, Pichia), трансфицированные рекомбинантными векторами экспрессии для дрожжей, содержащими последовательности, кодирующие модулятор; системы на основе клеток насекомых, инфицированных рекомбинантными вирусными векторами экспрессии (например, бакуловирус), содержащими последовательности, кодирующие модулятор; системы на основе клеток растений (например, Nicotiana, Arabidopsis, ряска, кукуруза, пшеница, картофель и т.д.), инфицированных рекомбинантными вирусными векторами экспрессии (например, вирус мозаики цветной капусты; вирус табачной мозаики) или трансфицированных рекомбинантными плазмидными векторами экспрессии (например, Ti-плазмида), содержащими последовательности, кодирующие модулятор; или системы на основе клеток млекопитающих (например, клетки COS, CHO, BHK, 293, 3T3 и т.д.), содержащие рекомбинантные конструкции экспрессии, содержащие промоторы, происходящие из генома клеток млекопитающих (например, металлотионеиновый промотор) или из вирусов млекопитающих (например, поздний промотор аденовируса; 7,5K промотор вируса коровьей оспы).
Используемое в данном документе выражение "клетка-хозяин" охватывает любую разновидность клеточной системы, которую можно сконструировать для получения полипептидов и антигенсвязывающих молекул по настоящему изобретению. В одном варианте осуществления клетка-хозяин сконструирована для обеспечения образования антигенсвязывающих молекул с модифицированными гликоформами. В предпочтительном варианте осуществления антигенсвязывающая молекула или вариант антигенсвязывающей молекулы представляет собой антитело, фрагмент антитела или слитый белок. В определенных вариантах осуществления можно осуществлять дополнительные манипуляции с клетками-хозяевами для обеспечения экспрессии повышенных уровней одного или нескольких полипептидов, имеющих активность N-ацетилглюкозаминилтрансферазы III (GnTI11). Совместимые клетки-хозяева предусматривают культивируемые клетки, например, культивируемые клетки млекопитающих, например, клетки CHO, клетки BHK, клетки NSO, клетки SP2/0, клетки миеломы YO, клетки миеломы мышей P3X63, клетки PER, клетки PER.C6 или клетки гибридомы, дрожжевые клетки, клетки насекомых и клетки растений, если упомянуть только некоторые, а также клетки, находящие в ткани трансгенного животного, трансгенного растения или культивируемого растения или животного.
Для долгосрочной продукции рекомбинантных белков с высоким выходом предпочтительной является стабильная экспрессия. Соответственно, клеточные линии, которые стабильно экспрессируют выбранный модулятор, могут быть сконструированы при помощи стандартных методик, принятых в данной области техники. Вместо применения векторов экспрессии, которые содержат вирусные точки начала репликации, клетки-хозяева могут быть трансформированы ДНК под управлением соответствующих регуляторных элементов экспрессии (например, промотор, энхансер, последовательности, терминаторы транскрипции, сайты полиаденилирования и т.д.) и селектируемым маркером. Можно применять любую из систем отбора, хорошо известных из уровня техники, в том числе систему экспрессии на основе гена глутаминсинтетазы (систему GS), которая обеспечивает эффективный подход для увеличения экспрессии в определенных условиях. Система GS обсуждается полностью или частично в связи с патентными документами EP 0216846, 0256055, 0323997 и 0338841 и патентными документами США №№ 5591639 и 5879936, каждый из которых включен в данный документ при помощи ссылки. Другая предпочтительная система экспрессии, набор CHO-S Freedom™, который в коммерчески предоставляется Life Technologies (номер в каталоге A13696-01), также обеспечивает создание стабильных клеточных линий, которые можно применять для получения модулятора.
Такие хозяева-системы экспрессии представляют собой среды, с применением которых кодирующие последовательности, представляющие интерес, можно получать и затем очищать, а также представляют собой клетки, которые при трансформации или трансфекции при помощи соответствующих нуклеотидных кодирующих последовательностей экспрессируют молекулу по настоящему изобретению in situ. Клетку-хозяина можно котрансфицировать при помощи двух векторов экспрессии по настоящему изобретению, например, первого вектора, кодирующего полипептид, происходящий из тяжелой цепи, и второго вектора, кодирующего полипептид, происходящий из легкой цепи.
Таким образом, в определенных вариантах осуществления настоящее изобретение предусматривает рекомбинантные клетки-хозяева, обеспечивающие экспрессию антител или их участков. Антитела, полученные путем экспрессии в таких рекомбинантных клетках-хозяевах, в данном документе называют рекомбинантными антителами. Настоящее изобретение также предусматривает клетки, являющиеся потомками таких клеток-хозяев, и антитела, продуцируемые ими.
C. Химический синтез
В дополнение, модуляторы могут быть химически синтезированы с использованием известных из уровня техники методик (например, см. Creighton, 1983, Proteins: Structures and Molecular Principles, W.H. Freeman & Co., N.Y., и Hunkapiller, M., et al., 1984, Nature 310:105-111). Кроме того, при необходимости неклассические аминокислоты или химические аналоги аминокислот (такие как D-изомеры общеизвестных аминокислот, 2,4-диаминомасляная кислота, a-аминоизомасляная кислота, 4-аминомасляная кислота и т.п.) могут быть введены в качестве замещения или добавления в полипептидную последовательность.
D. Трансгенные системы
В других вариантах осуществления модуляторы могут быть получены трансгенным путем с помощью создания млекопитающего или растения, которое является трансгенным по рекомбинантным молекулам, таким как последовательности тяжелой и легкой цепей иммуноглобулина, и которое продуцирует требуемые соединения в извлекаемой форме. Это предусматривает, например, получение белковых модуляторов (например, антител) в молоке коз, коров или других млекопитающих и извлечение из него. См., например, патентные документы США №№ 5827690, 5756687, 5750172 и 5741957. В некоторых вариантах осуществления трансгенных животных, отличных от человека, которые содержат локусы человеческого иммуноглобулина, иммунизируют для получения антител.
Другие трансгенные методики изложены в Hogan et al., Manipulating the Mouse Embryo: A Laboratory Manual 2nd ed., Cold Spring Harbor Press (1999); Jackson et al., Mouse Genetics and Transgenics: A Practical Approach, Oxford University Press (2000); и Pinkert, Transgenic Animal Technology: A Laboratory Handbook, Academic Press (1999), и в патентном документе США № 6417429. В некоторых вариантах осуществления отличными от человека животными являются мыши, крысы, овцы, свиньи, козы, крупный рогатый скот или лошади, и требуемый продукт продуцируется в крови, молоке, моче, слюне, слезной жидкости, слизи и других жидкостях организма, из которых его легко получают с использованием принятых в данной области методик очистки.
Другие совместимые системы продуцирования предусматривают способы получения антител в растениях, такие как описанные, например, в патентных документах США №№ 6046037 и 5959177, которые включены в данный документ по отношению к таким методикам.
E. Выделение/очистка
Как только модулятор в соответствии с настоящим изобретением получен путем рекомбинантной экспрессии или любой другой из раскрытых методик, он может быть очищен при помощи любого известного из уровня техники способа очистки иммуноглобулинов или белков. С учетом этого модулятор может быть “выделенным”, что означает, что его идентифицировали и отделили и/или извлекли из компонента окружающей его естественной среды. Загрязняющие компоненты окружающей его естественной среды являются материалами, которые могут мешать диагностическим или терапевтическим применениям полипептида и могут включать в себя ферменты, гормоны и другие белковые или небелковые растворенные вещества. Выделенные модуляторы включают в себя модуляторы in situ в рекомбинантных клетках, так как по меньшей мере один компонент естественной окружающей среды полипептида не будет присутствовать.
Если требуемая молекула продуцируется внутриклеточно, в качестве первого этапа может быть удален осадок в виде частиц либо клеток-хозяев, либо лизированных фрагментов, например, путем центрифугирования или ультрафильтрации. Если модулятор секретируется в среду, супернатанты из таких систем экспрессии, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белка, например, ультрафильтрационного устройства Amicon или Pellicon (Millipore Corp.). После удаления нерастворимых загрязнений препарат модулятора может быть дополнительно очищен с использованием стандартных методик, таких как, например, гидроксилапатитная хроматография, гель-электрофорез, диализ и аффинная хроматография, при этом особый интерес представляет аффинная хроматография. В этом отношении белок A может быть использован для очистки антител, которые основываются на тяжелых цепях человеческого IgG1, IgG2 или IgG4 (Lindmark, et al., J Immunol Meth 62:1 (1983)), в то время как белок G рекомендуют для всех мышиных изотипов и для человеческого IgG3 (Guss, et al., EMBO J 5:1567 (1986)). Другие методики для очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая HPLC, хроматография на силикагеле, хроматография на гепарине, сефарозная хроматография на анионо- или катионообменной смоле (например, колонка с полиаспартовой кислотой), хроматофокусирование, SDS-PAGE и осаждение сульфатом аммония, также доступны в зависимости от извлекаемого антитела. В особенно предпочтительных вариантах осуществления модуляторы по настоящему изобретению будут очищать, по меньшей мере частично, с использованием аффинной хроматографии с белком A или белком G.
VI. Фрагменты и производные SEZ6 модулятора
Независимо от выбранного способа создания и получения, модуляторы по настоящему изобретению будут реагировать, связываться, объединяться, образовывать комплекс, соединяться, прикрепляться, присоединяться, взаимодействовать или иным путем ассоциироваться с целевой детерминантой (например, с антигеном) и, тем самым, будут обеспечивать требуемые результаты. Если модулятор включает антитело или его фрагмент, конструкцию или производное, то такие ассоциации могут осуществляться через один или несколько “сайтов связывания” или “компонентов связывания”, экспрессированных на антителе, при этом сайт связывания содержит область полипептида, которая отвечает за избирательное связывание с целевой молекулой или с представляющим интерес антигеном. Связывающие домены содержат по меньшей мере один сайт связывания (например, интактное антитело IgG будет иметь два связывающих домена и два сайта связывания). Типичные связывающие домены включают в себя вариабельный домен антитела, связывающий рецептор домен лиганда, связывающий лиганд домен рецептора или ферментативный домен.
А. Антитела
Как отмечено выше, выражение "антитело" предназначено охватывать по меньшей мере поликлональные антитела, мультиклональные антитела, химерные антитела, CDR-привитые антитела, гуманизированные и приматизированные антитела, человеческие антитела, рекомбинантно полученные антитела, интраантитела, мультиспецифические антитела, биспецифические антитела, моновалентные антитела, мультивалентные антитела, антиидиотипические антитела, а также синтетические антитела.
B. Фрагменты
Независимо от того, какая форма модулятора (например, химерный, гуманизированный и т.п.) выбрана для осуществления настоящего изобретения, будет понятно, что его иммунореактивные фрагменты могут быть использованы согласно изложенному в данном документе. “Фрагмент антитела" содержит по меньшей мере участок интактного антитела. Используемое в данном документе выражение "фрагмент" молекулы антитела предусматривает антигенсвязывающие фрагменты антител, а выражение “антигенсвязывающий фрагмент” относится к полипептидному фрагменту иммуноглобулина или антитела, который иммуноспецифически связывается или реагирует с выбранным антигеном или его иммуногенной детерминантой или конкурирует с интактным антителом, из которого были получены фрагменты, за специфическое связывание с антигеном.
Иллюстративные фрагменты предусматривают: VL, VH, scFv, F(ab')2-фрагмент, Fab-фрагмент, Fd-фрагмент, Fv-фрагмент, фрагменты однодоменного антитела, диатела, линейные антитела, молекулы одноцепочечных антител и мультиспецифические антитела, образованные из фрагментов антител. Кроме того, активный фрагмент содержит часть антитела, которая сохраняет его способность взаимодействовать с антигеном/субстратом или рецепторами и модифицировать их способом, подобным таковому для интактного антитела (хотя, возможно, с несколько меньшей эффективностью).
В других вариантах осуществления фрагмент антитела является фрагментом, который содержит Fc-область и который сохраняет по меньшей мере одну из биологических функций, обычно ассоциированных с Fc-областью при ее наличии в интактном антителе, таких как связывание FcRn, модуляция времени полужизни антитела, функция ADCC и связывание комплемента. В одном варианте осуществления фрагмент антитела представляет собой моновалентное антитело, которое характеризуется in vivo временем полужизни, практически подобным таковому для интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающее плечо, соединенное с Fc-последовательностью, способной обеспечивать in vivo стабильность фрагмента.
Специалистам в данной области техники будет понятно, что фрагменты могут быть получены с помощью химической или ферментативной обработки (например, папаином или пепсином) интактного или полного антитела или цепи антитела или с помощью рекомбинантных средств. См., например, Fundamental Immunology, W. E. Paul, ed., Raven Press, N.Y. (1999), для более подробного описания фрагментов антител.
C. Производные
Настоящее изобретение, кроме того, относится к иммунореактивным производным модулятора и антигенсвязывающим молекулам, содержащим одну или несколько модификаций.
1. Мультивалентные антитела
В одном варианте осуществления модуляторы по настоящему изобретению могут быть моновалентными или мультивалентными (например, бивалентными, трехвалентными и т.п.). Используемое в данном документе выражение "валентность" означает число потенциальных сайтов связывания мишени, ассоциированных с антителом. Каждый сайт связывания мишени специфически связывает одну целевую молекулу, или специфическое положение или локус на целевой молекуле. Если антитело является моновалентным, то каждый сайт связывания молекулы будет специфически связываться с одним положением антигена или эпитопом. Если антитело содержит более одного сайта связывания мишени (мультивалентное), то каждый сайт связывания мишени может специфически связывать одни и те же или различные молекулы (например, может связываться с различными лигандами или различными антигенами, или различными эпитопами, или положениями на одном и том же антигене). См., например, патентный документ США № 2009/0130105. В каждом случае по меньшей мере один из сайтов связывания будет содержать эпитоп, мотив или домен, ассоциированные с изоформой SEZ6.
В одном варианте осуществления модуляторы представляют собой биспецифические антитела, у которых две цепи характеризуются различными специфичностями, как описано в Millstein et al., 1983, Nature, 305:537-539. Другие варианты осуществления предусматривают антитела с дополнительными специфичностями, такие как триспецифические антитела. Другие более усложненные совместимые мультиспецифические конструкции и способы их получения изложены в патентном документе США № 2009/0155255, а также в WO 94/04690; Suresh et al., 1986, Methods in Enzymology, 121:210; и в WO96/27011.
Как упоминалось выше, мультивалентные антитела могут иммуноспецифически связываться с различными эпитопами требуемой целевой молекулы или могут иммуноспецифически связываться с целевой молекулой, а также с гетерологичным эпитопом, таким как гетерологичный полипептид, или материалом твердой подложки. Притом, что в предпочтительных вариантах осуществления антитела против SEZ6 связывают только два антигена (т.e. биспецифичные антитела), антитела с дополнительными специфичностями, такие как триспецифичные антитела, также охватываются настоящим изобретением. Биспецифические антитела также включают в себя сшитые или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может быть соединено с авидином, а другое - с биотином. Такие антитела были предложены, например, для нацеливания клеток иммунной системы на нежелательные клетки (патентный документ США № 4676980), а также для лечения инфекции HIV (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгированные антитела могут быть получены с использованием любых подходящих способов сшивания. Приемлемые средства сшивания хорошо известны из уровня техники и раскрыты в патентном документе США № 4676980 вместе с рядом методик сшивания.
В других вариантах осуществления вариабельные домены антитела с требуемыми специфичностями связывания (с сайтами для объединения антитело-антиген) сливают с последовательностями константного домена иммуноглобулина, такого как константный домен тяжелой цепи иммуноглобулина, содержащий по меньшей мере часть шарнира, CH2- и/или CH3-областей, с использованием способов, хорошо известных специалистам в данной области техники.
2. Модификации Fc-области
В дополнение к различным модификациям, замещениям, добавлениям или делециям в вариабельной или связывающей области раскрытых модуляторов (например, Fc-SEZ6 или антитела против SEZ6), изложенным выше, специалистам в данной области будет понятно, что выбранные варианты осуществления в соответствии с настоящим изобретением также могут предусматривать замещения или модификации константной области (т.e. Fc-области). Более конкретно, предполагается, что SEZ6 модуляторы в соответствии с настоящим изобретением могут содержать inter alia одно или несколько дополнительных замещений аминокислотных остатков, мутаций и/или модификаций, которые дают соединение с предпочтительными характеристиками, в том числе без ограничения измененная фармакокинетика, увеличенный срок полужизни в сыворотке, повышенная аффинность связывания, пониженная иммуногенность, повышенное продуцирование, измененное связывание Fc-лиганда с Fc-рецептором (FcR), повышенная или пониженная “ADCC” (антителозависимая клеточноопосредованная цитотоксичность) или “CDC” (комплементзависимая цитотоксичность) активность, измененное гликозилирование и/или дисульфидные связи и модифицированная специфичность связывания. В этом отношении будет понятно, что эти Fc-варианты преимущественно могут быть использованы для усиления эффективных противоопухолевых свойств раскрытых модуляторов.
С этой целью определенные варианты осуществления настоящего изобретения могут предусматривать замещения или модификации Fc-области, например, добавление одного или нескольких аминокислотных остатков, замещений, мутаций и/или модификаций для получения соединения с усиленными или предпочтительными функциями эффектора Fc. Например, изменения в аминокислотных остатках, вовлеченных во взаимодействие между Fc-доменом и Fc-рецептором (например, FcγRI, FcγRIIA и B, FcγRIII и FcRn) может приводить к повышенной цитотоксичности и/или к измененной фармакокинетике, например, к увеличенному времени полужизни в сыворотке (см., например, Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995), каждая из которых включена в данный документ при помощи ссылки).
В выбранных вариантах осуществления антитела с повышенными in vivo значениями времени полужизни могут быть созданы путем модификации (например, замены, делеции или добавления) аминокислотных остатков, идентифицированных как вовлеченные во взаимодействия между Fc-доменом и FcRn-рецептором (см., например, международные публикации №№ WO 97/34631; WO 04/029207; патентный документ США № 6737056, и патентный документ США № 2003/0190311. Что касается таких вариантов осуществления, Fc-варианты могут обеспечивать значения времени полужизни у млекопитающего, предпочтительно, человека, более 5 дней, более 10 дней, более 15 дней, предпочтительно, более 20 дней, более 25 дней, более 30 дней, более 35 дней, более 40 дней, более 45 дней, более 2 месяцев, более 3 месяцев, более 4 месяцев или более 5 месяцев. Увеличенное время полужизни дает более высокий титр сыворотки, что, таким образом, снижает частоту введения антител и/или снижает концентрацию антител, подлежащих введению. Связывание с человеческим FcRn in vivo и время полужизни в сыворотке полипептидов с высокой аффинностью связывания с человеческим FcRn может быть оценено, например, у трансгенных мышей или в линиях трансфицированных клеток человека, экспрессирующих человеческий FcRn, или у приматов, которым вводят полипептиды с вариантной Fc-областью. В WO 2000/42072 описываются варианты антитела с улучшенным или уменьшенным связыванием с FcRn. См. также, например, Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001).
В других вариантах осуществления изменения Fc могут приводить к усилению или снижению активности ADCC или CDC. Как известно из уровня техники, CDC называется лизирование целевой клетки в присутствии комплемента, а ADCC называется форма цитотоксичности, при которой секретируемый Ig связывается с FcR, присутствующими на определенных цитотоксических клетках (например, на клетках естественных киллерах, нейтрофилах и макрофагах), что позволяет этим цитотоксическим эффекторным клеткам специфично связываться с несущими антиген целевыми клетками, а затем убивать целевую клетку цитотоксинами. В контексте настоящего изобретения вариантам антитела придают "измененную" аффинность связывания с FcR, что обеспечивает либо усиленное, либо пониженное связывание по сравнению с исходным или немодифицированным антителом или с антителом, содержащим FcR с нативной последовательностью. Такие варианты, которые демонстрируют пониженное связывание, могут обладать незначительным связыванием или его отсутствием, например, 0-20% связывание с FcR по сравнению с нативной последовательностью, например, как определено при помощи методик, хорошо известных из уровня техники. В других вариантах осуществления вариант будет характеризоваться усиленным связыванием по сравнению с нативным Fc-доменом иммуноглобулина. Будет понятно, что эти типы Fc-вариантов преимущественно могут быть использованы для усиления эффективных противоопухолевых свойств раскрытых модуляторов. В еще других вариантах осуществления такие изменения приводят к увеличенной аффинности связывания, сниженной иммуногенности, увеличенному продуцированию, измененному гликозилированию и/или дисульфидным связям (например, для сайтов конъюгирования), модифицированной специфичности связывания, усиленному фагоцитозу и/или к понижающей регуляции рецепторов клеточной поверхности (например B-клеточный рецептор; BCR) и т.д.
3. Измененное гликозилирование
Другие варианты осуществления относятся к одной или нескольким сконструированным гликоформам, т.e. к SEZ6 модулятору, содержащему измененный паттерн гликозилирования или измененную углеводную композицию, ковалентно присоединенные к белку (например, в Fc-домене). См., например, Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740. Сконструированные гликоформы могут быть применимыми для ряда целей, в том числе, без ограничения, для усиления или снижения эффекторной функции, повышения аффинности модулятора по отношению к мишени или облегчения продуцирования модулятора. В определенных вариантах осуществления, в которых желательно снижение эффекторной функции, молекула может быть сконструирована для экспрессии агликозилированной формы. Хорошо известны замещения, которые могут приводить к устранению одного или нескольких сайтов гликозилирования каркасной структуры вариабельной области с устранением тем самым гликозилирования по этому сайту (см., например, патентные документы США №№ 5714350 и 6350861). В свою очередь, усиленные эффекторные функции или улучшенное связывание может быть обеспечено содержащей Fc молекуле путем конструирования одного или нескольких дополнительных сайтов гликозилирования.
Другие варианты осуществления предусматривают Fc-вариант, который обладает измененной композицией гликозилирования, например, гипофукозилированное антитело, содержащее сниженные количества фукозильных остатков, или антитело, обладающее усиленными делящими пополам GlcNAc структурами. Было продемонстрировано, что такие измененные паттерны гликозилирования повышают способность антител против ADCC. Сконструированные гликоформы могут быть созданы любым способом, известным специалисту в данной области техники, например, с помощью использования сконструированных или штаммов, экспрессирующих вариант, с помощью совместной экспрессии с одним или несколькими ферментами (например, с N-ацетилглюкозаминилтрансферазой III (GnTI11)), с помощью экспрессии молекулы, содержащей Fc-область, в различных организмах или клеточных линиях из различных организмов или с помощью модификации углевода(ов) после экспрессии молекулы, содержащей Fc-область (см., например, WO 2012/117002).
4. Дополнительная обработка
Модуляторы могут быть дифференциально модифицированы в ходе или после образования, например, путем гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации с помощью известных защитных/блокирующих групп, протеолитического расщепления, связывания с молекулой антитела или другим клеточным лигандом и т.п. Любая из многочисленных химических модификаций может быть выполнена при помощи известных методик, в том числе, без ограничения, специфическое химическое расщепление цианогенбромидом, трипсином, химотрипсином, папаином, V8-протеазой, NaBH4, ацетилирование, формилирование, окисление, восстановление, метаболический синтез в присутствии туникамицина и т.п.
Различные посттрансляционные модификации, также охваченные настоящим изобретением, предусматривают, например, N-связанные или O-связанные углеводные цепи, обработку N-концевой или C-концевой областей, присоединение химических частей к аминокислотному скелету, химические модификации N-связанной или O-связанной углеводных цепей, а также добавление или делецию N-концевого метионинового остатка в результате экспрессии в прокариотической клетке-хозяине. Более того, модуляторы также могут быть модифицированы выявляемой меткой, такой как ферментативная, флуоресцентная, радиоизотопная или аффинная метка, для обеспечения выявления и выделения модулятора.
VII. Характеристики модулятора
Независимо от способа получения или упомянутых выше форм, которые принимает модулятор, различные варианты осуществления раскрытых модуляторов могут характеризоваться определенными характеристиками. В выбранных вариантах осуществления клетки, продуцирующие антитело (например, гибридомы или колонии дрожжей), можно отобрать, клонировать и подвергнуть дополнительному скринингу на предмет подходящих свойств, в том числе, например, устойчивого роста, высокого уровня продукции модулятора, и как более подробно обсуждается ниже, требуемых характеристик модулятора. В других случаях характеристики модулятора можно обеспечить или на них можно повлиять путем выбора определенного антигена (например, специфической изоформы SEZ6) или иммунореактивного фрагмента целевого антигена для инокуляции животного. В следующих вариантах осуществления выбранные модуляторы могут быть сконструированы, как описано выше, для увеличения или улучшения иммунохимических характеристик, таких как аффинность или фармакокинетика.
А. Нейтрализующие модуляторы
В определенных вариантах осуществления модуляторы будут включать “нейтрализующие” антитела или их производные или фрагменты. Другими словами, настоящее изобретение может предусматривать молекулы антител, которые связываются со специфическими доменами, мотивами или эпитопами и способны блокировать, снижать или ингибировать биологическую активность SEZ6. В более общем смысле выражение “нейтрализующие антитело” относится к антителу, которое связывается или взаимодействует с целевой молекулой или лигандом и предотвращает связывание или ассоциацию целевой молекулы с партнером по связыванию, таким как рецептор или субстрат, тем самым препятствуя биологическому ответу, который в ином случае будет осуществляться в результате взаимодействия молекул.
Следует понимать, что анализы конкурентного связывания, известные из уровня техники, можно применять для оценки связывания и специфичности антитела или его иммунологически функционального фрагмента или производного. Применительно к настоящему изобретению будет предусматриваться, что антитело или фрагмент ингибирует или снижает связывание SEZ6 с партнером по связыванию или субстратом (например, нейротрофическим лигандом), если избыток антитела приводит к снижению количества партнера по связыванию, связанного с SEZ6, по меньшей мере на приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% или более, как измерено, например, при помощи пониженной активности нейротрофического лиганда или в in vitro анализе конкурентного связывания. В случае антител против SEZ6, например, нейтрализующие антитело или антагонист, предпочтительно, будет изменять активность лиганда по меньшей мере на приблизительно 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% или более. Следует понимать, что эту модифицированную активность можно измерять непосредственно при помощи принятых в данной области техники методик или можно измерять по влиянию, которое оказывает измененная активность на последующие процессы (например, онкогенез, выживание клеток или активация пути).
B. Интернализирующие модуляторы
Хотя данные показывают, что SEZ6 или его выбранные изоформы могут присутствовать в растворимой форме, по меньшей мере некоторое количество SEZ6, вероятно, остается ассоциированным с клеточной поверхностью, тем самым обеспечивая интернализацию раскрытых модуляторов. Следовательно, антитела против SEZ6 по настоящему изобретению могут быть интернализированы, по меньшей мере до некоторой степени, с помощью клеток которые экспрессируют SEZ6. Например, антитело к SEZ6, которое связывается с SEZ6 на поверхности инициирующей опухоль клетки, может быть интернализовано инициирующей опухоль клеткой. В особенно предпочтительных вариантах осуществления такие антитела против SEZ6 могут быть ассоциированы или конъюгированы с противораковыми средствами, например, цитотоксическими частями, которые уничтожают клетки после интернализации. В особенно предпочтительных вариантах осуществления модулятор будет предусматривать конъюгат интернализирующего антитела и лекарственного средства.
Используемое в данном документе выражение модулятор, который “обеспечивает интернализацию” относится к модулятору, который поглощается клеткой (вместе с любой нагрузкой) после связывания с соответственным антигеном или рецептором. Как будет понятно, интернализирующий модулятор в предпочтительных вариантах осуществления может включать антитело, в том числе фрагменты антител и их производные, а также конъюгаты на основе антитела. Интернализация может происходить in vitro или in vivo. Что касается терапевтических применений, интернализация, предпочтительно, будет происходить in vivo у индивида, нуждающегося в этом. Количество интернализованных молекул антитела может быть достаточным или соответствующим для уничтожения клетки, экспрессирующей антиген, в особенности раковой стволовой клетки, экспрессирующей антиген. В зависимости от активности антитела или конъюгата на основе антитела, в некоторых случаях для уничтожения целевой клетки, с которой связывается антитело, является достаточным поглощение клеткой одной молекулы антитела. Например, определенные токсины являются настолько высокоэффективными, что интернализация нескольких конъюгированных с антителом молекул токсина является достаточной для уничтожения опухолевой клетки. Происходит ли интернализация антитела после связывания с клеткой млекопитающего, можно определить при помощи различных анализов, в том числе описанных в примерах ниже (например, примеры 15, 17 и 18). Способы выявления того, происходит ли интернализация антитела в клетку, также описаны в патентном документе США № 7619068, который включен в данный документ при помощи ссылки во всей его полноте.
C. Истощающие модуляторы
В других вариантах осуществления антитела будут включать истощающие антитела или их производные или фрагменты. Выражение “истощающее” антитело относится к антителу, которое предпочтительно, связывается или ассоциируется с антигеном на клеточной поверхности или вблизи клеточной поверхности и индуцирует, стимулирует или вызывает гибель клетки или ее устранение (например, посредством CDC, ADCC или введения цитотоксического средства). В некоторых вариантах осуществления выбранные истощающие антитела будут ассоциированы или конъюгированы с цитотоксическим средством.
Предпочтительно, истощающее антитело будет способно приводить к удалению, выведению из строя, устранению или уничтожению по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97% или 99% опухолеродных клеток с SEZ6 в определенной популяции клеток. В некоторых вариантах осуществления популяция клеток может содержать обогащенные, отделенные, очищенные или выделенные клетки, обеспечивающие поддержание опухоли. В других вариантах осуществления популяция клеток может содержать образцы целой опухоли или гетерогенные опухолевые экстракты, которые содержат клетки, обеспечивающие поддержание опухоли. Специалисты в данной области техники поймут, что стандартные биохимические методики, как описано в примерах ниже (например, примеры 14 и 15) можно применять для отслеживания и количественной оценки сокращения количества опухолеродных клеток или клеток, обеспечивающих поддержание опухоли, в соответствии с изложенным в данном документе.
D. Определение секции и связывание с эпитопом
Также следует понимать, что раскрытые модуляторы на основе антитела против SEZ6 будут ассоциироваться или связываться с дискретными эпитопами или иммуногенными детерминантами, представленными на выбранной мишени ее или фрагменте. В определенных вариантах осуществления эпитоп или иммуногенные детерминанты включают химически активные поверхностные группировки молекул, например, аминокислоты, боковые цепи сахаров, фосфорильные группы или сульфонильные группы, и в определенных вариантах осуществления могут иметь специфические пространственные структурные характеристики и/или специфические характеристики заряда. Таким образом, используемое в данном документе выражение “эпитоп” предусматривает любую белковую детерминанту, способную к специфическому связыванию с иммуноглобулином или T-клеточным рецептором или иному взаимодействию с молекулой. В определенных вариантах осуществления антитело, как указано, специфически связывается (или иммуноспецифически связывается или реагирует) с антигеном, в случае если оно, предпочтительно, распознает целевой для него антиген в сложной смеси белков и/или макромолекул. В предпочтительных вариантах осуществления антитело, как указано, специфически связывается с антигеном, если равновесная константа диссоциация (KD) меньше или равна 10−6M или меньше или равна 10−7M, более предпочтительно, если равновесная константа диссоциации меньше или равна 10−8M, и даже более предпочтительно, если константа диссоциации меньше или равна 10−9M.
Более определенно, выражение “эпитоп” используется в его общепринятом биохимическом смысле и относится к тому участку целевого антигена, который может распознаваться и специфически связываться определенным модулятором на основе антитела. Если антиген представляет собой полипептид, например, SEZ6, эпитопы, как правило, могут быть образованы как смежными аминокислотами, так и аминокислотами, не являющимися смежными, расположенными рядом посредством образования третичной структуры белка (“конформационные эпитопы”). В этих конформационных эпитопах точки взаимодействия возникают по аминокислотным остаткам белка, которые линейно отделены друг от друга. Эпитопы, образованные смежными аминокислотами (иногда называемые “линейными” или “непрерывными” эпитопами), как правило, сохраняются после денатурации белка, в то время как эпитопы, образованные посредством образования третичной структуры, как правило, утрачиваются после денатурации белка. В любом случае, эпитоп для антитела, как правило, включает в себя по меньшей мере 3, а еще чаще по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
В связи с этим следует понимать, что в определенных вариантах осуществления эпитоп может быть ассоциирован или находиться в одной или нескольких областях, доменах или мотивах белка SEZ6 (например, аминокислоты 1-906 изоформы 1). Как более подробно обсуждается в данном документе, внеклеточная область белка SEZ6 содержит ряд общепризнанных доменов, в том числе пять Sushi доменов и два CUB домена вместе с N-концевым доменом. Для целей настоящего раскрытия выражение “домен” будет применяться в соответствии с его общепринятым значением и, как подразумевается, будет относиться к обнаруживаемой или определяемой консервативной структурной единице белка, которая характеризуется содержимым с отличительной вторичной структурой. Во многих случаях гомологичные домены с общими функциями, как правило, будут характеризоваться сходством последовательности и будут обнаруживаться в ряде отличающихся белков (например, как сообщается, Sushi домены обнаружены по меньшей мере в большом числе различных белков). Аналогичным образом, принятое в данной области техники выражение “мотив” будет применяться в соответствии с его общепринятым значением и, как правило, будет относиться к короткой консервативной области белка, которая обычно составляет от десяти до двадцати смежных аминокислотных остатков. Как обсуждается во всем документе, выбранные варианты осуществления предусматривают модуляторы, которые ассоциируются или связываются с эпитопом в пределах специфических областей, доменов или мотивов SEZ6.
В любом случае, если требуемый эпитоп на антигене определен, возможно получить антитела к этому эпитопу, например, посредством иммунизации при помощи пептида, содержащего эпитоп, с применением методик, описанных в настоящем изобретении. В альтернативном случае, в ходе процесса обнаружения получение и характеристика антител могут привести к выяснению сведений о требуемых эпитопах, расположенных в специфических доменах или мотивах. Исходя из этих сведений затем возможно провести конкурентный скрининг антител на предмет связывания с одним и тем же эпитопом. Подход для достижения этого заключается в проведении исследований в конкурентных условиях для обнаружения антител, которые конкурентно связываются друг с другом, т.е. антитела конкурируют за связывание с антигеном. Высокопроизводительный способ для определения секции антител исходя из их перекрестной конкуренции описан в WO 03/48731. Другие способы определения секции или картирования на уровне доменов или картирования эпитопов, предусматривающие конкуренцию модуляторов или экспрессию фрагментов антигена на поверхности клеток дрожжей, приведены в примерах 9 и 10 ниже.
Используемое в данном документе выражение “определение секции” относится к способам, применяемым для группирования или классификации антител исходя из их антигенсвязывающих характеристик и конкуренции. В то время как методики являются пригодными для определения и распределения по категориям модуляторов согласно настоящему изобретению, секции не всегда непосредственно коррелируют с эпитопами и такое первоначальное определение связывания с эпитопом можно дополнительно улучшить и подтвердить при помощи других методик, принятых в данной области техники, как описано в данном документе. Однако, как обсуждается и показано в примерах ниже, эмпирическое отнесение модуляторов на основе антитела к отдельным секциям предоставляет сведения, которые могут указывать на терапевтический потенциал раскрытых модуляторов.
Более конкретно, можно определить, связывается ли выбранное эталонное антитело (или его фрагмент) с одним и тем же эпитопом или перекрестно конкурирует за связывание со вторым тестовым антителом (т.е. находится в одной и той же секции) при помощи способов, известных из уровня техники и приведенных в примерах в данном документе. В одном варианте осуществления модулятор на основе эталонного антитела ассоциируется с антигеном SEZ6 при насыщающих условиях и затем способность вторичного или тестового модулятора на основе антитела связываться с SEZ6 определяют при помощи стандартных иммунохимических методик. Если тестовое антитело фактически способно связываться с SEZ6 в одно и то же время, что и эталонное антитело к SEZ6, тогда вторичное или тестовое антитело связывается с эпитопом, отличающимся от такового для первичного или эталонного антитела. Однако, если тестовое антитело фактически не способно связываться с SEZ6 в одно и то же время, тогда тестовое антитело связывается с одним и тем же эпитопом, перекрывающимся эпитопом или эпитопом, расположенным в непосредственной близости (по меньшей мере стерически) от эпитопа, связанного первичным антителом. Другими словами, тестовое антитело конкурирует за связывание с антигеном и находится в одной и той же секции, что и эталонное антитело.
Выражение “конкурировать” или “конкурирующее антитело”, используемое в контексте раскрытых модуляторов, означает конкуренцию между антителами, как определено при помощи анализа, в котором тестовое антитело или иммунологически функциональный фрагмент в условиях теста фактически предотвращает или ингибирует специфическое связывание эталонного антитела с общим антигеном. Обычно такой анализ предусматривает применение очищенного антигена (например, SEZ6 или его домена или фрагмента), связанного с твердой поверхностью или клетками, несущими одно из немеченого тестового иммуноглобулина и меченого эталонного иммуноглобулина. Конкурентное ингибирование измеряют при помощи определения количества метки, связанной с твердой поверхностью или клетками в присутствии тестового иммуноглобулина. Обычно тестовый иммуноглобулин присутствует в избытке и/или ему дают возможность связаться первым. Антитела, определенные при помощи конкурентного анализа (конкурирующие антитела), предусматривают антитела, связывающиеся с тем же эпитопом, что и эталонное антитело, и антитела, связывающиеся с соседним эпитопом, достаточно близко лежащим по отношению к эпитопу, связанному эталонным антителом, для того чтобы могли возникнуть стерические затруднения. Дополнительные подробности относительно способов определения конкурентного связывания предоставлены в примерах в данном документе. Обычно, если конкурирующее антитело присутствует в избытке, оно будет ингибировать специфическое связывание эталонного антитела с общим антигеном по меньшей мере на 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75%. В некоторых случаях, связывание ингибируется по меньшей мере на 80%, 85%, 90%, 95% или 97% или более.
Напротив, в случае связывания эталонного антитела, оно, предпочтительно, будет ингибировать связывание добавленного в дальнейшем тестового антитела (т.е. SEZ6 модулятора) по меньшей мере на 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70% или 75%. В некоторых случаях, связывание тестового антитела ингибируется по меньшей мере на 80%, 85%, 90%, 95% или 97% или более.
В связи с настоящим изобретением и как изложено в примерах 9 и 10 ниже было определено (при помощи поверхностного плазмонного резонанса или интерферометрии биослоя), что внеклеточный домен SEZ6 позволяет определить при помощи конкурентного связывания по меньшей мере семь секций, называемых в данном документе “секция A” - “секция F” и “секция U”.
В связи с этим и как известно из уровня техники и подробно описано в примерах ниже, требуемые данные по определению секции или конкурентному связывания можно получать при помощи твердофазного прямого или непрямого радиоиммуноанализа (RIA), твердофазного прямого или непрямого иммуноферментного анализа (EIA или ELISA), конкурентного сэндвич-анализа, системы Biacore™ 2000 (т.е. поверхностный плазмонный резонанс - GE Healthcare), анализатора ForteBio® (т.е. интерферометрия биослоя - ForteBio, Inc.) или методики проточной цитометрии. Выражение “поверхностный плазмонный резонанс”, используемое в данном документе, относится к оптическому явлению, которое дает возможность анализа специфических взаимодействий в реальном времени при помощи определения изменений концентраций белков в пределах биосенсорной матрицы. Выражение “интерферометрия биослоя” относится к оптической аналитической методике, при помощи которой анализируют интерференционную картину белого света, отраженного от двух поверхностей, слоя иммобилизованного белка на элементе биосенсора и внутреннего эталонного слоя. Любое изменение количества молекул, связанных с элементом биосенсора, приводит к смещению интерференционной картины, которое можно измерить в реальном времени. В особенно предпочтительных вариантах осуществления анализ (либо поверхностный плазмонный резонанс, либо интерферометрию биослоя, либо проточную цитометрию) осуществляют при помощи прибора Biacore или ForteBio или проточного цитометра (например, FACSAria II), как продемонстрировано в примерах ниже.
Для дополнительного определения характеристик эпитопов, с которыми раскрытые модуляторы на основе антитела против SEZ6 ассоциируются или связываются, проводили картирование эпитопов на уровне доменов с применением модификации протокола, описанного Cochran et al. (J Immunol Methods. 287 (1-2):147-158 (2004), которая включена в данный документ при помощи ссылки). Вкратце, отдельные домены SEZ6, содержащие конкретные аминокислотные последовательности, экспрессировали на поверхности клеток дрожжей, и связывание с каждым антителом к SEZ6 определяли посредством проточной цитометрии. Результаты обсуждаются ниже в примере 10 и показаны на фиг. 14A и 14B.
Другие совместимые методики картирования эпитопов предусматривают анализ мутантов при помощи аланинового сканирования, пептидные блоты (Reineke (2004) Methods Mol Biol 248:443-63) (специально включена в данный документ при помощи ссылки во всей ее полноте) или анализ с расщеплением на пептиды. В дополнение, можно использовать способы, такие как вырезание эпитопа, экстракция эпитопа и химическая модификация антигенов (Tomer (2000) Protein Science 9: 487-496) (специально включена в данный документ при помощи ссылки во всей ее полноте). В других вариантах осуществления определение профиля при помощи модификации (MAP), также известное как определение профиля антитела исходя из структуры антигена (ASAP), предоставляет способ, который дает возможность распределения по категориям больших количеств моноклональных антител (mAb), направленных против одного и того же антигена, согласно значениям сходства профиля связывания каждого антитела с химически или ферментативно модифицированными антигенными поверхностями (патентный документ США № 2004/0101920, специально включен в данный документ при помощи ссылки во всей его полноте). Каждая категория может отражать уникальный эпитоп, либо совершенно отличающийся, либо частично перекрывающийся с эпитопом, представленным в другой категории. Эта технология обеспечивает быструю фильтрацию генетически идентичных антител, например, определение характеристик может быть направлено на генетически различные антитела. Следует понимать, что MAP можно применять для сортировки модуляторов на основе антитела против hSEZ6 согласно настоящему изобретению на группы антител, связывающихся с различными эпитопами.
Средства, пригодные для изменения структуры иммобилизованного антигена, предусматривают ферменты, такие как протеолитические ферменты (например, трипсин, эндопротеиназа Glu-C, эндопротеиназа Asp-N, химотрипсин и т.д.). Средства, пригодные для изменения структуры иммобилизованного антигена, также могут являться химическими веществами, например, сукцинимидильные сложные эфиры и их производные, соединения, содержащие первичные амины, гидразины и карбогидразины, свободные аминокислоты и т.д.
Антигенный белок может быть иммобилизован либо на поверхностях биосенсорного чипа, либо на гранулах полистирола. Последнее можно осуществлять при помощи, например, анализа, такого как мультиплексный анализ для выявления LUMINEX™ (Luminex Corp.). Благодаря способности LUMINEX осуществлять мультиплексный анализ с до 100 различными типами гранул, LUMINEX предоставляет практически неограниченные антигенные поверхности с различными модификациями, что приводит в результате к улучшенной разрешающей способности по отношению к определению профиля эпитопов для антитела в ходе анализа при помощи биосенсора.
E. Характеристики связывания модулятора
Помимо специфичности по отношению к эпитопам, раскрытые антитела можно охарактеризовать при помощи физических характеристик, таких как, например, аффинности связывания. В связи с этим настоящее изобретение дополнительно охватывает применение антител, которые имеют высокую аффинность связывания по отношению к одной или нескольким изоформам SEZ6 или, в случае панантител, более чем одному представителю семейства SEZ6.
Выражение “KD”, используемое в данном документе, как предполагается, относится к константе диссоциации определенного взаимодействия антитело-антиген. Антитело согласно настоящему изобретения, как указано, иммуноспецифически связывается с его целевым антигеном, если константа диссоциации KD (koff/kon) составляет ≤ 10-7M. Антитело специфически связывается с антигеном с высокой аффинностью, если KD составляет ≤ 5×10-9M, и с очень высокой аффинностью, если KD составляет ≤ 5×10-10M. В одном варианте осуществления настоящего изобретения антитело имеет KD ≤ 10-9M и скорость диссоциации приблизительно 1×10-4/с. В одном варианте осуществления настоящего изобретения скорость диссоциации составляет < 1×10-5/с. В других вариантах осуществления настоящего изобретения антитела будут связываться с SEZ6 с KD от приблизительно 10-7M до 10-10M и в еще другом варианте осуществления они будут связываться с KD ≤ 2×10-10M. Другие выбранные варианты осуществления настоящего изобретения предусматривают антитела, которые имеют константу диссоциации или KD (koff/kon) менее 10-2M, менее 5×10-2M, менее 10-3M, менее 5×10-3M, менее 10-4M, менее 5×10-4M, менее 10-5M, менее 5×10-5M, менее 10-6M, менее 5×10-6M, менее 10-7M, менее 5×10-7M, менее 10-8M, менее 5×10-8M, менее 10-9M, менее 5×10-9M, менее 10-10M, менее 5×10-10M, менее 10-11M, менее 5×10-11M, менее 10-12M, менее 5×10-12M, менее 10-13M, менее 5×10-13M, менее 10-14M, менее 5×10-14M, менее 10-15M или менее 5×10-15M.
В конкретных вариантах осуществления антитело согласно настоящему изобретению, которое иммуноспецифически связывается с SEZ6, имеет константу скорости ассоциации или скорость kon (или ka)(SEZ6 (Ab)+антиген (Ag)kon←Ab-Ag) по меньшей мере 105M-1с-1, по меньшей мере 2×105M-1с-1, по меньшей мере 5×105M-1с-1, по меньшей мере 106M-1с-1, по меньшей мере 5×106M-1с-1, по меньшей мере 107M-1с-1, по меньшей мере 5×107M-1с-1 или по меньшей мере 108M-1с-1.
В другом варианте осуществления антитело согласно настоящему изобретению, которое иммуноспецифически связывается с SEZ6, имеет константу скорости дисссоциации или скорость koff (или kd)(SEZ6 (Ab)+антиген (Ag)koff←Ab-Ag) менее 10-1с-1, менее 5×10-1с-1, менее 10-2с-1, менее 5×10-2с-1, менее 10-3с-1, менее 5×10-3с-1, менее 10-4с-1, менее 5×10-4с-1, менее 10-5с-1, менее 5×10-5с-1, менее 10-6с-1, менее 5×10-6с-1 менее 10-7с-1, менее 5×10-7с-1, менее 10-8с-1, менее 5×10-8м-1, менее 10-9с-1, менее 5×10-9с-1 или менее 10-10с-1.
В других выбранных вариантах осуществления настоящего изобретения антитела против SEZ6 будут иметь константу аффинности или Ka (kon/koff) по меньшей мере 102M-1, по меньшей мере 5×102M-1, по меньшей мере 103M-1, по меньшей мере 5×103M-1, по меньшей мере 104M-1, по меньшей мере 5×104M-1, по меньшей мере 105M-1, по меньшей мере 5×105M-1, по меньшей мере 106M-1, по меньшей мере 5×106M-1, по меньшей мере 107M-1, по меньшей мере 5×107M-1, по меньшей мере 108M-1, по меньшей мере 5×108M-1, по меньшей мере 109M-1, по меньшей мере 5×109M-1, по меньшей мере 1010M-1, по меньшей мере 5×1010M-1, по меньшей мере 1011M-1, по меньшей мере 5×1011M-1, по меньшей мере 1012M-1, по меньшей мере 5×1012M-1, по меньшей мере 1013M-1, по меньшей мере 5×1013M-1, по меньшей мере 1014M-1, по меньшей мере 5×1014M-1, по меньшей мере 1015M-1 или по меньшей мере 5×1015M-1.
Помимо вышеупомянутых характеристик модулятора, антитела по настоящему изобретению можно дополнительно охарактеризовать при помощи дополнительных физических характеристик, в том числе, например, температурной стабильности (т.е. температура плавления; Tm) и изоэлектрических точек. (См., например, Bjellqvist et al., 1993, Electrophoresis 14:1023; Vermeer et al., 2000, Biophys. J. 78:394-404; Vermeer et al., 2000, Biophys. J. 79: 2150-2154, каждая из которых включена в настоящий документ при помощи ссылки).
VIII. Конъюгированные модуляторы
А. Обзор
Как только модуляторы по настоящему изобретению были образованы и/или получены и отобраны согласно представленным в данном документе методикам, они могут быть связаны, слиты, конъюгированы (например, ковалентно или нековалентно) или иным образом ассоциированы с фармацевтически активными частями или частями, обеспечивающими диагностику, или биологически совместимыми модификаторами. Используемые в данном документе выражения “конъюгат”, или “конъюгат модулятора”, или “конъюгат антитела” будут применяться в широком смысле и подразумевать любую биологически активную или поддающуюся обнаружению молекулу или лекарственное средство, ассоциированное с раскрытыми модуляторами независимо от способа ассоциации. В связи с этим следует понимать, что эти конъюгаты, в дополнение к раскрытым модуляторам, могут содержать пептиды, полипептиды, белки, пролекарства, которые метаболизируются до активного средства in vivo, полимеры, молекулы нуклеиновой кислоты, малые молекулы, связывающие средства, миметики, синтетические лекарственные средства, неорганические молекулы, органические молекулы и радиоактивные изотопы. Более того, как указано выше, выбранный конъюгат может быть ковалентно или нековалентно ассоциирован или связан с модулятором и характеризоваться различными стехиометрическими молярными соотношениями, в зависимости, по меньшей мере частично, от способа, применяемого для осуществления конъюгирования.
Особенно предпочтительные аспекты настоящего изобретения будут подразумевать конъюгаты модулятора на основе антитела или конъюгаты антитело-лекарственное средство, которые можно применять для диагностики и/или лечения пролиферативных расстройств. Следует понимать, что если иное не определено контекстом, выражения “конъюгат антитело-лекарственное средство” или “ADC” или формула M-[L-D]n, как подразумевается, охватывает конъюгаты, содержащие как терапевтические части, так и части, обеспечивающие диагностику. В таких вариантах осуществления конъюгированные соединения антитело-лекарственное средство будут содержать SEZ6 модулятор (как правило, антитело к SEZ6) в качестве модулятора или клеточной связывающей единицы (сокращенно CBA, M или Ab в настоящем документе), терапевтическую (например, противораковое средство) или диагностическую часть (D), а также, необязательно, линкер (L), который соединяет лекарственное средство и связывающее антиген средство. Для целей настоящего раскрытия “n”, как предусматривается, означает целое число от 1 до 20. В предпочтительном варианте осуществления модулятор представляет собой mAb к SEZ6, содержащее по меньшей мере одну CDR из вариабельных областей тяжелой и легкой цепи, как описано выше.
Специалистам в данной области будет понятно, что ряд различных реакций доступны для присоединения или ассоциации терапевтических или диагностических частей и/или линкеров со связывающими средствами. В выбранных вариантах осуществления это может быть выполнено с помощью реакции аминокислотных остатков связывающего средства, например, молекулы антитела, в том числе аминогрупп лизина, свободных карбоксильных групп глутаминовой и аспарагиновой кислот, сульфгидрильных групп цистеина и различных частей ароматических аминокислот. Одним из наиболее часто используемых неспецифических способов ковалентного присоединения является карбодиимидная реакция со связыванием карбокси- (или амино-) группы соединения с амино- (или карбокси-) группами антитела. Кроме того, бифункциональные средства, такие как диальдегиды или сложные имидоэфиры, использовали для связывания аминогруппы соединения с аминогруппами молекулы антитела. Также доступной для связывания лекарственных средств со связывающими средствами является реакция с основанием Шиффа. Этот способ предусматривает окисление периодатом лекарственного средства, которое содержит гликольные или гидроксигруппы, с образованием таким образом альдегида, которые затем подвергают реакции со связывающим средством. Присоединение происходит путем образования основания Шиффа с аминогруппами связывающего средства. Изотиоцианаты и азлактоны также могут быть использованы в качестве соединяющих средств для ковалентного присоединения лекарственных средств к связывающим средствам.
В других вариантах осуществления раскрытые модуляторы в соответствии с настоящим изобретением могут быть конъюгированы или ассоциированы с белками, полипептидами или пептидами, которые обеспечивают выбранные характеристики (например, битоксины, биомаркеры, метки очистки и т.п.). Согласно определенным предпочтительным вариантам осуществления настоящее изобретение охватывает применение модуляторов или их фрагментов, рекомбинантно слитых или химически конъюгированных (в том числе как ковалентное, так и нековалентное конъюгирование) с гетерологичным белком или пептидом, при этом белок или пептид содержит по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или по меньшей мере 100 аминокислот. Конструкция не должна быть обязательно непосредственно присоединенной, и это может происходить через аминокислотные линкерные последовательности. Например, антитела могут быть использованы для нацеливания гетерологичных полипептидов на конкретные типы клеток, экспрессирующие SEZ6, либо in vitro, либо in vivo, путем слияния или конъюгации модуляторов в соответствии с настоящим изобретением с антителами, специфичными по отношению к конкретным рецепторам клеточной поверхности, для обеспечения биспецифичных конструкций. Более того, модуляторы, слитые или конъюгированные с гетерологичными полипептидами, также могут быть использованы в in vitro иммуноанализах и могут быть особенно совместимыми с методикой очистки (например, гистидиновые метки), известной из уровня техники. См., например, международную публикацию WO 93/21232; европейский патент № 439095; Naramura et al., 1994, Immunol. Lett. 39:91-99; патент США № 5474981; Gillies et al., 1992, PNAS 89:1428-1432; и Fell et al., 1991, J. Immunol. 146:2446-2452.
B. Линкеры
Помимо вышеупомянутых пептидных линкеров или спейсеров, следует учитывать, что некоторые другие виды или типы линкера могут быть использованы для ассоциации раскрытых модуляторов с фармацевтически активными или диагностическими частями или биосовместимыми модификаторами. В некоторых вариантах осуществления линкер расщепляется при внутриклеточных условиях так, что расщепление линкера высвобождает единицу лекарственного средства из антитела во внутриклеточную среду. В других вариантах осуществления линкерная единица не расщепляется, и лекарственное средство высвобождается, например, путем разрушения антитела.
Линкеры ADC, предпочтительно, являются стабильными во внеклеточной среде, что предотвращает агрегацию ADC молекул и сохраняет ADC свободно растворимыми в водной среде и в мономерном состоянии. Перед транспортировкой или доставкой в клетку конъюгат антитело-лекарственное средство (ADC), предпочтительно, является стабильным и сохраняется интактным, т.e. антитело остается связанным с частью лекарственного средства. Линкеры являются стабильными вне целевой клетки и могут быть расщеплены при некоторой степени эффективности внутри клетки. Эффективный линкер будет: (i) сохранять свойства специфического связывания антитела; (ii) обеспечивать внутриклеточную доставку конъюгата или части лекарственного средства; (iii) сохраняться стабильным и интактным, т.e. нерасщепленным, до доставки или транспортировки конъюгата к его целевому сайту и (iv) сохранять цитотоксичность, эффект киллинга клеток или цитостатический эффект PBD части лекарственного средства. Стабильность ADC может быть измерена стандартными аналитическими методиками, такими как масс-спектроскопия, HPLC и методика разделения/анализа с помощью LC/MS. Для ковалентного соединения антитела и части лекарственного средства необходим линкер с двумя реакционноспособными функциональными группами, т.e. быть двухвалентным в смысле способности к реакции. Известны двухвалентные линкерные реагенты, которые применимы для соединения двух или более функциональных или биологически активных частей, таких как пептиды, нуклеиновые кислоты, лекарственные средства, токсины, антитела, гаптены и репортерные группы, и были описаны способы получения их конъюгатов (Hermanson, G.T. (1996) Bioconjugate Techniques; Academic Press: New York, p 234-242).
С этой целью определенные варианты осуществления настоящего изобретения предусматривают применение линкера, который может расщепляться расщепляющим средством, которое присутствует во внутриклеточной среде (например, в лизосоме, или эндосоме, или кавеоле). Линкер может быть, например, пептидильным линкером, который расщепляется внутриклеточной пептидазой или протеазой, в том числе без ограничения лизосомальной или эндосомальной протеазой. В некоторых вариантах осуществления пептидильный линкер состоит по меньшей мере из двух аминокислот или по меньшей мере из трех аминокислот. Расщепляющие средства могут включать в себя катепсины B и D, а также плазмин, каждый из которых, как известно, гидролизует дипептидные производные лекарственного средства, что приводит к высвобождению активного лекарственного средства внутри целевых клеток. Типичными пептидильными линкерами, которые могут расщепляться тиолзависимой протеазой катепсином-B, являются пептиды, содержащие Phe-Leu, так как катепсин-B, как было обнаружено, интенсивно экспрессируется в раковых тканях. Другие примеры таких линкеров раскрываются, например, в патентном документе США № 6214345 и патентный документ США № 2012/0078028, каждый из которых включен в данный документ посредством ссылки во всей своей полноте. В особенно предпочтительном варианте осуществления пептидильный линкер, расщепляемый внутриклеточной протеазой, представляет собой Val-Cit линкер, Ala-Val линкер или Phe-Lys линкер, такие как описанные в патентном документе США № 6214345. Одно преимущество применения внутриклеточного протеолитического высвобождения терапевтического средства заключается в том, что в случае конъюгирования активность средства обычно уменьшена и значения стабильности в сыворотке для конъюгатов обычно являются высокими.
В других вариантах осуществления расщепляемый линкер является чувствительным к pH, т.е. чувствительным к гидролизу при определенных значениях pH. Обычно чувствительный к pH линкер гидролизируется при кислотных условиях. Например, можно использовать нестабильный в кислотных условиях линкер, который гидролизируется в лизосоме (например, гидразон, оксим, семикарбазон, тиосемикарбазон, амид цис-аконитовой кислоты, ортоэфир, ацеталь, кеталь или т.п.) (см., например, патенты США №№ 5122368; 5824805; 5622929). Эти линкеры являются относительно стабильными при нейтральных условиях pH, например, в крови, но являются нестабильными при pH ниже 5,5 или 5,0, приблизительных значениях pH лизосомы.
В других вариантах осуществления линкер является расщепляемым при восстановительных условиях (например, дисульфидный линкер). Ряд дисульфидных линкеров известны из уровня техники, в том числе, например, те, которые могут быть образованы при помощи SATA (N-сукцинимидил-S-ацетилтиоацетат), SPDP (N-сукцинимидил-3-(2-пиридилдитио)пропионат), SPDB (N-сукцинимидил-3-(2-пиридилдитио)бутират) и SMPT (N-сукцинимидилоксикарбонил-альфа-метил-альфа-(2-пиридилдитио)толуол). В других конкретных вариантах осуществления линкер представляет собой малонатный линкер (Johnson et al., 1995, Anticancer Res. 15:1387-93), малеимидобензоильный линкер (Lau et al., 1995, Bioorg-Med-Chem. 3(10):1299-1304), или 3′-N-амидный аналог (Lau et al., 1995, Bioorg-Med-Chem. 3(10):1305-12). В других вариантах осуществления линкерная единица не расщепляется, и лекарственное средство высвобождается путем разрушения антитела. (См. патентную публикацию США № 2005/0238649, включенную в данный документ при помощи ссылки во всей полноте и для всех целей).
Более конкретно, в предпочтительных вариантах осуществления (изложены в патентном документе США № 2011/0256157, который включен в данный документ при помощи ссылки во всей его полноте) совместимые линкеры будут предусматривать:
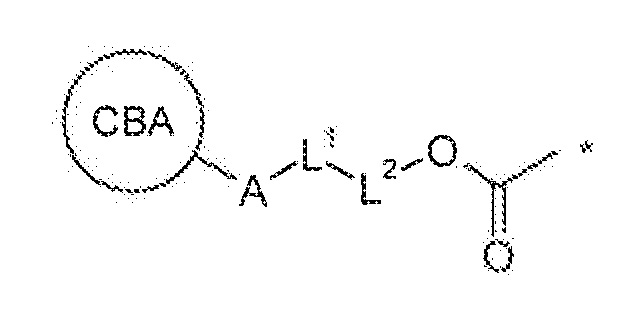
где звездочка указывает точку присоединения к цитотоксическому средству, CBA представляет собой средство связывания с клеткой/модулятор, L1 представляет собой линкер, A представляет собой соединяющую группу, соединяющую L1 с клеточным связывающим средством, L2 представляет собой ковалентную связь или вместе с -OC(=O)- образует "жертвуемый" линкер, а L1 или L2 представляет собой расщепляемый линкер.
L1, предпочтительно, представляет собой расщепляемый линкер и может быть назван триггером активации линкера для расщепления.
Природа L1 и L2, если присутствуют, может широко варьировать. Эти группы выбирают на основе их характеристик расщепления, которые могут быть обусловлены условиями на участке, к которому доставляется конъюгат. Предпочтительными являются линкеры, расщепляемые под действием ферментов, хотя также можно использовать линкеры, которые расщепляются при изменениях pH (например, нестабильные в кислотных или основных условиях), температуры или при облучении (например, фотонестабильные). Линкеры, которые расщепляются в восстановительных или окислительных условиях, также могут найти применение согласно настоящему изобретению.
L1 может содержать непрерывную последовательность аминокислот. Аминокислотная последовательность может представлять собой целевой субстрат для ферментативного расщепления, что, тем самым, обеспечивает высвобождение R10 из положения N10.
В одном варианте осуществления L1 расщепляется под действием фермента. В одном варианте осуществления ферментом является эстераза или пептидаза.
В одном варианте осуществления L2 присутствует и вместе с -C(=O)O- образует "жертвуемый" линкер. В одном варианте осуществления L2 является субстратом для ферментативной активности, что, тем самым, обеспечивает высвобождение R10 из положения N10.
В одном варианте осуществления, если L1 расщепляется под действием фермента и L2 присутствует, то фермент расщепляет связь между L1 и L2.
L1 и L2, если присутствуют, могут быть соединены при помощи связи, выбранной из:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, и -NHC(=O)NH-.
Аминогруппа L1, которая соединяется с L2, может находиться на N-конце аминокислоты или может происходить из аминогруппы боковой цепи аминокислоты, например, боковой цепи аминокислоты лизина.
Карбоксильная группа L1, которая соединяется с L2, может находиться на C-конце аминокислоты или может происходить из карбоксильной группы боковой цепи аминокислоты, например, боковой цепи аминокислоты глутаминовой кислоты.
Гидроксильная группа L1, которая соединяется с L2, может происходить из гидроксильной группы боковой цепи аминокислоты, например, боковой цепи аминокислоты серина.
Выражение “боковая цепь аминокислоты” предусматривает такие группы, обнаруживаемые во: (i) встречающихся в природе аминокислотах, таких как аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин; (ii) минорных аминокислотах, таких как орнитин и цитруллин; (iii) не встречающихся в природе аминокислотах, бета-аминокислотах, синтетических аналогах и производных встречающихся в природе аминокислот; и (iv) всех их энантиомерах, диастереомерах, обогащенных изомерами, меченых изотопами (например, 2H, 3H, 14C, 15N), защищенных формах и рацемических смесях.
В одном варианте осуществления -C(=O)O- и L2 вместе образуют группу:

где звездочка указывает положение точки присоединения к лекарственному средству или цитотоксическому средству, волнистая линия указывает точку присоединения к линкеру L1, Y представляет собой -N(H)-, -O-, -C(=O)N(H)- или -C(=O)O-, и n равняется 0-3. Фениленовое кольцо необязательно замещено одним, двумя или тремя заместителями, как описано в данном документе. В одном варианте осуществления фениленовая группа необязательно замещена галогеном, NO2, R или OR.
В одном варианте осуществления Y представляет собой NH.
В одном варианте осуществления n равняется 0 или 1. Предпочтительно, n равняется 0.
Если Y представляет собой NH и n равняется 0, "жертвуемый" линкер можно называть п-аминобензилкарбонильным линкером (PABC).
"Жертвуемый" линкер будет обеспечивать высвобождение защищенного соединения в случае активации удаленного участка при прохождении вдоль линий, показанных ниже (для n=0):
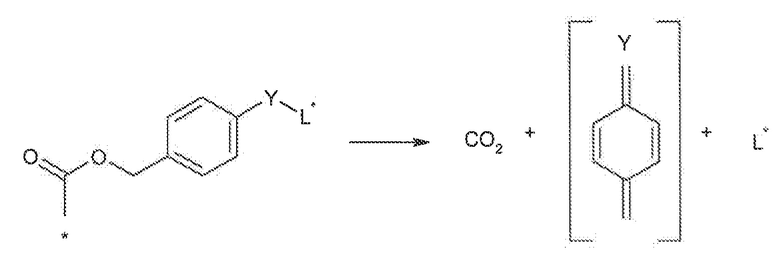
где L* представляет собой активированную форму оставшегося участка линкера. Эти группы характеризуются преимуществом, заключающимся в отделении участка активации от соединения, защита которого осуществляется. Как описано выше, фениленовая группа необязательно может быть замещенной.
В одном варианте осуществления, описанном в данном документе, группа L* представляет собой линкер L1, как описано в данном документе, который может включать в себя дипептидную группу.
В другом варианте осуществления -C(=O)O- и L2 вместе образуют группу, выбранную из:
где звездочка, волнистая линия, Y и n определены выше. Каждое фениленовое кольцо необязательно замещено одним, двумя или тремя заместителями, как описано в данном документе. В одном варианте осуществления фениленовое кольцо, имеющее заместитель Y, необязательно является замещенным, а фениленовое кольцо, не имеющее заместитель Y, является незамещенным. В одном варианте осуществления фениленовое кольцо, имеющее заместитель Y, является незамещенным, а фениленовое кольцо, не имеющее заместитель Y, необязательно является замещенным.
В другом варианте осуществления -C(=O)O- и L2 вместе образуют группу, выбранную из:
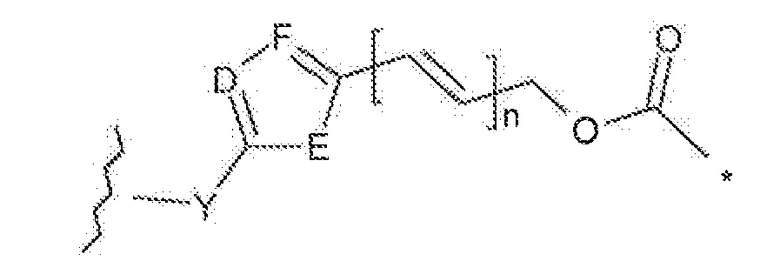
где звездочка, волнистая линия, Y и n определены выше, E представляет собой O, S или NR, D представляет собой N, CH или CR, и F представляет собой N, CH или CR.
В одном варианте осуществления D представляет собой N.
В одном варианте осуществления D представляет собой CH.
В одном варианте осуществления E представляет собой O или S.
В одном варианте осуществления F представляет собой CH.
В предпочтительном варианте осуществления линкер представляет собой линкер, нестабильный при воздействии катепсина.
В одном варианте осуществления L1 содержит дипептид. Дипептид может быть представлен как -NH-X1-X2-CO-, где -NH- и -CO- представляют собой N- и C-концы аминокислотных групп X1 и X2, соответственно. Аминокислоты в дипептиде могут представлять собой любую комбинацию природных аминокислот. Если линкер является линкером, нестабильным при воздействии катепсина, дипептид может представлять собой участок действия для катепсин-опосредованного расщепления.
Дополнительно, в случае аминокислотных групп, имеющих функциональные карбоксильные или аминогруппы боковой цепи, например Glu и Lys, соответственно, CO и NH могут представлять собой эти функциональные группы боковой цепи.
В одном варианте осуществления группа -X1-X2- в дипептиде -NH-X1-X2-CO- выбрана из:
-Phe-Lys-, -Val-Ala-, -Val-Lys-, -Ala-Lys-, -Val-Cit-, -Phe-Cit-, -Leu-Cit-, -Ile-Cit-, -Phe-Arg- и -Trp-Cit-, где Cit представляет собой цитруллин.
Предпочтительно, группа -X1-X2- в дипептиде -NH-X1-X2-CO- выбрана из:
-Phe-Lys-, -Val-Ala-, -Val-Lys-, -Ala-Lys- и -Val-Cit-.
Наиболее предпочтительно, группа -X1-X2- в дипептиде -NH-X1-X2-CO- представляет собой -Phe-Lys- или -Val-Ala-.
Можно применять другие комбинации дипептидов, в том числе описанные Dubowchik et al., Bioconjugate Chemistry, 2002, 13,855-869, которая включена в данный документ при помощи ссылки.
В одном варианте осуществления боковая цепь аминокислоты при необходимости является дериватизированной. Например, аминогруппа или карбоксильная группа боковой цепи аминокислоты может быть дериватизированной.
В одном варианте осуществления аминогруппа NH2 боковой цепи аминокислоты, такой как лизин, является дериватизированной формой, выбранной из группы, состоящей из NHR и NRR’.
В одном варианте осуществления карбоксильная группа COOH боковой цепи аминокислоты, такой как аспарагиновая кислота, является дериватизированной формой, выбранной из группы, состоящей из COOR, CONH2, CONHR и CONRR’.
В одном варианте осуществления боковая цепь аминокислоты при необходимости является химически защищенной. Защитная группа боковой цепи может представлять собой группу, как обсуждается ниже в отношении группы RL. Защищенные аминокислотные последовательности расщепляются ферментами. Например, было установлено, что дипептидная последовательность, содержащая остаток Lys, защищенный по боковой цепи при помощи Boc, расщепляется катепсином.
Защитные группы для боковых цепей аминокислот хорошо известны из уровня техники и описаны в каталоге Novabiochem. Дополнительные стратегии применительно к защитным группам изложены в Protective Groups in Organic Synthesis, Greene and Wuts.
Возможные защитные группы боковой цепи показаны ниже для тех аминокислот, которые имеют реакционноспособные функциональные группы боковой цепи:
Arg: Z, Mtr, Tos;
Asn: Trt, Xan;
Asp: Bzl, t-Bu;
Cys: Acm, Bzl, Bzl-OMe, Bzl-Me, Trt;
Glu: Bzl, t-Bu;
Gln: Trt, Xan;
His: Boc, Dnp, Tos, Trt;
Lys: Boc, Z-Cl, Fmoc, Z, Alloc;
Ser: Bzl, TBDMS, TBDPS;
Thr: Bz;
Trp: Boc;
Tyr: Bzl, Z, Z-Br.
В одном варианте осуществления защита боковой цепи выбрана так, чтобы являться независимой от группы, представленной в качестве или являющейся частью блокирующей группы, если она присутствует. Таким образом, удаление защитной группы боковой цепи не приводит к удалению блокирующей группы или любой функциональной группы, относящейся к защитной группе, которая является частью блокирующей группы.
В других вариантах осуществления настоящего изобретения выбранные аминокислоты не имеют реакционноспособной функциональной группы боковой цепи. Например, аминокислоты могут быть выбраны из: Ala, Gly, Ile, Leu, Met, Phe, Pro и Val.
В одном варианте осуществления дипептид применяется в комбинации с "жертвуемым" линкером. "Жертвуемый" линкер может быть соединен с -X2-.
Если "жертвуемый" линкер присутствует, -X2- непосредственно соединен с "жертвуемым" линкером. Предпочтительно, группа -X2-CO- соединена с Y, где Y представляет собой NH, тем самым образуется группа -X2-CO-NH-.
-NH-X1- непосредственно соединен с A. A может содержать функциональную группу -CO-, при этом образуется амидная связь с -X1-.
В одном варианте осуществления L1 и L2 вместе с -OC(=O)- содержат группу NH-X1-X2-CO-PABC-. Группа PABC непосредственно соединена с цитотоксическим средством. Предпочтительно, "жертвуемый" линкер и дипептид вместе образуют группу -NH-Phe-Lys-CO-NH-PABC-, которая проиллюстрирована ниже:
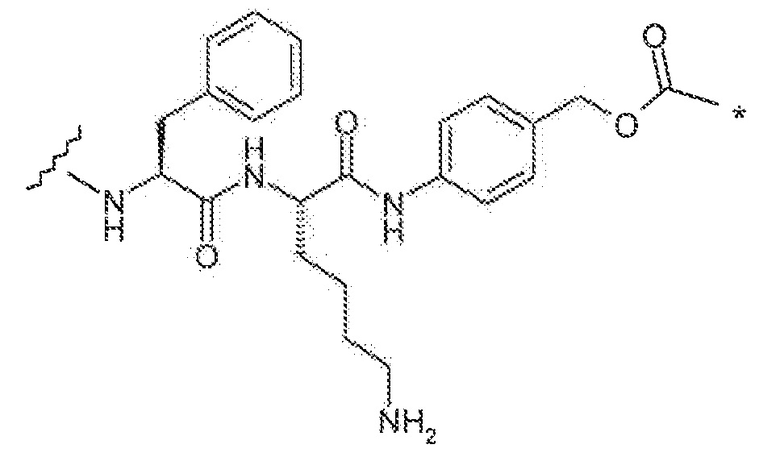
где звездочка указывает точку присоединения к выбранной цитотоксической части, и волнистая линия указывает точку присоединения к оставшемуся участку линкера L1 или точку присоединения к A. Предпочтительно, волнистая линия указывает точку присоединения к A. Боковая цепь аминокислоты Lys может быть защищенной, например, при помощи Boc, Fmoc или Alloc, как описано выше.
В альтернативном случае, "жертвуемый" линкер и дипептид вместе образуют группу -NH-Val-Ala-CO-NH-PABC-, которая проиллюстрирована ниже:

где звездочка и волнистая линия определены выше.
В альтернативном случае, "жертвуемый" линкер и дипептид вместе образуют группу -NH-Val-Cit-CO-NH-PABC-, которая проиллюстрирована ниже:
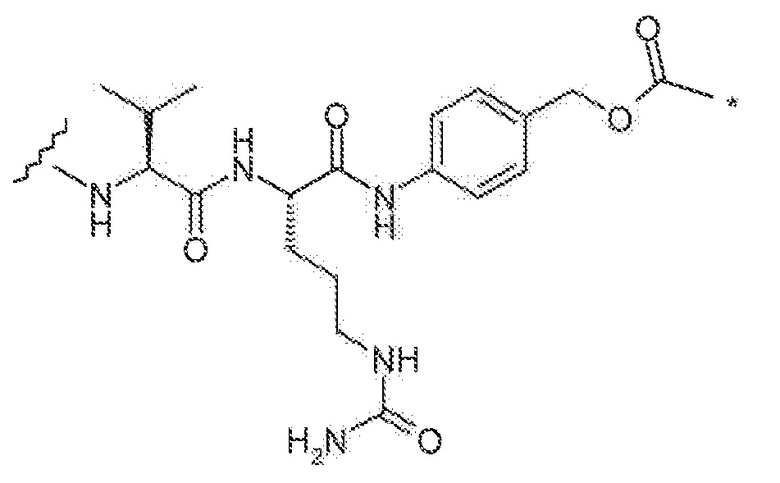
где звездочка и волнистая линия определены выше.
В некоторых вариантах осуществления настоящего изобретения будет предпочтительно, если часть лекарственное средство, содержит незащищенную иминную связь, например, если часть B присутствует, то линкер не содержит свободную аминогруппу (H2N-). Таким образом, если линкер имеет структуру -A-L1-L2-, то он предпочтительно, не будет содержать свободную аминогруппу. Это предпочтение является особенно значимым, если линкер содержит дипептид, например, в качестве L1; причем в этом варианте осуществления будет предпочтительно, если одна из двух аминокислот не выбрана из лизина.
Без углубления в теорию, комбинация незащищенной иминовой связи в части лекарственного средства и свободной аминогруппы в линкере может вызывать димеризацию части лекарственное средство-линкер, которая может мешать конъюгации такой части лекарственное средство-линкер с антителом. Реакцию между этими группами можно ускорить в случае, если свободная аминогруппа присутствует в виде иона аммония (H3N+-), например, если сильную кислоту (например, TFA) применяли для снятия защиты со свободной аминогруппы.
В одном варианте осуществления A представляет собой ковалентную связь. Таким образом, L1 и средство связывания с клеткой непосредственно соединены. Например, если L1 содержит непрерывную аминокислотную последовательность, N-конец последовательности может непосредственно соединяться со средством связывания с клеткой.
Таким образом, если A представляет собой ковалентную связь, соединяющая часть между средством связывания с клеткой, и L1 может быть выбрана из:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-, -C(=O)NHC(=O)-, -S-, -S-S-, -CH2C(=O)- и =N-NH-.
Аминогруппа L1, которая соединяется с SEZ6 модулятором, может находиться на N-конце аминокислоты или может происходить из аминогруппы боковой цепи аминокислоты, например, боковой цепи аминокислоты лизина.
Карбоксильная группа L1, которая соединяется с модулятором, может находиться на C-конце аминокислоты или может происходить из карбоксильной группы боковой цепи аминокислоты, например, боковой цепи аминокислоты глутаминовой кислоты.
Гидроксильная группа L1, которая соединяется со средством связывания с клеткой, может происходить из гидроксильной группы боковой цепи аминокислоты, например, боковой цепи аминокислоты серина.
Тиольная группа L1, которая соединяется с модуляторным средством, может происходить из тиольной группы боковой цепи аминокислоты, например, боковой цепи аминокислоты серина.
Примечания, приведенные выше по отношению к аминогруппе, карбоксильной, гидроксильной и тиольной группам L1, также применяются к средству связывания с клеткой.
В одном варианте осуществления L2 вместе с -OC(=O)- представляет собой:
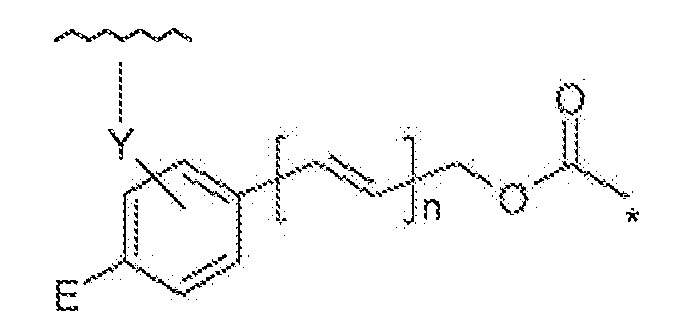
где звездочка указывает точку присоединения к положению N10, волнистая линия указывает точку присоединения к L1, n равняется 0-3, Y представляет собой ковалентную связь или функциональную группу, и E представляет собой активируемую группу, например, при помощи ферментативного воздействия или света, таким образом, с образованием "жертвуемой" структурной единицы. Фениленовое кольцо необязательно дополнительно замещено одним, двумя или тремя заместителями, как описано в данном документе. В одном варианте осуществления фениленовая группа необязательно дополнительно замещена галогеном, NO2, R или OR. Предпочтительно, n равняется 0 или 1, наиболее предпочтительно, 0.
E выбран так, что группа является поддающейся активации, например, при помощи света или под воздействием фермента. E может представлять собой -NO2 или глюкуроновую кислоту. Первое может быть поддающимся воздействию нитроредуктазы, второе - воздействию β-глюкуронидазы.
В этом варианте осуществления "жертвуемый" линкер будет обеспечивать высвобождение защищенного соединения, если E является активированным, причем это осуществляется вдоль линий, показанных ниже (для n=0):
где звездочка указывает положение точки присоединения к положению N10, E* представляет собой активированную форму E, и Y является описанным выше. Эти группы характеризуются преимуществом, заключающимся в отделении участка активации от соединения, защита которого осуществляется. Как описано выше, фениленовая группа необязательно может быть замещенной.
Группой Y может быть ковалентная связь с L1.
Группой Y может быть функциональная группа, выбранная из:
-C(=O)-, -NH-, -O-, -C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-, -NHC(=O)NH, -C(=O)NHC(=O)- и -S-.
Если L1 представляет собой дипептид, будет предпочтительным то, что Y представляет собой -NH- или -C(=O)- с образованием тем самым амидной связи между L1 и Y. В этом варианте осуществления дипептидная последовательность может не быть субстратом для ферментативной активности.
В другом варианте осуществления A представляет собой спейсерную группу. Таким образом, L1 и средство связывания с клеткой соединены опосредованно.
L1 и A могут быть соединены связью, выбранной из:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH- и -NHC(=O)NH-.
Предпочтительно, линкер содержит электрофильную функциональную группу для реакции с нуклеофильной функциональной группой в модуляторе. Нуклеофильные группы на антителах включают в себя без ограничения: (i) N-концевые аминогруппы, (ii) аминогруппы боковой цепи, например, лизин, (iii) тиольные группы боковой цепи, например, цистеин, и (iv) гидроксильные или аминогруппы сахара, если антитело является гликозилированным. Амино, тиольные и гидроксильные группы являются нуклеофильными и способны к реагированию с образованием ковалентных связей с электрофильными группами в линкерных частях и линкерных реагентах, в том числе: (i) малеимидными группами, (ii) активированными дисульфидами, (iii) активными сложными эфирами, такими как NHS (N-гидроксисукцинимидными) сложными эфирами, HOBt (N-гидроксибензотриазольными) сложными эфирами, галогенформиатами и галогенангидридами; (iv) алкильными и бензильными галоидами, такими как галогенацетамиды; и (v) альдегидами, кетонами, карбоксилом, а также некоторыми из показанных далее:
Определенные антитела имеют восстанавливаемые дисульфиды между цепями, т.е. цистеиновые мостики. Антитела можно сделать реакционноспособными для конъюгации с линкерными реагентами при обработке восстанавливающим средством, таким как DTT (дитиотреитол). Каждый цистеиновый мостик будет, таким образом, теоретически образовывать два реакционноспособных тиоловых нуклеофила. Дополнительные нуклеофильные группы можно вводить в антитела посредством реакции лизинов с 2-иминотиоланом (реагент Траута), приводящей в результате к превращению амина в тиол. Реакционноспособные тиольные группы можно вводить в антитело (или ее фрагмент) путем введения одного, двух, трех, четырех или более цистеиновых остатков (например, получение мутантных антител, содержащих один или несколько ненативных цистеиновых аминокислотных остатков). В патенте США № 7521541 описывается конструирование антител путем введения реакционноспособных цистеиновых аминокислот.
В некоторых вариантах осуществления линкер имеет реакционноспособную нуклеофильную группу, которая является способной к реакции с электрофильной группой, присутствующей на антителе. Пригодные электрофильные группы на антителе включают без ограничения альдегидную и кетоновую карбонильную группу. Гетероатом в нуклеофильной группе линкера может реагировать с электрофильной группой на антителе и образовывать ковалентную связь с единицей антитела. Пригодные нуклеофильные группы на линкере включают без ограничения гидразин, оксим, амино, гидроксил, гидразина, тиосемикарбазона, гидразин-карбоксилата и арилгидразида. Электрофильная группа на антителе обеспечивает удобный участок для прикрепления линкера.
В одном варианте осуществления группа A представляет собой:
где звездочка указывает положение точки присоединения к L1, волнистая линия указывает точку присоединения к средству связывания с клеткой, и n равняется от 0 до 6. В одном варианте осуществления n равняется 5.
В одном варианте осуществления группа A представляет собой:
где звездочка указывает положение точки присоединения к L1, волнистая линия указывает точку присоединения к средству связывания с клеткой, и n равняется от 0 до 6. В одном варианте осуществления n равняется 5.
В одном варианте осуществления группа A представляет собой:
где звездочка указывает положение точки присоединения к L1, волнистая линия указывает точку присоединения к средству связывания с клеткой, и n равняется 0 или 1, а m равняется от 1 до 30. В предпочтительном варианте осуществления n равняется 1, а m равняется 0-10, 1 или 8, предпочтительно, 4-8 и, наиболее предпочтительно, 4 или 8. В другом варианте осуществления m равняется от 10 до 30 и, предпочтительно, от 20 до 30. В альтернативном случае, m равняется от 0 до 50. В этом варианте осуществления m, предпочтительно, равняется 10-40, и n равняется 1.
В одном варианте осуществления группа A представляет собой:
где звездочка указывает положение точки присоединения к L1, волнистая линия указывает точку присоединения к средству связывания с клеткой, и n равняется 0 или 1, а m равняется от 1 до 30. В предпочтительном варианте осуществления n равняется 1, а m равняется 0-10, 1 или 8, предпочтительно, 4-8 и, наиболее предпочтительно, 4 или 8. В другом варианте осуществления m равняется от 10 до 30 и, предпочтительно, от 20 до 30. В альтернативном случае, m равняется от 0 до 50. В этом варианте осуществления m, предпочтительно, равняется 10-40, и n равняется 1.
В одном варианте осуществления соединение между средством связывания с клеткой и A осуществляется через тиоловый остаток средства связывания с клеткой и малеимидную группу A.
В одном варианте осуществления соединение между средством связывания с клеткой и A представляет собой:

где звездочка указывает положение точки присоединения к оставшемуся участку A, и волнистая линия указывает точку присоединения к оставшемуся участку средства связывания с клеткой. В этом варианте осуществления атом S, как правило, происходит из модулятора.
В каждом из вариантов осуществления выше альтернативную функциональную группу можно применять вместо происходящей из малеимида группы, показанной ниже:
где волнистая линия указывает точку присоединения к средству связывания с клеткой, как указано ранее, и звездочка указывает связь с оставшимся участком группы A.
В одном варианте осуществления происходящая из малеимида группа заменена группой:
где волнистая линия указывает точку присоединения к средству связывания с клеткой, и звездочка указывает связь с оставшимся участком группы A.
В одном варианте осуществления происходящая из малеимида группа заменена группой, которая необязательно вместе со средством связывания с клеткой выбрана из:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-, -NHC(=O)NH, -C(=O)NHC(=O)-, -S-, -S-S-, -CH2C(=O)-, -C(=O)CH2-, =N-NH- и -NH-N=.
В одном варианте осуществления происходящая из малеимида группа заменена группой, которая необязательно вместе со средством связывания с клеткой выбрана из:
где волнистая линия указывает либо точку присоединения к средству связывания с клеткой, либо связь с оставшимся участком группы A, и звездочка указывает другую из точек присоединения к средству связывания с клеткой или связь с оставшимся участком группы A.
Другие группы, подходящие для соединения L1 с выбранным модулятором описаны в WO 2005/082023.
В другом предпочтительном варианте осуществления модуляторы по настоящему изобретению могут быть соединены с биологически совместимыми полимерами, содержащими линкерные группы для лекарственных средств. В связи с этим один такой тип совместимого полимера включает полимеры Fleximer® (Mersana Therapeutics). Такие полимеры по сообщениям являются биоразлагаемыми, хорошо переносимыми и были клинически подтверждены. Более того, такие полимеры являются совместимыми с рядом удовлетворяющих требованиям технологий создания линкеров и их химических свойств, что обеспечивает контроль фармакокинетических показателей, локализацию высвобождения лекарственного средства и улучшенное биораспределение.
Выбранные модуляторы могут также быть непосредственно конъюгированы с радиоактивными изотопами или могут содержать макроциклические хелаторы, пригодные для конъюгации ионов радиоактивных металлов (как описано в данном документе). В определенных вариантах осуществления макроциклический хелатор представляет собой 1,4,7,10-тетраазациклододекан-N,N',N'',N''-тетрауксусную кислоту (DOTA), которая может быть присоединена к антителу через линкерную молекулу. Такие линкерные молекулы широко известны из уровня техники и описаны в Denardo et al., 1998, Clin Cancer Res. 4:2483; Peterson et al., 1999, Bioconjug. Chem. 10:553; и Zimmerman et al., 1999, Nucl. Med. Biol. 26:943.
В более общем смысле методики конъюгирования терапевтических фрагментов или цитотоксических средств с модуляторами являются хорошо известными. Как обсуждалось выше, фрагменты могут быть конъюгированы с модуляторами с помощью любого принятого в данной области техники способа, в том числе, без ограничения, альдегидный мостик/мостик-основание Шиффа, сульфгидрильный мостик, кислотонеустойчивый мостик, цис-аконитиловый мостик, гидразоновый мостик, ферментативно разрушаемый мостик (см., в общем, Garnett, 2002, Adv Drug Deliv Rev 53:171). Также см., например, Amon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", в Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", в Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", в Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", в Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985), и Thorpe et al., 1982, Immunol. Rev. 62:119. В предпочтительных вариантах осуществления a модулятор SEZ6 другими словами конъюгированы a терапевтические фрагмент или цитотоксическое средство могут быть интернализованы клеткой после связывания с молекулой SEZ6, соединенной с поверхностью клетки, доставляя таким образом терапевтическую полезную нагрузку.
C. Биосовместимые модификаторы
В выбранных вариантах осуществления модуляторы по настоящему изобретению могут быть конъюгированы или иным образом ассоциированы с биосовместимыми модификаторами, которые могут быть использованы для регулирования, изменения, улучшения или ослабления модуляторных характеристик при необходимости. Например, антитела или слитые конструкции с повышенным сроком полужизни in vivo могут быть образованы путем присоединения полимерных молекул с относительно высокой молекулярной массой, таких как коммерчески доступный полиэтиленгликоль (PEG) или подобные биосовместимые полимеры. Специалистам в данной области будет понятно, что PEG может быть получен со многими отличающимися молекулярными массами и молекулярными конфигурациями, которые могут быть выбраны для обеспечения специфичных свойств для антитела (например, может быть подобран срок полужизни). PEG может быть присоединен к модуляторам или фрагментам или производным антител с помощью мультифункционального линкера или без него посредством сайт-специфической конъюгации PEG к N- или C-концу указанных антител или фрагментов антител или через эпсилон-аминогруппы, присутствующие на лизиновых остатках. Можно применять дериватизацию линейного или разветвленного полимера, что приводит в результате к минимальной потере биологической активности. Степень конъюгации может быть с большой точностью отслеживать с помощью SDS-PAGE и масс-спектрометрии, чтобы гарантировать оптимальную конъюгацию молекул PEG с молекулами антител. Непрореагировавший PEG можно отделить от конъюгатов антитело-PEG с помощью, например, гель-хроматографии или ионообменной хроматографии. Подобным образом, раскрытые модуляторы могут быть конъюгированы с альбумином для того, чтобы сделать антитело или фрагмент антитела более стабильным in vivo или с более длительным временем полужизни in vivo. Методики хорошо известны в уровне техники, см. например, публикации международных заявок №№ WO 93/15199, WO 93/15200 и WO 01/77137; и европейский патент № 0413622. Другие биологически совместимые конъюгаты очевидны для специалиста в данной области техники, и их можно легко идентифицировать в соответствии с изложенным в данном документе.
D. Средства диагностики или выявления
В других предпочтительных вариантах осуществления модуляторы по настоящему изобретению или их фрагменты или производные конъюгированы с обеспечивающим диагностику или выявляемым средством, маркером или репортером, которые могут представлять собой, например, биологическую молекулу (например, пептид или нуклеотид), малую молекулу, флуорофор или радиоизотоп. Меченые модуляторы могут использоваться для мониторинга развития или прогрессирования гиперпролиферативного расстройства или как часть процедуры клинического исследования для определения эффективности конкретной терапии, в том числе раскрытых модуляторов (т.е. терагностика), или для определения дополнительного курса лечения. Такие маркеры или репортеры могут также использоваться при очистке выбранного модулятора, анализе модулятора (например, связывания эпитопа или связывания антитела), разделении или выделении TIC или в доклинических процедурах или токсикологических исследованиях.
Такой диагностический анализ и/или выявление может выполняться путем соединения модулятора с выявляемыми веществами, в том числе без ограничения различными ферментами, включающими, например, пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; простетическими группами, такими как без ограничения стрептавидин-биотин и авидин/биотин; флуоресцентными материалами, такими как без ограничения умбеллиферон, флуоресцеин, флоресцеин-изотиоцианат, родамин, дихлортриазиниламин-флуоресцеин, дансил хлорид или фикоэритрин; люминисцентными материалами, такими как без ограничения люминол; биолюминисцентными материалами, такими как без ограничения люцифераза, люциферин и экворин; радиоактивными материалами, такими как без ограничения йод (131I, 125I, 123I, 121I), углерод (14C), сера (35S), тритий (3H), индий (115In, 113In, 112In, 111In) и технеций (99Tc), талий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (133Xe), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn и 117Tin; испускающими позитроны металлами, используемыми в различных вариантах позитронно-эмиссионной томографии, ионами нерадиоактивных парамагнитных металлов и молекулами, которые содержат радиоактивную метку или конъюгированы со специфическими радиоактивными изотопами. В таких вариантах осуществления приемлемый метод выявления хорошо известен в уровне техники и легко доступен из ряда коммерческих источников.
Как указано выше, в других вариантах осуществления модуляторы или их фрагменты могут быть слиты или конъюгированы с маркерными последовательностями или соединениями, такими как пептид или флуорофор, для облегчения очистки, или диагностических или аналитических процедур, таких как иммуногистохимия, биослойная интерферометрия, поверхностный плазмонный резонанс, проточная цитометрия, конкурентный ELISA, FAC и т.п. В предпочтительных вариантах осуществления маркер содержит гистидиновую метку, например, предоставленную вектором pQE (Qiagen), среди прочих, многие из которых коммерчески доступны. Другие пептидные метки, применимые для очистки, включают в себя без ограничения гемагглютининовую "HA" метку, которая соответствует эпитопу, полученному из белка гемагглютинина гриппа (Wilson et al., 1984, Cell 37:767), и "flag" метку (патент США № 4703004).
E. Терапевтические части
Как упоминалось ранее, модуляторы или их фрагменты или производные также могут быть конъюгированы, связаны или слиты или иным образом ассоциированы с “терапевтической частью” или “лекарственным средством”, таким как антипролиферативное или противораковое средство, в том числе без ограничения цитотоксические средства, цитостатические средства, противоангиогенные средства, циторедуцирующие средства, химиотерапевтические средства, лучевую терапию и радиотерапевтические средства, противораковые средства направленного действия, BRM, терапевтические антитела, противораковые вакцины, цитокины, гормональные терапевтические средства, средства лучевой терапии и противометастатические средства и иммунотерапевтические средства.
Предпочтительные иллюстративные противораковые средства включают цитохалазин B, грамицидин D, этидиум бромид, эметин, митомицин, этопозид, тенопозид, викристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрацин, майтансиноиды, такие как DM-1 и DM-4 (Immunogen, Inc.), дион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, эпирубицин и циклофосфамид, а также их аналоги или гомологи. Дополнительные совместимые цитотоксины включают доластатины и ауристатины, в том числе монометилауристатин E (MMAE) и монометилауристатин F (MMAF) (Seattle Genetics, Inc.), аманитины, такие как альфа-аманитин, бета-аманитин, гамма-аманитин или эпсилон-аманитин (Heidelberg Pharma AG), средства связывания малой бороздки ДНК, такие как производные дуокармицина (Syntarga, B.V.) и модифицированные димеры пирролобензодиазепина (Spirogen, Ltd.), ингибиторы сплайсинга, такие как аналоги или производные меямицина (например, FR901464, как изложено в патентном документе США № 7825267), средства связывания микротрубочек, такие как аналоги эпотилона и паклитаксел, и ДНК-повреждающие средства, такие калихеамицины и эсперамицины. Кроме того, в определенных вариантах осуществления SEZ6 модуляторы по настоящему изобретению могут быть ассоциированы с молекулами, связывающими CD3, для рекрутинга цитотоксических T-клеток и нацеливания их на клетки, вызывающие развитие опухоли (BiTE technology; см. например, Fuhrmann, S. et. al. Annual Meeting of AACR Abstract No. 5625 (2010), которая включена в настоящий документ посредством ссылки).
Кроме того, дополнительные совместимые противораковые средства включают, но без ограничения, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил декарбазин), алкилирующие средства (например, мехлорэтамин, тиоэпа, хлорамбуцил, мелфалан, кармустин (BCNU) и ломустин (CCNU), бусульфан, дибромманнитол, стрептозотоцин и цис-дихлордиаминплатину (II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин и антрамицин (AMC)) и антимитотические средства (например, винкристин и винбластин). Более обширный перечень терапевтических частей можно найти в публикации PCT WO 03/075957 и патентном документе США № 2009/0155255, каждый из которых включен в настоящий документ при помощи ссылки.
Как указано выше, выбранные варианты осуществления настоящего изобретения направлены на конъюгированные SEZ6 модуляторы, такие как конъюгаты антитела против SEZ6 и лекарственного средства, которые содержат пирролобензодиазепин (PBD) в качестве цитотоксического средства. Следует понимать, что PBD представляют собой алкилирующие средства, которые оказывают противоопухолевую активность посредством ковалентного связывания с ДНК в малой бороздке и ингибирования синтеза нуклеиновых кислот. В связи с этим было показано, что PBD имеют сильные противоопухолевые свойства, при этом характеризуются минимальным подавлением костного мозга. PBD, совместимые с настоящим изобретением, могут быть связаны с SEZ6 модулятором при помощи любого из нескольких типов линкеров (например, пептидильного линкера, содержащего малеимидоную часть со свободным сульфгидрилом) и в определенных вариантах осуществления находятся в димерной форме (т.e. димеры PBD). Совместимые PBD (и необязательные линкеры), которые могут быть конъюгированы с раскрытыми модуляторами, описаны, например, в патентных документах США №№ 6362331, 7049311, 7189710, 7429658, 7407951, 7741319, 7557099, 8034808, 8163736, патентном документе США № 2011/0256157 и поданных заявках PCT WO2011/130613, WO2011/128650 и WO2011/130616, каждый из которых включен в настоящий документ при помощи ссылки. Следовательно, в особенно предпочтительных вариантах осуществления модулятор будет подразумевать антитело к SEZ6, конъюгированное или ассоциированное с одним или несколькими димерами PBD (т.е. SEZ6-PBD ADC).
В особенно предпочтительных вариантах осуществления совместимые PBD, которые могут быть конъюгированы с раскрытыми модуляторами, описаны в патентном документе США № 2011/0256157. В данном раскрытии димеры PBD, т.е. содержащие две части PBD, могут быть предпочтительными. Таким образом, предпочтительными конъюгатами по настоящему изобретению являются конъюгаты формулы (AB) или (AC):
где:
пунктирные линии обозначают необязательное присутствие двойной связи между C1 и C2 или C2 и C3;
R2 независимо выбран из H, OH, =O, =CH2, CN, R, OR, =CH-RD, =C(RD)2, O-SO2-R, CO2R и COR, а также необязательно дополнительно выбран из галогена или дигалогена;
где RD независимо выбран из R, CO2R, COR, CHO, CO2H и галогена;
R6 и R9 независимо выбраны из H, R, OH, OR, SH, SR, NH2, NHR, NRR’, NO2, Me3Sn и галогена;
R7 независимо выбран из H, R, OH, OR, SH, SR, NH2, NHR, NRR’, NO2, Me3Sn и галогена;
R10 представляет собой линкер, соединенный с модулятором или его фрагментом или производным, как описано выше;
Q независимо выбран из O, S и NH;
R11 представляет собой либо H, либо R, или где Q представляет собой O, SO3M, где M представляет собой катион металла;
каждый из R и R' независимо выбран из необязательно замещенных C1-12алкильных, C3-20гетероциклильных и C5-20арильных групп, и в отношении группы NRR’ необязательно R и R' вместе с атомом азота, к которому они присоединяются, образуют необязательно замещенное 4-, 5-, 6- или 7-членное гетероциклическое кольцо; и
где R2'', R6'', R7'', R9'', X'', Q'' и R11'' являются такими, как определено для R2, R6, R7, R9, X, Q и R11, соответственно, и RC представляет собой блокирующую группу.
Двойная связь
В одном варианте осуществления двойная связь отсутствует между C1 и C2, а также C2 и C3.
В одном варианте осуществления пунктирные линии обозначают необязательное присутствие двойной связи между C2 и C3, как показано ниже:
В одном варианте осуществления двойная связь присутствует между C2 и C3, если R2 представляет собой C5-20арил или C1-12алкил.
В одном варианте осуществления пунктирные линии обозначают необязательное присутствие двойной связи между C1 и C2, как показано ниже:
В одном варианте осуществления двойная связь присутствует между C1 и C2, если R2 представляет собой C5-20арил или C1-12алкил.
R2
В одном варианте осуществления R2 независимо выбран из H, OH, =O, =CH2, CN, R, OR, =CH-RD, =C(RD)2, O-SO2-R, CO2R и COR, а также необязательно дополнительно выбран из галогена или дигалогена.
В одном варианте осуществления R2 независимо выбран из H, OH, =O, =CH2, CN, R, OR, =CH-RD, =C(RD)2, O-SO2-R, CO2R и COR.
В одном варианте осуществления R2 независимо выбран из H, =O, =CH2, R, =CH-RD, и =C(RD)2.
В одном варианте осуществления R2 независимо представляет собой H.
В одном варианте осуществления R2 независимо представляет собой =O.
В одном варианте осуществления R2 независимо представляет собой =CH2.
В одном варианте осуществления R2 независимо представляет собой =CH-RD. В соединении PBD группа =CH-RD может иметь любую конфигурацию, показанную ниже:
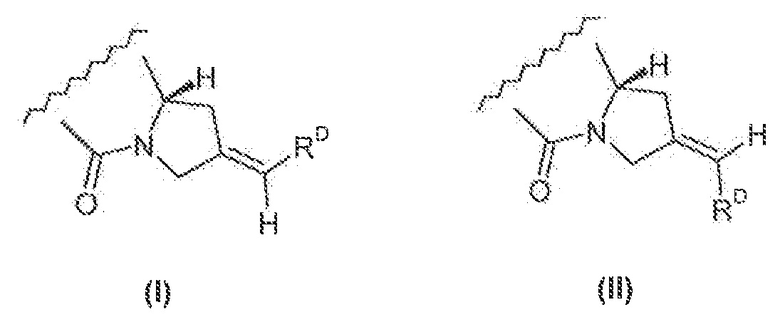
В одном варианте осуществления конфигурацией является конфигурация (I).
В одном варианте осуществления R2 независимо представляет собой =C(RD)2.
В одном варианте осуществления R2 независимо представляет собой =CF2.
В одном варианте осуществления R2 независимо представляет собой R.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный C5-20арил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный C1-12алкил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный C5-20арил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный C5-7арил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный C8-10арил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный фенил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный нафтил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный пиридил.
В одном варианте осуществления R2 независимо представляет собой необязательно замещенный хинолинил или изохинолинил.
В одном варианте осуществления R2 несет одну-три группы-заместителя, при этом 1 и 2 являются более предпочтительными, и однозамещенные группы являются наиболее предпочтительными. Заместители могут находиться в любом положении.
Если R2 представляет собой C5-7арильную группу, один заместитель, предпочтительно, находится на кольцевом атоме, который не является соседним по отношению к связи с остальной частью соединения, т.e., предпочтительно, β или γ по отношению к связи с остальной частью соединения. Следовательно, если C5-7арильная группа представляет собой фенил, то заместитель, предпочтительно, находится в мета- или пара-положениях, и более предпочтительно, находится в пара-положении.
В одном варианте осуществления R2 выбран из:
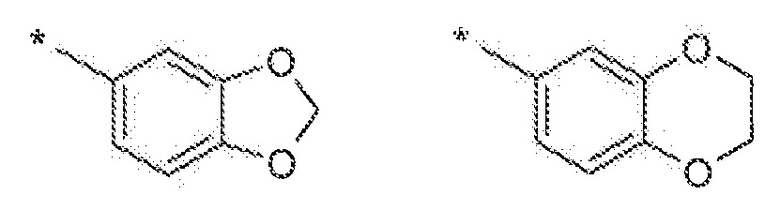
где звездочка обозначает точку присоединения.
Где R2 представляет собой C8-10арильную группу, например, хинолинил или изохинолинил, он может нести любое число заместителей в любом положении хинолинового или изохинолинового колец. В некоторых вариантах осуществления он несет один, два или три заместителя, и они могут находиться либо на проксимальном и дистальном кольцах, либо и на том, и на другом (если заместителей больше одного).
В одном варианте осуществления если R2 необязательно замещен, то заместители выбраны из тех заместителей, приведенных в разделе заместителей ниже.
Если R необязательно замещен, то заместители, предпочтительно, выбраны из:
галогена, гидроксила, эфира, формила, ацила, карбокси, сложного эфира, ацилокси, амино, амидо, ациламидо, аминокарбонилокси, уреидо, нитро, циано и тиоэфира.
В одном варианте осуществления если R или R2 необязательно замещен, то заместители выбраны из группа, состоящей из R, OR, SR, NRR’, NO2, галогена, CO2R, COR, CONH2, CONHR и CONRR’.
Если R2 представляет собой C1-12алкил, то необязательный заместитель может дополнительно включать C3-20гетероциклильные и C5-20арильные группы.
Если R2 представляет собой C3-20гетероциклил, то необязательный заместитель может дополнительно включать C1-12алкильные и C5-20арильные группы.
Если R2 представляет собой C5-20арильные группы, то необязательный заместитель может дополнительно включать C3-20гетероциклильные и C1-12алкильные группы.
Следует понимать, что термин “алкил” охватывает подклассы алкенила и алкинила, а также циклоалкил. Таким образом, если R2 представляет собой необязательно замещенный C1-12алкил, то следует понимать, что алкильная группа необязательно содержит одну или несколько двойных или тройных связей углерод-углерод, которые могут образовывать часть конъюгированной системы. В одном варианте осуществления необязательно замещенная C1-12алкильная группа содержит по меньшей мере одну двойную или тройную связь углерод-углерод, и эта связь конъюгирована с двойной связью, присутствующей между C1 и C2 или C2 и C3. В одном варианте осуществления C1-12алкильной группой является группа, выбранная из насыщенного C1-12алкила, C2-12алкенила, C2-12алкинила и C3-12циклоалкила.
Если заместителем на R2 является галоген, он, предпочтительно, представляет собой F или Cl, более предпочтительно, Cl.
Если заместителем на R2 является эфир, в некоторых вариантах осуществления он может быть алкоксигруппой, например, C1-7алкокси группой (например, метокси, этокси), или в некоторых вариантах осуществления он может быть C5-7арилоксигруппой (например, фенокси, пиридилокси, фуранилокси).
Если заместителем на R2 является C1-7алкил, предпочтительно, он может быть C1-4алкильной группой (например, метил, этил, пропил, бутил).
Если заместителем на R2 является C3-7гетероциклил, в некоторых вариантах осуществления он может быть C6 содержащей азот гетероциклильной группой, например, морфолино, тиоморфолино, пиперидинил, пиперазинил. Эти группы могут быть связаны с остатком части PBD через атом азота. Эти группы могут быть далее замещены, например, C1-4алкильными группами.
Если заместителем на R2 является бис-окси-C1-3алкилен, то предпочтительно, он представляет собой бис-окси-метилен или бис-окси-этилен.
Особенно предпочтительные заместители для R2 включают метокси, этокси, фтор, хлор, циано, бис-окси-метилен, метил-пиперазинил, морфолино и метил-тиенил.
Особенно предпочтительные замещенные R2 группы включают без ограничения 4-метокси-фенил, 3-метоксифенил, 4-этокси-фенил, 3-этокси-фенил, 4-фтор-фенил, 4-хлор-фенил, 3,4-бис-оксиметилен-фенил, 4-метилтиенил, 4-цианофенил, 4-феноксифенил, хинолин-3-ил и хинолин-6-ил, изохинолин-3-ил и изохинолин-6-ил, 2-тиенил, 2-фуранил, метоксинафтил и нафтил.
В одном варианте осуществления R2 представляет собой галоген или дигалоген. В одном варианте осуществления R2 представляет собой -F или -F2, заместители которого показаны ниже как (III) и (IV), соответственно.
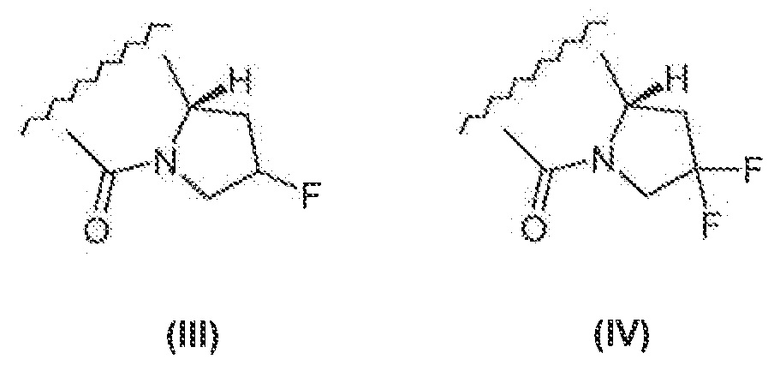
RD
В одном варианте осуществления RD независимо выбран из R, CO2R, COR, CHO, CO2H и галогена.
В одном варианте осуществления RD независимо представляет собой R.
В одном варианте осуществления RD независимо представляет собой галоген.
R6
В одном варианте осуществления R6 независимо выбран из H, R, OH, OR, SH, SR, NH2, NHR, NRR’, NO2, Me3Sn- и галогена.
В одном варианте осуществления R6 независимо выбран из H, OH, OR, SH, NH2, NO2 и галогена.
В одном варианте осуществления R6 независимо выбран из H и галогена.
В одном варианте осуществления R6 независимо представляет собой H.
В одном варианте осуществления R6 и R7 вместе образуют группу -O-(CH2)p-O-, где p равняется 1 или 2.
R7
R7 независимо выбран из H, R, OH, OR, SH, SR, NH2, NHR, NRR’, NO2, Me3Sn и галогена.
В одном варианте осуществления R7 независимо представляет собой OR.
В одном варианте осуществления R7 независимо представляет собой OR7A, где R7A независимо представляет собой необязательно замещенный C1-6алкил.
В одном варианте осуществления R7A независимо представляет собой необязательно замещенный насыщенный C1-6алкил.
В одном варианте осуществления R7A независимо представляет собой необязательно замещенный C2-4алкенил.
В одном варианте осуществления R7A независимо представляет собой Me.
В одном варианте осуществления R7A независимо представляет собой CH2Ph.
В одном варианте осуществления R7A независимо представляет собой аллил.
В одном варианте осуществления соединение является димером, где R7 группы каждого мономера вместе образуют димерный мостик формулы X-R″-X, связывающий мономеры.
R8
В одном варианте осуществления соединение является димером, где R8 группы каждого мономера вместе образуют димерный мостик формулы X-R″-X, связывающий мономеры.
В одном варианте осуществления R8 независимо представляет собой OR8A, где R8A независимо представляет собой необязательно замещенный C1-4алкил.
В одном варианте осуществления R8A независимо представляет собой необязательно замещенный насыщенный C1-6алкил или необязательно замещенный C2-4алкенил.
В одном варианте осуществления R8A независимо представляет собой Me.
В одном варианте осуществления R8A независимо представляет собой CH2Ph.
В одном варианте осуществления R8A независимо представляет собой аллил.
В одном варианте осуществления R8 и R7 вместе образуют группу -O-(CH2)p-O-, где p равняется 1 или 2.
В одном варианте осуществления R8 и R9 вместе образуют группу -O-(CH2)p-O-, где p равняется 1 или 2.
R9
В одном варианте осуществления R9 независимо выбран из H, R, OH, OR, SH, SR, NH2, NHR, NRR’, NO2, Me3Sn- и галогена.
В одном варианте осуществления R9 независимо представляет собой H.
В одном варианте осуществления R9 независимо представляет собой R или OR.
R и R'
В одном варианте осуществления R независимо выбран из необязательно замещенных C1-12алкильной, C3-20гетероциклильной и C5-20арильной групп. Каждая из этих групп определена в разделе заместителей ниже.
В одном варианте осуществления R независимо представляет собой необязательно замещенный C1-12алкил.
В одном варианте осуществления R независимо представляет собой необязательно замещенный C3-20гетероциклил.
В одном варианте осуществления R независимо представляет собой необязательно замещенный C5-20арил.
В одном варианте осуществления R независимо представляет собой необязательно замещенный C1-12алкил.
Вышеописанное в отношении R2 представляет собой различные варианты осуществления относительно предпочтительных алкильных и арильных групп, а также идентичности и числа необязательных заместителей. Предпочтения, изложенные для R2, как это применяется для R, являются применимыми по необходимости ко всем другим группам R, например, где R6, R7, R8 или R9 представляют собой R.
Предпочтения для R применяются также к R'.
В некоторых вариантах осуществления настоящего изобретения представлено соединение с группой-заместителем -NRR'. В одном варианте осуществления R и R' вместе с атомом азота, к которому они присоединяются, образуют необязательно замещенное 4-, 5-, 6- или 7-членное гетероциклическое кольцо. Кольцо может содержать дополнительный гетероатом, например, N, O или S.
В одном варианте осуществления гетероциклическое кольцо само замещено группой R. Если присутствует дополнительный гетероатом N, то заместитель может находиться на гетероатоме N.
R''
R'' представляет собой C3-12алкиленовую группу, цепь которой может быть прервана одним или несколькими гетероатомами, например, O, S, N(H), NMe, и/или ароматическими кольцами, например, бензеновым или пиридиновым, при этом кольца необязательно замещены.
В одном варианте осуществления R'' представляет собой C3-12алкиленовую группу, цепь которой может быть прервана одним или несколькими гетероатомами и/или ароматическими кольцами, например, бензеновым или пиридиновым.
В одном варианте осуществления алкиленовая группа необязательно прервана одним или несколькими гетероатомами, выбранными из O, S, и NMe, и/или ароматическими кольцами, при этом кольца необязательно замещены.
В одном варианте осуществления ароматическое кольцо представляет собой C5-20ариленовую группу, где арилен принадлежит к двухвалентной части, полученной путем удаления двух атомов водорода из двух атомов ароматического кольца ароматического соединения, часть которого имеет от 5 до 20 кольцевых атомов.
В одном варианте осуществления R'' представляет собой C3-12алкиленовую группу, цепь которой может быть прервана одним или несколькими гетероатомами, например, O, S, N(H), NMe, и/или ароматическими кольцами, например, бензеновым или пиридиновым, при этом кольца необязательно замещены NH2.
В одном варианте осуществления R'' представляет собой C3-12алкиленовую группу.
В одном варианте осуществления R'' выбран из C3, C5, C7, C9 и C11алкиленовой группы.
В одном варианте осуществления R'' выбран из C3, C5 и C7алкиленовой группы.
В одном варианте осуществления R'' выбран из C3 и C5алкиленовой группы.
В одном варианте осуществления R'' представляет собой C3алкиленовую группу.
В одном варианте осуществления R'' представляет собой C5алкиленовую группу.
Алкиленовые группы, приведенные выше, необязательно могут быть прерваны одним или несколькими гетероатомами и/или ароматическими кольцами, например, бензеновым или пиридиновым, при этом кольца необязательно замещены.
Алкиленовые группы, приведенные выше, необязательно могут быть прерваны одним или несколькими гетероатомами и/или ароматическими кольцами, например, бензеновым или пиридиновым.
Алкиленовые группы, приведенные выше, могут быть незамещенными линейными алифатическими алкиленовыми группами.
X
В одном варианте осуществления X выбран из O, S или N(H).
Предпочтительно, X представляет собой O.
R10
Предпочтительно, совместимые линкеры, такие как описанные выше, присоединяют модулятор SEZ6 (CBA/Ab/M) к части лекарственного средства D PBD через ковалентную связь(и) в положении R10 (т.e. N10). Линкер представляет собой бифункциональную или мультифункциональную часть, которая может быть использована для связывания одной или нескольких частей лекарственного средства (D) и модулятора (предпочтительно, антитела) с формированием конъюгатов антитело-лекарственное средство (ADC). Линкер (L) может быть стабильным вне клетки, т.e. внеклеточным, или он может расщепляться под действием ферментативной активности, гидролиза или других метаболических условий. Конъюгаты антитело-лекарственное средство (ADC) можно удобно получать с использованием линкера, имеющего реакционную функциональную группу для связывания с частью лекарственного средства и с антителом. Цистеинтиол или амин, например, N-концевой или аминокислотной боковой цепи, такие как лизин, антитела (Ab) может образовывать связь с функциональной группой линкерного или спейсерного реагента, части лекарственного средства PBD (D) или реагента лекарственное средство-линкер (D-L).
Многие функциональные группы на линкере, присоединенные к N10 положению части PBD, могут быть применимыми для реагирования со средством связывания с клеткой. Например, сложноэфирная, сложнотиоэфирная, амидная, тиоамидная, карбаматная, тиокарбаматная, мочевинная, тиомочевинная, эфирная, тиоэфирная или дисульфидная связи могут быть образованы из реакции промежуточных соединений линкер-лекарственное средство PBD и средства связывания с клеткой.
В другом варианте осуществления линкер может быть замещен группами, которые модулируют агрегацию, растворимость или реакционную способность. Например, сульфонатный заместитель может повышать растворимость реагента в воде и облегчать реакцию соединения линкерного реагента с антителом или части лекарственного средства или облегчать реакцию присоединения Ab-L с D или D-L с Ab в зависимости от пути синтеза, используемого для получения ADC.
В одном предпочтительном варианте получения R10 представляет собой группу:

где звездочка указывает точку присоединения к N10 положению, CBA представляет собой средство связывания с клеткой/модулятор, L1 представляет собой линкер, A представляет собой соединяющую группу, соединяющую L1 с клеточным связывающим средством, L2 представляет собой ковалентную связь или вместе с -OC(=O)- образует "жертвуемый" линкер, а L1 или L2 представляет собой расщепляемый линкер.
L1, предпочтительно, представляет собой расщепляемый линкер и может быть назван триггером активации линкера для расщепления.
Как обсуждалось в разделе линкеров выше, природа L1 и L2, если присутствуют, может широко варьировать. Эти группы выбирают на основе их характеристик расщепления, которые могут быть обусловлены условиями на участке, к которому доставляется конъюгат. Предпочтительными являются линкеры, расщепляемые под действием ферментов, хотя также можно использовать линкеры, которые расщепляются при изменениях pH (например, нестабильные в кислотных или основных условиях), температуры или при облучении (например, фотонестабильные). Линкеры, которые расщепляются при условиях восстановления или окисления, также могут найти применение в настоящем изобретении.
L1 может содержать непрерывную последовательность аминокислот. Аминокислотная последовательность может представлять собой целевой субстрат для ферментативного расщепления, что, тем самым, обеспечивает высвобождение R10 из положения N10.
В одном варианте осуществления L1 расщепляется под действием фермента. В одном варианте осуществления ферментом является эстераза или пептидаза.
В одном варианте осуществления L2 присутствует и вместе с -C(=O)O- образует "жертвуемый" линкер. В одном варианте осуществления L2 является субстратом для ферментативной активности, что, тем самым, обеспечивает высвобождение R10 из положения N10.
В одном варианте осуществления, если L1 расщепляется под действием фермента и L2 присутствует, то фермент расщепляет связь между L1 и L2.
Что касается присоединения выбранного линкера к выбранному PBD, группа RC удаляется из N10 положения определенных частей PBD с предоставлением N10-C11 иминовой связи, карбиноламина, замещенного карбиноламина, если QR11 представляет собой OSO3M, бисульфитного аддукта, тиокарбиноламина, замещенного тиокарбиноламина или замещенного карбиналамина.
В одном варианте осуществления RC может быть защитной группой, которая удаляется с предоставлением N10-C11 иминовой связи, карбиноламина, замещенного карбиноламина или, если QR11 приедставляетсобой OSO3M, бисульфитного аддукта. В одном варианте осуществления RC представляет собой защитную группу, которая удаляется с предоставлением N10-C11 иминовой связи.
Группа RC предназначена для удаления при тех же условиях, что необходимы для удаления группы R10, например, с получением N10-C11 иминовой связи, карбиноламина и т.д. Блокирующая группа действует как защитная группа для предназначенной функциональной группы в N10 положении. Блокирующая группа не должна быть реакционно способной по отношению средству связывания с клеткой. Например, RC не такой же как RL.
Соединения, имеющие блокирующую группу, могут быть использованы в качестве промежуточных соединений в синтезе димеров, имеющих иминовый мономер. В качестве альтернативы, соединения, имеющие блокирующую группу, могут быть использованы в качестве конъюгатов, в которых блокирующая группа удаляется в целевом местоположении с получением имина, карбиноламина, замещенного карбиноламина и т.д. Таким образом, в этом варианте осуществления блокирующая группа может упоминаться как терапевтически удаляемая защитная группа азота, как определено в WO 00/12507.
В одном варианте осуществления группа RC удаляется при условиях, при которых расщепляется линкер RL группы R10. Таким образом, в одном варианте осуществления блокирующая группа расщепляется под действием фермента.
В альтернативном варианте осуществления блокирующая группа удаляется перед присоединением линкера RL к модулятору. В этом варианте осуществления блокирующая группа удаляется при условиях, при которых линкер RL не расщепляется.
Если соединение содержит функциональную группу G1 для образования присоединения к средству связывания с клеткой, то блокирующая группа удаляется перед добавлением или раскрытием G1.
Блокирующая группа может быть использована как часть стратегии защитных групп для обеспечения того, что только одна из мономерных единиц в димере присоединяется к средству связывания с клеткой.
Блокирующая группа может быть использована в качестве маскировки для N10-C11 иминовой связи. Блокирующая группа может быть удалена тогда, когда иминовая функциональная группа потребуется в соединении. Блокирующая группа также является маскировкой для карбиноламина, замещенного карбиноламина и бисульфитного аддукта, как описано выше.
В одном варианте осуществления RC является карбаматной защитной группой.
В одном варианте осуществления карбаматная защитная группа выбрана из:
Alloc, Fmoc, Boc, Troc, Teoc, Psec, Cbz и PNZ.
Необязательно карбаматная защитная группа, кроме того, выбирается из Moc.
В одном варианте осуществления RC является линкерной группой RL, не имеющей функциональной группы для соединения со средством связывания с клеткой.
Настоящая заявка, в частности, относится к таким RC группам, которые являются карбаматами.
В одном варианте осуществления RC представляет собой группу:
в которой звездочка указывает точку присоединения к N10 положению, G2 представляет собой терминирующую группу, L3 представляет собой ковалентную связь или расщепляемый линкер L1, L2 представляет собой ковалентную связь или вместе с OC(=O) образует "жертвуемый" линкер.
Если оба L3 и L2 представляют собой ковалентные связи, то G2 и OC(=O) вместе образуют карбаматную защитную группу, как определено выше.
L1 определен выше в отношении R10.
L2 определен выше в отношении R10.
Ниже описаны различные терминирующие группы, в том числе те, которые основаны на хорошо известных защитных группах.
В одном варианте осуществления L3 представляет собой расщепляемый линкер L1, и L2 вместе с OC(=O) образует "жертвуемый" линкер. В этом варианте осуществления G2 представляет собой Ac (ацетил) или Moc или карбаматную защитную группу, выбранную из: Alloc, Fmoc, Boc, Troc, Teoc, Psec, Cbz и PNZ. Необязательно карбаматная защитная группа, кроме того, выбирается из Moc.
В другом варианте осуществления G2 представляет собой ацильную группу -C(=O)G3, где G3 выбран из алкила (в том числе циклоалкила, алкенила и алкинила), гетероалкила, гетероциклила и арила (в том числе гетероарила и карбоарила). Эти группы необязательно могут быть замещенными. Ацильная группа вместе с аминогруппой L3 или L2, в случае необходимости, могут образовывать амидную связь. Ацильная группа вместе с гидроксильной группой из L3 или L2, в случае необходимости, могут образовывать сложноэфирную связь.
В одном варианте осуществления G3 представляет собой гетероалкил. Гетероалкильная группа может содержать полиэтиленгликоль. Гетероалкильная группа может содержать гетероатом, такой как O или N, рядом с ацильной группой, образуя тем самым карбаматную или карбонатную группу, в случае необходимости, с гетероатомом, присутствующим в группе L3 или L2, в случае необходимости.
В одном варианте осуществления G3 выбран из NH2, NHR и NRR’. Предпочтительно, G3 представляет собой NRR’.
В одном варианте осуществления G2 является группой:
в которой звездочка указывает точку присоединения к L3, n равняется 0-6, а G4 выбран из OH, OR, SH, SR, COOR, CONH2, CONHR, CONRR', NH2, NHR, NRR', NO2 и галогена. Группы OH, SH, NH2 и NHR являются защищенными. В одном варианте осуществления n равняется 1-6, и предпочтительно, n равняется 5. В одном варианте осуществления G4 представляет собой OR, SR, COOR, CONH2, CONHR, CONRR' и NRR'. В одном варианте осуществления G4 представляет собой OR, SR и NRR'. Предпочтительно, G4 выбран из OR и NRR', наиболее предпочтительно, G4 представляет собой OR. Наиболее предпочтительно, G4 представляет собой OMe.
В одном варианте осуществления группа G2 представляет собой:
В которой звездочка указывает точку присоединения к L3, и n и G4 определены выше.
В одном варианте осуществления группа G2 представляет собой:
в которой звездочка указывает точку присоединения к L3, n равняется 0 или 1, m равняется 0-50, а G4 выбран из OH, OR, SH, SR, COOR, CONH2, CONHR, CONRR', NH2, NHR, NRR', NO2 и галогена. В предпочтительном варианте осуществления n равняется 1, а m равняется 0-10, 1 или 2, предпочтительно, 4-8 и, наиболее предпочтительно, 4 или 8. В другом варианте осуществления n равняется 1, а m равняется 10-50, предпочтительно, 20-40. Группы OH, SH, NH2 и NHR являются защищенными. В одном варианте осуществления G4 представляет собой OR, SR, COOR, CONH2, CONHR, CONRR' и NRR'. В одном варианте осуществления G4 представляет собой OR, SR и NRR'. Предпочтительно, G4 выбран из OR и NRR', наиболее предпочтительно, G4 представляет собой OR. Предпочтительно, G4 представляет собой OMe.
В одном варианте осуществления группа G2 представляет собой:
в которой звездочка указывает точку присоединения к L3, а n, m и G4 определены выше.
В одном варианте осуществления группа G2 представляет собой:

в которой n равняется 1-20, m равняется 0-6, и G4 выбран из OH, OR, SH, SR, COOR, CONH2, CONHR, CONRR', NH2, NHR, NRR', NO2 и галогена. В одном варианте осуществления n равняется 1-10. В другом варианте осуществления n равняется 10-50, предпочтительно, 20-40. В одном варианте осуществления n равняется 1. В одном варианте осуществления m равняется 1. Группы OH, SH, NH2 и NHR являются защищенными. В одном варианте осуществления G4 представляет собой OR, SR, COOR, CONH2, CONHR, CONRR' и NRR'. В одном варианте осуществления G4 представляет собой OR, SR и NRR'. Предпочтительно, G4 выбран из OR и NRR', наиболее предпочтительно, G4 представляет собой OR. Предпочтительно, G4 представляет собой OMe.
В одном варианте осуществления группа G2 представляет собой:
в которой звездочка указывает точку присоединения к L3, а n, m и G4 определены выше.
В каждом из вышеприведенных вариантов осуществления G4 может быть OH, SH, NH2 и NHR. Эти группы, предпочтительно, являются защищенными.
В одном варианте осуществления OH является защищенной с помощью Bzl, TBDMS или TBDPS.
В одном варианте осуществления SH является защищенной с помощью Acm, Bzl, Bzl-OMe, Bzl-Me или Trt.
В одном варианте осуществления NH2 или NHR являются защищенными с помощью Boc, Moc, Z-Cl, Fmoc, Z или Alloc.
В одном варианте осуществления группа G2 присутствует в комбинации с группой L3, которая представляет собой дипептид.
Блокирующая группа не предназначена для соединения с модулятором. Таким образом, другой мономер, присутствующий в димере, служит точкой присоединения к модулятору через линкер. Следовательно, является предпочтительным, чтобы функциональная группа, присутствующая в блокирующей группе, не была доступной для реакции с модулятором. Таким образом, реакционноспособные функциональные группы, такие как OH, SH, NH2, COOH, предпочтительно, избегать. Однако такая функциональная группа может присутствовать в блокирующей группе, если защищена, как описано выше.
Таким образом, согласно изложенному в настоящем документе один вариант осуществления настоящего изобретения относится к конъюгату, содержащему соединение:
где CBA представляет собой средство связывания с клеткой/модулятор, и n равняется 0 или 1. L1 определен выше, и каждый RE и RE'' независимо выбраны из H или RD.
В другом варианте осуществления конъюгат содержит соединение:
где CBA представляет собой средство связывания с клеткой/модулятор, L1 определен выше, каждый Ar1 и Ar2 независимо представляет собой необязательно замещенный C5-20арил, а n равняется 0 или 1.
Специалистам в данной области будет понятно, что другие симметричные и aсимметричные PBD димеры и линкеры являются совместимыми с настоящим изобретением и могут быть выбраны без излишнего эксперимента на основе изложенного в настоящем документе и в уровне техники.
Другой аспект настоящего изобретения относится к ADC, содержащим радиоизотопы. Типичные радиоизотопы, которые могут быть совместимыми с такими вариантами осуществления, включают в себя, без ограничения, йод (131I, 125I, 123I, 121I), углерод (14C), медь (62Cu, 64Cu, 67Cu), серу (35S), тритий (3H), индий (115In, 113In, 112In, 111In), висмут (212Bi, 213Bi), технеций (99Tc), таллий (201Ti), галлий (68Ga, 67Ga), палладий (103Pd), молибден (99Mo), ксенон (133Xe), фтор (18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn, 117Sn, 225Ac, 76Br и 211At. Другие радионуклиды также пригодны в качестве диагностических и терапевтических средств, особенно в энергетическом диапазоне 60-4000 кэВ. В зависимости от состояния, подлежащего лечению, и требуемого терапевтического профиля, специалисты в данной области могут без труда выбрать соответствующий радиоизотоп для применения с раскрытыми модуляторами.
SEZ6 модуляторы в соответствии с настоящим изобретением также могут быть конъюгированы с терапевтической частью или лекарственным средством, которые модифицируют данную биологическую реакцию (например, модификаторами биологической реакции или BRM). То есть терапевтические средства или части, совместимые с настоящим изобретением, не должны рассматриваться как ограниченные классическими химическими терапевтическими средствами. Например, в особенно предпочтительных вариантах осуществления частью лекарственным средством может быть белок, или полипептид, или их фрагмент, обладающий требуемой биологической активностью. Такие белки могут включать в себя, например, токсин, такой как абрин, рицин A, онконаза (или другая цитотоксическая РНКаза), эндотоксин Рseudomonas, холерный токсин или дифтерийный токсин; белок, такой как фактор некроза опухоли, α-интерферон, β-интерферон, фактор роста нервов, тромбоцитарный фактор роста, тканевой активатор плазминогена, апоптическое средство, например, TNF-α, TNF-β, AIM I (см., международную публикацию WO 97/33899), AIM II (см., международную публикацию WO 97/34911), Fas Ligand (Takahashi et al., 1994, J. Immunol., 6:1567) и VEGI (см., международную публикацию WO 99/23105), тромботическое средство или противоангиогенное средство, например, ангиостатин или эндостатин; или модификатор биологической реакции, такой как, например, лимфокин (например, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), гранулоцитарно-макрофагальный колониестимулирующий фактор ("GM-CSF") и гранулоцитарный колониестимулирующий фактор ("G-CSF")) или фактор роста (например, гормон роста ("GH")). Как указано выше, способы слияния или конъюгации модуляторов с полипептидными частями известны в уровне техники. В дополнение к раскрытым выше предметным ссылкам см., например, патенты США №№ 5336603; 5622929; 5359046; 5349053; 5447851 и 5112946; EP 307434; EP 367166; публикации PCT WO 96/04388 и WO 91/06570; Ashkenazi et al., 1991, PNAS USA 88:10535; Zheng et al., 1995, J Immunol 154:5590; и Vil et al., 1992, PNAS USA 89:11337, каждая из которых включена в настоящий документ посредством ссылки. Более того, как указано выше, ассоциация модулятора с такими частями не обязательно должна быть прямой, но может осуществляться через линкерные последовательности. Как упоминалось ранее, такие линкерные молекулы общеизвестны в уровне техники и раскрываются в Denardo et al., 1998, Clin Cancer Res 4:2483; Peterson et al., 1999, Bioconjug Chem 10:553; Zimmerman et al., 1999, Nucl Med Biol 26:943; Garnett, 2002, Adv Drug Deliv Rev 53:171, каждая из которых включена в настоящий документ.
IX. Диагностика и скрининг
А. Диагностика
Другой вариант осуществления настоящего изобретения относится к in vitro или in vivo способам выявления, диагностики или мониторинга пролиферативных расстройств и способы скрининга клеток от пациента для идентификации опухолеродных клеток, в том числе CSC. Такие способы включают в себя идентификацию индивидуума, больного раком, для лечения или мониторинга развития рака, предусматривающую контакт пациента или полученного от пациента образца (т.e. либо in vivo, либо in vitro) с модулятором, описанным в настоящем документе, и выявление наличия или отсутствия, или уровня ассоциации модулятора со связанными или свободными мишеневыми молекулами в образце. В особенно предпочтительных вариантах осуществления модулятор будет содержать выявляемую метку или репортерную молекулу, как описано в настоящем документе.
В некоторых вариантах осуществления ассоциация модулятора, такого как антитело, с конкретными клетками в образце, вероятно, означает, что образец может содержать CSC, тем самым показывая, что индивидуума, больного раком, можно эффективно лечить модулятором, описанным в настоящем документе. Способы дополнительно могут предусматривать этапы сравнения уровня связывания с контролем. Наоборот, если модулятор представляет собой Fc-конструкцию, то свойства связывания можно использовать и контролировать (непосредственно или опосредованно, in vivo или in vitro) при контакте с образцом для обеспечения необходимой информации.
Иллюстративные совместимые способы анализа включают в себя радиоиммунологические анализы, ферментативные иммунологические анализы, анализы конкурентного связывание, флуоресцентный иммунологический анализ, иммуноблот-анализы, вестерн-блоттинг, анализы с использованием проточной цитометрии и ELISA. Соответствующая in vivo терагностика или диагностика может предусматривать принятые в данной области методики визуализации или мониторинга, такие как магнитно-резонансная визуализация, компьютеризированная томография (например, сканирование CAT), позитронная томография (например, сканирование PET), рентгенография, ультразвуковое исследование и т.п., как будет известно специалистам в данной области.
В другом варианте осуществления настоящее изобретение относится к способу анализа развития и/или патогенеза рака in vivo. В другом варианте осуществления анализ развития и/или патогенеза рака in vivo предусматривает определение степени развития опухоли. В другом варианте осуществления анализ предусматривает идентификацию опухоли. В другом варианте осуществления анализ развития опухоли выполняют на первичной опухоли. В другом варианте осуществления анализ выполняют в течение времени в зависимости от типа рака, как известно специалисту в данной области. В другом варианте осуществления дополнительный анализ вторичных опухолей, происходящих от метастазирующих клеток первичной опухоли осуществляют in-vivo. В другом варианте осуществления анализируют размер и форму вторичных опухолей. В некоторых вариантах осуществления выполняют дополнительный анализ ex vivo.
В другом варианте осуществления настоящее изобретение относится к способу анализа развития и/или патогенеза рака in vivo, предусматривающему определение метастазирования клеток или выявление и количественное определение уровня циркулирующих опухолевых клеток. В еще одном варианте осуществления анализ метастазирования клеток предусматривает определение прогрессирующего развития клеток на участке, который расположен на расстоянии от первичной опухоли. В другом варианте осуществления анализ метастазирования клеток на участке предусматривает путь распространения новообразования. В определенном варианте осуществления клетки могут распространяться через кровеносную сосудистую систему, лимфатическую систему, полости организма или их комбинации. В другом варианте осуществления анализ метастазирования клеток выполняют, учитывая миграцию, диссеминацию, экстравазацию, пролиферацию клеток или их комбинации.
Следовательно, в особенно предпочтительном варианте осуществления модуляторы по настоящему изобретению могут быть использованы для выявления и количественного определения уровней SEZ6 в образце пациента (например, в плазме или крови), которые, в свою очередь, можно использовать для выявления, диагностики или мониторинга SEZ6-ассоциированных расстройств, в том числе пролиферативных расстройств. В связанных вариантах осуществления модуляторы по настоящему изобретению могут быть использованы для выявления, мониторинга и/или количественного определения циркулирующих опухолевых клеток либо in vivo, либо in vitro (см., например, WO 2012/0128801, которая включена в настоящий документ при помощи ссылки). В других предпочтительных вариантах осуществления циркулирующие опухолевые клетки могут включать раковые стволовые клетки.
В определенных примерах опухолеродные клетки у индивида или в образце от индивида могут быть оценены или охарактеризованы с использованием раскрытых модуляторов до лечения или режима для установления исходного уровня. В других примерах образец получают от индивида, который получал лечение. В некоторых примерах образец берут от индивида по меньшей мере через приблизительно 1, 2, 4, 6, 7, 8, 10, 12, 14, 15, 16, 18, 20, 30, 60, 90 дней, 6 месяцев, 9 месяцев, 12 месяцев или >12 месяцев после того, как индивид начал или окончил лечение. В определенных примерах опухолеродные клетки оценивают или характеризуют после определенного количества доз (например, после 2, 5, 10, 20, 30 или более доз терапевтического средства). В других примерах опухолеродные клетки характеризуют или оценивают через 1 неделю, 2 недели, 1 месяц, 2 месяца, 1 год, 2 года, 3 года, 4 года или более после получения одного или нескольких терапевтических средств.
В другом аспекте, и как обсуждается более подробно ниже, настоящее изобретение относится к набору для выявления, мониторинга или диагностики гиперпролиферативного расстройства, идентификации индивидуума с таким расстройством для возможного лечения или мониторинга развития (или регрессии) расстройства у пациента, при этом набор содержит модулятор, описанный в настоящем документе, и реагенты для выявления влияния модулятора на образец.
Еще один аспект настоящего изобретения относится к применению меченого SEZ6 для иммуногистохимии (IHC). В этом отношении SEZ6 IHC может быть использована в качестве диагностического инструмента для диагностирования различных пролиферативных расстройств и для мониторинга потенциальной реакции на лечение в том числе на терапию SEZ6 модулятором. Соответствующие диагностические анализы могут быть выполнены на тканях, которые были химически фиксированы (в том числе без ограничения формальдегидом, глутеральдегидом, тетраоксидом осмия, дихроматом калия, уксусной кислотой, спиртами, солями цинка, хлоридом ртути, тетраоксидом хрома и пикриновой кислотой) и залиты (в том числе без ограничения в гликольметакрилат, парафин и смолы) или законсервированы путем замораживания. Как обсуждается более подробно ниже такие анализы можно использовать для принятия решений по лечению и определения режимов и времени дозировки.
B. Скрининг
В определенных вариантах осуществления модуляторы также могут быть использованы для скрининга или идентификации соединений или средств (например, лекарственных средств), которые изменяют функцию или активность опухолеродных клеток или их потомства путем взаимодействия с антигеном (например, их генотипические или фенотипические компоненты). Такие соединения и средства могут быть лекарственными средствами-кандидатами, у которых, например, проводят скрининг в отношении лечения пролиферативного расстройства. В одном варианте осуществления система или способ предусматривают опухолеродные клетки, содержащие SEZ6, и соединение или средство (например, лекарственное средство), при этом клетки и соединение или средство находятся в контакте друг с другом. В таких вариантах осуществления клетки индивида можно идентифицировать, контролировать и/или обогащать с использованием раскрытых модуляторов.
В еще одном варианте осуществления способ предусматривает контакт, непосредственный или опосредованный, опухолеродных клеток или их потомства с тестируемым средством или соединением и определение того, модулирует ли тестируемое средство или соединение активность или функцию ассоциированных с антигеном опухолеродных клеток. Одним примером непосредственного взаимодействия является физическое взаимодействие, тогда как опосредованное взаимодействие предусматривает действие композиции на промежуточную молекулу, которая, в свою очередь, действует на упоминаемый объект (например, клетку или клеточную культуру). Типичные активности или функции, которые можно модулировать, включают в себя изменения клеточной морфологии или жизнеспособности, экспрессии маркера, дифференцировки или дедифференцировки, клеточного дыхания, митохондриальной активности, целостности мембраны, созревания, пролиферации, жизнеспособности, апоптоза или клеточной смерти.
Способы скрининга и идентификации средств и соединений включают в себя приемлемые для высокопроизводительного скрининга, который предусматривает панели клеток (например, микропанели), расположенные или размещенные, необязательно в предварительно определенных местоположениях или местонахождениях. Например, клетки могут быть расположены или размещены (предварительно высеяны) в чашке для культивирования, пробирке, колбе, роллерном флаконе или планшете (например, в отдельном многолуночном планшете или чашке, например, в 8-, 16-, 32-, 64-, 96-, 384- и 1536-луночном планшете или чашке). Высокопроизводительными автоматизированными или выполненными вручную способами можно исследовать химические взаимодействия и определять уровни экспрессии многих генов за короткий период времени. Были разработаны методики, в которых используют молекулярные сигналы (например, через флуорофоры), и автоматизированные анализы, которые обрабатывают информацию с очень высокой скоростью (см., например, Pinhasov et al., Comb. Chem. High Throughput Screen. 7:133 (2004)). Например, широко применяли технологию с использованием микропанели для исследования взаимодействий тысяч генов одновременно при обеспечении информации по конкретным генам (см., например, Mocellin и Rossi, Adv. Exp. Med. Biol. 593:19 (2007)).
Библиотеки, которые можно подвергать скринингу, включают, например, библиотеки малых молекул, библиотеки фаговых дисплеев, библиотеки фаговых дисплеев полностью человеческого антитела (Adimab, LLC), библиотеки siRNA и аденовирусные векторы трансфекции.
X. Фармацевтические препараты и терапевтические применения
A. Составы и пути введения
В зависимости от формы модулятора вместе с каким-либо необязательным конъюгатом, способа предполагаемой доставки, заболевания, подлежащего лечению или мониторингу и ряда других параметров композиции в соответствии с настоящим изобретением могут быть составлены по желанию с использованием принятых в данной области методик. В некоторых вариантах осуществления терапевтические композиции в соответствии с настоящим изобретением могут быть введены сами по себе или с минимумом дополнительных компонентов, тогда как другие необязательно могут быть составлены с содержанием подходящих фармацевтически приемлемых носителей, включающих наполнители и добавки, которые хорошо известны из уровня техники (см., например, Gennaro, Remington: The Science and Practice of Pharmacy with Facts and Comparisons: Drugfacts Plus, 20th ed. (2003); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe et al., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000)). Различные фармацевтически приемлемые носители, которые включают в себя среды, вспомогательные средства и разбавители, легкодоступны из многочисленных коммерческих источников. Более того, также доступен ассортимент фармацевтически приемлемых веществ-добавок, таких как регулирующие pH и буферные средства, регулирующие тоничность средства, стабилизаторы, увлажняющие средства и т.п. Определенные неограничивающие иллюстративные носители включают в себя солевой раствор, буферный солевой раствор, декстрозу, воду, глицерин, этанол и их комбинации.
Более конкретно, будет очевидно, что в некоторых вариантах осуществления терапевтические композиции по настоящему изобретению могут быть введены сами по себе или с минимумом дополнительных компонентов. Напротив, SEZ6 модуляторы по настоящему изобретению необязательно могут быть составлены с содержанием подходящих фармацевтически приемлемых носителей, включающих наполнители и добавки, которые хорошо известны в уровне техники и являются относительно инертными веществами, которые облегчают введение модулятора или которые содействуют обработке активных соединений в препаратах, которые фармацевтически оптимизированы для доставки к участку действия. Например, наполнитель может придавать форму или консистенцию или действовать как разбавитель для улучшения фармакокинетики или стабильности модулятора. Приемлемые наполнители или добавки включают в себя без ограничения стабилизирующие средства, увлажняющие и эмульгирующие средства, соли для варьирующей осмолярности, инкапсулирующие средства, буферы и усилители проницаемости кожи. В определенных предпочтительных вариантах осуществления фармацевтические композиции могут быть представлены в лиофилизированной форме и их восстанавливают, например, в буферном солевом растворе перед введением.
Раскрытые модуляторы для системного введения могут быть составлены для энтерального, парентерального или местного введения. Более того, все три типа состава могут быть использованы одновременно для достижения системного введения активного ингредиента. Наполнители, а также составы для парентеральной и непарентеральной доставки лекарственного средства изложены в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing (2000). Приемлемые составы для парентерального введение включают в себя водные составы активных соединений в растворимой в воде форме, например, растворимые в воде соли. Кроме того, суспензии активных соединений можно вводить в виде подходящих для масляной инъекции суспензий. Приемлемые липофильные растворители или среды включают в себя жирные масла, например, гексилзамещенный поли(лактид), кунжутное масло, или синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды. Водные инъекционные суспензии могут содержать вещества, которые повышают вязкость суспензии, и они включают, например, карбоксиметилцеллюлозу натрия, сорбит и/или декстран. Необязательно суспензия также может содержать стабилизаторы. Липосомы также могут быть использованы для инкапсулирования средства для доставки в клетку.
Приемлемые составы для энтерального введения включают в себя твердые или мягкие желатиновые капсулы, пилюли, таблетки, в том числе покрытые таблетки, эликсиры, суспензии, сиропы или ингаляции и их формы с контролируемым высвобождением.
В целом соединения и композиции по настоящему изобретению, содержащие SEZ6 модуляторы, можно вводить in vivo индивиду при необходимости этого различными путями, в том числе без ограничения пероральным, внутривенным, внутриартериальным, подкожным, парентеральным, внутриназальным, внутримышечным, внутричерепным, внутрисердечным, внутрижелудочковым, внутритрахеальным, буккальным, ректальным, внутриперитонеальным, внутридермальным, местным, чрескожным и интратекальным, или другим путем с помощью имплантации или ингаляции. Заявленные композиции могут быть составлены в препараты в твердой, полутвердой, жидкой или газообразной формах; в том числе без ограничения таблетки, капсулы, порошки, гранулы, мази, составы, суппозитории, клизмы, инъекции, ингаляторы и аэрозоли. Соответствующие состав и путь введения могут быть выбраны согласно предполагаемому применению и терапевтическому режиму.
B. Дозировки
Подобным образом, конкретный режим дозировки, т.e. доза, сроки и повторение, будет зависеть от конкретного индивидуума и истории болезни этого индивидуума, а также эмпирических заключений, таких как фармакокинетика (например, время полувыведения, скорость клиренса и т.п.). Частота введения может быть определена и отрегулирована в курсе лечения и основывается на снижении числа пролиферативных или опухолеродных клеток, поддерживании уменьшения таких неопластических клеток, уменьшения пролиферации неопластических клеток или замедления развития метастазирования. В других вариантах осуществления вводимая дозировка может быть отрегулирована или уменьшена для регулирования потенциальных побочных эффектов и/или токсичности. В качестве альтернативы, могут быть приемлемыми составы пролонгированного непрерывного высвобождения заявленной терапевтической композиции.
В целом, модуляторы в соответствии с настоящим изобретением могут быть введены в различных диапазонах. Они включают в себя от приблизительно 10 мкг/кг массы тела до приблизительно 100 мг/кг массы тела на дозу; от приблизительно 50 мкг/кг массы тела до приблизительно 5 мг/кг массы тела на дозу; от приблизительно 100 мкг/кг массы тела до приблизительно 10 мг/кг массы тела на дозу. Другие диапазоны включают в себя от приблизительно 100 мкг/кг массы тела до приблизительно 20 мг/кг массы тела на дозу и от приблизительно 0,5 мг/кг массы тела до приблизительно 20 мг/кг массы тела на дозу. В определенных вариантах осуществления дозировка составляет по меньшей мере приблизительно 100 мкг/кг массы тела, по меньшей мере приблизительно 250 мкг/кг массы тела, по меньшей мере приблизительно 750 мкг/кг массы тела, по меньшей мере приблизительно 3 мг/кг массы тела, по меньшей мере приблизительно 5 мг/кг массы тела, по меньшей мере приблизительно 10 мг/кг массы тела.
В определенных вариантах осуществления модуляторы будут вводиться при приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 мкг/кг массы тела на дозу. Другие варианты осуществления будут предусматривать введение модуляторов при 200, 300, 400, 500, 600, 700, 800 или 900 мкг/кг массы тела на дозу. В других предпочтительных вариантах осуществления раскрытые модуляторы будут вводиться при 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг/кг. В следующих вариантах осуществления модуляторы могут вводиться при 12, 14, 16, 18 или 20 мг/кг массы тела на дозу. В следующих вариантах осуществления модуляторы могут вводиться при 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 90 или 100 мг/кг массы тела на дозу. Согласно изложенному в настоящем документе будет понятно, что вышеупомянутые дозировки применимы как для неконъюгированных модуляторов, так и для модуляторов, конъюгированных с цитотоксическим средством. Специалист в данной области сможет без труда определить подходящие дозировки для различных конъюгированных и неконъюгированных модуляторов на основе доклинических исследований на животных, клинических наблюдений и стандартных медицинских и биохимических методик и измерений.
Что касается конъюгированных модуляторов, особенно предпочтительные варианты осуществления будут предусматривать дозировки от приблизительно 50 мкг/кг до приблизительно 5 мг/кг массы тела на дозу. В этом отношении конъюгированные модуляторы могут быть введены при 50, 75 или 100 мкг/кг или при 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1 мг/кг массы тела на дозу. В других предпочтительных вариантах осуществления конъюгированные модуляторы в соответствии с настоящим изобретением могут быть введены при 1,25, 1,5, 1,75, 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75 или 5 мг/кг массы тела на дозу. В особенно предпочтительных вариантах осуществления такие дозировки конъюгированных модуляторов будут вводиться внутривенно за период времени. Более того, такие дозировки можно вводить несколько раз за определенный курс лечения.
Другие режимы дозировки могут быть основаны на расчетах площади поверхности тела (BSA), как раскрыто в патенте США № 7744877. Хорошо известно, что BSA рассчитывается с использованием роста и массы пациента и дает показатель размера индивида, представленный площадью поверхности его или ее тела. В определенных вариантах осуществления модуляторы можно вводить при дозировках от 10 мг/м2 до 800 мг/м2, от 50 мг/м2 до 500 мг/м2 и при дозировках 100 мг/м2, 150 мг/м2, 200 мг/м2, 250 мг/м2, 300 мг/м2, 350 мг/м2, 400 мг/м2 или 450 мг/м2.
Также следует иметь ввиду, что известные из уровня техники и эмпирические методики могут быть использованы для определения подходящей дозировки для конъюгированных модуляторов (т.e. ADC).
В любом случае SEZ6 модуляторы (и конъюгированные, и неконъюгированные), предпочтительно, вводить по мере необходимости индивидам при потребности этого. Определение частоты введения может быть осуществлено специалистами в данной области, например, лечащим врачом, на основе оценки состояния, подлежащего лечению, возраста индивида, подлежащего лечению, тяжести состояния, подлежащего лечению, общего состояния здоровья индивида, подлежащего лечению, и т.п. В общем смысле, эффективную дозу SEZ6 модулятора вводят индивиду один или несколько раз. Более конкретно, эффективную дозу модулятора вводят индивиду один раз в месяц, более одного раза в месяц или менее одного раза в месяц. В определенных вариантах осуществления эффективная доза SEZ6 модулятора может вводиться несколько раз, в том числе на протяжении по меньшей мере месяца, по меньшей мере шести месяцев, по меньшей мере года, по меньшей мере двух лет или на протяжении нескольких лет. В других вариантах осуществления между введением раскрытых модуляторов проходит несколько дней (2, 3, 4, 5, 6 или 7), несколько недель (1, 2, 3, 4, 5, 6, 7 или 8) или несколько месяцев (1, 2, 3, 4, 5, 6, 7 или 8) или даже год или несколько лет.
В определенных предпочтительных вариантах осуществления курс лечения, включающий конъюгированные модуляторы, будет предусматривать несколько доз выбранного лекарственного продукта (т.e. ADC) на протяжении недель или месяцев. Более конкретно, конъюгированные модуляторы по настоящему изобретению можно вводить один раз каждый день, каждые два дня, каждые четыре дня, каждую неделю, каждые десять дней, каждые две недели, каждые три недели, каждый месяц, каждые шесть недель, каждые два месяца, каждые десять недель или каждые три месяца. В этом отношении следует понимать, что дозировки можно изменить или интервалы можно регулировать на основе реакции пациента и клинической практики.
Дозировки и режимы также можно определять эмпирически для раскрытых терапевтических композиций у индивидуумов, которые получили одно или несколько введений. Например, индивидуумы могут получать поэтапные дозировки терапевтической композиции, полученной, как описано в настоящем документе. В выбранных вариантах осуществления дозировка может постепенно повышаться или понижаться или уменьшаться на основе соответствующих эмпирически определенных или наблюдаемых побочных эффектов или токсичности. Для оценки эффективности выбранной композиции маркер конкретного заболевания, расстройства или состояния может быть таким, как описано ранее. Варианты осуществления, в которых индивидуум страдает раком, предусматривают непосредственные измерения размера опухоли с помощью пальпации или визуального наблюдения, опосредованное измерение размера опухоли с помощью рентгеновских лучей или других методик визуализации; улучшение, оцененное непосредственной биопсией опухоли и микроскопическим исследованием образца опухоли; измерение опосредованного опухолевого маркера (например, PSA для рака предстательной железы) или антигена, идентифицированных согласно способам, описанным в настоящем документе, уменьшение боли или паралича; улучшенные речь, зрение, дыхание или другое нарушение, ассоциированные с опухолью; повышенный аппетит или повышение качества жизни, как измерено принятыми тестами, или увеличение продолжительности жизни. Специалисту в данной области будет понятно, что дозировка будет варьировать в зависимости от индивидуума, типа неопластического состояния, стадии неопластического состояния, начало ли неопластическое состояние местазировать в другое местоположение у индивидуума, и применялось ли более раннее и сопутствующее лечение.
C. Комбинированные терапевтические средства
Комбинированные терапевтические средства могут быть особенно применимыми в снижении или ингибировании нежелательной пролиферации неопластических клеток, снижении случаев возникновения рака, снижении или предотвращении повторного проявления рака или снижении или предотвращении распространения или метастазирования рака. В таких случаях модуляторы в соответствии с настоящим изобретением могут функционировать как сенсибилизирующие или химиосенсибилизирующие средства путем удаления CSC, которые могли бы иным образом поддерживать и закреплять опухолевую массу и, тем самым, обеспечивать более эффективное применение существующих стандартных в лечении циторедуцирующих или противораковых средств. То есть, раскрытые модуляторы в определенных вариантах осуществления могут обеспечивать усиленный эффект (например, аддитивный или синергический по природе), который усиливает механизм действия другого веденного терапевтического средства. В контексте настоящего изобретения “комбинированное терапевтическое средство” должно интерпретироваться в широком смысле, и оно обозначает просто введение модулятора и одного или нескольких противораковых средств, которые включают без ограничения цитотоксические средства, цитостатические средства, противоангиогенные средства, циторедуцирующие средства, химиотерапевтические средства, лучевую терапию и радиотерапевтические средства, противораковые средства направленного действия (в том числе и моноклональные антитела, и низкомолекулярные структуры), BRM, терапевтические антитела, противораковые вакцины, цитокины, гормональные терапевтические средства, лучевую терапию и противометастатические средства и иммунотерапевтические средства, в том числе и специфические, и неспецифические подходы.
Результаты комбинированной терапии не должны быть аддитивными в отношении эффектов, наблюдаемых при каждой выполняемой отдельно обработке (например, антитело и противораковое средство). Хотя обычно желательны по меньшей мере аддитивные эффекты, полезным является любой усиленный противоопухолевый эффект вышеупомянутого одного из отдельных терапевтических средств. Более того, для настоящего изобретения не требуется, чтобы объединенная обработка обладала синергическими эффектами. Однако специалистам в данной области будет понятно, что с определенными выбранными комбинациями, которые предусматривают предпочтительные варианты осуществления, может наблюдаться синергизм.
В осуществлении комбинированной терапии модулятор и противораковое средство могут быть введены индивиду одновременно, либо в одной композиции, либо в виде двух или более отдельных композиций с использованием одинаковых или различных путей введения. В качестве альтернативы, модулятор может предшествовать или следовать после обработки противораковым средством, например, с интервалами, варьирующими от минут до недель. Период времени между каждой доставкой является таким, что противораковое средство и модулятор способны оказывать комбинированный эффект на опухоль. По меньшей мере в одном варианте осуществления и противораковое средство и модулятор вводят с интервалом от приблизительно 5 минут до приблизительно двух недель. В следующих вариантах осуществления между введением модулятора и противоракового средства может проходить несколько дней (2, 3, 4, 5, 6 или 7), несколько недель (1, 2, 3, 4, 5, 6, 7 или 8) или несколько месяцев (1, 2, 3, 4, 5, 6, 7 или 8).
Комбинированное терапевтическое средство можно вводить один раз, дважды или по меньшей мере в течение периода времени до тех пор, пока состояние не будет вылечено, облегчено или устранено. В некоторых вариантах осуществления комбинированное терапевтическое средство вводят несколько раз, например, от трех раз в день до одного раза каждые шесть месяцев. Введение можно осуществлять по схеме, такой как три раза в день, дважды в день, один раз в день, один раз каждые два дня, один раз каждые три дня, один раз в неделю, один раз каждые две недели, один раз каждый месяц, один раз каждые два месяца, один раз в три месяца, один раз каждые шесть месяцев, или введение может быть непрерывным через мининасос. Комбинированное терапевтическое средство может быть введено каким-либо путем, как отмечено ранее. Комбинированное терапевтическое средство может быть введено на участок, удаленный от участка опухоли.
В одном варианте осуществления модулятор вводят в комбинации с одним или несколькими противораковыми средствами за короткий цикл лечения индивиду, нуждающемуся в этом. Настоящее изобретение также охватывает периодическое введение или ежедневные дозы, поделенные на несколько отдельных введений. Модулятор и противораковое средство могут быть введены поочередно, в чередующиеся дни или недели; или может назначаться последовательность обработок антителом, за которой следует одна или несколько обработок противораковым терапевтическим средством. В любом случае, как будет понятно рядовому специалисту в данной области техники, подходящие дозы химиотерапевтических средств, как правило, будут приблизительно соответствовать дозам, уже используемым для клинических терапевтических средств, где химиотерапевтические средства вводят отдельно или в комбинации с другими химиотерапевтическими средствами.
В другом предпочтительном варианте осуществления SEZ6 модуляторы в соответствии с настоящим изобретением могут быть использованы в поддерживающей терапии для снижения или устранения вероятности повторного появления опухоли после начального проявления заболевания. Предпочтительно, расстройство будет излечено, и начальная опухолевая масса устранена, снижена или иным образом уменьшена, так что пациент не обнаруживает симптомы или находится в ремиссии. В то же время индивиду могут быть введены фармацевтически эффективные количества раскрытых модуляторов один или несколько раз, даже хотя отсутствуют или обнаруживаются несущественные симптомы заболевания при помощи стандартных диагностических методик. В некоторых вариантах осуществления, модуляторы будут вводиться в соответствии с регулярной схемой за период времени, такой как раз в неделю, раз в каждые две недели, раз в месяц, раз в каждые шесть недель, раз в каждые два месяца, раз в каждые три месяца, раз в каждые шесть месяцев или раз в год. Принимая во внимание изложенное в настоящем документе, специалист в данной области сможет без труда определить благоприятные дозировки и режимы дозировки для снижения возможности повторного появления заболевания. Более того, такие обработки можно продолжать в течение периода недель, месяцев, лет или даже неограниченно в зависимости от реакции пациента и клинических и диагностических параметров.
В другом предпочтительном варианте осуществления модуляторы по настоящему изобретению могут быть использованы профилактически или в качестве вспомогательной терапии для профилактики или снижения вероятности метастазирования опухоли после процедуры циторедукции. Используемая в настоящем раскрытии “процедура циторедукции” определена в широком смысле и будет означать любую процедуру, методику или способ, который устраняет, снижает, лечит или уменьшает опухоль или пролиферацию опухоли. Типичные процедуры циторедукции включают без ограничения хирургическую операцию, виды лучевой терапии (т.е. направленное излучение), химиотерапию, иммунотерапию или абляцию. В подходящее время, которое без труда определит специалист в данной области с учетом настоящего раскрытия, раскрытые модуляторы могут быть введены, как предполагают клинические, диагностические или терагностические процедуры для снижения метастазирования опухоли. Модуляторы могут быть введены один или несколько раз в фармацевтически эффективных дозировках, определяемых при помощи стандартных методик. Предпочтительно, режим дозировки будет сопровождаться подходящими диагностическими методиками или методиками мониторинга, которые позволяют его модифицировать.
Другие варианты осуществления настоящего изобретения предусматривают введение раскрытых модуляторов индивидам, которые не обнаруживают симптомы, но обладают повышенным риском развития пролиферативного расстройства. То есть модуляторы по настоящему изобретению могут быть использованы в истинном предупредительном смысле и назначаться пациентам, которые были проверены или протестированы и имеют один или несколько отмеченных факторов риска (например, геномные признаки, семейный анамнез, результаты in vivo или in vitro тестов и т.д.), но не имеют развитой неоплазии. В таких случаях специалисты в данной области смогут определить эффективный режим дозировки путем эмпирического наблюдения или путем общепринятой клинической практики.
D. Противораковые средства
Выражение “противораковое средство” или “антипролиферативное средство” означает любое средство, которое может быть использовано для лечения расстройства, связанного с пролиферацией клеток, такого как рак, и включает без ограничения цитотоксические средства, цитостатические средства, противоангиогенные средства, циторедуцирующие средства, химиотерапевтические средства, лучевую терапию и радиотерапевтические средства, нацеленные противораковые средства, BRM, терапевтические антитела, противораковые вакцины, цитокины, гормональные терапевтические средства, лучевую терапию и противометастатические средства и иммунотерапевтические средства. Следует понимать, что в выбранных вариантах осуществления, как обсуждалось выше, такие противораковые средства могут предусматривать конъюгаты и могут быть ассоциированы с модуляторами перед введением. В определенных вариантах осуществления раскрытое противораковое средство будет связано с SEZ6 модулятором для обеспечения ADC, как указано выше в настоящем документе.
Используемое в настоящем документе выражение “цитотоксическое средство” означает вещество, которое является токсическим для клеток и уменьшает или ингибирует функцию клеток и/или вызывает разрушение клеток. Как правило, вещество представляет собой встречающуюся в природе молекулу, полученную из живого организма. Примеры цитотоксических средств включают без ограничения низкомолекулярные токсины или ферментативно активные токсины бактерий (например, дифтерийный токсин, эндотоксин и экзотоксин Pseudomonas, стафилококковый энтеротоксин A), грибов (например, α-сарцин, рестриктоцин), растений (например, абрин, рицин, модессин, вискумин, противовирусный белок лаконоса, сапонин, гелонин, моморидин, трихосантин, токсин ячменя, белки Aleurites fordii, диантиновые белки, белки Phytolacca mericana (PAPI, PAPII и PAP-S), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Saponaria officinalis, гелонин, митегеллин, рестриктоцин, феномицин, неомицин и трихотецины) или животных (например, цитотоксические РНКазы, такие как внеклеточные РНКазы из поджелудочной железы; ДНКаза I, в том числе их фрагменты и/или варианты).
Для целей настоящего изобретения “химиотерапевтическое средство” предусматривает химическое соединение, которое неспецифически уменьшает или ингибирует рост, пролиферацию и/или выживание раковых клеток (например, цитотоксические или цитостатические средства). Такие химические средства часто направлены на внутриклеточные процессы, необходимые для роста или деления клеток, и, таким образом, являются особенно эффективными против злокачественных клеток, которые обычно растут и делятся быстро. Например, винкристин деполимеризует микротрубочки и, таким образом, препятствует вхождению клеток в митоз. В целом, химиотерапевтические средства могу включать любое химическое средство, которое ингибирует или разработано для ингибирования злокачественной клетки или клетки, которая, вероятно, станет злокачественной или образует опухолеродное потомство (например, TIC). Такие средства часто вводятся и зачастую наиболее эффективны, в комбинации, например, в схемах, таких как CHOP или FOLFIRI. И в этом случае в выбранных вариантах осуществления такие химиотерапевтические средства могут быть конъюгированы с раскрытыми модуляторами.
Примеры противораковых средств, которые могут быть использованы в комбинации с (или конъюгированы с) модуляторами по настоящему изобретению, включают без исключения алкилирующие средства, алкилсульфонаты, азиридины, этиленимины и метиламеламины, ацетогенины, камптотецин, бриостатин, каллистатин, CC-1065, криптофицины, доластатин, дуокармицин, элеутеробин, панкратистатин, саркодиктиин, спонгистатин, азотистые иприты, антибиотики, эндииновые антибиотики, динемицин, бисфосфонаты, эсперамицин, хромопротеиновые эндииновые антибиотические хромофоры, аклациномицины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, эрлотиниб, вемурафениб, кризотиниб, сорафениб, ибрутиниб, энзалутамид, аналоги фолиевой кислоты, аналоги пурина, андрогены, антиадреналиновые средства, корректор фолиевой кислоты, такой как фролиновая кислота, ацеглатон, альдофосфамидгликозид, аминолевулиновую кислоту, енилурацил, амсакрин, бестрабуцил, бисантрен, эдатраксат, дефофамин, демеколцин, диазиквон, эльфорнитин, ацетат эллиптиния, эпотилон, этоглуцид, нитрат галлия, гидроксимочевину, лентинан, лонидайнин, майтансиноиды, митогуазон, митоксантрон, мопиданмол, нитраерин, пентостатин, фенамет, пирарубицин, лозоксантрон, подофиллиновую кислоту, 2-этилгидразид, прокарбазин, PSK® полисахаридный комплекс (JHS Natural Products, Юджин, Орегон), разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно T-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; тиотепа; таксоиды, хлоранбуцил; GEMZAR® гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселода; ибандронат; иринотекан (камптосар, CPT-11), ингибитор топоизомеразы RFS 2000; дифторметилорнитин; ретиноиды; капецитабин; комбретастатин; лейковорин; оксалиплатин; ингибиторы PKC-альфа, Raf, H-Ras, EGFR и VEGF-A, которые снижают пролиферацию клеток, а также фармацевтически приемлемые соли, кислоты или производные любого из вышеприведенного. Также в это определение включены противогормональные средства, которые действуют с регулированием или ингибированием действия гормонов на опухоли, такие как антиэстрогены и селективные модуляторы эстрогенового рецептора, ингибиторы ароматазы, ингибирующие фермент ароматазу, который регулирует продукцию эстрогена в надпочечниках, и антиандрогены; а также троксацитабин (цитозиновый аналог 1,3-диоксоланнуклеозида); антисмысловые олигонуклеотиды, рибозимы, такие как ингибитор экспрессии VEGF и ингибитор экспрессии HER2; вакцины, PROLEUKIN® rIL-2; LURTOTECAN® ингибитор топоизомеразы 1; ABARELIX® rmRH; винорелбин и эсперамицин, а также фармацевтически приемлемые соли, кислоты или производные любого из вышеприведенного.
В других вариантах осуществления модуляторы в соответствии с настоящим изобретением могут быть использованы в комбинации с любым из ряда антител (или иммунотерапевтических средств), в настоящее время проходящих клинические испытания или коммерчески доступных. Для этой цели раскрытые модуляторы могут быть использованы в комбинации с антителом, выбранным из группы, состоящей из абаговомаба, адекатумумаба, афутузумаба, алемтузумаба, альтумомаба, аматуксимаба, анатумомаба, арцитумомаба, бавитуксимаба, бектумомаба, бевацизумаба, биватузумаба, блинатумомаба, брентуксимаб, кантузумаба, катумаксомаба, цетуксимаба, цитатузумаба, циксутумумаба, кливатузумаба, конатумумаба, даратумумаба, дрозитумаба, дулиготумаба, дусигитумаба, детумомаба, дацетузумаба, далотузумаба, экромексимаба, элотузумаба, энситуксимаба, эртумаксомаба, этарацизумаба, фарлетузумаба, фиклатузумаба, фигитумумаба, фланвотумаба, футуксимаба, ганитумаба, гемтузумаба, гирентуксимаба, глембатумумаба, ибритумомаба, иговомаба, имгатузумаба, индатуксимаба, инотузумаба, интетумумаба, ипилимумаба, иратумумаба, лабетузумаба, лексатумумаба, линтузумаба, лорвотузумаб, лукатумумаба, мапатумумаба, матузумаба, милатузумаба, минретумомаба, митумомаба, моксетумомаба, нарнатумаба, наптумомаба, нецитумумаба, нимотузумаба, нофетумомаба, оракатузумаба, офатумумаба, оларатумаба, онартузумаба, опортузумаба, ореговомаба, панитумумаба, парзатузумаба, патритумаба, пемтумомаба, пертузумаба, пинтумомаба, притумумаба, ракотумомаба, радретумаба, рилотумумаба, ритуксимаба, робатумумаба, сатумомаба, сибротузумаба, силтуксимаба, симтузумаба, солитомаба, такатузумаба, таплитумомаба, тенатумомаба, терпротумумаба, тигатузумаба, тозитумомаба, трастузумаба, тукотузумаба, ублитуксимаба, велтузумаба, ворзетузумаба, вотумумаба, залутумумаба, CC49, 3F8 и их комбинаций.
Другие особенно предпочтительные варианты осуществления будут предусматривать применение антител, одобренных для терапии рака, в том числе без ограничения ритуксимаб, трастузумаб, гемтузумаб озогамицин, алемтузумаб, ибритумомаб тиуксетан, тозитумомаб, бевацизумаб, цетуксимаб, пантимумаб, офатумумаб, ипилимумаб и брентуксимаб ведотин. Специалисты в данной области смогут без труда выявить дополнительные противораковые средства, которые совместимы с изложенным в настоящем документе.
E. Лучевая терапия
Настоящее изобретение также предусматривает комбинацию модуляторов с лучевой терапией (т.е. любым механизмом для индуцирования повреждения ДНК локально в пределах опухолевых клеток, таким как гамма-облучение, рентгеновские лучи, УФ-облучение, микроволны, испускание электронов и подобное). Также предусматривается комбинированная терапия с применением направленной доставки радиоизотопов к опухолевым клеткам, и она может быть использована в сочетании с противораковым средством направленного действия или другими нацеливающими средствами. Как правило, лучевую терапию применяют импульсами в течение периода времени от приблизительно 1 до приблизительно 2 недель. Лучевая терапия может быть применена по отношению к индивидам с раком головы и шеи в течение приблизительно 6-7 недель. Необязательно, лучевая терапия может быть применена как однократная доза или как множественные, последовательные дозы.
XI. Показания
Следует понимать, что модуляторы в соответствии с настоящим изобретением могут быть использованы для диагностики, лечения или ингибирования возникновения или повторного появления любого SEZ6-ассоциированного расстройства. Соответственно, вводимые отдельно или в комбинации с противораковым средством или лучевой терапией, модуляторы по настоящему изобретению особенно пригодны для общего лечения неопластических состояний у пациентов или индивидов, которые могут включать доброкачественные или злокачественные опухоли (например, карциному надпочечника, печени, почки, мочевого пузыря, молочной железы, желудка, яичника, ободочной и прямой кишки, предстательной железы, поджелудочной железы, легкого, щитовидной железы, гепатокарциному, карциному шейки матки, эндометрия, пищевода и матки; саркомы; глиобластомы и различные опухоли головы и шеи); лейкозы и лимфонеоплазии; другие расстройства, такие как расстройства, связанные с нейронами, глией, астроцитами, гипоталамусом и другими железами, макрофагами, эпителием, стромой и бластоцелем; и воспалительные, ангиогенные, иммунологические расстройства и расстройства, вызванные патогенами. В частности, ключевыми мишенями для лечения являются неопластические состояния, включающие солидные опухоли, хотя гемобластозы находятся в пределах объема настоящего изобретения. Предпочтительно, “индивид” или “пациент”, подлежащий лечению, будет представлять собой человека, хотя, используемые в настоящем документе выражения в явной форме настаивают на включении любого вида млекопитающих.
Более конкретно, неопластические состояния индивида для лечения в соответствии с настоящим изобретением могут быть выбраны из группы, включающей без ограничения опухоли надпочечника, СПИД-ассоциированные формы рака, альвеолярную саркому мягких тканей, астроцитомы, рак мочевого пузыря (плоскоклеточную карциному и переходноклеточную карциному), рак кости (злокачественную адамантиному, аневризмальные кисты кости, остеохондрому, остеосаркому), рак головного мозга и рак спинного мозга, метастатические опухоли головного мозга, рак молочной железы, хемодектомы, рак шейки матки, хондросаркому, хордому, хромофобную почечно-клеточную карциному, светлоклеточную карциному, рак толстой кишки, рак ободочной и прямой кишки, кожные доброкачественные фиброзные гистиоцитомы, десмопластические мелкокруглоклеточные опухоли, эпиндемомы, опухоли Юинга, внескелетную миксоидную хондросаркому, несовершенный костный фиброгене, фиброзную дисплазию кости, рак желчного пузыря и рак желчного протока, гестационное трофобластическое заболевание, эмбрионально-клеточные опухоли, рак головы и рак шеи, инсуломы, саркому Капоши, рак почки (нефробластому, папиллярную почечно-клеточную карциному), лейкозы, липому/доброкачественные липоматозные опухоли, липосаркому/злокачественные липоматозные опухоли, рак печени (гепатобластома, печеночноклеточную карциному), лимфомы, виды рака легкого (мелкоклеточную карциному, аденокарциному, плоскоклеточную карциному, крупноклеточную карциному и т.д.), медуллобластому, меланому, менингиомы, множественные эндокринные неоплазии, множественную миелому, миелодиспластический синдром, нейробластому, нейроэндокринные опухоли, рак яичника, виды рака поджелудочной железы, виды папиллярных карцином щитовидной железы, опухоли паращитовидных желез, виды детского рака, опухоли оболочек периферических нервов, феохромоцитому, опухоли гипофиза, рак предстательной железы, меланому задней части сосудистой оболочки глаза, редкие расстройства кроветворной системы, метастатический рак почки, рабдоидную опухоль, рабдомиосаркому, саркомы, рак кожи, саркомы мягких тканей, плоскоклеточный рак, рак желудка, синовиальную саркому, рак яичка, карциному вилочковой железы, тимому, метастатический рак щитовидной железы и виды рака матки (карциному шейки матки, карциному эндометрия и лейомиому).
В определенных предпочтительных вариантах осуществления пролиферативное расстройство будет предусматривать солидную опухоль, включающую без ограничения карциному надпочечника, печени, почки, мочевого пузыря, молочной железы, желудка, яичника, шейки матки, матки, пищевода, ободочной и прямой кишки, предстательной железы, поджелудочной железы, легкого (как мелкоклеточную, так и не относящуюся к мелкоклеточной), щитовидной железы, саркомы, глиобластомы и различные опухоли головы и шеи. В других предпочтительных вариантах осуществления, и как показано в примерах ниже, раскрытые модуляторы особенно эффективны при лечении мелкоклеточного рака легкого (SCLC) и рака легкого, не относящегося к мелкоклеточному (NSCLC), (например, плоскоклеточного рака легкого, не относящегося к мелкоклеточному, или плоскоклеточного мелкоклеточного рака легкого). В одном варианте осуществления рак легкого является не поддающимся лечению, рецидивным или устойчивым к средству на основе платины (например, карбоплатину, цисплатину, оксалиплатину, топотекану) и/или таксану (например, доцетакселу, паклитакселу, ларотакселу или кабазитакселу). Кроме того, в особенно предпочтительных вариантах осуществления раскрытые модуляторы могут быть использованы в конъюгированной форме для лечения мелкоклеточного рака легкого.
Что касается мелкоклеточного рака легкого, особенно предпочтительные варианты осуществления будут предусматривать введение конъюгированных модуляторов (ADC). В выбранных вариантах осуществления конъюгированные модуляторы будут вводиться пациентам, проявляющим ограниченную стадию заболевания. В других вариантах осуществления раскрытые модуляторы будут вводиться пациентам, проявляющим запущенную стадию заболевания. В других предпочтительных вариантах осуществления раскрытые конъюгированные модуляторы будут вводиться не поддающимся лечению пациентам (т.e. пациентам, у которых наблюдается рецидив во время или сразу после завершения курса начальной терапии). Другие варианты осуществления предусматривают введение раскрытых модуляторов восприимчивым пациентам (т.е. пациентам, рецидив у которых возникает более, чем через 2-3 месяца после первичной терапии). В каждом случае следует понимать, что совместимые модуляторы могут находиться в конъюгированном или неконъюгированном состоянии в зависимости от выбранного режима дозировки и клинического диагноза.
Как обсуждалось выше, раскрытые модуляторы также могут быть использованы для профилактики, лечения или диагностики опухолей с нейроэндокринными свойствами или фенотипами, в том числе нейроэндокринных опухолей. Настоящие или канонические нейроэндокринные опухоли (NET), происходящие из диффузной эндокринной системы, являются редкими, с частотой возникновения 2-5 на 100000 человек, но очень быстро растущими. Нейроэндокринные опухоли наблюдаются в почке, мочеполовом тракте (мочевой пузырь, простата, яичники, шейка матки и эндометрий), желудочно-кишечном тракте (толстая кишка, желудок), щитовидной железе (медуллярный рак щитовидной железы) и легком (мелкоклеточная карцинома легких и крупноклеточная нейроэндокринная карцинома). Эти опухоли могут секретировать некоторые гормоны, в том числе серотонин и/или хромогранин A, которые могут вызывать симптомы истощения, известные как карциноидный синдром. На такие опухоли могут указывать положительные иммуногистохимические маркеры, такие нейрон-специфическая енолаза (NSE, также известная как гамма-енолаза, символ гена = ENO2), CD56 (или NCAM1), хромогранин A (CHGA) и синаптофизин (SYP), или гены, как известно, проявляющие повышенную экспрессию, такие как ASCL1. К сожалению, традиционные химиотерапевтические средства не были особенно эффективными в лечении NET, и метастазирование в печень является обычным исходом.
Хотя раскрытые модуляторы преимущественно можно применять для лечения нейроэндокринных опухолей, их также можно применять для лечения, профилактики или диагностики псевдонейроэндокринных опухолей (pNET), которые генотипически или фенотипически имитируют, имеют сходство или характеризуются общими признаками с каноническими нейроэндокринными опухолями. Псевдонейроэндокринные опухоли или опухоли с нейроэндокринными свойствами представляют собой опухоли, которые происходят из клеток диффузной нейроэндокринной системы или из клеток, в которых каскад нейроэндокринной дифференцировки ошибочно был повторно активирован в ходе опухолеродного процесса. Такие pNET обычно имеют определенные общие фенотипические или биохимические характеристики с обычными нейроэндокринными опухолями, в том числе способность образовывать разновидности биологически активных аминов, нейротрансмиттеров и пептидных гормонов. Гистологически такие опухоли (NET и pNET) обладают общим внешним видом, часто демонстрирующим плотно соединенные мелкие клетки с минимальным количеством цитоплазмы с легкой цитопатологией и круглыми - овальными ядрами с пунктирным рисунком. Для целей настоящего изобретения обычным образом экспрессируемые гистологические маркеры или генетические маркеры, которые могут быть использованы для указания на нейроэндокринные и псевдонейроэндокринные опухоли, включают без исключения хромогранин A, CD56, синаптофизин, PGP9.5, ASCL1 и нейрон-специфическую енолазу (NSE).
Соответственно, модуляторы по настоящему изобретению фактически могут быть использованы для лечения как псевдонейроэндокринных опухолей, так и канонических нейроэндокринных опухолей. В связи с этим модуляторы могут быть использованы, как описано в настоящем документе, для лечения нейроэндокринных опухолей (как NET, так и pNET), возникающих в почке, мочеполовом тракте (мочевой пузырь, простата, яичники, шейка матки и эндометрий), желудочно-кишечном тракте (толстая кишка, желудок), щитовидной железе (медуллярный рак щитовидной железы) и легком (мелкоклеточная карцинома легких и крупноклеточная нейроэндокринная карцинома). Более того, модуляторы по настоящему изобретению могут быть использованы для лечения опухолей, экспрессирующих один или несколько маркеров, выбранных из группы, состоящей из NSE, CD56, синаптофизина, хромогранина A, ASCL1 и PGP9.5 (UCHL1). То есть, настоящее изобретение может быть использовано для лечения индивида, страдающего от опухоли, которая представляет собой NSE+, или CD56+, или PGP9.5+, или ASCL1+, или SYP+, или CHGA+, или некоторые их комбинации.
Что касается гемобластозов, кроме того, будет понятно, что соединения и способы по настоящему изобретению могут быть особенно эффективны в лечении ряда B-клеточных лимфом, в том числе низкой степени злокачественности/NHL лимфомы из фолликулярных клеток (FCC), лимфомы из клеток мантийной зоны (MCL), диффузной крупноклеточной лимфомы (DLCL), NHL из малых лимфоцитов (SL), средней степени злокачественности/фолликулярной NHL, диффузной NHL средней степени злокачественности, иммунобластной NHL высокой степени злокачественности, лимфобластной NHL высокой степени злокачественности, мелкоклеточной с нерассеченными ядрами NHL высокой степени злокачественности, генерализованной NHL, макроглобулинемии Вальденстрема, лимфоплазмацитоидной лимфомы (LPL), лимфомы из клеток мантийной зоны (MCL), фолликулярной лимфомы (FL), диффузной крупноклеточной лимфомы (DLCL), лимфомы Беркитта (BL), СПИД-связанных лимфом, моноцитарной B-клеточной лимфомы, ангиоиммунобластной лимфаденопатии, мелкоклеточной лимфоцитарной, фолликулярной, диффузной крупноклеточной, диффузной мелкоклеточной с рассеченными ядрами, крупноклеточной иммунобластной лимфобластомы, мелкоклеточной, с нерассеченными ядрами, Беркитта и неберкитовской, фолликулярной, преимущественно крупноклеточной; фолликулярной, преимущественно мелкоклеточной с рассеченными ядрами и фолликулярной, смешанной мелкоклеточной с рассеченными ядрами и крупноклеточной лимфом. См., Gaidono et al., "Lymphomas", в CANCER: PRINCIPLES & PRACTICE OF ONCOLOGY, Vol. 2: 2131-2145 (DeVita et al., eds., 5.sup.th ed. 1997). Специалистам в данной области будет понятно, что эти лимфомы будут зачастую иметь разные названия из-за изменения систем классификации, и что пациенты с лимфомами, классифицируемыми под различными названиями, также могут получать пользу от комбинированных терапевтических схем по настоящему изобретению.
Настоящее изобретение также предусматривает предупредительное или профилактическое лечение индивидов, у которых обнаруживаются доброкачественные или предзлокачественные опухоли. Помимо того, что они являются SEZ6-ассоциированным расстройством, не предполагается, что любой конкретный тип опухоли или пролиферативного расстройства должен быть исключен из лечения с помощью настоящего изобретения. Однако тип опухолевых клеток может иметь отношение к применению настоящего изобретения в комбинации с вторичными терапевтическими средствами, в частности, химиотерапевтическими средствами и нацеленными противораковыми средствами.
XII. Изделия
Также предусмотрены фармацевтические упаковки и наборы, содержащие один или несколько контейнеров, содержащих одну или несколько доз SEZ6 модулятора. В определенных вариантах осуществления предусмотрена единичная дозировка, где единичная дозировка содержит предопределенное количество композиции, содержащей, например, антитело к SEZ6, с одним или несколькими дополнительными средствами или без них. Для других вариантов осуществления такая единичная дозировка предоставлена в виде шприца-ручки для инъекций однократного применения. В других вариантах осуществления композиция, которая содержится в единичной дозировке, может содержать солевой раствор, сахарозу и подобное; буфер, такой как фосфатный, и подобное; и/или она составлена с соблюдением стабильного и эффективного диапазона pH. В качестве альтернативы, в определенных вариантах осуществления композиция может предусматриваться в виде лиофилизированного порошка, который может быть восстановлен при добавлении подходящей жидкости, например, стерильной воды. В определенных предпочтительных вариантах осуществления композиция содержит одно или несколько веществ, которые ингибируют агрегацию белков, в том числе без ограничений сахарозу и аргинин. Какая-либо этикетка на контейнере(ах) или связанная с ним(и) указывает, что заключенная в нем(них) композиция применяется для диагностики или лечения выбранного болезненного состояния.
Настоящее изобретение также предусматривает наборы для получения единиц для однократного или многократного введения SEZ6 модулятора и, необязательно, одного или нескольких противораковых средств. Набор содержит контейнер и этикетку или листок-вкладыш на контейнере или ассоциированный с ним. Подходящие контейнеры включают, например, флаконы, ампулы, шприцы и т.д. Контейнеры могут быть получены из различных материалов, таких как стекло или пластик, и содержать фармацевтически эффективное количество раскрытых модуляторов в конъюгированной или неконъюгированной форме. В других предпочтительных вариантах осуществления контейнер(ы) содержит стерильное входное отверстие (например, контейнер может представлять собой мешок для внутривенных растворов или ампулу с пробкой, поддающейся прокалыванию с помощью иглы для подкожных инъекций). Такие наборы, как правило, будут содержать в подходящем контейнере фармацевтически приемлемый состав SEZ6 модулятора и, необязательно, одно или несколько противораковых средств в том же или других контейнерах. Наборы также могут содержать другие фармацевтически приемлемые составы или для диагностики, или для комбинированной терапии. Например, вдобавок к SEZ6 модулятору по настоящему изобретению такие наборы могут содержать любое одно или несколько из ряда противораковых средств, таких как химиотерапевтические или радиотерапевтические лекарственные средства; противоангиогенные средства; противометастатические средства; нацеленные противораковые средства; цитотоксические средства и/или другие противораковые средства. Такие наборы также могут предусматривать подходящие реагенты для конъюгации SEZ6 модулятора с противораковым средством или диагностическим средством (например, см. патентный документ США № 7422739, который включен в настоящий документ посредством ссылки во всей своей полноте).
Более конкретно, наборы могут иметь один контейнер, который содержит SEZ6 модулятор с дополнительными компонентами или без таковых, или они могут иметь отдельные контейнеры для каждого требуемого средства. Если комбинированные терапевтические средства предусматриваются для конъюгации, единый раствор может быть предварительно смешан, либо при комбинации молярных эквивалентов, либо при избытке одного компонента по отношению к другому. В качестве альтернативы, SEZ6 модулятор и любое необязательное противораковое средство набора могут содержаться отдельно в отдельных контейнерах перед введением пациенту. Наборы также могут содержать второй/третий контейнер, предназначенный для помещения стерильного, фармацевтически приемлемого буфера или другого разбавителя, такого как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буфер (PBS), раствор Рингера и раствор декстрозы.
Если компоненты набора предусмотрены в виде одного или нескольких жидких растворов, жидкий раствор, предпочтительно, представляет собой водный раствор, при этом особенно предпочтительным является стерильный водный раствор. Однако компоненты набора могут быть предусмотрены как сухой порошок(и). Если реагенты или компоненты предусмотрены в виде сухого порошка, порошок может быть восстановлен путем добавления подходящего растворителя. Это предполагает, что растворитель также может быть предусмотрен в другом контейнере.
Как кратко указано выше, наборы могут также содержать средства, с помощью которых антитело и любые необязательные компоненты вводят животному или пациенту, например, одну или несколько игл или один или несколько шприцов, или даже капельницу, пипетку или другое подобное приспособление, с помощью которого состав может быть инъецирован или введен животному или нанесен на участок организма, пораженный заболеванием. Наборы по настоящему изобретению будут также включать средство для помещения ампул, или подобного, и другой компонент для строгого ограничения их движения для продажи, такие как, например, пластиковые контейнеры, полученные с помощью литья под давлением или выдувания, в которые требуемые ампулы и другие приспособления помещают и удерживают. Какая-либо этикетка или листок-вкладыш указывает на то, что композиция SEZ6 модулятора применяются для лечения рака, например, мелкоклеточного рака легкого.
В других предпочтительных вариантах осуществления модуляторы по настоящему изобретению могут быть использованы в сочетании с диагностическими или терапевтическими устройствами, пригодными для диагностики или лечения пролиферативных расстройств, или содержать их. Например, в одном предпочтительном варианте осуществления соединения и композиции по настоящему изобретению могут быть объединены с определенными диагностическими устройствами или инструментами, которые могут быть использованы для выявления, отслеживания, количественной оценки или определения профиля клеток или маркерных соединений, связанных с этиологией или манифестацией пролиферативных расстройств. Для выбранных вариантов осуществления маркерные соединения могут предусматривать NSE, CD56, синаптофизин, хромогранин A и PGP9.5.
В особенно предпочтительных вариантах осуществления устройства могут быть использованы для выявления, отслеживания и/или количественной оценки циркулирующих опухолевых клеток либо in vivo, либо in vitro (см., например, WO 2012/0128801, которая включена в настоящий документ путем ссылки). В других предпочтительных вариантах осуществления, и как обсуждалось выше, циркулирующие опухолевые клетки могут включать раковые стволовые клетки.
XIII. Реагенты для исследований
В других предпочтительных вариантах осуществления настоящего изобретения также используются свойства раскрытых модуляторов в качестве инструмента, пригодного для идентификации, отслеживания, выделения, разделения или обогащения популяций или субпопуляций клеток, вызывающих развитие опухоли, посредством способов, таких как проточная цитометрия, сортировка клеток с активированной флуоресценцией (FACS), сортировка клеток с магнитной активацией (MACS) или лазерное разделение. Специалисты в данной области техники поймут, что модуляторы могут быть использованы в нескольких совместимых методиках для определения характеристик и манипуляции с TIC, в том числе с раковыми стволовыми клетками (например, см. патентные документы США №№ 12/686359, 12/669136 и 12/757649, каждый из которых включен в настоящий документ в качестве ссылки в полном объеме).
XIV. Прочее
Если в настоящем документе не определено иное, научные и технические выражения, применяемые в связи с настоящим изобретением, будут иметь значения, которые в большинстве случаев понимают рядовые специалисты в данной области. Более того, если контекст не требует иного, выражения в единственном числе будут включать множественное число, а выражения в множественном числе будут включать единственное число. Более конкретно, используемые в данном описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если контекст явно не указывает на иное. Таким образом, например, ссылка на "белок" подразумевает несколько белков; ссылка на "клетку" подразумевает смеси клеток и т.п. В дополнение, диапазоны, предусмотренные в описании и прилагаемой формуле изобретения, включают как крайние точки, так и все точки между крайними точками. Следовательно, диапазон 2,0-3,0 включает 2,0, 3,0 и все точки между 2,0 и 3,0.
В целом, используемые номенклатура и методики, связанные с клеточной и тканевой культурой, молекулярной биологией, иммунологией, микробиологией, генетикой и химией и гибридизацией белков и нуклеиновых кислот, описанные в настоящем документе, хорошо известны и обычно применяются в области техники. Способы и методики по настоящему изобретению, как правило, проводят в соответствии с традиционными способами, хорошо известными в уровне техники, и как описано в различных общих и более конкретных ссылках, которые цитируются и обсуждаются по всему настоящему описанию, если не указано иное. См., например, Abbas et al., Cellular and Molecular Immunology, 6th ed., W.B. Saunders Company (2010); Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); и Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). Ферментативные реакции и методики очистки проводят в соответствии с инструкциями производителя, как обычно осуществляется в области техники или как описано в настоящем документе. Используемые номенклатура и лабораторные процедуры и методики, связанные с аналитической химией, химией органического синтеза и медицинской и фармацевтической химией, описанные в настоящем документе, хорошо известны и обычно применяются в области техники. Более того, любые заглавия разделов, используемые в настоящем документе, приведены только для организационных целей, и их не следует толковать как ограничивающие описанный объект.
XV. Ссылочные документы для SEZ6
Все ссылки или документы, раскрытые или процитированные в данном описании, без ограничения, включены в настоящий документ посредством ссылки в во всей их полноте. Более того, любые заглавия разделов, используемые в настоящем документе, приведены только для организационных целей, и их не следует толковать как ограничивающие описанный объект.
1. Bork P, Beckmann G. (1993). The CUB domain. A widespread module in developmentally regulated proteins. J Mol Biol. 231:539-45. PMID: 8510165.
2. Galluzzo P, and Bocchetta M (2011). Notch signaling in lung cancer. Expert Rev Anticancer Ther. 11:533-40. PMID: 21504320.
3. Gunnersen JM et al. (2007). Sez-6 proteins affect dendritic arborization patterns and excitability of cortical pyramidal neurons. Neuron. 56:621-39. PMID: 18031681.
4. Gunnersen JM et al. (2009). Seizure-related gene 6 (Sez-6) in amacrine cells of the rodent retina and the consequence of gene deletion. PLoS One. 4:e6546. PMID: 19662096.
5. Herbst R, Nicklin MJ (1997). SEZ-6: promoter selectivity, genomic structure and localized expression in the brain. Brain Res Mol Brain Res. 44:309-22. PMID: 9073173.
6. Klimstra DS, et al. (2010). The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems. Pancreas. 39:707-12. PMID: 20664470.
7. Klöppel G. (2011). Classification and pathology of gastroenteropancreatic neuroendocrine neoplasms. Endocr Relat Cancer. 18 Suppl 1:S1-16. PMID: 22005112.
8. Mulley JC et al. (2011). The Role of Seizure-Related SEZ6 as a Susceptibility Gene in Febrile Seizures. Neurol Res Int. 2011:917565. PMID: 21785725.
9. Shimizu-Nishikawa K et al., (1995). Cloning and expression of SEZ-6, a brain-specific and seizure-related cDNA. Brain Res Mol Brain Res. 28:201-10. PMID: 7723619.
10. Yao JC et al. (2008). One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35825 cases in the United States. J Clin Oncol. 26:3063-72. PMID: 18565894.
11. Yu ZL et al., (2007). Febrile seizures are associated with mutation of seizure-related (SEZ) 6, a brain-specific gene. J Neurosci Res. 85:166-72. PMID: 17086543.
XVI. Выбранные варианты осуществления настоящего изобретения
В дополнение к раскрытию и примерам в настоящем документе, настоящее изобретение направлено на выбранные варианты осуществления, конкретно изложенные непосредственно ниже.
Предполагаемая формула изобретения:
1. Выделенный SEZ6 модулятор.
2. Выделенный SEZ6 модулятор по п. 1, где SEZ6 модулятор включает антагонист SEZ6.
3. Выделенный SEZ6 модулятор по п. 1, где SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
4. Выделенный SEZ6 модулятор по п. 3, где антитело или его иммунореактивный фрагмент включает моноклональное антитело.
5. Выделенный SEZ6 модулятор по п. 4, где моноклональное антитело выбрано из группы, состоящей из химерных антител, гуманизированных антител и человеческих антител.
6. Выделенный SEZ6 модулятор по п. 4 Ошибка! Источник ссылки не найден., где указанное моноклональное антитело включает нейтрализующее антитело.
7. Выделенный SEZ6 модулятор по п. 4, где указанное моноклональное антитело включает истощающее антитело.
8. Выделенный SEZ6 модулятор по п. 4, где указанное моноклональное антитело включает интернализирующее антитело.
9. Выделенный SEZ6 модулятор по п. 8, где указанное моноклональное антитело дополнительно содержит цитотоксическое средство.
10. Выделенный SEZ6 модулятор по п. 4, где указанное моноклональное антитело содержит вариабельную область легкой цепи с тремя определяющими комплементарность областями и вариабельную область тяжелой цепи с тремя определяющими комплементарность областями, где определяющие комплементарность области тяжелой и легкой цепи содержат по меньшей мере одну определяющую комплементарность область, приведенную на фиг. 10A или фиг. 10B, соответственно.
11. Выделенный SEZ6 модулятор по п. 4, где указанное моноклональное антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40, SEQ ID NO:42, SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:48, SEQ ID NO:50, SEQ ID NO:52, SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104, SEQ ID NO:106, SEQ ID NO:108, SEQ ID NO:110, SEQ ID NO:112, SEQ ID NO:114, SEQ ID NO:116, SEQ ID NO:118, SEQ ID NO:120, SEQ ID NO:122, SEQ ID NO:124, SEQ ID NO:126, SEQ ID NO:128, SEQ ID NO:130, SEQ ID NO:132, SEQ ID NO:134, SEQ ID NO:136, SEQ ID NO:138, SEQ ID NO:140, SEQ ID NO:142, SEQ ID NO:144, SEQ ID NO:146, SEQ ID NO:148, SEQ ID NO:150, SEQ ID NO:152, SEQ ID NO:154, SEQ ID NO:156, SEQ ID NO:158, SEQ ID NO:160, SEQ ID NO:162, SEQ ID NO:164, SEQ ID NO:166 и SEQ ID NO:168, и при этом указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33, SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43, SEQ ID NO:45, SEQ ID NO:47, SEQ ID NO:49, SEQ ID NO:51, SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103, SEQ ID NO:105, SEQ ID NO:107, SEQ ID NO:109, SEQ ID NO:111, SEQ ID NO:113, SEQ ID NO:115, SEQ ID NO:117, SEQ ID NO:119, SEQ ID NO:121, SEQ ID NO:123, SEQ ID NO:125, SEQ ID NO:127, SEQ ID NO:129, SEQ ID NO:131, SEQ ID NO:133, SEQ ID NO:135, SEQ ID NO:137, SEQ ID NO:139, SEQ ID NO:141, SEQ ID NO:143, SEQ ID NO:145, SEQ ID NO:147, SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:153, SEQ ID NO:155, SEQ ID NO:157, SEQ ID NO:159, SEQ ID NO:161, SEQ ID NO:163, SEQ ID NO:165, SEQ ID NO:167 и SEQ ID NO:169.
12. Выделенный SEZ6 модулятор, содержащий CDR из любой из вариабельных областей легкой или тяжелой цепи, приведенных в п. 11.
13. Выделенный SEZ6 модулятор, содержащий конкурирующее антитело, где указанное конкурирующее антитело ингибирует связывание выделенного SEZ6 модулятора по п. 10 или п. 11 с SEZ6 по меньшей мере на приблизительно 40%.
14. Нуклеиновая кислота, кодирующая аминокислотную последовательность вариабельной области тяжелой цепи или аминокислотную последовательность вариабельной области легкой цепи по п. 11.
15. Вектор, содержащий нуклеиновую кислоту по п.14.
16. Выделенный SEZ6 модулятор по п. 1, содержащий аминокислотную последовательность, выбранную из группы, состоящую из SEQ ID NO:3, SEQ ID NO:4 и их фрагментов.
17. Выделенный SEZ6 модулятор по п. 16, где SEZ6 модулятор дополнительно содержит по меньшей мере участок константной области иммуноглобулина.
18. Выделенный SEZ6 модулятор по п. 1, где указанный модулятор при введении индивиду, нуждающемуся в этом, снижает частоту клеток, вызывающих развитие опухоли.
19. Выделенный SEZ6 модулятор по п. 18, где снижение частоты определяется при помощи проточного цитометрического анализа поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли.
20. Выделенный SEZ6 модулятор по п. 18, где снижение частоты определяется при помощи иммуногистохимического выявления поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли.
21. Выделенный SEZ6 модулятор по п. 18, где указанные клетки, вызывающие развитие опухоли, включают клетки, обеспечивающие поддержание опухоли.
22. Выделенный SEZ6 модулятор по п.1, дополнительно содержащий цитотоксическое средство.
23. Фармацевтическая композиция, содержащая выделенный SEZ6 модулятор по п.1.
24. Фармацевтическая композиция по п. 23, где указанный выделенный SEZ6 модулятор включает моноклональное антитело.
25. Фармацевтическая композиция по п. 24, где указанное моноклональное антитело включает гуманизированное антитело.
26. Фармацевтическая композиция по п. 25, где указанное гуманизированное антитело содержит цитотоксическое средство.
27. Выделенный SEZ6 модулятор по п. 26 где указанное цитотоксическое средство включает пирролобензодиазепин.
28. Выделенный SEZ6 модулятор по п. 26, где указанное цитотоксическое средство включает ауристатин.
29. Способ лечения SEZ6-ассоциированного расстройства, включающий введение терапевтически эффективного количества SEZ6 модулятора индивиду, нуждающемуся в этом.
30. Способ по п. 29, отличающийся тем, что указанные SEZ6 модулятор включает антагонист SEZ6.
31. Способ по п. 29, отличающийся тем, что указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
32. Способ по п. 31, отличающийся тем, что антитело или его иммунореактивный фрагмент включает моноклональное антитело.
33. Способ по п. 32, отличающийся тем, что моноклональное антитело выбрано из группы, состоящей из химерных антител, гуманизированных антител и человеческих антител.
34. Способ по п. 33, отличающийся тем, что указанное моноклональное антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, где указанная вариабельная область легкой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32, SEQ ID NO:34, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:40, SEQ ID NO:42, SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:48, SEQ ID NO:50, SEQ ID NO:52, SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104, SEQ ID NO:106, SEQ ID NO:108, SEQ ID NO:110, SEQ ID NO:112, SEQ ID NO:114, SEQ ID NO:116, SEQ ID NO:118, SEQ ID NO:120, SEQ ID NO:122, SEQ ID NO:124, SEQ ID NO:126, SEQ ID NO:128, SEQ ID NO:130, SEQ ID NO:132, SEQ ID NO:134, SEQ ID NO:136, SEQ ID NO:138, SEQ ID NO:140, SEQ ID NO:142, SEQ ID NO:144, SEQ ID NO:146, SEQ ID NO:148, SEQ ID NO:150, SEQ ID NO:152, SEQ ID NO:154, SEQ ID NO:156, SEQ ID NO:158, SEQ ID NO:160, SEQ ID NO:162, SEQ ID NO:164, SEQ ID NO:166 и SEQ ID NO:168, и при этом указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33, SEQ ID NO:35, SEQ ID NO:37, SEQ ID NO:39, SEQ ID NO:41, SEQ ID NO:43, SEQ ID NO:45, SEQ ID NO:47, SEQ ID NO:49, SEQ ID NO:51, SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103, SEQ ID NO:105, SEQ ID NO:107, SEQ ID NO:109, SEQ ID NO:111, SEQ ID NO:113, SEQ ID NO:115, SEQ ID NO:117, SEQ ID NO:119, SEQ ID NO:121, SEQ ID NO:123, SEQ ID NO:125, SEQ ID NO:127, SEQ ID NO:129, SEQ ID NO:131, SEQ ID NO:133, SEQ ID NO:135, SEQ ID NO:137, SEQ ID NO:139, SEQ ID NO:141, SEQ ID NO:143, SEQ ID NO:145, SEQ ID NO:147, SEQ ID NO:149, SEQ ID NO:151, SEQ ID NO:153, SEQ ID NO:155, SEQ ID NO:157, SEQ ID NO:159, SEQ ID NO:161, SEQ ID NO:163, SEQ ID NO:165, SEQ ID NO:167 и SEQ ID NO:169.
35. Способ по п. 34, отличающийся тем, что указанное моноклональное антитело представляет собой гуманизированное антитело.
36. Способ по п. 32, отличающийся тем, что указанное моноклональное антитело включает нейтрализующее антитело.
37. Способ по п. 32, отличающийся тем, что указанное моноклональное антитело включает интернализирующее антитело.
38. Способ по п. 37, отличающийся тем, что указанное интернализирующее антитело содержит цитотоксическое средство.
39. Способ по п. 38, отличающийся тем, что указанное цитотоксическое средство включает пирролобензодиазепин.
40. Способ по п. 38, отличающийся тем, что указанное цитотоксическое средство включает ауристатин.
41. Способ по п. 39, отличающийся тем, что указанное SEZ6-ассоциированное расстройство включает неопластическое расстройство.
42. Способ по п. 41, отличающийся тем, что указанное неопластическое расстройство включает опухоль, характеризующуюся нейроэндокринными свойствами.
43. Способ по п. 42, отличающийся тем, что указанная опухоль, характеризующаяся нейроэндокринными свойствами, включает нейроэндокринную опухоль.
44. Способ по п. 41, отличающийся тем, что индивид страдает от неопластического расстройства, выбранного из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака шейки матки, рака эндометрия, рака желудка, рака почки, рака печени, рака легкого, рака яичника, рака ободочной и прямой кишки, рака поджелудочной железы, рака предстательной железы и рака молочной железы.
45. Способ по п. 44, отличающийся тем, что индивид страдает от рака легкого.
46. Способ по п. 45, отличающийся тем, что индивид страдает от мелкоклеточного рака легкого.
47. Способ по п. 41, отличающийся тем, что у индивида, страдающего от указанного неопластического расстройства, проявляются опухоли, содержащие клетки, вызывающие развитие опухоли.
48. Способ по п. 47, дополнительно включающий этап снижения частоты клеток, вызывающих развитие опухоли, у указанного индивида.
49. Способ по п. 48, отличающийся тем, что снижение частоты определяют при помощи проточного цитометрического анализа поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли, или иммуногистохимического выявления поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли.
50. Способ по п. 48, отличающийся тем, что снижение частоты определяют при помощи способа из группы, состоящей из in vitro и in vivo анализа в предельном разведении.
51. Способ по п. 50, отличающийся тем, что снижение частоты определяют при помощи in vivo анализа в предельном разведении, предусматривающего трансплантацию живых человеческих опухолевых клеток мыши с ослабленным иммунитетом.
52. Способ по п. 51, отличающийся тем, что снижение частоты определяют при помощи in vivo анализа в предельном разведении, предусматривающего количественную оценку клеток, вызывающих развитие опухоли, с применением статистических методик распределения Пуассона.
53. Способ по п. 50, отличающийся тем, что снижение частоты определяют при помощи in vitro анализа в предельном разведении, предусматривающего осаждение при предельном разведении живых человеческих опухолевых клеток в условиях, способствующих образованию колоний in vitro.
54. Способ по п. 53, отличающийся тем, что снижение частоты, определяемое при помощи in vitro анализа в предельном разведении, предусматривает количественную оценку клеток, вызывающих развитие опухоли, с применением статистических методик распределения Пуассона.
55. Способ по п. 29 дополнительно предусматривающий этап введения противоракового средства.
56. Способ по п. 29, отличающийся тем, что указанный SEZ6 модулятор содержит один или несколько CDR из любой из SEQ ID NO:20-169.
57. Способ по п. 29, отличающийся тем, что указанный SEZ6 модулятор включает модулятор для всех SEZ6.
58. Способ по п. 57, отличающийся тем, что указанный SEZ6 модулятор содержит цитотоксическое средство.
59. Способ снижения частоты клеток, вызывающих развитие опухоли у индивида, нуждающегося в этом, предусматривающий этап введения SEZ6 модулятора указанному индивиду.
60. Способ по п. 59, отличающийся тем, что клетки, вызывающие развитие опухоли, включают клетки, обеспечивающие поддержание опухоли.
61. Способ по п. 60, отличающийся тем, что указанные клетки, обеспечивающие поддержание опухоли выбраны из клеток, экспрессирующих маркеры, выбранные из группы, состоящей из CD44+, CD324+ и CD133+ клеток.
62. Способ по п. 59, отличающийся тем, что указанный SEZ6 модулятор включает антитело.
63. Способ по п. 62, отличающийся тем, что указанное антитело включает моноклональное антитело.
64. Способ по п. 63, отличающийся тем, что указанное моноклональное антитело дополнительно содержит цитотоксическое средство.
65. Способ по п. 59, отличающийся тем, что индивид страдает от неопластического расстройства, выбранного из группы, состоящей из рака надпочечника, рака мочевого пузыря, рака шейки матки, рака эндометрия, рака почки, рака печени, рака легкого, рака яичника, рака ободочной и прямой кишки, рака поджелудочной железы, рака предстательной железы и рака молочной железы.
66. Способ по п. 65, отличающийся тем, что индивид страдает от рака легкого.
67. Способ по п. 66, отличающийся тем, что индивид страдает от мелкоклеточного рака легкого.
68. Способ по п. 59, отличающийся тем, что частоту клеток, вызывающих развитие опухоли, снижают по меньшей мере на 10%.
69. Способ по п. 59, отличающийся тем, что снижение частоты определяют при помощи проточного цитометрического анализа поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли, или иммуногистохимического выявления поверхностных маркеров опухолевых клеток, которые известны для обогащения клеток, вызывающих развитие опухоли.
70. Способ сенсибилизации опухоли у индивида для лечения противораковым средством, включающий этап введения SEZ6 модулятора указанному индивиду.
71. Способ по п. 70, отличающийся тем, что указанный SEZ6 модулятор включает антитело.
72. Способ по п. 70, отличающийся тем, что указанная опухоль представляет собой солидную опухоль.
73. Способ по п. 70, отличающийся тем, что указанное противораковое средство включает химиотерапевтическое средство.
74. Способ по п. 70, отличающийся тем, что указанное противораковое средство содержит иммунотерапевтическое средство.
75. Способ диагностики пролиферативного расстройства у индивида, нуждающегося в этом, включающий этапы:
i. получение образца ткани от указанного индивида;
ii. приведение в контакт образца ткани по меньшей мере с одним SEZ6 модулятором и
iii. выявление или количественная оценка SEZ6 модулятора, соединенного с образцом.
76. Способ по п. 75, отличающийся тем, что SEZ6 модулятор включает моноклональное антитело.
77. Способ по п. 76, отличающийся тем, что моноклональное антитело функционально связано с репортером.
78. Изделие, пригодное для выявления, диагностики или лечения SEZ6-ассоциированных расстройств, содержащее емкость, содержащую SEZ6 модулятор и инструктивные материалы для применения указанного SEZ6 модулятора для лечения или диагностики SEZ6-ассоциированного расстройства.
79. Изделие по п. 78, отличающееся тем, что указанный SEZ6 модулятор представляет собой моноклональное антитело.
80. Изделие по п. 78, отличающееся тем, что емкость включает считываемый планшет.
81. Способ лечения индивида, страдающего от неопластического расстройства, включающий этап введения терапевтически эффективного количества по меньшей мере одного интернализирующего SEZ6 модулятора.
82. Способ по п. 81, отличающийся тем, что указанный SEZ6 модулятор включает антитело.
83. Способ по п. 82, отличающийся тем, что указанное антитело включает моноклональное антитело.
84. Способ по п. 83, отличающийся тем, что указанное моноклональное антитело включает гуманизированное антитело.
85. Способ по п. 83, отличающийся тем, что моноклональное антитело дополнительно содержит цитотоксическое средство.
86. Способ по п. 81 дополнительно предусматривающий этап введения противоракового средства.
87. Способ по п. 81, отличающийся тем, что неопластическое расстройство включает опухоль, характеризующуюся нейроэндокринными свойствами.
88. Способ по п. 81, отличающийся тем, что неопластическое расстройство включает опухоль, характеризующуюся свойствами нейронов.
89. Способ по п. 81, отличающийся тем, что неопластическое расстройство включает рак легкого.
90. Способ по п. 81, отличающийся тем, что неопластическое расстройство включает мелкоклеточный рак легкого.
91. Способ лечения индивида, страдающего от неопластического расстройства, включающий этап введения терапевтически эффективного количества по меньшей мере одного нейтрализующего SEZ6 модулятора.
92. Способ по п. 91, отличающийся тем, что указанный SEZ6 модулятор включает антитело.
93. Способ по п. 92, отличающийся тем, что указанное антитело включает моноклональное антитело.
94. Способ по п. 93, отличающийся тем, что указанное моноклональное антитело включает гуманизированное антитело.
95. Способ по п. 94, отличающийся тем, что указанное гуманизированное антитело дополнительно содержит цитотоксическое средство.
96. Способ по п. 91 дополнительно предусматривающий этап введения противоракового средства.
97. Способ по п. 91, отличающийся тем, что неопластическое расстройство включает опухоль, характеризующуюся свойствами нейронов.
98. Способ по п. 91, отличающийся тем, что неопластическое расстройство включает опухоль, характеризующуюся нейроэндокринными свойствами.
99. Способ по п. 91, отличающийся тем, что неопластическое расстройство включает рак легкого.
100. Способ по п. 99, отличающийся тем, что неопластическое расстройство включает мелкоклеточный рак легкого.
101. Способ идентификации, выделения, разделения или обогащения популяции клеток, вызывающих развитие опухоли, включающий этап приведения в контакт указанных клеток, вызывающих развитие опухоли, с SEZ6 модулятором.
102. Способ по п. 101, отличающийся тем, что указанный SEZ6 модулятор включает антитело.
103. SEZ6 модулятор, включающий гуманизированное антитело, где указанное гуманизированное антитело содержит вариабельную область легкой цепи и вариабельную область тяжелой цепи, причем указанная вариабельная область легкой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, приведенных в SEQ ID NO:170, SEQ ID NO:172, SEQ ID NO:174, SEQ ID NO:176, SEQ ID NO:178, SEQ ID NO:180, SEQ ID NO:182, SEQ ID NO:184, SEQ ID NO:186, SEQ ID NO:188, SEQ ID NO:190 и SEQ ID NO:192, и при этом указанная вариабельная область тяжелой цепи содержит аминокислотную последовательность, имеющую по меньшей мере 60% идентичность с аминокислотной последовательностью, выбранной из группы, состоящей из аминокислотных последовательностей, выбранных из группы, состоящей из SEQ ID NO:171, SEQ ID NO:173, SEQ ID NO:175, SEQ ID NO:177, SEQ ID NO:179, SEQ ID NO:181, SEQ ID NO:183, SEQ ID NO:185, SEQ ID NO:187, SEQ ID NO:189, SEQ ID NO:191, SEQ ID NO:193, SEQ ID NO:194, SEQ ID NO:195, SEQ ID NO:196, SEQ ID NO:197, SEQ ID NO:198 и SEQ ID NO:199.
104. Способ ингибирования или профилактики метастазирования у индивида, нуждающегося в этом, включающий этап введения фармацевтически эффективного количества SEZ6 модулятора.
105. Способ по п. 104, отличающийся тем, что индивида подвергают процедуре циторедукции перед или после введения SEZ6 модулятора.
106. Способ по п. 105, отличающийся тем, что указанная процедура циторедукции включает введение по меньшей мере одного противоракового средства.
107. Способ проведения поддерживающей терапии у индивида, нуждающегося в этом, включающий этап введения фармацевтически эффективного количества SEZ6 модулятора.
108. Способ по п. 107, отличающийся тем, что указанного индивида лечили от неопластического расстройства перед введением SEZ6 модулятора.
109. Способ истощения клеток, вызывающих развитие опухоли, у индивида, страдающего от пролиферативного расстройства, включающий этап введения SEZ6 модулятора.
110. Способ диагностики, выявления или мониторинга SEZ6-ассоциированного расстройства in vivo у индивида, нуждающегося в этом, включающий этап введения SEZ6 модулятора.
111. Способ диагностики, выявления или мониторинга SEZ6-ассоциированного расстройства у индивида, нуждающегося в этом, включающий этап приведения в контакт циркулирующих опухолевых клеток с SEZ6 модулятором.
112. Способ по п. 111, отличающийся тем, что указанный этап приведения в контакт происходит in vivo.
113. Способ по п. 111, отличающийся тем, что указанный этап приведения в контакт происходит in vitro.
114. Способ лечения опухоли, характеризующейся нейроэндокринными свойствами, у пациента, нуждающегося в этом, включающий этап введения терапевтически эффективного количества SEZ6 модулятора.
115. Способ по п. 114, отличающийся тем, что указанная опухоль, характеризующаяся нейроэндокринными свойствами, представляет собой нейроэндокринную опухоль.
116. SEZ6 модулятор, полученный из антитела, выбранного из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200.
117. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с Sushi доменом 1 SEZ6.
118. SEZ6 модулятор по п. 117, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
119. SEZ6 модулятор по п. 118, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
120. SEZ6 модулятор по п. 119, где указанный SEZ6 модулятор включает ADC.
121. SEZ6 модулятор по п. 120, где указанный ADC содержит пирролобензодиазепин.
122. SEZ6 модулятор по п. 121, дополнительно содержащий линкер.
123. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с Sushi доменом 2 SEZ6.
124. SEZ6 модулятор по п. 123, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
125. SEZ6 модулятор по п. 124, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
126. SEZ6 модулятор по п. 125, где указанный SEZ6 модулятор включает ADC.
127. SEZ6 модулятор по п. 126, где указанный ADC содержит пирролобензодиазепин.
128. SEZ6 модулятор по п. 127, дополнительно содержащий линкер.
129. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с Sushi доменом 3 SEZ6.
130. SEZ6 модулятор по п. 129, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
131. SEZ6 модулятор по п. 130, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
132. SEZ6 модулятор по п. 131, где указанный SEZ6 модулятор включает ADC.
133. SEZ6 модулятор по п. 132, где указанный ADC содержит пирролобензодиазепин.
134. SEZ6 модулятор по п. 133, дополнительно содержащий линкер.
135. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с Sushi доменом 4 SEZ6.
136. SEZ6 модулятор по п. 135, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
137. SEZ6 модулятор по п. 136, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
138. SEZ6 модулятор по п. 137, где указанный SEZ6 модулятор включает ADC.
139. SEZ6 модулятор по п. 138, где указанный ADC содержит пирролобензодиазепин.
140. SEZ6 модулятор по п. 139, дополнительно содержащий линкер.
141. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с Sushi доменом 5 SEZ6.
142. SEZ6 модулятор по п. 141, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
143. SEZ6 модулятор по п. 142, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
144. SEZ6 модулятор по п. 143, где указанный SEZ6 модулятор включает ADC.
145. SEZ6 модулятор по п. 144, где указанный ADC содержит пирролобензодиазепин.
146. SEZ6 модулятор по п. 145, дополнительно содержащий линкер.
147. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с CUB доменом 1 SEZ6.
148. SEZ6 модулятор по п. 147, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
149. SEZ6 модулятор по п. 148, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
150. SEZ6 модулятор по п. 149, где указанный SEZ6 модулятор включает ADC.
151. SEZ6 модулятор по п. 150, где указанный ADC содержит пирролобензодиазепин.
152. SEZ6 модулятор по п. 151, дополнительно содержащий линкер.
153. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с CUB доменом 2 SEZ6.
154. SEZ6 модулятор по п. 153, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
155. SEZ6 модулятор по п. 154, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
156. SEZ6 модулятор по п. 155, где указанный SEZ6 модулятор включает ADC.
157. SEZ6 модулятор по п. 156, где указанный ADC содержит пирролобензодиазепин.
158. SEZ6 модулятор по п. 157, дополнительно содержащий линкер.
159. Выделенный SEZ6 модулятор, который связывается с эпитопом, ассоциированным с N-концевым доменом SEZ6.
160. SEZ6 модулятор по п. 159, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
161. SEZ6 модулятор по п. 160, где указанное антитело или его иммунореактивный фрагмент включает моноклональное антитело.
162. SEZ6 модулятор по п. 161, где указанный SEZ6 модулятор включает ADC.
163. SEZ6 модулятор по п. 162, где указанный ADC содержит пирролобензодиазепин.
164. SEZ6 модулятор по п.163, дополнительно содержащий линкер.
165. Выделенный SEZ6 модулятор, относящийся к секции, выбранной из группы, состоящей из секции A, секции B, секции C, секции D, секции E, секции F и секции U.
166. Выделенный SEZ6 модулятор, относящийся к секции, определенной с помощью эталонного антитела, выбранного из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200.
167. Конъюгат антитела и лекарственного средства формулы M-[L-D]n или его фармацевтически приемлемая соль, где:
a. M включает SEZ6 модулятор;
b. L включает линкер;
c. D представляет собой антипролиферативное средство; и
d. n составляет целое число от приблизительно 1 до приблизительно 20.
168. Конъюгат антитела и лекарственного средства по п. 167, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
169. Конъюгат антитела и лекарственного средства по п. 168, где указанное антитело включает моноклональное антитело.
170. Конъюгат антитела и лекарственного средства по п. 169, где указанное антитело получено из антитела, выбранного из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200.
171. Конъюгат антитела и лекарственного средства по п. 169, где указанное антитело является гуманизированным.
172. Конъюгат антитела и лекарственного средства по п. 167, где линкер включает расщепляемый линкер.
173. Конъюгат антитела и лекарственного средства по п. 172, где указанный расщепляемый линкер включает пептидильный линкер.
174. Конъюгат антитела и лекарственного средства по п. 167, где указанное антипролиферативное средство включает цитотоксическое средство.
175. Конъюгат антитела и лекарственного средства по п. 174, где указанное цитотоксическое средство включает пирролобензодиазепин.
176. Конъюгат антитела и лекарственного средства по п. 175, где указанный пирролобензодиазепин включает димер пирролобензодиазепина.
177. Выделенный SEZ6 модулятор, относящийся к секции, выбранной из группы, состоящей из секции A, секции B, секции C, секции D, секции E, секции F и секции U.
178. Выделенный SEZ6 модулятор, относящийся к секции, определенной с помощью эталонного антитела, выбранного из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200.
179. Конъюгат антитела и лекарственного средства формулы:
M-[L-D]n
или его фармацевтически приемлемая соль, где
a) M включает SEZ6 модулятор;
b) L включает необязательный линкер;
c) D представляет собой цитотоксическое средство, выбранное из группы, состоящей из ауристатинов, майтансиноидов, аманитинов и димеров пирролобензодиазепина;
d) n составляет целое число от приблизительно 1 до приблизительно 20.
180. Конъюгат антитела и лекарственного средства по п. 179, где указанный SEZ6 модулятор включает антитело или его иммунореактивный фрагмент.
181. Конъюгат антитела и лекарственного средства по п. 180, где указанное антитело включает моноклональное антитело.
182. Конъюгат антитела и лекарственного средства по п. 181, где указанное антитело получено из антитела, выбранного из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200.
183. Конъюгат антитела и лекарственного средства по п. 182, где указанное антитело является гуманизированным.
184. Конъюгат антитела и лекарственного средства по п. 183, где линкер включает расщепляемый линкер.
185. Конъюгат антитела и лекарственного средства по п. 184, где указанный расщепляемый линкер включает пептидильный линкер.
186. Конъюгат антитела и лекарственного средства по п. 185, где указанное антипролиферативное средство включает цитотоксическое средство.
187. Конъюгат антитела и лекарственного средства по п. 186, где указанное цитотоксическое средство включает пирролобензодиазепин.
188. Конъюгат антитела и лекарственного средства по п. 187, где указанный пирролобензодиазепин включает димер пирролобензодиазепина.
189. SEZ6 модулятор, содержащий CDR из любой из SEQ ID NO:20-203.
190. SEZ6 модулятор по п. 189, где указанный модулятор включает несколько CDR из любой из SEQ ID NO:20-203.
191. Модулятор на основе антитела против SEZ6, который конкурирует за связывание с белком SEZ6 с эталонным антителом, выбранным из группы, состоящей из SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200, где связывание модулятора на основе антитела против SEZ6 с белком SEZ6 ингибируется по меньшей мере на 30%.
192. SEZ6 модулятор, который связывается с эпитопом белка SEZ6, содержащим аминокислоты Q12, P14, I16, E17 и E18 (SEQ ID NO:401).
193. SEZ6 модулятор, который связывается с эпитопом белка SEZ6, содержащим аминокислоты L73, P74, F75, Q76, P77, D78 и P79 (SEQ ID NO:402).
194. Способ лечения индивида, страдающего от пролиферативного расстройства, включающий этап введения SEZ6 модулятора, который связывается с эпитопом, содержащемся в домене SEZ6, выбранном из группы, состоящей из N-концевого домена, Sushi домена 1, Cub домена 1, Sushi домена 2, Cub домена 2, Sushi домена 3, Sushi домена 4 и Sushi домена 5.
195. Модулятор на основе гуманизированного антитела против SEZ6, выбранный из группы, состоящей из hSC17.16, hSC17.17, hSC17.24, hSC17.28, SC17.34, hSC17.46, SC17.151, SC17.155, SC17.156, SC17.161 и SC17.200.
Примеры
Настоящее изобретение, описанное, таким образом, в общих чертах выше, будет легче понять благодаря ссылке на следующие примеры, приведенные с целью иллюстрации и не предназначенные для ограничения настоящего изобретения. Примеры не предназначены для представления экспериментов, приведенных ниже, как всех или единственных выполняемых экспериментов. Если не указано иное, части являются весовыми частями, молекулярный вес является средневесовым молекулярным весом, температура измеряется в градусах по Цельсию, а давление является атмосферным или близким к таковому.
Пример 1
Идентификация опухолей, имеющих нейроэндокринные свойства, и анализ экспрессии маркеров при помощи секвенирования всего транскриптома
Нейроэндокринные опухоли (NET), происходящие из диффузной эндокринной системы, являются редкими, с частотой возникновения 2-5 на 100000 человек, но очень быстро растущими. Нейроэндокринные опухоли наблюдаются в надпочечнике, почке, мочеполовом тракте (мочевой пузырь, простата, яичники, шейка матки и эндометрий), поджелудочной железе, желудочно-кишечном тракте (желудок и толстая кишка), щитовидной железе (медуллярный рак щитовидной железы) и легком (мелкоклеточная карцинома легких, крупноклеточная нейроэндокринная карцинома и карциноид). Эти опухоли могут секретировать некоторые гормоны, в том числе серотонин и/или хромогранин A, которые могут вызывать симптомы истощения, известные как карциноидный синдром. На эти опухоли могут указывать положительные иммуногистохимические маркеры, такие как нейрон-специфическая енолаза (NSE, также известная как гамма-енолаза, символ гена = ENO2), CD56/NCAM1 и синаптофизин. Традиционные виды химиотерапии не были успешными при лечении NET, и частым исходом является смертность в связи с распространением метастазов. К сожалению, в большинстве случаев единственным возможным способом радикального лечения является хирургическая операция, при условии, что она имеет место после раннего выявления и до метастазирования опухоли. В связи с этим выполнили работу по идентификации новых терапевтических мишеней, ассоциированных с опухолями, характеризующимися нейроэндокринными свойствами.
Для идентификации и характеристики таких опухолей, поскольку они наблюдаются у пациентов с раком, создали и поддерживали большой банк опухолей из нетрадиционных ксенотрансплантатных моделей (NTX) с использованием методик, принятых в данной области техники. Банк опухолей из NTX, содержащий значительное количество дискретных линий опухолевых клеток, распространяли в мышах с ослабленным иммунитетом посредством многократных перевивок гетерогенных опухолевых клеток, первоначально полученных от многочисленных пациентов с раком, пораженных разнообразными злокачественными новообразованиями в виде солидных опухолей. (Следует обратить внимание на то, что в некоторых примерах и фигурах в данном документе количество перевивок тестируемого образца указано как p0-p#, добавленное к обозначению образца, где p0 указывает на неперевитый образец, полученный непосредственно из опухоли пациента, а p# указывает на то, сколько раз перевивали опухоль на мышах перед тестированием.) Постоянная доступность большого количества дискретных линий опухолевых клеток из NTX ранней перевивки, характеризующихся четко определенными линиями дифференцировки, значительно облегчает идентификацию и характеристику клеток, очищенных из линий клеток. В этой работе применение линий клеток из NTX, подвергнутых минимальному количеству перевивок, упрощает проведение экспериментов in vivo и обеспечивает результаты, которые можно легко проверить. Более того, опухоли из NTX ранней перевивки отвечают на действие терапевтических средств, таких как иринотекан (т.е. Camptosar®) и цисплатин/этопозид в схемах лечения, что обеспечивает клинически значимую информацию, дающую понимание механизмов, лежащих в основе управления ростом опухоли, устойчивости к существующим видам терапии и повторного развития опухоли.
Поскольку линии опухолевых клеток из NTX были устойчивыми, их фенотип характеризовали различными способами для исследования глобальной экспрессии генов. Для определения того, какие линии из NTX в банке могут представлять собой клетки NET, создавали профили экспрессии генов путем секвенирования всего транскриптома и/или анализа с помощью микропанелей. В частности, данные исследовали для идентификации опухолей, в которых наблюдались высокие уровни экспрессии конкретных генов, о которых известно, что их уровень экспрессии повышен в NET, или которые применяются в качестве гистохимических маркеров нейроэндокринной дифференцировки (например, ASCL1, NCAM1, CHGA), а также опухолей с измененной экспрессией генов сигнального пути NOTCH, свидетельствующей о подавлении NOTCH-сигналинга (например, со сниженными уровнями рецепторов NOTCH и измененными уровнями лигандов и эффекторных молекул).
Более конкретно, после получения различных устойчивых линий опухолевых клеток из NTX, как это обычно делают для опухолей человека у нескольких мышей с ослабленным иммунитетом, производили резекцию опухолей после достижения объема 800-2000 мм3, клетки подвергали диссоциации и диспергировали в суспензии с применением методик ферментативного расщепления, принятых в данной области техники (см., например, патент США № 2007/0292414, включенный в настоящий документ). Из диссоциированных клеточных препаратов, полученных из этих линий из NTX, затем элиминировали мышиные клетки и субпопуляции опухолевых клеток человека затем дополнительно выделяли путем сортировки клеток с активированной флуоресценцией и лизировали в лизирующем буфере для выделения РНК RLTplus (Qiagen). Эти лизаты затем хранили при -80°C до применения. После размораживания общую РНК экстрагировали при помощи набора для выделения RNeasy (Qiagen) в соответствии с инструкциями изготовителя и ее количество определяли на спектрофотометре Nanodrop (Thermo Scientific) и Bioanalyzer 2100 (Agilent Technologies), опять-таки используя протоколы производителя и рекомендуемые параметры настройки инструментов. Полученные в результаты препараты общей РНК подходили для генного секвенирования и анализа экспрессии генов.
Секвенирование всего транскриптома при помощи системы секвенирования нового поколения SOLiD (секвенирование путем лигирования/выявления олигонуклеотидов) 4.5 или SOLiD 5500xl (Life Technologies) от Applied Biosystems (ABI) осуществляли на образцах РНК из линий из NTX. кДНК образовывали из образцов общей РНК, используя модифицированный протокол для полного транскриптома (WT) от ABI, разработанный для малого вводимого количества общей РНК, либо систему для секвенирования РНК Ovation V2™ (NuGEN Technologies Inc.). В модифицированном протоколе для малого вводимого количества WT применяется 1,0 нг общей РНК для амплификации 3'-конца мРНК, что приводит к сильному смещению экспрессии картированных генов в сторону 3', тогда как система NuGen позволяет осуществлять более устойчивую амплификацию всего транскрипта и включает амплификацию как мРНК, так и неполиаденилированных кДНК-транскриптов при помощи случайных гексамеров. Библиотеку кДНК разбивали на фрагменты и добавляли адаптеры со штрих-кодами для обеспечения объединения фрагментов библиотек из различных образцов.
Платформы для секвенирования нового поколения SOLiD 4.5 и SOLiD 5500xl от ABI позволяют проводить параллельное секвенирование транскриптомов из нескольких линий из NTX и отсортированных популяций. На основе каждого образца РНК конструируют библиотеку кДНК, которую разбивают на фрагменты и штрих-кодируют. Штрих-коды на каждом фрагменте библиотеки позволяют объединять несколько образцов в равных концентрациях и совместно прогонять их, обеспечивая при этом специфичность образцов. Образцы подвергали эмульсионной ПЦР при помощи роботизированной системы SOLiD™ EZ Bead™ от ABI, обеспечивающей целостность образцов. При секвенировании спаренных концов образуется прочтение в направлении 5'-3' длиной 50 оснований и прочтение в направлении 3'-5' длиной 25 оснований для каждого клонально амплифицированного фрагмента на отдельной грануле, имеющейся в пуле. В случае платформы 5500xl для каждого набора из 8 образцов, объединенных согласно способу, упомянутому выше, гранулы равномерно помещают в 6 отдельных каналов-дорожек на отдельном чипе. В результате этого образуется в среднем более 50 миллионов прочтений длиной 50 оснований и 50 миллионов прочтений длиной 25 оснований для каждого из 8 образцов и составится очень точное представление уровня мРНК-транскриптов в опухолевых клетках. Данные, сгенерированные платформой SOLiD, применяли в картировании 34609 генов, аннотированных в RefSeq версии 47 с использованием версии hg19.2 опубликованного генома человека от NCBI, и они обеспечивали измерения уровней РНК в большинстве образцов, доступные для проверки.
Платформа SOLiD способна собирать данные не только об экспрессии, но также и о SNP, известных и неизвестных событиях альтернативного сплайсинга, малых некодирующих РНК и, возможно, об обнаружении новых экзонов исключительно за счет охвата прочтений (прочтения картированы исключительно для ранее неаннотированных геномных местоположений). Таким образом, применение этой платформы для секвенирования нового поколения, подключенной к проприетарному программному обеспечению для анализа и визуализации данных, позволяет, таким образом, обнаруживать дифференциальную экспрессию транскриптов, а также различия и/или предпочтения для конкретных сплайс-вариантов экспрессируемых мРНК-транскриптов. Данные секвенирования, полученные с помощью платформы SOLiD, представлены номинально в виде значений экспрессии транскриптов с использованием количественных показателей RPM (количество прочтений на миллион) и RPKM (количество прочтений на тысячу пар оснований на миллион), что обеспечивает проведение базового анализа дифференциальной экспрессии в качестве общепринятой практики.
Секвенирование всего транскриптома четырех мелкоклеточных раковых опухолей легкого (SCLC) (LU73, LU64, LU86 и LU95), одной опухоли яичника (OV26) и крупноклеточной нейроэндокринной карциномы (LCNEC; LU37) давало в результате определение паттернов экспрессии генов, обычно обнаруживаемых в NET (фиг. 6A). Более конкретно, эти опухоли характеризовались высоким уровнем экспрессии нескольких маркеров NET (ASCL1, NCAM1, CHGA), а также сниженными уровнями рецепторов и эффекторных молекул Notch (например, HES1, HEY1) и повышенными уровнями маркеров подавления Notch (например, DLL3 и HES6). В отличие от этого, все из 4 образцов нормальных легких, 3 опухолей, представляющих собой аденокарциному легкого (LU137, LU146 и LU153), и 3 форм плоскоклеточной карциномы легкого (LU49, LU70 и LU76) характеризовались экспрессией различных рецепторов и эффекторных молекул Notch и не демонстрировали повышенную экспрессию супрессоров Notch, таких как HES6 и DLL3.
Более того, как видно из фиг. 6B, анализ данных по всему транскриптому, сравнивающий образцы нормальной ткани с различными популяциями легочных NTX, имеющих нейроэндокринные свойства, показал, что SEZ6 был активирован на уровне мРНК-транскриптов у четырех популяций рака легкого, имеющих нейроэндокринные свойства (LU73, LU64, LU86 и LU95), в сравнении с крайне низкой или отсутствующей экспрессией транскриптов в тестируемых нормальных тканях. Эти результаты позволяют предположить, что SEZ6 может играть важную роль в онкогенезе и поддержании определенных видов рака (в том числе видов рака легкого с нейроэндокринными свойствами). На этом основании, SEZ6 выбрали для дополнительного анализа в качестве потенциальной иммунотерапевтической мишени.
Пример 2
Анализ экспрессии генов с помощью микропанелей и RT-PCR в выбранных опухолях из NTX с нейроэндокринными свойствами
С целью идентификации дополнительных NET в вышеупомянутом банке опухолей из NTX помимо тех, для которых имеются данные по SOLiD всего транскриптома, исследовали больший набор линий из NTX с применением анализа с помощью микропанелей. В частности, 2-6 мкг образцов общей РНК, полученных из целых опухолей 46 линий из NTX или из 2 нормальных тканей, анализировали с использованием платформы для анализа с помощью микропанелей OneArray® (Phalanx Biotech Group), которая содержит 29187 зондов, предназначенных для нацеливания на 19380 генов в геноме человека. Более конкретно, образцы РНК получали (как описано в примере 1) из сорока шести целых опухолей из NTX, полученных от пациентов, включающих следующие формы рака: рак ободочной и прямой кишки (CR), меланому (SK), рак почки (KD), рак легкого (LU), рак яичника (OV), рак эндометрия (EM), рак молочной железы (BR), рак печени (LIV) или рак поджелудочной железы (PA). Нормальную ткань ободочной или прямой кишки (NormCR) и нормальную ткань поджелудочной железы (NormPA) ткани применяли в качестве контрольных образцов. Еще более конкретно, опухоли легкого дополнительно классифицировали с разбиением на следующие подклассы: формы мелкоклеточного рака легкого (SCLC), формы плоскоклеточного рака (SCC) или крупноклеточная нейроэндокринная карцинома (LCNEC). Образцы РНК прогоняли в трех повторностях, используя протоколы производителя, и полученные данные анализировали при помощи стандартных промышленных практик для нормализации и преобразования измеренных значений интенсивности, полученных для рассматриваемого гена в каждом образце. Для создания стандартной дендрограммы по данным анализа с помощью микропанелей для этих 48 образцов применяли алгоритм несмещенной иерархической кластеризации Пирсона-Спирмена, называемый hclust.2, в пакете программ R/BioConductor. Как известно в данной области техники, R/BioConductor является открытым языком статистического программирования, широко применяемым в научном сообществе, финансовом секторе и фармацевтической промышленности для анализа данных. Как правило, опухоли размещают и объединяют в кластеры, исходя из паттернов экспрессии генов, интенсивности экспрессии и т.д.
Как показано на фиг. 7A, на дендрограмме, полученной на основании данных 48 образцов и по всем 19380 генам, линии из NTX объединены друг с другом в кластеры на основе их типа опухоли или ткани, из которой они происходят. Некоторые опухоли, с которыми обычно ассоциированы нейроэндокринные фенотипы, объединены друг с другом в кластеры на ветви, обозначенной (1); они включают формы рака кожи, многочисленные формы рака легкого и другие NET. Интересно, что на подветви, обозначенной (2), показано, что две крупноклеточные раковые опухоли легкого с нейроэндокринными свойствами (LU50.LCNEC и LU37.LCNEC) и мелкоклеточная раковая опухоль легкого (LU102.SCLC) объединены в кластер с опухолями яичника (OV26) и почки (KD66) (кластер C), что позволяет предположить, что эти последние опухоли также имеют нейроэндокринные фенотипы. Более того, на фиг. 7A показан кластер D, состоящий из 3 дополнительных опухолей SCLC, и справа от него находится небольшой кластер (кластер E), содержащий дополнительную опухоль SCLC (LU100) и нейроэндокринную опухоль эндометрия (EM6). Все из опухолей в кластерах D и E, как обычно понимается, имеют некоторые нейроэндокринные свойства, исходя из академической литературы и опытов по изучению патологических процессов в клинических условиях. Тот факт, что кластер G, состоящий из SCC, можно обнаружить на совершенно другой ветви дендрограммы на фиг. 7A, указывает на то, что объединение в кластеры обусловлено не исключительно органом происхождения опухоли.
Более близкое изучение группы генных маркеров, ассоциированных с NET (фиг. 7B) показывает, что для них характерна сильная экспрессия в опухолях, содержащихся в кластерах C и D, тогда как в опухолях из кластера G (плоскоклеточная карцинома легкого) они экспрессируются на минимальном уровне, что позволяет предположить, что кластеры C и D представляют NET или опухоли с нейроэндокринным фенотипом. Более конкретно, NET из кластера C характеризуются высоким уровнем экспрессии ASCL1, CALCA, CHGA, SST и NKX2-1, тогда как NET из кластера D характеризуются высоким уровнем экспрессии CHGA, ENO2 и NCAM1, и экспрессия именно этих генов, обуславливающих нейроэндокринный фенотип, частично отвечает за объединение этих опухолей в кластеры. Интересным свойством является сильная экспрессия в кластере D KIT, гена, о котором изредка сообщали, что он ассоциирован с нейроэндокринными опухолями, но который в других случаях, очевидно, связан с онкогенезом. Это происходит в отличие от наблюдаемого для опухолей SCC в кластере G, у которых отсутствует сильная экспрессия любых из этих генов (фиг. 7B).
Опухоли в кластере C демонстрируют фенотип, согласующийся с ослаблением передачи сигналов с помощью Notch: отсутствие экспрессии любого из рецепторов Notch, относительно низкий уровень экспрессии JAG1 и HES1 и высокие уровни экспрессии ASCL1 (фиг. 7C). Интересно, что в кластере D демонстрируется высокий уровень экспрессии HES6, транскрипционного фактора, который может содействовать активности ASCL1 путем антагонистического действия на активность HES1 посредством образования гетеродимеров.
С учетом вышеупомянутых результатов в различных линиях из NTX и нормальных тканях исследовали экспрессию мРНК, кодирующей HES6, с помощью аппарата Applied Biosystems 7900HT (Life Technologies) с выполнением количественной RT-PCR в формате Taqman (qRT-PCR) в соответствии с протоколами производителя. РНК выделяли, как описано выше, и проверяли для гарантирования качества, приемлемого для анализа экспрессии генов. РНК из нормальных тканей была закуплена (Agilent Technologies и Life Technologies). Для синтеза кДНК при помощи набора архивов кДНК (Life Technologies) применяли 200 нг РНК. кДНК применяли для анализа по методу qRT-PCR на микропанелях низкой плотности Taqman (TLDA; Life Technologies), который заключался в анализе HES6 в формате Taqman для измерения уровней мРНК, кодирующей HES6.
Уровни мРНК, кодирующей HES6, показаны для каждой линии из NTX или образца нормальной ткани (отдельная точка на графике) после нормализации к эндогенным контрольным образцам. Нормализованные значения откладывали на графике относительно средней экспрессии в нормальных тканях, представляющих интерес с точки зрения токсичности (NormTox). Данная методика позволяла проводить быструю идентификацию и характеристику разнообразных опухолей, обладающих нейроэндокринными свойствами, из банка опухолей из NTX посредством измерения уровней HES6 и других релевантных маркеров. На фиг. 7D проиллюстрирована общая сверхэкспрессия HES6 в отобранных опухолях с нейроэндокринными свойствами (например, LU-SCLC, LU-LCNEC) по сравнению с нормальными тканями, опухолями молочной железы, толстой кишки, печени и другими выбранными опухолями. Особенно важно, что эти данные анализа с помощью микропанелей и qPCR показывают, что по меньшей мере некоторые опухоли эндометрия, почки и яичника могут проявлять нейроэндокринные свойства опухолей (фиг. 7A и 7D).
Данные анализа с помощью микропанелей, полученные как описано выше, не только показывали, что опухоли в кластерах C, D и E характеризовались различными нейроэндокринными маркерами, но также показывали, что опухоли в этих кластерах экспрессировали маркеры, указывающие на нейрогенез, нейрональное коммитирование или дифференцировку в направлении нейрональной судьбы (фиг. 7E). Что особенно интересно, опухоли в кластере D зачастую показывают более сильную и более устойчивую повышенную экспрессию многих из этих маркеров (например, рецепторы BEX1 и BEX4, CD56, NRCAM, SEMA, факторы SOX и ZIC) и зачастую сниженную повышенную экспрессию гормонов в сравнении с другими кластерами, что позволяет предположить в большей мере фенотип нейронов.
Пример 3
Экспрессия мРНК SEZ6 в опухолях, имеющих нейроэндокринные свойства и свойства нейронов
Для идентификации опухолей, характеризующихся нейроэндокринными свойствами, применяли различные методики, в том числе секвенирование всего транскриптома (пример 1) и анализ с помощью микропанелей и qRT-PCR (пример 2). Полученные таким образом данные дополнительно анализировали для обнаружения потенциальных терапевтических мишеней, которые экспрессируются на высоком уровне в нейроэндокринных опухолях при сравнении с опухолями, не относящимися к нейроэндокринными, и нормальными тканями. Как обсуждалось в примере 1, было обнаружено, что SEZ6, трансмембранный белок, пересекающий мембрану однократно, который, в основном, экспрессируется в нормальном головном мозге, характеризуется высоким уровнем экспрессии во многих нейроэндокринных опухолях (фиг. 6B).
Данные анализа с помощью микропанелей, полученные в примере 2, показали, что опухоли, расположенные в кластерах C, D и E, экспрессировали нейроэндокринные маркеры (фиг. 7B) и маркеры нейронов (фиг. 7E). Примечательно, что опухоли в тех же самых кластерах также показывали высокие уровни SEZ6-транскриптов, что позволяет предположить, что SEZ6 ассоциирован с опухолями, характеризующимися нейроэндокринными свойствами и свойствами нейронов (фиг. 7F). Это полностью соответствует известной роли SEZ6 в постнатальном развитии переднего мозга и продолжающейся экспрессии в специфических областях гиппокампа у взрослого организма. Полагают, что SEZ6 играет важные роли в распознавании клетки клеткой и передаче сигнала. Зачастую пути, связанные с развитием, экпрессируются в опухолях ненадлежащим образом.
Чтобы определить уровни экспрессии мРНК SEZ6 в различных образцах опухолевых линий из NTX проводили qRT-PCR с применением анализа SEZ6 в формате Taqman, по сути, как описано в примере 2 выше. На фиг. 8A показана экспрессия SEZ6 относительно средней экспрессии в нормальных тканях и нормализована к экспрессии эндогенного контрольного гена ALAS1. Экспрессия гена SEZ6 повышается более чем в 10000000 раз в популяции из нейроэндокринных NTX в сравнении с нормальными тканями. Пять из линий SCLC из NTX, показанных на фиг. 8A, представляют собой образцы мРНК, экстрагированные непосредственно из материалов первичной биопсии (p0). Экспрессия SEZ6 в этих неперевитых опухолях демонстрирует, что экспрессия SEZ6 не является артефактом, который происходит в результате растущих опухолей человека у мышей. Три подтипа NSCLC также представлены на фиг. 8A: LU25 представляет собой веретеноклеточную карциному, LU50 представляет собой крупноклеточную нейроэндокринную карциному (LCNEC), а LU85 представляет собой плоскоклеточную карциному (SCC). KDY66 и OV26, опухоли почки и яичника, соответственно, объединялись в кластер на микропанели с опухолями SCLC и LCNEC (фиг. 7A), что позволяет предположить, что они также характеризуются нейроэндокринными свойствами.
Для расширения экспрессии SEZ6 на более широкий спектр образцов опухолей проводили qRT-PCR при помощи системы Fluidigm BioMark™ HD. Вкратце, 1 нг РНК, полученной как описано в примере 1, превращали в кДНК при помощи набора архивов кДНК (Life Technologies). кДНК предварительно амплифицировали при помощи анализа в формате Taqman, специфичного для SEZ6, и затем использовали для проведения qRT-PCR. Экспрессию в нормальных тканях (NormTox или Norm) сравнивали с экспрессией в следующих линиях из NTX, где число в скобках указывает на число протестированных уникальных линий из NTX: BR (5), CR (6), KDY (9), OV (16), PA (9), аденокарцинома легкого (LU-Adeno) (7), LCNEC (2), SCC (11) и SCLC (15) (фиг. 8B). SCLC и LCNEC из NTX показывают самую высокую экспрессию SEZ6, хотя некоторая экспрессия SEZ6 также наблюдалась у линий OV, PA, CR и LU-Adeno из NTX относительно образцов нормальной ткани.
“NormTox” представлены следующими образцами нормальной ткани: два образца из толстой кишки, два образца из почки, два образца из печени, два образца из легкого, два образца из поджелудочной железы, два образца из сердца, один образец из пищевода, один образец из скелетных мышц, один образец из кожи, один образец из тонкого кишечника, один образец из селезенки, один образец из желудка и один образец из трахеи. Другой комплект нормальных тканей, обозначенный “Norm”, представлен следующими образцами нормальной ткани: головной мозг, молочная железа, шейка матки, яичник, мононуклеарные клетки периферической крови, плацента, предстательная железа, семенники, вилочковая железа и щитовидная железа. Большинство нормальных тканей не имели экспрессии SEZ6, хотя низкая экспрессия наблюдалась в поджелудочной железе, толстой кишке, печени и легких, и высокая экспрессия в головном мозге. Различные анализы в формате Taqman, специфичные для SEZ6, с применением по сути такого же способа как выше осуществляли на различных опухолевых линиях из NTX. Число опухолевых линий, которые тестировали на каждый тип опухоли, обозначено в знаменателе, тогда как число опухолей, которые экспрессировали SEZ6, обозначено в числителе: 1/5 CR, 2/2 GA, 1/1 GB (глиобластома), 1/1 KDY, 2/6 SK, 2/4 LU-Adeno, 2/2 LCNEC, 3/10 LU-SCC, 10/10 SCLC и 1/2 OV (данные не показаны).
Совместно эти данные позволяют предположить, что экспрессия SEZ6 повышена в опухолях, характеризующихся нейроэндокринными свойствами и свойствами нейронов, что позволяет предположить, что он может служить в качестве терапевтической мишени для лечения этих типов опухолей.
Пример 4
Экспрессия мРНК SEZ6 в образцах различных опухолей и нормальной ткани с применением qRT-PCR
Для расширения анализа экспрессии SEZ6 на более широкий спектр образцов опухолей проводили qRT-PCR в формате Taqman фактически согласно описанному в предыдущих примерах на 384-луночной панели для qPCR TissueScan™ (Origene Technologies). Эта панель позволяет проводить сравнение экспрессии генов по 18 различным типам солидных опухолей, при том, что от пациентов получены несколько образцов каждого типа опухоли, и в нормальной прилегающей ткани.
В связи с этим на фиг. 9A и 9B показаны абсолютный и относительный уровни экспрессии гена SEZ6, соответственно, в образцах целых опухолей (серые точки) или нормальной прилегающей ткани (NAT; белые точки) от пациентов с одним из восемнадцати различных типов солидных опухолей. Более конкретно, на фиг. 9A показан абсолютный уровень экспрессии мРНК SEZ6 в различных образцах целой опухоли или соответственной нормальной прилегающей ткани. На фиг. 9B показан уровень экспрессии SEZ6, нормализованный по β-актину, и отложенный на графике относительно экспрессии в нормальной прилегающей ткани для каждого проанализированного типа опухоли. Образцам, в которых не был выявлен SEZ6, присваивали значение Ct, равное 50, представляющее последний цикл амплификации в протоколе эксперимента. Каждая точка представляет отдельный образец ткани, при этом среднее геометрическое значение представлено в виде черной линии.
При использовании этой панели Origene, сверхэкспрессию SEZ6 наблюдали в подмножестве раковых опухолей надпочечника, печени, легкого, яичника и поджелудочной железы, многие из которых могут представлять нейроэндокринные опухоли или опухоли с недостаточно зрелыми нейроэндокринными фенотипами. Как показывает абсолютная экспрессия гена на фиг. 9A, нормальный семенник и поджелудочная железа представляют собой единственные нормальные ткани с высоким уровнем экспрессии SEZ6. Это позволяет предполагать, что SEZ6 может играть роль в онкогенезе и/или прогрессировании опухоли в широком спектре опухолей, в том числе без ограничений в опухолях с нейроэндокринными свойствами и свойствами нейронов.
Пример 5
Клонирование и экспрессия рекомбинантных белков SEZ6
SEZ6 человека
Чтобы получить и разработать все молекулярные и клеточные материалы, требуемые в настоящем изобретении, принадлежащие SEZ6 человека, кДНК (фиг. 3A; SEQ ID NO:5), кодирующий окончательно зрелый белок SEZ6 человека (фиг. 3B, SEQ ID NO:6) получали следующим образом. Коммерческую кДНК SEZ6 человека закупили у Open Biosystems, причем эта последовательность кДНК соответствовала номеру доступа в NCBI BC146292. Выравнивание последовательностей показало, что белок, кодируемый BC146292, отличался на несколько остатков от такового из RefSeq NP_849191 (см. остатки 414, 415 и 417, фиг. 3C), кодирующего эндогенный белок SEZ6 человека. Для амплификации двух отдельных фрагментов кДНК из клона BC146292 использовали ПЦР, в которой используемые праймеры вводили требуемые изменения в кДНК в остатки 414-417 во время процесса ПЦР с перекрывающимися праймерами для получения кДНК, кодирующей зрелый белок SEZ6 с последовательность, идентичной последовательности, кодируемой NM_178860, последовательности мРНК, кодирующей белок SEZ6 человека. Исправленный клон кДНК, названный hSCRx17 (фиг. 3A), использовали для всего последующего конструирования конструкций, экспрессирующих зрелый белок SEZ6 человека или его фрагменты.
Чтобы получить иммунореактивные или иммуноспецифичные модуляторы для молекулы SEZ6 получали химерный слитый ген, в котором часть ECD белка SEZ6 человека сливали с Fc-доменом человеческого IgG2 (фиг. 4A, SEQ ID NO:8). Это делали следующим образом: кДНК, кодирующую ECD SEZ6 амплифицировали при помощи PCR из клона кДНК hSCRx17 (фиг. 3A) и этот продукт PCR впоследствии субклонировали в вектор экспрессии под управлением CMV в рамку считывания и ниже последовательности сигнального пептида IgK и выше кДНК Fc человеческого IgG2, при помощи стандартных молекулярных методик. Последовательность кДНК, кодирующая слитый белок hSEZ6-Fc, называемая hSCRx17-Fc ORF, показана на фиг. 4A; соответствующая белковая последовательность, кодируемая hSCRx17-Fc ORF, показан на фиг. 4B (SEQ ID NO:9). Подчеркнутые области последовательностей соответствуют Fc человеческого IgG2. Выделенные жирным, подчеркнутые последовательности соответствуют сигнальному пептиду IgK, а последовательности с жирным шрифтом соответствуют участкам слитого белка, кодируемым сайтами рестрикции для клонирования, фланкирующими ECD SEZ6.
Для получения рекомбинантного белка ECD hSEZ6 использовали сходную стратегию на основе ПЦР. Фрагмент кДНК, кодирующий ECD SEZ6, амплифицировали из клона кДНК hSCRx17 и субклонировали в вектор экспрессии под управлением CMV в рамку считывания и ниже последовательности сигнального пептида IgK, и в рамку считывания выше последовательности, кодирующей 9-гистидиновую эпитопную метку (SEQ ID NO:400).
Вектор экспрессии под управлением CMV обеспечивает высокий уровень временной экспрессии в клетках HEK-293T и/или CHO-S. Суспензионные или прикрепленные культуры клеток HEK-293T или суспензионные клетки CHO-S трансфицировали конструкциями экспрессии, кодирующими один из белков hSEZ6 ECD-Fc или hSEZ6-ECD-His, с применением полиэтилениминового полимера в качестве реагента для трансфицирования. Через три-пять дней после трансфекции, белки hSEZ6 ECD-Fc или hSEZ6-ECD-His очищали от осветленных клеточных супернатантов при помощи AKTA explorer и либо колонки MabSelect SuRe™ Protein A (GE Healthcare Life Sciences), либо колонки Nickel-EDTA (Qiagen), соответственно.
Стабильную клеточную линию, сверхэкспрессирующую рекомбинантный SEZ6 человека, конструировали с использованием лентивирусных векторов для трансдукции клеток HEK-293T следующим образом: PCR-амплификацию проводили с использованием клона hSCRx17 в качестве шаблона для получения фрагмента кДНК, кодирующего зрелый белок SEZ6 человека. Фрагмент, который был получен, субклонировали в рамку считывания ниже последовательности, кодирующей сигнальный пептид IgK и эпитопную метку DDK, ранее встроенные выше сайта множественного клонирования pCDH-EF1-MCS-T2A-GFP (System Biosciences), при помощи стандартных методик молекулярного клонирования. Полученный бицистронный лентивирусный вектор использовали для конструирования клеточных линий, сверхэкспрессирующих полипептид человеческий SEZ6-T2A пептид-GFP. Последовательность T2A активирует пропуск рибосомой образования пептидной связи, что приводит в результате к двум независимым белкам, в этом случае SEZ6 и GFP.
SEZ6 мыши
Стабильную клеточную линию, сверхэкспрессирующую рекомбинантный SEZ6 мыши, конструировали по сути, как описано выше для рекомбинантного SEZ6 человека. Клетки HEK-293T подвергали трансдукции с помощью лентивирусного вектора, экспрессирующего SEZ6 мыши. Вектор конструировали по сути следующим образом. Фрагмент кДНК (фиг. 5A; SEQ ID NO:10), кодирующий зрелый белок SEZ6 мыши, приведенный как RefSeq NM_021286 в базе данных NCBI (фиг. 5B; SEQ ID NO:11) получали путем ПЦР-амплификации из коммерческой кДНК SEZ6 мыши (Origene; #MC203634) и субклонировали ниже последовательности сигнального пептида IgK и последовательности эпитопной метки DDK, предварительно встроенных выше сайта множественного клонирования pCDH-EF1-MCS-IRES-RFP (System Biosciences), при помощи стандартных методик молекулярного клонирования. Этот полученный бицистронный лентивирусный вектор использовали для получения клеточной линии HEK-293T, сверхэкспрессирующей SEZ6 мыши и RFP.
SEZ6 крысы
Для получения и разработки всех молекулярных и клеточных материалов, требуемых в настоящем изобретении, принадлежащие белкам SEZ6 крысы, кДНК (фиг. 5C, SEQ ID NO:12), кодирующую окончательно зрелый белок SEZ6 крысы (фиг. 5D, SEQ ID NO:13) получали следующим образом. кДНК, кодирующую зрелый белок крысы полной длины (т.е. белок полной длины за вычетом сигнального пептида дикого типа), амплифицировали из кДНК marathon-ready из головного мозга крысы (Clontech #639412). Выравнивания последовательности показали, что ECD кодируемого белка является гомологичной эндогенному белку SEZ6 крысы, приведенному как RefSeq NP_001099224 в базе данных NCBI. Этот клон кДНК, названный rSCRx17 (фиг. 5D), использовали для последующего конструирования конструкций, экспрессирующих фрагменты зрелого белка SEZ6 крысы.
SEZ6 яванского макака
Для получения и разработки всех молекулярных и клеточных материалов, требуемых в настоящем изобретении, принадлежащие белкам SEZ6 яванского макака, кДНК (фиг. 5E, SEQ ID NO:14) кодирующий белок SEZ6 яванского макака (фиг. 5F, SEQ ID NO:15), получали следующим образом. Прогнозируемую последовательность ORF SEZ6 яванского макака собирали при помощи биоинформатического анализа следующим способом: ORF гена SEZ6 человека получили из номера доступа NCBI NM_178860 и сравнили, при помощи алгоритма BLAST с контигами, полученными в ходе секвенирования всего генома по методу дробовика, в базе данных NCBI. Затем результаты BLAST использовали для сборки прогнозируемой ORF SEZ6 яванского макака. Последовательность, кодирующую прогнозируемый сигнальный пептид дикого типа SEZ6 яванского макака, удаляли из этой последовательности, полученной с помощью BLAST, и замещали последовательностью, кодирующей последовательность сигнального пептида IgK. После оптимизации кодонов для продукции в клетках млекопитающих, эту полную гибридную последовательность ORF предлагали как синтетический ген (GeneWiz). Этот оптимизированный клон кДНК, названный cSCRx17 (фиг. 3E), использовали для последующего конструирования конструкций, экспрессирующих фрагменты белка SEZ6 яванского макака.
SEZ6L и SEZ6L2 человека
В геноме человека существует два гена, близкородственных с SEZ6, подобный связанному с припадком гомологу 6 (SEZ6L) и подобный связанному с припадком гомологу 6-2 (SEZ6L2). Хотя общая процентная идентичность между этими тремя белками относительно низкая (~42%), существуют более мелкие отрезки совершенной идентичности между парами или всеми тремя белками. Чтобы исследовать любую возможную перекрестную реактивность модуляторов на основе антитела против SEZ6 с человеческими белками SEZ6L и SEZ6L2, были подвергнуты оптимизации кодонов и синтезированы (GeneWiz) открытые рамки считывания, кодирующие ECD человеческого белка SEZ6L (NP_0066938) и человеческого белка SEZ6L2 (NP_001230261). Эти оптимизированные последовательности кДНК, кодирующие ECD человеческих белков SEZ6L или SEZ6L2, показаны на фиг. 5G и 5I.
Материал для исследования перекрестной реактивности
Материал получали, чтобы исследовать, перекрестно реагируют модуляторы SEZ6 по настоящему изобретению с гомологами SEZ6 крысы и/или гомологами SEZ6 яванского макака, или с близкородственными белками SEZ6L и SEZ6L2 человека. Разрабатывали химерные слитые гены, в которых участок ECD либо белка SEZ6 крысы, либо белка SEZ6 яванского макака (подчеркнут на фиг. 5D и 5F, соответственно) сливали с 9-гистидиновой эпитопной меткой (SEQ ID NO:400). При помощи PCR, фрагмент кДНК, кодирующий ECD или SEZ6 крысы, или SEZ6 яванского макака амплифицировали либо из rSCRx17, либо из cSCRx17, соответственно, и субклонировали в вектор экспрессии под управлением CMV в рамку считывания и ниже последовательности сигнального пептида IgK, и в рамку считывания и выше последовательности, кодирующей 9-гистидиновую эпитопную метку (SEQ ID NO:400). Подобным образом, разрабатывали химерные слитые гены, в которых открытую рамку считывания, кодирующую участок ECD белков SEZ6L или SEZ6L2 человека, субклонировали в вектор экспрессии под управлением CMV в рамку считывания и ниже последовательности сигнального пептида IgK, и в рамку считывания и выше последовательности, кодирующей 9-гистидиновую эпитопную метку (SEQ ID NO:400). Полученные последовательности кодируемого белка для этих слитых белков показаны на фиг. 5H и 5J, соответственно, с подчеркнутой последовательностью, представляющую ECD конкретного рассматриваемого белка.
Векторы с ECD SEZ6 крысы или яванского макака и His, полученные выше, использовали для получения и очистки рекомбинантного белка rSEZ6-ECD-His и белка cSEZ6-ECD-His, соответственно, следующим образом: с применением методик, принятых в данной области техники, суспензионные или прикрепленные культуры клеток HEK-293T или суспензионные клетки CHO-S трансфицировали векторами экспрессии, кодирующими белок rSEZ6-ECD-His или cSEZ6-ECD-His. Полиэтилениминовый полимер использовали в качестве реагента для трансфицирования. Через три-пять дней после трансфекции белок rSEZ6-ECD-His или cSEZ6-ECD-His очищали из просветленных клеточных супернатантов при помощи AKTA explorer и колонок Nickel-EDTA (Qiagen). Подобным образом, векторов ECD SEZ6L и SEZ6L2 человека-His использовали для получения и очистки рекомбинантных белков ECD SEZ6L и SEZ6L2 человека и His, как описано для гомологов крысы и гомологов яванского макака.
Пример 6
Получение модуляторов на основе мышиных антител против SEZ6
SEZ6 модуляторы в форме мышиных антител получали в соответствии с изложенным в настоящем документе посредством инокуляции человеческим SEZ6-Fc. В связи с этим, три линии мышей использовали для получения модуляторов на основании мышиных моноклональных антител с высокой аффинностью, которые можно использовать для ассоциирования с SEZ6 и/или ингибирования его действия для профилактики и/или лечения различных пролиферативных расстройств. Конкретно, линии мышей Balb/c, CD-1 и FVB иммунизировали человеческим рекомбинантным SEZ6-Fc и использовали для получения гибридом.
Антиген SEZ6-Fc очищали от супернатата от клеток CHO-S, сверхэкспрессирующих конструкцию SEZ6-Fc, изложенную в примере 5 (фиг. 4A и 4B). 10 мкг иммуногена SEZ6-Fc использовали для первой иммунизации, за чем следовали 5 мкг и 2,5 мкг иммуногена SEZ6-Fc для последующих трех иммунизаций и пяти иммунизаций, соответственно. Все иммунизации проводили с помощью иммуногена, эмульгированного с равным объемом адъюванта TITERMAX® Gold (CytRx Corporation) или квасцов. Мышиные антитела получали путем иммунизации шести самок мышей (по две из каждой из: Balb/c, CD-1, FVB) в подушечку стопы для всех инъекций.
Анализы по методу твердофазного ELISA применяли для скрининга образцов сыворотки мышей в отношении IgG-антител мышей, специфичных для SEZ6 человека. Положительный сигнал, превышающий фон, свидетельствовал о наличии антител, специфичных для SEZ6. Вкратце, 96-луночные планшеты (VWR International, № в каталоге 610744) покрывали рекомбинантным SEZ6-His при 0,5 мкг/мл в покрывающем буфере для ELISA в течение ночи. После промывания в PBS, содержащем 0,02% (об./об.) Tween 20, лунки блокировали с помощью 3% (вес./об.) BSA в PBS при 200 мкл/лунка в течение 1 часа при комнатной температуре (RT). Мышиную сыворотку титровали (1:100, 1:200, 1:400 и 1:800), и добавляли в планшеты, покрытые SEZ6, при 50 мкл/лунка, и инкубировали при RT в течение 1 часа. Планшеты промывали и затем инкубировали с 50 мкл/лунка HRP-меченного антитела козы к IgG мыши в разведении 1:10000 в 3% BSA-PBS или 2% FCS в PBS в течение 1 часа при RT. Планшеты вновь промывали, и добавляли 40 мкл/лунка субстратного раствора TMB (Thermo Scientific 34028) на 15 минут при RT. После проявления добавляли равный объем 2 н. H2SO4 для прекращения обусловленного субстратом проявления, и планшеты анализировали на спектрофотометре при OD 450.
Иммунизированных мышей с положительной реакцией сыворотки умерщвляли, и дренирующие лимфатические узлы (подколенные и паховые, а также медиальные подвздошные, если они были увеличены) иссекали и применяли в качестве источника антителообразующих клеток. Суспензию отдельных клеток, состоящую из B-клеток (228,9×106 клеток), сливали с клетками несекретирующей миеломы P3x63Ag8.653 (№ CRL-1580 в ATCC) в соотношении 1:1 путем электрослияния. Электрослияние выполняли при помощи системы BTX Hybrimmune™ (BTX Harvard Apparatus) согласно указаниям производителя. По окончании процедуры слияния клетки ресуспендировали в среде для селекции гибридом, дополненной азасерином (Sigma, № A9666), среде DMEM с высоким содержанием глюкозы с пируватом натрия (Cellgro, № в каталоге 15-017-CM), содержащей 15% сыворотки Fetal Clone I (Hyclone), 10% BM Condimed (Roche Applied Sciences), 4 мМ L-глутамина, 100 МЕ пенициллина-стрептомицина и 50 мкМ 2-меркаптоэтанола, и затем высевали в три колбы T225 по 90 мл селективной среды на колбу. Колбы затем помещали в увлажненный инкубатор, содержащий 5% CO2 и 95% воздуха, при 37°C на 6-7 дней.
Через шесть-семь дней роста библиотеку, состоящую из клеток, растущих массой в T225, высевали по 1 клетке на лунку в 96-луночные планшеты Falcon с U-образным дном при помощи сортировщика клеток Aria I. Выбранные гибридомы затем выращивали в 200 мкл культуральной среды, содержащей 15% сыворотку Fetal Clone I (Hyclone), 10% BM-Condimed (Roche Applied Sciences), 1 мМ пирувата натрия, 4 мМ L-глутамина, 100 МЕ пенициллина-стрептомицина, 50 мкМ 2-меркаптоэтанола и 100 мкМ гипоксантина. Любые остающиеся неиспользованные гибридомные клетки из библиотеки замораживали для будущего тестирования библиотеки. Через десять-одиннадцать дней роста супернатанты из каждой лунки с высеянными клетками анализировали в отношении антител, реагирующих с SEZ6, с помощью анализов по методам ELISA и FACS.
Для скрининга путем ELISA 96-луночные планшеты покрывали SEZ6-Fc из расчета 0,3 мкг/мл в PBS в течение ночи при 4°C. Планшеты промывали и блокировали с помощью 3% BSA в PBS/Tween в течение часа при 37°C и применяли незамедлительно или выдерживали при 4°C. Неразведенные супернатанты гибридомы инкубировали на планшетах в течение часа при RT. Планшеты промывали и зондировали HRP-меченным антителом козы к IgG мыши в разведении 1:10000 в 3% BSA-PBS в течение одного часа при RT. Планшеты затем инкубировали с субстратным раствором согласно описанному выше и прочитывали при OD 450. Клетки из лунок, содержащие иммуноглобулин, предпочтительно, связывающийся с SEZ6 человека, что определяют по сигналу, превышающему фон, переносили и размножали.
Выбранные лунки с жизнеспособными гибридомами, секретирующими мышиный иммуноглобулин, также подвергали скринингу в отношении специфичности к SEZ6 человека и яванского макака, перекрестной реактивности SEZ6 крысы и мыши с помощью анализа на основе проточной цитометрии с клетками 293, сконструированными для сверхэкспрессии выбранного антигена или конструкций, полученных в предыдущем примере.
Для анализов по методу проточной цитометрии 50×104 клеток h293, подвергнутых трансдукции с помощью, соответственно, SEZ6 человека, яванского макака, крысы или мыши, инкубировали в течение 30 минут с 25-100 мкл надосадочной жидкости гибридомы. Клетки промывали в PBS, 2% FCS, дважды и затем инкубировали с 50 мкл вторичного антитела козы к IgG мыши, специфичного для Fc-фрагмента, конъюгированного с DyLight 649, в разведении 1:200 в PBS/2%FCS. Через 15 минут инкубирования клетки дважды промывали в PBS, 2% FCS, и ресуспендировали в таком же буфере с DAPI и анализировали путем проточной цитометрии с применением FACSCanto II согласно инструкциям производителя. Клетки из лунок, содержащие иммуноглобулин, который, предпочтительно, связывался с клетками SEZ6+ GFP+, переносили и размножали. Полученные в результате специфические клональные гибридомы hSEZ6 подвергали криоконсервированию в замораживающей среде CS-10 (Biolife Solutions) и хранили в жидком азоте. Антитела, связывающиеся с клетками с SEZ6 человека, яванского макака, крысы или мыши, отмечали как перекрестно-реагирующие (см. фиг. 11A).
Анализы по методам ELISA и проточной цитометрии подтвердили, что очищенные антитела из большинства или всех этих гибридом связываются с SEZ6 в зависимости от концентрации. Клетки из лунок, содержащие иммуноглобулин, который связывался с клетками с SEZ6 GFP, переносили и размножали. Полученные в результате клональные гибридомы подвергали криоконсервированию в замораживающей среде CS-10 (Biolife Solutions) и хранили в жидком азоте.
Проводили одно слияние и высеивали в 48 планшетов (4608 лунок при при эффективности клонирования, составляющей приблизительно 40%). Первоначальный скрининг дал на выходе шестьдесят три мышиных антитела, которые ассоциировались с SEZ6 человека. Впоследствии проводили второй скрининг, и он дал на выходе 134 антитела, которые ассоциировались с SEZ6 человека.
Пример 7
Секвенирование мышиных SEZ6 модуляторов
Исходя из изложенного выше, для секвенирования и дополнительного анализа выбирали ряд иллюстративных отдельных моноклональных антител, которые, очевидно, связываются с иммобилизованными SEZ6 человека или клетками h293-hSEZ6 с высокой аффинностью. Как показано в виде таблицы на фиг. 10A и 10B, анализ последовательностей вариабельных областей легких цепей (фиг. 10A) и вариабельных областей тяжелых цепей (фиг. 10B) выбранных моноклональных антител, образованных в примере 6, подтвердил, что многие из них имеют новые области, определяющие комплементарность, и часто демонстрируют новые варианты расположения VDJ. Следует обратить внимание на то, что области, определяющие комплементарность, приведенные на фиг. 10A и 10B, определены по Chothia et al., выше.
На первом этапе секвенирования иллюстративных модуляторов выбранные гибридомные клетки лизировали в реагенте Trizol® (система для очистки РНК Trizol Plus, Life Technologies) для получения РНК. В связи с этим 104-105 клеток ресуспендировали в 1 мл Trizol и энергично встряхивали после добавления 200 мкл хлороформа. Образцы затем центрифугировали при 4°C в течение 10 минут, и водную фазу переносили в свежеприготовленную микроцентрифужную пробирку, куда добавляли равный объем изопропанола. Пробирки вновь энергично встряхивали, и им давали возможность для инкубирования при RT в течение 10 минут перед центрифугированием при 4°C в течение 10 минут. Полученные в результате образцы осажденной РНК однократно промывали в 1 мл 70% этанола и высушивали при RT в течение короткого периода перед ресуспендированием в 40 мкл воды, обработанной DEPC. Качество препаратов РНК определяли путем фракционирования 3 мкл в 1% агарозном геле перед хранением при - 80°C до применения.
Вариабельные области тяжелых цепей Ig из каждой гибридомы амплифицировали с помощью смеси 5'-праймеров, содержащей тридцать два специфичных праймера для лидерных последовательностей мышей, предназначенных для нацеливания на весь репертуар VH мыши, в комбинации с 3'-праймерами для Cγ мыши, специфичными для всех изотипов Ig мыши. ПЦР-фрагмент VH длиной 400 п.о. секвенировали с обоих концов при помощи тех же праймеров для ПЦР. Аналогично, смесь тридцати двух 5'-праймеров для лидерных последовательностей Vκ, предназначенных для амплификации представителей каждого из семейств генов Vκ мыши, в сочетании с одним обратным праймером, специфичным для константной области каппа-цепи мыши, применяли для амплификации и секвенирования легкой цепи каппа-типа. Транскрипты VH и VL амплифицировали из 100 нг общей РНК с применением полимеразной цепной реакции с обратной транскриптазой (RT-PCR).
В общей сложности провели восемь реакций RT-PCR для каждой гибридомы: четыре для Vκ-области легкой цепи и четыре для V-области тяжелой цепи гамма-типа (γ1). Для амплификации применяли набор для одноэтапной RT-PCR (Qiagen). В данном наборе предусмотрены смесь обратных транскриптаз Sensiscript и Omniscript, ДНК-полимераза HotStarTaq, смесь dNTP, буфер и Q-раствор, новая добавка, позволяющая осуществлять эффективную амплификацию "сложных" (например, богатых GC) матриц. Получали реакционные смеси, содержащие 3 мкл РНК, 0,5 мкл 100 мкМ праймеров для тяжелой цепи или легкой цепи каппа-типа (синтезированных IDT под заказ), 5 мкл 5× буфера для RT-PCR, 1 мкл dNTP, 1 мкл смеси ферментов, содержащей обратную транскриптазу и ДНК-полимеразу, и 0,4 мкл ингибитора рибонуклеазы RNasin (1 единица). Реакционная смесь содержит все реагенты, необходимые как для обратной транскрипции, так и для ПЦР. Параметры программы термоциклера устанавливали следующим образом: 50°C в течение 30 минут, 95°C в течение 15 минут для этапа RT, за которым следовали 30 циклов ПЦР (95°C в течение 30 секунд, 48°C в течение 30 секунд, 72°C в течение одной минуты). Затем осуществляли конечное инкубирование при 72°C в течение 10 минут.
Для получения продуктов ПЦР для прямого секвенирования ДНК их очищали при помощи набора для очистки продуктов ПЦР QIAquick™ (Qiagen) согласно протоколу производителя. ДНК элюировали из спин-колонки с применением 50 мкл стерильной воды и затем подвергали прямому секвенированию обеих нитей. Экстрагированные продукты ПЦР подвергали прямому секвенированию при помощи специфичных праймеров для V-области. Нуклеотидные последовательности анализировали при помощи IMGT для идентификации генных сегментов V, D и J в конфигурации зародышевой линии с наиболее высокой степенью гомологии последовательностей. Полученные последовательности сравнивали с известными последовательностями ДНК в конфигурации зародышевой линии, кодирующими V- и J-области Ig, с помощью V-BASE2 (Retter et al., выше), и путем выравнивания генов VH и VL с генами из базы данных генов мышей в конфигурации зародышевой линии получали аннотированные последовательности, приведенные на фиг. 10A и 10B.
Более конкретно, на фиг. 10A показаны непрерывные аминокислотные последовательности семидесяти пяти новых вариабельных областей легких цепей мыши из антител против SEZ6 (SEQ ID NO:20-168, четные номера) и одиннадцати вариабельных областей гуманизированных легких цепей (SEQ ID NO:170-192, четные номера), полученных из иллюстративных легких цепей мыши. Аналогично, на фиг. 10B показаны непрерывные аминокислотные последовательности семидесяти пяти новых вариабельных областей тяжелых цепей мыши (SEQ ID NO:21-169, четные номера) из тех же антител против SEZ6 и одиннадцати вариабельных областей гуманизированных тяжелых цепей (SEQ ID NO:171-193, четные номера) из тех же антител мыши, предоставляющих гуманизированные легкие цепи. Таким образом, в совокупности на фиг. 10A и 10B представлены аннотированные последовательности семидесяти пяти функциональных антител против SEZ6 (называемых SC17.1, SC17.2, SC17.3, SC17.4, SC17.8, SC17.9, SC17.10, SC17.11, SC17.14, SC17.15, SC17.16, SC17.17, SC17.18, SC17.19, SC17.22, SC17.24, SC17.27, SC17.28, SC17.29, SC17.30, SC17.32, SC17.34, SC17.35, SC17.36, SC17.38, SC17.39, SC17.40, SC17.41, SC17.42, SC17.45, SC17.46, SC17.47, SC17.49, SC17.50, SC17.53, SC17.54, SC17.56, SC17.57, SC17.59, SC17.61, SC17.63, SC17.71, SC17.72, SC17.74, SC17.76, SC17.77, SC17.79, SC17.81, SC17.82, SC17.84, SC17.85, SC17.87, SC17.89, SC17.90, SC17.91, SC17.93, SC17.95, SC17.97, SC17.99, SC17.102, SC17.114, SC17.115, SC17.120, SC17121, SC17.122, SC17.140, SC17.151, SC17.156, SC17.161, SC17.166, SC17.187, SC17.191, SC17.193, SC17.199 и SC17.200) и одиннадцати гуманизированных антител (называемых hSC17.16, hSC17.17, hSC17.24, hSC17.28, hSC17.34, hSC17.46, hSC17.151, hSC17.155, hSC17.156, hSC17.161 и hSC17.200). Следует обратить внимание на то, что эти же обозначения могут относиться к клону, вырабатывающему рассматриваемое антитело, и по этой причине применение любого конкретного обозначения следует интерпретировать в контексте связанного раскрытия.
Дополнительно, hSC17.200vL1 (SEQ ID NO:192) представляет собой вариант гуманизированной конструкции легкой цепи hSC17.200 (SEQ ID NO:190), hSC17.155vH1 - vH6 (SEQ ID NO:193-198) представляют собой варианты конструкции тяжелой цепи hSC.155 (SEQ ID NO:184), которая происходит из SC17.90 (SEQ ID NO:127), и что hSC161vH1 (SEQ ID NO:199) представляет собой вариант конструкции тяжелой цепи hSC17.161 (SEQ ID NO:189). Как будет обсуждаться более подробно ниже, эти варианты конструировали и тестировали для оптимизации одного или нескольких биохимических свойств исходного антитела.
Кроме того, соответствующие аминокислотные последовательности каждого из семидесяти пяти иллюстративных мышиных модуляторов и одиннадцати гуманизированных модуляторов и варианты, изложенные на фиг. 10A и 10B, включены в перечень последовательностей настоящей заявки (SEQ ID NO:220-399).
Для целей настоящей заявки SEQ ID NO каждого конкретного антитела являются последовательными. Таким образом, mAb SC17.1 содержит SEQ ID NO:20 и 21 применительно к вариабельным областям легкой и тяжелой цепи, соответственно. В связи с этим SC17.2 содержит SEQ ID NO:22 и 23, SC17.9 содержит SEQ ID NO:24 и 25 и т.д. Более того, последовательности нуклеиновой кислоты, соответствующие каждой аминокислотной последовательности антитела на фиг. 10A и 10B, прилагаются к настоящей заявке в перечне последовательностей, поданном вместе с ней. В рассматриваемом перечне последовательностей включенные последовательности нуклеиновой кислоты имеют SEQ ID NO, на двести большие, чем номера соответствующих аминокислотных последовательностей (легкой или тяжелой цепи). Таким образом, последовательности нуклеиновой кислоты, кодирующие аминокислотные последовательности вариабельной области легкой и тяжелой цепи mAb SC17.1 (т.е. SEQ ID NO:20 и 21), имеют SEQ ID NO:220 и 221 в перечне последовательностей. В связи с этим последовательности нуклеиновой кислоты, кодирующие все раскрытые аминокислотные последовательности вариабельной области легкой и тяжелой цепи, в том числе таковые, кодирующие гуманизированные конструкции и их варианты, пронумерованы сходным образом и имеют SEQ ID NO:220-399.
Пример 8
Получение химерных и гуманизированных SEZ6 модуляторов
Как упоминалось выше, одиннадцать мышиных антител из примера 7 гуманизировали с помощью привития области, определяющей комплементарность (CDR). Каркасные структуры тяжелых и легких цепей человека выбирали на основе сходства последовательностей и структуры в отношении функциональных генов человека в конфигурации зародышевой линии. В связи с этим сходство структуры оценивали путем сравнения канонической структуры CDR мыши с человеческими кандидатами, имеющими такие же канонические структуры, как описано в Chothia et al. (выше).
Более конкретно, одиннадцать мышиных антител SC17.16, SC17.17, SC17.24, SC17.28, SC17.34, SC17.46, SC17.151, SC17.155, SC17.156, SC17.161 и SC17.200 гуманизировали при помощи компьютеризированного способа привития CDR (база данных Abysis, UCL Business Plc.) и стандартных методик молекулярной инженерии с получением модуляторов hSC17.16, hSC17.17, hSC17.24, hSC17.28, hSC17.34, hSC17.46, hSC17.151, hSC17.155, hSC17.156, hSC17.161 и hSC17.200. Каркасные области вариабельных областей человека выбирали на основе их наиболее высокой степени гомологии последовательностей в отношении рассматриваемой последовательности каркасной структуры мыши и ее канонической структуры. Для целей анализа гуманизации отнесение аминокислот к каждому из CDR-доменов находится в соответствии с нумерацией по Kabat et al. (выше).
Процедуры молекулярной инженерии проводили при помощи методик, принятых в данной области техники. С этой целью общую мРНК экстрагировали из гибридом и амплифицировали согласно приведенному в примере 7 непосредственно выше.
Из информации о нуклеотидных последовательностях получали данные в отношении генных сегментов V, D и J, соответствующих тяжелым и легким цепям рассматриваемых мышиных антител. На основе данных о последовательностях разрабатывали новые наборы праймеров, специфичных для лидерной последовательности VH- и VK-областей легких цепей антител Ig, для клонирования рекомбинантного моноклонального антитела. Впоследствии последовательности V-(D)-J выравнивали с последовательностями мышиных Ig зародышевой линии. Полученные генетические структуры для каждой из одиннадцати гуманизированных конструкций показаны в таблице 1 непосредственно ниже.
Гуманизированные антитела, перечисленные в таблице 1, соответствуют аннотированным последовательностям легкой и тяжелой цепи, приведенным на фиг. 10A и 10B (SEQ ID NO:170-191). Соответствующие последовательности нуклеиновой кислоты вариабельных областей легкой и тяжелой цепи изложены в перечне последовательностей. В таблице 1 дополнительно показано, что очень немногие изменения в каркасных структурах были необходимыми для сохранения благоприятных свойств связывающихся модуляторов. В связи с этим изменения в каркасных структурах или обратные мутации производили только в трех из вариабельных областей тяжелой цепи и только две модификации каркасных структур выполнили в вариабельных областях легкой цепи.
Следует обратить внимание на то, что для некоторых гуманизированных вариабельных областей легкой и тяжелой цепи (например, hSC17.200, hSC17.155 и hSC17.161) консервативные аминокислотные мутации вводили в CDR для решения проблем, связанных со стабильностью, при этом сохраняя связывание с антигеном. В каждом случае было обнаружено, что аффинность связывания антител с модифицированными CDR была эквивалентной либо соответствующему химерному, либо мышиному антителу. Последовательности девяти иллюстративных вариантов гуманизированных цепей (легкой и тяжелой) перечислены в конце фиг. 10A и 10B (SEQ ID NO:192-199), где они сохраняют обозначение гуманизированной исходной цепи с пометкой, указывающей на то, что они были изменены (например, hSC17.200vL1, hSC17.155vH1-6 и hSC17.161vH1).
После гуманизации всех выбранных антител путем привития CDR полученные в результате аминокислотные последовательности вариабельных областей легкой и тяжелой цепи анализировали для определения их гомологии относительно мышиных донорных и человеческих акцепторных вариабельных областей легкой и тяжелой цепи. По результатам, показанным в таблице 2 ниже, выявляли, что гуманизированные конструкции неизменно проявляли более высокую степень гомологии относительно последовательностей человеческого акцептора, чем относительно последовательностей мышиного донора. Более конкретно, гуманизированные вариабельные области тяжелой и легкой цепи, как правило, демонстрируют более высокую процентную гомологию с ближайшим совпадением из человеческих генов зародышевой линии (84%-95%) по сравнению с гомологией гуманизированных последовательностей вариабельных областей и белковых последовательностей донорной гибридомы (74%-89%).
(акцептора CDR)
(донора CDR)
После тестирования, и как будет обсуждаться в примере 9, каждая из гуманизированных конструкций проявляла благоприятные характеристики связывания, приблизительно сопоставимые с таковыми, демонстрируемыми мышиными исходными антителами (данные не показаны).
Как только последовательности нуклеиновой кислоты, кодирующие вариабельные области, гуманизированные либо мышиные, будут определены, антитела по настоящему изобретению можно экспрессировать и выделять при помощи методик, принятых в данной области техники. С этой целью фрагменты синтетической ДНК, кодирующие выбранные вариабельные области тяжелой цепи (гуманизированные или мышиные), клонировали в вектор экспрессии IgG1 человека. Аналогично, фрагмент ДНК, кодирующий вариабельную область легкой цепи (опять же гуманизированную или мышиную), клонировали в вектор экспрессии легкой цепи человека. Выбранное антитело затем экспрессировали посредством введения полученных конструкций нуклеиновых кислот, кодирующих тяжелую и легкую цепи, в клетки CHO путем котрансфекции.
Более конкретно, один совместимый способ получения антител включает прямое клонирование генов мышиных или гуманизированных вариабельных областей (амплифицированных при помощи ПЦР) в выбранные векторы экспрессии иммуноглобулина человека. Все праймеры, применяемые в ПЦР, специфичных в отношении генов Ig, включали сайты рестрикции, которые обеспечивали возможность прямого клонирования в векторы экспрессии, содержащие константные области тяжелой и легкой цепи IgG1 человека. Вкратце, ПЦР-продукты очищали при помощи набора для очистки продуктов PCR Qiaquick (Qiagen), с последующим расщеплением с помощью AgeI и XhoI (для тяжелой цепи) и XmaI и DraIII (для легкой цепи), соответственно. Расщепленные ПЦР-продукты очищали перед лигированием в векторы экспрессии. Реакции лигирования проводили в общем объеме 10 мкл с 200 ед. ДНК-лигазы T4 (New England Biolabs), 7,5 мкл расщепленного и очищенного продукта ген-специфичной ПЦР и 25 нг линеаризованной векторной ДНК. Компетентные бактерии E. coli DH10B (Life Technologies) трансформировали посредством теплового шока при 42°C с помощью 3 мкл продукта лигирования и высевали на чашки с ампициллином (100 мкг/мл). Фрагмент области VH, полученный с помощью AgeI и EcoRI, затем вставляли в те же самые сайты вектора экспрессии pEE6.4HuIgG1, тогда как синтетическую вставку XmaI-DraIII VK, клонировали в сайты XmaI-DraIII соответствующего вектора экспрессии pEE12.4Hu-Kappa.
Клетки, продуцирующие выбранное антитело, получали путем трансфекции клеток HEK 293 с помощью подходящих плазмид с применением 293фектина. В связи с этим, плазмидную ДНК очищали с помощью спин-колонок QIAprep (Qiagen). Клетки эмбриональной почки человека (HEK) 293T (№ в ATCC CRL-11268) культивировали в 150 мм чашках (Falcon, Becton Dickinson) при стандартных условиях в среде Игла, модифицированной по способу Дульбекко (DMEM), дополненной 10% термоинактивированной FCS, 100 мкг/мл стрептомицина, 100 Ед/мл пенициллина G (все от Life Technologies).
Для транзиентной трансфекции клетки выращивали до 80% конфлюэнтности. Равные количества векторной ДНК, кодирующей IgH- и соответствующую IgL-цепь (по 12,5 мкг каждой), добавляли к 1,5 мл Opti-MEM, смешанной с 50 мкл реагента для трансфекции HEK 293 в 1,5 мл Opti-MEM. Смесь инкубировали в течение 30 мин. при комнатной температуре и равномерно распределяли по культуральной чашке. Образцы надосадочной жидкости собирали через три дня после трансфекции, заменяли 20 мл свежей DMEM, дополненной 10% FBS, и вновь собирали в день 6 после трансфекции. Культуральные супернатанты очищали от остатков клеток с помощью центрифугирования при 800×g в течение 10 мин. и хранили при 4°C. Рекомбинантные химерные и гуманизированные антитела очищали с помощью гранул с белком G (GE Healthcare) и хранили при подходящих условиях.
Пример 9
Характеристики SEZ6 модуляторов
Различные способы применяли для анализа характеристик связывания и иммуногистохимических характеристик выбранных SEZ6 модуляторов, полученных, как изложено выше. Конкретно, ряд модуляторов на основе антитела характеризовали касательно аффинности, определения секций и перекрестной реактивности относительно антигена на SEZ6 человека, яванского макака, крысы и мыши вместе с белками SEZ6L и SEZ6L2 с помощью способов, принятых в данной области, в том числе проточной цитометрии. Значения аффинности и константы скорости kon и koff выбранных модуляторов измеряли с применением анализа по методу интерферометрии биослоя на ForteBio RED (ForteBio, Inc.) или поверхностного плазмонного резонанса с помощью Biacore 2000, в каждом случае в соответствии с инструкциями производителя.
Результаты определения характеристик изложены в виде таблицы на фиг. 11A, где можно увидеть, что выбранные модуляторы, как правило, характеризовались относительно высокими аффинностями в наномолярном диапазоне и, во многих случаях, перекрестно реагировали с одним или несколькими ортологами SEZ6. На фиг. 12 дополнительно перечислена эмпирически определенная секция, занятая заявленным модулятором. Совместно эти данные демонстрируют варьирующие свойства связывания раскрытых модуляторов, а также их потенциальную пригодность для фармацевтической разработки исходя из их реактивности на животных моделях.
В связи с этим проводили проточную цитометрию с применением FACSCanto II согласно инструкциям производителя, чтобы подтвердить, что выбранные модуляторы на основе антитела SC17 могут иммуноспецифично ассоциироваться с SEZ6 человека, и определить, перекрестно реагируют ли одни и те же модуляторы с SEZ6 яванского макака, крысы и/или мыши в дополнение к SEZ6L и SEZ6L2. Более конкретно модуляторы тестировали в отношении перекрестной реактивности с SEZ6 мыши и SEZ6 крысы при помощи проточной цитометрии с клеточными линиями Neuro2a (№ в каталоге ATCC CCL131) и RIN-m5F (№ по кат. ATCC CRL-11605), которые экспрессируют SEZ6 мыши и SEZ6 крысы, соответственно. Для проверки перекрестной реактивности с SEZ6 яванского макака, для анализа по методам проточной цитометрии применяли дрожжи, представляющие внеклеточный домен SEZ6 яванского макака (Boder et al., 1997).
Вкратце, 1×105 клеток на лунку клеток Neuro2a, RIN-5mF или дрожжей, представляющих SEZ6 яванского макака, инкубировали в течение 30 минут с 50 мкл буфера PBS (2% FCS) с 5 мкг/мл антитела. Клетки дважды промывали в том же буфере и затем инкубировали с DyLight 649-меченным вторичным антителом козы к IgG мыши, специфичным для Fc-фрагмента, разбавленным 1:200 в буфере PBS из расчета 50 мкл на образец. После инкубации в течение 15 минут клетки дважды промывали буфером PBS и ресуспендировали в том же буфере с DAPI для анализа по методам проточной цитометрии для Neuro2a и Rin-m5F или буфере без DAPI анализа по методам проточной цитометрии для клеток дрожжей с cSEZ6. Антитела, которые связывались с клеточными линиями Neuro2a или RIN-m5F, или дрожжами, представляющими SEZ6 яванского макака, считали перекрестно-реактивными с SEZ6 мыши, SEZ6 крысы или SEZ6 яванского макака, соответственно. На фиг. 11A показаны результаты анализа перекрестной реактивности. Шесть антител перекрестно реагировали с SEZ6 человека и мыши (SC17.6, SC17.7, SC17.19, SC17.24, SC17.26 и SC17.42); шесть с SEZ6 человека и крысы (SC17.6, SC17.17, SC17.19, SC17.26, SC17.28, SC17.34 и SC17.42) и шесть с SEZ6 человека и яванского макака (SC17.17, SC17.24, SC17.26, SC17.34, SC17.36 и SC17.45). Следует обратить внимание на то, что SC17.6 дублирует SC17.16 и проявляет такие же характеристики связывания.
Для подтверждения данных анализа перекрестной реактивности выше относительно SEZ6 крысы и для определения констант аффинности и скорости kon и koff выбранных эффекторов, осуществляли либо анализ по методу интерферометрии биослоя на ForteBio RED (ForteBio, Inc.), либо поверхностного плазмонного резонанса на Biacore 2000 (GE Healthcare). Аффинности определяли как для человеческого рекомбинантного SEZ6-His, так и для крысиного рекомбинантного SEZ6-His, полученных в примере 5. Как видно из фиг. 11A, ряд протестированных антител перекрестно реагировали с SEZ6 крысы. Выбранные модуляторы характеризовались относительно высокими аффинностями в отношении как SEZ6 крысы, так и человека в наномолярном диапазоне.
Для определения перекрестной реактивности с белками представителями семейства, SEZ6L и SEZ6L2, применяли анализ на основе ELISA. Планшеты покрывали белками SEZ6, SEZ6L или SEZ6L2 из расчета 0,2 мкг/мл в PBS в течение ночи. После промывания в PBS, содержащем 0,05% (об./об.) Tween 20 (PBST), лунки блокировали с помощью 2% (вес./об.) BSA в PBS (PBSA) при 100 мкл/лунка в течение 1 часа при комнатной температуре. Затем добавляли антитело из расчета 1 мкг/мл в 100 мкл PBSA на 1 час при комнатной температуре. После промывания в PBST инкубировали с HRP-меченным антителом козы к IgG мыши в разведении 1:2000 в PBSA из расчета 100 мкл/лунка в течение 1 часа при комнатной температуре. Планшеты промывали и добавляли 100 мкл/лунка субстратного раствора TMB (Thermo Scientific 34028) на 15 минут при комнатной температуре. После проявления добавляли равный объем 2M H2SO4 для прекращения обусловленного субстратом проявления, и анализировали на спектрофотометре при OD 450. На фиг. 11A показано, что одно антитело перекрестно реагировало с SEZ6L (SC17.7) и пять антител перекрестно реагировали с SEZ6L2 (SC17.6, SC17.7, SC17.19, SC17.26 и SC17.28). Как обсуждалось выше, такие антитела ко всем SEZ6 совместимы с изложенным в настоящем документе и могут быть использованы в сочетании с раскрытыми способами.
Характеристики связывания следующих гуманизированных конструкций из примера 8, hSC17.16, hSC17.17, hSC17.24, hSC17.28, hSC17.34 и hSC17.46, анализировали, чтобы определить, не изменил ли существенно процесс привития CDR их характеристики связывания. Гуманизированные конструкции (CDR-привитые) сравнивали с “традиционными” химерными антителами, содержащими вариабельные области мышиных исходных (или донорных) тяжелой и легкой цепей и человеческую константную область, практически эквивалентную таковой применяемой в гуманизированных конструкциях. С этими конструкциями осуществляли поверхностный плазмонный резонанс с применением Biacore 2000 (GE Healthcare) для идентификации каких-либо незначительных изменений в константах скорости, обусловленных процессом гуманизации. Во всех случаях гуманизированные антитела обладали аффиностью связывания эквивалентной или лучшей, чем у соответствующих мышиных антител (данные не показаны).
Определение секций антител осуществляли для различных SEZ6 модуляторов, как показано на фиг. 11A. Применяли ForteBio RED согласно инструкциям производителя для идентификации конкурирующих антител, принадлежащих к одной и той же или различным секциям. Вкратце, эталонное антитело (Ab1) захватывали на чипе для захвата антител против иммуноглобулинам мыши, затем применяли несвязывающееся антитело в высокой концентрации для блокирования чипа, и собирали данные об исходном уровне. Мономерный рекомбинантный человеческий SEZ6 (описанный в примере 5) затем захватывали с помощью специфического антитела (Ab1), и наконечник погружали в лунку с тем же антителом (Ab1) в качестве контроля либо в лунку с другим тестовым антителом (Ab2). Если для нового антитела наблюдалось дополнительное связывания, то определяли, что Ab1 и Ab2 находятся в различных секциях. Если не происходило дополнительное связывание, что определяли путем сравнения уровней связывания с таковыми для контрольного Ab1, то определяли, что Ab2 находится в той же секции. Как известно в данной области техники, этот способ можно расширить для скрининга больших библиотек уникальных антител с применением полной группы антител, представляющих уникальные секции, в 96-луночном планшете. В данном случае этот способ определения секции антител демонстрировал, что антитела, подвергнутые скринингу, принадлежат по меньшей мере к семи различным секциям относительно белка SEZ6. Секции A-F представляют собой уникальные секции и антитела, содержащиеся в каждой из этих секций, конкурируют друг с другом (но не конкурируют с антителами из других определенных секций) за связывание с белком SEZ6. Секция U содержит антитела, которые не конкурируют с антителами в секциях A-F, но могут конкурировать за связывание друг с другом.
Пример 10
Картирование эпитопов SEZ6 модуляторов
Чтобы определить характеристики эпитопов, с которыми раскрытые модуляторы на основе антитела против SEZ6 ассоциируются или связываются, проводили картирование эпитопов на уровне доменов с применением модификации протокола, описанного Cochran et al. (J Immunol Methods. 287 (1-2):147-158 (2004), который включен в настоящий документ посредством ссылки). Индивидуальные домены SEZ6 экспрессировали на поверхности дрожжей и связывание каждым из антител против SEZ6 определяли посредством проточной цитометрии.
Плазмидные конструкции дрожжевого дисплея получали для экспрессии следующих конструкций: внеклеточный домен SEZ6 (аминокислоты 1-904); Sushi домен 1 (аминокислоты 336-395), CUB домен 1 (аминокислоты 297-508), Sushi домен 2 (аминокислоты 511-572), CUB домен 2 (аминокислоты 574-685), Sushi домен 3 (аминокислоты 690-748), Sushi домен 4 (аминокислоты 750-813), Sushi домен 5 (аминокислоты 817-878) и Sushi домен 5+C-конец (аминокислоты 817-904). Дополнительно, N-концевой домен (аминокислоты 1-335) разделили на 3 фрагмента, названные N1 (аминокислоты 1-70), N2 (аминокислоты 71-169) и N3 (аминокислоты 169-335), каждый из которых клонировали в плазмиду для дрожжевого дисплея. Нумерация аминокислот не включает лидерный пептид. Информацию о доменах см. в общем на странице ввода Q53EL9 в базе данных UniProtKB/Swiss-Prot. Эти плазмиды вводили путем трансформации в дрожжи, которые затем выращивали и индуцировали, как описано в Cochran et al. Следует обратить внимание на то, что вся нумерация аминокислот основана на зрелом белке SEZ6 без лидерной последовательности из 19 аминокислот.
Для тестирования конкретной конструкции в отношении связывания 200000 индуцированных дрожжевых клеток, экспрессирующих требуемую конструкцию дважды промывали в PBS+1 мг/мл BSA (PBSA), и инкубировали в 50 мкл PBSA с антителом курицы к c-myc (Life Technologies) из расчета 0,1 мкг/мл и либо 50 нМ очищенного антитела или разведения 1:2 неочищенного супернатанта от гибридом, культивируемых в течение 7 дней. Клетки инкубировали в течение 90 минут на льду и затем дважды промывали в PBSA. Затем клетки инкубировали в 50 мкл PBSA с подходящими вторичными антителами: для мышиных антител, Alexa 488-конъюгированное антитело к курице и Alexa 647-конъюгированное антитело козы к мыши (оба Life Technologies) добавляли из расчета 1 мкг/мл каждое, и для гуманизированных или химерных антител, Alexa 647-конъюгированное антитело к курице (Life Technologies) и R-фикоэритрин-конъюгированное антитело козы к человеку (Jackson Immunoresearch) добавляли из расчета 1 мкг/мл каждое. Через двадцать минут инкубации на льду клетки дважды промывали с помощью PBSA и анализировали на FACS Canto II.
Все модуляторы связывались уникальным образом с одним доменом, экспрессированным на дрожжевых клетках. В некоторых случаях клоны антитела специфично связывались с дрожжами, экспрессирующими Sushi домен 5+C-конец, но не с дрожжами, экспрессирующими Sushi домен 5. Сделали заключение, что эти клоны антитела связывались только с C-концевой областью (аминокислоты 879-904).
Эпитопы классифицировали либо как конформационные (т.е. прерывистые), либо как линейные. Дрожжи, представляющие конструкцию с ECD SEZ6, обрабатывали термически в течение 30 минут при 80°C, чтобы денатурировать антиген, дважды промывали ледяным PBSA и затем подвергали такому же протоколу окрашивания и анализу по метода проточной цитометрии, как описано выше. Антитела, которые связывались как с денатурированными, так и с нативными дрожжами, классифицировали как связывающиеся с линейным эпитопом, тогда как антитела, которые связывались с нативными дрожжами, но не связывались с денатурированными дрожжами, классифицировали как конформационно-специфичные.
Сводка данных по картированию эпитопов на уровне домена для протестированных антител представлена в таблице 3 ниже. Антитела, которые связывают линейный эпитоп подчеркнуты, а антитела, которые связывают представителей семейства SEZ6, SEZ6L и SEZ6L2, обозначены звездочкой и/или крестиком, соответственно.
Интересную и неожиданную тенденцию наблюдали, когда проводили in vitro анализ цитолиза клеток с применением домен-картированных модуляторов на основе антитела против SEZ6, описанных в этом примере 10. In vitro киллинг-анализ, проводимый по сути, как описано ниже в примере 14, определял способность конкретного антитела интернализовать и уничтожать клетки HEK-293. Фиг. 11B представляет собой график эффективности протестированных антител в зависимости от доменов, с которыми они связываются. Антитела, которые связываются с определенными доменами, в том числе: N1, N3, Sushi доменом 1 и Sushi доменом 4, характеризовались повышенным in vitro киллингом. Антитела, которые ассоциировали с Sushi доменом 4, которые являлись очень эффективными в интернализации и киллингу клеток, характеризуются сильной корреляцией с каркасными областями зародышевой линии мыши IGHV1-34 и IKV4-59.
Далее проводили тонкое картирование эпитопов у выбранных антител для определения специфической аминокислоты, с которой они связываются. Антитела, которые связываются с линейным эпитопом, картировали с применением набора для фагового дисплея петидной библиотеки Ph.D.-12 (New England Biolabs E8110S). Антителом, выбранным для картирования эпитопа, покрывали пробирку Nunc MaxiSorp (Nunc) из расчета 50 мкг/мл в 3 мл 0,1 M раствора бикарбоната натрия, pH 8, и инкубировали в течение ночи. Пробирку блокировали с помощью 3% раствора BSA в растворе бикарбоната. Затем, 1011 вводимого фага в PBS+0,1% Tween-20 давали возможность связаться, затем следовали десять последовательных промывок с помощью 0,1% Tween-20 для отмывки несвязавшегося фага. Оставшийся фаг элюировали с помощью 1 мл 0,2 M глицина в течение 10 минут при комнатной температуре при легком перемешивании, с последующей нейтрализацией с помощью 150 мкл 1 M Tris-HCl, pH 9. Элюированный фаг амплифицировали и вновь подвергали пэннингу с 1011 вводимого фага с применением 0,5% Tween-20 в ходе этапов промывки для повышения жесткости отбора. ДНК из 24 бляшек от элюированного фага из второго раунда выделяли с применением набора для выделения на спин-колонках Qiaprep M13 (Qiagen) и секвенировали. Связывание клонального фага подтверждали с помощью анализа ELISA, где картированным антителом или контрольным антителом покрывали планшет для ELISA, блокировали и подвергали действию каждого клона фага. Связывание фага выявляли с применением антитела против M13, конъюгированного с пероксидазой хрена (GE Healthcare), и раствора для ELISA 1-Step Turbo TMB (Pierce). Пептидные последовательности фага из специфично связывающихся фагов выравнивали при помощи Vector NTI (Life Technologies) с пептидной последовательностью антигена ECD для определения связывающего эпитопа.
Антитела, которые связывались с прерывистым эпитопом картировали при помощи методики, описанной у Chao et al. (2007). Библиотеки ECD SEZ6 мутантов получали с помощью ПЦР с внесением ошибок с применением нуклеотидных аналогов 8-оксо-2'-деоксигуанозин-5'-трифосфата и 2'-дезокси-p-нуклеозид-5'-трифосфата (оба от TriLink Bio) для показателя нацеленного мутагенеза одна мутация аминокислоты на клон. Их трансформировали в формат дрожжевого дисплея. С помощью методики, описанной выше для картирования на уровне доменов, библиотеку окрашивали на c-myc и связывание антитела из расчета 50 нМ. При помощи FACS Aria (BD) отсортировывали клоны, которые характеризовались потерей связывания по сравнению с ECD SEZ6 дикого типа. Эти клоны повторно выращивали и подвергали другому раунду сортировки FACS по потере связывания с целевым антителом. При помощи набора для выделения дрожжевых плазмид из малых объемов Zymoprep (Zymo Research) выделяли и секвенировали отдельные клоны ECD. При необходимости мутации преобразовывали к виду клонов ECD с одной мутацией при помощи набора для сайт-направленного мутагенеза Quikchange (Agilent).
После этого проводили скрининг отдельных клонов ECD для определения того, являлась ли потеря связывания результатом мутации в эпитопе или мутации, которая вызывает неправильное сворачивание. Мутации, которые затрагивали цистеин, пролин и стоп-кодоны, автоматически отбрасывались из-за высокой вероятности мутации, обуславливающей неправильное сворачивание. Затем оставшиеся клоны ECD подвергали скринингу в отношении связывания с неконкурирующим, конформационно-специфичным антителом. Сделано заключение, что клоны ECD, потерявшие связывание с неконкурирующими, конформационно специфичными антителами, содержат мутации с неправильным сворачиванием, тогда как клоны ECD, сохранявшие связывание, эквивалентное ECD SEZ6, были свернуты правильным образом. Было сделано заключение, что мутации в клонах ECD в последней группе находились в эпитопе. Также конструировали модели гомологии выделенных доменов при помощи MODELLER для подтверждения того, что идентифицированные остатки находятся в эпитопе: 1) расположены в непосредственной близости друг от друга в свернутой модели гомологии, и 2) имели боковые цепи, которые подвержены действию растворителя, и не погружены, поскольку погруженные остатки будет иметь более высокий шанс вызвать неправильное сворачивание, и с малой вероятностью будут являться частью эпитопа связывания. Обзор антител с их эпитопами приведен в таблице 4.
NR указывает на то, что SEQ ID NO не был присвоен, так как эпитопы были прерывистыми.
В случае SC17.34, SC17.36 и SC17.46 точковые мутации конструировали в выделенном домене, Sushi домен 1, который, как определили при картировании на уровне доменов, представляет собой домен связывания. В случае SC17.46 кандидатные мутации для скрининга не были идентифицированы в скрининге на основе библиотек; скорее их идентифицировали на основании картирования доменов, потери перекрестной реактивности с ECD SEZ6 яванского макака и ECD SEZ6 крысы и выравнивания последовательностей различных видов для идентификации отличий в видовой первичной последовательности. Эти кандидатные мутации подвергали такому же анализу как и другие антитела для подтверждения эпитопа SC17.46.
Пример 11
Выявление экспрессии на поверхности SEZ6 с помощью проточной цитометрии
Проточную цитометрию применяли для оценки специфичности антител против SEZ6, которые получали для выявления присутствия человеческого белка SEZ6 на поверхности разработанных клеточных линий HEK-293T, сконструированных как описано в примере 5. Для подтверждения специфичности окрашивания использовали изотипически окрашенные и "fluorescence minus one" (FMO)-контроли. Вкратце, HEK-293T, подвергнутые трансдукции с помощью SEZ6 человека и GFP (см. пример 5) и собранных опухолевых образцов из NTX, подвергали диссоциации и диспергировали в суспензии с применением методик ферментативного расщепления, принятых в данной области техники (см., например, патент США № 2007/0292414, который включен в данный документ), инкубировали в течение 30 минут с антителом к SEZ6. Клетки дважды промывали в PBS (2% FCS) и затем инкубировали с DyLight 649-меченным вторичным антителом козы к IgG мыши, специфичным для Fc-фрагмента, разбавленным 1:200 в буфере PBS из расчета 50 мкл на образец. После 15 минут инкубации клетки дважды промывали PBS и ресуспендировали в PBS с DAPI и анализировали посредством проточной цитометрии, как обсуждалось ранее.
Как продемонстрировано с помощью иллюстративных данных, показанных на фиг. 12A для SC17.33, SEZ6 модулятор явно распознавал клетки HEK-293T-HuSEZ6. Эти данные демонстрируют, что получены модуляторы, которые специфично распознавали SEZ6 человека, экспрессированные на клеточной поверхности.
Экспрессию человеческого белка SEZ6 на поверхности выбранных опухолей из NTX оценивали посредством проточной цитометрии с применением нескольких иллюстративных антител SC17. Экспрессию SEZ6 в LU37, LU86 и KDY66 тестировали с применением антитела SC17.6, тогда как экспрессию SEZ6 в LU50, LU100 и LU73 тестировали с применением антител SC17.10, SC17.42 и SC17.28, соответственно. Результаты приведены на фиг. 13A. Опухоли из NTX собирали, подвергали диссоциации и совместно окрашивали с применением коммерчески доступных антител против CD45 мыши, к H-2Kd мыши, к EpCAM человека и одного из описанных выше антител мыши к SEZ6 человека. Данные, показанные на фиг. 13A, получали с применением клеток, которые не окрашивались положительно в случае вышеупомянутых антител к мыши, но окрашивались положительно в случае антител против EpCAM человека. Подобно экспериментам с окрашиванием HEK-293T, описанным выше, изотипически окрашенные и "fluorescence minus one" (FMO)-контроли использовали для подтверждения отсутствия неспецифического окрашивания. Как видно из фиг. 13A, окрашивание с помощью антител против SEZ6 было более интенсивным, чем FMO во всех опухолевых клеток человека из NTX, на что указывают смещение профиля флуоресценции вправо и изменения значений средней интенсивности флуоресценции (MFI) для опухолей легкого LU37, LU50 и LU86 из NTX и опухоли почки KDY66 из NTX. Эти данные позволяют предположить, что белок SEZ6 экспрессируется на поверхности различных опухолей из NTX и, следовательно, поддается модуляции с помощью антитела против SEZ6.
Пример 12
Экспрессия белка SEZ6 в различных опухолях
С учетом повышенных уровней мРНК-транскрипта SEZ6, ассоциированных с различными опухолями, выполнили работу для демонстрации соответствующего повышения уровня экспрессии белка SEZ6 в опухолях из NTX. Экспрессию белка SEZ6 выявляли с помощью (i) анализа сэндвич-ELISA с электрохемилюминисценцией SEZ6 применением платформы MSD Discovery (Meso Scale Discovery, LLC); и (ii) иммуногистохимического окрашивания.
Опухоли из NTX удаляли из мышей хирургическим путем и мгновенно замораживали на сухом льду/этаноле. К размороженным кускам опухоли добавляли буфер для экстракции белков (Biochain Institute, Inc.), и опухоли измельчали при помощи системы TissueLyser (Qiagen). Лизаты очищали путем центрифугирования (20000g, 20 минут, 4°C) и количественно определяли общую концентрацию белка в каждом лизате с помощью бицинхониновой кислоты. Белковые лизаты хранили при -80°C до анализа. Лизаты нормальных тканей приобретали у Novus Biologicals.
Концентрации белки SEZ6 в образцах лизатов определяли путем интерполяции значений из стандартной кривой концентрации белка, которую получали с применением очищенного рекомбинантного белка SEZ6 (пример 5). Стандартную кривую для белка SEZ6 получали и анализ количественной оценки осуществляли следующим образом:
стандартные планшеты MSD покрывали в течение ночи при 4°C 30 мкл антитела SC17.17 из расчета 2 мкг/мл в PBS. Планшеты промывали в PBST и блокировали в 150 мкл 3% раствора Blocker A от MSD в течение одного часа. Планшеты вновь промывали в PBST. Затем антитело SC17.36 конъюгировали с sulfo-tag от MSD и 25 мкл SC17.36 с меткой добавляли к промытым планшетам при 0,5 мкг/мл в 1% Blocker A от MSD. 25 мкл разведенного 10x лизата в 1% Blocker A от MSD или рекомбинантного стандарта SEZ6 в серийном разведении в 1% Blocker A от MSD, содержащем 10% буфер для экстракции белков, также добавляли в лунки и инкубировали в течение двух часов. Планшеты промывали в PBST. Буфер Read T от MSD с поверхностно-активным веществом разводили водой до 1X, и в каждую лунку добавляли 150 мкл. Планшеты прочитывали на устройстве формирования изображения MSD Sector 2400 при помощи программы анализа из системы интегрированного программного обеспечения с получением значений концентрации SEZ6 в образцах из NTX путем интерполяции на основании стандартной кривой. Значения затем разделили на общую концентрацию белка с получением количества нанограммов SEZ6 на миллиграмм общего белка лизата. Полученные концентрации приведены на фиг. 12B, где каждая точка представляет концентрации белка SEZ6, полученные для отдельной опухолевой линии из NTX. Хотя каждая точка получена из отдельной линии из NTX, в большинстве случаев тестировали несколько биологических образцов из одной и той же линии из NTX, и значения усредняли с получением экспериментальной точки на графике.
На фиг. 12B показано, что по сравнению с лизатами нормальной ткани, выбранные опухоли почки, яичника и LCNEC характеризовались умеренную экспрессию белка SEZ6, тогда как самая высокая экспрессия белка SEZ6 наблюдалась у опухолей SCLC. Все лизаты нормальных тканей были отрицательными в отношении экспрессии белка SEZ6 за исключением лизата из нормального головного мозга и глаза.
Иммуногистохимию (IHC) проводили на PDX опухолях для подтверждения того, что SEZ6 экспрессируется на поверхности определенных PDX опухолей, и чтобы определить местоположение белка SEZ6 в архитектуре опухоли.
IHC проводили на срезах ткани, фиксированной формалином и залитой в парафин, при помощи способа косвенного выявления, который включал мышиное моноклональное первичное антитело против SEZ6 (клон 17.140), специфичные к мыши вторичные антитела, конъюгированные с биотином, комплекс авидин/биотин, связанный с пероксидазой хрена, и выявления с помощью DAB (Nakene PK 1968; 16:557-60). При окрашивании ксенотрансплантатных PDX опухолей применяли средство для блокирования мышиного IgG (Vector Laboratories; № по каталогу PK-2200). Проверили SC17.140 и подтвердили, что оно подходит для IHC, путем демонстрации специфического окрашивания на срезах осадков клеток HEK-293T, сверхэкспрессирующих SEZ6, в сравнении с осадками интактных клеток HEK-293T, полученных как известно в области техники. Специфичность дополнительно подтверждали путем конкуренции сигнала в случае 5 молярного избытка очищенного рекомбинантного SEZ6 на клетках HEK-293T, сверхэкспрессирующих SEZ6 человека, и ксенотрансплантатных опухолях, которые, как было показано с помощью IHC, экспрессируют SEZ6 (данные не показаны). На фиг. 16 показана экспрессия SEZ6, измеренная с помощью IHC на опухолях SCLC из NTX. Интенсивности окрашивания давали оценку, учитывая интенсивность окрашивания от 0 (отсутствует) до 3 (сильное окрашивание). Результаты показывают, что 64% протестированных опухолей SCLC из NTX экспрессировали SEZ6.
Эти данные в сочетании с данными о транскрипции мРНК, относящимися к экспрессии SEZ6, приведенными выше (пример 4), и экспрессии белка SEZ6 на клеточной поверхности (пример 11), убедительно подкрепляют предположение, что детерминанты SEZ6 представляют перспективные мишени для терапевтического вмешательства.
Пример 13
Обогащение популяций клеток, вызывающих развитие опухоли
Опухолевые клетки можно разделять в широком смысле на два типа субпопуляций клеток: клетки, не относящиеся к опухолеродным (NTG), и клетки, вызывающие развитие опухоли (TIC). TIC обладают способностью образовывать опухоли при имплантации в мышей с ослабленным иммунитетом. Раковые стволовые клетки (CSC) представляют собой подмножество TIC и они способны к самовоспроизведению в течение неопределенного периода времени, при этом сохраняется способность к мультилинейной дифференцировке. Для определения того, может ли экспрессия SEZ6 коррелировать с повышенной онкогенностью, проводили секвенирование всего транскриптома, проточную цитометрию и анализ на онкогенность, все из которых описаны ниже.
Анализ всего транскриптома относительно экспрессии SEZ6 в различных образцах опухоли проводили, как описано в примере 1. CSC идентифицировали на основе экспрессии CD324, который, как было показано, является маркером стволовых клеток в различных опухолях (см. заявку PCT 2012/031280). Результаты на фиг. 6A показывают, что экспрессия мРНК SEZ6 была повышена в CSC относительно NTG клеток, выделенных из двух линий опухолей SCLC из NTX (LU86 и LU95).
Проточную цитометрию проводили на клетках из опухолей легкого из NTX, по сути как описано в примере 11. Клетки LU86, LU117 и LU64 совместно окрашивали с применением CD324, маркера популяций CSC (см. заявка PCT 2012/031280), и антитела против SEZ6, SC17.10, SC17.28 или SC17.42, соответственно, для определения того экспрессируется ли SEZ6 по-разному у этих популяций. Как отмечено на фиг. 13B, клетки LU86, LU117 и LU64, окрашивающиеся положительно как в отношении CD324, так и SEZ6 (сплошная черная линия), сдвигались далее вправо относительно клеток, окрашивающихся положительно только в отношение SEZ6 (пунктирная черная линия), что указывает на то, что SEZ6 экспрессируется на CSC на намного более высоком уровне по сравнению с популяцией клеток NTG. Изотипический контроль общей популяции показан как область диаграммы, закрашенная серым цветом (MOPC = IgG1).
Для определения того, может ли экспрессия SEZ6 на клеточной поверхности коррелировать с повышенной способностью к образованию опухолей, осуществляли исследование онкогенности. Опухолевые образцы из NTX подвергали диссоциации и диспергировали в суспензию с применением методик ферментативного расщепления, принятых в данной области техники (см., например, патент США № 2007/0292414, включенный в настоящий документ). Клеточные диссоциированные препараты, полученные из этих линий из NTX, окрашивали антителами, конъюгированными с флуоресцентной меткой, которые специфично распознают мышиные CD45, H2kD, человеческий CD324 и человеческий SEZ6, клон SC17.42. Два подмножества клеток человека, оба идентифицированные на основании отсутствия окрашивания на мышиные CD45 или H2kD (для сокращения количества клеточных препаратов с мышиными клетками), выделяли при помощи проточного цитометра FACSAria™ (BD Biosciences). Одно подмножество выделяли на основании совместной экспрессии CD324 и SEZ6, тогда как другое подмножество выделяли на основании фенотипа CD324+SEZ6-. Субпопуляции, обогащенные различными маркерами, впоследствии трансплантировали в самок мышей с ослабленным иммунитетом NOD/SCID посредством подкожной инъекции в жировую подушку молочной железы при дозе приблизительно 50 клеток на мышь.
Фиг. 14A и 14B иллюстрируют результаты таких экспериментов, проводимых при помощи иллюстративных клеточных линий из NTX, происходящих из NSCLC опухолей, полученных от пациентов. Фиг. 14A представляет собой диаграмму рассеяния (селектируются с помощью CD324 и SEZ6), показывающую распределение mCD45-H2kD- подмножества исходных опухолевых и отсортированных прогнозируемых онкогенных клеток. На фиг. 14B в графическом виде показан измеренный объем опухоли, возникшей в результате имплантации отсортированных субпопуляций клеток в мышей с ослабленным иммунитетом. Значения в скобках указывают число развившихся опухолей на мышь с проведенной имплантацией.
Особенно важно, что данные из фиг. 14 показывают, что онкогенность была неизменно ассоциирована с субпопуляцией клеток, экспрессирующих SEZ6 в комбинации с высокими уровнями CD324. Напротив, эти же самые данные демонстрируют, что опухолевые клетки, либо не экспрессирующие SEZ6, либо экспрессирующие его на низком уровне, были намного менее онкогенными, чем их аналоги с высоким уровнем экспрессии или положительные. На основании сгенерированных было неожиданно обнаружено, что субпопуляции опухолевых клеток, экспрессирующие фенотип CD324+SEZ6+, как правило, содержат очень большую часть онкогенных способностей, и делается предположение, что SEZ6 может обеспечивать эффективную терапевтическую модель для модуляции опухолеродных клеток.
Пример 14
Модуляторы SEZ6 облегчают доставку цитотоксических средств в HEK-293T клетки, экспрессирующие SEZ6
Для демонстрации того, что SEZ6 модуляторы по настоящему изобретению способны опосредовать доставку цитотоксического средства живым клеткам, выполняли in vitro анализ уничтожения клеток с применением выбранных модуляторов на основе антитела против SEZ6, связанных с токсином сапорином. Сапорин уничтожает клетки посредством нарушения работы рибосом в цитоплазме. Таким образом, клеточная смерть при помощи следующего анализа указывает на то, что антитела против SEZ6 способны к интернализации и доставке цитотоксических средств в цитоплазму целевой клетки.
Fab-фрагмент антитела против IgG мыши, ковалентно связанный с сапорином (“Fab-сапорин”) (Advanced Targeting Systems, #IT-48), комбинировали с немеченными антителами к SEZ6 и инкубировали с клетками HEK-293T, экспрессирующими SEZ6 человека (см. пример 5). Способность полученных комплексов сапорина к интернализации и уничтожению клеток измеряли через 72 часа посредством измерения жизнеспособности клеток.
А именно, 500 клеток на лунку в DMEM, дополненной 10% фетальной бычьей сыворотки, высевали в 96-луночные планшеты, обработанные для выращивания тканевых культур, за один день перед добавлением антител и токсина. Клетки HEK-293T, экспрессирующие SEZ6 человека, обрабатывали контролем (IgG1, IgG2a или IgG2b) или очищенными мышиными SEZ6 модуляторами при концентрации 100, 50 или 10 пМ, вместе с 2 нМ Fab-сапорина. Клетки культивировали в течение трех дней, после чего определяли путем подсчета количества жизнеспособных клеток при помощи Cell Titer Glo® (Promega) согласно инструкциям производителя. Грубые единицы люминесценции (RLU), полученные с применением культур, содержащих клетки с сапорином, конъюгированным с Fab-фрагментом, принимали за 100% эталонные значения, и все другие показатели (называемые нормализованными RLU или “% живых клеток”) рассчитывали соответствующим образом. На фиг. 15A показано, что многие из протестированных SEZ6 модуляторов опосредовали киллинг клеток HEK-293T зависимым от концентрации образом. Изотипические контроли (IgG2a, IgG2b и IgG1) не влияли на количество клеток, как показывают результаты в первых трех рядах фиг. 15A (ND = не определено).
Этот анализ демонстрирует, что интернализация может происходить после связывания SEZ6-специфичного антитела с клеточной поверхностью, без необходимости в дополнительном сшивании или димеризации.
Пример 15
SEZ6 модуляторы опосредуют цитотоксичность у клеток опухоли легкого in vitro
Для подтверждения результатов примера 14 и определения того, могут ли SEZ6 модуляторы опосредовать интернализацию токсина и цитолиз опухолевых клеток человека (в отличие от сконструированных клеток) клетки из NTX, истощенные по мышиным линиям, высевали и впоследствии подвергали воздействию антител против SEZ6 и Fab-сапорина.
Опухоли из NTX подвергали диссоциации в суспензию отдельных клеток и высевали на планшеты Primaria™ (BD Biosciences) в дополненную фактором роста бессывороточную среду, известную в области техники. После культивирования клеток в течение одного дня при 37°C/5%CO2/5%O2 их обрабатывали контролем (IgG1, IgG2a или IgG2b) или мышиным SEZ6 модулятором и Fab-сапорином, как описано в примере 14. Через семь дней сапориновую цитотоксичность, опосредованную модулятором, оценивали путем количественного определения оставшихся живых клеток с применением Cell Titer Glo.
Как видно из фиг. 15B снижение количества опухолевых клеток было очевидным, когда LU37, опухоль NSCLC, и LU80, опухоль SCLC, подвергали воздействию SEZ6 модуляторов SC17.6 (дублирующего SC17.16) и SC17.33. Аналогичным образом, когда LU100, опухоль SCLC, подвергали воздействию четырех SEZ6 модуляторов, SC17.6, SC17.19, SC17.33 и SC17.34, из расчета 50 и 500 пМ происходило снижение числа опухолевых клеток. В отличие от этого, изотипические контрольные антитела не влияли на число живых клеток после обработки.
Эти данные демонстрируют не только то, что типичные антитела, описанные в настоящем документе, способны связывать антиген SEZ6 на клеточной поверхности и облегчать доставку цитотоксической нагрузки, что приводит к клеточной гибели, но приведенные выше данные также демонстрируют, что несколько антител против SEZ6 могут опосредовать киллинг опухолевых клеток из различных NTX.
Пример 16
Получение конъюгатов антитела против SEZ6 и лекарственного средства
На основании in vitro киллинг-анализов с сапорином в примерах 14 и 15 и для дополнительной демонстрации универсальности настоящего изобретения получали конъюгаты антитела против SEZ6 и лекарственного средства, имеющие структуру M-[L-D], описанную выше. Другими словами, получали конъюгаты антитела против SEZ6 и лекарственного средства (SEZ6-ADC) с применением ковалентно связанных цитотоксических средств. Более конкретно, получали SEZ6-ADC, содержащие линкер, описанный в данном документе или в литературных источниках, приведенных непосредственно ниже, и выбранные димеры пирролобензодиазепина (PBD), которые были ковалентно присоединены к раскрытым модуляторам (см., например, патенты США №№ 2011/0256157 и 2012/0078028 и патент США № 6214345, каждый из которых включен в данный документ посредством ссылки во всей своей полноте).
Комбинации лекарственного средства PBD и линкера синтезировали и очищали при помощи принятых в данной области техники методик с учетом цитируемых литературных источников. Хотя для создания выбранных комбинаций лекарственного средства и линкера использовали различные димеры PBD и линкеры, каждая линкерная группа содержала концевой малеимидо-фрагмент со свободным сульфгидрилом. При помощи этих линкеров получали конъюгаты путем частичного восстановления mAb с помощью трис-(2-карбоксиэтил)-фосфина (TCEP) с последующей реакцией восстановленных Cys-остатков с нагрузкой с линкером, имеющим малеимидо-фрагмент.
Более конкретно, выбранный модулятор на основе антитела против SEZ6 восстанавливали при помощи 1,3 моль TCEP на моль mAb в течение 2 ч. при 37°C в 25 мМ Tris-HCl, pH 7,5, и 5 мМ буфера на основе EDTA. Реакционной смеси позволяли охладиться до 15°C, и добавляли нагрузку с линкером в DMSO в соотношении 2,7 моль/моль mAb с последующим добавлением дополнительного количества DMSO до конечной концентрации 6% (об./об.). Реакции позволяли протекать в течение 1 часа. Непрореагировавший комплекс лекарственное средство-линкер кэпировали путем добавления избытка N-ацетилцистеина. SEZ6-ADC (или SC17-ADC) затем очищали на ионообменной колонке с применением системы AKTA Explorer FPLC (G.E. Healthcare) для удаления агрегированного высокомолекулярного антитела, сорастворителя и малых молекул. Буфер для элюированного ADC затем заменяли путем тангенциальной поточной фильтрации (TFF) на буферную смесь с последующими корректировкой концентрации и добавлением моющего средства. Конечный ADC анализировали в отношении концентрации белка (путем измерения поглощения УФ-излучения), агрегации (SEC), соотношения лекарственного средства и антитела (DAR) путем обращенно-фазовой (RP) HPLC, присутствие неконъюгированного антитела путем HPLC по типу хроматографии гидрофобных взаимодействий (HIC), наличия небелковых материалов путем RP HPLC и in vitro цитотоксичности с применением линии клеток, экспрессирующих SEZ6.
Применяя вышеупомянутую процедуру или по существу аналогичную методику, создавали и тестировали в различных in vivo и in vitro моделях ряд ADC (т.е. M-[L-D]n), содержащих различные модуляторы SEZ6 и димеры PBD. Применительно к этим примерам и настоящему раскрытию такие ADC можно обычно называть SEZ6-ADC или SC17-ADC. Отдельные ADC будут называться в соответствии с обозначением антитела (например, SC17.17) и конкретного комплекса линкер-цитотоксическое средство - ADC1, ADC2 и т.д. Таким образом, иллюстративные модуляторы, совместимые с настоящим изобретением, могут включать SC17.17-ADC1 или SC17.24-ADC2, где ADC1 и ADC2 представляют отдельные цитотоксические средства в виде димеров PBD (и необязательно линкер).
В качестве исходной точки, in vitro цитотоксичность hSC17.17-ADC1 измеряли при IC50, равном 11 нМ, при воздействии на клетки HEK293, сверхэкспрессирующие SEZ6 (данные не показаны).
Пример 17
Конъюгированные SEZ6 модуляторы опосредуют цитотоксичность в клетках опухоли легкого in vitro
ADC, полученные в примере 16 выше, тестировали для определения того, способны ли они опосредовать интернализацию токсина и цитолиз первичных опухолевых клеток человека in vitro.
Опухолевые клетки из NTX, истощенные по мышиным линиям, подвергали воздействию ADC к SEZ6 или мышиного изотипического контроля (msIgG1) с применением такого же способа, как описано в примере 15, за исключением того, что Fab-сапорин не добавляли. Когда LU64, опухоль SCLC, и OV26, опухоль яичника NET, обрабатывали ADC к SEZ6 (SC17.24-ADC2, SC17.28-ADC2 и SC17.34-ADC2), наблюдали усиленное снижение процента жизнеспособных клеток по сравнению с контролем msIgG1 (ФИГ 17A). Хотя msIgG1 может быть цитотоксическим для клеток при высоких концентрациях, все три протестированных ADC к SEZ6 были более сильными, что указывает на иммуноспецифичный ответ на SEZ6, а не общий ответ на цитотоксин PBD.
Пример 18
Конъюгированные SEZ6 модуляторы подавляют рост опухоли In vivo
ADC, полученные в примере 16 выше, тестировали для демонстрации их способности к сморщиванию и подавлению роста опухоли человека из NTX у иммунодефицитных мышей.
Опухоли из NTX, происходящие от пациента, выращивали подкожно в боках самок реципиентных мышей NOD/SCID при помощи принятых в данной области техники методик. Объем опухоли и массу мышей регистрировали дважды в неделю. Когда объем опухоли достигал 150-250 мм3, мышей случайно распределяли по группам обработки и инъецировали внутрибрюшинно SC17-ADC1 или антигаптеновый контроль MsIgG1-ADC1. Мышам вводили три инъекции из расчета 1 мкг/кг (обозначены вертикальными линиями на фиг. 17B и фиг. 18A и 18B) за период семь дней. После лечения объем опухоли и массу мышей отслеживали до тех пор, пока опухоли не превышали 800 мм3 или мыши не становились больными.
На фиг. 17B показано, что ADC к SEZ6 способны ингибировать in vivo рост опухоли SCLC (LU86) и LCNEC (LU50) у мышей. В случае LU86 пять протестированных ADC (SC17.3-ADC1, SC17.24-ADC1, SC17.26-ADC1, SC17.28-ADC1 и SC17.34-ADC1) приводили к длительным ремиссиям, длящимся, в некоторых случаях, свыше 120 дней после обработки. В частности, обработка с помощью SC17.34-ADC1 ингибировала рост опухоли в течение всего периода проведения данного исследования при этой дозе, тогда как SC17.24-ADC1 приводило к значительному ингибированию роста опухоли, при этом время до прогрессирования составляло более 50 дней. Аналогичным образом, обработка LU50 с помощью пяти иллюстративных ADC (SC17.3-ADC1, SC17.17-ADC1, SC17.24-ADC1, SC17.34-ADC1 и SC17.46-ADC1) приводила к подавлению роста опухоли, длящемуся до 35 дней в случае SC17.46. Более того, у мышей, обработанных SC17-ADC1, не проявлялись неблагоприятные воздействия на здоровье, кроме типично наблюдаемых у имммунодефицитных, опухоленесущих мышей NOD/SCID. Эти результаты позволяют предположить, что раскрытые ADC могут быть использованы для эффективного подавления роста опухоли и что характерные особенности связывания модулятора SC17 могут оказывать влияние на эффективность in vivo.
Более определенно, способность ряда конъюгированных модуляторов значительно замедлять или подавлять рост опухоли in vivo в течение продолжительных периодов дополнительно подтверждает применение SEZ6 в качестве терапевтической цели для лечения пролиферативных расстройств.
Пример 19
Гуманизированные конъюгированные SEZ6 модуляторы подавляют рост опухоли In vivo
С учетом поразительных результатов, полученных с помощью модуляторов на основе мышиных ADC к SEZ6, проводили дополнительные эксперименты для демонстрации эффективности иллюстративных гуманизированных модуляторов на основе ADC к SEZ6 при лечении опухолей SCLC in vivo. Выбранные гуманизированные ADC к SEZ6 (с применением модуляторов hSC17.17, hSC17.24, hSC17.34 и hSC17.46), полученные как изложено в примере 16, и изотипический контрольный ADC с человеческим IgG1 (huIgG1) вводили иммунодефицитным мышам, несущим различные опухоли из NTX. Режим дозировки был таким же, как обозначенный в примере 18.
Результаты этих экспериментов представлены на фиг. 18A и 18B. Полного и долговременного устранения опухолевой массы достигали путем введения гуманизированных ADC к SEZ6 в четырех опухолях SCLC. На фиг. 18A показано уменьшение опухоли LU80 с помощью hSC17.17-ADC1 и hSC17.46-ADC1 и устранение опухоли LU64 с помощью hSC17.17-ADC1, hSC17.34-ADC1 и hSC17.46-ADC1. На фиг. 18B показано уменьшение опухоли LU117 с помощью hSC17.17-ADC1 и hSC17.46-ADC1 и устранение опухоли LU111 с помощью hSC17.34-ADC1 и hSC17.46-ADC1. Отсутствие повторного появления опухоли наблюдали в течение более 50 дней в 3 из 4 этих исследований. В каждом исследовании объем опухолей и массу мышей у контрольных животных регистрировали до тех пор, пока опухоли не превышали 800 мм3 или мыши не становились больными.
Эти результаты демонстрируют неожиданную применимость ряда гуманизированных SEZ6 модуляторов для эффективного замедления роста различных опухолей.
Специалисты в данной области также будут понимать, что настоящее изобретение может быть воплощено в других специальных формах без отступления от его духа и главных особенностей. Поскольку изложенное выше описание настоящего изобретения раскрывает только его типичные варианты осуществления, следует понимать, что, как предполагается, другие варианты находятся в пределах объема настоящего изобретения. Следовательно, настоящее изобретение не ограничивается конкретными вариантами осуществления, которые были описаны подробно в настоящем документе. Правильнее ссылаться на прилагаемую формулу изобретения, указывающую на объем и содержание настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНЪЮГАТ АНТИТЕЛО ПРОТИВ MUC1-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2019 |
|
RU2804703C2 |
| СПОСОБЫ И АНТИТЕЛА ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2016 |
|
RU2757489C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ВНЕКЛЕТОЧНЫМ ДОМЕНОМ ТИРОЗИНКИНАЗНОГО РЕЦЕПТОРА (ALK) | 2007 |
|
RU2460540C2 |
| ДИАГНОСТИКА И ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛА ПРОТИВ EREG | 2007 |
|
RU2537245C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2012 |
|
RU2641260C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕНСПЕЦИФИЧЕСКОГО РЕЦЕПТОРА НА ОСНОВЕ ГУМАНИЗИРОВАННОГО АНТИТЕЛА ПРОТИВ EGFRvIII | 2014 |
|
RU2708032C2 |
| АНТИТЕЛА ПРОТИВ РЕЦЕПТОРА ФОЛИЕВОЙ КИСЛОТЫ 1, ИХ ИММУНОКОНЪЮГАТЫ И ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2610663C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ГУМАНИЗИРОВАННОГО АНТИ-CD19 ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА | 2014 |
|
RU2711975C2 |
| АНТИ-ТАТ226 АНТИТЕЛА И ИММУНОКОНЪЮГАТЫ | 2007 |
|
RU2448980C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ РАКА | 2013 |
|
RU2633505C2 |







































































































































































































































































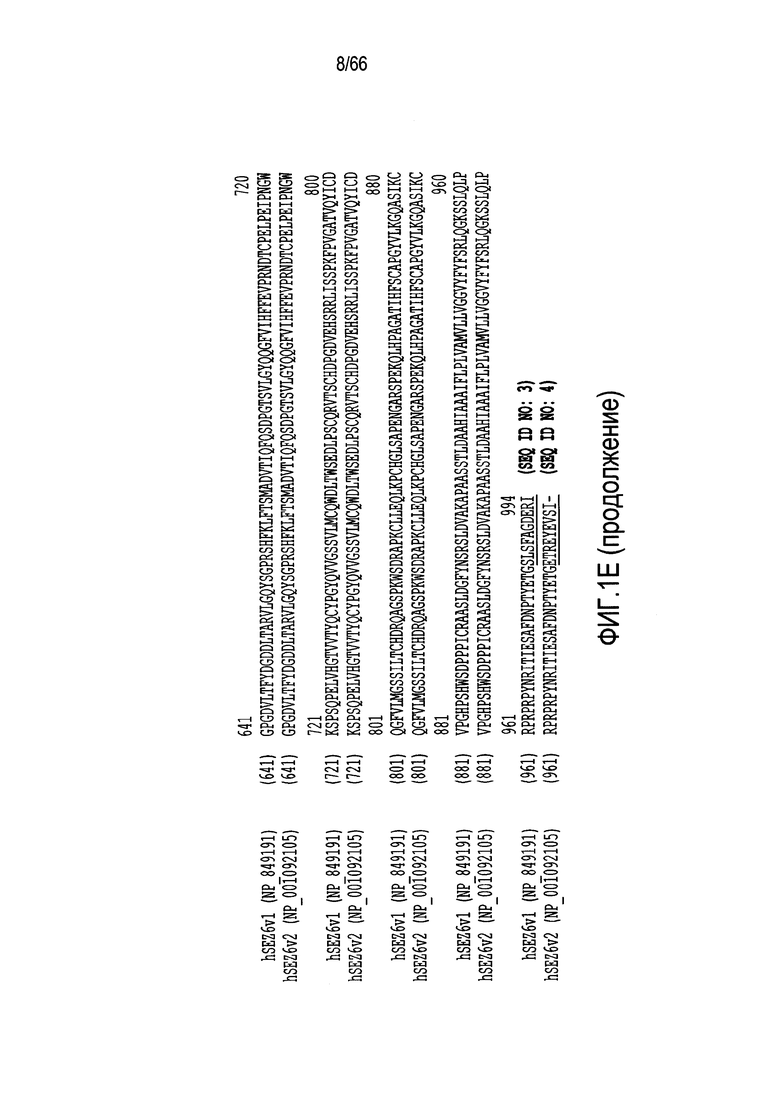
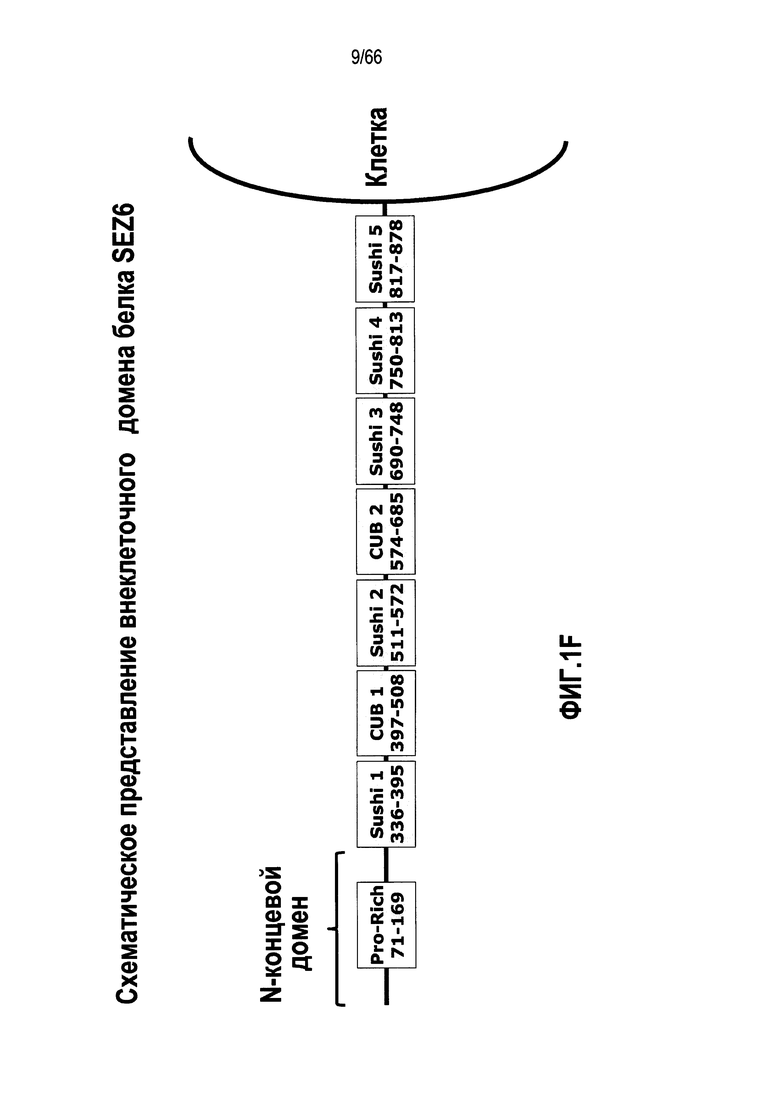

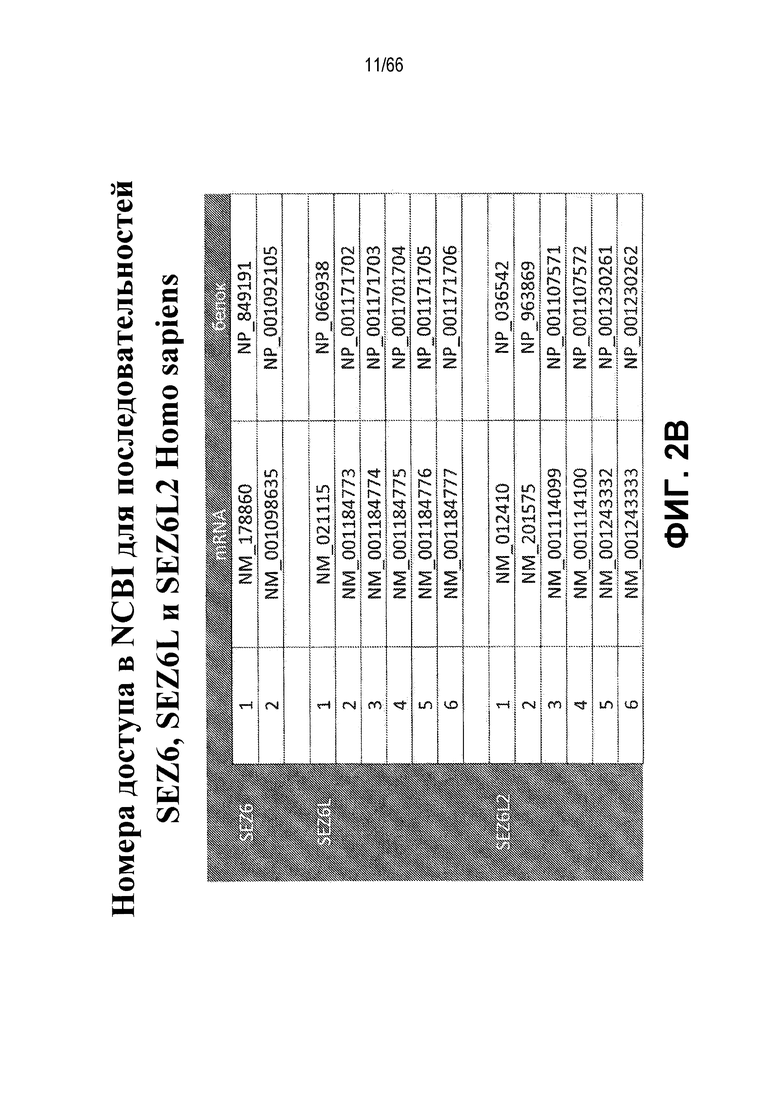
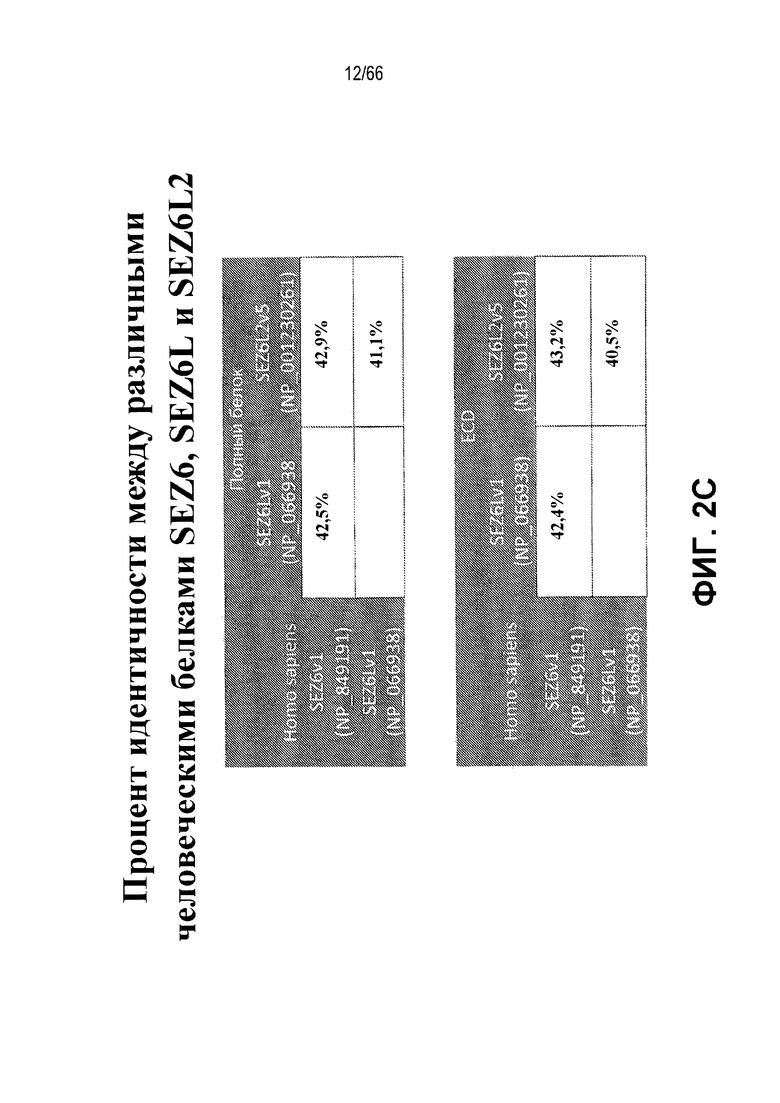
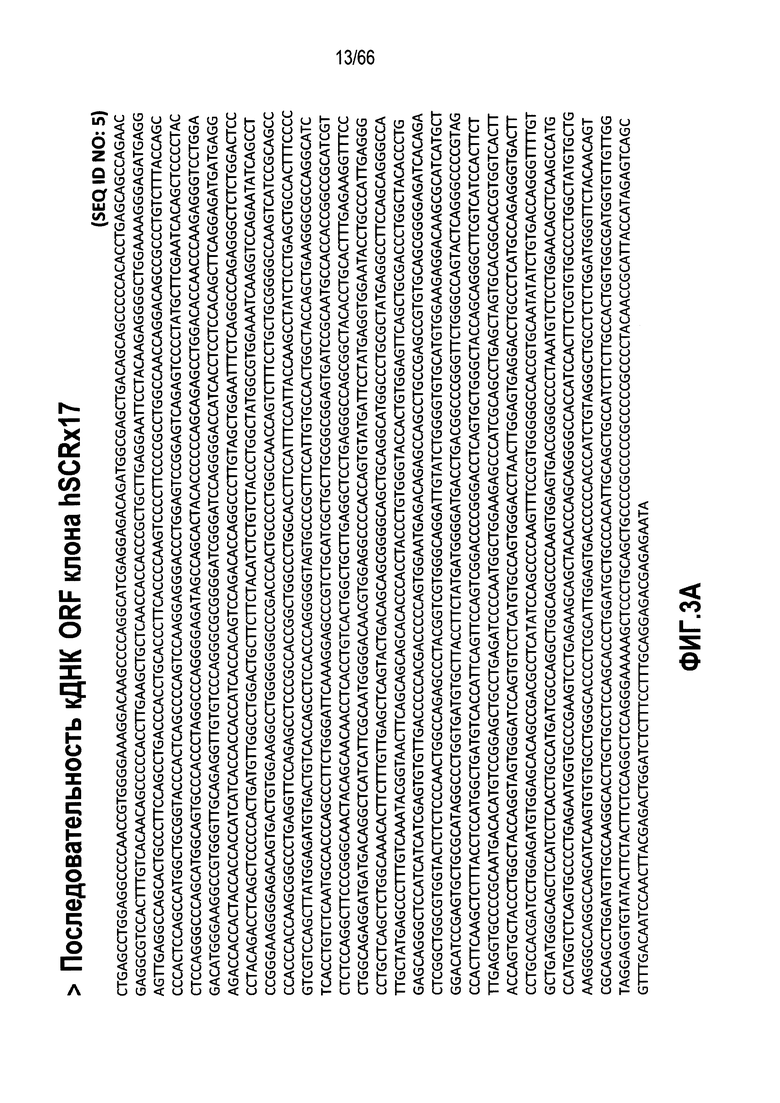














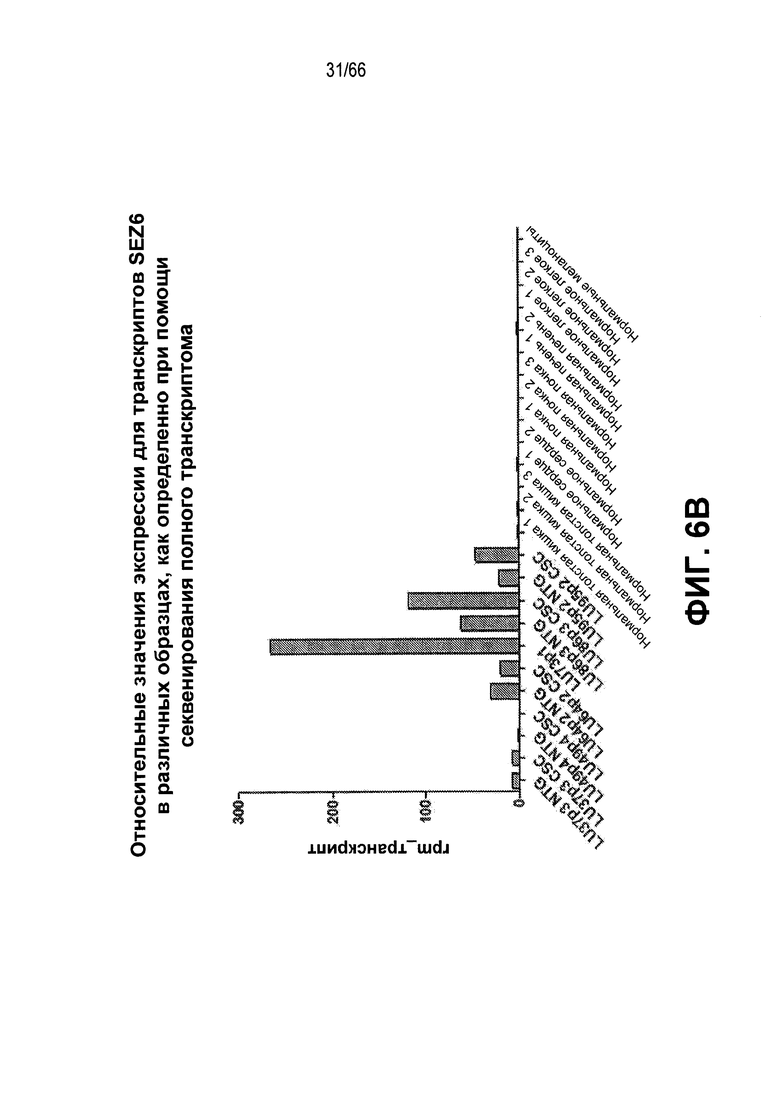
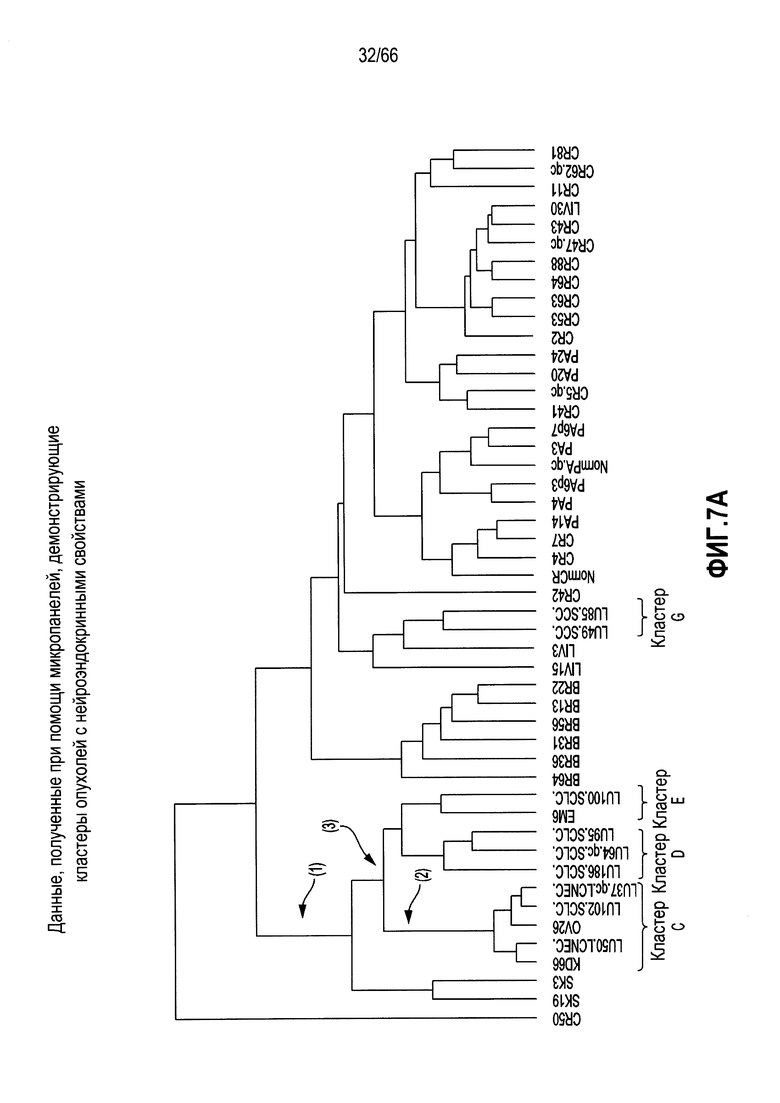


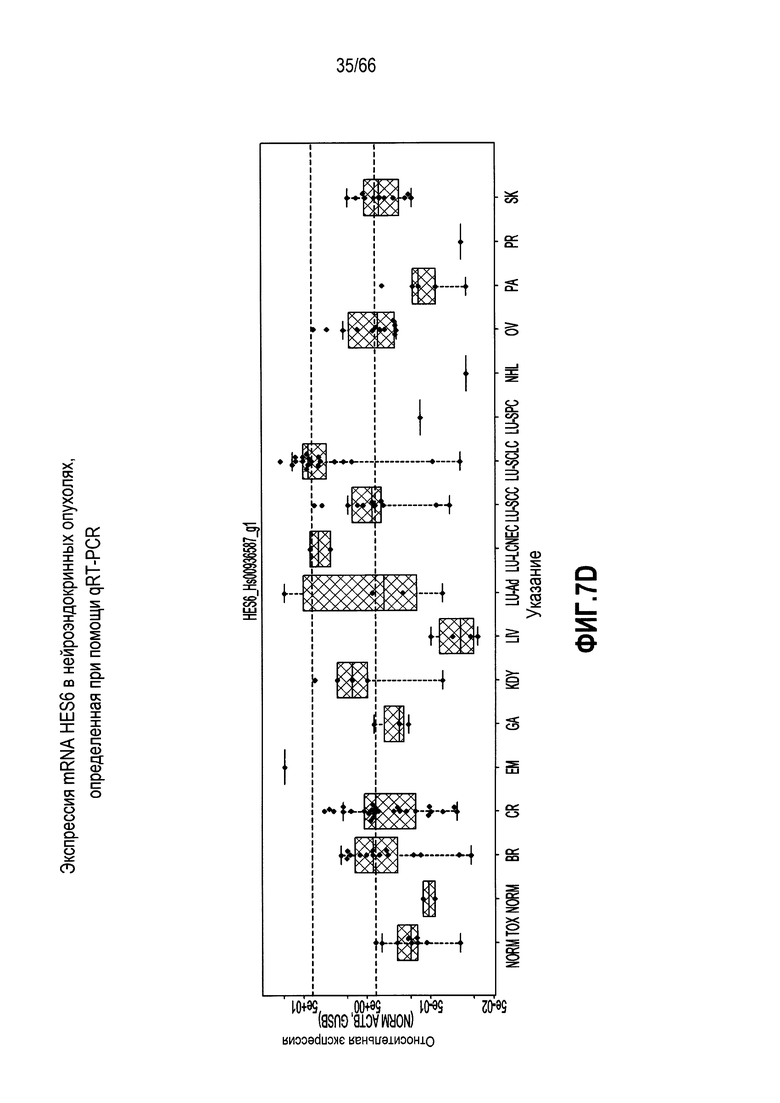
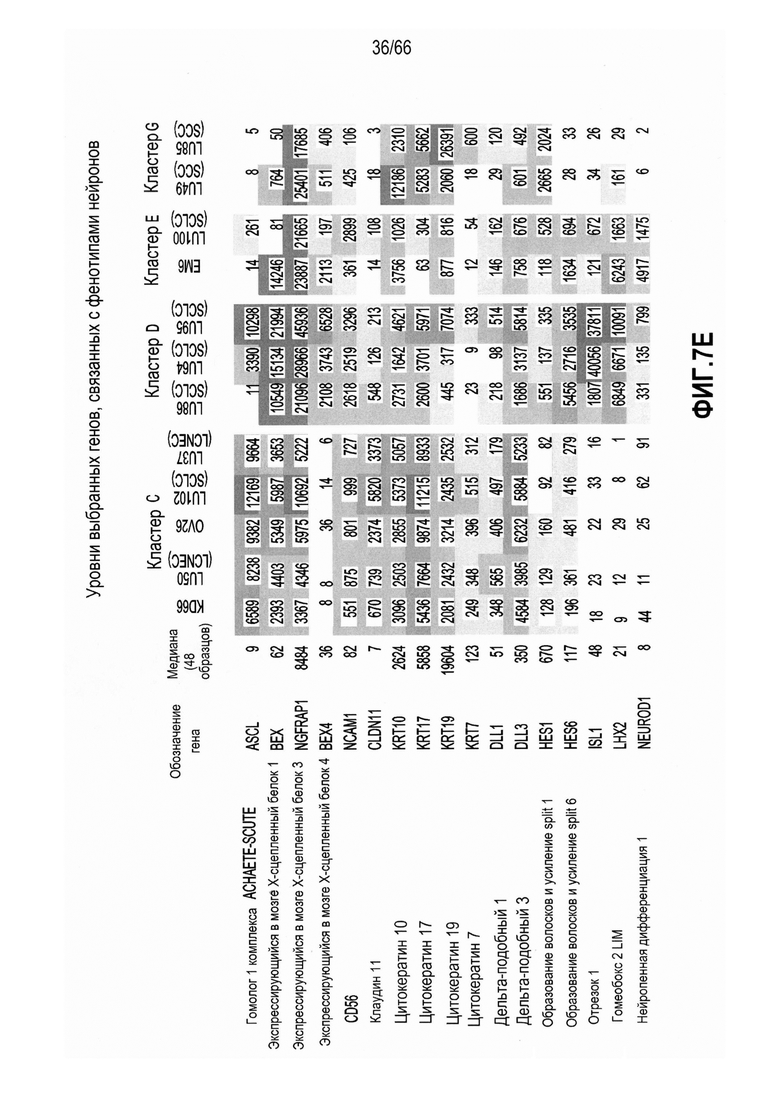
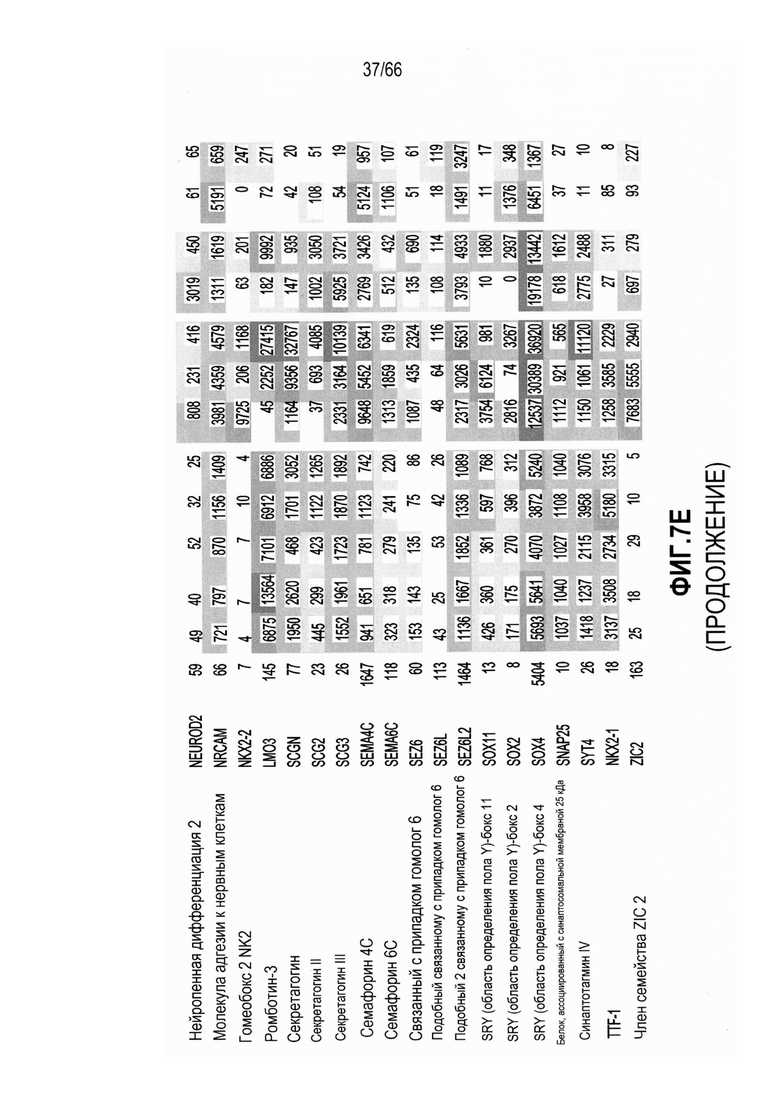
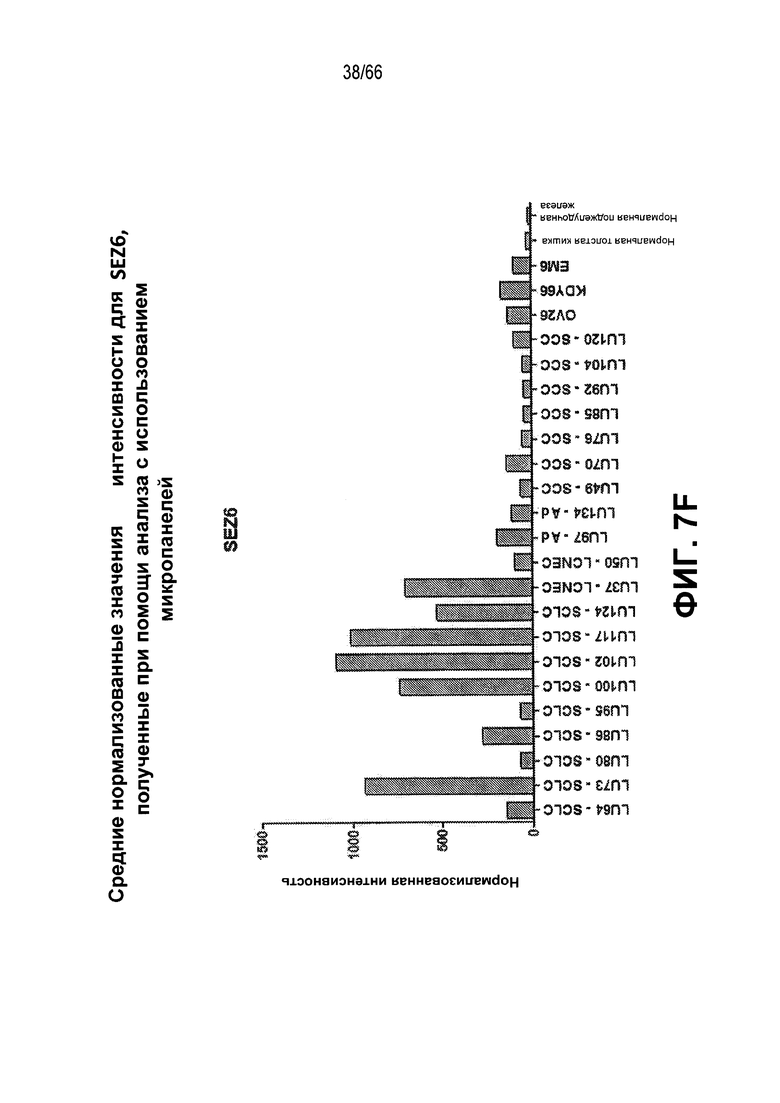
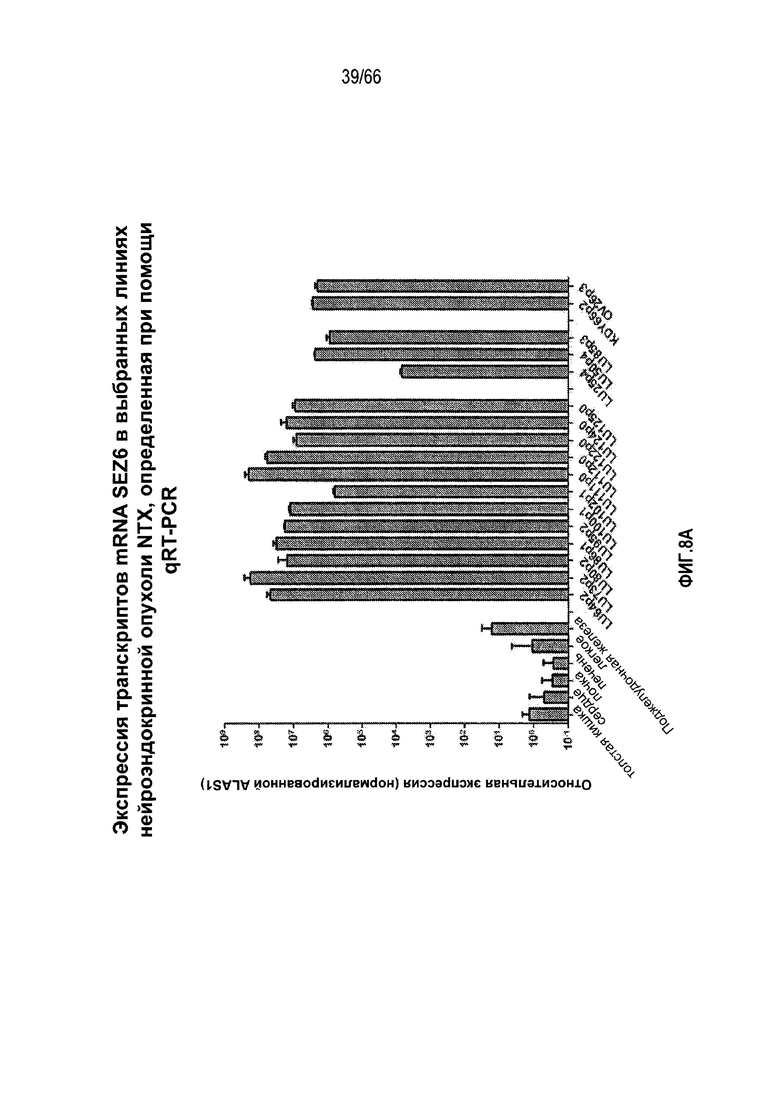
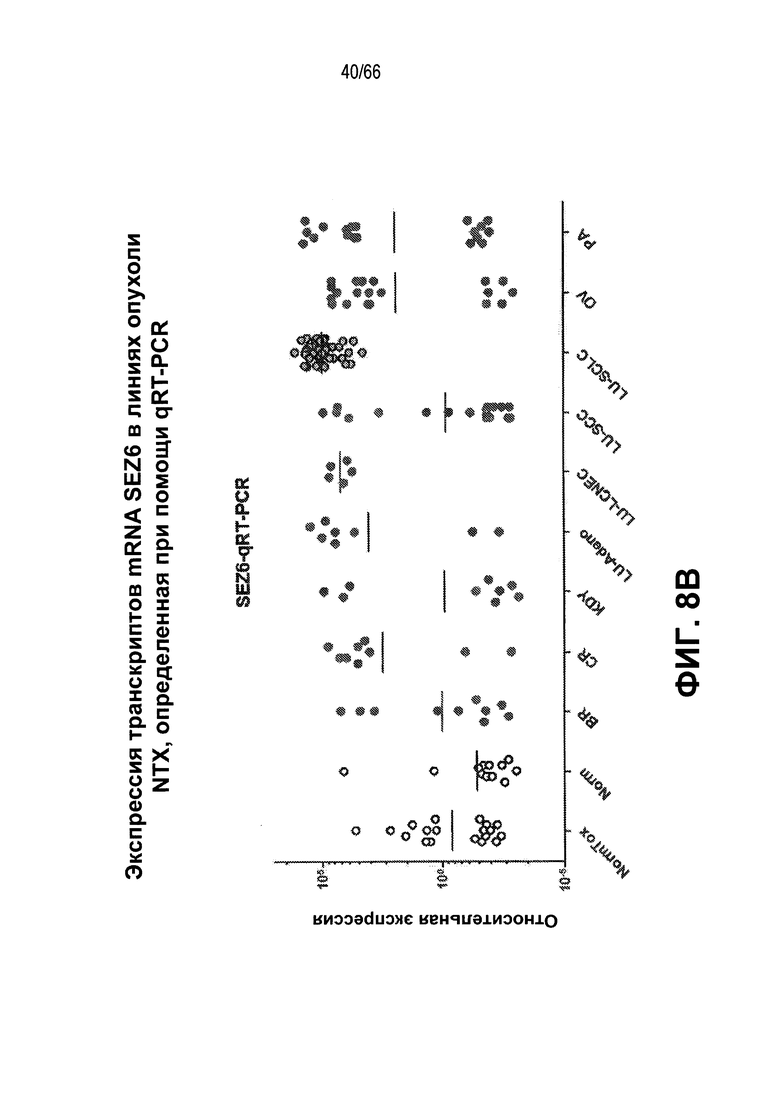
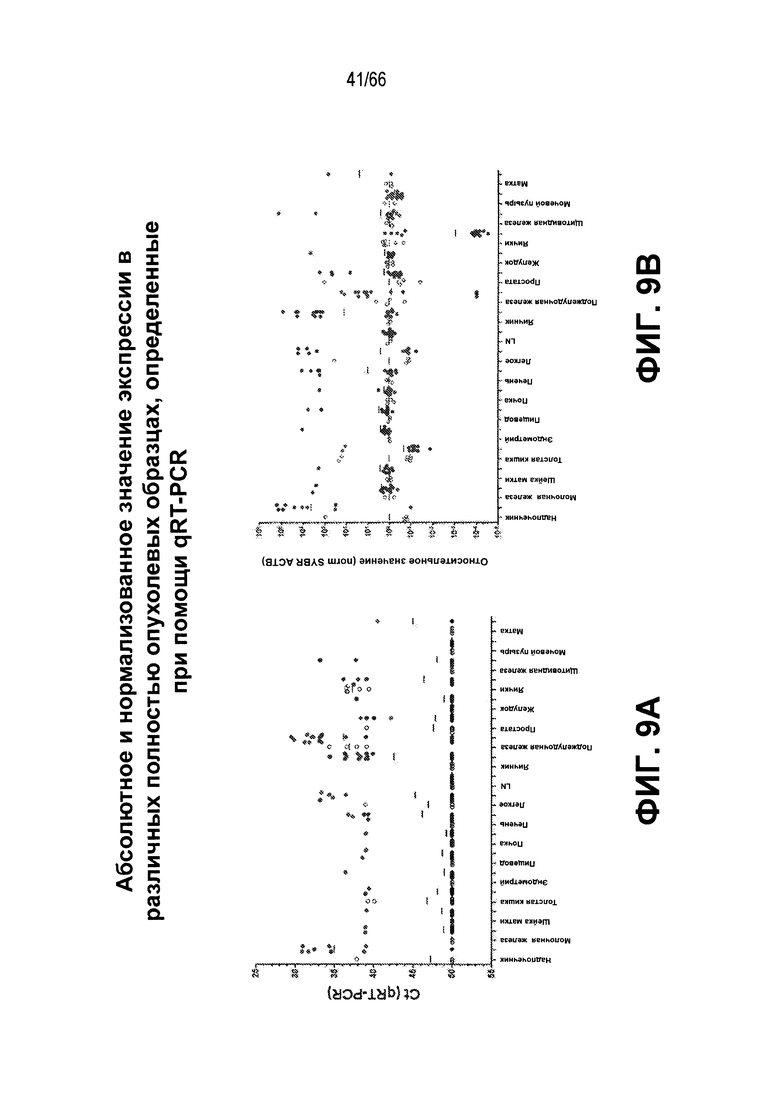
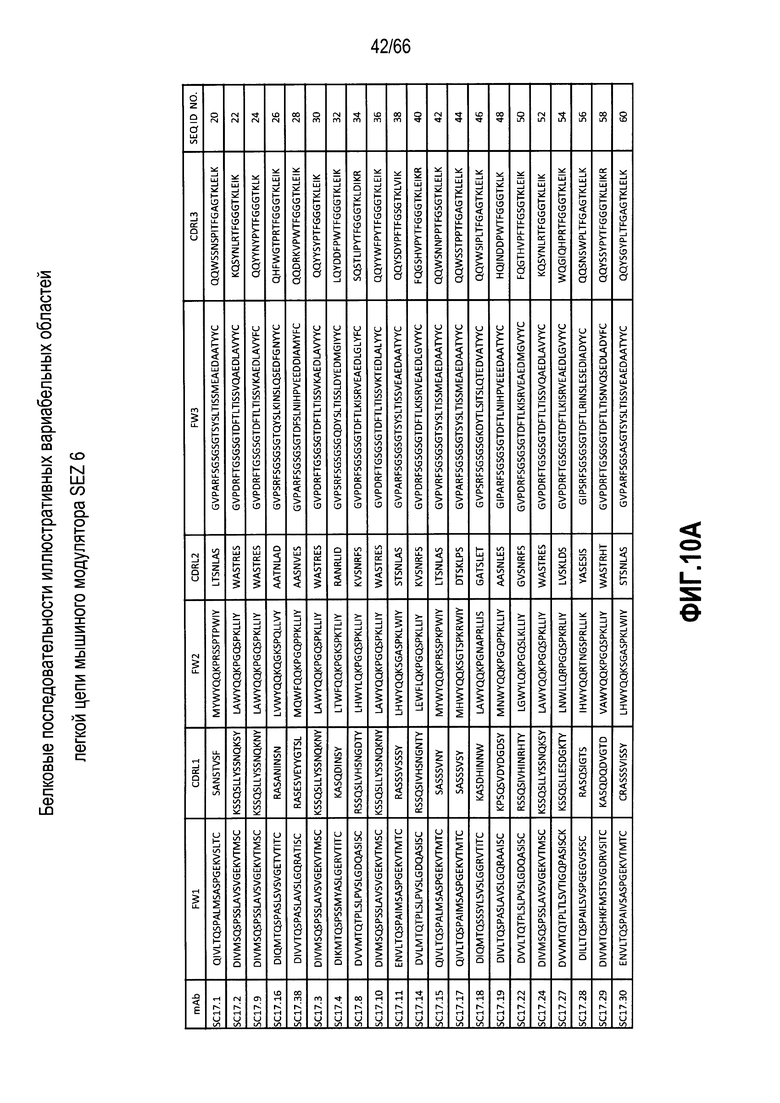
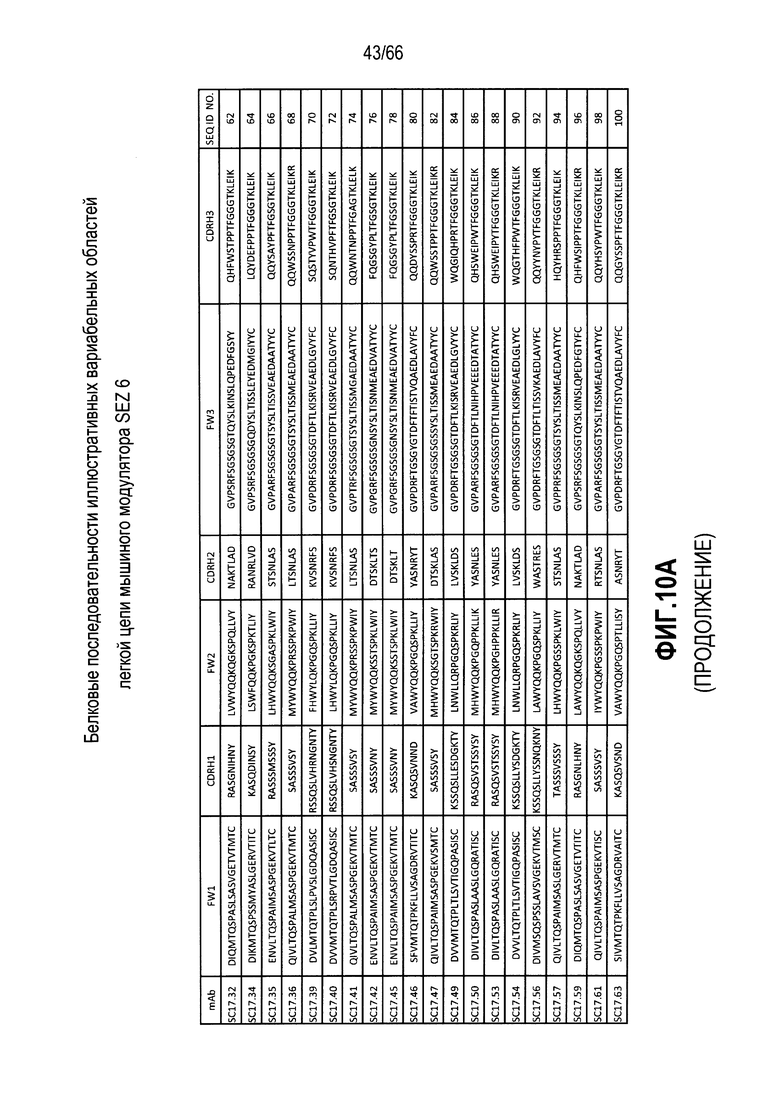
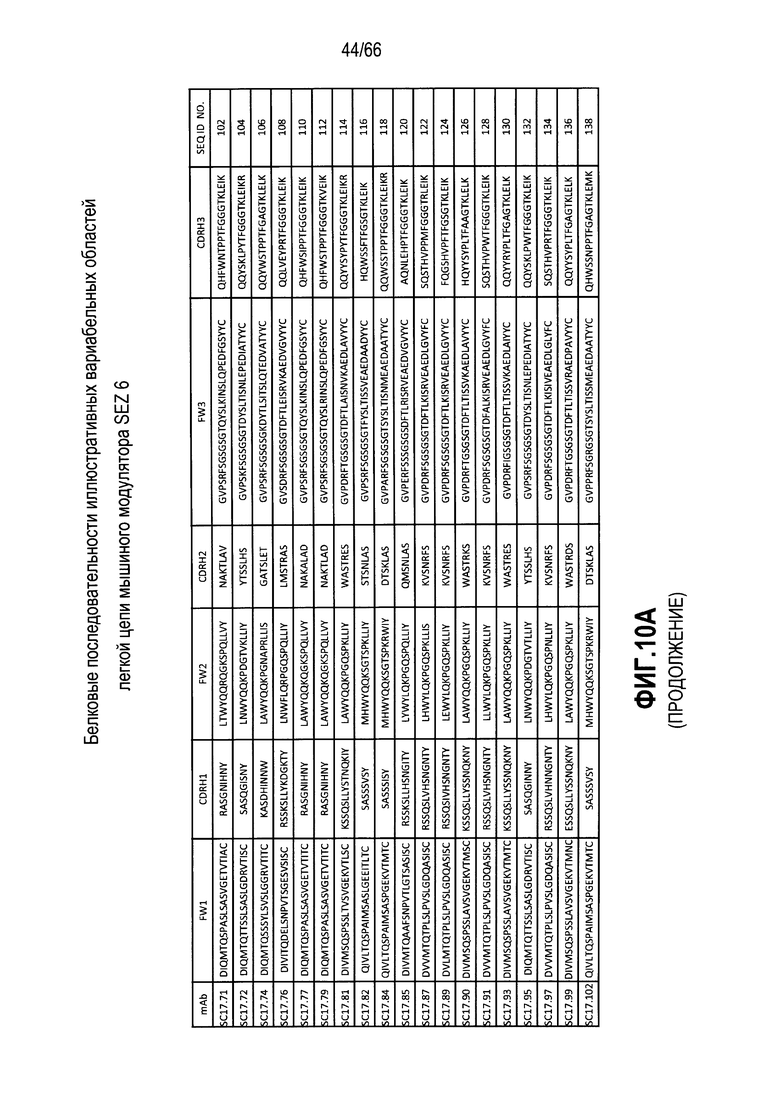
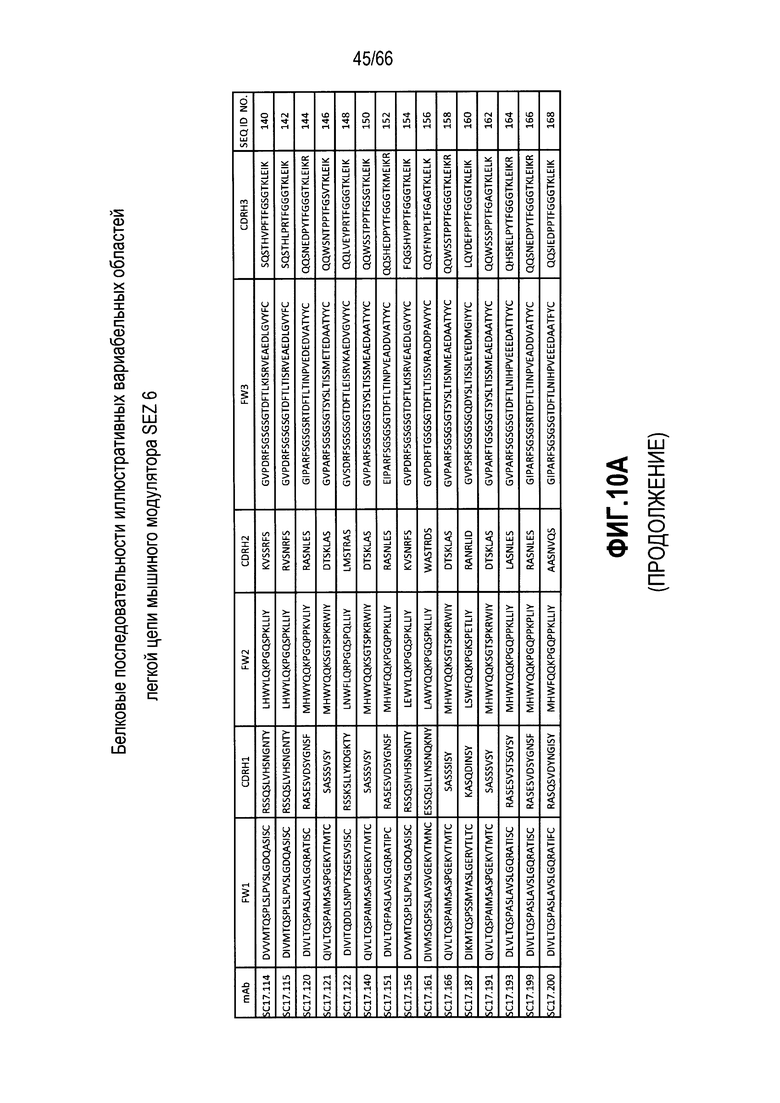
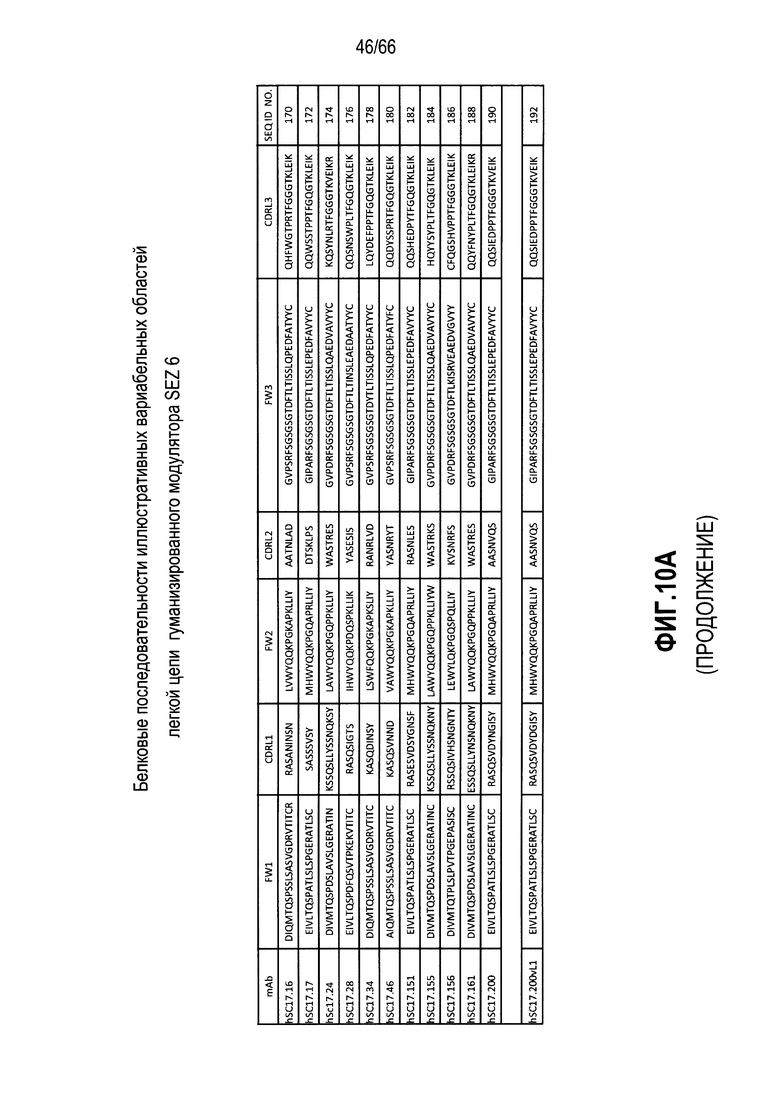



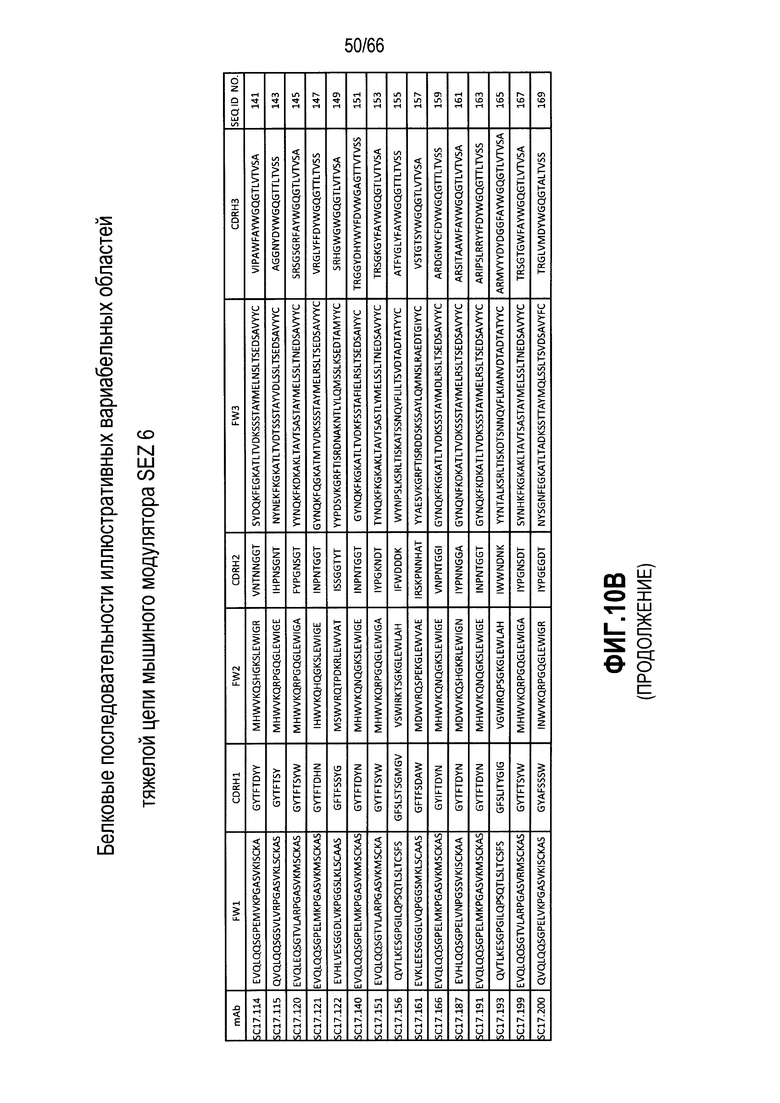
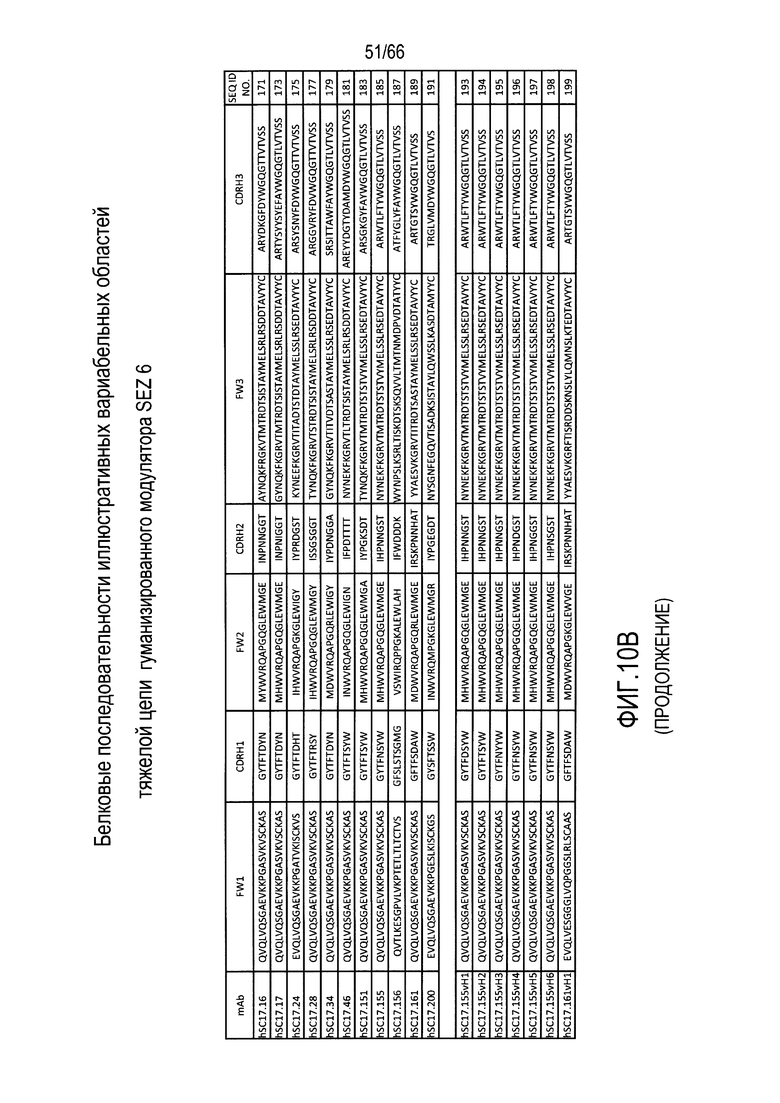
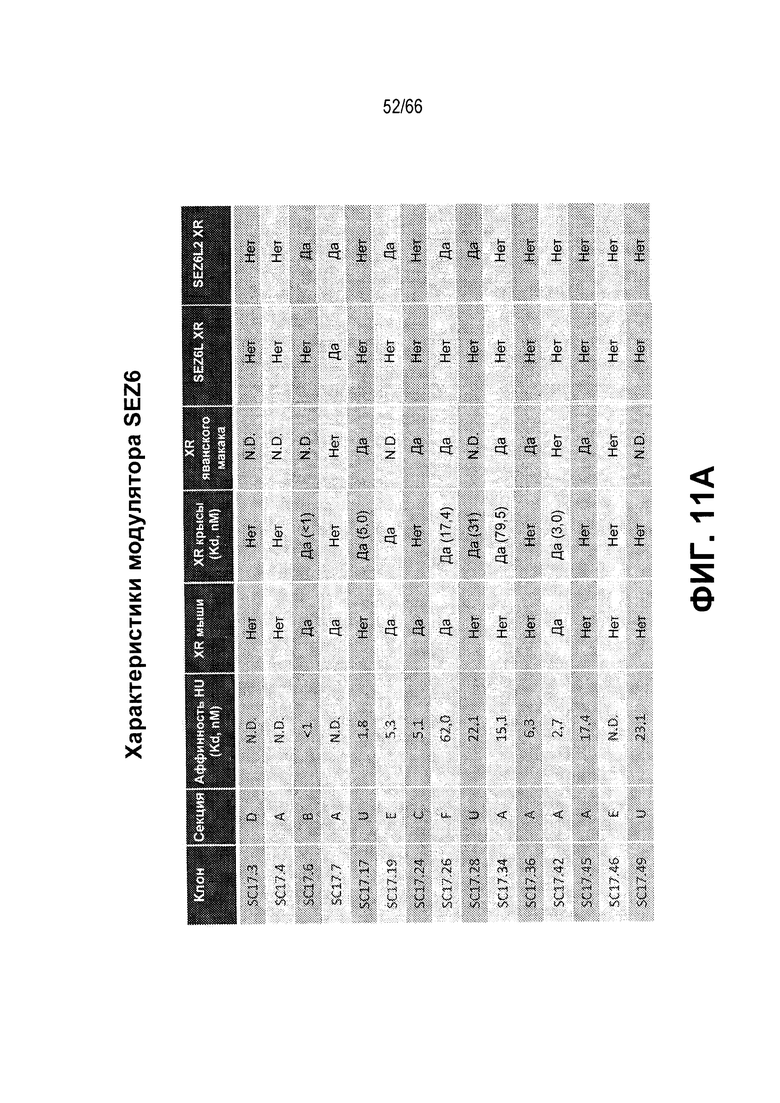
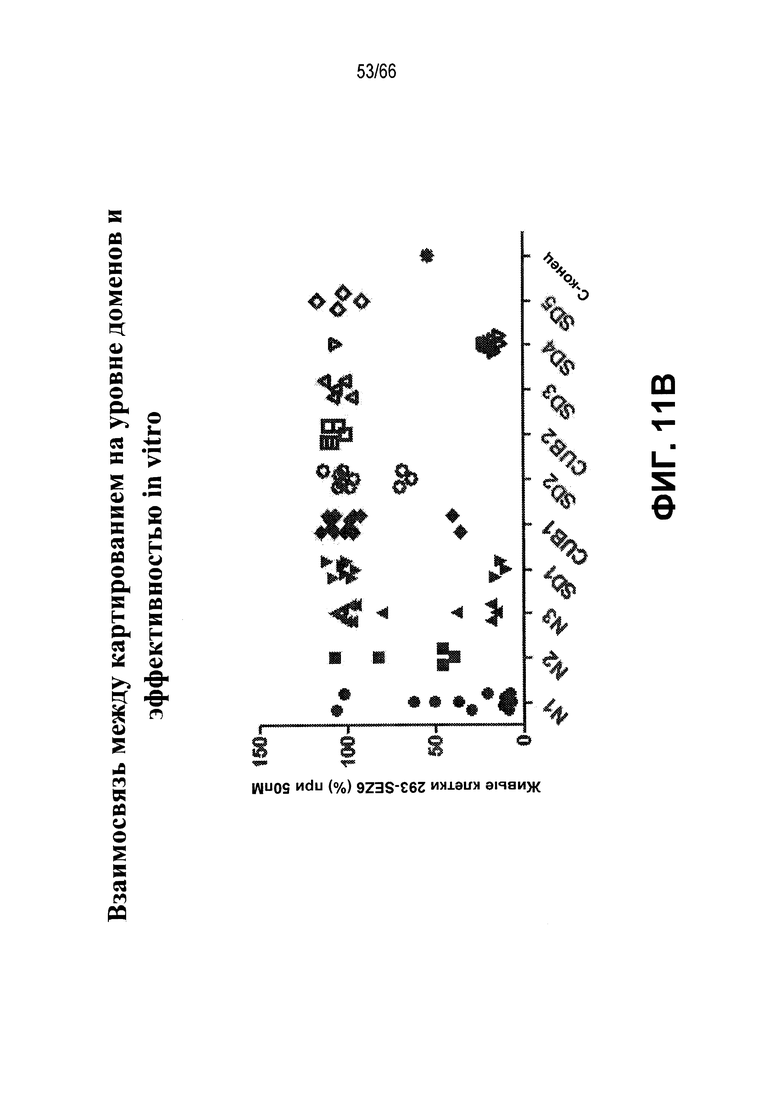
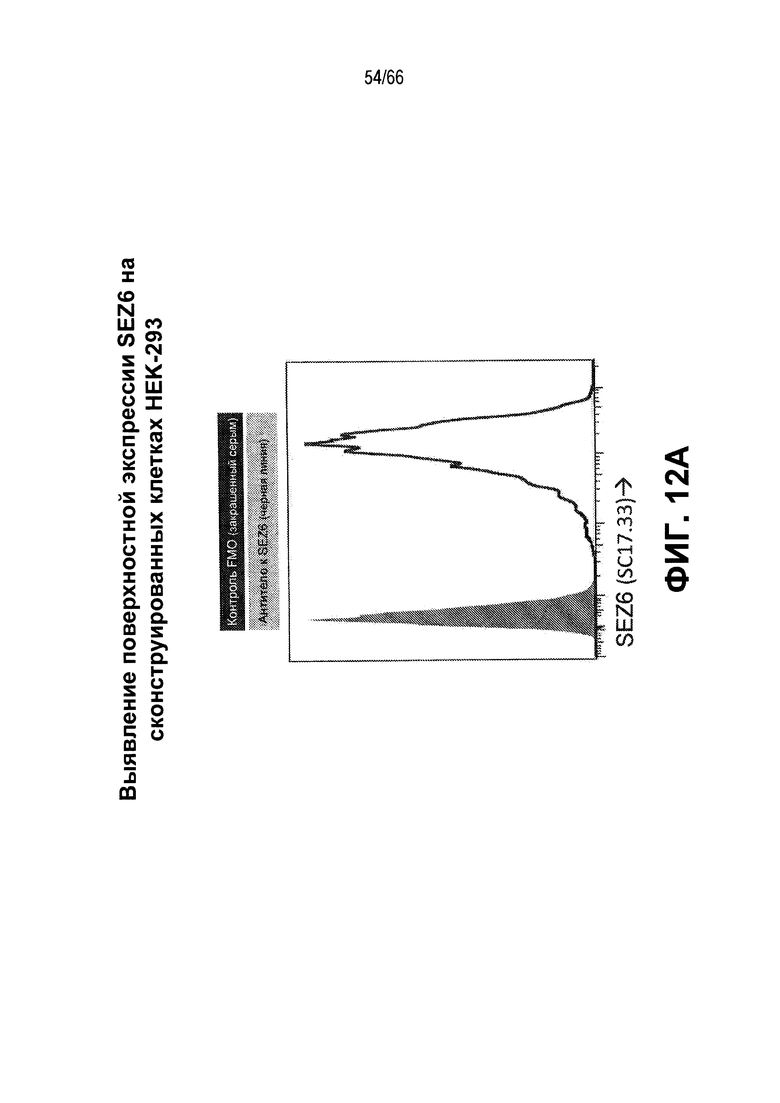
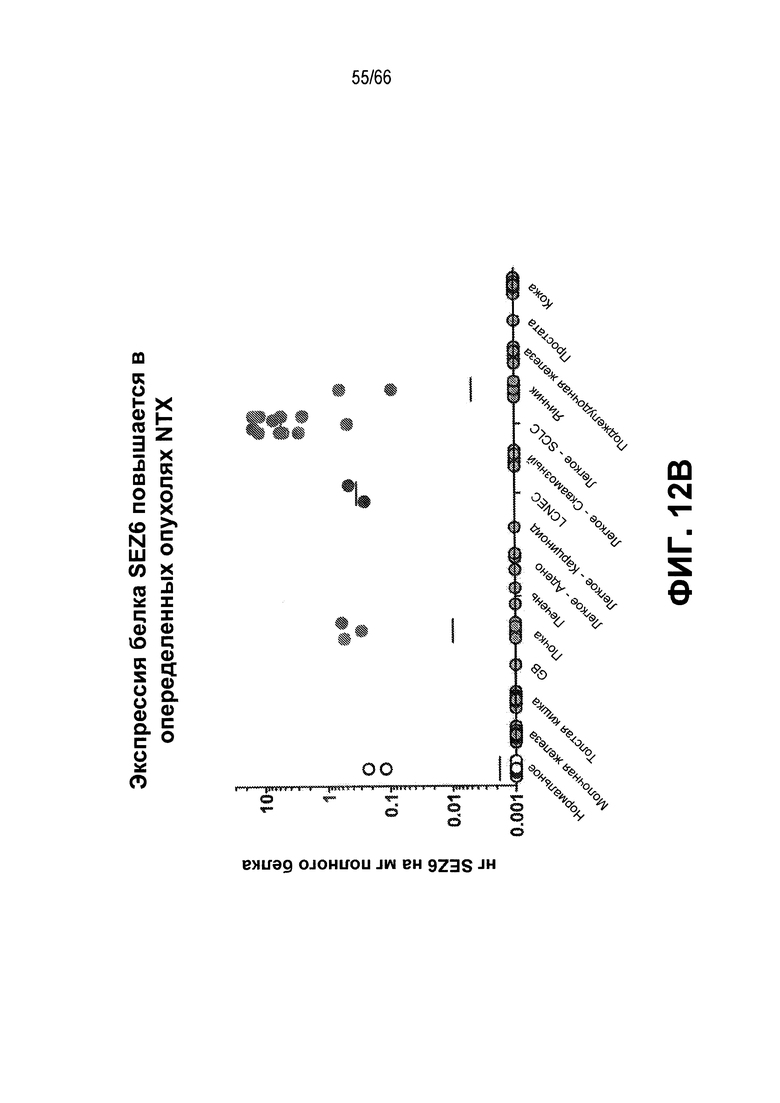
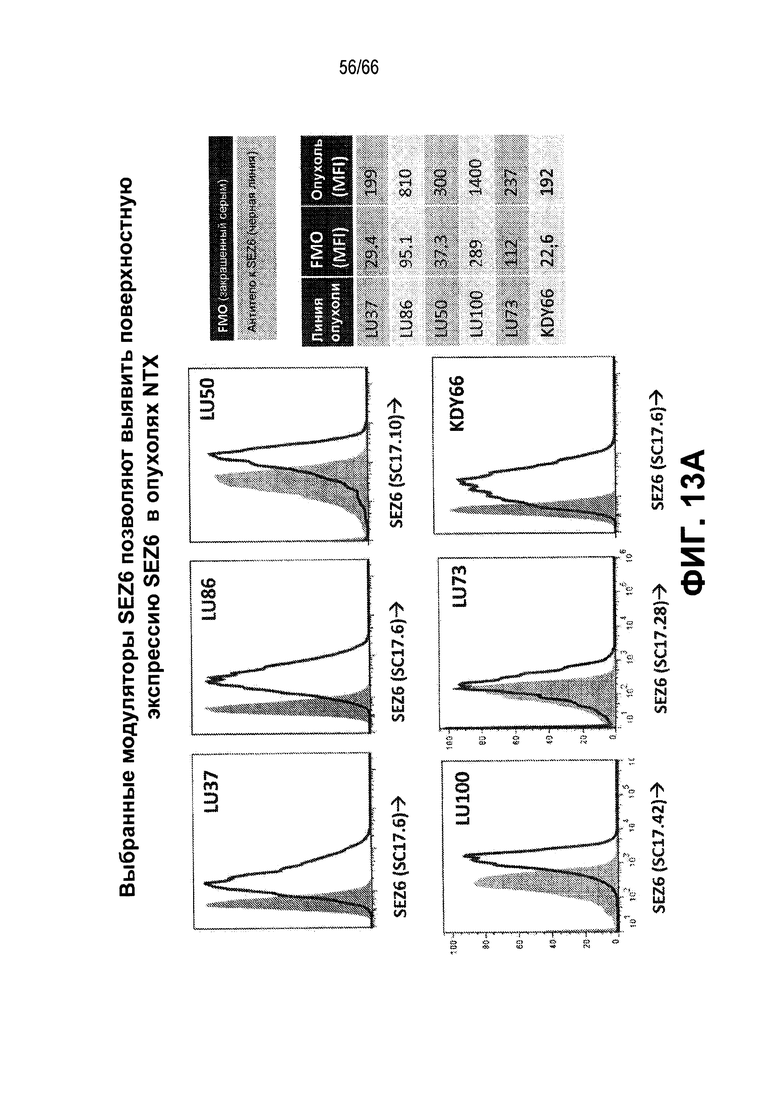
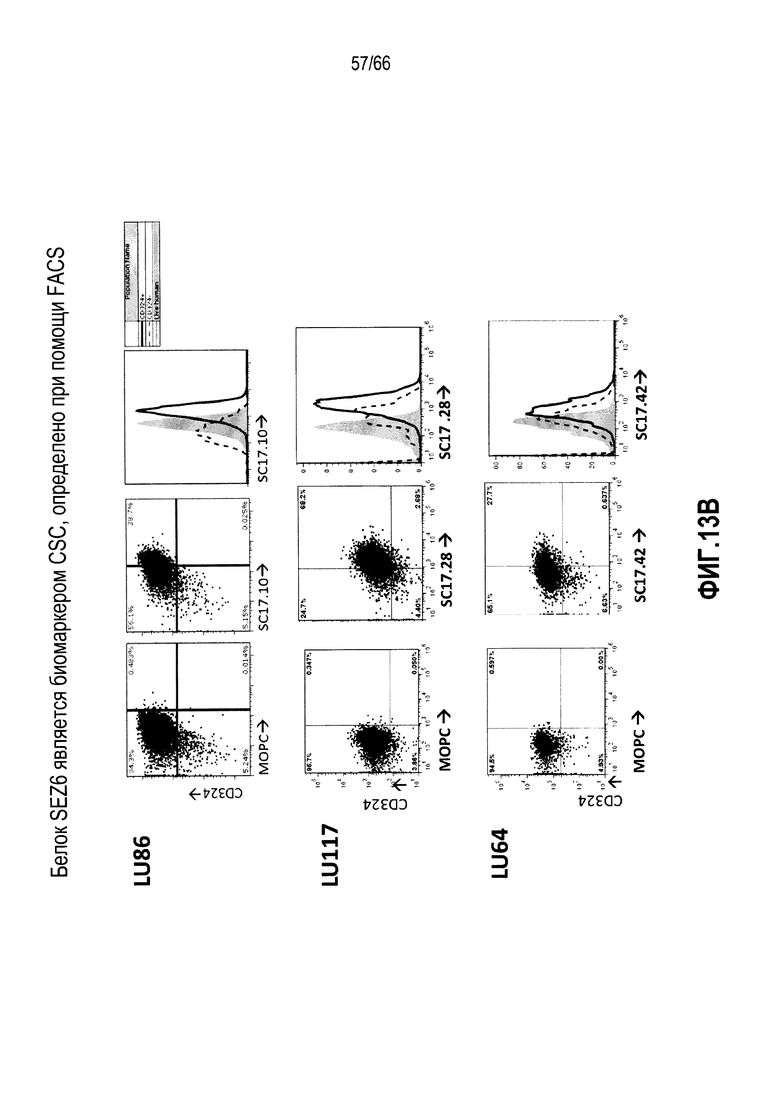
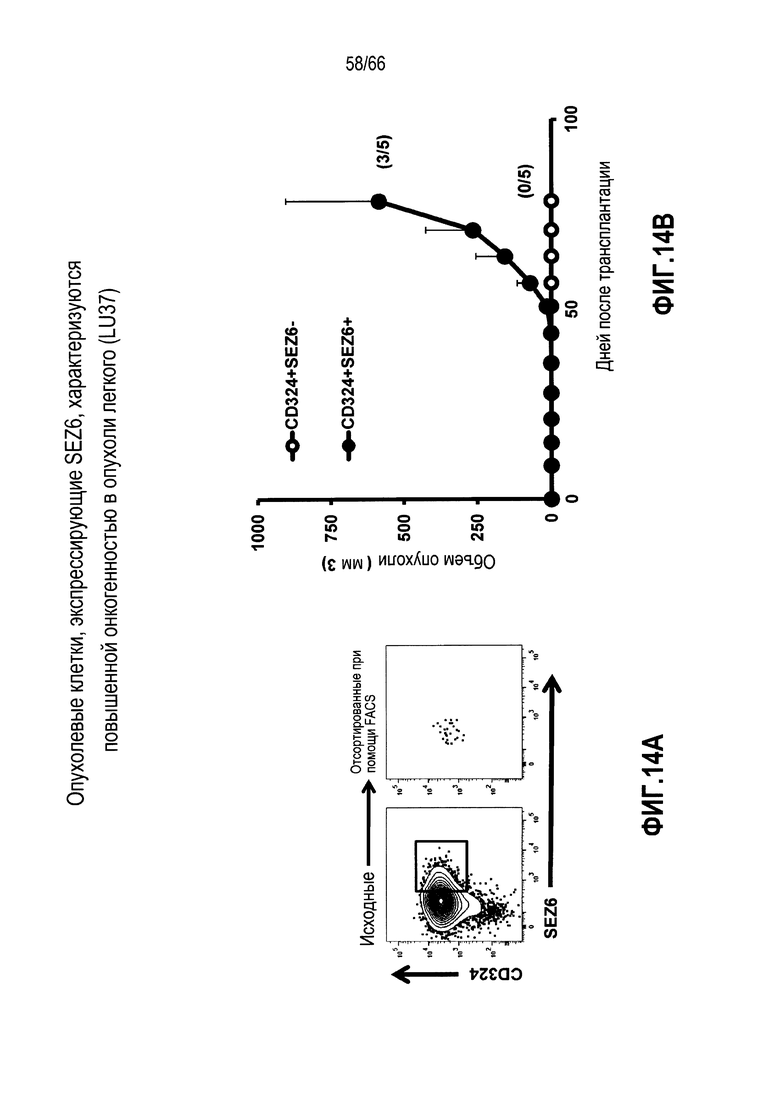


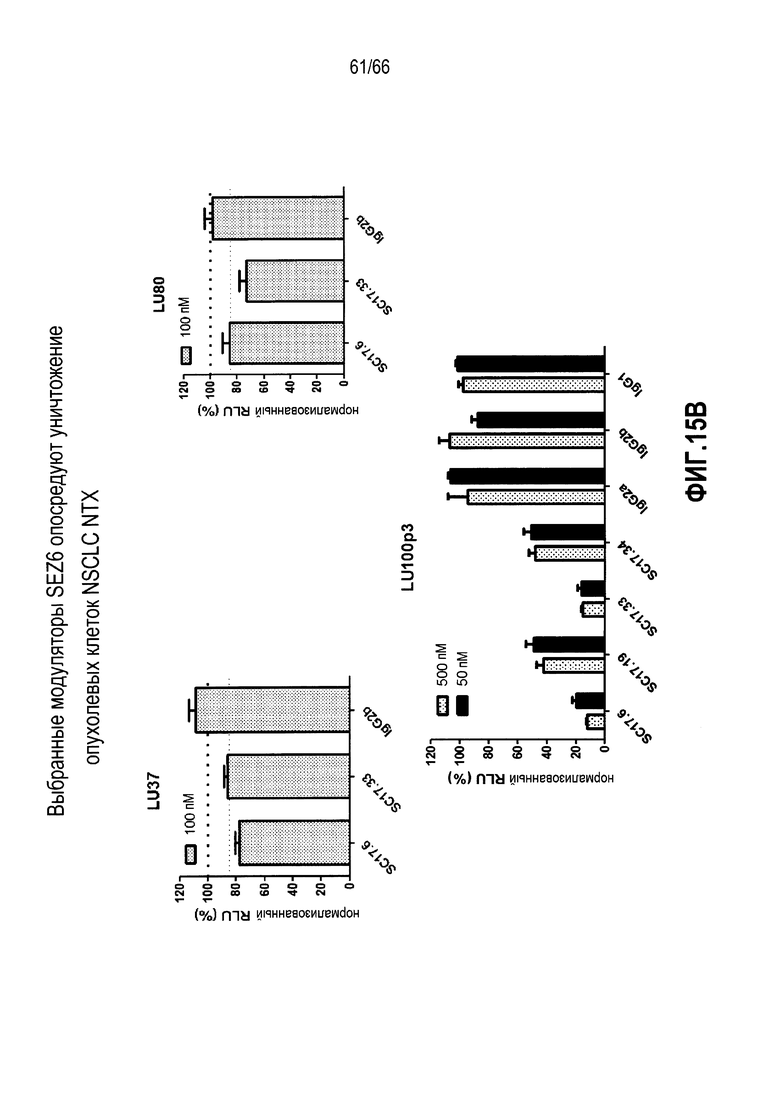
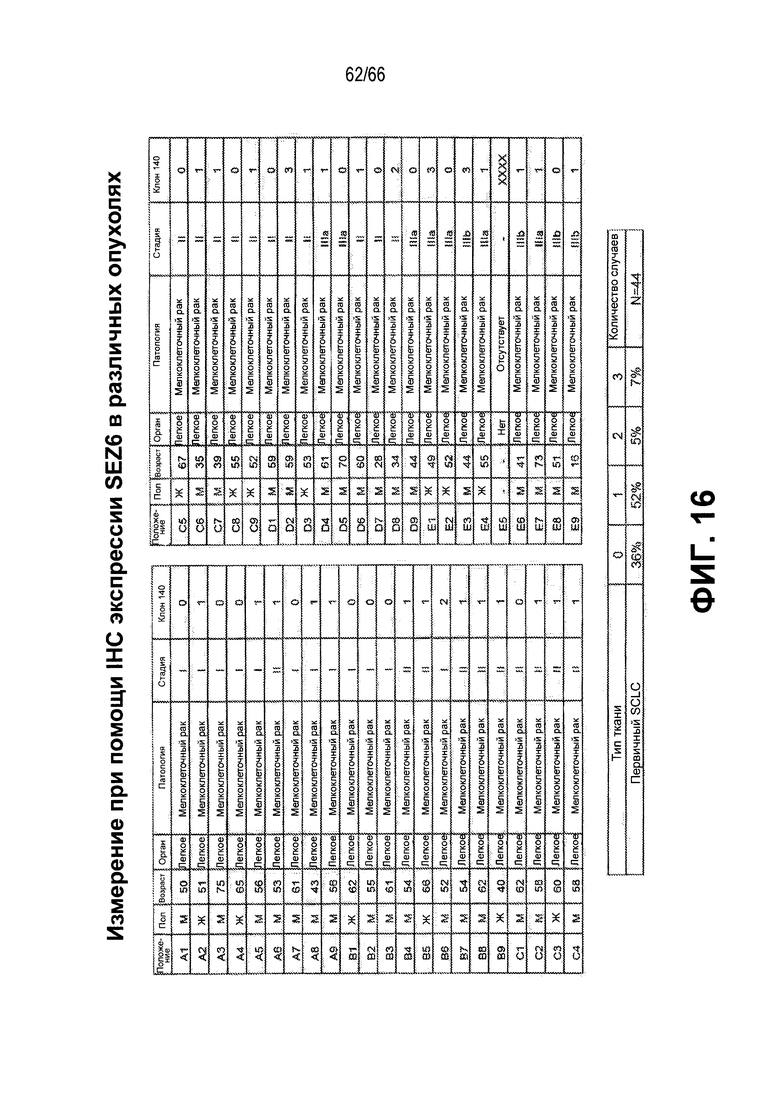
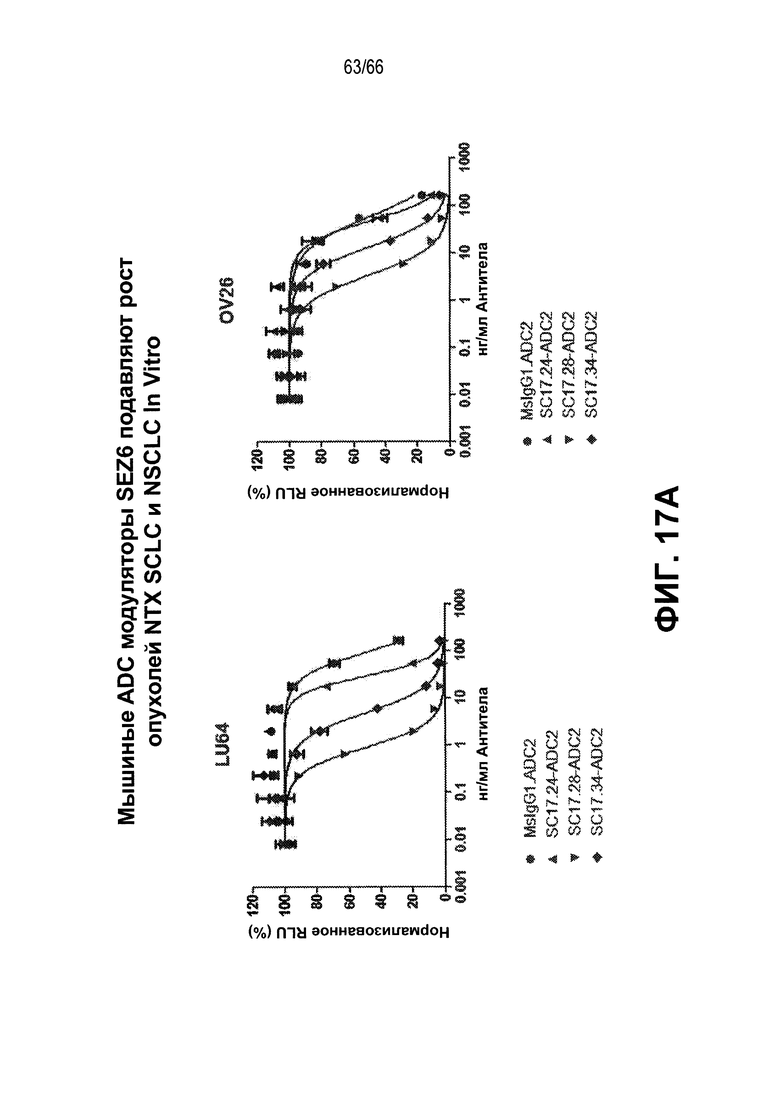
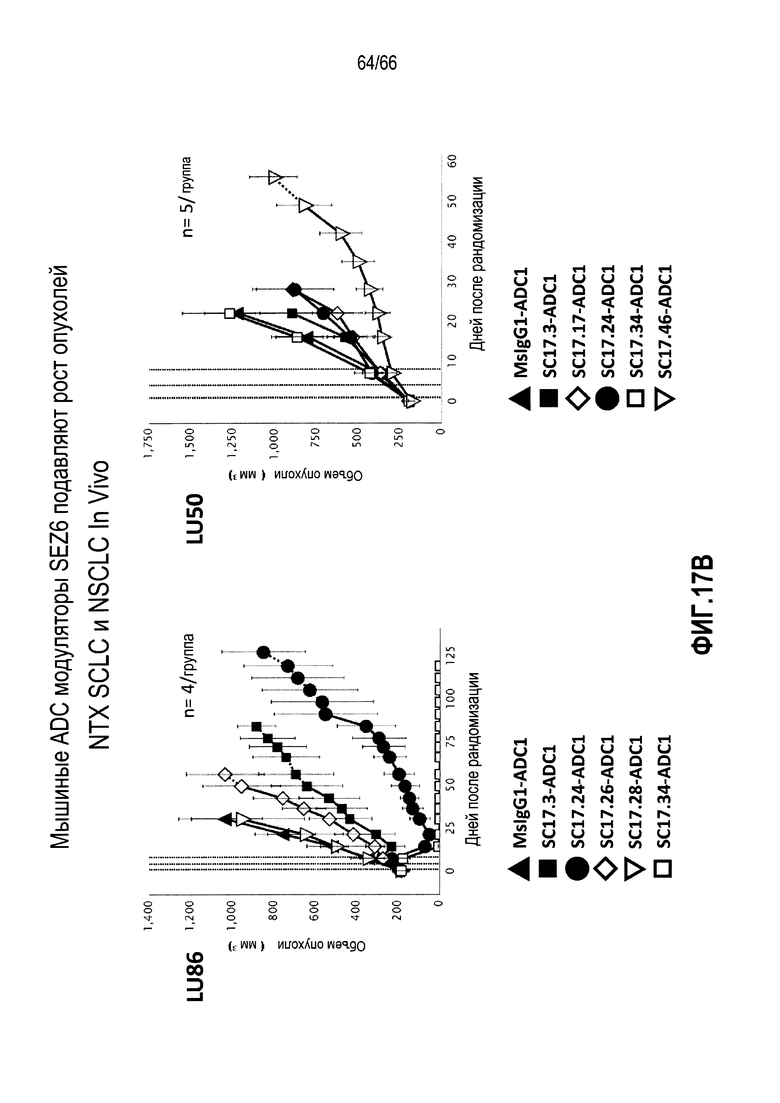
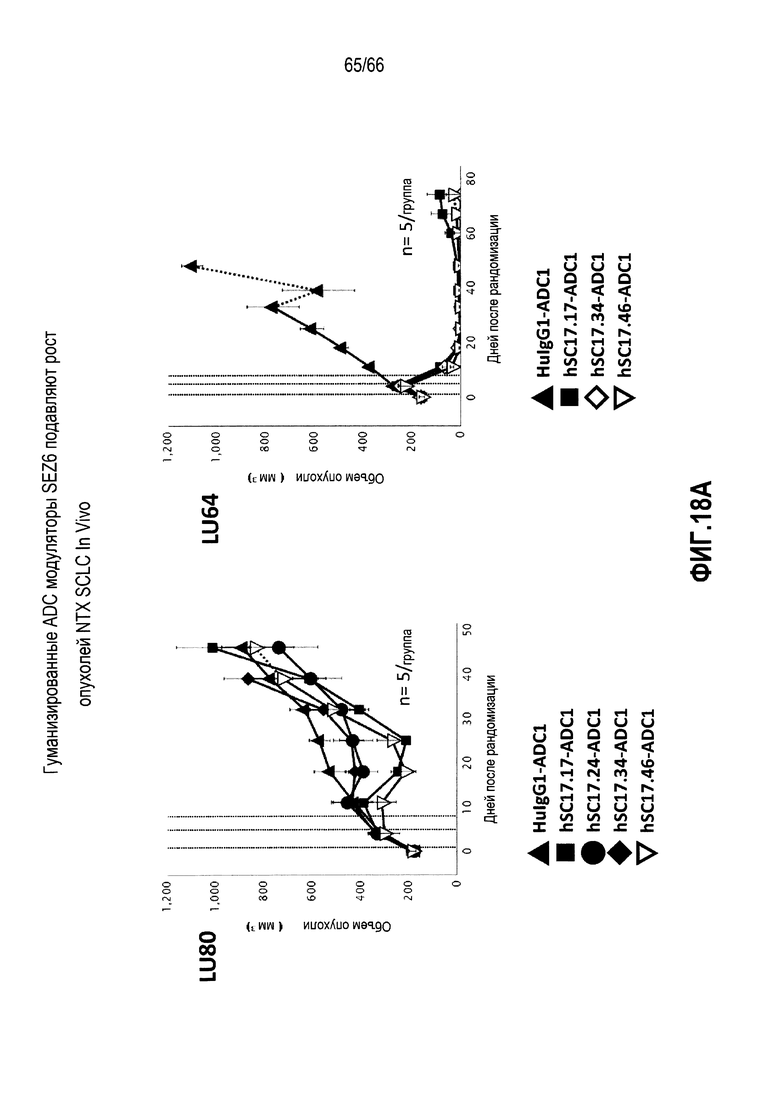
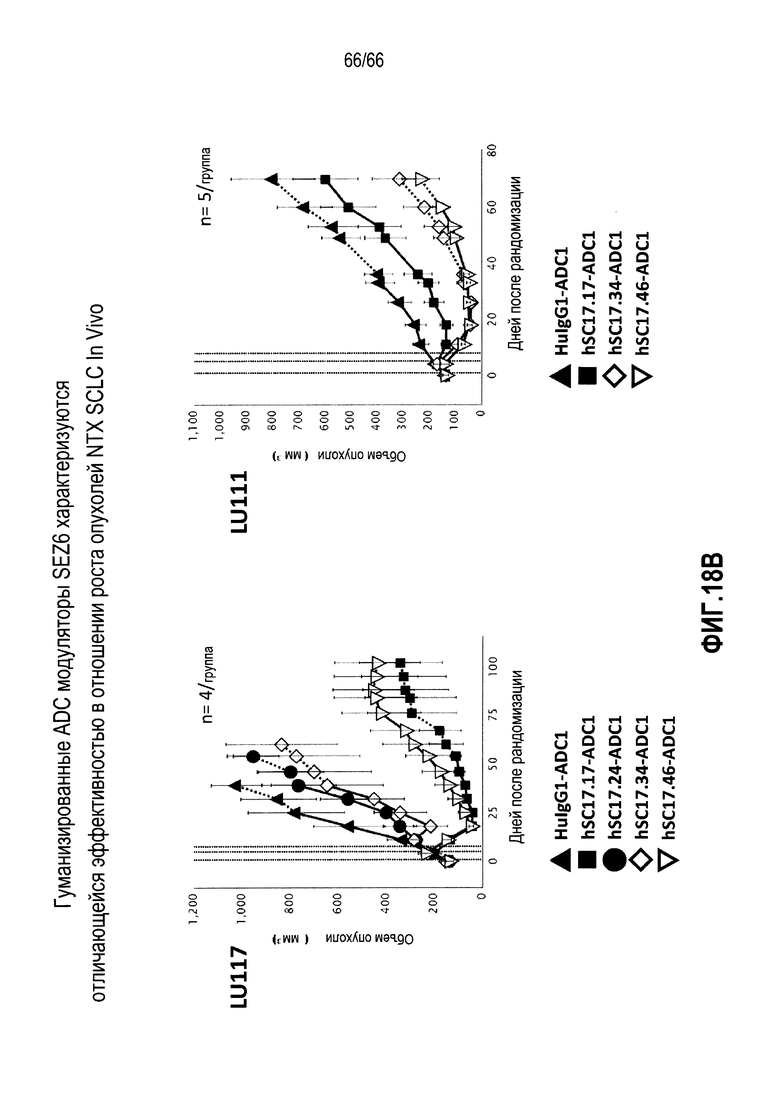
Изобретение относится к области биохимии. Описана группа изобретений, включающая моноклональное антитело, которое связывается с белком SEZ6 человека, нуклеиновую кислоту, кодирующую тяжелую цепь вышеуказанного антитела, вектор, содержащий вышеуказанную нуклеиновую кислоту, нуклеиновую кислоту, кодирующую легкую цепь вышеуказанного антитела, вектор, содержащий вышеуказанную нуклеиновую кислоту, клетку-хозяин, конъюгат «антитело-лекарственное средство», фармацевтическую композицию для лечения SEZ6-связанного расстройства, применение вышеуказанного антитела или конъюгата для получения лекарственного средства для лечения злокачественного новообразования, способ лечения злокачественного новообразования, способ снижения количества инициирующих злокачественное новообразования клеток у пациента, набор для лечения злокачественного новообразования, набор для уменьшения количества инициирующих злокачественных новообразований клеток. Изобретение расширяет арсенал средств для связывания с белком SEZ6 человека. 18 н. и 38 з.п. ф-лы, 52 ил., 4 табл., 19 пр.
1. Моноклональное антитело, где указанное моноклональное антитело связывается с белком SEZ6 человека и содержит:
(а) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191;
(b) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 172, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 173;
(c) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 20, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 21;
(d) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 22, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 23;
(e) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 24, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 25;
(f) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 170, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 171;
(g) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 28, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 29;
(h) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 30, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 31;
(i) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 32, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 33;
(j) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 34, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 35;
(k) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 36, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 37;
(l) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 38, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 39;
(m) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 40, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 41;
(n) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO:42, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 43;
(o) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 46, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 47;
(p) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 48, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 49;
(q) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 50, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 51;
(r) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 174, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 175;
(s) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 54, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 55;
(t) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 176, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 177;
(u) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 58, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 59;
(v) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 60, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 61;
(w) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 62, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 63;
(x) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 178, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 179;
(y) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 66, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 67;
(z) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 68, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 69;
(aa) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 70, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 71;
(bb) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 72, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 73;
(cc) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 74, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 75;
(dd) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 76, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 77;
(ee) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 78, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 79;
(ff) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 180, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 181;
(gg) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 82, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 83;
(hh) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 84, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 85;
(ii) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 86, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 87;
(jj) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 88, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 89;
(kk) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 90, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 91;
(ll) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 92, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 93;
(mm) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 94, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 95;
(nn) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 96, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 97;
(oo) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 98, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 99;
(pp) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 100, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 101;
(qq) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 102, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 103;
(rr) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 104, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 105;
(ss) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 106, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 107;
(tt) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 108, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 109;
(uu) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 110, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 111;
(vv) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 112, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 113;
(ww) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 114, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 115;
(xx) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 116, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 117;
(yy) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 118, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 119;
(zz) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 120, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 121;
(aaa) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 122, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 123;
(bbb) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 124, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 125;
(ccc) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 126, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 127;
(ddd) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 128, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 129;
(eee) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 130, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 131;
(fff) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 132, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 133;
(ggg) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 134, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 135;
(hhh) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 136, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 137;
(iii) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 138, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 139;
(jjj) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 140, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 141;
(kkk) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 142, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 143;
(lll) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 144, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 145;
(mmm) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 146, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 147;
(nnn) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 148, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 149;
(ooo) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 150, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 151;
(ppp) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 182, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 183;
(qqq) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 186, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 187;
(rrr) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 188, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 189;
(sss) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 158, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 159;
(ttt) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 160, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 161;
(uuu) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 162, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 163;
(vvv) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 164, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 165; или
(www) три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 166, и три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 167.
2. Моноклональное антитело по п.1, содержащее:
(а) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 190, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 191;
(b) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 172, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 173;
(с) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 20, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 21;
(d) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 22, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 23;
(e) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 24, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 25;
(f) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 170, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 171;
(g) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 28, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 29;
(h) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 30, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 31;
(i) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 32, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 33;
(j) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 34, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 35;
(k) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 37;
(l) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 38, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 39;
(m) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 40, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 41;
(n) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 42, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 43;
(o) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 46, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 47;
(p) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 48, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 49;
(q) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 50, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 51;
(r) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 174, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 175;
(s) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 54, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 55;
(t) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 176, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 177;
(u) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 58, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 59;
(v) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 60, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 61;
(w) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 62, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 63;
(x) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 178, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 179;
(y) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 66, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 67;
(z) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 68, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 69;
(aa) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 70, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 71;
(bb) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 72, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 73;
(cc) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 71, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 75;
(dd) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 76, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 77;
(ee) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 78, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 79;
(ff) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 180, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 181;
(gg) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 82, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 83;
(hh) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 84, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 85;
(ii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 86, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 87;
(jj) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 88, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 89;
(kk) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 90, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 91;
(ll) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 92, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 93;
(mm) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 94, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 95;
(nn) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 96, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 97;
(oo) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 98, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 99;
(pp) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 100, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 101;
(qq) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 48, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 103;
(rr) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 104, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 105;
(ss) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 106, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 107;
(tt) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 108, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 109;
(uu) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 110, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 111;
(vv) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 112, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 113;
(ww) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 114, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 115;
(xx) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 116, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 117;
(yy) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 118, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 119;
(zz) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 102, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 121;
(aaa) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 54, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 123;
(bbb) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 124, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 125;
(ccc) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 126, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 127;
(ddd) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 128, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 129;
(eee) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 130, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 131;
(fff) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 132, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 133;
(ggg) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 134, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 135;
(hhh) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 136, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 137;
(iii) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 58, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 139;
(jjj) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 140, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 141;
(kkk) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 142, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 143;
(lll) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 144, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 145;
(mmm) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 146, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 147;
(nnn) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 148, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 149;
(ooo) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 150, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 151;
(ppp) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 182, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO:183;
(qqq) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 186, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 187;
(rrr) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 188, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 189;
(sss) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 158, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 159;
(ttt) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 160, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 161;
(uuu) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 162, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 163;
(vvv) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 164, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 165; или
(www) вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 166, и вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 167.
3. Моноклональное антитело по п.1, содержащее
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 172, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 173.
4. Моноклональное антитело по п.3, содержащее
остатки 24-34 SEQ ID NO: 172 для CDR-L1,
остатки 50-56 SEQ ID NO: 172 для CDR-L2,
остатки 89-97 SEQ ID NO: 172 для CDR-L3,
остатки 31-35 SEQ ID NO: 173 для CDR-H1,
остатки 50-65 SEQ ID NO: 173 для CDR-H2 и
остатки 95-102 SEQ ID NO: 173 для CDR-H3,
причем остатки пронумерованы согласно Кэбату.
5. Моноклональное антитело по п.3, содержащее
остатки 23-34 SEQ ID NO: 172 для CDR-L1,
остатки 50-56 SEQ ID NO: 172 для CDR-L2,
остатки 89-97 SEQ ID NO: 172 для CDR-L3,
остатки 26-32 SEQ ID NO: 173 для CDR-H1,
остатки 50-58 SEQ ID NO: 173 для CDR-H2 и
остатки 95-102 SEQ ID NO: 173 для CDR-H3,
причем остатки пронумерованы согласно Chothia.
6. Моноклональное антитело по п.3, содержащее
остатки 30-36 SEQ ID NO: 172 для CDR-L1,
остатки 46-55 SEQ ID NO: 172 для CDR-L2,
остатки 89-96 SEQ ID NO: 172 для CDR-L3,
остатки 30-35 SEQ ID NO: 173 для CDR-H1,
остатки 47-58 SEQ ID NO: 173 для CDR-H2 и
остатки 93-101 SEQ ID NO: 173 для CDR-H3,
причем остатки пронумерованы согласно MacCallum.
7. Моноклональное антитело по п.3, содержащее
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 172, и
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 173.
8. Моноклональное антитело по п.1, содержащее
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191.
9. Моноклональное антитело по п.8, содержащее
остатки 24-34 SEQ ID NO: 190 для CDR-L1,
остатки 50-56 SEQ ID NO: 190 для CDR-L2,
остатки 89-97 SEQ ID NO: 190 для CDR-L3,
остатки 31-35 SEQ ID NO: 191 для CDR-H1,
остатки 50-65 SEQ ID NO: 191 для CDR-H2 и
остатки 95-102 SEQ ID NO: 191 для CDR-H3,
причем остатки пронумерованы согласно Кэбату.
10. Моноклональное антитело по п.8, содержащее
остатки 23-34 SEQ ID NO: 190 для CDR-L1,
остатки 50-56 SEQ ID NO: 190 для CDR-L2,
остатки 89-97 SEQ ID NO: 190 для CDR-L3,
остатки 26-32 SEQ ID NO: 191 для CDR-H1,
остатки 50-58 SEQ ID NO: 191 для CDR-H2 и
остатки 95-102 SEQ ID NO: 191 для CDR-H3,
причем остатки пронумерованы согласно Chothia.
11. Моноклональное антитело по п.8, содержащее
остатки 30-36 SEQ ID NO: 190 для CDR-L1,
остатки 46-55 SEQ ID NO: 190 для CDR-L2,
остатки 89-96 SEQ ID NO: 190 для CDR-L3,
остатки 30-35 SEQ ID NO: 191 для CDR-H1,
остатки 47-58 SEQ ID NO: 191 для CDR-H2 и
остатки 93-101 SEQ ID NO: 191 для CDR-H3,
причем остатки пронумерованы согласно MacCallum.
12. Моноклональное антитело по п.8, содержащее
вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 190, и
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 191.
13. Моноклональное антитело по п.1, которое выбрано из группы, состоящей из химерного антитела, CDR-привитого антитела и гуманизированного антитела.
14. Моноклональное антитело по п.1, причем указанное антитело включает интернализированное антитело.
15. Антитело по любому из пп.1-14, которое конъюгировано с цитотоксическим средством.
16. Моноклональное антитело по п.15, причем цитотоксическое средство представляет собой пирролобензодиазепин (PBD), ауристатин, майтансиноид, дуокармицин или калихеамицин.
17. Моноклональное антитело по п.3, содержащее
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191; и
причем цитотоксическое средство представляет собой калихеамицин.
18. Нуклеиновая кислота, кодирующая вариабельную область тяжелой цепи антитела по любому из пп.1-14.
19. Нуклеиновая кислота, кодирующая вариабельную область легкой цепи антитела по любому из пп.1-14.
20. Вектор, содержащий нуклеиновую кислоту по п.18, для получения антитела по любому из пп.1-14.
21. Вектор, содержащий нуклеиновую кислоту по п.19, для получения антитела по любому из пп.1-14.
22. Клетка-хозяин, содержащая нуклеиновую кислоту по п.20, для получения антитела по любому из пп.1-14.
23. Клетка-хозяин, содержащая нуклеиновую кислоту по п.21 для получения антитела по любому из пп.1-15.
24. Конъюгат "антитело-лекарственное средство" для нацеливания цитотоксического средства на клетки, экспрессирующие SEZ6, содержащий моноклональное антитело, конъюгированное, связанное или иным образом присоединенное к цитотоксическому средству, причем моноклональное антитело представляет собой антитело по любому из пп.1-14.
25. Конъюгат по п.24, который имеет формулу M-[L-D]n, где
a) M представляет моноклональное антитело;
b) L представляет собой необязательный линкер;
c) D представляет собой лекарственное средство, которое является цитотоксическим агентом, и
d) n равно целому числу от 1 до 20.
26. Конъюгат по п.25, в котором моноклональное антитело конъюгировано с цитотоксическим средством посредством линкера.
27. Конъюгат по п.26, в котором линкер состоит из нерасщепляемого линкера.
28. Конъюгат по п.24, причем цитотоксическое средство представляет собой пирролобензодиазепин (PBD), ауристатин, майтансиноид, дуокармицин или калихеамицин.
29. Конъюгат по п.25, причем цитотоксическое средство представляет собой пирролобензодиазепин (PBD), ауристатин, майтансиноид, дуокармицин или калихеамицин.
30. Конъюгат по п.24, в котором цитотоксическое средство представляет собой калихеамицин.
31. Конъюгат по п.24, содержащее
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191.
32. Конъюгат "антитело-лекарственное средство" для нацеливания калихемацина на клетки, экспрессирующие SEZ6, содержащий моноклональное антитело, конъюгированное с цитотоксическим средством,
причем антитело содержит
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191; и
причем цитотоксическое средство представляет собой калихеамицин.
33. Фармацевтическая композиция для лечения SEZ6-связанного расстройства, содержащая
(i) терапевтически эффективное количество антитела по любому из пп.15-17 или конъюгата "антитело-лекарственное средство" по любому из пп.24-32 и
(ii) фармацевтически приемлемый носитель.
34. Применение антитела по любому из пп.15-17 для получения лекарственного средства для лечения злокачественного новообразования.
35. Применение по п.34, причем злокачественное новообразование выбрано из группы, состоящей из рака надпочечников, рака мочевого пузыря, рака шейки матки, рака эндометрия, рака почек, рака печени, рака легких, рака яичников, колоректального рака, рака поджелудочной железы, рака предстательной железы и рака молочной железы.
36. Применение по п.35, причем указанный рак легких представляет собой мелкоклеточный рак легких.
37. Применение по п.34, содержащее
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191;
причем цитотоксический агент представляет собой калихеамицин; и
причем злокачественным новообразованием является мелкоклеточный рак легких.
38. Применение конъюгата по любому из пп.24-32 для получения лекарственного средства для лечения злокачественного новообразования.
39. Применение по п.38, причем злокачественное новообразование выбрано из группы, состоящей из рака надпочечников, рака мочевого пузыря, рака шейки матки, рака эндометрия, рака почек, рака печени, рака легких, рака яичников, колоректального рака, рака поджелудочной железы, рака предстательной железы и рака молочной железы.
40. Применение по п.39, причем указанный рак легких представляет собой мелкоклеточный рак легких.
41. Применение по п.38, содержащее
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191;
причем цитотоксический агент представляет собой калихеамицин; и
причем злокачественным новообразованием является мелкоклеточный рак легких.
42. Применение антитела по любому из пп.15-17 для получения лекарственного средства для снижения количества инициирущих злокачественное новообразование клеток.
43. Применение по п.42, причем антитело содержит
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191; и
причем цитотоксическое средство представляет собой калихеамицин.
44. Применение конъюгата по любому из пп.24-32 для получения лекарственного средства для снижения количества инициирущих злокачественное новообразование клеток.
45. Применение по п.44, причем антитело содержит
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191; и
причем цитотоксическое средство представляет собой калихеамицин.
46. Способ лечения злокачественного новообразования, включающий введение терапевтически эффективного количества антитела по любому из пп.15-17 или конъюгата по любому из пп.24-32 пациенту.
47. Способ по п.46, причем злокачественное новообразование выбрано из группы, состоящей из рака надпочечников, рака мочевого пузыря, рака шейки матки, рака эндометрия, рака почек, рака печени, рака легких, рака яичников, колоректального рака, рака поджелудочной железы, рака предстательной железы и рака молочной железы.
48. Способ по п.47, причем указанный рак легких представляет собой мелкоклеточный рак легких.
49. Способ по п.46, причем антитело содержит
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191;
причем цитотоксический агент представляет собой калихеамицин; и
причем злокачественным новообразованием является мелкоклеточный рак легких.
50. Способ снижения количества инициирующих злокачественное новообразования клеток у пациента, включающий стадию введения терапевтически эффективного количества антител по любому из пп.15-17 или конъюгата по любому из пп.24-32, пациенту.
51. Набор для лечения злокачественного новообразования, содержащий:
(а) один или несколько контейнеров, содержащих фармацевтическую композицию по п.33, и
(b) этикетку или вкладыш, связанные с одним или несколькими контейнерами, на которых указан режим дозирования для больного злокачественным новообразованием.
52. Набор по п.51, причем злокачественное новообразование является раком легких.
53. Набор по п.52, причем указанный рак легких представляет собой мелкоклеточный рак легких.
54. Набор по п.51, причем антитело содержит
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191;
причем цитотоксический агент представляет собой калихеамицин; и
причем злокачественным новообразованием является мелкоклеточный рак легких.
55. Набор для уменьшения количества инициирующих злокачественных новообразований клеток, содержащий:
(а) один или более контейнеров, содержащих антитело по любому из пп.15-17, конъюгат по любому из пп.24-32 или фармацевтическую композицию по п.33, и
(b) этикетку или вкладыш, связанные с одним или несколькими контейнерами, на которых указано, что композиция предназначена для уменьшения количества инициирующих злокачественную опухоль клеток.
56. Набор по п.55, причем антитело содержит
три определяющие комплементарность области легкой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 190, и
три определяющие комплементарность области тяжелой цепи вариабельной области, содержащей аминокислотную последовательность SEQ ID NO: 191; и
причем цитотоксическое средство представляет собой калихеамицин.
| WO 2001083552 A2, 08.11.2001 | |||
| GUNNERSEN J.M | |||
| et al., "Seizure-related gene 6 (Sez-6) in amacrine cells of the rodent retina and the consequence of gene deletion", PLoS One | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| OSAKI G | |||
| et al., "The distribution of the seizure-related gene 6 (Sez-6) protein during postnatal development of the mouse forebrain suggests multiple functions for this protein: an analysis using a new antibody", Brain Res | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| SHIMIZU-NISHIKAWA K | |||
| et al., "Cloning and characterization of seizure-related gene, SEZ-6", Biochem Biophys Res Commun | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| РЫБАЛЬСКИЙ Н.Г., СЕРОВА М | |||
| А., ИГНАТЬЕВА Г.А., СТАРЧЕУС А.П | |||
| "Моноклональные антитела и гибридомы", Москва: ВАСХНИЛ, 1989, стр | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
Авторы
Даты
2019-06-17—Публикация
2013-02-22—Подача