По данной заявке испрашивается приоритет по условной заявке США с серийным номером No.60/703265, поданной 27 июля 2005 года, содержание которой полностью включено в настоящее описание в качестве ссылки.
Область изобретения
Настоящее изобретение относится к способам обнаружения и диагностики рака толстого кишечника, а также к способам лечения и профилактики рака толстого кишечника.
Предпосылки изобретения
Рак ободочной и прямой кишки представляет собой одну из наиболее распространенных причин смерти от злокачественной опухоли во всем мире. Несмотря на различные достижения в диагностике и лечении рака ободочной и прямой кишки, у многих пациентов рак ободочной и прямой кишки на развернутой стадии приводит к высокой смертности. Для улучшения их прогноза требуется разработка чувствительных и специфичных диагностических биомаркеров для выявления карцином на ранней стадии и разработка более эффективных и менее вредных лекарственных средств для терапии. Для достижения этой цели требуется лучшее понимание молекулярных механизмов колоректального канцерогенеза. Последние молекулярные исследования показали, что колоректальный канцерогенез вовлекает накопление генетических изменений, которые включают генетические изменения в генах опухолевой супрессии и/или онкогенах, включая APC, p53, beta-catenin и K-ras (Nishisho I, et al. Science 253: 665-669, 1991; Baker SJ, et al., Science 244: 217-221, 1989; Morin PJ, et al., Science 275: 1787-1790, 1997; Forrester K, et al., Nature 327: 298-303, 1987). В дополнение к этим типам изменений, в образование опухолей ободочной и прямой кишки вовлечены эпигенетические явления, такие как измененное метилирование (Jones PA & Laird PW, Nat Genet 21: 163-167, 1999) и потеря импринтинга (Cui H, et al., Nat Med 4: 1276-1280, 1998), и/или ослабленная регуляция контроля транскрипции путем генетических изменений или другого неизвестного механизма(ов). Относительно вовлеченных в канцерогенез генов можно ожидать, что ингибирование генных продуктов, необходимых для пролиферации и/или выживания раковых клеток, приведет к ингибированию их роста или гибели клеток. Таким образом, молекулы, которые обладают онкогенной активностью и специфично экспрессируются в раковых клетках, представляют собой перспективные мишени для разработки новых противораковых лекарственных средств.
TOM34 человека был открыт с помощью баз данных EST и кДНК для человека, и был предсказан в качестве компонента митохондриального аппарата импорта белков, поскольку предсказанный белок обладает гомологией последовательности в участке мотива из 62 остатков с известным семейством митохондриальных рецепторов Tom70 дрожжей (Nuttall SD, et al., DNA Cell Biol 16: 1067-1074, 1997). Однако последние исследования показали, что после фракционирования тканей и клеток TOM34 входит в состав, главным образом, цитозольной фракции и, частично, митохондриальной и мембранной фракции (Chewawiwat N, et al., J Biochem (Tokyo) 125: 721-727, 1999). В другом исследовании посредством иммуногистохимического окрашивания была показана его субклеточная локализация в цитоплазме клеток HeLa (Chun-Song Yand Henry Y., Archives of Biochemistry and Biophysics 400: 105-110, 2002; Abhijit M, et al., Archives of Biochemistry and Biophysics 400: 97-104, 2002). C помощью дрожжевой двухгибридной системы скрининга было показано, что TOM34 взаимодействует in vitro с валосин-содержащим белком (VCP), членом семейства AAA (АТФаз, ассоциированных с множеством видов клеточной активности) (Chun-Song Y, et al., Archives of Biochemistry and Biophysics 400: 105-110, 2002) или с белком теплового шока массой 90 кДа (hsp90) (Young JC, et al., J Biol Chem 273: 18007-18010, 1998). Однако биологическая роль TOM34 остается неясной.
Было показано, что CD8+ цитотоксические T-лимфоциты (CTL) распознают пептиды эпитопов, образованные из опухоль-ассоциированных антигенов (TAA), представленные на молекуле MHC I класса, и лизируют опухолевые клетки. После открытия семейства MAGE в качестве первого примера TAA с использованием иммунологических подходов были открыты многие другие TAA (Boon T., Int J Cancer. 1993; 54(2):177-80, Boon T & van der Bruggen P, J Exp Med. 1996; 183(3):725-9, van der Bruggen P, et. al., Science. 1991; 254(5038):1643-7, Brichard V, et. al., J Exp Med. 1993; 178(2):489-95, Kawakami Y, et. al., J Exp Med. 1994; 180(1):347-52), и некоторые из них в настоящее время находятся в процессе клинической разработки в качестве мишеней для иммунотерапии. Открытые к настоящему времени TAA включают MAGE (van der Bruggen P, et. al., Science. 1991; 254(5038):1643-7), gp100 (Kawakami Y, et. al., J Exp Med. 1994; 180(1):347-52), SART (Shichijo S, et. al., J Exp Med. 1998; 187(3):277-88), NY-ESO-1 (Chen YT, et. al., Proc Natl Acad Sci USA. 1997; 94(5):1914-8). В то же время было показано, что генные продукты, для которых уже показана некоторая специфичная сверхэкспрессия опухолевыми клетками, распознаются в качестве мишеней для клеточных иммунных ответов. Они включают p53 (Umano Y, et. al., Br J Cancer. 2001; 84(8):1052-7), HER2/neu (Tanaka H, et. al., Br J Cancer. 2001; 84(1):94-9), CEA (Nukaya I, et. al., Int J Cancer. 1999; 80(1):92-7) и другие.
Несмотря на то, они представляют собой примеры существенного прогресса, который был достигнут в фундаментальных и клинических исследованиях (Rosenberg SA, et. al., Nat Med. 1998; 4(3):321-7, Mukherji B, et al., Proc Natl Acad Sci U S A. 1995; 92(17):8078-82, Hu X, et. al., Cancer Res. 1996; 56(11):2479-83), существует очень ограниченное количество TAA-кандидатов, главным образом, для лечения аденокарцином, включая рак толстого кишечника. Если существуют TAA, которые экспрессируются в большом количестве только в раковых клетках, но не в нормальных клетках, то они могут быть перспективными кандидатами для иммунотерапевтических мишеней.
Сущность изобретения
Для подтверждения роли молекул в колоректальном канцерогенезе и выявления новых терапевтических мишеней для пациентов с колоректальной карциномой (CRC), авторы настоящего изобретения получили профили экспрессии с использованием микроматрицы кДНК, состоящей из 23040 генов (Lin YM, et al., Oncogene 21: 4120-4128, 2002). Среди генов, демонстрирующих повышенную экспрессию в опухолях ободочной и прямой кишки, авторы настоящего изобретения сосредоточили внимание на TOM34 (транслоказе наружной митохондриальной мембраны массой 34 кДа), поскольку уровни его экспрессии часто были повышены, в 16 из 20 исследуемых образцов CRC. Нозерн-блот-анализ множества тканей показал высокую экспрессию этого гена в яичке и яичнике и слабую в предстательной железе, селезенке и толстом кишечнике, но не показал ее в какой-либо другой из 11 исследованных нормальных тканей взрослых. Иммуногистохимическое окрашивание TOM34 показало значительное его накопление в тканях CRC по сравнению с соответствующей им нераковой слизистой тканью.
В настоящем изобретении была подтверждена частая повышенная экспрессия TOM34 человека в CRC и его экспрессия в яичке и яичнике, но не в других 15 исследованных нормальных тканях взрослых. Поскольку супрессия этого TOM34 посредством siRNA значительно снижала рост раковых клеток толстого кишечника, генный продукт может быть потенциальной терапевтической мишенью для опухолей человека, а также пригодным диагностическим маркером.
Кроме того, полагали, что TOM34 может служить в качестве TAA (опухоль-ассоциированного антигена), который может индуцировать выраженный клеточный иммунный ответ против рака толстого кишечника. Для проверки этого предположения авторы настоящего изобретения стимулировали PBMC, полученные от здоровых добровольцев, пептидами, образованными из TOM34, а затем получили пептид-специфичные клоны CTL, которые также распознают и уничтожают опухолевые клетки, экспрессирующие антиген.
Конкретно, трансфекция раковых клеток толстого кишечника HCT116 и RKO малой интерферирующей РНК (siRNA), специфичной к TOM34, эффективно подавляла его экспрессию и значительно ингибировала рост клеток.
Кроме того, авторами настоящего изобретения исследованы пептиды с последовательностями, образованными из TOM34, в отношении их способности выступать в качестве антигенных пептидов эпитопов и разработан новый пептид эпитопа для эффективной иммунотерапии рака, которая может индуцировать выраженный клеточный иммунный ответ против рака толстого кишечника. Мононуклеарные клетки периферической крови (PBMC) здоровых доноров стимулировали, используя пептиды, имеющие неполные последовательности TOM34. Были выбраны те пептиды, для которых было прогнозировано, что они связываются с HLA-A*2402. Авторами настоящего изобретения успешно идентифицирован определенный антигенный пептид, последовательность которого образована из TOM34, который может индуцировать клеточные линии цитотоксических T-лимфоцитов (CTL), демонстрирующих специфичную цитотоксичность против клеток, которые представляют антиген с ограничением по HLA-A24. Из этих клеточных линий CTL были получены клоны CTL. Последующий анализ клонов CTL показал, что они обладают выраженной цитотоксической активностью не только против нагруженных пептидом клеток-мишеней, но также против клеток, которые эндогенно экспрессируют TOM34. Кроме того, анализ ингибирования "холодной" мишенью показал, что клоны CTL специфично распознают антигенный пептид в комплексе с молекулой MHC I класса. Эти результаты убедительно подтверждают, что пептид представляет собой пептид эпитопа, ограниченный по HLA-A24, который может индуцировать сильный и специфичный иммунный ответ против раковых клеток толстого кишечника, экспрессирующих TOM34.
Эти открытия подтверждают, что TOM34 вовлечен в рост раковых клеток и может внести вклад в разработку новых противораковых лекарственных средств и/или способа диагностики CRC.
Настоящее изобретение основано на открытии паттерна экспрессии гена TOM34. Нуклеотидная последовательность и аминокислотная последовательность TOM34 указаны в SEQ ID NO:60 и 61, соответственно. Эти последовательности также доступны в Genbank под регистрационным номером NO. AB085681.
Таким образом, настоящее изобретение относится к способу диагностики рака толстого кишечника или выявления предрасположенности к нему у субъекта путем определения уровня экспрессии TOM34 в полученном от пациента биологическом образце, таком как образец ткани. Нормальная клетка представляет собой клетку, полученную из ткани толстого кишечника. Изменение, например, повышение уровня экспрессии гена по сравнению с нормальным контрольным уровнем гена, указывает на то, что субъект страдает раком толстого кишечника или обладает риском его развития.
Когда он используется в контексте настоящего изобретения, термин "предрасположенность к раку толстого кишечника" включает состояние субъекта, заключающееся в наличии предрасположенности, наличии тенденции, распространенности, склонности или чувствительности к раку толстого кишечника. Кроме того, указанный термин также включает наличие у субъекта риска возникновения рака толстого кишечника.
В контексте настоящего изобретения выражение "контрольный уровень" относится к уровню экспрессии белка, выявляемому в контрольном образце. Контрольный уровень может представлять собой отдельный паттерн экспрессии, образованный одной контрольной популяцией или множеством паттернов экспрессии. Например, контрольный уровень может представлять собой базу данных паттернов экспрессии ранее тестированных клеток. "Нормальный контрольный уровень" относится к уровню экспрессии гена, выявленному у нормального здорового индивида или у популяции индивидов, о которых известно, что они не страдают раком толстого кишечника. Нормальный индивид представляет собой индивид без клинических симптомов рака толстого кишечника.
Повышение уровня экспрессии TOM34, выявленное в тестируемом образце по сравнению с нормальным контрольным уровнем, указывает на то, что субъект (от которого получен образец) страдает CRC или обладает риском его развития.
В соответствии с настоящим изобретением уровень экспрессии гена считают "измененным", когда экспрессия гена возрастает на 10%, 25%, 50% по сравнению с контрольным уровнем. Альтернативно, уровень экспрессии считают "повышенным", когда экспрессия гена повышается с кратностью, по меньшей мере, 0,1, по меньшей мере, 0,2, по меньшей мере, 1, по меньшей мере, 2, по меньшей мере, 5 или, по меньшей мере, 10 или более от контрольного уровня. Экспрессию определяют путем детектирующей гибридизации, например, зонда TOM34 с транскриптом гена полученного от пациента образца ткани.
В контексте настоящего изобретения полученный от пациента образец ткани представляет собой любую ткань, полученную от тестируемого субъекта, например, пациента, о котором известно, что у него имеется рак толстого кишечника, или у которого подозревают его наличие. Например, ткань может содержать эпителиальную клетку. Более конкретно, ткань может представлять собой эпителиальную клетку из колоректальной карциномы.
Настоящее изобретение дополнительно относится к способам идентификации средства, которое ингибирует экспрессию или активность TOM34, путем контактирования тестируемой клетки, экспрессирующей TOM34, с тестируемым соединением и определения уровня экспрессии TOM34 или активности его генного продукта. Тестируемая клетка может представлять собой эпителиальную клетку, такую как эпителиальная клетка, полученная из колоректальной карциномы. Снижение уровня экспрессии TOM34 или активности его генного продукта по сравнению с контрольным уровнем или активностью гена или генного продукта указывает на то, что тестируемое соединение является ингибитором TOM34, и его можно использовать для уменьшения симптомов рака толстого кишечника.
Настоящее изобретение также относится к набору, содержащему реагент для обнаружения, который связывается с нуклеиновыми кислотами или полипептидами TOM34.
Терапевтические способы по настоящему изобретению включают способ лечения или профилактики рака толстого кишечника у субъекта, включающий стадию введения субъекту антагониста или ингибитора TOM34, который представляет собой, например, антисмысловую композицию или композицию антитела. Антагонист или ингибитор может действовать либо на уровне нуклеиновой кислоты, либо на уровне белка, так чтобы происходило снижение или ингибирование экспрессии или активности TOM34.
В контексте настоящего изобретения антисмысловая композиция снижает экспрессию определенного гена-мишени. Например, антисмысловая композиция может содержать нуклеотид, который является комплементарным последовательности TOM34. Альтернативно, данный способ может включать стадии введения субъекту композиции малой интерферирующей РНК (siRNA). В контексте настоящего изобретения композиция siRNA снижает экспрессию TOM34. В другом способе лечение или профилактику рака толстого кишечника у субъекта можно проводить путем введения субъекту рибозимной композиции. В контексте настоящего изобретения композиция специфичного к нуклеиновой кислоте рибозима снижает экспрессию TOM34. В действительности, ингибирующий эффект siRNA на TOM34 был подтвержден. Например, в разделе "Примеры" отчетливо показано, что siRNA против TOM34 ингибирует клеточную пролиферацию раковых клеток толстого кишечника. Таким образом, в настоящем изобретении TOM34 представляет собой предпочтительную терапевтическую мишень рака толстого кишечника.
Настоящее изобретение также включает вакцины и способы вакцинации. Например, способ лечения или профилактики рака толстого кишечника у субъекта может включать введение субъекту вакцины, содержащей полипептид, кодируемый нуклеиновой кислотой TOM34, или иммунологически активный фрагмент такого полипептида. В контексте настоящего изобретения иммунологически активный фрагмент представляет собой полипептид, который обладает длиной, более короткой, чем длина полноразмерного встречающегося в природе белка, который, тем не менее, индуцирует иммунный ответ, аналогичный иммунному ответу, индуцируемому полноразмерным белком. Например, длина иммунологически активного фрагмента должна составлять, по меньшей мере, 8 остатков, и он должен быть способен стимулировать иммунную клетку, такую как T-клетка или B-клетка. Стимуляцию иммунных клеток можно выявлять путем определения клеточной пролиферации, выработки цитокинов (например, IL-2) или продукции антитела.
Если нет иных указаний, все технические и научные термины, используемые в настоящем описании, имеют такое значение, какое обычно понимает специалист в области, к которой относится это изобретение. Хотя на практике или при тестировании настоящего изобретения могут быть использованы способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящем документе, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем описании, полностью включены в настоящее описание путем ссылок. Ничто в настоящем документе не следует истолковывать как допущение того, что настоящее изобретение не дает права датировать такую публикацию более ранним числом на основании предшествующего изобретения.
В случае несоответствий, руководством будет служить настоящее описание, включая определения. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Одним из преимуществ способов, описанных в настоящем документе, является то, что заболевание идентифицируют до выявления явных клинических симптомов рака толстого кишечника. Другие признаки и преимущества данного изобретения будут понятны из следующего подробного описания и формулы изобретения.
Краткое описание рисунков
На фигуре 1 представлен уровень экспрессии гена TOM34 в различных тканях. (A) Полуколичественный ОТ-ПЦР-анализ гена TOM34 в раковых тканях толстого кишечника и соответствующей им нераковой слизистой ткани. T, опухолевая ткань; N, нормальная ткань. Экспрессия GAPDH служила в качестве внутреннего контроля. (B) Нозерн-блот-анализ TOM34 во множестве тканей. Размер транскрипта TOM34 составляет приблизительно 2,0 т.п.н.
На фигуре 2 представлен уровень экспрессии белка, кодируемого геном TOM34 в различных тканях. (A) Вестерн-блот-анализ TOM34 в раковых тканях толстого кишечника и соответствующей им нераковой слизистой ткани. T, опухолевая ткань; N, нормальная ткань. (B) Экспрессия TOM34 в клеточных линиях рака толстого кишечника. Экспрессия бета-актина служила в качестве внутреннего контроля.
На фигуре 3 представлен результат иммуногистохимического окрашивания TOM34 в раковых тканях толстого кишечника. (A и B) Репрезентативные изображения окрашивания в раковых и нераковых клетках. Увеличение: X40. (C и D) Изображения нормальной слизистой оболочки и раковых тканей (C, нормальная, D, опухолевая). Увеличение: X200.
На фигуре 4 представлен супрессирующий эффект siRNA против TOM34 на экспрессию гена TOM34 или рост клеток клеточной линии CRC. (A) Эффект siRNA на экспрессию TOM34 в клетках HCT116. Экспрессию TOM34 анализировали вестерн-блот-анализом. Экспрессия бета-актина служила в качестве внутреннего контроля. Для отрицательного контроля получали EGFP-специфичную siRNA (siEGFP). (B) Эффект TOM34-siRNA на рост клеток HCT116. Жизнеспособность клеток HCT116 в ответ на EGFP-siRNA или TOM34-siRNA определяли посредством MTT-теста в трех повторах. Величины ошибки, SD. Звездочкой указано значимое отличие (P<0,0001), определенное с помощью F-критерия Шиффа.
На фигуре 5 представлен цитотоксический эффект линии CTL, индуцированной 10-мерным пептидом TOM34-299. Для линий CTL, стимулированных 10-мерным пептидом TOM34-299, показана пептид-специфичная цитотоксичность.
Для линий CTL показана высокая цитотоксическая активность против клеток-мишеней (TISI), нагруженных TOM34-299, в то время как для них не было показано значительной цитотоксической активности против тех же клеток-мишеней (TISI), не нагруженных пептидом. Это показывает, что линии CTL обладают пептид-специфичной цитотоксичностью.
На фигуре 6 представлена сильная и пептид-специфичная цитотоксичность линий CTL, стимулированных посредством TOM34-299.
Для линий CTL показана сильная и антиген-специфичная цитотоксичность, выявляемая уже при соотношении E/T, составляющем 1,2.
На фигуре 7 представлена выраженная цитотоксичность клонов CTL. Могут быть получены клоны CTL с очень сильной цитотоксичностью, которые являются специфичными в отношении TOM34-299.
Для клонов CTL, полученных из линий CTL против TOM34-299, показаны различные активности в отношении уничтожения, где некоторые из них обладают очень сильной активностью.
На фигуре 8 представлена HLA-специфичность клонов CTL, индуцированных посредством TOM34-299. Клоны CTL, индуцированные посредством TOM34-299, распознают и лизируют опухолевые клетки, эндогенно экспрессирующие TOM34, с ограничением по HLA.
Цитотоксическую активность в отношении клеточных линий рака толстого кишечника DLD-1 и HT29, которые эндогенно экспрессируют TOM34, тестировали с использованием клонов CTL, индуцированных посредством TOM34-299 в качестве эффекторных клеток. Клетки SNU-C2A использовали в качестве мишени, которая эндогенно экспрессирует TOM34, но не экспрессирует HLA-A24. Для клонов CTL показана высокая цитотоксическая активность как против клеток DLD-1, так и против клеток HT29, которые экспрессируют TOM34, а также HLA-A24. С другой стороны, для них не показано значительной цитотоксической активности против клеток SNU-C2A, которые экспрессируют TOM34, но не экспрессируют HLA-A24.
На фигуре 9 представлена HLA-специфичность клонов CTL, индуцированных посредством TOM34-299. Клон CTL, индуцированный посредством TOM34-299, специфично распознает TOM34 с ограничением по HLA-A24.
Анализ ингибирования "холодной" мишенью проводили, как описано в "Материалах и способах". Клетки HT29, меченные Na2 51CrO4, получали в качестве "горячей" мишени, а клетки TISI, нагруженные или не нагруженные пептидом TOM34-299, использовали без мечения 51Cr в качестве "холодных" мишеней. Соотношение E/T было фиксировано на 20. Цитотоксическая активность клона CTL против клеток HT29 ингибировалась путем добавления клеток TISI, только когда они были нагружены пептидом.
На фигуре 10 представлена специфичность цитотоксической активности клона CTL, индуцированного посредством TOM34-299. Цитотоксическая активность клона CTL, индуцированного посредством TOM34-299, специфично блокировалась антителами, распознающими T-клеточные поверхностные антигены HLA I класса или CD8.
Цитотоксическую активность клона CTL против клеток HT29 определяли в присутствии антител, распознающих T-клеточные поверхностные антигены. Активность CTL заметно блокировалась добавлением антител, которые распознают HLA I класса или CD8, и на нее оказывало незначительное влияние добавление антител к HLA II класса или CD4, в то же время добавление контрольного антитела с совпадающим изотипом совсем ее не ингибировало.
Подробное описание изобретения
Как это используется в настоящем описании, форма единственного числа означает «по меньшей мере, один», если нет иных конкретных указаний. На протяжении этого описания и последующей формулы изобретения, если контекст не требует иного, слово "содержать" и его варианты, такие как "содержит" и "содержащий", следует понимать как заключающее в себе указанное число или стадию, или группу чисел или стадий, но не исключающее какого-либо другого числа или стадии, или группы чисел или стадий.
Настоящее изобретение основано, частично, на выявлении повышенной экспрессии TOM34 в клетках из тканей толстого кишечника пациентов с CRC. Повышенную экспрессию гена идентифицировали с использованием комплексной системы микроматриц кДНК.
Используя микроматрицу кДНК, содержащую 23040 генов, первоначально создавали комплексные профили экспрессии генов для 20 пациентов. У пациентов с CRC TOM34 экспрессируется на высоком уровне.
Идентифицированный в настоящем изобретении TOM34 используют для диагностических целей в качестве маркера CRC и в качестве гена-мишени, экспрессию которого изменяют для лечения или смягчения симптомов CRC.
Путем определения уровня экспрессии TOM34 в образце клеток диагностируют CRC. Аналогично, путем определения уровня экспрессии TOM34 в ответ на различные средства, можно идентифицировать и средства для лечения CRC.
Настоящее изобретение предусматривает определение (например, измерение) экспрессии TOM34. Используя информацию о последовательности, предоставляемую в записях базы данных GeneBank™ для последовательности TOM34, осуществляют выявление и количественное определение TOM34 с применением способов, хорошо известных специалисту в данной области. Например, последовательность в записях базы данных последовательностей, соответствующую TOM34, используют для конструирования зонда для определения последовательности РНК TOM34, например, в анализе нозерн-блот-гибридизации. В качестве другого примера, последовательности можно использовать для конструирования праймеров для специфичной амплификации TOM34, например, в способах определения на основе амплификации, таких как полимеразная цепная реакция на основе обратной транскрипции.
Затем уровень экспрессии TOM34 в тестируемой популяции клеток, например, в полученном от пациента образце тканей, сравнивают с уровнем экспрессии TOM34 в эталонной популяции. Эталонная популяция клеток включает одну или несколько клеток, для которых известен сравниваемый параметр, т.е. клетки CRC или клетки не CRC.
В любом случае, паттерн экспрессии генов в тестируемой популяции клеток по сравнению с эталонной популяцией клеток указывает на CRC или предрасположенность к нему, в зависимости от состава эталонной популяции. Например, если эталонная популяция клеток состоит из клеток не CRC, сходные паттерны экспрессии генов в тестируемой популяции клеток и эталонной популяции клеток указывает на то, что тестируемая популяция клеток представляет собой не CRC. Напротив, если эталонная популяция клеток состоит из клеток CRC, сходный профиль экспрессии генов между тестируемой популяцией клеток и эталонной популяцией клеток указывают на то, что тестируемая популяция клеток включает клетки CRC.
Уровень экспрессии TOM34 в тестируемой популяции клеток считают измененным по уровню экспрессии, если уровень его экспрессии отличается от эталонной популяции клеток с кратностью, составляющей более чем 1,0, 1,5, 2,0, 5,0, 10,0 или более, по сравнению с уровнем экспрессии соответствующего TOM34 в эталонной популяции клеток.
Отличающуюся экспрессию гена между тестируемой популяцией клеток и эталонной популяцией клеток нормализуют по отношению к контрольной нуклеиновой кислоте, например, к гену "домашнего хозяйства". Например, контрольная нуклеиновая кислота представляет собой кислоту, о которой известно, что она не отличается в зависимости от ракового или неракового состояния клетки. Уровни экспрессии контрольной нуклеиновой кислоты в тестируемой и эталонной нуклеиновой кислоте можно использовать для нормализации уровней сигнала в сравниваемых популяциях. Контрольные гены включают β-актин, глицеральдегид-3-фосфатдегидрогеназу или рибосомальный белок P1.
Тестируемую популяцию клеток сравнивают с множеством эталонных популяций клеток. Каждая из множества эталонных популяций может отличаться по известному параметру. Таким образом, тестируемую популяцию клеток можно сравнивать со второй эталонной популяцией клеток, о которой известно, что она содержит, например, клетки CRC, а также со второй эталонной популяцией, о которой известно, что она содержит, например, клетки не CRC (нормальные клетки). Тестируемая клетка входит в состав типа ткани или образца клеток от субъекта, о котором известно, что он обладает клетками CRC, или который предположительно обладает клетками CRC.
Тестируемую клетку получают из ткани организма или жидкости организма, например, из биологической жидкости (такой как кровь или моча). Например, тестируемую клетку очищают из ткани. Предпочтительно, тестируемая популяция клеток содержит эпителиальную клетку. Эпителиальная клетка представляет собой клетку из ткани, о которой известно, что она представляет собой CRC, или которая предположительно представляет собой CRC.
Клетки в эталонной популяции клеток получают из типа ткани, который является сходным с тестируемой клеткой. Необязательно, эталонная популяция клеток представляет собой клеточную линию, например клеточную линию CRC (положительный контроль) или нормальную линию клеток не CRC (отрицательный контроль). Альтернативно, контрольную клеточную популяцию получают из базы данных молекулярной информации, полученной из клеток, для которых известен анализируемый параметр или состояние.
Субъект предпочтительно представляет собой млекопитающее. Млекопитающее может представлять собой, например, человека, не относящегося к человеку примата, мышь, крысу, собаку, кошку, лошадь или корову.
Экспрессию TOM34, описанного в настоящем документе, определяют на уровне белка или нуклеиновой кислоты с использованием способов, известных в данной области. Например, для определения экспрессии гена можно использовать анализ нозерн-гибридизации с использованием зондов, которые специфично распознают последовательность. Альтернативно, экспрессию измеряют с использованием ПЦР-анализов на основе обратной транскрипции, например, с использованием праймеров, специфичных к TOM34. Экспрессию также определяют на белковом уровне, т.е. определением уровней полипептида, кодируемого генным продуктом, описанным в настоящем документе, или его биологической активности. Такие способы хорошо известны в данной области и включают, например, способы иммунологического анализа на основе антител к белку, кодируемому TOM34. Биологическая активность белка, кодируемого геном, также хорошо известна.
Диагностика CRC
В контексте настоящего изобретения CRC диагностируют путем определения уровня экспрессии TOM34 в тестируемой популяции клеток (т.е. в полученном от пациента биологическом образце). Предпочтительно, тестируемая популяция клеток содержит эпителиальную клетку, например, клетку, полученную из ткани толстого кишечника. Экспрессию генов также можно измерять в крови или других жидкостях организма, таких как моча. Для измерения уровней белка можно использовать другие биологические образцы. Например, уровень белка в крови или сыворотке, полученной от субъекта, подлежащего диагностированию, можно измерять путем иммунологического анализа или другого общепринятого биологического анализа.
Экспрессию TOM34 определяют в тестируемой клетке или биологическом образце и сравнивают с нормальным контрольным уровнем экспрессии, ассоциированным с анализируемым TOM34. Нормальный контрольный уровень представляет собой профиль экспрессии TOM34, как правило, обнаруживаемый в популяции, о которой известно, что в ней отсутствует CRC. Изменение (например, повышение) уровня экспрессии TOM34 в полученном от пациента образце указывает на то, что субъект страдает CRC или обладает риском развития CRC. Например, повышение экспрессии TOM34 в тестируемой популяции по сравнению с нормальным контрольным уровнем указывает на то, что субъект страдает CRC или обладает риском развития CRC.
Изменение TOM34 в тестируемой популяции по сравнению с нормальным контрольным уровнем указывает на то, что субъект страдает CRC или обладает риском развития CRC.
Уровень экспрессии TOM34 в биологическом образце можно оценивать количественным определением мРНК, соответствующей белку, кодируемому TOM34. Количественные способы для мРНК известны специалистам в данной области. Например, уровни мРНК TOM34 можно оценивать нозерн-блоттингом или ОТ-ПЦР. Поскольку нуклеотидные последовательности TOM34 известны, любой специалист в данной области может сконструировать нуклеотидные последовательности зондов или праймеров для количественного определения TOM34. Например, специфичный для TOM34 набор праймеров, содержащий нуклеотидную последовательность SEQ ID NO:43 и 44, представляет собой предпочтительный набор праймеров.
Также уровень экспрессии TOM34 можно анализировать, исходя из активности или количества белка TOM34. Способ определения количества белка TOM34 представлен ниже. Например, для определения белков в биологических материалах пригодными являются способы иммунологического анализа. В качестве биологического образца для определения белка или его активности можно использовать любые биологические материалы, при условии, что ген TOM34 экспрессируется в образце пациента с раком толстого кишечника. Например, в качестве такого биологического образца можно назвать образец ткани толстого кишечника. Однако также можно анализировать жидкости организма, такие как кровь и моча. С другой стороны, для определения активности белка, кодируемого геном TOM34, подходящий способ может быть выбран в соответствии с активностью подлежащего анализу белка.
Уровень экспрессии гена TOM34 в биологическом образце оценивают и сравнивают с уровнем в нормальном образце (например, в образце, полученном от субъекта без заболевания). Когда такое сравнение показывает, что уровень экспрессии генов выше, чем в нормальном образце, делают заключение, что субъект страдает раком толстого кишечника. Уровень экспрессии гена TOM34 в биологических образцах от нормального субъекта и субъекта, подлежащего диагностированию, можно определять одновременно. Альтернативно, нормальные диапазоны уровней экспрессии можно определять статистическим способом, исходя из результатов, полученных анализом уровня экспрессии гена в образцах, ранее полученных от контрольной группы. Результат, полученный путем сравнения образца субъекта, сравнивают с нормальным диапазоном; когда результат не соответствует нормальном диапазону, делают заключение, что субъект страдает раком толстого кишечника или обладает риском развития рака толстого кишечника.
В настоящем изобретении также предусмотрены диагностические средства для диагностики рака толстого кишечника. Диагностическое средство по настоящему изобретению содержит соединение, которое связывается с полинуклеотидом или полипептидом гена TOM34. Предпочтительно, в качестве такого соединения можно использовать олигонуклеотид, который гибридизуется с полинуклеотидом гена TOM34, или антитело, которое связывается с полипептидом, кодируемым геном TOM34. Более того, в качестве такого соединения также можно использовать аптамер, такой как РНК-, ДНК- или пептидный аптамер. Предпочтительно, диагностическое средство содержит обнаруживаемую метку, такую как флуоресцентная, люминесцентная или биолюминесцентная метка, которые широко известны в данной области.
Данный способ диагностики рака толстого кишечника можно применять для оценки эффективности лечения рака толстого кишечника у субъекта. В соответствии со способом от субъекта, подвергнутого лечению от рака толстого кишечника, получают биологический образец, такой как тестируемая популяция клеток. Способ оценки можно проводить в соответствии с общепринятыми способами диагностики рака толстого кишечника.
При необходимости, биологические образцы получают от субъекта в различные моменты времени до, в ходе или после лечения. Затем определяют уровень экспрессии гена TOM34 в биологическом образце и сравнивают с контрольным уровнем, полученным, например, для эталонной популяции клеток, которая включает клетки, о которых известно их состояние в отношении рака толстого кишечника (т.е. раковую клетку или нераковую клетку). Контрольный уровень определяют в биологическом образце, в случае которого не проводили лечение.
Если контрольный уровень получен для биологического образца, который не содержит раковых клеток, сходство между уровнем экспрессии в полученном от субъекта биологическом образце и контрольным уровнем указывает на то, что лечение является эффективным. Различие между уровнем экспрессии гена TOM34 в полученном от субъекта биологическом образце и контрольным уровнем указывает на менее благоприятный клинический исход или прогноз.
Идентификация средств, которые ингибируют экспрессию TOM34
Средство, которое ингибирует экспрессию TOM34 или активность его генного продукта, можно идентифицировать путем контактирования тестируемой популяции клеток, экспрессирующих TOM34, с тестируемым средством и последующим определением уровня экспрессии TOM34 или активности его генного продукта. Снижение уровня экспрессии TOM34 или уровня активности его генного продукта в присутствии этого средства по сравнению с уровнем экспрессии или активности в отсутствие тестируемого средства указывает на то, что средство является ингибитором TOM34 и что оно применимо для ингибирования CRC.
Тестируемая популяция клеток может представлять собой любую клетку, экспрессирующую TOM34. Например, тестируемая популяция клеток может содержать эпителиальную клетку, такую как клетка, источником которой является ткань толстого кишечника. Более того, тестируемая клетка может представлять собой иммортализованную клеточную линию, источником которой является клетка карциномы или рак ободочной и прямой кишки. Альтернативно, тестируемая клетка может представлять собой клетку, которую трансфицировали посредством TOM34 или которую трансфицировали регуляторной последовательностью (например, промоторной последовательностью) из TOM34, функционально связанной с репортерным геном.
Оценка эффективности лечения CRC у субъекта
TOM34 с отличающейся экспрессией, идентифицированный в данном изобретении, также позволяет проводить мониторинг курса лечения CRC. В этом способе тестируемую популяцию клеток получают от субъекта, прошедшего лечение от CRC. При необходимости, тестируемые популяции клеток получают от субъекта в различные моменты времени до, в ходе и/или после лечения. Затем определяют экспрессию TOM34 в клеточной популяции и сравнивают с эталонной популяцией клеток, которая включает клетки с известным состоянием в отношении CRC. В контексте настоящего изобретения эталонные клетки не должны представлять собой клетки, подвергавшиеся представляющему интерес лечению.
Если эталонная популяция клеток не содержит клеток CRC, сходство экспрессии TOM34 в тестируемой популяции клеток и эталонной популяции клеток указывает на то, что представляющее интерес лечение является эффективным. Однако различие в экспрессии TOM34 в тестируемой популяции и нормальной контрольной эталонной популяции клеток указывает на менее благоприятный клинический исход или прогноз. Аналогично, если эталонная популяция клеток содержит клетки CRC, различие в экспрессии TOM34 в тестируемой популяции клеток и эталонной популяции клеток указывает на то, что представляющее интерес лечение является эффективным, в то время как сходство в экспрессии TOM34 в тестируемой популяции и контрольной эталонной популяции раковых клеток указывает на менее благоприятный клинический исход или прогноз.
Кроме того, уровень экспрессии TOM34, определенный в биологическом образце, полученном от субъекта после лечения (т.е. уровни после лечения), можно сравнивать с уровнем экспрессии TOM34, определенным в биологическом образце, полученном от субъекта до начала лечения (т.е. уровни до лечения). Снижение уровня экспрессии TOM34 в образце после лечения указывает на то, что представляющее интерес лечение является эффективным, в то время как повышение или сохранение уровня экспрессии в образце после лечения указывает на менее благоприятный клинический исход или прогноз.
Как его используют в настоящем описании, термин "эффективный" указывает на то, что лечение приводит к снижению экспрессии гена с патологически повышенной активностью, или к снижению размера, распространенности или метастатического потенциала CRC у субъекта. Когда представляющее интерес лечение проводят в профилактических целях, термин "эффективный" означает, что лечение замедляет или предотвращает образование CRC или замедляет, предотвращает или смягчает симптом клинического CRC. Оценку опухолей толстого кишечника можно проводить с использованием стандартных клинических протоколов.
Кроме того, эффективность может быть определена совместно с любым известным способом диагностики или лечения CRC. CRC можно диагностировать, например, путем идентификации симптоматических аномалий, например, снижения массы тела, боли в животе, боли в спине, анорексии, тошноты, рвоты и генерализованного дискомфорта, слабости и желтухи.
Выбор лекарственного средства для лечения CRC, которое является подходящим для конкретного индивида
Различия в генетической структуре индивидов могут приводить к различиям в их относительных способностях метаболизировать различные лекарственные средства. Средство, которое метаболизируется у субъекта с оказанием воздействия в качестве средства против CRC, может проявлять себя путем индукции изменения паттерна экспрессии гена в клетках субъекта, от паттерна, свойственного раковому состоянию, до паттерна экспрессии гена, свойственного нераковому состоянию. Таким образом, TOM34 с отличающейся экспрессией, описанный в настоящем документе, дает возможность тестирования предполагаемого терапевтического или профилактического ингибитора CRC в тестируемой популяции клеток от выбранного субъекта, чтобы определить, является ли средство подходящим ингибитором CRC у субъекта.
Для идентификации ингибитора CRC, который является подходящим для конкретного субъекта, тестируемую популяцию клеток от субъекта подвергают воздействию лекарственного средства и определяют экспрессию TOM34.
В контексте способа по настоящему изобретению тестируемая популяция клеток содержит клетку CRC, экспрессирующую TOM34. Предпочтительно, тестируемая клетка представляет собой эпителиальную клетку. Например, тестируемую популяцию клеток можно инкубировать в присутствии средства-кандидата, и можно определять паттерн экспрессии генов тестируемой популяции клеток и сравнивать с одним или несколькими эталонными профилями, например, с эталонным профилем экспрессии CRC или эталонным профилем экспрессии не CRC.
Снижение экспрессии TOM34 в тестируемой популяции клеток относительно эталонной популяции клеток, содержащей CRC, указывает на то, что средство обладает терапевтическим потенциалом.
В контексте настоящего изобретения тестируемое средство может представлять собой любое соединение или композицию. Иллюстративные тестируемые средства включают, но не ограничиваются ими, иммуномодулирующие средства.
Скрининговые анализы для идентификации лекарственных средств
Используя ген TOM34, белки, кодируемые геном, или участок регуляции транскрипции гена, можно проводить скрининг соединений, которые изменяют экспрессию гена или биологическую активность полипептида, кодируемого геном. Такие соединения используют в качестве фармацевтических средств для лечения или профилактики CRC.
Таким образом, настоящее изобретение предусматривает способ скрининга соединений для лечения или профилактики CRC с использованием полипептида TOM34. Вариант осуществления этого способа скрининга включает стадии:
a) контактирования тестируемого соединения с полипептидом, кодируемым полинуклеотидом TOM34;
b) выявления активности связывания между полипептидом и тестируемым соединением; и
c) выбора тестируемого соединения, которое связывается с полипептидом.
Полипептид TOM34, который используется для скрининга, может представлять собой рекомбинантный полипептид или белок из природного источника, или его неполный пептид. Полипептид, который контактирует с тестируемым соединением, может представлять собой, например, очищенный полипептид, растворимый белок, форму, связанную с носителем, или слитый белок, слитый с другими полипептидами.
В качестве способа скрининга белков, например, которые связываются с полипептидом TOM34, с использованием полипептида TOM34, можно применять многие способы, хорошо известные специалисту в данной области. Такой скрининг можно проводить, например, способом иммунопреципитации, конкретно, следующим образом. Ген, кодирующий полипептид TOM34, экспрессируют в клетках хозяина (например, животного) и т.д., путем встраивания гена в экспрессирующий вектор для чужеродных генов, такой как pSV2neo, pкDNA I, pкDNA3.1, pCAGGS и pCD8. Промотор, который используется для экспрессии, может представлять собой любой промотор, который может быть обычно использован, и он включает, например, ранний промотор SV40 (Rigby in Williamson (ed.), Genetic Engineering, vol. 3. Academic Press, London, 83-141 (1981)), промотор EF-α (Kim DW, et al., Gene 91: 217-23 (1990)), промотор CAG (Niwa et al., Gene 108: 193-9 (1991)), промотор RSV LTR (Cullen, Methods in Enzymology 152: 684-704 (1987)), промотор SRα (Takebe et al., Mol Cell Biol 8: 466-72 (1988)), предранний промотор CMV (Seed and Aruffo, Proc Natl Acad Sci USA 84: 3365-9 (1987)), поздний промотор SV40 (Gheysen and Fiers, J Mol Appl Genet 1: 385-94 (1982)), поздний промотор аденовируса (Kaufman et al., Mol Cell Biol 9: 946-58 (1989)), промотор HSV TK и т.д. Введение гена в клетку-хозяина для экспрессии чужеродного гена можно проводить в соответствии с любыми способами, например, способом электропорации (Chu et al., Nucleic Acids Res 15: 1311-26 (1987)), способом с фосфатом кальция (Chen and Okayama, Mol Cell Biol 7: 2745-52 (1987)), способом с DEAE-декстраном (Lopata et al., Nucleic Acids Res 12: 5707-17 (1984); Sussman and Milman, Mol Cell Biol 4: 1641-3 (1984)), способом с липофектином (Derijard, B Cell 76: 1025-37 (1994); Lamb et al., Nature Genetics 5: 22-30 (1993): Rabindran et al., Science 259: 230-4 (1993)) и т.д. Полипептид, кодируемый геном TOM34, можно экспрессировать в качестве слитого белка, содержащего участок распознавания (эпитоп) моноклонального антитела, путем встраивания эпитопа моноклонального антитела с выявленной специфичностью на N- или C-конец полипептида. Можно использовать коммерчески доступную систему эпитоп-антитело (Experimental Medicine 13: 85-90 (1995)). Векторы, которые могут экспрессировать слитый белок, например, с β-галактозидазой, связывающим мальтозу белком, глутатион-S-трансферазой, зеленым флуоресцентным белком (GFP) и т.д. посредством использования их сайтов множественного клонирования, являются коммерчески доступными.
Также описан слитый белок, полученный встраиванием только небольших эпитопов, имеющих от нескольких до двенадцати аминокислот, так чтобы при слиянии свойства полипептида TOM34 не изменялись. В качестве системы эпитоп-антитело для скрининга белков, связывающихся с полипептидом TOM34, могут быть использованы эпитопы, такие как полигистидин (His-tag), агрегат HA гриппа, c-myc человека, FLAG, гликопротеин вируса везикулярного стоматита (VSV-GP), белок гена 10 T7 (T7-tag), гликопротеин вируса простого герпеса человека (HSV-tag), E-tag (эпитоп на моноклональном фаге) и т.п., и моноклональные антитела, распознающие их (Experimental Medicine 13: 85-90 (1995)).
В случае иммунопреципитации, при добавлении этих антител к клеточному лизату, полученному с использованием соответствующего детергента, образуется иммунный комплекс. Иммунный комплекс состоит из полипептида TOM34, полипептида, обладающего способностью связываться с полипептидом, и антитела. Помимо использования антител против указанных выше эпитопов, имммунопреципитацию также можно проводить с использованием антител против полипептида TOM34, причем антитела могут быть получены, как описано выше.
Когда антитело представляет собой антитело IgG мыши, иммунный комплекс можно преципитировать, например, с помощью белок А-сефарозы или белок G-сефарозы. Если полипептид, кодируемый геном TOM34, получают в качестве слитого белка с эпитопом, таким как GST, иммунный комплекс может быть образован таким же образом, как в случае использования антитела против полипептида TOM34, с использованием вещества, специфично связывающегося с этими эпитопами, такого как глутатион-сефароза 4B.
Иммунопреципитацию можно проводить согласно или соответственно, например, способам из литературы (Harlow and Lane, Antibodies, 511-52, Cold Spring Harbor Laboratory publications, New York (1988)).
Для анализа иммунопреципитированных белков обычно используют SDS-PAGE, и связывающийся белок можно анализировать по молекулярной массе белка с использованием гелей с соответствующей концентрацией. Поскольку белок, связавшийся с полипептидом TOM34, трудно выявить обычным способом окрашивания, таким как окрашивание Кумасси или окрашивание серебром, чувствительность обнаружения белка можно повысить культивированием клеток в культуральной среде, содержащей радиоактивный изотоп, 35S-метионин или 35S-цистеин, мечением белков в клетках и выявлением белков. Белок-мишень можно очищать непосредственно из SDS-полиакриламидного геля и, когда определена молекулярная масса белка, может быть определена его последовательность.
В качестве способа скрининга белков, связывающихся с полипептидом TOM34, с применением полипептида можно использовать, например, вестерн-блоттинг-анализ (Skolnik et al., Cell 65: 83-90 (1991)). Конкретно, связывание белка с полипептидом TOM34 может быть достигнуто путем получения библиотеки кДНК из клеток, тканей, органов (например, тканей, таких как яичко или яичник), или культивируемых клеток (например, CW2, DLD1, HCT116, HCT15, RKO, LS174T), предположительно экспрессирующих белок, связывающийся с полипептидом TOM34, используя фаговый вектор (например, ZAP), экспрессирующий белок на LB-агарозе, фиксируя экспрессированный белок на фильтре, подвергая взаимодействию очищенный и меченый полипептид TOM34 с указанным выше фильтром, и определяя с помощью метки бляшки, экспрессирующие белки, связывающиеся с полипептидом TOM34. Полипептид по настоящему изобретению можно метить, используя связывание между биотином и авидином, или используя антитело, которое специфично связывается с полипептидом TOM34, или пептидом или полипептидом (например, GST), слитым с полипептидом TOM34. Также можно использовать способы с применением радиоизотопа или флуоресценции и т.д.
Альтернативно, в другом варианте осуществления способа скрининга по настоящему изобретению можно применять клетки, использующие двухгибридную систему ("MATCHMAKER Two-Hybrid system", "MATCHMAKER Mammalian Two-Hybrid Assay Kit", "MATCHMAKER one-Hybrid system" (Clontech); "HybriZAP Two-Hybrid Vector System" (Stratagene); ссылки "Dalton and Treisman, Cell 68: 597-612 (1992)", "Fields and Sternglanz, Trends Genet 10: 286-92 (1994)").
В двухгибридной системе полипептид по настоящему изобретению сливают с SRF-связывающим участком или GAL4-связывающим участком и экспрессируют в дрожжевых клетках. Получают библиотеку кДНК из клеток, предположительно экспрессирующих белок, связывающийся с полипептидом по настоящему изобретению, так чтобы при экспрессии происходило слияние библиотеки с участком активации транскрипции VP16 или GAL4. Затем библиотеку кДНК вводят в указанные выше дрожжевые клетки и из выявленных положительных клонов выделяют кДНК из библиотеки (когда белок, связывающийся с полипептидом по настоящему изобретению, экспрессируется в дрожжевых клетках, связывание двух белков активирует репортерный ген, приводя к положительным определяемым клонам). Белок, кодируемый кДНК, может быть получен введением указанной выше выделенной кДНК в E.coli и экспрессией белка.
В дополнение к гену HIS3 в качестве репортерного гена можно использовать, например, ген Ade2, ген lacZ, ген CAT, ген люциферазы и т.п.
Соединение, связывающееся с полипептидом, кодируемым геном TOM34, также может быть подвергнуто скринингу с использованием аффинной хроматографии. Например, полипептид по настоящему изобретению можно иммобилизовать на носителе аффинной колонки, и тестируемое соединение, содержащее белок, способный связываться с полипептидом по настоящему изобретению, наносят на колонку. Тестируемое соединение в данном описании может представлять собой, например, клеточные экстракты, клеточные лизаты и т.д. После нанесения тестируемого соединения колонку промывают, и могут быть получены соединения, связывающиеся с полипептидом по настоящему изобретению.
Когда тестируемое соединение представляет собой белок, для получения ДНК, кодирующей белок, анализируют аминокислотную последовательность полученного белка, исходя из последовательности синтезируют ДНК-олигонуклеотид и проводят скрининг библиотек кДНК с использованием олигонуклеотида ДНК в качестве зонда.
В настоящем изобретении в качестве способа обнаружения и количественного определения связывающегося соединения можно применять биосенсор с использованием эффекта поверхностного плазмонного резонанса. При использовании такого биосенсора взаимодействие между полипептидом по настоящему изобретению и тестируемым соединением можно исследовать в реальном времени в качестве сигнала поверхностного плазмонного резонанса, используя только небольшое количество полипептида и без применения мечения (например, BIAcore, Pharmacia). Таким образом, с использованием биосенсора, такого как BIAcore, можно оценивать связывание между полипептидом по настоящему изобретению и тестируемым соединением.
Способы скрининга молекул, которые связываются, когда иммобилизованный полипептид TOM34 подвергают воздействию синтетических химических соединений или группы природных веществ, или библиотеки фагового пептидного дисплея, и способы скрининга с использованием высокопроизводительных способов на основе комбинаторной химии (Wrighton et al., Science 273: 458-64 (1996); Verdine, Nature 384: 11-13 (1996); Hogan, Nature 384: 17-9 (1996)) для выделения не только белков, но и химических соединений, которые связываются с белком TOM34 (включая агонист и антагонист), хорошо известны специалисту в данной области.
Альтернативно, настоящее изобретение предусматривает способ скрининга соединения для лечения или профилактики CRC с использованием полипептида, кодируемого геном TOM34, включающий следующие стадии:
a) контактирования тестируемого соединения с полипептидом, кодируемым полинуклеотидом TOM34;
b) выявления биологической активности полипептида стадии (a); и
c) выбора тестируемого соединения, которое подавляет биологическую активность полипептида, кодируемого полинуклеотидом TOM34, по сравнению с биологической активностью указанного полипептида, выявленной в отсутствие тестируемого соединения.
Поскольку белок TOM34 обладает активностью в отношении запуска пролиферации клеток CRC, соединение, которое ингибирует эту активность данного белка, можно подвергать скринингу с использованием этой активности в качестве показателя.
Для скрининга можно использовать любые полипептиды, при условии, что они обладают биологической активностью белка TOM34. Такая биологическая активность включает активность белка TOM34 человека в отношении пролиферации клеток. Например, можно использовать белок TOM34 человека, а также можно использовать полипептиды, функционально эквивалентные этим белкам. Такие полипептиды могут быть экспрессированы клетками эндогенно или экзогенно.
Соединение, выделенное с помощью этого скрининга, является кандидатом для агонистов или антагонистов полипептида, кодируемого геном TOM34. Термин "агонист" относится к молекулам, которые активируют функцию полипептида посредством связывания с ним. Аналогично, термин "антагонист" относится к молекулам, которые ингибируют функцию полипептида посредством связывания с ним. Кроме того, соединение, выделенное с помощью этого скрининга, является кандидатом для соединений, которые ингибируют in vivo взаимодействие полипептида TOM34 с молекулами (включая ДНК и белки).
Когда биологическая активность, подлежащая обнаружению в данном способе, представляет собой клеточную пролиферацию, ее можно выявлять, например, путем получения клеток, которые экспрессируют полипептид TOM34, культивирования клеток в присутствии тестируемого соединения и определения скорости пролиферации клеток, измерения клеточного цикла и т.п., а также путем измерения активности в отношении образования колоний, как описано в примерах.
В другом варианте осуществления настоящее изобретение относится к способам скрининга соединений для лечения или профилактики CRC. Как подробно описано выше, контролируя уровни экспрессии TOM34, можно контролировать начало и прогрессию CRC. Таким образом, соединения, которые могут быть использованы для лечения или профилактики CRC, можно идентифицировать посредством скрининга, где в качестве показателей используют уровни экспрессии TOM34. В контексте настоящего изобретения такой скрининг может включать, например, следующие стадии:
a) контактирования соединения-кандидата с клеткой, экспрессирующей TOM34; и
b) выбора соединения-кандидата, снижающего уровень экспрессии TOM34 по сравнению с контрольным уровнем в отсутствие соединения-кандидата.
Клетки, экспрессирующие TOM34, включают, например, клеточные линии, полученные из CRC; такие клетки можно использовать для указанного выше скрининга по настоящему изобретению (например, CW2, DLD1, HCT116, RKO, LS174T). Уровень экспрессии можно оценивать способами, хорошо известными специалисту в данной области. В способе скрининга соединение, которое снижает уровень экспрессии TOM34, может быть выбрано в качестве средства-кандидата для применения в целях лечения или профилактики CRC.
Альтернативно, способ скрининга по настоящему изобретению может включать следующие стадии:
a) контактирования соединения-кандидата с клеткой, в которую введен вектор, содержащий участок регуляции транскрипции TOM34 и репортерный ген, который экспрессируется под контролем участка регуляции транскрипции;
b) определения экспрессии или активности указанного репортерного гена; и
c) выбора соединения-кандидата, снижающего экспрессию или активность указанного репортерного гена.
Подходящие репортерные гены и клетки-хозяева хорошо известны в данной области. Репортерная конструкция, необходимая для скрининга, может быть получена с использованием участка регуляции транскрипции маркерного гена. Если участок регуляции транскрипции маркерного гена известен специалистам в данной области, то репортерная конструкция может быть получена с использованием предшествующей информации о последовательности. Если участок регуляции транскрипции маркерного гена остается неопределенным, нуклеотидный сегмент, содержащий участок регуляции транскрипции, можно выделить из геномной библиотеки, исходя из информации о нуклеотидной последовательности маркерного гена.
Примеры подложек, которые могут быть использованы для связывания белков, включают нерастворимые полисахариды, такие как агароза, целлюлоза и декстран; и синтетические смолы, такие как полиакриламид, полистирол и силикон; предпочтительно можно использовать коммерчески доступные гранулы и планшеты (например, многолуночные планшеты, биосенсорный чип и т.д.), изготовленные из указанных выше материалов. При использовании гранул ими можно наполнять колонку.
Связывание белка с подложкой можно проводить в соответствии с общепринятыми способами, такими как химическое связывание и физическая адсорбция. Альтернативно, белок может быть связан с подложкой посредством антител, специфично распознающих белок. Кроме того, связывание белка с подложкой также можно проводить с помощью авидина и биотина.
Связывание белков проводят в буфере, например, но не ограничиваясь ими, в фосфатном буфере и Трис-буфере, при условии, что буфер не ингибирует связывание между белками.
В настоящем изобретении в качестве способа обнаружения или количественного определения связанного белка можно применять биосенсор с использованием эффекта поверхностного плазмонного резонанса. При использовании такого биосенсора взаимодействие между белками можно исследовать в реальном времени в качестве сигнала поверхностного плазмонного резонанса, с использованием только небольших количеств полипептида и без применения мечения (например, BIAcore, Pharmacia).
Альтернативно, полипептид TOM34 можно метить и метку связываемого белка можно использовать для обнаружения и количественного определения связанного белка. Конкретно, после предварительного мечения одного из белков меченый белок приводят в контакт с другим белком в присутствии тестируемого соединения, а затем связанные белки после промывания выявляют или количественно определяют с помощью метки.
Для мечения белка в данном способе можно использовать средства для мечения, такие как радиоизотопы (например, 3H, 14C, 32P, 33P, 35S, 125I, 131I), ферменты (например, щелочная фосфатаза, пероксидаза хрена, β-галактозидаза, β-глюкозидаза), флуоресцентные вещества (например, флуоресцеинизотиоцианат (FITC), родамин) и биотин/авидин. Когда белок метят радиоизотопом, обнаружение или количественное определение можно проводить путем жидкостной сцинтилляции. Альтернативно, белки, меченные ферментами, можно выявлять или количественно определять путем добавления субстрата фермента для определения с помощью абсорбциометра ферментативного изменения субстрата, такого как образование окраски. Далее, в случае, когда в качестве метки используют флуоресцентное вещество, связанный белок можно выявлять или количественно определять с использованием флуорофотометра.
В случае применения антитела в данном скрининге, антитело предпочтительно метят одним из средств для мечения, упомянутых выше, и выявляют или количественно определяют на основе средства для мечения. Альтернативно, антитело против полипептида TOM34 или актина можно использовать в качестве первичного антитела, выявляемого вторичным антителом, которое мечено средством для мечения. Кроме того, антитело, связанное с белком в скрининге по настоящему изобретению, можно выявлять или количественно определять с использованием колонки с белком G или белком A.
Альтернативно, в другом варианте осуществления способа скрининга по настоящему изобретению можно использовать клетки, использующие двухгибридную систему ("MATCHMAKER Two-Hybrid system", "MATCHMAKER Mammalian Two-Hybrid Assay Kit", "MATCHMAKER one-Hybrid system" (Clontech); "HybriZAP Two-Hybrid Vector System" (Stratagene); ссылки "Dalton and Treisman, Cell 68: 597-612 (1992)", "Fields and Sternglanz, Trends Genet 10: 286-92 (1994)").
В двухгибридной системе проводят слияние полипептида TOM34 по настоящему изобретению с SRF-связывающим или GAL4-связывающим участком и экспрессируют в дрожжевых клетках.
В качестве репортерного гена, помимо гена HIS3, можно использовать, например, ген Ade2, ген lacZ, ген CAT, ген люциферазы и т.п.
В способах скрининга по настоящему изобретению можно использовать любое тестируемое соединение, например, клеточные экстракты, супернатант клеточной культуры, продукты ферментации микроорганизмов, экстракты из морских организмов, растительные экстракты, очищенные или неочищенные белки, пептиды, непептидные соединения, синтетические микромолекулярные соединения и природные соединения. В настоящем изобретении тестируемое соединение также можно получать, используя любой из множества подходов к способам комбинаторных библиотек, известных в данной области, включая (1) биологические библиотеки, (2) пространственно адресуемые параллельные твердофазные или жидкофазные библиотеки, (3) способы синтетических библиотек, требующие упрощения, (4) способ библиотек "одна гранула-одно соединение" и (5) способы синтетических библиотек с использованием селекции методом аффинной хроматографии. Способы биологических библиотек с использованием селекции методом аффинной хроматографии ограничиваются пептидными библиотеками, в то время как другие четыре похода применимы к библиотекам пептидов, непептидных олигомеров или низкомолекулярных соединений (Lam (1997) Anticancer Drug Des. 12: 145-67). Примеры способов синтеза молекулярных библиотек могут быть найдены в данной области (DeWitt et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6909-13; Erb et al. (1994) Proc. Natl. Acad. Sci. USA 91: 11422-6; Zuckermann et al. (1994) J. Med. Chem. 37: 2678-85; Cho et al. (1993) Science 261: 1303-5; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33: 2059; Carell et al. (1994) Angew. Chem. Int. Ed. Engl. 33: 2061; Gallop et al. (1994) J. Med. Chem. 37: 1233-51). Библиотеки соединений могут находиться в растворе (см. Houghten (1992) Bio/Techniques 13: 412-21) или на гранулах (Lam (1991) Nature 354: 82-4), чипах (Fodor (1993) Nature 364: 555-6), бактериях (патент США No. 5223409), спорах (патент США. No. 5571698; 5403484 и 5223409), плазмидах (Cull et al. (1992) Proc. Natl. Acad. Sci. USA 89: 1865-9) или фагах (Scott and Smith (1990) Science 249: 386-90; Devlin (1990) Science 249: 404-6; Cwirla et al. (1990) Proc. Natl. Acad. Sci. USA 87: 6378-82; Felici (1991) J. Mol. Biol. 222: 301-10; патентная заявка США 2002103360).
Соединение, выделенное способами скрининга по настоящему изобретению, является кандидатом для лекарственных средств, которые ингибируют активность полипептида TOM34, для лечения или профилактики заболеваний, относящихся, например, к клеточно-пролиферативным заболеваниям, таким как CRC. Соединение, в котором часть структуры соединения, полученного данными способами скрининга по настоящему изобретению, преобразована путем вставки, делеции и/или замены, относится к соединениям, полученным способами скрининга по настоящему изобретению.
Фармацевтические композиции для лечения или профилактики CRC
При введении соединения, выделенного способом по настоящему изобретению, в качестве фармацевтического средства для человека и других млекопитающих, таких как мыши, крысы, морские свинки, кролики, кошки, собаки, овцы, свиньи, крупный рогатый скот, обезьяны, бабуины и шимпанзе, выделенное соединение можно вводить непосредственно или его можно составить в дозированную форму, используя известные способы получения фармацевтических средств. Например, в соответствии с потребностью, лекарственные средства можно принимать орально в виде покрытых сахаром таблеток, капсул, эликсиров и микрокапсул, или не орально, в форме инъекций стерильных растворов или суспензий с водой или любой другой фармацевтически приемлемой жидкостью. Например, соединения можно смешивать с фармацевтически приемлемыми носителями или средами, конкретно, стерилизованной водой, физиологическим раствором, растительными маслами, эмульгаторами, суспендирующими веществами, поверхностно-активными веществами, стабилизаторами, вкусовыми добавками, эксципиентами, носителями, консервантами, связующими веществами и т.п., в стандартной лекарственной форме, требуемой для общепринятого внедрения лекарственных средств. Количество активного ингредиента, содержащееся в таком препарате, обеспечивает достижение подходящей дозы в указанном диапазоне.
Примеры добавок, которые могут быть добавлены в таблетки и капсулы, включают, но не ограничиваются ими, связующие вещества, такие как желатин, кукурузный крахмал, трагакантовая камедь и аравийская камедь; эксципиенты, такие как кристаллическая целлюлоза; способствующие набуханию вещества, такие как кукурузный крахмал, желатин и альгиновая кислота; смазывающие вещества, такие как стеарат магния; подсластители, такие как сахароза, лактоза или сахарин; и вкусовые добавки, такие как мята перечная, масло Gaultheria adenothrix и вишня. Когда стандартной лекарственной формой является капсула, в указанные выше ингредиенты может быть дополнительно включен жидкий носитель, такой как масло. Стерильные составы для инъекции можно составлять в соответствии с обычными способами применения лекарственных средств с использованием носителей, таких как дистиллированная вода, подходящая для инъекции.
В качестве водных растворов дли инъекции можно использовать физиологический раствор, глюкозу и другие изотонические жидкости, включая адъюванты, такие как D-сорбит, D-манноза, D-маннит и хлорид натрия. Их можно использовать совместно с подходящими солюбилизаторами, такими как спирт, например, этанол; полиспирты, такие как пропиленгликоль и полиэтиленгликоль; и неионные поверхностно-активные вещества, такие как Полисорбат 80 (TM) и HCO-50.
В качестве масляной жидкости можно использовать кунжутное масло или соевое масло, которые можно использовать совместно с бензилбензоатом или бензиловым спиртом в качестве солюбилизатора, и их можно составлять с буфером, таким как фосфатный буфер и натрий-ацетатный буфер; болеутоляющим средством, таким как прокаина гидрохлорид; стабилизатором, таким как бензиловый спирт и фенол, и/или антиоксидантом. Полученным составом для инъекции можно заполнять подходящую ампулу.
Для введения фармацевтической композиции по настоящему изобретению пациентам, например в виде внутриартериальной, внутривенной или подкожной инъекции или в виде интраназального, трансбронхиального, внутримышечного или орального введения, можно использовать способы, хорошо известные специалистам в данной области. Доза и способ введения варьируют в зависимости от массы тела и возраста пациента и способа введения; однако специалист в данной области может соответственно выбрать подходящий способ введения. Если указанное соединение кодируется ДНК, то для проведения терапии ДНК может быть вставлена в вектор для генной терапии и вектор введен пациенту. Доза и способ введения варьируют в зависимости от массы тела, возраста и симптомов пациента; однако специалист в данной области может выбрать подходящие.
Например, хотя доза соединения, которое связывается с белком по настоящему изобретению и регулирует его активность, зависит от симптомов, при оральном введении нормальному взрослому человеку (масса 60 кг), доза, как правило, составляет от приблизительно 0,1 мг до приблизительно 100 мг в сутки, предпочтительно от приблизительно 1,0 мг до приблизительно 50 мг в сутки и более предпочтительно от приблизительно 1,0 мг до приблизительно 20 мг в сутки.
При парентеральном введении соединения в форме инъекции нормальному взрослому человеку (масса 60 кг), хотя существуют некоторые различия в зависимости от пациента, органа-мишени, симптомов и способа введения, удобной является внутривенная инъекция дозы от приблизительно 0,01 мг до приблизительно 30 мг в сутки, предпочтительно от приблизительно 0,1 до приблизительно 20 мг в сутки и более предпочтительно от приблизительно 0,1 до приблизительно 10 мг в сутки. В случае других животных, подходящее количество дозы можно вычислить обычным способом путем преобразования относительно 60 кг массы тела.
Оценка прогноза у субъекта с CRC
Настоящее изобретение также относится к способу оценки прогноза у субъекта с CRC, включающему стадию сравнения экспрессии TOM34 в тестируемой популяции клеток с экспрессией TOM34 в эталонной популяции клеток, полученной от пациентов в диапазоне стадий заболевания. Путем сравнения экспрессии гена TOM34 в тестируемой популяции клеток и эталонной популяции(ях) клеток, или путем сравнения паттерна экспрессии гена с течением времени в тестируемых популяциях клеток, полученных от субъекта, можно оценивать прогноз для субъекта.
Например, повышение экспрессии TOM34 по сравнению с нормальным контролем указывает на менее благоприятный прогноз. Напротив, сходство экспрессии TOM34 с нормальным контролем указывает на более благоприятный прогноз у субъекта.
Наборы
Также настоящее изобретение относится к реагенту для обнаружения CRC, например, к нуклеиновой кислоте, которая специфично связывается с нуклеиновыми кислотами TOM34 или идентифицирует их, такой как олигонуклеотидные последовательности, комплементарные участку нуклеиновой кислоты TOM34, или к антителу, которое связывается с белками, кодируемыми нуклеиновой кислотой TOM34, или к аптамеру. Реагенты для обнаружения могут быть упакованы совместно в форме набора. Например, реагенты для обнаружения могут быть упакованы в отдельные контейнеры, например, с нуклеиновой кислотой или антителом (либо связанными с твердой матрицей, либо упакованными отдельно с реагентами для связывания их с матрицей), с контрольным реагентом (положительным и/или отрицательным) и/или с обнаруживаемой меткой. Также в набор могут быть включены инструкции (например, напечатанные, записанные на магнитную ленту, VCR, CD-ROM и т.д.) для проведения анализа. Формат анализа набора может представлять собой нозерн-гибридизацию или "сэндвич"-ELISA, оба из которых известны в данной области.
Например, реагент для обнаружения CRC может быть иммобилизован на твердой матрице, такой как пористая полоска, для формирования, по меньшей мере, одной области обнаружения CRC. Область пористой полоски для измерения или обнаружения может включать множество областей, каждая из которых содержит нуклеиновую кислоту. Полоска для тестирования также может содержать области для отрицательного и/или положительного контролей. Альтернативно, контрольные области могут быть расположены на полоске, отдельной от полоски для тестирования. Необязательно, различные области обнаружения могут содержать различные количества иммобилизованных нуклеиновых кислот, т.е. большее количество в первой области обнаружения и меньшие количества в последующих областях. При добавлении тестируемого образца количество участков, воспроизводящих обнаруживаемый сигнал, отражает количественный показатель количества CRC, представленного в образце. Области обнаружения могут формироваться в любой соответственно обнаруживаемой форме и, как правило, они представлены в форме полосы или пятна, перекрывающего ширину панели для тестирования.
Способы ингибирования CRC
Настоящее изобретение дополнительно относится к способу лечения или смягчения симптома CRC у субъекта путем снижения экспрессии TOM34 (или активности его генного продукта). Подходящие терапевтические соединения можно вводить профилактически или терапевтически субъекту, страдающему CRC или обладающему риском развития (или восприимчивостью к) CRC. Такие субъекты могут быть идентифицированы с использованием стандартных клинических способов или путем обнаружения отклоненного уровня экспрессии TOM34 или измененной активности его генного продукта. В контексте настоящего изобретения подходящие терапевтические средства включают, например, ингибиторы регуляции клеточного цикла и клеточной пролиферации.
Альтернативно, способ лечения по настоящему изобретению может включать стадию уменьшения экспрессии, функции, или как экспрессии, так и функции генных продуктов TOM34, экспрессия которых аберрантно повышена (ген "с повышенной активностью" или "со сверхэкспрессией") в клетках толстого кишечника. Экспрессию можно ингибировать любым из нескольких способов, известных в данной области. Например, экспрессию можно ингибировать введением субъекту нуклеиновой кислоты, которая ингибирует экспрессию или является антагонистом экспрессии, сверхэкспрессированного гена, например, введением антисмыслового олигонуклеотида или малой интерферирующей РНК, которая прекращает экспрессию сверхэкспрессированного гена.
Безусловно, в описанных в настоящем документе вариантах осуществления способов лечения или смягчения течения используется, с соответствующими изменениями, применение соединения, которое снижает экспрессию TOM34 (или активность его генного продукта), как описано в настоящем документе, для получения фармацевтической композиции для лечения или смягчения течения рака толстого кишечника у субъекта. Такое соединение может представлять собой, например, антисмысловую последовательность, siRNA, антитело, аптамеры или рибозимную композицию.
Антисмысловые нуклеиновые кислоты и siRNA
Как указано выше, для снижения уровня экспрессии гена можно использовать антисмысловые нуклеиновые кислоты, соответствующие нуклеотидной последовательности TOM34. Антисмысловые нуклеиновые кислоты, соответствующие TOM34, который обладает повышенной активностью при CRC, могут использоваться для лечения CRC. Конкретно, антисмысловые нуклеиновые кислоты по настоящему изобретению могут действовать посредством связывания с нуклеотидной последовательностью TOM34, или соответствующей ей мРНК, ингибируя, тем самым, транскрипцию или трансляцию генов, запуская деградацию мРНК и/или ингибируя экспрессию белков, кодируемых TOM34, ингибируя, таким образом, функцию белков. Как это используется в настоящем описании, термин "антисмысловые нуклеиновые кислоты" включает как нуклеотиды, которые полностью комплементарны последовательности-мишени, так и последовательности, имеющие неправильно спаренное основание в одном или нескольких нуклеотидах, при условии, что антисмысловые нуклеиновые кислоты могут специфично гибридизоваться с последовательностями-мишенями. Например, антисмысловые нуклеиновые кислоты по настоящему изобретению включают полинуклеотиды, которые обладают гомологией, составляющей, по меньшей мере, 70% или более, предпочтительно, по меньшей мере, 80% или более, более предпочтительно, по меньшей мере, 90% или более, еще более предпочтительно, по меньшей мере, 95% или более на протяжении участка, по меньшей мере, из 15 соседних нуклеотидов. Для определения гомологии можно использовать алгоритмы, известные в данной области.
Антисмысловая нуклеиновая кислота по настоящему изобретению действует на клетки, продуцирующие кодируемые TOM34 белки, связываясь с ДНК или мРНК, кодирующей белок, ингибируя их транскрипцию или трансляцию, запуская деградацию мРНК и ингибируя экспрессию белка, приводя, тем самым, к ингибированию функции белка.
Антисмысловая нуклеиновая кислота по настоящему изобретению может быть преобразована в препарат для наружного применения, такой как жидкая мазь или примочка, путем смешивания с подходящим материалом основы, который является неактивным в отношении нуклеиновой кислоты.
Также, при необходимости, антисмысловые нуклеиновые кислоты по настоящему изобретению могут быть составлены в таблетки, порошки, гранулы, капсулы, липосомальные капсулы, инъекции, растворы, капли для носа и лиофилизированные средства путем добавления эксципиентов, изотонических средств, солюбилизаторов, стабилизаторов, консервантов, обезболивающих средств и т.п. Их можно получать в соответствии с известными способами.
Антисмысловые нуклеиновые кислоты по настоящему изобретению можно вводить пациенту путем непосредственного применения в болезненной области или путем инъекции в кровеносный сосуд, так чтобы они могли достигнуть болезненной области. Для повышения продолжительности действия и проницаемости через мембраны также можно использовать закрепляющий материал для антисмысловой нуклеиновой кислоты. Примеры включают, но не ограничиваются ими, липосомы, поли-L-лизин, липиды, холестерин, липофектин или их производные.
Дозу производного антисмысловой нуклеиновой кислоты по настоящему изобретению можно корректировать надлежащим образом в соответствии с состоянием пациента и использовать в требуемых количествах. Например, можно вводить дозу в диапазоне от 0,1 до 100 мг/кг, предпочтительно от 0,1 до 50 мг/кг.
Антисмысловые нуклеиновые кислоты по настоящему изобретению ингибируют экспрессию белка по настоящему изобретению и, таким образом, могут использоваться для подавления биологической активности белка по настоящему изобретению. Кроме того, ингибиторы экспрессии, содержащие антисмысловые нуклеиновые кислоты по настоящему изобретению, являются подходящими в том, что они могут ингибировать биологическую активность белка по настоящему изобретению.
Связывание siRNA с транскриптом, соответствующим TOM34, в клетке-мишени приводит к снижению продукции белка клеткой. Длина олигонуклеотида составляет, по меньшей мере, 10 нуклеотидов, и она может соответствовать длине встречающегося в природе транскрипта. Предпочтительно, длина олигонуклеотида составляет менее 75, 50, 25 нуклеотидов. Наиболее предпочтительно, длина олигонуклеотида составляет 19-25 нуклеотидов.
Антисмысловые нуклеиновые кислоты по настоящему изобретению включают модифицированные олигонуклеотиды. Например, для обеспечения устойчивости олигонуклеотида к нуклеазам можно использовать модифицированные тиогруппой олигонуклеотиды.
Также для снижения уровня экспрессии TOM34 можно использовать siRNA против TOM34. В настоящем описании термин "siRNA" относится к двухцепочечной молекуле РНК, которая препятствует трансляции мРНК-мишени. Для введения siRNA в клетку можно использовать стандартные способы, включая способы, в которых ДНК представляет собой матрицу, с которой транскрибируют РНК. В контексте настоящего изобретения siRNA содержит смысловую последовательность нуклеиновой кислоты и антисмысловую последовательность нуклеиновой кислоты против маркерного гена с повышенной активностью, такого как TOM34. siRNA конструируют таким образом, чтобы отдельный транскрипт обладал как смысловой, так и комплементарной антисмысловой последовательностями гена-мишени, например, представлял собой шпилечную структуру.
siRNA против TOM34 гибридизуется с мРНК-мишенью и, таким образом, снижает или ингибирует продукцию полипептидов, кодируемых TOM34, путем ассоциации с нормальным одноцепочечным транскрпитом мРНК, препятствуя, тем самым, трансляции и, таким образом, экспрессии белка. Таким образом, молекулы siRNA по настоящему изобретению можно определять по их способности к специфичной гибридизации с мРНК TOM34 в строгих условиях. Для целей этого изобретения термины "гибридизуется" или "специфично гибридизуется" используют для указания на способность двух молекул нуклеиновых кислот гибридизоваться в "строгих условиях гибридизации". Выражение "строгие условия гибридизации" относится к условиям, при которых молекула нуклеиновой кислоты гибридизуется с ее последовательностью-мишенью, как правило, в комплексной смеси нуклеиновых кислот, но не гибридизуется на определяемом уровне с другими последовательностями. Строгие условия зависят от последовательности и они отличаются в различных случаях. Более длинные последовательности гибридизуются специфично при более высоких температурах. Подробное руководство по гибридизации нуклеиновых кислот представлено в Tijssen, Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). Как правило, строгие условия выбирают так, чтобы температура была приблизительно на 5-10°C ниже, чем температура плавления (Tm) конкретной последовательности при определенной ионной силе и pH. Tm представляет собой температуру (при определенной ионной силе, pH, и концентрации нуклеиновой кислоты), при которой 50% зонда, комплементарного мишени, равновесно гибридизуется с последовательностью-мишенью (поскольку последовательности-мишени представлены в избытке, при равновесии при Tm оккупировано 50% зондов). Строгие условия также могут быть достигнуты добавлением дестабилизирующих веществ, таких как формамид. Для селективной или специфичной гибридизации положительный сигнал, по меньшей мере, в два раза превышает фон, предпочтительно он в 10 раз превышает фон гибридизации. Иллюстративные строгие условия гибридизации могут быть следующими: 50% формамид, 5× SSC и 1% SDS, инкубация при 42°C, или 5× SSC, 1% SDS, инкубация при 65°C, с промыванием в 0,2× SSC, и 0,1% SDS при 50°C.
В контексте настоящего изобретения длина siRNA предпочтительно составляет менее чем 500, 200, 100, 50 или 25 нуклеотидов. Более предпочтительно, длина siRNA составляет 19-25 нуклеотидов. Иллюстративная последовательность нуклеиновой кислоты для продукции siRNA против TOM34 включает последовательности нуклеотидов SEQ ID NO:48 или 52 в качестве последовательности-мишени. В РНК или ее производных в нуклеотидной последовательности основание "t" должно быть замещено на "u". Таким образом, например, настоящее изобретение относится к двухцепочечной молекуле РНК, содержащей нуклеотидную последовательность 5'-gaaaguguucucuacucca-3' (SEQ ID NO:48) или 5'-ggauggaaacugcagagac-3' (SEQ ID NO:52). В целях повышения ингибирующей активности siRNA нуклеотид "u" может быть добавлен к 3'-концу антисмысловой цепи последовательности-мишени. Количество добавляемых "u" составляет, по меньшей мере, 2, обычно, от 2 до 10, предпочтительно от 2 до 5. Добавленные "u" образуют отдельную цепь на 3'-конце антисмысловой цепи siRNA.
siRNA против TOM34 может быть непосредственно введена в клетки в форме, которая способна связываться с транскриптами мРНК. В этих вариантах осуществления молекулы siRNA по настоящему изобретению, как правило, являются модифицированными, как описано выше для антисмысловых молекул. Также возможны другие модификации, например, было показано, что конъюгированные с холестерином siRNA обладают улучшенными фармакологическими свойствами (Song et al. Nature Med. 9:347-351 (2003)). Альтернативно, ДНК, кодирующая siRNA, может быть доставлена в векторе.
Векторы могут быть получены, например, путем клонирования последовательности-мишени TOM34 в экспрессирующий вектор, имеющий функционально связанные регуляторные последовательности, фланкирующие последовательность таким образом, чтобы обеспечить экспрессию (путем транскрипции молекулы ДНК) обеих цепей (Lee, N.S. et al., (2002) Nature Biotechnology 20: 500-505). Молекулу РНК, которая является антисмысловой для мРНК TOM34, транскрибируют с помощью первого промотора (например, 3'-промоторной последовательности клонируемой ДНК) и молекулу РНК, которая представляет собой смысловую цепь для мРНК TOM34, транскрибируют с помощью второго промотора (например, 5'-промоторной последовательности клонированной ДНК). Смысловая и антисмысловая цепи гибридизуются in vivo с образованием конструкций siRNA для подавления TOM34. Альтернативно, для создания смысловой и антисмысловой цепей конструкции siRNA можно использовать две конструкции. Клонированный TOM34 может кодировать конструкцию, имеющую вторичную структуру, например, шпилечную структуру, где один транскрипт обладает как смысловой, так и комплементарной антисмысловой последовательностями из гена-мишени.
Между смысловой и антисмысловой последовательностями может быть расположена последовательность петли, состоящая из произвольной нуклеотидной последовательности, для образования структуры шпильки с петлей. Таким образом, настоящее изобретение также относится к siRNA, имеющей общую формулу 5'-[A]-[B]-[A']-3', где [A] представляет собой рибонуклеотидную последовательность, соответствующую последовательности, которая специфично гибридизуется с мРНК или кДНК TOM34. В предпочтительных вариантах осуществления [A] представляет собой рибонуклеотидную последовательность, соответствующую последовательности TOM34,
[B] представляет собой рибонуклеотидную последовательность, состоящую из 3-23 нуклеотидов, и
[A'] представляет собой рибонуклеотидную последовательность, состоящую из последовательности, комплементарной [A]. Участок [A] гибридизуется с [A'], а затем образуется петля, состоящая из участка [B]. Длина последовательности петли может составлять предпочтительно от 3 до 23 нуклеотидов. Последовательность петли, например, может быть выбрана из группы, состоящей из следующих последовательностей (http://www.ambion.com/techlib/tb/tb_506.html). Кроме того, последовательность петли, состоящая из 23 нуклеотидов, также приводит к активной siRNA (Jacque, J.-M., et al., (2002) Nature 418: 435-438).
CCC, CCACC или CCACACC: Jacque, J. M, et al., (2002) Nature, Vol. 418: 435-438.
UUCG: Lee, N.S., et al., (2002) Nature Biotechnology 20: 500-505. Fruscoloni, P., et al., (2003) Proc. Natl. Acad. Sci. USA 100(4): 1639-1644.
UUCAAGAGA: Dykxhoorn, D. M., et al., (2002) Nature Reviews Molecular Cell Biology 4: 457-467.
Таким образом, последовательность петли может быть выбрана из группы, состоящей из CCC, UUCG, CCACC, CCACACC и UUCAAGAGA. Предпочтительная последовательность петли представляет собой UUCAAGAGA (в ДНК "ttcaagaga"). Иллюстративная шпилечная siRNA, подходящая для применения в контексте настоящего изобретения, включает:
для TOM34-siRNA-D (siD, для последовательности-мишени SEQ ID NO:48)
5'-gaaaguguucucuacucca-[B]-uggaguagagaacacuuuc-3' (SEQ ID NO:49) и
для TOM34-siRNA-E (siE, для последовательности-мишени SEQ ID NO:52)
5'-ggauggaaacugcagagac-[B]-gucucugcaguuuccaucc-3' (SEQ ID NO:53).
Нуклеотидную последовательность подходящих siRNA можно разрабатывать с использованием компьютерной программы для разработки siRNA, доступной на web-сайте Ambion (http://www.ambion.com/techlib/misc/siRNA_finder.html). Компьютерная программа выбирает нуклеотидные последовательности для синтеза siRNA на основе следующего протокола.
Выбор участков-мишеней для siRNA
1. Начиная с инициирующего кодона AUG целевого транскрипта, считывать в направлении 5'-3' до динуклеотидных последовательностей AA. Записывать наличие каждого AA и соседние с 3'-стороны 19 нуклеотидов в качестве потенциальных участков-мишеней siRNA. Tuschl, et al. не рекомендуют конструирование siRNA к 5'- и 3'-нетранслируемым областям (UTR) и областям вблизи инициирующего кодона (в пределах 75 оснований), поскольку они могут обладать большим количеством участков для связывания регуляторных белков. UTR-связывающие белки и/или комплексы инициации трансляции могут препятствовать связыванию эндонуклеазного комплекса siRNA.
2. Сравнить потенциальные участки-мишени с базой данных генома человека и удалить из рассмотрения любые последовательности-мишени со значительной гомологией с другими кодирующими последовательностями. Поиск гомологии можно проводить с использованием BLAST, который можно найти на сервере NCBI: www.ncbi.nlm.nih.gov/BLAST/.
3. Выбрать подходящие последовательности-мишени для синтеза. В Ambion можно выбрать предпочтительно несколько последовательностей-мишеней вдоль длины подлежащего оценке гена.
Регуляторные последовательности, фланкирующие последовательности гена TOM34, могут быть идентичными или различными, так что их экспрессию можно модулировать независимо, или временным или пространственным образом. siRNA транскрибируют внутриклеточно путем клонирования матриц TOM34, соответственно, в вектор, содержащий, например, транскрипционный элемент РНК-полимеразы III из малой ядерной РНК (snRNA) U6 или промотор РНК H1 человека. Для введения вектора в клетку можно использовать средство для усиления трансфекции. В качестве усиливающего трансфекцию средства применимыми являются FuGENE (Rochediagnostices), липофектамин 2000 (Invitrogen), олигофектамин (Invitrogen) и нуклеофектор (Wako pure Chemical).
Антисмысловой олигонуклеотид или siRNA по настоящему изобретению ингибирует экспрессию полипептида по настоящему изобретению и, таким образом, применим для подавления биологической активности полипептида по настоящему изобретению. Также ингибиторы экспрессии, содержащие антисмысловой олигонуклеотид или siRNA по настоящему изобретению, являются применимыми, так как они могут ингибировать биологическую активность полипептида по настоящему изобретению. Таким образом, композиция, содержащая антисмысловой олигонуклеотид или siRNA по настоящему изобретению, является пригодной для лечения CRC.
Антитела
Альтернативно, функцию генного продукта TOM34, который сверхэкспрессируется при CRC, можно ингибировать введением соединения, которое связывает генные продукты или иным образом ингибирует их функцию. Например, соединение представляет собой антитело, которое связывается с генным продуктом TOM34.
Настоящее изобретение относится к применению антител, в частности, антител против белка, кодируемого TOM34, или фрагментов таких антител. Как его используют в настоящем описании, термин "антитело" относится к молекуле иммуноглобулина, имеющей определенную структуру, которая взаимодействует (т.е. связывается) только с антигеном, который использовали для синтеза антитела (т.е. генным продуктом маркера с повышенной активностью), или с антигеном, близко сходным с ним. Кроме того, антитело может представлять собой фрагмент антитела или модифицированное антитело, при условии, что оно связывается с белком, кодируемым TOM34. Например, фрагмент антитела может представлять собой Fab, F(ab')2, Fv или одноцепочечный Fv (scFv), в котором Fv-фрагменты из H- и L-цепей лигированы соответствующим линкером (Huston J. S. et al. Proc. Natl. Acad. Sci. U.S.A. 85:5879-5883 (1988)). Более конкретно, фрагмент антитела можно получать обработкой антитела ферментом, таким как папаин или пепсин. Альтернативно, можно конструировать ген, кодирующий фрагмент антитела, встроенный в экспрессирующий вектор, и экспрессировать в соответствующей клетке-хозяине (см., например, Co M.S. et al. J. Immunol. 152:2968-2976 (1994); Better M. and Horwitz A. H. Methods Enzymol. 178:476-496 (1989); Pluckthun A. and Skerra A. Methods Enzymol. 178:497-515 (1989); Lamoyi E. Methods Enzymol. 121:652-663 (1986); Rousseaux J. et al. Methods Enzymol. 121:663-669 (1986); Bird R.E. and Walker B.W. Trends Biotechnol. 9:132-137 (1991)).
Антитело можно модифицировать путем конъюгации с различными молекулами, такими как полиэтиленгликоль (PEG). Настоящее изобретение относится к таким модифицированным антителам. Модифицированное антитело может быть получено химической модификацией антитела. Такие способы модификации являются общепринятыми в данной области.
Альтернативно, антитело может включать химерное антитело, имеющее вариабельную область, образованную из не относящегося к человеку антитела, и константную область, образованную из антитела человека, или гуманизированное антитело, содержащее определяющую комплементарность область (CDR), образованную из не относящегося к человеку антитела, и каркасную область (FR) и константную область, образованные из антитела человека. Такие антитела можно получать с использованием известных способов. Гуманизацию можно проводить путем замещения последовательностями CDR, или последовательностью CDR, грызунов соответствующих последовательностей антитела человека (см., например, Verhoeyen et al., Science 239:1534-1536 (1988)). Таким образом, такие гуманизированные антитела представляют собой химерные антитела, где по существу менее чем интактный вариабельный домен человека замещен соответствующей последовательностью из не относящегося к человеку вида.
Также можно использовать полностью человеческие антитела, содержащие, в дополнение к каркасным областям и константным областям человека, вариабельные области человека. Такие антитела можно получать с использованием различных способов, известных в данной области. Например, способы in vitro включают применение рекомбинантных библиотек фрагментов антител человека, воспроизведенных в бактериофаге (например, Hoogenboom & Winter, J. Mol. Biol. 227:381-8 (1991)). Аналогично, антитела человека можно получать путем введения локусов иммуноглобулинов человека трансгенным животным, например, мышам, у которых эндогенные гены иммуноглобулинов частично или полностью инактивированы. Этот подход описан, например, в патентах США №№ 6150584; 5545807; 5545806; 5569825; 5625126; 5633425; 5661016.
Противораковые методы терапии, направленные на определенные молекулярные изменения, которые происходят в раковых клетках, были проверены посредством клинической разработки и одобрения регулирующими ведомствами противораковых лекарственных средств, таких как трастузумаб (Герцептин) для лечения рака молочной железы на развернутой стадии, иматиниба мезилат (Гливек) для лечения хронического миелоидного лейкоза, гефитиниб (Иресса) для лечения немелкоклеточного рака легкого (NSCLC) и ритуксимаб (mAb против CD20) для лечения B-клеточной лимфомы и лимфомы из клеток мантийной зоны (Ciardiello F. et al., Clin Cancer Res. 2001 Oct; 7(10):2958-70. Slamon DJ. et al., N Engl J Med. 2001 Mar 15; 344(11):783-92.; Rehwald U. et al., Blood. 2003 Jan 15; 101(2):420-424.; Fang G. et al., (2000). Blood, 96, 2246-2253). Эти лекарственные средства являются клинически эффективными и лучше переносимыми, чем традиционные противораковые средства, поскольку они нацелены только на трансформированные клетки. Таким образом, такие лекарственные средства не только повышают выживаемость и качество жизни раковых пациентов, но также подтверждают концепцию молекулярно нацеленной раковой терапии. Кроме того, нацеленные лекарственные средства могут повышать эффективность стандартной химиотерапии, когда их применяют в сочетании с ней (Gianni L. (2002). Oncology, 63 Suppl 1, 47-56; Klejman A. et al., (2002). Oncogene, 21, 5868-5876). Таким образом, в будущем способы лечения рака, возможно, будут включать комбинирование традиционных лекарственных средств со специфичными в отношении мишени средствами, нацеленными на различные свойства опухолевых клеток, такие как ангиогенез и инвазивность.
Эти способы модулирования можно осуществлять ex vivo или in vitro (например, путем культивирования клетки со средством) или, альтернативно, in vivo (например, путем введения средства субъекту). Способы включают введение белка или сочетания белков, или молекулы нуклеиновой кислоты, или сочетания молекул нуклеиновых кислот в качестве терапии для противодействия аберрантной экспрессии генов с отличающейся экспрессией или нарушенной активности продуктов этих генов.
Заболевания и нарушения, которые характеризуются повышенными (относительно субъекта, не страдающего заболеванием или нарушением) уровнями экспрессии или повышенной биологической активностью генов или генных продуктов, соответственно, можно лечить лечебными средствами, которые являются антагонистами (т.е. снижают или ингибируют) активности сверхэкспрессированного гена или генов. Лечебные средства, которые являются антагонистами активности, можно вводить терапевтически или профилактически.
Таким образом, лечебные средства, которые можно использовать в контексте настоящего изобретения, включают, например, (i) полипептид сверхэкспрессированного гена или его аналоги, производные, фрагменты или гомологи; (ii) антитела против сверхэкспрессированного гена или генных продуктов; (iii) нуклеиновые кислоты, кодирующие сверхэкспрессированный ген; (iv) антисмысловые нуклеиновые кислоты или нуклеиновые кислоты, которые являются "дисфункциональными" (т.е. вследствие гетерологичной вставки в нуклеиновые кислоты сверхэкспрессированного гена); (v) малую интерферирующую РНК (siRNA); или (vi) модуляторы (т.е. ингибиторы, антагонисты, которые изменяют взаимодействие между сверхэкспрессированным полипептидом и его партнером по связыванию). Дисфункциональные антисмысловые молекулы используют для "нокаута" эндогенной функции полипептида путем гомологичной рекомбинации (см., например, Capecchi, Science 244: 1288-1292, 1989).
Повышенные уровни можно легко выявить с помощью количественного определения пептида и/или РНК, получая образец ткани пациента (например, из ткани биоптата) и оценки в нем in vitro уровней РНК или пептида, структуры и/или активности экспрессированных пептидов (или мРНК гена, экспрессия которого изменена). Способы, которые хорошо известны в данной области, включают, но не ограничиваются ими, иммунологические анализы (например, посредством вестерн-блот-анализа, иммунопреципитации с последующим электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS), иммуноцитохимии и т.д.) и/или анализы гибридизации для обнаружения экспрессии мРНК (например, нозерн-блот-анализы, дот-блоты, гибридизация in situ и т.д.).
Профилактическое введение проводят до проявления явных клинических симптомов заболевания, так что заболевание или нарушение предотвращается или, альтернативно, замедляется его прогрессирование.
Терапевтические способы по настоящему изобретению могут включать стадию контактирования клетки со средством, которое модулирует один или несколько видов активности генных продуктов генов с отличающейся экспрессией. Примеры средства, которое модулирует активность белка, включают, но не ограничиваются ими, нуклеиновые кислоты, белки, встречающиеся в природе распознаваемые такими белками лиганды, пептиды, пептидомиметики и другие малые молекулы.
Вакцинация против CRC
В настоящем изобретении было показано, что пептид, образованный из TOM34, представляет собой TAA-эпитоп, ограниченный по HLA-A24, который является распространенным аллелем HLA в японской и европейской популяциях. Кандидаты для связывающих HLA-A24 пептидов, образованных из TOM34, идентифицировали с использованием информации об их аффинности связывания с HLA-A24. После стимуляции T-клеток in vitro посредством дендритных клеток (DC), нагруженных этим пептидом, были успешно получены CTL с использованием TOM34-299 (KLRQEVKQNL (SEQ ID NO:7)). Для этих CTL была показана выраженная цитотоксическая активность против клеток колоректальной карциномы. Кроме того, для клонов и линий CTL, образованных из этих клеток, также показана специфичная цитотоксичность против положительных по HLA-A24 клеточных линий колоректальной карциномы, эндогенно сверхэкспрессирующих TOM34. Не было показано цитотоксической активности этих клонов и линий CTL против клеточных линий, в которых отсутствует экспрессия либо HLA-A24, либо TAA-мишени. Специфичная цитотоксическая активность этих клонов и линий CTL значительно ингибировалась "холодной" мишенью. Эти результаты показывают, что TOM34 являются пригодными в качестве TAA CRC и что TOM34 представляют собой пептиды эпитопов TAA, ограниченные по HLA-A24. Поскольку антиген TOM34 сверхэкспрессируется в большинстве CRC и ассоциирован с пролиферацией опухолевых клеток, он представляет собой хорошую мишень для применения в иммунотерапии против CRC.
Таким образом, настоящее изобретение дополнительно относится к способам лечения или профилактики CRC, причем указанные способы включают стадии введения иммуногенного пептида менее чем приблизительно из 40 аминокислот, часто менее чем приблизительно из 20 аминокислот, как правило, менее чем приблизительно из 15 аминокислот, содержащего аминокислотную последовательность SEQ ID NO:7. Альтернативно, иммуногенный пептид может содержать производное последовательности SEQ ID NO:7, в котором 1, 2, 3 или несколько аминокислот модифицированы, замещены или добавлены. В предпочтительных вариантах осуществления иммуногенный пептид представляет собой нонапептид или декапептид. Альтернативно, настоящее изобретение относится к способу индукции противоопухолевого иммунитета при CRC, причем указанный способ включает стадии введения иммуногенного пептида по настоящему изобретению, содержащего аминокислотную последовательность SEQ ID NO:7, или его производного, как описано выше. В настоящем изобретении пептид или его производное можно вводить субъекту in vivo или ex vivo. Кроме того, настоящее изобретение также относится к применению декапептида, содержащего аминокислотную последовательность SEQ ID NO:7, или его производного для получения иммуногенной композиции для лечения или профилактики CRC.
Анализ гомологии TOM34 показал, что они не обладают значительной гомологией с пептидами, образованными из каких-либо известных генных продуктов человека. Это снижает вероятность неизвестных или нежелательных иммунных ответов при иммунотерапии против этих молекул.
В отношении антигенов HLA, применение типа A-24, который в высокой степени экспрессируется у японцев, является благоприятным для достижения эффективных результатов, и применение таких подтипов, как A-2402, является еще более предпочтительным. Как правило, в клинике тип антигена HLA пациента, нуждающегося в лечении, исследуют заранее, что обеспечивает надлежащий выбор пептидов, обладающих высокими уровнями аффинности связывания с этим антигеном, или обладающих способностью индуцировать цитотоксические T-клетки (CTL) с помощью представления антигена. Кроме того, в целях получения пептидов, обладающих высокой аффинностью связывания и способностью индуцировать CTL, можно проводить замену или добавление 1, 2, 3, 4 или нескольких аминокислот, исходя из аминокислотной последовательности неполного пептида встречающегося в природе TOM34. В рамках настоящего описания термин "несколько" означает 5 или менее, или предпочтительно 3 или менее. Кроме того, в дополнение к пептидам, которые представлены в природе, поскольку регулярность последовательностей пептидов, представляемых путем связывания с HLA-антигенами, уже известна (Kubo, et al., J. Immunol., 152, 3913, 1994; Rammensee, et al., Immunogenetics. 41:178-228, 1995; Kondo, et al., J. Immunol. 155:4307-12, 1995), на основании такой регулярности можно проводить модификации иммуногенных пептидов по настоящему изобретению. Например, в пептидах, которые демонстрируют высокую аффинность связывания с HLA-24, их вторая аминокислота с N-конца замещена фенилаланином, тирозином, метионином или триптофаном, и пептиды, аминокислота которых на C-конце замещена фенилаланином, лейцином, изолейцином, триптофаном или метионином, могут быть также пригодными для применения.
Однако когда пептидная последовательность является идентичной части аминокислотной последовательности эндогенного или экзогенного белка, имеющего другую функцию, могут быть индуцированы побочные эффекты, такие как аутоиммунные нарушения или аллергические симптомы против определенных веществ, таким образом, предпочтительно, избегают случаев, когда последовательность совпадает с аминокислотной последовательностью другого белка, проводя поиск гомологии с использованием доступных баз данных. Кроме того, если из поиска гомологии ясно, что не существует пептидов, в которых отличается даже 1 или 2 аминокислоты, то нет опасности того, что модификации упомянутой выше аминокислотной последовательности в целях повышения аффинности связывания с антигенами HLA и/или повышения способности индуцировать CTL приведет к таким проблемам.
Хотя пептиды, обладающие высокой аффинностью связывания с антигенами HLA, как описано выше, являются высоко эффективными в качестве противораковых вакцин, пептиды-кандидаты, которые выбирают в соответствии с наличием высокой аффинности связывания в качестве показателя, необходимо исследовать на фактическое наличие способности индуцировать CTL. Подтверждение способности индуцировать CTL проводят путем индукции антиген-представляющих клеток (например, B-лимфоцитов, макрофагов и дендритных клеток), обладающих MHC-антигенами человека, или, более конкретно, дендритных клеток, полученных из мононуклеарных лейкоцитов периферической крови человека, и смешивания после стимуляции пептидами с CD8-положительными клетками, с последующим измерением цитотоксической активности против клеток-мишеней. В качестве реакционной системы можно использовать трансгенных животных, которых создавали для экспрессии HLA-антигена человека (например, животных, описанных в BenMohamed L., et al., Hum. Immunol. 2000 Aug.; 61(8):764-79). Например, в клетки-мишени можно вводить радиоактивную метку с 51Cr и т.п., и цитотоксическую активность можно вычислять, исходя из радиоактивности, испускаемой клетками-мишенями. Альтернативно, ее можно исследовать измерением IFN-γ, продуцируемого и высвобождаемого CTL в присутствии антиген-представляющих клеток, которые обладают иммобилизованными пептидами, и визуализацией зоны ингибирования в среде с использованием моноклональных антител против IFN-γ.
Как результат исследования способности пептидов индуцировать CTL, как описано выше, пептиды, обладающие высокой аффинностью связывания с HLA, не обязательно обладают высокой способностью к индукции. Кроме того, декапептид, содержащий аминокислотную последовательность, обозначаемую KLRQEVKQNL (SEQ ID NО:7), показал особенно высокую способность индуцировать CTL.
Как отмечено выше, настоящее изобретение относится к пептидам, обладающим способностью индуцировать цитотоксические T-клетки и содержащим аминокислотную последовательность SEQ ID NO:7, в которых 1, 2, 3, 4 или несколько аминокислот замещены или добавлены. Аминокислотная последовательность, содержащая 9 или 10 аминокислот, указанных в SEQ ID NO:7, в которой 1, 2, 3, 4 или несколько аминокислот замещены или добавлены, предпочтительно не совпадает с аминокислотной последовательностью других белков. В частности, подходящими примерами являются аминокислотное замещение второй аминокислоты с N-конца фенилаланином (F), тирозином (Y), метионином (M) или триптофаном (W), и замещение C-концевой аминокислоты фенилаланином (F), лейцином (L), изолейцином (I), триптофаном (W) или метионином (M), и аминокислотное добавление 1-2 аминокислот на N-конце и/или C-конце. Конкретно, настоящее изобретение относится к декапептиду, содержащему аминокислотную последовательность KLRQEVKQNL (SEQ ID NO:7), или K-[L, F, Y, M или W]-RQEVKQN-[L, F, L, I, W или M].
Пептиды по настоящему изобретению можно получать с использованием хорошо известных способов. Например, пептиды можно получать синтетически, с помощью технологии рекомбинантных ДНК или химического синтеза. Пептид по настоящему изобретению можно синтезировать отдельно или в качестве более длинных полипептидов, содержащих два или более пептидов. Пептид предпочтительно является выделенным, т.е. по существу не содержащим других встречающихся в природе белков клетки-хозяина и их фрагментов.
Пептиды могут иметь модификации, такие как гликозилирование, окисление боковой цепи или фосфорилирование; при условии, что модификации не нарушают биологической активности пептидов, как описано в настоящем документе. Другие модификации включают встраивание D-аминокислот или других миметиков аминокислот, которые можно использовать, например, для увеличения периода полужизни пептидов в сыворотке.
Пептиды по настоящему изобретению можно получать в сочетании, которое включает 2 или более пептидов по настоящему изобретению, для применения в качестве противораковой вакцины, которая может индуцировать CTL in vivo. Пептиды могут находиться в смеси или они могут быть конъюгированы друг с другом с использованием стандартных способов. Например, пептиды можно экспрессировать в виде одной полипептидной последовательности. Пептиды в сочетании могут быть одинаковыми или различными. При введении пептидов по настоящему изобретению пептиды представлены с высокой плотностью на HLA-антигенах антиген-представляющих клеток, затем происходит индукция CTL, которые специфично реагируют на комплекс, образованный представленным пептидом и HLA-антигеном. Альтернативно, антиген-представляющие клетки, которые имеют иммобилизованные пептиды по настоящему изобретению на своей клеточной поверхности, получают извлечением дендритных клеток у субъектов, их стимулируют пептидами по настоящему изобретению, индуцируют CTL у субъектов повторным введением субъектам этих клеток, и в результате может происходить повышение агрессивности в отношении клеток-мишеней.
Более конкретно, настоящее изобретение относится к лекарственным средствам для лечения опухолей или профилактики пролиферации, метастазирования и т.п. опухолей, которые содержат 1 или несколько пептидов по настоящему изобретению. Пептиды по настоящему изобретению можно использовать для лечения CRC.
Пептиды по этому изобретению можно вводить непосредственно в виде фармацевтической композиции, составленной общепринятыми способами составления. В таких случаях, в дополнение к пептидам по настоящему изобретению, могут быть включены носители, эксципиенты и т.п., которые обычно используют для лекарственных средств, в соответствующих случаях без конкретных ограничений. Иммуногенные композиции по настоящему изобретению можно применять для лечения и профилактики CRC.
Иммуногенные композиции для лечения и/или профилактики CRC, которые содержат пептиды по настоящему изобретению в качестве активных ингредиентов, могут содержать адъювант для эффективного установления клеточного иммунитета, или их можно вводить с другими активными ингредиентами, такими как противоопухолевые средства, и их можно вводить в виде состава в гранулах. Адъювант, который можно применять, включает адъюванты, описанные в литературе (Johnson, Clin. Microbiol. Rev., 7: 277-289, 1994). Иллюстративные адъюванты включают фосфат алюминия, гидроксид алюминия или квасцы. Кроме того, могут быть удобно использованы липосомальные составы, гранулярные составы, в которых лекарственное средство связано с гранулами диаметром несколько мкм, и составы, в которых с пептидом связан липид. Способ введения может представлять собой оральный, внутрикожный, подкожный способы, внутривенную инъекцию или подобные, и возможно системное введение или местное введение вблизи опухоли-мишени. Дозу пептидов по настоящему изобретению можно корректировать соответствующим образом в зависимости от подлежащего лечению заболевания, возраста пациента, массы, способа введения и т.п., и обычно она составляет от 0,001 мг до 1000 мг, предпочтительно от 0,01 мг до 100 мг, более предпочтительно от 0,1 мг до 10 мг, и ее предпочтительно вводят один раз в период от нескольких суток до нескольких месяцев. Квалифицированный специалист в данной области может соответствующим образом выбирать подходящую дозу.
Альтернативно, настоящее изобретение относится к внутриклеточным носителям, называемым экзосомами, которые на своей поверхности представляют комплексы, образованные пептидами по настоящему изобретению и HLA-антигенами. Экзосомы можно получать, например, с использованием способов, описанных подробно в опубликованном японском переводе международных публикаций № Hei 11-510507 и 2000-512161, и их предпочтительно получают с использованием антиген-представляющих клеток, полученных от субъектов, которым намечают проводить лечение и/или профилактику. Экзосомы по настоящему изобретению можно инокулировать в качестве противораковых вакцин, аналогично пептидам по настоящему изобретению.
Тип используемых HLA-антигенов должен совпадать с типом у субъекта, которому требуется лечение и/или профилактика. Например, для японцев часто является подходящим HLA-A24, в частности, HLA-A2402.
В некоторых вариантах осуществления вакцинные композиции по настоящему изобретению содержат компонент, который примирует цитотоксические T-лимфоциты. В качестве средств, способных примировать CTL in vivo против вирусных антигенов, были идентифицированы липиды. Например, к ε-и α-аминогруппам остатка лизина можно присоединять остатки пальмитиновой кислоты, а затем связывать с иммуногенным пептидом по настоящему изобретению. Затем липидированный пептид можно вводить либо непосредственно в мицелле или частице, включенной в липосому, либо эмульгированной в адъюванте. В качестве другого примера липида, примирующего ответы CTL, для примирования CTL можно использовать липопротеины E.coli, такие как трипальмитоил-S-глицерилцистеинлизерил-серин (P3CSS), ковалентно присоединенный к соответствующему пептиду (см., например, Deres, et al., Nature 342:561-4, 1989).
Иммуногенные композиции по настоящему изобретению также могут содержать нуклеиновые кислоты, кодирующие иммуногенные пептиды, описанные в настоящем документе. См., например, Wolff et. al. (1990) Science 247:1465-1468; патенты США №№ 5580859; 5589466; 5804566; 5739118; 5736524; 5679647 и WO 98/04720. Примеры технологий доставки на основе ДНК включают "голую ДНК", облегченную доставку (опосредуемую бупивикаином, полимерами, пептидом), катионные липидные комплексы и опосредуемую частицами ("генную пушку") или опосредуемую давлением доставку (см., например, патент США № 5922687).
Иммуногенные пептиды по настоящему изобретению также могут быть экспрессированы посредством вирусных или бактериальных векторов. Примеры экспрессирующих векторов включают аттенуированные вирусные хозяева, такие как вирус коровьей оспы или вирус оспы птиц. Этот подход включает применение вируса коровьей оспы, например, в качестве вектора для экспрессии нуклеотидных последовательностей, которые кодируют пептид. При введении в хозяина рекомбинантный вирус коровьей оспы экспрессирует иммуногенный пептид и, таким образом, индуцирует иммунный ответ. Векторы на основе вируса коровьей оспы и способы, пригодные для протоколов иммунизации, описаны, например, в патенте США № 4722848. Другой вектор представляет собой БЦЖ (Бацилла Кальметта-Герена). Векторы БЦЖ описаны в Stover, et al. (1991) Nature 351:456-460. Будет понятным широкое множество других векторов, пригодных для терапевтического введения или иммунизации, например, векторы на основе аденовируса и аденоассоциированного вируса, ретровирусные векторы, векторы Salmonella typhi, векторы на основе обезвреженного токсина сибирской язвы и т.п. См., например, Shata, et al. (2000) Mol. Med. Today 6:66-71; Shedlock, et al. (2000) J. Leukoc. Biol. 68:793-806; и Hipp, et al. (2000) In Vivo 14: 571-85.
Настоящее изобретение также относится к способам индукции антиген-представляющих клеток с использованием пептидов по этому изобретению. Антиген-представляющие клетки можно индуцировать путем индукции дендритных клеток из моноцитов периферической крови, с последующим контактированием (стимуляцией) их пептидами по настоящему изобретению in vitro, ex vivo или in vivo. Когда пептиды по настоящему изобретению вводят субъектам, происходит индукция антиген-представляющих клеток, на которых иммобилизованы пептиды по настоящему изобретению. Альтернативно, после иммобилизации пептидов по настоящему изобретению на антиген-представляющих клетках, клетки можно вводить субъекту в качестве вакцины. Например, введение ex vivo может включать стадии:
a: забора антиген-представляющих клеток от субъекта, и
b: контактирования антиген-представляющих клеток стадии a с пептидом.
Антиген-представляющие клетки, полученные на стадии b, можно вводить субъекту в качестве вакцины.
Данное изобретение также относится к способу индукции антиген-представляющих клеток, обладающих высокой способностью индуцировать цитотоксические T-клетки, причем способ включает стадию переноса генов, содержащих полинуклеотиды, которые кодируют пептиды по настоящему изобретению, в антиген-представляющие клетки in vitro. Введенные гены могут находиться в форме ДНК или РНК. В отношении способа введения, без конкретных ограничений, можно применять различные способы, обычно проводимые в данной области, такие как липофекция, электропорация и способ с фосфатом кальция. Более конкретно, введение можно проводить, как описано в Reeves, et al., Cancer Res., 56:5672, 1996; Butterfield, et al., J. Immunol., 161:5607, 1998; Boczkowski, et al., J. Exp. Med., 184:465, 1996; опубликованном японском переводе международной публикации № 2000-509281. При переносе гена в антиген-представляющие клетки происходит транскрипция, трансляция и т.п. гена в клетке, а затем образованный белок подвергается процессингу MHC I класса или II класса и проходит через каскад представления для представления неполных пептидов.
Кроме того, настоящее изобретение относится к способам индукции CTL с использованием пептидов по настоящему изобретению. Когда пептиды по настоящему изобретению вводят субъекту, происходит индукция CTL в организме субъекта и повышение интенсивности нацеливания иммунной системы на клетки CRC в опухолевых тканях. Альтернативно, их можно использовать для способа лечения ex vivo, в котором полученные от субъекта антиген-представляющие клетки и CD8-положительные клетки или мононуклеарные лейкоциты периферической крови контактируют (стимулируют) с пептидами по настоящему изобретению in vitro, и после индукции CTL клетки возвращают субъекту. Например, способ может включать стадии:
a: забора антиген-представляющих клеток от субъекта,
b: контактирования антиген-представляющих клеток стадии a с пептидом,
c: смешивания антиген-представляющих клеток стадии b с CD8+ T-клетками и совместного культивирования для индукции цитотоксических T-клеток, и
d: сбора CD8+ T-клеток из совместной культуры стадии c.
CD8+ T-клетки, обладающие цитотоксической активностью, полученные на стадии d, можно вводить субъекту в качестве вакцины. Таким образом, настоящее изобретение относится к клеткам CD8+, которые способны распознавать пептиды, описанные в настоящем документе, которые представлены молекулами MHC, например HLA-24. Кроме того, настоящее изобретение также относится к клеткам, например, APC, содержащим молекулу MHC I класса типа HLA-24, которая представляет пептид, описанный в настоящем документе.
Кроме того, настоящее изобретение относится к выделенным цитотоксическим T-клеткам, которые индуцированы с использованием пептидов по настоящему изобретению. Цитотоксические T-клетки, индуцированные стимуляцией антиген-представляющими клетками, которые представляют пептиды по настоящему изобретению, предпочтительно получают от субъектов, которым намереваются проводить лечение и/или профилактику, и их можно вводить отдельно или в сочетании с другими лекарственными средствами, включая пептиды по настоящему изобретению или экзосомы, для достижения противоопухолевых эффектов. Полученные цитотоксические T-клетки действуют специфично против клеток-мишеней, представляющих пептиды по настоящему изобретению, или предпочтительно те же пептиды, что использовали для индукции. Клетки-мишени могут представлять собой клетки, которые экспрессируют TOM34 эндогенно, или клетки, которые трансфицированы генами TOM34, а также мишенями для атаки могут стать клетки, которые представляют пептиды по настоящему изобретению на клеточной поверхности вследствие стимуляции этими пептидами.
Настоящее изобретение также относится к антиген-представляющим клеткам, которые включают представление комплексов, образованных HLA-антигенами и пептидами по настоящему изобретению. Антиген-представляющие клетки, которые получают контактированием с пептидами по настоящему изобретению или нуклеотидами, кодирующими пептиды по настоящему изобретению, предпочтительно получают от субъектов, которым намереваются проводить лечение и/или профилактику, и их можно вводить в качестве вакцин отдельно или в сочетании с другими лекарственными средствами, включая пептиды по настоящему изобретению, экзосомы или цитотоксические T-клетки.
В настоящем изобретении термин "вакцина" (также называемая иммуногенной композицией) относится к веществу, которое обладает функцией индукции противоопухолевого иммунитета или иммунитета для подавления CRC при инокуляции животным. В соответствии с настоящим изобретением было предположено, что полипептиды, содержащие аминокислотную последовательность SEQ ID NO:7, представляют собой ограниченные по HLA-A24 пептиды эпитопов, которые могут индуцировать сильный и специфичный иммунный ответ против клеток CRC, экспрессирующих TOM34. Таким образом, настоящее изобретение также относится к способу индукции противоопухолевого иммунитета с использованием полипептидов, содержащих аминокислотную последовательность SEQ ID NO:7. Как правило, противоопухолевый иммунитет включает иммунные ответы, такие как следующие иммунные ответы:
- индукция цитотоксических лимфоцитов против опухолей, содержащих клетки, экспрессирующие TOM34,
- индукция антител, которые распознают опухоли, содержащие клетки, экспрессирующие TOM34, и
- индукция продукции противоопухолевых цитокинов.
Таким образом, когда определенный белок индуцирует какой-либо один из этих иммунных ответов при инокуляции животному, делают заключение, что белок обладает эффектом индукции противоопухолевого иммунитета. Индукцию противоопухолевого иммунитета белком можно обнаружить, наблюдая ответ иммунной системы хозяина против белка in vivo или in vitro.
Например, способ обнаружения индукции цитотоксических T-лимфоцитов хорошо известен. Чужеродное вещество, которое проникает в живой организм, представляется T-клеткам и B-клеткам посредством действия антиген-представляющих клеток (APC). T-клетки, которые отвечают на антиген, представленный APC, специфичным в отношении антигена образом, дифференцируются в цитотоксические T-клетки (или цитотоксические T-лимфоциты; CTL) вследствие стимуляции антигеном, а затем пролиферируют (это называют активацией T-клеток). Таким образом, индукцию CTL определенным пептидом можно оценивать путем представления пептида T-клетке с помощью APC и определения индукции CTL. Кроме того, APC обладают эффектом активации CD4+ T-клеток, CD8+ T-клеток, макрофагов, эозинофилов и NK-клеток. Поскольку CD4+ T-клетки также важны в противоопухолевом иммунитете, действие пептида в отношении индукции противоопухолевого иммунитета можно оценивать с использованием эффекта активации этих клеток в качестве показателя.
Способ оценки индуцирующего действия CTL с использованием дендритных клеток (DC) в качестве APC хорошо известен в данной области. DC представляет собой иллюстративную APC, обладающую наиболее сильным действием в отношении индукции CTL среди APC. В этом способе тестируемый полипептид вначале контактирует с DC, а затем эта DC контактирует с T-клетками. Обнаружение T-клеток, обладающих цитотоксическими эффектами против представляющих интерес клеток после контактирования с DC, показывает, что тестируемый полипептид обладает активностью в отношении индукции цитотоксических T-клеток. Активность CTL против опухолей можно определить, например, с использованием лизиса меченных 51Cr опухолевых клеток в качестве показателя. Альтернативно, хорошо известен способ оценки степени повреждения опухолевых клеток с использованием активности захвата 3H-тимидина или высвобождения LDH (лактозодегидрогеназы) в качестве показателя.
Помимо DC, также в качестве APC можно использовать мононуклеарные клетки периферической крови (PBMC). Описано, что индукция CTL повышается при культивировании PBMC в присутствии GM-CSF и IL-4. Аналогично, было показано, что индукция CTL происходит путем культивирования PBMC в присутствии гемоцианина лимфы улитки (KLH) и IL-7.
Тестируемые полипептиды, для которых этими способами подтверждено, что они обладают активностью в отношении индукции CTL, представляют собой полипептиды, обладающие эффектом активации DC и активностью в отношении последующей индукции CTL. Таким образом, полипептиды, которые индуцируют CTL против опухолевых клеток, являются пригодными в качестве вакцин против CRC. Кроме того, в качестве вакцин против CRC являются пригодными APC, которые приобрели способность индуцировать CTL против CRC путем контактирования с полипептидами. Помимо всего, CTL, которые приобрели цитотоксичность вследствие презентации полипептидных антигенов с помощью APC, также можно использовать в качестве вакцин против CRC. Такие способы терапии CRC с использованием противоопухолевого иммунитета, вызванного APC и CTL, называют клеточной иммунотерапией.
Известно, что, как правило, при использовании полипептида для клеточной иммунотерапии эффективность индукции CTL повышают, комбинируя несколько полипептидов, имеющих различные структуры, и осуществляя их контактирование с DC. Таким образом, при стимуляции DC фрагментами белков предпочтительным является применение смеси фрагментов нескольких типов.
Альтернативно, индукцию противоопухолевого иммунитета полипептидом можно подтвердить, наблюдая индукцию продукции антитела против опухолей. Например, когда у лабораторного животного, иммунизированного полипептидом, происходит индукция антител против полипептида, и когда происходит подавление этими антителами роста, пролиферации или метастазирования опухолевых клеток, можно определить, что полипептид обладает способностью индуцировать противоопухолевый иммунитет.
Противоопухолевый иммунитет индуцируют введением вакцины по настоящему изобретению, и индукция противоопухолевого иммунитета обеспечивает лечение и профилактику CRC. Терапия против CRC или профилактика возникновения CRC включает любую из таких стадий, как ингибирование роста клеток CRC, обратное развитие клеток CRC и подавление распространения клеток CRC. Снижение смертности индивидов, имеющих CRC, снижение маркеров CRC в крови, смягчение обнаруживаемых симптомов, сопутствующих CRC и т.п., также относятся к терапии или профилактике CRC. Такие терапевтические и профилактические эффекты предпочтительно являются статистически значимыми, например, при исследовании при уровне значимости 5% или менее, где терапевтический или профилактический эффект вакцины против CRC сравнивают с контролем без введения вакцины. Например, для статистического анализа можно использовать t-тест Стьюдента, U-тест Манна-Уитни или ANOVA.
Упомянутый выше белок, обладающий иммунологической активностью, или полинуклеотид, или вектор, кодирующий белок, можно комбинировать с адъювантом. Адъювант относится к соединению, которое усиливает иммунный ответ против белка при введении совместно (или последовательно) с белком, обладающим иммунологической активностью. Примеры адъювантов включают, но не ограничиваются ими, холерный токсин, токсин сальмонеллы, квасцы и т.п. Кроме того, вакцину по настоящему изобретению можно комбинировать подходящим образом с фармацевтически приемлемым носителем. Примерами таких носителей являются стерилизованная вода, физиологический раствор, фосфатный буфер, культуральная жидкость и т.п. Помимо всего, вакцина при необходимости может содержать стабилизаторы, суспензии, консерванты, поверхностно-активные вещества и т.п. Вакцину вводят системно или местно. Введение вакцины можно осуществлять путем однократного введения или оно может быть усилено многократными введениями.
При использовании APC или CTL в качестве вакцины по настоящему изобретению CRC можно лечить или предотвращать, например, способом ex vivo. Более конкретно, проводят забор PBMC у субъекта, которому проводят лечение или профилактику, клетки приводят в контакт с полипептидом ex vivo, и после индукции APC или CTL клетки можно вводить субъекту. APC также можно индуцировать введением вектора, кодирующего полипептид, в PBMC ex vivo. APC или CTL, индуцированные in vitro, перед введением можно клонировать. Путем клонирования и выращивания клеток, обладающих высокой активностью в отношении повреждения клеток-мишеней, можно более эффективно проводить клеточную иммунотерапию. Кроме того, APC и CTL, выделенные этим способом, можно использовать для клеточной иммунотерапии не только у индивидов, от которых получены клетки, но также против сходных типов заболеваний у других индивидов.
Фармацевтические композиции для ингибирования CRC
В контексте настоящего изобретения подходящие фармацевтические составы включают составы, подходящие для орального, ректального, назального, местного (включая буккальное и сублингвальное введение), вагинального или парентерального (включая внутримышечное, подкожное и внутривенное) введения, или для введения посредством ингаляции или инсуффляции. Предпочтительно, введение представляет собой внутривенное введение. Составы необязательно упаковывают в отдельные дозированные единицы.
Фармацевтические составы, подходящие для орального введения, включают капсулы, крахмальные капсулы или таблетки, каждая из которых содержит предопределенное количество активного ингредиента. Подходящие составы также включают порошки, гранулы, растворы, суспензии и эмульсии. Активный ингредиент необязательно вводят в виде болюсного электуария или пасты. Таблетки и капсулы для орального введения могут содержать общепринятые эксципиенты, такие как связующие вещества, наполнители, смазывающие вещества, дезинтегрирующие вещества и/или смачивающие вещества. Таблетка может быть изготовлена прессованием или формованием, необязательно с одним или несколькими составными ингредиентами. Прессованные таблетки можно получать прессованием в подходящем устройстве активных ингредиентов в сыпучей форме, такой как порошок или гранулы, необязательно смешанных со связующим веществом, смазывающим веществом, инертным разбавителем, смазывающим, поверхностно-активным и/или диспергирующим веществом. Формованные таблетки можно изготавливать формованием в подходящем устройстве смеси порошкового соединения, смоченного инертным жидким разбавителем. На таблетки может быть нанесено покрытие в соответствии со способами, хорошо известными в данной области. Оральные жидкие препараты могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или они могут быть представлены в качестве сухого продукта, разбавляемого перед применением водой или другим подходящим растворителем. Такие жидкие препараты могут содержать общепринятые добавки, такие как суспендирующие вещества, эмульгаторы, неводные носители (которые могут включать пищевые масла), и/или консерванты. Таблетки необязательно могут быть составлены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение из них активного ингредиента. Упаковка таблеток может содержать одну таблетку, которую следует принимать каждый месяц.
Составы, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, необязательно содержат антиоксиданты, буферы, бактериостаты и растворимые вещества, которые обеспечивают изотоничность состава с кровью предполагаемого реципиента; а также водные и неводные стерильные суспензии, включающие суспендирующие вещества и/или загустители. Составы могут быть представлены в контейнерах для разовых доз и множественных доз, например, в виде герметично закрытых ампул и флаконов, и их можно хранить в высушенном замораживанием (лиофилизованном) состоянии, требующем только добавления стерильного жидкого носителя, например, физиологического раствора, воды для инъекций, непосредственно перед применением. Альтернативно, могут быть представлены составы для непрерывной инфузии. Растворы и суспензии для инъекций для немедленного применения можно получать из стерильных порошков, гранул и таблеток описанного ранее типа.
Составы, подходящие для ректального введения, включают суппозитории со стандартными носителями, такими как масло какао или полиэтиленгликоль. Составы, подходящие для местного введения в ротовую полость, например, через слизистую оболочку щеки или сублингвально, включают лепешки, содержащие активный ингредиент в обладающей вкусом основе, такой как сахароза и аравийская или трагакантовая камедь, и пастилки, содержащие активный ингредиент в основе, такой как желатин и глицерин или сахароза и аравийская камедь. Для интраназального введения соединения по настоящему изобретению можно использовать в виде жидкого аэрозоля, диспергируемого порошка или в форме капель. Капли можно составлять с водной или неводной основой, также содержащей одно или несколько диспергирующих средств, солюбилизирующих средств и/или суспендирующих средств.
Для введения путем ингаляции соединения могут быть удобно доставлены из инсуффлятора, небулайзера, пакетов с избыточным давлением или другими удобными способами доставки распыляемого аэрозоля. Пакеты с избыточным давлением могут содержать подходящий пропеллент, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае находящегося под давлением аэрозоля, дозированную единицу можно устанавливать с помощью клапана для доставки дозированного количества.
Альтернативно, для введения ингаляцией или инсуффляцией соединениям можно придавать форму сухой порошковой композиции, например, порошковой смеси соединения и подходящей порошковой основы, такой как лактоза или крахмал. Порошковая композиция может быть представлена в стандартной лекарственной форме, например, в виде капсул, картриджей, желатиновых или блистерных упаковок, из которых порошок можно вводить с помощью ингалятора или инсуффляторов.
Другие составы включают имплантируемые устройства и адгезивные пластыри с высвобождением лечебного средства.
Если желательно, можно применять описанные выше составы, адаптированные для обеспечения замедленного высвобождения активного ингредиента. Фармацевтические композиции также могут содержать другие активные ингредиенты, такие как противомикробные средства, иммунодепрессанты и/или консерванты.
Следует понимать, что в дополнение к ингредиентам, в частности, упомянутым выше, составы по настоящему изобретению могут включать другие средства, общепринятые в данной области, с учетом типа представляющего интерес состава. Например, составы, подходящие для орального введения, могут включать вкусовые добавки.
Предпочтительные стандартные лекарственные формы содержат эффективную дозу активного ингредиента, как приведено ниже, или ее соответствующую часть.
Для всех упомянутых выше условий композиции, например, полипептиды и органические соединения, можно вводить орально или посредством инъекции с дозой в диапазоне от приблизительно 0,1 до приблизительно 250 мг/кг в сутки. Диапазон доз для взрослого человека, как правило, составляет от приблизительно 5 мг до приблизительно 17,5 г/сутки, предпочтительно от приблизительно 5 мг до приблизительно 10 г/сутки и наиболее предпочтительно от приблизительно 100 мг до приблизительно 3 г/сутки. Таблетки или другие стандартные лекарственные формы в виде, представляемом дискретными единицами, могут удобно содержать количество, которое является эффективным в такой дозировке или в виде многократных дозировок, например, единицы, содержащие от приблизительно 5 мг до приблизительно 500 мг, как правило, от приблизительно 100 мг до приблизительно 500 мг.
Используемая доза будет зависеть от ряда факторов, включая возраст и пол субъекта, конкретное подлежащее лечению нарушение и его тяжесть. Также способ введения может варьировать в зависимости от состояния и его тяжести. В любом случае, специалисты в данной области могут вычислить подходящие и оптимальные дозы обычными способами, учитывая упомянутые выше факторы.
Аспекты настоящего изобретения описаны в представленных ниже примерах, которые не предназначены для ограничения объема данного изобретения, описанного в формуле изобретения. Следующие примеры иллюстрируют идентификацию и характеризацию генов с отличающейся экспрессией в клетках CRC.
ПРИМЕРЫ
Клеточные линии и клинические материалы
Клеточные линии рака толстого кишечника HCT116 и RKO получали из Американской коллекции типовых культур (Rockville, MD). Все эти клетки культивировали в качестве монослоев в соответствующей среде, McCoys 5A (Invitrogen, Carlsbad, CA) для HCT116 и RPMI 1640 (Sigma-Aldrich Corporation, St. Louis, MO) для RKO, дополненных 10% эмбриональной телячьей сывороткой (Cansera International Inc., Ontario, Canada) и 1% раствором антибиотика/противогрибкового средства (Sigma-Rich). Клетки поддерживали при 37°C в атмосфере увлажненного воздуха с 5% CO2. Раковые ткани и соответствующую нераковую слизистую оболочку извлекали у 12 пациентов в ходе хирургической операции, после получения информированного согласия.
Клетки TISI (HLA-A24/24) и EHM (HLA-A3/3), B-лимфобластоидные клеточные линии, представляли собой любезный подарок Takara Shuzo Co, Ltd. (Otsu, Japan). Клетки TISI использовали для анализа опосредуемой пептидом цитотоксичности. Клеточные линии колоректальной карциномы DLD-1 (HLA-A24/02), HT29 (HLA-A24/01) и SNU-C2A (HLA-A31/26) приобретали от ATCC. Клеточную линию хронического миелогенного лейкоза K562 приобретали от ATCC.
Полуколичественная ОТ-ПЦР
Общую РНК экстрагировали из культивируемых клеток или клинических тканей с использованием реагента TRIZOL (Invitrogen) в соответствии с протоколом изготовителя. Экстрагированную РНК обрабатывали ДНКазой I (Roche Diagnostics, Mannheim, Germany) и подвергали обратной транскрипции в одноцепочечные кДНК с использованием праймера oligo(dT)12-18 и обратной транскриптазы Superscript II (Invitrogen). Авторы настоящего изобретения получали соответствующие разведения каждой одноцепочечной кДНК для последующей амплификации посредством ПЦР с мониторингом гена GAPDH в качестве количественного контроля. Последовательности использованных праймеров представляют собой 5'-ACAACAGCCTCAAGATCATCAG-3' (SEQ ID NO:41) и 5'-GGTCCACCACTGACACGTTG-3' (SEQ ID NO:42) для GAPDH; 5'-TGGTATAAACCTAAGGCCCTGAT-3' (SEQ ID NO:43) и 5'-TAAACAGCTTAGGTGCCTCTCTG-3' (SEQ ID NO:44) для TOM34. Все реакции амплификации проводили путем первоначальной денатурации при 94°C в течение 2 мин, с последующими 18 (для GAPDH) или 29 циклами (для TOM34) амплификации при 94°C в течение 30 с, 60°C в течение 30 с, и 72°C в течение 30 с на системе для ПЦР GeneAmp 9700 (PE Applied Biosystems, Foster, CA).
Нозерн-блоттинг
Блоты множества тканей человека (BD Bioscience, Palo Alto, CA) гибридизовали меченным 32P продуктом ПЦР TOM34. Зонд получали посредством ОТ-ПЦР с использованием набора праймеров 5'-GAACGTGAAGGCATTCTACAGA-3' (SEQ ID NO:45) и 5'-TAAACAGCTTAGGTGCCTCTCTG-3' (SEQ ID NO:44), и последующего мечения случайными олигонуклеотидами с 32P-dCTP с помощью набора Mega Label (Amersham Biosciences, Buckinghamshire, United Kingdom). Предгибридизацию, гибридизацию и промывание проводили в соответствии с рекомендациями поставщиков. Блоты подвергали авторадиографии с усиливающими экранами при -80°C в течение 10 суток.
Получение поликлонального антитела против TOM34
Полную кодирующую область TOM34 амплифицировали с использованием набора праймеров 5'-CATAAGCTTGCATGGCCCCCAAATTCCCA-3' (SEQ ID NO:58) и 5'-GTTAAGCTTTTAGTGTAGGTTCT-3', (SEQ ID NO:59), а затем клонировали в соответствующий участок для клонирования вектора pET28 (Novagen, Madison, WI) с получением плазмид, экспрессирующих белок TOM34 с His-меткой. Рекомбинантный белок экспрессировали в Escherichia coli, штамме BL21-CodonPlus (DE3)-RIL (Stratagene, LaJolla, CA), и очищали с использованием сверхтекучей металлоаффинной смолы TALON (BD Bioscience) в соответствии с протоколом изготовителя. Белок инокулировали кроликам и иммунизированные сыворотки очищали на аффинных колонках в соответствии со стандартным способом. Вестерн-блот-анализ проводили, используя белки, экстрагированные из клеток с использованием 0,1% RIPA-подобного буфера, содержащего 50 мМ Трис-HCl (pH 7,5), 250 мМ NaCl, 0,1% SDS и 0,5% NP40 с набором коктейля ингибиторов протеаз III (CALBIOCHEM, La Jolla, CA).
Иммуногистохимия
Иммуногистохимическое окрашивание проводили с использованием аффинно очищенного поликлонального антитела против TOM34 человека. Залитые парафином срезы подвергали воздействию пероксидазной системы для иммунологического окрашивания SAB-PO (Nichirei, Tokyo, Japan), затем антигены извлекали из депарафинизированных и регидратированных тканей путем предварительной обработки срезов 0,01M цитратным буфером (pH 6,0) при 108°C в течение 10 мин в автоклаве.
Конструирование psiU6BX, экспрессирующего siRNA к TOM34
Плазмиды, экспрессирующие siRNA, получали клонированием двухцепочечных олигонуклеотидов в участок BbsI в векторе psiU6BX, как описано ранее (WO2004/076623). Последовательности пар олигонуклеотидов представляли собой:
5'-CACCGAAAGTGTTCTCTACTCCATTCAAGAGATGGAGTAGAGAACACTTTC-3' (SEQ ID NO:46) и
5'-AAAAGAAAGTGTTCTCTACTCCATCTCTTGAATGGAGTAGAGAACACTTTC-3' (SEQ ID NO:47) для siD;
5'-CACCGGATGGAAACTGCAGAGACTTCAAGAGAGTCTCTGCAGTTTCCATCC-3' (SEQ ID NO:50) и
5'-AAAAGGATGGAAACTGCAGAGACTCTCTTGAAGTCTCTGCAGTTTCCATCC-3' (SEQ ID NO:51) для siE.
После фосфорилирования T4-полинуклеотидкиназой пары олигонуклеотидов кипятили в течение пяти мин, а затем подвергали отжигу с получением двухцепочечных олигонуклеотидов при медленном охлаждении. Контрольную плазмиду, psiU6BX-EGFP, получали с использованием олигонуклеотида, состоящего из представленных ниже последовательностей. каждая из нуклеотидных последовательностей, последовательности-мишени siRNA и SEQ ID NO представлены в таблице 1.
5'-CACCGAAGCAGCACGACTTCTTCTTCAAGAGAGAAGAAGTCGTGCTGCTTC-3' (SEQ ID NO:54) и
5'-AAAAGAAGCAGCACGACTTCTTCTCTCTTGAAGAAGAAGTCGTGCTGCTTC-3' (SEQ ID NO:55).
Для исследования эффекта TOM34-siRNA проводили вестерн-блот-анализ с использованием антитела против TOM34 через пять суток после трансфекции плазмидами.
Последовательность специфичного двухцепочечного олигонуклеотида, встроенного в экспрессирующий siRNA вектор, и последовательности-мишени для каждой siRNA
Анализ образования колоний
Клетки HCT116, посеянные на 10-см чашку (4×105 клеток/чашка), временно трансфицировали плазмидами, экспрессирующими TOM34-siRNA, с использованием реагента FuGENE6 (Roche Diagnostics) и поддерживали в среде, содержащей 10% эмбриональную телячью сыворотку с 800 мкг/мл генетицина, в течение двух недель. Выжившие клетки фиксировали 100% метанолом и окрашивали раствором Гимза. В другом эксперименте подсчитывали жизнеспособные клетки с помощью набора для подсчета клеток (DOJINDO, kumamoto, Japan).
Статистический анализ
Статистическую значимость анализировали посредством ANOVA с F-тестом Шиффа, используя коммерчески доступное программное обеспечение (Statview; SAS Institute, Cary, NC).
Пептид, образованный из TOM34
Нонамерные и 10-мерные пептиды, образованные из пептидной последовательности TOM34, которые могут связываться с молекулой HLA-A24, были предсказаны с помощью программного обеспечения для предсказания связывания (http://bimas.dcrt.nih.gov/cgi-bin/molbio/ken_parker_comboform) (Parker KC, et. al., J Immunol. 1994; 152(1):163-75). Эти пептиды синтезировали в Mimotopes, San Diego, CA, в соответствии со стандартным способом твердофазного синтеза и очищали методом обращенно-фазовой ВЭЖХ. Чистоту (>90%) и идентичность пептидов определяли методом аналитической ВЭЖХ и масс-спектрометрическим анализом, соответственно. Пептиды растворяли в диметилсульфоксиде (ДМСО) при 20 мг/мл и хранили при -80°C.
Индукция CTL in vitro
Для индукции CTL против пептидов, представленных на HLA, в качестве антиген-представляющих клеток (APC) использовали образованные из моноцитов дендритные клетки (DC). DC получали in vitro, как описано в других источниках (Nukaya I, et al., Int J Cancer. 1999; 80(1):92-7; Tsai V, et al., J Immunol. 1997; 158(4):1796-802). В кратком изложении, выделяли мононуклеарные клетки периферической крови (PBMC) у нормальных добровольцев (HLA-A24) с помощью раствора Ficoll-Paque (Pharmacia) и разделяли посредством прикрепления к пластмассовому флакону для культивирования тканей (Becton Dickinson), чтобы повысить в них фракцию моноцитов. Обогащенную моноцитами популяцию культивировали в присутствии 1000 Е/мл GM-CSF (предоставленного Kirin Brewery Company) и 1000 Е/мл IL-4 (Genzyme) в AIM-V (Invitrogen), содержащей 2% инактивированную нагреванием аутологичную сыворотку (AS). После 7 суток в культуре DC, полученные с помощью цитокинов, нагружали 20 мкг/мл HLA-A24-связывающих пептидов в присутствии 3 мкг/мл β2-микроглобулина в течение 4 часов при 20°C в AIM-V. Затем эти нагруженные пептидом DC облучали (5500 рад) и смешивали в соотношении 1:20 с аутологичными CD8+ T-клетками, полученными путем положительной селекции с Dynabeads M-450 CD8 (Dynal) и Detachabead (Dynal). Эту смесь разделяли и аликвоты инкубировали в 48-луночных планшетах (Corning); причем каждая лунка содержала 1,5×104 нагруженных пептидом DC и 3×105 CD8+ T-клеток в 0,5 мл AIM-V/2% AS, содержащей 10 нг/мл IL-7 (Genzyme). Через трое суток эти культуры дополняли IL-2 (CHIRON) до конечной концентрации 20 МЕ/мл. На 7 и 14 сутки T-клетки дополнительно повторно стимулировали нагруженными аутологичным пептидом DC. DC получали каждый раз таким же способом, как описано выше. Цитотоксичность тестировали против нагруженных пептидом клеток TISI после 3 раунда стимуляции пептидом на 21 сутки.
Способ размножения CTL
Размножение CTL проводили в культуре с использованием способа, аналогичного способу, описанному Riddell, et al., (Walter et al, N Engl J Med 333:1038-1044 (1995), Riddel et al, Nature Med. 2:216-223 (1996)). Всего 5×104 CTL ресуспендировали в 25 мл AIM-V/5% AS с 25×106 облученных (3300 рад) PBMC и 5×106 облученных (8000 рад) клеток EHM в присутствии 40 нг/мл моноклонального антитела против CD3 (Pharmingen). Через одни сутки после инициации культуры к культуре добавляли 120 МЕ/мл IL-2. Культуру подпитывали свежей AIM-V/5% AS, содержащей 30 МЕ/мл IL-2 на 5, 8 и 11 сутки.
Получение клонов CTL
Культуры размноженных CTL разбавляли и клетки распределяли в лунках 96-луночных микропланшетов для титрования с круглым дном (Nalge Nunc International), доводя количество клеток до 0,3, 1 и 3 CTL/лунка. Затем CTL культивировали с 7×104 клеток/лунка аллогенных PBMC, 1×104 клеток/лунка EHM, 30 нг/мл антитела против CD3 и 125 Е/мл IL-2 всего в 150 мкл/лунка AIM-V, содержащей 5% AS. Через 10 суток к среде добавляли 50 мкл/лунка IL-2 до конечной концентрации IL-2 125 Е/мл. Цитотоксическую активность CTL тестировали на 14 сутки и клоны CTL размножали с использованием того же способа, что описан выше.
Анализ цитотоксичности
Клетки-мишени метили 100 мкКи Na2 51CrO4 (Perkin Elmer Life Sciences) в течение 1 ч при 37°C в CO2-инкубаторе. Нагруженные пептидом клетки-мишени получали инкубацией клеток с 20 мкг/мл пептида в течение 16 часов при 37°C, а затем метили. Меченые клетки-мишени промывали и смешивали с эффекторными клетками в конечном объеме 0,2 мл в микропланшетах для титрования с круглым дном. Планшеты центрифугировали (4 минуты при 800×g) для повышения межклеточного контакта и помещали в CO2-инкубатор при 37°C. После 4 часов инкубации из каждой лунки отбирали 0,1 мл супернатанта и определяли радиоактивность с помощью гамма-счетчика. В случае оценки цитотоксичности в отношении клеток-мишеней, которые эндогенно экспрессируют TOM34, цитолитическую активность тестировали в присутствии 30-кратного избытка немеченых клеток K562 для устранения какого-либо неспецифичного лизиса с помощью NK-подобных эффекторов. Специфичность в отношении антигена подтверждали анализом ингибирования "холодной" мишенью, в котором используют немеченые клетки TISI, нагруженные антигенным пептидом (20 мкг/мл в течение 16 часов при 37°C) для конкуренции за распознавание 51Cr-меченых опухолевых клеток HT29.
Процентное значение специфичной цитотоксичности определяли вычислением процентного значения специфичного высвобождения 51Cr по следующей формуле: {(cpm высвобождения из тестируемого образца - cpm спонтанного высвобождения)/(cpm максимального высвобождения - cpm спонтанного высвобождения)}×100. Спонтанное высвобождение определяли путем инкубации клеток-мишеней отдельно, в отсутствие эффекторных клеток, и максимальное высвобождение получали путем инкубации мишеней с 1 н. HCl. Все измерения проводили по два раза, и стандартные ошибки средних значений были постоянно ниже 10% величины среднего значения.
Результаты
Повышенная экспрессия TOM34 в CRC
В более ранних исследованиях авторов настоящего изобретения был идентифицирован ряд генов, уровень экспрессии которых часто изменялся в опухолях толстого кишечника при анализе профиля экспрессии по всему геному для 11 CRC и девяти аденом толстого кишечника с использованием микроматрицы кДНК, состоящей из 23040 генов. Среди генов, уровень экспрессии которых часто был повышенным в 11 карциномах, авторы настоящего изобретения сосредоточили внимание в настоящем изобретении на гене с внутренним идентификационным номером D3124, который соответствует TOM34 (регистрационный номер GeneBanck No: AB085681, SEQ ID NO:60, 61) (Транслоказа внешней митохондриальной мембраны массой 34 кДа). Последующий полуколичественный ОТ-ПЦР-анализ показал его повышенную экспрессию в 16 из 20 CRC исследованных клинических образцах (фиг.1A). Кроме того, TOM34 также обладал повышенной активностью во всех восьми печеночно-клеточных карциномах, в пяти из 19 случаев рака легкого, 3 из 9 случаев рака мочевого пузыря, семи из 27 случаев острого миелоидного лейкоза и девяти из 49 случаев саркомы мягких тканей по данным авторов настоящего изобретения, полученных с помощью микроматрицы кДНК. Для изучения его экспрессии в нормальных тканях человека авторами настоящего изобретения проведен нозерн-блот-анализ множества тканей с использованием кДНК TOM34 в качестве зонда. В результате анализа был показан транскрипт размером приблизительно 2,0 т.п.н., который обладал избыточной экспрессией в яичке и яичнике и слабо экспрессировался в предстательной железе, селезенке и толстом кишечнике, но не экспрессировался в какой-либо из 11 других исследованных тканей (фиг.1B).
Накопленный белок TOM34 в клеточных линиях рака ободочной и прямой кишки и тканях CRC
Авторами настоящего изобретения получено поликлональное антитело против TOM34 и исследована экспрессия белка TOM34 в восьми клеточных линиях CRC и 12 тканях CRC посредством иммуногистохимического окрашивания. Иммуноблот-анализ показал полосу TOM34, соответствующую массе 34 кДа, который избыточно экспрессировался во всех исследованных клеточных линиях CRC. С другой стороны, были показаны низкие уровни экспрессии в NIH3T3 и COS7, двух нераковых клеточных линиях (фиг. 2B). Вестерн-блот-анализ с использованием 16 CRC и соответствующих нераковых слизистых тканях показал его повышенную экспрессию в 15 из 16 опухолей по сравнению с нормальной слизистой тканью (фиг. 2A). Для исследования субклеточной локализации TOM34 авторами настоящего изобретения проведено иммуноцитохимическое окрашивание с использованием клеток HCT116 и RKO посредством антитела против TOM34, которое показало цитоплазматическую локализацию белка. Кроме того, авторами настоящего изобретения проведено иммуногистохимическое окрашивание с использованием 12 залитых парафином тканей рака толстого кишечника. В 11 из 12 опухолей происходило выраженное окрашивание TOM34 в цитоплазме раковых клеток, но он слабо окрашивался в нераковых слизистых тканях (фиг.3).
Эффект TOM34-siRNA на рост клеток рака толстого кишечника
Для выявления роли TOM34 в раковых клетках авторами настоящего изобретения созданы плазмиды, экспрессирующие siRNA к TOM34, и исследован их эффект на рост раковых клеток. Авторами настоящего изобретения получены две формы плазмид, экспрессирующих siRNA, сконструированных для подавления TOM34 (psiU6BX-TOM34-siD, и -siE), и контрольная плазмида (psiU6BX-siEGFP). Авторы трансфицировали клетки HCT116 посредством psiU6BX-TOM34-siD, psiU6BX-TOM34-siE или psiU6BX-siEGFP. Всетерн-блот-анализ экстрактов из трансфицированных клеток показал, что psiU6BX-TOM34-siD и psiU6BX-TOM34-siE значительно подавляют экспрессию TOM34 в трансфицированных клетках по сравнению с psiU6BX-siEGFP (фиг.4A). Авторы изобретения трансфицировали плазмидами, коэкспрессирующими ген устойчивости к неомицину, клетки HCT116 и культивировали их с соответствующей концентрацией генетицина в течение 13 суток. В соответствии со сниженной экспрессией TOM34 как psiU6BX-TOM34-siD, так и psiU6BX-TOM34-siE значительно замедляли рост трансфицированных клеток по сравнению с psiU6BX-siEGFP (фиг.4B). Эти данные показали, что экспрессия TOM34 ассоциирована с ростом раковых клеток.
Предсказание связывающих HLA-A24 пептидов, образованных из TOM34
В таблицах 2 и 3 представлены предсказанные пептиды для антигена в порядке высоты уровня аффинности связывания. Двадцать 10-мерных пептидов (таблица 2) и двадцать 9-мерных пептидов (таблица 3) выбирали в качестве антигена и исследовали, как описано ниже.
Предсказание кандидатов для эпитопов HLA I класса (HLA-A24:10-мер)
Предсказание кандидатов для эпитопов HLA I класса (HLA-A24:9-мер)
Стимуляция T-клеток с использованием предсказанных пептидов
Цитотоксические T-клетки, которые распознают пептиды, образованные из TOM34, получали способом, описанным в разделе "Материалы и способы". Полученные CTL с выявляемой цитотоксической активностью размножали и получали линии тех CTL, которые обладали более высокой цитотоксической активностью против нагруженной петидом мишени по сравнению с мишенью без нагрузки пептидом.
Линии CTL, стимулированные 10-мерным пептидом TOM34-299 (KLRQEVKQNL (SEQ ID NO:7)), показали выраженную цитотоксическую активность против нагруженной пептидом мишени, не показав какой-либо значительной цитотоксической активности против мишеней, не нагруженных пептидом (фиг.5). Линии CTL показали сильную и антиген-специфичную цитотоксичность, выявляемую уже при соотношении E/T, составляющем 1,2 (фиг.6).
Получение клонов CTL
Клоны CTL получали путем лимитирующего разведения культур CTL с последующим размножением, как описано в разделе "Материалы и способы". Полученные таким способом клоны CTL, специфичные в отношении TOM34-299, содержали те клоны, которые обладают очень высокой цитолитической активностью, с активностью всех клонов в диапазоне от 20% до 70% лизиса при соотношении E/T 1,2 и от 40% до >90% при соотношении E/T 10 (фиг.7).
Цитотоксическая активность против клеточных линий рака толстого кишечника, эндогенно экспрессирующих TOM34, в качестве мишеней
Клоны CTL, индуцированные против пептида TOM34-299, исследовали на их способность распознавать и вызывать гибель опухолевых клеток, эндогенно экспрессирующих TOM34. На фиг.8 представлен результат для двух клонов CTL, индуцированных против TOM34-299. Оба из двух клонов CTL показали выраженную цитотоксическую активность против клеточных линий рака толстого кишечника DLD-1 и HT29, которые экспрессируют TOM34, а также HLA-A24. С другой стороны, ни для одного из двух клонов CTL не было показано какой-либо значимой цитотоксической активности против клеточной линии рака толстого кишечника SNU-C2A, которая экспрессирует TOM34 но не HLA-A24 (фиг.8).
Анализ ингибирования "холодной" мишенью
Анализ ингибирования "холодной" мишенью проводили для подтверждения специфичности линий CTL. Клетки HT29, меченные 51Cr, использовали в качестве "горячей" мишени, в то время как клетки TISI, нагруженные или не нагруженные пептидом, использовали без мечения 51Cr в качестве "холодных" мишеней. Специфичный клеточный лизис против клеток-мишеней HT29 значительно ингибировался при добавлении нагруженных пептидом "холодных" клеток-мишеней при анализе в различных соотношениях, но совсем не ингибировался при добавлении "холодных" клеток-мишеней, не нагруженных пептидом. Результат представлен в качестве процентного значения специфичного лизиса при соотношении эффектор/"горячая" мишень, составляющем 20 (фиг.9).
Анализ гомологии антигенных пептидов
Клоны CTL, полученные против TOM34-299, показали очень сильную цитотоксическую активность. Это может означать, что последовательность этого пептида гомологична последовательностям, образованным из других молекул, о которых известно, что они сенсибилизируют иммунную систему человека. Для исключения этой вероятности проводили анализ гомологии с пептидными последовательностями в качестве запроса с использованием алгоритма BLAST (http://www.ncbi.nlm.nih.gov/blast/blast.cgi) (Altschul SF, et al., Nucleic Acids Res. 1997; 25(17):3389-402.; Altschul SF, et al., J Mol Biol. 1990; 215(3):403-10) и не выявили последовательности со значительной гомологией.
Это указывает на то, что последовательность TOM34-299 является уникальной, и существует небольшая вероятность, насколько известно авторам настоящего изобретения, индукции непредусмотренного иммунологического ответа на какую-либо не родственную ему молекулу.
Блокирование активности CTL антителами, которые связываются с T-клеточными поверхностными антигенами
Чтобы изучить, опосредуется ли выявленная активность в отношении уничтожения цитотоксическими T-клетками, исследовали эффекты антител на активность в отношении уничтожения с использованием антител, которые нейтрализуют функции T-клеточных поверхностных антигенов, связанных с активностью CTL. Активность CTL отчетливо блокировалась при добавлении антител, которые распознают HLA I класса или CD8, и в меньшей степени антителами к HLA II класса или CD4, как показано на фиг.10. Этот результат показывает, что цитотоксическая активность клона T-клеток, выявленная против клеток колоректальной карциномы HT29, представляет собой ограниченную по HLA активность в отношении уничтожения CD8-положительных T-лимфоцитов.
Обсуждение
В настоящем изобретении авторы показали, что TOM34 часто обладает повышенной активностью в CRC, и что он избыточно экспрессируется в нормальном яичке и яичнике и слабо экспрессируется в предстательной железе, селезенке и толстом кишечнике, но редко выявляется в других исследуемых нормальных тканях взрослого.
Одним из перспективных терапевтических подходов является иммунотерапия раковых заболеваний, которая включает опосредуемую T-клетками противоопухолевую вакцинацию. Распознавая пептидные антигены, представленные молекулами главного комплекса гистосовместимости (MHC), CD8+ цитотоксические T-клетки нацеливаются на клетки, представляющие антигены. Поскольку источником опухолевых клеток являются нераковые аутологичные клетки, большая часть опухолевых клеток уходит от иммунного надзора. Большое значение имеет идентификация антигенов, специфично экспрессируемых в раковых клетках, для проведения иммунотерапии рака. Антигены не экспрессируются в яичке вследствие отсутствия молекул MHC I класса (Jassim A, et al., Eur J Immunol 19: 1215-1220, 1989). Таким образом, гены, специфично экспрессирующиеся в злокачественной опухоли и яичке, должны стать мишенью для иммунотерапии. Поскольку TOM34 не обладает избыточной экспрессией в нормальных органах, за исключением яичка и яичника, и обладает повышенной активностью в большинстве случаев рака толстого кишечника, TOM34 может служить для терапевтического нацеливания на CRC в качестве нового антигена злокачественной опухоли-яичка.
Первоначально считали, что TOM34 функционирует в качестве компонента транслоказы для импорта белков в митохондрии, поскольку для этого белка показана гомология последовательности с дрожжевым белком Tom (Nuttall SD, et al., DNA Cell Biol 16: 1067-1074, 1997). Хотя TOM34 предположительно локализуется на наружной митохондриальной мембране, последние исследования показали, что он включен в цитозоль клеток Hela (Chun-Song Y & Henry W, Archives of Biochemistry and Biophysics 400: 105-110, 2002; Abhijit M, et al., Archives of Biochemistry and Biophysics 400: 97-104, 2002). В соответствии с этими данными авторы настоящего изобретения обнаружили субклеточную локализацию TOM34 в цитоплазме в клетках CRC путем иммуногистохимического окрашивания с использованием поликлонального антитела против TOM34. В другом сообщении, посредством скрининга с использованием дрожжевой двухгибридной системы выявили валосин-содержащий белок (VCP) и hsp90 в качестве взаимодействующих с TOM34 белков. VCP, член семейства AAA (АТФаз, ассоциированных с множеством видов клеточной активности), также известный как p97, образует комплекс с убиквитинилированным IκBα и субъединицами протеосомы 26S, подтверждая, что VCP может быть вовлечен в транслокацию транскрипционного фактора NFκB в ядро посредством деградации IκBα (Dai RM, et al., J Biol Chem 273: 3562-3573, 1998). HSP90 представляет собой молекулярный шаперон, взаимодействие с которым требуется для стабильности и функционирования большого количества молекул. Таким образом, TOM34 может быть стабилизирован путем связывания с HSP90. Поскольку HSP90 ассоциирует с онкогенными молекулами, такими как Raf1, AKT и SMYD3, был разработан ряд ингибиторов HSP90 для лечения злокачественной опухоли у человека. Предполагают, что эти ингибиторы вызывают тяжелые побочные эффекты вследствие препятствования нормальному функционированию HSP90, поскольку HSP90 экспрессируется повсеместно в большинстве нормальных тканей.
В заключение, TOM34 обладал повышенной активностью в CRC, но слабо экспрессировался в нормальных органах, за исключением яичка и яичника. Таким образом, вероятно, что ингибирование TOM34 не вызовет тяжелых побочных эффектов на нормальные клетки. Кроме того, подавление TOM34 приводило к ингибированию клеточного роста раковых клеток, подтверждая, что TOM34 играет существенную роль в их росте. Эти данные означают, что TOM34 представляет собой перспективную мишень для иммунотерапии и разработки противоопухолевых лекарственных средств против рака ободочной и прямой кишки человека.
Кроме того, идентификация новых TAA, которые индуцируют сильные и специфичные противоопухолевые иммунные ответы, дает основание для дальнейшего развития клинического применения стратегии пептидной вакцинации при различных типах злокачественных опухолей (Boon T & van der Bruggen P, J Exp Med. 1996; 183(3):725-9, van der Bruggen P, et al., Science. 1991; 254(5038):1643-7., Brichard V, et al., J Exp Med. 1993; 178(2):489-95., Kawakami Y, et al., J Exp Med. 1994; 180(1):347-52., Shichijo S, et al., J Exp Med. 1998; 187(3):277-88, Chen YT, et al., Proc Natl Acad Sci USA. 1997; 94(5):1914-8., Harris CC., J Natl Cancer Inst. 1996; 88(20):1442-55., Butterfield LH, et al., Cancer Res. 1999; 59(13):3134-42., Vissers JL, et al., Cancer Res. 1999; 59(21):5554-9., van der Burg SH, et al., J Immunol. 1996; 156(9):3308-14., Tanaka F, et al., Cancer Res. 1997; 57(20):4465-8., Fujie T, et al., Int J Cancer. 1999; 80(2):169-72., Kikuchi M, et al., Int J Cancer. 1999; 81(3):459-66., Oiso M, et al., Int J Cancer. 1999; 81(3):387-94).
Авторы настоящего изобретения анализировали пептиды, образованные из TOM34, в качестве эпитопов TAA, ограниченных по HLA-A24, одному из часто встречающихся аллелей HLA в японской, а также европейской популяциях (Date Y, et al., Tissue Antigens, 1996; 47: 93-101. Kondo A, et al., J Immunol, 1995; 155: 4307-12, Kubo RT, et al., J Immunol, 1994; 152: 3913-24). В настоящем изобретении авторы выбрали кандидатов для ограниченных по HLA-A24 пептидов эпитопов, образованных из TOM34, с использованием информации об их предсказанной аффинности связывания с HLA-A24. После стимуляции in vitro T-клеток посредством DC, нагруженных этими пептидами-кандидатами, успешно получили CTL с использованием пептида TOM34-299 (KLRQEVKQNL) (SEQ ID NO:7), для которых была показана выраженная цитотоксическая активность против нагруженных пептидом клеток TISI. Кроме того, клоны CTL, образованные из этих CTL, показали специфичную цитотоксичность также против клеточных линий колоректальной карциномы, эндогенно сверхэкспрессирующих TOM34 и положительных по HLA-A24. Цитотоксическая активность этих клонов CTL не проявлялась против клеточных линий, в которых отсутствовала экспрессия либо HLA-A24, либо TAA-мишени, и она значительно ингибировалась "холодной" мишенью. Эти результаты убедительно подтверждают, что TOM34 представляет собой новый TAA рака толстого кишечника и что TOM34-299 представляет собой специфичный пептид эпитопа TAA, ограниченного по HLA-A24. Поскольку этот антиген сверхэкспрессирован в большинстве случаев рака толстого кишечника и ассоциирован с пролиферацией опухолевых клеток, он, по-видимому, является хорошей мишенью для применения в иммунотерапии против рака толстого кишечника.
Анализ гомологии TOM34-299 показал, что он не обладает значительной гомологией с пептидами, образованными из каких-либо известных генных продуктов человека.
Промышленная применимость
Анализ генной экспрессии рака толстого кишечника, описанный в настоящем документе, проведенный сочетанием рассечения посредством лазерного захвата и микроматрицы кДНК всего генома, выявил определенные гены в качестве мишеней для профилактики и лечения рака. Исходя из экспрессии ряда этих генов с отличающейся экспрессией, настоящее изобретение относится к молекулярным диагностическим маркерам для идентификации и выявления CRC.
Описанные в настоящем документе способы также пригодны для идентификации дополнительных молекулярных мишеней для профилактики, диагностики и лечения CRC. Данные, приведенные в настоящем описании, усиливают всестороннее понимание CRC, способствуют разработке новых диагностических стратегий и предоставляют сведения для идентификации молекулярных мишеней для терапевтических лекарственных средств и профилактических средств. Такая информация обеспечивает более полное понимание образования опухолей толстого кишечника и обеспечивает индикаторы для разработки новых стратегий для диагностики, лечения, и, наконец, профилактики CRC.
Например, средства, которые блокируют экспрессию TOM34 или препятствуют его активности, обладают терапевтической применимостью в качестве средств против злокачественной опухоли, в частности, противораковых средств для лечения CRC. Примеры таких средств включают антисмысловые олигонуклеотиды, малые интерферирующие РНК и рибозимы против гена TOM34, и антитела, которые распознают TOM34. Альтернативно, идентификация новых TAA, которые индуцируют сильные и специфичные противоопухолевые иммунные ответы, дает основание для дальнейшего развития клинического применения стратегии пептидной вакцинации при CRC.
Кроме того, несмотря на то, что настоящее изобретение описано подробно и с учетом его конкретных вариантов осуществления, следует понимать, что представленное выше описание по своему характеру является иллюстративным и поясняющим и предназначено для иллюстрации данного изобретения и его предпочтительных вариантов осуществления. С помощью обычного экспериментирования специалист в данной области легко поймет, что можно проводить его различные изменения и модификации без отклонения от сущности и объема настоящего изобретения. Таким образом, данное изобретение предполагает определение не посредством представленного выше описания, а посредством представленной ниже формулы изобретения и ее эквивалентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СВЯЗАННЫЙ С РАКОМ ТОЛСТОГО КИШЕЧНИКА ГЕН ТОМ34 | 2006 |
|
RU2449020C2 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2600888C2 |
| ПЕПТИДЫ HJURP И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2011 |
|
RU2570560C2 |
| ПЕПТИДЫ CDC45L И ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ ТАКОВЫЕ | 2010 |
|
RU2562160C2 |
| ОЛИГОПЕПТИДЫ IMP-3 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2550695C2 |
| ПЕПТИДЫ NEIL3 И ВКЛЮЧАЮЩИЕ ИХ ВАКЦИНЫ | 2010 |
|
RU2733985C2 |
| ПЕПТИД CDCA1 И ВКЛЮЧАЮЩЕЕ ЕГО ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО | 2008 |
|
RU2486195C2 |
| ЭПИТОПНЫЕ ПЕПТИДЫ RAB6KIFL/KIF20A И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2532105C2 |
| ПЕПТИДЫ ТТК И ВАКЦИНЫ, ИХ СОДЕРЖАЩИЕ | 2010 |
|
RU2531348C2 |
| ПЕПТИДЫ ЭПИТОПОВ MYBL2 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2009 |
|
RU2496787C2 |















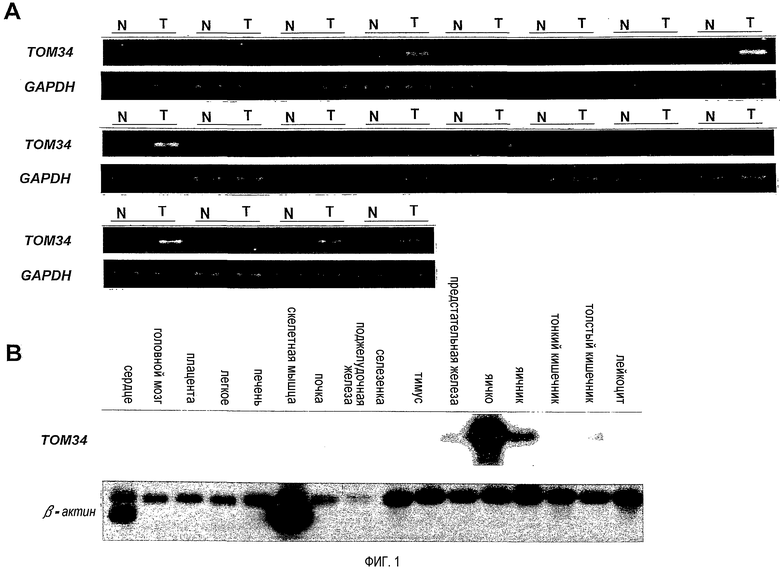
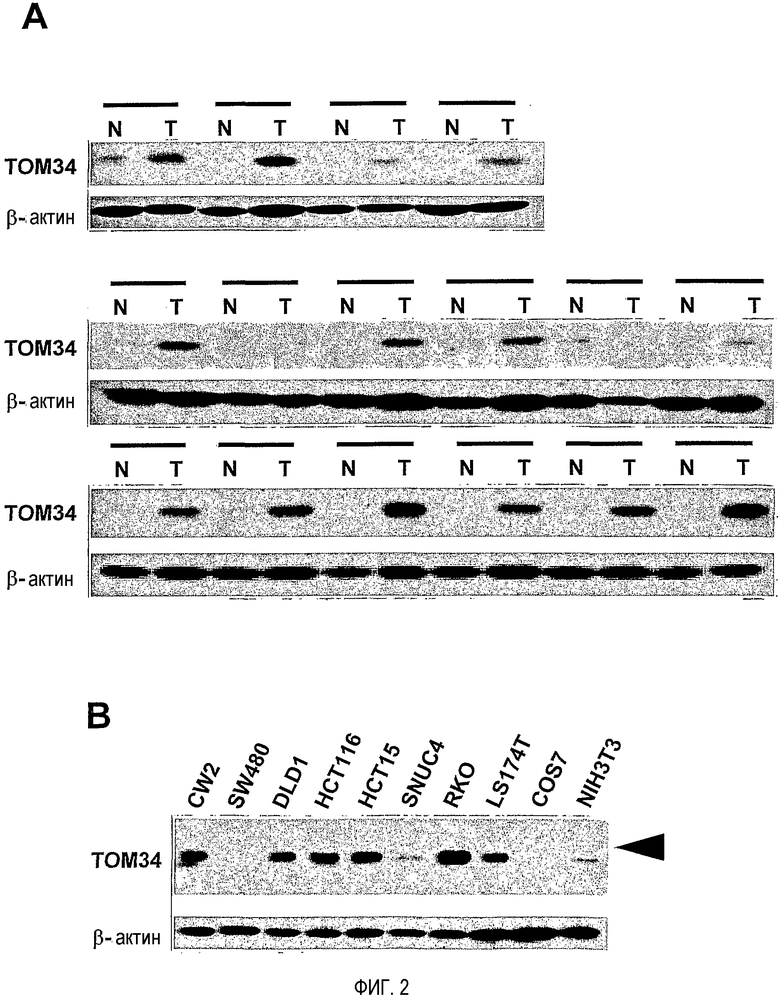
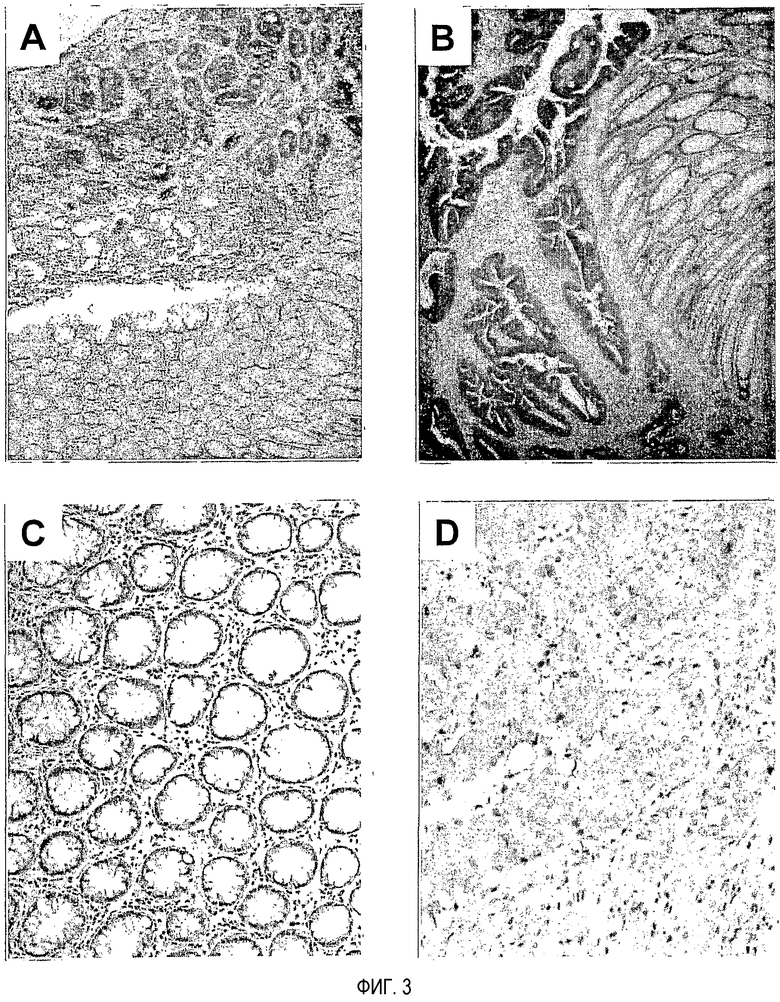
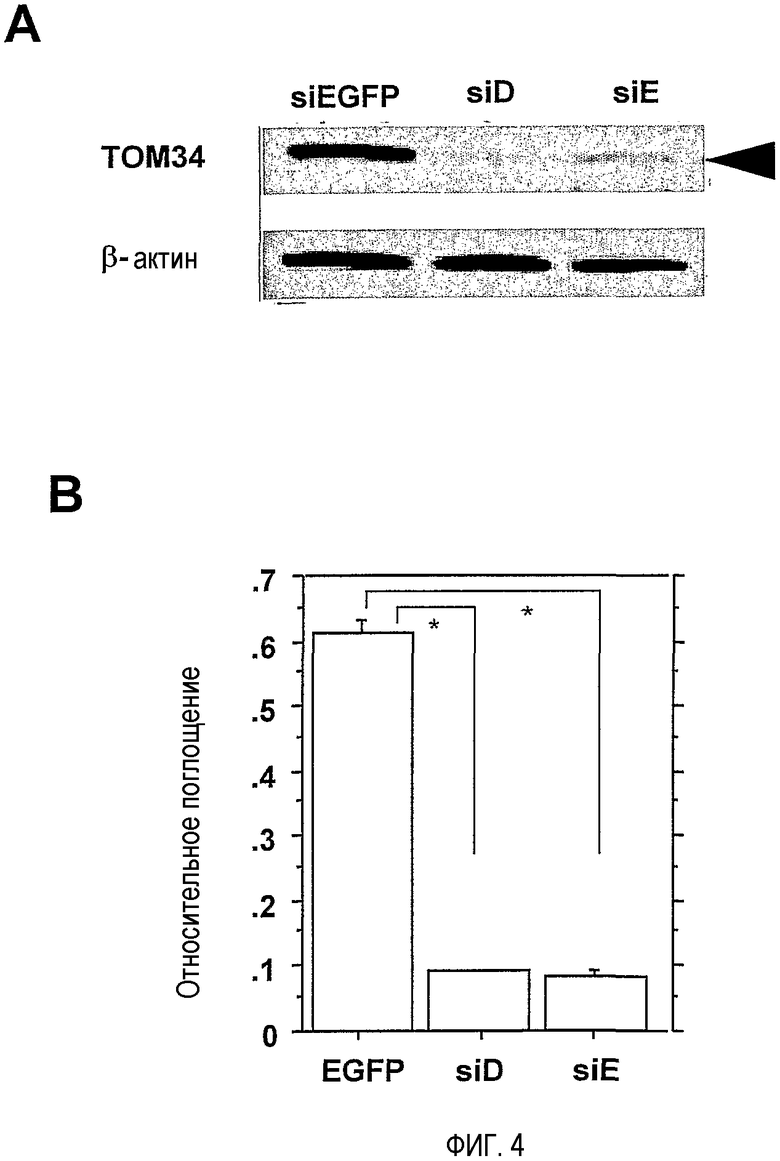
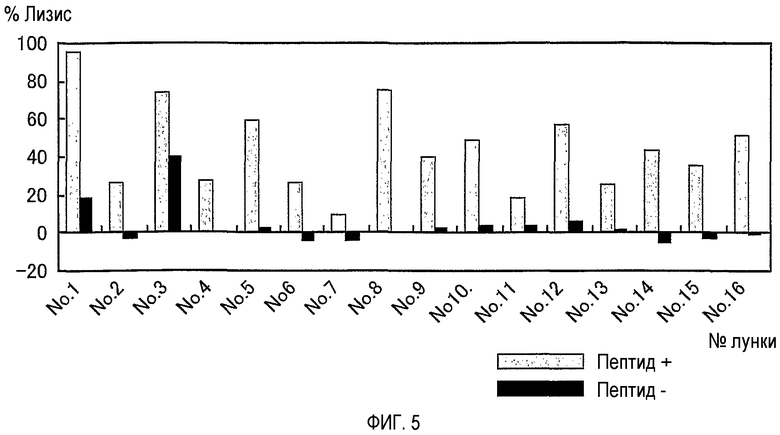
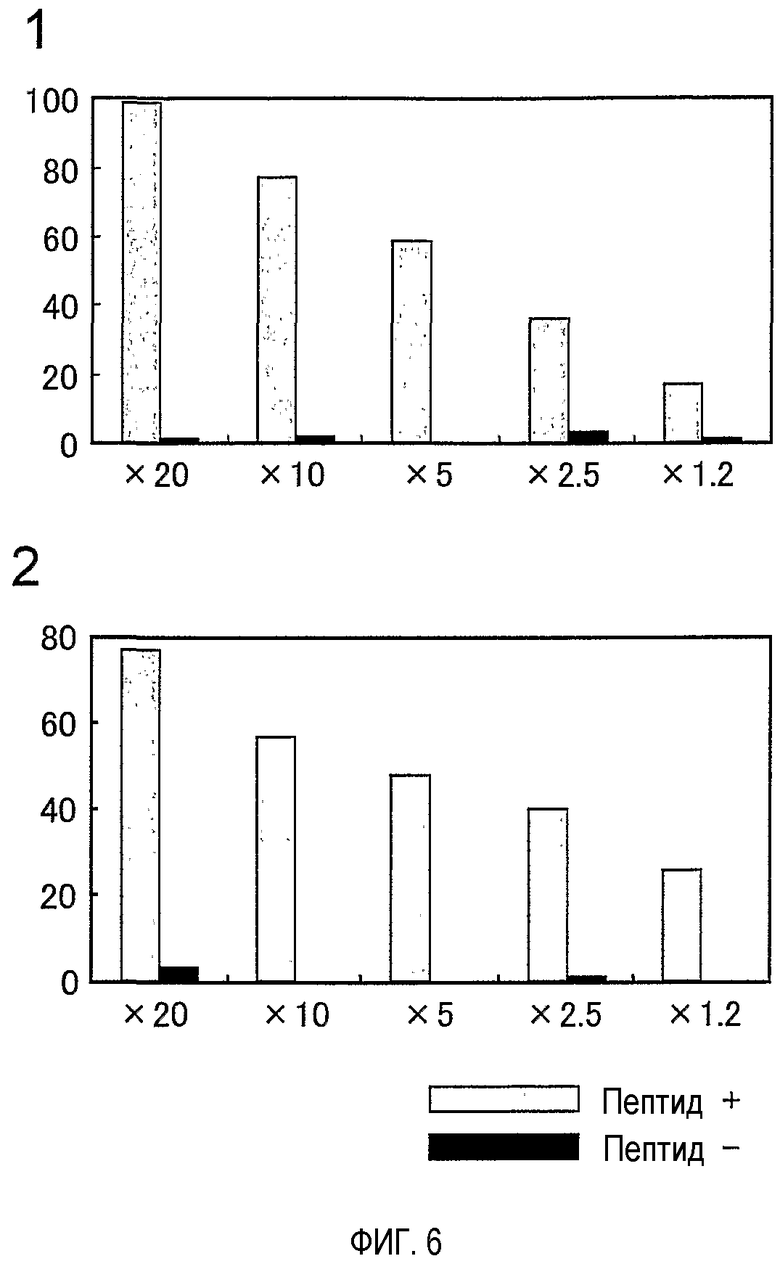
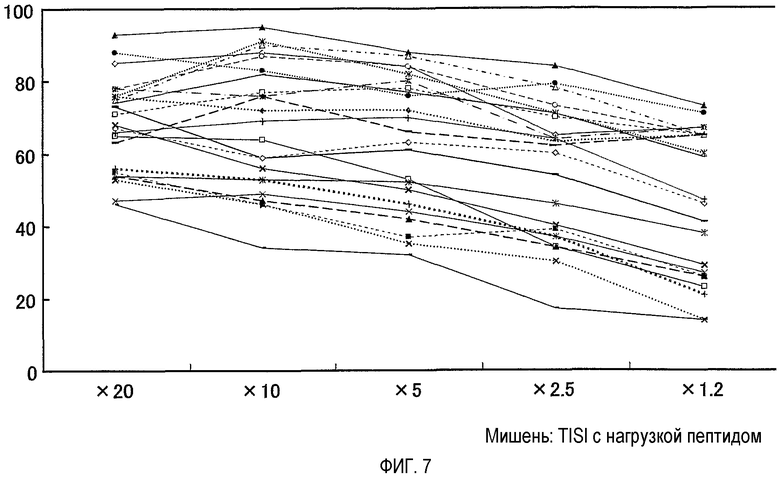
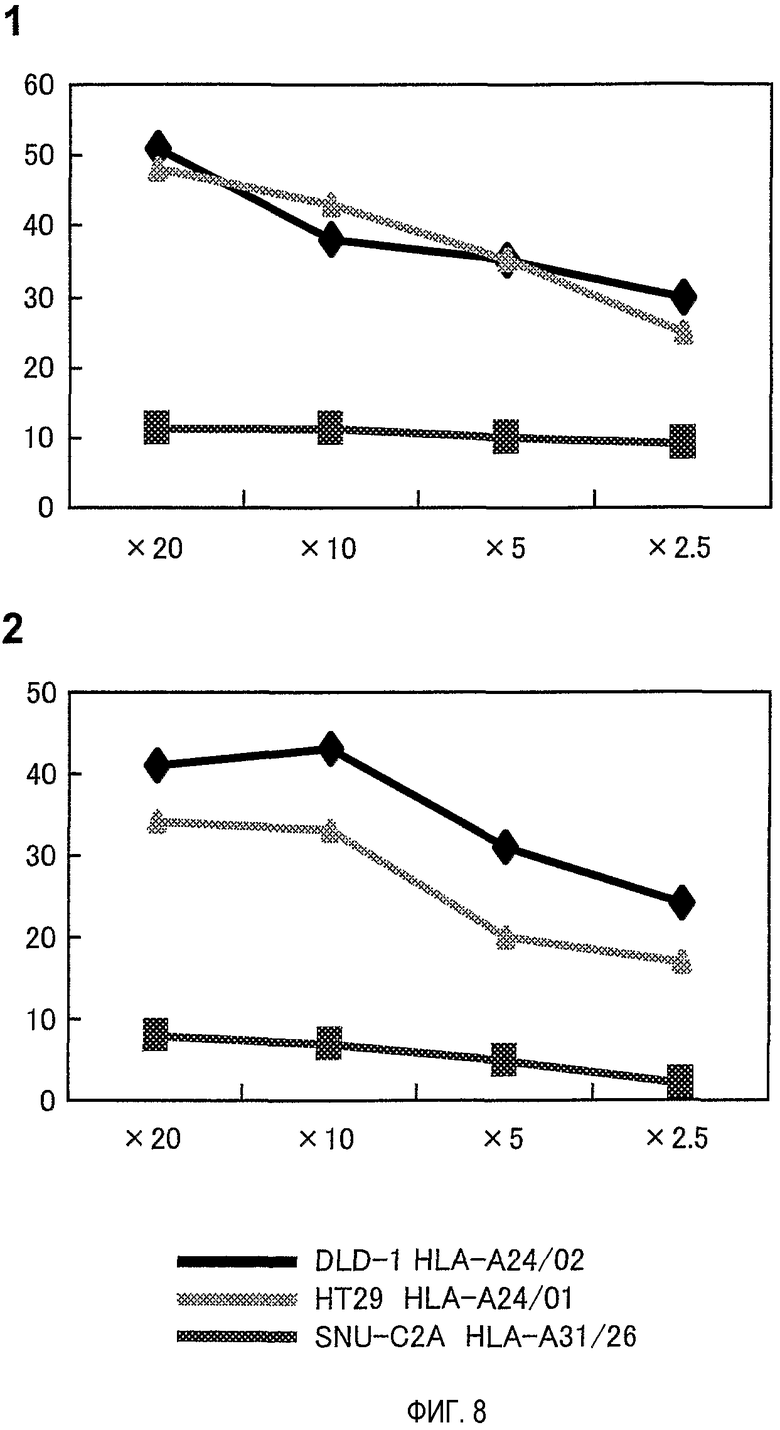
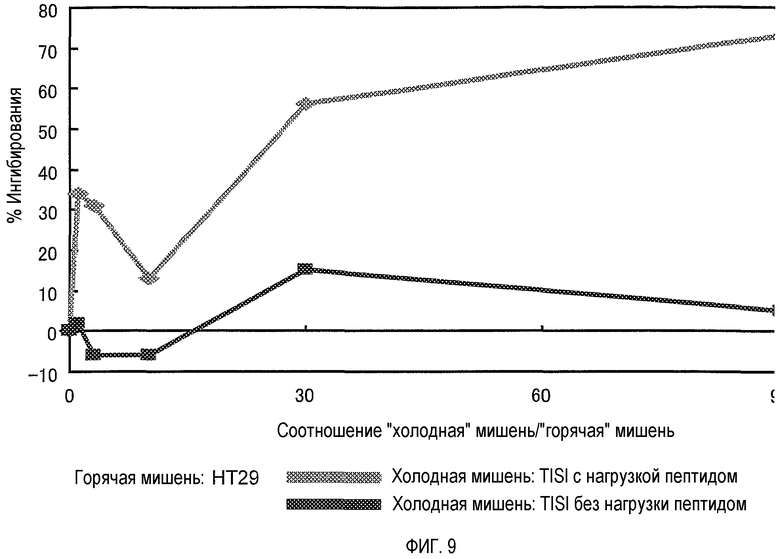
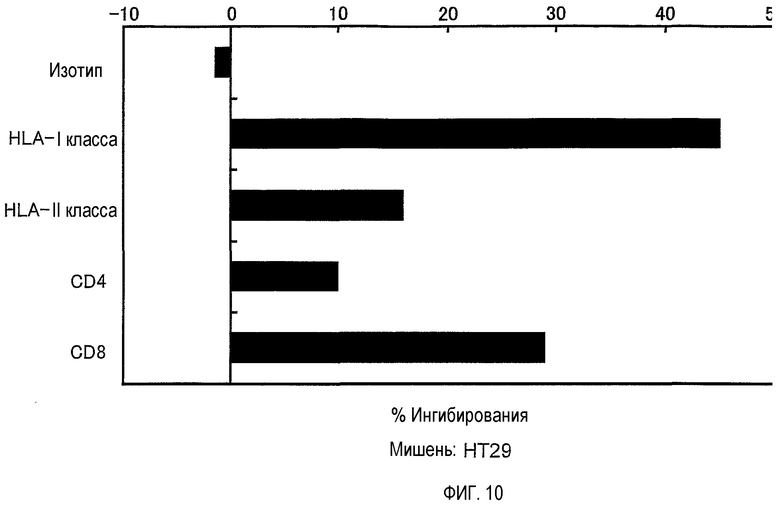
Изобретение относится к способу индуцирования противоопухолевого иммунитета приведением в контакт антиген-представляющей клетки с иммунологически активным фрагментом, выбранным из группы, состоящей из: (i) иммунологически активного фрагмента полипептида, кодируемого нуклеиновой кислотой ТОМ34, представляющего собой декапептид, обладающий способностью индуцировать цитотоксические Т-клетки, содержащий аминокислотную последовательность SEQ ID NO:7;
(ii) иммунологически активного фрагмента полипептида, кодируемого нуклеиновой кислотой ТОМ34, представляющего собой пептид, обладающий способностью индуцировать цитотоксические Т-клетки, где пептид содержит аминокислотную последовательность SEQ ID NO:7, в которой 1 или 2 аминокислоты замещены или добавлены;
(iii) иммунологически активного фрагмента (ii), где вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:7 представляет собой фенилаланин, тирозин, метионин или триптофан; и
(iv) иммунологически активного фрагмента (ii), где С-концевая аминокислота аминокислотной последовательности SEQ ID NO:7 представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин,
или с полинуклеотидом, кодирующим указанный фрагмент, или с вектором, содержащим этот полинуклеотид. Применение изобретения обеспечивает эффективную иммунотерапию рака. 10 ил., 3 табл.
Способ индуцирования противоопухолевого иммунитета, причем указанный способ включает стадию приведения антиген-представляющей клетки в контакт с иммунологически активным фрагментом, выбранным из группы, состоящей из
(i) иммунологически активного фрагмента полипептида, кодируемого нуклеиновой кислотой ТОМ34, представляющего собой декапептид, обладающий способностью индуцировать цитотоксические Т-клетки, содержащий аминокислотную последовательность SEQ ID NO:7;
(ii) иммунологически активного фрагмента полипептида, кодируемого нуклеиновой кислотой ТОМ34, представляющего собой пептид, обладающий способностью индуцировать цитотоксические Т-клетки, где пептид содержит аминокислотную последовательность SEQ ID NO:7, в которой 1 или 2 аминокислоты замещены или добавлены;
(iii) иммунологически активного фрагмента (ii), где вторая аминокислота с N-конца аминокислотной последовательности SEQ ID NO:7 представляет собой фенилаланин, тирозин, метионин или триптофан; и
(iv) иммунологически активного фрагмента (ii), где С-концевая аминокислота аминокислотной последовательности SEQ ID NO:7 представляет собой фенилаланин, лейцин, изолейцин, триптофан или метионин,
или с полинуклеотидом, кодирующим указанный фрагмент, или с вектором, содержащим этот полинуклеотид.
| MUKHOPADHYAY A | |||
| et al | |||
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| Arch | |||
| Biochem | |||
| Biophys | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| US 2004181344 A1, (MASSACHUSETTS INST TECHNOLOGY [US] ), 16.09.2004 | |||
| CHEWAWIWAT N | |||
| et al | |||
| Characterization of the Novel Mitochondrial Protein Import Component, Tom34, in Mammalian Cells | |||
| J | |||
| Biochem | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| РУЧНОЙ ПИТАТЕЛЬНЫЙ НАСОС | 1921 |
|
SU721A1 |
Авторы
Даты
2014-08-20—Публикация
2006-07-21—Подача