Текст описания приведен в факсимильном виде.



















































































































































































































































































































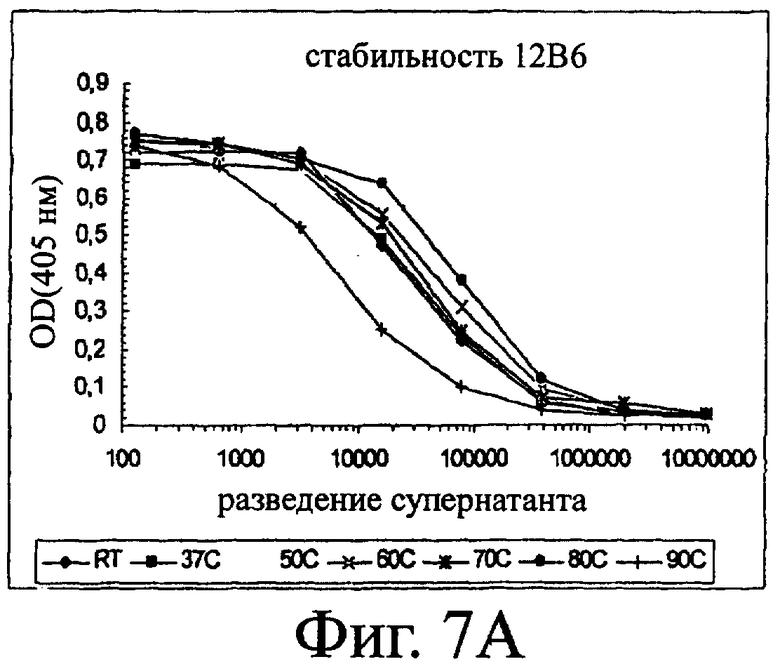
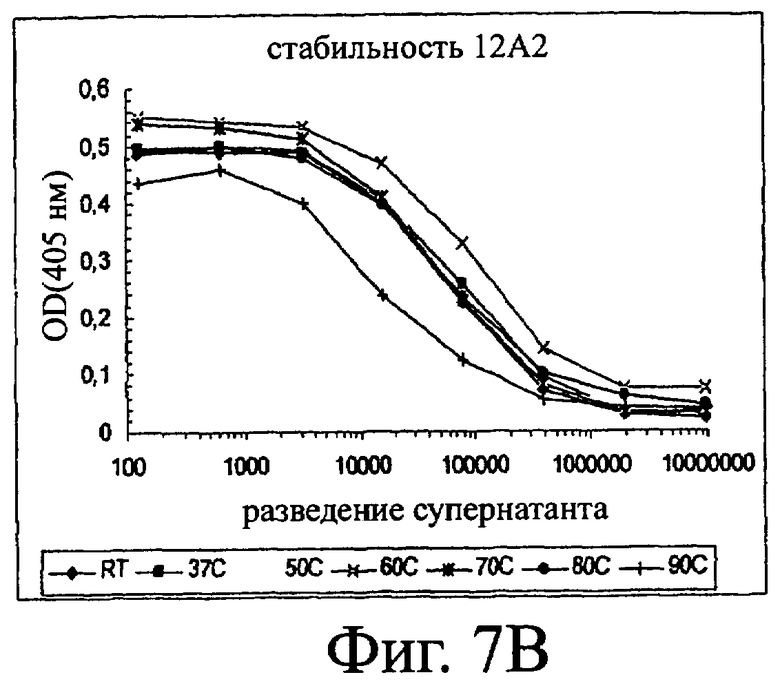
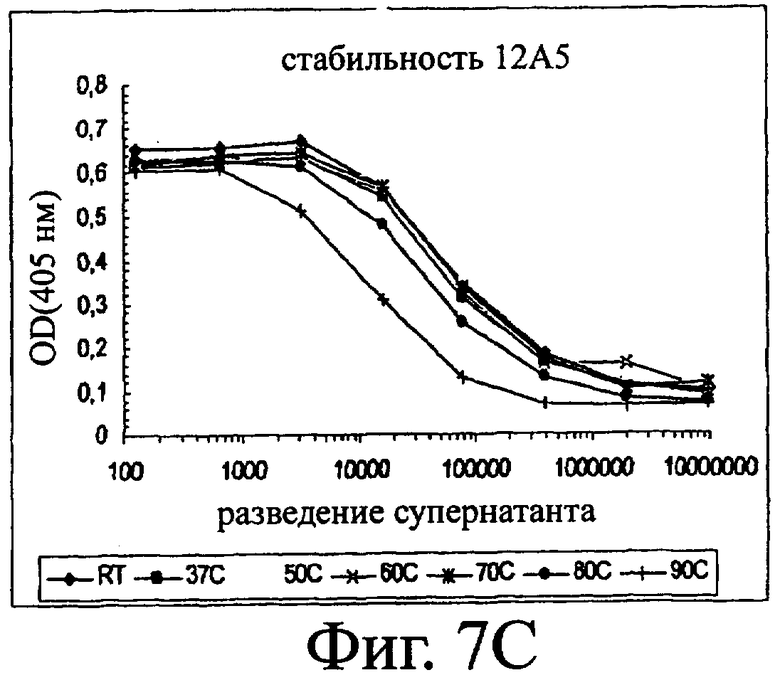
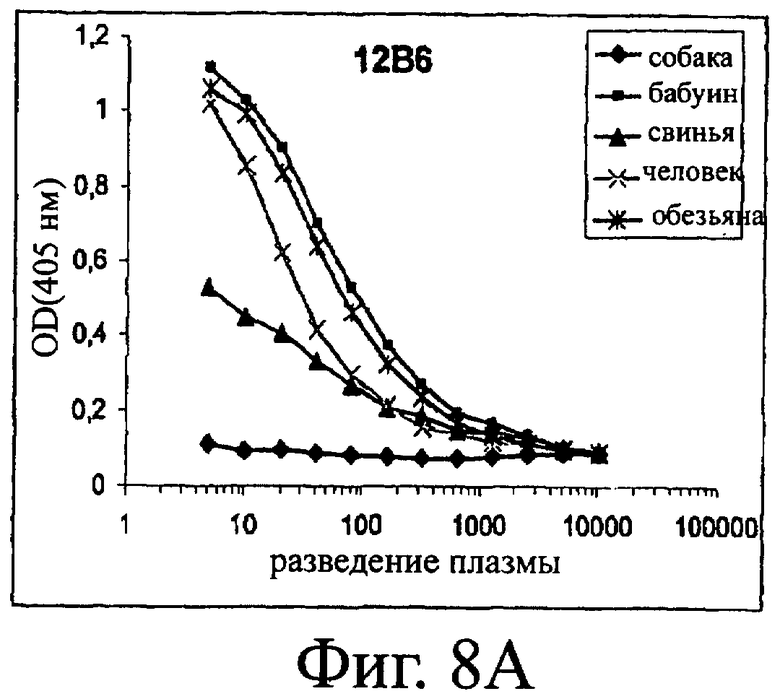
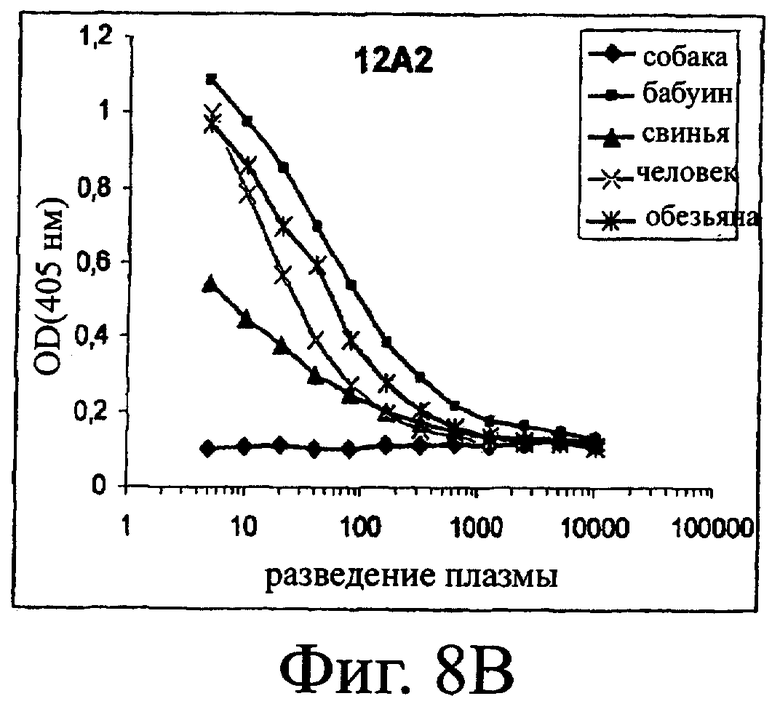
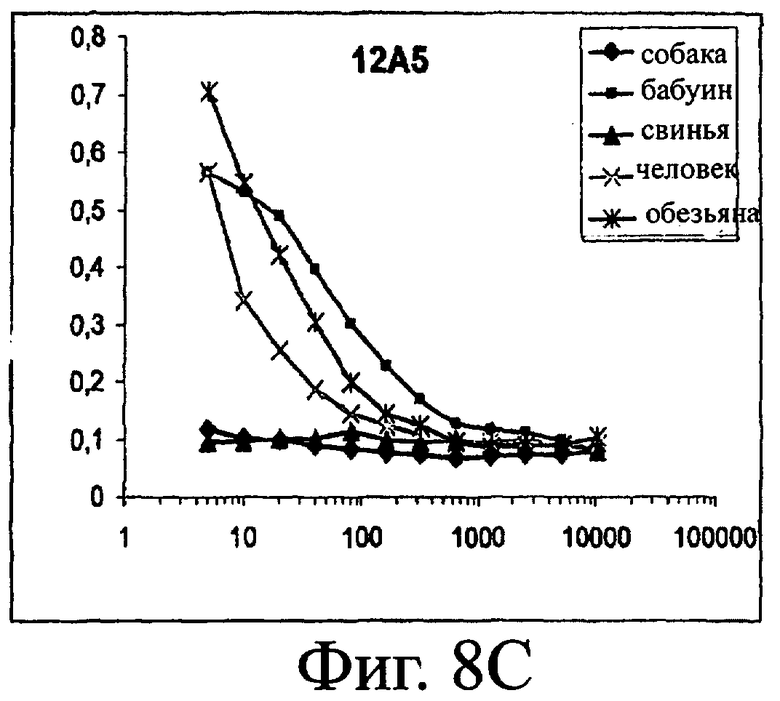




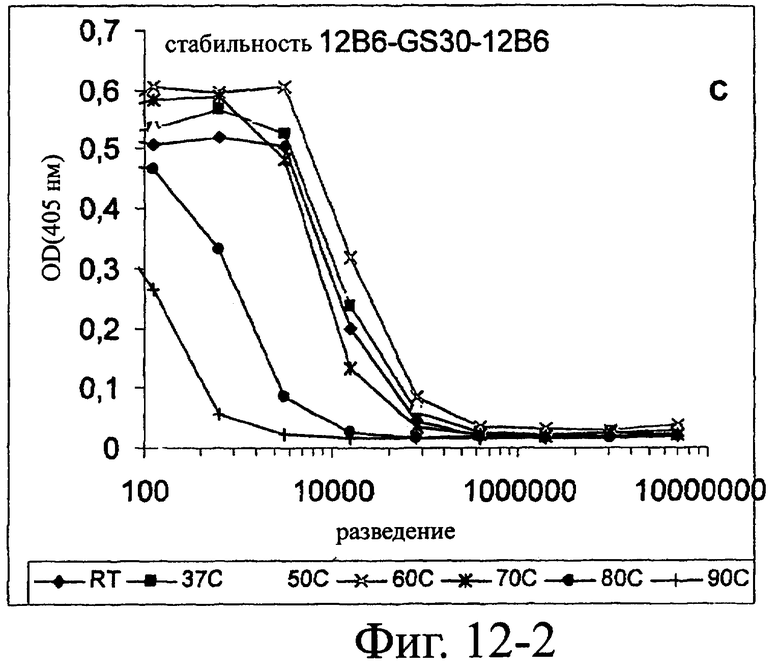
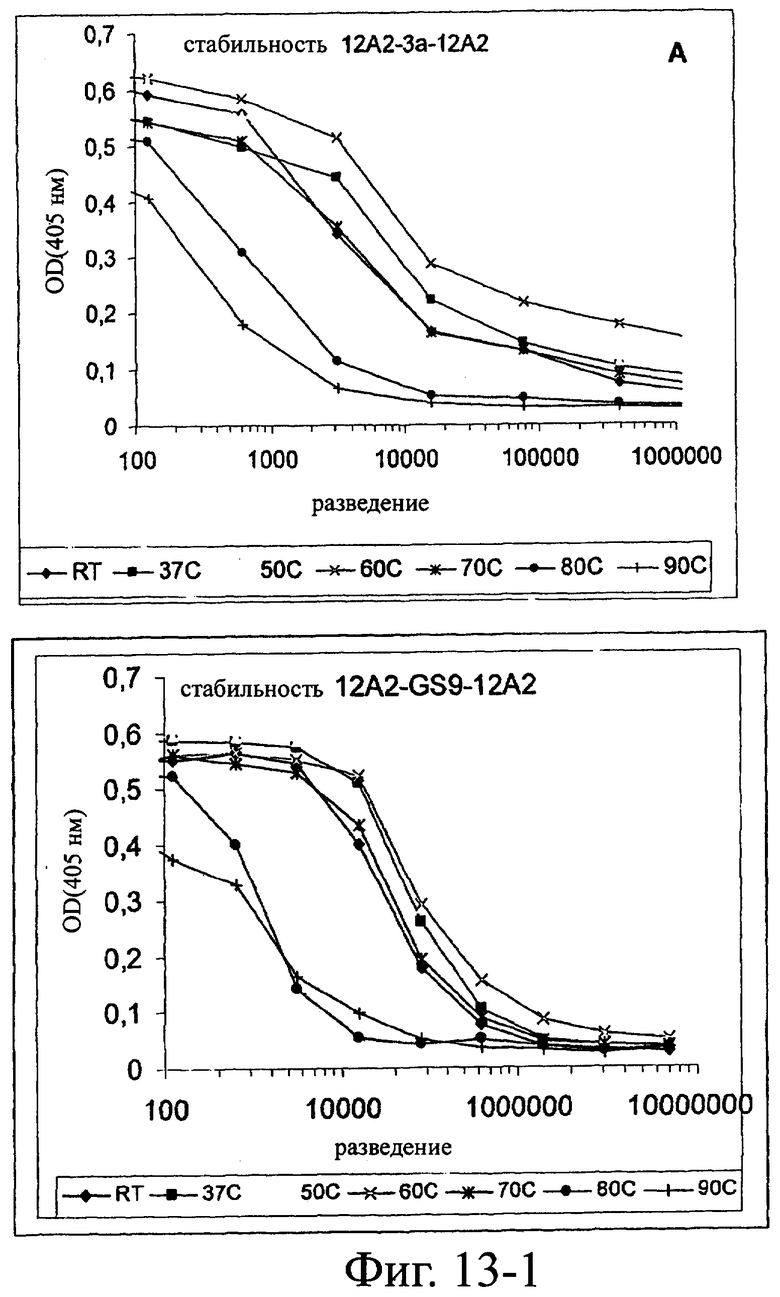














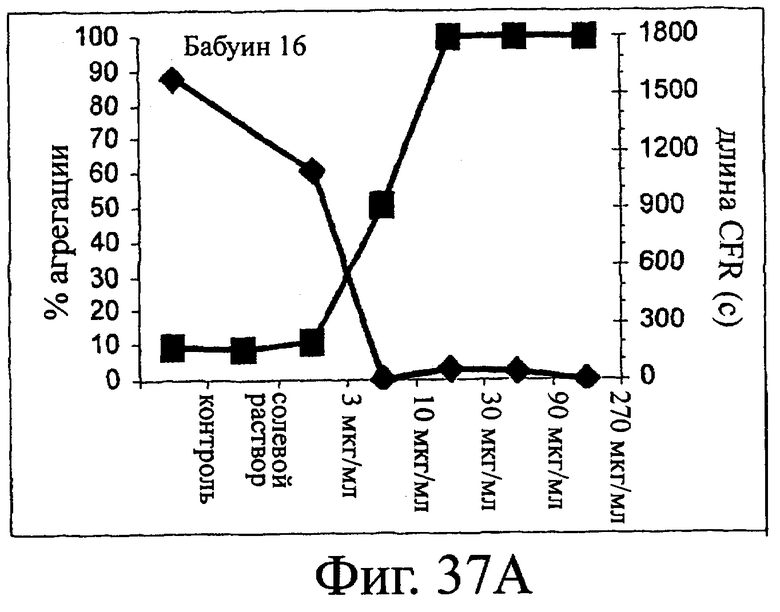
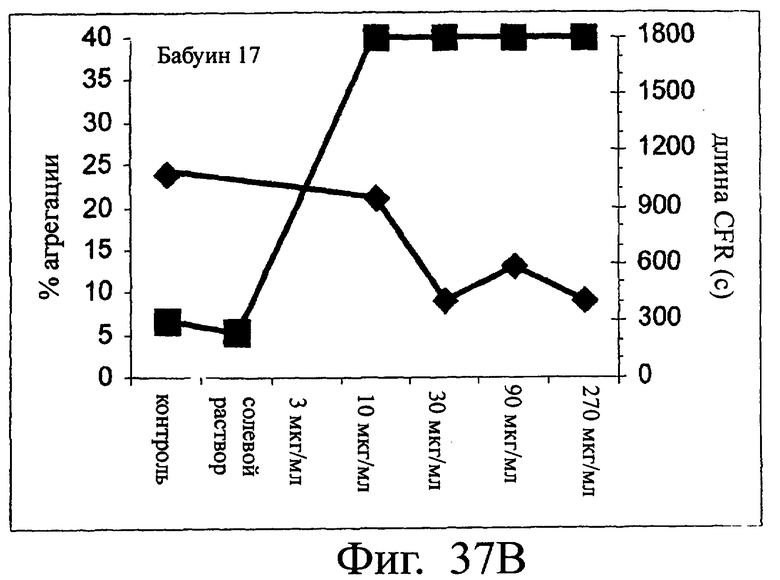
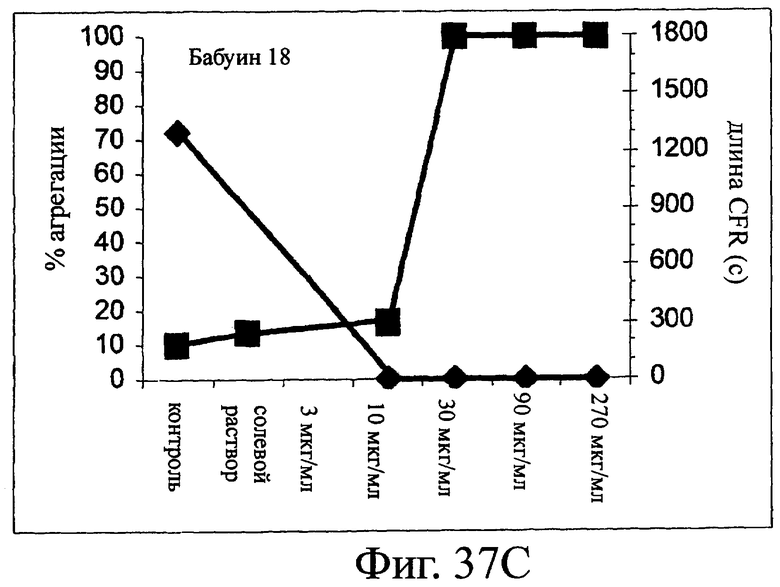

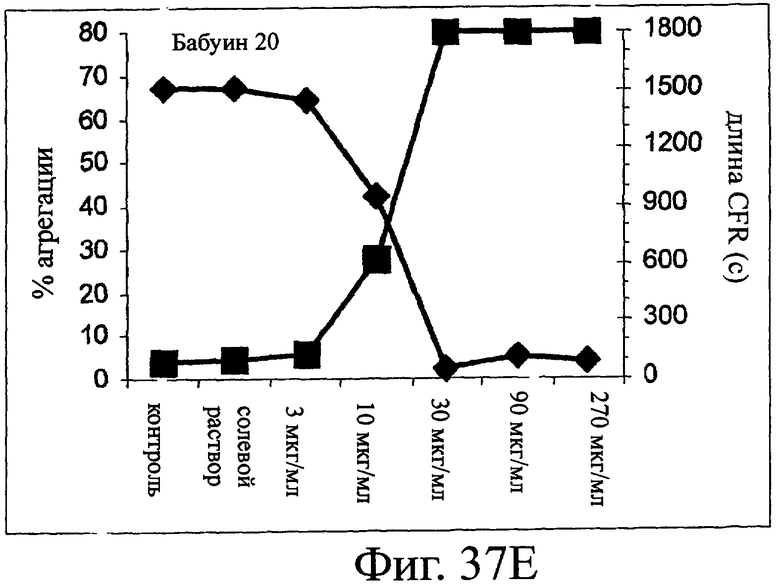








Изобретение относится к биотехнологии и представляет собой белок или полипептид, связывающийся с фактором фон Виллебранда (vWF), содержащий два нанотела, связывающихся с vWF. Также представлены нуклеотидная последовательность, кодирующая белок или полипептид, клетка хозяин, содержащая нуклеотидную последовательность, способ получения белка или полипептида. Кроме того, представлены применения белка или полипептида, в частности для изготовления лекарственного средства. Изобретение может эффективно применяться для профилактики или лечения заболевания или нарушения, связанного с опосредованной тромбоцитами агрегацией. 9 н. и 31 з.п. ф-лы, 66 ил., 60 табл.
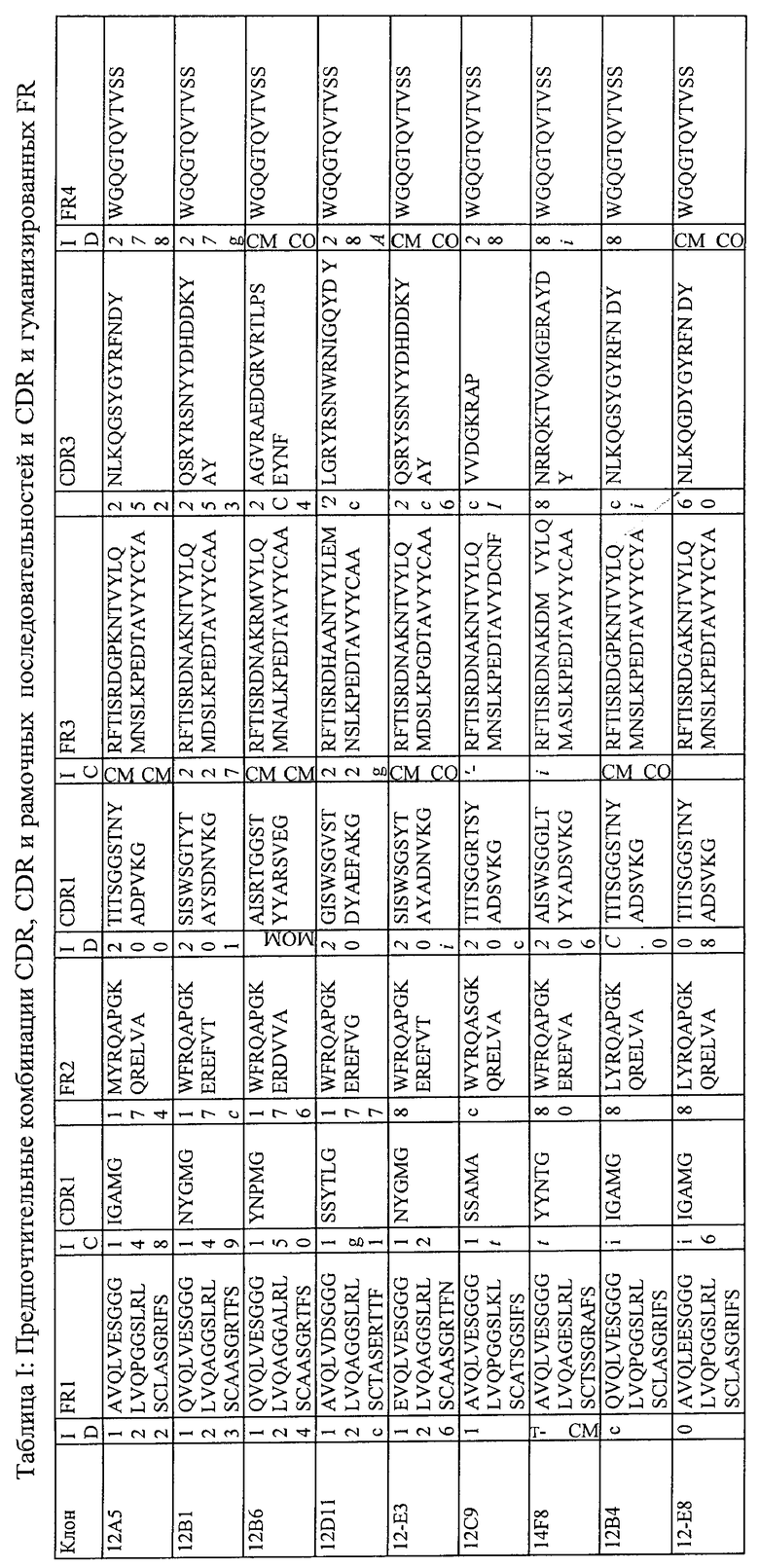
1. Белок или полипептид, связывающийся с фактором фон Виллебранда (vWF), который содержит два идентичных нанотела, где указанное нанотело связывается с фактором фон Виллебранда (vWF), и нанотело состоит из 4 каркасных областей (FR1-FR4 соответственно) и 3 определяющих комплементарность районов (CDR1-CDR3 соответственно), в котором:
i) CDR1 состоит, по существу, из:
- аминокислотной последовательности YNPMG [SEQ ID NO:22];
ii) CDR2 состоит, по существу, из:
- аминокислотной последовательности AISRTGGSTYYPDSVEG [SEQ ID NO:32]; или
- аминокислотной последовательности, которая имеет 2 различия или 1 различие в аминокислотах с аминокислотной последовательностью AISRTGGSTYYPDSVEG [SEQ ID NO:32];
(iii) CDR3 состоит, по существу, из:
- аминокислотной последовательности AGVRAEDGRVRTLPSEYTF [SEQ ID NO:42]; или
- аминокислотной последовательности, которая имеет 1 различие в аминокислотах с аминокислотной последовательностью AGVRAEDGRVRTLPSEYTF [SEQ ID NO:42];
(iv) любая замена аминокислоты в указанных CDR является консервативной заменой аминокислоты; и аминокислотная последовательность содержит только замены аминокислот, а не делеции или инсерции аминокислот, по сравнению с вышеуказанной аминокислотной последовательностью (аминокислотными последовательностями);
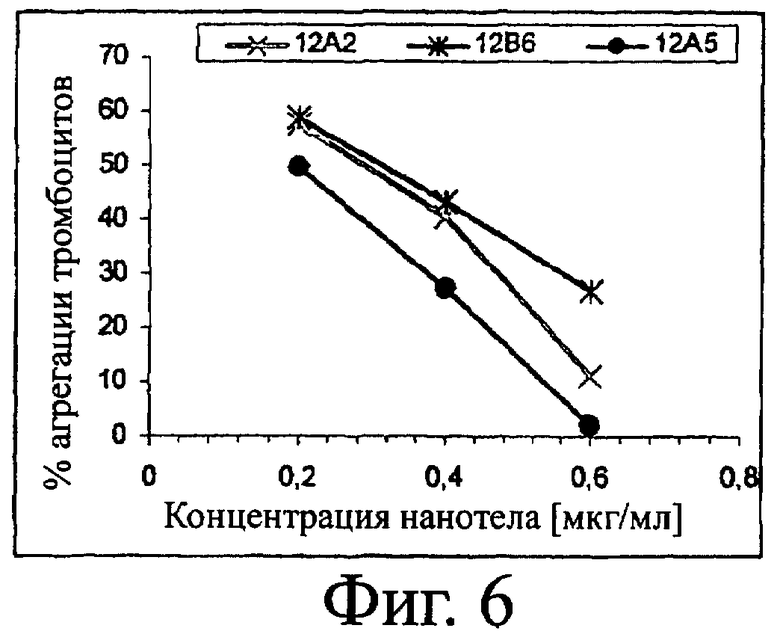
(v) указанный белок или полипептид полностью ингибирует адгезию тромбоцитов в концентрации 0,6 мкг/мл.;
(vi) указанные два антитела связаны друг с другом посредством линкера, и где линкер содержит 3-40 аминокислотных остатка, выбранных из глицина, серина и аланина.
2. Белок или полипептид по п.1, в котором CDR2 состоит, по существу, из аминокислотной последовательности AISRTGGSTYYPDSVEG [SEQ ID NO:32] или AISRTGGSTYYARSVEG [SEQ ID NO:31].
3. Белок или полипептид по п.1, в котором CDR2 состоит, по существу, из аминокислотной последовательности AISRTGGSTYYPDSVEG [SEQ ID NO:32].
4. Белок или полипептид по п.1, в котором CDR1 представляет собой аминокислотную последовательность YNPMG [SEQ ID NO:22]; CDR2 представляет собой аминокислотную последовательность AISRTGGSTYYPDSVEG [SEQ ID NO:32] и CDR3 представляет собой аминокислотную последовательность AGVRAEDGRVRTLPSEYTF [SEQ ID NO:42].
5. Белок или полипептид по п.1, в котором нанотело представляет собой нанотело класса KERE; причем нанотело класса KERE является нанотелом, в котором аминокислотные остатки в позициях 43-46 в соответствии с нумерацией «Kabat» образуют последовательность «KERE».
6. Белок или полипептид по п.1, в котором нанотело является гуманизированным вариантом нанотела.
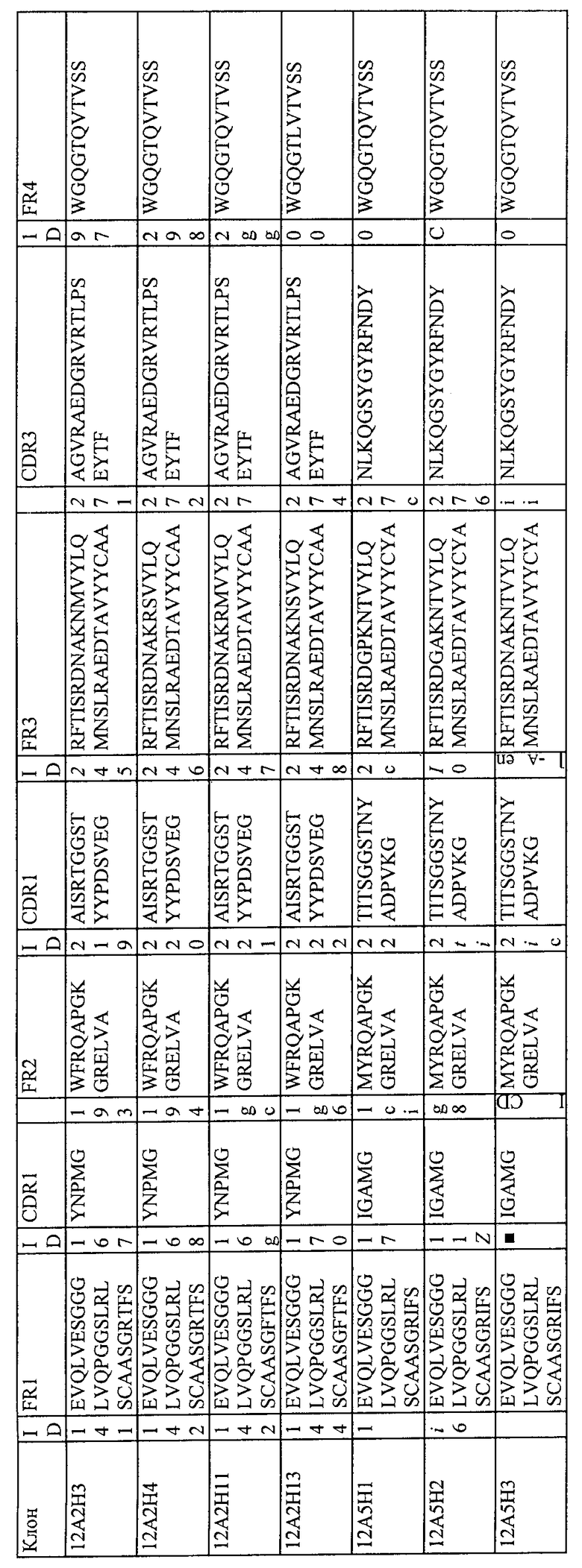
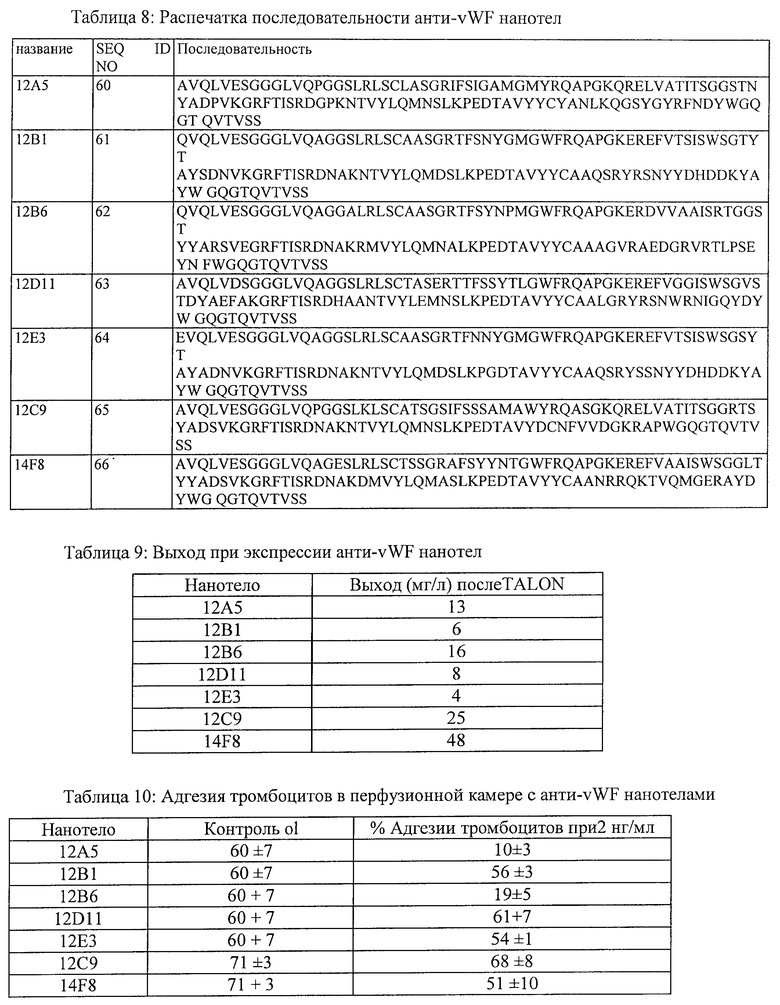
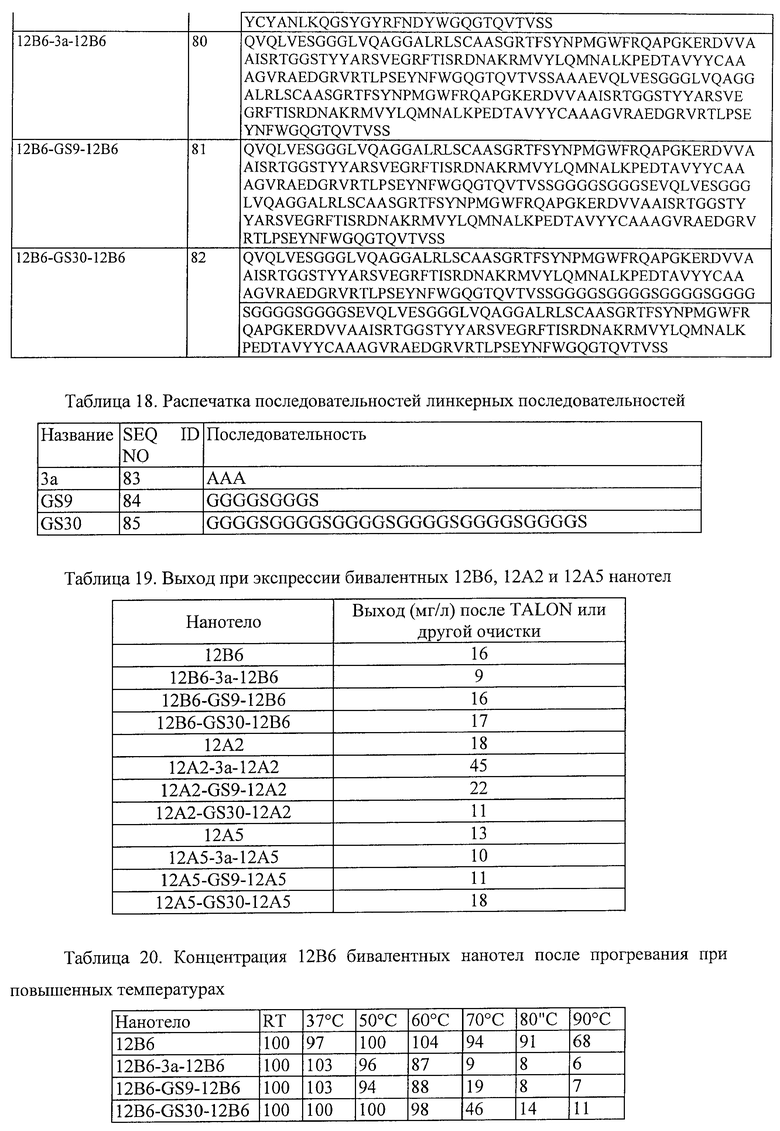
7. Белок или полипептид по п.1, в котором указанное нанотело имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из нанотел, выбранных из группы, состоящей из: 12В6 (SEQ ID NO:62); 12А2 (SEQ ID NO:71); 12F2 (SEQ ID NO:72); 14H10 (SEQ ID NO:73); 12B6H1 (SEQ ID NO:86); 12B6H2 (SEQ ID NO:87); 12B6H3 (SEQ ID NO:88); 12B6H4 (SEQ ID NO:89); 12A2H1 (SEQ ID NO:90); 12A2H3 (SEQ ID NO:91); 12A2H4 (SEQ ID NO:92); 12A2H11 (SEQ ID NO:93) и 12A2H13(SEQ ID NO:94).
8. Белок или полипептид по п.1, где нанотело имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из нанотел, выбранных из группы, состоящей из: 12А2 (SEQ ID NO:71); 12A2H1 (SEQ ID NO:90); 12A2H3 (SEQ ID NO:91); 12A2H4 (SEQ ID NO:92); 12A2H11 (SEQ ID NO:93) и 12А2Н13 (SEQ ID NO:94).
9. Белок или полипептид по п.1, где нанотело имеет 80% идентичность последовательности с нанотелом 12А2Н1 (SEQ ID NO:90).
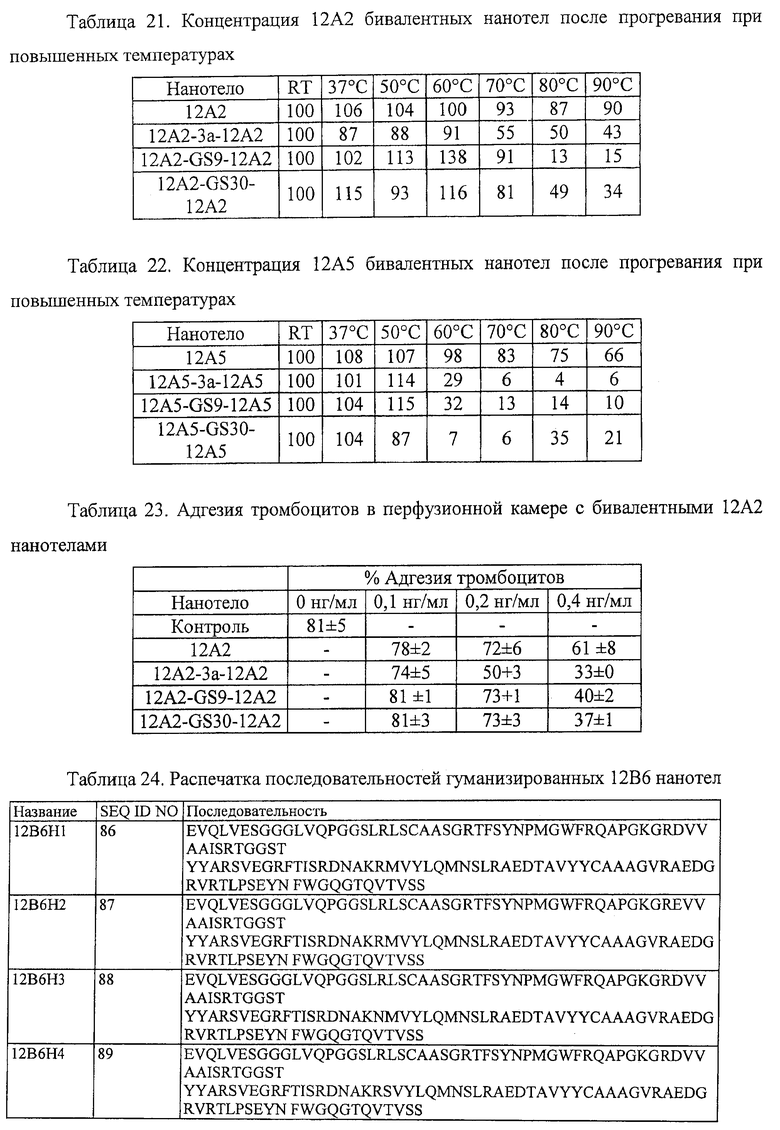
10. Белок или полипептид по п.1, в котором линкер, по существу, состоит из остатков глицина и серина.
11. Белок или полипептид по п.10, в котором линкер состоит из линкера GS9(SEQ ID NO:84).
12. Белок или полипептид по п.1, в котором линкер, по существу, состоит из остатков аланина.
13. Белок или полипептид по п.12, в котором линкер, по существу, состоит из 1-10 остатков аланина.
14. Белок или полипептид по п.12, в котором линкер, по существу, состоит из 3 остатков аланина.
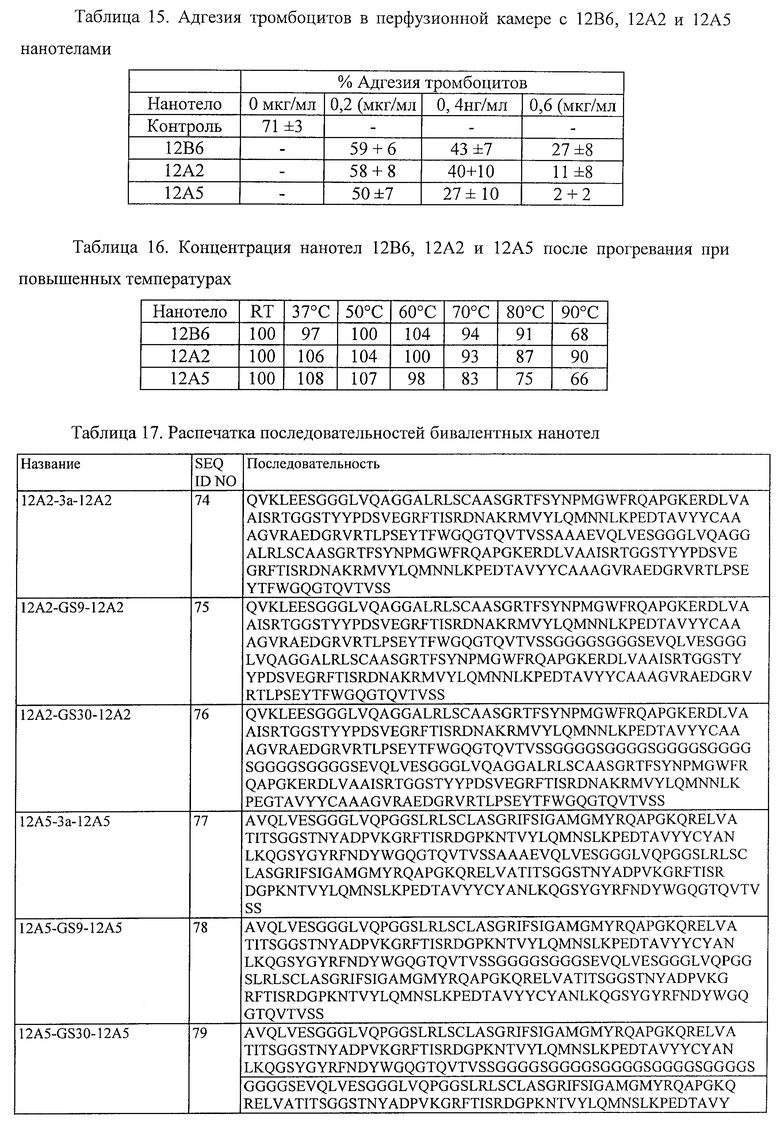
15. Белок или полипептид по п.1, который имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из полипептидов, выбранным из группы, состоящей из SEQ ID NO:74-76, SEQ ID NO:80-82 и SEQ ID NO:98-106.
16. Белок или полипептид по п.1, который имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из полипептидов, выбранным из группы, состоящей из SEQ ID NO:74-76 и SEQ ID NO:98-106.
17. Белок или полипептид по п.1, который имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из полипептидов, выбранным из группы, состоящей из SEQ ID NO:98-106.
18. Белок или полипептид по п.1, который имеет, по меньшей мере, 80% идентичность последовательности SEQ ID NO:98.
19. Белок или полипептид по п.1, который имеет последовательность SEQ ID NO:98.
20. Белок или полипептид по любому из пп.1-19, который связывает vWF с константой диссоциации (КD) менее 500 рМ.
21. Белок или полипептид, связывающийся с фактором фон Виллебранда (vWF), который содержит два идентичных нанотела, где указанное нанотело связывается с фактором фон Виллебранда (vWF) и нанотело состоит из 4 каркасных областей (FR1-FR4 соответственно) и 3 определяющих комплементарность районов (CDR1-CDR3 соответственно), в которых:
CDR1 состоит, по существу, из:
- аминокислотной последовательности YNPMG [SEQ ID NO:22];
и CDR2 состоит, по существу, из:
- аминокислотной последовательности AISRTGGSTYYPDSVEG [SEQ ID NO:32], или
- аминокислотной последовательности, которая имеет 2 различия или только 1 различие в аминокислотах с аминокислотной последовательностью AISRTGGSTYYPDSVEG [SEQ ID NO:32];
и CDR3 состоит, по существу, из:
- аминокислотной последовательности AGVRAEDGRVRTLPSEYTF [SEQ ID NO:42];
- любая замена аминокислоты в указанных CDR является консервативной заменой аминокислоты; и
- аминокислотная последовательность содержит только замены аминокислот, а не делеции или инсерции аминокислот, по сравнению с вышеуказанной аминокислотной последовательностью (аминокислотными последовательностями).
22. Белок или полипептид по п.21, в котором CDR2 состоит, по существу, из аминокислотной последовательности AISRTGGSTYYPDSVEG [SEQ ID NO:32]; или AISRTGGSTYYARSVEG [SEQ ID NO:31].
23. Белок или полипептид по п.21, в котором CDR2 состоит, по существу, из аминокислотной последовательности AISRTGGSTYYPDSVEG [SEQ ID NO:32].
24. Белок или полипептид по п.21, в котором CDR1 представляет собой аминокислотную последовательность YNPMG [SEQ ID NO:22]; CDR2 представляет собой аминокислотную последовательность AISRTGGSTYYPDSVEG [SEQ ID NO:32] и CDR3 представляет собой аминокислотную последовательность AGVRAEDGRVRTLPSEYTF [SEQ ID NO:42].
25. Белок или полипептид по п.21, в котором нанотело представляет собой нанотело класса KERE; причем нанотело класса KERE является нанотелом, в котором аминокислотные остатки в позициях 43-46 в соответствии с нумерацией «Kabat» образуют последовательность «KERE».
26. Белок или полипептид по п.21, в котором нанотело является гуманизированным вариантом нанотела.
27. Белок или полипептид по п.21, в котором указанное нанотело имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из нанотел, выбранных из группы, состоящей из: 12В6 (SEQ ID NO:62); 12А2 (SEQ ID N0:71); 12F2 (SEQ ID NO:72); 14H10 (SEQ ID NO:73); 12B6H1 (SEQ ID NO:86); 12B6H2 (SEQ ID NO:87); 12B6H3 (SEQ ID NO:88); 12B6H4 (SEQ ID NO:89); 12A2H1 (SEQ ID NO:90); 12A2H3 (SEQ ID NO:91); 12A2H4 (SEQ ID NO:92); 12A2H11 (SEQ ID NO:93) и 12A2H13 (SEQ ID NO:94).
28. Белок или полипептид по п.21, где нанотело имеет, по меньшей мере, 80% идентичность последовательности, по меньшей мере, с одним из нанотел, выбранных из группы, состоящей из: 12А2 (SEQ ID NO:71); 12А2Н1 (SEQ ID NO:90); 12А2Н3 (SEQ ID NO:91); 12A2H4 (SEQ ID NO:92); 12A2H11 (SEQ ID NO:93) и 12А2Н13 (SEQ ID NO:94).
29. Белок или полипептид по п.21, в котором нанотело имеет 80% идентичность последовательности с нанотелом 12А2Н1 (SEQ ID NO:90).
30. Белок или полипептид по любому из пп.21-29, который связывает vWF с константой диссоциации (KD) менее 500 рМ.
31. Белок или полипептид с SEQ ID NO:98, который полностью ингибирует адгезию тромбоцитов в концентрации 0,6 мкг/мл.
32. Нуклеотидная последовательность, кодирующая белок или полипептид по любому из пп.1-31.
33. Клетка-хозяин, представляющая собой бактериальную или дрожжевую клетку, содержащую нуклеотидную последовательность по п.32, которая способна экспрессировать белок или полипептид по любому из пп.1-31.
34. Способ получения белка или полипептида по любому из пп.1-31, включающий культивирование или поддержание клетки-хозяина по п.33 в условиях, в которых указанная клетка-хозяин продуцирует или экспрессирует белок или полипептид по любому из пп.1-31; который необязательно дополнительно включает выделение белка или полипептида по любому из пп.1-31.
35. Применение белка или полипептида по любому из пп.1-31 для изготовления лекарственного средства для введения человеку для профилактики или лечения заболевания или нарушения, связанного с опосредованной тромбоцитами агрегацией.
36. Применение белка или полипептида по любому из пп.1-31 для изготовления лекарственного средства для введения человеку для профилактики или лечения заболевания или нарушения, связанного с опосредованной тромбоцитами агрегацией, выбранного из неокклюзивного тромба, образования окклюзивного тромба, образования артериального тромба, острой коронарной окклюзии, окклюзивного заболевания периферических артерий, рестеноза и нарушений, возникающих вследствие шунтирования коронарных артерий, замены клапана коронарной артерии и коронарных вмешательств, таких как ангиопластика, стентирование или атерэктомия, гиперплазия после ангиопластики, атерэктомия или артериальное стентирование, окклюзивного синдрома в сосудистой системе или отсутствия раскрытого состояния больных артерий, тромбоцитопенической тромбогемолитической пурпуры (ТТР), преходящего ишемического нарушения мозгового кровообращения, нестабильной или стабильной стенокардии, синдрома HELLP, эндартерэктомии сонной артерии, стеноза сонной артерии, критической ишемии конечностей, кардиоэмболии, заболевания периферических сосудов, рестеноза и инфаркта миокарда.
37. Применение белка или полипептида по любому из пп.1-31 для изготовления лекарственного средства для введения человеку для лечения или профилактики состояния опосредованной тромбоцитами агрегации, где фармацевтически эффективное количество указанного белка или полипептида вводят в комбинации с дополнительным агентом.
38. Применение по п.37, где дополнительным агентом является тромболитическое средство, например тканевой активатор плазминогена.
39. Применение по п.37, где дополнительным агентом является аспегик, гепарин и/или плавике.
40. Применение по любому из пп.37-39, заключающееся в одновременном, раздельном или последовательном введении.
| WO 2000024781, 04.05.2000 | |||
| WO 2004062551, 29.07.2004 | |||
| БОБКОВА И.Н | |||
| и др | |||
| Клиническое значение определения фактора Виллебранда у больных волчаночным нефритом | |||
| Тер | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2011-11-10—Публикация
2006-05-19—Подача