Предлагаемое изобретение относится к области органической химии, в частности к способу получения диоктилового эфира.
Диоктиловый (дикаприловый) эфир (INCI: Cetiol ОЕ) - известный эмольент, обладает смягчающим действием, входит в состав косметических средств, фармацевтических эмульсий (крема, лосьоны, бальзамы, кондиционеры и т.д.) ([1] К. Hill // Pure Appl. Chem., 2007, 79 (11), 1999; [2] Патент РФ 2242216 (20.12.2004)).
Диоктиловый эфир с выходом 98% был получен при нагревании октанола-1 в присутствии фторированной ионообменной смолы Nafion-Н при 145-150°С в инертной атмосфере N2. Для выделения целевого продукта реакционную смесь отфильтровывали, промывали диэтиловым эфиром и сушили над MgSO4 ([3] Olah G., Shamma Т., Prakash S. // Catalysis Letter. 1997. 46. 1).

Недостатки метода:
1. Применение дорогостоящей перфторированной сульфатированной смолы Nafion-H, которая производится американской фирмой «Du Pont» (стоимость 1 кг смолы [31175-20-9] 194400 € ([4] Aldrich. Catalog handbook of fine chemicals 2007-2008).
2. Большой расход ионообменной смолы, в частности для получения 1 т дикаприлового эфира необходимо ~ 154 кг Nafion-H.
3. Ионообменная смола нерастворима в октаноле-1 и диоктиловом эфире, что создает большие сложности на всех стадиях технологического процесса: при загрузке реагентов, перемешивании и выделении целевого продукта.
4. Использование взрыво- и пожароопасного серного эфира на стадии выделения диоктилового эфира для промывания смолы.
5. Сульфатированная ионообменная смола термически нестабильна.
В литературе описаны примеры синтеза простых эфиров из спиртов через стадию их дегидратации с образованием алкена. Так, в работе ([5] Ballantine J.A., Davis M., Patel I., Pumell H., Rayanakorn M., Williams К. // J. Mol. Cat. 1984. 26. 37) эксперимент проводили с испоьзованием в качестве катализатора монтмориллонита в течение 4 ч при Т=200°С. Для октанола-1 конверсия составила от 45.5%. Основной продукт реакции дикаприловый эфир был получен с выходом 24.4%. Одновременно в реакционной массе присутствовали 1/2, 1/3, 1/4 эфиры, октен-1, октен-2 и димеры октена-1.
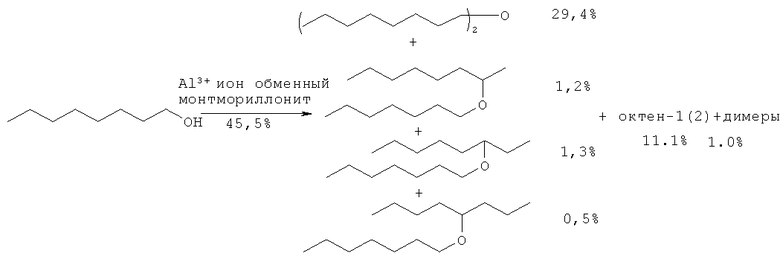
Недостатки метода:
1. Низкий выход диоктилового эфира ( ~13% общий выход).
2. Значительные трудности при выделении диоктилового эфира из-за неселективности реакции и образования сложной смеси продуктов.
В работе ([6] Патент США 5914430 (22.06.1999)) описан синтез диоктилового эфира в условиях гидрирования из (256 г) н-октаналя в присутствии катализатора палладия на угле (7.7 г Pd-C). Реакция проводится в автоклаве с подачей водорода при давлении 100 кг/см2 и скорости 800 мл/мин при 150°С в течение 8 ч. Выход диоктилового эфира по данному методу 93%.

Недостатки метода:
1. Взрывоопасность процесса из-за применения водорода под высоким давлением.
2. Труднодоступность и дороговизна каприлового альдегида и катализатора.
Диоктиловый эфир можно получить с выходом 8% межмолекулярной дегидратацией октанола-1 под действием ренийсодержащего катализатора ([7] Yi Liu, Ruimao Hua, Hong-Bin Sun, Xianquing Qui // Organometallics, 2005, 24(11), 2819).
На основании сходства по трем признакам (исходные реагенты - октанол-1, гомогенный катализатор, образование в результате реакции диоктилового эфира) за прототип взят метод синтеза диоктилового эфира из октанола-1 под действием ReBr(CO)5 ([7] Yi Liu, Ruimao Hua, Hong-Bin Sun, Xianquing Qui // Organometallics, 2005, 24(11), 2819).
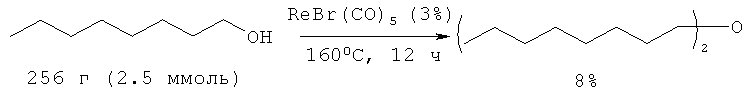
Прототип имеет следующие недостатки:
1. Труднодоступность и дороговизна катализатора ReBr(CO)5.
2. Низкий выход целевого продукта 8%.
В связи с этим авторы изобретения предлагают способ получения диоктилового эфира, не имеющий вышеперечисленных недостатков.
Задачей предлагаемого изобретения является повышение выхода диоктилового эфира за счет использования в качестве катализатора доступных соединений меди и CBr4.
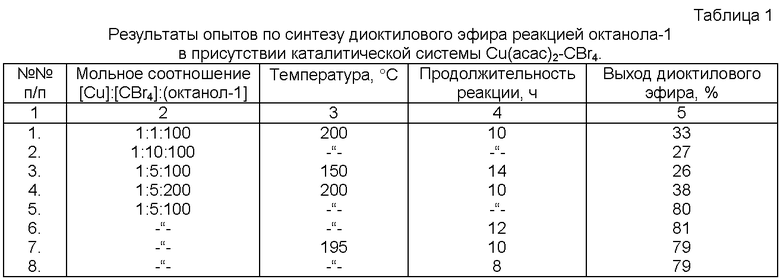
Сущность способа заключается в межмолекулярной дегидратации октанола-1 под действием Cu(acac)2 в присутствии CBr4 при 195-200°С в течение 8-12 часов, при мольном соотношении [Cu(acac)2]:[CBr4]:[октанол-1]=1:5:100. Общий выход диоктилового эфира по предложенному методу при конверсии октанола-1 ~90% составляет 79-81%:

Существенные отличия предлагаемого способа от прототипа:
1. Для получения диоктилового эфира из октанола-1 используется медьсодержащий катализатор Сu(асас)2, активированный тетрабромметаном СBr4.
2. Октанол-1, катализатор и СBr4 используются при следующем мольном соотношении: [Cu(acac)2]:[СBr4]:[октанол-1]=1:5:100.
Преимущества предлагаемого метода:
1. Доступность и дешевизна катализатора и активирующей добавки.
2. Низкий расход катализатора и СВг4.
3. Селективность процесса: общий выход диоктилового эфира по предложенному методу при конверсии октанола-1 ~90% составляет 79-81%.
Способ поясняется примером.
ПРИМЕР 1. Реакции проводили в стеклянной ампуле (V=12 мл), помещенной в микроавтоклав из нержавеющей стали (V=17 мл).
В ампулу под аргоном загрузили 1 ммоль Сu(асас)2, 5 ммоль СBr4 и 100 ммоль октанола-1. Запаянную ампулу поместили в автоклав, автоклав герметично закрыли и нагревали при 195-200°С в течение 8-12 часов. После окончания реакции автоклав охлаждали до 20°С, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлороформом, реакционную массу фильтровали через слой силикагеля (2 грамма). Непрореагировавший октанол-1 отгоняли, диоктиловый эфир выделяли вакуумной перегонкой.
Общий выход диоктилового эфира при проведении реакции при температуре 195-200°С в течение 8-12 ч при мольном соотношении [Cu(acac)2]:[октанол-1]:[СBr4]=1:100:5 составил 79-81%.
Выделенный диоктиловый эфир имел т. кип. 120-122°С/2 мм рт.ст. (лит. 99-101°С/0.47 мм рт.ст.) ([3] Olah G., Shamma Т., Prakash S. // Catalysis Letter, 1997. 46.1).
Выход 80%. Спектр ЯМР 1Н, δ, м.д.: 0.75-0.95 (м, 6Н, СН3), 1.2-1.65 (м, 24Н, CH2), 3.3-3.5 (м, 4Н, СН2). ЯМР 13С, δ, м.д.: 70.92, 31.81, 29.73, 29.44, 29.26, 26.17, 22.62, 13.80. Другие примеры, подтверждающие способ, приведены в таблице 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТАНОЛА-1 | 2005 |
|
RU2286332C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛИЧЕСКИХ ЭФИРОВ ИЗ ДИОЛОВ | 2016 |
|
RU2644163C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОГЕКСАНОЛА | 2009 |
|
RU2420506C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АДАМАНТИЛАЛКИЛОВЫХ ЭФИРОВ | 2012 |
|
RU2582620C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТАНОЛА-1 | 2010 |
|
RU2448942C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИМЕТИЛОВОГО ЭФИРА 2,5-ТИОФЕНДИКАРБОНОВОЙ КИСЛОТЫ ИЗ ТИОФЕНА | 2008 |
|
RU2404176C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 2-БЕНЗО[b]ФУРАНКАРБОНОВОЙ КИСЛОТЫ | 2010 |
|
RU2455299C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ФОРМАМИДОАДАМАНТАНА | 2014 |
|
RU2575213C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИМЕТИЛОВОГО ЭФИРА 2,5-ТИОФЕНДИКАРБОНОВОЙ КИСЛОТЫ ИЗ 2-ТИОФЕНКАРБОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2402541C2 |
| Способ получения N-(адамантан-1-ил)амидов | 2017 |
|
RU2679607C1 |
Настоящее изобретение относится к способу получения диоктилового эфира, известного эмольента, обладающего смягчающим действием и входящего в состав косметических средств и фармацевтических эмульсий. Способ заключается в каталитической дегидратации октанола-1 в присутствии каталитической системы Cu(acac)2-CBr4 при температуре 195-200°С в течение 8-12 ч при мольном соотношении [Сu(асас)2]:[СВr4]:[октанол-1]=1:5:100. Способ позволяет получить целевой продукт с высоким выходом. 1 табл.
Способ получения диоктилового эфира каталитической дегидратацией октанола-1

отличающийся тем, что октанол-1 подвергают взаимодействию с каталитической системой Сu(асас)2-CBr4 при температуре 195-200°С в течение 8-12 ч при мольном соотношении [Сu(асас)2]:[CBr4]:[октанол-1] 1:5:100.
| Yi Liu et al, Rhenium(I)-Catalysed Formation of a Carbon-Oxygen Bond: An Efficient Transition Metal Catalytic System for Etherification of Benzyl Alcohols | |||
| Organometallics, 2005, т.24, №11, с.2819-2821 | |||
| US 5914430 A, 22.06.1999 | |||
| Способ получения простых эфиров | 1975 |
|
SU841578A3 |
Авторы
Даты
2011-11-20—Публикация
2010-02-08—Подача