Область техники
Настоящее изобретение относится к способу идентификации и оценки эффективности соединений для лечения ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок, с целью разработки новых медицинских продуктов, а также к агентам, ингибирующим экспрессию и/или активность белка холинкиназы альфа и/или эффекты такой экспрессии.
Уровень техники
Холинкиназа (также известная как CK, CHK и ChoK) является начальным ферментом пути Кеннеди или пути синтеза фосфатидилхолина (РС) и фосфорилирует холин, превращая его в фосфорилхолин (PCho), в присутствии магния (Mg2+) и при участии аденозин-5'-трифосфата (АТФ) в качестве донора фосфатной группы. Опосредованная различными онкогенами трансформация индуцирует высокие уровни активности холинкиназы, вызывающие аномальное повышение внутриклеточных уровней продуктов холинкиназы, PCho, что служит косвенной поддержкой роли холинкиназы в образовании опухолей у человека. Однако существуют альтернативные механизмы образования PCho, которые не вызывают активацию холинкиназы и могли бы служить объяснением высоких уровней этого метаболита в опухолевых клетках.
Хотя засвидетельствовано, что активность фермента холинкиназы в опухолях и трансформированных клетках увеличивается, недостаточно продемонстрировано то, связано ли такое увеличение с канцерогенным процессом, поскольку не установлена ясная причинно-следственная связь между увеличением активности холинкиназы и опухолевой трансформацией. С другой стороны, до сих пор не идентифицирована молекула, ответственная за данный эффект.
Приблизительно 200 последовательностей генов, кодирующих полипептиды с первичной структурой, гомологичной холинкиназе, идентифицировано и обозначено как холинкиназа альфа а, холинкиназа альфа b, холинкиназа альфа 3, холинкиназа бета 1, холинкиназа бета 2, холинкиназа СКВ-1, холин/этаноламинкиназа, подобная холинкиназе этаноламинкиназа, Cots, Duff227, Cog3173 CPT1B, SF1, SHOX2, FHOD2, FLJ12242, KRT5, FBL, ARL6IP4 и т.п. (см. http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi#219541) как у человека, так и у других млекопитающих и грызунов (крыс, мышей, коров, морских свинок, кроликов, обезьян). На самом деле с 1982 года биохимически засвидетельствовано, что в различных тканях, выделенных из организма крыс, мышей и человека, существует по меньшей мере три изофермента с холинкиназной активностью, проявляющих различные физико-химические свойства.
По меньшей мере три гена, кодирующих белки с продемонстрированной холинкиназой активностью, недавно идентифицировано в геноме человека и обозначено как ck-альфа, ck-бета и HCEKV (заявка на патент США №2003186241), а также идентифицировано несколько генов, кодирующих белки, гомологичные на 30-65% белкам, кодируемым генами ck, таких как, например, гены CAI16602, CHKL, CAI16600, CAI16599, CAH56371, CAI16603, BAA91793, CAI16598, описанные на сайте htth://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi, и гены CPT1B, EKI2, SF1, SHOX2, FHOD2, FLJ12242, KRT5, FBL, ARI61pS, TOMM40, MLL, описанные на сайте http://www.ebi.ac.uk/cgi-bin/sumtab?tool=asdblast&jobid=blast-20050412-18072127. Очень уместная здесь характеристика различных изоферментов холинкиназы заключается в том, что они имеют различные биохимические свойства, и существуют значительные вариации в их сродстве к субстрату - холину или донору фосфата - АТФ, и даже вариации в их активной форме, которая может быть представлена в виде димеров или тетрамеров. Следовательно, необходимо определить, существует ли прямая связь между каким-либо из различных идентифицированных изоферментов холинкиназы и онкогенной способностью, приписанной их сверхэкспрессии в опухолях человека.
С другой стороны, как было установлено, ингибирование холинкиназы является новой и эффективной противоопухолевой стратегией для трансформированных онкогенами клеток, экстраполированной in vivo на голых мышей. Недавно опубликовано сообщение об увеличении активности холинкиназы в нескольких карциномах молочной железы человека, и наблюдалось, что изменение холинкиназы является частым событием в некоторых опухолях человека, таких как опухоли легкого, толстой и прямой кишок, а также предстательной железы.
Несмотря на корреляцию между теми или иными параметрами в настоящее время нет свидетельства, несомненно доказывающего, что сверхэкспрессия холинкиназы обладает онкогенной и опухолевой активностью в клетках человека. Засвидетельствовано, что ингибиторы холинкиназной активности, такие как гемихолиний-3 [Cuadrado A., Carnero A., Dolfi F., Jimenez B. and Lacal J.C. Oncogene 8, 2959-2968 (1993); Jimenez B., del Peso L., Montaner S., Esteve P. and Lacal J.C. J. Cell Biochem. 57, 141-149 (1995); Hernandez-Alcoceba R., Saniger L., Campos J., Nufiez M.C., Khaless F., Gallo M.A., Espinosa A., Lacal J.C. Oncogene, 15, 2289-2301 (1997)] или метиленхиноны с низкой токсичностью, описанные в заявке на патент Испании №200503263, обладают противоопухолевой активностью. Однако в вышеуказанных документах, как и в остальном предшествующем уровне техники, не было убедительно засвидетельствовано, что различные изоферменты с продемонстрированной холинкиназой активностью (ck-альфа, ck-бета, HCEKV и т.п.), идентифицированные в тканях человека, могли бы отвечать за обнаруженную ферментативную активность, а также нет указания на то, какой из изоферментов чувствителен к ингибированию обладающими противоопухолевой активностью ингибиторами. Такая идентификация изофермента необходима для установления его возможного использования в качестве мишени для лечения рака.
Объект изобретения
Главным объектом настоящего изобретения является способ in vitro обнаружения, идентификации и оценки эффективности соединений для лечения ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок.
Еще один объект настоящего изобретения основан на использовании нуклеотидных или пептидных последовательностей, происходящих из гена холинкиназы альфа, в способе обнаружения, идентификации, разработки и оценки эффективности соединений для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок.
Другим объектом настоящего изобретения является обеспечение агентов, отличающихся тем, что они ингибируют экспрессию и/или активность белка холинкиназы альфа, для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая один или несколько терапевтических агентов вместе с фармацевтически приемлемым наполнителем, для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок.
Также объектом настоящего изобретения является способ in vitro контролирования эффекта терапии, назначаемой больному раком, отличающийся тем, что оценку уровня экспрессии белка холинкиназы альфа в образце ткани, выделенном из больного, которому вводится противоопухолевый агент, осуществляют посредством определения в указанном образце по меньшей мере одного относящегося к белку холинкиназе альфа параметра, который выбирают из группы, состоящей из уровня его информационной РНК, концентрации указанного белка или его ферментативной активности, и сравнения полученной величины с величиной, соответствующей одному или нескольким образцам нормальной нераковой ткани.
Наконец, еще один объект настоящего изобретения представляет собой диагностический набор для осуществления настоящего изобретения.
Описание чертежей
Фиг.1: А) Активность холинкиназы (ChoK) в экстрактах клеток человека HEK293T (эмбриональных почечных клеток человека) после сверхэкспрессии холинкиназы альфа и бета (ex vivo анализ активности холинкиназы). В) Внутриклеточные уровни фосфорилхолина в живых клетках (анализ in vitro активности холинкиназы).
Фиг.2: А) Активность ChoK в экстрактах клеток ChoK293Т человека после сверхэкспрессии холинкиназы альфа и бета. В) Специфичность моноклональных антител против холинкиназы альфа в экстрактах, указанных в А).
Фиг.3: Сверхэкспрессия холинкиназы альфа, определенная с помощью иммуногистохимических методов, при NSCLC (немелкоклеточном раке легкого).
Фиг.4: Сверхэкспрессия холинкиназы альфа, определенная с помощью иммуногистохимических методов, при раке молочной железы.
Фиг.5: А) Сверхэкспрессия холинкиназы альфа, определенная с помощью иммуногистохимических методов, при раке толстой кишки. В) Полип, в котором наблюдается окрашивание, постепенно увеличивающееся от предраковых повреждений к массе опухоли.
Фиг.6: Независимый от прикрепления рост клеток, сверхэкспрессирующих холинкиназу альфа человека. Показаны как количество образованных колоний, так и их относительный размер для двух проанализированных линий клеток, HEK293 и MDCK.
Фиг.7: In vivo онкогенная активность холинкиназы альфа у мышей Nu/Nu.
Фиг.8: Экспрессия и ферментативная активность холинкиназы альфа в опухолях, индуцированных in vivo.
Фиг.9: Специфичность ингибитора MN58b в отношении холинкиназы альфа. Экстракты E.coli, в которой были экспрессированы рекомбинантные белки холинкиназа альфа или холинкиназа бета человека, анализировали в отсутствие (0) или в присутствии увеличивающихся концентраций MN58b.
Фиг.10: Противоопухолевый эффект ингибитора MN58b на опухоли, индуцированные сверхэкспрессией холинкиназы альфа.
Фиг.11: Блокирование экспрессии холинкиназы альфа при использовании миРНК-метода в клетках человека HEK293Т.
Фиг.12: Блокирование экспрессии холинкиназы альфа с помощью миРНК в раковых клетках, происходящих из карциномы молочной железы человека, обнаруживаемой с помощью вестерн-блоттинга А) и В) и по ферментативной активности С).
Фиг.13: Гибель вследствие апоптоза, индуцированного интерференционной РНК, специфичной в отношении холинкиназы альфа, в опухолевых клетках молочной железы человека MDA-MB-231. А) Анализ проточной цитометрией с использованием иодида пропидия. В) Расщепление RARP, ассоциируемого с гибелью клеток вследствие апоптоза.
Фиг.14: Интерференционная РНК, специфичная в отношении холинкиназы альфа, в первичных эпителиальных клетках молочной железы человека HMEC. A) Базальные уровни экспрессии холинкиназы альфа в нормальных клетках HMEC по отношению к опухолевым клеткам MDA-MB-231. В) Подавление холинкиназы альфа в HMEC. С) Подавление холинкиназы альфа не индуцирует гибель клеток в первичных клетках человека HMEC.
Фиг.15: Сверхэкспрессия холинкиназы альфа в раковой ткани молочной железы. Фиг.15а: Информационная РНК, соответствующая холинкиназе альфа, в тканях больных раком молочной железы, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в образце нормальной ткани. Фиг.15b: Средняя величина экспрессии холинкиназы альфа, представленная в виде единиц относительной экспрессии гена, рассчитанной из уровня мРНК с помощью 2-ΔΔct -метода, у индивидуумов без метастазов (первый прямоугольник, обозначенный "нет") или с метастазами (второй прямоугольник, обозначенный "да"). Фиг.15с: Эволюция вероятности выживания без заболевания в соответствии с количеством прошедших месяцев у больных с лимфатическими узлами (нижняя линия, отмеченная серыми линиями +) или без лимфатических узлов (верхняя линия, отмеченная черными линиями +).
Фиг.16: Экспрессия холинкиназы альфа в клеточных линиях, происходящих из рака легкого. Фиг.16а: Информационная РНК, соответствующая холинкиназе альфа, в клеточных линиях, происходящих из рака типа NSCLC (H1299 и H460) или SCLC (H510 и H82), обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальных первичных бронхиальных эпителиальных клетках (ВЕС). Фиг.16b: Белок холинкиназа альфа, обнаруженный с помощью иммуноанализа с использованием моноклонального антитела в нормальных бронхиальных эпителиальных клетках (ВЕС) и в клеточных линиях, происходящих из рака легкого, H460, H1299, H510 и H82; сразу под ним представлен сигнал, полученный в тех же самых образцах для тубулина. Фиг.16с: Активность холинкиназы альфа, представленная сигналом радиоактивно меченного PCho, определенного на микрограмм белка через 30 минут образования из меченого холина, в каждой из клеточных линий, указанных под соответствующими прямоугольниками.
Фиг.17: Экспрессия информационной РНК, соответствующей холинкиназе альфа, в тканях опухолей, выделенных от больных раком легкого NSCLC на ранних стадиях, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в образце нормальной ткани.
Фиг.18: Эволюция вероятности выживания больных раком легкого на протяжении времени, представленного месяцами, в том случае, когда экспрессия холинкиназы альфа обнаруживается (пунктирные линии, -+-) или не обнаруживается (непрерывные линии, +). Общая выживаемость больных на стадиях I-IV (диаграмма, расположенная в верней левой части), выживаемость без заболевания на стадиях I-IV (время, проходящее от момента, когда больных оперируют, до момента, когда они переживают рецидив) (диаграмма, расположенная в нижней левой части), выживаемость в случае рака на стадиях IA-IIIA (диаграмма, расположенная в верней правой части) и выживаемость без заболевания в случае стадий IA-IIIA (диаграмма, расположенная в нижней правой части).
Фиг.19: Экспрессия холинкиназы альфа в клеточных линиях, происходящих из рака мочевого пузыря. Фиг.19а: Информационная РНК, соответствующая холинкиназе альфа, в клеточных линиях, происходящих из рака мочевого пузыря, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальных иммортализованных клетках мочевого пузыря UrotSa; слева направо прямоугольники, соответствующие линиям HT1376, J82, SW780, TCCSup и UMVC3. Фиг.19b: Белок холинкиназа альфа, обнаруженный с помощью иммуноанализа с использованием моноклонального антитела в нормальных иммортализованных клетках мочевого пузыря (UrotSa) и в клеточных линиях, происходящих из рака мочевого пузыря TCCSup, J82, UMVC3, SW789 и HT1376, а также в отрицательном контроле (клетках НЕК293Т) и положительном контроле (клетках Неk-ChoK, трансфицированных плазмидой, экспрессирующей холинкиназу альфа); сразу под ним представлен сигнал, полученный в тех же самых образцах для тубулина. Фиг.19с: Активность холинкиназы альфа, представленная сигналом радиоактивно меченного PCho, определенного на микрограмм белка через 30 минут образования из меченого холина, в каждой из клеточных линий, указанных под соответствующими прямоугольниками.
Фиг.20: Экспрессия холинкиназы альфа у больных раком мочевого пузыря. Фиг.20а: Средние величины экспрессии, полученные при использовании опухолевых тканей 90 больных с помощью ранжированных микрорядов U133 Plus 2,0 Affymetrix, полученные в различных группах, классифицированных в соответствии с величиной фактора индукции: индукция, составляющая 1-3 раз (первый прямоугольник), индукция, составляющая 3-8 раз (второй прямоугольник), или индукция, составляющая 8-24 раза (третий прямоугольник). Фиг.20b: Информационная РНК, соответствующая холинкиназе альфа, у 20 больных раком мочевого пузыря, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальных иммортализованных клетках мочевого пузыря UrotSa; горизонтальная линия представляет собой уровень, с которого начинается ассоциация с худшим прогнозом развития заболевания у больного.
Фиг.21: Связь между экспрессией холинкиназы альфа и наличием узлов и/или метастазов. Фиг.21а: Средние уровни экспрессии холинкиназы альфа у негативных и позитивных больных относительно наличия лимфатических узлов (значения, отмеченные пустыми квадратами, □) или метастазов (значения, отмеченные заполненными кружками, ●), прямые линии соединяют средние величины, соответствующие негативным или позитивным индивидуумам, относительно характеристик, которые, как полагают, помогают увидеть разницу в уровне между группами. Фиг.21b, пропорция больных с метастазами (прямоугольники сплошного темного цвета, ▌) и без метастазов (прямоугольники с отметками в виде прорезей, //) в группах больных, классифицированных в соответствии с уровнем экспрессии холинкиназы альфа: низкой (пара прямоугольников слева), промежуточной (пара прямоугольников, расположенная в середине диаграммы) или высокой (пара прямоугольников, расположенная с правой стороны диаграммы).
Фиг.22: Схема действия конструкции, основанной на том, какая интерференционная РНК синтезируется. Когда репрессор присутствует (левая область "Нет экспрессии"), он связывается с конструкцией и предотвращает синтез РНК); когда присутствует индуктор (доксоциклин), он связывается с репрессором, предотвращая прикрепление последнего к интерференционной конструкции и делая возможным синтез интерференционной РНК (правая область "Экспрессия").
Фиг.23: Пролиферация клеток MDA-MB-231 (верхний ряд чашек) и Ch-ind-1 (нижний ряд чашек) в условиях роста (столбец "Контроль") или в присутствии химического ингибитора холинкиназы альфа MN58b (средний столбец) или RSM936 (правый столбец).
Фиг.24: Поведение клеток MDA-MB-231 (прямоугольники, помеченные "MDA") и Ch-ind-1 (прямоугольники, помеченные "Chind1") в отсутствии ("-") или в присутствии ("+") 10 мкг/мл доксоциклина через 10 дней ("10d") или 20 дней ("20d); А: Эффект генетического ингибирования холинкиназы альфа в соответствии с соотношением между уровнями холинкиназы альфа и GAPDH. В: Эффект на пролиферацию клеток в соответствии с соотношением между уровнями pCNA и GAPDH; С: Жизнеспособность клеток Ch-ind-1 в отсутствие (пунктирная линия) или в присутствии (непрерывная линия) индуктора, установленная на основании величин абсорбции при 500 нм, измеренных в различное время; D: Эффект на индукцию апоптоза в соответствии с соотношением между уровнем деградированного белка PARP и уровнем общего белка PARP (PARPdig/PARP общий).
Фиг.25: Специфичность поликлонального антитела против холинкиназы альфа. А: Иммуноанализ, в котором поликлональная антисыворотка против холинкиназы бета взаимодействует с образцами клеток, трансфицированных пустым вектором (линия, обозначенная "пустой"), вектором для экспрессии холинкиназы альфа (линия, обозначенная "ChoКA"), вектором для экспрессии холинкиназы бета (линия, обозначенная "ChoКВ") и вектором для экспрессии химерного белка, холинкиназы бета зеленого флуоресцирующего белка (линия, обозначенная "ChoKB5'GFP"). Стрелки указывают высоту расположения полосы холинкиназы бета и химерного белка. В: Иммуноанализ, в котором поликлональное антитело против холинкиназы альфа взаимодействует с образцами клеток, трансфицированных пустым вектором (линия, обозначенная "пустой"), вектором для экспрессии холинкиназы альфа (линия, обозначенная "ChoКA"), вектором для экспрессии холинкиназы бета (линия, обозначенная "ChoКВ") и вектором для экспрессии химерного белка, холинкиназы бета зеленого флуоресцирующего белка (линия, обозначенная "ChoKB5'GFP"). Стрелки указывают высоту расположения полосы холинкиназы альфа.
Фиг.26: Сравнение онкогенной способности холинкиназ альфа и бета. Увеличение со временем объема опухоли, измеряемого в см3, в соответствии с указанными на оси Х неделями, проходящими от момента введения мышам клеток, трансфицированных пустым вектором (данные, показанные ромбами, "♦"), вектором для экспрессии холинкиназы альфа (данные, показанные квадратами, "■"), вектором для экспрессии холинкиназы бета (данные, показанные треугольниками, "▲") и вектором для экспрессии холинкиназы альфа + вектором для экспрессии холинкиназы бета (данные, показанные х, "Х").
Фиг.27. Информационная РНК, соответствующая холинкиназе бета, в ткани больных раком легкого, обнаруженная с помощью количественной ПЦР в режиме реального времени, представленная в виде десятичного логарифма отношения между обнаруженным количеством и количеством, присутствующим в нормальной ткани.
Подробное описание изобретения
Для облегчения понимания настоящей заявки на патент значения некоторых терминов и выражений в контексте настоящего изобретения определены ниже.
Термин "субъект" или "индивидуум" относится к членам класса млекопитающих и включает в себя, не ограничиваясь перечисленным, домашних животных, приматов и людей; субъектом предпочтительно является мужчина или женщина любого возраста или расы.
Термин "рак" относится к заболеванию, которое характеризуется аномальным или неконтролируемым ростом клеток, способных вторгаться в смежные ткани и распространяться на отдаленные органы.
Термин "карцинома" относится к ткани, являющейся результатом аномального или неконтролируемого роста клеток.
Термин "рак молочной железы" или "карцинома молочной железы" относится к любому нарушению в виде злокачественной пролиферации клеток молочной железы.
Термин "рак толстой кишки" или "карцинома толстой кишки" относится к любому нарушению в виде злокачественной пролиферации клеток толстой кишки.
Термин "рак прямой кишки" или "карцинома прямой кишки" относится к любому нарушению в виде злокачественной пролиферации клеток прямой кишки.
Термин "опухоль" относится к любому аномальному тканевому образованию, являющемуся результатом доброкачественного (незлокачественного) или злокачественного процесса новообразования.
Термин "ген" относится к молекулярной цепи дезоксирибонуклеотидов, кодирующей белок.
Термин "ДНК" относится к дезоксирибонуклеиновой кислоте. Последовательность ДНК является последовательностью дезоксирибонуклеотидов.
Термин "кДНК" относится к последовательности нуклеотидов, комплементарной последовательности мРНК.
Термин "РНК" относится к рибонуклеиновой кислоте. Последовательность РНК является последовательностью рибонуклеотидов.
Термин "мРНК" относится к информационной рибонуклеиновой кислоте, которая является той фракцией общей РНК, с которой осуществляется трансляция белков.
Термин "мРНК, транскрибированная с" имеет отношение к транскрипции гена (ДНК) в мРНК в качестве первой стадии процесса экспрессии гена и трансляции белка.
Термин "последовательность нуклеотидов" или "нуклеотидная последовательность" без различия относится и к рибонуклеотидной последовательности (РНК), и к дезоксирибонуклеотидной последовательности (ДНК).
Термин "белок" относится к молекулярной цепи аминокислот, присоединенных посредством ковалентных или нековалентных связей. Данный термин включает в себя все формы посттрансляционных модификаций, например гликозилирование, фосфорилирование или ацетилирование.
Термин "пептид" и "полипептид" относится к молекулярной цепи аминокислот, представляющей собой белковый фрагмент. Термины "белок" и "пептид" используются без различия.
Термин "антитело" относится к гликопротеину, проявляющему специфическую активность связывания с молекулой-мишенью, которую называют "антиген". Термин "антитело" включает в себя моноклональные или поликлональные антитела, являющиеся интактными, или их фрагменты, а также он включает в себя антитела человека, гуманизированные антитела и антитела, не происходящие от человека. "Моноклональные антитела" являются гомогенной популяцией высокоспецифических антител, направленных против единственного антигенного сайта или "детерминанты". "Поликлональные антитела" включают гетерогенную популяцию антител, направленных против различных антигенных детерминант.
"Эпитоп" в качестве термина, используемого в настоящем изобретении, относится к антигенной детерминанте белка, которая является аминокислотной последовательностью белка, которую узнает специфическое антитело.
Термин "терапевтическая мишень" относится к нуклеотидной или пептидной последовательности, для которой может предназначаться и клинически применяться лекарственное средство или терапевтическое соединение.
Термин "антагонист" относится к любой молекуле, ингибирующей биологическую активность подвергнутой антагонистическому действию молекулы. Примеры молекул-антагонистов включают в себя среди прочих белки, пептиды, встречающиеся в природе вариации пептидных последовательностей и небольшие органические молекулы (с молекулярной массой, составляющей менее чем 500 Да).
Термин "нормальные ссылочные величины", используемый в настоящем изобретении, относится к уровню определенных белков, мРНК или других метаболитов, присутствующих в организме здорового индивидуума.
Термин "нормальная ткань", используемый в настоящем изобретении, относится к нераковой ткани, в том числе к коммерческим клеточным культурам.
Настоящее изобретение основано на открытии того, что экспрессия белка холинкиназы альфа приводит к увеличению образования опухолей, особенно рака легкого, молочной железы и рака толстой и прямой кишок. А также на неожиданном открытии того, что сверхэкспрессия указанного белка индуцирует образование опухолей in vivo и, следовательно, того, что ингибирование экспрессии и/или активности этого фермента является великолепным способом лечения ракового заболевания, особенно рака легкого, молочной железы и рака толстой и прямой кишок. Следовательно, холинкиназа альфа является хорошей возможной терапевтической мишенью при возникновении опухоли у человека.
В этом отношении настоящим изобретением обеспечивается, во-первых, способ in vitro обнаружения у индивидуума наличия ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок, определения стадии или тяжести указанного ракового заболевания у индивидуума или контролирования эффекта терапии, назначаемой страдающему раковым заболеванием индивидууму, включающий:
а) обнаружение и/или количественное определение белка холинкиназы альфа, мРНК гена холинкиназы альфа или соответствующей кДНК в образце указанного индивидуума, и
b) сравнение количества белка холинкиназы альфа, количества мРНК гена холинкиназы альфа или количества соответствующей кДНК, обнаруженного в образце индивидуума, с количеством белка холинкиназы альфа, с количеством мРНК гена холинкиназы альфа или с количеством соответствующей кДНК, обнаруженным в образцах контрольных индивидуумов или в более ранних образцах того же самого индивидуума, или с нормальными ссылочными величинами.
Способ, обеспечиваемый настоящим изобретением, обладает высокой чувствительностью и специфичностью и базируется на субъектах или индивидуумах, у которых диагностированы раковые заболевания, предпочтительно рак легкого, рак молочной железы и рак толстой и прямой кишок, имеющих высокие уровни мРНК, транскрибированной с гена холинкиназы альфа, или высокие концентрации белка, кодируемого геном холинкиназы альфа (белка холинкиназы альфа), по сравнению с соответствующими уровнями в образцах от субъектов, в истории болезни которых нет этих карцином. Однако между экспрессией гена холинкиназы бета у людей и каким-либо из ранее отмеченных типов ракового заболевания корреляции нет.
Предлагаемый способ включает стадию получения образца от индивидуума. Можно работать с различными образцами жидкости, такими как, например, моча, кровь, плазма, сыворотка, плевральная жидкость, асцитическая жидкость, синовиальная жидкость, желчь, желудочный сок, спинномозговая жидкость, фекалии, слюна, жидкости бронхоскопических образцов и т.п. Образец может быть получен любым традиционным методом, предпочтительно хирургической резекцией.
Образцы могут быть получены от субъектов, у которых диагноз поставлен ранее или у которых диагноз не поставлен, страдающих определенным типом ракового заболевания, а также от субъекта, подвергаемого лечению, или субъекта, которого ранее лечили от ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок.
Кроме того, данный способ включает стадию экстракции образца или для получения белкового экстракта из образца, или для получения экстракта общей РНК. Один из этих двух экстрактов является рабочим материалом для следующей стадии. Протоколы для экстрагирования общего белка или общей РНК хорошо известны квалифицированному в данной области специалисту (Chornczynski P. et al., Anal. Biochem., 1987, 162: 156; Chornczynski P., Biotechniques, 1993, 15: 532; Molina M.A. et al., Cancer Res., 1999, 59: 4356-4362).
В рамках настоящего изобретения можно использовать любой традиционный анализ для обнаружения ракового заболевания при условии, что им измеряются in vitro уровни мРНК, транскрибированной с гена холинкиназы альфа, или комплементарной ей кДНК, концентрация белка холинкиназы альфа в образцах, отобранных от подвергаемых анализу индивидуумов или от контрольных индивидуумов.
Следовательно, настоящим изобретением обеспечивается способ обнаружения наличия ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок, определения стадии или тяжести указанного ракового заболевания у индивидуума или контролирования эффекта терапии, назначаемой страдающему указанным раковым заболеванием индивидууму, или на основе измерения концентрации белка холинкиназы альфа, или на основе измерения уровня экспрессии гена холинкиназы альфа.
В том случае, когда изобретение направлено на обнаружение белка холинкиназы альфа, способ настоящего изобретения включает в качестве первой стадии приведение в контакт белкового экстракта из образца с композицией из одного или нескольких антител, специфичных в отношении одного или нескольких эпитопов белка холинкиназы альфа, а в качестве второй стадии - количественное определение комплексов, образованных антителами и белком холинкиназой альфа.
Существует широкое множество иммунологических анализов, пригодных для обнаружения и количественного определения формирования специфических комплексов антиген-антитело; ряд анализов конкурентного и неконкурентного связывания белка описаны ранее, и большой ряд этих анализов коммерчески доступен.
Следовательно, количество белка холинкиназы альфа можно определить с помощью таких антител, как, например, моноклональные антитела, поликлональные антитела, являющиеся интактными, или их фрагментами, "комби-тела" и Fab- или scFv-фрагменты антител, специфичных в отношении белка холинкиназы альфа, причем эти антитела являются антителами человека, гуманизированными антителами или антителами, не происходящими от человека. Антитела, используемые в этих анализах, могут быть мечеными или немечеными; немеченые антитела можно использовать в анализах агглютинации; меченые антитела можно использовать в широком ряде анализов. Молекулы меток, которые можно использовать для мечения антител, включают радионуклеотиды, ферменты, флуорофоры, хемилюминесцентные реагенты, ферментные субстраты или кофакторы, ингибиторы ферментов, частицы, красители и производные.
Существует широкое множество хорошо известных анализов, которые можно применить в настоящем изобретении, используя немеченые антитела (первичные антитела) и меченые антитела (вторичные антитела); эти способы включают вестерн-блоттинг, ELISA (твердофазный иммуноферментный анализ), РИА (радиоиммуноанализ), конкурентный EIA (конкурентный иммуноферментный анализ) DAS-ELISA (ELISA с использованием двухслойного иммуносэндвича), иммуноцитохимические и иммуногистохимические способы, способы, основанные на использовании белковых биочипов или ранжированных микрорядов, включающих специфические антитела, или анализы, основанные на преципитации из коллоидного раствора в таких форматах, как металлические щипы для измерения уровня жидкости. Другие способы обнаружения и количественного определения белка EFNB2 или белка EDNRA включают способы аффинной хроматографии, анализы связывания лигандов или анализы связывания лектина.
Предпочтительным иммуноанализом в способе настоящего изобретения является ELISA с использованием двухслойного иммуносэндвича (DAS-ELISA). В этом иммуноанализе можно использовать любое антитело или комбинацию антител, специфичных в отношении одного или нескольких эпитопов белка холинкиназы альфа. Примером одного из множества возможных форматов этого анализа является приведение в контакт с анализируемым образцом моноклоклонального антитела или поликлонального антитела, или фрагмента этого антитела, или комбинации антител, которые покрывают твердую фазу, и инкубирование в течение подходящего времени и при подходящих условиях для формирования комплексов антиген-антитело. После промывки при подходящих условиях для удаления неспецифических комплексов комплексы антиген-антитело инкубируют при подходящих условиях и в течение подходящего времени с индикаторным реагентом, включающим моноклональное или поликлональное антитело, или фрагмент этого антитела, или комбинацию этих антител, связанным с соединением, образующим сигнал. Присутствие белка холинкиназы альфа в анализируемом образце обнаруживают и количественно определяют, при его существовании, путем измерения образуемого сигнала. Количество белка холинкиназы альфа, присутствующее в анализируемом образце, пропорционально этому сигналу.
В том случае, когда изобретение направлено на обнаружение мРНК или кДНК, соответствующей гену холинкиназы альфа, а не кодируемых ими белков, обеспечиваемый настоящим изобретением способ обнаружения in vitro карцином имеет разные стадии. Поэтому, когда образец получен, а общая РНК экстрагирована, способ настоящего изобретения, обнаружение мРНК или кДНК, соответствующей гену холинкиназы альфа, включает в качестве первой стадии амплификацию мРНК, присутствующей в экстракте общей РНК, или соответствующей кДНК, синтезированной с помощью обратной транскрипции мРНК, а в качестве второй стадии количественное определение продукта амплификации мРНК или кДНК гена холинкиназы альфа.
Примером амплификации мРНК является обратное транскрибирование мРНК в кДНК (ОТ) с последующей полимеразной цепной реакцией (ПЦР); ПЦР является методом амплификации определенной нуклеотидной последовательности (мишени), содержащейся в смеси нуклеотидных последовательностей. В ПЦР используется присутствующая в избыточном количестве пара олигонуклеотидных праймеров, которые гибридизуются с комлементарными цепями нуклеотидной последовательности-мишени. Затем фермент с полимеразной активностью (ДНК-полимераза Taq) удлиняет каждый праймер, используя в качестве матрицы нуклеотидную последовательность-мишень. После диссоциации исходной цепи-мишени продукты удлинения превращаются в последовательности-мишени. Новые молекулы праймеров гибридизуются, и полимераза их удлиняет; цикл повторяют с тем, чтобы экспоненциально увеличить количество последовательностей-мишеней. Этот метод описывается в патентах США № 4683195 и 4683202. Ранее описано много методов обнаружения и количественного определения продуктов, амплифицированных с помощью ПЦР, и любой из них можно использовать в настоящем изобретении. В предпочтительном способе настоящего изобретения амплифицированный продукт обнаруживают с помощью электрофореза в агарозном геле.
В другом примере обнаружение мРНК проводят путем переноса мРНК на нейлоновую мембрану посредством таких методов переноса, как, например, нозерн-блоттинг, и обнаружения ее с помощью специфических зондов мРНК или кДНК, соответствующей гену холинкиназы альфа.
В конкретном воплощении настоящего изобретения амплификацию и количественное определение мРНК, соответствующей гену холинкиназы альфа, осуществляют в одно и то же время посредством количественной ОТ-ПЦР в режиме реального времени (к-ПЦР).
Последняя стадия обеспечиваемого настоящим изобретением способа обнаружения карцином, о которых идет речь, in vitro, в образце от индивидуума, включает сравнение количества белка холинкиназы альфа, количества мРНК гена холинкиназы альфа или количества соответствующей кДНК в образце от индивидуума с количеством белка холинкиназы альфа, количеством мРНК гена холинкиназы альфа или количеством соответствующей кДНК, определенных в образцах контрольных субъектов или в более ранних образцах того же самого индивидуума, или с нормальными ссылочными величинами.
Во-вторых, настоящим изобретением также обеспечивается способ in vitro идентификации и оценки эффективности соединений для лечения ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок, включающий:
а) приведение в контакт культуры опухолевых клеток, предпочтительно клеток опухоли легкого, молочной железы, толстой кишки или прямой кишки, с испытываемым соединением при подходящих условиях и в течение подходящего времени с осуществлением возможности их взаимодействия,
b) обнаружение и количественное определение уровней экспрессии гена холинкиназы альфа или белка холинкиназы альфа и
c) сравнение указанных уровней экспрессии с уровнями экспрессии контрольных культур опухолевых клеток, не обработанных испытываемым соединением.
Количественное определение уровней экспрессии гена холинкиназы альфа или белка холинкиназы альфа проводят подобно тому, как это указано в обеспечиваемом настоящим изобретением способе обнаружения in vitro наличия рака легкого, молочной железы или рака толстой и прямой кишок у индивидуума.
В том случае, когда агент снижает уровни экспрессии гена холинкиназы альфа или вызывает реверсирование эффектов высокой экспрессии указанного гена, предпочтительно уменьшение уровней пролиферации клеток, этот агент намечают для лечения ракового заболевания.
Следовательно, еще один объект настоящего изобретения относится к использованию нуклеотидных или пептидных последовательностей, происходящих из гена холинкиназы альфа, в способах обнаружения, идентификации, разработки и оценки эффективности соединений для лечения ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок. Необходимо отметить важность, которую недавно приобрели способы скрининга лекарственных средств, основанные на конкурентном или неконкурентном связывании молекул потенциальных лекарственных средств с терапевтической мишенью.
Другой дополнительный объект настоящего изобретения относится к использованию нуклеотидных или пептидных последовательностей, происходящих из гена холинкиназы альфа, для обнаружения наличия ракового заболевания, особенно рака легкого, молочной железы или рака толстой и прямой кишок, определения стадии или тяжести указанных раковых заболеваний у индивидуума или контролирования эффекта терапии, назначаемой индивидууму, страдающему каким-либо из этих раковых заболеваний.
Другим объектом настоящего изобретения является обеспечение агентов, отличающихся тем, что они ингибируют экспрессию и/или активность белка холинкиназы альфа. Такие агенты, которые можно идентифицировать и оценить в соответствии с настоящим изобретением, можно выбрать из группы, образованной:
а) антителом или комбинацией антител, специфичных в отношении одного или нескольких эпитопов, присутствующих в белке холинкиназы альфа, предпочтительно моноклональным антителом человека или гуманизированным моноклональным антителом; могущим также быть фрагментом антитела, одноцепочечным антителом или антиидиотипическим антителом,
b) цитотоксическими агентами, такими как токсины, молекулами с радиоактивными атомами или химиотерапевтическими агентами, включающими, но не ограничиваясь перечисленным, небольшие органические и неорганические молекулы, пептиды, фосфопептиды, антисмысловые молекулы, рибозимы, миРНК, трехспиральные молекулы и т.п., ингибирующими экспрессию и/или активность белка холинкиназы альфа, и
c) соединениями-антагонистами белка холинкиназы альфа, ингибирующими одну или несколько функций белка холинкиназы альфа.
Объект настоящего изобретения также составляет фармацевтическая композиция, содержащая терапевтически эффективное количество одного или нескольких ранее отмеченных агентов вместе с одним или несколькими наполнителями и/или веществами носителя. Кроме того, указанная композиция может содержать любой другой активный ингредиент, который не ингибирует функцию белка холинкиназы альфа.
Наполнители, вещества носителя и дополнительные вещества должны быть фармацевтически и фармакологически переносимыми, так чтобы их можно было объединить с другими соединениями состава или препарата и они не обладали какими-либо неблагоприятными эффектами на подвергаемый лечению организм. Фармацевтические композиции или составы включают такие фармацевтические композиции или составы, которые пригодны для орального или парентерального введения (в том числе подкожного, внутрикожного, внутримышечного и внутривенного), хотя наилучший способ введения зависит от состояния больного. Составы могут быть в форме единичных доз. Составы готовят в соответствии с известными в области фармакологии методами. Количества вводимых активных веществ могут варьировать в соответствии с особенностями терапии.
Еще одним объектом настоящего изобретения является диагностический набор для осуществления настоящего изобретения. Поэтому в конкретном воплощении настоящее изобретение включает набор, содержащий антитело, специфически узнающее белок холинкиназу альфа, и носитель в подходящем контейнере. В другом конкретном воплощении настоящего изобретения этот набор используют для обнаружения у индивидуума наличия ракового заболевания, предпочтительно рака легкого, молочной железы или рака толстой и прямой кишок, определения стадии или тяжести указанного ракового заболевания у индивидуума или контролирования эффекта терапии, назначаемой страдающему указанным раковым заболеванием индивидууму.
Последний объект настоящего изобретения представляет собой способ in vitro диагностики времени дожития больного раком молочной железы, легкого или мочевого пузыря, включающий оценку уровня экспрессии белка холинкиназы альфа в образце раковой ткани, выделенном из организма больного, посредством определения в указанном образце по меньшей мере одного относящегося к белку холинкиназе альфа параметра, который выбирают из группы, состоящей из уровня его информационной РНК, концентрации указанного белка или его ферментативной активности, и сравнения полученной величины с величиной, соответствующей одному или нескольким образцам нормальной нераковой ткани.
Следующие примеры иллюстрируют настоящее изобретение.
Пример 1
Холинкиназная активность изоформ
Как показано на фиг.1, и фермент CKα2 (52 кДа, 457 аминокислот), и фермент CKβ1 (45 кДа, 395 аминокислот) обладают сильной холинкиназной активностью, определяемой по их способности продуцировать фосфорилхолин из холина в присутствии АТФ и магния (фиг.1А). Эта активность демонстрируется и для их рекомбинантных форм, экспрессированных в E.coli, и после трансфекции в клетки человека HEK293. Однако несмотря на тот факт, что оба фермента обладают холинкиназной активностью, внутриклеточные уровни фосфорилхолина в живых клетках изменяются неодинаково и являются фактически неопределяемыми в клетках, которые сверхэкспрессируют холинкиназу бета (фиг.1В). Эти результаты говорят о том, что и физиологическая регуляция, и биологическая функция этих двух белков, и, следовательно, их значение в образовании опухолей могут отличаться.
Пример 2
Специфичность антитела
Разработали поликлональные и моноклональные антитела, узнающие фермент холинкиназу альфа, белок, который был наполовину очищен и использован в качестве антигена в фазе генерирования и в качестве контроля продуцирования в остальных фазах способа. Несмотря на то что эти антитела разрабатывались против холинкиназы альфа, поскольку полные последовательности обоих ферментов (CKα и CKβ) гомологичны на 65%, а в некоторых консервативных районах, таких как холинсвязывающий и каталитический домены, гомология достигает 75%, необходимо проверить, какой из изоферментов способен узнавать продуцированные поликлональные и моноклональные антитела. Авторы настоящего изобретения подтвердили, что используемые и поликлональные, и моноклональные антитела специфичны в отношении холинкиназы альфа и что они не узнают холинкиназу бета. Для этого оба белка холинкиназы альфа и бета сверхэкспрессировали в клетках человека HEK293Т и после проверки того, что два белка присутствуют и являются активными (фиг.2А), провели их анализ методами иммунологических анализов (вестерн-блоттингом) с использованием и поликлональных антител, которые использовались при проведении предшествующих исследований [Ramirez de Molina A., Gutierrez R., Ramos M.A., Silva J.M., Silva J., Sanchez J.J., Bonilla F., Lacal J.C. Oncogene 21, 4317-4322 (2002); Ramirez de Molina A., Rodriguez-Gonzalez A., Gutierrez R., Martinez-Pinero L., Sanchez J.J., Bonilla F., Rosell R., Lacal J. C. Biochem. Biophys. Res. Commun. 296, 580-583 (2002)], и новых моноклональных антител, разработанных против холинкиназы альфа. Как показано на фиг.2В, на которой демонстрируется пример с двумя этими антителами, даже при сверхэкспрессии холинкиназы бета в условиях, при которых активность увеличивается в 80 раз, ни одно из антител не узнает эту изоформу, при этом холинкиназа альфа узнается хорошо и в тех же самых условиях, и на эндогенных контрольных уровнях во всех случаях. Эти результаты означают, что группа предшествующих исследований, в которых использовались поликлональные антитела, устанавливает, что холинкиназа альфа является изоферметом, который сверхэкспрессируется в клеточных линиях, происходящих из опухолей человека, и в самих проанализированных опухолях.
Этих результатов не ожидали при условии, что поликлональные антитела, по определению, узнают различные эпитопы молекулы, а последовательности холинкиназ альфа и бета гомологичны на 65%, а в некоторых районах гомология доходит до 75%, особенно в консенсусных доменных районах, где расположены каталитический район и субстрат- и АТФ-связывающий район.
Пример 3
Специфичность для опухолей: изменение холинкиназы альфа в различных опухолях человека
Наличие антител с доказанной специфичностью против холинкиназы альфа позволило изучить возможные изменения в экспрессии холинкиназы альфа в некоторых из наиболее важных на сегодняшний день в развитых странах опухолях, таких как рак молочной железы, рак толстой кишки и рак легкого. Для проведения этого исследования сделали парафиновые срезы образцов от 38-50 различных больных, каждый из которых имел один их этих типов рака, и экспрессию холинкиназы альфа проанализировали с помощью иммуногистохимии (IHQ), метода, который позволяет обнаружить и идентифицировать "in situ" биомолекулярные компоненты, являющиеся интегральной частью клеток и тканей, и который можно провести в автоматическом режиме в отделении патологической анатомии любой больницы. В образцах тканей молочной железы, толстой кишки или легкого этих больных обнаружили следующее:
- Во всех случаях окрашивание опухоли узнающим холинкиназу альфа антителом высокоспецифично, что делает возможным ясно отличить опухолевую ткань от нормальной смежной ткани.
- Нет случая окрашивания нормальной ткани.
- Фермент холинкиназа альфа сверхэкспрессируется с частотой в диапазоне 62-100% для этого типа опухоли, что демонстрирует вовлечение в высокой степени этой изоформы, холинкиназы альфа, в образование опухоли у человека.
На фиг.3 можно увидеть пример результатов, полученных для крупноклеточного рака легкого (NSCLC), который сегодня составляет 80% случаев рака легкого. Видно, что происходит окрашивание холинкиназы альфа в цитоплазме, которое является специфичным в отношении опухолевых узлов и, как ранее указывалось, специфически окрашивает 62% образцов.
В соответствии с этой идеей подобные исследования проводились с использованием 38 больных раком молочной железы, при этом в 97% случаев снова наблюдалась сверхэкспрессия холинкиназы альфа, специфичная в отношении опухолевых тканей (фиг.4).
Наконец, провели исследование экспрессии холинкиназы альфа при раке толстой кишки, для чего сделали парафиновые срезы 40 образцов от различных больных раком толстой кишки, за которыми наблюдали на протяжении более 4 лет. Анализ начали с карцином in situ на стадиях I, II, III и IV. Подобно предыдущему случаю, нормальную ткань каждого препарата, смежную с опухолевой тканью, использовали в качестве нормальной ткани. В нормальных тканях позитивное окрашивание не было получено ни в одном случае из любого из 40 образцов, что подтверждает высокую специфичность окрашивания холинкиназы альфа в опухолевой ткани, в которой во всех случаях снова наблюдалась сверхэкспрессия фермента (фиг.5А). Эти результаты поддерживают вывод о вовлечении в высокой степени изоформы этого фермента в рак толстой кишки. Кроме того, этот результат привел к проведению анализа предраковых повреждений, ACF и полипов с различными степенями дисплазии, результаты которого ясно показывают, что сверхэкспрессия холинкиназы альфа является ранним событием в процессе образования опухоли ткани толстой кишки, который происходит как период дисплазии, что говорит о возможном поведении гена холинкиназы альфа в качестве гена "вратаря" в этих опухолях и, следовательно, об уместности его рассмотрения в качестве возможной новой терапевтической мишени. На фиг.5В, на которой показан полип, можно видеть, что окрашивание нормальной ткани является фактически неопределяемым, а когда начинает происходить дисплазия (бинуклеарные клетки), окрашивание увеличивается, становясь более интенсивным в массе опухоли.
Пример 4
Специфичность для опухолей: онкогенное поведение фермента холинкиназы альфа
Установив очень высокую частоту нарушения регуляции холинкиназы альфа в некоторых из наиболее важных на сегодняшний день опухолях, провели исследование для определения того, обладает ли сам этот белок онкогенной способностью, т.е. обладает ли холинкиназа альфа онкогенной активностью. Для этого сначала исследовали то, придает ли этот ген независимо от прикрепления способность к росту, что подразумевает измерение его трансформирующей способности. Клетки человека HEK293T трансфицировали пустым вектором в качестве контроля и вектором для экспрессии холинкиназы альфа и поместили в мягкий агар. Как видно на фиг.6, сверхэкспрессия этого белка достаточна для индуцирования онкогенной трансформации и клеток человека HEK293T, и эпителиальных клеток собаки MDCK.
Установив, что холинкиназа альфа обладает трасформирующей активностью в клетках HEK293T, исследовали их онкогенный потенциал in vivo. Для этого мышам с иммунодепрессией (Nu/Nu) ввели с помощью инъекции миллион клеток человека HEK293T, которые сверхэкспрессировали или пустой вектор в качестве контроля, или вектор для экспрессии холинкиназы альфа. Рост опухолей контролировали по меньшей мере дважды в неделю на протяжении 50 дней после введения. В то время как контрольные клетки не индуцировали никаких опухолей ни в одной из инъецированных мышей, клетки, которые сверхэкспрессировали холинкиназу альфа, индуцировали опухоли у 8 из 30 инъецированных мышей (26%), которые достигали средней величины, составляющей 0,6 см3, после 45 дней (фиг.7). Эти результаты демонстрируют, что сверхэкспрессия холинкиназы альфа достаточна для индуцирования опухолей in vivo, и, следовательно, она является хорошей возможной терапевтической мишенью при образовании опухолей у человека. Для проверки того, сохраняют ли опухоли, индуцированные холинкиназой альфа, увеличенную экспрессию и активность холинкиназы альфа, опухоли хирургически извлекли, лизировали и определили уровни активности и экспрессии этого фермента относительно указанных уровней в исходных клетках HEK293T, использованных в качестве контроля. Как видно на фиг.8, все проанализированные опухоли сохраняют высокие уровни экспрессии и ферментативной активности в той степени, которая подобна той, которая наблюдалась до инокуляции, что демонстрирует, что сверхэкспрессия холинкиназы альфа индуцирует образование опухолей in vivo.
Пример 5
Фармакологическая специфичность
После подтверждения онкогенной активности изоформы холинкиназы альфа и высокой частоты ее сверхэкспрессии в опухолях человека исследовали, является ли противоопухолевый эффект ингибитора MN58b [Hernandez-Alcoceba R., Saniger L., Campos J., Nunez M.C., Khaless F., Gallo M.A., Espinosa A., Lacal J.C. Oncogene, 15, 2289-2301 (1997); Hernandez-Alcoceba R., Fernandez F., Lacal J. C. Cancer Res. 59, 3112-3118 (1999); Ramires de Molina A., Banez-Coronel M., Gutierres R., Rodriguez Gonzales A., Olmeda D., Megias D., Lacal J.C. Cancer Res. 64:6732-6739 (2004)] специфичным в отношении этой изоформы холинкиназы альфа или, напротив, его можно отнести к возможному взаимодействию этого ингибитора с изоформой холинкиназы бета. Такая проверка необходима, поскольку гомология между двумя изоформами, холинкиназой альфа и холинкиназой бета, составляет до 75% в субстратсвязывающих доменах и в каталитическом районе. Для этого две изоформы холинкиназы (CKα и CKβ) сверхэкспрессировали в штамме бактерии E.coli, у которого отсутствует холинкиназная активность, и, следовательно, любая наблюдаемая ферментативная активность обусловлена рекомбинантно экспрессированной изоформой холинкиназы. Как видно на фиг.9, на ферментативную активность холинкиназы альфа влияет обработка ингибитором MN58b, и его эффект является более выраженным, чем эффект, вызванный тем же самым ингибитором, на β-изоформу. Фактически MN58b является в 20 раз более активным в отношении холинкиназы альфа, чем в отношении холинкиназы бета.
Установив, что опухоли образуются in vivo при сверхэкспрессии холинкиназы альфа и что MN58b является специфным в отношении этой изоформы, проверили, является ли рост опухолей, индуцированных ChoKα, чувствительным к ингибированию MN58b. Для этого миллион клеток человека HEK293T, трансфицированных геном ckα, в которых демонстрировалась высокая сверхэкспрессия фермента холинкиназы альфа, подкожно ввели мышам с иммунодепрессией Nu/Nu. Когда объем опухолей достиг 0,1 см3, начали обработку специфичным в отношении холинкиназы альфа ингибитором, MN58b, который вводили внутрибрюшинно в стерильной физиологической сыворотке на протяжении 5 последовательных дней с 9-дневным покоем в дозе 5 мг/кг. Контрольные мыши получали эквивалентные дозы носителя в соответствии с той же самой схемой введения, и опухоли контролировали по меньшей мере дважды в неделю. Как показано на фиг.10, ингибирование холинкиназы альфа приводит к сильному ингибированию роста опухолей, достигая уменьшения на 80% в росте опухолей. Эти результаты демонстрируют, что сверхэкспрессия холинкиназы альфа не только достаточна для индуцирования опухолей in vivo, но и от активности холинкиназы альфа зависит пролиферация опухолевых клеток.
Пример 6
Генетическая специфичность
Все эти результаты поддерживают возможность использования холинкиназы альфа в качестве новой терапевтической мишени для разработки новой противоопухолевой стратегии. Однако химические ингибиторы могут осуществлять свое антипролиферативное действие посредством действий, которые скрыты от исследователя, даже несмотря на то, что они сконструированы специально против конкретного фермента, как в случае ингибитора MN58b. В литературе описан ряд случаев, в которых, как показано, ингибиторы, специально сконструированные против киназы, также влияют на другие киназы, которые даже не имеют близкого отношения друг к другу. В последние несколько лет был разработан подход, который позволяет более точно установить эффекты подавления конкретных ферментов с помощью использования миРНК (маленьких интерференционных РНК), которые способны точно и избирательно элиминировать мРНК для определенного белка без воздействия на остальные клеточные белки. В данном случае подтвердили, что фармакологическое подавление ингибитором MN58b, специфичным в отношении холинкиназы альфа, поддерживается на генетическом уровне с помощью специфического ингибирования холинкиназы альфа при использовании миРНК-метода. Этот метод позволил без сомнения признать, что ChoKα является новой мишенью при лечении ракового заболевания. С этой целью синтезировали олигонуклеотид, способный гибридизоваться с информационной РНК для холинкиназы альфа (который назвали siCHKA) и, следовательно, способный специфически блокировать экспрессию этого белка. Сначала подтвердили, что эта миРНК эффективно блокирует в клетках человека HEK293T экспрессию холинкиназы альфа и эндогенного белка и ChoKα, слитого с GST и трансфицированного в те же самые клетки (фиг.11).
После подтверждения того, что эта интерференционная РНК, специфичная в отношении холинкиназы альфа, действительно способна эффективно блокировать экспрессию этого белка, проверили ее эффект в опухолевых клетках, происходящих из карциномы молочной железы человека, MDA-MB-231, в которых фармакологическое ингибирование холинкиназы с помощью MN58b, как было ранее описано, индуцирует сильный противоопухолевый эффект вследствие индукции апоптоза. Как видно на фиг.12, несмотря на низкую эффективность трансфекции, полученную в этих клетках, наблюдали, что трансфекция siCHKA в MDA-MВ-231 вызывает ингибирование и экспрессии холинкиназы альфа, и ее ферментативной активности. Для проверки того, что эффект генетического ингибирования холинкиназы альфа с помощью миРНК подобен эффекту, полученному при фармакологическом ингибировании с помощью MN58b, тем самым определенно демонстрируя специфичность эффекта на холинкиназу альфа, определи жизнеспособность клеток после трансфекции с использованием интерференционной siCHKA. Как и после обработки опухолевых клеток MN58b, наблюдается снижение жизнеспособности клеток, связанное с гибелью вследствие апоптоза, который является специфичным в отношении клеток, трансфицированных агентом, подавляющим холинкиназу альфа (фиг.13).
Наконец, как и в случае с MN58b, подтвердили, что экспрессия интерференционной siCHKA, специфичной в отношении холинкиназы альфа, не имеет эффекта на жизнеспособность нормальных первичных клеток молочной железы человека HMEC (эпителиальных клеток молочной железы человека). В этих клетках базовая экспрессия этого белка является очень низкой при условии, что опухолевые клетки, как описано ранее, конститутивно сверхэкспрессируют холинкиназу альфа. Однако несмотря на эту низкую базовую экспрессию холинкиназы альфа в первичных клетках HMEC, получают четкое подавление экспрессии фермента холинкиназы альфа, и можно видеть, что эти клетки в отличие от того, что происходит в опухолевых клетках, не погибают вследствие апоптоза, а происходит остановка их жизненного цикла (фиг.14), результат, идентичный результату, наблюдаемому для тех же самых клеток, обработанных ингибитором MN58b [Rodriguez-Gonzalez A., Ramirez de Molina A., Fernandez F., Ramos M.A., Nunez M. del C., Campos J.M., Lacal J.C. Oncogene 22:8803-8812 (2003); Rodriguez-Gonzalez A., Ramirez de Molina A., Fernandez F., Lacal J.C. Oncogene 23:8247-8259 (2004); Rodriguez-Gonzalez A., Ramirez de Molina A., Banez-Coronel M., Megias D., Nunez M.C. and Lacal J.C. Int. J. Oncol 26:999-1008 (2005)].
Пример 7
Эффект холинкиназы альфа на рак молочной железы:
частота выживаемости
Для получения количественных данных, подтверждающих вовлечение холинкиназы альфа в образование и развитие опухолей, провели дополнительные анализы, позволяющие количественно определить экспрессию холинкиназы альфа у больных такими типами раковых заболеваний, с которыми, по-видимому, связана холинкиназа альфа (раком молочной железы, легкого и мочевого пузыря), и определить связь холинкиназы альфа с прогнозом развития заболевания у указанных больных.
С одной стороны, проводились количественные анализы экспрессии холинкиназы альфа путем выделения информационной РНК из образцов больных. Для этого проводились автоматические количественные ПЦР в режиме реального времени с использованием специфических Taqman-проб, которые узнают только объект изучения - информационную РНК, соответствующую ChoKα. Полученные данные представляют в десятичном логарифмическом масштабе относительно контрольного образца нормальной ткани.
В случае данных, полученных в отношении рака молочной железы, полученные результаты показаны на фиг.15а. Видно, что образцы с уровнями активации ChoKα, превышающей серединную активацию, соответствуют больным с худшим прогнозом (наличие лимфатических узлов, развитие метастазов, низкая выживаемость). Эти данные подтверждаются данными, представленными на фиг.15b и 15с. На фиг.15b, подготовленной с использованием данных, полученных для 63 больных раком молочной железы, видно, что средняя величина экспрессии ChoKα (рассчитанной в виде единиц относительной экспрессии гена, рассчитанной из уровня мРНК с помощью 2-ΔΔct-метода (Livak K.J. and Schmitttgen T.D. (2001). Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods 25, 402-408)) намного выше у больных, имеющих метастазы, по сравнению с больными, у которых их нет. Если вероятность выживания этих больных представить в соответствии с наличием лимфатических узлов, которые в значительной степени ассоциируются с увеличенной по отношению к контролям экспрессией ChoKα (р<0,001), на классической кривой Каплана-Мейера (Kaplan EL., Meier P., Nonparametric estimation from incomplete observation. J. Am. Stat. Assoc., 53:457-481 (1958)) можно увидеть, что вероятность выживания значительно снижается, когда увеличивается присутствие позитивных лимфатических узлов (р=0,046) (фиг.15с), при этом такая же тенденция наблюдается, когда выживаемость больных представляется в соответствии с экспрессией ChoKα (р=0,059).
Пример 8
Эффект холинкиназы альфа на рак легкого:
уровень сверхэкспрессии и частота выживаемости
Несколько исследований провели, чтобы дополнить исследование важности сверхэкспрессии холинкиназы альфа для рака легкого.
Во-первых, определили уровни мРНК, соответствующей указанному ферменту, в клеточных линиях, происходящих от больных раком легкого, с помощью автоматических количественных ПЦР в режиме реального времени с использованием специфических Taqman-проб. Их проводили с использованием как клеточных линий, соответствующих наиболее часто встречающемуся типу рака легкого (75-85%), немикроцитному или NSCLC (немелкоклеточному раку легкого), представленному линиями H460 и H1299, так и линий, соответствующих другого типу рака, микроцитному или SCLC (мелкоклеточному раку легкого), представленному линиями H510 и H82, при этом данные представляли в логарифмическом масштабе относительно нормальных первичных бронхиальных эпителиальных клеток человека, ВЕС. Результаты показаны на фиг.16а. Эти данные дополнили данными по определению уровней белка в каждой из этих клеточных линий с помощью иммуноанализа с использованием моноклонального антитела (фиг.16b) и данными по определяемой ферментативной активности в тех же самых линиях с помощью измерения радиоактивно меченного продукта (Pcho), образованного через 30 минут из меченого субстрата (Сho) (фиг.16с). Во всех случаях наблюдается увеличение относительно контролей, которое является особенно значительным в случае линий SCLC, особенно Н510.
Также в указанных клеточных линиях проверили антипролиферативный эффект ингибирования СhoК, вызванного добавлением MN58b, и получили результаты, продемонстрированные в следующей таблице, в которой цифры в круглых скобках указывают чувствительность каждой клетки по сравнению с первичными клетками. Во всех проанализированных временных периодах разница между первичными клетками и четырьмя клеточными линиями, происходящими из опухолей, была значительной (р<0,001).
Антипролиферативный эффект ингибирования СhoК против клеточных линий, происходящих из опухолей легкого человека
IC50 (мкМ)
IC50 (мкМ)
IC50 (мкМ)
Эти результаты дополнили исследованиями сверхэкспрессии ChoKα в образцах опухолей человека от больных раком легкого, конкретно в ткани больного NSCLC, из которого опухоль была извлечена на ранней стадии. На фиг.17 показаны результаты, полученные с помощью анализа в виде количественных ПЦР в режиме реального времени информационной РНК, соответствующей ChoKα, у указанных больных, прооперированных на ранних стадиях, указанные результаты демонстрируют, что на такой ранней стадии заболевания ChoKα уже сверхэкспрессируется относительно нормальной ткани в 53% случаев. Снова при анализе связи между экспрессией ChoKα и тяжестью ракового заболевания (стадией и наличием или отсутствием метастазов) наблюдали, что высокая экспрессия ChoKα ассоциируется с более высокой степенью злокачественности, как показано в таблице 2.
Сверхэкспрессия ChoKα в соответствии с тяжестью рака легкого
b Стадии с более крупными опухолями с вовлечением узлов и наличием метастазов.
Как и в случае рака молочной железы, на начальных стадиях NSCLC сверхэкспрессия ChoKα при раке легкого ассоциируется с худшим прогнозом, как видно на диаграммах, представленных на фиг.18. На этой фигуре видно, что вероятность выживания остается на протяжении времени на величине 1 у больных, у которых не обнаружена постоянная экспрессия ChoKα, в то время как у больных, у которых обнаружена сверхэкспрессия ChoKα, вероятность снижается и достигает серединной величины в момент времени, равняющийся 9 месяцам, когда оценивается выживаемость без заболевания, т.е. времени, проходящем от момента, когда больных оперируют, до момента, когда они переживают рецидив.
Пример 9
Эффект холинкиназы альфа на рак мочевого пузыря:
уровень сверхэкспрессии и частота выживаемости
Аналогичные исследования проводились также с больными раком мочевого пузыря. Во-первых, определили уровни мРНК, соответствующей указанному ферменту, в клеточных линиях, происходящих от больных раком мочевого пузыря, снова с помощью автоматических количественных ПЦР в режиме реального времени с использованием специфических Taqman-проб, схожих с теми, которые описаны в примере 8 для случая рака легкого. Использовали линии HT1376, J82, SW780, TCCSup и UMVC3, при этом данные представляли в логарифмическом масштабе относительно нормальных иммортализованных клеток мочевого пузыря, UrotSa. Результаты показаны на фиг.19а. Эти данные дополнили данными по определению уровней белка в каждой из этих клеточных линий с помощью иммуноанализа с использованием моноклонального антитела (фиг.19b) и оценкой обнаруживаемой в них ферментативной активности (фиг.19с). Видно, что различные клеточные линии демонстрируют увеличенные уровни СhoКα относительно нормальных иммортализованных клеток UrotSa, а также, что увеличение экспрессии белка в клеточных линиях, происходящих из рака мочевого пузыря, также сопровождается сходным увеличением активности фермента холинкиназы альфа.
Кроме того, в этих клеточных линиях проверили антипролиферативный эффект ингибирования СhoК, вызванного добавлением MN58b, при этом получили результаты, продемонстрированные в следующей таблице, в которой цифры в круглых скобках указывают фактор индукции относительно клеточной линии с более низкими уровнями Сho, TCCSup, поскольку посчитали, что данные, полученные для TCCSup, недостаточно заслуживают доверия, чтобы проводить в отношении них сравнение.
Антипролиферативный эффект ингибирования СhoК против клеточных линий, происходящих из рака мочевого пузыря человека
Кроме того, для установления параллелизма с эффектами, наблюдаемыми in vivo, проанализировали экспрессию СhoКα в опухолевой ткани 90 больных раком мочевого пузыря методом, основанным на использовании ранжированных микрорядов, конкретно чипа U133 Plus 2,0 Affymetrix. Полученные результаты показаны на фиг.20а. На указанной фигуре видно, что у немногим более половины, 49 больных, демонстрировался фактор индукции экспрессии, составляющий 1-3 раз; у 25 больных демонстрировался фактор индукции экспрессии, составляющий 3-8 раз; в то время как у 12 из них фактор индукции экспрессии составлял от 8 до 24 раз.
Данные, полученные при использовании ранжированных микрорядов, подтвердили с помощью анализа в виде количественных ПЦР в режиме реального времени, результаты которого показаны на фиг.20b. В указанном анализе применили коммерческую РНК из нормальной ткани мочевого пузыря человека в качестве эталона, используя GAPDH в качестве контроля. В 18 из 20 проанализированных образцов (10 из которых соответствовали 10 больным с более низкой экспрессией ChoKα, а 10 других соответствовали 10 больным с более высокой экспрессией) результаты экспрессии ChoK, полученные при использовании ранжированных микрорядов Affymetrix, совпадают с результатами экспрессии, полученными в анализе с использованием Taqman-проб. Частота сверхэкспрессии ChoKα в опухолях составляла 55%. Больные со сверхэкспрессией были наиболее метастатическими.
Связь между сверхэкспрессией ChoKα и прогрессированием метастазов подтвердили с помощью данных по экспрессии ChoKα от всех больных, полученных методом, основанным на использовании ранжированных рядов, результаты которого показаны на фиг.21а и 21b. На фиг.21а демонстрируются вариации в средних уровнях экспрессии ChoKα между негативными и позитивными больными относительно наличия лимфатических узлов (значения, соединенные линией с пустыми квадратами на концах) или развития метастазов (значения, соединенные линией с заполненными кружками на концах). На фиг.21b, однако, показана диаграмма, представляющая собой вариации в пропорции больных с метастазами (прямоугольники сплошного темного цвета, ▌) и без метастазов (прямоугольники с отметками в виде прорезей, //) в группах больных с низкой экспрессией ChoKα (пара прямоугольников слева), промежуточной экспрессией ChoKα (пара прямоугольников, расположенная в середине диаграммы) или высокой экспрессией ChoKα (пара прямоугольников, расположенная с правой стороны диаграммы), на которой видно, что процент больных с метастазами (53%) в группе с низкой экспрессией ненамного выше, чем процент больных без метастазов (47%), в то время как в группе с высокой экспрессией ChoKα большинство, 72%, имеют метастазы, а оставшиеся 28% их не имеют. Наблюдается связь между экспрессией ChoKα и развитием метастазов, которая не достигает уровня статистической значимости.
Для демонстрации того, что сверхэкспрессия ChoKα имеет отношение к раку мочевого пузыря in vivo, также использовали модель ортотопического рака мочевого пузыря, которая физиологически очень напоминает то, что происходит, когда в мочевом пузыре образуется опухоль, используя клетки МВТ-2 (клетки опухоли мочевого пузыря мыши). В этих клетках, которые уже сверхэкспрессировали ChoKα относительно нормальных клеток мыши, этот белок еще более экспрессировали с целью оценки того, увеличивает ли более высокая экспрессия ChoKα агрессивность или инвазивность этих опухолей. Для этого клетки МВТ-2, содержащие пустой вектор, в котором отсутствуют последовательности, делающие возможным экспрессию гена ChoKα (контрольная группа мышей, состоящая из трех мышей), или клетки МВТ-2, сверхэкспрессирующие ChoKα в результате трансфекции вектором с последовательностью, кодирующей указанный фермент (ChoKα-группа мышей, состоящая из трех мышей), непосредственно инокулировали в мочевой пузырь мышей посредством катетера. Образование опухолей контролировали в обеих группах посредством магнитно-ядерного резонанса с контрастом в виде гадолиния, а также развития заболевания у мышей (физического состояния, выживаемости, гистологического исследования опухолей, анализа возможной инвазии почек и других органов). Через 19 дней после инокуляции клеток ChoKα-мыши находились в плохом состоянии, 2 из них с очень большой опухолью, в то время как мыши, которые получили пустой вектор (контрольная группа), начали находиться в плохом состоянии через 50 дней после инокуляции клеток.
Результаты примеров 7, 8 и 9 подтверждают, что ChoKα сверхэкспрессируется с высокой частотой при опухолях молочной железы, легкого и мочевого пузыря человека. Ее сверхэкспрессия ассоциируется с клиническим параметрами, указывающими на большую злокачественность: наличием лимфатических узлов, метастазов и низкой выживаемостью больных.
Пример 10
Генетическая специфичность:
модель индуцибельного подавления
Установив, что подавление ChoKα в опухолевых клетках является летальным, индуцирующим гибель клеток вследствие апоптоза, как продемонстрировано в описанных в примере 6 исследованиях, проведенным в транзиторном исследовании, невозможно иметь стабильную клеточную популяцию, экспрессирующую интерференционную конструкцию, в этом типе исследования. В транзиторных исследованиях затрагивается процент вариабельной клеточной популяции, при этом общая популяция никогда не затрагивается, что маскирует результаты. Было бы лучше исследовать эффект конструкции на популяцию, которая экспрессирует ее однородно так, чтобы не было необходимым иметь стабильную конститутивную модель. Это делает необходимым иметь модель индуцибельного подавления, которая позволяет получить популяцию с однородно подавленной экспрессией ChoKα.
Для этого интерференционную последовательность экспрессируют с конструкции, в которой она находится под влиянием репрессора, предотвращающего ее экспрессию. Проводят трансфекцию представляющей интерес индуцибельной конструкции совместно с репрессором, предотвращающим ее экспрессию, и после отбора гомогенной популяции с этой конструкцией клетки обрабатывают индуктором, который позволяет интерференционной последовательности экспрессироваться и, следовательно, подавлять экспрессию белка.
В индуцибельной модели, сконструированной для этого исследования, интерференционную конструкцию для ChoKα клонируют в векторе pSUPERIOR-pure (Oligoengine), а репрессор - в векторе pcDNA6/TR (Invitrogen). Используемым индуктором является доксоциклин, который, связываясь с репрессором, предотвращает его связывание с соответствующей последовательностью, поэтому экспрессия интерференционной последовательности более не предотвращается. Схему этой системы можно увидеть на фиг.22.
На фиг.23 и 24 показаны результаты, полученные в клетках Ch-ind-1, клеточной линии, происходящей из MDA-MB-231, способной экспрессировать интерференционную конструкцию после обработки индуцирующим агентом - доксоциклином. На фиг.23 показано, что индуцибельная линия все еще является чувствительной к химическому ингибированию ChoKα таким образом, который сходен с тем, что происходит в MDA-MB-231 (исходной контрольной линии, происходящей из аденокарциномы молочной железы, из которой происходит Ch-ind-1), поскольку результаты, полученные после обработки ингибиторами холинкиназы альфа MN58b или RSM936, аналогичны для обеих линий. На фиг.24, однако, показано, что при обработке обеих клеточных линий 10 мкг/мл доксоциклина генетическое ингибирование ChoKα происходит только в Ch-ind-1, так как индукция интерференционной модели с помощью доксоциклина может происходить только в линии Ch-ind-1, поскольку именно она имеет конструкцию, с которой может происходить, когда предотвращается связывание репрессора, синтез интерференционной РНК. Генетическое ингибирование ChoKα коррелирует с уменьшением пролиферации клеток (определяемой по pCNA) и увеличением гибели клеток вследствие апоптоза (определяемого по PARPdig, деградированному белку PARP, являющемуся индикатором апоптоза). Эффект можно начать наблюдать через 10 дней, хотя он все еще очень первоначальный, эффект намного более выражен через 20 дней после начала эксперимента (когда популяция очень мало экспрессирует ChoKα).
Результаты, полученные с индуцибельной моделью, подтверждают данные, ранее полученные в транзиторном исследовании, демонстрируя, что наблюдаемые эффекты обусловлены специфическим ингибированием ChoKα.
Пример 11
Оценка возможного эффекта сверхэкспрессии
ChoKα на канцерогенез
Несколько исследований провели для оценки возможного эффекта, который может иметь сверхэкспрессия холинкиназы бета (ChoKβ) на карцерогенез, и для определения, происходит ли увеличение активности холинкиназы, наблюдаемое в различных раковых тканях и клеточных линиях, происходящих из раковых тканей, исключительно за счет холинкиназы альфа или в этом принимает также участие холинкиназа бета.
Сначала продуцировали поликлональное антитело против ChoKβ. Его специфичность проверили в трех группах трансфицированных клеток НЕК293Т, одна из которых была трансфицирована конструкцией, с которой происходила экспрессия ChoKα, вторая группа была трансфицирована конструкцией, благодаря которой делалась возможной эспрессия ChoKβ, а третья группа была трансфицирована конструкцией, с которой происходила экспрессия химерного белка ChoKβ-GFP, а также в группе контрольных клеток, трансфицированных пустым вектором. Как видно в части А фиг.25, иммунологический анализ продемонстрировал специфичность указанного антитела, которое приводило к возникновению сигнала как в клетках, которые экспрессируют ChoKβ, так и в клетках, которые экспрессируют химерный белок ChoKβ-GFP, и не приводило к возникновению сигнала в полоске, соответствующей клеткам, трансфицированным конструкцией для экспрессии ChoKα; при использовании этой полоски моноклональные антитела, направленные против ChoKα, приводят, однако, к возникновению сигнала в полосе, находящейся на высоте, соответствующей ChoKα.
С целью проверки возможного эффекта ChoKβ на карцерогенез проанализировали ее возможную трансформирующую активность in vivo. Для этого снова использовали бестимусных мышей (Nu/Nu), которым ввели с помощью инъекции миллион клеток человека HEK293T, трансфицированных или пустым вектором в качестве контроля, вектором для экспрессии холинкиназы альфа или вектором для экпрессии холинкиназы бета, в последней группе осуществили трансфекцию вектора для экспрессии холинкиназы альфа совместно с вектором для экспрессии холинкиназы бета. Рост опухолей контролировали по меньшей мере дважды в неделю на протяжении 13 недель после введения. Как видно на фиг.26, четкая индукция опухолей наблюдается у животных, получивших клетки, трансфицированные вектором для экспрессии ChoKα, при этом индукция опухолей не наблюдалась у мышей, получивших клетки, трансфицированные вектором для экспрессии ChoKβ. Поражает, что у мышей, получивших клетки, трансфицированные обоими векторами, векторами для экспрессии ChoKα и ChoKβ, наблюдалась незначительная индукция опухолей величиной, которая значительно меньше той, которая наблюдается при экспрессии только ChoKα, и наблюдалась через более чем 11 недель после введения трансфицированных клеток, что может указывать на то, что ChoKβ может напрямую или косвенно регулировать ChoKα так, что ChoKβ ингибирует онкогенную активность ChoKα.
Эти данные дополнили определением, происходит ли сверхэкспрессия фермента холинкиназы бета в тканях, извлеченных от больных раком. На фиг.27 показаны данные, полученные при использовании образцов легких больных, прооперированных после выделения из них информационной РНК и проведения автоматических количественных ПЦР в режиме реального времени с использованием специфических Taqman-проб, при этом полученные данные представлены в десятичном логарифмическом масштабе относительно контрольного образца нормальной ткани. На этой фигуре видно, что в большинстве из проанализированных образцов экспрессия ChoKβ уменьшается относительно экспрессии ChoKβ в нормальной ткани в отличие от того, что происходит с ChoKα.
Эти данные не говорят о том, что существует корреляция между сверхэкспрессией холинкиназы бета и образованием и развитием опухолей.
Все приведенные в примерах результаты служат специфической поддержкой для использования холинкиназы альфа в качестве новой терапевтической мишени при лечении относящихся к опухолям заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РАКА | 2009 |
|
RU2509809C2 |
| СПОСОБЫ КЛАССИФИКАЦИИ ПАЦИЕНТОВ С СОЛИДНЫМ РАКОМ | 2017 |
|
RU2745730C2 |
| МЕТОД ДЕТЕКЦИИ РАКА | 2013 |
|
RU2646466C2 |
| МЕТОД ДЕТЕКЦИИ РАКА | 2013 |
|
RU2646464C2 |
| СПОСОБЫ ПРОГНОЗИРОВАНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2016 |
|
RU2760577C2 |
| РЕГИСТРАЦИЯ РАХ2 ДЛЯ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2009 |
|
RU2522485C2 |
| ИНГИБИТОРЫ РЕПАРАЦИИ ПОВРЕЖДЕНИЯ ДНК ДЛЯ ЛЕЧЕНИЯ РАКА | 2004 |
|
RU2413515C2 |
| ОТБОР БОЛЬНЫХ РАКОМ ДЛЯ ВВЕДЕНИЯ ИНГИБИТОРОВ СИГНАЛЬНОГО ПУТИ Wnt НА ОСНОВАНИИ СТАТУСА МУТАЦИИ RNF43 | 2013 |
|
RU2636000C2 |
| ГЕН MTS, МУТАЦИИ ДАННОГО ГЕНА И СПОСОБЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА MTS | 1995 |
|
RU2164419C2 |
| МУТАЦИИ ГЕНА МТS В ЗАРОДЫШЕВОЙ ЛИНИИ И СПОСОБ ВЫЯВЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К ЗЛОКАЧЕСТВЕННЫМ ОПУХОЛЯМ В ГЕНЕ МТS | 1995 |
|
RU2161309C2 |
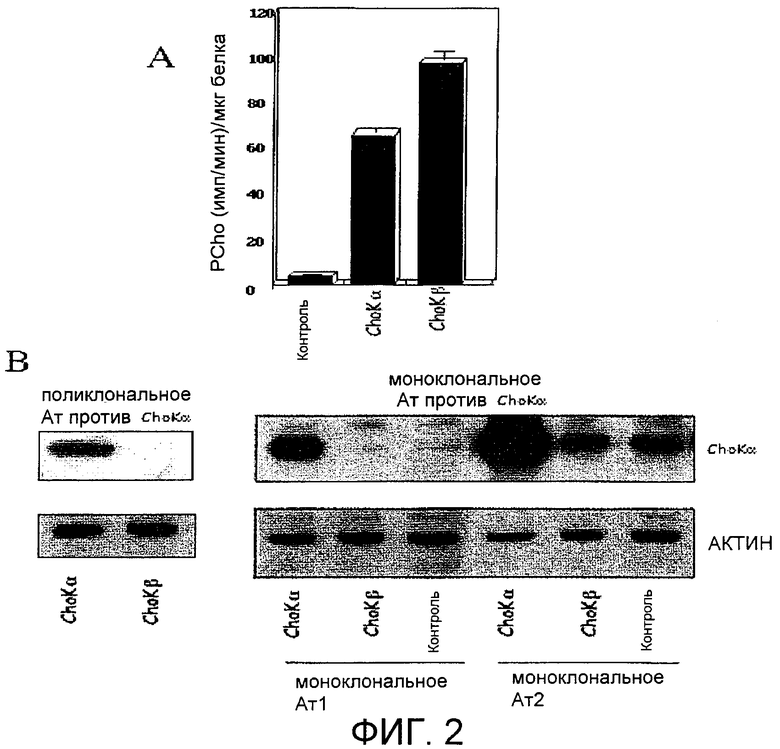

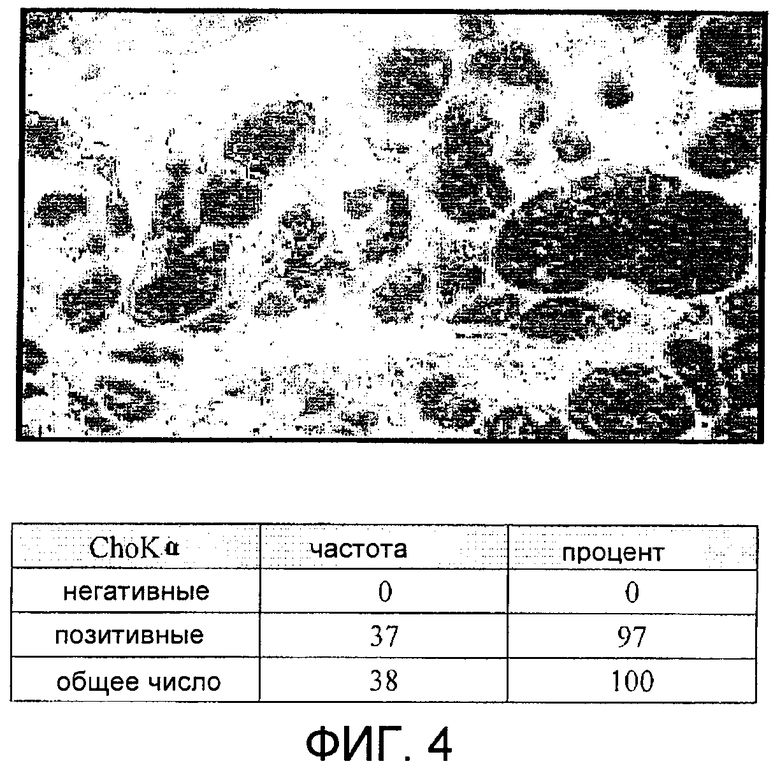
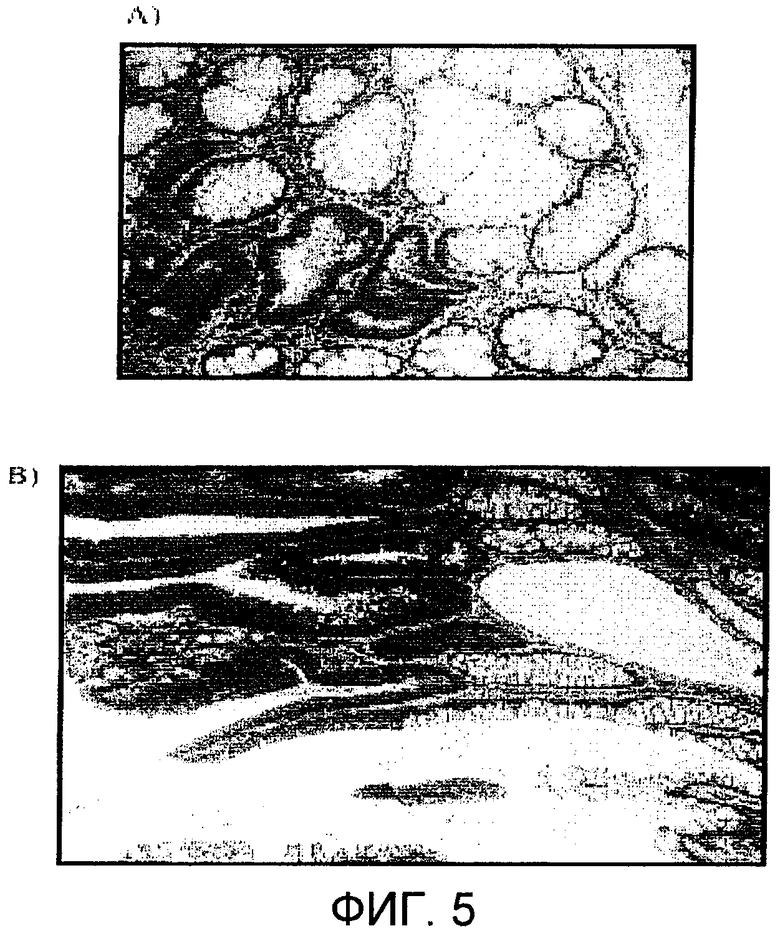
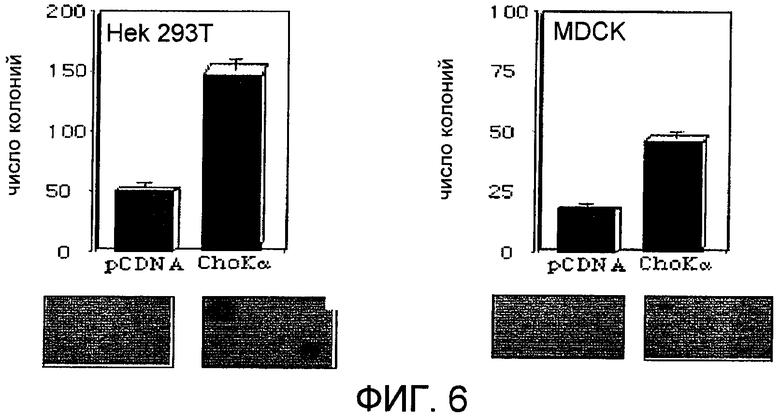
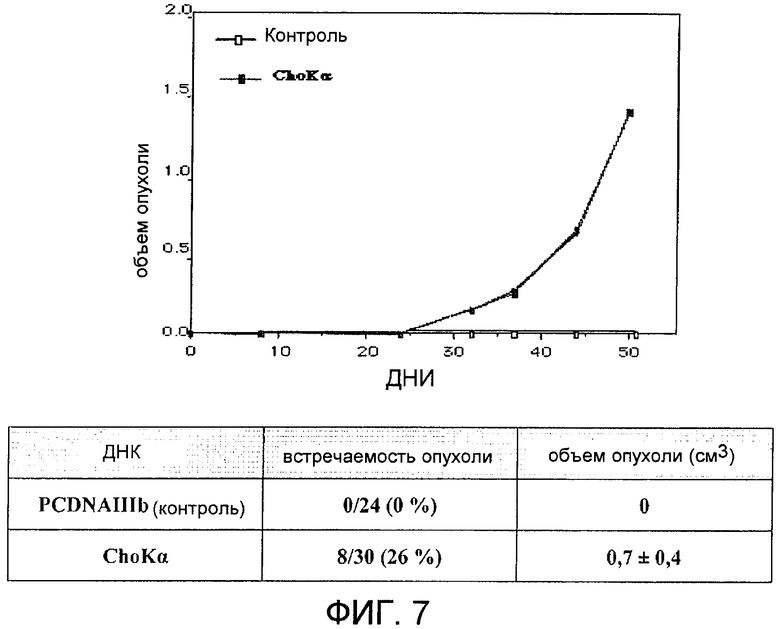
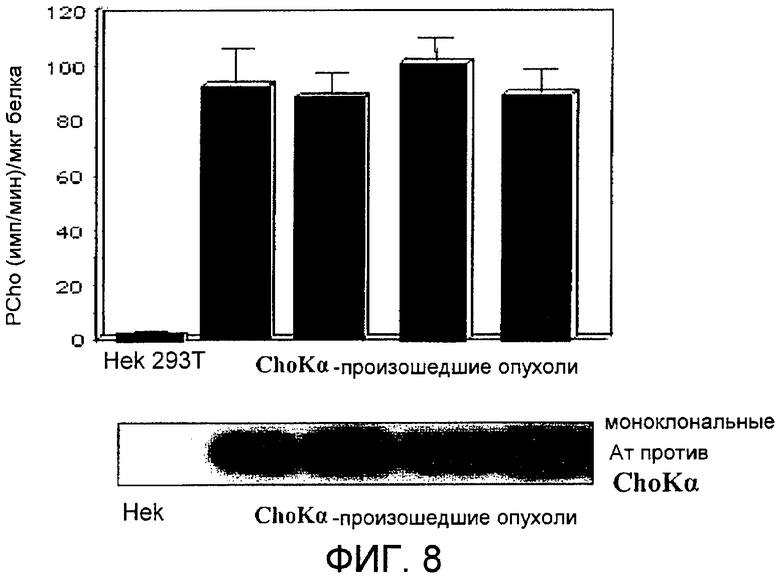
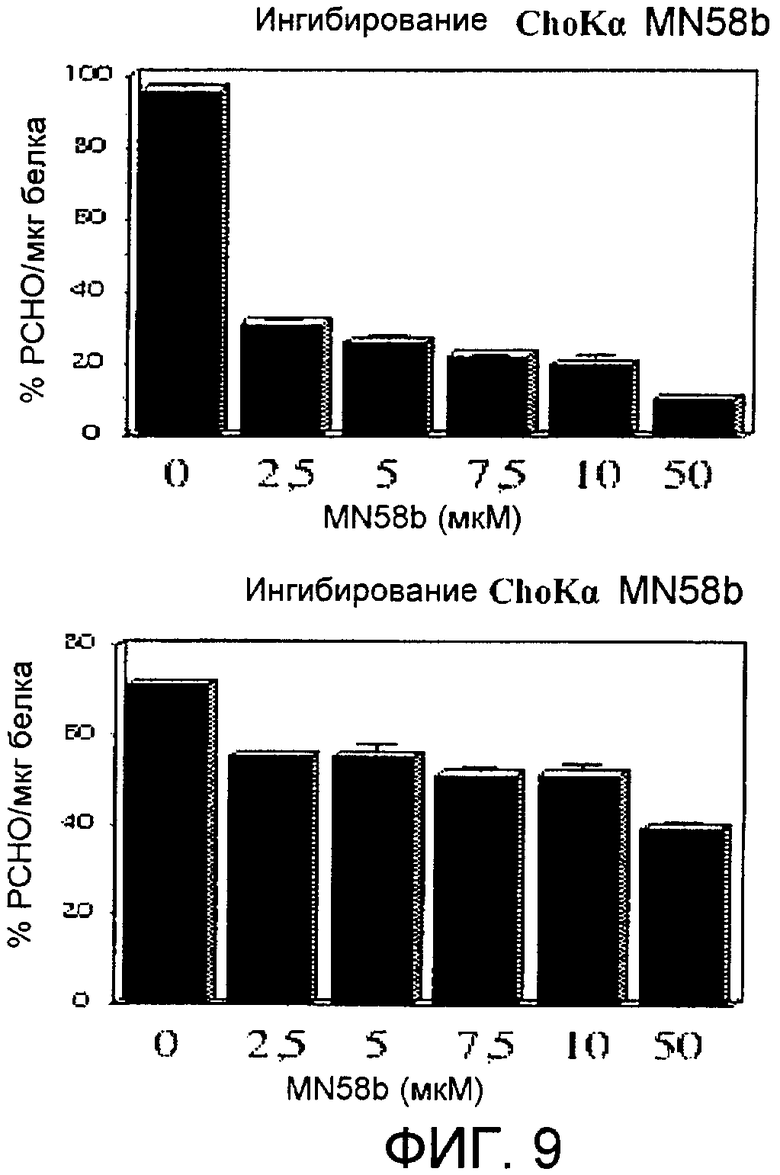
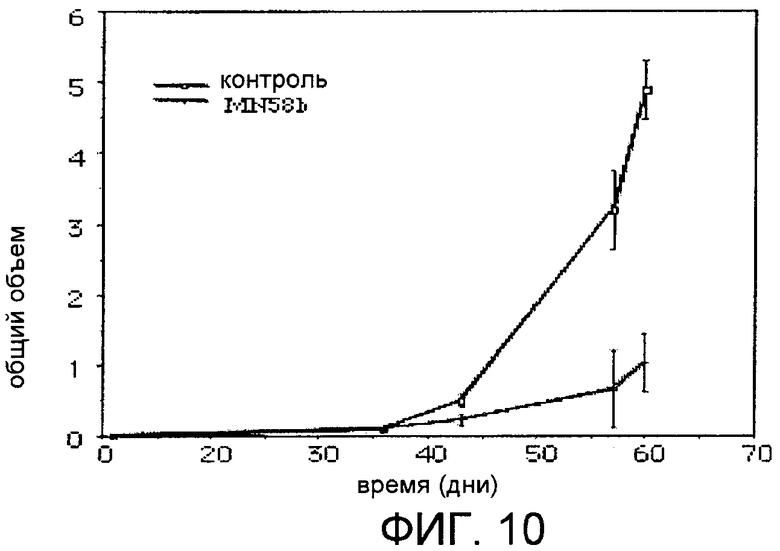
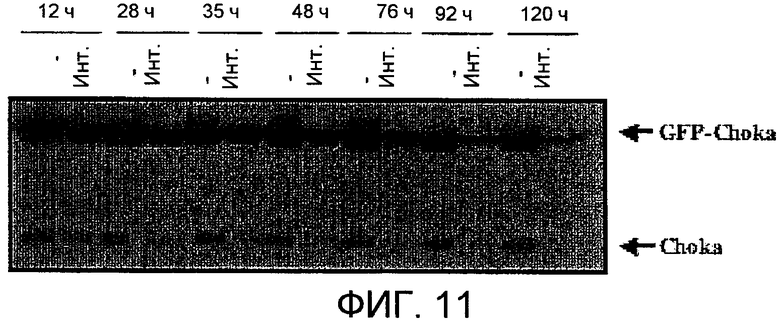

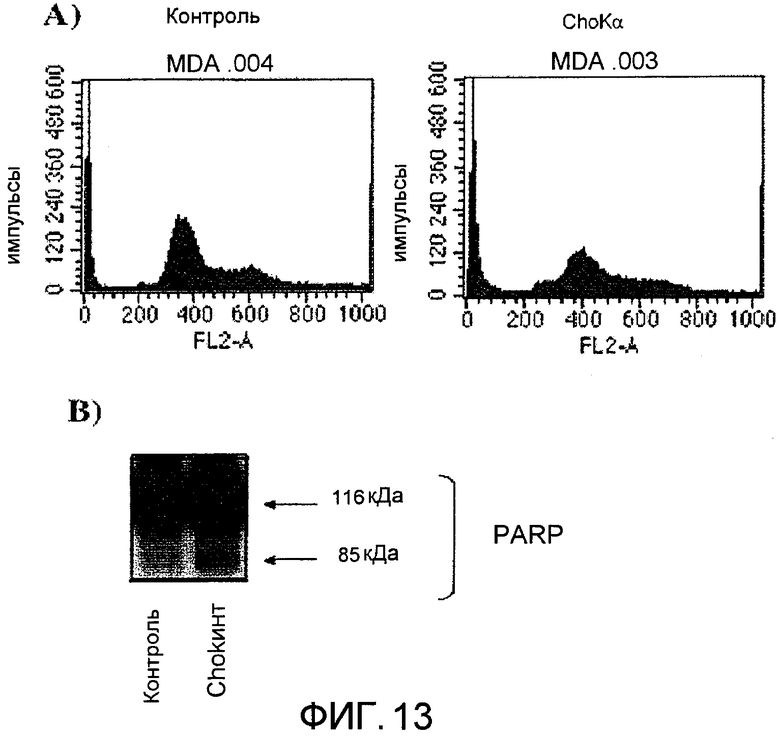
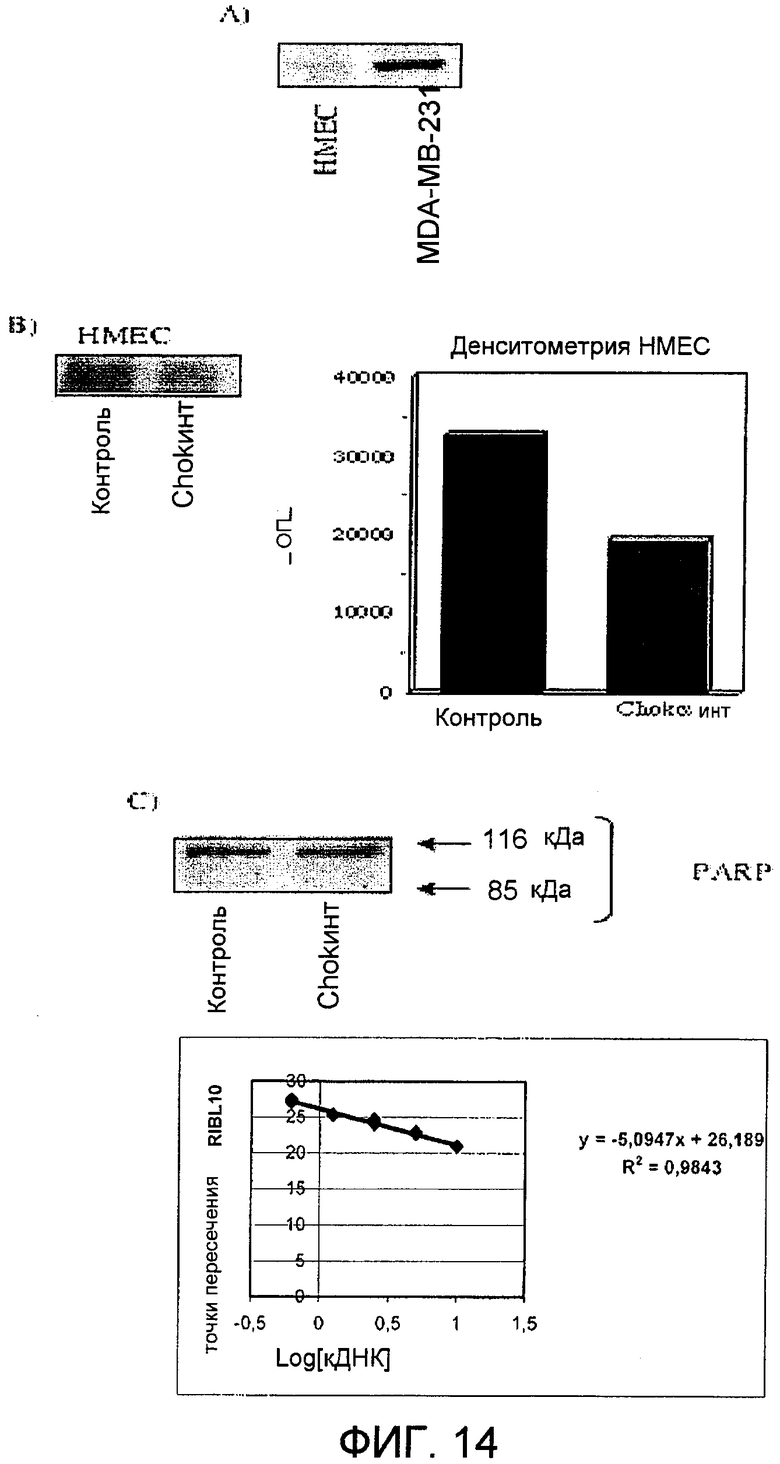

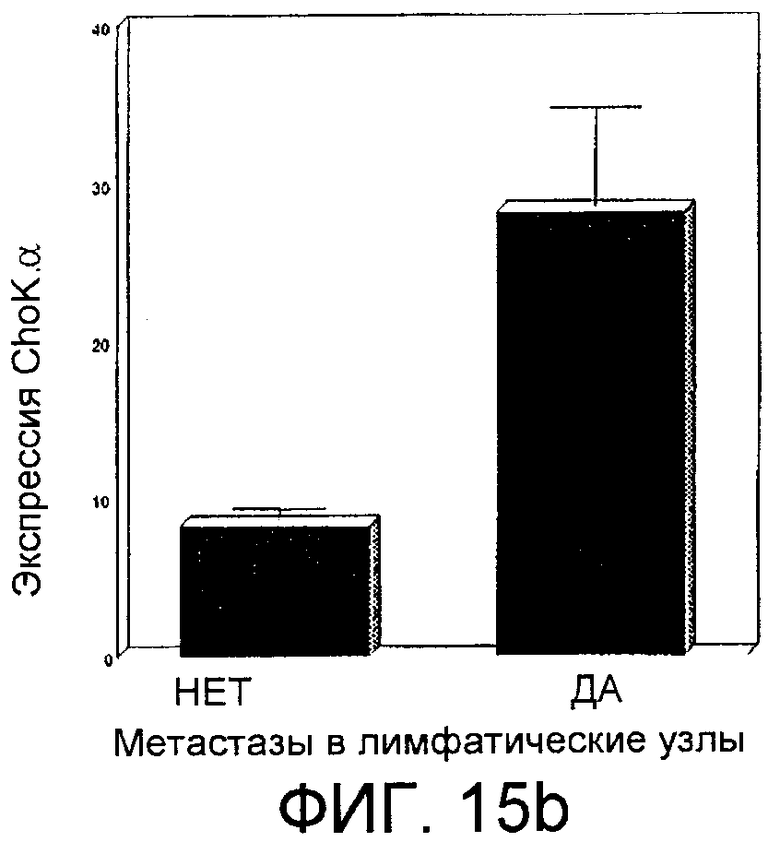
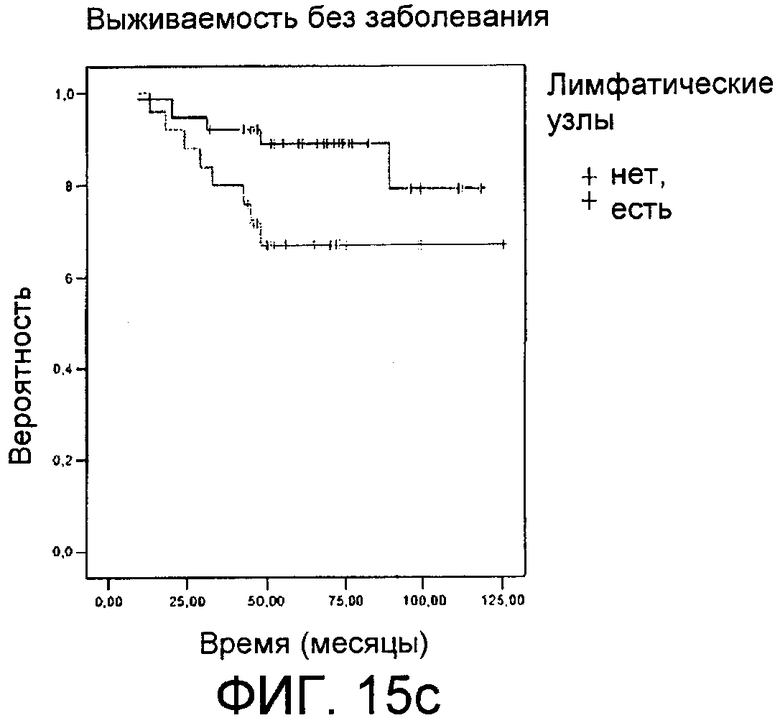
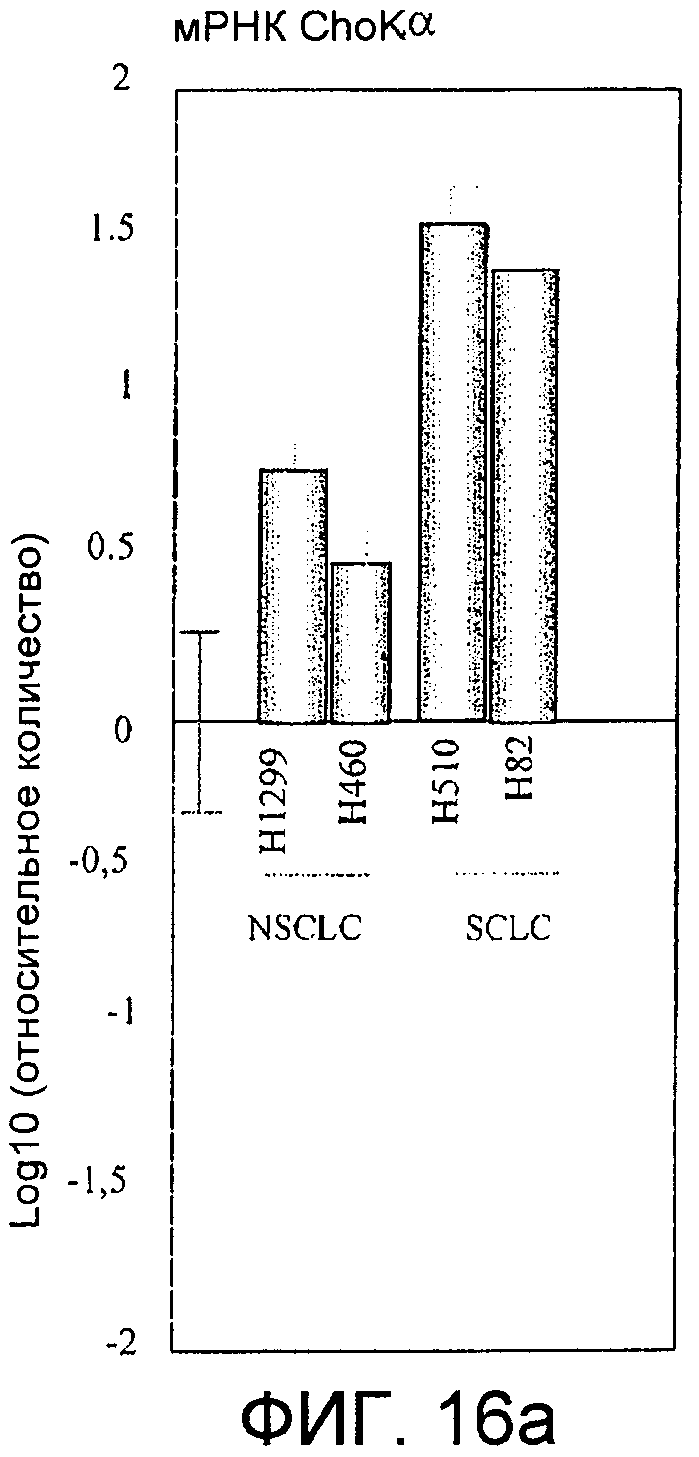
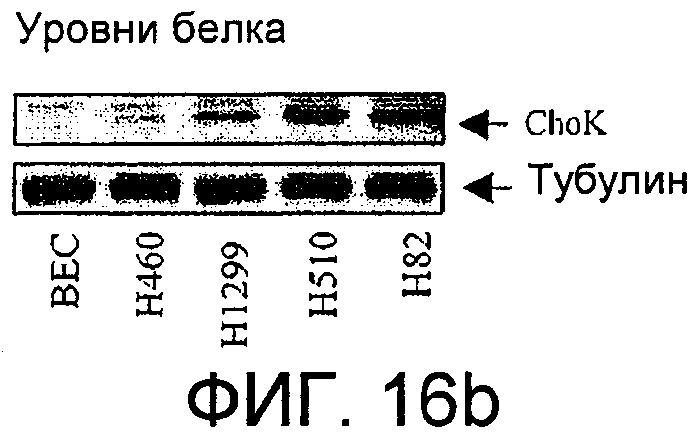
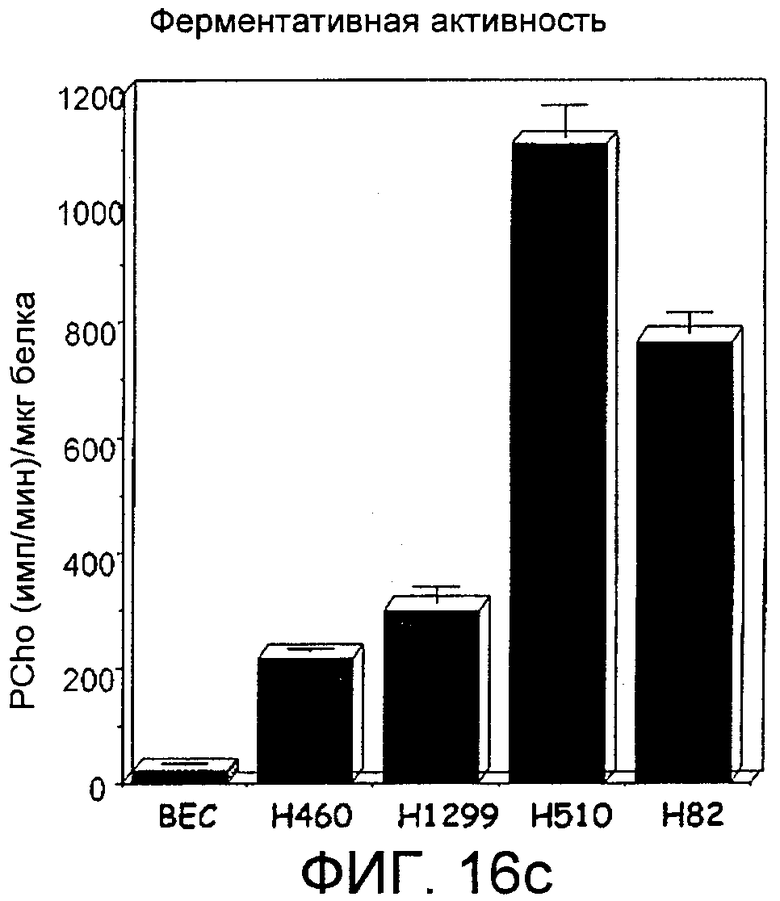
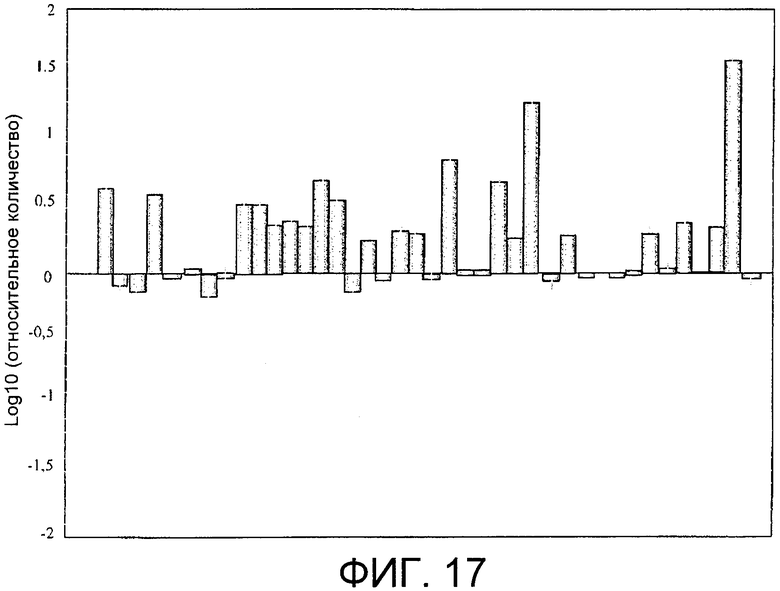
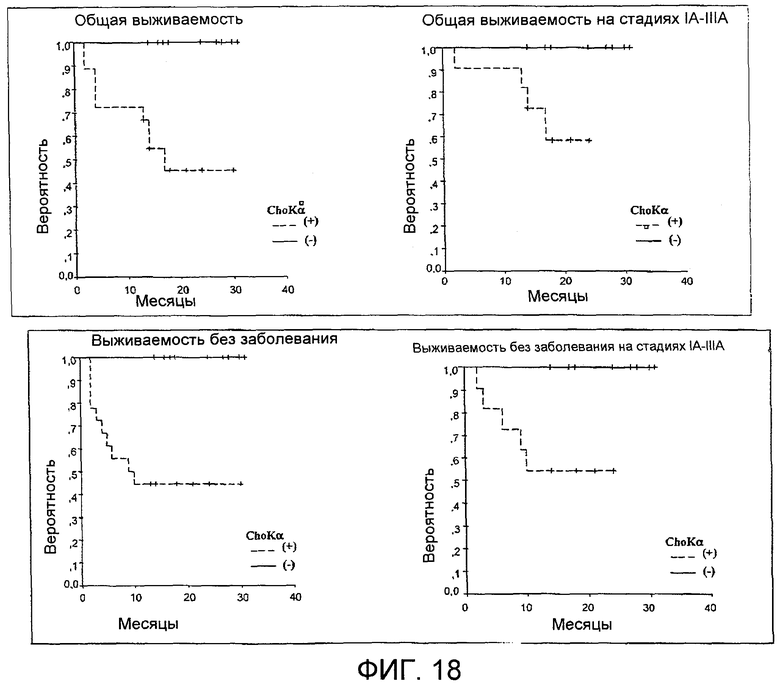
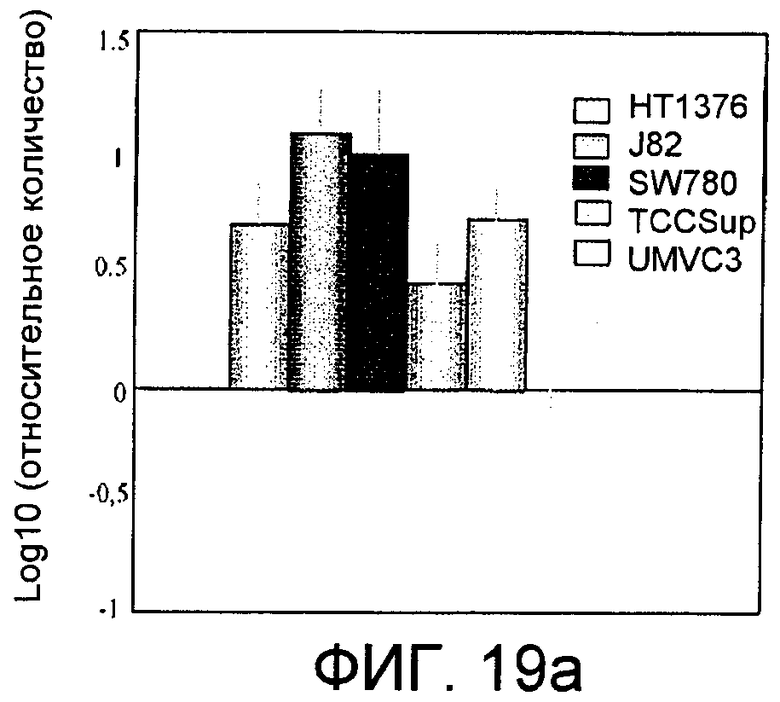

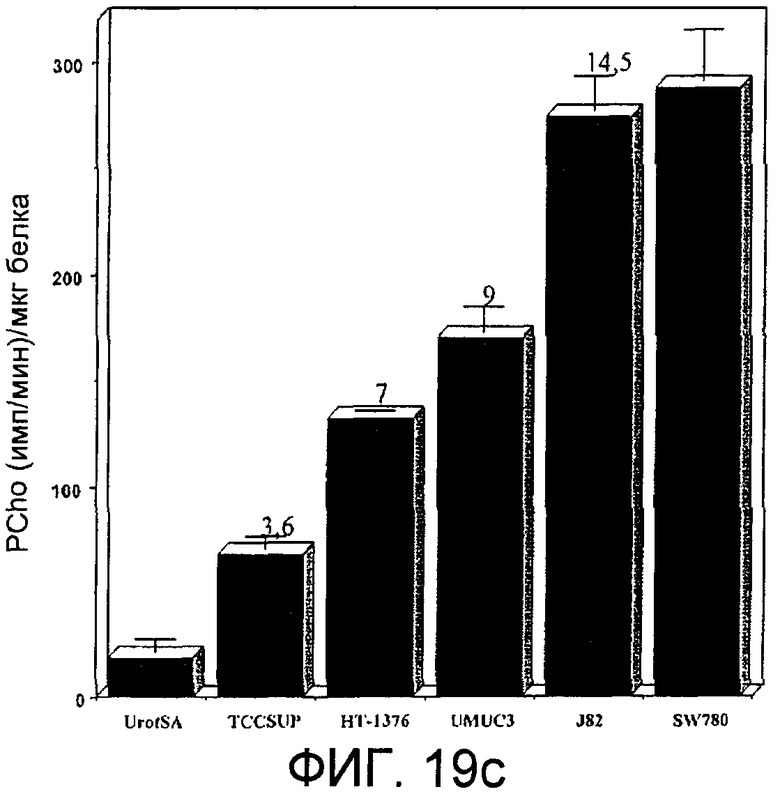
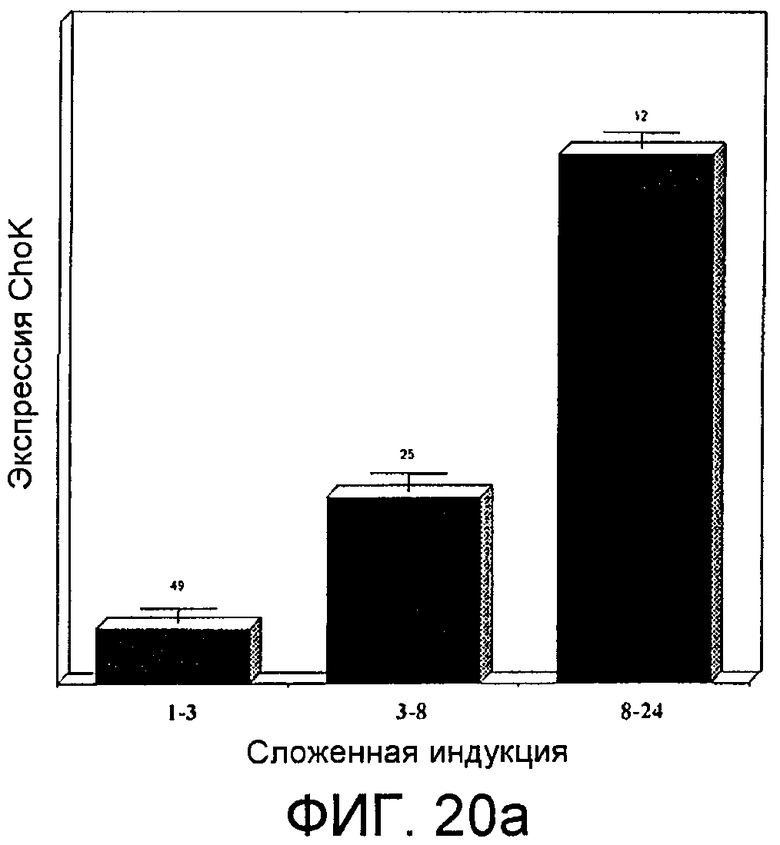

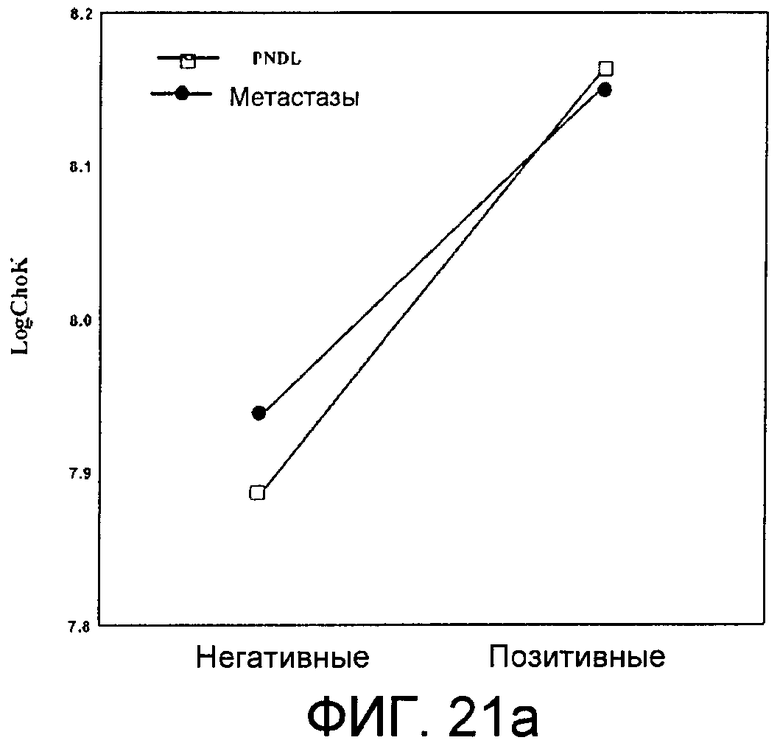
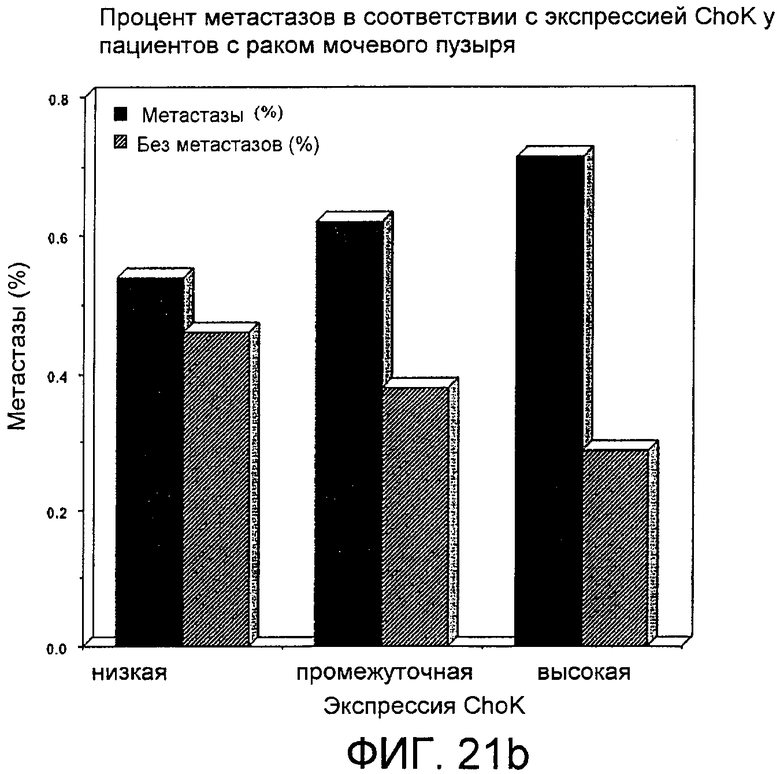
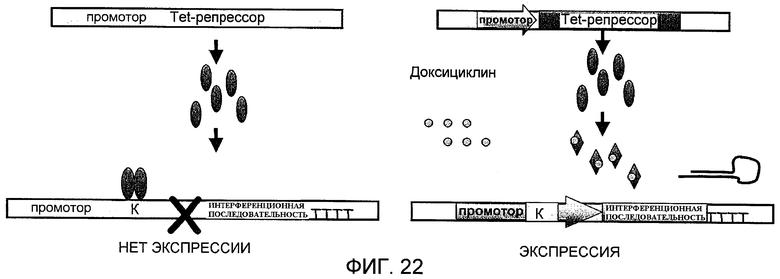
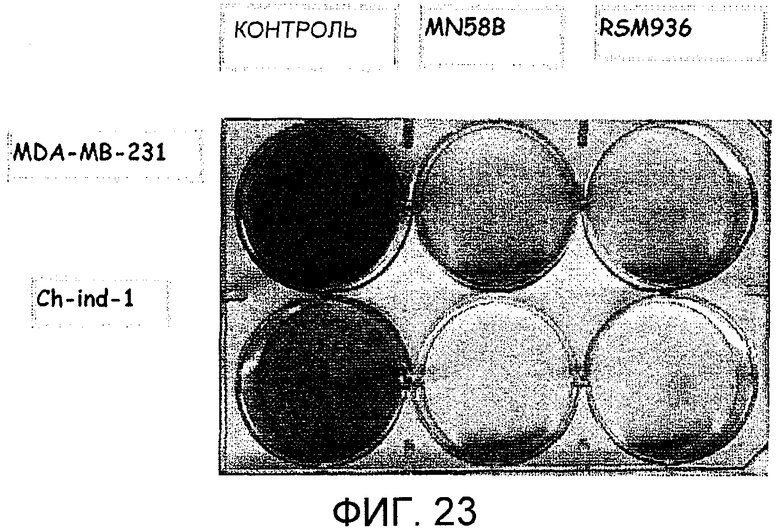
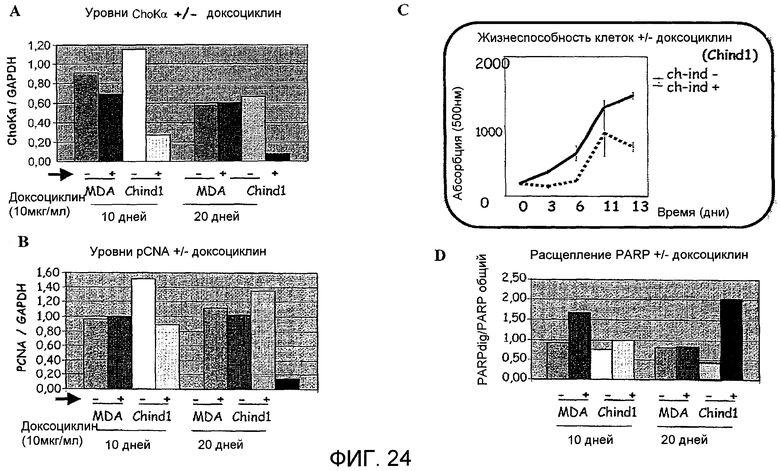

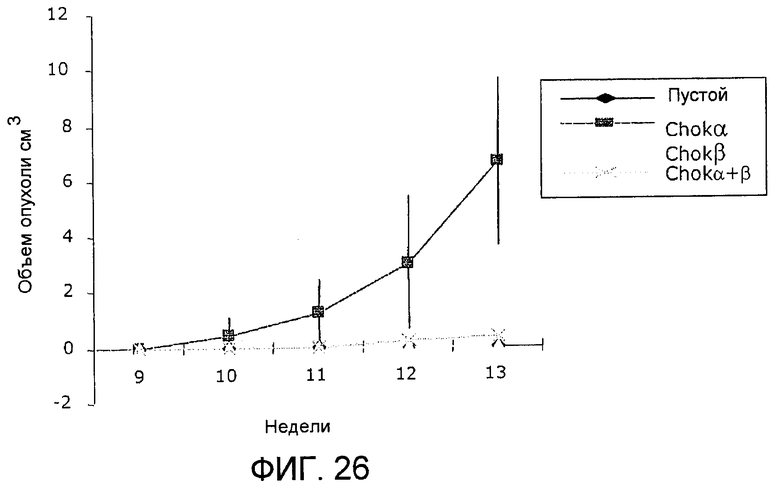

Изобретение относится к области биотехнологии, конкретно к способам in vitro определения стадии или тяжести заболевания раком у больного или контролирования эффекта терапии, назначаемой больному раком, и может быть использовано в медицине. Способ определения прогноза развития заболевания у больного раком предусматривает оценку уровня экспрессии гена холинкиназы альфа в образце раковой ткани, выделенном у больного, и сравнение полученной величины с величиной, соответствующей одному или более образцам нормальной нераковой ткани. По повышенным уровням экспрессии гена холинкиназы альфа дифференцируют больных с худшим прогнозом развития заболевания. Способ in vitro мониторинга эффекта противораковой терапии осуществляют путем оценки уровня экспрессии гена холинкиназы альфа в образце раковой ткани, выделенном у больного, которому вводится противоопухолевый агент, и сравнения полученной величины с величиной, соответствующей одному или более образцам нормальной нераковой ткани. При этом эффективная терапия снижает уровни экспрессии гена холинкиназы альфа или вызывает реверсирование эффектов высокой экспрессии указанного гена. Изобретение позволяет эффективно определять прогноз развития заболевания у больного раком или проводить мониторинг эффекта противораковой терапии у пациента. 2 н. и 4 з.п. ф-лы, 27 ил., 3 табл.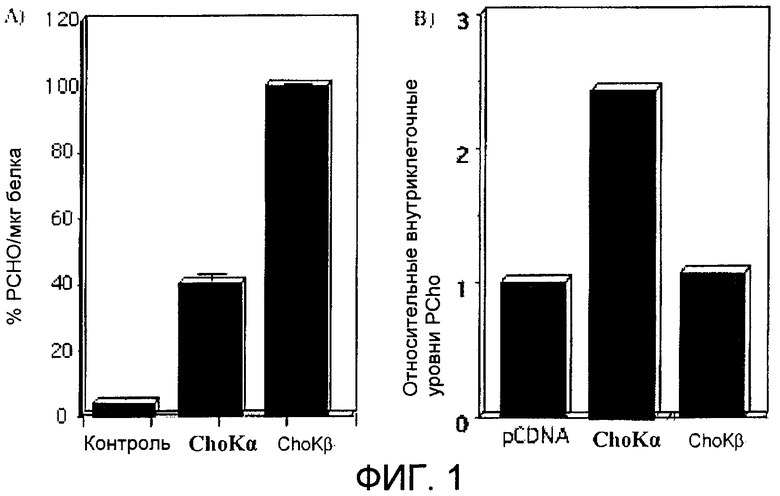
1. Способ in vitro определения прогноза развития заболевания у больного раком, предусматривающий оценку уровня экспрессии гена холинкиназы альфа в образце раковой ткани, выделенном у больного, посредством определения в указанном образце, по меньшей мере, одного относящегося к белку холинкиназе альфа параметра, который выбран из группы, состоящей из уровня его информационной РНК и концентрации указанного белка, и
сравнение полученной величины с величиной, соответствующей одному или более образцам нормальной нераковой ткани,
где повышенные уровни экспрессии гена холинкиназы альфа соответствуют больным с худшим прогнозом развития заболевания.
2. Способ по п.1, где определяют прогноз развития заболевания у больного раком легкого, молочной железы, толстой и прямой кишок или мочевого пузыря.
3. Способ по п.1, где уровень информационной РНК определяют посредством амплификации мРНК, присутствующей в экстракте общей РНК, и последующего количественного определения продукта амплификации мРНК.
4. Способ по п.3, который осуществляют с помощью количественной ПЦР в режиме реального времени.
5. Способ по любому из пп.1-4, где диагностируют время продолжительности жизни больного.
6. Способ in vitro мониторинга эффекта терапии, назначаемой больному раком, отличающийся тем, что оценку уровня экспрессии гена холинкиназы альфа в образце раковой ткани, выделенном у больного, которому вводится противоопухолевый агент, осуществляют посредством определения в указанном образце, по меньшей мере, одного относящегося к белку холинкиназы альфа параметра, который выбран из группы, состоящей из уровня его информационной РНК, концентрации указанного белка или его ферментативной активности, и сравнения полученной величины с величиной, соответствующей одному или более образцам нормальной нераковой ткани, где эффективная терапия снижает уровни экспрессии гена холинкиназы альфа или вызывает реверсирование эффектов высокой экспрессии указанного гена.
| AOYAMA С | |||
| et al | |||
| Structure and function of choline kinase isoforms in mammalian cells, Prog | |||
| Lipid | |||
| Res., 2004, v.43, n.3, p.266-281 | |||
| HERNANDEZ-ALCOCEBA R | |||
| et al., In vivo antitumor activity of choline kinase inhibitors: a novel target for anticancer drug discovery, Cancer Res., 1999, v.59, n.13, p.3112-3118 | |||
| NAKAGAMI K | |||
| et al., Increased choline |
Авторы
Даты
2011-11-27—Публикация
2006-04-12—Подача