Изобретение относится к биотехнологии, биологии и медицине и предназначено для выявления ядерного антигена пролиферирующих клеток PCNA человека иммуноцитохимическим и иммуноферментным методами, а также на иммуноблотах для научно-исследовательских и клинико-лабораторных целей.
Известно, что разновидности раковых новообразований можно классифицировать и оценить по степени злокачественности после проведения диагностической биопсии перерожденного участка ткани с последующим морфологическим и иммуноцитохимическим анализом клеток биоптата (М.А. Пальцев, Н.М. Аничков. Патологическая анатомия. - М.: Медицина, 2001).
Известно также, что для иммунодиагностики и прогностической оценки течения заболевания используются антитела к маркерным белкам онкозаболеваний различной нозологии, включая антитела к белкам, служащим биомаркерами пролиферативного состояния клеток (Lea P., Ling М. New molecular assays for cancer diagnosis and targeted therapy. Curr. Opin. Mol. Ther. 2008, 10: 251-259). Одним из них является ядерный антиген пролиферирующих клеток (PCNA, Proliferating Cell Nuclear Antigen) - субъединица ДНК полимеразы δ. Экспрессия белка PCNA начинается в G1 периоде клеточного цикла, достигая своего максимума во время S периода, когда он образует комплекс с ингибитором внутриклеточных киназ белком р21. Антитела к белку PCNA также широко используются также для решения многих фундаментальных вопросов, связанных с выяснением механизмов репликации ДНК в клетках млекопитающих (Moldovan G.L. et al. PCNA, the maestro of the replication fork. Cell 2007, 129: 665-79).
Для выявления белка PCNA у человека на сегодняшний день существует несколько доступных коммерчески поликлональных, так и моноклональных антител (МКА). Известные мышиные гибридомы, продуцирующие МКА к ядерному антигену пролиферирующих клеток человека PCNA, были получены при иммунизации мышей
полноразмерным рекомбинантным белком PCNA человека, слитым с глутатион-S-трансферазой (GST) (коммерчески доступные клоны k1A3, 1E12-1G10, 1G7, 4C10G3, 5А10, IPO-38, S1, 2A6, 2E9, 3A9, 3B1, 3G8, F-2);
различными рекомбинантными полипептидными участками белка PCNA человека (коммерчески доступные клоны 3G236, 339, 24);
выделенным белком PCNA из экстрактов клеток млекопитающих (коммерчески доступные клоны 2Q481, 2Q482, 1.ВВ.53, 1V006, 19F4).
К недостаткам описанных клонов относятся дороговизна МКА, продуцирующихся данными гибридомами, ввиду их зарубежного происхождения, а также отсутствие для некоторых из них данных о тестировании в реакциях иммуноцитохимии и иммуногистохимии, использующихся в ежедневной клинико-диагностической практике.
Известна наиболее близкая к заявленной гибридома, полученная при иммунизации мышей рекомбинантым белком PCNA крысы, слитым с белком А с поверхности клеточной стенки бактерии Staphylococcus aureus (коммерчески доступные клоны PC 10, РС11, РС5, РС8, 1.ВВ.51, SPM350, IML-83, 3Н2827, 9А307, 9А309, 2Q197, SPM350, 3G237, 0.N.508, 2Q483, 2Q2Q19799, 5F289, 0.Т.109, 6D645). К недостаткам заявленного аналога относится дороговизна МКА, продуцирующихся данной гибридомой, ввиду ее зарубежного происхождения. Также, для иммунизации был использован рекомбинантный белок PCNA крысы, слитый белком А с поверхности клеточной стенки бактерии Staphylococcus aureus, и полученные МКА специфичны к нескольким аминокислотным остаткам, идентичным у крысы и человека.
Задачей изобретения является расширение ассортимента моноклональных антител, обладающих специфичностью к полноразмерному белку PCNA человека, использующихся для иммунодиагностики и прогностической оценки течения онкозаболеваний различной нозологии у человека.
Поставленная задача решается за счет мышиной гибридомы Р56 - продуцента моноклонального антитела, выявляющего ядерный антиген пролиферирующих клеток человека PCNA методами иммуноцитохимии, иммуногистохимии, иммуноблотирования и иммуноферментного анализа, полученной путем иммунизации мышей линии Balb/c полноразмерным рекомбинантным белком PCNA человека, экспрессированным в Е.coli, слитым с шестью остатками гистидина в N-концевой области молекулы (6xHis-PCNA), и слиянием сенсибилизированных лимфоцитов селезенки иммунизированных мышей с клетками мышиной миеломы линии P3X63-Ag8.653 с помощью 50%-ного раствора полиэтиленгликоля с молекулярной массой 1450.
Продуцируемые гибридомой Р56 МКА к белку PCNA человека обладают селективной способностью связывать белок PCNA человека иммуноферментным методом, на иммуноблотах (фиг.3), на клеточном (фиг.2) и тканевом уровнях (фиг.4), включая парафиновые срезы, и расширяют существующий доступный ассортимент моноклональных антител к белку PCNA. Также следует отметить, что каждая вновь полученная гибридома уникальна. МКА, продуцируемые разными гибридомами, различаются по своей первичной структуре, по специфичности к различным антигенным детерминантам, аффинности и другим свойствам. Поэтому получение как можно большего количества МКА к белку PCNA человека важно с научной и практической точки зрения.
Технический результат изобретения заключается в получении линии гибридных культивируемых клеток мыши Р56, продуцирующей доступные для отечественных клинико-диагностических лабораторий МКА к полноразмерному ядерному антигену пролиферирующих клеток PCNA человека и эффективно выявляющих белок PCNA в клетках человека методами иммуноцитохимии, иммуногистохимии, иммуноблотирования.
Мышиную гибридому Р56 получают следующим образом:
Трем мышам линии Balb/c (весом 20 г) внутрибрюшинно инъецируют по 5 мкг белка 6xHis-PCNA, растворенного в 0.5 мл полного адъюванта Фрейнда, а затем дважды то же количество белка, растворенного в неполном адъюванте Фрейнда. Интервал между иммунизациями составляет 7 суток. Сенсибилизацию (т.е. появление в сыворотке крови животных антител к белку PCNA) проверяют в реакции непрямой иммунофлуоресценции методом иммуноблотирования на клетках человека HeLa и иммуноцитохимической реакции на биоптатах ткани молочной железы человека. Выделяют лимфоциты селезенки мыши, в сыворотке крови которой присутствуют антитела к белку PCNA человека. Их сливают с культивируемыми клетками мышиной миеломы линии P3X63-Ag8.653 в соотношении 3:1, используя в качестве сливающего агента 50%-ный раствор полиэтиленгликоля с молекулярной массой 1450. После завершения процедуры слияния клетки переносят в ячейки 96-луночных плоскодонных планшетов (0.2×106 клеток на ячейку) в среде RPMI 1640 с селективными агентами (0.1 мМ гипоксантина, 0.4 мкМ аминоптерина и 0.016 мМ тимидина). Через 7 суток производят скрининг культуральных жидкостей из лунок, давших рост гибридным клонам сначала методом иммуноферментного анализа (ИФА), используя в качестве субстрата рекомбинантный белок 6xHis-PCNA, выделенный из бактерий. Культуральную жидкость от ИФА-позитивных клонов затем тестируют методом иммунофлуоресценции на клетках человека HeLa, на иммуноблотах, а также с помощью постановки иммуноцитохимической реакции. В результате отбирают клон Р56, секретирующий моноклональное антитело, выявляющее белок PCNA в клетках HeLa в реакции непрямой иммунофлуоресценции (фиг.2) и на иммуноблотах (фиг.3), а также в злокачественно трансформированных клетках молочной железы человека с помощью иммуноцитохимической реакции (фиг.4). Клетки клона Р56 четырехкратно клонируют методом лимитирующих разведений и выводят в массовую культуру по стандартной методике.
Мышиная гибридома Р56 принята на депонирование по форме «Национальное патентное депонирование» 15 сентября 2010 г. Всероссийской коллекцией промышленных микроорганизмов ФГУПГосНИИГенетика с коллекционным номером ВКПМ Н-107.
Мышиная гибридома Р56 имеет следующие характеристики:
Морфологические признаки: Культура имеет вид суспензии, где клетки собраны в конгломераты и слабо прикрепляются к субстрату.
Условия культивирования клеток гибридомы Р56. Среда для культивирования - RPMI 1640 («ПанЭко», Россия), 20% эмбриональной телячьей сыворотки ("HyClone", США), 2 мМ L-глутамина, по 100 ед/мл пенициллина и стрептомицина. Условия культивирования: 37°C, абсолютная влажность и 5% CO2 в атмосфере. Частота пассирования - каждые 3-4 суток, кратность рассева 1:5-1:10.
Способ криоконсервирования клеток гибридомы Р56. Криозащитная среда: 55% среды RPMI 1640 («ПанЭко», Россия), 40% эмбриональной сыворотки теленка ("HyClone") и 5% диметилсульфоксида ("Sigma-Aldrich", США). Криоампулы с клеточной взвесью помещают на сутки в холодильник на -70°C, после чего переносят в жидкий азот (-196°C) для длительного хранения. Жизнеспособность после размораживания - 80-90%. После размораживания клетки культивируют при плотности 0.2-0.3·106 кл/мл. Бактерии, грибы, дрожжи и микоплазма в культуре не обнаружены.
Изотип моноклонального антитела Р56: Моноклональное антитело Р56 относится к иммуноглобулинам класса IgGl.
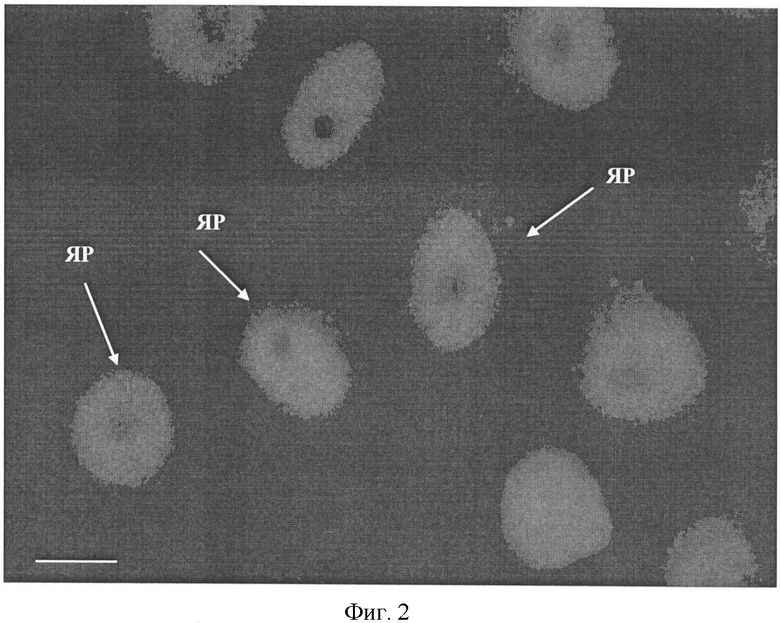
Специфичность моноклонального антитела Р56. Моноклональное антитело Р56 выявляет белок PCNA в клетках человека разного тканевого и линейного происхождения, включая клетки линии HeLa (карцинома шейки матки, фиг.2), а также пролиферирующие клетки ткани молочной железы человека, фиг.4. Антитело Р56 узнает белок PCNA на иммуноблотах в суммарных лизатах клеток человека HeLa (фиг.3).
Оптимальные титры антител Р56, определяемые в культуральной жидкости на клетках HeLa методом непрямой иммунофлуоресценции, составляют 1:20, методом иммуноцитохимии 1:50, методом иммуноблотов - 1:200.
Продуцируемое гибридомой Р56 МКА рекомендуется для специфического выявления ядерного антигена пролиферирующих клеток белок PCNA человека методами иммуноферментного анализа, иммунофлуоресценции, иммуноцитохимии и иммуноблотирования.
Изобретение иллюстрируют следующие чертежи
Фиг.1. Схема вектора pQE-PCNA, созданного в ходе работы, для экспрессии рекомбинантного белка 6xHis-PCNA.
Где кДНК PCNA - кодирующая последовательность ДНК PCNA человека, клонированная в вектор pQE-30 (Qiagen, Германия); AmpR - ген, обуславливающий устойчивость трансформированных бактериальных клеток к антибиотику ампициллину; RGS-6xHis - участок плазмиды pQE-PCNA, кодирующий шесть гистидинов, BamHI и HindIII - сайты расщепления эндонуклеазами рестрикции BamHI и HindIII. Получение плазмиды pQE-PCNA описано в Примере 1.
Фиг.2. Специфичность антитела Р56, продуцируемого гибридомой Р56, к белку PCNA в клетках человека линии HeLa, выявляемая методом иммунофлуоресценции.
Стрелками указаны окрашенные антителом Р56 ядра пролиферирующих клеток линии HeLa (обозначены ЯР). Для выявления связавшихся с антигеном антител использовались вторичные антитела к иммуноглобулинам мыши, конъюгированные с флуорохромом Alexa Fluor 488 (Molecular Probes, США), как описано в Примере 2. Масштабная линия, 10 мкм.
Фиг.3. Специфичность антитела Р56, продуцируемого гибридомой Р56, к белку PCNA в клетках человека линии HeLa, выявляемая на иммуноблотах.
Выявление белка PCNA антителом Р56 после переноса белков на мембрану. Клеточные лизаты приготовлены, а мембрана проявлена, как описано в Примере 3. Стрелкой указана электрофоретическая подвижность рекомбинантного белка 6xHis-PCNA, соответствующая расчетной.
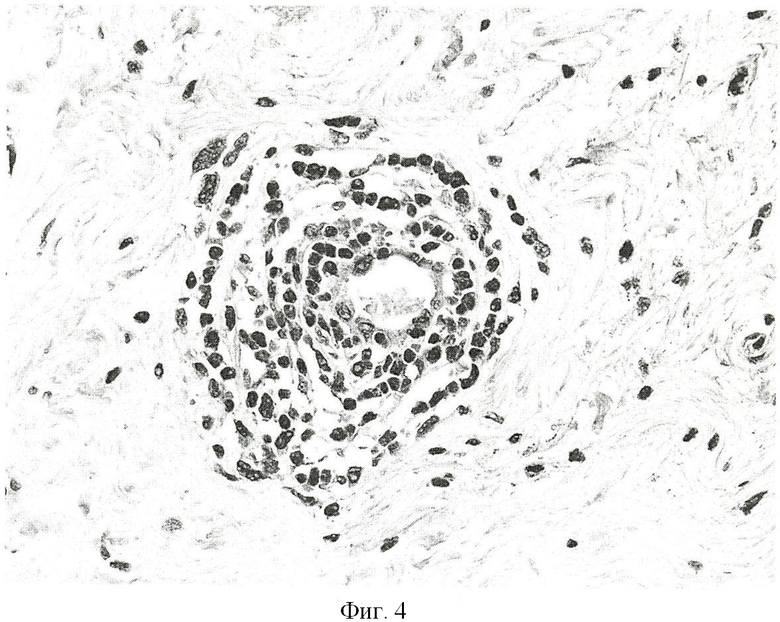
Фиг.4. Специфичность антитела Р56, продуцируемого гибридомой Р56, к белку PCNA в пролиферирующих клетках ткани молочной железы человека, выявляемая методом иммуноцитохимии. Для выявления связавшихся с антигеном антител, используют вторичные антитела к иммуноглобулинам мыши, конъюгированные с пероксидазой хрена (Sigma, США), как описано в Примере 4.
Специфическая окраска ядер клеток на парафиновом срезе биоптата ткани молочной железы человека, фиксированном формалином, свидетельствует о наличии клеток в пролиферативной фазе роста.
Изобретение иллюстрируют следующие примеры:
Пример 1. Экспрессия и выделение рекомбинантного белка PCNA из бактерий
Для получения полноразмерного рекомбинантного белка PCNA человека, слитого в N-концевой области молекулы с шестью остатками гистидина (6xHis-PCNA), используют вектор pQE-30 (Qiagen, Германия). Ген PCNA человека (нуклеотидная последовательность и открытая рамка считывания кДНК PCNA человека доступны в базе данных GeneBank по адресу http://www.ncbi.nlm.nih.gov/genbank/ с порядковыми номерами NM_002592, NP_002583) амплифицируют на матрице кДНК, полученной из мРНК клеток линии HeLa с использованием ген-специфических праймеров (5'-ggatccatgttcgaggcgcgcctggtc -3', 5'- aagcttctaagatccttcttcatcctcg -3', встроенные сайты эндонуклеаз рестрикции BamHI/HindIII подчеркнуты) (Фиг.1). Амплифицированные фрагменты ДНК очищают и клонируют в вектор pQE-3О по сайтам, созданным эндонуклеазами рестрикции BamHI и EcoRI. В результате получают плазмиду pQE-PCNA, несущую ген белка PCNA человека, слитый с последовательностью ДНК, кодирующей шесть гистидинов (Фиг.1). Плазмиду тестируют на наличие нуклеотидных замен методом автоматического секвенирования ДНК.
Компетентные клетки E.coli штамма BL21-Codon-Plus (Stratagene, США) химически трансформируют плазмидой pQE-PCNA, высевают на чашки с LB-агаром, содержащим 100 мкг/мл ампициллина, и инкубируют при 37°С в течение 16 ч.
Для экспрессии рекомбинантного белка 6xHis-PCNA в денатурирующих условиях 5 мл среды LB инокулируют единичной колонией с LB-чашки и инкубируют при горизонтальном перемешивании (250 об/мин) 16 ч при 37°С. После окончания инкубации 250 мл среды LB, содержащей 100 мкг/мл ампициллина, инокулируют 5 мл ночной бактериальной культуры. При достижении суспензией оптической плотности 0.6 ед. (при λ=600 нм) индуцируют экспрессию плазмиды с помощью 0.1 мМ изопропил-1-тио-β-D-галактопиранозида, ИПТГ (Aldrich, США). Наработку белка 6xHis-PCNA осуществляют при 37°С в течение 4 ч и постоянном горизонтальном перемешивании клеток в режиме 200 об/мин.
Бактерии осаждают при 5000 g в течение 10 мин (4°С), осадок ресуспендируют на льду в 40 мл денатурирующего буфера А, содержащего 8М мочевину, 0,1М NaN2PO4, 0,01 М Трис-(гидроксиметил)-аминометан, 0,5М NaCl, рН 8.0. Бактериальные клетки разрушают на льду с помощью ультразвукового дезинтегратора (20 импульсов по 1 мин каждый) и смешивают с Тритоном Х-100 до конечной концентрации 1%. Суспензию центрифугируют при 12000g 10 мин, к полученному супернатанту добавляют 2 мл 50% агарозы Ni-NTA (Sigma, США), предварительно уравновешенной в 20 объемах буфера А.
Полученную суспензию инкубируют при 4°C с орбитальным перемешиванием в течение 3-х часов. После инкубации Ni-NTA агарозу переносят в хроматографическую колонку (AmershamPharmaciaBiotech, Великобритания), последовательно промывая 200 мл буфера Б, содержащего 8М мочевину, 0,1М NaH2PO4, 0,01М Трис-(гидроксиметил)-аминометан, 0,5М NaCl, рН 6.4. Для определения момента выхода белка с колонки используют детектор (Bromma, Швеция), измеряющий концентрацию белка по поглощению УФ излучения с длиной волны 280 нм. Рекомбинантный белок 6xHis-PCNA элюируют 7 мл буфера В, содержащего 8М мочевину, 0,05М NaH2PO4, 0,01 М Трис-(гидроксиметил)-аминометан, 1M NaCl, рН 5.9.
Пример 2. Способы фиксации клеток для выявления белка PCNA в реакции непрямой иммунофлуоресценции
Монослойную культуру (HeLa) выращивают на покровных стеклах до достижения 70% конфлуентности. Клетки фиксируют, помещая в охлажденный (-18°С) метанол на 10 мин, высушивают на воздухе при комнатной температуре и помещают в PBS (140 мМ NaCl; 2,7 мМ KСl; 1,5 мМ KН2РO4 и 8,1 мМ Na2HPO4; рН 7.2-7.4) на 10 мин.
После фиксации клетки инкубируют с антителом Р56 (разведение супернатанта 1:20 в PBS) 1 ч при комнатной температуре, а затем с козьими антителами к иммуноглобулинам мыши, конъюгированными с флуорохромом Alexa Fluor 488 (Molecular Probes, США), 30 мин при комнатной температуре. Препараты заключают в Мовиол и изучают в микроскоп Axiovert 200 (Carl Zeiss, Германия), сопряженный с монохромной 13-битной камерой CoolSnapcf(Roper Scientific, США), используя объективы PlanNeoFluar ×40/ЧА 0.75 и PlanNeoFluar ×100/ЧА 1.25. Результаты представлены на фиг.2.
Пример 3. Способ получения суммарных лизатов клеток и выявления белка PCNA на иммуноблотах
5×106 клеток лизируют на льду в буфере, содержащем 50 mМ Трис-(гидроксиметил)-аминометана (рН 7.5), 150 mM NaCl, 10% глицерина, 0.5% Тритона Х-100 и коктейль протеазных ингибиторов (Sigma, США). Суммарную концентрацию белков в лизатах определяют по методу Лоури (модификация Петерсона) с помощью набора Protein Assay Kit (Sigma, США), следуя рекомендациям производителя.
Перед электрофоретическим разделением к приготовленным лизатам добавляют 5×-ный буфер Лэммли, содержащий 250 мМ Трис-(гидроксиметил)-аминометана (рН 6.8), 50% глицерина, 10% додецилсульфата натрия (ДСН), 500 мМ β-меркаптоэтанола, 0.5% бромфенолового синего. Образцы подвергают термической обработке при 100°С 5 мин. В каждый карман 12% полиакриламидного геля с ДСН (ПААГ-ДСН) наносят лизаты, содержащие не менее 50 мкг суммарного белка. Электрофоретическое разделение белков в ПААГ-ДСН проводят 30 мин при 60 В и 60 мин при 160 В для дальнейшего разделения в электрофорезной камере. Гель инкубируют в буфере для проведения полусухого электроблоттинга, содержащем 50 мМ Трис-(гидроксиметил)-аминометана, 38 мМ глицина, 0.1% ДСН и 20% метанола. Перенос белков на нитроцеллюлозную мембрану (0.22 мкм, Millipore, США) проводят при постоянном напряжении 20 В 30 мин. Мембрану инкубируют с антителами Р56 (разведение 1:200), а затем с антителами к иммуноглобулинам мыши, конъюгированными с пероксидазой хрена (разведение 1:2000, Sigma, США). Оба антитела разводят в буфере TBST, содержащем 20 мМ Трис-(гидроксиметил)-аминометана (рН 7.6), 150 мМ NaCl, 0.05% Твина-20. Мембрану проявляют методом хемилюминесценции, используя набор ECL+Plus (AmershamPharmaciaBiotech, Великобритания) согласно инструкции производителя. Проявитель рентгеновской пленки Hyperfilm (AmershamPharmaciaBiotech, США) содержит 7% метола и 7% гидрохинона, фиксаж - 25% Na2S2O3 и 2.5% Na2SO3. Результаты показаны на фиг.3.
Пример 4. Приготовление замороженных срезов для иммуногистохимического выявления белка PCNA
Иммуноцитохимическое исследование проводят на биопсийном и операционном материале, фиксированном 10%-ным нейтральным формалином, забуференным фосфатным буфером PBS, в течение 24 часов. После гистологической проводки материал заливают в парафин и затем готовят срезы толщиной 4 мкм. Срезы монтируют на специальные высокоадгезивные стекла (Dako, США) и высушивают в течение 18 часов при температуре 37°С.
Парафин далее удаляют со срезов в трех сменах ксилола, по 2 мин в каждой смене. Проводят срезы через спирты с объемной долей этанола 100% (абс), 100% (абс), 70% по 2 мин в каждом и промывают в дистиллированной воде.
Срезы инкубируют с антителами Р56 (разведение 1:50), а затем с антителами к иммуноглобулинам мыши, конъюгированными с пероксидазой хрена (разведение 1:2000, Sigma, США). Оба антитела разводят в буфере TBST.
Иммуноцитохимическое окрашивание среза биоптата ткани молочной железы человека с использованием МКА к белку PCNA человека выявляет пролиферирующие клетки, что свидетельствует о наличии онкопролиферативного заболевания (фиг.4).
Пример 5. Выделение сенсибилизированных лимфоцитов из селезенки мыши
Селезенку мыши, в крови которой присутствуют антитела к белку PCNA человека, выделяют и помещают в стерильных условиях в чашку Петри диаметром 100 мм, содержащую 10 мл среды RPMI 1640 (ПанЭко, Россия). Измельчают селезенку с помощью иглы (номер 19), закрепленной на шприце объемом 1 мл, до тех пор, пока большая часть лимфоцитов не перемещается в среду. Переносят лимфоциты вместе со средой в стерильную пробирку объемом 15 мл и оставляют взвесь на 2 мин при комнатной температуре. Аккуратно удаляют супернатант и переносят взвесь лимфоцитов в новую стерильную пробирку. Осаждают лимфоциты при 500g 5 мин. В результате выделяют около 5×107 лимфоцитов.
Пример 6. Слияние лимфоцитов селезенки с клетками миеломы мыши линии Р3Х63-Ag8.653
3×107 выделенных лимфоцитов дважды промывают центрифугированием при 500g в теплой (37°С) среде RPMI 1640 в течение 5 мин. 107 миеломных клеток линии Р3Х63-Ag8.653 суспендируют в 20 мл среды RPMI 1640 и промывают, как указано выше для лимфоцитов. Нагревают пробирку с 50%-ным стерильным раствором полиэтиленгликоля (ПЭГ) молекулярной массы 1450 (Hybri-MaxТМ, Sigma-Aldrich, США) при 37°С в водяной бане. Осадки клеток ресуспендируют в 5 мл среде RPMI 1640 и сливают в одну пробирку, центрифугируют при 800g 5 мин. Супернатант удаляют и к осадку по каплям добавляют 0.5 мл ПЭГ при постоянном перемешивании клеток. Добавляют 10 мл среды RPMI 1640 и центрифугируют при 500g 5 мин. Супернатант удаляют, а к осадку добавляют 20 мл ростовой среды RPMI 1640, содержащей 20% эмбриональной телячьей сыворотки ("HyClone", США), 2 мМ L-глутамина, по 100 ед./мл пенициллина и стрептомицина и селективные агенты - 0.1 мМ гипоксантина, 0.4 мкМ аминоптерина и 0.016 мМ тимидина. Клетки рассевают в ячейки 96-луночных плоскодонных планшетов из расчета 0.2×106 клеток на ячейку. Появление клонов оценивают с помощью инвертированного микроскопа Axiovert 200, используя фазово-контрастный объектив 10×.
Пример 7. Метод лимитирующих разведений
В каждую из лунок 96 луночного плоскодонного планшета добавляют по 100 мкл ростовой селективной среды (см. пример 5). Из ячейки с клоном, вырабатывающим антитела к белку PCNA, отбирают 100 мкл суспензии, переносят в крайнюю верхнюю левую ячейку и пипетируют. Из ячейки отбирают 100 мкл суспензии и добавляют к ячейке, расположенной под ней. Повторяют операцию 6 раз, в результате чего все ячейки в первом левом ряду будут содержать клетки. Затем с помощью 8-канальной пипетки производят те же операции в направлении от крайнего ряда вдоль планшета вправо. Появление клонов анализируют с помощью инвертированного микроскопа Axiovert 200, используя фазово-контрастный объектив 10×. Через 7 суток отмечают плашки, в которых присутствует только один клон. В результате отбирают клон, секретирующий моноклональное антитело, выявляющее белок PCNA в клетках HeLa в реакции непрямой иммунофлуоресценции и на иммуноблотах, а также в злокачественно трансформированных клетках молочной железы человека с помощью иммуноцитохимической реакции. Клетки положительного клона четырехкратно клонируют методом лимитирующих разведений и выводят в массовую культуру по стандартной методике.

Изобретение относится к биотехнологии, биологии и медицине. Описана мышиная гибридома Р56, коллекционный номер ВКПМ Н-107, - продуцент моноклонального антитела, выявляющего ядерный антиген пролиферирующих клеток человека PCNA методами иммуноцитохимии, иммуногистохимии, иммуноблотирования и иммуноферментного анализа, полученная путем иммунизации мышей линии Balb/c полноразмерным рекомбинантным белком PCNA человека, экспрессированным в E.coli, слитым с шестью остатками гистидина в N-концевой области молекулы, и слиянием сенсибилизированных лимфоцитов селезенки иммунизированных мышей с клетками мышиной миеломы линии P3X63-Ag8.653 с помощью 50%-ного раствора полиэтиленгликоля с молекулярной массой 1450. Полученная гибридома секретирует моноклональное антитело (названо "Р56"), специфичное к белку PCNA человека вне зависимости от тканевого или линейного происхождения клеток. Изобретение позволяет специфически выявлять ядерный антиген пролиферирующих клеток человека PCNA иммуноферментным методом. 4 ил.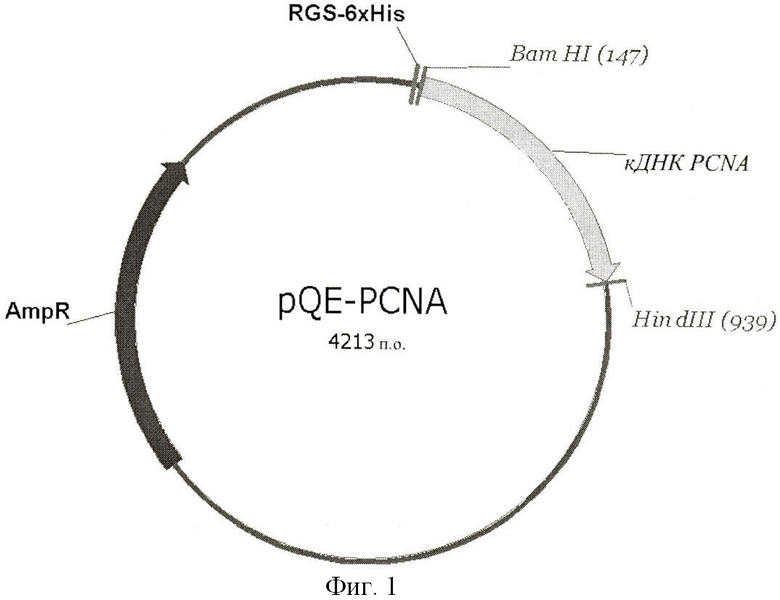
Мышиная гибридома Р56, коллекционный номер ВКПМ Н-107 - продуцент моноклонального антитела, выявляющего ядерный антиген пролиферирующих клеток человека PCNA методами иммуноцитохимии, иммуногистохимии, иммуноблотирования и иммуноферментного анализа, полученная путем иммунизации мышей линии Balb/c полноразмерным рекомбинантным белком PCNA человека, экспрессированным в E.coli, слитым с шестью остатками гистидина в N-концевой области молекулы, и слиянием сенсибилизированных лимфоцитов селезенки иммунизированных мышей с клетками мышиной миеломы линии Р3Х63-Ag8.653 с помощью 50%-ного раствора полиэтиленгликоля с молекулярной массой 1450.
| Tachibana Т et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Hybridoma (Larchmt), 2010 Apr; 29(2):169-71 | |||
| РЫБАЛЬСКИЙ Н.Г., СЕРОВА М.А., ИГНАТЬЕВА Г.А., СТАРЧЕУС А.П | |||
| Моноклональные антитела и гибридомы | |||
| - М.: ВАСХНИЛ, 1989. | |||
Авторы
Даты
2011-12-10—Публикация
2010-10-25—Подача