Мышиная гибридома YKL-39, клон 1B2 G4 - продуцент моноклонального антитела, обладающего специфичностью к хитиназоподобному белку YKL-39 человека.
Изобретение относится к биотехнологии, биологии и медицине и предназначено для выявления цитоплазматического белка человека YKL-39 (CHI3L2) в плазме крови онкологических больных методом ИФА, в неопластических клетках и клеточных линиях глиобластомы и др. тканей иммуноцитохимическим, иммуногистохимическим и иммунофлуоресцентным методами, а также методом иммуноблоттинга для научно-исследовательских и клинико-лабораторных целей.
На сегодняшний день антитела являются мощным инструментом для изучения фундаментальных вопросов, направленных на выяснение функций белков человека в норме и при патологиях.
Проблема диагностики, в том числе ранней, онкологических заболеваний, основанная на анализе крови является актуальной последние 20 лет. В качестве маркеров для диагностики используются белки, нуклеиновые кислоты, везикулы, секретируемые опухолевыми клетками и сами опухолевые клетки. Такая диагностика проводится методом иммуноферментного анализа и позволяет выявлять заболевания на начальной стадии. Стандартные иммуноцитохимические методы анализа, с использованием антител к известным белкам-маркерам биоптата опухоли позволяют классифицировать тип новообразований и оценить степень их злокачественности (М.А. Пальцев, Н.М. Аничков. Патологическая анатомия. - М.: Медицина, 2001). Иммуногистохимическая окраска моноклональными антителами высокоспецифичных клеточных белков в сочетании с иммунопероксидазным методом позволяет не только оценивать опухоли низкой степени дифференцировки, опухоли неизвестного происхождения, более точно различать опухоли различного тканевого происхождения (Клиническая онкология: учебное пособие / под ред. П.Г. Брюсова, П.Н. Зубаревой. – СПб.: СпецЛит, 2012. – 455 с.: ил.), но и позволяет выбрать соответствующие методы лечения.
Хитиназоподобные белки у млекопитающих — белки, образующиеся в зоне воспаления и опухолевого роста. В последнее время отдельные представители семейства изучаются как потенциальные биомаркеры различных заболеваний человека, в том числе солидных опухолей (глиомы, рака предстательной железы и яичников). На сегодняшний̆ день не существует клинически релевантного и доступного метода определения концентраций этих биомаркеров в циркулирующей крови. Одним из охарактеризованных белков является YKL-39. YKL-39, также известный как хитиназа-3-подобный белок 2 (CHI3L2), представляет собой секреторный белок хондроцитов, принадлежащих к семейству гликозилгидролазы 18. Его самая высокая экспрессия наблюдается в хондроцитах, синовиоцитах, легких и сердце, а также макрофагах. На сегодняшний день он может считаться маркером остеоартрита в синовиальной жидкости и сыворотки крови (Hu, B., Trinh, K., Figueira, W. F. and Price, P. A. (1996). Isolation and sequence of a novel human chondrocyte protein related to mammalian members of the chitinase protein family. J Biol Chem 271, 19415-19420; Steck, E., Breit, S., Breusch, S. J., Axt, M. and Richter, W. (2002). Enhanced expression of the human chitinase 3-like 2 gene (YKL-39) but not chitinase 3-like 1 gene (YKL-40) in osteoarthritic cartilage. Biochem Biophys Res Commun 299, 109-115; Knorr, T., Obermayr, F., Bartnik, E., Zien, A. and Aigner, T. (2003). YKL-39 (chitinase 3- like protein 2), but not YKL-40 (chitinase 3-like protein 1), is up regulated in osteoarthritic chondrocytes. Ann Rheum Dis 62, 995-998). Он не обнаруживается в селезенке, поджелудочной железе и печени. YKL-39 также может экспрессироваться в развивающемся мозге и плаценте. Также повышенный уровень экспрессии гена YKL-39 показан у пациентов с болезнью Альцгеймера и в глиобласомах (Colton, C. A., Mott, R. T., Sharpe, H., Xu, Q., Van Nostrand, W. E. and Vitek, M. P. (2006). Expression profiles for macrophage alternative activation genes in AD and in mouse models of AD. J Neuroinflammation 3, 27). Какую функциональную роль может выполняет данный белок в глиобластомах на данный момент не известно, однако предполагается, что он может отвечать за пролиферативную способность клеток и ремоделирование внеклеточного матрикса (Miyatake, K., Tsuji, K., Yamaga, M., Yamada, J., Matsukura, Y., Abula, K., Sekiya, I. and Muneta, T. (2013). Human YKL39 (chitinase 3-like protein 2), an osteoarthritis- associated gene, enhances proliferation and type II collagen expression in ATDC5 cells. Biochem Biophys Res Commun 431, 52-57). За счет того, что данный белок секретируем, на него возлагают надежды как на потенциальный маркер глиобластом. Существуют публикации, в которых показано, что внесение хитиназоподобных белков в панель маркеров различных тестов приводит к повышению как чувствительности, так и специфичности тестов. Данная характеристика хитиназоподобных белков существенно расширяет их область применения.
Для выявления белка YKL-39 у человека на сегодняшний день существует несколько доступных коммерческих как поликлональных, так и моноклональных антител. Известные мышиные и кроличьи гибридомы, продуцирующие моноклональные антитела к цитоплазматическому антигену YKL-39 человека, были получены при иммунизации животных как полноразмерным рекомбинантным белком YKL-39 человека, так и различными рекомбинантными и синтетическими полипептидными участками белка YKL-39 человека. К недостаткам описанных клонов относятся дороговизна моноклональных антител, продуцируемых данными гибридомами, ввиду их зарубежного происхождения, а также отсутствие для некоторых из них данных о тестировании в реакциях иммуногистохимии, иммунофлуоресценции, использующихся в ежедневной клинико-диагностической практике, а также иммуноблоттинге.
Задачей изобретения является расширение ассортимента моноклональных антител, обладающих специфичностью к белку YKL-39 человека, использующихся для иммунодиагностики и прогностической оценки течения опухолевых заболеваний у человека.
Поставленная задача решается за счет мышиной гибридомы YKL-39, клон 1B2 G4 - продуцента моноклонального антитела, выявляющего YKL-39 методами иммуноферментного анализа, иммуноцитохимии, иммуногистохимии, иммунофлуоресценции и иммуноблоттинга, полученной путем иммунизации мышей линии Balb/c рекомбинантным полноразмерным белком, и слиянием сенсибилизированных спленоцитов иммунизированных мышей с клетками мышиной миеломы линии sp2/0 с помощью полиэтиленгликоля с молекулярной массой 1500.
Продуцируемые гибридомой 1B2 G4 моноклональные антитела к белку YKL-39 человека обладают селективной способностью связывать белок YKL-39 человека в иммуноферментном анализе (Таб.1), на иммуноблотах (Фиг.4), на клеточном (Фиг.2, Фиг.3) и тканевом уровнях (на парафиновых срезах) (Фиг.1), и расширяют существующий доступный ассортимент моноклональных антител к белку YKL-39. Также следует отметить, что каждая вновь полученная гибридома уникальна. Моноклональные антитела, продуцируемые разными гибридомами, различаются по своей первичной структуре, по специфичности к различным антигенным детерминантам, аффинности и другим свойствам. Поэтому получение как можно большего количества моноклональных антител к белку YKL-39 человека важно с научной и практической точки зрения.
Технический результат изобретения заключается в получении линии гибридом мыши 1B2 G4, продуцирующей доступные для отечественных клинико-диагностических лабораторий моноклональные антитела к цитоплазматическому антигену YKL-39 человека, пригодных для иммуноферментного анализа, иммуноцитохимии, иммуногистохимии, иммуноблоттинга и иммунофлуоресценции, и позволяющие использоваться для диагностики глиобластом.
Мышиную гибридому YKL-39, клон 1B2 G4 получали следующим образом:
Для получения бактериального штамма, экспрессирующего рекомбинантный белок YKL-39, его кодирующая последовательность была заклонирована в вектор pET45b(+). Ген YKL-39 человека (нуклеотидная последовательность кДНК YKL-39 человека доступны в базе данных GeneBank по адресу http://www.ncbi.nlm.nih.gov/genbank/ с порядковым номером NM_004000.2) амплифицируют на матрице кДНК, полученной из мРНК клеток линии LN229 с использованием ген-специфических праймеров (YKL-39 F3006 Xho ACTTCTCGAGACCATGGGAGCAACCACC, YKL-39 R3006 Hind TAGAAAGCTTCAAGGAGCCAAGGCTTC, встроенные сайты эндонуклеаз рестрикции XhoI/HindIII). Амплифицированные фрагменты ДНК очищали и клонировали в вектор pET45b(+) по сайтам, созданным эндонуклеазами рестрикции. В результате была получена плазмида, несущая ген белка YKL-39 человека. Плазмиду тестировали на наличие нуклеотидных замен методом автоматического секвенирования ДНК. Компетентные клетки E. coli штамм BL21 DE3 химически трансформировали полученной плазмидой pET45b(+)-YKL-39, высевали на чашки с LB-агаром, содержащим 100 мкг/мл ампициллина, и инкубировали при 37°С в течение 16 ч. Далее в 50 мл среды LB переносили единичную колонию и наращивали при 37°С в течение 16 ч при постоянном перемешивании. Далее из ночной культуры экспрессию белков в бактериях E.coli BL21 DE3 стимулировали с помощью IPTG в конечной концентрации 1мМ в течение 4-5 часов при 37ºC. По истечении времени стимуляции клетки бактерий были лизированы, сонифицированы с помощью ультразвука и подвержены процедуре очистки.
На первой стадии тельца включения экстрагировались 5М мочевиной в PBST в течение 1 часа при комнатной температуре. При этом не происходило растворения целевых белков, однако отделялось множество примесей и наблюдалось значительное уменьшение массы осадка телец включения.
На второй стадии для лизиса телец включения был использован буфер следующего состава: (Аргинин – 0.5 М, Мочевина – 6 М, Трис – 20 мМ, рН 10.0, Дитиотреитол – 50 мМ, ЭДТА – 5 мМ, Глицин 10 мМ). Лизис осуществляли в течение 12 часов при +4°С. Раствор центрифугировали при 10 000 об/мин в течение 5 минут при +4°С. Если оставался осадок, его повторно экстрагировали ½ объема лизирующего буфера с последующем центрифугированием и объединением супернатантов. Рефолдинг белков проводили путем перевода гельфильтрацией на колонке Сефадекса G-25 в буфер следующего состава с последующей инкубацией в течение 12-36 часов при 4°С: (NaCL – 0.5 М, Мочевина 4 (1) М*, Аргинин – 0.5 (0.05) М*, ЭДТА – 1 мМ, Цистеамин – 10 мМ, Имидазол – 2 мМ, PBST – до 50 мл. *- начальные значения (в скобках) по результатам эксперимента были корректированы в сторону увеличения)). Дальнейшую очистку белков производили метал-хелатной хроматографией (IMAC) на колонке IMAC Sepharose 6 Fast Flow (GEHealthCare, 17-0921-08). Для этого белки переводили гельфильтрацией на колонке Сефадекса G-25 в IMAC-буфер следующего состава: (NaCL – 0.5 М, Мочевина – 1М, Имидазол – 5 мМ, Аргинин – 50 мМ, PBST – до 50 мл). Белок наносили на колонку IMAC Sepharose 6 Fast Flow, уравновешенную буфером, приведенного выше состава. Колонку промывали ступенчатым градиентом концентрации имидазола. Было установлено, что до концентрации имидазола 20 мМ видимой элюции целевого белка не происходит. Эффективная элюция белка YKL-39 с минимальными примесями происходит при 75 мМ имидазола. Полученный в результате процедуры очистки белок YKL-39 был использован в качестве антигена для дальнейшей иммунизации мышей.
Первичную иммунизацию проводили мышам Balb/c (самкам, 18 гр), вводя около 30 мкг антигена (рекомбинантный белок Ykl-39) с полным адъювантом Фрейнда (1:1) в лапы и в холку. Бустирование антигеном с неполным адъювантом Фрейнда проводили через две недели после первичной иммунизации. Гибридизацию (слияние) спленоцитов мышей с клеточной линией Sp 2/0 делали через 3 дня (на 4-й день) после бустирования с помощью PEG 1500. В среду для посадки гибридом (RPMI-1640 с 15% FetalClone I) добавляли HAT в соответствии с рекомендациями производителя. Полученные гибридомы были рассажены на три 96-луночные планшета по 150 мкл суспензии в лунку и оставлены на 10 дней после чего были протестированы методом ИФА. В результате тестирования отобран 21 клон, хорошо связывающий антиген. Проведено первое клонирование для всех клонов. По результатам ИФА на взаимодействие с полноразмерным рекомбинантным Ykl-39 отсажено по 3 субклона для 21 клона, а затем отобраны сильные субклоны. В результате отобрано и заморожено 19 клонов. В качестве дополнительных ИФА-тестов были тесты на взаимодействие с неконсервативными последовательностями (NCR) YKL-39, YKL-40, SI-CLP, c N и C-концевыми частями YKL-39, с полноразмерным YKL-40, пептидом 2 YKL-39 (226-241), пептидом 4 SI-CLP (259-276). По результатам ИФА-тестов, показывающих взаимодействие антител с другими антигенами было отобрано для наработки антител и заморозки 4 финальных клона: 1A12A4, 1C12A4, 1D1A1, 1B2G4 (Таб. 1).
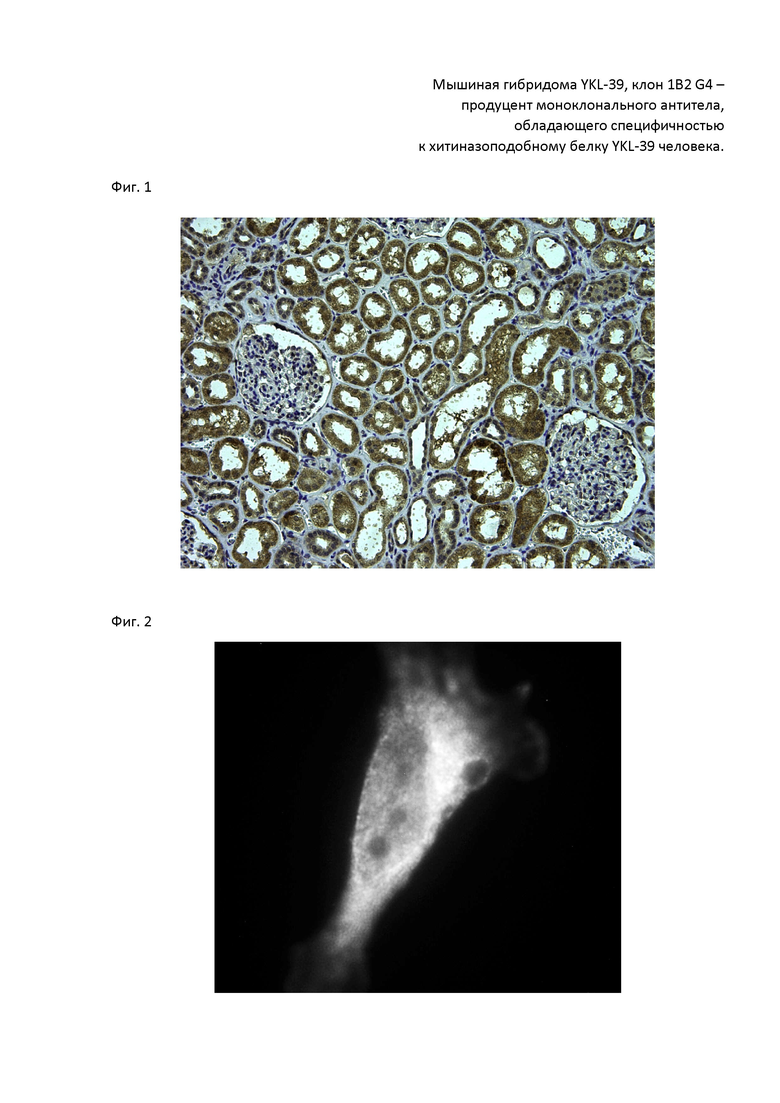
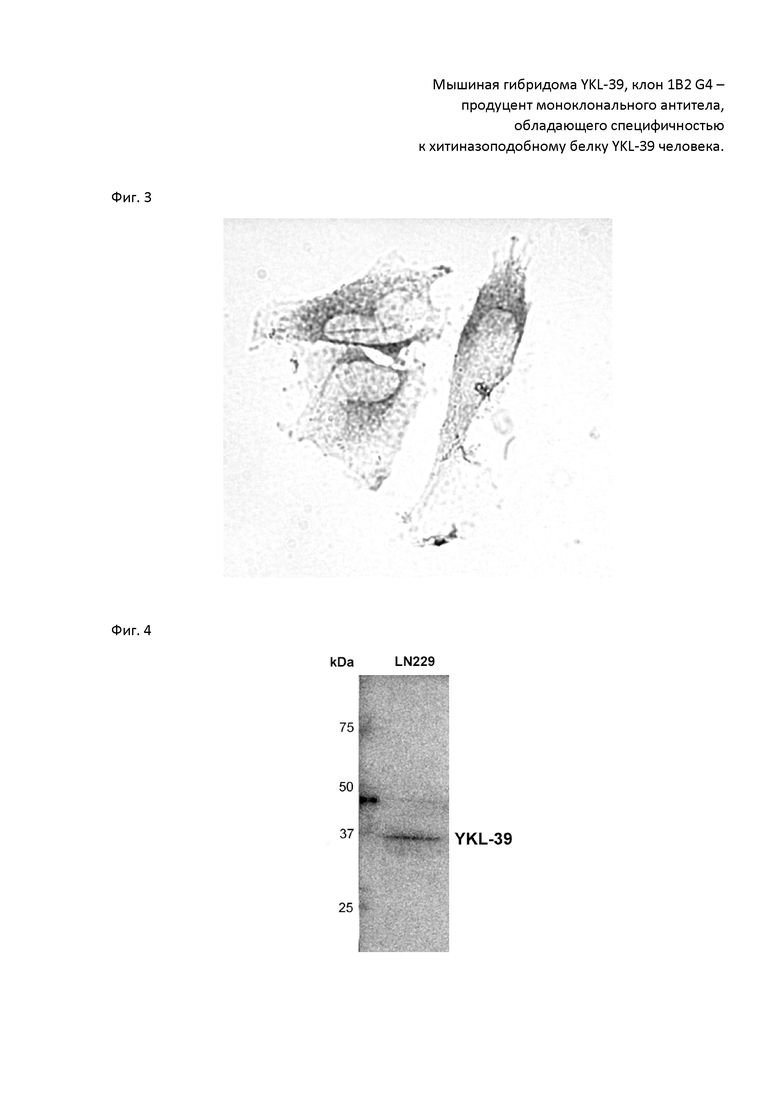
Затем отобранные по ИФА антитела тестировали методом иммуноцитохимии и иммунофлуоресценции. Антиетела всех 4 клонов протестировали на клетках культуры LN229. Только одни антитела показали четкое связывание с антигеном YKL-39 в клетках в виде гранул в цитоплазме – клон 1B2 G4 (Фиг. 2, 3).
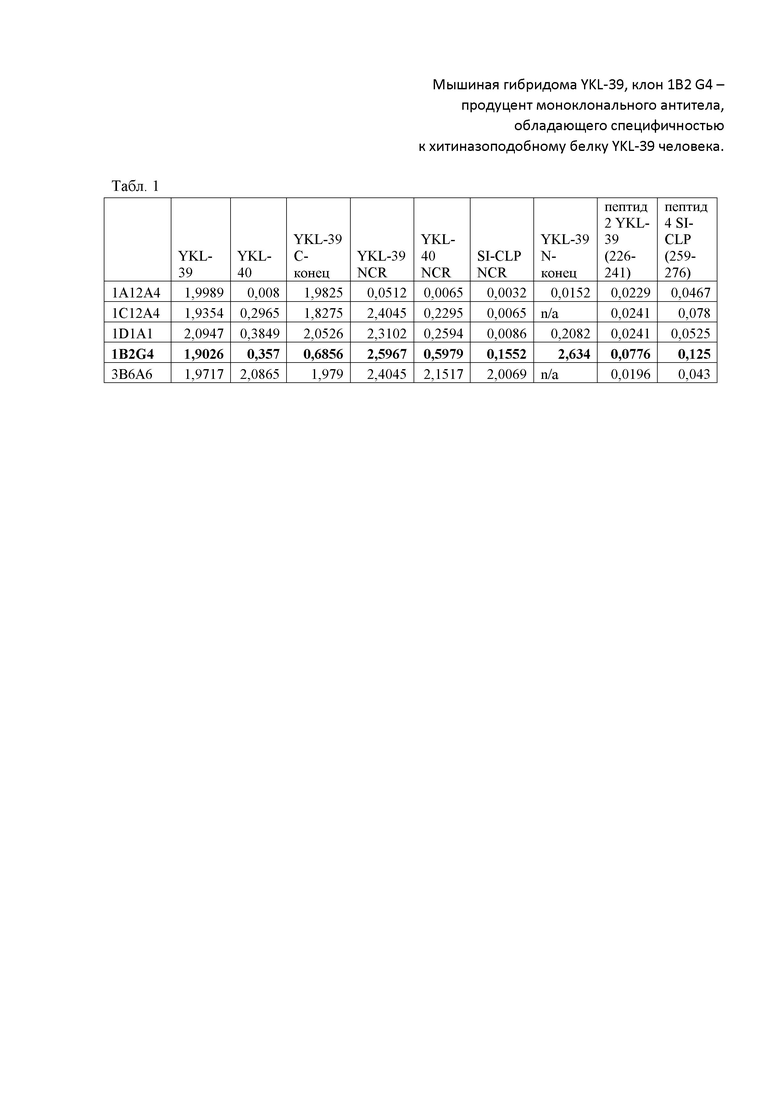
Антитела к белку YKL-39, клон 1B2 G4 тестировали методом иммуногистохимии на срезах нормальной почки (Фиг. 1). Наблюдалась четкая цитоплазматическая окраска клеток почечных канальцев.
Дополнительно был проведен иммуноблоттинг (Фиг. 4) для проверки антител на тотальных лизатах клеточной линии глиобластомы LN229 и показано, что антитела к Ykl-39, клон 1B2 G4 связывают белок Ykl-39.
Таким образом антитела, продуцируемые гибридомой Ykl-39, клон 1B2 G4, тестировали методами иммуноферментного анализа, иммуноцитохимии, непрямой иммунофлуоресценции, иммуноблоттинга на тотальных лизатах клеточной линии LN229, содержащей белок YKL-39. Антитела связываются с полноразмерным белком Ykl-39, c неконсервативной последовательностью Ykl-39, c N-концевой последовательностью Ykl-39, специфически работают в иммуноцитохимии на клетках LN229, иммуногистохимии на тканях почки и иммуноблоттинге на тотальных лизатах LN229.
Мышиная гибридома YKL-39, клон 1B2 G4 - продуцент моноклонального антитела YKL-39 - имеет следующие характеристики:
Морфологические признаки: Культура имеет вид суспензии, где клетки собраны в конгломераты и слабо прикрепляются к субстрату.
Условия рутинного культивирования клеток гибридомы YKL-39, клон 1B2 G4: Среда для культивирования – RPMI-1640 («HyClone», США), 7,5% эмбриональной телячьей сыворотки FetalClone 1 («HyClone», США), 4 мМ L-глутамина, 100 мкг/мл гентамицина. Условия культивирования: 37°C, абсолютная влажность и 5% СО2 в атмосфере. Частота пассирования - каждые 3-4 суток, кратность рассева 1:5-1:10.
Способ криоконсервирования клеток гибридомы YKL-39, клон 1B2 G4. В суспензию клеток в кондиционированной среде добавляют 7-10% ДМСО («ПанЭко», Россия). Криопробирки с суспензией клеток перемешивают и помещают на сутки в холодильник на -80°С, затем переносят в жидкий азот для длительного хранения. Жизнеспособность клеток после размораживания 80%. После размораживания клетки культивируют при плотности 0.2-0.3·106 кл/мл.
Бактерии, грибы, дрожжи и микоплазма в культуре не обнаружены.
Изотип моноклонального антитела YKL-39, клон 1B2 G4: моноклональное антитело, секретируемое гибридомой 1B2 G4, относится к иммуноглобулинам класса IgG2b.
Специфичность моноклонального антитела YKL-39, клон 1B2 G4. Моноклональное антитело выявляет белок YKL-39 в тканях почки человека (Фиг.1), в ряде клеточных линий разного тканевого происхождения, например, в линии LN229 (глиобластома) (Фиг.2, 3). Антитело 1B2 G4 также узнает рекомбинантный YKL-39 в тотальных клеточных лизатах клеточной линии глиобластомы LN229 на иммуноблотах (Фиг.4).
Оптимальные разведения антител YKL-39, клон 1B2 G4, определяемые в супернатанте методом иммуногистохимии – 1:1, методом непрямой иммунофлуоресценции - 1:2, методом иммуноблотов - 1:2.
Продуцируемое гибридомой 1B2 G4 моноклональное антитело рекомендуется для специфического выявления антигена YKL-39 в крови и прочих жидкостях методом иммуноферментного анализа, в тканях, содержащих данный антиген – методом иммуногистохимии, а также в цитоплазме неопластических клеток глиобластомы человека методами иммуноцитохимии, иммунофлуоресценции, иммуноблоттинга.
Изобретение иллюстрируют следующие фотографии и таблица:
Табл. 1. ИФА, показывающий связывание антител к Ykl-39, клон 1B2 G4 помимо полноразмерного Ykl-39 с различными антигенами: неконсервативными последовательностями (NCR) YKL-39, YKL-40, SI-CLP, c N и C-концевыми частями YKL-39, с полноразмерным YKL-40, пептидом 2 YKL-39 (226-241), пептидом 4 SI-CLP (259-276).
Фиг. 1. Специфичность антитела YKL-39, клон 1B2 G4, продуцируемого гибридомой 1B2 G4, к белку YKL-39 в клетках почки, выявляемая методом иммуногистохимии. Для детекции связавшихся с антигеном антител, были использованы вторичные антитела к иммуноглобулинам мыши, конъюгированные с полимерной пероксидазой хрена (ПраймБиоМед, Россия) и субстрат ДАБ, как описано в Примере 1. Специфическая гранулярная окраска цитоплазмы клеток канальцев на парафиновом срезе ткани, фиксированном формалином, свидетельствует о наличии клеток, экспрессирующих YKL-39.
Фиг. 2. Специфичность антитела, продуцируемого гибридомой 1B2 G4, к белку YKL-39 в клетках человека линии LN229, выявляемая методом иммунофлуоресценции. Стрелками обозначен окрашенный антителом 1B2 G4 YKL-39, располагающийся в везикулах эпителиальных клеток линии LN229. Для выявления связавшихся с антигеном антител использовались вторичные антитела к иммуноглобулинам мыши, конъюгированные с флуорохромом Alexa Fluor 488 (Molecular Probes, США), как описано в Примере 2.
Фиг.3. Специфичность антитела, продуцируемого гибридомой YKL-39, клон 1B2 G4, к белку YKL-39 в клетках человека линии LN229, выявляемая методом иммуноцитохимии. Темные точки представляют собой окрашенный антителом антиген YKL-39, располагающийся в везикулах клеток линии LN229. Для выявления связавшихся с антигеном антител использовались вторичные антитела к иммуноглобулинам мыши, конъюгированные с полимерной пероксидазой хрена (ПраймБиоМед, Россия) и субстрат ДАБ как описано в Примере 2.
Фиг. 4. Специфичность антитела, продуцируемого гибридомой YKL-39, клон 1B2 G4, к белку YKL-39 на тотальных лизатах клеточной линии глиобластомы LN229 выявляется на иммуноблотах. Связывание белка YKL-39 антителом 1B2 G4 после переноса белков на мембрану. Белковые лизаты приготовлены, а мембрана проявлена, как описано в Примере 3. Электрофоретическая подвижность белка соответствует расчетной.
Изобретение иллюстрируют следующие примеры:
Пример 1. Приготовление срезов для иммуногистохимического выявления белка YKL-39.
Иммуногистохимическое исследование проводят на операционном материале, фиксированном 10%-ным нейтральным формалином, забуференным фосфатным буфером, в течение 24 часов. После гистологической проводки материал заливают в парафин и затем готовят срезы толщиной 2-4 мкм. Срезы монтируют на специальные высокоадгезивные стекла (SuperFrost Plus, ApexLab) и высушивают в течение 18 часов при температуре 37°С.
Парафин далее удаляют со срезов в трех сменах ксилола, по 10 мин в каждой смене. Проводят срезы через спирты с объемной долей изопропанола 100% (I), 100% (II), 70%, 50% по 5 мин в каждом и промывают в дистиллированной воде. Блокировка эндогенной пероксидазы проводится в 3% перекиси водорода 10 минут. Срезы инкубируют с антителами YKL-39, клон 1B2 G4, а затем с антителами к иммуноглобулинам мыши, конъюгированными с полимерной пероксидазой хрена (ПраймБиоМед, Россия). Окрашивание проявляется при добавлении субстрата ДАБ хромогена на 5-10 минут (ПраймБиоМед, Россия). Результат представлен на Фиг.1.
Пример 2. Способы фиксации клеток для выявления белка YKL-39 в реакции непрямой иммунофлуоресценции и иммуноцитохимии.
Культуру LN229 выращивают на покровных стеклах до достижения 30% конфлуентности. Клетки фиксируют, помещая в 3,7% параформальдегид на 15 мин, с последующей промывкой в PBS (ПанЭко, Россия) на 10 мин. После фиксации и промывок клетки инкубируют с антителом YKL-39, клон 1B2 G4 1 ч при комнатной температуре, а затем с козьими антителами к иммуноглобулинам мыши, конъюгированными с флуорохромом Alexa488 (JacksonImmunoresearch, США), или полимерной пероксидазой хрена (ПраймБиоМед, Россия) 40 или 15 мин, соответственно, при комнатной температуре. Для визуализации окрашивания в нефлуоресцентном методе добавляют субстрат ДАБ хромоген на 5-10 минут (ПраймБиоМед, Россия) Препараты заключают в среду для заключения на водной основе и изучают в микроскоп Olympus BX53 (Cheminst, Германия), сопряженный с 2 мп камерой Infinity 2 (Lumenera, США), используя объективы U PlanFL N Ч40/ЧА 0.75 и U PlanFL N Ч100/ЧА 1.30. Для иммунофлуоресценции используются фильтры, U-FUNA и U-FGNA (Olympus, Япония). Результаты представлены на Фиг. 2 и 3.
Пример 3. Способ получения тотальных клеточных лизатов и выявления нативного белка YKL-39 методом иммуноблоттинга.
5Ч105 клеток линии LN229 лизируют на льду в буфере, содержащем 50 mМ Трис-(гидроксиметил)-аминометана (рН 7.5), 150 mM NaCl, 10% глицерина, 0.5% Тритона Х-100 и коктейль протеазных ингибиторов (Roche, США). Суммарную концентрацию белков в лизатах определяют по методу Бредфорд с помощью Protein Assay Kit (Bio-Rad, США), следуя рекомендациям производителя.
Перед электрофоретическим разделением к приготовленным лизатам добавляют 5Ч-ный буфер Лэммли, содержащий 250 мМ Трис-(гидроксиметил)-аминометана (рН 6.8), 50% глицерина, 10% додецилсульфата натрия (ДСН), 500 мМ бета-меркаптоэтанола, 0.5% бромфенолового синего. Образцы подвергают термической обработке при 95°С 5 мин. В каждую лунку 10% полиакриламидного геля с ДСН (ПААГ-ДСН) наносят лизаты, содержащие не менее 15 мкг суммарного белка. Электрофоретическое разделение белков в ПААГ-ДСН проводят 30 мин при 60 В и 60 мин при 120 В для дальнейшего разделения в электрофорезной камере. Далее гель инкубируют в буфере для проведения блоттинга, содержащем 50 мМ Трис-(гидроксиметил)-аминометана, 38 мМ глицина, 0.1% ДСН и 20% метанола. Перенос белков на нитроцеллюлозную мембрану (0.22 мкм, Millipore, США) проводят при постоянной силе тока 250 мА 60 мин. Мембрану блокируют 5% молоком (Bio-Rad, США) 1 час, инкубируют с антителами YKL-39, клон 1B2 G4 (ночь при +4°С), а затем с антителами к иммуноглобулинам мыши, конъюгированными с пероксидазой хрена (разведение 1:5000, Abcam, США) -1 час. Сухое молоко (Bio-Rad, США) и антитела разводят в буфере TBST, содержащем 20 мМ Трис-(гидроксиметил)-аминометана (рН 7.6), 150 мМ NaCl, 0.05% Твина-20. Мембрану проявляют методом хемилюминесценции, используя набор ECL+Plus (Millipore, Великобритания) согласно инструкции производителя. Хемилюминесцентную реакцию регистрируют на приборе ChemiDoc MP (Bio-Rad, UK) с последующей обработкой с помощью программы ChemiDoc XRS+ imaging systems. Результаты представлены на Фиг.4.
| название | год | авторы | номер документа |
|---|---|---|---|
| Мышиная гибридома YKL-40, клон 2G8 C10 - продуцент моноклонального антитела, обладающего специфичностью к цитоплазмотическим антигенам YKL-39, YKL-40 и SI-CLP человека | 2019 |
|
RU2728228C1 |
| Мышиная гибридома SI-CLP, клон 3D4 - продуцент моноклонального антитела, обладающего специфичностью к белку SI-CLP | 2019 |
|
RU2714685C1 |
| Мышиная гибридома PU.1, клон 4G6 - продуцент моноклонального антитела, обладающего специфичностью к белку PU.1 человека | 2022 |
|
RU2788714C1 |
| Мышиная гибридома AMACR, клон G8 - продуцент моноклонального антитела, обладающего специфичностью к альфа-метилацил-коэнзим A рацемазе (AMACR) человека | 2016 |
|
RU2636042C1 |
| МЫШИНАЯ ГИБРИДОМА Р56 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА, ОБЛАДАЮЩЕГО СПЕЦИФИЧНОСТЬЮ К ЯДЕРНОМУ АНТИГЕНУ ПРОЛИФЕРИРУЮЩИХ КЛЕТОК PCNA ЧЕЛОВЕКА | 2010 |
|
RU2435850C1 |
| МЫШИНАЯ ГИБРИДОМА S148 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА К БЕЛКУ ЯДРЫШКА SURF-6 МЛЕКОПИТАЮЩИХ | 2010 |
|
RU2421514C1 |
| МЫШИНАЯ ГИБРИДОМА S79 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНОГО АНТИТЕЛА, ОБЛАДАЮЩЕГО СПЕЦИФИЧНОСТЬЮ К БЕЛКУ ЯДРЫШКА SURF-6 ЧЕЛОВЕКА | 2010 |
|
RU2422516C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ХИТИНАЗО-ПОДОБНОГО БЕЛКА YKL-40 В БИОПТАТАХ И ЭКСКРЕТАХ ЧЕЛОВЕКА | 2009 |
|
RU2423707C2 |
| Штамм гибридных клеток животных Mus musculus 1F1 - продуцент моноклонального антитела к нуклеокапсидному белку N вируса SARS-CoV-2 | 2021 |
|
RU2769817C1 |
| ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК МЫШИНОЙ ГИБРИДОМЫ А3, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ К АНТИГЕНУ ЯДРЫШЕК КЛЕТОК ЧЕЛОВЕКА | 2005 |
|
RU2296159C2 |
Изобретение относится к области биохимии, в частности к мышиной гибридоме YKL-39, клону 1B2 G4. Изобретение позволяет продуцировать моноклональное антитело иммуноглобулина класса IgG2b. 4 ил., 1 табл., 3 пр.
Мышиная гибридома YKL-39, клон 1B2 G4 – продуцент моноклонального антитела, узнающего белок Ykl-39 методом иммуноферментного анализа, а также в неопластических клетках глиобластомы и в клетках других органов, содержащих данный антиген, методами иммуноцитохимии, иммуногистохимии, иммуноблотирования и иммунофлуоресценции, полученная путем иммунизации мышей линии Balb/c полноразмерным рекомбинантным белком YKL-39 человека и слиянием сенсибилизированных спленоцитов иммунизированных мышей с клетками мышиной миеломы линии sp2/0 с помощью 50%-ного раствора полиэтиленгликоля с молекулярной массой 1500.
| RANOK A | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для обрезывания караваев теста | 1921 |
|
SU317A1 |
| US 20070122413 A1 от 31.05.2007 | |||
| ЧЕРНОШЕЙ Д.А | |||
| и др | |||
| Методы иммуноанализа, основанные на применении меченых компонентов, учебно-методическое пособие, Минск, 2007, БГМУ, 28 с | |||
| НОВЫЕ ПЕПТИДЫ ДЛЯ ПРИМЕНЕНИЯ В ИММУНОТЕРАПИИ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 1999 |
|
RU2233290C2 |
Авторы
Даты
2018-09-19—Публикация
2017-06-28—Подача