Изобретение относится к биотехнологии, в частности к генной и белковой инженерии. Оно может быть использовано для получения рекомбинантного [Leu1, Thr2]-63-десульфатогирудина-1, лекарственного препарата, используемого для предотвращения гиперкоагуляции крови.
Повышенная склонность крови к свертыванию в кровяном русле и последующее тромбообразование являются причиной многих заболеваний и патологических состояний, главные из которых - инсульт и инфаркт миокарда. Так, именно тромбоз коронарных сосудов вызывает инфаркт миокарда, тромбоз сосудов головного мозга приводит к тромботическому инсульту. Все тяжелые инфекции, сепсис приводят к гиперкоагуляции, которая требует применения препаратов, тормозящих свертывание крови. Венозные тромбоэмболии, коронарные и церебральные тромбозы, облитерации артерий нижних конечностей, развитие которых чаще всего обусловлено гематогенными тромбофилиями, прочно занимают во всех цивилизованных странах первое место среди причин смертности и инвалидизации больных. В отличие от традиционного антикоагулянтого препарата гепарин, гирудин не нейтрализуются гепариназой, белками плазмы, фибрин-мономером, макрофагами и эндотелиальными клетками и не зависят от уровня антитромбина-III. Гирудин активно подавляет функцию тромбина, связанного с тромбом. Он не вызывает тромбоцитопению, обладает слабовыраженными иммуногенными свойствами, не оказывает гепатотоксического действия и не повышает сосудистую проницаемость.
Гирудин относится к группе изоингибиторов тромбина прямого действия, секретируемых медицинской пиявкой Hirudo medicinalis и издавна использующихся в медицинской практике благодаря их антикоагулянтной активности (Dodt J., Muller H.-P., Seemuller U., Chang J.Y. // FEBS Lett., 1984, V.165, P.180-184). Основная биологическая функция гирудина заключается в предотвращении свертывания крови за счет нейтрализации коагулирующей активности тромбина при образовании комплекса тромбин-гирудин.
Природные гирудины представляют собой близкородственные полипептиды, содержащие 64-66 аминокислотных остатков. Рекомбинантный гирудин отличается от природной формы гирудина-1 заменой двух первых аминокислот и отсутствием сульфатирования по аминокислотному остатку Tyr-63. Отсутствие сульфатной группы несколько снижает антикоагулянтную активность ингибитора. Биосинтез сульфогирудина в E.coli может быть осуществлен при использовании пары аминоацил-тРНК-синтетазы и тРНК, специфичной для сульфотирозина (C.C.Liu, P.G.Schultz, // Nat.Biotechnol, 2006, V.24, P.1536-1440).
[Leu1, Thr2]-63-десульфатогирудин-1-полипептид, содержащий 65 аминокислотных остатков, с молекулярной массой 6968,55 Да. Он состоит из двух доменов, центрального, структура которого поддерживается тремя дисульфидными связями, и кислого С-концевого "хвостового" домена (остатки 47-65). Аминокислотная последовательность [Leu1, Thr2]-63-десульфатогирудин-1 и нуклеотидная последовательность его синтетического гена приведены на SEQ ID NO 1.
В мировой практике гирудин обычно получают микробиологическим способом в составе гибридного белка, лидерная часть которого обеспечивает транспорт полипептида в периплазму клетки Escherichia coli или с использованием дрожжей с последующим выделением препарата из культуральной среды.
Известно получение [Leu1, Thr2]-63-десульфатогирудина в E.coli в составе нескольких предшественников, содержащих сигнальные последовательности поверхностного мембранного белка Serratia marcescens, белка oprF Pseudomonas fluorescens, белка lamb В Escherichia coli (кодируемого геном рецептора лямбда (lamB)) и фумаратредуктазы Shewanella putrifaciens (Патент РФ №2261867, МКИ С07К 14/815, опубл. 2005).
Известен способ получения гирудина, при котором белок объединен с сигнальной последовательностью α-циклодекстрин-гликозил-трансферазы (СGТазы). Как вариант рассматривается создание npe-Leu-гирудин, в котором исходная последовательность [Leu1, Thr2]-63-десульфатогирудина удлинена с N-конца трипептидом Ala-Thr-Arg, удаляемым в дальнейшем трипсином (Патент РФ №2118365, МКИ C12N 15/00, опубл. 1998).
К недостаткам известных способов получения [Leu1, Thr2]-63-десульфатогирудина в бактериальных клетках Escherichia coli относятся усложнение технологии получения препарата вследствие увеличения рабочих объемов. В то же время как при использовании дрожжевых клеток достигается высокий выход целевого белка, но увеличивается продолжительность методики в связи с увеличением времени ферментации.
Известен наиболее близкий к заявленному способ получения рекомбинантного гирудина из бактериального штамма Е.coli в составе гибридного белка, в котором N-концевая часть гирудина соединена с интеином See VMA из Saccharomyces cerevisiae, обеспечивающим автокаталитическое расщепление белка-предшественника с получением гирудина с выходом 17 мг с литра культуральной среды (Kochanowski R., Kotlowski R., Sweda P. // Prot.Expr.Purif. / 2006, V.50, P.25-30). Однако данный метод используется для получения препарата в небольших количествах.
Изобретение решает задачу получения бактериального штамма-продуцента, позволяющего получать рекомбинантный [Leu1, Thr2]-63-десульфатогирудина-1 с высоким выходом.
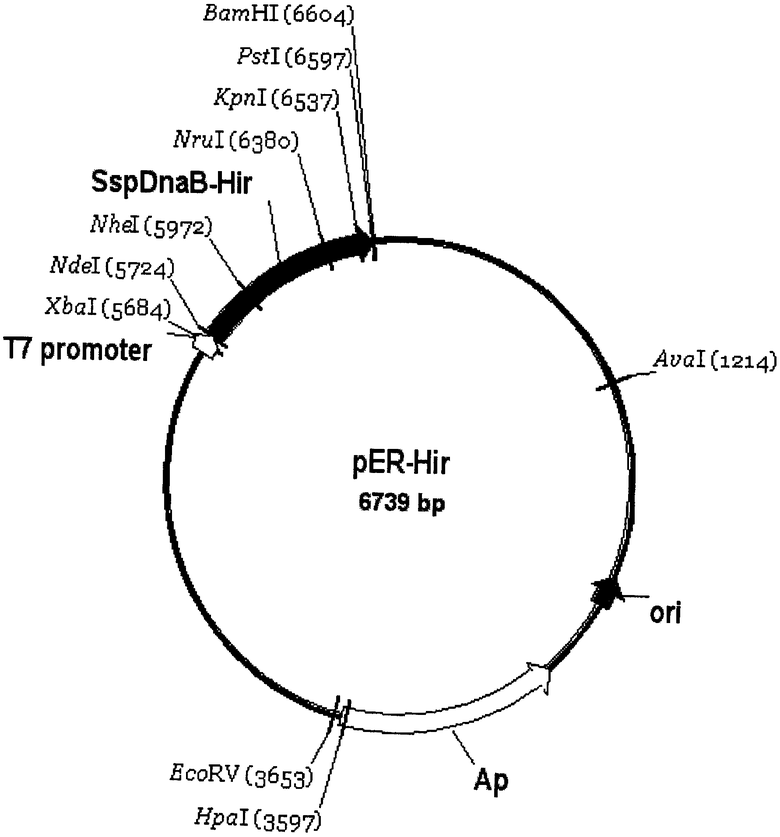
Поставленная задача решается за счет структуры рекомбинантной плазмидной ДНК pER-Hir, кодирующей полипептид, содержащий [Leu1, Thr2]-63-десульфато-гирудин-1 и мини-интеин Ssp DnaB, имеющей молекулярную массу 4.4 МДа и физическую карту, приведенную на фиг.1, состоящей из: SapI/BamHI-фрагмента ДНК плазмиды pTWIN-1, содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, ген модифицированного мини-интеина Ssp DnaB, со встроенной в него последовательностью хитин-связывающего домена, и SapI/BamHI-фрагмента ДНК, содержащего последовательность гена рекомбинантного [Leu1, Thr2]-63-десульфатогирудина-1, и содержащей в качестве генетического маркера ген β-лактамазы (Ар), детерминирующей устойчивость трансформированных плазмидой pER-Hir клеток E.coli к пенициллиновым антибиотикам, а также уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии влево от сайта BamHI: NruI - 186 п.о., NdeI -594 п.о., XbaI - 882 п.о., EcoRV - 2913 п.о., HpaI - 2966 п.о., а также за счет штамма Escherichia coli ER2566/pER-Hir, содержащего рекомбинантную плазмидную ДНК pER-Hir и являющегося продуцентом гибридного белка Int-Hir, включающего наряду со структурой рекомбинантного [Leu1, Thr2]-63-десульфатогирудина-1 структуру интеина Ssp DnaB.
Кроме того, поставленная задача решается за счет того, что в способе получения рекомбинантного гирудина, включающем культивирование штамма-продуцента Escherichia coli, полученного трансформацией клеток родительского штамма Escherichia coli ER2566 плазмидной ДНК, кодирующей рекомбинантный [Leu1, Thr2]-63-десульфато-гирудин-1, в качестве плазмидной ДНК используют сконструированную ДНК pER-Hir, в качестве штамма-продуцента используют штамм Escherichia coli ER2566/pER-Hir, после разрушения клеток в буферном растворе с помощью ультразвукового дезинтегратора гибридный белок отделяют в виде тел включения, тела включения растворяют в буферном растворе, содержащем 8М мочевину и имеющем рН 12, ренатурируют [Leu1, Thr2]-63-десульфатогирудин-1 в составе гибридного белка, адсорбируют на хитиновом сорбенте (New England BioLabs), индуцируют автокаталитическое расщепление гибридного белка промыванием хитинового сорбента буферным раствором с рН 6.5 и элюируют целевой продукт тем же буфером.
Заявляемый способ предполагает получение [Leu1, Thr2]-63-десульфатогирудина-1 из бактериального штамма Е.coli ER2566/pER-Hir в составе гибридного белка, содержащего HaN-конце модифицированный мини-интеин SspDnaB из Synechocystis sp, включающий хитинсвязывающий домен, а на С-конце - [Leu1, Thr2]-63-десульфато-гирудин-1, и способного к автокаталитическому расщеплению с образованием гирудина. Метод позволяет упростить технологию получения [Leu1, Thr2]-63-десульфато-гирудина-1, увеличить выход целевого продукта до 25 мг/л культуральной среды и в дальнейшем легко масштабировать процесс выделения.
Конструкция рекомбинантной плазмидной ДНК pER- Hir обеспечивает высокий уровень экспрессии (32% относительно общего клеточного белка) клонированного в ней гена гибридного белка Int-Hir (аминокислотная последовательность белка и нуклеотидная последовательность кодирующего его гена представлены на SEQ ID NO 2), содержащего на 5'-конце ген модифицированного интеина Ssp DnaB, соединенного с геном [Leu1, Thr2]-63-десульфатогирудина-1 (аминокислотная последовательность белка и нуклеотидная последовательность кодирующего его гена представлены на SEQ ID NO 1). Для конструирования плазмидной ДНК использован химический подход, позволяющий использовать для экспрессии клонированного структурного гена оптимальные регуляторные элементы, контролирующие его экспрессию.
Изобретение осуществляют следующим образом.
Для конструирования экспрессионной плазмиды искусственный ген Hir, структура которого приведена на SEQ ID NO 1, получают химико-ферментативным синтезом. Концевые его участки, содержащие соответствующие вектору сайты рестриктаз, вводят с помощью ПЦР с синтетическими олигонуклеотидными праймерами P-int и P-ter.
Полученный таким образом дуплекс клонируют в плазмидный вектор pGEM 5Zf(-), обработанный эндонуклеазой EcoRV. SapI/BamHI-фрагмент с геном рекомбинантного Hir, полученный после расщепления созданного рекомбинантного вектора pGEM 5Zf(-)-Hir соответствующими эндонуклеазами рестрикции Sapl и BamHI, клонируют в экспрессионную плазмиду pTWIN1, содержащей ген интеина из Synechocystis sp.dnaB (Wu, H., Xu, M.-Q., Liu, X.-Q (1998) Biochim. Biophys. Acta, 1387, 422-432., Evans, J, Bermer, J, Xu, M.-Q (1999) J. Biol. Chem. 274, 18359-18363) и полученной в результате рекомбинантной плазмидой pER-Hir трансформируют клетки штамма Е. coli ER2566.
Предлагаемый штамм-продуцент Escherichia coli ER2566/pER- Hir характеризуется следующими признаками.
Морфологические признаки.
Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки.
Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или YT-среде) образуют интенсивную ровную муть.
Физико-биологические признаки.
Клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам.
Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент Е.coli ER2566/pER-Hir отличается от штамма-реципиента Е.coli ER2566 только наличием рекомбинантной плазмидной ДНК pER-Hir, которая и придает ему устойчивость к пенициллиновым антибиотикам.
Штамм-продуцент Е.coli ER2566/pER-Hir получают путем трансформации компетентных клеток Е.coli ER2566 рекомбинантной плазмидной ДНК pER-Hir. Штамм Е.coli ER2566/pER-Hir является продуцентом гибридного белка Int-Hir, который накапливается в клетках в виде тел включения.
В результате создан штамм-продуцент Е.coli ER2566/pER-Hir, в котором при индукции изопропилтио-β-D-галактозидом образуется гибридный белок Int-Hir, содержащий на N-конце модифицированный интеин Ssp DnaB, включающий хитин-связывающий домен, а на С-конце - [Leu1, Thr2]-63-десульфатогирудин-1.
Штамм продуцент Е.coli ER2566/pER-Hir культивируют в среде YT, содержащей 100 мкг/мл ампициллина при 37°С до оптического поглощения культуры A595 0.8, затем индуцируют IPTG (до концентрации 0.2 мМ) и выращивают 4 ч при 37°С. Клетки отделяют центрифугированием (5000 g, 20 мин, 4°С). Из 1 л культуры получают 3.0 г влажных клеток. Клеточную биомассу гомогенизируют в буфере А (50 мМ Трис-HCl, рН 8.0, 10 мМ EDTA) и затем разрушают 10 мин с помощью ультразвукового дезинтегратора (40 кГц). Осадок после центрифугирования (15000 g, 45 мин) отделяют, ресуспендируют в буфере А и снова центрифугируют. Осадок телец включения растворяют в буфере В (50 мМ Трис-HCl, рН 12, 10 мМ EDTA, 8M мочевина, 100 мМ NaCl и 10 мМ β-меркаптоэтанол). Образовавшийся после солюбилизации тел включения раствор (20 мл) разбавляют в буфере С (50 мМ Трис-HCl, рН 8.0, 10 мМ EDTA, 100 мМ NaCl) до концентрации детергента 0.4 М и концентрации восстанавливающего реагента 0.5 мМ. Ренатурацию [Leu1, Thr2]-63-десульфатогирудина-1 проводят в составе гибридного белка Int-Hir под воздействием кислорода воздуха в течение 48 часов при 4°С. Затем наносят на колонку с 15 мл хитинового сорбента (New England BioLabs) и индуцируют автокаталитическое расщепление изменением рН с 8 до 6.5 за счет промывания хитинового сорбента буфером D (50 мМ Трис-HCl, рН 6.5, 10 мМ EDTA, 100 мМ NaCl). Практически чистый Hir с нативными дисульфидными связями элюируют с хитинового сорбента буфером D. Полученные 30 мл элюата с концентрацией 0,8 мг/мл лиофильно высушивают.
Техническим результатом данного метода является получение [Leu1, Thr2]-63-десульфатогирудина-1 с выходом 7.5% относительно суммарного белка клетки, что составляет 25 мг/л культуральной среды.
Изобретение иллюстрируют чертежи.
Фиг.1. Физическая карта рекомбинантной плазмиды pER-Hir. Указаны уникальные сайты эндокуклеаз рестрикции, ori - участок инициации рекликации плазмиды. Ар - ген β-лактамазы. SspDnaB-Hir - ген рекомбинантного белка Int-Hir, сосотоящий из интеина SspDnaB и [Leu1, Thr2]-63-десульфатогирудина-1.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК pER- Hir
Химический синтез олигонуклеотидов выполняют твердофазным фосфоамидитным методом на ДНК-синтезаторе ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов- 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтил-диизо-пропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 А), к которому через 3'-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 25 мкмоль/г). Используют синтетический цикл, описанный в работе (Nichols N.M., Benner J.S., Martin D.D., Evans T.C., Jr. // Biochemistry. 2003. V.42. P.5301-5311).
Полимеразную цепную реакцию проводят в 50 мкл инкубационной смеси, содержащей 10 нг плазмиды с искусственным геном рекомбинантного Hir в качестве матрицы, по 60 пмоль каждого праймера P-int и P-ter, 1х буфер для Taq-ДНК-полимеразы, 5 мМ dNTP (дезоксирибонуклеотидов, каждого в концентрации 1.25 мМ), 5 ед. акт. Taq-ДНК-полимеразы. Полимеразную цепную реакцию проводят в ДНК-амплификаторе при следующих условиях: 1) денатурация - 30 с при 92°С, отжиг - 30 с при 56°С, элонгация - 30 с при 72°С (5 циклов ПЦР); 2) денатурация - 30 с при 92°С, отжиг - 30 с при 60°С, элонгация - 30 с при 72°С (25 циклов ПЦР). Результаты ПЦР определяют с помощью электрофореза ДНК в 2%-агарозном геле. Очистку ПЦР-продукта осуществляют с помощью набора MinElute PCR Purification Kit (QIAGEN, #27106).
3 мкг плазмидного вектора pGEM 5Zf(-) (Promega) обрабатывают рестриктазой EcoRV (10 ед.акт) в 20 мкл реакционной смеси, содержащей 2 мкл 10х буфера R (10 мМ Трис-HCl рН 8.5, 10 мМ MgCl2, 100 мМ KCl, 0.1 мг/мл БСА) в течение 2 часов при 37°С. Результаты реакции рестрикции определяют с помощью электрофореза в 1%-агарозном геле. Выделение нужных фрагментов плазмидной ДНК из агарозного геля проводят с помощью набора MinElute Gel Extraction Kit (QIAGEN, # 28606).
Полученный синтетический SapI/BamHI-фрагмент с геном рекомбинантного Hir, нуклеотидная последовательность которого представлена на SEQ ID NO 1, в количестве 2 мкг, лигируют с плазмидным вектором pGEM 5Zf(-) (1 мкг), обработанным рестриктазой EcoRV. Лигирование проводят в 20 мкл инкубационной смеси, содержащей 2 мкл 10x буфера для Т4-ДНК-лигазы (400 мМ Трис-HCl рН 7.8, 100 мМ MgCl2, 100 мМ ДТТ, 5 мМ rАТР), 2 мкл 5 мМ rАТР и 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С. 10 мкл полученной лигазной смеси используют для трансформации компетентных клеток Е.coli XLI-Blue. Трансформанты высевают на чашки с YT-агаром, содержащие 100 мкг/мл ампициллина, 40 мкг/мл X-Gal (5-бром-4-хлор-3-индолил-β-D-галактопиранозида) и 0.5 мМ ИПТГ. Отбор клонов осуществляют с помощью полимеразной цепной реакции с праймерами P-int и P-ter.
3 мкг полученного рекомбинантного вектора pGEM 5Zf(-)-Hir и 1 мкг плазмидного вектора pTWIN1 (New England BioLabs) отдельно друг от друга обрабатывают рестриктазой SapI (10 ед. акт.) в 40 мкл реакционной смеси, содержащей 4 мкл 10х буфера для рестриктазы Sapl (33 мМ Трис-ацетат рН 7.9, 10 мМ CH3COOMg, 66 мМ CH3COONa, 0.1 мг/мл БСА) в течение 2 часов при 37°С. Результаты реакции рестрикции определяют с помощью электрофореза в 1%-агарозном геле. Выделение нужных фрагментов плазмидной ДНК из агарозного геля проводят с помощью набора MinElute Gel Extraction Kit. Выделенные фрагменты плазмидных векторов отдельно друг от друга обрабатывают рестриктазой BamHI (10 ед. акт.) в 20 мкл реакционной смеси, содержащей 2 мкл 10х буфера для рестриктазы BamHI (10 мМ Трис-HCl рН 8.0, 5 мМ MgCl2 100 мМ KCl, 0.02% тритон Х-100, 1 мМ Р-меркаптоэтанол, 0.1 мг/мл БСА) в течение 2 часов при 37°С. Результаты реакции рестрикции определяют с помощью электрофореза в 1%-агарозном геле. Выделение нужных фрагментов плазмидной ДНК из агарозного геля проводят с помощью набора MinElute Gel Extraction Kit.
Полученный при этом SapI/BamHI-фрагмент с геном рекомбинантного Hir лигируют с векторной плазмидой pTWINI (New England BioLabs), расщепленной по тем же сайтам рестриктаз. Лигирование проводят в 20 мкл инкубационной смеси, содержащей 2 мкл 10х буфера для Т4-ДНК-лигазы (400 мМ Трис-HCl рН 7.8, 100 мМ MgCl2 100 мМ ДТТ, 5 мМ rАТР), 2 мкл 5 мМ rАТР и 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
10 мкл полученной лигазной смеси используют для трансформации компетентных клеток Е.coli ER2566. Трансформанты высевают на чашки с YT-агаром, содержащим 100 мкг/мл ампициллина. Отбор клонов осуществляют с помощью полимеразной цепной реакции с праймерами P-int и P-ter.
В результате получают рекомбинантную плазмиду pER-Hir для экспрессии гибридного белка Int-Hir, содержащего на N-конце модифицированный мини-интеин SspDnaB из Synechocystis sp, включающий хитин-связывающий домен, а на С-конце - [Leu1, Thr2]-63-десульфатогирудин-1.
Пример 2.
Получение штамма-продуцента Е.coli ER2566/pER-Hir и определение его продуктивности.
Штамм-продуцент Е.coli ER2566/pER-Hir получают трансформацией компетентных клеток Е.coli ER2566 рекомбинантной плазмидой pER-Hir, создание которой описано в примере 1. Клетки штамма Е.coli ER2566/pER-Hir являются продуцентом гибридного белка Int-Hir (SEQ ID NO 2).
Штамм продуцент Е.coli ER2566/ pER-Hir выращивают при 37°С в 100 мл YT-среды (рН 7.4) с 100 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до оптического поглощения культуры А 595 0.7-0.8, добавляют изопропилтио-β-D-галактозид (ИПТГ) до концентрации 0.2 мМ и продолжают процесс еще 4 ч. Каждый час отбирают пробу по 2 мл, определяют A550 и количество культуры, соответствующее 1 мл с А5501.0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки разрушают в 100 мкл лизирующего буфера с красителем бромфеноловым синим в течение 20 с на ультразвуковом дезинтеграторе (18 кГц), нагревают 3 мин при 100°С и пробы по 1 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют с помощью системы гель-документирования Gel Doc XR Plus (Bio-Rad). Уровень экспрессии гибридного белка Int-Hir по результатам электрофореза в 15% SDS-ПААГ составляет 32% относительно общего клеточного белка.
Пример 3.
Получение гибридного белка Int-Hir.
Штамм продуцента Е. coli ER2566/pER-Hir, создание которого описано в примере 2, культивируют в среде YT, содержащей 100 мкг/мл ампициллина при 37°С до оптического поглощения культуры А595 0.8, затем добавляют ИПТГ (до концентрации 0.2 мМ) и выращивают 4 ч при 37°С. Клетки отделяют центрифугированием (5000 g, 20 мин, 4°С). Из 1 л культуры получают 3.0 г влажных клеток. Клеточную биомассу гомогенизируют в буфере А (50 мМ Трис-HCl, рН 8.0, 10 мМ EDTA) и затем разрушают 10 мин с помощью ультразвукового дезинтегратора (40 кГц). Осадок после центрифугирования (15000 g, 45 мин) отделяют, ресуспендируют в буфере А и снова центрифугируют. Осадок тел включения растворяют в буфере В (50 мМ Трис-HCl, рН 12, 10 мМ EDTA, 100 мМ NaCl, 8M мочевина, 10 мМ β-меркаптоэтанол).
Пример 4.
Ренатурация и расщепление гибридного белка и выделение рекомбинантного [Leu1, Thr2]-63-десульфатогирудина-1.
Образовавшийся после солюбилизации тел включения раствор (20 мл) разбавляют в буфере С (50 мМ Трис-HCl, рН 8.0, 10 мМ EDTA, 100 мМ NaCl) до концентрации детергента 0.4 М и концентрации восстанавливающего реагента 0.5 мМ. Ренатурацию [Leu1, Thr2]-63-десульфатогирудина-1 проводят в составе гибридного белка Int-Hir под воздействием кислорода воздуха в течение 24 часов при 4°С. Затем наносят на колонку с 15 мл хитинового сорбента (New England BioLabs) и индуцируют автокаталитическое расщепление изменением рН с 8 до 6.5 за счет промывания хитинового сорбента буфером D (50 мМ Трис-HCl, рН 6.5, 10 мМ EDTA, 100 мМ NaCl). Практически чистый Hir с нативными дисульфидными связями элюируют с хитинового сорбента буфером D. Полученные 30 мл элюата с концентрацией 0,8 мг/мл лиофильно высушивают.
Выход рекомбинантного [Leu1, Thr2]-63-десульфатогирудина-1 составляет 25 мг/л клеточной культуры штамма-продуцента.
Аминокислотные и нуклеотидные последовательности, представленные в описании:

SEQ ID NO 1.
Аминокислотная последовательность [Leu1, Thr2]-63-десульфатогирудина-1 и нуклеотидная последовательность его синтетического гена.

SEQ ID NO 2.
А) Нуклеотидная последовательность гибридного гена Ssp DnaB-Hir. Жирными буквами отмечены стартовый и терминирующий кодоны. Б) Аминокислотная последовательность гибридного белка Int-Hir. Последовательность хитин-связывающего домена показана жирным шрифтом, аминокислота на месте расщепления гибридного белка подчеркнута и выделена жирным шрифтом, последовательность [Leu1, Thr2]-63-десульфатогирудина-1 выделена курсивом.
Изобретение относится к области генной и белковой инженерии и касается рекомбинантной плазмидной ДНК pER-Hir, кодирующей гибридный белок, способный к автокаталитическому расщеплению с образованием [Leu1, Thr2]-63-десульфатогирудина, штамму Escherichia coli ER2566/pER-Hir - продуценту указанного белка и способу получения генно-инженерного [Leu1, Thr2]-63-десульфатогирудина. Представленная рекомбинантная плазмидная ДНК состоит из SapI/BamHI-фрагмента ДНК плазмиды pTWIN-1, содержащей промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы (Ар), ген модифицированного мини-интеина Ssp DnaB, со встроенной в него последовательностью хитин-связывающего домена, и SapI/BamHI-фрагмента ДНК, содержащего последовательность гена рекомбинантного [Leu1, Thr2]-63-десульфато-гирудина-1, содержащую в качестве генетического маркера ген β-лактамазы (Ар), и уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии влево от сайта BamHI: NruI - 186 п.о., NdeI - 594 п.о., XbaI - 882 п.о., EcoRV - 2913 п.о., HpaI - 2966 п.о. Изобретения позволяют получить рекомбинантный белок [Leu1, Thr2]-63-десульфатогирудин-1, который используют в качестве лекарственного препарата, применяемого для предотвращения гиперкоагуляции крови. 3 н.п. ф-лы, 1 ил.
1. Рекомбинантная плазмидная ДНК pER-Hir, созданная для экспрессии гибридного белка Int-Hir, содержащего [Leu1, Thr2]-63-десульфатогирудин-1 (его аминокислотная последовательность и нуклеотидная последовательность кодирующего его гена представлена на SEQ ID NO 1) и мини-интеин Ssp DnaB, имеющая молекулярную массу 4,4 МДа и физическую карту, приведенную на фиг.1, состоящая из: SapI/BamHI-фрагмента ДНК плазмиды pTWIN-1, содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы (Ар), ген модифицированного мини-интеина Ssp DnaB со встроенной в него последовательностью хитин-связывающего домена и SapI/BamHI-фрагмента ДНК, содержащего последовательность гена рекомбинантного [Leu1, Thr2]-63-десульфато-гирудина-1, содержащую в качестве генетического маркера ген β-лактамазы (Ар), детерминирующий устойчивость трансформированных плазмидой pER-Hir клеток E.coli к пенициллиновым антибиотикам и уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии влево от сайта BamHI: NruI -186 п.о., NdeI - 594 п.о., XbaI - 882 п.о., EcoRV - 2913 п.о., HpaI - 2966 п.о.
2. Штамм Escherichia coli ER2566/pER-Hir, созданный путем трансформации клеток родительского штамма Escherichia coli ER2566 рекомбинантной плазмидной ДНК pER-Hir по п.1 - продуцент гибридного белка Int-Hir.
3. Способ получения рекомбинантного [Leu1, Thr2]-63-десульфатогирудина-1, включающий культивирование штамма-продуцента Escherichia coli ER2566/pER-Hir по п.2; отделение гибридного белка Int-Hir в виде тел включения после разрушения клеток с помощью ультразвукового дезинтегратора в буферном растворе А, содержащем 50 мМ Трис-HCl, рН 8,0, 10 мМ EDTA; растворение тел включения в буферном растворе В, содержащем 50 мМ Трис-HCl, рН 12, 10 мМ EDTA, 100 мМ NaCl, 8M мочевину, 10 мМ β-меркаптоэтанола; ренатурацию [Leu1, Thr2]-63-десульфатогирудин-1 в составе гибридного белка, осуществляемую в течение 48 ч при 4°С под воздействием кислорода воздуха после разведения в буферном растворе С, содержащем 50 мМ Трис - HCl, рН 8,0, 10 мМ EDTA, 100 мМ NaCl; адсорбирование гибридного белка на колонке с хитиновым сорбентом (New England BioLabs), индуцирование его автокаталитического расщепления промыванием хитинового сорбента буферным раствором D, содержащим 50 мМ Трис-HCl, рН 6,5, 10 мМ EDTA, 100 мМ NaCl, и элюирование целевого продукта тем же буфером.
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| УСТРОЙСТВО для ПОЛУЧЕНИЯ РАЗНОСТНОЙ ЧАСТОТЫ ДВУХ ИМПУЛЬСНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ | 0 |
|
SU324712A1 |
| MADAN KATRAGADDA et al | |||
| Expression of compstatin in Escherichia coli: Incorporation of unnatural amino acids enhances its activity | |||
| Protein Expression and Purification, 2006 V.47, p.289-295. | |||
Авторы
Даты
2011-12-10—Публикация
2009-10-23—Подача