Изобретение относится к биотехнологии, в частности к генной и белковой инженерии. Оно может быть использовано для получения рекомбинантного эпидермального фактора роста человека.
Эпидермальный фактор роста человека (hEGF), или урогастрон, участвует в ряде физиологических процессов, связанных с эмбриональным ростом, регенерацией тканей, регуляцией функционирования эндокринной системы, заживлением ран, секрецией желудочного сока (Medical World News. 1986, V.13, №10, P.17, P.3589-3593). В связи с этим он представляет интерес для таких областей медицины, как микрохирургия глаза, ожоговая терапия, лечение язв желудка и т.д.
hEGF представляет собой полипептид, содержащий 53 аминокислотных остатка, соединенных тремя дисульфидными связями. Аминокислотная последовательность hEGF и нуклеотидная последовательность его синтетического гена приведены на фиг.1.
Природный hEGF ранее выделяли из мочи человека (Gregory H., Preston В.М. // Int. J. Peptide and Protein Res., 1977, V.9, №2, P.107-112), но низкое (менее 0.1%) содержание его в этом источнике делало его практически недоступным для широкого применения в медицине.
Более доступным является рекомбинантный hEGF, для получения которого предложены многочисленные методы. Во всех описанных способах успех микробиологического получения рекомбинантного hEGF достигается за счет использования секреции его из бактериальной клетки, что позволяет предохранять его от действия протеаз. Для того чтобы избежать деградации in vivo короткие пептиды экспрессируют в составе гибридного гена. К недостаткам использованных ранее методов получения hEGF относятся низкий выход целевого белка и трудности его выделения и очистки.
Известен наиболее близкий способ получения рекомбинантного hEGF, в котором также используется секреция его из бактериальной клетки (Tong W.Y., Yao S.J. Zhu Z.Q. // Appl. Microbiol. Biotechnol. 2001, V.57, 674-9). К недостаткам этого способа относится трудности выделения и очистки.
Изобретение решает задачу получения генно-инженерного эпидермального фактора роста с помощью рекомбинантной плазмидной ДНК, кодирующей гибридный белок, высокопродуктивного рекомбинантного бактериального штамма-продуцента указанного белка и определения условий ренатурации эпидермального фактора роста в составе гибридного белка и условий неферментативного автокаталитического расщепления гибридного белка для получения рекомбинантного hEGF.
Поставленная задача решается за счет того, что в способе получения рекомбинантного эпидермального фактора роста человека, включающем культивирование штамма-продуцента Escherichia coli, полученного трансформацией клеток родительского штамма Escherichia coli ER2566 плазмидной ДНК, кодирующей рекомбинантный эпидермальный фактор роста, в качестве плазмидной ДНК используют сконструированную ДНК pER-hEGF, в качестве штамма-продуцента используют штамм Escherichia coli ER2566/pER-hEGF, после разрушения клеток в буферном растворе с помощью ультразвука гибридный белок отделяют в виде тел включения, тела включения растворяют в буфере, содержащем 6 М мочевину, ренатурируют гибридный белок, адсорбируют его на хитиновом сорбенте и затем индуцируют автокаталитическое расщепление сменой буфера с изменением рН с 10,0 до 7,0 с отделением целевого продукта, который элюируют с сорбента.
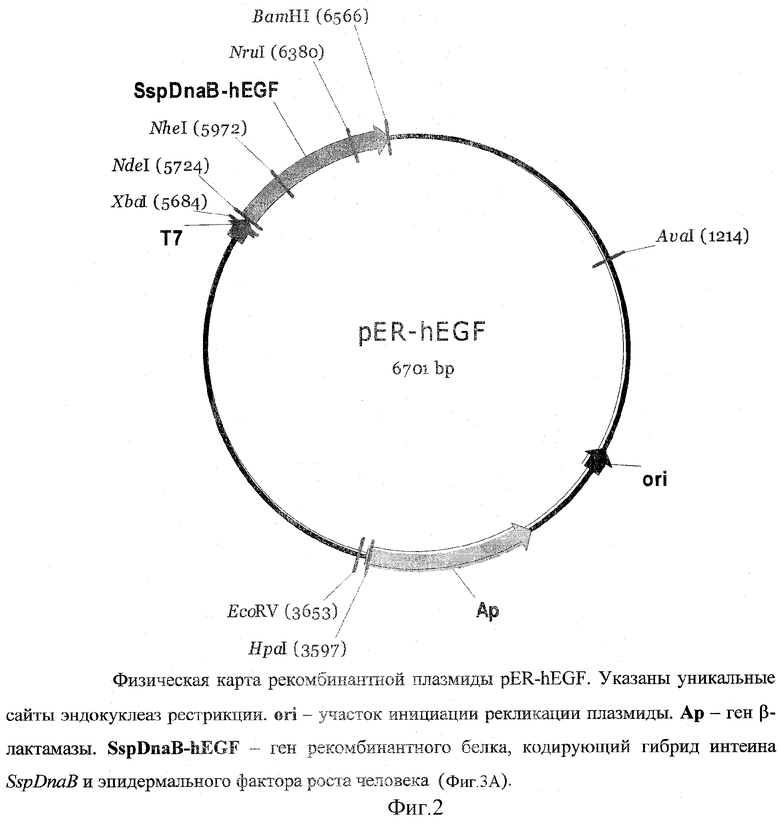
Кроме того, поставленная задача решается за счет структуры рекомбинантной плазмидной ДНК pER-hEGF, кодирующей гибридный белок, содержащий эпидермальный фактор роста человека и мини-интеин Ssp DnaB, имеющей молекулярную массу 4.4 МДа и физическую карту, приведенную на фиг.2, состоящей из: SapI/BamHI-фрагмента ДНК плазмиды pTWIN-1, содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, ген модифицированного мини-интеина Ssp DnaB, со встроенной в него последовательностью хитин-связывающего домена, и SapI/BamHI-фрагмента ДНК, содержащего последовательность гена рекомбинантного эпидермального фактора роста человека, содержащей: в качестве генетического маркера ген β-лактамазы (Ар), детерминирующей устойчивость трансформированных плазмидой pER- hEGF клеток Е.coli к пеницилл 2966 п.о., и новым антибиотикам; уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии влево от сайта BamHI: NruI - 186 п.о., NdeI - 594 п.о., XbaI - SS2 п.о., EcoRV - 2913 п.о., HpaI - 296 п.о.,
а также за счет штамма Escherichia coli ER2566, содержащего рекомбинантную плазмидную ДНК pER-hEGF, продуцент гибридного белка Int-hEGF, включающего, наряду со структурой рекомбинантного эпидермального фактора роста человека, структуру мини-интеина Ssp DnaB.
Конструкция рекомбинантной плазмидной ДНК pER-hEGF обеспечивает высокий уровень экспрессии клонированного в ней гена гибридного белка Int-hEGF, содержащего на 5′-конце ген модифицированного интеина DnaB, соединенного встык с геном hEGF (фиг.3). Для конструирования плазмиды использован химический подход, позволяющий использовать для экспрессии клонированного структурного гена оптимальные регуляторные элементы, контролирующие его экспрессию.
Изобретение осуществляют следующим образом:
Для конструирования экспрессионной плазмиды искусственный ген hEGF, структура которого приведена на фиг.1, получают химико-ферментативным синтезом, как это было описано ранее (Батчикова Н.В., Скапцова Н.В., Твардовская С.Е., Бесидский Е.С., Даньков Ю.В., Степанов А.И., Ажаев А.В. // Биоорган. химия., 1988, т.14, №5, 621-630). Концевые его участки, содержащие соответствующие вектору сайты рестриктаз, вводят с помощью ПЦР с синтетическими олигонуклеотидными праймерами P-int и P-ter.
SapI
P-int GGTGGTTGCTCTTCCAACAATTCTGACTCTGAATGCCCA
BamHI
P-ter GGTGGTGGATCCTCAACGCAGTTCCCACCATTTC
Полученный таким образом дуплекс после расщепления соответствующими эндонуклеазами рестрикции SapI и BamHI клонируют в экспрессионную плазмиду pTWIN1 (New England Biolabs) и лигазной смесью трансформируют клетки Е.coli ER2566.
Предлагаемый штамм-продуцент Escherichia coli ER2566/pER-hEGF характеризуется следующими признаками:
Морфологические признаки. Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или YT-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки. Клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент Е.coli ER2566/pER-hEGF отличается от штамма-реципиента Е.coli ER2566 только наличием рекомбинантной плазмидной ДНК pER-hEGF, которая и придает ему устойчивость к пенициллиновым антибиотикам.
Штаммы-продуценты получают путем трансформации компетентных клеток Е.coli ER2566 рекомбинантной плазмидной ДНК pER-hEGF.
Клетки Е.coli ER2566/pER-hEGF являются суперпродуцентом. При индукции изопропилтио-β-D-галактозидом происходит эффективный биосинтез гибридного белка Int-hEGF, который накапливается в клетках в виде тел включения.
В результате создан продуцент Е.coli ER2566/pER-hEGF, в котором при индукции образуется гибридный белок Int-hEGF (фиг.ЗБ), содержащий на N-конце модифицированный интеин Ssp DnaB, включающий хитин-связывающий домен, а на С-конце - hEGF.
Штамм-продуцент Е.coli ER2566/pER-hEGF культивируют в среде YT, содержащей 50 мг/мл ампициллина при 37°С до оптического поглощения культуры А595 0.8, затем индуцируют IPTG (до концентрации 0.2 мМ) и выращивают 4 ч при 37°С. Клетки отделяют центрифугированием (5000 g, 20 мин, 4°С). Из 1 л культуры получают 3.0 г влажных клеток. Клетки ресуспендируют в буфере А (50 мМ Трис-HCl, 10 мМ EDTA, 200 мМ NaCl, рН 10.0) и затем разрушают с помощью ультразвукового дезинтегратора. Осадок после центрифугирования (15000 g, 45 мин) отделяют, ресуспендируют в буфере А, снова центрифугируют, промывают буфером В (буфер А, содержащий 1% Тритона Х-100). Осадок телец включения растворяют в буфере С (буфер А, содержащий 6 М мочевину). Образовавшийся после солюбилизации телец включения раствор (15 мл) разбавляют буфером А, до концентрации мочевины 0,5 М при концентрации 0,25 мМ MESNA. Ренатурация гибридного белка и рефолдинг эпидермального фактора роста с образованием нативных S-S связей в составе гибридного белка происходит под воздействием кислорода воздуха в течение 48 ч при 4°С. Затем гибридный белок наносят на хитиновый сорбент и индуцируют автокаталитическое расщепление за счет смены буферов А на G (75 мл) (буфер А рН 6.5, содержащий 0,25 мМ MESNA), изменяя рН буфера с 10.0 до 6,5.
Практически чистый hEGF с окисленными дисульфидными связями элюируют с хитинового сорбента буфером G. Получают 30 мл элюата с концентрацией 0,7 мг/мл. Выход hEGF составляет 5% (относительно суммарного белка клетки). Идентификацию полипептидных продуктов, получаемых при выделении, проводят с помощью MALDI-масс-спектрометрии. Последовательность рекомбинантного hEGF была подтверждена С-концевым секвенированием.
Изобретение иллюстрируют примеры.
Пример 1.
Конструирование рекомбинантной плазмидной ДНК pER-hEGF
Химический синтез олигонуклеотидов выполняют твердофазным фосфоамидитным методом на ДНК-синтезаторе ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3′-конца к 5′-концу с помощью защищенных фосфамидитов - 5′-диметокситритил-N-ацил-2′-дезоксинуклеозид-3′-О-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 Å), к которому через 3′-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Используют синтетический цикл, описанный в работе (Nichols, N.M., Benner, J.S., Martin, D.D., Evans, T.C., Jr. // Biochemistry. 2003. V.42. P.5301-5311).
Полимеразную цепную реакцию проводят в 50 мкл инкубационной смеси, содержащей 10 нг плазмиды с искусственным геном рекомбинантного hEGF в качестве матрицы, 70 пмоль каждого праймера (P-int и P-ter), 1×буфер для Taq-ДНК-полимеразы, ΣdNTP (каждый в концентрации 1.25 мМ), 5 ед. Taq-ДНК-полимеразы. Полимеразную цепную реакцию проводят в ДНК-амплификаторе при следующих условиях: 1) денатурация 30 сек при 92°С, отжиг 30 сек при 56°С, элонгация 30 сек при 72°С (5 циклов); 2) денатурация 30 сек при 92°С, отжиг 30 сек при 60°С, элонгация 30 сек при 72°С (25 циклов). Результаты ПЦР определяют с помощью электрофореза ДНК в 2%-агарозном геле. Выделение ДНК (плазмидной или продуктов ПЦР) из агарозного геля проводят с помощью набора "DNA Gel Extraction Kit" (Millipore). Для приготовления 1%-ного раствора агарозы использовали 1×TAE буфер (40 мМ Tris-ацетат рН 8.0, 0,1 мМ Na2EDTA). После проведения электрофореза нужные фрагменты ДНК вырезают из агарозного геля и помещают в 1,5 мл-пробирки, прилагаемые к набору. Центрифугируют 10 минут при 5 об/мин.
1 мкг плазмидной ДНК pTWIN1 и 2 мкг искусственного гена hEGF (продукт ПЦР) отдельно друг от друга обрабатывают 10 ед. эндонуклеазы рестрикции SapI в 1x-кратном буфере для рестриктазы SapI (NewEnglandBiolabs) в 20 мкл реакционной смеси. Реакцию проводят в течение 1,5 часов при 37°С. Результаты рестрикции анализируют с помощью электрофореза в 1%-агарозном геле (для плазмидной ДНК) и 2%-агарозном геле (для продуктов ПЦР). Выделение ДНК (плазмидной или продуктов ПЦР) из агарозного геля проводят с помощью набора "DNA Gel Extraction Kit" (Millipore). Выделенные фрагменты отдельно друг от друга обрабатывают 10 ед. эндонуклеазы рестрикции BamHI в 1x-кратном буфере R (10 мМ трис-HCl, рН 8,0, 5 мМ MgCl2, 100 мМ KCl, 0,1 мг/мл BSA, 0.02% Triton X-100) в 40 мкл реакционной смеси. Реакцию проводят в течение 1,5 часов при 37°С.
Полученный при этом SapI/BamHI-фрагмент с геном рекомбинантного hEGF лигируют с векторной плазмидой pTWIN-1 (New England BioLabs), расщепленной по тем же сайтам рестриктаз. Лигирование проводят в 20 мкл инкубационной смеси, содержащей: 2 мкл 10х буфера для ДНК-лигазы фага Т4, 2 мкл 5 мМ АТР, 10 ед. ДНК-лигазы фага Т4 и 15 мкл лигазной смеси (pTWIN1 и встраиваемый фрагмент в соотношении 1:3). Реакционную смесь оставляют в холодильнике на ночь при +4°С.
Аликвоту лигазной смеси используют для трансформации компетентных клеток Е.coli ER2566). Трансформанты высевают на чашки с YT-агаром, содержащим 50 мкг/мл ампициллина. Скрининг рекомбинантов проводят с помощью гибридизации колоний in situ с 32P-меченым олигонуклеотидом Р-ter. Из гибридизующихся клонов выделяют ДНК плазмиды pER-hEGF и анализируют с помощью эндонуклеаз BamHI и EcoRI.
Пример 2.
Получение штамма-продуцента Е.coli ER2566/pER-hEGF и определение его продуктивности.
Штамм-продуцент Е.coli ER2566/pER-hEGF получают трансформацией компетентных клеток Е.coli ER2566 плазмидой pER-hEGF, как описано в примере 1. Клетки Е.coli ER2566, несущие плазмиду pER-hEGF, являются суперпродуцентом гибридного белка Int-hEGF (фиг.3Б).
Штамм продуцент Е.coli ER2566/pER-hEGF выращивают при 37°С в 100 мл YT-бульона (рН 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 6 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 сек ультразвуком (18 кГц), нагревают 3 мин при 100°С и пробы по 1 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Shimadzu CS-930.
Пример 3.
Получение гибридного белка Int-hEGF.
Штамм продуцента Е.coli ER2566/pER-hEGF культивируют в среде YT, содержащей 50 мг/мл ампициллина при 37°С до оптического поглощения культуры А595 0.8, затем индуцируют IPTG (до концентрации 0.2 мМ) и выращивают 4 ч при 37°С. Клетки отделяют центрифугированием (5000 g, 20 мин, 4°С). Из 1 л культуры получают 3.0 г влажных клеток. Клетки ресуспендируют в буфере А (50 мМ Трис-HCl, 10 мМ EDTA, 200 мМ NaCl, pH 10.0) и затем разрушают с помощью ультразвукового дезинтегратора (18 кГц, при 4°С). Осадок после центрифугирования (15000 g, 45 мин) отделяют, ресуспендируют в буфере А, снова центрифугируют, промывают буфером В (буфер А, содержащий 1% Тритона Х-100). Осадок телец включения растворяют в буфере С (буфер А, содержащий 6 М мочевину).
Пример 4.
Рефолдинг гибридного белка и одновременная ренатурация hEGF в составе гибридного белка.
Образовавшийся после солюбилизации телец включения раствор разбавляют буфером А до концентрации мочевины 0,5 М при концентрации 0,25 мМ MESNA. Рефолдинг гибридного белка и ренатурация эпидермального фактора роста с образованием нативных S-S связей в составе гибридного белка происходит под воздействием кислорода воздуха в течение 48 ч при 4°С.
Пример 5.
Расщепление гибридного белка Int-hEGF и выделение hEGF.
Ренатурированный гибридный белок наносят на хитиновый сорбент и индуцируют автокаталитическое расщепление за счет смены буфера А на буфер G (буфер А pH 6,5, содержащий 0,25 мМ MESNA), изменяя pH буфера с 10,0 до 6,5. Практически чистый hEGF с окисленными дисульфидными связями элюируют с хитинового сорбента буфером G. Фракции с содержанием белка hEGF не менее 95% объединяют и лиофилизуют. Выход рекомбинантного hEGF составляет 21 мг/л культуры клеток штамма-продуцента.


Изобретение относится к области генной и белковой инженерии и может быть использовано для получения рекомбинантного эпидермального фактора роста человека. Клетки Escherichia coli трансформируют плазмидной ДНК pER-hEGF с получением рекомбинантного штамма Escherichia coli ER2566/pER-hEGF - продуцента гибридного белка Int-hEGF, включающего, наряду со структурой рекомбинантного эпидермального фактора роста человека, структуру интеина. Проводят культивирование полученного штамма Escherichia coli ER2566/pER-hEGF с последующим разрушением клеток в буферном растворе с помощью ультразвука, после разрушения клеток гибридный белок отделяют в виде тел включения, тела включения растворяют в буфере, содержащем 6 М мочевину, ренатурируют гибридный белок, адсорбируют на хитиновом сорбенте, и затем индуцируют автокаталитическое расщепление изменением рН с 10.0 до 7.0 с получением целевого продукта, который элюируют с сорбента. Изобретение позволяет получить высокопродуктивный рекомбинантный бактериальный штамм-продуцент гибридного белка, а также получить рекомбинантный hEGF путем неферментативного автокаталитического расщепления гибридного белка. 3 н.п. ф-лы, 3 ил.
Sap1/BamH1-фрагмента ДНК плазмиды pTWIN-1, содержащего промотор и терминатор транскрипции Т7-РНК-полимеразы, усилитель трансляции гена 10 фага Т7, ген β-лактамазы, ген модифицированного мини-интеина Ssp DnaB со встроенной в него последовательностью хитин-связывающего домена, и Sapl/BamH1-фрагмета ДНК, содержащего последовательность гена рекомбинантного эпидермального фактора роста человека, содержащая в качестве генетического маркера ген β-лактамазы (Ар), детерминирующей устойчивость трансформированных плазмидой pER-hEGF клеток E.coli к пенициллиновым антибиотикам; уникальные сайты узнавания рестрикционных эндонуклеаз, расположенные на следующем расстоянии влево от сайта BamH1: NruI - 186 п.о., NdeI - 594 п.о., XbaI - 882 п.o., EcoRV - 2913 п.o., HpaI - 2966 п.о.
| YU R.J | |||
| et al., Intein-mediated rapid purification of recombinant human pituitary adenylate cyclase activating polypeptide, Acta | |||
| Biochim | |||
| Biophys | |||
| Sin., 2004, v.36, n.11, p.759-766 | |||
| TONG WY et al., An improved procedure for production of human epidermal growth factor from recombinant E.coli, Appl | |||
| Microbiol | |||
| Biotechnol., 2001, v.57, n.5-6, p.674-679 | |||
| ПЕПТИДНЫЙ ВЕКТОР, СПОСОБ ЕГО ПОЛУЧЕНИЯ, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК И ШТАММ ESCHERICHIA COLI B-8389 ВКПМ ДЛЯ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА | 2003 |
|
RU2248983C1 |
Авторы
Даты
2008-05-10—Публикация
2006-05-30—Подача