Область изобретения
Настоящее изобретение относится к применению аллелей гена DYAD и продукта этого гена из Arabidopsis, Boechera, риса и других растений для манипулирования гаметогенезом и развитием семян в целях получения семян, которые в зародыше имеют полный диплоидный геном, комплементарный материнскому. Также настоящее изобретение относится к применению измененного гена DYAD для получения нередуцированного женского гаметофита без существенного влияния на развитие пыльцы.
Предпосылки изобретения
Жизненный цикл растений сменяется между диплоидным спорофитным поколением и гаплоидным гаметофитным поколением. Мейоз представляет собой переход между диплоидной спорофитной и гаплоидной гаметофитной фазами жизненного цикла растений. Мейоз приводит к образованию гаплоидных спор. В растениях, в отличие от животных, продукты мейоза подвергаются дополнительным делениям с образованием многоклеточного гаплоидного гаметофита. Дифференцировка гамет происходит ближе к более поздним стадям развития гаметофита, после деления продуктов мейоза. Таким образом, половой процесс до оплодотворения включает две различные стадии: спорогенез, который включает мейоз и образование гаплоидных спор; и гаметогенез, который относится к развитию спор в гаметофит, содержащий гаметы и ассоциированные с ними клетки, требуемые для оплодотворения и для поддержания роста зародыша.
Большинство видов растений подвергаются половому размножению; однако некоторые виды растений способны к бесполому размножению. Термин апомиксис, как правило, понимают как замену полового размножения определенным формами бесполого размножения (Koltunow A. and Grossniklauss U. Annu. Rev. Plant Biol. Vol. 54: 547-74, 2003). Апомиксис представляет собой генетически контролируемый способ размножения растений, вовлекающий образование семени, в котором зародыш формируется без объединения женской и мужской половой клеток. Существует три основных типа апомиктического воспроизведения: 1) апоспория, при которой зародыш развивается партеногенетически из хромосомно нередуцированной яйцеклетки в зародышевом мешке, образованном из нуцеллуса, 2) диплоспория, при которой зародыш развивается партеногенетически из нередуцированной яйцеклетки в зародышевом мешке, образованном из материнской клетки мегаспор, и 3) адвентивная эмбриония, при которой эмбрион развивается непосредственно из соматической клетки. Первые два типа апомиксиса вместе классифицируют как гаметофитный апомиксис, поскольку в обоих случаях эмбрион развивается из женского гаметофита или зародышевого мешка, в то время как в случае адвентивной эмбрионии эмбрион развивается непосредственно из соматической клетки без промежуточной стадии женского гаметофита. Таким образом, гаметофитный апомиксис включает два компонента: i) апомейоз, или продукцию нередуцированного женского гаметофита (эмбриональный мешок), который сохраняет родительский генотип, и ii) партеногенетическое развитие зародыша с оплодотворением центральной клетки, которая развивается в эндосперм, или без него.
Таким образом, апомиксис представляет собой репродуктивный процесс, который обходит женский мейоз и сингамию, с образованием эмбрионов, генетически идентичных материнскому организму. Три типа апомиксиса обладают экономическим потенциалом, поскольку они могут приводить к передаче потомству любого генотипа, независимо от гетерозиготности. При апомиктическом воспроизведении, потомство особенно адаптивных или гибридных генотипов будет поддерживать их генотип на протяжении повторяющихся жизненных циклов. В дополнение к фиксированному гетерозису, апомиксис может обеспечивать возможность коммерческой продукции гибридов в сельскохозяйственных культурах, где эффективные системы восстановления мужской стерильности или способности к оплодотворению для получения гибридов не известны или не развиты. Таким образом, апомиксис может обеспечить более эффективное развитие гибрида. Также апомиксис упрощает получение гибрида и повышает генетическое разнообразие видов растений с хорошими системами мужской стерильности. Может быть высоко желательным встраивание генов, контролирующих облигатный апомиксис или апомиксис на высоком уровне, в культивируемые виды, и возможность легко гибридизовать перекрестно-совместимые половой и апомиктический генотипы для получения чистосортных гибридов F1. Перенос апомиксиса в важные сельскохозяйственные культуры может обеспечить возможность развития чистосортных гибридов и коммерческую продукцию гибридов без необходимости в цитоплазматической-ядерной мужской стерильности и дорогостоящих трудоемких процессах получения. Облигатно апомиктический гибрид F1 может передавать признак потомству через семена неопределенно долго и можно считать, что он обеспечивает вегетативный или клональный способ размножения через семена. Развитие апомиктически размножающихся сельскохозяйственных культур также может обеспечить значительный вклад в отношении продовольственного обеспечения в развивающихся странах (Spillane C, SteimerA, and Grossniklaus U, Sex. Plant Reprod. 14: 179-187, 2001).
В действительности, большинство известных генов, контролирующих апомиксис, находятся в диких видах, которые имеют отдаленное родство с культивируемыми видами. Хотя межвидовое скрещивание может быть возможным между культивируемыми и дикими видами, спаривание хромосом между геномами, обычно, является низким или не происходит, что приводит к отсутствию успеха этого подхода.
Краткое описание рисунков
На фигуре 1 представлен уменьшенный набор семян в мутантных растениях dyad. Модальный диапазон составляет 1-10 семян на растение.
На фигуре 2 представлена жизнеспособность нормальной пыльцы в мутантных растениях dyad с использованием окрашивания Alexander. (Фигура 2A) дикий тип. (Фигура 2B) dyad.
На фигуре 3 представлен мужской и женский мейоз в случае дикого типа и мутантной формы dyad. (Фигура 3A-C) Дикий тип. (Фигура 3D-F) dyad. (Фигура 3A, D) Мужской мейоцит в конце мейоза 1 (телофаза). (Фигура 3B, E) Мужской мейоцит на стадии тетрады. (Фигура 3C, F) Женский мейоцит в анафазе 1. dyad подвергается эквационному женскому мейозу.
На фигуре 4 представлена плоидность хромосом репрезентативного потомка диплоидного мутантного растения dyad. (Фигура 4A) Соматическая клетка триплоидного растения-потомка, показывающая 15 хромосом. (Фигура 4B) Мужской мейоз 1 триплоидного растения-потомка, несущего 15 хромосом, показывающих сегрегацию 9:6. (Фигура 4C) Соматическая клетка диплоидного растения-потомка, показывающая 10 хромосом.
На фигуре 5 представлена комплементация мутантной формы dyad гомологом DYAD Boechera holboelli: (Фигура 5A) мутантная форма dyad, показывающая неудлиненные стручки. (Фигура 5B) мутантная форма dyad, трансформированная геном BhDYAD, демонстрирующая семена с удлиненными стручками. (Фигура 5C) Сравнение стручков из мутантного растения dyad (1) комплементирующего растения (2) и растения дикого типа (3). (Фигура 5D) Раскрытый стручок комплементирующего растения, показывающий полный набор семян. (Фигура 5E) Раскрытый стручок из растения дикого типа.
На фигуре 6 представлена диаграмма, показывающая кассету pBI101.3::Dyad::(Δ)GR, используемую для конструирования зависимой от условий комплементирующей линии DYAD.
На фигуре 7 представлен полиакриламидный гель, на котором показан полиморфизм CAPS для генотипирования эндогенного локуса DYAD, как описано в примере 6. Фигура 7A: Разделенные расщепленные HinF1 фрагменты амплифицированных посредством праймеров KNEF/KNER продуктов. Фигура 7B: Разделенные расщепленные HinF1 фрагменты амплифицированных посредством праймеров KKF/KKR продуктов.
На фигуре 8 представлена зависимая от условий комплементация фенотипа dyad примера 6.
Фигура 8A: Соцветие, показывающее неудлиненный стручок (фенотип dyad) до и после обработки дексаметазоном. Стрелкой показано положение наиболее молодого открытого цветка в начале обработки. Через 5-7 суток после начала обработки показано удлинение стручков (фенотип дикого типа). Фигура 8B: Отделенные стручки, проявляющие стерильный (dyad) фенотип перед обработкой дексаметазоном. Фигура 8C: показан восстановленный фенотип дикого типа после зависимой от условий комплементации посредством обработки дексаметазоном. Фигура 8D: Раскрытый стручок, показывающий полный набор семян после обработки дексаметазоном.
На фигуре 9 показана морфология семяпочки после зависимой от условий комплементации фенотипа dyad примера 6.
Фигура 9A: Очищенная семяпочка, показывающая фенотип dyad и отсутствие зародышевого мешка на стадии зрелой семяпочки до обработки дексаметазоном. Фигура 9B: Зародышевый мешок, восстановленный после обработки дексаметазоном.
На фигуре 10 показано варьирование размера семян, продуцируемых мутантной формой dyad и различия в размере семян, полученных при реципрокных скрещиваниях между диплоидными и тетрплоидными штаммами Arabidopsis.
Фигура 10A: Семена из самоопыленных диплоидных растений Col-O дикого типа обладают единообразным нормальным размером. Фигура 10B: Семена из тетраплоидного растения. Фигура 10C: Размер семян из самоопыленных растений dyad варьирует между большим (L), нормальным (N) и уменьшенным (S). Фигура 10D: Материнский избыток - семена тетраплоидного женского организма, скрещенного с диплоидным мужским организмом, являются уменьшенными. Фигура 10E: Отцовский избыток - семена тетраплоидного мужского организма, скрещенного с диплоидным женским организмом, являются более крупными по сравнению с семенами от скрещивания с материнским избытком.
На фигуре 11 показано выравнивание белковых последовательностей для белка DYAD из Arabidopsis (SEQ ID NO:5), Boechera (SEQ ID NO:18), риса (SEQ ID NO:51) и тополя (Populus trichocarpa) (SEQ ID NO:26), с использованием Clustal W как на http://www.ebi.ac.uk/clustalw с параметрами по умолчанию.
На фигуре 12 показано выравнивание полипептидных последовательностей DYAD риса (SEQ ID NO:51) с предполагаемыми полипептидными последовательностями DYAD маиса (SEQ ID NO:55 и 54) с использованием Clustal W (1,82). Фигура 12A: Выравнивание аминокислот 1-147 DYAD риса. Фигура 12B: Выравнивание аминокислот 317-803 DYAD риса.
На фигуре 13 показано картирование полипептидной последовательности DYAD из риса по отношению к двум контигам Zea mays, идентифицированным в качестве содержащих кодирующие DYAD последовательности.
Описание изобретения
Существует две основные стратегии, которые можно рассматривать в целях внесения апомиксиса в сельскохозяйственные культуры. Первая представляет собой интрогрессию от родственников дикого типа в сельскохозяйственные виды. Вторая представляет собой идентификацию генов из размножающихся половым путем видов, которые могут обеспечить аспекты апомиксиса, с последующим объединением этих генов для достижения полного спектра апомиксиса. Затем эти гены можно встраивать в сельскохозяйственные культуры с использованием трансгенных способов. Таким образом, например, экспрессию одного или нескольких генов можно использовать для обеспечения апомейоза, и эти гены можно комбинировать с другим набором генов или другими способами обработки в целях индукции партеногенетического развития зародыша. Способы индукции партеногенеза в растениях известны в данной области (см., например, патент США No.5840567). Предпочтительным способом индукции партеногенетического развития для применения в настоящем изобретении является опыление растением с использованием пыльцы, которую облучили, инактивируя посредством этого в ней способность к оплодотворению. (Pandey K.K. and Phung M., Theoret. Appl. Genet., Vol. 62:295-300, 1982; Lofti M. et al, Plant Cell Reprod., Vol. 21:1121-1128, 2003).
Этот способ является предпочтительным, поскольку в нем использовали множество видов растений и, как оказалось, он является общеприменимым, наиболее просто в отношении растений, имеющих неполные цветки (однодомных и двудомных). Однако его можно применять к гермафродитным растениям, имеющим полные цветки, в которых мужскую часть сделали стерильной или из которых фертильную пыльцу механически удалили или отделили.
Конкретная доза облучения для стерилизации пыльцы будет варьировать в зависимости от особенностей вида. Как правило, достаточной является доза приблизительно от 10 до 2000 Грэй. Предпочтительно, доза составляет приблизительно от 100 до 500 Грэй, более предпочтительно от 200 до 250 Грэй.
Успешную индукцию партеногенеза можно выявить скринингом семян в отношении наличия зародышей, например посредством разрезания или посредством наблюдения семян на столе для осмотра с подсветкой после культивирования в жидкой среде, как описано Lofti M. et al., Plant Cell Reprod., Vol. 21: 1121-1128, 2003.
Были предприняты попытки внесения апомиктического признака в размножающиеся в норме половым путем культуры. Asker S. (Hereditas, Vol. 91: 231-241, 1979) описывает, что попытки не были успешными в случае пшеницы, сахарной свеклы и маиса. В публикации PCT WO 89/00810 (Maxon et al, 1989) описана индукция апомиктической формы размножения в культивируемых растениях с использованием экстрактов из неодомашненных стерильных растений люцерны. Когда индукцию мужской стерильности оценивали в сорго, подсолнухе, просе американском и томате, описано, что в сорго, подсолнухе и просе американском был уменьшен набор семян и в томате был снижен набор плодов.
Несмотря на то, что апомиксис эффективно используют в Citrus для получения единообразного и не обладающего заболеваниями и вирусами корневища (Parlevliet J. E. et al., in Citrus. Proc. Am. Soc. Hort. Sci., Vol. 74: 252-260, 1959), и в буйволиной траве (Bashaw, Crop Science, Vol. 20: 112, 1980) и Poa (Pepin et al., Crop Science, Vol. 11: 445-448, 1971) для получения улучшенных сортов, он не был успешно перенесен в сельскохозяйственные растения.
Второй подход в направлении обеспечения апомиксиса вовлекает идентификацию связанных с апомиксисом генов в размножающихся половым путем видах, и манипулирование с ними. Связанная с развитием точка зрения на апомиксис позволяет предположить, что апомиксис связан с половым размножением и вовлекает действие генов, которые также участвуют в каскаде полового размножения (Tucker M.R. et al., Plant Cell, Vol. 15(7): 1524- 1537, 2003). При половом размножении, как правило, материнская клетка мегаспор, образующаяся из гиподермального слоя в направлении верхушки развивающейся семяпочки, увеличивается и проходит мейоз и два клеточных деления с образованием линейной тетрады мегаспор, каждая из которых обладает гаплоидным набором хромосом. Наиболее часто среди различных видов растений, три наиболее апикальных споры подвергаются дегенерации, в то время как функциональная халазальная спора претерпевает три раунда ядерного деления, сопровождающиеся ростом клеток с образованием зародышевого мешка с яйцеклеткой, двумя полярными ядрами, двумя синергидами и тремя противоположно расположенными клетками. Апомиксис представляет собой процесс, который требует множества стадий, и контроль полного каскада апомиксиса, как было показано для определенных видов, требует действия множества генов (van Dijk et al., Heredity, Vol. 83: 715-721,1999; Matzk F., et al., Plant Cell, 17(l):13-24, 2005). Считалось, что отдельные составляющие стадии, контролируемые одним или рядом генов в каскаде, действующие по отдельности, могут оказывать отрицательный эффект на способность к оплодотворению (Spillane C, Steimer A. and Grossniklaus U., Sex. Plant Reprod. Vol. 14: 179-87, 2001), и что только согласованное действие полного набора генов, включающего весь каскад, способно эффективно обеспечивать апомиксис. Генетический и молекулярный анализ мутантных форм Arabidopsis привел к идентификации ряда генов, которые участвуют в стадиях спорогенеза и гаметогенеза (Yang W. C. and Sundaresan V., Curr. Opin. Plant Biol. Vol. 3(1): 53-57, 2000). Мутантную форму dyad в Arabidopsis идентифицировали, как вызывающую женскую стерильность (Siddiqi I. et al., Development, Vol. 127(1):197-207, 2000) и ее анализ показал, что мутантные растения dyad являются дефектными при женском мейозе. Большинство женских мейоцитов в мутантной форме dyad претерпевают однократное деление мейозом с образованием двух клеток вместо четырех, с последующей остановкой дальнейших стадий развития, включая гаметогенез. Было выявлено, что мужской мейоз, развитие пыльцы, и мужская способность к оплодотворению у мутантной формы dyad являются нормальными (Siddiqi I. et al., Development, Vol. 127(1):197-207, 2000; Reddy T. V., et al., Development, Vol. 130 (24):5975-5987, 2003). Анализ мейотических хромосом в процессе женского мейоза показал, что гомологичные хромосомы не подвергаются конъюгации и что редукционное 1 деление мейоза заменяется эквационным (Agashe B., Prasad C. K., and Siddiqi I., Development, Vol. 129(16), 3935-3943, 2002). Независимое исследование привело к идентификации гена SWI1 (Motamayor J. C., et al., Sex. Plant Reprod. Vol. 12:209-218, 2000; Mercier R., et al., Genes and Dev. Vol. 15: 1859-1871, 2001), который является идентичным DYAD. Ген, идентифицированный с помощью этих исследований, в дальнейшем в настоящем документе обозначают как ген DYAD. Ген DYAD дикого типа из Arabidopsis кодирует белок из 639 аминокислот (SEQ ID NO:5). Описано три аллеля гена DYAD в Arabidopsis. Они представляют собой: i) dyad, имеющий укорочение с 508 аминокислоты; таким образом, в полученном белке отсутствует 130 C-концевых аминокислот, имеющихся в белке дикого типа; ii) swi1.1, вызывающий продукцию сниженных количеств белка дикого типа, что приводит к тому, что некоторые женские мейоциты претерпевают эквационное 1 деление мейоза, в то время как другие претерпевают редукционное деление; и iii) swi1.2 который создает стоп-кодон в положении 394 и приводит к женскому фенотипу, сходному с dyad, но также дополнительно приводит к дефектам мужского мейоза, приводящим к мужской стерильности. Положение, соответствующее аллелю dyad в Boechera может представлять собой мутацию, которая обеспечивает сдвиг рамки считывания в положении 508 аминокислотной последовательности и приводит к стоп-кодону после десяти дополнительных кодонов (т.е. в положении 518). Соответствующие положения в рисе находятся в 563 и 572 положениях соответственно.
Без связи этого изобретения с какой-либо теорией, авторы изобретения предполагают, что уменьшение количества белка DYAD, имеющего участок полипептида, являющегося C-концевым относительно положения 394 (в Arabidopsis, и соответствующих положений других видов) приводит к фенотипу, при котором женские мейоциты претерпевают эквационное 1 деление мейоза, что приводит к сохранению женского генотипа (и, таким образом, гетерозиготности) в женских гаметах. Сохранение нормального (или приблизительно такого) количества белка DYAD, имеющего домен от положения 394 до положения 508 (в Arabidopsis и в соответствующих положениях в других видах) обеспечивает нормальное развитие пыльцы, в то время как устранение этого домена в растении приводит к стерильному мужскому фенотипу.
До создания настоящего изобретения, не было описано, что растения, гомозиготные по аллелям dyad или swi1.2, обладают набором семян. Было описано, что растения, несущие аллель swi1.1, обладают уменьшенным набором семян, когда они являются гомозиготными, однако образованные семена анализировали в отношении их хромосомного состава и было выявлено, что они являются диплоидными, показывая, таким образом, что семена появляются в результате нормального мегаспорогенеза и мегагаметогенеза (Motamayor J. C, et al., Sex. Plant Reprod. Vol. 12:209-218, 2000). Как описано ранее, споры, образующиеся в результате эквационного однократного деления мейозом в dyad, swi1.1 и swi1.2 остаются на стадии остановки и до создания настоящего изобретения, не было известно, обладают ли какие-либо из них потенциалом в отношении развития в женские гаметы. Также до создания настоящего изобретения не было известно, претерпевают ли хромосомы рекомбинацию в процессе эквационного однократного деления женским мейозом и теряют ли продукты в результате исходную гетерозиготность. Вероятность рекомбинации, сопровождающей эквационное деление, подтверждается исследованиями на дрожжах, которые показывают, что диплоидные клетки могут входить в мейоз, претерпевать мейотическую рекомбинацию, а затем выходить из мейоза при переносе в среду для роста, и делиться митотически. Такое митотическое деление может приводить к потере гетерозиготности в отношении генетического маркера, если рекомбинация произошла между геном и центромерой (Esposito R. E. and Esposito M. S., Proc. Natl. Acad. Sci. USA Vol. 71(8): 3172-3176 1974). Настоящее изобретение относится к открытию, что продукты эквационного 1 деления мейоза, выявляемые в различных гомозиготных по dyad мутантных растениях, способны давать начало функциональному нередуцированному зародышевому мешку, который обладает характерными признаками апомейоза, важного компонента апомиксиса.
Настоящее изобретение относится к применению гена DYAD, особенно его мутантных аллелей, и их генных продуктов, из Arabidopsis, Boechera, Rice, Populus и других растений для манипулирования гаметогенезом и развитием семян с целью получения семян, зародышевый генотип которых содержит полный диплоидный геном, комплементарный материнскому. В одном варианте осуществления продуцируют триплоидные семена в Arabidopsis и других типах растений. Также настоящее изобретение относится к способу получения гетерозисного растения с использованием мутантных аллелей гена DYAD и продукта гена. В некоторых вариантах осуществления, растения и семена содержат полный диплоидный геном, комплементарный материнскому, и в них отсутствует вклад отцовского генома, и, таким образом, они являются истинными апомиктами. В некоторых примерах этих вариантов осуществления, растение, приводящее к материнскому геному, представляет собой гибрид, обладающий набором аллелей, имеющим требуемый фенотип, и способ по этому изобретению позволяет фиксацию и легкое воспроизведение этого сочетания аллелей.
Настоящее изобретение относится к применению гена DYAD и его генного продукта, которые приводят к образованию семян, содержащих полный диплоидный геном, комплементарный материнскому. Это изобретение является пригодным для получения триплоидных растений, которые можно использовать для получения не содержащего семян плода, для конструирования трисомных линий для исследований по картированию, и для поддержания гетерозиготности родительского растения и апомиксиса. Аллели DYAD, используемые в настоящем изобретении, приводят к образованию нередуцированного (диплоидного) зародышевого мешка. Также это изобретение относится к применению гена DYAD для обеспечения образования нередуцированного зародышевого мешка без существенного влияния на развитие пыльцы. Кроме того, это изобретение относится к применению гена DYAD для продукции полиплоидов более высокого порядка посредством самоопыления триплоидов, которое может быть пригодным для целей создания растений с повышенной биомассой.
Следует понимать, что различные варианты осуществления этого изобретения будут проявлять различные аспекты этого изобретения, и они могут обеспечить различные преимущества этого изобретения. Не каждый вариант осуществления будет обладать всеми преимуществами этого изобретения.
Определения
Выражение "последовательность нуклеиновой кислоты" относится к структуре полимера дезоксирибонуклеотидных или рибонуклеотидных оснований, считываемой от 5'- к 3'-концу. В случаях двухцепочечной нуклеиновой кислоты, "последовательность нуклеиновой кислоты" включает комплементарную ей последовательность на другой цепи.
"Нуклеиновая кислота" или "полинуклеотид" относится к одноцепочечному или двухцепочечному полимеру ДНК или РНК (или в некоторых случаях аналогов дезоксирибонуклеотидов или рибонуклеотидов, таких как тиофосфатные аналоги или аналоги PNA, или нуклеотиды, имеющие производные нуклеотидного основания) и включает хромосомную ДНК, самореплицирующиеся плазмиды, инфекционные полимеры ДНК или РНК (или аналогов) и ДНК или РНК (или аналоги), которые выполняют, главным образом, структурную функцию.
Термин "полинуклеотидная последовательность" часто является взаимозаменяемым с термином "полинуклеотид", однако иногда он может относиться к информации о последовательности молекулы, а не к самой молекуле.
"Промотор" определяют как ряд контролирующих последовательностей нуклеиновых кислот, которые направляют транскрипцию функционально связанной нуклеиновой кислоты. Как используют в настоящем документе, "растительный промотор" представляет собой промотор, который функционирует в растениях. Промоторы включают необходимые последовательности нуклеиновых кислот вблизи точки начала транскрипции, такие как в случае базального промотора полимеразы II типа, TATA-элемент. Также промотор необязательно включает отдаленные энхансерные или репрессорные элементы, которые могут быть расположены на расстоянии вплоть до нескольких тысяч пар оснований от участка начала транскрипции. "Конститутивный" промотор представляет собой промотор, который является активным в естественных условиях и условиях развития. "Индуцибельный" промотор представляет собой промотор, который является активным при естественной регуляции или связанной с развитием регуляции. Термин "функционально связанный" относится к функциональной связи между контролирующей экспрессию последовательностью нуклеиновой кислоты (такой как промотор или группа участков связывания факторов транскрипции) и второй последовательностью нуклеиновой кислоты, где последовательность контроля экспрессии направляет транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
"Экспрессирующая кассета" содержит три основных элемента: i) промотор; ii) второй полинуклеотид, который может быть назван "кодирующим полинуклеотидом" или "кодирующей последовательностью", который функционально связан с промотором и транскрипция которого направляется указанным промотором при введении экспрессирующей кассеты в клетку; и iii) терминирующий полинуклеотид, который осуществляет прекращение транскрипции и расположен непосредственно ниже указанного второго полинуклеотида.
Термин "растение" включает целые растения, органы растений (например, листья, стебли, цветки, корни и т.д.), семена и клетки растений и их потомков. Класс растений, который можно использовать в способе по этому изобретению, главным образом, является настолько широким, каким является класс высших растений, пригодных для способов трансформации, включая покрытосемянные (однодольные и двудольные растения), а также голосемянные. Он включает растения с различными уровнями плоидности, включая полиплоидный, диплоидный и гаплоидный уровни. В некоторых вариантах осуществления этого изобретения предпочтительно, чтобы растение представляло собой однодомное растение.
Полинуклеотид является "гетерологичным" организму или второму полинуклеотиду, если он обладает отличающейся последовательностью и его источником является чужеродный вид, или, если его источником является тот же вид, он модифицирован по сравнению с его исходной формой. Например, промотор, функционально связанный с гетерологичной кодирующей последовательностью, относится к кодирующей последовательности из вида, отличающегося от вида, который является источником промотора, или, если он из того же вида, то к кодирующей последовательности, которая отличается от любых встречающихся в природе аллельных вариантов.
Полинуклеотид, являющийся "экзогенным" для отдельного растения, представляет собой полинуклеотид, который вводят в растения способами, отличными от полового скрещивания. Примеры способов, которыми можно проводить введение, описаны ниже, и они включают опосредуемую Agrobacterium трансформацию, биолистические способы, электропорацию и т.п. Такое растение, содержащее экзогенную нуклеиновую кислоту, называют в настоящем описании поколением R1 трансгенного растения. Трансгенные растения, которые возникают при половом скрещивании или посредством самоопыления, являются потомками такого растения.
"Нуклеиновая кислота DYAD" или "полинуклеотидная последовательность DYAD", используемая в этом изобретении, представляет собой подпоследовательность или полноразмерную полинуклеотидную последовательность нуклеиновой кислоты, которая кодирует полипептид, вовлеченный в контроль мейоза, и которая, при мутации, обеспечивает аспекты апомиксиса в отношении образования нередуцированного женского гаметофита.
"Ген DYAD" включает нуклеиновую кислоту DYAD совместно с промотором и другими последовательностями контроля транскрипции и трансляции, которые обеспечивают экспрессию продукта гена DYAD в клетке-хозяине, предпочтительно в растении.
Гены DYAD представляют собой класс генов растений, которые приводят к транскриптам, содержащим кодирующие белок участки, которые кодируют полипептиды, обладающие значительной идентичностью последовательности с полипептидом, кодируемым геном DYAD Arabidopsis (SEQ ID NO:1), и они были идентифицированы в рисе (Genbank ID: 62733414) и других растениях. Также ген DYAD был идентифицирован в Populus trichocarpa и Zea mays (пример 9). Ген DYAD находится в виде одной копии в Arabidopsis дикого типа. Более того, содержание транскрипта является очень низким, поскольку он экспрессируется только в спороцитах, которые составляют очень небольшую группу клеток в репродуктивных тканях. Ранее было показано, что ген DYAD Arabidopsis играет критическую роль в мейотической хромосомной организации (Agashe B., Prasad C. K., and Siddiqi I., Development Vol. 129(16): 3935-39432002). Таким образом, очень вероятно, что его функция является консервативной в растениях других видов, как показывают по наличию близко родственного гена в рисе. Данные в настоящей заявке показывают, что Boechera также обладает геном DYAD, близко сходным по последовательности с геном DYAD Arabidopsis.
В случае как экспрессии трансгенов, так и ингибирования эндогенных генов (например, посредством РНК-интерференции, антисмыслового или смыслового подавления) специалист поймет, что используемая полинуклеотидная последовательность не должна быть идентичной, а она может быть только "по существу идентичной" последовательности гена, из которого она была образована, или полинуклеотида, который подлежит ингибированию. Как объяснено ниже, эти по существу идентичные варианты конкретно охватываются термином "нуклеиновая кислота DYAD".
В случае когда полинуклеотидная последовательность транскрибируется и транслируется с образованием функционального полипептида, специалист поймет, что вследствие вырожденности кодонов ряд полинуклеотидных последовательностей будет кодировать один и тот же полипептид. Эти варианты конкретно охватываются терминами "нуклеиновая кислота DYAD". Кроме того, термин конкретно включает последовательности, по существу идентичные (определенные, как описано ниже) с полинуклеотидной последовательностью DYAD, описанной в настоящем документе, и которые кодируют полипептиды, которые либо представляют собой мутантные формы полипептидов DYAD дикого типа, либо сохраняют функцию полипептида DYAD (например, вследствие консервативных замен аминокислот в полипептиде DYAD). Кроме того, варианты могут представлять собой варианты, которые кодируют доминантно-негативные мутантные формы, как описано ниже, а также нонсенс-мутантные формы или мутантные формы со сдвигом рамки считывания, которые приводят к преждевременной терминации трансляции.
Две нуклеиновых кислоты или два полипептида называют "идентичными", если последовательность нуклеотидов или аминокислотных остатков, соответственно, в двух молекулах является одинаковой при выравнивании на максимальное соответствие, как описано ниже. Термины "идентичный" или "процентная идентичность" в контексте двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей относятся к двум или нескольким последовательностям или подпоследовательностям, которые являются одинаковыми или обладают определенным процентным количеством аминокислотных остатков или нуклеотидов, которые являются одинаковыми, при сравнении и выравнивании на максимальное соответствие на протяжении окна сравнения, как определяют с использованием одного из представленных ниже алгоритмов сравнения последовательностей или посредством выравнивания вручную и визуального исследования. Когда процентную идентичность последовательностей используют в отношении белков или пептидов, известно, что положения остатков, которые не являются идентичными, часто отличаются посредством консервативных аминокислотных замен, где аминокислотные остатки замещены другими аминокислотными остатками со сходными химическими свойствами (например, заряд или гидрофобность) и таким образом, не изменяющими функциональные свойства молекулы. Когда последовательности отличаются консервативными заменами, процентную идентичность последовательностей можно повышать для коррекции вследствие консервативной природы замены. Способы проведения этой коррекции хорошо известны специалистам в данной области. Как правило, они вовлекают оценку консервативной замены как частичного, а не полного несоответствия оснований, повышая посредством этого процентную идентичность последовательностей. Таким образом, например, когда идентичной аминокислоте присваивают показатель 1 и неконсервативной замене присваивают показатель ноль, консервативной замене присваивают показатель между нулем и 1. Оценку консервативных замен проводят, например, в соответствии с алгоритмом Meyers & Miller, Computer Applic. Biol. Sci. 4:11-17 (1988) например, как выполнено в программе PC/GENE (Intelligenetics, Mountain View, Calif., USA).
Выражение "по существу идентичные" в контексте двух нуклеиновых кислот или полипептидов, относится к последовательностям или подпоследовательностям, которые обладают по меньшей мере 60%, предпочтительно 80%, наиболее предпочтительно 90-95% идентичностью нуклеотидных или аминокислотных остатков при выравнивании на максимальное соответствие на протяжении окна сравнения, как определяют с использованием одного из представленных ниже алгоритмов сравнения последовательностей или посредством выравнивания вручную и визуального исследования. Также это определение относится к последовательности, комплементарной тестируемой последовательности, которая обладает значительной комплементарностью последовательности или подпоследовательности, когда тестируемая последовательность обладает значительной идентичностью с контрольной последовательностью.
Для сравнения последовательностей, как правило, одна последовательность выступает в качестве контрольной последовательности, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей, тестируемую и контрольную последовательности вводят в компьютер, обозначают координаты подпоследовательностей, если необходимо, и обозначают параметры программы с алгоритмом для последовательностей. Обычно используют параметры программы по умолчанию, однако также могут быть указаны альтернативные значения для параметров. Затем алгоритм сравнения последовательностей вычисляет процентные идентичности последовательностей для тестируемых последовательностей относительно контрольной последовательности, на основе параметров программы.
Как используют в настоящем документе, "окно сравнения" включает указание на сегмент соседних положений, как правило, от 20 до 600, обычно от приблизительно 50 до приблизительно 200, более обычно от приблизительно 100 до приблизительно 150 соседних положений, в которых последовательность можно сравнивать с контрольной последовательностью из такого же количества соседних положений после оптимального выравнивания двух последовательностей. Способы выравнивания последовательностей хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения, например, можно проводить посредством алгоритма локальной гомологии Smith & Waterman, Adv. Appl. Math. 2:482 (1981), посредством алгоритма для выравнивания по гомологии Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), посредством способа поиска сходства Pearson & Lipman, Proc. Natl. Acad. Sci. USA 85:2444 (1988), посредством компьютерных осуществлений этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wis.), или посредством выравнивания вручную и визуального исследования.
Одним примером пригодного алгоритма является PILEUP. PILEUP проводит множественное выравнивание последовательностей из группы сходных последовательностей с использованием прогрессирующих попарных выравниваний, показывая взаимосвязь и процентную идентичность последовательностей. Также он строит дерево или дендрограмму, показывающую кластеризацию взаимосвязей, используемую для проведения выравнивания. PILEUP использует упрощение способа прогрессирующего выравнивания Feng D. F., & Doolittle, R.F., J. Mol. Evol. Vol. 35:351-360 (1987). Используемый способ является сходным со способом, описанным Higgins & Sharp, CABIOS 5:151-153 (1989). Программа может выравнивать вплоть до 300 последовательностей, с максимальной длиной каждой из которых, составляющей 5000 нуклеотидов или аминокислот. Процесс множественного выравнивания начинается с попарного выравнивания двух наиболее сходных последовательностей, приводящему к кластеру из двух выровненных последовательностей. Затем этот кластер выравнивают со следующей наиболее сходной последовательностью или кластером выровненных последовательностей. Два кластера последовательностей выравнивают простым продолжением попарного выравнивания двух отдельных последовательностей. Конечное выравнивание проводят посредством серии прогрессирующих попарных выравниваний. Программа выполняется посредством указания конкретных последовательностей и их аминокислотных или нуклеотидных координат для участков сравнения последовательностей и посредством указания параметров программы. Например, контрольную последовательность можно сравнивать с другими тестируемыми последовательностями в целях определения взаимосвязи процентных идентичностей последовательностей с использованием следующих параметров: штраф за делецию по умолчанию (3.00), штраф за продолжение делеции по умолчанию (0.10), и оцениваемые концевые делеции.
Другим примером алгоритма, пригодного для определения процентной идентичности последовательностей и сходства последовательностей является алгоритм BLAST, который описан в Altschul S.F., et al., J. Mol. Biol. Vol. 215: 403-410 (1990). Программное обеспечение для проведения анализа BLAST является общедоступным через National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/). Этот алгоритм включает первоначальную идентификацию пар последовательностей с максимальным сходством (HSP) посредством идентификации коротких слов длиной W в представляющей интерес последовательности, которые либо совпадают, либо удовлетворяют некоторому оцениваемому положительно порогу значения T при выравнивании со словом такой же длины в последовательности из базы данных. T определяется как порог значений для соседних слов (Altschul S. F., et al., J. Mol. Biol. Vol. 215: 403-410 (1990). Эти первоначальные совпадения соседних слов выступают в роли предшественников для начала поиска в целях обнаружения более длинных HSP, содержащих их. Поиск совпадений слов распространяется в обоих направлениях вдоль каждой последовательности до тех пор, пока суммарное значение для выравнивания может повышаться. Продолжение поиска совпадений слов в каждом направлении останавливается, если: суммарное значение для выравнивания снижается по величине X ниже максимально достижимого значения; суммарное значение снижается до нуля или ниже, при накоплении одного или нескольких выровненных остатков с отрицательным значением; или если достигают конца любой последовательности. Параметры алгоритма BLAST W, T и X определяют чувствительность и скорость выравнивания. Программа BLAST (для нуклеотидных последовательностей) использует в качестве параметров по умолчанию длину слова (W) 11, оценочную матрицу BLOSUM62 (см. Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89:10915, 1989) фрагменты для выравнивания (B) 50, ожидаемое значение (E) 10, M=5, N=-4 и сравнение обеих цепей.
Также алгоритм BLAST осуществляет статистический анализ сходства между двумя последовательностями (см., например, Karlin & Altschul, Proc. Natl. Acad. Sci. USA 90:5873, 1993). Одним показателем сходства, обеспечиваемый алгоритмом BLAST, является наименьшая суммарная вероятность (P(N)), которая предполагает указание вероятности, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями может произойти случайным образом. Например, нуклеиновая кислота рассматривается как сходная с контрольной последовательностью, если наименьшая суммарная вероятность при сравнении анализируемой нуклеиновой кислоты с контрольной нуклеиновой кислотой составляет менее чем приблизительно 0,2, более того, в одном аспекте менее чем приблизительно 0,01, и, более всего, в одном аспекте менее чем приблизительно 0,001.
"Консервативно модифицированные варианты" применяют в отношении последовательностей как аминокислот, так и нуклеиновых кислот. В отношении конкретных последовательностей нуклеиновых кислот, консервативно модифицированные варианты относятся к нуклеиновым кислотам, которые кодируют идентичные или по существу идентичные аминокислотные последовательности, или, где нуклеиновая кислота не кодирует аминокислотную последовательность, к по существу идентичным последовательностям. Вследствие вырожденности генетического кода, любой данный белок кодируется большим количеством функционально идентичных нуклеиновых кислот. Например, все из кодонов GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, где кодоном определяется аланин, кодон может быть заменен на любые соответствующие указанные кодоны без изменения кодируемого полипептида. Такие варианты нуклеиновых кислот являются "молчащими вариантами", которые представляют собой один вид консервативно модифицированных вариантов. Каждая последовательность нуклеиновой кислоты, представленная в настоящем документе, которая кодирует полипептид, также описывает все возможные молчащие варианты нуклеиновой кислоты. Специалист поймет, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном для метионина) можно модифицировать с получением функционально идентичной молекулы. Таким образом, для каждой описанной последовательности подразумевается каждый молчащий вариант нуклеиновой кислоты, который кодирует полипептид.
"По существу идентичная последовательность" представляет собой последовательность, в которой изменение последовательности не влияет на предполагаемую функцию молекулы.
В отношении аминокислотных последовательностей, специалист поймет, что отдельные замены, делеции или вставки в нуклеиновую кислоту, пептид, полипептид или белковую последовательность, которые изменяют, добавляют или удаляют отдельную аминокислоту или небольшое процентное количество аминокислот в кодируемой последовательности, представляют собой "консервативно модифицированный вариант", когда изменение приводит к замене аминокислоты химически сходной аминокислотой. Таблицы консервативных замен, в которых представлены функционально сходные аминокислоты, хорошо известны в данной области.
Ниже представлено шесть групп, каждая из которых содержит аминокислоты, которые представляют собой консервативные замены друг для друга:
1) Аланин (A), Серин (S), Треонин (T);
2) Аспарагиновая кислота (D), Глутаминовая кислота (E);
3) Аспарагин (N), Глутамин (Q);
4) Аргинин (R), Лизин (K);
5) Изолейцин (I), Лейцин (L), Метионин (M), Валин (V); и
6) Фенилаланин (F), Тирозин (Y), Триптофан (W). (см., например, Creighton, Proteins (1984)).
Признаком того, что две последовательности нуклеиновых кислот или полипептидов являются по существу идентичными, является то, что полипептид, кодируемый первой нуклеиновой кислотой, является иммунологически перекрестно-реактивным в отношении антител, индуцированных против полипептида, кодируемого второй нуклеиновой кислотой. Таким образом, полипептид, как правило, является по существу идентичным второму полипептиду, например, где два пептида отличаются только консервативными заменами. Другим признаком того, что две последовательности нуклеиновых кислот являются по существу идентичными, является то, что две молекулы или комплементарные им молекулы гибридизуются друг с другом в строгих условиях, как описано ниже.
Выражение "селективно (или специфично) гибридизуется с" относится к связыванию, образованию дуплекса или гибридизации молекулы только с конкретной нуклеотидной последовательностью в строгих условиях гибридизации, когда эта последовательность находится в комплексной смеси (например, тотальная клеточная ДНК или РНК, или ДНК или РНК библиотеки).
Выражение "строгие условия гибридизации" относится к условиям, в которых зонд будет гибридизоваться с его подпоследовательностью-мишенью, как правило, в комплексной смеси нуклеиновых кислот, но не с другими последовательностями. Строгие условия являются зависимыми от последовательности и они будут различными в различных условиях. Более длинные последовательности гибридизуются специфично при более высоких температурах. Обширное руководство по гибридизации нуклеиновых кислот находится в Tijssen, Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Probes, "Overview of principles of hybridizatoin and the strategy of nucleic acid assays", Elsevier (1993). Как правило, строгие условия выбирают приблизительно на 5-10°C ниже температуры плавления Tm конкретной последовательности при определенной ионной силе и pH. Условия низкой строгости, как правило, выбирают, чтобы они составляли приблизительно на 15-30°C ниже Tm. Tm представляет собой температуру (при определенной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% зонда, комплементарного мишени, равновесно гибридизуется с последовательностью-мишенью (поскольку последовательности-мишени представлены в избытке, при равновесии при Tm окупируются 50% зонда). Строгие условия представляют собой условия, при которых концентрация соли представляет собой приблизительно менее чем 1,0 M концентрацию ионов натрия, как правило, приблизительно от 0,01 до 1,0 M концентрацию ионов натрия (или других солей) при pH от 7,0 до 8,3, и температура составляет по меньшей мере приблизительно 30°C для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере приблизительно 60°C для длинных зондов (например, более 50 нуклеотидов). Строгие условия также можно создавать с помощью добавления дестабилизаторов, таких как формамид. Для селективной или специфичной гибридизации положительный сигнал по меньшей мере в два раза превышает фоновую гибридизацию, предпочтительно в 10 раз превышает фоновую гибридизацию.
Нуклеиновые кислоты, которые не гибридизуются друг с другом в строгих условиях, тем не менее, являются по существу идентичными, если полипептиды, которые они кодируют, являются по существу идентичными. Это происходит, например, когда создают копию нуклеиновой кислоты с использованием максимальной вырожденности кодонов, допускаемой генетическим кодом. В таких случаях, нуклеиновые кислоты, как правило, гибризидуются в умеренно строгих условиях гибридизации.
В настоящем изобретении, геномную ДНК или кДНК, содержащую нуклеиновые кислоты DYAD, подлежащие применению в этом изобретении, можно идентифицировать на стандартных саузерн-блотах в строгих условиях с использованием последовательностей нуклеиновых кислот, описанных в настоящем документе. Для целей этого описания, пригодные строгие условия для таких гибридизаций представляют собой условия, которые включают гибридизацию в буфере из 40% формамида, 1 M NaCl, 1% SDS при 37°C, и по меньшей мере одно промывание в от 0,1X до 1X SSC, предпочтительно 0,5X SSC, более предпочтительно 0,2X SSC при температуре по меньшей мере приблизительно 50°C, как правило, приблизительно 55°C, вплоть до приблизительно 60°C, в течение 20 минут, или эквивалентные условия. Положительная гибридизация по меньшей мере в два раза превышает фоновый сигнал. Специалисты в данной области легко поймут, что можно использовать альтернативные условия гибридизации и промывания для обеспечения условий сходной строгости.
Следующим признаком того, что два полинуклеотида являются по существу идентичными, является то, что контрольную последовательность, амплифицированную парой олигонуклеотидных праймеров, затем можно использовать в качестве зонда в строгих условиях гибридизации для выделения тестируемой последовательности из библиотеки кДНК или геномной библиотеки, или для идентификации тестируемой последовательности, например, в нозерн-блотах или саузерн-блотах.
"Гибрид растения" определяют как растение, полученное скрещиванием двух культиваров одного вида растений.
"Межвидовой гибрид" определяют как растение, полученное скрещиванием двух растений различных видов.
"Женское родительское растение" в репродуктивном процессе определяют как растение, которое образует семя.
Настоящее изобретение относится гену DYAD и его продукту и способам, вовлекающим применение молекулярно-генетических подходов для контроля развития семени и апомиксиса. Кроме того, это изобретение относится к мутантным аллелям гена DYAD, которые экспрессируют укороченную форму полипептида DYAD, лишенную C-концевой части нативного белка, и вызывают развитие нередуцированного женского гаметофита, в то же время по существу не изменяя развитие пыльцы, как определяют посредством анализов жизнеспособности пыльцы и микроскопического исследования сегрегации хромосом при мужском мейозе. Также оно относится к нуклеотидным последовательностям специфичного для женского организма аллеля гена DYAD, который кодирует полипептид DYAD, лишенный C-концевой части нативного полипептида DYAD, и так что экспрессия мутантного полипептида в растениях специфично приводит к развитию нередуцированного женского гаметофита, но по существу не влияет на разлитие пыльцы. Такой мутантный аллель может экспрессировать полипептид DYAD, который, например, в случае мутантного аллеля из Arabidopsis, лишен всей нативной полипептидной последовательности между аминокислотой 509 и аминокислотой 639 в SEQ ID NO:5 или ее части, но содержит весь участок, кодирующий полипептидные последовательности вплоть до аминокислоты 394. Кроме того, оно также относится к нуклеотидным последовательностям, которые гибридизуются в строгих условиях с последовательностью, приведенной в SEQ ID NO:4 и которые кодируют производные нативных полипептидов DYAD с C-концевой делецией, где делеция соответствует участку между аминокислотами 509 и 639 в SEQ ID NO:5, как определяют сравнением с SEQ ID NO:5 с использованием окна сравнения. Соответствующие участки белков DYAD Boechera, Rice и Populus могут быть идентифицированы с учетом фигуры 11. Композиции по этому изобретению также содержат производные последовательностей нативного полипептида DYAD с C-концевой делецией и слитые белки и нуклеиновые кислоты, которые их кодируют, образованные из указанных выше полипептидов DYAD и белковых последовательностей, таких как белки рецепторов глюкокортикоидного гормона, которые в зависимости от условий транспортируют слитый белок в ядро растительной клетки.
Способы по этому изобретению включают экспрессию полинуклеотидных последовательностей DYAD в растениях для получения нередуцированных женских гамет, которые сохраняют генотип родителя. Получение таких нередуцированных женских гамет является пригодным для обеспечения апомиксиса и для фиксации гетерозиса, а также для получения триплоидных растений. В одном варианте осуществления этого изобретения полинуклеотидную последовательность DYAD можно встраивать в геном растения любым из нескольких хорошо известных способов трансформации, где она экспрессируется в растении в качестве антисмысловой последовательности или в качестве двухцепочечной РНК, что приводит, таким образом, к ингибированию эндогенного гена DYAD и обеспечению продукции нередуцированных женских гамет. В другом варианте осуществления этого изобретения C-концевую делецию полинуклеотидной последовательности DYAD вносят в геном растения в качестве части экспрессирующей кассеты, и она приводит к образованию нередуцированных женских гаметофитов, в то же время, по существу не изменяя развитие пыльцы. Затем экспрессию полинуклеотидных последовательностей DYAD в растениях, приводящую к образованию нередуцированного женского гаметофита, можно использовать для получения апомиктических семян посредством партеногенетического развития яйцеклетки в зародыш. Экспрессия таких полинуклеотидных последовательностей DYAD в гибридах растений приводит к образованию нередуцированных женских гамет, которые сохраняют генотип родителя, обеспечивая, посредством этого, фиксацию гетерозиса в следующем поколении. Фиксация гетерозиса является очень полезной, поскольку она может обеспечить увеличение количества семян гибридов посредством самоопыления без необходимости прибегать к скрещиванию между двумя родительскими культиварами различного генотипа.
Другой вариант осуществления этого изобретения представляет собой экспрессию полинуклеотидных последовательностей DYAD в межвидовых гибридах видов растений, приводящую к образованию нередуцированной женской гаменты, которую можно использовать для создания апомиктических семян. Создание таких апомиктических семян является пригодным для интрогрессии агрономически пригодных генов из одного вида растения в другой вид. Другой вариант осуществления этого изобретения вовлекает зависимую от условий или контролируемую экспрессию полинуклеотидных последовательностей DYAD или полипептидных последовательностей DYAD и/или их активность. Такую зависимую от условий экспрессию можно использовать для получения поколения нередуцированных женских гамет и, таким образом, апомиктических семян, только когда это желательно. Способы достижения зависимой от условий экспрессии или активности полинуклеотидных и полипептидных последовательностей в растениях хорошо известны в данной области и включают, но не ограничиваются ими, индуцируемую этанолом экспрессию генов (Devaux et al., Plant J., Vol. 36(6): 918-930, 2003), индуцируемый стероидными гормонами контроль активности (Schena M., Lloyd A. M. and Davis R. W., Proc. Natl. Acad. Sci. USA Vol. 88(23): 10421-10425, 1991), и опосредуемый тетрациклином контроль экспрессии (Bohner S. et al., Plant J. Vol. 9(1): 87-95, 1999).
В примере 6, ниже, описан один вариант осуществления этого изобретения, где может быть получена гомогенная популяция растений, проявляющую мутантный по dyad фенотип. Тот же эффект может быть достигнут посредством использования зависимых от условий RNAi или антисмысловых последовательностей для DYAD, в которых конструкцию RNAi или антисмысловую конструкцию для DYAD экспрессируют под контролем зависимого от условий промотора. Другим проявлением этого изобретения является экспрессия комплементирующей копии гена DYAD в растении под контролем зависимого от условий промотора, с генетическим фоном, который является гомозиготным в отношении мутантного аллеля dyad. Другим проявлением этого изобретения может быть скрещивание первого растения, обладающего конструкцией RNAi или антисмысловой конструкцией для DYAD, экспрессируемой под контролем промотора, который экспрессируется под контролем трансактиватора и где первое растение лишено трансактиватора, со вторым растением, которое экспрессирует трансактиватор.
Выделенные последовательности, полученные как описано в настоящем документе, можно использовать во множестве способов, например, для подавления или изменения экспрессии эндогенного гена DYAD. Модулирование экспрессии гена DYAD или активности DYAD в растениях является особенно пригодным, например, в качестве части системы для получения апомиктического семени.
Выделение нуклеиновых кислот DYAD
Главным образом, номенклатура и лабораторные способы в технологии рекомбинантных ДНК, описанные ниже, являются теми, которые хорошо известны и обычно используются в данной области. Для клонирования, выделения ДНК и РНК, амплификации и очистки используют стандартные способы. Главным образом, ферментные реакции, вовлекающие ДНК-лигазу, ДНК-полимеразу, эндонуклеазы рестрикции и т.п., проводят в соответствии с инструкциями изготовителя. Эти способы и различные другие способы, главным образом, проводят в соответствии с Sambrook et al., Molecular Cloning-A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, N. Y., (1989).
Выделение нуклеиновых кислот DYAD можно проводить множеством способов. Например, можно использовать олигонуклеотидные зонды на основе последовательностей, описанных в настоящем документе, для идентификации требуемого гена в библиотеке кДНК или геномной ДНК. Для конструирования геномных библиотек, создают большие сегменты геномной ДНК посредством случайной фрагментации, например, с использованием эндонуклеаз рестрикции, и лигируют с ДНК вектора с образованием конкатамеров, которые могут быть упакованы в пригодный вектор. Для получения библиотеки кДНК, мРНК выделяют из требуемого органа, такого как яйцеклетка, и получают из мРНК библиотеку кДНК, которая содержит транскрипт гена DYAD. Альтернативно кДНК можно получать из мРНК, экстрагированной из других тканей, в которых экспрессируются гены DYAD или гомологи.
Затем библиотеку кДНК или геномную библиотеку можно подвергать скринингу с использованием зонда на основе последовательности клонированного гена DYAD, описанного в настоящем документе. Зонды можно использовать для гибридизации с последовательностями геномной ДНК или кДНК для выделения гомологичных генов в тех же или отличающихся видах растений. Альтернативно можно использовать антитела, индуцированные против полипептида DYAD, для скрининга экспрессирующей библиотеки мРНК.
Альтернативно представляющие интерес нуклеиновые кислоты можно амплифицировать из образцов нуклеиновых кислот с использованием способов амплификации. Например, технологию полимеразной цепной реакции (ПЦР) можно использовать для амплификации последовательностей генов DYAD непосредственно из геномной ДНК, из кДНК, из геномных библиотек или из библиотек кДНК. ПЦР и другие способы амплификации in vitro также могут быть пригодны, например, для клонирования последовательностей нуклеиновых кислот, которые кодируют подлежащие экспрессии белки, для получения нуклеиновых кислот с целью применения в качестве зондов для детекции наличия требуемой мРНК в образцах, для секвенирования нуклеиновых кислот, или для других целей. Для общего обзора ПЦР см. PCR Protocols: A Guide to Methods and Applications. (Innis, M, Gelfand, D., Sninsky, J. and White, T., eds.), Academic Press, San Diego (1990).
Пригодные праймеры и зонды для идентификации последовательностей DYAD из тканей растений получают посредством сравнений последовательностей, представленных в настоящем документе, с другими родственными DYAD генами или белками, которые они кодируют. Например, DYAD Boechera holboelli можно сравнивать с близко родственным геномом из риса (Genbank ID No. 50917243). С использованием этих способов, специалист может идентифицировать консервативные участки в генах или полипептидах, описанных в настоящем документе, для получения соответствующих последовательностей праймеров и зондов. Праймеры, которые специфично гибридизуются с консервативным участками в родственных генах DYAD, можно использовать для амплификации последовательностей из широко дивергентных видов растений. Затем можно использовать стандартные способы гибридизации нуклеиновых кислот с использованием условий, описанных выше, для идентификации полноразмерных клонов кДНК или геномных клонов.
Контроль активности или экспрессии гена DYAD
Поскольку гены DYAD вовлечены в контроль мейоза и плоидности женского гаметофита, в ряде случаев является пригодным ингибирование активности или экспрессии гена эндогенного DYAD. Например, ингибирование экспрессии или модификацию активности DYAD посредством применения аллеля, несущего C-концевую делецию, как описано выше, можно использовать для получения плода с отсутствием семени или с небольшим/деградированным семенем (обозначаемого в настоящем документе как "бессемянный плод"). В большинстве видах растений создание триплоидов вызывает дефекты образования зародышевых клеток вследствие несбалансированной сегрегации хромосом в мейозе и приводит к отсутствию семян или к образованию небольших/деградированных семян. Ингибирование экспрессии или активности эндогенного DYAD может обеспечить контроль плоидности. Таким образом, в некоторых вариантах осуществления растений по этому изобретению, в которых активность DYAD ингибирована или модифицирована, семена отсутствуют или деградируют, и образуется бессемянный плод.
Другим применением нуклеиновых кислот по этому изобретению является развитие апомиктических линий растений (т.е. растений, в яйцеклетках которых происходят процессы бесполого размножения, см., Kolrunow A., Plant Cell, Vol.5: 1425-1437 (1993) для описания апомиксиса). Апомиксис обеспечивает новый способ селекции и фиксации комплексных гетерозиготных генотипов, которые не могут просто поддерживаться традиционным скрещиванием. Таким образом, например, можно получать и легко поддерживать новые гибридные линии с требуемыми признаками (например, гетерозисом).
Специалист поймет, что для модулирования активности или экспрессии гена DYAD можно использовать множество способов. Активность DYAD можно модулировать в клетке растения на генном, транскрипционном, посттранскрипционном, трансляционном или посттрансляционном уровнях. Способы модулирования активности DYAD на каждом из этих уровней, главным образом, хорошо известны специалисту и некоторые из них кратко рассмотрены ниже.
Способы внесения генетических мутаций в гены растений хорошо известны. Например, семена или другой материал растений можно обрабатывать мутагенным химическим веществом, в соответствии со стандартными способами. Такие химические вещества включают, но не ограничиваются ими, следующие вещества: диэтилсульфат, этиленимин, этилметансульфонат и N-нитрозо-N-этилмочевина. Альтернативно можно использовать ионизирующее излучение из таких источников, например, как рентгеновские лучи, гамма-лучи, или быстрые нейтроны. Растения, несущие мутации в последовательностях гена DYAD, можно идентифицировать посредством молекулярного скрининга объединенных популяций подвергнутых мутагенезу растений с использованием ПЦР-праймеров для амплификации нуклеотидных последовательностей DYAD с последующим анализом продуктов ПЦР в целях идентификации растений, несущих генетические мутации в полинуклеотидных последовательностях DYAD. Способы скрининга и идентификации растений, несущих мутации в конкретных последовательностях генов, описаны (Henikoff S., Bradley T. J. и Comai L., Plant Physiol. Vol. 135(2): 630-636, 2004).
Альтернативно можно использовать гомологичную рекомбинацию для нацеленного разрушения генов посредством специфичного удаления или изменения гена DYAD in vivo (см., главным образом, Grewal and Klar, Genetics 146: 1221-1238 (1997) и Xu et al., Genes Dev. 10: 2411-2422 (1996)). В растениях была показана гомологичная рекомбинация (Puchta et al., Experientia 50: 277-284 (1994), Swoboda et al., EMBO J. 13: 484-489 (1994); Offringa et al., Proc. Natl. Acad. Sci. USA 90: 7346-7350 (1993); и Kempin et al. Nature 389:802-803 (1997)).
При применении технологии гомологичной рекомбинации в отношении генов по этому изобретению, проводят мутации in vitro в выбранных участках последовательностей гена DYAD (включая расположенные с 5'-стороны, расположенные с 3'-стороны и межгенные участки), таких как описано в настоящем документе, а затем их вводят в требуемое растение с использованием стандартных способов. Поскольку известно, что эффективность гомологичной рекомбинации зависит от используемого вектора, для повышения эффективности селекции в отношении экспрессии измененного гена DYAD в трансгенных растениях удобно применять бицистронные нацеленные на ген векторы, как описано Mountford et al. Proc. Natl. Acad. Sci. USA 91: 4303-4307 (1994); и Vaulont et al. Transgenic Res. 4: 247-255 (1995). Мутантный ген будет взаимодействовать с геном-мишенью дикого типа таким образом, что в трансгенных клетках растений будут происходить гомологичная рекомбинация и нацеленная замена гена дикого типа, приводящие к подавлению активности DYAD2.
Альтернативно можно использовать олигонуклеотиды, состоящие из непрерывного участка из остатков РНК и ДНК в дуплексной конформации с двойными шпилечными кэпами на концах. Последовательность РНК/ДНК конструируют, чтобы она выравнивалась с последовательностью гена-мишени DYAD и чтобы она содержала требуемую нуклеотидную замену. Введение химерного олигонуклеотида в экстрахромосомную T-ДНК-плазмиду приводит к эффективной и специфичной конверсии гена DYAD, направляемой химерными молекулами в небольшом количестве трансформированных клеток растений. Этот способ описан в Cole-Strauss et al. Science 273:1386-1389 (1996) and Yoon et al. Proc. Natl. Acad. Sci. USA 93: 2071-2076 (1996).
Экспрессию гена можно инактивировать с использованием способов рекомбинантных ДНК посредством трансформации клеток растений конструкциями, содержащими транспозоны или последовательности T-ДНК. Мутантные формы DYAD, полученные этими способами, идентифицируют в соответствии со стандартными способами. Например, мутантные формы можно подвергать детекции посредством ПЦР или посредством детекции наличия или отсутствия мРНК DYAD, например, посредством нозерн-блотов или обратной транскрипции с последующей ПЦР (ОТ-ПЦР). Селекцию мутантных форм также можно проводить посредством анализа изменения способности к оплодотворению, женского мейоза и развития мегаспор.
Последовательности выделенных нуклеиновых кислот, полученных как описано в настоящем документе, также можно использовать во множестве способов для контроля экспрессии эндогенного гена DYAD на различных уровнях. Подпоследовательности описанных в настоящем описании последовательностей можно использовать для контроля транскрипции, накопления РНК, трансляции и т.п.
Для ингибирования экспрессии гена в растениях можно использовать множество способов. Например, удобно использовать технологию РНК-интерференции (RNAi). Для ее проведения, сегмент нуклеиновой кислоты из требуемого гена клонируют в качестве инвертированного повтора, в котором две копии разделены спейсером, длина которого обычно может составлять между 5 и 2000 нуклеотидами, предпочтительно между 30 и 500 нуклеотидами и более предпочтительно между 50 и 200 нуклеотидами. Инвертированный повтор функционально связывают с промотором, за которым следует терминатор, так что обе копии будут транскрибироваться и приведут к типам РНК, которые являются самокомплементарными вдоль всей длины или ее части. Затем конструкцию трансформируют в растения и получают двухцепочечную РНК.
В качестве другого примера, для ингибирования экспрессии гена DYAD удобно использовать антисмысловую технологию. Для ее проведения, сегмент нуклеиновой кислоты из требуемого гена клонируют и функционально связывают с промотором, так что будет транскрибироваться антисмысловая цепь РНК. Затем конструкцию трансформируют в растения и получают антисмысловую цепь РНК. Было предположено, что в клетках растений антисмысловое подавление может действовать на всех уровнях регуляции гена, включая подавление трансляции РНК (см., Bourque Plant Sci. (Limerick) 105: 125-149 (1995); Pantopoulos In Progress in Nucleic Acid Research and Molecular Biology, Vol. 48. Cohn, W. E. и K. Moldave (Ed.). Academic Press, Inc.: San Diego, Calif., USA; London, England, UK. p. 181-238; Heiser et al. Plant Sci. (Shannon) 127: 61-69 (1997)) и предотвращение накопления мРНК, которая кодирует представляющий интерес белок (см., Baulcombe Plant Mol. Bio. 32:79-88 (1996); Prins и Goldbach Arch. Virol. 141: 2259-2276 (1996); Metzlaff et al. Cell 88: 845-854 (1997), Sheehy et al., Proc. Nat. Acad. Sci. USA, 85:8805-8809 (1988), и Hiatt et al., патент США No. 4801340).
Подлежащей введению сегмент нуклеиновой кислоты, как правило, будет по существу идентичен по меньшей мере части эндогенного гена DYAD или генов, подлежащих подавлению. Однако для ингибирования экспрессии последовательность не должна быть абсолютно идентичной. Векторы по настоящему изобретению можно конструировать таким образом, что ингибиторный эффект применяется в отношении других генов в семействе генов, проявляющих гомологию или значительную гомологию гену-мишени.
Для антисмыслового подавления, введенная последовательность также не должна быть полноразмерной относительно либо первичного продукта транскрипции, либо полностью процессированной мРНК. Как правило, можно использовать более высокую гомологию для компенсации применения более короткой последовательности. Более того, введенная последовательность не обязательно должна иметь тот же паттерн интронов или экзонов, и гомология некодирующих сегментов может быть равно эффективной. В норме, следует использовать последовательность из между приблизительно 30 или 40 нуклеотидами и приблизительно полноразмерной нуклеотидной последовательностью, хотя последовательность по меньшей мере приблизительно из 100 нуклеотидов является предпочтительной, последовательность по меньшей мере приблизительно из 200 нуклеотидов является более предпочтительной, и последовательность из приблизительно от 500 до приблизительно 1700 нуклеотидов является особенно предпочтительной.
Для подавления экспрессии гена DYAD можно проводить нацеливание на множество участков гена. Мишени могут включать, например, кодирующие участки, интроны, последовательности из точек соединения экзон/интрон, 5'- или 3'-нетранслируемые области, и т.п. В некоторых вариантах осуществления, можно конструировать конструкции для устранения способности регуляторных белков связываться с последовательностями гена DYAD, которые требуются для его клеточно- и/или тканеспецифичной экспрессии. Такие транскрипционные регуляторные последовательности могут быть расположены либо с 5'-стороны, либо с 3'-стороны, либо в кодирующей области гена и они могут либо запускать (положительный регуляторный элемент), либо подавлять (отрицательный регуляторный элемент) транскрипцию гена. Эти последовательности можно идентифицировать с использованием стандартного делеционного анализа, хорошо известного специалистам в данной области. После идентификации последовательностей антисмысловую конструкцию, нацеленную на эти последовательности, вводят в растения для контроля транскрипции гена в конкретной ткани, например, при развитии семяпочек и/или семени.
Для нарушения экспрессии гена DYAD можно использовать образование тройной спирали на основе олигонуклеотида. Тройная ДНК может ингибировать транскрипцию и репликацию ДНК, создавать сайт-специфичные мутации, расщеплять ДНК и индуцировать гомологичную рекомбинацию (см., например, Havre and Glazer J. Virology 67:7324-7331 (1993); Scanlon et al. FASEB J. 9:1288- 1296 (1995); Giovannangeli et al. Biochemistry 35:10539-10548 (1996); Chan и Glazer J. Mol. Medicine (Berlin) 75: 267-282 (1997)). Трехспиральные ДНК можно использовать для нацеливания на те же последовательности, которые идентифицированы для антисмысловой регуляции.
Также для ингибирования экспрессии генов DYAD можно использовать каталитические молекулы РНК или рибозимы. Является возможным конструирование рибозимов, которые специфично образуют пары практически с любой РНК-мишенью и расщепляют фосфодиэфирный остов в конкретной области, функционально инактивируя посредством этого РНК-мишень. При проведении этого расщепления, рибозим сам по себе не изменяется, и, таким образом, он обладает способностью к повторному циклу и расщеплению других молекул, что делает его истинным ферментом. Включение последовательностей рибозима в антисмысловые РНК придает им активность в отношении расщепления РНК, повышая посредством этого активность конструкций. Таким образом, рибозимы можно использовать для нацеливания на те же последовательности, которые были идентифицированы для антисмысловой регуляции.
Было идентифицировано множество классов рибозимов. Один класс рибозимов образован из множества небольших кольцевых РНК, которые способны к саморасщеплению и репликации в растениях. РНК реплицируются либо отдельно (вироидные РНК), либо с вирусом-помощником (сателлитные РНК). Примеры включают РНК из вироида солнечного ожога авокадо и сателлитные РНК из вируса кольцевой пятнистости табака, вируса временной полосатости люцерны, вируса стеблевой пятнистости бархатистого табака, вируса стеблевой пятнистости паслена кистецветного и вируса стеблевой пятнистости клевера подземного. Конструирование и применение специфичных к РНК-мишени рибозимов описано в Zhao and Pick Nature 365:448-451 (1993); Eastham and Ahlering J. Urology 156:1186-1188 (1996); Sokol и Murray Transgenic Res. 5:363-371 (1996); Sun et al. Mol. Biotechnology 7:241-251 (1997); и Haseloff et al. Nature, 334:585-591 (1988).
Другим способом подавления является смысловая косупрессия. Было показано, что введение нуклеиновой кислоты в смысловой ориентации является эффективным способом блокирования транскрипции генов-мишеней. Для примера применения этого способа в целях модулирования экспрессии эндогенных генов см., Assaad et al. Plant Mol. Bio. 22: 1067-1085 (1993); Flavell Proc. Natl. Acad. Sci. USA 91: 3490-3496 (1994); Stam et al. Annals Bot. 79: 3-12 (1997); Napoli et al., The Plant Cell 2:279-289 (1990); и патенты США No. 5034323, 5231020 и 5283184.
Эффект подавления может происходить, когда введенная последовательность не содержит саму кодирующую последовательность, а только интрон или нетранслируемые последовательности, гомологичные последовательностям, находящимся в первичном транскрипте эндогенной последовательности. Введенная последовательность, главным образом, будет по существу идентичной эндогенной последовательности, предназначенной для подавления. Эта минимальная идентичность, главным образом, будет составлять более приблизительно 65%, однако более высокая идентичность может приводить к более эффективному подавлению экспрессии эндогенных последовательностей. По существу большая идентичность, составляющая более чем приблизительно 80%, является предпочтительной, хотя идентичность от приблизительно 95% до полной идентичности будет наиболее предпочтительной. Как в случае антисмысловой регуляции, эффект следует применять к любым другим белкам в сходном семействе генов, проявляющем гомологию или значительную гомологию.
Для смысловой супрессии, введенная последовательность, требующая менее чем абсолютной идентичности, также не обязательно должна быть полноразмерной, относительно либо первичного продукта транскрипции, либо полностью процессированной мРНК. Это может быть предпочтительным для избежания конкурентного образования некоторых растений, которые обладают сверхэкспрессией. Более высокая идентичность в более коротких по сравнению с полноразмерной последовательностях компенсирует более длинную менее идентичную последовательность. Более того, введенная последовательность необязательно должна иметь тот же паттерн интронов или экзонов, и идентичность некодирующих сегментов должна быть равноэффективной. В норме, используют последовательность с диапазонами размеров, указанными выше для антисмысловой регуляции. Кроме того, нацеливание на те же участки генов, которые указаны для антисмысловой регуляции, можно проводить с использованием технологий косупрессии.
Альтернативно, активность DYAD может модулировать устранение белков, которые необходимы для клеточно-специфичной экспрессии гена DYAD. Таким образом, экспрессию регуляторных белков и/или последовательностей, которые контролируют экспрессию гена DYAD, можно модулировать с использованием способов, описанных в настоящем документе.
Другим способом является применение подавления сконструированными тРНК трансляции мРНК DYAD. Этот способ вовлекает применение подавляющих тРНК для трансактивации генов-мишеней, содержащих преждевременные стоп-кодоны (см., Betzner et al. Plant J. 11:587-595 (1997); и Choisne et al. Plant J. 11: 597-604 (1997). Первоначально создают растительную линию, содержащую конститутивно экспрессируемый ген DYAD, который содержит стоп-кодон amber. Также создают множество линий растений, каждая из которых содержит конструкции подавляющих ген тРНК под регуляцией клеточно-специфичных промоторов. Затем генную конструкцию тРНК встраивают скрещиванием в линии DYAD для активации активности DYAD направленным образом. Эти линии с подавляющей тРНК также можно использовать для нацеливания экспрессии любого типа гена на тот же тип клеток или ткани.
Получение доминантно-негативных форм полипептидов DYAD, дефектных по их способности связывать другие белки, является удобным способом ингибирования активности эндогенного DYAD. Этот подход вовлекает трансформацию растений конструкциями, кодирующими мутантные полипептиды DYAD, которые формируют дефектные комплексы с эндогенными белками, и, таким образом, препятствуют надлежащему образованию комплекса. Мутантный полипептид может отличаться от встречающейся в природе последовательности на уровне первичной структуры посредством аминокислотных замен, вставок, делеций и т.п. Эти модификации можно использовать во множество сочетаний с получением конечной модифицированной белковой цепи. Применение доминантно-негативных мутантов для инактивации генов-мишеней описано в Mizukami et al. Plant Cell 8:831-845 (1996).
Другая стратегия для воздействия на способность белка DYAD взаимодействовать с собственным или с другими белками вовлекает применение антител, специфичных к DYAD. В этом способе клеточно-специфичную экспрессию специфичных к DYAD Ат используют для инактивации функциональных доменов через распознавание антитело:антиген (см., Hupp et al. Cell 83:237-245 (1995)).
Применение нуклеиновых кислот по изобретению для усиления экспрессии гена DYAD
Выделенные последовательности, полученные как описано в настоящем документе, также можно использовать для обеспечения экспрессии конкретной нуклеиновой кислоты DYAD в целях усиления или повышения экспрессии эндогенного гена. Усиленную экспрессию также можно использовать, например, для повышения вегетативного роста посредством предотвращения образования семян в растениях. Когда является желательной сверхэкспрессия гена, можно использовать требуемый ген из другого вида для снижения потенциальных смысловых подавляющих эффектов.
Специалист поймет, что полипептиды, кодируемые генами по этому изобретению, аналогично другим белкам, имеют отличающиеся домены, которые выполняют отличающиеся функции. Таким образом, последовательности генов не обязательно должны быть полноразмерными, при условии экспрессии требуемого функционального домена белка.
Модифицированные белковые цепи можно легко конструировать с использованием различных технологий рекомбинантных ДНК, хорошо известных специалистам в данной области и подробно описанных ниже. Например, цепи могут отличаться от встречающейся в природе последовательности на уровне первичной структуры посредством аминокислотных замен, вставок, делеций и т.п. Эти модификации можно использовать во множестве сочетаний с получением конечной модифицированной белковой цепи.
Получение рекомбинантных векторов
Для применения выделенных последовательностей в указанных выше способах, получают рекомбинантные ДНК-векторы, пригодные для трансформации клеток растений. Способы трансформации широкого множества видов высших растений хорошо известны и описаны в технической и научной литературе. См., например, Weising et al. Ann. Rev. Genet. 22:421-477 (1988). Последовательность ДНК, кодирующую требуемый полипептид, например последовательность кДНК, кодирующую полноразмерный белок или слитый с последовательностью внутриклеточной локализации белок DYAD, или укороченный белок DYAD, предпочтительно будут комбинировать с последовательностями регуляции инициации транскрипции или трансляции, которые будут направлять транскрипцию последовательности с гена в определенных тканях трансформированного растения.
Например, для сверхэкспрессии можно использовать промоторный фрагмент растения, который будет направлять экспрессию гена во всех тканях регенерировавшего растения. Такие промоторы называют в настоящем документе "конститутивными" промоторами и они являются активными в большинстве условий окружающей среды и стадий развития или клеточной дифференцировки. Примеры конститутивных промоторов включают участок инициации транскрипции вируса мозаики цветной капусты (CaMV) 35S, 1'- или 2'-помотор, образованный из T-ДНК Agrobacterium tumafaciens, и другие участки инициации транскрипции из различных генов растений, известные специалистам. Такие гены включают, например, ACT11 из Arabidopsis (Huang et al. Plant Mol. Biol. 33:125-139 (1996)), Cat3 из Arabidopsis (GenBank No. U43147, Zhong et al., Mol. Gen. Genet. 251:196-203 (1996)), ген, кодирующий десатуразу стеароил-ацильного белка-переносчика из Brassica napus (Genbank No. X74782, Solocombe et al. Plant Physiol. 104:1167-1176 (1994)), GPcl из маиса (GenBank No. X15596, Martinez et al. J. Mol. Biol 208:551-565 (1989)), и Gpc2 из маиса (GenBank No. U45855, Manjunath et al., Plant Mol. Biol. 33:97-112 (1997)).
Альтернативно, промотор растения может направлять экспрессию нуклеиновой кислоты DYAD в конкретной ткани или, в ином случае, он может находиться под более точным контролем окружающей среды или стадии развития. Примеры условий окружающей среды, которые могут вызывать транскрипцию посредством индуцибельных промоторов, включают анаэробные условия, повышенную температуру или наличие света. Такие промоторы обозначают в настоящем описании как "индуцибельные" или "тканеспецифичные" промоторы. Специалист поймет, что тканеспецифичный промотор может направлять экспрессию функционально связанных последовательностей в тканях, отличных от ткани-мишени. Таким образом, как используют в настоящем документе, тканеспецифичный промотор представляет собой промотор, который направляет экспрессию предпочтительно в ткани-мишени, однако также приводит к некоторой экспрессии в других тканях. Зависимую от условий экспрессию, тканеспецифичную экспрессию или сочетание этих двух типов можно проводить с использованием трансактиватора, где нуклеиновую кислоту DYAD можно помещать под контроль синтетического промотора, который запускается гетерологичным или синтетическим трансактиватором. Затем тканеспецифичная и/или зависящая от условий экспрессия трансактиватора будет запускать соответствующую экспрессию нуклеиновой кислоты DYAD. Примеры трансактивируемых и индуцибельных систем, которые использовали в растениях, включают mGal4:VP16/UAS, pOp/LhG4, GVE/VGE, GVG, pOp6/LhGR и XVE (рассмотренные в Moore et al., The Plant Journal 45: 651-683 (2006)).
Примеры промоторов под контролем стадий развития включают промоторы, которые инициируют транскрипцию только (или главным образом только) в определенных тканях, таких как плод, семена или цветки. Промоторы, которые направляют экспрессию нуклеиновых кислот в семяпочках, цветках или семенах, являются особенно пригодными в настоящем изобретении. Как используют в настоящем документе, специфичный для семян промотор представляет собой промотор, который направляет экспрессию в тканях растений. Такие промоторы могут быть, например, специфичными для семяпочки (которые включают промоторы, которые направляют экспрессию в материнских тканях или женском гаметофите, таких как яйцеклетки или центральная клетка), специфичными для зародыша, специфичными для эндосперма, специфичными для кожуры, специфичными для оболочки семени или некоторых их сочетаний. Примеры включают промотор из специфичного для семяпочки гена BEL1, описанного в Reiser et al. Cell 83:735-742 (1995) (GenBank No. U39944), и промотор из специфичного для мужского мейоцита гена DUET (Reddy T. V., et al., Development, Vol. 130 (24):5975-5987, 2003). Другие пригодные специфичные для семян промоторы получают из следующих генов: MAC1 из маиса (Sheridan et al. Genetics 142:1009-1020 (1996), Cat3 из маиса (GenBank No. L05934, Abler et al. Plant Mol. Biol. 22:10131-1038 (1993), ген, кодирующий олеосин массой 18 кДа из маиса (GenBank No. J05212, Lee et al. Plant Mol. Biol. 26:1981-1987 (1994)), viviparous-1 из Arabidopsis (Genbank No. U93215), ген, кодирующий олеосин из Arabidopsis (Genbank No. Z17657), Atmycl из Arabidopsis (Urao et al. Plant Mol. Biol. 32:571-576 (1996), семейство генов запасных белков 2S из Arabidopsis (Conceicao et al. Plant J. 5:493-505 (1994)), ген, кодирующий олеосин массой 20 кДа из Brassica napus (GenBank No. M63985), napA из Brassica napus (GenBank No. J02798, Josefsson et al. JBL 26:12196-1301 (1987), семейство генов напинов из Brassica napus (Sjodahl et al. Planta 197:264-271 (1995), ген, кодирующий запасной белок 2S из Brassica napus (Dasgupta et al. Gene 133:301-302 (1993)), гены, кодирующие олеосин A (Genbank No. U09118) и олеосин B (Genbank No. U09119) из соевых бобов, и ген, кодирующий низкомолекулярный богатый серой белок из соевых бобов (Choi et al. Mol. Gen., Genet. 246:266-268 (1995)).
Кроме того, промоторные последовательности из генов DYAD, описанные в настоящем документе, можно использовать для направления экспрессии полинуклеотидов DYAD по этому изобретению или гетерологичных последовательностей. Если является желательной экспрессия собственного полипептида, следует включать участок полиаденилирования на 3'-конце кодирующей области. Участок полиаденилирования может быть образован из любого природного гена, из множества других генов растений или из T-ДНК.
Вектор, содержащий последовательности (например, промоторные или кодирующие участки) из генов по этому изобретению, как правило, будет содержать маркерный ген, который придает поддающийся селекции фенотип клеткам растений. Например, маркер может кодировать устойчивость к биоцидам, в частности устойчивость к антибиотикам, такую как устойчивость к канамицину, G418, блеомицину, гигромицину, или устойчивость к гербицидам, такую как устойчивость к хлорсульфурону или Basta.
Получение трансгенных растений
Конструкции ДНК по этому изобретению можно встраивать в геном требуемого растения-хозяина множеством общепринятых способов. Например, конструкцию ДНК можно встраивать в геномную ДНК клетки растения с использованием способов, таких как электропорация и микроинъекция в протопласты клеток растений, или конструкцию ДНК можно вводить непосредственно в ткань растения с использованием баллистических способов, таких как бомбардировка частицами ДНК.
Способы микроинъекции известны в данной области и хорошо описаны в научной и патентной литературе. Введение конструкций ДНК с использованием осаждения полиэтиленгликолем описано в Paszkowski et al. Embo J. 3:2717-2722 (1984). Способы электропорации описаны в Fromm et al. Proc. Natl. Acad. Sci. USA 82:5824 (1985). Способы баллистической трансформации описаны в Klein et al. Nature 327:70-73 (1987).
Альтернативно конструкции ДНК можно комбинировать с пригодными фланкирующими участками T-ДНК и встраивать в общепринятый вектор-хозяин Agrobacterium tumefaciens. Вирулентные функции хозяина Agrobacterium tumefaciens будут направлять встраивание конструкции и расположенного рядом маркера в ДНК клетки растения, при инфицировании клетки бактерией. Способы опосредуемой Agrobacterium tumefaciens трансформации, включая обезвреживание и применение бинарных векторов, хорошо описаны в научной литературе. См., например Horsch et al. Science 233:496-498 (1984), и Fraley et al. Proc. Natl. Acad. Sci. USA 80:4803 (1983).
Трансформированные клетки растений, которые получены любым из указанных выше способов трансформации, можно культивировать для регенерации целого растения, которое обладает трансформированным генотипом и, таким образом, требуемым фенотипом, таким как повышенная масса семян. Такие способы регенерации основаны на манипулировании с помощью определенных фитогормонов в культуральной среде для роста ткани, как правило, с использованием на биоцидного и/или гербицидного маркера, который вводят совместно с требуемыми нуклеотидными последовательностями. Регенерация растений из культивируемых протопластов описана в Evans et al., Protoplasts Isolation and Culture, Handbook of Plant Cell Culture, pp. 124-176, MacMillilan Publishing Company, New York, 1983; и Binding, Regeneration of Plants, Plant Protoplasts, pp. 21-73, CRC Press, Boca Raton, 1985. Также регенерацию можно проводить из каллюса, эксплантатов, органов растений или их частей. Такие способы регенерации описаны, главным образом, в Klee et al. Ann. Rev. of Plant Phys. 38:467-486 (1987).
Нуклеиновые кислоты по этому изобретению можно использовать для придания признаков по существу любому растению. Таким образом, это изобретение можно применять в широком диапазоне растений, включая виды из родов Anacardium, Arachis, Asparagus, Atropa, Avena, Brassica, Citrus. Citrullus, Capsicum, Carthamus, Cocos, Coffea, Cucumis, Cucurbita, Daucus, Elaeis, Fragaria, Glycine, Gossypium, Helianthus, Heterocallis, Hordeum, Hyoscyamus, Lactuca, Linum, Lolium, Lupinus, Lycopersicon, Malus, Manihot, Majorana, Medicago, Nicotiana, Olea, Oryza, Panieum, Pannesetum, Persea, Phaseolus, Pistachia, Pisum, Pyrus, Prunus, Raphanus, Ricinus, Secale, Senecio, Sinapis, Solanum, Sorghum, Theobromus, Trigonella, Triticum, Vicia, Vitis, Vigna и Zea.
Специалист поймет, что после стабильного включения экспрессирующей кассеты в трансгенные растения и подтверждения ее действия, ее можно вводить в другие растения посредством полового скрещивания. Можно использовать любой из стандартных способов скрещивания, в зависимости от подлежащего скрещиванию вида.
Семя, полученное от растений по настоящему изобретению, можно анализировать в соответствии с хорошо известными способами в целях идентификации растений с требуемым признаком. Если для контроля экспрессии гена DYAD используют антисмысловые или другие способы, то для скрининга требуемых растений можно использовать ОТ-ПЦР или нозерн-блот анализ. Кроме того, можно выявлять наличие независимого от оплодотворения репродуктивного развития. Растения можно подвергать скринингу, например, в отношении способности образовывать не содержащие зародыш семена, образовывать семя, которое прекращает развитие после оплодотворения или образовывать плод в отсутствии оплодотворения. Эти способы будут зависеть частично от конкретного подлежащего применению вида растения, однако их будут проводить в соответствии со способами, хорошо известными специалистам.
Следующие примеры приведены в качестве иллюстрации настоящего изобретения и их не следует истолковывать, как ограничивающие объем настоящего изобретения.
ПРИМЕР 1: Мутантная форма dyad обладает дефектной женской способностью к оплодотворению и уменьшенным набором семян
Мутантную форму dyad выделяли при скрининге стерильных мутантных форм Arabidopsis среди совокупности подвергнутых мутагенезу посредством EMS растений M2 (Siddiqi I. et. al. Development Vol. 127(1): 197-207 (2000)). Анализ способности к оплодотворению с помощью возвратных скрещиваний показал, что мутантная форма обладала женской стерильностью, но мужской способностью к оплодотворению. Анализ женского спорогенеза и развития семяпочки показал, что dyad подвергался дефектному женскому мейозу, приводящему к одному мейотическому делению вследствие дефектного прохождения мейотического клеточного цикла с последующей остановкой и прекращением развития женских гамет в большинстве семяпочек. Анализ женского мейоза посредством наблюдения хромосомных препаратов мейоцитов показал, что женский мейоз был аномальным в мутантной форме dyad: хромосомы не образовывали синапс и подвергались эквационному делению вместо редукционного деления, которое в норме происходит при мейозе 1 (Agashe B., Prasad C. K., and Siddiqi L, Development Vol. 129(16): 3935-3943 (2002)).
Как показано на фигуре 1, набор семян в мутантной форме dyad является значительно уменьшенным по сравнению с диким типом и среди различных мутантных растений dyad наблюдали вариантность в количестве семян в наборе. Набор семян был спорадическим и случайным, так что не было выявлено единообразия с точки зрения количества среди растений в популяции. Колебания для набора семян составляли 1-10 на растение, однако они варьировали вплоть до максимального количества, составляющего приблизительно 275, которое наблюдали редко (1 на 500 растений).
ПРИМЕР 2: Мужской мейоз и способность к оплодотворению являются нормальными у мутантной формы dyad
Жизнеспособность пыльцы исследовали с использованием окрашивания Alexander и было выявлено, что пыльца является полностью жизнеспособной и сравнимой с диким типом (фигура 2). Исследование мужского мейоза посредством анализа хромосомных препаратов мейоцитов показал, что мужской мейоз был нормальным и приводил к образованию тетрады гаплоидных спор (фигура 3). Мужской мейоз, мужская способность к оплодотворению и развитие пыльцы, а также ее функция, таким образом, были нормальными в мутантной форме dyad. С другой стороны женский мейоз является аномальным в случае dyad. Не было выявлено образования синапса гомологичных хромосом, и редукционное 1 деление мейоза в женском мейозе дикого типа (Фигура 3C) заменяется эквационным делением в dyad (фигура 3E).
ПРИМЕР 3: Семена, полученные из мутантной формы dyad, прорастают с образованием триплоидных растений
Возможно, что семена, продуцируемые мутантной формой dyad, появляются вследствие нормального мейоза в небольшом количестве женских мейоцитов, который продолжается возникновением нормального функционального зародышевого мешка, который затем оплодотворяется гаплоидной пыльцой с образованием семени. В этом случае, эти семена будут отражать случаи избежания аномального мейоза, который происходит в мутантной форме dyad. Для исследования этой возможности, семенам (n=169) из растений dyad давали прорасти, и было выявлено, что они прорастают с высокой эффективностью (90%) и приводят к морфологически нормальным проросткам, за исключением того, что несколько из них привели к аномальным проросткам (10%). Не было случаев варьирования по форме, симметрии и количеству семядолей в растущих проростках. Это является противоположностью проросткам, образованным из других мейотических мутантных форм, таких как AtSpoll-1 и AtDmcl, которые претерпевают случайную сегрегацию хромосом в мейозе 1, что приводит к более высокой доле анеуплоидных потомков, которые показывают ряд аномалий развития на стадии прорастания (Grelon M. et al., The EMBO J., Vol 20: 589-600, 2001, Couteau F. et al., Plant Cell, Vol. 11(9): 1623-1634, 1999). Последующий вегетативный рост проростков при переносе в почву также был нормальным и привел к растениям, в которых вегетативный рост был сходным с диким типом, а также с родительскими мутантными растениями dyad. Основное выявленное отличие заключалось в размере цветков, когда растения начинали зацветать. В большинстве растений (n=41/52) наблюдали повышение размера цветков, сравнимое с диким типом. Увеличенный размер цветков, возможно, можно отнести к повышению мощности или благоприятным влияниям окружающей среды. Поскольку растения растут в контролируемых условиях, авторы настоящего изобретения исключили последнюю возможность. Другой возможной причиной повышения размера цветкового органа может быть повышение плоидности. Повышение плоидности проявляется повышением размера вегетативных и цветковых структур, в частности пыльцевых зерен (Altmann T., et al., Plant Cell Reports. Vol. 13: 652-656, 1994). Бутоны из случайным образом выбранных растений исследовали в отношении их уровня плоидности посредством анализа хромосом в соматических клетках и мужских мейоцитах. Посредством исследования мейотических хромосомных препаратов было выявлено, что в 17/19 случаев растения были триплоидными и остальные 2 растения были диплоидными (фигура 4). Поскольку развитие пыльцы и мужской мейоз являются нормальными в мутантной форме dyad, в то время как редукционный женский мейоз заменяется эквационным делением, эти результаты подтверждают, что большинство семян, которые являются триплоидными, образовались при оплодотворении нередуцированной (диплоидной) яйцеклетки нормальным гаплоидным спермием, а не образовались при нормальном женском мейозе в небольшом количестве семяпочек, т.е. большинство семян не показывают избежания аномального мейоза.
ПРИМЕР 4: Триплоидные растения, образованные из dyad, сохраняют все гетерозиготные маркеры
Триплоидные семена, образованные в мутантной форме dyad, могут представлять собой продукт оплодотворения нередуцированного зародышевого мешка нормальной гаплоидной пыльцой, что может согласовываться с эквационным женским мейозом, который происходит в dyad. Если такой нередуцированный зародышевый мешок образуется из нередуцированной мегаспоры, которая образуется из продукта эквационного деления материнской клетки мегаспоры, где хромосомы остаются в виде одновалентных и не подвергаются рекомбинации, тогда генотип нередуцированного зародышевого мешка будет идентичным генотипу диплоидной родительской клетки. Таким образом, если родительское растение является гетерозиготным в отношении молекулярного маркера, тогда триплоидное потомство также будет гетерозиготным по этому маркеру. Если считают, что маркер, не связанный с центромерой, находится в гетерозиготном состоянии, тогда при полном отсутствии рекомбинации будет достигаться 100% передача гетерозиготности в полученной женской гамете и триплоидном потомстве. Если рекомбинация и скрещивание происходят, тогда в полученном триплоидном потомстве 100% гетерозиготность не будет сохраняться. В случае маркера, который не связан с центромерой, можно ожидать гомозиготности в нередуцированном зародышевом мешке с частотой 33% и в триплоидном потомстве с частотой 16,7%, в то время как при полном отсутствии рекомбинации гомозигот не будет. Образование нередуцированных зародышевых мешков без потери гетерозиготности является высоко желательным для обеспечения апомиксиса и фиксации гетерозиса. Авторы настоящего изобретения использовали микросателлит для измерения потери гетерозиготности среди триплоидного потомства мутантных растений dyad. Мутантные растения dyad были идентифицированы в сегрегирующей популяции F2 после скрещивания изотипов Nossen (No-O) дикого типа и мутантной формы dyad Columbia (Col). Маркеры-кандидаты, распределенные в каждой из пяти хромосом Arabidopsis и не связанные с центромерой (>35 cM) получали из базы данных TAIR (www.arabidopsis.org). Родительские растения, используемые для получения популяции F2, исследовали для определения полиморфизма, и, исходя из результатов, авторы выбрали 5 различных маркеров (таблица 1) на 4 различных хромосомах для генотипирования 50 мутантных растений dyad F2 и идентификации маркеров, для которых каждое растение было гетерозиготным. Самоопыленные семена собирали из 50 растений F2 по отдельности и выращивали в виде 50 различных семейств, состоящих из различного количества сиблингов. Это привело всего к 196 растениям, распределенным по 50 семействам. Всех членов каждого семейства подвергали генотипированию в отношении тех маркеров, по которым родительское растение было гетерозиготным, с получением между 74-119 растений, распределенных среди всех 50 семейств F2 для каждого маркера.
Анализ маркеров потомства растений dyad для определения потери гетерозиготности и рекомбинации
№
Из 196 растений, подвергнутых скринингу, авторы настоящего изобретения получили 35 растений, которые были гомозиготными в отношении по меньшей мере одного маркера, для которого родительское растение было гетерозиготным. Плоидность 22 в этих 35 растениях определяли получением мейотических хромосомных препаратов. Было выявлено, что 21 растение было диплоидным, а другие были гиперплоидными, имеющими 13 хромосом. Таким образом, в соответствии с анализом, потеря гетерозиготности была выявлена практически только в диплоидах. Среди растений, которые не показали потери гетерозиготности, случайным образом выбрали 15 растений из отдельных семейств F2 и исследовали в отношении их плоидности. Было выявлено, что все 15 из них являются триплоидными.
Таким образом, результаты показывают, что не происходит потери гетерозиготности в триплоидах, которые составляют основной класс потомства диплоидного мутантного растения dyad. Отсутствие обнаружения потери гетерозиготности в триплоидах также исключает альтернативный возможный механизм их образования, а именно полиспермию, т.е. оплодотворение гаплоидной женской гаметы двумя отдельными мужскими гаметами, что также может предполагать потерю гетерозиготности. Данные авторов настоящего изобретения показывают, что триплоидное потомство мутантных растений dyad образуется вследствие оплодотворения нередуцированного зародышевого мешка, который сохраняет генотип родительского растения. Образование нередуцированного зародышевого мешка является ключевым аспектом апомиксиса.
ПРИМЕР 5: Выделение и функциональная характеризация гомолога DYAD из Boechera holboelli
Кодирующий геномный участок гомолога DYAD размером 3 т.п.н. из факультативно апомиктического Boechera holboellii изолятов диплоидного Greenland и триплоидного Colorado (Naumova T. N., et al, Sex. Plant Reprod. Vol. 14: 195-200, 2001) клонировали с использованием праймеров Bho5Bam (SEQ ID NO:39) и Bho3Bam (SEQ ID NO:40). Геномный клон BhDYAD (SEQ ID NO:16) функционально связывали с промотором DYAD Arabidopsis и использовали для трансформации мутантных растений dyad для тестирования комплементации. кДНК BhDYAD также амплифицировали и секвенировали (SEQ ID NO:17). Опосредуемая Agrobacterium трансформация вакуумной инфильтрацией in planta запускала экспрессию конструкции в растениях F1, которые были гетерозиготными по dyad. Авторы настоящего изобретения получили 42 трансформанта, из которых 9 трансформантов были гомозиготными по мутантному аллелю dyad, как определяют посредством CAPS и микросателлитных маркеров, которые фланкируют локус dyad (Agashe B, Prasad C. K., and Siddiqi L, Development Vol. 129(16): 3935-3943 (2002)). Из 9 трансформантов 4 трансформанта показали комплементацию мутантного фенотипа dyad, который можно определять по довольно удлиненным стручкам (фигура 5), в которых был выявлен полный набор семян. Остальные 5 растений были стерильными, вероятно вследствие косупрессии.
Рост растений Arabidopsis
Штамм Arabidopsis, обладающий мутацией dyad, был таким, как описано ранее (Siddiqi I., et. al., Development. Vol. 127(1): 197-207 (2000)). Популяцию F2, используемую для анализа микросателлитных маркеров, получали скрещиванием между штаммом No-O (экотип Nossen) и мутантной формой dyad с происхождением из экотипа Col-0, как описано (Siddiqi L, et. al., Development. Vol. 127(1): 197-207 (2000)). Растения выращивали в контролируемых условиях, как описано (Siddiqi L, et. al., Development. Vol. 127(1): 197-207 (2000)). Для прорастания семян в чашках Петри, семена поверхностно стерилизовали этанолом в течение 10 мин, с последующей обработкой их 0,025% хлоридом ртути в течение 5 мин. Далее, семена промывали три раза стерильной водой, удаляя какие-либо следы хлорида ртути. Семена ресуспендировали в тепловатом 0,5% легком агаре и равномерно распределяли на планшетах с агаром MS (0,7%), дополненным 2% сахарозой. Планшетам давали возможность высохнуть в течение часа в ламинаре и планшеты закрывали парафильмом и хранили в холодной комнате при 4°C для стратификации в течение 3 суток. После этого планшеты перемещали в вегетационную камеру. Частоты проращивания вычисляли через две недели после этого.
Для выращивания семян в горшках, синтетическую среду, используемую для выращивания растений, получали смешиванием в равном соотношении Soilrite: Perlite: Vermiculite (Keltech Energies Ltd., Karnataka 574 108, India). Смесь для горшка равномерно помещали в горшки, перфорированные на дне, обеспечивающие капиллярный подъем, и горшки пропитывали 1X раствором MS, содержащим основные соли: CaCl2 (4 мМ), MgSO4 (1,5 мМ), KNO3 (18,8 мМ), NH4NO3 (20,6 мМ), KH2PO4 (1,25 мМ pH 5,6), Fe-ЭДТА (20 мМ), к которым добавляли 1 мл (1000X) неосновных солей: (H3BO3 (70 мМ), MnCl2 (14 мМ), CuSO4 (0,5 мМ), ZnSO4 (1 мМ), NaMoO4 (0,2 мМ), NaCl (10 мМ), CoCl2 (0,01 мМ)) на литр. Семена равномерно распределяли на поверхности горшка и накрывали оберточной бумагой Saran и держали при 4-8°C в течение 3 суток для стратификации, а затем перемещали в вегетационную камеру. В случае пересаживания, горшки покрывали оберточной бумагой Saran после перемещения проростков в почвенную среду, и сразу помещали в вегетационную камеру. Оберточную бумагу Saran удаляли после укоренения растений в смеси для пересаживания в горшок. Поливку проводили с регулярными промежутками с использованием дистиллированной воды.
Анализ набора семян
Сегрегирующую популяцию F2, обладающую мутацией dyad в экотипе Col-0 использовали для оценки частоты набора семян в гомозиготных по dyad растениях. Мутантным растениям dyad позволяли расти до их конечной стадии, когда растение прекращало цвести. После этой стадии поливку прекращали для обеспечения достижения стручками зрелости для сбора. При этом наиболее низкие стручки, которые становились желтыми и были близки к осыпанию, по отдельности вскрывали, и семена, при их наличии, собирали для каждого растения отдельно. Аналогично требуемые семена собирали с регулярными промежутками для избежания возможной потери семян. В завершение, собранные семена объединяли для каждого растения отдельно для подсчета общего количества семян на растение.
Жизнеспособность пыльцы
Прижизненное окрашивание на микроспоры в пыльнике проводили, как описано (Alexander M. P., Stain Technol. Vol. 44(3): 117-122, 1971).
Мейотические препараты
Анализ женского и мужского мейотических препаратов является таким, как описано (Agashe B, Prasad C. K., and Siddiqi I., Development Vol. 129(16): 3935-3943 (2002))
Выделение ДНК растений
Геномную ДНК для анализа микросателлитных маркеров выделяли в соответствии со способом, описанным Dellaporta S. L., et al., Plant Mol. Bio. Rep., Vol. 1: 19-21 (1983) с небольшими модификациями. Приблизительно 500 мг ткани листьев собирали из отдельного растения в 1,5-мл пробирки eppendorf и быстро замораживали в жидком азоте. Затем ткань измельчали до мелкого порошка с использованием микропестика. К этому порошку добавляли 200 мкл свежего полученного буфера для экстракции (100 мМ Tris (pH 8), 50 мМ ЭДТА, 500 мМ NaCl, 1,4% SDS, и 10 мМ β-меркаптоэтанол) и мелко гомогенизировали с помощью микропестика. Затем добавляли равный объем 2X CTAB и смесь осторожно встряхивали. Затем смесь инкубировали при 65°C в течение 5 минут на водяной бане со встряхиванием. После этого образцу позволяли охладиться и добавляли равный объем смеси хлороформ:изоамиловый спирт 24:1 и перемешивали осторожно и центрифугировали в течение 10 мин при 13000 об/мин. Водную фазу, содержащую ДНК, переносили в свежую пробирку eppendorf и добавляли 2/3 объема ледяного изопропанола для осаждения ДНК. ДНК осаждали центрифугированием при 4°C, 13000 об/мин, в течение 20 мин. Осадок ДНК промывали 70% этанолом, осадок сушили в течение 30 минут и суспендировали в 50 мкл стерильной воды или буфера TE (pH 8,0), содержащего РНКзу, не содержащую ДНКазы, (20 мкг/мл).
Анализ маркеров
Исходя из исследования родительских растений экотипов Col-0 и No-O, было выбрано 5 микросателлитных маркеров из 4 различных хромосом, которые совершенно не связаны с центромерой. Эти маркеры использовали в сегрегирующей популяции F2 (No-O x Col-0 (dyad)) для выбора растений, которые являются гетерозиготными по данному маркеру. Семена из этих растений dyad собирали и проращивали в отдельных чашках Петри, так что каждый потомок представляет собой сибс конкретного материнского растения dyad. Аналогично, данные, касающиеся сибсов из различных растений, которые были гетерозиготными в отношении данного маркера, рассматривали совместно для анализа маркеров. Перечень микросателлитных маркеров и их положение представлены в таблице 1. Последовательности праймеров, используемых для амплификации микросателлитов, получены из web-сайта TAIR (www.arabidopsis.org):
nga 162
nga162F SEQ ID NO:6
nga162R SEQ ID NO:7
nga225
nga225F SEQ ID NO:8
nga225R SEQ ID NO:9
nga168
nga168F SEQ ID NO:10
nga168R SEQ ID NO:11
nga1107
nga1107F SEQ ID NO:12
ngall07R SEQ ID NO:13
nga6
nga6F SEQ ID NO:14
nga6R SEQ ID NO:15
ПЦР проводили в 1X буфере для ПЦР (Perkin Elmer), содержащем 2 мМ MgCl, по 0,2 мМ каждого dNTP, 1 единицу ДНК-полимеразы Taq (Perkin-Elmer/Cetus), и 5 пмоль прямого и обратного фланкирующих праймеров с температурой отжига 55°C, удлинением при 72°C в течение 20 секунд. Продукты ПЦР разделяли в 8% полиакриламидном геле при 150 В в течение 3 ч и окрашивали бромидом этидия, и изображение фиксировали с использованием системы документации гелей Syngene (Synoptics Inc. UK).
Растительные материалы
Факультативно апомиктические диплоидный Greenland и триплоидный Colorado изоляты Boechera holboellii представляли собой любезный подарок Kim Boutilier (Naumova T. N., et al., Sex. Plant Reprod. Vol. 14: 195-200, 2001). Растения выращивали в горшках, содержащих среду, как описано для Arabidopsis, и их выращивали в условиях, идентичных условиям для Arabidopsis.
Клонирование промотора DYAD
Промоторный участок DYAD размером 1,8 т.п.н. амплифицировали из экотипа Col-0 с использованием праймеров pg2r4 (SEQ ID NO:48) и PDYBAM (SEQ ID NO:47) и продукт клонировали в вектор pGEMT (Promega) в соответствии с инструкциями изготовителя.
Клонирование гомолога DYAD из Boechera holboellii
Геномный кодирующий участок гомолога DYAD Arabidopsis из Boechera holboellii (BhDYAD) амплифицировали с помощью праймеров, обладающих участком BamH1 на 5'-конце: Bho5BAM (SEQ ID NO:39) и Bho3BAM. (SEQ ID NO:40). Полученный фрагмент размером 3 т.п.н. клонировали в pGEMT.
Конструирование бинарного вектора pCAMBIA1300, управляющего BhDYAD под промотором DYAD Arabidopsis
BhDYAD извлекали из pGEMT в качестве фрагмента BamHI размером 3 т.п.н. и клонировали в вектор pCAMBIA1300, несущий растительный селективный маркер для гигромицина. Ориентацию проверяли с использованием праймеров BDY3 (SEQ ID NO:36) и OCSR (SEQ ID NO:38). Промоторный участок DYAD размером 1,6 т.п.н. (SEQ ID NO:22) выделяли в виде фрагмента SacI из вектора pGEMT и встраивали выше BhDYAD в вектор pCAMBIA1300. Ориентацию промотора в отношении геномной последовательности BhDYAD подтверждали с использованием праймеров ismr4 (SEQ ID NO:37) и bdy1 (SEQ ID NO:35).
Скрещивание с тремя родителями
Перенос сконструированного как указано выше бинарного вектора pCAMBIA в Agrobacterium (AGLl) проводили посредством скрещивания с тремя родителями, как описано (Agashe B, Prasad C. K., and Siddiqi I, Development, Vol. 129(16): 3935-3943 (2002)).
Трансформация растений Arabidopsis
Для анализа комплементации BhDYAD, растения F1 Col-0 x dyad трансформировали конструкцией, обладающей BhDYAD, управляемым промотором DYAD Arabidopsis. Опосредуемую Agrobacterium трансформацию вакуумной инфильтрацией in planta проводили в соответствии с Bechtold N. and Pelletier G., Methods Mol. Biol., Vol. 82: 259-66 (1998).
Селекция трансформантов
Семена TO из инфильтированных вакуумом растений F1 помещали в чашку Петри, содержащую 0,8% агар Bacto, 1 мМ KNO3 и 1% сахарозу с 20 мкг/мл гигромицина. После холодной стратификации в течение 3 суток, планшеты переносили в вегетационную камеру. Трансформанты, которые являются устойчивыми к гигромицину, можно идентифицировать уже через 5 суток после переноса вследствие довольно удлиненного корня, прямого гипокотиля и хорошо раскинувшимся несущим семядолю листьям. Выбранные трансформанты далее переносили в планшеты MS, содержащие гигромицин и, после установления устойчивости, их в конечном итоге переносили в почвенную среду. Более того, растения проверяли в отношении наличия вставки с использованием праймеров bdy3 и OCSR, как описано ранее.
Генотипирование в отношении зиготности в локусе dyad
Идентифицировали три генотипа из сегрегирующей популяции F2 dyad посредством кодоминантных маркеров CAPS (Konieczny A. и Ausubel F. M., Plant J., Vol. 4(2): 403-410, 1993) и переменных микросателлитов. Фланкирующие последовательности мутантного аллеля dyad образованы из экотипа Landsberg erecta и фланкирующие последовательности из аллеля дикого типа обладают последовательностью экотипа Colombia. Таким образом, SNP в этих фланкирующих последовательностях использовали для получения маркеров CAP, которые тесно связаны с локусом dyad и фланкируют его с любой стороны (KNEF (SEQ ID NO:31) и KNER(SEQ ID NO:32), KKF(SEQ ID NO:33) и KKR(SEQ ID NO:34)) и праймеры микросателлитных маркеров (KMF (SEQ ID NO:29 и KMR (SEQ ID NO:30)), которые тесно связаны с DYAD (Agashe B, Prasad C. K., and Siddiqi L, Development Vol. 129(16): 3935-3943 (2002)). Генотипирование в локусе dyad с использованием указанных выше маркеров, проводили как описано (Agashe B, Prasad C. K., и Siddiqi I., Development Vol. 129(16): 3935-3943 (2002)).
Выделение РНК и синтез кДНК
Хорошо развитые отдельные бутоны из диплоидного растения Greenland использовали для выделения тотальной РНК посредством реагента TriZol (Invitrogen) в соответствии с инструкциями изготовителя. 4 мкг тотальной РНК использовали для синтеза первой цепи кДНК с использованием системы для синтеза кДНК SuperscriptTM Choice (GIBCO BRL). Далее кДНК амплифицировали для клонирования с использованием праймеров 5RF3 (SEQ ID NO:41) и Bho3BAM (SEQ ID NO:40). Полученный фрагмент размером 1,9 т.п.н. клонировали в pGEMT и секвенировали. Результаты представлены в списке последовательностей в качестве SEQ ID NO:17. Аминокислотная последовательность соответствующего белка DYAD представлена в SEQ ID NO:18.
ПРИМЕР 6: Конструирование зависимого от условий аллеля DYAD и развитие гомогенной популяции трансгенных растений, показывающей мутантный фенотип dyad
Стратегия, используемая для конструирования зависимого от условий аллеля гена DYAD, была основана на слиянии связывающего гормон домена глюкокортикоидного рецептора крысы (GR) (SEQ ID NO:27) с C-концом DYAD и встраиванием слитой конструкции в геном растений, гомозиготных в отношении мутантного аллеля dyad (dy/dy). Слитый белок DYAD-GR в чистом виде не способен комплементировать мутантную форму dyad, поскольку домен GR обеспечивает цитоплазматическую локализацию в отсутствии стероидного гормона, в то время как область действия DYAD расположена в ядре. Однако в присутствии стероидного гормона, слитый белок высвобождается из цитоплазматического связывающего участка и становится способным к перемещению в ядро, где он может комплементировать мутантную форму dyad. Стадии конструирования были следующими: бинарный вектор растения pBI101,3 расщепляли посредством BamHI плюс SacI для удаления репортерного гена GUS и замены его фрагментом BamHI-SacI, содержащим домен GR (A.M. Lloyd et al., Science 266, 436-439 (1994)).
Полученную плазмиду назвали pBI101.3::GR. Далее для амплификации посредством ПЦР C-концевого участка гена DYAD размером 304 т.п.н использовали праймеры DyCF (SEQ ID NO:43) и DyPB (SEQ ID NO:42) (которые содержат последовательность для модификации терминирующего кодона и введения участков рестрикции для BamHI и PstI). Модифицированную последовательность клонировали в качестве фрагмента PstI размером 216 т.п.н. в плазмиду pBS (KS)::Dyad, которая обладала геномным клоном размером 5,8 т.п.н. (SEQ ID NO:28), содержащим целый ген DYAD, соответствующий координатам от 9684 до 3878 клона P1 MFG13 (Acc No. AB025621), с получением pBS(KS)::Dyad*. Полученная плазмида содержала ген DYAD, в котором терминирующий кодон TGA заменен GGG и который также обладал участком BamHI совместно с замененным кодоном. Фрагмент SalI-BamHI размером 269 т.п.н. из pBSII(KS)::Dyad*, который содержал нуклеотиды с 9684 по 9416 в MFG13 клонировали в pBI101.3::GR с последующим расщеплением посредством SalI плюс BamHI. Затем оставшийся участок DYAD из 9417-5335 клонировали в качестве фрагмента BamHI-BamHI из pBS(KS)::Dyad* в продукт предшествующей стадии, что привело к слиянию в рамке считывания домена GR с C-концом DYAD. Конечная плазмида, названная pBI101.3::DyadΔGR, представлена на фигуре 6.
Конструкцию вводили в штам Agrobacterium AGL1 посредством скрещивания трех родителей с использованием штамма-помощника E. coli HB 101[pRK2013]. Область T-ДНК трансформировали в растения Arabidopsis (TO), которые были гетерозиготным в отношении мутантного алллеля dyad (+/dy) посредством трансформации in-planta (Bechtold N. and Pelletier G., Methods Mol. Biol., Vol. 82: 259-66, 1998). Проводили селекцию устойчивых к канамицину проростков T1, высевая семена на планшеты с агаром MS, содержащим канамицин (50 мг/литр), и их переносили в планшеты MS + канамицин для подтверждения устойчивого фенотипа. Трансформанты далее идентифицировали посредством ПЦР с использованием праймеров DyCF (SEQ ID NO:43) и GRrev (SEQ ID NO:44). Подтвержденные устойчивые к канамицину проростки переносили в почву и выращивали до взрослого состояния. После цветения и развития первых 8-10 стручков, растения поливали раз в трое суток 10 мМ дексаметазоном в дополнение к опрыскиванию раз в сутки 10 мМ дексаметазоном + 0,015% Silwet L-77. Было отмечено, что в нескольких растениях, в которых была показана стерильность перед обработкой дексаметазоном, развились способные к оплодотворению стручки через 5-7 суток после начала обработки дексаметазоном. Часть растительного материала использовали для саузерн-анализа в целях определения количества копий вставки, и также генотипировали в отношении локуса с использованием ПЦР на основе маркеров CAP, близко связанных с локусом dyad и фланкирующих его. Мутантная форма dyad была первоначально выделена из источника Ler, а затем подвергнута интрогрессии в штамм Col. Таким образом аллель Ler маркеров CAPS является диагностическим для мутантной формы dyad, в то время как аллель Col является признаком дикого типа (фигура 7). Вставки отдельных копий идентифицировали среди растений, которые обладали по меньшей мере одной копией мутантного аллеля dyad, и семена из этих растений высевали на чашки с MS + канамицин. Устойчивые к канамицину проростки переносили в почву и генотипировали в отношении локуса dyad. Растения, которые были гомозиготными по мутантному аллелю dyad, идентифицировали и выращивали до зрелого состояния. После цветения все растения подпитывали водой в течение начальной фазы плоть до раскрытия первых 8-10 цветков с последующей поливкой раствором, содержащим дексаметазон, как описано выше. Линии, которые показывали зависимую от условий стерильность, идентифицировали посредством скрининга различных однокопийных вставок. В качестве примера, одна линия No. 33, представленная на фигуре 8, привела к мутантным растениям dyad (dy/dy), все из которых показали стерильность в ходе первоначальной фазы репродуктивного роста и которые стали фертильными после обработки дексаметазоном. Семяпочки из бутонов, извлеченные до обработки дексаметазоном, показали мутантный фенотип dyad, в то время как семяпочки, выделенные после обработки дексаметазоном, показали фенотип дикого типа (фигура 9). Собирали семена гомозиготных мутантных растений dyad с получением семейств T3, и семейства T3, которые были гомозиготными в отношении вставки DYAD-GR, идентифицировали посредством скрининга семейств, которые давали все устойчивые к канамицину проростки. Эти результаты иллюстрируют конструирование зависимого от условий аллеля DYAD и его введение в растения, обеспечивая посредством этого растения, которые показывают мутантный фенотип dyad в одном наборе условий (отсутствие дексаметазона) и фенотип дикого типа, когда их подпитывали (или опрыскивали) дексаметазоном. Эти результаты также обеспечивают разработку гомогенной популяции растений, все из которых показывают мутантный фенотип dyad.
Последовательность домена глюкокортикоидного рецептора, используемого в этом исследовании (914 т.п.н.) (SEQ ID NO:27)

Геномная последовательность Dyad, используемая для клонирования в качестве фрагмента Sal1 в pBS(KS)::Dyad (5807 т.п.н.) (SEQ ID NO:28)
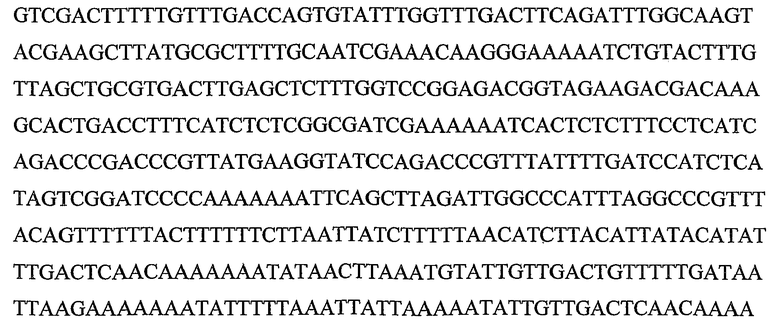



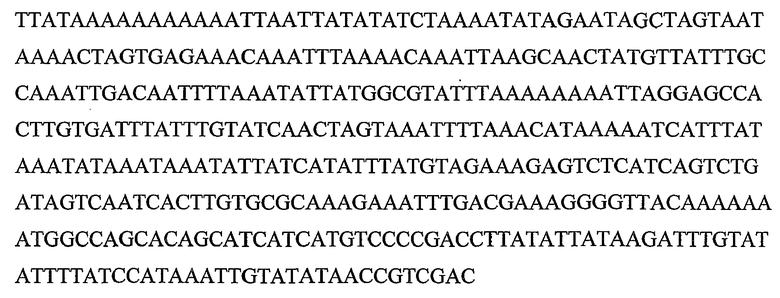
ПРИМЕР 7: Самоопыленное семя мутантной формы dyad, которое является триплоидным (3n), содержит диплоидный (2n) вклад из женской гаметы
Возвратные скрещивания проводили между татраплоидными (4n) и диплоидными (2n) растениями Arabidopsis дикого типа. В обоих случаях семена, которые образуются, являются триплоидными. Однако когда мужское родительское растение было тетраплоидным и женское родительское растение было диплоидным, образованные семена были крупными, в то время когда мужское родительское растение было диплоидным и женское родительское растение было тетраплоидным, семена были уменьшенными. Эти результаты представлены на фигуре 10 и масса 100 семян для каждой категории семян представлена в таблице 2.
Масса 100 семян, полученных из растений при различных скрещиваниях
Эти открытия воспроизводят данные, известные в предшествующем уровне техники (Scott RJ et al., Development 125, 3329-3341, 1998). Без связи с какой-либо теорией в отношении механизма, неэквивалентность отцовского и материнского генома в регуляции развития семян была объяснена в соответствии с теорией конфликта родитель-потомок (Haig D. и Westoby M., Am. Nat. Vol. 134: 147-155, 1989), как возникшая вследствие конкуренции за распределение ресурсов между материнским родителем, который ограничивает рост зародыша, способствуя равному распределению ресурсов среди всех семян, и каждым зародышем, физическое состояние которого повышается при запасании большего количества ресурсов. В соответствии с Haig D. and Westoby M., Am. Nat. Vol. 134: 147-155, 1989, подвергнутые импринтингу гены, которые по материнской линии экспрессируются в зародыше, будут действовать для ограничения роста зародыша, в то время как гены, экспрессируемые по отцовской линии, будут способствовать повышенному росту зародыша. Таким образом, семена, которые содержат дополнительный эквивалент отцовского генома будут больше, чем нормальные, вследствие избыточного дозирования продуктов генов, которые обеспечивают рост зародыша, в то время как семена, которые содержат дополнительный эквивалент материнского генома, будут меньше нормальных, вследствие избыточного дозирования продуктов генов, которые ограничивают рост зародыша.
Для определения материнского и отцовского вклада в самоопыленные семена мутантной формы dyad, анализировали размер семян. Самоопыленные семена, полученные из мутантных растений dyad, обладали гетерогенным размером и их классифицировали в любую из трех категорий: крупные, нормальные и уменьшенные, как изображено на фигуре 10. Распределение размеров по классам из 7 отдельных мутантных растений dyad представлено ниже:
Распределение размера по классам для семян из мутантных растений dyad
Получали семена каждого класса из множества растений, проращивали и выращивали в растения. Плоидность каждого растения определяли посредством подсчетов хромосом в мейотических препаратах. Результаты представлены в таблице 4, ниже:
Плоидность растения из каждого класса семян в самоопыленных мутантных формах dyad
Эти данные показывают, что большинство триплоидных растений являются уменьшенными и составляют основную часть категории уменьшенных семян. Выявление того, что большинство триплоидных растений являются уменьшенными, указывает на то, что они образуются в результате избытка материнского вклада (2n) и не в результате избытка отцовского вклада, который, таким образом, будет представлять собой 1n в триплоидных растениях. Совместно с данными примера 4 относительно того, что все триплоидные растения сохраняют родительскую гетерозиготность, эти результаты показывают, что сохранение гетерозиготности происходит вследствие женского родителя, и таким образом, что триплоидные растения образуются из нередуцированной женской гаметы, которая сохраняет родительскую гетерозиготность.
Для подтверждения того, что триплоидные растения в dyad образуются вследствие женского вклада 2n, авторы настоящего изобретения провели скрещивание мутантной формы dyad в качестве женского растения с линией ETC60 (дикий тип по dyad) в качестве мужского растения с получением семян F1. Линия ETC60 (описанная в патентной заявке США No. 10/857539) обладает одной копией транспозона Ds, обладающего геномом устойчивости к канамицину. После сегрегации по устойчивости к канамицину, за которой следует скрещивание F1 с диплоидными растениями дикого типа, можно определять вклад мужской гаметы в плоидность в растении F1. Семена после первого скрещивания проращивали и проростки переносили в почву. Шесть растений F1 тестировали в отношении гена устойчивости к канамицину с использованием специфичных к гену устойчивости к канамицину праймеров (KanF SEQ ID NO:49 и KanR SEQ ID NO:50), а также в отношении копии транспозона в ETC60 с использованием специфичного к транспозону праймера Ds5-2 (SEQ ID NO:45) в сочетании со специфичным к гену праймером GLTF (SEQ ID NO:46). Все шесть растений были положительными в отношении элемента Ds, несущего устойчивость к канамицину, и также было выявлено, что они являются способными к оплодотворению, как можно было ожидать для скрещенных растений, содержащих копию DYAD дикого типа. Плоидность шести растений исследовали с использованием препаратов мейотических хромосом. Было выявлено, что 3 растения были триплоидными с 15 хромосомами, 2 растения обладало 16 хромосомами и 1 обладало 17 хромосомами. Эти результаты подтверждают вероятность того, что женские гаметы образуются из нередуцированных/гиперплоидных спор. Оплодотворение нередуцированных женских гамет гаплоидной пыльцой может привести (практически) к триплоидным растениям, которые являются симплексными по гену устойчивости к канамицину (Kkk). Альтернативно триплоидные растения могут образовываться при оплодотворении гаплоидной женской гаметы нередуцированной мужской гаметой или двумя редуцированными мужскими гаметами, в случае которых триплоидные растения могут образовывать дуплекс гена устойчивости к канамицину (KKk).
Если растение в симплексном состояния скрестить с растением дикого типа, которое не обладает устойчивостью к канамицину, тогда сегрегационное соотношение устойчивости к канамицину и чувствительности в полученных растениях будет составлять 1:1. Однако если растение в дуплексном состоянии скрещивают с растением дикого типа, тогда можно ожидать, что сегрегационное соотношение будет составлять 5:1. Скрещивания проводили для двух триплоидных растений, полученных как указано выше, с растением дикого типа, и полученные семена оценивали в отношении сегрегации устойчивости к канамицину. Результаты, представленные в таблице 5, показывают сегрегацию 1:1 для устойчивости к канамицину, исключающую полиспермию, и показывают, что триплоидные растения образуются из нередуцированных женских гамет.
Сегрегация фенотипа KanR при скрещиваниях
семена*
5:1*** χ2=240,18;P<<0,001 S
5:1*** χ2=138,21;P<<0,001 S
** Критерий значимости по степени соответствия для соотношения 1:1 вычисляют, исключая непроросшие семена
*** Критерий значимости по степени несоответствия для соотношения 5:1 вычисляют, включая непроросшие семена в категорию KanR. Теоретически только 50% непроросших семян следует включать в каждую категорию (исходя из полученного соотношения проростков KanR и KanS), однако в целях повышения уровня значимости авторы настоящего изобретения включили всю совокупность непроросших семян в категорию KanR. Это показывает, что, даже несмотря на то, что авторы настоящего изобретения включили всю совокупность непроросших семян в категорию KanR, степень соответствия для соотношения 5:1 не является значимой и, таким образом, решительно поддерживает условие, оказывающее предпочтение только соотношению 1:1.
S значимость по критерию χ2, что указывает на несоответствие данному соотношению
NS незначимость по критерию χ2, что указывает на соответствие данному соотношению
ПРИМЕР 8: Ген DYAD и кодирующая последовательность из тополя (Populus trichocarpa)
Дополнительный пример гена DYAD из тополя находится на http://www.ornl.gov/sci/ipgc.
Трансляция кодирующего участка последовательности кДНК приводит к аминокислотной последовательности, которую сравнивают с аминокислотной последовательностью белка DYAD дикого типа из Arabidopsis thaliana с использованием программы Clustal W, как представлено на фигуре 11.
Гомолог AtDyad Populus trichocarpa
как на http://www.ornl.gov/sci/ipgc
Геномный участок (SEQ ID NO:24)
ЭКЗОН
ИНТРОН
Включая 2444 т.п.н. выше первого ATG




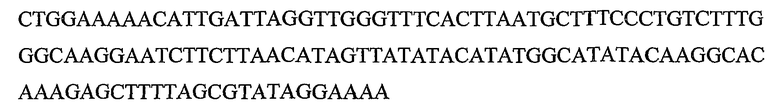
Транскрипт/CDS как в базе данных (2493 т.п.н.) (SEQ ID NO:25)

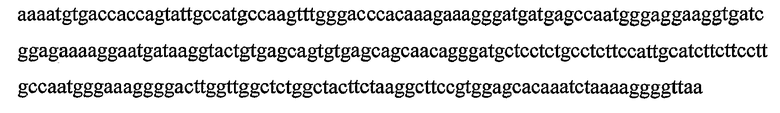
Белковая последовательность, как в базе данных (830 а.к.) (SEQ ID NO:26)

ПРИМЕР 9: Идентификация полинуклеотидов и полипептидов DYAD маиса
Поиск генома маиса с использованием TBLASTN и белка DYAD риса (SEQ ID NO:51) в качестве запроса на web-сайте (www.plantgdb.org) показал наличие предполагаемого гена DYAD в участке генома маиса, соответствующего контигам ZmGSStucl 1-12-04.1016.1 (SEQ ID NO:52) и ZmGSStucl 1-12-04.1016.2 (SEQ ID NO:53). Аннотация участка с использованием GENSCAN (http://genes.mit.edu) в сочетании с редактированием вручную привели к идентификации предполагаемых полипептидных последовательностей в маисе, которые могут быть выровнены с полипептидными последовательностями DYAD риса (Фигура 12). Настоящее изобретение относится к применению указанных полипептидных последовательностей и полинуклеотидных последовательностей маиса, кодирующих указанные полипептиды.
Полипептидные последовательности, полученные из Z. mays картируют в отношении нуклеотидных последовательностей контига, как показано ниже посредством нуклеотидных координат. Также представлены собранные неполные полипептидные последовательности Zm DYAD, кодируемые последовательностями контига.
Координаты и концептуальная трансляция ZmGSStuc11-12-04.1016.1 (SEQ ID NO:52)

Собранный полипептид Z. mays: (SEQ ID NO:54)

Координаты и концептуальная трансляция ZmGSStuc11-12-04.1016.2 (SEQ ID NO:53)
Собранный полипептид Z. mays: (SEQ ID NO:55)

ПРИМЕР 10: Общий способ для партеногенеза
Определение оптимальной дозы облучения:
1. Собрать пыльники из мужских родительских растений того же вида, что и женское родительское растение, подлежащее применению, или родственного ему вида, и облучать ионизирующим облучением в диапазоне доз, включающем 1, 5, 10, 20, 30, 50, 70, 100, 150, 200 крад.
2. Опылить цветки с удаленными пестиками или женские цветки из женского растения, которое отличается от родителя с облученной пыльцой тем, что они несут один или несколько рецессивных фенотипических маркеров или отличаются в отношении маркеров ДНК (микросателлиты, CAPS, или RAPD). Предпочтительным является применение 10-50 цветков для опыления при каждой дозе ионизирующего излучения.
3. Собрать семена из опыленных цветков и объединить семена от цветков, которые опылили пыльцой, которая получила такую же дозу облучения.
4. Прорастить семена и вырастить в растения, так чтобы получить приблизительно 20-100 растений для каждой дозы облучения.
5. Оценить генотип растений в отношении фенотипического маркера или ДНК-маркеров и вычислить соотношение растений, которые являются сходными с материнским родителем.
6. Выбрать дозировку, которая приводит к оптимальному сочетанию как высокой процентной доли жизнеспособных растений, так и высокой доли растений, которые являются сходными с материнским родителем.
Индукция партеногенеза в мутантном растении dyad:
1. Опылить мутантное растение dyad пыльцой, облученной с использованием соответствующей дозы ионизирующего излучения, определенной как описано выше.
2. Собрать семена.
3. Прорастить семена и вырастить в растения.
Идентификация партеногенетических растений:
1. Оценить растения в отношении рецессивного фенотипического маркера, который несет женский родитель. Растения, которые показывают рецессивный фенотип, классифицируют как партеногенетические. Кроме того, растения можно оценивать в отношении ДНК-маркеров посредством выделения ДНК из ткани растений с последующим анализом ДНК в отношении полиморфных маркеров. Растения, показывающие паттерны маркеров, характерные для женского родителя и лишенные маркерных полос для мужского растения, классифицируют в качестве партеногенетических. Таким образом, можно вычислить процентное количество партеногенетических растений в эксперименте по опылению.
2. Партеногенетические растения можно исследовать в отношении маркеров, для которых женский родитель был гетерозиготным. Те растения, которые сохраняют гетерозиготность для всех маркеров, по которым женская мутантная форма dyad была гетерозиготной, являются апомиктическими растениями.
Ниже представлены ссылки на возможные молекулярные маркеры, которые можно использовать для различных видов сельскохозяйственных растений:
Пшеница: www.gramene.org
1. Torada et al. (2006). SSR-based linkage map with new markers using an intraspecific population of common wheat. Theor Appl Genet. 2006 Apr; 112(6):1042-51.
2. Song et al. (2005). Development and mapping of microsatellite (SSR) markers in wheat. Theor Appl Genet. 2005 Feb; 110(3):550-60.
Рис: www.gramene.org
1. Harushima et al. (1998). A high-density rice genetic linkage map with 2275 markers..." Genetics 148: 479-494.
2. Causse et al. (1994). Saturated molecular map of the rice genome based on an interspecific backcross population. Genetics. 1994 Dec; 138(4):1251-74.
Маис: Coe et al. (2002). "Access to the maize genome: an integrated physical and genetic map". Plant Physiol. 128: 9-12. www.gramene.org
Ячмень: www.gramene.org:
Wenzl et al. (2006). A high-density consensus map of barley linking DArT markers to SSR, RFLP and STS loci and agricultural traits. BMC Genomics. 2006 Aug 12;7(l):206
Овес: www.gramene.org
De Koeyer et al. (2004). A molecular linkage map with associated QTLs from a hulless x covered spring oat population. Theor Appl Genet. 2004 May;108(7):1285-98.
Просо американское: www.gramene.org
An integrated genetic map and a new set of simple sequence repeat markers for pearl millet, Pennisetum glaucum. Theor Appl Genet. 2004 Nov; 109(7):1485-93.
Сорго: Chittenden et al. (1994). "A detailed RFLP map of Sorghum bicolor...". Theor. Appl. Genet. 87: 925-933.
Brassica oleracea: Bohuon et al. (1998). "Comparison of a Brassica oleracea genetic map with the genome of Arabidopsis thaliana". Genetics 150: 393-401.
Brassica juncea: Pradhan et al. (2003). A high-density linkage map in Brassica juncea (Indian mustard) using AFLP and RFLP markers. Theor Appl Genet. 2003 Feb;106(4):607-14.
Brassica napus: Piquemal et al. (2005). Construction of an oilseed rape (Brassica napus L.) genetic map with SSR markers. Theor Appl Genet. 2005 Nov;l 11(8):1514-23.
Brassica rapa: Kole et al. (1997). Genetic linkage map of a Brassica rapa recombinant inbred population. J. Hered. 88:553-557
Хлопок: Rong et al. (2004). "A 3347-locus genetic recombination map..." Genetics 166: 389-417.
Томат: Zhang et al. (2002). A molecular linkage map of tomato displaying chromosomal locations of resistance gene analogs based on a Lycopersicon esculentum x Lycopersicon hirsutum cross. Genome 2002 Feb; 45(1): 133-46.
Баклажан: Doganlar et al. (2002)A comparative genetic linkage map of eggplant (Solanum melongena) and its implications for genome evolution in the solanaceae. Genetics 161(4):1697-711
Стручковый перец: Genome mapping in capsicum and the evolution of genome structure in the solanaceae. Genetics 152(3): 1183-202.
Картофель: Tanksley et al. (1992). High density molecular linkage maps of the tomato and potato genomes. Genetics 132(4): 1141-1160.
Соя: Ferreira et al. (2000). Soybean genetic map of RAPD markers assigned to an existing scaffold RFLP map. J. Hered. 91(5): 392-396.
Тополь: Yin et al. (2001). Preliminary interspecific genetic maps of the populus genome constructed from RAPD markers. Genome 2001 Aug;44(4):602-9.
Tuskan et al. (2004). Characterization of microsatellites revealed by genomic sequencing of Populus trichocarpa. Canadian J. Forest Res. 34(1): 85-93.
Образец штамма E. coli DH5α, трансформированного плазмидой pBI101.3::DyadΔGR, был депонирован в International Depository Authority, Microbial Type Culture Collection Microbial Type Culture Collection and Gene Bank (MTCC, Institute of Microbial Technology (IMTECH), Council of Scientific and Industrial Research (CSIR), Sector-39A, Chandigarh - 160 036, India). Образец был депонирован 1 декабря 2006 года и он обладает внутренней ссылкой No. BI507. Образец, содержащий по меньшей мере 2500 семян популяции F2 от скрещивания между мутантной формой dyad в качестве мужского растения с женским растением дикого типа и который сегрегирует в направлении мутантной формы dyad, был депонирован в American Type Culture Collection (Manassas, VA20108, USA). Образец был отправлен 1 декабря 2006 года и обладает внутренней ссылкой Reference No. ISDYF2C. Образец, содержащий по меньшей мере 2500 семян (полученных из линии no. 33), которые являются гомозиготными по dyad и по вставке DyadΔGR и которые показывают зависимую от условий способность к оплодотворению в ответ на дексаметазон, был депонирован в American Type Culture Collection (Manassas, VA20108, USA). Образец был отправлен 1 декабря 2006 года и обладает внутренней ссылкой No. 33-5DYGR.
В настоящем документе цитированы различные статьи научной периодической и патентной литературы. Каждая такая статья включена в настоящее описание в качестве ссылки в полном объеме и для всех целей посредством такого цитирования.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЗДАНИЕ ГАПЛОИДНЫХ РАСТЕНИЙ И УСОВЕРШЕНСТВОВАНИЕ СЕЛЕКЦИИ РАСТЕНИЙ | 2010 |
|
RU2571927C2 |
| РАСТЕНИЯ ДЫНИ С ПОВЫШЕННОЙ УРОЖАЙНОСТЬЮ ПЛОДОВ | 2015 |
|
RU2696201C2 |
| ИДЕНТИФИКАЦИЯ И ПРИМЕНЕНИЕ МУТАНТНЫХ KRP У РАСТЕНИЙ | 2012 |
|
RU2631790C2 |
| КОМПОЗИЦИИ ДЛЯ ИНДУКЦИИ ГАПЛОИДИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2771141C2 |
| Brassica juncea КАЧЕСТВА ОМЕГА-9 | 2009 |
|
RU2557316C2 |
| ГЕТЕРОЗИГОТНЫЕ ПО CENH3 ОДНОДОЛЬНЫЕ РАСТЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ИНДУКЦИИ ГАПЛОИДОВ И ОДНОВРЕМЕННОГО РЕДАКТИРОВАНИЯ ГЕНОМА | 2021 |
|
RU2832578C1 |
| РАСТЕНИЯ ПШЕНИЦЫ С ПОВЫШЕННОЙ УСТОЙЧИВОСТЬЮ К ИМИДАЗОЛИНОНОВЫМ ГЕРБИЦИДАМ | 2002 |
|
RU2337531C2 |
| УСТОЙЧИВЫЕ К ГЕРБИЦИДАМ РАСТЕНИЯ ПОДСОЛНЕЧНИКА | 2009 |
|
RU2551781C2 |
| РАСТЕНИЯ ПШЕНИЦЫ С ПОВЫШЕННОЙ УСТОЙЧИВОСТЬЮ К ИМИДАЗОЛИНОНОВЫМ ГЕРБИЦИДАМ | 2002 |
|
RU2337532C2 |
| ГЕН-ВОССТАНОВИТЕЛЬ RF4 ДЛЯ ЦИТОПЛАЗМАТИЧЕСКОЙ МУЖСКОЙ СТЕРИЛЬНОСТИ (CMS) C-ТИПА КУКУРУЗЫ, МОЛЕКУЛЯРНЫЕ МАРКЕРЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2603005C2 |





















































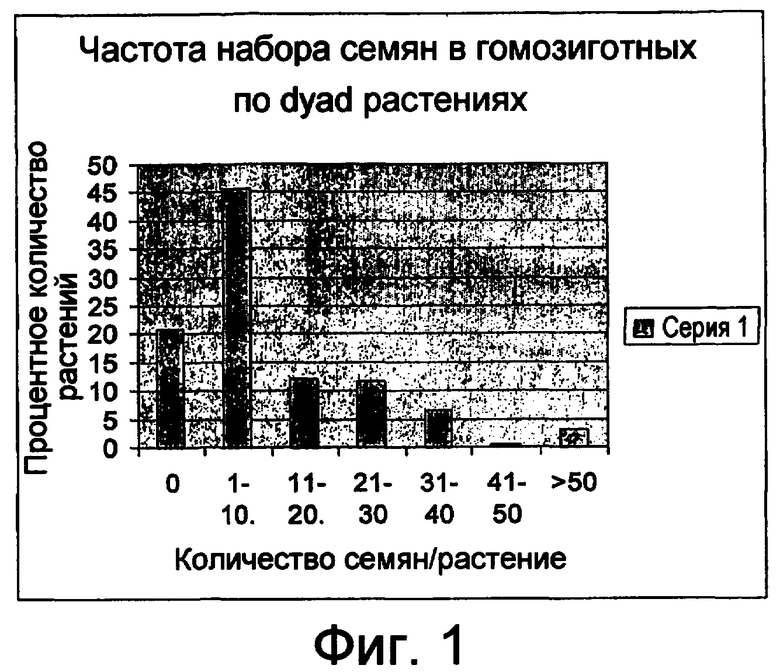
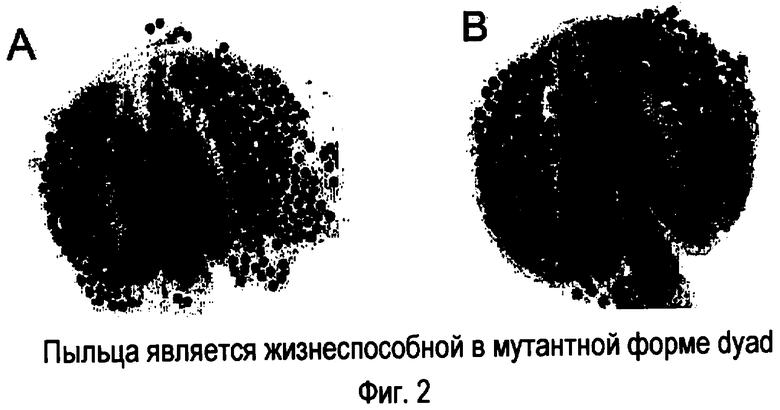
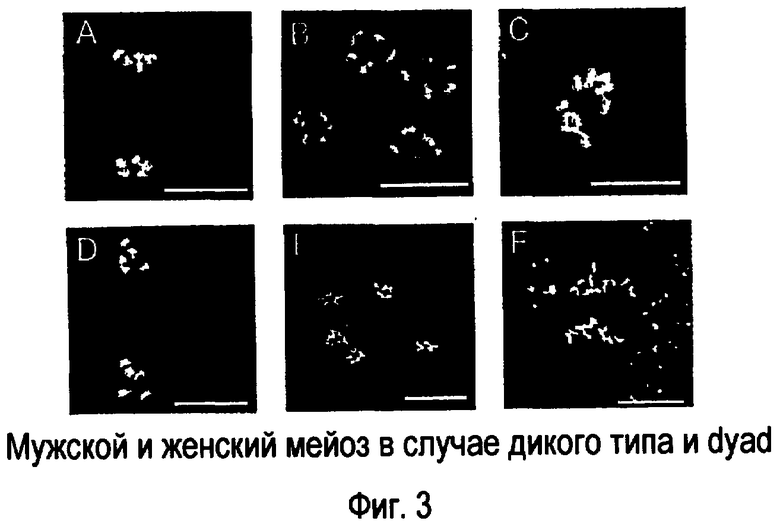

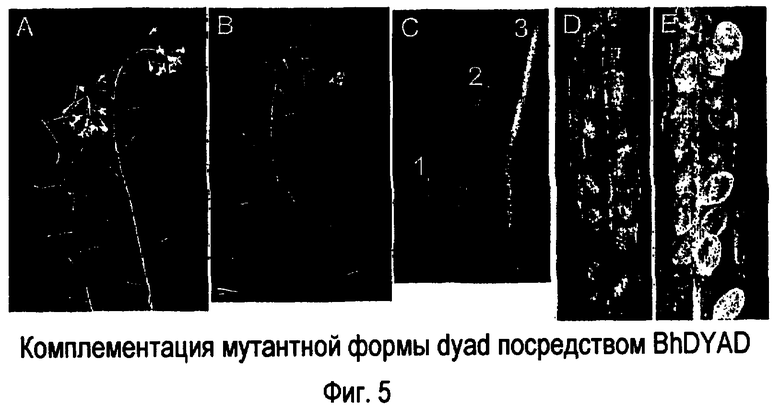
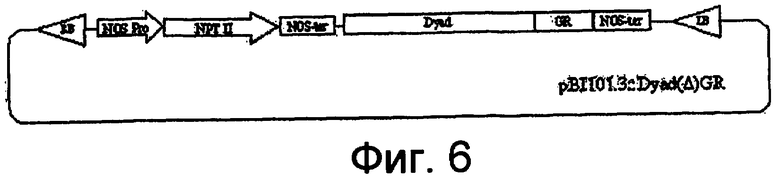

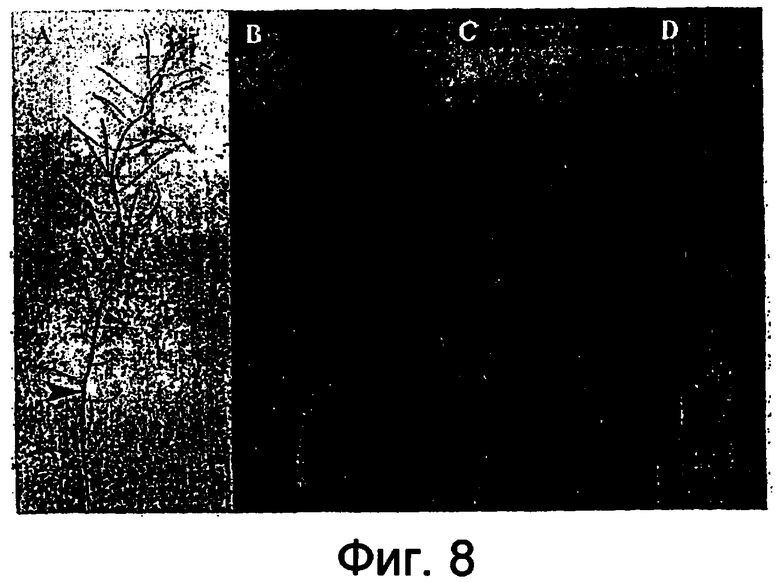
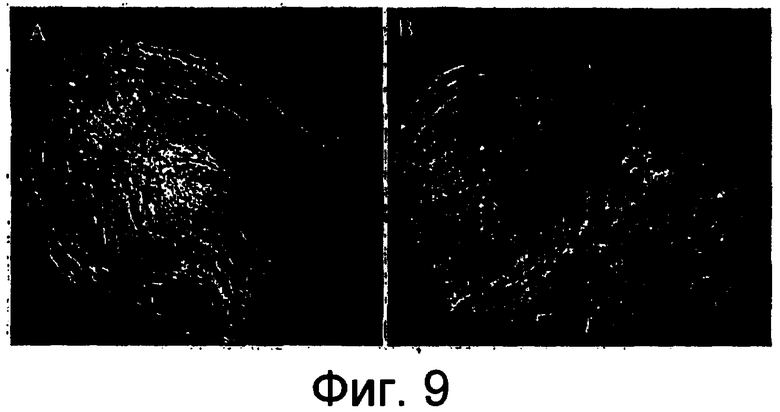
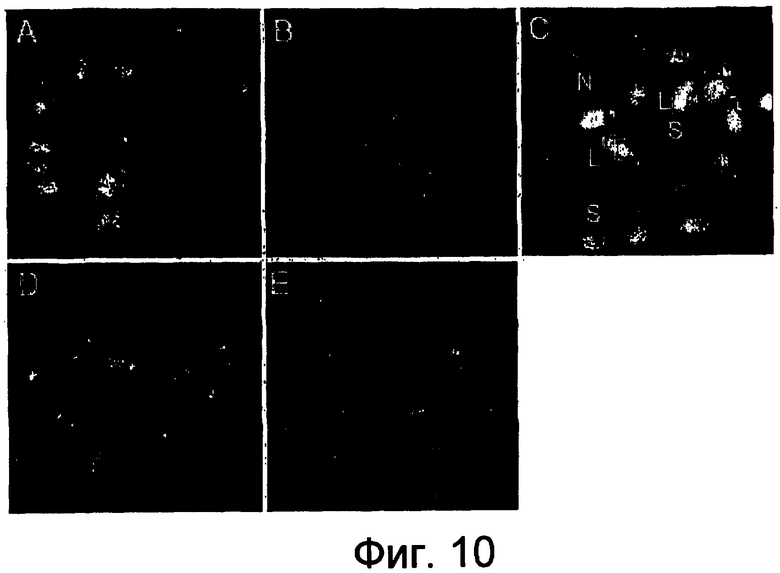

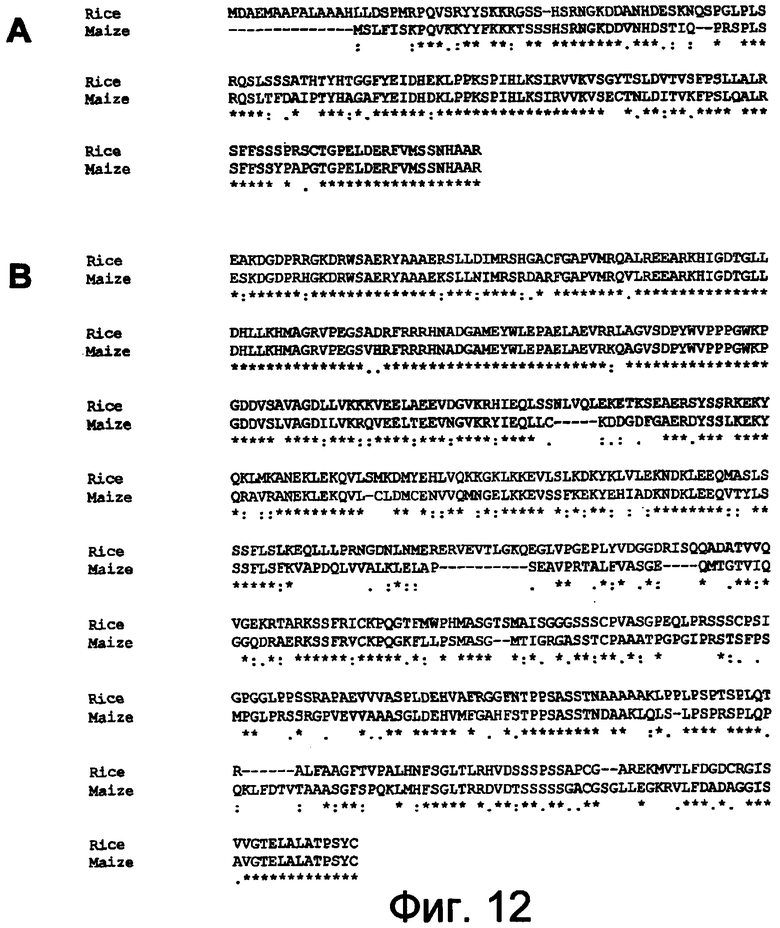
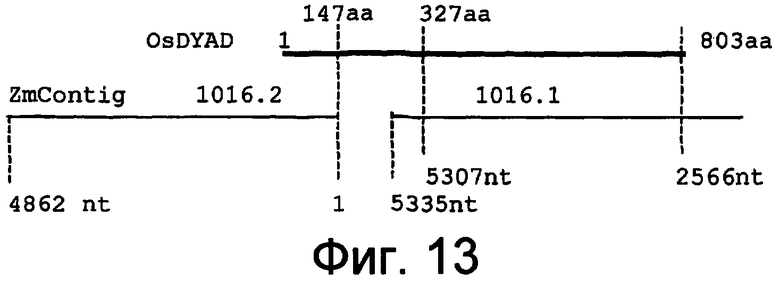
Настоящее изобретение относится к области биотехнологии и генетики растений. Рассмотрена экспрессирующая конструкция, обеспечивающая зависимую от условий экспрессию белка DYAD дикого типа в ядре клетки растения, гомозиготного по мутантному аллелю dyad, для осуществления апомиксиса. Предложены: растение для осуществления апомиксиса и его часть. Описаны способ получения семян, а также способы получения и размножения растения для осуществления апомиксиса. Использование изобретения обеспечивает зависимое от условий проявление фенотипа dyad дикого типа в растениях, содержащих геном, гомозиготный по мутантному аллелю dyad, и зависимое от условий сохранение гетерозиготности генотипа женского родительского растения. 7 н. и 12 з.п. ф-лы, 13 ил., 5 табл.
1. Растение для осуществления апомиксиса, содержащее геном, гомозиготный по мутантному аллелю dyad, и также содержащее по меньшей мере одну трансгенную копию полинуклеотида, кодирующего белок DYAD дикого типа, так что указанный белок DYAD экспрессируется в зависимости от условий в ядре клеток растения, и растение проявляет фенотип в условиях, при которых указанный белок DYAD не экспрессируется, где указанный фенотип включает продукцию семян, которые сохраняют женскую родительскую гетерозиготность без рекомбинации.
2. Растение по п.1, где указанное растение показывает женскую стерильность, когда указанный белок DYAD дикого типа не экспрессируется в ядре.
3. Растение по п.1, в котором указанный геном содержит по меньшей мере одну копию полинуклеотида, кодирующего белок DYAD дикого типа, слитый со связывающим лиганд доменом рецептора стероидного гормона.
4. Растение по п.3, в котором указанный связывающий лиганд домен рецептора стероидного гормона представляет собой связывающий лиганд домен рецептора для глюкокортикоидов.
5. Растение по п.1, в котором мутантный аллель dyad представляет собой аллель, с которого экспрессируется мутантный белок DYAD, укороченный в аминокислотном положении от 508 до 572.
6. Растение по п.5, в котором мутантный аллель dyad содержит полинуклеотид, имеющий нуклеотидную последовательность SEQ ID NO:1, или обладает нуклеотидной последовательностью, которая будет гибридизоваться с полинуклеотидом, комплементарным SEQ ID NO:1, SEQ ID NO:23 или SEQ ID NO:25 в условиях 40% формамида, 1 M NaCl, 1% SDS при 37°С, или в условиях, эквивалентных этим.
7. Растение по п.1, в котором белок DYAD дикого типа кодируется полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID NO:4 или SEQ ID NO:17 или SEQ ID NO:23 или SEQ ID NO:25, или полинуклеотидом, который гибридизуется с последовательностью, комплементарной SEQ ID NO:1 или SEQ ID NO:23 или SEQ ID NO:25 в условиях 40% формамида, 1 М NaCl, 1% SDS при 37°С, или в условиях, эквивалентных этим.
8. Растение по п.6, в котором белок DYAD дикого типа кодируется полинуклеотидом, содержащим нуклеотидную последовательность SEQ ID NO:4 или SEQ ID NO:17 или SEQ ID NO:23 или SEQ ID NO:25, или полинуклеотидом, который гибридизуется с последовательностью, комплементарной SEQ ID NO:1 или SEQ ID NO:23 или SEQ ID NO:25 в условиях 40% формамида, 1 М NaCl, 1% SDS при 37°С, или в условиях, эквивалентных этим.
9. Способ получения семян, имеющих зародышевый геном, который является гомозиготным по мутантному аллелю dyad и приводит к растению, которое зависит от условии в отношении экспрессии белка DYAD дикого типа в ядре клеток указанного растения для осуществления апомиксиса, включающий
i) трансформацию клеток первого растения, которое является гетерозиготным по мутантному аллелю dyad, вектором, содержащим конструкцию, которая обеспечивает зависимую от условий экспрессию белка DYAD дикого типа в ядре клеток указанного первого растения;
ii) самоопыление трансформированного первого растения, которое является гетерозиготным по мутантному аллелю dyad и содержит экспрессирующую конструкцию, которая обеспечивает зависимую от условий экспрессию белка DYAD дикого типа в ядре, и селекцию потомства с получением второго растения, которое является гомозиготным по мутантному аллелю dyad и по экспрессирующей конструкции; и
iii) получение семян второго растения или семян растения, являющегося потомком второго растения, когда указанное растение выращивают в условиях, при которых белок DYAD дикого типа не экспрессируется в ядре.
10. Способ по п.9, где указанное второе растение сохраняет женскую родительскую гетерозиготность в зародыше семян, образуемых указанным вторым растением в условиях, при которых белок DYAD дикого типа не экспрессируется в ядре.
11. Способ получения растения для осуществления апомиксиса, которое является гомозиготным в отношении мутантного аллеля dyad и является зависимым от условий в отношении экспрессии трансгенной копии белка DYAD дикого типа в ядре клеток растения, включающий
i) самоопыление первого растения, которое является гетерозиготным в отношении мутантного аллеля dyad и имеет геном, содержащий по меньшей мере одну трансгенную копию экспрессирующей конструкции, которая обеспечивает зависимую от условий экспрессию белка DYAD дикого типа в ядре, и сбор семян;
ii) выращивание семян растения и селекцию с получением второго растения, которое является гомозиготным в отношении мутантного аллеля dyad и содержит геном, имеющий по меньшей мере одну копию указанной экспрессирующей конструкции.
12. Способ по п.11, где указанное второе растение показывает сохранение женской родительской гетерозиготности в зародыше семян, образуемых указанным вторым растением в условиях, при которых белок DYAD дикого типа, кодируемый трансгенной копией, не экспрессируется в ядре.
13. Часть растения по п.1 для осуществления апомиксиса.
14. Способ размножения растения по п.1, включающий выращивание указанного растения в условиях, при которых трансгенный белок DYAD дикого типа экспрессируется в ядре, и сбор семян.
15. Способ размножения растения по п.3, включающий обработку указанного растения стероидным гормоном и сбор семян.
16. Способ по п.15, в котором указанный рецептор стероидного гормона представляет собой глюкокортикоидный рецептор, и стероидный гормон представляет собой дексаметазон.
17. Экспрессирующая конструкция, обеспечивающая зависимую от условий экспрессию гена DYAD дикого типа в ядре клетки растения, где указанная конструкция содержит полинуклеотид, кодирующий ген DYAD дикого типа, функционально связанный с промотором и терминатором, которые обеспечивают экспрессию в растениях, а кодирующая область гена DYAD функционально связана со связывающим лиганд доменом рецептора стероидного гормона с тем, чтобы обеспечить экспрессию слитого белка с указанным доменом.
18. Конструкция по п.17, где указанная клетка растения представляет собой материнскую клетку мегаспор.
19. Конструкция по п.17, где указанный связывающий лиганд домен рецептора стероидного гормона представляет собой связывающий лиганд домен рецептора для глюкокортикоидов.
| SIDDIQI I | |||
| et al., "The dyad gene is required for progression through female meiosis in Arabidopsis", Development (2000), 127: 197-207 | |||
| AGASHE B | |||
| et al., "Identification and analysis of DYAD: a gene required for meiotic chromosome organisation and female meiotic progression in Arabidopsis", Development (2002), 129: 3935-3943 | |||
| LLOYD A.M | |||
| et al., |
Авторы
Даты
2012-01-10—Публикация
2006-12-08—Подача