Область техники
Настоящее изобретение относится к инъекционному устройству для инъекции пациенту вещества, такого как лекарственное средство.
Предшествующий уровень техники
Одним из наиболее обычных путей введения лекарственных препаратов является инъекция, такая как внутривенная, подкожная или внутримышечная инъекция. Шприц, содержащий лекарственное средство, используется для инъекции, которая обычно проводится подготовленным медицинским персоналом. В определенных случаях, пациент подготавливается к использованию шприца для обеспечения возможности самостоятельной инъекции. Кроме того, определенные лекарственные средства составляются в предварительно заполненные шприцы для применения пациентом во избежание необходимости заполнения шприца пациентом. Однако некоторые пациенты могут быть не расположены к проведению самостоятельной инъекции, особенно если пациент боится уколов иголками.
Автоматические инъекционные устройства предоставляют альтернативу шприцу для доставки лекарственного средства. Автоматические инъекционные устройства использовались, например, для доставки лекарственных средств в неотложных условиях, таких как для введения эпинефрина для противодействия воздействиям тяжелых аллергических реакций, например, вызванных пищевой аллергией. Автоматические инъекционные устройства также были описаны для использования при введении антиаритмических лекарственных средств и селективных тромболитических средств во время сердечного приступа (см., например, патенты США №№3910260, 4004577, 4689042, 4755169 и 4795433). Различные типы автоматических инъекционных устройств также описаны, например, в патентах США №№3941130, 4261358, 5085642, 5092843, 5102393, 5267963, 6149626, 6270479 и 6371939.
В целом, предшествующие автоматические инъекционные устройства во время работы вызывают перемещение иглы шприца вперед и выдвижение из защитного корпуса перед приводом шприца для выталкивания дозы жидкости через иглу. Перемещение шприца в направлении кожи пациента с тем, чтобы игла выходила из шприца перед тем, как повышение давления жидкости, заполняющей шприц, помогает предотвратить капание жидкости из иглы перед тем, как произойдет действительная инъекция.
Такие предыдущие автоматические инъекционные устройства имеют несколько недостатков. Например, предыдущие устройства включают обнаженную иглу, которую пациент должен ввести в свое тело, что у большинства пациентов вызывает опасение и тревогу, в частности, у тех пациентов, у которых имеется «игольная фобия». Предыдущие устройства также трудно использовать пациентам, поддерживать их незагрязненное состояние и/или обеспечить точную дозировку лекарственного средства. Кроме того, пациенты, страдающие хроническими аутоиммунными заболеваниями, такими как ревматоидный артрит, а также пожилые и физически немощные пациенты, могут быть неспособны к самостоятельному проведению биологического лечения с использованием существующих инъекционных устройств. Поэтому существует потребность в таких устройствах для доставки самостоятельно вводимых лекарственных средств, которые могут безопасно использовать пациенты и которые содействуют соблюдению пациентами предписанных им схем биологической терапии.
Ингибиторы TNFα представляют собой эффективные средства для лечения аутоиммунных расстройств, таких как ревматоидный артрит, псориатический артрит, болезнь Крона. Такие ингибиторы, которые включают биологические агенты, такие как антитела, гибридные белки, обычно доставляются путем инъекции. Например, ингибитор TNFα адалимумаб (HUMIRA®, Abbott Laboratories, Lake County, Illinois), поступил в продажу в виде предварительно заполненного шприца для самостоятельного введения пациентами, и поэтому представляется важным кандидатом на применение с использованием усовершенствованных автоматических инъекционных устройств и способов.
Краткое описание сущности изобретения
Настоящее изобретение предоставляет усовершенствованные устройства, его компоненты и способы введения пациенту инъецируемых медикаментозных средств. В одном варианте осуществления, изобретение предоставляет автоматическое инъекционное устройство для выталкивания дозы жидкого лекарственного средства из иглы шприца, подвижно расположенного внутри корпуса устройства. Перед использованием, шприц по изобретению находится в отведенном назад положении внутри корпуса. Во время первой рабочей стадии, инициируемой нажатием кнопки запуска, привод проталкивает шприц в направлении проксимального конца корпуса для выдвижения иглы шприца из проксимального конца. На этой первой рабочей стадии, привод вызывает введение иглы в подкожную область пользователя, когда проксимальный конец устройства упирается в участок инъекции. На второй рабочей стадии, привод, который может представлять собой такой же или другой компонент как привод, который вызывает введение иглы, вызывает выталкивание жидкости, расположенной в шприце, в подкожную область.
Автоматическое инъекционное устройство по изобретению можно использовать для инъекции дозы ингибитора фактора опухолевого некроза-α (TNFα) с целью лечения любого числа заболеваний, включая ревматоидный артрит, псориаз, болезнь Крона, псориатический артрит и ювенильный ревматоидный артрит. В одном варианте осуществления, у пациента имеется расстройство, при котором TNFα оказывает повреждающее воздействие, выбранное из группы, состоящей из ревматоидного артрита, псориаза, болезни Крона, анкилозирующего спондилита, псориатического артрита и ювенильного ревматоидного артрита.
Автоматическое инъекционное устройство может включать окно для обеспечения возможности пользователю визуализировать содержимое и/или уровень содержимого шприца. Кроме того, автоматическое инъекционное устройство может включать индикатор для указания завершения инъекции. «Макет» или демонстрационное тренировочное автоматическое инъекционное устройство может быть также предоставлено для подготовки пользователя к применению автоматического инъекционного устройства для инъекции вещества без действительной инъекции вещества пользователю.
Изобретение предоставляет автоматическое инъекционное устройство для обеспечения подкожной инъекции вещества пользователю или пациенту, включающее корпус, имеющий открытый первый конец и второй конец, шприц, подвижно расположенный в корпусе, причем шприц включает гильзовую часть для вмещения вещества, полую иглу, сообщающуюся по текучей среде с гильзовой частью для выталкивания вещества из шприца, и пробку для герметизации гильзовой части и селективной подачи давления на вещество для принуждения его к движению через полую иглу, компонент привода шприца для первого движения шприца по направлению к первому концу корпуса с тем, чтобы игла выступила из первого конца и для последующей подачи давления на пробку, причем компонент привода шприца включает нагнетатель для селективной подачи давления на пробку, сжимаемую расширенную центральную часть и фланец между вторым концом компонента привода шприца и сжимаемой расширенной центральной частью и первый смещающий механизм для смещения компонента привода шприца в направлении первого открытого конца корпуса, причем первый смещающий механизм расположен между фланцем компонента привода шприца и вторым концом корпуса.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает кнопку запуска, расположенную на корпусе, для приведения в действие компонента привода шприца. В другом варианте осуществления, автоматическое инъекционное устройство включает кнопку запуска, соединенную с корпусом, для приведения в действие компонента привода шприца.
В другом варианте осуществления, автоматическое инъекционное устройство, кроме того, включает защелку, приводимую в действие кнопкой запуска для защелкивания компонента привода шприца в отведенном назад положении перед приведением в действие кнопки запуска.
Изобретение также включает автоматическое инъекционное устройство для обеспечения подкожной инъекции пользователю, включающее корпус, имеющий открытый первый конец, и второй конец, шприц, подвижно расположенный в корпусе, причем шприц включает гильзовую часть для вмещения вещества, полую иглу, сообщающуюся по текучей среде с гильзовой частью для выталкивания вещества из шприца, и пробку для герметизации гильзовой части и селективной подачи давления на вещество для принуждения его к движению через полую иглу, привод для селективного перемещения шприца по направлению к первому концу корпуса с тем, чтобы игла выступила из открытого первого конца корпуса и привода для выталкивания вещества из шприца после перемещения шприца по направлению к открытому первому концу корпуса. Первый съемный колпачок может покрывать первый конец корпуса.
Привод может включать первый смещающий механизм, второй смещающий механизм, привод шприца плунжерного типа и/или другое средство привода.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает дозу вещества, например, ингибитор TNFα, загруженный в гильзовую часть шприца.
В изобретение включено автоматическое инъекционное устройство для обеспечения подкожной инъекции вещества пользователю, включающее корпус, имеющий открытый первый конец, второй конец и окно, расположенное в боковой стенке для визуализации внутренней полости корпуса, шприц, подвижно расположенный в корпусе, причем шприц включает гильзовую часть для вмещения вещества, полую иглу, сообщающуюся по текучей среде с гильзовой частью для выталкивания вещества из шприца, и пробку для герметизации гильзовой части и селективной подачи давления на вещество для принуждения его к движению через полую иглу, привод для селективного перемещения шприца по направлению к первому концу корпуса с тем, чтобы игла выступила из открытого первого конца корпуса и привода для выталкивания вещества из шприца после перемещения шприца по направлению к открытому первому концу корпуса.
В одном варианте осуществления, окно имеет по существу форму замочной скважины. В еще одном варианте осуществления, окно включает линию заполнения в некотором положении в окне для индикации полной дозы вещества.
Изобретение, кроме того, предоставляет автоматическое инъекционное устройство для обеспечения подкожной инъекции пользователю, включающее корпус, имеющий открытый первый конец, и второй конец, шприц, подвижно расположенный в корпусе, причем шприц включает гильзовую часть для вмещения вещества, полую иглу, сообщающуюся по текучей среде с гильзовой частью, для выталкивания вещества из шприца, и пробку для герметизации гильзовой части и селективной подачи давления на вещество для принуждения его к движению через полую иглу, компонент привода шприца для селективной подачи давления на пробку, причем компонент привода шприца включает нагнетатель, сконфигурированный для вставления в гильзовую часть шприца, сжимаемую расширенную центральную часть и индикатор, расположенный между сжимаемой расширенной центральной частью и вторым концом компонента привода шприца для индикации, когда было произведено выталкивание содержимого шприца.
Изобретение включает автоматическое инъекционное устройство для обеспечения подкожной инъекции вещества пользователю, включающее корпус, имеющий открытый первый конец, второй конец и имеющий окно, образованное в его боковой стенке, шприц, подвижно расположенный внутри корпуса, для помещения и селективного выталкивания вещества из открытого первого конца; и
индикатор, который совмещается с окном в боковой стенке, когда шприц по существу опорожняется от вещества.
Другой аспект изобретения включает автоматическое инъекционное устройство, включающее корпус, имеющий по существу трубчатую конфигурацию, с открытым первым концом и вторым концом; шприц, подвижно расположенный внутри корпуса, причем шприц содержит дозу вещества, например, ингибитор TNF, где шприц перемещается внутри корпуса для инъекции ингибитора TNF пользователю.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает индикатор для индикации, когда вещество, например, ингибитор TNF, было вытолкнуто из шприца.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает окно, образованное в корпусе, для обеспечения возможности визуализации внутренней полости корпуса.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает индикатор, который совмещается с окном в боковой стенке, когда вещество, например, ингибитор TNF, было вытолкнуто из шприца.
Другой аспект изобретения представляет собой автоматическое инъекционное устройство для обеспечения подкожной инъекции вещества пользователю, включающее корпус, имеющий открытый первый конец, и второй конец, плунжер, включающий стержень, сконфигурированный для соединения на первом конце с пробкой шприца, сжимаемой расширенной центральной частью и фланцем между вторым концом стержня и сжимаемой расширенной центральной частью; и смещающий механизм для смещения плунжера по направлению к первому открытому концу корпуса, смещающий механизм, расположенный вокруг второго конца стержня между фланцем и вторым концом корпуса.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает кнопку запуска, расположенную на корпусе для приведения в действие плунжера.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает защелку, приводимую в действие кнопкой запуска, для защелкивания плунжера в отведенном назад положении перед приведением в действие кнопкой запуска.
В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает окно на корпусе для визуализации внутренней полости корпуса.
В еще одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает индикатор для индикации опорожнения шприца.
В другом варианте осуществления, автоматическое инъекционное устройство включает шприц, содержащий дозу вещества, например, ингибитора TNF, подлежащую инъекции пользователю.
В еще одном варианте осуществления, автоматическое инъекционное устройство включает съемный колпачок для покрытия одного из первого конца и второго конца корпуса.
В другом варианте осуществления, изобретение предоставляет автоматическое инъекционное устройство, кроме того, включающее оболочку иглы, которая продвигается по игле, выступающей через первый конец после выталкивания вещества из шприца.
Изобретение описывает автоматическое инъекционное устройство, включающее дозу ингибитора TNFα, например, адалимумаба. В одном варианте осуществления, автоматическое инъекционное устройство, кроме того, включает дозу ингибитора TNF, загруженную в гильзовую часть шприца.
Изобретение включает корпус для автоматического инъекционного устройства, включающий полый, по существу трубчатый кожух, включающий открытый первый конец, и второй конец, причем полый по существу трубчатый кожух сконфигурирован для приема шприца скольжением внутрь кожуха; первый стопор на внутренней поверхности корпуса для ограничения движения шприца в первом направлении, и второй стопор на внутренней поверхности корпуса для ограничения движения шприца во втором направлении.
В одном варианте осуществления, корпус, кроме того, включает выступ, сформированный между открытым первым концом и первым стопором для посадки смещающего механизма для смешения шприца в сторону от первого конца корпуса. В одном варианте осуществления, корпус, кроме того, включает окно, сформированное в боковой стенке корпуса для обеспечения возможности визуализации внутренней полости корпуса. В одном варианте осуществления, корпус, кроме того, включает кнопку запуска, соединенную со вторым концом трубчатого кожуха для селективного приведения в действие шприца для перемещения из первого, отведенного назад положения во второе, выступающее положение, в котором игла шприца выступает из первого конца, и, в то время как шприц находится во втором, выступающем положении, подачи давления для выталкивания вещества из шприца.
Изобретение, кроме того, включает шприц для использования в автоматическом инъекционном устройстве, включающее гильзовую часть для помещения вещества; полую иглу, по текучей среде, сообщающуюся с гильзовой частью; пробку для герметизации гильзовой части, причем пробка смещаема внутри гильзовой части для увеличения давления внутри гильзовой части для принуждения вещества к движению через полую иглу; первый стопор, сформированный на промежуточной части гильзовой части, для упора стопора в корпусе автоматического инъекционного устройства для ограничения движения шприца в первом направлении; и второй стопор, сформированный на дистальном конце гильзовой части для ограничения движения шприца относительно корпуса автоматического инъекционного устройства во втором направлении. В другом варианте осуществления, стопоры могут быть сформированы в других участках по всей гильзе.
В одном варианте осуществления, шприц, кроме того, включает плунжер сначала для селективного перемещения шприца по направлению к открытому первому концу корпуса автоматического инъекционного устройства, так что игла выступает из первого конца, а в последующем, подачи давления на пробку для того, чтобы вызвать выталкивание шприцем вещества через полую иглу.
В одном варианте осуществления, плунжер включает стержень, соединенный на первом конце с пробкой и сжимаемой расширенной центральной частью. В другом варианте осуществления, плунжер, кроме того, включает индикатор для индикации того, когда шприц произвел выталкивание по существу всего вещества через полую иглу. В одном варианте осуществления, шприц, кроме того, включает дозу ингибитора TNF, загруженную в гильзовую часть шприца. Причем ингибитор TNFα выбран из группы, состоящей из анти-TNFα антитела или его связывающей антиген части, гибридного белка TNF или рекомбинантного белка, связывающего TNF.
Изобретение, кроме того, предоставляет компонент привода шприца для инъекционного устройства, включающий стержневую часть, имеющую первый конец, второй конец и радиально расширенную часть, которая сжимается радиально внутрь для выталкивания текучей среды, и нагнетатель, сформированный на первом конце стержневой части для подачи давления на пробку шприца.
В одном варианте осуществления, компонент привода шприца, кроме того, включает часть крепления, сформированную на втором конце стержневой части для прикрепления цилиндрической пружины к компоненту привода шприца. В одном варианте осуществления, компонент привода шприца, кроме того, включает индикатор для индикации завершения инъекции, сформированный в сплошной стержневой части между радиально расширенной частью и вторым концом. В одном варианте осуществления, компонент привода шприца, кроме того, включает удерживающий фланец для удерживания цилиндрической пружины в сжатом положении до приведения в действие. В одном варианте осуществления, компонент привода шприца, кроме того, включает основание пружины для цилиндрической пружины, простирающейся между закрепляющим концом и удерживающим фланцем. В одном варианте осуществления, основание может включать гибкие ножки, вокруг которых намотана пружина. В другом варианте осуществления, закрепляющий конец включает опоры с ушками, простирающиеся от основания, и сконфигурированные для вхождения в размыкаемое зацепление с кнопкой запуска.
Изобретение, кроме того, предоставляет изготовленное изделие, включающее упаковочный материал и автоматическое инъекционное устройство, содержащее ингибитор TNFα. В одном варианте осуществления, ингибитор TNFα включает адалимумаб. В одном варианте осуществления, доза адалимумаба составляет 40 мг. Изготовленное изделие может также включать спиртовой тампон для подготовки участка кожи к инъекции и/или дозовый лоток для помещения автоматического инъекционного устройства.
Изобретение также предоставляет изготовленное изделие, включающее автоматическое инъекционное устройство, имеющее предварительно заполненный шприц, содержащий дозу ингибитора TNFα; и спиртовой тампон для подготовки участка кожи к инъекции, упакованные с инструкциями по применению для лечения артрита путем инъекции дозы в кожу пользователя с использованием автоматического инъекционного устройства.
Изобретение также включает способ инъекции вещества, включающий стадии предоставления автоматического инъекционного устройства, включающего корпус, имеющий открытый первый конец, второй конец, шприц, подвижно расположенный внутри корпуса, содержащий вещество, колпачок, покрывающий первый конец, и колпачок, покрывающий кнопку запуска на втором конце; удаления первого колпачка; удаления второго колпачка для обеспечения доступа к кнопке запуска; расположения открытого первого конца устройства в контакте с кожей пользователя; нажатия кнопки запуска для того, чтобы вызвать выдвижение иглы шприца из открытого первого конца и в кожу пользователя и в последующем выталкивание вещества через иглу в подкожную область пользователя; и удаления устройства после выталкивания вещества.
В одном варианте осуществления, автоматическое инъекционное устройство удерживается под углом примерно 90 градусов относительно поверхности кожи пользователя. В одном варианте осуществления, индикатор обеспечивает пользователю показание, когда шприц по существу опорожнен от вещества. В одном варианте осуществления, вещество, загруженное в шприц, представляет собой дозу ингибитора TNF.
В еще одном варианте осуществления изобретения, способ включает (а) расположение автоматического инъекционного устройства в участке инъекции на поверхности кожи пользователя; (b) включение механизма активации для начала инъекции вещества пользователю; (с) поддержание включения механизма активации в течение предписанного периода времени для продолжения инъекции вещества; и (d) удаление автоматического инъекционного устройства с участка инъекции после прохождения предписанного периода времени.
В еще одном варианте осуществления изобретения, способ включает (а) расположение автоматического инъекционного устройства в участке инъекции; (b) включение механизма активации для начала инъекции вещества пользователю; (с) поддержание включения механизма активации для продолжения инъекции вещества до выявления видимого индикатора завершения инъекции; и (d) удаление автоматического инъекционного устройства с участка инъекции после выявления видимого индикатора завершения инъекции.
Изобретение также описывает способ подготовки реципиента к применению автоматического инъекционного устройства.
Один аспект изобретения включает устройство для подготовки реципиента к использованию автоматического инъекционного устройства, включающего корпус, имеющий окно, кнопку запуска на первом конце корпуса; и индикатор, подвижно расположенный внутри корпуса, причем индикатор совмещается с окном корпуса после того, как пользователь нажимает кнопку запуска.
В одном варианте осуществления, устройство, кроме того, включает компонент включения для селективного перемещения индикатора из спрятанного положения в положение, совмещенное с окном. В одном варианте осуществления, компонент включения включает стержень, имеющий закрепляющую часть на первом конце, которая защелкивается кнопкой запуска, фланцованную часть для удерживания смещающего механизма по направлению к первому концу корпуса, и где индикатор сформирован между вторым концом стержня и фланцованной частью.
Изобретение также предоставляет набор для подготовки реципиента к применению автоматического инъекционного устройства, где автоматическое инъекционное устройство включает иглу и лекарственное средство, причем набор включает: (а) демонстрационное автоматическое инъекционное устройство, в котором отсутствует игла и лекарственное средство; и (b) инструкции по использованию автоматического инъекционного устройства.
В одном варианте осуществления, инструкции информируют реципиента о способе использования демонстрационного автоматического инъекционного устройства, причем способ включает: (а) расположение автоматического инъекционного устройства в участке инъекции; (b) включение механизма привода для начала инъекции лекарственного средства; (с) поддержание включения механизма привода в течение предписанного периода времени для продолжения инъекции лекарственного средства; и (d) удаление автоматического инъекционного устройства с участка инъекции после истечения предписанного периода времени.
В одном варианте осуществления, предписанный период времени составляет 10 секунд. В другом варианте осуществления, предписанный период времени составляет, по меньшей мере, 10 секунд.
В другом варианте осуществления, инструкции, кроме того, информируют о том, что первоначальное включение механизма привода сопровождается слышимым звуком. В другом варианте осуществления, инструкции, кроме того, информируют о том, что завершение инъекции лекарственного средства сопровождается видимым индикатором завершения.
В одном варианте осуществления, инструкции, кроме того, информируют о том, что участок инъекции можно стерилизовать перед размещением автоматического инъекционного устройства в участке инъекции.
В одном варианте осуществления, инструкции, кроме того, информируют о том, что автоматическое инъекционное устройство необходимо обследовать для определения соответствующей дозировки и рецептуры лекарственного средства перед размещением автоматического инъекционного устройства в участке инъекции.
В одном варианте осуществления, инструкции, кроме того, передают реципиенту, по меньшей мере, одно сообщение, выбранное из группы, состоящей из сообщений о том, что: (а) использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца; (b) использование автоматического инъекционного устройства пациентами предпочтительнее, по сравнению с предварительно заполненным шприцем; (с) пациенту легче использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц; (d) пациенту удобнее использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц; (е) автоматическое инъекционное устройство уменьшает тревогу пациентов, испытывающих страх перед иголками, по сравнению с предварительно заполненным шприцем, поскольку игла не видна в устройстве; и (f) автоматическое инъекционное устройство сконструировано для легкости использования с первоначального применения устройства.
В одном варианте осуществления, реципиент представляет собой врача, который назначает лекарственное средство. В другом варианте осуществления, реципиент представляет собой пациента, который принимает лекарственное средство. В еще одном варианте осуществления, реципиент представляет собой лицо, которое осуществляет уход, такое как член семьи.
Изобретение также включает демонстрационное автоматическое инъекционное устройство, включающее
корпус, имеющий открытый первый конец, второй конец и имеющий окно, сформированное в его боковой стенке, шприц, подвижно расположенный внутри корпуса; механизм приведения в действие, связанный со шприцем, для сдавливания шприца; и индикатор, который совмещается с окном в боковой стенке, когда шприц полностью сдавлен.
Изобретение, описывает аудиовизуальное устройство для рекламы реципиенту автоматического инъекционного устройства, содержащего лекарственное средство, причем устройство передает реципиенту, по меньшей мере, одно сообщение, выбранное из группы, состоящей из сообщений о том, что: (а) использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца; (b) использование автоматического инъекционного устройства пациентами предпочтительнее, по сравнению с предварительно заполненным шприцем; (с) пациенту легче использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц; (d) пациенту удобнее использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц; (е) автоматическое инъекционное устройство уменьшает тревогу пациентов, испытывающих страх перед иголками, по сравнению с предварительно заполненным шприцем, поскольку игла не видна в устройстве; и (f) автоматическое инъекционное устройство сконструировано для легкости использования с первоначального применения устройства.
Изобретение также включает аудиовизуальное устройство или печатный материал для подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство, причем аудиовизуальное устройство сообщает инструкции: (а) расположить автоматическое инъекционное устройство в участке инъекции; (b) включить механизм приведения в действие для начала инъекции лекарственного средства; (с) поддерживать включение механизма активации в течение предписанного периода времени для продолжения инъекции лекарственного средства; и (d) удалить автоматическое инъекционное устройство из участка инъекции после истечения предписанного периода времени.
Изобретение также включает аудиовизуальное устройство или печатный материал для подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство, причем аудиовизуальное устройство сообщает инструкции: (а) расположить автоматическое инъекционное устройство в участке инъекции; (b) включить механизм приведения в действие для начала инъекции лекарственного средства; (с) поддерживать включение механизма активации в течение предписанного периода времени для продолжения инъекции лекарственного средства до тех пор, пока не будет выявлен видимый индикатор завершения инъекции; и (d) удалить автоматическое инъекционное устройство из участка инъекции, когда выявлен видимый индикатор завершения инъекции.
Изобретение, кроме того, предоставляет способ подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство. В одном варианте осуществления, способ включает сообщение реципиенту инструкций: (а) расположить автоматическое инъекционное устройство в участке инъекции; (b) включить механизм приведения в действие для начала инъекции лекарственного средства; (с) поддерживать включение механизма активации для продолжения инъекции лекарственного средства до тех пор, пока не будет выявлен видимый индикатор завершения инъекции; и (d) удалить автоматическое инъекционное устройство из участка инъекции, когда выявлен видимый индикатор завершения инъекции.
В одном варианте осуществления, автоматическое инъекционное устройство включает индикаторное окно, а видимый индикатор завершения инъекции включает цветной индикатор, например, желтый, появляющийся в индикаторном окне.
В одном варианте осуществления, инструкции, кроме того, сообщают, что первоначальное включение механизма активации сопровождается слышимым звуком.
В одном варианте осуществления, инструкции, кроме того, сообщают, что включение механизма активации поддерживается в течение предписанного периода времени, например, 10 секунд, для продолжения инъекции лекарственного средства. В одном варианте осуществления, инструкции, кроме того, сообщают, что участок инъекции следует стерилизовать перед расположением автоматического инъекционного устройства в участке инъекции.
В одном варианте осуществления, инструкции, кроме того, сообщают, что автоматическое инъекционное устройство нужно обследовать для определения соответствующей дозировки и рецептуры лекарственного средства перед размещением автоматического инъекционного устройства в участке инъекции.
В другом аспекте, изобретение относится к способу подготовки пользователя к использованию автоматического инъекционного устройства, где автоматическое инъекционное устройство включает иглу и лекарственное средство, причем способ включает предоставление пользователю: (а) демонстрационного автоматического инъекционного устройства, не имеющего иглу и лекарственное средство; и (b) инструкции по применению автоматического инъекционного устройства.
В еще одном аспекте, изобретение относится к набору для подготовки реципиента к применению автоматического инъекционного устройства, включающего иглу и лекарственное средство, причем набор включает: (а) демонстрационное или «тренировочное» автоматическое инъекционное устройство, в котором отсутствует игла и лекарственное средство; и (b) инструкции по применению автоматического инъекционного устройства.
В еще одном аспекте, изобретение относится к способу подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство. Способ подготовки включает сообщение реципиенту инструкций: (а) расположить автоматическое инъекционное устройство в участке инъекции; (b) включить механизм приведения в действие для начала инъекции лекарственного средства; (с) поддерживать включение механизма активации в течение предписанного периода времени для продолжения инъекции лекарственного средства; и (d) удалить автоматическое инъекционное устройство из участка инъекции после истечения предписанного периода времени.
Предпочтительные предписанные периоды времени включения механизма активации включают 10 секунд, или включение механизма активации в течение, по меньшей мере, 10 секунд. В определенных вариантах осуществления, инструкции, кроме того, сообщают, что первоначальное включение механизма активации сопровождается слышимым звуком. В определенных вариантах осуществления, инструкции, кроме того, сообщают о том, что завершение инъекции лекарственного средства сопровождается видимым индикатором завершения инъекции. В определенных вариантах осуществления, инструкции, кроме того, информируют о том, что участок инъекции следует стерилизовать перед размещением автоматического инъекционного устройства в участке инъекции. В определенных вариантах осуществления, инструкции, кроме того, информируют о том, что автоматическое инъекционное устройство необходимо обследовать для определения соответствующей дозировки и рецептуры лекарственного средства перед размещением автоматического инъекционного устройства в участке инъекции.
В другом аспекте, изобретение относится к способу подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство. Способ подготовки включает сообщение реципиенту инструкций: (а) расположить автоматическое инъекционное устройство в участке инъекции; (b) включить механизм приведения в действие для начала инъекции лекарственного средства; (с) поддерживать включение механизма активации для продолжения инъекции лекарственного средства до тех пор, пока не будет выявлен видимый индикатор завершения инъекции; и (d) удалить автоматическое инъекционное устройство из участка инъекции, когда выявлен видимый индикатор завершения инъекции.
В предпочтительном варианте осуществления, автоматическое инъекционное устройство включает индикаторное окно, а видимый индикатор завершения инъекции включает цветной индикатор, появляющийся в индикаторном окне. Цветной индикатор может представлять собой, например, индикатор желтого цвета.
В одном варианте осуществления, инструкции представлены в печатном документе или в аудиовизуальном устройстве. В другом варианте осуществления, аудиовизуальное устройство представляет собой кассету системы домашнего видео (VHS) или цифровой видеодиск (DVD). В одном варианте осуществления, инструкции сообщаются реципиенту устно.
В одном варианте осуществления, реципиент представляет собой врача, который назначает лекарственное средство. В одном варианте осуществления, реципиент представляет собой пациента, который принимает лекарственное средство.
Изобретение также включает изготовленное изделие, включающее упаковочный материал; ингибитор TNFα, такой как адалимумаб; и этикетку или упаковочный вкладыш, содержащийся внутри упаковочного материала, указывающий на то, что в исследованиях ингибитора TNFα с использованием автоматического инъекционного устройства по изобретению для лечения расстройства, при котором ингибитор TNFα оказывает повреждающее воздействие, такого как ревматоидный артрит, самыми часто встречающимися побочными явлениями (АЕ) были бронхит, гиперчувствительность, артритическая боль, кашель и ринит.
Изобретение, кроме того, предоставляет изготовленное изделие, включающее: упаковочный материал; автоматическое инъекционное устройство, например, автоинъектор в виде ручки, заполненное ингибитором TNFα; и этикетку или вкладыш упаковки, содержащийся внутри упаковочного материала, указывающие, что биоэквивалентность ингибитора TNFα одинакова независимо от того, является ли участок инъекции бедро или живот.
Изготовленное изделие по изобретению может включать этикетку. В одном варианте осуществления, этикетка по изобретению указывает на то, как ингибитор TNFα, например, антитело против ингибитора TNF, или его связывающая антиген часть, упаковано в виде изготовленного изделия. В одном варианте осуществления, этикетка по изобретению указывает ингибитор TNFα, например, антитело против ингибитора TNF, или его связывающая антиген часть, отпускается в картонной коробке, содержащей 6 спиртовых тампонов для подготовки участка кожи для инъекции и 6 дозовых лотков (например, маркированной «Первоначальная упаковка для лечения болезни Крона»). В другом варианте осуществления, этикетка указывает на то, что каждый дозовый лоток состоит из одноразовой ручки, причем каждая ручка содержит предварительно заполненный стеклянный шприц емкостью 1 мл с фиксированной иглой 27 калибра длиной  дюйма, что обеспечивает введение 40 мг (0,8 мл) ингибитора TNFα.
дюйма, что обеспечивает введение 40 мг (0,8 мл) ингибитора TNFα.
Настоящее изобретение относится к автоматическим инъекционным устройствам для введения лекарственных средств и, в частности, относится к композициям и способам содействия применению таких средств и к композициям и способам для подготовки пользователей (например, пациентов и медицинского персонала) к использованию таких устройств. Изобретение основано, по меньшей мере, частично, на результатах клинического исследования, сравнивающего автоматическое инъекционное устройство для введения адалимумаба (HUMIRA®) с предварительно заполненным шприцем для введения адалимумаба (HUMIRA®). Исследование выявило многочисленные преимущественные признаки автоматического инъекционного устройства и идентифицировало определенные аспекты применения устройства, которые следует осветить при подготовке индивидуума к использованию устройства.
Соответственно, в одном аспекте, изобретение относится к способу привлечения реципиента к использованию автоматического инъекционного устройства, включающего лекарственное средство. Способ включает передачу реципиенту, по меньшей мере, одного сообщения, выбранного из группы, состоящей из сообщений о том, что:
(а) использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца; (b) использование автоматического инъекционного устройства пациентами предпочтительнее, по сравнению с предварительно заполненным шприцем; (с) пациенту легче использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц; (d) пациенту удобнее использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц; (е) автоматическое инъекционное устройство уменьшает тревогу пациентов, испытывающих страх перед иголками, по сравнению с предварительно заполненным шприцем, поскольку игла не видна в устройстве; и (f) автоматическое инъекционное устройство сконструировано для легкости использования с первоначального применения устройства.
В предпочтительном варианте осуществления, реципиенту передается сообщение о том, что использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца, например, что 80% пациентов при клиническом испытании оценили автоматическое инъекционное устройство как менее болезненное, чем предварительно заполненный шприц. В другом предпочтительном варианте осуществления, реципиенту передается сообщение о том, что использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца, например, что 90% пациентов при клиническом испытании оценили автоматическое инъекционное устройство как менее болезненное, чем предварительно заполненный шприц.
В определенном варианте осуществления, реципиенту передается сообщение о том, что автоматическое инъекционное устройство содержит иглу с пятью фасками, по сравнению с иглой с тремя фасками для предварительно заполненного шприца.
В другом аспекте, изобретение относится к аудиовизуальному устройству для привлечения реципиента к использованию автоматического инъекционного устройства, включающего лекарственное средство, причем устройство передает пользователю, по меньшей мере, одно представленное выше сообщение. В способах и композициях по изобретению, привлекающие сообщения или инструкции по подготовке могут передаваться реципиенту, например, устно и/или в письменном виде. Альтернативно или в дополнение, аудиовизуальное устройство представляет собой кассету системы домашнего видео (VHS) или цифровой видеодиск (DVD).
В способах по изобретению, реципиент привлекающего сообщения или подготовительных инструкций может представлять собой, например, врача, который назначает лекарственное средство, пациента, который принимает лекарственное средство, или лицо, которое осуществляет уход за пациентом.
В способах и композициях по изобретению, автоматическое инъекционное устройство предпочтительно обеспечивает подкожную инъекцию лекарственного средства. Предпочтительные варианты осуществления автоматического инъекционного устройства описаны в настоящем документе.
Автоматическое инъекционное устройство, используемое в способах и композициях по изобретению, может включать вещество или лекарственное средство, которое представляет собой, например, антитело, цитокин, вакцину, гибридный белок или ростовой фактор. В предпочтительном варианте осуществления, лекарственное средство представляет собой ингибитор TNFα (например, антитело против TNF или его связывающую антиген часть, гибридный белок TNF или рекомбинантный белок, связывающий TNF), такой как инфликсимаб (Remicade™, Centocor, Horsham, PA) , CDP 571, CDP 870, анти-TNF dAb, голимумаб, адалимумаб, этанерцепт (Enbrel™, Amgen, California), p55TNFRIgG (ленерцепт) или r-ТВР-1. Особенно предпочтительным лекарственным средством для применения в автоматическом инъекционном устройстве является адалимумаб (HUMIRA®). Другое особенно предпочтительное лекарственное средство для применения в автоматическом инъекционном устройстве представляет собой изолированное человеческое антитело, которое диссоциируется из человеческого TNFα при Кd 1×10-8 М или менее и константе скорости Koff 1×10-3 с-1 или менее, обеих определенных поверхностным резонансом плазмона, и нейтрализует цитотоксичность человеческого TNFα в стандартном анализе L929 in vitro при IC50 1×10-7 M или менее. В одном варианте осуществления, автоматическое инъекционное устройство, включая его виды применения и композиции, включает дозу ингибитора TNFα.
В одном варианте осуществления, анти-TNFα антитело или его связывающая антиген часть выбраны из группы, состоящей из химерного антитела, гуманизированного антитела, человеческого антитела и мультивалентного антитела.
В одном варианте осуществления, анти-TNFα антитело представляет собой изолированное человеческое антитело или его связывающую антиген часть со следующими характеристиками: а) диссоциируется из человеческого TNFα при константе скорости Koff 1×10-3 с-1 или менее, по данным определения поверхностным резонансом плазмона; b) имеет домен CDR3 легкой цепи, включающий аминокислотную последовательность SEQ ID NO:3, или модифицирован из SEQ ID NO:3 замещением одного аланина в положении 1, 4, 5, 7 или 8 или от одного до пяти консервативными аминокислотными замещениями в положениях 1, 3, 4, 6, 7, 8 и/или 9; и с) имеет домен CDR3 тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO:4, или модифицирован из SEQ ID NO:4 замещением одного аланина в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или от одного до пяти консервативными аминокислотными замещениями в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
В одном варианте осуществления, анти-TNFα антитело представляет собой изолированное человеческое антитело или его связывающую антиген часть, причем вариабельная область легкой цепи (LCVR) включает аминокислотную последовательность SEQ ID NO:1, а вариабельная область тяжелой цепи (HCVR) включает аминокислотную последовательность SEQ ID NO:2.
В одном варианте осуществления, анти-TNFα антитело или его связывающая антиген часть выбраны из группы, состоящей из инфликсимаба, голимумаба и адалимумаба.
В одном варианте осуществления, ингибитор TNFα выбран из группы, состоящей из инфликсимаба, CDP 571, CDP 870, анти-TNF dAb, голимумаба, адалимумаба, этанерцепта, p55TNFRIgG и r-ТВР-1.
В одном варианте осуществления, вещество, которое загружается в автоматическое инъекционное устройство, представляет собой рецептуру, включающую адалимумаб, хлорид натрия, одноосновный дигидрофосфат натрия, двухосновный дигидрофосфат натрия, цитрат натрия, моногидрат лимонной кислоты, маннит, полисорбат 80 и воду.
В одном варианте осуществления, автоматическое инъекционное устройство используется для доставки пользователю анти-TNFα антитела или его связывающей антиген части, причем введение производится по схеме введения 2 раза/день или по схеме введения множества вариабельных доз.
Краткое описание чертежей
Предыдущие и другие объекты, признаки и преимущества настоящего изобретения, а также само изобретение, будет полнее понятно из следующего описания предпочтительных вариантов осуществления при его прочтении вместе с сопровождающими чертежами.
Фиг.1 представляет собой вид в перспективе автоматического инъекционного устройства в соответствии с иллюстративным вариантом осуществления изобретения.
Фиг.2 представляет собой вид с пространственным разделением деталей автоматического инъекционного устройства в соответствии с иллюстративным вариантом осуществления изобретения.
Фиг.3 представляет собой схематический вид в разрезе автоматического инъекционного устройства одного варианта осуществления изобретения перед применением.
Фиг.4 представляет собой схематический вид в разрезе автоматического инъекционного устройства фиг.3 во время последующей стадии работы.
Фиг.5 представляет собой схематический вид в разрезе автоматического инъекционного устройства фиг.3 во время конечной стадии работы.
Фиг.6 иллюстрирует вариант осуществления автоматического инъекционного устройства в соответствии с одним вариантом осуществления изобретения.
Фиг.7 представляет собой вид с пространственным разделением деталей устройства пускового механизма автоматического инъекционного устройства фиг.6 в соответствии с иллюстративным вариантом осуществления изобретения.
Фиг.8А-8С представляют собой различные виды, иллюстрирующие дистальный компонент корпуса, цилиндрическую пружину и компонент запуска шприца устройства пускового механизма фиг.7 при сборке без кнопки запуска.
Фиг.9 представляет собой вид в перспективе дистального компонента корпуса устройства пускового механизма фиг.7.
Фиг.10 представляет собой вид в перспективе компонента приведения шприца в действие механизма устройства пускового механизма фиг.7.
Фиг.11 представляет собой вид с пространственным разделением деталей комплекта корпуса шприца автоматического инъекционного устройства фиг.6 в соответствии с иллюстративным вариантом осуществления изобретения.
Фиг.12 иллюстрирует вариант осуществления держателя шприца комплекта корпуса шприца фиг.11.
Фиг.13 иллюстрирует вариант осуществления кожуха с уступами комплекта корпуса шприца фиг.11.
Фиг.14 иллюстрирует вариант осуществления проксимального колпачка комплекта корпуса шприца фиг.11.
Фиг.15а и 15b представляют собой соответственно вид сбоку в перспективе и вид сбоку в разрезе собранного комплекта кожуха пружины фиг.11 в соответствии с одним вариантом осуществления изобретения.
Фиг.16a и 16b представляют собой виды в разрезе под углами смещения 90 градусов друг от друга, иллюстрирующие автоматическое инъекционное устройство в сборе, где комплект корпуса шприца и устройство пускового механизма соединены вместе.
Фиг.17 представляет собой детальный вид границы раздела между комплектом корпуса шприца и устройством пускового механизма автоматического инъекционного устройства одного варианта осуществления изобретения, иллюстрирующий индикатор компонента приведения в действие шприца в соответствии с одним вариантом осуществления изобретения.
Фиг.18-22 представляют собой вид в разрезе автоматического инъекционного устройства в соответствии с другим вариантом осуществления изобретения.
Фиг.23 представляет собой детальный вид окна дисплея автоматического инъекционного устройства в соответствии с одним вариантом осуществления изобретения.
Фиг.24 иллюстрирует использование автоматического инъекционного устройства иллюстративного варианта осуществления изобретения для инъекции препарата, такого как ингибитор TNF, в подкожную область пользователя.
Фиг.25 иллюстрирует схему автоинъекционной ручки для самостоятельного введения адалимумаба.
На фиг.26 показаны результаты конечного анализа предпочтений пациентов после третьего посещения.
На фиг.27 иллюстрируются результаты, показывающие вероятность переключения на ручку, и вероятность рекомендации использования ручки другим.
Детальное описание изобретения
Настоящее изобретение представляет автоматические инъекционные устройства, их компоненты и способы инъекции пациенту вещества, такого как жидкое лекарственное средство, для оказания помощи или излечения медицинского состояния. В одном варианте осуществления, автоматическое инъекционное устройство представляет собой ручку, т.е., ручку-автоинъектор или ручку для автоинъекции (взаимозаменяемо используемые в настоящем документе). Настоящее изобретение также представляет демонстрационное или «тренировочное» автоматическое инъекционное устройство, которое можно использовать для обучения пациента использованию автоматического инъекционного устройства.
Настоящее изобретение также относится к автоматическим инъекционным устройствам для введения веществ (также именуемых в настоящем документе лекарственными средствами) и, в частности, относится к композициям и способам привлечения к использованию таких устройств и к композициям и способам подготовки людей к использованию таких устройств. Изобретение, по меньшей мере частично, основано на результатах клинического исследования, сравнивающего автоматическое инъекционное устройство для введения адалимумаба (HUMIRA®) с предварительно заполненным шприцем для введения адалимумаба (HUMIRA®). Исследование, детально описанное в настоящем документе в примерах 1 и 2, выявило многочисленные преимущественные признаки автоматического инъекционного устройства по изобретению и идентифицировало определенные аспекты способов применения устройства, которые следует осветить при подготовке реципиентов к использованию устройства.
I. Определения
С тем, чтобы можно было легче понять изобретение, ниже определены некоторые термины.
Используемый в настоящем документе термин «автоматическое инъекционное устройство» (или «автоинъектор») предназначен для обозначения устройства, которое позволяет индивидууму (также именуемому в настоящем документе пользователем или пациентом) самостоятельно ввести дозировку вещества, такого как жидкий лекарственный препарат, причем устройство отличается от стандартного шприца включением механизма автоматической подачи лекарственного средства индивидууму инъекцией при включении механизма.
Используемый в настоящем документе термин «предварительно заполненный шприц» предназначен для обозначения шприца, который заполняется лекарственным средством непосредственно перед введением лекарственного средства индивидууму, и шприца, который заполняется лекарственным средством и хранится в этом предварительно заполненном виде в течение некоторого периода времени перед введением лекарственного средства индивидууму.
Используемый в настоящем документе термин «реципиент» предназначен для обозначения любого лица или индивидуума, который получает сообщения, привлекающие к использованию устройства по изобретению, или инструкции по подготовке к использованию способов и композиций по изобретению, описанному в настоящем документе. Предпочтительные реципиенты включают врачей, которые назначают лекарственное средство для введения автоматическим инъекционным устройством, и пациентов, которые применяют лекарственное средство, предназначенное для введения автоматическим инъекционным устройством, и лиц, осуществляющих уход за ними.
Используемый в настоящем документе термин «передача реципиенту» предназначен для обозначения любого средства, которым сообщение, привлекающее к использованию устройства по изобретению, или инструкция по подготовке к использованию способов и композиций по изобретению, описанному в настоящем документе, передается или выражается реципиенту. Не ограничивающие примеры средств передачи сообщения или инструкции реципиенту включают устное сообщение, письменное сообщение и сообщение через аудиовизуальное устройство.
Используемый в настоящем документе термин «первоначальное применение автоматического инъекционного устройства» предназначен для обозначения первого эпизода применения автоматического инъекционного устройства для введения вещества, например, лекарственного средства, индивидууму.
Используемый в настоящем документе термин «печатный документ» предназначен для обозначения любого документа, который содержит напечатанное письменное сообщение. Не ограничивающие примеры печатных документов включают брошюры, листовки, вкладыши изделий, афиши, магнитно-маркерные доски, настольные информационные таблички и упаковочные этикетки.
Используемый в настоящем документе термин «аудиовизуальное устройство» предназначен для обозначения любого устройства, которое способно сообщить информацию в слышимой или видимой форме. Не ограничивающие примеры аудиовизуальных устройств включают кассеты системы домашнего видео (VHS), цифровые видеодиски (DVD), CD-ROMS (компактные диски, содержащие данные, доступные для компьютера), цифровые видеокассеты, пленки 8 мм или 35 мм и компьютеры, представляющие на дисплее файлы Интернета.
Используемый в настоящем документе термин «демонстрационное автоматическое инъекционное устройство» или «устройство для подготовки» или «подготовитель» предназначен для обозначения автоматического инъекционного устройства, которое используется для демонстрации процедуры по использованию автоматического инъекционного устройства, включая осмотр и ощущения от использования устройства, но которое не подходит для введения вещества, например, лекарственного средства, потому что в нем отсутствует один или несколько необходимых компонентов для введения вещества, например, лекарственного средства и/или иглы. В предпочтительном варианте осуществления, в демонстрационном автоматическом инъекционном устройстве отсутствует игла и вещество, например, лекарственное средство, по сравнению с автоматическим инъекционным устройством.
II. Автоматическое инъекционное устройство
Ниже изобретение будет описано относительно определенных иллюстративных вариантов осуществления. Хотя настоящее изобретение описано в отношении применения устройства для обеспечения подкожной инъекции дозы ингибитора TNF, специалисту в данной области будет понятно, что изобретение не ограничивается иллюстративным вариантом осуществления, и что инъекционное устройство можно использовать для инъекции любого подходящего вещества пользователю. Кроме того, компоненты и способ применения автоматического инъекционного устройства не ограничиваются описанными ниже иллюстративными вариантами осуществления.
Используемый в настоящем документе термин «дистальный» относится к части или концу автоматического инъекционного устройства или компоненту в автоматическом инъекционном устройстве, самому отдаленному от участка инъекции, когда устройство прижато к коже индивидуума для инъекции, или для имитации инъекции. Термин «проксимальный» относится к части или концу автоматического инъекционного устройства или компоненту в автоматическом инъекционном устройстве, самому близкому к участку инъекции на теле пользователя во время инъекции.
Фиг.1 и 2 поверхностно иллюстрируют автоматическое инъекционное устройство 10, подходящее для подкожной инъекции пациенту дозы вещества, такого как жидкий препарат, в соответствии с иллюстративным вариантом осуществления изобретения. Автоматическое инъекционное устройство 10 включает корпус 12 для помещения контейнера, такого как шприц, содержащего дозу вещества, подлежащую инъекции пациенту, как детально описано ниже. Корпус 12 предпочтительно имеет трубчатую конфигурацию, хотя специалисту в данной области будет понятно, что корпус 12 может иметь любой подходящий размер, форму и конфигурацию для помещения шприца или другого контейнера подлежащего инъекции вещества. Хотя изобретение будет описано в отношении шприца, установленного в корпусе 12, специалисту в данной области будет понятно, что в автоматическом инъекционном устройстве 10 может использоваться любой подходящий контейнер для хранения и подачи вещества.
На фиг.2, шприц предпочтительно с возможностью скольжения установлен в корпусе 12, как детально описано ниже. В неактивированном положении, шприц окружен оболочкой и отведен назад внутри корпуса 12. При приведении устройства в действие игла шприца выступает из первого (проксимального) конца 20 корпуса 12 для обеспечения возможности выталкивания вещества из шприца в тело пациента. Как показано, первый конец 20 корпуса 12, т.е., проксимальный конец, включает отверстие 28, через которое игла шприца выступает во время приведения в действие устройства 10.
На фиг.1 и 2, второй (дистальный) конец 30 корпуса 12, т.е., дистальный конец, включает кнопку запуска 32 для приведения в действие шприца с перемещением из заключенного в оболочку положения внутри корпуса 12 в выступающее положение, и для последующего выталкивания вещества из иглы в тело пациента. Корпус 12 содержит один или несколько приводов, которые выполняют функции перемещения шприца и выталкивания вещества из шприца.
Иллюстративное автоматическое инъекционное устройство 10, показанное на фиг.1 и 2, может также включать первый съемный колпачок 24 (или игольный колпачок) для покрытия первого конца 20 корпуса 12 для предотвращения обнажения иглы в шприце перед использованием. В иллюстративном варианте осуществления, первый колпачок 24 может включать распорку 26 для замыкания и/или покрытия внутренних компонентов устройства 10 до готовности пользователя к пуску устройства 10. Альтернативно, первый колпачок 24 может включать резьбовую винтовую часть, а внутренняя поверхность корпуса 12 у отверстия 28 может включать винтовую резьбу. В соответствии с положениями изобретения, можно использовать любой .соединительный механизм.
Второй съемный колпачок 34 (или колпачок пускателя) может покрывать второй конец 30 корпуса 12 для предотвращения случайного нажатия кнопки запуска 32.
Второй колпачок 34 может иметь отличительный цвет для дифференцировки первого конца 20 и второго конца 30 устройства, хотя специалисту в данной области будет понятно, что колпачок 34 и корпус 12 могут иметь любой подходящий цвет, размер и конфигурацию.
В иллюстративном варианте осуществления фиг.1 и 2, корпус 12 и колпачки 24 и 34 могут, кроме того, включать графические изображения, символы и/или цифры для облегчения использования автоматического инъекционного устройства 10. Например, в иллюстративном варианте осуществления, корпус 12 включает стрелку 125 на наружной поверхности, указывающую в сторону первого конца 20 устройства, для индикации того, как устройство 10 следует удерживать относительно поверхности кожи пациента (т.е., с прижатием первого конца к участку инъекции), как показано на фиг.2. Кроме того, первый колпачок 24 маркирован цифрой «1» для указания того, что пользователю следует сначала удалить первый колпачок 24 устройства, а второй колпачок маркирован цифрой «2» для указания того, что второй колпачок 34 должен быть удален после удаления первого колпачка 24 во время подготовки к последующей инъекции с использованием иллюстративного автоматического инъекционного устройства 10. Специалисту в данной области будет понятно, что автоматическое инъекционное устройство 10 может иметь любые подходящие графические изображения, символы и/или цифры для содействия инструктажу пользователя, или автоматическое инъекционное устройство может не быть снабжено такими графическими изображениями, символами и/или цифрами.
Как показано на фиг.2, первый конец 20 корпуса 12 может иметь больший диаметр, чем второй конец 30. Выступ 29 может быть образован в месте перехода между двумя диаметрами для упора колпачка 34 для содействия посадки второго колпачка 34 на второй конец 30 корпуса.
Как проиллюстрировано на фиг.1 и 2, корпус 12 также предпочтительно включает окно дисплея 130 для обеспечения возможности пользователю видеть содержимое шприца, содержащегося внутри корпуса 12, как детально описано ниже. Окно 130 может включать отверстие в боковой стенке корпуса 12 или может включать прозрачный материал в корпусе 12 для обеспечения возможности визуализации внутренней полости устройства 10.
Корпус 12 может быть изготовлен из любого подходящего хирургического материала, включая без ограничения пластик и другие известные материалы.
Фиг.3-5 представляют собой схематический вид внутренних компонентов автоматического инъекционного устройства 10 в соответствии с одним вариантом осуществления изобретения. Как показано, шприц 50 или другой подходящий контейнер для вещества расположен в пределах внутренней полости корпуса 12. Иллюстративный шприц 50 включает полую гильзовую часть 53 для помещения дозы подлежащего инъекции жидкого вещества. Иллюстративная гильзовая часть 53 имеет по существу цилиндрическую форму, хотя специалисту в данной области будет понятно, что гильзовая часть 53 может иметь любую подходящую форму или конфигурацию. Уплотнитель, иллюстрируемый в виде пробки 54, герметизирует дозу внутри гильзовой части 53. Шприц 50 может, кроме того, включать соединенную с гильзовой частью 53 и сообщающуюся с ней через жидкость полую иглу 55, через которую доза может выталкиваться подачей давления на пробку 54. Полая игла 55 выступает из первого, проксимального конца 53а гильзовой части 53. Второй конец 53b гильзовой части 53 включает фланец 56 или другой подходящий механизм для упора стопора, схематически представленного элементом под цифрой 123, в корпусе 12 для ограничения движения шприца 50 внутри корпуса 12, как описано ниже. Специалисту в данной области будет понятно, что изобретение не ограничивается иллюстративным вариантом осуществления шприца 50, и что любой подходящий контейнер для помещения дозы подлежащего инъекции вещества можно использовать в соответствии с положениями изобретения. В иллюстративном варианте осуществления, показанном на фиг.3-5, игла 55 представляет собой фиксированную иглу двадцать седьмого калибра длиной полдюйма. Кончик иллюстративной полой иглы 55 может включать пять фасок для содействия введению. Однако игла 55 может иметь любой подходящий размер, форму и конфигурацию, подходящие для прокола кожи пользователя для доставки вещества в подкожную область и не ограничивается иллюстративным вариантом осуществления. Подходящие типы игл хорошо известны в данной области.
Автоматическое инъекционное устройство 10, показанное на фиг.3-5, кроме того, включает привод шприца 70, проиллюстрированный в виде плунжера, для селективного перемещения и приведения в действие шприца 50 для инъекции дозы, содержащейся в шприце 50, в тело пользователя. Иллюстративный плунжер 70 включает стержневую часть 71, имеющую первый конец 71a, являющийся неотъемлемой частью, соединенный или сообщающийся через жидкость с пробкой 54 для селективной подачи давления на пробку 54 для вытеснения дозы из иглы 55. Плунжер 70 может включать снабженный фланцем второй конец 72.
В одном варианте осуществления, привод шприца включает множественные компоненты и/или большее количество приводов присутствует в автоматическом инъекционном устройстве по изобретению.
Плунжер 70 на фиг.3-5 смещен вперед по направлению к первому концу 20 устройства 10 первым смещающим механизмом, иллюстрируемым в виде цилиндрической пружины 88, расположенной около или над имеющим фланец вторым концом плунжера 70. В варианте осуществления, иллюстрируемом на фиг.3-5, проксимальный конец 88а цилиндрической пружины 88 упирается в имеющий фланец второй конец 72 плунжера 70 для селективной подачи давления и проксимального перемещения плунжера 70. Альтернативно, плунжер 70 простирается через центр пружины 88. Перед использованием устройства 10, цилиндрическая пружина 88 (или другой подходящий механизм) сжимается между плунжером 70 и корпусом 12, сохраняя энергию. Пусковой механизм 91, который активируется любым подходящим средством запуска, таким как кнопка запуска 32, показанная на фиг.1 и 2, удерживает плунжер 70 и первый смещающий механизм 88 в отведенном назад, фиксированном положении, показанном на фиг.3, кнопка запуска 32 нажата. В иллюстративном варианте осуществления, пусковой механизм 91 фиксирует имеющий фланец второй конец 72 плунжера 70. Когда пользователь нажимает кнопку 32 или активирует другое средство запуска, пусковой механизм 91 освобождает имеющий фланец второй конец 72 плунжера 70, позволяя цилиндрической пружине 88, которая подает давление на имеющий фланец второй конец 72, протолкнуть плунжер 70 по направлению к первому концу устройства 10.
Второй смещающий механизм, иллюстрируемый в виде цилиндрической пружины 89 на фиг.3-5, удерживает шприц 50 в отведенном назад положении внутри корпуса 12 перед использованием, как показано на фиг.1 и 3. В отведенном назад положении, игла 55 предпочтительно полностью окружена оболочкой внутри корпуса 12. Цилиндрическая пружина 89 иллюстративного шприца расположена около проксимальной части гильзовой части 53 и может быть посажена на выступ 121, образованный в пределах внутренней поверхности корпуса. Верхний конец цилиндрической пружины 89 упирается в имеющий фланец второй конец 56 шприца 50. Сила упругости второго смещающего механизма 89 отталкивает имеющий фланец второй конец 56 шприца 50 от первого конца 20 корпуса 12, посредством этого удерживая шприц 50 в отведенном назад положении до приведения в действие. Другие компоненты устройства 10 могут также располагать шприц 50 относительно корпуса 12.
Первый смещающий механизм 88 и второй смещающий механизм 89 могут иметь любую подходящую конфигурацию и растягивающее напряжение, подходящие для использования при смещении определенных компонентов устройства. Например, первый смещающий механизм 88 имеет любой подходящий размер, форму, энергию и свойства, подходящие для перемещения плунжера 70 и шприца 50 вперед при освобождении. Второй смещающий механизм 89 имеет любой подходящий размер, форму, энергию и свойства, подходящие для отведения назад шприца 50 перед приведением в действие. Можно также использовать другие подходящие средства для содействия перемещению и выталкиванию из шприца.
В иллюстративном варианте осуществления, показанном на фиг.3-5, плунжер 70, кроме того, включает сжимаемую расширенную центральную часть 76. В иллюстративном варианте осуществления, стержень 71 расщеплен в центральной части для образования пары выступающих колен 78, которые ограничивают сжимаемую расширенную центральную часть 76. Выступающие колена 78 могут быть предварительно образованы в виде части формованного плунжера 70 или могут быть отдельно прикреплены к плунжеру 70. Выступающие колена 78 являются сжимаемыми с тем, чтобы они могли перемещаться радиально внутрь для того, чтобы эта часть стержня приобрела окружность, аналогичную окружности остального стержня. Сжимаемая расширенная центральная часть 76 облегчает перемещение шприца 50, за которым следует выталкивание дозы в две по существу отдельные стадии, как описано ниже.
Как показано на фиг.4, когда средство привода 320 приводит в действие пусковое устройство 91 для освобождения плунжера 70, сила упругости цилиндрической пружины 88 проталкивает плунжер 70 вперед (проксимально). Во время первой рабочей стадии, движущийся плунжер 70 толкает шприц 50 вперед так, что кончик иглы 55 выступает из первого конца 20 корпуса 12. Первая смещающая сила, обеспечиваемая первой цилиндрической пружиной 88, достаточна для преодоления смещающей силы второй цилиндрической пружины 89 для обеспечения возможности движения шприца 50 против направленной назад сдвигающей силы второй цилиндрической пружины 89. На первой рабочей стадии, расширенная область 76 плунжера 70, образованная выступающими коленами 78, упирается во второй конец 56 гильзовой части 53, предотвращая перемещение плунжера 70 внутри гильзовой части 53 шприца. Таким образом, вся сдвигающая сила от первой цилиндрической пружины 88 подается для перемещения шприца 50 вперед по направлению к первому концу 20 устройства 10.
Средство привода 320, иллюстрируемое на фиг.3-5, может иметь любой подходящий размер, форму, конфигурацию и локализацию, подходящие для высвобождения плунжера 70, или иного приведения в действие устройства 10. Например, на той же фиг.2, средство привода 320 может представлять собой кнопку запуска 32, образованную на дистальном конце 30 корпуса 12, или может включать другое подходящее устройство, такое как защелка, включатель, приводимый в действие закручиванием, и другие устройства, известные в данной области. Хотя иллюстративное средство привода 320 расположено по направлению к дистальному концу 30 устройства 10, специалисту в данной области будет понятно, что средство привода 320 может быть расположено в любом подходящем участке на устройстве 10.
Перемещение вперед шприца 50 по направлению к проксимальному концу 20 устройства 10 продолжается против смещающей силы цилиндрической пружины 89 до тех пор пока имеющий фланец второй конец 56 гильзовой части 53 не упрется в стопор 123, такой как выступ фланца на корпусе 12, как показано на фиг.4. Специалисту в данной области будет понятно, что можно использовать альтернативные стопорные или ограничивающие механизмы, и что изобретение не ограничивается иллюстративным стопорным механизмом.
Как показано на фиг.4, на первой функциональной стадии кончик иглы 55 приводится в движение через отверстие 28 на первом конце 20 устройства 10 с тем, чтобы игла 55 могла проколоть кожу пациента. В течение этой стадии, гильзовая часть 53 шприца предпочтительно остается герметично закрытой без выталкивания вещества через иглу 55. Противодействие, оказываемое стопорными механизмами 56, 123, удерживает в выбранном положении иглу 55, выступающую из проксимального открытого конца 28 устройства 10 на последующих этапах. До тех пор пока механизмы 56, 123 не остановят движение шприца 50, сжимаемая расширенная центральная часть 76 плунжера 70 предотвращает движение плунжера 70 относительно гильзовой части 53.
Стопоры 56, 123 могут быть расположены в любом подходящем участке относительно открытого первого конца 20 для того, чтобы обеспечить шприцу 50 возможность обеспечить проникновение иглы в кожу на любую нужную глубину, подходящую для инъекции.
На второй рабочей стадии, которая начинается после защелкивания имеющей фланец части 56 стопорным механизмом 123 или другим стопорным механизмом корпуса 12, останавливающего дальнейшее движение гильзовой части 53, продолжающееся действие смещающей силы цилиндрической пружины 88 продолжает толкать плунжер 70 относительно корпуса 12, как показано на фиг.5.
Смещающая сила вызывает радиальное сжатие внутрь колен 78 плунжера 70 и его скольжение вовнутрь гильзовой части 53. Хотя взаимодействие между компонентами 123 и 56 удерживает гильзовую часть 53 в выбранном положении (при выступающей игле) и с коленами 78 в спавшемся состоянии, цилиндрическая пружина 88 толкает плунжер 70 внутри гильзовой части. После того как плунжер 70 преодолевает необходимую силу для обеспечения возможности сжатия и вхождение колен 78 в гильзовую часть 53, плунжер 70 оказывает давление на пробку 54, вызывая выталкивание содержимого шприца 50 через выступающую иглу 55. Ввиду того, что на первой рабочей стадии произошло смещение иглы 55 в кожу, содержимое гильзовой части 53 инъецируется непосредственно в подкожную область пациента.
На фиг.6, в одном варианте осуществления изобретения, автоматическое инъекционное устройство 10 может включать 2 блокировочных компонента: корпус шприца в сборе 121, содержащий проксимальные компоненты устройства 10 (например, гильзу 53 шприца, цилиндрическую пружину 89, иглу 55 и другие проксимальные компоненты) и комплект механизма запуска 122, содержащий дистальные компоненты устройства (например, средство для приведения в действие шприца). Корпус шприца в сборе 121 и комплект механизма запуска 122 могут быть соединены любым подходящим средством. В иллюстративном варианте осуществления, проксимальный конец 122а комплекта механизма запуска 122 может иметь размер и конфигурацию, приспособленные для вставления в дистальный конец 121b корпуса шприца в сборе 121. Кроме того, одно или более ушек 127 (детально показанные на фиг.7, 8А-8С и 9) на проксимальном конце 122а комплекта механизма запуска 122, могут защелкиваться в соответствующие отверстия 126 на дистальном конце 121b комплекта механизма запуска 122 для обеспечения совмещения и соединения двух устройств в сборе 121, 122, и заключенных в них компонентов.
Фиг.7 представляет собой вид с пространственным разделением деталей комплекта механизма запуска 122 в соответствии с иллюстративным вариантом осуществления изобретения. Как показано, комплект механизма запуска 122 включает иллюстративную кнопку запуска 32, иллюстративный колпачок 34 привода, иллюстративный дистальный корпусной компонент 12b (пусковой корпус) и цилиндрическую пружину 88 или другой смещающий механизм. Иллюстративный комплект механизма запуска 122, кроме того, включает привод шприца, иллюстрируемый в виде компонента 700 приведения в действие шприца, который простирается от проксимального конца 122а дистального корпусного компонента 12b для перемещения шприца 50 на первой стадии и приведения шприца 50 в действие для выталкивания его содержимого на второй фазе.
Фиг.8А-8С иллюстрируют дистальный корпусной компонент 12b, цилиндрическую пружину 88 и компонент привода шприца 700 при сборке без кнопки запуска 32. Фиг.9 представляет собой вид в перспективе дистального корпусного компонента 12b, а фиг.10 представляет собой вид в перспективе компонента привода 700 шприца в соответствии с иллюстративным вариантом осуществления изобретения.
Как показано на фиг.1-2 и 7-9, дистальный корпусной компонент 12b включает по существу трубчатый корпус, который может включать контуры 128 для облегчения захвата устройства 10 пользователем. Выступ 29 может быть образован в дистальной области 30 для содействия посадке колпачка 34 привода, как описано выше. Спереди от выступа 29, дистальный корпусной компонент 12b имеет размер и форму, сконфигурированные для вставления в дистальный конец корпуса шприца 121. Ушки 127 образованы для содействия соединению и/или фиксации вместе двух компонентов корпуса, 12а и 12b. Как показано на фиг. 9, ушки 127 могут быть образованы в выемке 127а на поверхности проксимального конца дистального корпусного компонента 12b и могут также или альтернативно включать ребра 127b для направления ушек в замыкающее положение относительно проксимального корпусного компонента 12а. Специалисту в данной области будет понятно, что можно использовать любое подходящее средство для соединения вместе двух компонентов в сборе, и что изобретение не ограничивается иллюстративным соединительным средством.
Как показано на фиг.2 и 8С, дистальный корпусной компонент 12b может включать закрепляющий колпачок 12с, соединенный с дистальным концом меньшего диаметра дистального корпусного компонента 12b для закрепления механизмов запуска для приведения устройства 10 к дистальному корпусному компоненту 12b. Граница раздела между закрепляющим колпачком 12с и дистальным корпусным компонентом 12b может образовывать канавку 1234 для содействия защелкиванию кнопки запуска 32 на дистальном конце дистального корпусного компонента 12b, или она может быть соединена другим подходящим соединительным средством, как описано выше.
На фиг.3 и 10, компонент 700 привода шприца представляет собой предпочтительно интегрированный компонент, изготовленный из подходящего материала, такого как пластик на основе ацеталя, хотя можно также использовать другие подходящие материалы. Компонент 700 привода шприца включает создающий избыточное давление конец 754 для подачи давления на пробку 54 соответствующего шприца 50, стержневую часть 70 плунжера со сжимаемой расширенной центральной частью, иллюстрируемой в виде колен 78 плунжера, а также другие компоненты, такие как компоненты для закрепления цилиндрической пружины 88 к компоненту 700 привода шприца, как описано ниже. Сжимаемая расширенная центральная часть 76 облегчает перемещение соответствующего шприца 50 в продвинутое вперед положение и выталкивание содержимого шприца 50 в две отдельных стадии, как описано выше. Альтернативно, привод шприца может включать множественные приводы для перемещения и/или содействия выталкиванию содержимого из шприца 50.
Компонент 700 привода шприца фиг.2 и 10, кроме того, может включать индикатор 190 в сплошной стержневой части 70 дальше от колен 78. Во время работы устройства 10 и после завершения инъекции, индикатор 190 сконфигурирован для совмещения с окном 130 на корпусе 12 для индикации завершения инъекции. Индикатор 190 предпочтительно имеет отличительный цвет или конструкцию для представления завершения инъекции.
Как показано на фиг.2, 7, 8С и 10, иллюстративный компонент 700 привода шприца, кроме того, включает удерживающий фланец 720 для удерживания приводящей в действие цилиндрической пружины 88 в сжатом положении до приведения в действие. Удерживающий фланец 720 имеет размеры и изготовлен из материала, который предпочтительно обеспечивает возможность компоненту 700 привода шприца скользящим образом и легко двигаться внутри корпуса 12, когда устройство 10 приведено в действие. Простираясь дистально от удерживающего фланца 720, компонент 700 привода шприца образует основание 788 для приводящей в действие цилиндрической пружины 88. Основание 788 заканчивается закрепляющей частью 789 пускателя. Иллюстративное основание 788 может включать гибкие ножки 788а, 788b, вокруг которых намотана пружина 88. Закрепляющая часть 789 пускателя может включать имеющую ушки стойку 7891, простирающуюся от основания 788, и сконфигурированную для селективного вхождения в зацепление с закрепляющим колпачком 12с и/или дистальным корпусным компонентом 12b. Кнопка запуска 32, соединенная с дистальным концом дистального корпусного компонента 12b, сконфигурирована для удерживания закрепляющей части 789 пускателя до приведения в действие. При приведении в действие кнопка запуска 32 освобождает закрепляющую часть 789 пускателя, позволяя цилиндрической пружине 88 протолкнуть компонент 700 привода шприца по направлению к проксимальному концу 20 устройства 10 при описанной выше работе.
В отведенном назад, закрепленном положении, показанном на фиг.2, 8С и 10 (соответствующей схематическому изображению на фиг.3), закрепляющий конец 789 пускателя взаимодействует с корпусом 12, который удерживает имеющую ушки стойку 7891 в защелкнутом положении, против действия смещающей силы цилиндрической пружины 88 для удерживания компонента 700 привода шприца в отведенном назад положении. В этом положении фланец 720 отводит пружину 88 до упора в заднюю, дистальную стенку 712 дистального корпусного компонента 12b. Отверстие 713 в закрепляющем колпачке 12с обеспечивает доступ кнопки запуска 32 к закрепляющей части 789. В отведенном назад положении, нагнетатель 754 компонента 700 привода шприца выступает из отверстия 228 на проксимальном конце 122а дистального корпусного компонента 12b. Когда дистальный корпусной компонент 12b соединяется с соответствующим механизмом запуска 121 шприца, нагнетатель 754 выступает в заключенную в нем гильзовую часть шприца. Нагнетатель 754 может сообщаться с пробкой 54 шприца 50, заключенного в устройство 10, путем объединения с ней, являясь ею, путем соединения с ней или другим способом, и может иметь любой подходящий размер, форму и конфигурацию, подходящие для подачи давления на пробку 54. В одном варианте осуществления, нагнетатель 754 имеет сечение, соответствующее форме гильзовой части 53 соответствующего шприца 50 с тем, чтобы по существу герметизировать гильзовую часть 53, и нагнетатель 754 сконфигурирован для движения путем скольжения внутри гильзовой части 53 для подачи давления на пробку 54 и приведения в действие шприца 50.
В предпочтительном варианте осуществления, изображенном на фиг.7-10, компонент 700 привода шприца составляет один интегрированный механизм для закрепления соответствующего шприца 50, пружину 88 и другие компоненты, приводящие в действие и перемещающие шприц 50 в выдвинутое вперед положение, и полностью выталкивающие содержимое шприца 50.
Фиг.11 представляет собой вид с пространственным разделением деталей комплекта корпуса шприца 121 иллюстративного варианта осуществления изобретения, который сконфигурирован для соединения и взаимодействия с комплектом механизма запуска 122 фиг.7-10. Иллюстративный комплект корпуса шприца 121 включает проксимальный компонент корпуса 12а, проксимальный колпачок 24, второй смещающий механизм 89, держатель 500 шприца и кожух с уступом 12d, образующий проксимальную часть 20 корпуса 12 при сборке и включает проксимальное отверстие 28, как также показано на фиг. 2. Компоненты 12а, 12d, 89, 500 и 24 совместно действуют для помещения шприца 50, содержащего вещество, подлежащее инъекции, и содействия работе устройства 10 на двух различных стадиях работы, как описано выше.
Иллюстративные варианты осуществления держателя 500 шприца, кожуха с уступом 12d и проксимального колпачка показаны в деталях соответственно на фиг.12, 13 и 14. Фиг.15а и 15b представляют собой соответственно вид сбоку в перспективе и вид сбоку в разрезе собранного комплекта кожуха пружины 121 в соответствии с одним вариантом осуществления изобретения. Специалисту в данной области будет понятно, что изобретение не ограничивается этими иллюстративными вариантами осуществления.
На фиг.1, 2, 11, 12 и 15b, держатель 500 шприца иллюстративного варианта осуществления охватывает дистальную половину шприца 50, используемого в устройстве 10. Шприц 50 помещен в держатель 500 и они оба содержатся в корпусе 12. Во время работы, шприц 50 и держатель 500 перемещаются вперед (например, проксимально) внутри корпуса 12. Корпус 12 стопорит и ограничивает движение держателя 500, а держатель 500 в свою очередь стопорит и ограничивает движение шприца 50. Иллюстративный держатель 500 шприца имеет по существу трубчатую структуру, включающую вырезы в виде окон 501, предпочтительно совмещенные с окном 130 на корпусе 12а для обеспечения пользователю возможности осмотра содержимого шприца 50 перед работой. Держатель 500 шприца может включать имеющий фланец дистальный конец 562, сконфигурированный для образования границы раздела с имеющим фланец дистальным концом 56 (показанным на фиг.3 и 15b) шприца 50. Имеющий фланец дистальный конец 562 может служить в качестве демпфера для шприца 50. Держатель 500 шприца может, кроме того, включать промежуточный фланец 563, который в иллюстративном варианте осуществления образует стопор для шприца 50, который взаимодействует с внутренним стопором 256 (показанным на фиг.15b) на проксимальном компоненте 12а корпуса для ограничения перемещения вперед шприца 50. Иллюстративный держатель 500 шприца может, кроме того, включать проксимальную закрепляющую часть 503, которая ограничивает движение шприца 50 в дистальном, направленном назад направлении. В иллюстративном варианте осуществления, проксимальная закрепляющая часть 503 включает радиальную канавку, сконфигурированную для вхождения в зацепление с внутренним стопором 256. Соединитель 504 держателя шприца протирается вперед мимо проксимальной закрепляющей части 503 для содействия соединению держателя 500 шприца с дистальным концом пружины 89 и кожухом с уступом 12d, как показано на фиг.15b. В одном варианте осуществления, держатель 500 шприца стационарно фиксирован внутри корпуса 12, а шприц 50 селективно и регулируемо скользит внутри и относительно держателя 500 шприца. Альтернативно, держатель 500 шприца расположен с возможностью скольжения внутри корпуса 12 и селективно переносит шприц 50 внутри корпуса 12. Держатель 500 шприца может иметь любую подходящую конфигурацию и размер, подходящие для переноса или направления шприца 50 внутри корпуса 12.
На фиг.13 и 15b, иллюстративный кожух с уступом 12d образует проксимальный конец 20 корпуса 12. Иллюстративный кожух с уступом 12d имеет по существу трубчатый корпус, включающий проксимальную втулку 112, ограничивающую проксимальное отверстие 28 устройства 10, через которое игла 55 шприца выступает во время работы устройства 10. Уступ 113 от основной части 116 трубчатого корпуса образует проксимальную втулку 112 меньшего диаметра, чем основной части 116 трубчатого корпуса кожуха с уступом 12d. Как показано на фиг.15b, уступ 113 образует стопор для движения вперед пружины 89 для ограничения пружины 89 и предотвращения движения вперед пружины 89 по направлению к проксимальному концу 20 устройства 10. В иллюстративном варианте осуществления, показанном на фиг.15b, дистальная кромка 115 кожуха с уступом 12d упирается в проксимальную сторону стопора 256 проксимального компонента 12а корпуса. На фиг.13, дистальные плечи 114 выступают из кожуха с уступом 12d для запирания в кожухе с уступом 12d для предотвращения случайных уколов иглой.
На фиг.14, 15а и 15b, внутренняя часть иллюстративного колпачка 24 может включать множество радиальных борозд 241, 243 для приема выступающих частей кожуха с уступом 12d и проксимального компонента 12а кожуха. Например, как лучше всего иллюстрируется на фиг.15b, первая радиально наружная борозда 241 принимает проксимальный конец боковой стенки 242 проксимального компонента 12а кожуха. Вторая, радиально внутренняя борозда 243 принимает проксимальный конец втулки 112. Втулка 26 колпачка выступает во внутренний просвет 1012 корпуса 12 и окружает проксимальный конец шприца 50, загруженный в него, когда колпачок 24 соединен с корпусом 12. В одном варианте осуществления, внутреннее покрытие 246 иглы (как показано на фиг.15b) колпачка 24 окружает в виде оболочки иглу 55 шприца. Когда колпачок 24 удаляется, игла 55 шприца обнажается внутри просвета 1012 корпуса 12. Колпачок 24 может также включать отверстие его проксимального конца 248.
Как описано выше и показано на фиг.15а, отверстия 126 в проксимальном компоненте 12а корпуса принимают ушки 127 комплекта механизма запуска 122 для облегчения сборки устройства 10. Описанное выше окно 130 для обеспечения пользователю возможности осматривать содержимое шприца, содержащееся в комплекте 121, а также видеть индикатор 190, который заполняет окно 130, после завершения инъекции, может быть образовано в проксимальном компоненте 12а корпуса.
Фиг.16a и 16b представляют собой виды в разрезе под углами смещения 90 градусов друг от друга, иллюстрирующие автоматическое инъекционное устройство 10 в сборе, где корпус шприца в сборе 121 и комплект механизма запуска 122 соединены вместе, так что нагнетатель 754 компонента 700 приведения в действие шприца выступает в гильзовую часть 53 шприца 50, заключенного в корпус шприца в сборе 121 и в сообщении с пробкой 54 шприца 50.
Как показано, на фиг.16b закрепляющая часть 789 пускателя компонента 700 приведения в действие шприца закреплена по направлению к дистальному концу корпуса 12 кнопкой запуска 32. Когда пользователь нажимает кнопку запуска 32, приводные плечи 32а, соединенные с кнопкой запуска 32, сжимают имеющую ушки стойку 7891 закрепляющей части 789 пускателя, освобождая механизм привода шприца 700, и освобождая пружину 88. Перед работой, сжимаемая расширенная центральная часть 76, иллюстрируемая в виде колен 78, компонента 700 приведения в действие шприца находится выше фланца 56 шприца 50 для обеспечения сжимаемой расширенной центральной части 76 при проталкивании освобожденной цилиндрической пружиной 88 возможности подачи давления на гильзовую часть 53 шприца, посредством этого, перемещая шприц 50 вперед внутри корпуса 12 при приведении в действие. Как описано выше, когда стопор, такой как стопор 256 на проксимальном компоненте 12а корпуса, как показано на фиг.15b и фиг.16а, зацепляет шприц и останавливает дополнительное движение вперед выступающего шприца 50, продолжающая действовать на пружину 88 смещающая сила будет продолжать перемещение компонента 700 приведения в действие шприца вперед, вызывая сжатие сжимаемой расширенной центральной части 76 и ее перемещение в гильзовую часть 53 шприца 50. Перемещение вперед компонента 700 приведения в действие шприца внутри гильзовой части 53 вызывает подачу давления нагнетателем 754 на пробку 54, вызывая выталкивание содержимого шприца в участок инъекции.
Как также показано на фиг.16а и 16b, колпачок 34 привода может включать стабилизирующий выступ 340, который простирается через кнопку запуска 32 и между ушками стойки 7891 компонента 700 приведения в действие шприца для стабилизации компонентов устройства перед приведением в действие.
Фиг.17 представляет собой детальный вид границы раздела между комплектом 121 корпуса шприца и комплектом пускового механизма 122 (как показано на фиг.6 и 8а) автоматического инъекционного устройства 10 одного варианта осуществления изобретения, иллюстрирующий индикатор 190 компонента 700 приведения в действие шприца в соответствии с одним вариантом осуществления изобретения. Индикатор 190 может иметь отличительный цвет и/или конструкцию для указания пользователю, что инъекция завершена. Также на фиг.2, индикатор 190 сконфигурирован для совмещения с окном 130 корпуса 12 после того, как компонент 700 приведения в действие шприца при сжимаемой расширенной центральной части 76, находящейся в сжатом состоянии и сдвинутой вперед внутри гильзовой части 53, завершает инъекцию и полностью или по существу полностью выталкивает содержимое шприца 50 из иглы 55 и в тело пациента. Таким образом, перед работой устройства 10, гильза 53 шприца совмещается с окном 130, и в нем видно его содержимое. После инъекции, при перемещении вперед проксимального конца 20 устройства 10 гильзовой частью 53 шприца, так что игла 55 выступает из проксимального конца 20 в участок инъекции, и компонент 700 приведения в действие шприца переместился вперед внутри гильзовой части 53 шприца, индикатор 190 совмещается с окном 130 для указания завершения инъекции. Поэтому, даже если первая стадия работы (перемещение шприца 50 в обнаженное положение с выступающей иглой 55) завершена, индикатор 190 не совместится с окном 130 или иным образом укажет на завершение инъекции до тех пор пока компонент 700 приведения в действие шприца не вытолкнет содержимое шприца 50 из гильзы 53.
Фиг.18-22 представляют собой вид в разрезе собранного автоматического инъекционного устройства 10' в соответствии с иллюстративным вариантом осуществления изобретения. Иллюстративный вариант осуществления автоматического инъекционного устройства 10' включает два стыкующихся проксимальный и дистальный компонента 12а, 12b корпуса. Проксимальный и дистальный компоненты 12а, 12b корпуса стыкуются для образования полной конструкции корпуса 12. Как показано, проксимальный компонент 12а корпуса, образующий проксимальный конец корпуса 12, принимает проксимальный конец дистального компонента 12b корпуса. Совместно действующие выступ 312 и борозда 313 или множество совместно действующих выступов 312 и борозд 313, облегчают стыковку проксимального и дистального компонентов 12а, 12b в иллюстративном варианте осуществления. Альтернативно можно использовать другие подходящие механизмы стыковки. Ступенька 29, образованная на наружной поверхности дистального компонента 12b корпуса, может образовать стопор для второго съемного колпачка 34.
Как показано, кнопка запуска 32' может представлять собой колпачок, покрывающий дистальный конец дистального компонента 12b корпуса. Иллюстративная кнопка запуска 32' скользит относительно дистального компонента 12b корпуса для приведения в действия пускателя шприца, такого как плунжер 70 или компонент 700 приведения в действие шприца. Ступенька/опора 138, образованная на наружной поверхности дистального компонента 12b корпуса около дистального конца 30 дистального компонента 12b корпуса, обеспечивает возможность перемещения кнопки запуска 32' относительно корпуса 12 и ограничивает его, как показано на фиг.20 и 22. Эта иллюстративная кнопка запуска 32' удерживает с возможностью освобождения гибкие закрепляющие плечи 172 плунжера 70' . При нажатии, кнопка запуска 32' освобождает гибкие закрепляющие плечи 172 для предоставления возможности первому смещающему механизму, иллюстрируемому в виде пружины 88' , протолкнуть плунжер 70' по направлению к проксимальному концу устройства 10'.
В варианте осуществления, показанном на фиг.18-22, плунжер 70', кроме того, включает фланец 72', расположенный между сжимаемой расширенной средней частью 78 и дистальным концом стержня 71' плунжера. Первый смещающий механизм 88' посажен между внутренним дистальным концом корпуса 12 и фланцем 72' для смещения плунжера 70 по направлению к проксимальному концу корпуса 12'. Как описано выше, когда кнопка запуска 34' освобождает закрепляющие плечи 172, цилиндрическая пружина 88' или другой смещающий механизм проталкивает плунжер 70' по направлению к проксимальному концу 20 устройства 10.
Иллюстративный вариант осуществления 10', кроме того, включает индикатор 190, образованный на промежуточной части стержня 71' плунжера между фланцем 12' и сжимаемой расширенной частью 76, иллюстрируемой в виде гибких колен 78'.
Шприц 50', показанный на фиг.18-22, может включать выступы или другой подходящий компонент для содействия регулируемому перемещению шприца внутри корпуса 12'. Например, на фиг.18, шприц 50' включает втулку 157, образующую проксимальный выступ 158 для упора в проксимальную сторону первого выступа 168, образованного на внутренней поверхности корпуса 12' для ограниченного движения шприца 50' в дистальном направлении внутри корпуса 12'. Втулка 157 может также образовывать фланец 159, который может упираться в дистальную сторону первого выступа 168 для ограничения движения шприца 50' в проксимальном направлении во время инъекции.
В варианте осуществления, показанном на фиг.18-22, второй смещающий механизм, иллюстрируемый в виде цилиндрической пружины 89' , расположен около проксимальной части шприца 50' . Ступенька 169, образованная на проксимальной внутренней поверхности кожуха 12' , принимает проксимальный конец цилиндрической пружины 89' . На фиг.19, проксимальный выступ 158 втулки 157 шприца, или другой подходящим образом расположенный механизм, принимает дистальный конец цилиндрической пружины 89' . Как описано выше, второй смещающий механизм 89' смещает шприц 50' в отведенное назад положение внутри корпуса 12' до приведения в действие устройства 10.
Как показано на фиг.18-22, автоматическое инъекционное устройство 10' включает индикатор 190 для указания пользователю устройства 10, когда доза из шприца 50 была полностью или по существу полностью вытолкнута. В иллюстративном варианте осуществления, индикатор 190 образован на части стержня 71' плунжера между сжимаемой расширенной центральной частью 76 и фланцем 72'. По мере того как стержень 71 плунжера перемещается во время работы, индикатор 190 продвигается по направлению к окну 130 и совмещается с ним, когда доза опорожняется из шприца. Индикатор 190, который предпочтительно имеет цвет или тип, отличный от инжектированного вещества, полностью заполняет окно 130 для указания на то, что дозировка была впрыснута. Можно использовать любой подходящий индикатор.
После инъекции дозы из устройства 10 через иглу 55, оболочка 112 иглы, которая может быть образована проксимальным концом 20 кожуха 12d, может автоматически продвигаться поверх обнаженной иглы 55, выступающей из проксимального конца 20 корпуса для предотвращения случайных уколов.
На фиг.23, иллюстративный корпус 12 включает окно 130, сформированное через боковую стенку корпуса 12 для обеспечения пользователю возможности обозревать содержимое шприца.
Иллюстративное окно 130 предпочтительно имеет форму замочной скважины. Например, окно 130 включает первый конец 132, который является по существу линейным, и может включать изогнутый внутренний край 132а. Второй конец 134 окна 130 может иметь по существу форму полусферы и быть шире, чем первый конец 132 окна 130. Окно 130 может включать линию заполнения 135 для обеспечения возможности верификации точной дозировки внутри шприца.
В соответствии с одним вариантом осуществления изобретения, иллюстративное автоматическое инъекционное устройство можно использовать для доставки дозы ингибитора TNF, используемого для лечения артрита и других заболеваний. В одном варианте осуществления, раствор, содержащийся в шприце 50 или 50', содержит 40 мг лекарственного продукта (блокатора или ингибитора TNFα), 1 мл адалимумаба: 40 мг адалимумаба, 4,93 мг хлорида натрия, 0,69 мг одноосновного дегидрофосфата натрия, 1,22 мг двухосновного дегидрофосфата натрия, 0,24 мг цитрата натрия, 1,04 мг моногидрата лимонной кислоты, 9,6 мг маннита, 0,8 мг полисорбата 50 и воду для инъекции, при необходимости с добавлением гидроксида натрия по Фармакопее США для доведения рН примерно до 5,2.
Фиг.24 иллюстрирует использование устройства для доставки дозировки вещества, такого как ингибитор TNF, в подкожную область пользователя, в соответствии с иллюстративным вариантом осуществления изобретения. На первой стадии, пользователю предоставляется предварительно загруженное автоматическое инъекционное устройство, такое как описанное выше устройство 10 или устройство 10' . Затем, пользователь выбирает и подготавливает участок инъекции 400 для приема вещества в подкожную область. Например, пользователь может очистить участок инъекции, используя подходящее чистящее устройство, такое как спиртовой подготовительный тампон, который может быть объединен с устройством 10 или 10' по настоящему изобретению. После подготовки, пользователь готовит дозу для инъекции. Например, пользователь может обследовать раствор через окно 130 для обеспечения того, чтобы раствор имел нужный цвет и консистенцию, и чтобы уровень жидкости находился на линии заполнения для обеспечения соответствующей дозировки. После обеспечения соответствующей дозировки и содержимого в предварительно заполненном шприце 50, пользователь затем удаляет первый колпачок 24 и второй колпачок 34 устройства 10 или 10' для обнажения отверстия 28 на первом конце 20 и кнопки запуска 32 на втором конце 30. Затем пользователь размещает автоматическое инъекционное устройство 10 или 10' открытым первым концом 20, прилегающим или находящимся проксимально от участка инъекции. Пользователь может произвести надавливание на кожу в этой области для облегчения инъекции. Автоматическое инъекционное устройство 10 или 10' предпочтительно удерживается под углом примерно 90 градусов к поверхности тела пользователя, прижимая к коже, как показано на фиг.24. После размещения, пользователь нажимает кнопку запуска 32 для начала инъекции. Нажатие кнопки запуска может вызвать появление слышимого индикатора (шума) , такого как «щелчок», для индикации начала инъекции. Как описано выше, нажатие кнопки запуска 32 вызывает освобождение кнопкой запуска закрепления, такого как закрепляющий конец 789 компонента 700 приведения в действие шприца, давая возможность смещающей пружине 88 протолкнуть компонент 700 приведения в действие шприца и, таким образом, шприц 50 по направлению к проксимальному концу 20 устройств 10 или 10'. После того как шприц 50 прокалывает кожу или иным образом поступает в участок введения, движение шприца 50 вперед прекращается, и затем механизм приведения шприца в действие или другой механизм толкает пробку 54 шприца для выталкивания содержимого шприца 50.
Пользователь удерживает автоматическое инъекционное устройство 10 или 10' в положении, показанном на фиг.24, в течение заданного периода времени. Если индикатор 190 обеспечен в автоматическом инъекционном устройстве 10, пользователь удерживает автоматическое инъекционное устройство 10 в указанном положении до тех пор, пока индикатор 190 не заполнит окно 130, указывая на то, что была инъецирована полная или по существу полная доза вещества. После этого, пользователь удаляет устройство 100 для извлечения иглы 55 из кожи. Игла 55 предпочтительно автоматически зачехлена для предотвращения случайных уколов. Затем пользователь может выбросить пустое автоматическое инъекционное устройство 10 или 10'.
В соответствии с другим вариантом осуществления изобретения, может быть предоставлено тренировочное автоматическое инъекционное устройство для подготовки пользователей к использованию автоматического инъекционного устройства 10 или 10'. Иллюстративное тренировочное автоматическое инъекционное устройство имитирует функциональность тренировочного автоматического инъекционного устройства 10 или 10' без инъекции вещества в тело пациента. Тренировочное автоматическое инъекционное устройство может иметь по существу такие же компоненты, как описанные выше автоматические инъекционные устройства 10 или 10', но при этом в нем нет иглы и/или лекарственного средства. Например, тренировочное автоматическое инъекционное устройство может быть заполнено воздухом, который при приведении в действие выталкивается из гильзовой части 53 шприца. В рабочем состоянии тренировочное автоматическое инъекционное устройство продвигает шприц вперед и выталкивает воздух или другое нейтральное вещество, предпочтительно без проникновения в кожу пользователя. Тренировочное автоматическое инъекционное устройство предпочтительно включает индикатор, такой как индикатор 190. Тренировочное автоматическое инъекционное устройство может помочь подготовить пользователя с целью его привыкания к имитационному манипулированию, звуку, ощущению, работе, использованию индикатора 190 и/или времени использования автоматического инъекционного устройства без расходования ценных ресурсов.
Настоящее изобретение обеспечивает существенные преимущества перед способами введения лекарственных средств, в частногсти ингибиторов TNFα предшествующего уровня техники. Например, автоматическое инъекционное устройство повышает полноту и удобство введения, менее болезненно, включает скрытую иглу для устранения ожидания и тревоги пациентов, в той или иной степени страдающих «боязнью иглы», так что страх устраняется как фактор воздействия на пациентов. Кроме того, автоматическое инъекционное устройство эффективно доставляет лекарственное средство или другого вещества, одновременно являясь безопасным. Автоматическое инъекционное устройство по изобретению также обеспечивает преимущества безопасности. В отличие от традиционных шприцев, при использовании автоматического инъекционного устройства нет экспонирования иглы. Автоматическое инъекционное устройство содержит белую игольную втулку, которая окружает иглу и защищает пациентов от травмы вонзившейся иглой перед и после использования. К тому же, защитный колпачок на автоматическом инъекционном устройстве предотвращает случайный ошибочный запуск, что может произойти при использовании предварительно заполненных шприцев. Слышимый «щелчок» оповещает о начале инъекции, а отличительный индикатор в смотровом окне показывает пациенту, что была полностью введена полная доза.
Примеры использования автоматического инъекционного устройства по изобретению также детально описаны в предварительной заявке на патент США под серийным номером 60/818231, которая специально полностью включена в настоящий документ ввиду ссылки на нее. Другие примеры автоматического инъекционного устройства детально описаны в документе РСТ/ЕР 2005/002487, который специально полностью включен в настоящий документ ввиду ссылки на него. В заявках на конструктивные патенты США 29/265691 и 29/265646 также описаны автоматические инъекционные устройства, каждая из которых также включена в настоящий документ ввиду ссылки на нее.
III. Ингибиторы TNFα для использования в композициях и способах по изобретению
Настоящее изобретение можно использовать для введения пользователю (также именуемому в настоящем документе пациентом) дозы вещества, такого как жидкое лекарственное средство, например, ингибитор TNFα. В одном варианте осуществления доза, доставляемая автоматическим инъекционным устройством по изобретению, включает антитела против человеческого TNFα или его связывающую антиген часть. Особенно предпочтительное лекарственное средство представляет собой ингибитор TNFα.
Используемый в настоящем документе термин «человеческий TNFα» (представленный в настоящем документе аббревиатурой hTNFα, или просто hTNF) предназначен для обозначения человеческого цитокина, который существует в виде секретируемой формы 17 кДа и связанной с мембраной формы 26 кДа, биологически активная форма из которых составлена из триммера не ковалентно связанных молекул 17 кДа. Структура hTNFα описана, кроме того, например, в Pennica, D., et at. (1984) Nature 312:724-729; Davis, J.M., et al. (1987) документах Biochemistry 26:1322-1326; и Jones, E.Y., et al. (1989) Nature 338:225-228.
Термин «человеческий TNFα» предназначен для включения рекомбинантного человеческого TNFα (rhTNFα), который можно получить стандартными способами рекомбинантной экспрессии, или приобрести в торговой сети (R&D Systems, Catalog No. 210-TA, Minneapolis, MN). TNFα также именуется TNF.
Термин «ингибитор TNFα» относится к средству, которое препятствует активности TNFα. Этот термин также включает каждое из человеческих антител против TNFα (взаимозаменяемо используемый в настоящем документе с антителами против TNFα) и к частям антитела, описанным в настоящем документе, а также к антителам, описанным в патентах США №№6090382; 6258562; 6509015 и в заявках на патенты США под серийными №№09/801105 и 10/302356. В одном варианте осуществления, ингибитор TNFα, используемый в изобретении, представляет собой антитело против TNFα или его фрагмент, включая инфликсимаб (Remicade®, Johnson and Johnson; описанный в патенте США №5656272, включенном в настоящий документ ввиду ссылки на него), CDP571 (гуманизированное моноклинальное IgG4 антитело против TNF-альфа), CDP 870 (фрагмент гуманизированного моноклонального антитела против TNF-альфа), и dAb против TNF (Peptech), CNTO 148 (голимумаб; медарекс и центокор, см. WO 02/12502), и адалимумаб (HUMIRA® Abbott Laboratories, человеческое mAb против TNF, описанное в патенте США №6090382 в виде D2E7). Дополнительные антитела против TNF, которые можно использовать в изобретении, описаны в патентах США №№ 6593458; 6498237; 6451983 и 6448380, каждый из которых включен в настоящий документ ввиду ссылки на него. В другом варианте осуществления, ингибитор TNFα представляет собой гибридный белок TNF, например, этанерцепт (Enbrel®, Amgen; описанный в документах WO 91/03553 и WO 09/406476, включенных в настоящий документ ввиду ссылки на них) . В другом варианте осуществления, ингибитор TNFα представляет собой рекомбинантный белок, связывающий TNF (r-TBP-I) (Serono).
Используемый в настоящем документе термин «антитело» предназначен для обозначения молекул иммуноглобулина, состоящих из четырех полипептидных цепей, двух тяжелых (Н) цепей и двух легких (L) цепей, взаимно соединенных дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначенные в настоящем документе аббревиатурами HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначенные в настоящем документе аббревиатурами LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL могут быть, кроме того, подразделены на области гипервариабельности, именуемые областями, определяющими комплементарность (CDR), со вставленными областями, которые более сохранны, именуемыми каркасными областями (FR). Каждая VH и VL составлена из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Антитела по изобретению, кроме того, детально описаны в патентах США №№6090382; 6258562 и 6509015, каждый из которых полностью включен в настоящий документ ввиду ссылки на него.
Используемый в настоящем документе термин «связывающая антиген часть» антитела (или просто «часть антитела») относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, hTNFα). Было показано, что фрагменты антитела полной длины могут выполнять связывающую антиген функцию антитела. Примеры связывающих фрагментов, охватываемые термином «связывающая антиген часть» антитела, включают (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и СН1; (ii) фрагмент F(ab')2, бивалентный фрагмент, включающий два фрагмента Fab, связанные дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и СН1; (iv) фрагмент Fv, состоящий из доменов VL и VH одного плеча антитела, (v) фрагмент dAb (Ward et al. (1989) Nature 341: 544-546), который состоит из доменов VH и VL; (vi) изолированную область, определяющую комплементарность (CDR); и (vii) антитело против двойного вариабельного домена (DVD). Кроме того, хотя два домена фрагмента Fv кодируются отдельными генами, они могут быть соединены с использованием рекомбинантных способов, синтетическим линкером, который обеспечивает возможность получить их в виде одной белковой цепи, в которой области VL и VH спариваются для образования моновалентных молекул (известных как одноцепочечные Fv (scFv); см., например. Bird et al. (1988) Science 242:423-426; and Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также охватываются термином «связывающая антиген часть» антитела. Охватываются также другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой бивалентные, биспецифические антитела, в которых домены VH и VL экспрессированы на одной полипептидной цепи, но с использованием линкера, который является слишком коротким для обеспечения возможности спаривания между двумя доменами на той же цепи, принуждая, посредством этого, домены к спариванию с комплементарными доменами другой цепи, и созданию сайтов связывания антигена (см., нaпримep, Holliger et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448 ;Poljak et al. (1994) Structure 2:1121-1123). (Части антитела по изобретению более детально описаны в патентах США №№6090382, 6258562, 6509015, каждый из которых полностью включен в настоящий документ ввиду ссылки на них).
В одном варианте осуществления, ингибитор TNF, используемый в способах и композициях по изобретению, включает гибридный белок TNF, например, этанерцепт (Enbrel®, Amgen; описанный в документах WO 91/03553 и WO 09/406476, включенных в настоящий документ ввиду ссылки на них), а также рекомбинантный связывающий TNF белок (r-TBP-I) (Serono).
В одном варианте осуществления, ингибитор TNF, используемый в способах и композициях по изобретению, включает изолированные человеческие антитела или его связывающие антиген части, которые связываются с человеческим TNFα с высоким сродством и низкой частотой отбраковки, и имеют высокую нейтрализующую способность. Предпочтительно, человеческие антитела по изобретению являются рекомбинантными, нейтрализующими антитела против человеческого hTNFa. Наиболее предпочтительное рекомбинантное, нейтрализующее антитело по изобретению именуется в настоящем документе D2E7, также именуемое HUMIRA® или адалимумаб (аминокислотная последовательность области VL D2E7 показана в SEQ ID NO:1 патента США №6090382; аминокислотная последовательность области VH D2E7 показана в SEQ ID NO:2 патента США № 6090382). Свойства D2E7 (HUMIRA®) были описаны в патентах США Salfield et al. №№6090382, 6258562 и 6509015, каждый из которых включен в настоящий документ ввиду ссылки на него. Другие примеры ингибиторов TNFα включают химерные и гуманизированные мышиные антитела против hTNFα, которые были подвергнуты клиническому испытанию для лечения ревматоидного артрита (см., например, Elliott et al. (1994) Lancet 344:1125-1127; Elliot et al. (1994) Lancet 344:1105-1110; Rankin et al. (1995) Br. J. Rheumatol. 34:334-342). В другом варианте осуществления, ингибитор TNFa, используемый в изобретении, представляет собой антитело против TNFa или его фрагмент, включающий инфликсимаб (Remicade®, Johnson and Johnson; описанный в патенте США № 5656272, включенном в настоящий документ ввиду ссылки на него), CDP571 (гуманизированное моноклональное IgG4 антитело против TNF-альфа), CDP 870 (фрагмент гуманизированного моноклонального антитела против TNF-альфа), dAb против TNF (Peptech), и CNTO 148 (голимумаб; медарекс и центокор, см. WO 02/12502).
Используемый в настоящем документе термин «рекомбинантное человеческое антитело» предназначено для включения всех человеческих антител, которые получены, экспрессированы, созданы или выделены рекомбинантными средствами, такими как антитела, экспрессируемые с использованием вектора рекомбинантной экспрессии, трансфецированного в клетку-хозяин (описанными ниже), антитела, выделенные из библиотеки рекомбинантных, комбинаторных человеческих антител (описанных ниже), антитела, выделенные у животных (например, мыши), которые трансгенны для генов человеческого иммуноглобулина (см, например, Taylor et al. (1992) Nucl. Acids Res. 20:6287), или антитела, полученные, экспрессированные, созданные или выделенные любым другим средством, которое включает сплайсинг генных последовательностей человеческого иммуноглобулина в другие последовательности ДНК. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, полученные из последовательностей иммуноглобулина человеческой зародышевой линии. Однако, в определенных вариантах осуществления, такие рекомбинантные человеческие антитела подвергаются мутагенезу in vitro (или in vivo, когда используется животное, трансгенное для последовательностей человеческого Ig) , и, таким образом, секвенируются аминокислотные последовательности областей VH и VL рекомбинантных антител, которые, хотя и получены из последовательностей VH и VL человеческой зародышевой линии и связаны с ними, не могут естественно существовать внутри репертуара зародышевой линии человеческих антител in vivo.
Такие химерные, гуманизированные, человеческие и имеющие двойную специфичность антитела могут быть получены методиками рекомбинантной ДНК, известными в данной области, например, с использованием способов, описанных в международной заявке РСТ №PCT/US 86/02269; заявке на европейский патент №184187; заявке на европейский патент №171496; заявке на европейский патент №173494; в международной публикации РСТ № WO 86/01533; патенте США №4816567; заявке на европейский патент №125023; Better etal. (1988) Science 240:1041-1043; Liu et al. (1987) Proc. Natl. Acad. Sci. USA 84:3439-3443; Liu et al. (1987) J. Immunol. 139:3521-3526; Sun et al. (1987) Proc. Natl. Acad. Sci. USA 84:214-218; Nishimura et al. (1987) Cancer Res. 47:999-1005; Wood et al. (1985) Nature 314:446-449; Shaw et al. (1988) J. Natl. Cancer Inst. 80:1553-1559; Morrison (1985) Science 229:1202-1207; Oi et al. (1986) BioTechniques 4:214; патент сша No. 5,225,539; Jones et al. (1986) Nature 321:552-525; Verhoeyan et al. (1988) Science 239:1534; и Beidler et al. (1988) J. Immunol. 141:4053-4060, Queen et al., Proc. Natl. Acad. Sci. USA 86:10029-10033 (1989), US 5,530,101, US 5,585,089, US 5.693,761, US 5,693,762, Selick et al., WO 90/07861, и , Winter, US 5,225.539.
Используемый в настоящем документе термин «изолированное антитело» предназначен для обозначения антитела, которое по существу лишено других антител, имеющих различные антигенные специфичности (например, изолированное антитело, которое специфически связывает hTNFα, по существу лишено антител, которые специфически связывают антигены, отличные от hTNFα) . Изолированное антитело, которое специфически связывает hTNFα может, однако, обладать перекрестной реактивностью с другими антигенами, такими как молекулы TNFα от других видов. Кроме того, изолированное антитело может быть по существу лишено другого клеточного материала и/или химических веществ.
Используемый в настоящем документе термин «нейтрализующее антитело» (или «антитело, которое нейтрализует активность hTNFα») предназначен для обозначения антитела, связывание которого с hTNFα, приводит к ингибированию биологической активности hTNFα. Это ингибирование биологической активности hTNFα можно оценить измерением одного или нескольких показателей биологической активности hTNFa, таких как цитотоксичность, вызванная hTNFα (или in vitro, или in vivo), клеточная активация, вызванная hTNFα, и связывание с рецепторами hTNFa. Эти показатели биологической активности hTNFα можно оценить одним или несколькими стандартными анализами in vitro или in vivo, известными в данной области (см. патент США № 6090382). Предпочтительно, способность антитела нейтрализовать активность hTNFα оценивается ингибированием цитотоксичности клеток L929, вызванной hTNFα. В качестве дополнительного или альтернативного показателя активности hTNFα, можно оценить способность антитела ингибировать вызванную hTNFα экспрессию ELAM-1 на HUVEC, как меру клеточной активации, вызванной hTNFα.
Используемый в настоящем документе термин «поверхностный резонанс плазмона» относится к оптическому феномену, который обеспечивает возможность анализа в реальном масштабе времени биоспецифических взаимодействий путем выявления изменений концентраций белка внутри матрицы биосенсора, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ). Дополнительные описания представлены в примере 1 патента США № 6258562 и в документах Jönsson et al. (1993) Ann. Biol. Clin. 51:19; Jönsson etal. (1991) Biotechniques 11:620-627; Johnsson et al. (1995) J. Mol. Recognit. 8:125; и Johnnson et al. (1991) Anal.Biochem. 198:268.
Используемый в настоящем документе термин «Koff» предназначен для обозначения константы снижения скорости диссоциации антитела из комплекса антитело/антиген.
Используемый в настоящем документе термин «Кd» относится к константе диссоциации конкретного взаимодействия антитела-антигена.
Используемый в настоящем документе термин «IC50» относится к концентрации ингибитора, требуемой для ингибирования представляющего интерес биологического исхода, например, нейтрализации цитотоксической активности.
Используемый в настоящем документе термин «доза» относится к количеству вещества, такого как ингибитор TNFα, которое вводится пользователю, предпочтительно с использованием автоматического инъекционного устройства по изобретению. В одном варианте осуществления, доза включает эффективное количество, например, включая 20 мг, 40 мг, 80 мг и 160 мг ингибитора TNFα адалимумаба.
Используемый в настоящем документе термин «дозирование» относится к введению вещества (например, антитела против TNFα) для достижения терапевтической цели (например, лечение ревматоидного артрита).
«Схема введения» описывает план лечения для вещества, такого как ингибитор TNFα, например, план лечения в течение продолжительного периода времени и/или в течение всего курса лечения, например, введение первой дозы ингибитора TNFα в 0 неделю с последующим введением второй дозы ингибитора TNFα по схеме введения 2 раза в неделю.
Используемые в настоящем документе термины «схема введения 2 раза в неделю», «дозирование 2 раза в неделю» и «введение 2 раза в неделю» относятся к динамике введения вещества (например, антитела против TNFα) пациенту для достижения терапевтической цели, например, в течение курса лечения. Схема введения 2 раза в неделю не предназначена для включения схемы введения 1 раз в неделю. Предпочтительно, вещество вводится 1 раз в 9-19 дней, предпочтительнее, 1 раз в 11-17 дней, еще предпочтительнее, 1 раз в 13-15 дней, а наиболее предпочтительно, 1 раз в 14 дней. В одном варианте осуществления, схему введения 2 раза в неделю начинают у пациента на 0 неделе лечения. В другом варианте осуществления, поддерживающая доза вводится по схеме введения 2 раза в неделю. В одном варианте осуществления, и ударная, и поддерживающая дозы вводятся в соответствии со схемой введения 2 раза в неделю. В одном варианте осуществления, схема введения 2 раза в неделю включает схему введения, при которой дозы ингибитора TNFα вводятся пациенту 1 раз в 2 недели, начиная с 0 недели. В одном варианте осуществления, введение 2 раза в неделю включает схему введения, при которой дозы ингибитора TNFα вводятся пациенту 1 раз в 2 недели последовательно в течение данного периода времени, например, 4 недели, 8 недель, 16 недель, 24 недели, 26 недель, 32 недели, 36 недель, 42 недели, 48 недель, 52 недели, 56 недель и т.д. Способы введения 1 раз в 2 недели описаны также в заявке на патент США №20030235585, включенной в настоящий документ ввиду ссылки на нее.
Термин «комбинация», как в фразе «первое средство в комбинации со вторым средством», включает совместное введение первого средства и второго средства, которые, например, могут быть растворены или взаимно смешаны в одном и том же фармацевтически приемлемом носителе, или введение первого средства с последующим введением второго средства, или введение второго средства с последующим введением первого средства.
Термин «сопутствующее», как в фразе «сопутствующее терапевтическое лечение», включает введение средства в присутствии второго средства. Способ сопутствующего терапевтического лечения включает способы, в которых совместно вводятся первое, второе, третье или дополнительное вещества. Способ сопутствующего терапевтического лечения также включает способы, в которых первое или дополнительное средства вводятся в присутствии второго или дополнительного веществ, где второе или дополнительное вещества могли, например, вводиться ранее. Способ сопутствующего терапевтического лечения может выполняться поэтапно различными пациентами. Например, один индивидуум может ввести пользователю первое средство, а второй индивидуум может ввести пользователю второе вещество, и этапы введения можно выполнять в одно и то же время или почти в одно и то же время, или в сроки, разделенные промежутками времени, пока первое вещество (и дополнительные вещества) находятся после введения в присутствии второго вещества (и дополнительных веществ). Лицо, осуществляющее введение, и пользователь могут представлять собой одно и то же существо (например, человека).
Используемый в настоящем документе термин «комбинированное лечение» относится к введению двух или более терапевтических веществ, например, антитела против TNFα и другого лекарственного средства. Другое лекарственное средство (средства) можно вводить одновременно, перед или после введения антитела против TNFα.
Термин «лечение», используемый в контексте настоящего изобретения, предназначен для включения терапевтического лечения, а также профилактических или подавляющих мер для лечения расстройства, такого как расстройство, при котором TNFα оказывает повреждающее действие, например, ревматоидного артрита.
В одном варианте осуществления, изобретение предоставляет усовершенствование способы применения и композиции для лечения расстройства, при котором TNFα оказывает повреждающее действие, например, ревматоидного артрита, ингибитором TNFα, например, антителом против человеческого TNFα, или его связывающей антиген частью, посредством автоматического инъекционного устройства.
Вещество, которое доставляется через автоматическое инъекционное устройство, может представлять собой ингибитор TNFα. Ингибитор TNFα включает любое средство (или вещество), которое препятствует активности TNFα. В предпочтительном варианте осуществления, ингибитор TNFα может нейтрализовать активность TNFα, в частности, повреждающую активность TNFα, которая связана с расстройствами, при которых активность TNFα оказывает повреждающее действие, включая без ограничения ревматоидный артрит, ювенильный ревматоидный артрит, анкилозирующий спондилит, болезнь Крона, псориаз и псориатический артрит.
В одном варианте осуществления, ингибитор TNFα, используемый в изобретении, представляет собой антитело против TNFα (также именуемое в настоящем документе TNFα антителом), или его связывающий антиген фрагмент, включая химерное, гуманизированное и человеческое антитела. Примеры TNFα антител, которые можно использовать в изобретении, включают без ограничения инфликсимаб (Remicade®, Johnson and Johnson; описанный в патенте США №5656272, включенном в настоящий документ ввиду ссылки на него), CDP571 (гуманизированное моноклональное IgG4 антитело против TNF-альфа), CDP 870 (фрагмент гуманизированного моноклонального антитела против TNF-альфа), dAb против TNF (Peptech), CNTO 148 (голимумаб; медарекс и центокор, см. WO 02/12502), и адалимумаб (HUMIRA® Abbott Laboratories, человеческое mAb против TNF, описанное в патенте США №6090382 в виде D2E7). Дополнительные антитела против TNF, которые можно использовать в изобретении, описаны в патентах США №№6593458; 6498237; 6451983 и 6448380, каждый из которых включен в настоящий документ ввиду ссылки на него.
Другие примеры ингибиторов TNFα, которые можно использовать в способах и композициях по изобретению, включают этанерцепт (Enbrel, описанный в документах WO 91/03553 и WO 09/406476), растворимый рецептор TNF I типа, пэгилированный растворимый рецептор TNF I типа (PEG TNF-R1), p55TNFRIgG (ленерцепт), и рекомбинантный связывающий TNF белок (r-TBP-I) (Serono). Примеры ингибиторов TNFα включают без ограничения инфликсимаб (Remicade™) , CDP 571, CDP 870, анти-TNF dAb, голимумаб, адалимумаб, этанерцепт (Enbrel™) , p55TNFRIgG (ленерцепт) и r-ТВР-1. Особенно предпочтительным ингибитором TNFα является адалимумаб (HUMIRA®).
В одном варианте осуществления, термин «ингибитор TNFα» исключает инфликсимаб. В одном варианте осуществления, «ингибитор TNFα» исключает адалимумаб. В другом варианте осуществления, «ингибитор TNFα» исключает адалимумаб и инфликсимаб.
В одном варианте осуществления, термин «ингибитор TNFα» исключает этанерцепт, и, необязательно, адалимумаб, инфликсимаб и адалимумаб и инфликсимаб.
В одном варианте осуществления, термин «ингибитор TNFα» исключает инфликсимаб. В другом варианте осуществления, термин «ингибитор TNFα» исключает адалимумаб и инфликсимаб.
В одном варианте осуществления, изобретение описывает виды применения и композицию для лечения или определения эффективности ингибитора TNFα для лечения ревматоидного артрита, где TNFα антитело представляет собой изолированное человеческое антитело, или его связывающую антиген часть, которая с высоким сродством и низкой частотой отбраковки связывается с человеческим TNFα, а также имеет высокую нейтрализующую способность. Предпочтительно, человеческие антитела, используемые в изобретении, являются рекомбинантными, нейтрализующими антителами против человеческого hTNFα. Наиболее предпочтительное рекомбинантное, нейтрализующее антитело по изобретению именуется в настоящем документе D2E7, также именуемое HUMIRA® или адалимумаб (аминокислотная последовательность области VL D2E7 показана в SEQ ID NO:1; аминокислотная последовательность области VH D2E7 показана в SEQ ID NO:2) . Свойства D2E7 (адалимумаб/HUMIRA®) были описаны в патентах США Salfeld et al. №№6090382, 6258562 и 6509015, каждый из которых включен в настоящий документ ввиду ссылки на него. Способы по изобретению можно также выполнять, используя химерные и гуманизированные мышиные антитела против hTNFα, которые были подвергнуты клиническому испытанию для лечения ревматоидного артрита (см., например, Elliott, MJ., et al. (1994) Lancet 344:1125-1127; Elliot, M.J., et al. (1994) Lancet 344:1105-1110; Rankin, B.C., et al. (1995) Br. J. Rheumatol. 34:334-342).
В одном варианте осуществления, способ по изобретению включает определение эффективности антител против адалимумаба и частей антител, антител, связанных с адалимумабом, и частей антител, или других человеческих антител и частей антител с эквивалентными свойствами в отношении адалимумаба, такое как связывание с высоким сродством с hTNFα с низкой кинетикой диссоциации и высокой нейтрализующей способностью, для лечения ревматоидного артрита. В одном варианте осуществления, изобретение предоставляет лечение изолированным человеческим антителом или его связывающей антиген частью, которая диссоциируется от человеческого TNFα при Кd 1×10-8 М или менее и константе скорости Koff 1×10-3 с-1 или менее, обеих определенных поверхностным резонансом плазмона, и нейтрализует цитотоксичность человеческого TNFα в стандартном анализе L929 in vitro при IC50 1×10-7 M или менее. Предпочтительнее, изолированное человеческое антитело или его связывающая антиген часть диссоциируется от человеческого hTNFa при Koff 5×10-4 с-1 или менее, или еще предпочтительнее, изолированное человеческое антитело или его связывающая антиген часть диссоциируется от человеческого hTNFα при Koff 1×10-4 с-1 или менее. Предпочтительнее, изолированное человеческое антитело или его связывающая антиген часть нейтрализует цитотоксичность человеческого TNFα в стандартном анализе L929 in vitro при IC50 1×10-8 М или менее, еще предпочтительнее, при IС50 1×10-9 М или менее, а еще более предпочтительнее, при IC50
1×10-10 М или менее. В предпочтительном варианте осуществления, антитело представляет собой изолированное человеческое рекомбинантное антитело или его связывающую антиген часть.
В данной области хорошо известно, что домены CDR3 тяжелой и легкой цепи антитела играют важную роль в специфичности/сродстве связывания антитела с антигеном. Соответственно, в другом аспекте, изобретение относится к лечению болезни Крона введением человеческих антител, которые имеют медленную кинетику диссоциации для ассоциации с hTNFα и которые имеют домены CDR3 тяжелой и легкой цепи, которые структурно идентичны или связаны с доменами D2E7. Положение 9 D2E7 VL CDR3 может быть занято Аlа или Thr по существу без воздействия на Koff. Соответственно, согласованный мотив для D2E7 VL CDR3 включает аминокислотную последовательность: Q-R-Y-N-R-A-P-Y-(Т/А) (SEQ ID NO:3). Кроме того, положение 12 D2E7 VH CDR3 может быть занято Туr или Asn по существу без воздействия на Koff. Соответственно, согласованный мотив для D2E7 VH CDR3 включает аминокислотную последовательность: V-S-Y-L-S-T-A-S-S-L-D-(Y/N) (SEQ ID NO:4). Кроме того, как продемонстрировано в примере 2 патента США № 6090382, домен CDR3 тяжелой и легкой цепей D2E7 склонен к замещению одним аланиновым остатком (в положении 1, 4, 5, 7 или 8 в пределах VL CDR3 или в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 в пределах VH CDR3) по существу без воздействия на Koff. Кроме того, специалисту в данной области будет понятно, учитывая склонность доменов D2E7 VL и VH CDR3 к замещениям аланином, может быть возможно замещение других аминокислот в пределах доменов CDR3, тем не менее, при сохранении низкой константы частоты отбраковки антитела, в частности, замещений консервативными аминокислотами. Предпочтительно, не более чем от одного до пяти замещений консервативными аминокислотами производится в пределах доменов D2E7 VL и/или VH CDR3. Предпочтительнее, не более чем от одного до трех замещений консервативными аминокислотами производится в пределах доменов D2E7 VL и/или VH CDR3. К тому же, замещения консервативных аминокислот не следует производить в положениях аминокислот, играющих решающую роль для связывания с hTNFα. Представляется, что положения 2 и 5 D2E7 VL CDR3 и положения 1 и 7 D2E7 VH CDR3 играют решающую роль для взаимодействия с hTNFα, и, таким образом, замещения консервативных аминокислот предпочтительно не производятся в этих положениях (хотя замещение аланина в положении 5 D2E7 VL CDR3 приемлемо, как описано выше) (см. патент США №6090382).
Соответственно, в другом варианте осуществления антитело или его связывающая антиген часть предпочтительно имеет следующие характеристики:
a) диссоциируется от человеческого TNFα при константе скорости Koff 1×10-3 с-1 или менее. По данным определения поверхностного резонанса плазмона;
b) имеет домен CDR3 легкой цепи, включающий аминокислотную последовательность SEQ ID NO:3, или модифицированную из SEQ ID NO:3 одним замещением аланина в положении 1, 4, 5, 7 или 8 от одного до пяти консервативными аминокислотными замещениями в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) имеет домен CDR3 тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO:4, или модифицированную из SEQ ID NO:4 одним замещением аланина в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 от одного до пяти консервативными аминокислотными замещениями в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
Предпочтительнее, антитело или его связывающая антиген часть диссоциируется от человеческого TNFα при Koff 5×10-4 с-1 или менее. Еще предпочтительнее, антитело или его связывающая антиген часть диссоциируется от человеческого TNFα при Koff 1×10-4 с-1 или менее.
В еще одном варианте осуществления, антитело или его связывающая антиген часть предпочтительно содержит вариабельную область легкой цепи (LCVR), имеющую домен CDR3, включающий аминокислотную последовательность SEQ ID NO:3, или модифицированную из SEQ ID NO:3 одним замещением аланина в положении 1, 4, 5, 7 или 8, и с вариабельной областью тяжелой цепи (HCVR), имеющую домен CDR3, включающий аминокислотную последовательность SEQ ID NO:4, или модифицированную из SEQ ID NO:4 одним замещением аланина в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11. Предпочтительно, LCVR, кроме того, имеет домен CDR2, включающий аминокислотную последовательность SEQ ID NO:5 (т.е., D2E7 VL CDR2) и HCVR, кроме того, имеет домен CDR2, включающий аминокислотную последовательность SEQ ID NO:6 (т.е., D2E7 VH CDR2). Еще предпочтительнее, LCVR, кроме того, имеет домен CDR1, включающий аминокислотную последовательность SEQ ID NO:7 (т.е., D2E7 VL CDR1) и HCVR имеет домен CDR1, включающий аминокислотную последовательность SEQ ID NO:8 (т.е., D2E7 VH CDR1). Каркасные области для VL предпочтительно из семейства человеческой зародышевой линии Vк1, предпочтительнее, из гена Vk человеческой зародышевой линии А20, а наиболее предпочтительно, из каркасных последовательностей D2E7 VL, показанных на фиг.1А и 1В патента США №6090382. Каркасные области для VH предпочтительно из семейства человеческой зародышевой линии VH3, предпочтительнее, из гена VH человеческой зародышевой линии DP-31, а наиболее предпочтительно, из каркасных последовательностей D2E7 VH, показанных на фиг.2А и 2В патента США №6090382.
Соответственно, в другом варианте осуществления, антитело или его связывающая антиген часть предпочтительно содержит вариабельную область легкой цепи (LCVR), включающую аминокислотную последовательность SEQ ID NO:1 (т.е., D2E7 VL) , и вариабельную область тяжелой цепи (HCVR), включающую аминокислотную последовательность SEQ ID NO:2 (т.е., D2E7 VH) . В определенных вариантах осуществления, антитело включает константную область тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Предпочтительно, константная область тяжелой цепи представляет собой константную область тяжелой цепи IgG1 или константную область тяжелой цепи IgG4. Кроме того, антитело может включать константную область легкой цепи, или константную область легкой цепи каппа, или константную область легкой цепи лямбда. Предпочтительно, антитело включает константную область легкой цепи каппа. Альтернативно, часть антитела может представлять собой, например, фрагмент Fab или одноцепочечный фрагмент Fv.
В других вариантах осуществления, в изобретении используется изолированное человеческое антитело или его связывающая антиген часть, содержащая связанные с D2E7 домены CDR3 VL и VH. Например, антитела или их связывающие антиген части с вариабельной областью легкой цепи (LCVR), имеющей домен CDR3, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:3, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25 и SEQ ID NO:26, или с вариабельной областью тяжелой цепи (HCVR), имеющей домен CDR3, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:4, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34 и SEQ ID NO:35.
TNFα антитело, используемое в способах и композициях по изобретению, может быть модифицировано для усовершенствованного лечения ревматоидного артрита. В некоторых вариантах осуществления, TNFα антитело или его связывающий антиген фрагмент химически модифицирован для обеспечения желаемого эффекта. Например, пэгилирование антител и фрагментов антител по изобретению можно проводить любой реакцией пэгилирования, известной в данной области, как описано, например, в следующих ссылках: Focus on Growth Factors 3:4-10 (1992); EP 0154316 и ЕР 0401384 (каждая из которых полностью включена в настоящий документ ввиду ссылки на нее). Предпочтительно, пэгилирование проводится посредством реакции ацилирования или реакции алкилирования с реактивной молекулой полиэтиленгликоля (или аналогичным реактивным растворимым в воде полимером). Предпочтительным растворимым в воде полимером для пэгилирования антител и фрагментов антител по изобретению является полиэтиленгликоль (PEG). Используемый в настоящем документе термин «полиэтиленгликоль» предназначен для охвата любых форм PEG, которые использовались для дериватизации других белков, таких как моно-(С1-С10)-алкокси- или арилоксиполиэтиленгликоль.
Способы получения пэгилированных антител и фрагментов антител по изобретению в целом включает стадии (а) взаимодействия антитела или фрагмента антитела с полиэтиленгликолем, например, реактивным сложноэфирным или альдегидным производным PEG, в условиях, посредством которых антитело или фрагмент антитела становится прикрепленным к одной или более группам PEG, и (b) получения продуктов реакции. Для среднего специалиста в данной области очевиден выбор оптимальных условий взаимодействия или реакций ацилирования на основании известных параметров и желаемого результата.
Пэгилированные антитела и фрагменты антител можно в целом использовать для лечения ревматоидного артрита введением описанных в настоящем документе TNFα антител или фрагментов антител. В целом, пэгилированные антитела и фрагменты антител увеличивали период полувыведения, по сравнению с не пэгилированными антителами и фрагментами антител. Пэгилированные антитела и фрагменты антител можно использовать отдельно, вместе или в комбинации с другими фармацевтическими композициями.
В еще одном варианте осуществления изобретения, TNFα антитела или их фрагменты могут быть изменены, где константная область антитела модифицирована для уменьшения, по меньшей мере, одной опосредованной константной областью биологической эффекторной функции относительно не модифицированного антитела. Для модифицирования антитела по изобретению с тем, чтобы оно проявляло сниженное связывание с Fc рецептором, сегмент константной области иммуноглобулина антитела может мутироваться в определенных областях, необходимых для взаимодействий Fc рецептора (FcR) (см., например, Canfield, S.M. и S.L. Morrison (1991) J. Exp. Med. 173:1483-1491; и Lund, J. et al.(1991) J. of Immunol. 147:2657-2662). Снижение способности антитела связываться с FcR может также снизить другие эффекторные функции, которые определяются взаимодействиями FcR, такие как опсонизация и фагоцитоз и антигензависимая клеточная цитотоксичность.
Антитело или часть антитела, используемые в композициях и способах по изобретению, могут быть дериватизированы или связаны с другой функциональной молекулой (например, другой пептид или белок). Соответственно, антитела и части антител по изобретению предназначены для включения дериватизированных или иным образом модифицированных форм описанных в настоящем документе антител против человеческого TNFα, включая иммуноадгезионные молекулы. Например, антитело и часть антитела по изобретению могут быть функционально связаны (химическим связыванием, генной гибридизацией, не ковалентной ассоциацией или иным образом) с одной или более другими молекулярными элементами, такими как другое антитело (например, биспецифическое антитело или диатело), выявляемый агент, цитотоксический агент, фармацевтическое средство и/или белок или пептид, которые могут опосредовать ассоциацию антитела или части антитела с другой молекулой (такой как коровая область стрептавидина или полигистидиновая метка).
Один тип дериватизированного антитела получается поперечной сшивкой двух или более антител (одинакового типа или различных типов, например, для создания биспецифических антител). Подходящие агенты поперечной сшивки включают те, которые являются гетерофункциональными, имеющими две отчетливо реактивные группы, разделенными соответствующим спейсером (например, сложный эфир м-малеимидбензоил-N-гидроксисукцинимида) или гомобифункционалом (например, дисукцинимидилсукцинатом) . Такие линкеры имеются от компании Pierce Chemical Company, Rockford, IL.
Полезные выявляемые агенты, которыми могут быть дериватизированы антитело или часть антитела, включают флюоресцентные соединения. Иллюстративные флюоресцентные выявляемые агенты включают флюоресцеин, флюоресцеинизоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и им подобные. Антитело может также быть дериватизировано выявляемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и им подобные. Когда антитело дериватизировано выявляемым ферментом, он выявляется добавлением дополнительных реагентов, которые фермент использует для продукции выявляемого продукта реакции. Например, когда присутствует выявляемый агент пероксидаза хрена, добавление пероксида водорода и диаминобензидина ведет к получению окрашенного продукта реакции, который является выявляемым. Антитело может быть также дериватизировано биотином и выявлено посредством непрямого измерения связывания авидина или стрептавидина.
Антитело или часть антитела, используемые в способах и композициях по изобретению, можно получить рекомбинантной экспрессией генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела, клетка-хозяин трансфецируется одним или более векторами рекомбинантной экспрессии, несущими фрагменты ДНК, кодирующие легкую и тяжелую цепи иммуноглобулина антитела, так что легкая и тяжелая цепь экспрессируются в клетке-хозяине и, предпочтительно, секретируются в среду, в которой культивируется клетка-хозяин, и из этой среды антитела можно извлечь. Стандартные методологии рекомбинантной ДНК используются для получения генов тяжелой и легкой цепей антитела, включения этих генов в векторы рекомбинантной экспрессии и внедрения векторов в клетки-хозяева, такие как описанные в документах Molecular Cloning; A Laboratory Manual, Second Edition, Cold Spring Harbor, N.Y., (1989), Ausubel, F.M. et al. (eds.) Current Protocols in Molecular Biology, Greene Publishing Associates, (1989) и в патенте США No. 4816397 by Boss et al.
Для экспрессии адалимумаба (D2E7) или связанного с адалимумабом (D2E7) антитела сначала получают фрагменты ДНК, кодирующие вариабельные области легкой и тяжелой цепи. Эти ДНК можно получить амплификацией и модификацией вариабельных последовательностей легкой и тяжелой цепи зародышевой линии с использованием полимеразной цепной реакции (PCR). Последовательности ДНК зародышевой линии для генов вариабельной области тяжелой и легкой цепи известны в данной области (см., например, базу данных "Vbase" human germline sequence database; см., также Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Tomlinson, I.M., et al. (1992) "The Repertoire of Human Germline VH Sequences Reveals about Fifty Groups of VH Segments with Different Hypervariable Loops" J. Mol. Biol. 227:776-798; и Cox, J.P.L. et al. (1994) "A Directory of Human Germline V78 Segments Reveals a Strong Bias in their Usage" Evr. J. Immunol. 24:827-836; Содержание каждой из которых специально включено в настоящий документ ввиду ссылки на нее). Для получения фрагмента ДНК, кодирующего вариабельную область тяжелой цепи D2E7 или связанного с D2E7 антитела, член семейства VH3 генов VH человеческой зародышевой линии амплифицируется стандартной PCR. Наиболее предпочтительно, амплифицируется последовательность VH DP-31 зародышевой линии.
Для получения фрагмента ДНК, кодирующего вариабельную область легкой цепи D2E7 или связанного с D2E7 антитела, член семейства Vк1 генов VL человеческой зародышевой линии амплифицируется стандартной PCR. Наиболее предпочтительно, амплифицируется последовательность А20 VL зародышевой линии. Затравки PCR, подходящие для использования в амплификации последовательностей VH и А20 зародышевой линии DP-31, можно обозначить на основании нуклеотидных последовательностей, раскрытых в приведенных выше ссылках, с использованием стандартных способов.
После получения фрагментов VH и VL зародышевой линии, эти последовательности можно подвергнуть мутации для кодирования D2E7 или связанных с D2E7 аминокислотных последовательностей, раскрытых в настоящем документе. Аминокислотные последовательности, кодируемые последовательностями ДНК VH и VL зародышевой линии сначала сравниваются с D2E7 или связанными с D2E7 аминокислотными последовательностями для идентификации аминокислотных остатков в D2E7 или связанными с D2E7 последовательностями, которые отличаются от зародышевой линии. Затем, соответствующие нуклеотиды последовательностей ДНК подвергаются мутации так, что подвергнутая мутации последовательность зародышевой линии кодирует D2E7 или связанную с D2E7 аминокислотную последовательность с использованием генетического кода для определения, какие нуклеотидные изменения следует произвести. Мутагенез последовательностей зародышевой линии проводится стандартными способами, такими как мутагенез, опосредованный PCR (при котором подвергнутые мутации нуклеотиды включаются в затравки PCR, так чтобы продукт PCR содержал мутации), или мутагенез, направленный на сайт.
Кроме того, следует отметить, что если последовательности «зародышевой линии», полученные PCR амплификацией, кодируют аминокислотные различия в каркасных областях из действительной конфигурации зародышевой линии (т.е., различия амплифицированной последовательности, по сравнению с последовательностью действительной зародышевой линии, например, в результате соматической мутации), может быть желательно изменение этих аминокислотных различий их возвращением к последовательностям действительной зародышевой линии (т.е., «обратная мутация» каркасных остатков в конфигурацию зародышевой линии).
После получения фрагментов ДНК, кодирующих D2E7 или связанные с D2E7 сегменты VH и VL (амплификацией и мутагенезом генов VH и VL зародышевой линии, как описано выше), этими фрагментами ДНК можно далее манипулировать стандартными методиками рекомбинантной ДНК, например, для конверсии генов вариабельной области в гены цепи полной длины антитела, в гены фрагмента Fab или в ген scFv. При этих манипуляциях, фрагмент ДНК, кодирующий VL или VH, оперативно связан с другим фрагментом ДНК, кодирующим другой белок, такой как константная область антитела или гибкий линкер. Термин «оперативно связан», используемый в настоящем контексте, предназначен для обозначения того, что два фрагмента ДНК соединены так, что аминокислотные последовательности, кодируемые этими двумя фрагментами ДНК, остаются внутри рамки.
Изолированную ДНК, кодирующую область VH, можно конвертировать в ген тяжелой цепи полной длины оперативным связыванием ДНК, кодирующей VH, с другой молекулой ДНК, кодирующей константные области тяжелой цепи (СН1, СН2 и СН3) . Последовательности человеческих генов константной области тяжелой цепи известны в данной области (см., например, Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) и фрагменты ДНК, охватывающие эти области, можно получить стандартной амплификацией PCR. Константная область тяжелой цепи может представлять собой константную область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD, но наиболее предпочтительно, представляет собой константную область IgG1 или IgG4. Для гена тяжелой цепи фрагмента Fab, ДНК, кодирующая VH, может быть оперативно связана с другой молекулой ДНК, кодирующей только константную область СН1 тяжелой цепи.
Изолированная ДНК, кодирующая область VL, может быть конверсирована в ген легкой цепи полной длины (а также ген легкой цепи Fab) оперативным связыванием ДНК, кодирующей VL, в другую молекулу ДНК, кодирующую константную область легкой цепи, CL. Последовательности человеческих генов константного региона легкой цепи известны в данной области (см., например, Kabat, Е.А., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242) и фрагменты ДНК, охватывающие эти области, можно получить стандартной амплификацией PCR. Константная область легкой цепи может представлять собой константную область каппа или лямбда, но наиболее предпочтительно, она представляет собой константную область каппа.
Для создания гена scFv, фрагменты ДНК, кодирующие VH и VL, оперативно связаны с другим фрагментом, кодирующим гибкий линкер, например, кодирующий аминокислотную последовательность (Сly4-Sеr)3, так, чтобы последовательности VH и VL могли экспрессироваться в виде смежного одноцепочечного белка с областями VL и VH, соединенные гибким линкером (см., например, Bird et al. (1988) Science 242:423-426; Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883; McCafferty et al., Nature (1990) 348:552-554).
Для экспрессирования антител или частей антител, используемых в изобретении, ДНК, кодирующие легкие и тяжелые цепи частичной или полной длины, полученные, как описано выше, вставляются в векторы экспрессии, так что гены оперативно связаны с транскрипционными и трансляционными контрольными последовательностями. В этом контексте, термин «оперативно связаны» предназначен для обозначения того, что ген антитела лигирован в вектор так, что транскрипционные и трансляционные контрольные последовательности внутри вектора выполняли предназначенную им функцию регулирования транскрипции и трансляции гена антитела. Вектор экспрессии и последовательность регулирования экспрессии выбраны для совместимости с экспрессией используемой клетки-хозяина. Ген легкой цепи антитела и ген тяжелой цепи антитела могут быть вставлены в отдельный вектор или, наиболее типично, оба гена вставляются в один и тот же вектор экспрессии. Гены антитела вставляются в вектор экспрессии стандартными способами (например, лигированием комплементарных рестрикционных сайтов на фрагменте гена антитела и векторе, или лигирование тупого конца, если рестрикционные сайты отсутствуют). Перед инсерцией последовательностей легкой и тяжелой цепи D2E7 или связанных с D2E7, вектор экспрессии может уже нести последовательности константной области антитела. Например, один подход к конверсии последовательностей VH и VL D2E7 или связанных с D2E7 в гены антитела полной длины состоит во вставке их в векторы экспрессии, уже кодирующие соответственно константную область тяжелой цепи и константную область легкой цепи, так, чтобы сегмент VH был оперативно связан с сегментом (сегментами) СН внутри вектора и сегмент VL был оперативно связан с сегментом CL внутри вектора. Дополнительно или альтернативно, вектор рекомбинантной экспрессии может кодировать сигнальный пептид, который содействует секреции цепи антитела из клетки-хозяина. Ген цепи антитела может быть клонирован в вектор так, чтобы сигнальный пептид был связан внутри рамки с аминоконцом гена цепи антитела. Сигнальный пептид может представлять собой сигнальный пептид иммуноглобулина или гетерологичный сигнальный пептид (т.е., сигнальный пептид из не иммуноглобулинового белка).
В дополнение к генам цепи антитела, векторы рекомбинантной экспрессии по изобретению несут регуляторные последовательности, которые регулируют экспрессию генов цепи антитела в клетке-хозяине. Термин «регуляторная последовательность» предназначен для включения промотеров, энхансеров и других элементов регулирования экспрессии (например, сигналов полиаденилирования), которые регулируют транскрипцию или трансляцию генов цепи антитела. Такие регуляторные последовательности описаны, например, в документе (см., например, in Goeddel; Gene Expression Technology: Method in Enzymology 185, Academic Press, San Diego, CA (1990). Специалистам в данной области должно быть понятно, что конструкция вектора экспрессии, включая выбор регуляторных последовательностей, может зависеть от таких факторов как выбор подлежащей трансформации клетки-хозяина, желаемый уровень экспрессии белка и т.д. Предпочтительные регуляторные последовательности для экспрессии клеток-хозяев млекопитающих включают вирусные элементы, которые направляют высокие уровни экспрессии белка в клетках млекопитающих, такие как промотеры и/или энхансеры, полученные из цитомегаловируса (CMV) (такого как промотер/энхансер CMV), обезьяньего вируса 40 (такого как промотер/энхансер SV 40) , аденовируса (например, основного позднего промотера аденовируса (AdMLP)) и полиомы. Дополнительное описание вирусных регуляторных элементов имеется, например, в патенте США №5168062 Stinski, патенте США №4510245 Bell et al. и патенте США №4968615 Schaffner et al.
В дополнение к генам цепи антитела и регуляторным последовательностям, векторы рекомбинантной экспрессии в изобретении могут нести дополнительные последовательности, такие как последовательности, которые регулируют репликацию вектора в клетках-хозяевах (например источниках репликации) и подвергаемые селекции маркерные гены. Подвергаемые селекции маркерные гены содействуют селекции клеток-хозяев, в которые был введен вектор (см., например, патенты США №№4399216, 4634665 и 5179017, все выданные Axel et al.). Например, обычно подвергаемые селекции маркерные гены придают устойчивость к лекарственным средствам, таким как G418, гигромицин или метотрексат, клетке-хозяину, в которую был введен вектор. Предпочтительные подвергаемые селекции маркерные гены включают ген дегидрофолат-редуктазы (DHFR) (для использования в dhfr-клетках-хозяевах селекцией/амплификацией метотрексатом) и ген neo (для селекции G418).
Для экспрессии легкой и тяжелой цепей, вектор(ы) экспрессии, кодирующий легкую и тяжелую цепи, трансфецируется в клетку-хозяин стандартными методиками. Различные формы термина «трансфекция» предназначены для охвата широкого разнообразия методик, обычно используемых для введения экзогенной ДНК в прокариотическую или эукариотическую клетку-хозяин, например, электропорообразования, осаждения фосфата кальция, трансфекции DEAE-декстраном и им подобных. Хотя теоретически возможно экспрессировать антитела по изобретению или в прокариотических, или в эукариотических клетках-хозяевах, экспрессия антител в эукариотических клетках, а наиболее предпочтительно, клетках-хозяевах млекопитающих, наиболее предпочтительна, потому что такие эукариотические клетки и, в частности, клетки млекопитающих, более вероятно, чем прокариотические клетки, осуществят сборку и секрецию должным образом складчатого и иммунологически активного антитела. Сообщалось, что прокариотическая экспрессия генов антитела неэффективна для продукции активных антител с высоким выходом (Boss, M.A. and Wood, C.R. (1985) Immunology Today 6:12-13).
Предпочтительные клетки-хозяева млекопитающих для рекомбинантной экспрессии антител по изобретению включают клетки яичников китайского хомячка (клетки СНО) (включая dhfr-CHO клетки, описанные в документе Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220, используемые с подвергаемым селекции DHFR маркером, например, как описано в документе R.J.Kaufman and P.A.Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NS0, клетки COS и клетки SP2. Когда в клетки-хозяева млекопитающих вводятся векторы рекомбинантной экспрессии, кодирующие гены антител, антитела продуцируются культивированием клеток-хозяев в течение периода времени, достаточного для обеспечения возможности экспрессии антитела в клетках-хозяевах, или, предпочтительнее, секреции антитела в культуральную среду, в которой выращиваются клетки-хозяева. Антитела можно извлечь из культуральной среды с использованием стандартных способов очистки белка.
Клетки-хозяева можно также использовать для продукции частей интактных антител, таких как фрагменты Fab или молекулы scFv. Понятно, что изменения описанной выше процедуры находятся в пределах объема настоящего изобретения. Например, может быть желательно трансфецировать клетку-хозяин ДНК, кодирующей или легкую цепь или тяжелую цепь (но не их обе) антитела по настоящему изобретению. Технологию рекомбинантной ДНК можно также использовать для удаления некоторого количества или всей ДНК, кодирующей каждую из или обе легкую и тяжелые цепи, в чем нет необходимости для связывания с hTNFα. Молекулы, экспрессируемые из таких усеченных молекул ДНК, также охватываются антителами по изобретению. Кроме того, могут продуцироваться функциональные антитела, в которых одна тяжелая и одна легкая цепь представляют собой антитело по изобретению, а другая тяжелая и легкая цепь являются специфичными для антигена, отличного от hTNFα, поперечной сшивкой антитела по изобретению со вторым антителом стандартными способами химической поперечной сшивки.
В предпочтительной системе для рекомбинантной экспрессии антитела или его связывающей антиген части по изобретению, вектор рекомбинантной экспрессии, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводится в клетки dhfr-CHO трансфекцией, опосредованной фосфатом кальция. Внутри вектора рекомбинантной экспрессии, каждый из генов тяжелой и легкой цепи антитела оперативно связан с регуляторными элементами энхансера CMV/промотера AdMLP для стимуляции высоких уровней транскрипции генов. Вектор рекомбинантной экспрессии также несет ген DHFR, который обеспечивает возможность отбора клеток СНО, которые были трансфецированы вектором с использованием селекции/амплификации метотрексатом. Отобранные трансформантные клетки-хозяева культивируются для обеспечения возможности экспрессии тяжелой и легкой цепей антитела, и интактное антитело извлекается из культуральной среды. Стандартные методики молекулярной биологии используются для получения вектора рекомбинантной экспрессии, трансфекции клеток-хозяев, выбора трансформантов, культивирования клеток-хозяев и извлечения антитела из культуральной среды.
В связи с описанным выше, композиции нуклеиновой кислоты, вектора и клетки-хозяина, которые можно использовать для рекомбинантной экспрессии антител и частей антител, используемых в изобретении, включают нуклеиновые кислоты и векторы, включающие указанные нуклеиновые кислоты, включающие человеческое TNFα антитело адалимумаб (D2E7). Нуклеотидная последовательность, кодирующая вариабельную область легкой цепи D2E7, показана в SEQ ID NO:36. Домен CDR1 LCVR охватывает нуклеотиды 70-102, домен CDR2 охватывает нуклеотиды 148-168, и домен CDR3 охватывает нуклеотиды 265-291. Нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи D2E7, показана в SEQ ID NO:37. Домен CDR1 HCVR охватывает нуклеотиды 91-105, домен CDR2 охватывает нуклеотиды 148-198, и домен CDR3 охватывает нуклеотиды 295-330. Специалисту в данной области будет понятно, что нуклеотидная последовательность, кодирующая антитела, связанные с D2E7, или их части (например, домен CDR, такой как домен CDR3), может быть получена из нуклеотидной последовательности, кодирующей D2E7 LCVR и HCVR, с использованием генетического кода и стандартных методик молекулярной биологии.
Рекомбинантные человеческие антитела по изобретению, в дополнение к D2E7 или его связывающей антиген части, или описанные в настоящем документе связанные с D2E7 антитела можно выделить скринингом библиотеки рекомбинантных комбинаториальных антител, предпочтительно, библиотеки проявления фага scFv, полученной с использованием кДНК VL и VH, полученных из мРНК, полученной из человеческих лимфоцитов. Методологии получения и скрининга таких библиотек известны в данной области. В дополнение к имеющимся в продаже наборам для создания библиотек проявления фага (например, the Pharmacia Recombinant Phage Antibody System, catalog no. 27-9400-01; и the Stratagene SurfZAP ™ phage display kit, catalog no.240612), примеры способов и реагентов, особенно подходящих для использования при создании и скрининге библиотек проявления антител, можно найти, например, в документах Ladner et al. U.S. Patent No. 5,223.409; Kang et al. PCT Publication No. WO 92/18619; Dower et al. PCT Publication No. WO 91/17271; inter et al. PCT Publication No. WO 92/20791; Markland et al. PCT Publication No. WO 92/15679; Breitling et al. PCT Publication No. WO 93/01288; McCafferty et al. PCT Publication No. WO 92/01047; Garrard et al. PCT Publication No. WO 92/09690; Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-65; Huse et al. (1989) Science 246:1275-1281; McCafferty et al.. Nature (1990) 348:552-554; Griffiths et al. (1993) EMBOJ 12:725-734; Hawkins et al. (1992) JMol Blol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrard et al. (1991)Bro/Technology 9:1373-1377;Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982.
В предпочтительном варианте осуществления, для изоляции человеческих антител с высоким сродством к hTNFα и низкой константой частоты отбраковки, мышиное антитело против hTNFα, имеющее высокое сродство к hTNFα и низкую константу частоты отбраковки (например, МАК 195, гибридома для которой имеет номер депозита ЕСАСС 87 050801) сначала используется для выбора человеческих последовательностей тяжелой и легкой цепи, имеющих одинаковую активность связывания в отношении hTNFα, с использованием способов импринтинга эпитопа, описанных в документе Hoogenboom et аl., публикация PCT № WO 93/06213. Библиотеки антител, используемые в данном способе, представляют собой предпочтительно библиотеки scFv, полученные и прошедшие скрининг, как описано в документах McCafferty et al., PCT Publication No. WO 92/01047, McCafferty et al., Nature (1990) 348:552-554; и Griffiths et al., (1993)EMBO J 12:725-734. Скрининг библиотек scFv антител предпочтительно проводится с использованием рекомбинантного человеческого TNFα в качестве антигена.
После выбора исходных сегментов человеческих VL и VH, выполняются эксперименты «смешивания и подбора», в которых проводится скрининг различных пар исходно выбранных сегментов VL и VH на связывание hTNFα для отбора предпочтительных комбинаций пар VL/VH. Кроме того, для дополнительного улучшения сродства и/или снижения частоты выбраковки по связыванию hTNFα, сегменты VL и VH предпочтительной пары (пар) VL/VH могут быть подвергнуты случайной мутации, предпочтительно, в пределах области CDR3 VH и/или VL, в процессе, аналогичном процессу соматической мутации in vivo, ответственном за созревания сродства антител во время естественного иммунного ответа. Это созревание сродства in vitro может быть достигнуто амплификацией областей VH и VL с использованием затравок PCR, комплементарных соответственно VH CDR3 или VL CDR3, причем затравки были подвергнуты «спайку» воздействием случайной смеси четырех нуклеотидных оснований в определенных положениях так, что полученные продукты PCR кодируют сегменты VH и VL, в которые были введены случайные мутации с области VH и/или VL CDR3. Можно провести повторный скрининг этих подвергнутых случайной мутации сегментов VH и VL для выявления связывания с hTNFα, и можно отобрать последовательности, которые проявляют высокое сродство и низкую частоту выбраковки в отношении hTNFα.
После скрининга и выделения hTNFα антитела по изобретению из библиотеки проявления рекомбинантного иммуноглобулина, нуклеиновую кислоту, кодирующую выбранное антитело, можно извлечь из пакета проявления (например, из генома фага) и субклонировать в другие векторы экспрессии стандартными методиками рекомбинантной ДНК. При желании, с нуклеиновой кислотой можно произвести дальнейшие манипуляции для создания других форм антитела по изобретению (например, связанные с нуклеиновой кислотой, кодирующей дополнительные домены иммуноглобулина, такие как дополнительные константные области). Для экспрессии рекомбинантного человеческого антитела, выделенного скринингом комбинаториальной библиотеки, ДНК, кодирующую антитело, клонируется в вектор рекомбинантной экспрессии и вводится в клетки-хозяева млекопитающих, как более детально описано выше.
Способы выделения человеческих нейтрализующих антител с высоким сродством и низкой частотой выбраковки в отношении hTNFα описаны в патентах США №№6090382, 6258562 и 6509015, каждый из которых включен в настоящий документ ввиду ссылки.
IV. Вещества для применения в автоматическом инъекционном устройстве
Способы и композиции по изобретению можно использовать с автоматическими инъекционными устройствами, которые вводят по существу любое вещество или лекарственное средство, подходящее для введения путем инъекции. Обычно, вещество или лекарственное средство должно быть в текучей, например, жидкой форме, хотя лекарственные средства в других формах, таких как гели или полутвердые вещества, суспензии, растворы веществ в виде частиц и т.д., также могут подходить для использования, если автоматическое инъекционное устройство сконструировано для обеспечения возможности введения таких форм лекарственного средства.
Предпочтительные лекарственные средства представляют собой биологические агенты, такие как антитела, цитокины, вакцины, гибридные белки и ростовые факторы. Способы получения антител описаны выше.
Не ограничивающие примеры других биологических агентов, которые можно использовать в качестве лекарственного средства в автоматическом инъекционном устройстве, включают без ограничения антитела или антагонисты человеческих цитокинов или ростовых факторов, например, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, IL-23, интерфероны, EMAP-II, GM-CSF, FGF и PDGF; антитела к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD38, CD30, CD40, CD45, CD69, CD80 (В7.1), CD86 (В7.2), CD90, CTLA или их лиганды, включая CD154 (gp39 или CD40L); ингибиторы фермента, превращающего TNFα (ТАСЕ); ингибиторы IL-1 (ингибиторы фермента, превращающего интерлейкин-1, IL-1RA и т.д.); интерлейкин-11; антагонисты IL-18, включая IL-18 антитела или растворимые рецепторы IL-18, или белки, связывающие IL-18; не истощающие анти-СD4 ингибиторы; антагонисты совместно стимулирующего пути CD80 (В7.1) или CD86 (В7.2), включая антитела, растворимые рецепторы или антагонистические лиганды; агенты, которые препятствуют передаче сигналов провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы киназы IRAK, NIK, IKK, р38 или MAP); ингибиторы фермента, превращающего IL-1β (ICE); ингибиторы передачи сигналов Т клеток, такие как ингибиторы киназы; ингибиторы металлопротеиназы; ингибиторы ангиотензин-превращающего фермента; растворимые цитокиновые рецепторы и их производные (например, растворимые рецепторы TNF р55 и р75 и производные p75TNFRIgG (Enbrel™ и p75TNFRIgG (Lenercept)), sIL-1RI, sIL-1RII, sIL-6R); противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGF-бета); ритуксимаб; IL-1 TRAP; MPA; CTLA4-Ig; IL-18 BP; анти-IL-18; анти-IL15; IDEC-CE9.1/SB 210396 (не истощающее приматизированное антитело против CD4; IDEC/SmithKline; см., например. Arthritis & Rheumatism (1995) Vol. 38, S185); DAB 486-IL-2 и/или DAB 389-IL-2 (гибридные белки IL-2; Seragen; см, например. Arthritis & Rheumatism (1993) Vol. 36, 1223); анти-Тас (гуманизированное анти-IL-2Rа; Protein Design Labs/Roche); IL-4 (противовоспалительный цитокин; DNAX/Schering); IL-10 (SCH 52000; рекомбинантный IL-10, противовоспалительный цитокин; DNAX/Schering); агонисты IL-10 и/или IL-4 (например, агонистические антитела); IL-IRA (антагонист рецепторов IL-1; Synergen/Amgen); анакинра (Kineret®/Amgen); TNF-bp/s-TNF (растворимый белок, связывающий TNF; см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S284; Amer. J. Physiol. - Heart and Circulatory Physiology (1995) Vol. 268, pp. 37-42); R973401 (ингибитор фосфодиэстеразы IV типа; см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S282); МК-966 (ингибитор СОХ-2; см., например, Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S81); илопрост (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S82); ингибитор zap-70 и/или 1ck (ингибитор тирозин-киназы zap-70 и/или 1ck); ингибитор VEGF и/или ингибитор VEGF-R (ингибиторы сосудистого эндотелиального клеточного ростового фактора или рецептор сосудистого эндотелиального клеточного ростового фактора; ингибиторы ангиогенеза); ингибиторы TNF-конвертазы; анти-IL-12 антитела; анти-IL-18 антитела; интерлейкин-11 (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S296); интерлейкин-13 (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S308); интерлейкин-17 (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S120); антитимоцитарный глобулин; анти-СD4 антитела; СD5-токсины; антисмысловые фосфортиоатные олигодеоксинуклеотиды ICAM-1 (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый комплементарный рецептор 1 (ТР10; Т Cell Sciences, Inc.); и анти-IL2R антитела.
Фармацевтические композиции могут быть загружены в автоматическое инъекционное устройство по изобретению для доставки пользователю. В одном варианте осуществления, антитела, части антител, а также другие ингибиторы TNFα могут быть включены в фармацевтические композиции, подходящие для введения пользователю с использованием устройства по изобретению. Обычно, фармацевтическая композиция включает антитело, часть антител или другой ингибитор TNFα и фармацевтически приемлемый носитель. Используемый в настоящем документе термин «фармацевтически приемлемый носитель» включает любой и все растворители, дисперсионные среды, покрытия, противобактериальные и противогрибковые средства, изотонические и задерживающие всасывание агенты и им подобные, которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают один или несколько из воды, солевого раствора, солевого раствора с фосфатным буфером, декстрозы, глицерина, этанола и им подобных, а также их комбинации. Во многих случаях, предпочтительно включение изотонических агентов, например, сахаров, полиспиртов, таких как манит, сорбит или хлорид натрия, в комбинации. Фармацевтически приемлемые носители могут, кроме того, включать небольшие количества дополнительных веществ, таких как смачивающие или эмульгирующие вещества, консерванты или буферы, которые удлиняют срок годности или усиливают эффективность антитела, части антитела или другого ингибитора TNFα.
Композиции для использования в способах и композициях по изобретению могут быть представлены в разнообразных формах, в соответствии с введением через устройство по изобретению, включая, например, жидкие растворы (например, инъецируемые и вливаемые растворы), дисперсии или суспензии. В предпочтительном варианте осуществления, антитело или другой ингибитор TNFα вводится подкожной инъекцией с использованием устройства по изобретению. В одном варианте осуществления, пользователь вводит себе ингибитор TNFα, включая без ограничения TNFα антитело, или его связывающую антиген часть с использованием устройства по изобретению.
Терапевтические композиции обычно должны быть стерильными и устойчивыми в условиях изготовления и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные инъецируемые растворы могут быть получены включением активного соединения (т.е., антитела, части антитела или другого ингибитора TNFα) в требуемом количестве в соответствующем растворителе по требованию с одним или комбинацией ингредиентов, перечисленных выше, с последующей фильтрационной стерилизацией. В целом, дисперсии получают включением активного соединения в стерильный носитель, который содержит основную дисперсионную среду, и требуемых других ингредиентов из перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, предпочтительными способами получения являются вакуумная сушка и лиофилизация, которая дает порошок активного ингредиента плюс любой желательный ингредиент из его ранее стерилизованного фильтрацией раствора. Соответствующую текучесть раствора можно поддерживать, например, использованием покрытия, такого как лецитин, поддержанием требуемого размера частиц в случае дисперсии и использованием поверхностно-активных веществ. Длительное всасывание инъецируемых композиций можно обеспечить включением в композицию вещества, которое задерживает всасывание, например, моностеаратов и желатина.
В одном варианте осуществления, изобретение включает автоматическое инъекционное устройство, например, ручку автоинъектора, включающую эффективный ингибитор TNFα и фармацевтически приемлемый носитель. Таким образом, изобретение предоставляет предварительно заполненное автоматическое инъекционное устройство, включающее ингибитор TNFa.
В одном варианте осуществления, антитело или часть антитела для использования в способах по изобретению включена в фармацевтическую рецептуру, как описано в документе PCT/IB 03/04502 и заявке на патент США №20040033228, включенных в настоящий документ ввиду ссылки на них. Эта рецептура включает антитело D2E7 (адалимумаб) в концентрации 50 мг/мл, где одна автоинъекционная ручка включает 40 мг антитела для подкожной инъекции. В одном варианте осуществления, автоматическое инъекционное устройство по изобретению (или конкретнее, шприц устройства) включает рецептуру адалимумаба, имеющую следующий состав: адалимумаб, хлорид натрия, одноосновный дигидрофосфат натрия, двухосновный дигидрофосфат натрия, цитрат натрия, моногидрат лимонной кислоты, маннит, полисорбат 80 и вода, например, вода для инъекций. В другом варианте осуществления, автоматическое инъекционное устройство включает адалимумаб в количестве 40 мг, 4,93 мг хлорида натрия, 0,69 мг одноосновного дигидрофосфата натрия, 1,22 мг двухосновного дигидрофосфата натрия, 0,24 мг цитрата натрия, 1,04 мг моногидрата лимонной кислоты, 9,6 мг маннита, 0,8 мг полисорбата 80 и воду, например, воду для инъекций. В одном варианте осуществления, при необходимости добавляется гидроксид натрия для доведения рН.
Величина дозы ингибитора TNFα в автоматическом инъекционном устройстве может варьироваться в соответствии с расстройством, по поводу которого ингибитор TNFα используется для лечения. В одном варианте осуществления, изобретение включает автоматическое инъекционное устройство, содержащее дозу адалимумаба примерно 20 мг; 40 мг адалимумаба; 80 мг адалимумаба и 160 мг адалимумаба. Следует отметить, что для всех описанных в настоящем документе диапазонов, включая диапазоны доз, все цифры, являющиеся промежуточными относительно приведенных величин, включены в изобретение, например, 36 мг адалимумаба, 48 мг адалимумаба и т.д. Кроме того, приведенные интервалы, использующие указанные цифры, также включены, например, от 40 до 80 мг адалимумаба. Приведенные в настоящем документе цифры не предназначены для ограничения объема изобретения.
Антитела и ингибиторы TNFα, используемые в изобретении, можно также вводить в форме белковых кристаллических рецептур, которые включают комбинацию кристаллов белка, инкапсулированных внутрь полимерного носителя, для образования покрытых частиц. Покрытые частицы белковых кристаллических рецептур могут иметь сферическую морфологию и представлять собой микросферы диаметром до 500 мкм, или они могут иметь некоторую другую морфологию и представлять собой микрочастицы. Увеличенная концентрация белковых кристаллов обеспечивает возможность подкожной доставки антитела по изобретению. В одном варианте осуществления, TNFα антитела по изобретению доставляются через устройство доставки белка, где одна или несколько белковых кристаллических рецептур или композиций вводится пользователю, имеющему расстройство, связанное с TNFα. Композиции и способы получения стабилизированных рецептур кристаллов цельного антитела или кристаллов фрагментов антител также описаны в документе WO 02/072636, который включен в настоящий документ ввиду ссылки на него. В одном варианте осуществления, рецептура, включающая кристаллизованные фрагменты антител, описанные в документе PCT/IB 03/04502 и заявке на патент США №20040033228, включенных в настоящий документ ввиду ссылки на них, используется для лечения ревматоидного артрита с использованием способов по изобретению.
Дополнительные активные соединения могут также быть включены в композиции. В определенных вариантах осуществления, антитело или часть антитела для использования в способах по изобретению, совместно включается в рецептуру с одним или несколькими дополнительными терапевтическими средствами, включая ингибитор или антагонист ревматоидного артрита. Например, антитело против hTNFα или часть антитела может быть совместно включена в рецептуру и/или совместно введена с одним или несколькими дополнительными антителами, которые связывают другие мишени, ассоциированные с расстройствами, связанными с TNFα (например, антителами, которые связывают другие цитокины, или которые связывают молекулы клеточной поверхности), одним или более цитокинами, растворимым рецептором TNFα (см., например, публикацию РСТ № WO 94/06476) и/или одним или более химических агентов, которые ингибируют продукцию или активность hTNFα (такими как производные циклогексан-илиден, как описано в публикации РСТ № WO 93/19751), или любой их комбинацией. Кроме того, одно или более антител по изобретению можно использовать в комбинации с двумя или более из указанных выше терапевтических средств. В таких комбинированных способах лечения можно преимущественно использовать более низкие дозировки вводимых терапевтических средств, таким образом, избегая возможных побочных эффектов, осложнений или низкого уровня реакции пациента, связанных с различными видами монотерапии. Дополнительные средства, которые можно использовать в комбинации с TNFα антителом или частью антитела, описаны в заявке на патент США №11/800531, которая полностью включена в настоящий документ.
Автоматическое инъекционное устройство, например, автоинъекционная ручка, по изобретению может содержать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела или части антитела по изобретению. «Терапевтически эффективное количество» относится к количеству, эффективному в дозировке и в течение периода времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела, части антитела или другого ингибитора TNFα, может варьироваться в соответствии с такими факторами, как патологическое состояние, возраст, пол и масса индивидуума, и способность антитела, части антитела, другого ингибитора TNFα, вызвать желаемую реакцию у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или повреждающие эффекты антитела, части антитела или другого ингибитора TNFα, перевешиваются терапевтически благоприятными воздействиями. «Профилактически эффективное количество» относится к количеству, эффективному в дозировках и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Обычно, поскольку профилактическая доза используется у пациентов перед заболеванием или на его ранних стадиях, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
V. Изготовленные изделия по изобретению
Изобретение также предоставляет изготовленное изделие или набор, включающий автоматическое инъекционное устройство по изобретению. В одном варианте осуществления, набор включает автоматическое инъекционное устройство, например, автоинъекционная ручка, такая как ручка HUMIRA®, содержащая жидкое лекарственное средство, например, ингибитор TNFα, такой как антитело, и инструкции по введению жидкого лекарственного средства. В одном варианте осуществления, набор включает инструкции по доставке ингибитора TNFα для лечения расстройства, в котором TNFα оказывает повреждающее воздействие, например, ревматоидного артрита, с использованием автоматического инъекционного устройства. В инструкциях может быть описано, как, например, подкожно, и когда, например, через 0 неделю, через 2 недели, через 4 недели и т.д., дозу ингибитора TNFα следует вводить пациенту для лечения.
Изготовленное изделие, также именуемое в настоящем документе набором, относится к упакованному продукту, содержащему автоматическое инъекционное устройство по изобретению. Набор предпочтительно включает коробку или контейнер, который содержит компоненты набора, т.е., автоматическое инъекционное устройство. В одном варианте осуществления, автоматическое инъекционное устройство, например, автоинъекционная ручка, заключено в дозовый лоток внутри набора или изделия. Набор может также включать инструкции по введению пациенту вещества, такого как жидкое лекарственное средство, например, TNFα антитело, с использованием автоматического инъекционного устройства по изобретению. Термин «вкладыш упаковки» используется для обозначения инструкций, обычно включаемых в продаваемые упаковки терапевтических продуктов, включающих жидкие лекарственные средства, которые содержат информацию о показаниях, применение, дозировке, введении, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов. В одном варианте осуществления, вкладыш упаковки представляет собой этикетку для терапевтического вещества, предоставляемого набором.
Набор или изготовленное изделие может включать этикетку или ярлык, содержащий сведения об утверждении Администрацией Пищевых продуктов и Лекарственных средств, где представлена последовательность операций по применению автоматического инъекционного устройства для введения вещества, например, ингибитора TNFα. Таким образом, изобретение также включает этикетки и ярлыки, используемые отдельно или в комбинации с изготовленным изделием, которые предоставляют пациенту информацию относительно автоматического инъекционного устройства, включая информацию о том, как применять устройство, какое вещество, например, жидкую дозу, содержит устройство для введения пациенту, и как удалить устройство после завершения введения. В одном варианте осуществления, этикетка обнаруживается на вкладыше упаковки. В одном варианте осуществления, этикетка представляет собой вкладыш упаковки, который включает информационный листок для пациента, предоставляющий пациенту информацию относительно того, как использовать автоматическое инъекционное устройство по изобретению.
Набор или изготовленное изделие по изобретению может содержать информацию об автоматическом инъекционном устройстве в отношении того, как устройство упаковано внутри набора или изделия. Набор может включать дозовый лоток, включающий автоматическое инъекционное устройство по изобретению, которое содержит вещество, например, ингибитор TNFα. В одном варианте осуществления, дозовый лоток предназначен для однократного использования устройства для введения средства. В другом примере, набор может включать 2 или более дозовых лотков, причем каждый содержит автоматическое инъекционное устройство, например, автоинъекционную ручку. Набор или изготовленное изделие может также указывать связанные предметы, необходимые для использования автоматического инъекционного устройства, например, спиртовые тампоны для обработки кожи, вкладыш упаковки с прилагаемой информационной листовкой для пациента и/или информационной брошюрой для пациента. Такой письменный материал, например, вкладыш упаковки с прилагаемой информационной листовкой для пациента и/или информационной брошюрой для пациента, может использоваться для предоставления реципиенту информации относительно методик введения, обычных побочных явлений, сведений об удалении устройства и т.д. В одном варианте осуществления, набор или изготовленное изделие по изобретению видимым снаружи упаковки набора или изделия образом указывает, что набор или изделие содержит 2 дозовых лотка, 2 спиртовых тампона для подготовки кожи, один вкладыш упаковки с прилагаемым информационным листком для пациента и одной информационной брошюрой для пациента.
Набор или изготовленное изделие по изобретению может содержать информацию, например, на этикетке, относительно того, как жидкая доза препарата, например, ингибитора TNFα (адалимумаба), упакована внутри автоматического инъекционного устройства, например, автоинъекционной ручки, по изобретению. Например, в одном варианте осуществления, этикетка по изобретению может указывать, что адалимумаб отпускается в картонной коробочке, содержащей 6 спиртовых тампонов для подготовки кожи и 6 дозовых лотков (начальная упаковка для лечения болезни Крона). В одном варианте осуществления, этикетка может также указывать, что каждый дозовый лоток состоит из одноразовой ручки, причем каждая ручка содержит предварительно заполненный стеклянный шприц емкостью 1 мл с фиксированной иглой 27 калибра длиной  дюйма, обеспечивающий 40 мг (0,8 мл) HUMIRA®.
дюйма, обеспечивающий 40 мг (0,8 мл) HUMIRA®.
В одном варианте осуществления, набор или изготовленное изделие по изобретению включает информацию, указывающую, что автоматическое инъекционное устройство, предоставленное внутри набора, включает рецептуру, включающую человеческое антитело адалимумаб (адалимумаб/HUМIRА®/D2Е7), как описано в документе PCT/IB 03/04502 и заявке на патент США №10/222140, включенных в настоящий документ ввиду ссылки на них.
В одном варианте осуществления, набор или изготовленное изделие по изобретению может содержать информацию, например, на этикетке, которая описывает, что HUMIRA® поставляется в виде стерильного, лишенного консервантов раствора адалимумаба для подкожного введения. Этикетка может, кроме того, описывать, что лекарственный продукт поставляется или в виде одноразового предварительно заполненного стеклянного шприца емкостью 1 мл, или в виде одноразовой предварительно заполненной ручки (ручки HUMIRA®). Этикетка по изобретению может указывать, что вовнутрь ручки включен одноразовый, предварительно заполненный стеклянный шприц емкостью 1 мл. Этикетка по изобретению может, кроме того, указывать, что раствор HUMIRA® является прозрачным и бесцветным, с рН примерно 5,2. Этикетка может также указывать, что HUMIRA® (адалимумаб) поставляется в предварительно заполненных шприцах или в предварительно заполненных ручках в виде лишенного консервантов, стерильного раствора для подкожного введения. В одном варианте осуществления, этикетка указывает, что автоматическое инъекционное устройство по изобретению, содержащее адалимумаб, предоставляется в картонной коробочке с ручкой HUMIRA®, где HUMIRA® отпускается в картонной коробочке, содержащей 2 спиртовых тампона для подготовки кожи и 2 дозовых лотка. Этикетка может, кроме того, определять, что каждый дозовый лоток состоит, по меньшей мере, из одной одноразовой ручки, содержащей предварительно заполненный стеклянный шприц емкостью 1 мл с фиксированной иглой 27 калибра длиной  дюйма, обеспечивающий 40 мг (0,8 мл) HUMIRA®.
дюйма, обеспечивающий 40 мг (0,8 мл) HUMIRA®.
Набор или изготовленное изделие по изобретению может содержать информацию, например, на этикетке, которая предоставляет информацию относительно того, как автоматическое инъекционное устройство должно выглядеть в наборе и/или как должно выглядеть вещество, содержащееся внутри автоматического инъекционного устройства, например, жидкое лекарственное средство. Такая информация может быть предоставлена для обеспечения безопасности относительно введения вещества пациенту, с тем, чтобы пациент знал, подвергся ли порче набор и/или автоматическое инъекционное устройство, и/или было ли вещество испорчено, так что не следует выполнять его введение. В одном варианте осуществления, этикетка указывает, что раствор в ручке HUMIRA® следует внимательно визуально обследовать для выявления материала в виде частиц и изменения цвета перед подкожным введением.
Набор или изготовленное изделие по изобретению может содержать информацию, например, на этикетке, которая предоставляет инструкции относительно того, как использовать автоматическое инъекционное устройство по изобретению, включая введение вещества, например, жидкого лекарственного средства, содержащегося внутри устройства. В одном варианте осуществления, этикетка указывает, что пациентов, использующих ручку HUMIRA®, следует проинструктировать производить инъекцию полного количества раствора, содержащегося в шприце (0,8 мл), что обеспечивает 40 мг HUMIRA®, в соответствии с инструкциями, представленными в информационной листовке для пациента.
Набор или изготовленное изделие по изобретению может содержать информацию, например, на этикетке, которая предоставляет инструкции по приготовлению к использованию ручки по изобретению. Например, этикетка может предоставлять инструкции по сборке для инъекции ручкой. В одном варианте осуществления, изобретение предоставляет ручку, заполненную HUMIRA®, где этикетка для указанной ручки может указывать, что пациенту потребуются следующие предметы для каждой дозы: одна ручка HUMIRA® и 1 спиртовой тампон для подготовки кожи (тампон на палочке). Этикетка может также указывать, что пациент должен найти чистую, плоскую рабочую поверхность. Этикетка может также указывать, что ручку не следует использовать, если уплотнители на верхней и нижней части картонной коробочки сломаны или отсутствуют, а также, необязательно, указание, что пациенту следует связаться с фармацевтом, если уплотнители сломаны. Этикетка может указывать пациенту, что ему следует извлечь один дозовый лоток, содержащий, например, ручку HUMIRA®, из холодильника (если вещество, например, жидкое лекарственное средство, требует охлаждения). Кроме того, этикетка, содержащая инструкции по применению ручки, заполненной HUMIRA®, может указывать, что пациенту не следует использовать ручку, которая заморожена, или если она была оставлена под прямым воздействием солнечного света. Этикетка может также указывать, что если у пациента нет всех элементов, необходимых для проведения инъекции, то следует вызвать фармацевта. Этикетка может также указывать, что пациенту следует использовать только предметы, предоставленные в коробочке, в которой поступает вещество, например, HUMIRA®.
Для этикеток по изобретению, относящихся к автоинъекционной ручке, включающей адалимумаб, этикетка может указывать, что пациенту следует проверить и удостовериться, что название HUMIRA® имеется на дозовом лотке и этикетке ручки; что пациенту следует проверить дату истечения срока годности на этикетке дозового лотка и этикетке ручки для того, чтобы удостовериться в том, что срок годности не истек, и, кроме того, пациенту не следует использовать ручку, если срок годности истек; и что пациенту следует иметь поблизости защищенный от проколов контейнер для удаления использованной ручки.
Набор или изготовленное изделие может также содержать, или внутри упаковки, или посредством сопровождающей информации, материал для использования для лечения описанных в настоящем документе расстройств. В одном варианте осуществления, упаковка специфична для расстройства, которое подвергается лечению TNFa антителом, например, адалимумабом. Набор или изготовленное изделие, кроме того, может включать второе средство (как описано в настоящем документе), упакованное или совместно вложенное с инструкциями по применению второго средства с первым средством (как описано в настоящем документе).
Способы применения автоматического инъекционного устройства по изобретению более детально описаны ниже в примерах. Кроме того, любой из способов, описанных в настоящем документе, относящихся к автоматическому инъекционному устройству, может быть включен в этикетку по изобретению.
VI. Способы и композиции для использования с автоматическим инъекционным устройством
Способы и композиции для доставки вещества с использованием автоматического инъекционного устройства
Изобретение также предоставляет способы применения автоматического инъекционного устройства по изобретению для доставки вещества, например, лекарственного средства или жидкой дозы лекарственного средства, такого как ингибитор TNFα. В одном варианте осуществления, автоматическое инъекционное устройство представляет собой автоинъекционную ручку, такую как ручка HUMIRA®.
В способы включены способы подготовки к применению автоматического инъекционного устройства, например, автоинъекционной ручки, по изобретению.
Применение автоматического инъекционного устройства может требовать, чтобы пациент сначала выбрал и подготовил участок инъекции. Например, способы выбора и подготовки участка инъекции для введения автоинъекционной ручки, такой как ручка HUMIRA®, включают сначала тщательное мытье рук пациента. В целом, для проведения инъекции из автоматического инъекционного устройства, выбирается чистая или здоровая часть тела пациента. В одном варианте осуществления, участок выбирается на передней поверхности бедер или живота пациента. Если выбрана поверхность живота, то пациенту следует избегать области 2 дюйма вокруг пупка. Для инъекции автоинъекционной ручкой, такой как ручка HUMIRA®, каждый раз, когда производится инъекция, следует выбирать другой участок. Каждую новую инъекцию следует производить, по меньшей мере, на расстоянии одного дюйма от ранее использованного участка. В целом, в качестве участков инъекции не следует использовать области, где имеется нежная кожа, кровоизлияния, краснота или твердость, или где имеются рубцы или метки растяжения. Пациенту может помочь ведение записей расположения предшествующих участков инъекции.
После выбора участка инъекции, пациент в целом очищает эту область. В одном варианте осуществления, участок, в который предстоит инъекция HUMIRA®, сначала протирается спиртовым тампоном для подготовки поверхности кожи. После очистки к области участка инъекции не следует снова прикасаться до тех пор, пока пациент не будет готов к инъекции.
Способы по изобретению также включают подготовку подлежащей инъекции дозы вещества внутри автоматического инъекционного устройства, например, автоинъекционной ручки. В одном варианте осуществления, автоинъекционная ручка удерживается при первом съемном колпачке, направленном кверху. Пациенту следует осмотреть раствор или вещество, например, жидкое лекарственное средство, через окна на боковой стороне автоматического инъекционного устройства, например, автоинъекционной ручки, для того, чтобы удостовериться, например, в том, что жидкость прозрачна и бесцветна. В целом, автоматическое инъекционное устройство, например, автоинъекционную ручку, не следует использовать, если жидкость мутна или имеет измененный цвет, или содержит хлопья или частицы. Кроме того, не следует использовать автоматическое инъекционное устройство, например, автоинъекционную ручку, если она заморожена.
После определения того, что автоматическое инъекционное устройство, например, автоинъекционная ручка, пригодна для применения и инъекции, устройство может удерживаться при первом съемном колпачке, направленном вниз. Такое действие может служить для определения уровня жидкого лекарственного средства внутри автоматического инъекционного устройства, например, автоинъекционной ручки.
В одном варианте осуществления, перед инъекцией следует провести проверку для удостоверения в том, что количество жидкости в автоматическом инъекционном устройстве, например, автоинъекционной ручке, находится на уровне или близко к уровню линии, видимой через окно. В одном варианте осуществления, эта линия представляет полную дозу продукта. Верхняя поверхность жидкости может быть изогнутой. Если в автоматическом инъекционном устройстве, например, автоинъекционной ручке, не содержится нужное количество жидкости, то автоинъекционную ручку не следует использовать и, необязательно, следует вызывать фармацевта.
Способы инъекции для доставки вещества, такого как жидкое лекарственное средство, с использованием автоматического инъекционного устройства, например, автоинъекционной ручки, по изобретению могут включать следующее. Автоматическое инъекционное устройство, например, автоинъекционная ручка, удерживается одной рукой. Другой рукой пациент сначала удаляет и выбрасывает съемный колпачок. В одном варианте осуществления, первый съемный колпачок следует снимать прямо и/или не следует скручивать. После удаления первого съемного колпачка, пациент должен проверить, были ли удалена вместе с первым съемным колпачком оболочка иглы. После удаления, внутреннее покрытие иглы удерживается в колпачке. Не следует прикасаться к игле, заключенной в гильзу шприца. Дистальный конец кожуха с уступами будет обнажен после удаления первого съемного колпачка. Первый съемный колпачок не следует надевать повторно, поскольку можно повредить иглу. Кроме того, пациент должен соблюдать предосторожность во избежание падения или раздавливания автоматического инъекционного устройства, например, автоинъекционной ручки, поскольку она содержит шприц.
После удаления первого съемного колпачка, удаляется второй съемный колпачок (также именуемый защитным колпачком) для обнажения кнопки запуска на верхней части. Пациенту следует удалять второй съемный колпачок прямым оттягиванием. Второй съемный колпачок не следует скручивать. После удаления первого и второго съемных колпачков, автоматическое инъекционное устройство, например, автоинъекционная ручка, теперь готово к использованию. Пациенту следует понимать, что автоматическое инъекционное устройство, например, автоинъекционная ручка, приводится в действие после удаления второго съемного колпачка, и, кроме того, что нажатие кнопки запуска под вторым съемным колпачком приведет к выбросу лекарственного средства. Пациент также должен понимать, что кнопку запуска не следует удалять до тех пор, пока не будет должным образом расположено устройство. Кроме того, в этот момент автоматическое инъекционное устройство, например, автоинъекционную ручку, не следует снова закрывать колпачком, так как это может вызвать выброс препарата устройством.
Когда пациент готов произвести инъекцию, автоматическое инъекционное устройство, например, автоинъекционную ручку, следует расположить так, чтобы было видно окно. Пациент своей свободной рукой может осторожно сжать ограниченную область очищенной кожи в участке инъекции, создавая плоскую поверхность, на которую помещается автоматическое инъекционное устройство, например, автоинъекционная ручка. Проксимальный конец автоматического инъекционного устройства, например, автоинъекционной ручки, может быть размещен под углом 90 градусов к плоской поверхности кожи. Автоматическое инъекционное устройство, например, автоинъекционная ручка, должно располагаться так, чтобы оно не произвело инъекцию иглы в пальцы пациента. Для начала инъекции, нажимается кнопка запуска. В одном варианте осуществления, нажатие кнопки запуска производится пальцем, например, указательным пальцем пациента, для начала инъекции. Альтернативно, в другом варианте осуществления, пациент для начала инъекции может также нажать кнопку запуска большим пальцем кисти руки. Во время инъекции, пациент должен пытаться не закрывать окно. В одном варианте осуществления, при нажатии кнопки запуска, будет раздаваться слышимый индикатор, например щелчок. Слышимый индикатор, например щелчок, может указывать на начало инъекции. В одном варианте осуществления, автоинъекционная ручка, содержащая адалимумаб, производит шум при нажатии кнопки запуска. После нажатия кнопки запуска следует продолжать давление на кнопку запуска, и пациент может продолжать удерживание автоматического инъекционного устройства, например, автоинъекционной ручки, при постоянном давлении на участок инъекции до окончания процесса. В одном варианте осуществления, процесс надавливания на кнопку запуска для завершения инъекции может занять примерно до 10 секунд. Для инъекции, постоянное давление на участок инъекции поддерживается в течение всего периода времени.
При использовании автоматического инъекционного устройства, например, автоинъекционной ручки, пациент будет знать, что инъекция закончилась, когда в окне появляется индикатор, занимает все видимое поле обзора и останавливается. Когда инъекция заканчивается, автоматическое инъекционное устройство, например, автоинъекционная ручка, извлекается из кожи пользователя. Кожух автоматически продвинется вперед поверх кончика иглы. Пациент может прижать ватный шарик к участку инъекции и удерживать его, например, в течение 10 секунд. Пациенту не следует тереть участок инъекции, и его не должно тревожить, если имеется небольшое выделение крови. После инъекции, автоматическое инъекционное устройство, например, автоинъекционную ручку, следует удалить, так чтобы пациент не пытался коснуться иглы. Втулка иглы предотвращает прикосновение пациента к игле.
Следует отметить, что любая из инструкций, приведенных в способах использования автоматического инъекционного устройства по изобретению, может быть включена в этикетку для автоматического инъекционного устройства, например, автоинъекционной ручки, по изобретению.
Способы и композиции для тренировки реципиента по использованию автоматического инъекционного устройства
Другой аспект изобретения относится к способам и композициям для тренировки реципиента по использованию автоматического инъекционного устройства. На основании опыта применения устройства в клинических исследованиях, в настоящее время были выявлены определенные важные признаки для успешного использования устройства, и эти признаки могут быть включены в рабочие способы для тренировки реципиентов по применению автоматического инъекционного устройства. Такие способы тренировки и композиции, используемые в таких способах, благоприятны для передачи конечному пользователю устройства или компании, которая будет внедрять, назначать или продавать устройство конечному пользователю, информации о важных признаках для успешного использования устройства.
Кроме того, использование демонстрационного автоматического инъекционного устройства или подготовительного устройства, которое имитирует внешний вид и тактильное восприятие действительного автоматического инъекционного устройства, но которое неспособно вводить вещество или лекарственное средство, особенно полезно при подготовке реципиента к успешному применению действительного автоматического инъекционного устройства, поскольку оно позволяет реципиенту испытать и осуществить манипулирование и регулировку устройства без необходимости неизбежного введения лекарственного средства.
Соответственно, в одном аспекте, изобретение предоставляет способ подготовки реципиента к использованию автоматического инъекционного устройства, где автоматическое инъекционное устройство включает иглу и лекарственное средство, причем способ включает предоставление реципиенту:
(а) демонстрационного автоматического инъекционного устройства, не имеющего иглу и лекарственное средство; и
(b) инструкций по применению автоматического инъекционного устройства.
В другом аспекте, изобретение предоставляет набор для подготовки реципиента к применению автоматического инъекционного устройства, где автоматическое инъекционное устройство включает иглу и лекарственное средство, причем набор включает:
(a) демонстрационное автоматическое инъекционное устройство, в котором отсутствует игла и лекарственное средство;
и
(b) инструкции по применению автоматического инъекционного устройства.
В предпочтительном варианте осуществления, реципиент представляет собой врача, который назначает лекарственное средство, содержащееся внутри автоматического инъекционного устройства. В другом варианте осуществления, реципиент представляет собой пациента, который принимает лекарственное средство, содержащееся внутри автоматического инъекционного устройства. Другие примеры реципиентов включают фармацевтов, которые отпускают автоматическое инъекционное устройство, членов семьи или другие категории пациентов, которые принимают лекарственное средство, и представителей, которые готовят врачей или пациентов по использованию автоматического инъекционного устройства.
В определенных вариантах осуществления способа, включая способы подготовки, описанные в настоящем документе, инструкции по использованию автоматического инъекционного устройства, передаются реципиенту устно. В других предпочтительных вариантах осуществления, инструкции передаются реципиенту в письменном виде (например, через отпечатанный документ) или через аудиовизуальное устройство. В наборах по изобретению, инструкции по применению автоматического инъекционного устройства обычно содержатся в напечатанном документе или аудиовизуальном устройстве. Предпочтительные аудиовизуальные устройства включают кассеты VHS и DVD.
Демонстрационное автоматическое инъекционное устройство сконструировано для того, чтобы иметь внешний вид и вызывать тактильное восприятие действительного автоматического инъекционного устройства, но которое не имеет, по меньшей мере, один компонент, необходимый для обеспечения возможности успешного введения лекарственного средства конечным пользователем, а наиболее предпочтительно, по меньшей мере, не имеет иглу, что позволяет избежать нечаянных уколов иглой при использовании демонстрационного автоматического инъекционного устройства. Предпочтительно, демонстрационное автоматическое инъекционное устройство лишено и иглы, и лекарственного средства, которое содержится в действительном автоматическом инъекционном устройстве.
В другом аспекте, изобретение предоставляет способ подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство, причем способ включает передачу реципиенту инструкций:
(a) расположить автоматическое инъекционное устройство в участке инъекции;
(b) включить механизм приведения в действие для начала инъекции лекарственного средства;
(c) поддерживать включение механизма приведения в действие в течение назначенного периода времени для продолжения инъекции лекарственного средства; и
(d) удалить автоматическое инъекционное устройство из участка инъекции после прохождения назначенного периода времени.
Изобретение также предоставляет аудиовизуальное устройство для подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство, причем аудиовизуальное устройство передает реципиенту инструкции:
(a) расположить автоматическое инъекционное устройство в участке инъекции;
(b) включить механизм приведения в действие для начала инъекции лекарственного средства;
(c) поддерживать включение механизма приведения в действие в течение предписанного периода времени для продолжения инъекции лекарственного средства; и
(d) удалить автоматическое инъекционное устройство из участка инъекции после истечения предписанного периода времени.
Предпочтительно, аудиовизуальное устройство представляет собой кассету VHS или DVD.
В описанных выше способах подготовки и аудиовизуальных устройствах, инструкции могут, кроме того, передавать сообщение о том, что первоначальное включение механизма приведения в действие сопровождается слышимым звуком, таким как «щелчок». Другие примеры слышимых звуков включают звонок, зуммер или тональный сигнал.
В других вариантах осуществления описанных выше способов подготовки и аудиовизуальных устройств, инструкции могут, кроме того, передавать сообщение о том, что завершение инъекции лекарственного средства сопровождается видимым индикатором завершения инъекции и/или инструкции могут, кроме того, передавать сообщение о том, что участок инъекции следует стерилизовать перед размещением автоматического инъекционного устройства в участке инъекции.
Другие примеры инструкции, которые могут передаваться в описанных выше способах подготовки и аудиовизуальных устройствах, описаны в дополнительных деталях в примере 4.
В еще одном аспекте, изобретение предоставляет способ подготовки реципиента по использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство, причем способ включает передачу реципиенту инструкции:
(a) расположить автоматическое инъекционное устройство в участке инъекции;
(b) включить механизм приведения в действие для начала инъекции лекарственного средства;
(c) поддерживать включение механизма приведения в действие для продолжения инъекции лекарственного средства до тех пор, пока не будет выявлен видимый индикатор завершения инъекции; и
(d) удалить автоматическое инъекционное устройство из участка инъекции, когда выявлен видимый индикатор завершения инъекции.
Изобретение также представляет аудиовизуальное устройство для подготовки реципиента к использованию автоматического инъекционного устройства, причем автоматическое инъекционное устройство включает механизм приведения в действие и лекарственное средство, причем аудиовизуальное устройство передает реципиенту инструкции:
(a) расположить автоматическое инъекционное устройство в участке инъекции;
(b) включить механизм приведения в действие для начала инъекции лекарственного средства;
(c) поддерживать включение механизма приведения в действие для продолжения инъекции лекарственного средства до тех пор, пока не будет выявлен видимый индикатор завершения инъекции; и
(d) удалить автоматическое инъекционное устройство из участка инъекции, когда выявлен видимый индикатор завершения инъекции.
Предпочтительно, автоматическое инъекционное устройство включает индикаторное окно, а видимый индикатор завершения инъекции включает цветной индикатор, появляющийся в индикаторном окне. Предпочтительным цветом индикатора является желтый цвет индикатора. Другие примеры подходящих цветных индикаторов включают красный, оранжевый, синий, зеленый, розовый или пурпурный цветные индикаторы. Другие примеры видимых индикаторов завершения инъекции включают появление символа или изображения в индикаторном окне после завершения инъекции и появление «отжатой» кнопки на автоматическом инъекционном устройстве после завершения инъекции.
В других вариантах осуществления описанных выше способов подготовки и аудиовизуальных устройств, инструкции могут, кроме того, передавать сообщение о том, что включение механизма приведения в действие следует поддерживать в течение предписанного периода времени продолжения инъекции лекарственного средства и/или инструкции могут, кроме того, передавать сообщение, что участок инъекции следует простерилизовать перед расположением автоматического инъекционного устройства в участке инъекции. Предпочтительно, предписанный период времени составляет 10 секунд. Другой предпочтительный предписанный период времени составляет, по меньшей мере, 10 секунд. В различных других вариантах осуществления, предписанный период времени составляет 1 секунду, 2 секунды, 3 секунды, 4 секунды, 5 секунд, 6 секунд, 7 секунд, 8 секунд, 9 секунд, 11 секунд, 12 секунд, 13 секунд, 14 секунд, 15 секунд, 30 секунд, 45 секунд или 1 минуту.
В другом варианте осуществления описанных выше способов подготовки и аудиовизуальных устройств, инструкции, кроме того, передают сообщение о том, что автоматическое инъекционное устройство следует обследовать на наличие правильной дозировки и рецептуры лекарственного средства перед размещением автоматического инъекционного устройства в участке инъекции.
Такое обследование можно провести, например, осмотром лекарственного средства через окно, имеющееся в автоматическом инъекционном устройстве, которое обеспечивает возможность визуализации жидкого лекарственного средства, содержащегося в устройстве. Примеры обследования на наличие правильной дозировки и рецептуры включают обследование для выявления того, является ли лекарственное средство прозрачным и бесцветным (например, что оно не помутнело и не содержит вещество в виде частиц) и обследование для выявления того, находится' ли уровень лекарственного средства у видимой в окне индикации «линии заполнения» или близко к ней.
Другие примеры инструкций, которые могут передаваться в описанных выше способах подготовки и аудиовизуальных средствах, описаны в дополнительных деталях в примере 4.
VII. Способы и композиции для привлечения к применению автоматического инъекционного устройства
Другой аспект изобретения относится к способам и композициям для привлечения к применению автоматического инъекционного устройства. На основании результатов клинических исследований, в настоящее время были обнаружены преимущественные признаки автоматического инъекционного устройства, и эти признаки могут быть включены в рабочие способы привлечения к применению автоматического инъекционного устройства. Такие способы содействия распространению и композиции, используемые в таких способах, благоприятны для информирования конечного пользователя устройства или компании, которая будет внедрять, назначать или продавать устройство пользователю, о преимущественных признаках устройства.
Соответственно, в одном аспекте изобретение предоставляет способ привлечения пациента к применению автоматического инъекционного устройства, содержащего вещество, такое как лекарственное средство, причем способ включает передачу реципиенту, по меньшей мере, одного сообщения, выбранного из группы, состоящей из сообщений о том, что:
(a) использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца ;
(b) использование автоматического инъекционного устройства пациентами предпочтительнее, по сравнению с предварительно заполненным шприцем;
(c) пациенту легче использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц;
(а) пациенту удобнее использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц;
(e) автоматическое инъекционное устройство уменьшает тревогу пациентов, испытывающих страх перед иголками, по сравнению с предварительно заполненным шприцем, поскольку игла не видна в устройстве; и
(f) автоматическое инъекционное устройство сконструировано для легкости использования с первоначального применения устройства.
В предпочтительном варианте осуществления, реципиенту передается сообщение о том, что использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца. Например, реципиенту передается сообщение о том, что 80% пациентов при клиническом испытании оценили автоматическое инъекционное устройство как менее болезненное, чем предварительно заполненный шприц.
В другом предпочтительном варианте осуществления, реципиенту передается сообщение о том, что пациенты предпочитают использование автоматического инъекционного устройства использованию предварительно заполненного шприца. Например, передается сообщение о том, что 90% пациентов при клиническом испытании предпочли автоматическое инъекционное устройство предварительно заполненному шприцу.
Реципиенту также может передаваться сообщение об определенных структурных признаках автоматического инъекционного устройства. Например, реципиенту может дополнительно передаваться сообщение о том, что автоматическое инъекционное устройство содержит иглу с пятью фасками, по сравнению с иглой с тремя фасками для предварительно заполненного шприца. В качестве другого примера, реципиенту может передаваться сообщение о том, что в устройстве не видна игла (т.е., она не видна пользователю устройства, когда устройство используется в соответствии с инструкциями).
В предпочтительном варианте осуществления, реципиент представляет собой врача, который назначает лекарственное средство, содержащееся внутри автоматического инъекционного устройства. В другом варианте осуществления, реципиент представляет собой пациента, который принимает лекарственное средство, содержащееся внутри автоматического инъекционного устройства. Другие примеры реципиентов включают фармацевтов, которые отпускают автоматическое инъекционное устройство, членов семьи или лиц, осуществляющих уход за пациентами, которые принимают лекарственное средство, и представителей, которые готовят врачей или пациентов к использованию автоматического инъекционного устройства.
В предпочтительном варианте осуществления, по меньшей мере, одно сообщение передается реципиенту устно. В другом предпочтительном варианте осуществления, по меньшей мере, одно сообщение передается указанному реципиенту письменно (например, посредством напечатанного документа, такого как вкладыш упаковки). В еще одном предпочтительном варианте осуществления, по меньшей мере, одно сообщение передается реципиенту посредством аудиовизуального устройства.
В другом аспекте, изобретение относится к аудиовизуальному устройству для привлечения реципиента к использованию автоматического инъекционного устройства, включающего лекарственное средство, где устройство передает реципиенту, по меньшей мере, одно сообщение, выбранное из группы, состоящей из сообщений о том, что:
(a) использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца;
(b) использование автоматического инъекционного устройства пациентами предпочтительнее, по сравнению с предварительно заполненным шприцем;
(c) пациенту легче использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц;
(d) пациенту удобнее использовать автоматическое инъекционное устройство, чем предварительно заполненный шприц;
(e) автоматическое инъекционное устройство уменьшает тревогу пациентов, испытывающих страх перед иголками, по сравнению с предварительно заполненным шприцем, поскольку игла не видна в устройстве; и
(f) автоматическое инъекционное устройство сконструировано для легкости использования с первоначального применения устройства.
В предпочтительном варианте осуществления, аудиовизуальное устройство представляет собой кассету системы домашнего видео (VHS). В другом предпочтительном варианте осуществления, аудиовизуальное устройство представляет собой или цифровой видеодиск (DVD).
В предпочтительном варианте осуществления, аудиовизуальное устройство передает реципиенту сообщение о том, что использование автоматического инъекционного устройства менее болезненно, чем использование предварительно заполненного шприца. Например, аудиовизуальное устройство может передавать сообщение о том, что 80% пациентов при клиническом испытании оценили автоматическое инъекционное устройство как менее болезненное, чем предварительно заполненный шприц.
В другом предпочтительном варианте осуществления, аудиовизуальное устройство передает реципиенту сообщение о том, что пациенты предпочитают использование автоматического инъекционного устройства предварительно заполненному шприцу.
Например, аудиовизуальное устройство может передавать реципиенту сообщение о том, что 90% пациентов при клиническом испытании предпочли автоматическое инъекционное устройство предварительно заполненному шприцу.
Аудиовизуальное устройство может передавать реципиенту сообщение об определенных структурных признаках автоматического инъекционного устройства. Например, аудиовизуальное устройство может передавать сообщение о том, что автоматическое инъекционное устройство содержит иглу с пятью фасками, по сравнению с иглой с тремя фасками для предварительно заполненного шприца. В качестве другого примера, аудиовизуальное устройство может передавать сообщение о том, что в устройстве не видна игла (т.е., она не видна пользователю устройства, когда устройство используется в соответствии с инструкциями).
В еще одних вариантах осуществления, автоматическое инъекционное устройство, ранее описанное в данной технической области, используется в способах и композициях по изобретению, относящихся к подготовке к использованию и к привлечению к использованию автоматического инъекционного устройства. Подходящие автоматические инъекционные устройства были описаны в данной области техники, включая без ограничения устройства, описанные в патентах США №№3941130, 4261358, 5085642, 5092843, 5102393, 5267963, 6149626, 6270479 и 6371939.
VIII. Расстройства, при которых активность TNFα оказывает повреждающее действие и которые можно лечить ингибитором TNFα, используя автоматическое инъекционное устройство
Автоматическое инъекционное устройство, например, автоинъекционную ручку, по изобретению можно использовать в способах лечения устройств, включая, в одном варианте осуществления, расстройства, связанные с повреждающей активностью TNFα. В одном варианте осуществления, автоматическое инъекционное устройство, например, автоинъекционная ручка, используется для доставки вещества, например, ингибитора TNFα, пациенту для лечения, где расстройство включает без ограничения ревматоидный артрит (включая ювенильный артрит), болезнь Крона, псориаз, псориатический артрит и анкилозирующий спондилит.
Используемый в настоящем документе термин «расстройство, при котором активность TNFα оказывает повреждающее воздействие» предназначен для включения заболеваний и других расстройств, при которых было показано, что присутствие TNFα у пациента, страдающего расстройством, или ответственно, или подозревается его ответственность за патофизиологию расстройства, или оно является фактором, который вносит вклад в усугубление расстройства. Соответственно, расстройство, при котором активность TNFα оказывает повреждающее воздействие, представляет собой расстройство, при котором ожидается, что ингибирование активности TNFα облегчит симптомы и/или прогрессирование расстройства. Наличие таких расстройств может быть доказано, например, увеличением концентрации TNFα в биологической жидкости пациента, страдающего расстройством (например, увеличением концентрации TNFα в сыворотке, плазме, синовиальной жидкости и т.д. пациента), которое можно выявить, например, используя антитело против TNFα, как описано выше. Имеются многочисленные примеры расстройств, при которых активность TNFα оказывает повреждающее воздействие, и они обсуждаются ниже.
А. Аутоиммунные заболевания
Считалось, что фактор опухолевого некроза играет роль в патофизиологии разнообразных аутоиммунных заболеваний. Например, считалось, что TNFα участвует в активации тканевого воспаления и вызывает деструкцию суставов при ревматоидном артрите (см., например, Moeller, A., et al. (1990) Cytokine 2:162-169; U.S. Patent No. 5,231,024 to Moeller et al.; European Patent Publication No. 260 610 Bl by Moeller. A.; Tracey and Cerami, supra; Arend, W.P. и Dayer, J-M. (1995) Arth. Rheum. 38:151-160; Fava, R.A., et al. (1993) Clin. Exp. Immunol. 94:261-266).
Считалось также, что TNFα способствует гибели островковых клеток и опосредовании устойчивости к инсулину при диабете (см., например, приведенный выше документ Тrасеу и Cerami; публикацию РСТ No WO 94/08609). Считалось также, что TNFα опосредует цитотоксичность в отношении олигодендроцитов и индукцию воспалительных бляшек при рассеянном склерозе (см., например, приведенный выше документ Тгасеу и Cerami). Химерные и гуманизированные мышиные антитела против TNFα были подвергнуты клиническому испытанию для лечения ревматоидного артрита (см., например, Elliott, M.J., et al. (1994) Lancet 344:1125-1127; Elliot, M.J., et al. (1994) Lancet 344:1105-1110; Rankin, E.С., et al. (1995) Br. J. Rheumatol. 34:334-342).
TNFα антитела, такие как адалимумаб, можно применять для лечения аутоиммунных заболеваний, в частности, заболеваний, связанных с воспалением. Примеры таких аутоиммунных состояний включают ревматоидный артрит, ревматоидный спондилит, остеоартрит и подагрический артрит, аллергию, рассеянный склероз, аутоиммунный диабет, аутоиммунный увеит и нефротический синдром. Другие примеры аутоиммунных состояний включают мультисистемные аутоиммунные заболевания и аутоиммунную потерю слуха.
В одном варианте осуществления изобретения, ингибитор TNFα используется для лечения аутоиммунных расстройств, таких как волчанка. Было показано, что волчанка связана с активностью TNF (Shvidel et аl. (2002) Hematol J. 3:32; Studnicka-Benke et al. (1996) Br J Rheumatol. 35:1067). Используемый в настоящем документе термин «волчанка» относится к хроническому, воспалительному аутоиммунному расстройству, называемому красная волчанка, которое может поражать многие органные системы, включая кожу, суставы и внутренние органы. Волчанка представляет собой общий термин, который включает ряд специфических типов волчанки, включая системную волчанку, волчаночный нефрит и волчаночный церебрит. При системной волчанке (SLE), естественные защитные механизмы организма обращаются против организма, и уклоняющиеся формы иммунных клеток атакуют ткани организма. Могут продуцироваться антитела, которые могут реагировать против клеток крови, органов и тканей организма. Эта реакция приводит к появлению иммунных клеток, атакующих пораженные системы, вызывая хронические заболевания. Волчаночный нефрит, также именуемый волчаночным клубочковым заболеванием, представляет собой почечное расстройство, которое обычно представляет собой осложнение SLE, и характеризуется повреждением клубочков, и прогрессирующей потерей почечной функции. Волчаночный церебрит относится к другому осложнению SLE, которое представляет собой воспаление мозга и/или центральной нервной системы.
Другое аутоиммунное заболевание, которое можно лечить, используя TNFα антитело, представляет собой болезнь Крона, которая более детально описана ниже в разделе «Кишечные расстройства»
В. Кишечные расстройства
Считалось, что фактор опухолевого некроза участвует в патофизиологии воспалительных кишечных расстройств, включая болезнь Крона (см., например, Тгасу et аl. (1986) Science 234:470; Sun et аl. (1988) J. Clin. Invest. 81:1328; MacDonald et а1. (1990) Clin. Exp. Immunol. 81:301). Химерные мышиные антитела против hTNFα были подвергнуты клиническому испытанию для лечения болезни Крона (van Dullemen et аl. (1995) Gastroenterology 109:129). Изобретение включает лечение, включающее введение TNFα антитела, полученного с использованием способа по изобретению, для лечения кишечных расстройств, таких как идиопатическое воспалительное кишечное заболевание, с использованием человеческих антител или его связывающих антиген фрагментов. Идиопатическое воспалительное кишечное заболевание (IBD) включает два синдрома, болезнь Крона и язвенный колит. В одном варианте осуществления, антитело, полученное с использованием способа по изобретению, также используется для лечения расстройств, часто связанных с IBD и болезнью Крона. Термин «расстройство, связанное с воспалительным кишечным расстройством (IBD)» или «расстройство, связанное с болезнью Крона», используемый взаимозаменяемо в настоящем документе, используется для описания состояний и осложнений, обычно связанных с IBD и болезнью Крона.
Изобретение также включает схему с использованием множественных вариабельных доз, включающую введение TNFα антитела для лечения болезни Крона. Это лечение болезни Крона основано на локализации, распространении и тяжести заболевания. Фармакологические вмешательства включают противовоспалительные средства (аминосалицилаты и кортикостероиды) и иммуномодуляторные средства (азатиоприн и 6-меркаптопурин [6-МР] , циклоспорин, метотрексат [МТХ], антибиотические средства и биологические средства). Уровни С-реактивного белка (CRP) и скорости осаждения эритроцитов (ESR) отражают острую фазу неспецифических реакций. Эндоскопия представляет собой первичное средство диагностики болезни Крона. Рентгенологические признаки болезни Крона, проявляемые бариевым исследованием, включают отек слизистой, афтозные и линейные изъязвления, асимметричное сужение и стриктуры, и разделение соседних петель кишки, вызванное утолщением брыжейки. Аномалии являются очаговыми и асимметричными. Первичное гистологическое поражение представляет собой афтозную язву. Состоянием субъектов с болезнью Крона можно оценить, используя показатель активности болезни Крона (CDAI), который представляет собой стандартный показатель активности заболевания, причем более высокие балльные показатели указывают на более высокую активность заболевания.
Примеры связанных с болезнью Крона расстройств, которые можно лечить, используя способы по изобретению, включают свищи в мочевом пузыре, влагалище и коже, кишечные обструкции; абсцессы; алиментарные дистрофии; осложнения в результате применения кортикостероидов; воспаление суставов; узловую эритему; гангренозную пиодермию и поражения глаз. Другие расстройства, обычно связанные с болезнью Крона, включают артралгии, связанные с болезнью Крона, образование свищей вследствие болезни Крона, колит неопределенной этиологии и дивертикулит.
С. Спондилоартропатии
Считалось, что TNFα играет роль в патофизиологии широкого разнообразия расстройств, включая воспалительные заболевания, такие как спондилоартропатии (см., например, Moeller et аl. (1990) Cytokine 2:162; патент США №5231024; Европейская патентная публикация №260610). Изобретение предоставляет способы применения множественных вариабельных доз для ингибирования активности TNFα у пациента, страдающего спондилоартропатией, причем способ включает введение пациенту антитела, части антитела с тем, чтобы ингибировать активность TNFα у пациента, страдающего спондилоартропатией.
Используемый в настоящем документе термин «спондилоартропатия» или «Спондилоартропатии» используется для обозначения любого из нескольких заболеваний, поражающих суставы позвоночника, причем такие заболевания разделяют общие клинические, рентгенологические и гистологические признаки. Ряд спондилоартропатии разделяют генетические характеристики, т.е., они связаны с аллелью HLA-B27. В одном варианте осуществления, термин «спондилоартропатия» используется для обозначения любого из нескольких заболеваний, поражающих суставы позвоночника, исключая анкилозирующий спондилит, причем такие заболевания разделяют общие клинические, рентгенологические и гистологические признаки. Примеры спондилоартропатий включают анкилозирующий спондилит, псориатический артрит/спондилит, энтеропатический артрит, реактивный артрит или синдром Рейтера и недифференцированные спондилоартропатии. Примеры экспериментальных моделей, используемых для исследования спондилоартропатий, включают ank/ank трансгенных мышей, HLA-B27 трансгенных крыс (см. Taurog et al. (1998) The Spondyloarthritides. Oxford: Oxford University Press).
Автоматическое инъекционное устройство по изобретению можно также использовать для лечения пациентов, имеющих риск развития спондилоартропатий, способами с применением множественных вариабельных доз. Примеры пациентов, имеющих риск развития спондилоартропатий, включают людей, страдающих артритом. Спондилоартропатии могут быть связаны с другими формами артрита, включая ревматоидный артрит. В одном варианте осуществления, антитела используются в способах с применением множественных вариабельных доз для лечения пациента, который страдает спондилоартропатией, связанной с ревматоидным артритом. Примеры спондилоартропатий, которые можно лечить TNFα антителом, описаны ниже.
1. Анкилозирующий спондилит (AS)
Считалось, что фактор опухолевого некроза играет роль в патофизиологии анкилозирующего спондилита (см. Verjans et al. (1991) Arthritis Rheum. 34:486; Verjans et al. (1994) Clin Exp Immunol. 97:45; Kaijtzel et al. (1999) Hum Immunol. 60:140).
Анкилозирующий спондилит (AS) представляет собой воспалительное расстройство, вовлекающее в воспалительный процесс один или более позвонков. AS представляет собой хроническое воспалительное заболевание, которое поражает осевой скелет и/или периферические суставы, включая суставы между позвонками позвоночника и крестцово-подвздошные суставы и суставы между позвоночником и тазом. AS в конечном счете может вызвать объединение или срастание позвонков. Спондилоартропатии, включая AS, могут быть связаны с псориатическим артритом (PsA) и/или воспалительным кишечным заболеванием (IBD), включая язвенный колит и болезнь Крона.
Ранние проявления AS можно определить рентгенологическими тестами, включая компьютерно-томографические (СТ) сканы и магнитно-резонансные (MRI) сканы. Ранние проявления AS часто включают сакроилиит и изменения крестцово-подвздошных суставов, о чем свидетельствует нечеткость кортикальных краев подхрящевой кости с последующими эрозиями и склерозом. Усталость также была отмечена в качестве обычного симптома AS (Duffy et al. (2002) ACR 66th Annual Scientific Meeting Abstract). Соответственно, способы с применением множественных вариабельных доз, включающие введение антитела или его связывающий антиген фрагмент по изобретению, можно использовать для лечения AS.
В одном варианте осуществления, способ с применением множественных вариабельных доз по изобретению используется для лечения спондилоартропатии, связанной с IBD, включая AS. AS часто лечат нестеродиными противовоспалительными лекарственными средствами (NSAID), такими как аспирин или индометацин. Соответственно, TNFα антитело, используемое в способе с применением множественных вариабельных доз по изобретению, можно также вводить в комбинации со средствами, обычно используемыми для снижения воспаления и боли, обычно связанными с анкилозирующим спондилитом.
2. Псориатический артрит
Считалось, что фактор опухолевого некроза играет роль в патофизиологии псориатического артрита (PsA) (Partsch et al. (1998) Ann Rheum Dis. 57:691; Ritchlin et al. (1998) J Pheumatol. 25:1544). Как указано в настоящем документе, псориатический артрит или псориаз, связанный с кожей, относится к хроническому воспалительному артриту, который связан с псориазом, являющимся часто встречающимся хроническим кожным заболеванием, которое вызывает появление красных бляшек на теле. Примерно у 1 из 20 лиц с псориазом разовьется артрит наряду с кожным поражением, а примерно в 75% случаев псориаз предшествует артриту. PsA проявляется разнообразными путями в диапазоне от легкого до тяжелого артрита, причем артрит обычно поражает пальцы и позвоночник. При поражении позвоночника, симптомы аналогичным симптомам анкилозирующего спондилита, как описано выше. TNFα антитело или его связывающий антиген фрагмент, полученные с использованием изобретения, можно использовать для лечения PsA.
PsA иногда связан с калечащим артритом. Калечащий артрит относится к расстройству, которое характеризуется избыточной эрозией кости, приводящей к грубой, эрозивной деформации, которая обезображивает сустав. В одном варианте осуществления, антитела, полученные с использованием способа по изобретению, применяются для лечения калечащего артрита.
3. Реактивный артрит/синдром Рейтера
Считалось, что фактор опухолевого некроза играет роль в патофизиологии реактивного артрита, который также именуется синдромом Рейтера (Braun et al. (1999) Arthritis Rheum. 42(10):2039). Реактивный артрит (ReA) относится к артриту, который осложняет инфекцию в других участках тела, часто после кишечных или мочеполовых инфекций. ReA часто характеризуется определенными клиническими симптомами, включая воспаление суставов (артрит), уретрит, конъюнктивит и поражения кожи и слизистых оболочек. Кроме того, ReA может возникнуть после инфекции, связанной с заболеванием, передаваемым половым путем, или дизентерийной инфекции, включая хламидии, campylobacter, salmonella, или yersinia. Соответственно, антитела, полученные с использованием способа по изобретению, можно применять для лечения ReA.
4. Недифференцированные спондилоартропатии
В одном варианте осуществления, антитела, полученные с использованием способов по изобретению, применяются для лечения пациентов, страдающих недифференцированными спондилоартропатиями (см. Zeidler et al. (1992) Rheum Dis Clin North Am. 18:187). Другие термины, используемые для описания недифференцированных спондилоартропатий, включают серонегативный олигоартрит и недифференцированный олигоартрит. Используемый в настоящем документе термин «недифференцированные спондилоартропатии» относится к расстройству, при котором у пациента проявляются лишь некоторые из симптомов, связанных со спондилоартропатией.
Это состояние обычно наблюдается у молодых взрослых людей, не имеющих IBD, псориаз или классические симптомы AS или синдрома Рейтера. В некоторых случаях, недифференцированные спондилоартропатии могут являться ранним показателем AS. В одном варианте осуществления, изобретение включает введение TNFα антитела или его связывающего антиген фрагмента, полученных с использованием заявленного способа, для лечения недифференцированных спондилоартропатий.
D. Поражения кожи и ногтей
Считалось, что фактор опухолевого некроза играет роль в патофизиологии поражений кожи и ногтей. Взаимозаменяемо используемый в настоящем документе термин «кожное расстройство» или «кожное заболевание» относится к отличным от ран в результате повреждения аномалиям кожи, которые вызвали состояние воспаления. В одном варианте осуществления, кожное расстройство по изобретению представляет собой воспалительное кожное расстройство, при котором кожа характеризуется расширением капилляров, лейкоцитарной инфильтрацией, краснотой, жаром и/или болью. Примеры кожных расстройств включают без ограничения псориаз, обыкновенную пузырчатку, склеродермию, атопический дерматит, саркоидоз, узловую эритему, гнойный гидраденит, плоский лишай, синдром Sweet и витилиго. Используемый в настоящем документе термин «кожное расстройство и поражение ногтей, при котором активность TNFα оказывает повреждающее действие» предназначен для включения поражений кожи и/или ногтей и других расстройств, при которых было показано или подозревалось, что присутствие TNFα у пациента, страдающего этим расстройством, ответственно за патофизиологию расстройства или фактором, который способствует усугублению расстройства, например, псориаза. Соответственно, кожные расстройства и поражение ногтей, при которых активность TNFα оказывает повреждающее действие, представляют собой расстройства, при которых ожидается, что ингибирование активности TNFα облегчит симптомы и/или прогрессирование расстройства. Применение антител, частей антител и других ингибиторов TNFα по изобретению при лечении специфических кожных и ногтевых расстройств обсуждается ниже. В определенных вариантах осуществления, способ лечения по изобретению проводится в комбинации с другим терапевтическим средством, как описано ниже. В одном варианте осуществления, антитела, полученные с использованием способа по изобретению, включающие введение TNFα антитела в комбинации с другим терапевтическим средством используется для лечения псориаза и лечения псориаза, связанного с артритом.
1. Псориаз
Считалось, что фактор опухолевого некроза играет роль в патофизиологии псориаза (Takematsu et al. (1989) Arch Dermatol Res. 281:398; Victor and Gottlieb (2002; J Drugs Dermatol. 1:264).
Используемый в настоящем документе термин «псориаз» относится к кожным расстройствам, связанным с гиперплазией эпидермиса. Примеры псориаза включают без ограничения хронический бляшковидный псориаз, каплевидный псориаз, инвертированный псориаз, пустулезный псориаз, простой псориаз и эритродермический псориаз. Псориаз может быть также связан с другими воспалительными расстройствами, включая воспалительное кишечное заболевание (IBD) и ревматоидный артрит (RA).
Псориаз описан как воспаление кожи (раздражение и краснота), характеризуемое частыми эпизодами красноты, зуда и толстыми, сухими, серебристыми чешуями на коже. В частности, образуются поражения, которые включают первичные и вторичные изменения пролиферации эпидермиса, воспалительные реакции кожи и экспрессии регуляторных молекул, таких как лимфокины и воспалительные факторы. Псориатическая кожа морфологически характеризуется увеличенным оборотом эпидермальных клеток, утолщенным эпидермисом, аномальной кератинизацией, воспалительными клеточными инфильтратами в эпидермисе и полиморфоядерной лейкоцитарной и лимфоцитарной инфильтрацией слоев эпидермиса, приводящей к увеличению базального клеточного цикла. Псориаз часто поражает ногти, на которых проявляется образованием углублений, отделением ногтя, утолщением и изменением цвета. Псориаз часто связан с другими воспалительными расстройствами, например, артритом, включая ревматоидный артрит, воспалительное кишечное заболевание (IBD) и болезнь Крона. Приблизительно у одной трети пациентов с псориазом имеется также псориатический артрит (PsA), который, как описано выше, вызывает тугоподвижность, отек суставов, боль и снижение диапазона движения (Greaves et al. (1995) N. Eng. J. Med. 332:581).
О псориазе чаще всего свидетельствуют поражения в области туловища, локтевых суставов, коленных суставов, волосистой кожи головы, кожных складок или ногтей пальцев рук, но он может поражать любую или все части кожи. Обычно, продвижение новых клеток кожи вверх из нижних слоев на поверхность занимает примерно 1 месяц. При псориазе этот процесс занимает лишь несколько дней, приводя к скоплению мертвых клеток кожи и образованию толстой чешуи. Симптомы псориаза включают: сухие или красные кожные бляшки, покрытые серебристыми чешуями; приподнятые бляшки кожи, сопровождающиеся красными границами, которые могут растрескиваться и становиться болезненными и которые обычно локализуются на локтях, коленях, туловище, волосистой коже головы и кистях рук; поражения кожи, включая пустулы, растрескивание кожи и красноту кожи; острую или тупую боль в суставах, которая может быть связана с артритом, например, псориатическим артритом.
Лечение по поводу псориаза часто включает местные кортикостероиды, аналоги витамина D, и применяемые местно или перорально ретиноиды, или их комбинации. В одном варианте осуществления, TNFα антитело по изобретению вводится в комбинации с одним из этих обычных средств лечения или в присутствии их. Дополнительные терапевтические средства, которые можно комбинировать с TNFα антителом, полученным с использованием способов по изобретению, для лечения псориаза, более детально описаны ниже.
Диагностика псориаза обычно основана на виде кожи. Кроме того, для исключения других кожных расстройств может потребоваться биопсия кожи или соскабливание и культивирование кожных бляшек. Для выявления псориатического артрита в случае наличия и стойкого характера суставной боли можно использовать рентгеновское исследование.
Мониторинг улучшения состояния при псориазе у пациента можно проводить с помощью балльной оценки показателя площади и тяжести псориаза (PASI) у пациента. Способ определения PASI был описан в документах Fredriksson и Pettersson (1978) Dermatologica 157:238 и Marks et al. (1989) Arch Dermatol 125:235. Вкратце, этот показатель основан на оценке четырех анатомических участков, включая голову, верхние конечности, туловище и нижние конечности, на наличие эритемы, уплотнения и слущивания, с использование шкалы из 5 пунктов (0 = отсутствие симптомов; 1 = незначительные; 2 = умеренные; 3 = выраженные; 4 = очень выраженные). На основании степени поражений в данном анатомическом участке, пораженная область обозначается присвоенной ей цифровой величиной (0=0; 1 = <10%; 2 = 10-29%; 3 = 30-49%; 4 = 50-69%; 5 = 70-89%; 6 = 90-100%). Затем рассчитывают балльную оценку PASI, где возможный диапазон балльной оценки PASI составляет от 0,0 до 72,0, причем самая высокая балльная оценка представляет полную эритродермию самой тяжелой степени.
В одном варианте осуществления изобретения, TNFα антитело используется для лечения псориаза, включая хронический бляшковидный псориаз, каплевидный псориаз, инвертированный псориаз, пустулезный псориаз, простой псориаз и эритродермический псориаз, псориаз может быть также связан с другими воспалительными расстройствами, включая воспалительное кишечное заболевание (IBD) и ревматоидный артрит (RA). В другом варианте осуществления, TNFα антитело, такое как адалимумаб, используется для лечения пациентов, у которых имеется псориаз в комбинации с PsA. Специфические типы псориаза, включенные в способы лечения по изобретению, детально описаны ниже.
а. Хронический бляшковидный псориаз Считалось, что фактор опухолевого некроза играет роль в патофизиологии хронического бляшковидного псориаза (Asadullah et al. (1999) Br J Dermatol. 141:94). Хронический бляшковидный псориаз (также именуемый простым псориазом) представляет собой самую распространенную форму псориаза. Хронический бляшковидный псориаз характеризуется приподнятыми покрасневшими бляшками кожи в диапазоне размера от монеты до гораздо более крупного. При хроническом бляшковидном псориазе, бляшки могут быть одиночными или множественными, они могут варьироваться по размеру от нескольких миллиметров до нескольких сантиметров. Бляшки обычно красные с шелушащейся поверхностью и отражают свет при осторожном соскабливании, создавая «серебристый» эффект. Поражения при хроническом бляшковидном псориазе (которые часто являются симметричными) возникают по всему телу, но преимущественно на разгибательных поверхностях, включая коленную, локтевую, пояснично-крестцовую области, волосистую кожу головы и ногти. Иногда хронический бляшковидный псориаз может возникнуть на половом члене, вульве и изгибах кожи, но шелушение обычно отсутствует. Диагностика у пациентов с хроническим бляшковидным псориазом обычно основана на описанных выше клинических признаках. В частности, распределение, цвет и типичное серебристое шелушение поражения при хроническом бляшковидном псориазе характерны для хронического бляшковидного псориаза.
b. Каплевидный псориаз
Каплевидный псориаз относится к форме псориаза с характерными шелушащимися бляшками в форме капель воды. Воспалительная гиперемия каплевидного псориаза в целом возникает после инфекции, особенно, стрептококковой инфекции горла. Диагностика каплевидного псориаза обычно основана на виде кожи, и том, что часто в анамнезе имеется недавняя ангина.
с. Инвертированный псориаз
Инвертированный псориаз представляет собой форму псориаза, при которой у пациента имеются гладкие, обычно влажные области кожи, которые являются красными и воспаленными, которые отличаются от шелушения, связанного с бляшковидным псориазом. Инвертированный псориаз также именуется интертригинозным псориазом или флексуральным псориазом. Инвертированный псориаз возникает преимущественно в подмышечных ямках, паху, под молочными железами и в других кожных складках вокруг половых органов и ягодиц, и, в результате локализации проявлений, трение и выделение пота могут вызвать раздражение пораженных областей.
d. Пустулезный псориаз
Пустулезный псориаз, также именуемый ладонно-подошвенным псориазом, представляет собой форму псориаза, которая вызывает появление заполненных гноем волдырей, которые варьируются по размеру и локализации, но часто возникают на кистях рук и стопах. Волдыри могут быть локализованными или распространенными по большим площадям тела. Пустулезный псориаз может вызывать болезненность при надавливании или постоянную боль, он может вызвать повышение температуры.
е. Другие псориатические расстройства
Другие примеры псориатических расстройств, которые можно лечить TNFα антителом, доставляемым с использованием способов по изобретению, включают эритродермический псориаз, простой псориаз, псориаз, связанный с IBD, и псориаз, связанный с артритом, включая ревматоидный артрит.
2. Обыкновенная пузырчатка
Обыкновенная пузырчатка представляет собой тяжелое аутоиммунное системное дерматологическое заболевание, которое часто поражает слизистую оболочку ротовой полости и кожу. Считают, что патогенез обыкновенной пузырчатки представляет собой аутоиммунный процесс, который направлен на дерматосомы кожи и слизистой оболочки ротовой полости. В последующем, клетки не прилипают друг к другу. Расстройство проявляется в виде крупных, заполненных жидкостью, склонных к разрыву пузырей, и имеет отчетливый гистологический вид. Противовоспалительные средства являются единственным эффективным терапевтическим средством по поводу этого заболевания, при котором наблюдается высокая смертность. Осложнениями, которые возникают у пациентов, страдающих обыкновенной пузырчаткой, являются не облегчаемая боль, нарушение питания и потеря жидкости и инфекции.
3. Атопический дерматит/экзема
Атопический дерматит (также именуемый экземой) представляет собой хроническое кожное расстройство, характеризуемое шелушащимися и зудящими бляшками. У людей с экземой часто имеется семейный анамнез аллергических состояний, подобных астме, сенной лихорадке или экземе. Атопический дерматит представляет собой реакцию гиперчувствительности (аналогичную аллергии), которая возникает в коже, вызывая хроническое воспаление. Воспаление вызывает зуд и шелушение кожи. Хроническое раздражение и расчесывание могут вызвать утолщение кожи, и она может приобрести текстуру, похожую на кожу. Подверженность воздействию раздражителей внешней среды может усугубить симптомы, так же как сухость кожи, подверженность воздействию воды, изменениям температуры и стрессу.
Субъекты с атопическим дерматитом могут быть идентифицированы определенными симптомами, которые часто включают интенсивный зуд, волдыри с выделением жидкости и образованием коросты, красноту кожи или воспаление вокруг волдырей, сыпь, области сухой, уплотненной кожи, кровоточащие области кожи в результате расчесов и выделения/кровотечение из ушей.
4. Саркоидоз
Саркоидоз представляет собой заболевание, при котором грануломатозное воспаление возникает в лимфатических узлах, легких, печени, глазах, коже и/или других тканях. Саркоидоз включает кожный саркоидоз (саркоидоз кожи) и узловой саркоидоз (саркоидоз лимфатических узлов). Пациентов с саркоидозом можно идентифицировать по симптомам, которые часто включают общий дискомфорт, беспокойство или недомогание; лихорадку; поражения кожи.
5. Узловая эритема
Узловая эритема относится к воспалительному расстройству, которое характеризуется болезненными при надавливании, красными узелками под кожей, обычно на передней поверхности нижних отделов ног. Поражения, связанные с узловой эритемой, часто начинаются в виде плоских, но плотных, горячих красных болезненных объемных образований (в поперечнике приблизительно 1 дюйм). В пределах нескольких дней, поражения могут стать пурпурными и затем в течение нескольких недель постепенно превращаться в коричневатую, плоскую бляшку.
В некоторых случаях, узловая эритема может быть связана с инфекциями, включая стрептококковую инфекцию, кокцидиоидомикоз, туберкулез, гепатит В, сифилис, болезнь кошачьих царапин, туляремию, инфекцию yersinia, лептоспироз, пситтакоз, гистоплазмоз, мононуклеоз (EBV). В других случаях, узловая эритема может быть связана с чувствительностью к определенным лекарственным средствам, включая пероральные контрацептивы, пенициллин, сульфонамиды, сульфоны, барбитураты, гидантоин, фенацетин, салицилаты, йодиды и прогестин. Узловая эритема часто связана с другими расстройствами, включая лейкоз, саркоидоз, ревматизм и язвенный колит.
Симптомы узловой эритемы обычно проявляются на голенях, но поражения могут также возникать на других областях тела, включая ягодицы, икры, лодыжки, бедра и верхние конечности. Другие симптомы у пациентов с узловой эритемой могут также включать лихорадку и недомогание.
6. Гнойный гидраденит
Гнойный гидраденит относится к кожному расстройству, при котором отекшие, болезненные, воспаленные поражения или припухлости развиваются в паховой области и иногда в подмышках и под молочными железами. Гнойный гидраденит возникает, когда выходные протоки апокринных желез блокируются выделяемым потом или неспособны нормально дренировать ввиду неполного развития желез. Выделения, захваченные в железах, принуждают пот и бактерии к поступлению в окружающую ткань, вызывая подкожное уплотнение, воспаление и инфекцию. Гнойный гидраденит ограничивается областями тела, которые содержат апокринные железы. Эти области представляют собой подмышечную, ареолярную сосковую, паховую, промежностную, околоанальную и околопупочную области.
7. Плоский лишай
Считалось, что фактор опухолевого некроза играет роль в патофизиологии плоского лишая (Sklavounou et al. (2000) J Oral Pathol Med. 29:370). Плоский лишай относится к расстройству кожи и слизистых оболочек, приводящему к воспалению, зуду и отчетливым поражениям кожи. Плоский лишай может быть связан с гепатитом С или определенными лекарственными средствами.
8. Синдром Sweet
Считалось, что воспалительные цитокины, включая фактор опухолевого некроза играет роль в патофизиологии синдрома Sweet (Reuss-Borst et al. (1993) Br J Haematol. 84:356). Синдром Sweet, который был описан R.D. Sweet в 1964 г, характеризуется внезапным началом лихорадки, лейкоцитоза и кожного высыпания. Высыпание состоит из болезненных при надавливании, эритематозных, четко ограниченных папул и бляшек, которые микроскопически проявляются как плотные нейтрофильные инфильтраты. Эти поражения могут появляться в любых местах, но преимущественно развиваются в верхней части тела, включая лицо. Отдельные поражения часто описываются как псевдовезикулярные или псевдопустулезные, но могут быть явно пустулезными, буллезными или язвенными. У пациентов с синдромом Sweet также часто отмечалось поражение ротовой полости и глаз (конъюнктивит или эписклерит). Лейкоз также был связан с синдромом Sweet.
9. Витилиго
Витилиго относится к состоянию кожи, при котором имеется потеря пигмента из областей кожи, приводящая к белым пятнам неправильной формы с нормальной текстурой кожи. Поражения, характерные для витилиго, имеют вид плоских депигментированных областей. Края поражений резко ограничены, но имеют неправильную форму. Часто пораженные области у пациентов с витилиго включают лицо, локти и колени, кисти рук и стопы, и половые органы.
10. Склеродермия
Считалось, что фактор опухолевого некроза играет роль в патофизиологии склеродермии (Tutuncu et al. (2002) Clin Exp Rheumatol. 20(6 Suppl 28):S146; Mackiewicz et al. (2003) Clin Exp Rheumatol. 21:41; Murota et al. (2003) Arthritis Rheum. 48:1117).
Склеродермия относится к диффузному заболеванию соединительной ткани, характеризуемому изменениями в коже, кровеносных сосудах, скелетных мышцах и внутренних органах. Склеродермия также именуется синдромом CREST или прогрессирующим системным склерозом, и обычно поражает людей в возрасте 30-50 лет. Женщины поражаются чаще, чем мужчины.
Причина склеродермии неизвестна. Заболевание может вызвать местные или системные симптомы. Течение и тяжесть заболевания у пораженных лиц широко варьируется. Избыточные отложения коллагена в коже и других органах вызывает развитие симптомов. Также возникает повреждение мелких кровеносных сосудов внутри кожи и пораженных органов. В коже может возникнуть изъязвление, обызвествление и изменения пигментации. Системные признаки могут включать фиброз и дегенеративные изменения сердца, легких, почек и желудочно-кишечного тракта.
У пациентов, страдающих склеродермией, проявляются определенные клинические признаки, включая обеление, синеву или красноту пальцев кистей рук и пальцев стоп в ответ на воздействие тепла и холода (феномен Рейно), боль, тугоподвижность и отек пальцев и суставов, утолщение кожи и лоснящиеся кисти рук и лоб, пищеводный рефлюкс или изжогу, затруднение глотания и одышку. Другие клинические симптомы, используемые для диагностики склеродермии, включают повышенную скорость осаждения эритроцитов (ESR), повышенный ревматоидный фактор (RF), положительный тест на противоядерные антитела, анализ мочи, который выявляет белок и микроскопическую кровь, рентгенография грудной клетки, которая может выявить фиброз, и исследования легочной функции, которые выявляют рестриктивное легочное заболевание.
11. Поражения ногтей
Поражения ногтей включают любую аномалию ногтей. Используемый в настоящем документе термин «поражение ногтей» или «заболевание ногтей» относится к состояниям, при которых ногти пальцев кистей рук или пальцев стоп приобретают аномальный цвет, форму, текстуру или толщину. Определенные поражения ногтей включают без ограничения образование углублений, койлонихию, линии Beau, ложкообразные ногти, онихолизис, желтые ногти, ногтевой птеригиум (наблюдаемый при плоском лишае) и лейконихию. Образование углублений характеризуется присутствием небольших углублений на ногтевой поверхности. Гребни или линейные возвышения могут развиваться вдоль ногтя, возникая «в продольном» или «поперечном» направлении. Линии Beau представляют собой линейные углубления, которые возникают в «поперечном» направлении (поперек) на ногтях кистей рук. Лейконихия описывает белые полосы или пятна на ногтях. Койлонихия представляет собой аномальную форму ногтей кистей рук, где ноготь имеет приподнятые гребни и является тонким и вогнутым. Койлонихия часто связана с дефицитом железа.
Поражения ногтей, которые можно лечить TNFα антителом по изобретению, также включают псориатические поражения ногтей. Псориатические поражения ногтей включают изменения ногтей, которые можно связать с псориазом. В некоторых случаях, псориаз может возникать только в ногтях и нигде больше на теле. Псориатические изменения в ногтях имеют диапазон от легких до тяжелых, в целом отражая степень псориатического поражения ногтевой пластинки, ногтевой матрицы, т.е., ткани, из которой растет ноготь, ногтевого ложа, т.е., ткани под ногтем, и кожи в основании ногтя. Поражение ногтевого ложа гнойным типом псориаза может привести к потере ногтя. Изменения ногтей при псориазе подпадают под общие категории, которые могут возникнуть по отдельности или все вместе. В одной категории псориатических ногтей, ногтевая пластинка имеет глубокие ямки, вероятно вследствие дефектов роста ногтей, вызванного псориазом. В другой категории, ноготь имеет цвет, измененный в желтый или желто-розовый, возможно, вследствие псориатического поражения ногтевого ложа. Третий подтип псориатических ногтей характеризуется белыми областями, которые появляются под ногтевой пластинкой. Белые области в действительности представляют собой воздушные пузырьки, где ногтевая пластинка становится отслоенной от ногтевого ложа. Вокруг ногтя может также быть покрасневшая кожа. О четвертой категории свидетельствует разрушение ногтевой пластинки на желтоватые бляшки, т.е., ониходистрофия, вероятно, вследствие псориатического поражения ногтевой матрицы. Пятая категория характеризуется полной потерей ногтя вследствие псориатического поражения матрицы ногтя и ногтевого ложа.
Антитела, полученные с использованием способов по изобретению, можно также использовать для лечения поражений ногтей, часто связанных с плоским лишаем. Ногти у пациентов с плоским лишаем часто проявляют истончение и шероховатость поверхности ногтевой пластинки с продольными гребнями или ногтевым птеригием.
Антитела, полученные с использованием изобретения, можно использовать для лечения поражений ногтей, таких как поражения, описанные в настоящем документе. Часто поражения ногтей связаны с кожными расстройствами. В одном варианте осуществления, изобретение включает лечение по поводу поражений ногтей с использованием TNFα антитела и способов и композиций по изобретению. В другом варианте осуществления, поражение ногтей связано с другим расстройством, включая кожное расстройство, такое как псориаз. В другом варианте осуществления, поражение, связанное с поражением ногтей, представляет собой артрит, включая псориатический артрит.
12. Другие расстройства кожи и ногтей
Антитела, полученные с использованием способа по изобретению, можно использовать для лечения других расстройств кожи и ногтей, таких как хронический актинический дерматит, буллезная псевдопузырчатка и гнездная алопеция. Хронический актинический дерматит (CAD) также именуется дерматитом вследствие светочуствительности/актиническим ретикулоидным синдромом (PD/AR). CAD представляет собой состояние, при котором кожа становится воспаленной, в частности, в областях, которые подвергались воздействию солнечного света, или искусственного света. Обычно, у пациентов с CAD имеются аллергии к определенным веществам, которые вступают в контакт с их кожей, в частности, различным цветам, деревьям, духам, солнцезащитным средствам и каучуковым составам. Буллезная псевдопузырчатка относится к кожному расстройству, характеризуемому образование крупных волдырей на туловище и конечностях. Гнездная алопеция относится к потере волос, характеризуемой круглыми пятнами полного облысения на волосистой коже головы или бороде.
Е. Другие расстройства, связанные с TNFα
В одном варианте осуществления, изобретение описывает способ введения множества вариабельных доз для лечения расстройств, связанных с TNFα, при которых активность TNFα оказывает повреждающее действие, причем способ включает введение пациенту TNFα антитела с целью лечения указанного расстройства, связанного с TNFα. Примеры расстройств, связанных с TNFα, при которых активность TNFa оказывает повреждающее действие, обсуждаются ниже.
1. Ювенильный артрит
Считалось, что фактор опухолевого некроза играет роль в патофизиологии ювенильного артрита, включая ювенильный ревматоидный артрит (Grom et al. (1996) Arthritis Rheum. 39:1703; Mangge et al. (1995) Arthritis Rheum. 8:211). В одном варианте осуществления, TNFα антитело используется для лечения ювенильного ревматоидного артрита с использованием способов и композиций по изобретению.
Используемый в настоящем документе термин «ювенильный ревматоидный артрит» или "JRA" относится к хроническому, воспалительному заболеванию, которое возникает в возрасте до 16 лет, которое может вызвать повреждение сустава или соединительной ткани. JRA также именуется ювенильным хроническим полиартритом и болезнью Still.
JRA вызывает воспаление и тугоподвижность суставов в течение более чем 6 недель у ребенка в возрасте 16 лет или менее. Воспаление вызывает красноту, отек, тепло и болезненность в суставах. Может быть поражен любой сустав, и воспаление может ограничить подвижность пораженных суставов. Один тип JRA может также поражать внутренние органы.
JRA часто классифицируется на 3 группы по количеству пораженных суставов, симптомам и наличию или отсутствию определенных антител, обнаруживаемых анализом крови. Эти классификации помогают врачу определить, как заболевание будет прогрессировать, и поражены ли внутренние органы или кожа. Классификации JRA включают следующие:
а. JRA с поражением небольшого количества суставов, при котором поражаются четыре или меньшее количество суставов. JRA с поражением небольшого количества суставов представляет собой самую распространенную форму JRA и обычно поражает крупные суставы, такие как коленные суставы.
b. Многосуставной JRA, при котором поражаются пять или более суставов. Чаще всего поражаются мелкие суставы, такие как суставы кистей рук и стоп, но заболевание может также поражать крупные суставы.
с. Системный JRA характеризуется отеком суставов, лихорадкой, легкой кожной сыпью и может также поражать внутренние органы, такие как сердце, печень, селезенка и лимфатические узлы. Системный JRA также именуется болезнью Still. У небольшой процентной доли этих детей развивается артрит во многих суставах, и у них может быть тяжелый артрит, который продолжается во взрослом возрасте.
2. Эндометриоз
Считалось, что фактор опухолевого некроза играет роль в патофизиологии эндометриоза, поскольку у женщин с эндометриозом имеются возросшие брюшинные уровни TNF (Eisermann el al. (1988) Fertil Steril 50:573; Halme (1989) Am J Obstet Gynecol 161:1718; Mori et al. (1991) Am J Reprod Immunol 26:62; .Taketani et al. (1992) Am J Obstet Gynecol 167:265; Overton et al. (1996) Hum Reprod 1996; 11:380).
В одном варианте осуществления, TNFa антитело можно использовать для лечения эндометриоза. Используемый в настоящем документе термин «эндометриоз» относится к состоянию, при котором ткань, в норме выстилающая матку (эндометрий), растет в других областях тела, вызывая боль, нерегулярные менструации и часто бесплодие.
3. Простатит
Считалось, что фактор опухолевого некроза играет роль в патофизиологии простатита, поскольку у мужчин с хроническим простатитом и хронической болью в тазовой области имеются значительно более высокие уровни TNF и IL-1 в семенной жидкости, по сравнению с контролями (Alexander et al. (1998) Urology 52:744; Nadler et al. (2000) J Urol 164:214; Orhan et al. (2001) Int J Urol 8:495). Кроме того, на крысиной модели простатита, уровни TNF были также повышены, по сравнению с контролями (Asakawa et al. (2001) Hinyokika Kiyo 47:459; Harris et al. (2000) Prostate 44:25). В одном варианте осуществления, TNFα антитело по изобретению используется для лечения простатита.
Используемый в настоящем документе термин «простатит» относится к воспалению предстательной железы. Простатит также именуется синдромом боли в тазовой области. Простатит проявляется в разнообразных формах, включая не бактериальный простатит, бактериальный простатит и острый простатит. Острый простатит относится к воспалению предстательной железы, которое развивается внезапно. Острый простатит обычно вызван бактериальной инфекцией предстательной железы. Хронический простатит представляет собой воспаление предстательной железы, которое развивается постепенно, продолжается в течение продолжительного периода, и обычно имеет слабо выраженные симптомы. Хронический простатит также обычно вызван бактериальной инфекцией.
4. Хороидальная неоваскуляризация
Считалось, что фактор опухолевого некроза играет роль в патофизиологии хороидальной неоваскуляризации. Например, в хирургически иссеченных хороидальных неоваскулярных оболочках, неоваскулярные сосуды положительно окрашивались и на TNF, и на IL-1 (Oh H et al. (1999) Invest Ophthalmol Vis Sci 40:1891). В одном варианте осуществления, TNFα антитело используется для лечения хороидальной неоваскуляризации. Используемый в настоящем документе термин «хороидальная неоваскуляризация» относится к росту новых кровеносных сосудов, которые исходят из сосудистой оболочки глаза, через разрушение оболочки Bruch в подсетчаточный пигментный эпителий (sub-RPE) или подсетчаточное пространство. Хороидальная неоваскуляризация (CNV) представляет собой основную причину потери зрения у пациентов, страдающих этим состоянием.
5. Ишиас
Считалось, что фактор опухолевого некроза играет роль в патофизиологии ишиаса (Ozaktay et al. (2002) Eur Spine J. 11:467; Brisby et al. (2002) Eur Spine J. 11:62). В одном варианте осуществления, TNFα антитело используется для лечения ишиаса. Используемый в настоящем документе термин «ишиас» относится к состоянию, включающему нарушенное движение и/или ощущение в нижней конечности, вызванное повреждением седалищного нерва. Ишиас также обычно именуется нейропатией седалищного нерва и дисфункцией седалищного нерва. Ишиас представляет собой форму периферической нейропатии. Он возникает, когда имеется повреждение седалищного нерва, расположенного в задней части нижней конечности. Седалищный нерв контролирует мышцы задней части коленного сустава и нижней части ноги и обеспечивает чувствительность задней части бедра, части нижнего отдела ноги и подошвы стопы. Ишиас может быть показателем другого расстройства, включая грыжевое выпячивание межпозвонкового диска поясничной области, стеноза спинномозгового канала, дегенеративного заболевания диска, перешеечного спондилоистеза и синдрома шишковидного тела.
6. Синдром Шегрена
Считалось, что фактор опухолевого некроза играет роль в патофизиологии синдрома Шегрена (Koski et al. (2001) Clin Exp Rheumatol. 19:131). В одном варианте осуществления, TNFα антитело по изобретению используется для лечения синдрома Шегрена. Используемый в настоящем документе термин «синдром Шегрена» относится к системному воспалительному расстройству, характеризуемому сухостью во рту, уменьшенным образованием слезной жидкости и сухостью других слизистых оболочек, и он часто связан с аутоиммунными ревматическими расстройствами, такими как ревматоидный артрит. Сухость глаз и ротовой полости представляют собой самые распространенные симптомы этого синдрома. Симптомы могут возникать отдельно или с симптомами, связанными с ревматоидным артритом или другими заболеваниями соединительной ткани. Может наблюдаться связанное с синдромом увеличение слюнных желез. Может возникнуть поражение других органов. Синдром может быть связан с ревматоидным артритом, системной красной волчанкой, склеродермией, полимиозитом и другими заболеваниями.
7. Увеит
Считалось, что фактор опухолевого некроза играет роль в патофизиологии увеита (Wakefield and Lloyd (1992) Cytokine 4:1; Woon et al. (1998) Curr Eye Res. 17:955). В одном варианте осуществления, TNFα антитело по изобретению используется для лечения увеита. Используемый в настоящем документе термин «увеит» относится к воспалению сосудистой оболочки глазного яблока, которая представляет собой слой между склерой и сетчаткой и включает радужку, ресничное тело и собственно сосудистую оболочку глаза. Увеит также обычно именуется иритом, парс планитом, хороидитом, хориоретинитом, передним увеитом и задним увеитом. Самой распространенной формой увеита является передний увеит, который включает воспаление передней части глаза, которая обычно изолирована от радужки. Это состояние часто называется иритом. В одном варианте осуществления, термин увеит относится к воспалению сосудистой оболочки глазного яблока, которое исключает воспаление, связанное с аутоиммунным заболеванием, т.е., исключает аутоиммунный увеит.
8. Влажная дегенерация желтого пятна
Считалось, что фактор опухолевого некроза играет роль в патофизиологии влажной дегенерации желтого пятна. В одном варианте осуществления, TNFα антитело по изобретению используется для лечения влажной дегенерации желтого пятна. Используемый в настоящем документе термин «дегенерация желтого пятна» относится к расстройству, которое поражает желтое пятно (центральную часть сетчатки глаза) и вызывает снижение остроты зрения и возможную потерю центрального зрения. У пациентов с влажной дегенерацией желтого пятна развиваются новые кровеносные сосуды под сетчаткой, что вызывает кровоизлияние, отек и образование рубцовой ткани.
9. Остеопороз
Считалось, что фактор опухолевого некроза играет роль в патофизиологии остеопороза (Tsutsumimoto et аl. (1999) J Bone Miner Res. 14:1751). Термин «остеопороз» используется для обозначения расстройства, характеризуемого прогрессирующей потерей плотности кости и истончение костной ткани. Остеопороз возникает, когда организм не может формировать достаточное количество новой кости, или когда слишком большое количество старой кости реабсорбируется организмом, или имеют место оба эти процесса. TNFa антитело или его связывающий антиген фрагмент по изобретению можно использовать для лечения остеопороза.
10. Остеоартрит
Считалось, что фактор опухолевого некроза играет роль в патофизиологии остеоартрита (Venn et al. (1993) Arthritis Rheum. 36:819; Westacott et al. (1994) J Rheumatol. 21:1710). Остеоартрит (ОА) также именуется гипертрофическим остеоартритом, остеоартрозом и дегенеративным заболеванием суставов. ОА представляет собой дегенеративное заболевание суставов скелета, которое поражает определенные суставы, обычно коленные суставы, тазобедренные суставы, суставы кистей рук и позвоночника у взрослых людей всех возрастов. ОА характеризуется рядом следующих проявлений, включая дегенерацию и истончение суставного хряща, с ассоциированным развитием «язв» или кратеров, образованием остеофитов, гипертрофией кости по краям и изменения синовиальной оболочки и увеличение пораженных суставов. Кроме того, остеоартрит сопровождается болью и тугоподвижностью, в частности, после продолжительной активности. Антитело или его связывающий антиген фрагмент по изобретению можно использовать для лечения остеоартрита. Характерные рентгенологические признаки остеоартрита включают сужение суставного пространства, подхрящевой склероз, остеофитоз, образование подхрящевых кист, свободное костное тело (или «суставная мышь»).
Лекарственные средства, используемые для лечения остеоартрита, включают разнообразные нестероидные противовоспалительные препараты (NSAID). Кроме того, ингибиторы СОХ2, включая целебрекс, виоксс и бекстра, и эторикоксиб также используются для лечения ОА. Стероиды, которые инъецируются непосредственно в сустав, можно также применять для снижения воспаления и боли. В одном варианте осуществления, TNFα антитела по изобретению вводятся в комбинации с NSAID, ингибитором СОХ2 и/или стероидами.
11. Другие заболевания
Способы по изобретению можно также использовать для лечения различных других расстройств, при которых активность TNFα оказывает повреждающее воздействие. Примеры других заболеваний и расстройств, при которых считалось, что активность TNFα играет роль в патофизиологии, и, таким образом, их можно лечить с использованием антитела или части антитела по изобретению, включают воспалительные поражения костей, костное резорбционное заболевание, нарушения свертываемости, ожоги, реперфузионное повреждение, образование келоида, образование рубцовой ткани, пирексию, заболевание периодонта, ожирение, радиационную токсичность, возрастную кахексию, болезнь Альцгеймера, отек мозга, воспалительное повреждение мозга, рак, синдром хронической усталости, дерматомиозит, лекарственные реакции, такие как синдром Стивенса-Джонсона и реакция Яриша-Герксхайнера, отек в спинном мозге и вокруг него, семейные периодические лихорадки, синдром Фелти, фиброз, гломерулонефриты (например, пост-стрептококковый гломерулонефрит или IgA нефропатия), ослабление фиксации протезов, микроскопический полиангиит, смешанное расстройство соединительной ткани, множественную миелому, рак и кахексию, расстройство множественных органов, миелодиспластический синдром, орхит, остеолизис, панкреатит, включая острый, хронический панкреатит и абсцесс поджелудочной железы, полимиозит, прогрессирующую почечную недостаточность, псевдоподагру, гангренозную пиодермию, рецидивирующий полихондрит, ревматическое сердечное заболевание, саркоидоз, склерозирующий холангит, инсульт, реконструктивную операцию по поводу торакоабдоминального отдела аорты (ТААА), периодический синдром, связанный с рецепторами TNF (TRAPS), симптомы, связанные с вакцинацией против желтой лихорадки, воспалительные заболевания, связанные с ушами, хроническое ушное воспаление, хронический средний отит с холестеатомой или без нее, ушное воспаление, миотоз, рак яичников, рак ободочной и прямой кишки, терапию, связанный с лечением индуцированный воспалительный синдром (например, синдромы после введения IL-2) и расстройство, связанное с реперфузионным повреждением.
Способы по изобретению можно также использовать для лечения следующих заболеваний: синдром приобретенного иммунодефицита, заболевания, связанные с приобретенным иммунодефицитом, приобретенная пернициозная анемия, острые коронарные синдромы, острая и хроническая боль (различные формы боли), острый идиопатический полиневрит, острое иммунное заболевание, связанное с трансплантацией органов, острое или хроническое иммунное заболевание, связанное с трансплантацией органов, острая воспалительная демиелинизирующая полирадикулонейропатия, острая ишемия, острое печеночное заболевание, острый ревматизм, острый поперечный миелит, болезнь Аддисона, (острый) респираторный дистресс синдром взрослых, болезнь Стилла взрослых, алкогольный цирроз, вызванное алкоголем поражение печени, аллергические заболевания, аллергия, облысение, гнездное облысение, болезнь Альцгеймера, анафилаксия, анкилозирующий спондилит, легочное заболевание, связанное с анкилозирующим спондилитом, синдром антител против фосфолипидов, апластическая анемия, артериосклероз, артропатия, астма, атероматозное заболевание/артериосклероз, артериосклероз, атопическая аллергия, атопическая экзема, атопический дерматит, атопический аутоиммунный гипотиреоз, аутоиммунное буллезное заболевание, аутоиммунный дерматит, аутоиммунный диабет, аутоиммунное расстройство, связанное со стрептококковой инфекцией, аутоиммунная энтеропатия, аутоиммунный лимфолейкоз, аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунная потеря слуха, аутоиммунный лимфопролиферативный синдром (ALPS), гипогликемия, опосредованная аутоиммунными процессами, аутоиммунный миокардит, аутоиммунная нейтропения, аутоиммунная преждевременная недостаточность яичников, аутоиммунная тромбоцитопения (AITP), аутоиммунное заболевание щитовидной железы, аутоиммунный увеит, облитерирующий бронхиолит, болезнь Бехчета, блефарит, бронхоэктазия, буллезная псевдопузырчатка, кахексия, сердечнососудистые заболевания, катастрофический антифосфолипидный синдром, чревная болезнь, шейный спондилез, хламидиевая инфекция, холестаз, хронический активный гепатит, жировая дистрофия печени, хроническая эозинофильная пневмония, синдром хронической усталости, хроническое иммунное заболевание, связанное с трансплантацией органов, хроническая ишемия, хронические заболевания печени, хронический мышечнокожный кандидоз, рубцовая псевдопузырчатка, клинически изолированный синдром (CIS) с риском рассеянного склероза, обычная варьирующаяся иммунная недостаточность (обычная вариабельная гипогаммаглобулинемия), заболевание соединительной ткани, связанное с интерстициальным легочным заболеванием, конъюнктивит, гемолитическая анемия с положительной реакцией Кумбса, психиатрическое расстройство с началом в детском возрасте, хроническое обструктивное легочное заболевание (COPD), болезнь Крона, криптогенный аутоиммунный гепатит, криптогенный фиброзирующий альвеолит, дакриоцистит, депрессия, склеродермный дерматит, дерматомиозит, легочное заболевание, связанное с дерматомиозитом/полимиозитом, диабетическая ретинопатия, сахарный диабет, дилятационная миокардиопатия, дискоидная красная волчанка, грыжевое выпячивание межпозвонковых дисков, пролапс межпозвонковых дисков, диссеминированное внутрисосудистое свертывание, лекарственный гепатит, лекарственное интерстициальное легочное заболевание, лекарственная иммунная гемолитическая анемия, эндокардит, эндометриоз, эндофтальмит, энтеропатический синовиит, эписклерит, полиморфная эритема, большая полиморфная эритема, женское бесплодие, фиброз, пневмосклероз, псевдопузырчатка беременности, гигантоклеточный артериит (GCA), гломерулонефриты, зобный аутоиммунный гипотиреоз (болезнь Хашимото), синдром Гудпасчура, подагрический артрит, болезнь трансплантат против хозяина (GVHD), болезнь Грэйвса, инфекция стрептококками группы В (GBS), синдром Жуллена-Барре (GBS), легочное заболевание, связанное с гемосидерозом, сенная лихорадка, сердечная недостаточность, гемолитическая анемия, пурпура Геноха-Шенлейна, гепатит В, гепатит С, синдром Хьюджеса, хорея Хантингтона, гипертиреоз, гипопаратиреоз, идиопатическая лейкопения, идиопатическая тромбоцитопения, идиопатическая болезнь Паркинсона, идиопатическая интерстициальная пневмония, идиосинкратическое заболевание печени, аллергия, опосредованная IgE, иммунная гемолитическая анемия, миозит с тельцами включения, инфекционные заболевания, инфекционное глазное воспалительное заболевание, воспалительное кишечное заболевание, воспалительное демиелинирующее заболевание, воспалительное заболевание сердца, воспалительное почечное заболевание, инсулинзависимый сахарный диабет, интерстициальный пневмонит, IPF/UIP (идиопатический пневмосклероз/обычная интерстициальная пневмония), ирит, ювенильный хронический артрит, ювенильная пернициозная анемия, ювенильный ревматоидный артрит, болезнь Кавасаки, кератит, сухой кератоконъюнктивит, болезнь Куссмауля или болезнь Куссмауля-Мейера, паралич Лэндри, гистиоцитоз клеток Лангерганса, линейная IgA болезнь, «мраморный» васкулит, артрит Лайма, лимфоцитарное инфильтративное легочное заболевание, дегенерация желтого пятна, мужское бесплодие - идиопатическое или без уточнения диагноза, злокачественные заболевания, микроскопический васкулит почек, микроскопический полиангиит, легочное заболевание, связанное со смешанным заболеванием соединительной ткани, болезнь Бехтерева, расстройства двигательных нейронов, псевдопузырчатка слизистых оболочек, рассеянный склероз (все подтипы: первичный прогрессирующий, вторичный прогрессирующий, рецидивирующий ремитирующий и т.д.), множественная органная недостаточность, миалгический энцефалит/болезнь Ryal Free, тяжелая миастения, миелодиспластический синдром, инфаркт миокарда, миокардит, нефротический синдром, расстройства нервных корешков, нейропатия, не алкогольный стеатогепатит, не-А не-В гепаптит, неврит зрительного нерва, отторжение трансплантатов органов, остеоартрит, остеолизис, рак яичников, яичниковая недостаточность, панкреатит, паразитарные заболевания, болезнь Паркинсона, JRA с поражением небольшого количества суставов, листовидная пузырчатка, обыкновенная пузырчатка, окклюзивное заболевание периферических артерий (PAOD), заболевания периферических сосудов (PVD), заболевания периферических артерий (PAD), факогенный увеит, флебит, узелковый полиартериит (или узелковый периартериит), полихондрит, ревматическая полимиалгия, полиоз, многосуставной JRA, синдром полиэндокринной недостаточности, полимиозит, недостаточность множества желез I типа и недостаточность множества желез II типа, ревматическая полимиалгия (PMR), постинфекционное интерстициальное легочное заболевание, поствоспалительное интерстициальное легочное заболевание, синдром расстройств после искусственного кровообращения, преждевременная яичниковая недостаточность, первичный билиарный цирроз, легочная микседема, первичный паркинсонизм, первичный склерозирующий холангит, первичный склерозирующий гепатит, первичный васкулит, рак предстательной железы и прямой кишки и гематопоэтические злокачественные заболевания (лейкоз и лимфома), простатит, псориаз, псориаз 1 типа, псориаз 2 типа, псориатический артрит, псориатическая артропатия, легочная гипертензия, вызванная заболеванием соединительной ткани, легочное проявление узелкового полиартериита, чистая эритроцитарная аплазия, первичная надпочечниковая недостаточность, радиационной фиброз, реактивный артрит, болезнь Рейтера, рецидивирующий нейромиелит зрительного нерва, почечное заболевание с неустановленным диагнозом, рестеноз, ревматоидный артрит, интерстициальное легочное заболевание, связанное с ревматоидным артритом, ревматическое заболевание сердца, SAPHO (синовиит, угри, пустулез, гиперостоз и остеит), саркоидоз, шизофрения, синдром Шмидта, склеродермия, вторичный амилоидоз, шоковое легкое, склерит, ишиас, вторичная надпочечниковая недостаточность, синдром сепсиса, септический артрит, септический шок, серонегативная артропатия, заболевание соединительной ткани, связанное с силиконом, заболевание легких, связанное с синдромом Шегрена, синдром Шегрена, дерматоз Фекддона-Вилкинсона, аутоиммунитет к сперме, спондилоартропатия, анкилозирующий спондилит, спорадический синдром Стивенса-Джонсона (SJS), болезнь Стилла, инсульт, симпатическая офтальмия, синдром системной воспалительной реакции, системная красная волчанка, легочное заболевание, связанное с системной красной волчанкой, системный склероз, интерстициальное легочное заболевание, связанное с системным склерозом, болезнь/артериит Такаясу, артериит височной артерии, заболевания, опосредованные Th2 типом и Тh1 типом, тироидит, синдром токсического шока, токсоплазматический ретинит, токсический эпидермальный некролизис, поперечный миелит, TRAPS (рецептор фактора опухолевого некроза, устойчивость к инсулину типа В с очерняющим акантозом, аллергическая реакция 1 типа, аутоиммунный гепатит типа 1 (классический аутоиммунный или люпоидный гепатит), аутоиммунный гепатит типа 2 (гепатит, вызванный антителами против LKM (микросом печени/почек), диабет II типа, артропатия при язвенном колите, язвенный колит, сыпь, обычная интерстициальная пневмония (UIP), увеит, васкулитное диффузное легочное заболевание, васкулит, весенний конъюнктивит, вирусный ретинит, витилиго, синдром Фогта-Коянаги-Харада (синдром VKH), грануломатоз Вегенера, влажная дегенерация желтого пятна, заживление ран, артропатия, связанная с инфекцией yersisnia и salmonella.
Другие примеры расстройств, которые можно лечить с использованием способов и композиций по изобретению обнаруживаются в публикации США №2004-0126372.
Понятно, что все из указанных выше расстройств, связанных с TNFα, где целесообразно, включают и взрослые, и ювенильные формы заболевания. Понятно также, что все из указанных выше расстройств включают и хронические, и острые формы заболевания. Кроме того, способы с использованием множественных вариабельных доз по изобретению можно использовать для лечения каждого из указанных выше расстройств, связанных с TNFα, отдельно или в комбинации друг с другом, например, пациента, страдающего увеитом и волчанкой.
Изобретение также включает изготовленное изделие, включающее упаковочный материал; автоматическое инъекционное устройство, например, автоинъекционную ручку, содержащую шприц, заполненный ингибитором TNFα, таким как адалимумаб, и вкладыш упаковки, содержащийся внутри упаковочного материала, указывающий, что в исследованиях ингибитора TNFα с использованием автоматического инъекционного устройства по изобретению для лечения ревматоидного артрита, самыми частыми побочными явлениями (АЕ) были бронхит, гиперчувствительность, артритическая боль, кашель и ринит.
Другие примеры биологических агентов, которые можно вводить пользователю с использованием автоматического инъекционного устройства, например, автоинъекционной ручки, по изобретению, включают без ограничения антитела или антагонисты человеческих цитокинов или ростовых факторов, например, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, IL-23, интерфероны, EMAP-II, GM-CSF, FGF и PDGF; антитела к молекулам клеточной поверхности, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (В7.1), CD86 (В7.2), CD90, CTLA или их лиганды, включая CD154 (gp39 или CD40L); актемра (тоцилизумаб) гуманизированное МАb против рецептора интерлейкина 6 (IL-6); ингибиторы фермента, превращающего TNFα (ТАСЕ); ингибиторы IL-1 (ингибиторы фермента, превращающего интерлейкин-1, IL-1RA и т.д.); интерлейкин 11; антагонисты IL-18, включая IL-18 антитела или растворимые рецепторы IL-18, или белки, связывающие IL-18; не истощающие анти-СD4 ингибиторы; антагонисты совместно стимулирующего пути CD80 (В7.1) или CD86 (В7.2), включая антитела, растворимые рецепторы или антагонистические лиганды; агенты, которые препятствуют передаче сигналов провоспалительными цитокинами, такими как TNFα или IL-1 (например, ингибиторы киназы IRAK, NIK, IKK, р38 или MAP); ингибиторы фермента, превращающего IL-1β (ICE); ингибиторы передачи сигналов Т клеток, такие как ингибиторы киназы; ингибиторы металлопротеиназы; ингибиторы ангиотензин-превращающего фермента; растворимые цитокиновые рецепторы и их производные (например, растворимые рецепторы TNF р55 или р75 и производные p75TNFRIgG (Enbrel™ и p75TNFRIgG (Lenercept)), sIL-1RI, sIL-1RII, sIL-6R); противовоспалительные цитокины (например, IL-4, IL-10, IL-11, IL-13 и TGFb); ритуксимаб; IL-1 TRAP; MRA; CTLA4-Ig; IL-18 BP; анти-IL-18; анти-IL15; IDEC-CE9.1/SB 210396 (не истощающее приматизированное антитело против CD4; IDEC/SmithKline; см., например. Arthritis & Rheumatism (1995) Vol. 38, S185); DAB 486-IL-2 и/или DAB 389-IL-2 (гибридные белки IL-2; Seragen; см, например. Arthritis & Rheumatism (1993) Vol. 36, 1223); анти-Тас (гуманизированное анти-IL-2Rа; Protein Design Labs/Roche); IL-4 (противовоспалительный цитокин; DNAX/Schering); IL-10 (SCH 52000; рекомбинантный IL-10, противовоспалительный цитокин; DNAX/Schering); агонисты IL-10 и/или IL-4 (например, агонистические антитела); IL-1RA (антагонист рецепторов IL-1; Synergen/Amgen); анакинра (Kineret®/Amgen); TNF-bp/s-TNF (растворимый белок, связывающий TNF; см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S284; Amer. J. Physiol. - Hearst and Circulatory Physiology (1995) Vol. 268, pp. 37-42); R973401 (ингибитор фосфодиэстеразы IV типа; см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S282); MK-966 (ингибитор СОХ-2; см., например, Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S81); илопрост (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S82); ингибитор zap-70 и/или 1ck (ингибитор тирозин-киназы zap-70 и/или 1ck); ингибитор VEGF и/или ингибитор VEGF-R (ингибиторы сосудистого эндотелиального клеточного ростового фактора или рецептор сосудистого эндотелиального клеточного ростового фактора; ингибиторы ангиогенеза); ингибиторы TNF-конвертазы; анти-IL-12 антитела; анти-IL-18 антитела; интерлейкин-11 (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S296); интерлейкин-13 (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S308); интерлейкин-17 (см., например. Arthritis & Rheumatism (1996) Vol. 39, No 9 (supplement), S120); антитимоцитарный глобулин; анти-СD4 антитела; СD5-токсины; антисмысловые фосфортиоатные олигодеоксинуклеотиды ICAM-1 (ISIS 2302; Isis Pharmaceuticals, Inc.); растворимый комплементарный рецептор 1 (ТР10; Т Cell Sciences, Inc.), эфализумаб, и анти-IL2R антитела, включая анти-IL12 антитело (АВТ 874); анти-IL18 антитело (АВТ 325); мелкомолекулярный ингибитор LCK; мелкомолекулярный ингибитор СОТ; анти-IL1 антитело; мелкомолекулярный ингибитор МК2; анти-СD19 антитело; мелкомолекулярный ингибитор CXCR3; мелкомолекулярный ингибитор CCR5; мелкомолекулярный ингибитор CCR11, антитело против E/L селектина; мелкомолекулярный ингибитор Р2Х7; мелкомолекулярный ингибитор IRAK-4; мелкомолекулярный агонист глюкокортикоидного рецептора; антитело против рецептора С5а; мелкомолекулярный ингибитор рецептора С5а; анти-СD32 антитело; и CD32 в качестве терапевтического белка.
Другие примеры биологических агентов, которые можно вводить пользователю с использованием автоматического инъекционного устройства, например, автоинъекционной ручки, по заявке, включают без ограничения мелкомолекулярный ингибитор KDR (АВТ-123), мелкомолекулярный ингибитор Tie-2; метотрексат; преднизон; целекоксиб; фолиевую кислоту; гидроксихлорохинсульфат; рофекоксиб; этанерцепт; инфликсимаб; анакинру (Kineret®/Amgen); лефлуномид; напроксен; валдекоксиб; сульфасалазин; ибупрофен; метилпреднизолон; мелоксикам; метилпреднизолон ацетат; тиомалат золота-натрия; аспирин; азатиоприн; триамсинолон ацетонид; пропоксифен напсилат/ацетилпараминофенол; фолат; набуметон; диклофенак; пироксикам; этодолак; диклофенак натрий; оксапрозин; оксикодон гидрохлорид; гидрокодон битартрат/ацетилпараминофенол; диклофенак натрий/мисопрозол; фентанил; анакинра, человеческий рекомбинант; трамадол гидрохлорид; салсалат; сулиндак; цианокобаламин/свободная кислота/пиридоксин; ацетаминофен; алендронат натрий; преднизолон; морфин сульфат; лидокаин гидрохлорид; индометацин; глюкозамин сульфат/хондроитин; циклоспорин; сульфадиазин; гель амитриптилина; гель оксикодона/ ацетаминофен; гель олопатадина; мисопростол; напроксен натрий; омепразол; микофенолат мофетил; циклофосфамид; ритуксимаб; IL-1 TRAP; MRA; CTLA4-IG; IL-18 ВР; АВТ-874; АВТ-325 (анти-IL 18); анти-IL 15; BIRB-796; SCIO-469; VX-702; AMG-548; VX-740; рофлумиласт; IC-485; CDC-801; и месопрам, антибиотики, включая кларитромицин (Biaxin®), ципрофлоксацин (Cipro®) и метронидазол (Flagyl®), месаламин, преднизон, азатиоприн, меркаптопурин, инфликсимаб, будезонид, суфласалазин, метилпреднизолон натрий сукцинат, дифеноксилат/атропин сульфат, лоперамид гидрохлорид, метотрексат, омепразол, фолат, ципрофлоксацин/декстроза-вода, гидрокодон битартрат/ацетилпараминофенол, тетрациклин гидрохлорид, флюоцинонид, метронидазол, тимеросал/борная кислота, гиосциамин сульфат, холестирамин/сахароза, ципрофлоксацин гидрохлорид, меперидин гидрохлорид, мидазолам гидрохлорид, оксикодон гидрохлорид/ацетаминофен, прометазин гидрохлорид, фосфат натрия, сульфаметоксазол/триметоприм, целекоксиб, поликарбофил, пропоксифен напсилат, гидрокортизон, мультивитамины, балсалазид динатрий, кодеин фосфат/ацетилпараминофенол, гель колесевелама, цианокобаламин, фолиевая кислота, левофлоксацин, натализумаб, метилпреднизолон, интерферон-гамма, сарграмостим (GM-CSF), нестероидные противовоспалительные препараты (NSAID), ингибиторы СОХ2, включая Cerebrex®, Vioxx® и Bextra®, эторикоксиб, ибупрофен, диклофенак и мисопростол, напроксен, мелоксикам, индометацин, диклофенак, целекоксиб, рофекоксиб, сульфасалазин, преднизон, метотрексат, азатиоприн, миноциклин, преднизон, этанерцепт, и инфликсимаб; рофекоксиб; целекоксиб; фолиевая кислота; сульфасалазин; напроксен; лефлуномид; метилпреднизолон ацетат; индометацин; гидроксихлорохин сульфат; сулиндак; преднизон; усиленный бетаметазон дипропионат; инфликсимаб; метотрексат; фолат; триамсинолон ацетонид; дикофенак; диметилсульфоксид; пироксикам; диколфенак натрий; кетопрофен; мелоксикам; преднизон; метилпреднизолон; набуметон; толметин натрий; кальципотриен; циклоспорин; диколфенак; натрий/мисопростол; флуоцинонид; глюкозамин сульфат; тиомалат золота-натрия; гидрокодон; битартрат/ацетилпараминофенол,; ибупрофен; ресидронат натрий; сульфадиазин; тиогуанин; валдекоксиб; алефацепт; RAPTIVA® (эфализумаб), мелкомолекулярный ингибитор KDR (АВТ-123), мелкомолекулярный ингибитор Tie-2, кальципотриен, клобетазол пропионат, триамсинолон ацетонид, галобетазол пропионат, тазаротен, метотрексат, флуоцинанид, усиленный бетаметазон дипропионат, флуоцинолон, ацетонид, ацитретин, дегтевый шампунь, бетаметазон валерат, мометазон фуроат, кетоконазол, прамоксин/флуоцинолон, гидрокортизон валерат, флурандренолид, мочевина, бетаметазон, клобетазол пропионат/мягчитель, флутиказон пропионат, азитромицин, гидрокортизон, увлажняющий состав, фолиевую кислоту, дезонид, угольная смола, дифлоразон диацетат, этанерцепт, фолат, молочная кислота, метоксален, гидрохлорид/субгаллат висмута/оксид цинка/резорцин, метилпреднизолон ацетат, преднизон, солнцезащитный агент, салициловую кислоту, гальцинонид, антралин, клокортолон пивалат, угольный экстракт, угольный деготь/салициловую кислоту, угольный деготь/салициловая кислота/сера, дезоксиметазон, диазепам, мягчительное средство, мягчительное средство пимекроллимус, флуоцинонид/мягчительное средство, минеральное масло/касторовое масло/лактат натрия, минеральное масло/арахисовое масло, вазелин/изопропил миристат, псорален, салициловая кислота, мыло/трибромсалан, тимеросал/борная кислота, целекоксиб, алефацепт, RAPTIVA® (эфализумаб), такролимус, пимекролимус, PUVA, и сульфасалазин.
Изобретение далее иллюстрируется следующими примерами, которые не следует рассматривать как ограничивающие. Содержания всех ссылок, патентов и опубликованных патентных заявок, приведенных по всей этой заявке, включены в настоящий документ ввиду ссылки на них.
В следующих примерах описываются исследования с использованием иллюстративного автоматического инъекционного устройства, например, автоинъекционной ручки, по изобретению. Иллюстративная автоинъекционная ручка, описанная в следующирх примерах, содержит человеческое TNFα антитело, например, адалимумаб (HUMIRA®), и часто именуется ниже как ручка HUMIRA®.
Пример 1: Применение автоматического инъекционного устройства для введения ингибитора TNFα
Обзор/резюме исследования
Адалимумаб представляет собой терапевтическое моноклональное антитело для подкожного введения 2 биоэквивалентными, одноразовыми инъекционными устройствами: готовым к применению, предварительно заполненным шприцем и интегрированной, одноразовой системой доставки, автоинъекционной ручкой. Хотя было показано, что пациенты, требующие длительного подкожного введения лекарственных средств, предпочитают ручки шприцам, нет данных по предпочтению и болевым ощущениям при использовании биологических веществ пациентами с хроническими воспалительными заболеваниями. Таким образом, целью следующего исследования (исследования TOUCH) была оценка боли в участке инъекции, безопасности и предпочтения пациентами двух устройств доставки адалимумаба.
Целью исследования TOUCH (испытание возможности применения в клинических учреждениях автоинъектора HUMIRA в сравнении предварительно заполненного шприца) была оценка того, какой способ доставки предпочитали пациенты с ревматоидным артритом: предварительно заполненный шприц HUMIRA или новую ручку HUMIRA.
Вкратце, пациентов с ревматоидным артритом (RA) включали во II фазу многоцентрового, открытого, одноплечевого последовательного испытания. Пациенты подкожно вводили себе стандартную дозу адалимумаба один раз в 2 недели в каждое из 3 контролируемых клинических посещений: посещение 1 (шприц), посещения 2 и 3 (ручка). В каждое посещение, пациенты оценивали в баллах свое болевое ощущение в 2 точки времени и выражали свои впечатления и предпочтения каждого из устройств доставки. Безопасность оценивали в течение всего исследования и через 70 дней после введения конечной дозы исследования.
В целом, в испытание были включены 52 пациента, и они завершили все 3 посещения. 40 пациентов (76,9%) сообщили, что использование ручки было менее болезненно, чем шприца, 4 пациента (7,7%) считали, что использование шприца было менее болезненно, и 8 пациентов (15,4%) не имели предпочтения. В посещения 2 и 3, у пациентов было значимое среднее уменьшение боли в участке инъекции непосредственно после инъекции (соответственно -1,4 и -1,6, р<0,01) и через 15-30 минут после инъекции (-0,6 в обе точки времени, р<0,01). ≈90% пациентов считали применение ручки более удобным и легким. У пациентов были статистически значимые уменьшения балльных оценок боли от посещения 1 к посещению 2 и от посещения 1 к посещению 3. Типы и кумулятивная частота побочных явлений в течение 2-недельного периода после инъекции шприцем и 4-недельного периода после 2 инъекций ручками были сравнимы. 5 пациентов (9,6%) отметили побочные явления, включая бронхит, гиперчувствительность, артритическую боль, кашель и ринит после инъекции шприцем, и 8 (15,4%) после инъекции ручкой. Не было побочных явлений, приведших к прекращению инъекций. Таким образом, оба устройства доставки были безопасными, и не было значимых различий побочных явлений, отмеченных для каждого из устройств доставки. Кроме того, 46 пациентов (88,5%) предпочитали ручку, 3 (5,8%) предпочитали шприц и у 3 (5,8%) не было предпочтения. В целом, пациенты оценивали применение ручки как более легкое, более удобное, требующее меньше времени для инъекции и более безопасное.
В заключение, пациенты испытывали меньшую боль при самостоятельном введении адалимумаба с использованием ручки и предпочитали ее шприцу. Кроме того, пациенты воспринимали применение ручки как более легкое и более удобное. Между двумя биоэквивалентными устройствами доставки не было отмечено различий явлений безопасности.
Детальное исследование
Следующее исследование было выполнено для оценки того, какой способ доставки предпочитали пациенты (также именуемые в настоящем документе пользователями) - предварительно заполненный шприц (PFS) HUMIRA® (также именуемый адалимумабом) или новую ручку HUMIRA®. Следующее исследование было также выполнено для сравнения двух способов введения, включая уровень болевого ощущения в участке инъекции, вызываемого этими двумя устройствами доставки.
Структура исследования включала II фазу многоцентрового, открытого исследования с участием пациентов, имевших предшествующий опыт введения адалимумаба с использованием предварительно заполненного шприца. Включению в исследование подлежали пациенты, возраст которых составлял ≥18 лет, у которых был RA, диагностированный в соответствии с пересмотренными в 1987 г критериями Американской Коллегии Ревматологии, и они самостоятельно вводили себе 40 мг адалимумаба подкожно 1 раз в 2 недели с помощью предварительно заполненного шприца в течение, по меньшей мере, 3 месяцев. Основные критерии исключения включали пациентов с анамнезом злокачественных заболеваний, пациентов с нарушенным иммунитетом или анамнезом инфекции вирусом иммунодефицита, демиелинирующих заболеваний или не излеченных хронических заболеваний; пациентов с активными инфекциями, требующими лечения; пациентов с активным туберкулезом или положительным тестом с очищенным белковым производным в пределах, по меньшей мере, 6 месяцев; пациентов, которые получали активные исследуемые препараты в пределах 30 дней или 5 периодов полувыведения; пациентов, которые регулярно применяли любое лекарственное средство, вводимое посредством подкожной инъекции, за исключением адалимумаба; и женщин, которые были беременны или кормили грудью. Пациентам в данном исследовании было разрешено продолжать прием стандартных противоревматических лекарственных средств в той дозировке, в которой они принимали их перед исследованием.
Пациенты (n=52) проводили себе инъекцию предварительно заполненным шприцем HUMIRA® в 0 неделю с последующими инъекциями ручкой HUMIRA® через 2 и 4 недели при заполнении анкет во все 3 точки времени. Пациенты проводили рейтинг своего предпочтения инъекции по нескольким признакам, включая общее предпочтение, легкость применения, удобство, время для завершения инъекции, воспринимаемую безопасность и боль.
Исследование включало 3 исследуемых посещения самостоятельного введения пациентами адалимумаба 1 раз в 2 недели. Каждая инъекция при каждом посещении производилась под наблюдением медицинского работника. На первом посещении, пациенты самостоятельно вводили себе подкожно 40 мг адалимумаба посредством предварительно заполненного шприца, удерживаемого под углом 45 градусов к поверхности кожи. На втором посещении, персонал, проводящий исследование, инструктировал пациентов, как правильно вводить адалимумаб с использованием ручки, и объяснял пациентам характерные признаки ручки (фиг.25), включающие окно для осмотра раствора препарата перед инъекцией и желтую полосу для индикации завершения инъекции; последовательное открывание защитных колпачков для предотвращения случайного ошибочного запуска; и правильное расположение, захват и приведение в действие устройства одним нажатием кнопки. На 2-м и 3-м посещениях, пациенты самостоятельно вводили себе адалимумаб с использованием ручки, удерживаемой под углом 90 градусов к поверхности кожи. Пациенты на первом посещении выбирали для самостоятельной инъекции или область бедра, или область живота, и их контролировали для того, чтобы обеспечить использование ими того же участка тела для инъекции на 2-м и 3-м посещениях, производя каждую инъекцию на расстоянии, по меньшей мере, 2 дюйма от предыдущего участка инъекции.
Пациенты использовали ручку в соответствии со следующей очередностью операций: сначала перед инъекцией с использованием ручки пациентов знакомили с устройством ручки путем просмотра видеоматериала и чтения брошюры, описывающей 5 этапов. Пациенты также использовали демонстрационную ручку для практики использования ручки перед инъекцией ручкой. Этапы использования ручки HUMIRA® включали настройку ручки, при которой ручка извлекалась из коробки, и ей давали возможность адаптироваться к комнатной температуре, оставляя ее на 15-20 минут. Затем пациент протирает кожу спиртовым тампоном перед инъекцией. Выбирается и подготавливается участок инъекции. Инъекция HUMIRA® проводилась с использованием ручки нажатием кнопки запуска пациентом. После слышимого «щелчка» начиналась инъекция, которая продолжалась примерно 10 секунд. Через 10 секунд, или когда желтая полоса прекращала движение в окне, инъекция была завершена.
Исходные демографические данные для исследования были получены у пациентов, которые использовали HUMIRA® PFS от 3 до 32 месяцев, при средней продолжительности использования 15,4 месяца. Пациенты сообщили, что самостоятельная инъекция PFS продолжалась от <1 минуты до 5 минут при средней продолжительности <1 минуты. Исходные оценки включали длительность лечения адалимумабом, длительность самостоятельного введения адалимумаба, обычный участок инъекции, длительность времени инъекции и общее впечатление от введения адалимумаба через шприц. Балльную оценку боли в участке инъекции проводили по 11-очковой цифровой рейтинговой шкале в диапазоне от 0 (отсутствие боли) до 10 (насколько возможно сильная боль) в 2 точки времени после инъекции: сразу после инъекции и через 15-30 минут после инъекции (Huskisson Lancet. 1974; 304:1127-1131 и Jorgensen et al. Annals of Pharmacotherapy. 1996, 30:729-732). После каждой инъекции, пациенты также проводили рейтинг своих общих впечатлений от шприца в сравнении с ручкой как «крайне неблагоприятные», «неблагоприятные», «нейтральные», «благоприятные» или «крайне благоприятные».
В 0 неделю пациентов опрашивали для получения следующих сведений: количество времени, в течение которого они получали HUMIRA®, их типичный участок инъекции, их типичное время инъекции, и общее впечатление от шприца. Самыми частыми участками инъекции были живот (25/52) и бедро (22/52).
Анализ предпочтений пациентов проводили после последнего посещения или после преждевременного выхода из исследования. Во время анализа пациентов просили провести рейтинг их общих предпочтений (шприц, ручка или отсутствие предпочтения) и обосновать их предпочтения. Проводили также рейтинг предпочтений пациентов (шприц, ручка или отсутствие предпочтения) по каждой из следующих категорий: легкость применения, удобство, время для проведения инъекции, безопасность и уменьшение боли. Пациентов также просили провести рейтинг вероятности их переключения на ручку, если она имеется по той же цене («крайне вероятно», «не вероятно», «нейтрально», «вероятно» или «крайне вероятно») и вероятность того, что они будут рекомендовать ручку другому пациенту, получающему адалимумаб (такие же рейтинги, как описано выше).
При первой и третьей инъекциях (2 и 4 недели) пациентов просили провести рейтинг непосредственных болевых ощущений при использовании ручки (шкала 0-10, где 0 = отсутствие боли и 10 = насколько возможно сильная боль), выраженности боли через 15-30 минут (шкала 0-10), оценить их общее впечатление, их участок инъекции, то, испытали ли они влажную или нормальную инъекцию, соблюдали ли они инструкции по применению ручки и любые дополнительные комментарии.
В конце исследования, пациентам раздавали окончательную анкету предпочтения для определения следующих характеристик:
общее предпочтение, а также его причины; конкретное предпочтение, относящееся к легкости применения, удобству, времени инъекции, безопасности, уменьшению боли; то, вероятно ли было бы переключение пациента с PFD на ручку; и то, вероятно ли было бы то, что пациент рекомендовал ручку другим пациентам, принимающим адалимумаб.
Безопасность оценивали в исходном состоянии (для сравнения) и в ходе всего исследования с использованием клинических лабораторных данных и данных физикального обследования. У пациентов проводили мониторинг для выявления сообщений о связанных с лечением побочных явлениях (АЕ), спонтанно представленных пациентом, или представленных исследователем. Тяжелое АЕ определяли в соответствии с Медицинским словарем нормативной деятельности (MedDRA, версия 9.0) как АЕ, которое было смертельным или угрожающим жизни; требующим длительной госпитализации; приводящих к значительной потере трудоспособности, врожденной аномалии, врожденному дефекту, выкидышу или плановому прерыванию беременности; или потребовало медикаментозного/хирургического вмешательства для предотвращения другого тяжелого исхода. О количестве и процентной доле исследуемых пациентов с АЕ сообщали по подписанным бланкам информированного согласия до 70 дней после последнего посещения в ходе исследования (время, в 5 раз превышающее определенный период полувыведения адалимумаба). Оценки безопасности и переносимости препарата также сравнивали 2- и 4-недельные периоды после введения с использованием соответственно шприца и ручки. Обычный гематологический анализ, биохимический анализ сыворотки и серологию, а также анализ мочи проводили в сертифицированной клинической лаборатории. Лабораторные справочные диапазоны получали перед началом исследования, и исследователь анализировал их в целях скрининга.
Для демонстрации эквивалентности между балльными оценками боли после введения предварительно заполненным шприцем в сравнении с ручкой при 80% статистической силе требовался размер выборки приблизительно 50 пациентов при допуске предела эквивалентности ±5, стандартном отклонении (различий) 1,25 и односторонней частоте ошибки типа I 0,025. Оценки предпочтения и боли в участке инъекции охватывали всех участников, которые получали 1 инъекцию шприцем и, по меньшей мере, 1 инъекцию ручкой. Исходные характеристики, предпочтения и другие данные по категориям обобщали с использованием средних величин и процентных долей. «Точный» 95% доверительный интервал (CI) рассчитывали для сравнения пациентов, которые или предпочитали ручку, или не имели предпочтения, с пациентами, которые предпочитали предварительно заполненный шприц. Изменения от исходного уровня боли в участке инъекции анализировали, используя парный t критерий Стьюдента и расчетом 95% CI. Анализы безопасности охватывали всех пациентов, которые получали, по меньшей мере, 1 инъекцию. Частоты АЕ при использовании каждого устройства сравнивали, используя критерий McNemar. Все статистические исследования выполняли на уровне статистической значимости 0,05. Статистический анализ выполняли, используя программное обеспечение SAS®, выпуск 8.2 (SAS Institute, Inc., Сагу, North Carolina) операционной системой UNIX версии 11.0.
Результаты промежуточных исследований
Промежуточное исследование 1
В промежуточном исследовании проводили статистический и описательный анализ информации, полученной у 17 пациентов; у 11 было все 3 посещения, а у 6 было 2 посещения. В исследовании также изучали данные в исходном состоянии и при первом посещении еще у 7 пациентов.
Общие превосходные результаты свидетельствовали о том, что отдается предпочтение ручке перед шприцем. Боль при инъекции была сравнима при использовании ручки или шприца, хотя проявилось различие боли в участке после инъекции, главным образом, в пользу ручки.
- Большинство пациентов сообщили или об отсутствии, или о минимальной боли во время инъекции обеими устройствами.
- Большинство пациентов сообщили о меньшей боли в участке после инъекции при использовании ручки, чем шприца (средние величины по шкале 0-10: 3,6 (шприц); 2,4 (ручка 1); 1,9 (ручка 2)).
Предпочтение: практически все пациенты считали ручку превосходящей шприц по всем рейтинговым характеристикам, таким как общее предпочтение, меньшая болезненность, легкость применения, удобство и безопасность. Ручка была предпочтительна в 63 из 66 ответов (6 вопросов о предпочтении 11 пациентам).
Все 11 пациентов считали вероятным (4) или крайне вероятным (7) переключение на ручку и рекомендацию ручки другим.
Дополнительные детали промежуточного исследования 1 включали следующее.
Данные по боли: (17 пациентов, применявших ручку 1; 11 пациентов, применявших ручку 2) показаны ниже в таблице 1.1, где боль при инъекции (шкала 0-10; средние величины) - при использовании ручки, боль всегда или такая же или меньше, чем боль при использовании шприца.
В таблице 1.2 ниже показаны детали исследования 1 на основании другой популяции пациентов, описанной в таблице 1.1. Боль в участке после инъекции (шкала 0-10, средние величины) - 11 пациентов сообщили, что боль при использовании ручки была такой же или меньше, у 6 пациентов ручка увеличила болевое ощущение с 1 до 3-5.
Данные о предпочтении (EF: крайне благоприятное; F:
благоприятное; N: нейтральное; U: неблагоприятное; EU: крайне неблагоприятное)
Ручка 1: общее впечатление было главным образом EF (7) или F (6).
Ручка 2: было главным образом EF (6) или F (4) . У пациента 904 при использовании ручки 2 было EU, хотя у него было EF при использовании ручки 1, но он также «крайне вероятно» мог переключиться на ручку и рекомендовать ее другим.
Промежуточное исследование 2
В промежуточном исследовании (по времени после промежуточного исследования 1) обследовали 19 пациентов при 3 инъекциях. Резюме промежуточного исследования 1 включало исключительно результаты предпочтения на основании описательных анализов, полученных у 31 пациента: 19 имели все 3 посещения, 5 имели 2 посещения и 7 имели лишь первое посещение.
Общие превосходные результаты подтвердили, что ручка определенно предпочтительнее, чем шприц. Практически все пациенты считали, что ручка превосходит шприц по всем рейтинговым характеристикам, таким как общее предпочтение, меньшая болезненность, легкость применения, удобство или безопасность. Ручку предпочли в 106 из 114 ответах (6 вопросов о предпочтении 19 пациентам).
18 из 19 пациентов предпочли ручку и считали крайне вероятным или вероятным переключение на ручку и рекомендацию ее использования другим. Один пациент предпочел шприц, считал не вероятным переключение на ручку и нейтрально относился к рекомендации использования ручки другим. Дополнительные детали включали следующее.
Субъективное впечатление от шприца:
n=31
Крайне благоприятное = 2 (6,5%)
Благоприятное =8 (26%)
Нейтральное = 11 (35%)
Неблагоприятное =8 (26%)
Крайне неблагоприятное = 2 (6,5%)
Субъективное впечатление после посещения 2 - первая инъекция ручкой:
n=24
Крайне благоприятное = 12 (50%)
Благоприятное = 8 (33,3%)
Нейтральное =2 (8,3%)
Неблагоприятное = 1 (4,2%)
Крайне неблагоприятное = 1 (4,2%)
Субъективное впечатление после посещения 3 - вторая инъекция ручкой:
n=19
Крайне благоприятное = 11 (57,9%)
Благоприятное = 6 (31,6%)
Нейтральное = 1 (5,3%)
Крайне неблагоприятное =1 (5,3%)
Субъективное впечатление после посещения 3 - вторая инъекция ручкой:
n=19
Когда пациентов спросили об их общем предпочтении на основании опыта использования шприца и ручки HUMIRA®, 18 из 19 лиц предпочли ручку. Один субъект предпочел шприц.
Когда пациентов спросили, какой способ инъекции HUMIRA®, был предпочтителен с точки зрения:
Легкости применения - все 19 лиц предпочли ручку
Удобства - 18 лиц предпочли ручку; 1 субъект не отметил предпочтения
Времени, требуемого для завершения инъекции - 17 из 19 лиц предпочли ручку; у 2 субъектов не было предпочтения
Безопасности - 17 из 19 лиц предпочли ручку; у 2 субъектов не было предпочтения
Меньшей болезненности - 16 из 19 лиц предпочли ручку; 1 субъект предпочел шприц; и у 2 субъектов не было предпочтения
Когда пациентов спросили: «Какова вероятность того, что вы бы использовали ручку, если бы она имела такую же стоимость как шприц?», 12 лиц сообщили: «Крайне вероятно»; 6 лиц сообщили: «Вероятно» и 1 субъект сообщил «Мало вероятно».
Когда пациентов спросили: «Какова вероятность того, что вы порекомендуете ручку другому пользователю HUMIRA®?», 11 пользователей сообщили: «Крайне вероятно»; 7 пользователей сообщили: «Вероятно» и 1 пользователь сообщил о «нейтральной» оценке.
Некоторые комментарии пользователей, которые предпочли ручку:
«Применение ручки легкое, более быстрое и менее болезненное»
«Безопаснее, быстрее и легче вводить при отсутствии фактора страха»
«Потому что мне не нравится игла, которую я могу действительно видеть»
«Легче удерживать/вводить»
«Менее болезненно, быстро и легко вводить»
«Оно вам подходит»
«Оно облегчает слежение за моими действиями + управление инъекцией при проведении способа. И он не казался таким болезненным, как раньше».
«Было не так больно, как раньше».
«Удобный способ».
«Боль не такая сильная и длится меньше».
Некоторые комментарии пользователей о том, почему они НЕ выбрали шприц в качестве предпочтительного устройства для инъекции;
«Больно»
«Больше времени подготовки, физической и психологической»
«Шприц требует большего времени, при этом больше этапов».
«Тяжелее использовать».
«Медленнее, больнее»
«Тяжелее удерживать/вводить»
«При введении может ощущаться жжение, инъекция болезненнее».
«При использовании шприца тебе нужно давить поршень до конца, тогда как при использовании ручки ты однократно нажимаешь кнопку и наблюдаешь, когда остановится желтая метка»
«Мне легче использовать ручку, при этом меньше вероятность моей ошибки»
«Потому что ручку легче использовать, и боль после ее применения меньше»
«Чем дольше время инъекции - тем больше она болезненна»
«При медленном введении ощущается жжение»
Информация от субъекта, который предпочел шприц
В отношении легкости применения, удобства и времени, затрачиваемого на выполнение инъекции, и безопасности предпочтительна ручка; меньше боли - при использовании шприца; насколько вероятно использование ручки - мало вероятно; насколько вероятна рекомендация ручки - нейтральное отношение.
Комментарии - «Мне кажется, что я лучше контролирую инъекционную иглу. Вторая инъекция была более болезненной, чем при использовании шприца».
Промежуточное исследование 3
В промежуточном исследовании, при обследовании 35 пациентов были получены следующие ответы:
- Какой способ инъекции HUMIRA® вы бы предпочли с точки зрения времени, которое требует проведение инъекции? Ручку (n=29); шприц (n=2); нет предпочтения (n=4)
- Какой способ инъекции HUMIRA® вы бы предпочли с точки зрения безопасности? Ручку (n=31); шприц (n=0); нет предпочтения (n=4)
Результаты завершенного исследования
Склонность и исходные характеристики пациентов
Всего в исследование было включено 52 пациента, которые завершили все 3 посещения в ходе исследования. Во время исследования, ни один пациент не прекратил лечение. Исходные демографические и исходные результаты обследования включены в таблицу 1.3. Пациентов, включенных в исследование, лечили адалимумабом в течение среднего периода лечения 15,4 месяца, и они самостоятельно вводили себе адалимумаб шприцем во время периодов своего лечения (средняя длительность самостоятельного введения составила 14,9 месяцев). Кроме того, приблизительно 655 пациентов получали сопутствующее лечение метотрексатом, и 35% получали сопутствующее лечение стероидами. Пациентов фактически поровну разделили на группы, которые обычно инъецировали дозы адалимумаба в область живота или бедра, в то время как небольшая процентная доля пациентов чередовала участки инъекции. Во время исследования, 29 пациентов (55,8%) выбрали область живота в качестве участка инъекции, и 23 пациента (44,2%) выбрали область бедер в качестве участка инъекции.
Боль в участке инъекции
Рейтинги боли в участке инъекции включены в таблицу 2. При первом посещении, непосредственно после инъекции шприцем, средний рейтинг боли в участке инъекции составил 3,7. Средние рейтинги боли уменьшились на 37% до 2,3 при втором посещении и на 46% до 2,0 при третьем посещении сразу после инъекции ручкой. Средние внутригрупповые изменения боли в участке инъекции сразу после инъекции при втором посещении (ручка) и третьем посещении (ручка) были статистически значимо снижены (соответственно Р = 0,002 и Р<0,001), по сравнению с первым посещением (шприц) (таблица 2). Средние рейтинги боли через 15-30 минут после инъекции составили 0,8 при первом посещении; 0,2 при втором посещении; и 0,2 при третьем посещении. Аналогичным образом, средние внутригрупповые изменения боли в участке инъекции через 15-30 минут после инъекции при втором посещении (ручка) и третьем посещении (ручка) были статистически значимо снижены (соответственно Р = 0,004 и Р = 0,001), по сравнению с первым посещением (шприц) (таблица 2).

Общие впечатления
При первом посещении пациенты равномерно разделились по рейтингу их общих впечатлений от своих первых инъекций шприцем. Приблизительно одна треть пациентов оценили свои общие впечатления от инъекции шприцем как «благоприятные» или «крайне благоприятные», приблизительно одна треть оценила свои впечатления как «нейтральные», и приблизительно одна треть оценила их как «неблагоприятные» или «крайне неблагоприятные» (таблица 3). После применения ручки более чем 80% пациентов при втором посещении оценили их общие впечатления от ручки как «благоприятные» или «крайне благоприятные» при втором посещении (86,5%) и третьем посещении (88,5%).
N=52
N=52
N=52
Предпочтение пациентов
Конечный обзор предпочтений пациентов, который был назначен после третьего посещения, показал, что в целом, 88,5% (95% ДИ 84,1, 98,8) пациентов предпочли ручку, 5,8% (95% ДИ 1,2, 15,9) предпочли шприц и 5,8% не имели предпочтений (фиг.26). Пациентов просили составить список некоторых причин их предпочтений. Большинство пациентов, которые выбрали ручку в качестве их предпочтительного устройства доставки, сказали, что ее было легче применять при меньшей болезненности, чем при использовании шприца. Другие причины, по которым пациенты предпочитали ручку, включали следующее: отсутствие гематом в участке инъекции; более короткое время инъекции; меньше длительность подготовки и меньше этапов, которые следует соблюдать; лучший контроль над устройством; требуется меньше усилий; нет необходимости в проталкивании шприца для введения иглы в кожу; не видна игла; меньше забот, связанных с хранением и удалением иглы; и отсутствие необходимости в оттягивании поршня шприца назад для проверки наличия крови. Пациенты, которые выбрали шприц в качестве своего предпочтительного устройства доставки привели следующие причины: известность шприца/отсутствие необходимости в замене; трудности удаления колпачка ручки; лучший контроль за инъекционной иглой и меньшая болезненность, чем при использовании ручки.
Когда пациентов просили составить рейтинг определенных причин их предпочтений, больше пациентов предпочли ручку шприцу (в порядке от самой большой до самой маленькой процентной доли) по следующим причинам: легкость применения; удобство; общая безопасность и общие характеристики (одинаковая процентная доля); меньше времени для завершения инъекции и меньшая болезненность (фиг.2). Более 94% пациентов сказали, что они бы вероятно или крайне вероятно использовали ручку, если бы она была доступна по такой же цене как шприц (фиг.27). Аналогичным образом, более 94% пациентов сказали, что они бы рекомендовали ручку другому пациенту, который принимает адалимумаб (фиг.27).
Соблюдение назначенного лечения
При каждом посещении медицинский работник оценивал методики инъекции, используемые пациентами, для содействия определению эффективности процедуры тренировки. В целом, по каждому оцениваемому компоненту (т.е., подготовленный спиртом участок инъекции, проверенный уровень и качество препарата, удаленные по порядку колпачки, подготовленная плоская поверхность кожи, удерживаемый плоский участок кожи во время инъекции, правильное расположение ручки, правильный запуск ручки, поддержание постоянного давления без оттягивания, продолжение инъекции до завершения и наблюдаемый желтый стопор в окне при завершении инъекции) рейтинг выполнения методик подготовки пациента и инъекции составил 98-100% (на посещение). Приблизительно 90% пациентов отметили, что инструкционные устройства (видео или брошюры), используемые медицинскими работниками, обеспечивали адекватную подготовку.
Оценки безопасности
Во время этого исследования не наблюдались новые сигналы безопасности. Было продемонстрировано, что адалимумаб в целом безопасен и хорошо переносим, независимо от доставки шприцем или ручкой. Не наблюдались статистически значимые различия между АЕ, отмеченными во время использования шприца, в сравнении с использованием ручки или с точки зрении всех АЕ, или по отдельному предпочтительному термину MedDRA. Всего 13 пациентов сообщили о связанных с лечением АЕ: 5 при использовании предварительно заполненного шприца (9,6%) и 10 (19,2%) после 2 инъекций ручкой. Два пациента сообщили об АЕ во время использования и шприца, и ручки. Большинство АЕ имели степень от легкой до умеренной и включали бронхит, гиперчувствительность, артритическую боль, кашель и ринит. Были отмечены 3 инфекции и 1 реакция лекарственной гиперчувствительности. У двоих пациентов имелись тяжелые АЕ при использовании ручки. Из них 69-летний белый мужчина с анамнезом гипертонии и ишемической болезни сердца, приведшей к тройному аортокоронарному шунтированию, потребовал госпитализации ввиду обострения застойной сердечной недостаточности, диагноза, впервые установленного в 1989 г. Этот пациент получил вторую дозу адалимумаба посредством ручки после стабилизации его состояния и выздоровления. Другим пациентом был 51-летний белый мужчина, который потребовал госпитализации для лечения пневмонии приблизительно через 71 день после начала исследуемого лечения. Во время этого исследования не было отмечено других представляющих интерес явлений, связанных с TNF-антагонистом, включая злокачественные новообразования, демиелинирующие явления (включая рассеянный склероз) или реакции, подобные волчанке. Ни один пациент не прекратил участие в исследовании в ответ на связанное с лечением АЕ, и не было отмечено отказов устройств.
Окончательные результаты исследования показывают, что 46 из 52 пациентов предпочли ручку (88,5%), тогда как 5,8% (n=3) не имели предпочтения и 5,8% предпочли PFS (n=3). Кроме того, 40 из 52 пациентов считали ручку менее болезненной (76,9%), хотя 15,4% не имели предпочтения. Только 7,7% считали, что PFS был менее болезнен. Кроме того, ответы пациентов указывали на то, что ручку было легче использовать, поскольку 49 из 52 пациентов считали, что ручку применять легче (94,2%). Наконец, ручка считалась более удобной, поскольку 48 из 52 пациентов считали ручку более удобной (92,3%). 61,5% (n=32) пациентов сказали, что они бы вероятно рекомендовали ручку другому пользователю HUMIRA®, хотя 32,7% (n=17) сказали, что они бы вероятно не рекомендовали ее и 5,8% (n=3) нейтрально оценивали проблему. Дополнительные результаты исследования показаны ниже в таблицах 4-6.
Средняя величина
Средняя величина
(шприц)
(N=52) n(%)
(ручка)
(N=52) n(%)
(ручка)
(N=52) n(%)

Типы и кумулятивная частота побочных явлений (АЕ) в течение 2-недельного периода после инъекции шприцем и 4-недельного периода после 2 инъекций ручкой были сравнимы. 5 пациентов (9,6%) сообщили о АЕ, включающих бронхит, гиперчувствительность, артритическую боль, кашель и ринит после инъекции шприцем и 8 (15,4%) после инъекции ручкой. Не было АЕ, приведших к прекращению лечения.
Хотя ручка была сконструирована для обеспечения пациентам большего удобства, было неясно, какие характеристики, такие как меньшая болезненность, вызовут предпочтения пациентов. Данное исследование показало, что все отдельные характеристики - меньшая боль при инъекции, безопасность, легкость применения, удобство и время для завершения инъекции - были в пользу ручки относительно шприца. В данном исследовании ручка проявила статистически значимое преимущество в отношении боли при инъекции, которая была снижена на 46% сразу после инъекции и на 75% через 15-30 минут после инъекции.
Относительно предпочтения пациенты были поровну разделены по их общим впечатлениям от шприца относительно 5 предварительно определенных категорий (т.е., «крайне благоприятное», «благоприятное», «нейтральное», «неблагоприятное», «крайне неблагоприятное»). Однако после переключения на ручку рейтинг общего впечатления пациентов значительно сдвинулся в сторону или «благоприятного», или «крайне благоприятного». Кроме того, лишь после 2 инъекций ручкой большинство пациентов сказали, что они «вероятно» или «крайне вероятно» переключатся на ручку и будут рекомендовать ручку другому пациенту, который получает лечение адалимумабом, свидетельствуя о быстром принятии пациентами ручки и ее свойств.
Эти результаты могут иметь важные лечебные последствия для пациентов, которые требуют длительного применения ингибитора TNF или других видов биологической терапии. Ввиду связи предпочтения пациентов с соблюдением назначенного лечения (Schwartzman et al. Arthritis Research & Therapy. 2004; 6 (Suppl 2): S19-S23) , предпочтение определенного пути введения может быть существенным фактором в выборе врачом биологической терапии. Кроме того, считается, что соблюдение назначенного лечения является одним из самых важных факторов в поддержании длительных положительных эффектов терапии антагонистом TNF, и поэтому, отсутствие соблюдения назначенного лечения может резко снизить эффективность лечения (Schwartzman et al. (2004)).
В итоге, пациенты определили, что легче применять ручку, чем предварительно заполненный шприц. Кроме того, пациенты обнаружили, что ручка была удобнее, чем шприц, и менее болезненна, чем предварительно заполненный шприц. Пациенты предпочли ручку HUMIRA® PFS HUMIRA® по всем рейтинговым параметрам. Примерно 90% пациентов сообщили об общем предпочтении ручки, по сравнению с предварительно заполненным шприцем. 8 из 10 пациентов также рекомендовали бы ручку другим пациентам, применяющим адалимумаб. Наконец, 80% пациентов оценили ручку как менее болезненную, чем PFS.
Это исследование показывает, что пациенты считали, что ручка с адалимумабом вызывала значительно меньшую боль, чем традиционный предварительно заполненный шприц. Кроме того, получавшие адалимумаб пациенты с RA предпочли подкожную инъекцию адалимумаба автоинъекционной ручкой предварительно заполненному шприцу. Пациенты считали, что ручку легче применять, она более удобна и требовала меньше времени для инъекции. В отношении профиля безопасности, не наблюдались видимые различия между двумя устройствами доставки. Общее предпочтение пациентами устройства в виде автоинъекционной ручки может привести к улучшенному соблюдению назначенного лечения, и, в свою очередь, к улучшенным клиническим исходам во время длительной терапии самостоятельным введением биологических средств.
Пример 2: Оценка относительной биодоступности, безопасности и переносимости одиночных доз адалимумаба, введенных посредством автоинъекционной ручки и предварительно заполненного шприца
Ревматоидный артрит (RA) представляет собой хроническое, инвалидизирующее заболевание, которое требует длительного лечения, которое является безопасным и эффективным. Современные инструменты доставки биологических препаратов, предварительно заполненные шприцы, болезненны и обременительны. Предварительно заполненные, одноразовые автоинъекционные ручки, подобные тем, которые описаны в приведенном ниже примере, обеспечивают возможность более удобного введения.
Целью следующего примера было сравнение биодоступности, безопасности и переносимости адалимумаба, вводимого подкожно посредством автоинъекционной ручки в сравнении с предварительно заполненным шприцем.
Структура исследования
Адалимумаб вводили ручкой или предварительно заполненным шприцем в область живота или бедра здоровым, взрослым добровольцам в этом многоцентровом, открытом, параллельном групповом исследовании I фазы. Схема А включала 40-мг подкожную дозу адалимумаба посредством автоинъекционной ручки, тогда как Схема В включала 40-мг подкожную дозу адалимумаба посредством предварительно заполненного шприца.
Образцы крови брали пункцией вены перед введением (час 0); и через 4, 12, 24, 36, 48, 60, 72, 84, 96, 108, 120, 132, 144, 168, 192, 240, 288, 336 и 360 часов; и через 3, 4, 5, 6, 7 и 8 недель после введения. Концентрацию адалимумаба в сыворотке определяли с использованием утвержденного двойного иммунного анализа антигена. Анализ имел нижний предел количественного определения 3,125 нг/мл в разведенной сыворотке.
Основные критерии включения были: возраст 18-55 лет и общее хорошее состояние пациентов. Основные критерии исключения были:
беременность и положительная кожная проба PPD (очищенным от белка туберкулином).
Фармакокинетический анализ включал анализ фармакокинетических (РК) параметров, которые представляли собой оцениваемое применение не компартментальных способов. Включенные РК параметры представляли собой: максимальная наблюдаемая концентрация в сыворотке (Сmax) ; время до достижения Сmax (Тmax); площадь под кривой динамики во времени концентрации в сыворотке (AUC) от 0 до 360 ч (AUC0-360) ; и AUC от 0 до 1344 ч (AUC0-1344).
Статистический анализ выполняли с использованием следующих соображений. Четырехпутевой анализ ковариации (ANCOVA) выполняли для Tmax и логарифмов AUC и Сmax при использовании в качестве факторов схемы, участка инъекции, центре исследования и пола. Ковариатом была масса тела. Для оценки биоэквивалентности схем, 2 односторонние процедуры тестирования проводили для AUC и Сmax посредством 90% доверительного интервала для соотношения центральных величин схем. Соотношение центральных величин схем соответствует разности основных эффектов схем на модели ANCOVA.
Безопасность определяли на основании оценок побочных явлений (АЕ), физикальных обследований, показателей жизненно важных функций и лабораторных тестов.
В исследование было включено всего 295 здоровых добровольцев мужчин и женщин. Из них 146 добровольцев получали дозу 40 мг адалимумаба посредством автоинъекционной ручки и 149 лиц получали дозу 40 мг адалимумаба посредством предварительно заполненного шприца. В таблице 7 содержится итоговая статистика демографических параметров.
Все величины представляют собой Среднюю ± SD (стандартное отклонение), за исключением процентных долей
Профили динамики во времени средней концентрации адалимумаба в сыворотке были одинаковы при двух схемах. Фармакокинетические профили ручки и предварительно заполненного шприца также были сравнимы между двумя участками инъекции, бедром и животом.
Фармакокинетические параметры адалимумаба после введения по каждой из двух схем были одинаковы (таблица 8). Центральные величины Тmах, логарифмически трансформированная Cmax, AUC0-360 AUC0-1344 для ручки статистически достоверно не отличались от величин для предварительно заполненного шприца (таблица 8).
При обеих схемах одна доза 40 мг адалимумаба вводится подкожно.
Все величины представляют собой Среднюю ± SD.
90% доверительные интервалы для логарифмически трансформированных AUC0-360, AUC0-1344 и Сmах были заключены в пределах диапазона от 0,80 до 1,25, указывая на то, что схема А с использованием автоинъекционной ручки была биоэквивалентна сравнительной схеме В с использованием предварительно заполненного шприца в обоих участках инъекции, бедре и животе (таблица 9).

В этом исследовании автоинъектор был хорошо переносим при профиле безопасности, сравнимом с таковым предварительно заполненного шприца (таблица 10)
N=146
n(%)
n(%)
Во время исследования не было случаев смерти или прекращений инъекций вследствие побочных явлений. Один доброволец сообщил о тяжелом побочном явлении в виде аппендицита, потребовавшего операции и госпитализации на 20-й день исследования. Этот субъект попросил продолжить участие в исследовании после выписки из больницы, и ему было разрешено продолжить участие после полного медицинского обследования. Большинство возникающих во время лечения побочных явлений исследователи оценивали как не связанные или возможно связанные с препаратом исследования и легко выраженные.В заключение, автоинъекционная ручка была биоэквивалентна предварительно заполненному шприцу. Оба курса были также биоэквивалентны в каждом участке инъекции, животе и бедре. Профиль безопасности ручки был сравним с профилем безопасности предварительно заполненного шприца.
Пример 3: Внедрение автоматического инъекционного устройства HUMIRA®, по сравнению с предварительно заполненным шприцем для доставки HUMIRA®
Представитель компании HUMIRA® посещает врача, который ранее назначил пациентам HUMIRA® PFS. Представитель обеспечивает устную презентацию врачу, в котором исследование TOUCH и его результаты описываются для врача (исследование TOUCH представлено, например, выше в примере 1) . В частности, представитель передает врачу, что 90% пациентов сообщили об общем предпочтении ручки HUMIRA®, по сравнению с PFS, 8 из 10 рекомендовали бы ручку другим пациентам, которые получали HUMIRA®, и 80% пациентов оценивали ручку как менее болезненную чем PFS. Кроме того, представитель передает врачу флипкарту и DVD, каждая из которых описывает исследование TOUCH и передает, что 90% пациентов сообщили об общем предпочтении ручки HUMIRA® по сравнению с PFS, 8 из 10 рекомендовали бы ручку другим пациентам, которые получали HUMIRA®, и 80% пациентов оценивали ручку как менее болезненную чем PFS.
Пример 4: Способы подготовки к применению автоматического инъекционного устройства HUMIRA®
Представитель компании HUMIRA® посещает врача, который ранее назначил пациентам HUMIRA® PFS. Представитель обеспечивает устную презентацию врачу, описывающую, как используется ручка HUMIRA® для доставки дозы HUMIRA® пациенту. Эта презентация включает инструкции по проведению следующих стадий:
(i) извлечь ручку HUMIRA® из холодильника за 15-20 минут до инъекции;
(ii) выбрать участок инъекции на бедре или животе (где участок должен быть на расстоянии, по меньшей мере, 1 дюйм от предыдущего участка инъекции, и, по меньшей мере, 2 дюймов от пупка) и протереть участок инъекции спиртовым тампоном;
(iii) исследовать раствор HUMIRA® в ручке HUMIRA® через окно в ручке для того, чтобы удостовериться, что жидкость прозрачна и бесцветна. Также, удерживая ручку так, чтобы конец иглы был направлен вниз, провести проверку для того, чтобы удостовериться в том, что уровень жидкости такой же или близкий к линии, видимой через окно (для того, чтобы удостовериться в присутствии правильной дозировки);
(iv) снять колпачки с игольного конца и с конца кнопки запуска ручки. Осторожно сдавить площадь очищенной кожи достаточного размера и поместить ручку под углом 90 градусов с упором в кожу. Нажать кнопку запуска, плотно прижимая ручку к коже, и слушать до появления «щелчка». Продолжать надавливание на кнопку запуска и считать до 10 секунд. Убедиться в том, что в окне дисплея полностью появился и остановился желтый индикатор;
и
(v) выбросить ручку в соответствующий контейнер (например, контейнер Sharps).
Кроме того, представитель предоставляет врачу флипкарту и DVD, которые передают инструкции провести стадии (i)-(v), как представлено выше. Кроме того, представитель предоставляет врачу тренировочный набор, причем набор включает (1) демонстрационное автоматическое инъекционное устройство, которое имитирует ручку HUMIRA®, но не содержит иглы и дозы HUMIRA®, (2) брошюру, которая передает инструкции провести стадии (i)-(v), как представлено выше, и (3) аудиовизуальное устройство (кассету VHS или DVD), которое передает инструкции провести стадии (i)-(v), как представлено выше.
Эквиваленты
Специалистам в данной области будет понятно или они, используя не более чем обычное экспериментирование, смогут определить множество эквивалентов описанных в настоящем документе определенных вариантов осуществления изобретения. Такие эквиваленты охватываются следующей формулой изобретения. Содержание всех ссылок, патентов, патентных заявок и опубликованных патентных заявок, приведенных по всему тексту заявки, включены в настоящий документ ввиду ссылки на них.
| название | год | авторы | номер документа |
|---|---|---|---|
| АВТОМАТИЧЕСКОЕ ИНЪЕКЦИОННОЕ УСТРОЙСТВО | 2007 |
|
RU2575906C2 |
| АВТОМАТИЧЕСКОЕ ИНЪЕКЦИОННОЕ УСТРОЙСТВО | 2010 |
|
RU2524487C2 |
| УСОВЕРШЕНСТВОВАННАЯ ПУСКОВАЯ КНОПКА ДЛЯ АВТОМАТИЧЕСКОГО ИНЪЕКЦИОННОГО УСТРОЙСТВА | 2010 |
|
RU2582401C2 |
| УЛУЧШЕННЫЕ ВЫСОКОКОНЦЕТРИРОВАННЫЕ ЖИДКИЕ ПРЕПАРАТЫ АНТИТЕЛ ПРОТИВ TNF-альфа | 2011 |
|
RU2639386C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ДИАГНОСТИКИ АНКИЛОЗИРУЮЩИХ СПОНДИЛИТОВ С ИСПОЛЬЗОВАНИЕМ БИОМАРКЕРОВ | 2006 |
|
RU2438704C2 |
| ОЧИСТКА АНТИТЕЛА | 2007 |
|
RU2466740C2 |
| НОСИМОЕ УСТРОЙСТВО ДЛЯ АВТОМАТИЧЕСКОЙ ИНЪЕКЦИИ ДЛЯ УПРАВЛЯЕМОЙ ПОДАЧИ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2011 |
|
RU2695703C2 |
| СТАБИЛЬНЫЕ КОМПОЗИЦИИ С ВЫСОКИМИ КОНЦЕНТРАЦИЯМИ БЕЛКОВ АНТИТЕЛ ЧЕЛОВЕКА ПРОТИВ TNF-АЛЬФА | 2010 |
|
RU2560701C2 |
| СПОСОБЫ ВЫЯВЛЕНИЯ ПРЕПАРАТОВ И АУТОАНТИТЕЛ ПРОТИВ TNF | 2010 |
|
RU2571489C2 |
| Способы идентификации антител с пониженной иммуногенностью | 2013 |
|
RU2648141C2 |










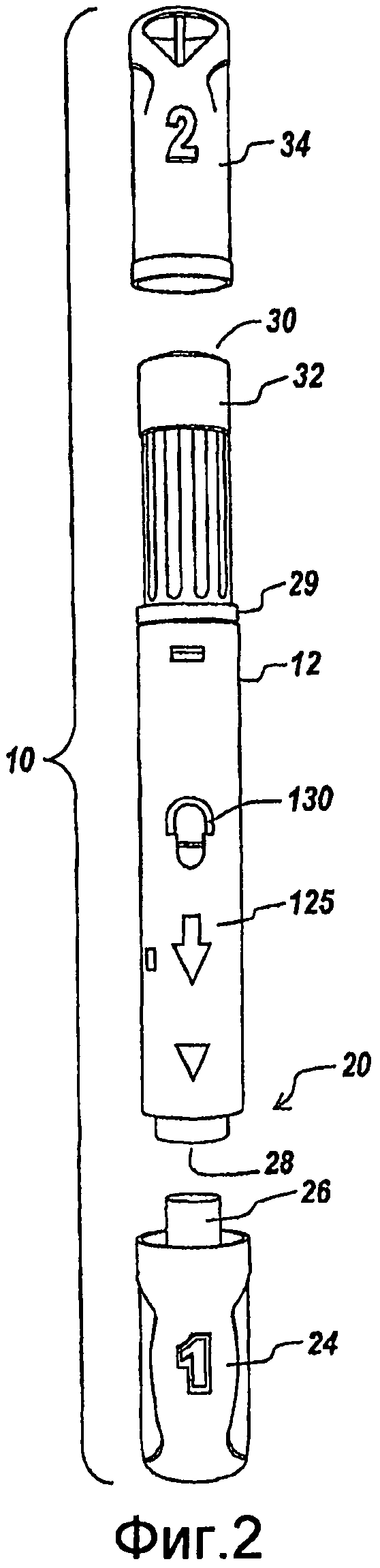





























Изобретение относится к медицинской технике, а именно к инъекционному устройству для инъекции пациенту вещества, такого как лекарственное средство. Автоматическое инъекционное устройство для обеспечения подкожной инъекции вещества пользователю включает корпус, шприц, компонент привода шприца и первый смещающий механизм. Корпус имеет открытый первый конец и второй конец. Шприц подвижно расположен в корпусе. Шприц включает гильзовую часть для вмещения вещества, полую иглу, сообщающуюся по текучей среде с гильзовой частью для выталкивания вещества из шприца, и пробку для герметизации гильзовой части и селективной подачи давления на вещество для принуждения его к движению через полую иглу. Компонент привода шприца предназначен для первого движения шприца по направлению к первому концу корпуса с тем, чтобы игла выступила из первого конца и для последующей подачи давления на пробку. Компонент привода шприца содержит стержневую часть, имеющую первый конец, второй конец и радиально расширенную часть, которая сжимается радиально внутрь для выталкивания текучей среды, и нагнетатель, сформированный на первом конце стержневой части, для селективной подачи давления на пробку, и фланец между вторым концом стержня и радиально расширенной частью. Первый смещающий механизм предназначен для смещения компонента привода шприца в направлении первого открытого конца корпуса. Первый смещающий механизм расположен между фланцем компонента привода шприца и вторым концом корпуса. Набор для упакованного автоматического инъекционного устройства включает вышеуказанное автоматическое инъекционное устройство и спиртовой тампон для подготовки участка кожи к инъекции, упакованные с инструкциями по применению для лечения артрита путем инъекции дозы в кожу пользователя с использованием автоматического инъекционного устройства. Во втором варианте выполнения набор включает упаковочный материал и ранее указанное устройство, включающее дозу ингибитора TNFα. В третьем варианте выполнения набор включает спиртовой тампон для подготовки участка кожи к инъекции и дозовый лоток, где дозовый лоток включает ранее указанное устройство, включающее дозу ингибитора TNFα. В четвертом варианте выполнения набор включает упаковочный материал и ранее указанное устройство, включающее адалимумаб. Изобретение безопасно используется пациентами и содействует соблюдению пациентами предписанных им схем биологической терапии. 5 н. и 54 з.п. ф-лы, 27 ил., 10 табл.
1. Автоматическое инъекционное устройство для обеспечения подкожной инъекции вещества пользователю, включающее:
корпус, имеющий открытый первый конец и второй конец,
шприц, подвижно расположенный в корпусе, причем шприц включает гильзовую часть для вмещения вещества, полую иглу, сообщающуюся по текучей среде с гильзовой частью для выталкивания вещества из шприца, и пробку для герметизации гильзовой части и селективной подачи давления на вещество для принуждения его к движению через полую иглу,
компонент привода шприца для первого движения шприца по направлению к первому концу корпуса с тем, чтобы игла выступила из первого конца и для последующей подачи давления на пробку, причем компонент привода шприца содержит стержневую часть, имеющую первый конец, второй конец и радиально расширенную часть, которая сжимается радиально внутрь для выталкивания текучей среды, и нагнетатель, сформированный на первом конце стержневой части, для селективной подачи давления на пробку, и фланец между вторым концом стержня и радиально расширенной частью; и
первый смещающий механизм для смещения компонента привода шприца в направлении первого открытого конца корпуса, причем первый смещающий механизм расположен между фланцем компонента привода шприца и вторым концом корпуса.
2. Автоматическое инъекционное устройство по п.1, кроме того, включающее кнопку запуска, соединенную с корпусом для приведения в действие компонента привода шприца.
3. Автоматическое инъекционное устройство по п.2, кроме того, включающее защелку, приводимую в действие кнопкой запуска, для защелкивания компонента привода шприца в отведенном назад положении перед приведением в действие кнопки запуска.
4. Автоматическое инъекционное устройство по п.1, кроме того, включающее окно на корпусе для осмотра внутреннего пространства корпуса.
5. Автоматическое инъекционное устройство по п.1 или 4, кроме того, включающее индикатор для индикации того, что содержимое шприца вытолкнуто.
6. Автоматическое инъекционное устройство по п.1, дополнительно включающее по меньшей мере один съемный колпачок для покрытия одного из первого конца и второго конца корпуса.
7. Автоматическое инъекционное устройство по п.1, дополнительно включающее оболочку иглы, которая продвигается по игле, выступающей через первый конец корпуса, после выталкивания вещества из шприца.
8. Автоматическое инъекционное устройство по п.4, где окно, по существу, имеет форму замочной скважины.
9. Автоматическое инъекционное устройство по п.4, где окно включает линию заполнения в некотором положении в окне для индикации полной дозы вещества.
10. Автоматическое инъекционное устройство по п.5, в котором индикатор расположен между радиально расширенной частью и вторым концом компонента привода шприца.
11. Автоматическое инъекционное устройство по п.5, в котором индикатор совмещается с окном, когда содержимое шприца было вытолкнуто из шприца.
12. Автоматическое инъекционное устройство по п.1, в котором корпус дополнительно содержит первый стопор на внутренней поверхности корпуса для ограничения движения шприца в первом направлении и второй стопор на внутренней поверхности корпуса для ограничения движения шприца во втором направлении.
13. Автоматическое инъекционное устройство по п.12, в котором корпус дополнительно включает выступ, сформированный между открытым первым концом и первым стопором для посадки смещающего механизма для смещения шприца в сторону от первого конца корпуса.
14. Автоматическое инъекционное устройство по п.13, в котором корпус включает окно, сформированное в боковой стенке корпуса, для обеспечения возможности визуализации внутренней полости корпуса.
15. Автоматическое инъекционное устройство по п.12, в котором корпус дополнительно включает кнопку запуска, соединенную со вторым концом кожуха для селективного приведения в действие шприца для перемещения из первого отведенного назад положения во второе выступающее положение, в котором игла шприца выступает из первого конца, и, в то время как шприц находится во втором выступающем положении, подачи давления для выталкивания вещества из шприца.
16. Автоматическое инъекционное устройство по п.1, в котором первый стопор сформирован на промежуточной части гильзовой части для упора стопора в корпусе; и
второй стопор сформирован на дистальном конце гильзовой части корпуса.
17. Автоматическое инъекционное устройство по п.16, в котором компонент привода шприца включает плунжер сначала для селективного перемещения шприца по направлению к открытому первому концу корпуса автоматического инъекционного устройства, так что игла выступает из первого конца, а в последующем, подачи давления на пробку для того, чтобы вызвать выталкивание шприцем вещества через полую иглу.
18. Автоматическое инъекционное устройство по п.16, в котором шприц дополнительно включает рецептуру, где рецептура включает адалимумаб, хлорид натрия, одноосновный дигидрофосфат натрия, двухосновный дигидрофосфат натрия, цитрат натрия, моногидрат лимонной кислоты, маннит, полисорбат 80 и воду.
19. Автоматическое инъекционное устройство по п.18, в котором шприц дополнительно включает гидроксид натрия.
20. Автоматическое инъекционное устройство по п.1, в котором компонент привода шприца дополнительно содержит часть крепления, сформированную на втором конце стержневой части для прикрепления спиральной пружины к компоненту привода шприца.
21. Автоматическое инъекционное устройство по п.1, в котором компонент привода шприца дополнительно содержит индикатор для индикации завершения инъекции, сформированный в сплошной стержневой части между радиально расширенной частью и вторым концом.
22. Автоматическое инъекционное устройство по п.21, в котором компонент привода шприца дополнительно содержит удерживающий фланец для удерживания спиральной пружины в сжатом положении до приведения в действие.
23. Автоматическое инъекционное устройство по п.22, в котором компонент привода шприца дополнительно содержит основание пружины для цилиндрической пружины, проходящей между закрепляющим концом и удерживающим фланцем.
24. Автоматическое инъекционное устройство по п.23, в котором основание пружины включает гибкие ножки, вокруг которых намотана пружина.
25. Автоматическое инъекционное устройство по п.24, в котором закрепляющий конец включает опоры с ушками, проходящие от основания и сконфигурированные для вхождения в размыкаемое зацепление с кнопкой запуска.
26. Автоматическое инъекционное устройство по любому из пп.1-4, 6-25, дополнительно включающее дозу ингибитора TNFα.
27. Автоматическое инъекционное устройство по п.26, где ингибитор TNFα выбран из группы, состоящей из анти-TNFα антитела или его связывающей антиген части, гибридного белка TNF или рекомбинантного белка, связывающего TNF.
28. Автоматическое инъекционное устройство по п.27, где гибридный белок TNF представляет собой этанерцепт.
29. Автоматическое инъекционное устройство по п.27, где ингибитор TNFα выбран из группы, состоящей из инфликсимаба, CDP 571, CDP 870, анти-TNF dAb, голимумаба, адалимумаба, этанерцепта, p55TNFRIgG и r-ТВР-1.
30. Автоматическое инъекционное устройство по п.27, где анти-TNFα антитело или его связывающая антиген часть выбраны из группы, состоящей из химерного антитела, гуманизированного антитела и мультивалентного антитела.
31. Автоматическое инъекционное устройство по п.27, где анти-TNFα антитело или его связывающая антиген часть выбраны из группы, состоящей из инфликсимаба, голимумаба и адалимумаба.
32. Автоматическое инъекционное устройство по п.27, где анти-TNFα антитело или его связывающая антиген часть представляет собой человеческое антитело.
33. Автоматическое инъекционное устройство по п.32, где человеческое анти-TNFα антитело или его связывающая антиген часть диссоциируется из человеческого TNFα при Кd 1·10-8 М или менее и константе скорости Кoff 1·10-3 с-1 или менее, обеих определенных поверхностным резонансом плазмона, и нейтрализует цитотоксичность человеческого TNFα в стандартном анализе L929 in vitro при IС50 1·10-7 М или менее.
34. Автоматическое инъекционное устройство по п.32, где человеческое антитело или его связывающая антиген часть имеет следующие характеристики:
a) диссоциируется из человеческого TNFα при константе скорости Koff 1·10-3 с-1 или менее по данным определения поверхностным резонансом плазмона;
b) имеет домен CDR3 легкой цепи, включающий аминокислотную последовательность SEQ ID NO:3, или модифицирован из SEQ ID NO:3 замещением одного аланина в положении 1, 4, 5, 7 или 8 или от одного до пяти консервативными аминокислотными замещениями в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) имеет домен CDR3 тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO:4, или модифицирован из SEQ ID NO:4 замещением одного аланина в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или от одного до пяти консервативными аминокислотными замещениями в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
35. Автоматическое инъекционное устройство по п.32, где человеческое антитело или его связывающая антиген часть включает вариабельную область легкой цепи (LCVR), включающую аминокислотную последовательность SEQ ID NO:1, и вариабельную область тяжелой цепи (HCVR), включающую аминокислотную последовательность SEQ ID NO:2.
36. Автоматическое инъекционное устройство по п.32, где человеческое антитело или его связывающая антиген часть представляет собой адалимумаб.
37. Автоматическое инъекционное устройство по п.26, где указанная доза включает 40 мг дозы.
38. Автоматическое инъекционное устройство по п.37, где доза представляет собой дозу 40 мг адалимумаба.
39. Набор для упакованного автоматического инъекционного устройства, включающий:
автоматическое инъекционное устройство по любому из пп.1-4, 27-38; и спиртовой тампон для подготовки участка кожи к инъекции, упакованные с инструкциями по применению для лечения артрита путем инъекции дозы в кожу пользователя с использованием автоматического инъекционного устройства.
40. Набор для упакованного автоматического инъекционного устройства, включающий:
a) упаковочный материал; и
b) автоматическое инъекционное устройство по любому из пп.1-4, 27-38, включающее дозу ингибитора TNFα.
41. Набор для упакованного автоматического инъекционного устройства, включающий спиртовой тампон для подготовки участка кожи к инъекции и дозовый лоток, где дозовый лоток включает любое из автоматических инъекционных устройств по любому из пп.1-4, 27-38, включающее дозу ингибитора TNFα.
42. Набор по п.39, где ингибитор TNFα выбран из группы, состоящей из анти-TNFα антитела или его связывающей антиген части, гибридного белка TNF или рекомбинантного белка, связывающего TNF.
43. Набор по п.42, где гибридный белок TNF представляет собой этанерцепт.
44. Набор по п.42, где ингибитор TNFα выбран из группы, состоящей из инфликсимаба, CDP 571, CDP 870, анти-TNF dAb, голимумаба, адалимумаба, этанерцепта, p55TNFRIgG и r-ТВР-1.
45. Набор по п.42, где анти-TNFα антитело или его связывающая антиген часть выбраны из группы, состоящей из химерного антитела, гуманизированного антитела и мультивалентного антитела.
46. Набор по п.42, где анти-TNFα антитело выбрано из группы, состоящей из инфликсимаба, голимумаба и адалимумаба.
47. Набор по п.42, где анти-TNFα антитело или его связывающая антиген часть представляет собой человеческое антитело.
48. Набор по п.47, где человеческое анти-TNFα антитело или его связывающая антиген часть диссоциируется из человеческого TNFα при Кd 1·10-8 М или менее и константе скорости Koff 1·10-3 с-1 или менее, обеих определенных поверхностным резонансом плазмона, и нейтрализует цитотоксичность человеческого TNFα в стандартном анализе L929 in vitro при IС50 1·10-7 М или менее.
49. Набор по п.47, где человеческое анти-TNFα антитело или его связывающая антиген часть имеет следующие характеристики:
a) диссоциируется из человеческого TNFα при константе скорости Koff 1·10-3 с-1 или менее по данным определения поверхностным резонансом плазмона;
b) имеет домен CDR3 легкой цепи, включающий аминокислотную последовательность SEQ ID NO:3, или модифицирован из SEQ ID NO:3 замещением одного аланина в положении 1, 4, 5, 7 или 8 или от одного до пяти консервативными аминокислотными замещениями в положениях 1, 3, 4, 6, 7, 8 и/или 9;
c) имеет домен CDR3 тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO:4, или модифицирован из SEQ ID NO:4 замещением одного аланина в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или от одного до пяти консервативными аминокислотными замещениями в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
50. Набор по п.47, где человеческое анти-TNFα антитело или его связывающая антиген часть включает вариабельную область легкой цепи (LCVR), включающую аминокислотную последовательность SEQ ID NO:1, и вариабельную область тяжелой цепи (HCVR), включающую аминокислотную последовательность SEQ ID NO:2.
51. Набор по п.47, где человеческое анти-TNFα антитело или его связывающая антиген часть представляет собой адалимумаб.
52. Набор по п.51, где доза адалимумаба составляет 40 мг дозы.
53. Набор по п.42 дополнительно включает дозу адалимумаба в рецептуре, где рецептура включает адалимумаб, хлорид натрия, одноосновный дигидрофосфат натрия, двухосновный дигидрофосфат натрия, цитрат натрия, моногидрат лимонной кислоты, маннит, полисорбат 80 и воду.
54. Набор по п.53, дополнительно включает дозу 40 мг адалимумаба.
55. Набор по п.53, дополнительно включает гидроксид натрия.
56. Набор для упакованного автоматического инъекционного устройства, включающий:
a) упаковочный материал; и
b) автоматическое инъекционное устройство по п.1, включающее адалимумаб.
57. Набор по п.40, где ингибитор TNFα выбран из группы, состоящей из анти-TNFα антитела или его связывающей антиген части, гибридного белка TNF или рекомбинантного белка, связывающего TNF.
58. Набор по п.41, где ингибитор TNFα выбран из группы, состоящей из анти-TNFα антитела или его связывающей антиген части, гибридного белка TNF или рекомбинантного белка, связывающего TNF.
59. Набор по п.54 дополнительно включает гидроксид натрия.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| ИНЪЕКТОР | 2000 |
|
RU2169584C1 |
| АВТОМАТИЧЕСКОЕ ИЛИ РУЧНОЕ УСТРОЙСТВО ДЛЯ ИНЪЕКЦИЙ ЖИДКОГО ЛЕКАРСТВЕННОГО СРЕДСТВА | 1994 |
|
RU2131748C1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2012-01-10—Публикация
2007-06-29—Подача