1. ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данной заявке согласно § 119(e) 35 U.S.С. (Свод федеральных законов США) испрашивается приоритет для предварительной заявки с серийным №61/703170, поданной 19 сентября 2012 г., содержание которой включено сюда посредством ссылки во всей ее полноте.
2. ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в формате ASCII посредством EFS-Web и является тем самым включенным посредством ссылки во всей его полноте. Указанная копия ASCII, созданная 17 сентября 2013 г., названа 381493-721WO(118133)_SL.txt и имеет размер 6980 байт.
3. ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В-клеточные эпитопы представляют собой сайты молекул, которые распознаются антителами иммунной системы. Идентификация В-клеточных эпитопов в терапевтических белках может быть полезной при конструировании вариантов, которые не индуцируют иммунный ответ при введении пациентам.
В-клеточные эпитопы можно идентифицировать путем индивидуального мутирования аминокислот белка, типично на аланин (аланиновое сканирование), и определения влияния каждой мутации на связывание антителом (Onda et al., 2011, Proc. Natl. Acad. Sci. 108(14): 5742-7). Нарушение связывания белок-антитело после мутагенеза указывает на то, что мутировавший остаток является частью В-клеточного эпитопа, распознаваемого антителом. Обнаружили, что даже одна мутация в В-клеточном эпитопе может устранять связывание с группой антител, направленных на данный белок, и что иммуногенность белка может быть снижена введением мутаций в В-клеточный эпитоп (Nagata, Pastan, 2009, Advanced Drug Delivery Reviews 61: 977-985). Однако данный подход также является времязатратным и трудоемким. Кроме того, аланиновое сканирование не обязательно идентифицирует мутации, которые обеспечили бы наибольшее уменьшение иммуногенности.
Таким образом, существует потребность в простом, нетрудоемком, и, тем не менее, всестороннем способе, который обеспечивает идентификацию и устранение В-клеточных эпитопов.
4. КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем описании предложена система, которая обеспечивает выяснение иммуногенного вклада любой и каждой аминокислоты в пределах интересующей области в исходном антителе. В данном описании предложено то, что аминокислотный остаток в любом, некотором или во всех положениях исходного антитела может быть мутирован до некоторой или всех других 19 аминокислот, и может быть оценен эффект данной мутации на иммуногенность антитела. Также может быть оценен эффект мутаций на уровень экспрессии и/или связывание антитела с молекулой-мишенью, обеспечивая идентификацию вариантов антитела, в которых иммуногенные области устраняются или уменьшаются, сохраняющих, тем не менее, полезные свойства (например, подходящие уровни экспрессии, связывание с молекулой-мишенью). Соответственно, согласно настоящему описанию предложены способы уменьшения иммуногенности антитела. Данные способы основаны на скрининге и на идентификации вариантов антитела с пониженным связыванием с антиидиотипическими антителами. Уменьшение связывания с антиидиотипическими антителами коррелирует с пониженной иммуногенностью in vivo (см., например, Nagata, Pastan, 2009, Advanced Drug Delivery Reviews 61: 977-985).
Способы по данному изобретению обычно включают стадии (а) приведения в контакт библиотеки клеток-хозяев с антиидиотипическим антителом, которое специфично связывается с исходным антителом, причем исходное антитело представляет собой моноклональное антитело, которое связывается с молекулой-мишенью, библиотека клеток-хозяев содержит клетки-хозяева млекопитающих, каждая из которых экспрессирует на поверхности клетки вариант антитела, отличающийся от исходного антитела одной точечной мутацией аминокислоты; (б) осуществления идентификации популяции клеток в указанной библиотеке клеток-хозяев, которые экспрессируют варианты антитела, демонстрирующие пониженное связывание с антиидиотипическим антителом относительно исходного антитела; и (в) осуществления идентификации варианта антитела, которым обогащена данная популяция, идентифицируя посредством этого вариант исходного антитела с пониженной иммуногенностью. В некоторых аспектах данные способы влекут за собой подвергание библиотеки клеток-хозяев проточной цитометрии и сортировке популяции из библиотеки клеток-хозяев с использованием, например, сортировки клеток, активированной флуоресценцией (FACS).
В некоторых аспектах данные способы дополнительно включают стадию определения того, связывается ли вариант антитела, имеющий пониженную иммуногенность, с молекулой-мишенью на уровне, который по существу является равным или лучшим, чем для исходного антитела, и/или экспрессируется ли он на уровне, который по существу является равным или лучшим, чем уровень экспрессии исходного антитела. В конкретных воплощениях связывание и экспрессию определяют посредством проточной цитометрии, сортировки с использованием магнитных шариков, BIAcore, FACS, ELISA (твердофазный иммуноферментный анализ), AlphaLisa или KinExA (кинетический эксклюзионный анализ), и определяют до, одновременно с или после идентификации вариантов антитела, имеющих пониженную иммуногенность.
Описанные здесь способы применяли к антителу против TNF-α (фактор некроза опухолей-альфа) D2E7 (также известному как адалимумаб). Идентифицировали варианты D2E7 с пониженным связыванием с одним, двумя или тремя разными антиидиотипическими антителами. Согласно настоящему изобретению предложены антитела против TNF-α с последовательностями CDR (определяющая комплементарность область), родственными последовательностям D2E7, но которые имеют по меньшей мере одну замену, которая уменьшает связывание с анти-Id (антиидиотипическими) антителами. Такие варианты иногда здесь называются вариантами с «пониженной иммуногенностью».
Антитела против TNF-α по данному изобретению содержат шесть CDR, имеющих аминокислотные последовательности, соответствующие SEQ ID NO: 5 (CDR-H1), SEQ ID NO: 6 (CDR-H2), SEQ ID NO: 7 (CDR-H3), SEQ ID NO: 8 (CDR-L1), SEQ ID NO: 9 (CDR-L2) и SEQ ID NO: 10 (CDR-L3), и имеют по меньшей мере одну замену, выбранную из G5F в CDR-L1, G5I в CDR-L1, G5V в CDR-L1, G5W в CDR-L1, G5Y в CDR-L1, R7I в CDR-L1, R7T в CDR-L1, R7V в CDR-L1,
N8A в CDR-L1, N8D в CDR-L1, N8E в CDR-L1, N8G в CDR-L1, N8L в CDR-L1, N8M в CDR-L1, N8Q в CDR-L1, N8R в CDR-L1, N8T в CDR-L1, A1I в CDR-L2, А1Т в CDR-L2, A1V в CDR-L2, T4D в CDR-L2, R2G в CDR-L3, N4F в CDR-L3, N4M в CDR-L3, N4W в CDR-L3, N4Y в CDR-L3, R5L в CDR-L3, R5N в CDR-L3, R5W в CDR-L3, R5Y в CDR-L3, T9Y в CDR-L3, D1S в CDR-H1, Y2A в CDR-H1, Y2C в CDR-H1, Y2K в CDR-H1, Y2M в CDR-H1, Y2R в CDR-H1, Y2S в CDR-H1, Y2V в CDR-H1, Н5С в CDR-H1, H5D в CDR-H1, Н5Е в CDR-H1, H5S в CDR-H1, Н5Т в CDR-H1, Т3А в CDR-H2, T3G в CDR-H2, T3N в CDR-H2, W4A в CDR-H2, W4F в CDR-H2, W4H в CDR-H2, W4L в CDR-H2, W4M в CDR-H2, W4V в CDR-H2, N5G в CDR-H2, S6D в CDR-H2, S6L в CDR-H2, I9K в CDR-H2, D10L в CDR-H2, Y11A в CDR-H2, Y11C в CDR-H2, Y11E в CDR-H2, Y11F в CDR-H2, Y11G в CDR-H2, Y11H в CDR-H2, Y11I в CDR-H2, Y11K в CDR-H2, Y11L в CDR-H2, Y11M в CDR-Н2, Y11N в CDR-H2, Y11Q в CDR-H2, Y11R в CDR-H2, Y11S в CDR-H2, Y11V в CDR-H2, Y11W в CDR-H2, A12Y в CDR-H2, D13N в CDR-H2, V15D в CDR-H2, V15L в CDR-H2, V15M в CDR-H2, V15Q в CDR-H2, V15T в CDR-H2, E16F в CDR-Н2, Е16Н в CDR-H2, Е16K в CDR-H2, E16R в CDR-H2, Е16Т в CDR-H2, E16W в CDR-H2, G17A в CDR-H2, G17C в CDR-H2, G17E в CDR-H2, G17H в CDR-H2, G17I в CDR-H2, G17K в CDR-H2, G17L в CDR-H2, G17M в CDR-H2, G17N в CDR-Н2, G17P в CDR-H2, G17Q в CDR-H2, G17R в CDR-H2, G17S в CDR-H2, G17T в CDR-H2, G17Y в CDR-H2, V1G в CDR-H3, V1R в CDR-H3, V1W в CDR-H3, L4T в CDR-H3, L4V в CDR-H3, T6V в CDR-H3, S9K в CDR-H3, S9W в CDR-H3, S9Y в CDR-H3 и D11V в CDR-H3. Шесть данных CDR могут в совокупности иметь вплоть до 8, вплоть до 7, вплоть до 6, вплоть до 5 или вплоть до 4 аминокислотных замен по сравнению с последовательностями CDR адалимумаба. В некоторых аспектах каждая CDR может иметь вплоть до 4, вплоть до 3 или вплоть до 2 замен по сравнению с CDR адалимумаба. В конкретных воплощениях антитела против TNF-α по данному изобретению имеют одну или более чем одну комбинацию аминокислотных замен, при которой замена(ы) в тяжелой цепи, при ее (их) наличии, содержит(ат) по меньшей мере одну из (а) Y2K в CDR-H1; (б) Y2M в CDR-H1; (в) Y2K в CDR-H1 и T6V в CDR-H3; (г) Y2K в CDR-H1, V1G в CDR-H3 и T6V в CDR-H3; (д) V1W в CDR-H3; и (е) V1G в CDR-H3 и T6V в CDR-H3, и при которой замена(ы) в легкой цепи, при ее (их) наличии, содержит(ат) по меньшей мере одну из (а) G5S в CDR-L1 и A11S в CDR-L1; (б) R7I в CDR-L1; (в) G5S в CDR-L1, R7T в CDR-L1 и A11S в CDR-L1; и (г) G5S в CDR-L1, R7I в CDR-L1 и A11S в CDR-L1. В конкретных воплощениях антитела по данному изобретению содержат комбинацию аминокислотных замен, выбранных из замен, представленных на ФИГ. 22.
Антитела против TNF-α по данному изобретению предпочтительно имеют ослабленное связывание с одним, двумя, тремя, четырьмя, пятью или всеми шестью антиидиотипическими антителами против адалимумаба 5А1, 10F8, 7А11, 1Н11, 6А11 и 10В7.
Настоящее изобретение дополнительно относится к нуклеиновокислотным молекулам, кодирующим антитела против TNF-α по данному изобретению, и к содержащим их клеткам-хозяевам.
Настоящее изобретение дополнительно относится к фармацевтическим композициям, содержащим антитела против TNF-α по данному изобретению, и к способам лечения пациента-человека, страдающего от иммунного расстройства, путем введения данных антител против TNF-α или содержащих их фармацевтических композиций. В определенных аспектах иммунным расстройством, которое лечат, является ревматоидный артрит (RA) (включая RA от умеренного до тяжелого у взрослых), ювенильный идиопатический артрит (ЛА) (включая ЛА от умеренного до тяжелого полиартикулярного у пациентов в возрасте 4 года и старше), псориатический артрит (PsA) (включая PsA у взрослых), анкилозирующий спондилит (AS) (включая AS у взрослых), болезнь Крона (CD) (включая CD от умеренной до тяжелой у взрослых), хронический бляшечный псориаз (Ps) (включая хронический бляшечный псориаз от умеренного до тяжелого у взрослых) или аксиальный спондилоартрит (axSpA) (включая тяжелый axSpA у взрослых пациентов, которые не имеют рентгенологического доказательства структурного повреждения).
5. КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1А - 1В: на ФИГ. 1А представлены транслируемые аминокислотные последовательности фрагментов вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) синтетического D2E7 (адалимумаб, HUMIRA). На ФИГ. 1Б представлены аминокислотные последовательности CDR фрагментов VH и VL D2E7. На ФИГ. 1В представлены нуклеотидные последовательности фрагментов VH D2E7 и VL D2E7 (SEQ ID NO: 1 и SEQ ID NO: 3 соответственно).
На ФИГ. 2: представлен список полезных мутаций в VL D2E7, которые будут приводить к нейтральному связыванию с TNF-α и ослабленному связыванию с анти-Id 5А1 (а), 10F8 (б) или 7А11 (в). Положения аминокислот приведены в контексте как индивидуальных CDR, так и нумерации по Kabat. На ФИГ. 2 раскрыты SEQ ID NO: 8-10, соответственно, в порядке появления.
ФИГ. 3А - 3Б: на ФИГ. 3А представлен список полезных мутаций в CDR-H1 и CDR-H2 VH D2E7, которые будут приводить к нейтральному связыванию с TNF-α и ослабленному связыванию с анти-Id 1Н11 (г), 6А11 (д) или 10В7 (е). На ФИГ. 3Б представлен список полезных мутаций в CDR-H3 VH D2E7, которые будут приводить к нейтральному связыванию с TNF-α и ослабленному связыванию с анти-Id 1Н11 (г), 6А11 (д) или 10В7 (е). Положения аминокислот приведены в контексте как индивидуальных CDR, так и нумерации по Kabat. На ФИГ. 3А раскрыты SEQ ID NO: 5-6 соответственно в порядке появления. На ФИГ. 3Б раскрыта SEQ ID NO: 7.
На ФИГ. 4 представлена структура D2E7 в векторах pYA206 и pCW600.
На ФИГ. 5 представлен график титрования человеческого TNF-α на Fab D2E7 дикого типа (WT), экспрессируемом на поверхности клетки.
На ФИГ. 6 представлен график титрования связывания антиидиотипических антител (анти-Id) с Fab D2E7 дикого типа (WT), экспрессируемым на поверхности клетки.
ФИГ. 7А - 7Б: на ФИГ. 7А представлены профили сортировки FACS для D2E7 дикого типа, окрашенного TNF-α. На ФИГ. 7Б представлены профили сортировки FACS для библиотеки точечных мутаций VH, окрашенных TNF-α.
На ФИГ. 8А - 8Б представлены профили сортировки FACS для D2E7 дикого типа и библиотеки точечных мутаций VH, окрашенных 1Н11.
На ФИГ. 9 представлены отношения обогащения молчащих мутаций кодонов D2E7 по положению. Положения аминокислот приведены в контексте индивидуальных CDR.
На ФИГ. 10 представлена карта планшета с подбиблиотеками D2E7. Положения аминокислот приведены в контексте как индивидуальных CDR, так и нумерации по Kabat. На ФИГ. 10 раскрыты SEQ ID NO: 8-10 и 5-7 сверху вниз, слева направо, соответственно, в порядке появления.
На ФИГ. 11 представлены профили FACS подбиблиотек мутантных D2E7 и контролей дикого типа.
На ФИГ. 12 представлены профили FACS подбиблиотек мутантных D2E7 и контролей дикого типа.
На ФИГ. 13А - 13Г представлена модель заполнения пространства вариабельной области тяжелой цепи D2E7. На панелях А, Б и В серым показаны CDR1, 2 и 3 легкой цепи соответственно. На панели Г серым показан эпитоп анти-Id 1Н11. В последовательности VH (SEQ ID NO: 2), описанной ниже, CDR показаны подчеркнутыми, а положения, которые являются важными для связывания с анти-Id 1Н11, - жирным дважды подчеркнутым текстом. Каждая из трех CDR дает один или более чем один аминокислотный остаток в эпитоп.
На ФИГ. 14А - 14Г представлена модель заполнения пространства вариабельной области легкой цепи D2E7. На панелях А, Б и В серым показаны CDR1, 2 и 3 легкой цепи соответственно. На панели Г серым показан эпитоп анти-Id 5А1 и 10F8. В последовательности VL (SEQ ID NO: 4), описанной ниже, CDR показаны подчеркнутыми, а положения, которые являются важными для связывания с анти-Id 5А1 и 10F8, - жирным дважды подчеркнутым текстом. Каждая из трех CDR дает один или более чем один аминокислотный остаток в эпитоп.
На ФИГ. 15 представлен одноточечный анализ FACS мутантов CDR1-2 VH D2E7.
На ФИГ. 16 представлен репрезентативный позиционный анализ D2E7.
На ФИГ. 17 представлены средние отношения обогащения 1Н11 по положению.
На ФИГ. 18 представлены средние отношения обогащения 5А1 по положению.
На ФИГ. 19 представлены средние отношения обогащения 10F8 по положению.
На ФИГ. 20А - 20Б показано влияние мутаций антитела против TNF-α на связывание антител против адалимумаба в образцах сыворотки от четырех оплачиваемых доноров. Положения аминокислот приведены согласно нумерации по Kabat. VL-SS относится к VL, имеющей замены G28S и A34S в CDR-L1 (нумерация по Kabat), соответствуя комбинации G5S плюс A11S в CDR-L1.
На ФИГ. 21А - 21Б показаны варианты антител против TNF-α с наибольшим снижением связывания с антителами против адалимумаба. VL-SS относится к VL, имеющей замены G28S и A34S в CDR-L1 (нумерация по Kabat), соответствуя комбинации G5S плюс A11S в CDR-L1.
На ФИГ. 22 показаны данные по связыванию для вариантов с множественными заменами аминокислот.VL-SS относится к VL, имеющей замены G28S и A34S в CDR-L1 (нумерация по Kabat), соответствуя комбинации G5S плюс A11S в CDR-L1.
6. ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
6.1. Способы идентификации антител с пониженной иммуногенностью
Согласно настоящему изобретению дополнительно предложена система, которая обеспечивает выяснение иммуногенного вклада любой и каждой аминокислоты в интересующей области в пределах интересующего антитела (исходного антитела). Данные способы включают подвергание исходного антитела всеохватывающему мутагенезу в одной или более чем одной области (например, в одной или более чем одной CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2, CDR-H3, FR-L1, FR-L2, FR-L3, FR-H1, FR-H2, FR-H3 и FR-H4) и оценку влияния мутаций на связывание с антиидиотипическим антителом («анти-Id»). Описанные здесь способы приводили к идентификации описанных выше вариантов антител против TNF-α с пониженной иммуногенностью.
Конструирование и построение библиотеки: конструируется библиотека антител, которая содержит каждую возможную замену одной аминокислоты в каждом возможном положении в желаемой области или домене исходного антитела, для идентификации эффекта (хорошего, плохого или нейтрального) мутации на связывание с анти-Id антителом. Затем строят библиотеку вариантов антитела, например с использованием «рандомизированных кодонов NNK» с получением вариантов с заменой одной аминокислоты, где «N» относится к любому основанию (например, А, С, G или Т) и «K» относится либо к G, либо к Т. При схеме рандомизации NNK могут кодироваться 32 разных кодона, покрывающих все 20 встречающихся в природе аминокислот. Аминокислотные остатки в каждом положении антитела можно мутировать до любой из 19 аминокислот, которые отличаются от аминокислоты дикого типа в том же самом положении, что приводит к точечной мутации одной аминокислоты в данном антителе. Конечным результатом является библиотека вариантов антитела, охватывающая группы из множества антител, имеющих один остаток, который отличается от члена к члену данной библиотеки. Общее множество составляющих библиотеки может насчитывать примерно 50-10000 членов (например, 50, 100, 500, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000, 5500, 6000, 6500, 7000, 7500, 8000, 8500, 9000, 9500 или 10000 членов), примерно 1000-5000 членов или примерно 1000 членов, на основании числа аминокислот, намеченных для мутации. Независимо от размера и сложности библиотеки, описанные здесь способы обеспечивают одновременный скрининг и одновременное секвенирование всех членов библиотеки.
В качестве неограничивающего примера для идентификации конкретных вариантов антитела с пониженной иммуногенностью по сравнению с исходным антителом аминокислотные остатки в определяющих комплементарность областях (CDR) являются потенциальными мишенями для мутации. Устранение или уменьшение В-клеточного эпитопа может давать антитело с пониженной иммуногенностью. Типично для мутации можно рассматривать и идентифицировать примерно от 50 до 60 положений аминокислот CDR. Можно конструировать и строить набор синтетических фрагментов ДНК, которые кодируют родительские VH или VL дикого типа и все возможные варианты антитела с заменой одной аминокислоты. Для получения вариантов антитела с заменой одной аминокислоты можно использовать описанные выше рандомизированные кодоны NNK. Таким образом, аминокислотные остатки в каждом положении в пределах CDR можно мутировать, что приводит к одноаминокислотным точечным мутациям вдоль выбранной области CDR. Конечным результатом являются библиотеки вариантов антитела, которые представляют собой группы из множества антител, имеющих один остаток, который отличается от члена к члену в данной библиотеке. В этом примере библиотека имеет приблизительно 1000-1300 членов, где в каждом из 50-60 или 65 положений аминокислот CDR в выбранной области производится замена на одну из 19 встречающихся в природе аминокислот всего для 20 разных аминокислот в любом данном положении (т.е. 50×20=1000; 60×20=1200 или 65×20=1300).
Экспрессия вариантов антитела: после построения библиотеки второй стадией является экспрессия библиотеки вариантов антитела для сортировки посредством дисплея на поверхности клетки. Библиотеку вариантов можно экспрессировать с использованием способов на основе дисплея, таких как, например, фаговый дисплей, дрожжевой дисплей, бактериальный дисплей и рибосомальный дисплей, и она предпочтительно экспрессируется в клетках млекопитающих для обеспечения правильного сворачивания и посттрансляционной модификации экспрессируемых вариантов.
Для экспрессии у млекопитающих трансмембранные домены, используемые для связывания и дисплея тетрамерных молекул иммуноглобулинов на поверхности клетки, могут представлять собой любой трансмембранный домен, способный к удалению посредством ферментативного, химического или фотолитического расщепления. В некоторых воплощениях трансмембранный домен фланкирован сайтами расщепления, которые распознаются и расщепляются расщепляющим ферментом. Например, расщепляющий фермент может представлять собой липазу, эстеразу, фосфатазу, гликозидазу или карбоксипептидазу. В некоторых воплощениях трансмембранный домен содержит олигонуклеотид или олигонуклеотидный аналог, имеющий последовательность, которая распознается и расщепляется нуклеазой, такой как рибонуклеаза (РНКаза) или дезоксирибонуклеаза (ДНКаза). В некоторых воплощениях трансмембранный домен содержит пептид или пептидный аналог, который распознается и расщепляется протеазой.
В некоторых воплощениях для получения иммуноглобулинов с трансмембранным доменом или без него можно использовать сплайсинг мРНК (матричная РНК) (см., например, патент США №7947495, включенный сюда посредством ссылки во всей его полноте).
В других воплощениях трансмембранный домен фланкирован рекомбиназными сайтами распознавания, которые распознаются рекомбиназой. Примеры рекомбиназных сайтов распознавания включают сайты lox, сайты att, сайты dif и сайты frt, но не ограничиваются ими. Относительно обзоров рекомбиназ, см., например, Sauer, 1994, Curr. Opin. Biotech. 5: 521-527; Landy, 1993, Curr. Opin. Biotech. 3: 699-707; Sadowski, 1993, FASEB 7: 760-767 и публикацию патента США №20040115814.
Трансмембранные домены для применения в описанных здесь композициях и способах могут происходить из мембранных белков типа I, типа II и типа III (см., например, Chesnut et al., 1996, J. Imm. Methods, 193: 17-27; Wahlberg et al., 1997, J. Cell Biol., 137: 555-562; Liao, 2001, Biotech, and Bioeng., 73: 313-323 и патенты США №5264357 и 6686168). Описанные здесь трансмембранные домены можно использовать для получения слитых белков иммуноглобулин-трансмембранный домен, содержащих полноразмерные антитела (например, IgG) или их фрагменты, которые связаны с и подвергаются дисплею на поверхности клеток, экспрессирующих слитые белки.
Трансмембранные домены, которые являются особенно полезными в описанных здесь композициях и способах, включают трансмембранный домен рецептора фактора роста тромбоцитов (PDGF-R) (см., например, Chesnut et al., 1996, J. Imm. Methods, 193: 17-27), трансмембранный домен B7-1 (см., например, Chou et al., 1999, Biotech. & Bioeng., 65(2): 160-169) и трансмембранный домен рецептора асиалогликопротеина (ASGPR) (см., например, Liao, 2001, Biotech. & Bioeng., 73: 313-323). В некоторых воплощениях термин «домен, связывающий с поверхностью клетки» относится к сигнальной последовательности GPI, которая направляет заякоривание иммуноглобулина на поверхности клетки посредством гликозилфосфатидилинозитольного (GPI) линкера (см., например, Medof et al., 1987, Proc. Natl. Acad. Sci. USA, 84: 2007-2011 и патенты США №5109133 и 5264357). В определенных случаях сигнальная последовательность GPI происходит из человеческого фактора ускорения распада (DAF). В других воплощениях якорь в виде трансмембранного домена поверхности клетки происходит из иммуноглобулинового белка.
Дисплейные векторы млекопитающих можно использовать для дисплея интактных антител, хотя дисплею также можно подвергать и фрагменты антитела, такие как, например, Fc, Fab', F(ab)'2 и одноцепочечный Fv. Как тяжелая, так и легкая цепи могут кодироваться в виде одного транскрипта посредством применения элемента участка внутренней посадки рибосомы (IRES), который соединяет полинуклеотидную последовательность, кодирующую вариабельные и константные области легких цепей с полинуклеотидом, кодирующим вариабельные и константные области тяжелых цепей.
В одном воплощении дисплейные векторы млекопитающих содержат удаляемый GPI якорь, слитый с С-концом константной области тяжелой цепи, для облегчения выделения антител с желаемыми характеристиками связывания и биологическими активностями. GPI якорь, при его наличии, обеспечивает дисплей молекул иммуноглобулинов на поверхности клетки-хозяина млекопитающего. Удаление GPI якоря посредством расщепления подходящими эндонуклеазами рестрикции обеспечивает превращение мембраносвязанных молекул иммуноглобулинов в растворимые.
Примеры подходящих клеток-хозяев млекопитающих включают клетки HeLa (клетки HeLa S3, АТСС CCL2.2), клетки Jurkat, клетки Raji, клетки Daudi, клетки эмбриональной почки человека (293-HEK; АТСС 293с18, АТСС CRL 1573), клетки почки африканской зеленой мартышки (CV-1; Vero; АТСС CRL 1587), клетки почки обезьяны, трансформированные SV40 (COS-1; АТСС CRL 1650), клетки почки собаки (MDCK; АТСС CCL 34), клетки почки детеныша хомяка (BHK-21, BHK-570; АТСС CRL 8544, АТСС CRL 10314), клетки яичника китайского хомяка (СНО-K1; АТСС CCL61; СНО DG44 (Chasin et al., 1986, Som Cell Molec Genet, 12, 555)) и другие линии клеток грызунов, такие как NSO, SP2/O, GH1 (АТСС CCL82), H-4-II-E (АТСС CRL 1548) и NIH-3T3 (АТСС CRL 1658).
В одном воплощении можно использовать способы и векторы, описанные в патенте США №7947495, включенном сюда посредством ссылки во всей его полноте. Система дисплея на поверхности клетки млекопитающего включает самореплицирующиеся векторы и клетки млекопитающих. Самореплицирующиеся векторы млекопитающих типично содержат: (1) самореплицирующуюся точку начала репликации; (2) по меньшей мере один эукариотический промотор; (3) фиксированный или удаляемый трансмембранный домен; (4) константную область легкой цепи; (5) константную область тяжелой цепи; (6) сайты рестрикции для вставки вариабельных областей легкой и тяжелой цепи; (7) участок внутренней посадки рибосомы (IRES) и (8) по меньшей мере один селектируемый маркер. Кроме того, векторы могут содержать прокариотическую точку начала репликации, терминатор транскрипции, сигнал полиаденилирования и/или лидерные последовательности, а также другие последовательности, необходимые для экспрессии в эукариотических клетках-хозяевах. После трансформации клетки-хозяева инкубируют при условиях, которые обеспечивают экспрессию антител. Образующиеся плазмиды можно легко выделять из клеток, как описано (см., например, Hirt, 1967, J. Mol. Biol., 26, 365-369).
Помимо приведенных выше методик для дисплея на поверхности клетки библиотек вариантов антитела можно использовать дрожжевую библиотеку поверхностного дисплея. Методика дрожжевого поверхностного дисплея (обзор дан в Boder, Wittrup, 2000, Methods in Enzymology 328: 430-444, которая включена сюда посредством ссылки во всей ее полноте) обеспечивает экспрессию библиотек антител на дрожжевой клеточной стенке в форме, доступной для взаимодействия с меченой молекулой для анализа в способах сортировки клеток. В одном воплощении варианты экспрессируются в виде слитых белков со всем или с частью дрожжевого белка AGA2, который подвергается дисплею на поверхности дрожжевой клеточной стенки, для сортировки согласно описанным ниже способам. См., например, Boder et al., 1997, Nat. Biotechnol. 15: 553-557 и Feldhaus et al., 2003, Nat. Biotechnol. 21: 163-170.
Также можно использовать фаговый дисплей вариантов антитела. Цепи антитела могут экспрессироваться в виде слитых белков с белком оболочки фага из наружной поверхности фага. Затем пакеты дисплея можно подвергать скринингу на предмет дисплея антител, связывающихся с мишенью. В одном воплощении варианты антитела подвергаются дисплею одновалентным образом из частиц нитчатого фага в виде слияний с продуктом гена III М13, упакованных в каждую частицу и экспрессируемых на внешней стороне фага. Способы фагового дисплея антител известны специалистам в данной области и описаны, например, в Hoogenboom, "Overview of Antibody Phage-Display Technology and Its Applications," из Methods in Molecular Biology: Antibody Phage Display: Methods and Protocols (2002) 178: 1-37 (O'Brien, Aitken, eds., Human Press, Totowa, N.J.).
В другом воплощении для экспрессии вариантов антитела используют методику рибосомального дисплея (см. Hanes et al., 2000, Meth. Enzymol. 328: 403-430; Pluckthun et al., 2000, Adv. Prot. Chem. 55: 367-403; Lipovsek, Pluckthun, 2004, J. Immunological Methods 290: 51-67). Технология рибосомального дисплея включает трансляцию in vitro и ковалентную или нековалентную связь между генотипом, таким как РНК, и кодируемым фенотипом, таким как вариант антитела, для отбора антител-вариантов, которые имеют ослабленное связывание с анти-Id антителами. Библиотеку получают путем осуществления синтеза пула ДНК различных последовательностей, которые затем транскрибируют с получением пула мРНК. Для получения подвергающихся дисплею кодируемых полипептидов или белков используют трансляцию in vitro и отбирают желаемые взаимодействия связывания с использованием иммобилизованного партнера связывания. Для получения кДНК (комплементарная ДНК), которые затем могут амплифицироваться, можно использовать мРНК, кодирующие связывающие молекулы, и процесс можно повторять для обогащения популяции генами, кодирующими антитела-варианты с желаемыми характеристиками. Отобранные белки можно идентифицировать путем клонирования индивидуальных кодирующих последовательностей и секвенирования ДНК.
Для экспрессии антител-вариантов также можно использовать систему бактериального дисплея. См., например, Skerra et al., 1988, Science 240: 1038-1041; Better et al., 1988, Science 240: 1041-1043; Harvey et al., 2004, Proc. Nat'l Acad. Sci. USA 101 (25): 9193-9198 и Mazor et al., 2007, Nat. Biotechnol. 25(5): 563-565.
Сортировка библиотеки: клетки-хозяева, осуществляющие дисплей экспрессируемых вариантов антитела, можно сортировать с использованием анализов обогащения на основе аффинности. Антитела-варианты можно сортировать на основе их (1) потери связывания с анти-Id, (2) возможно, сохранения связывания с антигеном-мишенью и (3) возможно, уровней экспрессии. Анти-Id представляют собой антитела, направленные против вариабельных областей других антител. По этой причине антигенсвязывающий сайт анти-Id может быть аналогичным молекуле-мишени, связываемой антителом, распознаваемым анти-Id. Способы получения анти-Id известны в данной области и обычно включают использование интересующего антитела (например, исходного антитела) в качестве иммуногена для получения антител традиционными способами, такими как способы, описанные ниже для исходного антитела. Анти-Id антитела могут быть моноклональными антителами или человеческого, или животного происхождения.
Примеры подходящих анализов для применения в сортировке вариантов антитела, включают сортировку клеток, активированную флуоресценцией (FACS), сортировку с использованием магнитных шариков, технологию скрининга антител CellSpot™ от Trellis Bioscience, Inc. (Южный Сан-Франциско, СА) и/или использование системы скрининга клонов клеток млекопитающих ClonePix FL от Genetix Ltd. (Hampshire, Великобритания), но не ограничиваются ими.
Для сортировки FACS клетки инкубируют с флуоресцентно меченным антителом (например, анти-Id или антителом, которое выявляет общий эпитоп в немутагенизированных частях вариантов) или антигеном-мишенью в концентрации, близкой к константе диссоциации (KD) в отношении аффинности исходного антитела, для максимального различения между исходным антителом и вариантами с аналогичными аффинностями. Окрашенные клетки сортируют на одну или более чем одну подпопуляцию таким образом, чтобы частоты вариантов с интересующим свойством либо возрастали, либо снижались в релевантной подпопуляции.
Сортировку на предмет связывания с анти-Id можно осуществлять с использованием любого из вышеописанных способов. В общем, клетки, экспрессирующие варианты антитела, инкубируют с анти-Id и сортируют по количеству связавшегося анти-Id. От клеток, экспрессирующих исходное антитело, можно получать значение исходного связывания, и можно идентифицировать клетки, которые демонстрируют пониженное связывание с анти-Id, путем сортировки клеток на подпопуляции, имеющие количество связавшегося анти-Id выше или ниже исходного значения.
Возможно, клетки, экспрессирующие варианты антитела, также сортируют на основании уровней экспрессии. Общее количество флуоресцентного антитела или антигена, связавшихся с клеткой, экспрессирующей вариант антитела, на протяжении, например, FACS, относят и к аффинности связывания, и к общему количеству антитела-варианта, подвергающегося дисплею. Количество антитела-варианта, подвергающегося дисплею, может варьировать от клона к клону. Таким образом, в некоторых случаях клетки, экспрессирующие интересующие антитела-варианты, например, полноразмерный IgG, связанный с поверхностью клетки через якорь в виде трансмембранного домена, можно сортировать, используя FACS с использованием флуоресцентно меченного антитела против данного иммуноглобулина (например, антитела против IgG) (помимо сортировки на предмет связывания с анти-Id). Разные антитела, используемые для выявления разных свойств, например анти-Id и антитело против IgG, используемое для выявления уровней экспрессии, типично метят флуорофорами, имеющими разные спектры возбуждения и/или испускания, обеспечивая посредством этого двухцветную систему выявления.
Клетки также можно сортировать на предмет связывания мишени. Типично будет желательным отбор варианта антитела, который сохраняет связывание с мишенью, например варианта с приблизительно равным или большим связыванием с молекулой-мишенью по сравнению с исходным антителом. Библиотеки, совместно окрашенные анти-Id и молекулой-мишенью, можно сортировать посредством FACS на две подпопуляции: первую популяцию с превышением определенного порога связывания мишени и вторую популяцию, дважды сортированную на предмет связывания с мишенью, а также на пониженное связывание с антиидиотипическим антителом. Разные молекулы, используемые для выявления разных свойств, например анти-Id и молекулу-мишень, типично метят флуорофорами, имеющими разные спектры возбуждения и/или испускания, предоставляя посредством этого двухцветную систему выявления.
В других воплощениях клетки можно сортировать на предмет связывания с анти-Id, уровней экспрессии и связывания мишени. В данных воплощениях можно использовать трехцветную систему выявления с использованием трех различимых меток.
При использовании двойного или тройного окрашивания для одновременной сортировки на предмет связывания с анти-Id и уровней экспрессии, и/или связывания с мишенью меченую мишень и меченые антитела типично метят флуорофорами, имеющими разные спектры возбуждения и/или испускания, предоставляя посредством этого двухцветную или трехцветную систему выявления. Сортировку на разные популяции также можно проводить серийно. Например, клетки, сортированные на подпопуляцию, имеющую пониженное связывание с анти-Id, можно сортировать на другие подпопуляции на основе связывания мишени и уровней экспрессии, причем сортировка на основе связывания мишени и уровней экспрессии происходит одновременно или последовательно. В других воплощениях варианты, идентифицированные во время сортировки на предмет связывания с антиидиотипическим антителом (и экспрессирующие их клетки-хозяева), характеризуют на предмет связывания мишени с использованием независимых способов подтверждения, описанных ниже.
Анализ сортированных популяций: после сортировки на подпопуляции частоту каждого варианта антитела в каждой подпопуляции можно определять посредством секвенирования плазмид, кодирующих варианты. Предпочтительным способом секвенирования ДНК по изобретению является «массовое параллельное секвенирование» или «массовое параллельное пиросеквенирование» (см., например, патенты США №6787308; 6833246; 6897023; 6956114; 7057026; 7115400, 7211390 и 7232656). Данный способ обеспечивает быстрое и недорогое секвенирование ДНК и ускоряет идентификацию конкретных вариантов антитела с желательной активностью или характеристиками.
После секвенирования можно осуществлять статистический анализ последовательностей для идентификации желаемых вариантов. Такой анализ может включать компьютерный анализ необработанных последовательностей ДНК. Необработанные последовательности ДНК могут быть переведены в последовательность белка, выровнены и сравнены с исходным антителом для идентификации мутаций. Частоту каждой аминокислоты, наблюдаемой в каждом положении, можно свести в таблицу для типа категории (например, пониженная иммуногенность и увеличение, уменьшение или нейтральная экспрессия или аффинность в отношении молекулы-мишени) и сравнить с исходным антителом. Вариантами с желательной активностью, такими как, например, варианты, у которых снижена иммуногенность, сохраняется экспрессия и/или сохраняется связывание с молекулой-мишенью, отобранная популяция будет обогащена, тогда как вариантами с нежелательными активностями отобранная популяция будет обеднена.
Для каждого варианта можно рассчитывать отношение обогащения (ER), которое дает меру степени обогащения или обеднения популяции вариантом по сравнению с другими вариантами и/или исходным антителом. В воплощениях, где клетки сортируют на основе (а) уровней экспрессии, превышающих определенный порог, и (б) низкого связывания с антиидиотипическим антителом («сортированная» популяция), число раз, которое обнаруживается мутация в данном положении, нормируют по числу раз, которое было секвенировано данное положение, и выражают в виде частоты на 1000 последовательностей. Затем частоту мутации в сортированной популяции делят на частоту в экспрессированной популяции с получением отношения обогащения (ER), которое показывает то, была ли сортированная популяция обогащена или обеднена мутацией по сравнению с экспрессированной популяцией, и в какой степени. Мутации, которыми обогащена сортированная популяция, будут иметь пониженное связывание с антиидиотипическим антителом, тогда как мутации, которыми сортированная популяция обеднена, будут иметь повышенное связывание с антиидиотипическим антителом. Аналогично отношения обогащения можно рассчитывать для каждого сортированного варианта согласно повышенной, пониженной или аналогичной (нейтральной) аффинности в отношении мишени.
В воплощениях, где клетки сортируют только в отношении пониженного связывания с антиидиотипическим антителом, например когда клетки одновременно не сортируют на предмет уровней экспрессии, отношение обогащения можно определять путем деления частоты мутации в подпопуляции, имеющей количество связавшегося антиидиотипического антитела меньше исходного значения, определенного для клеток, экспрессирующих исходное антитело, на частоту мутации в подпопуляции, имеющей количество связавшегося антиидиотипического антитела, соответствующее исходному значению или выше его.
Подтверждение индивидуальных вариантов: характеристики связывания индивидуально экспрессируемых вариантов полипептидов можно анализировать с использованием множества методик для подтверждения их поведения в контексте библиотеки. Данные методики включают BIAcore, FACS, ELISA, AlphaLisa и KinExA. В анализах BIAcore связывание определяется с использованием поверхностного плазмонного резонанса (SPR), оптического явления, обеспечивающего выявление немеченных участников взаимодействия, и их можно использовать для определения аффинности связывания индивидуальных вариантов антитела (например, заявка на патент США №2008/0274114 и Che et al., 2009, J. Pharm. and Biomed. Analysis 50(2): 183-188). AlphaLISA можно использовать для определения аффинности связывания индивидуальных вариантов с молекулой-мишенью (см., например, Ullman et al., 1996, Clinical Chemistry, 42(9): 1518-1526; и Hideharu et al., 2007, Cancer Science 98(8): 1275-1280). В KinExA (кинетический эксклюзионный анализ) измеряется концентрация не образующей комплекс молекулы рецептора (R) в смеси рецептора, лиганда (L) и комплекса LR. Концентрацию не образующего комплекс R измеряют, выдерживая смесь в фазе раствора с L, иммобилизованным на твердой фазе, в течение очень короткого периода времени. Выдерживают достаточно короткое «время контакта» между смесью в фазе раствора и L, иммобилизованным на твердой фазе, чтобы диссоциация комплекса LR не была значимой. При кинетическом исключении возможности значимой диссоциации комплекса LR с твердой фазой может связываться только не образующий комплекс («свободный») R. Количество свободного R, который связывается с твердой фазой (измеренное по испусканию флуоресценции от вторичной метки), является прямо пропорциональным концентрации свободного R в образце в виде фазы раствора. KinExA также можно использовать для определения аффинности связывания индивидуальных вариантов с молекулой-мишенью (см., например, заявку на патент США №2008/0274114 и Darling et al., 2004, ASSAY and Drug Development Technologies 2: 647-657).
6.2. Антитела-варианты против TNF-α
Описанные выше способы применяли к антителу против TNF-α D2E7, также известному как адалимумаб, для идентификации вариантов с пониженной аффинностью в отношении антиидиотипического антитела по сравнению с D2E7. Варианты, которые демонстрируют пониженную аффинность в отношении антиидиотипических антител, называются вариантами с «пониженной иммуногенностью».
В некоторых аспектах согласно настоящему изобретению предложены антитела против TNF-α, имеющие пониженную иммуногенность по сравнению с D2E7. Антитела против TNF-α по данному изобретению типично имеют одну или более чем одну аминокислотную замену в их CDR по сравнению с CDR D2E7, где указанная по меньшей мере одна или более чем одна замена снижает иммуногенность антитела по сравнению с D2E7. В определенных воплощениях пониженная иммуногенность возникает в результате устранения или уменьшения одного или более чем одного В-клеточного эпитопа.
Аминокислотные последовательности вариабельных областей тяжелой и легкой цепи D2E7 представлены SEQ ID NO: 2 и SEQ ID NO: 4 соответственно и кодируются SEQ ID NO: 1 и SEQ ID NO: 3 соответственно. Аминокислотные последовательности вариабельных областей тяжелой и легкой цепи также проиллюстрированы на ФИГ. 1А. Аминокислотные последовательности CDR D2E7 и их соответствующие идентификаторы представлены на ФИГ. 1Б. Нуклеотидные последовательности вариабельных областей тяжелой и легкой цепи D2E7 в том виде, в котором они опубликованы в патенте США №6090382, показаны на ФИГ. 1В. В композициях и способах по настоящему изобретению вместо опубликованных последовательностей можно использовать любые другие нуклеотидные последовательности, кодирующие SEQ ID NO: 2 или SEQ ID NO: 4.
В некоторых аспектах антитела против TNF-α согласно изобретению, имеющие пониженную иммуногенность, имеют сравнимое или улучшенное связывание с TNF-α относительно D2E7. Аффинность можно тестировать, например, подтверждающими способами, описанными в Разделе 6.1.
Типичные замены, дающие антитела против TNF-α с устраненными или уменьшенными В-клеточными эпитопами и имеющие меньшую иммуногенность по сравнению с D2E7, перечислены на ФИГ. 2 и 3 (т.е. ФИГ. 3А - 3Б). Подходящие замены включают G5F в CDR-L1, G5I в CDR-L1, G5V в CDR-L1, G5W в CDR-L1, G5Y в CDR-L1, R7I в CDR-L1, R7T в CDR-L1, R7V в CDR-L1, N8A в CDR-L1, N8D в CDR-L1, N8E в CDR-L1, N8L в CDR-L1, N8M в CDR-L1, N8Q в CDR-L1, N8R в CDR-L1, A1I в CDR-L2, А1Т в CDR-L2, A1V в CDR-L2, T4D в CDR-L2, R2G в CDR-L3, N4F в CDR-L3, N4M в CDR-L3, N4W в CDR-L3, N4Y в CDR-L3, R5L в CDR-L3, R5N в CDR-L3, R5W в CDR-L3, R5Y в CDR-L3, D1S в CDR-H1, Y2A в CDR-H1, Y2C в CDR-H1, Y2K в CDR-H1, Y2M в CDR-H1, Y2R в CDR-H1, Y2S в CDR-H1, Y2V в CDR-H1, Н5С в CDR-H1, H5D в CDR-H1, Н5Е в CDR-H1, H5S в CDR-H1, Н5Т в CDR-H1, Т3А в CDR-H2, T3G в CDR-H2, W4A в CDR-H2, W4F в CDR-H2, W4H в CDR-H2, W4L в CDR-H2, W4M в CDR-H2, W4V в CDR-H2, N5G в CDR-H2, S6D в CDR-H2, S6L в CDR-H2, I9K в CDR-H2, D10L в CDR-H2, Y11A в CDR-H2, Y11C в CDR-H2, Y11E в CDR-H2, Y11F в CDR-H2, Y11G в CDR-H2, Y11H в CDR-H2, Y11I в CDR-H2, Y11K в CDR-H2, Y11L в CDR-Н2, Y11M в CDR-H2, Y11N в CDR-H2, Y11Q в CDR-H2, Y11R в CDR-H2, Y11S в CDR-H2, Y11V в CDR-H2, Y11W в CDR-H2, A12Y в CDR-H2, D13N в CDR-H2, V15D в CDR-H2, V15L в CDR-H2, V15M в CDR-H2, V15Q в CDR-H2, V15T в CDR-Н2, E16F в CDR-H2, Е16Н в CDR-H2, Е16K в CDR-H2, Е16Т в CDR-H2, E16W в CDR-H2, G17A в CDR-H2, G17C в CDR-H2, G17E в CDR-H2, G17H в CDR-H2, G17I в CDR-H2, G17K в CDR-H2, G17L в CDR-H2, G17M в CDR-H2, G17P в CDR-Н2, G17Q в CDR-H2, G17R в CDR-H2, G17S в CDR-H2, G17T в CDR-H2, G17Y в CDR-H2, V1G в CDR-H3, V1R в CDR-H3, V1W в CDR-H3, L4T в CDR-H3, L4V в CDR-H3, T6V в CDR-H3, S9K в CDR-H3, S9W в CDR-H3, S9Y в CDR-H3 и D11V в CDR-H3.
Антитела против TNF-α по данному изобретению могут содержать любые замены, перечисленные на ФИГ. 2 и 3, одни или в комбинации, и, возможно, одну или более чем одну дополнительную замену. Типичные замены CDR-L1, дающие антитела с устраненными или уменьшенными Т-клеточными эпитопами и имеющие меньшую иммуногенность по сравнению с D2E7, перечислены в Таблице 11 публикации США №2010/0266613 А1 и международной публикации РСТ №2010/121140, каждая из которых включена сюда посредством ссылки во всей ее полноте. Подходящие замены и комбинации замен в CDR-L1 включают R7Q; A11S; R7Q плюс A11S; N8T; N8T плюс A11S; I6T; A11G; I6T плюс A11G; Q4G; Q4G плюс A11S; Q4G плюс A11G; Q4H; Q4H плюс A11S; Q4R; Q4R плюс A11S; G5S; G5S плюс A11S; N8S плюс A11S; I6T плюс A11S и N8T плюс A11G.
Типичные замены, дающие антитела с повышенной афинностью к TNF-α по сравнению с D2E7, перечислены в Таблицах 12 и 25 публикации США №2010/0266613 А1 и международной публикации РСТ №2010/121140. Подходящие замены включают S3K в CDR-L2, S3R в CDR-L2, S3N в CDR-L2, Т4Н в CDR-L2, T4Q в CDR-L2, T4V в CDR-L2, T4F в CDR-L2, T4W в CDR-L2, T4Y в CDR-L2; L5R в CDR-L2, L5K в CDR-L2, Q6K в CDR-L2, Q6R в CDR-L2, D1G в CDR-H1, Y2H в CDR-H1, A3G в CDR-H1 и T3N в CDR-H2.
Антитела по данному изобретению могут содержать одну или более чем одну замену, описанную в Таблицах 11-25 публикации США №2010/0266613 А1 и международной публикации РСТ №2010/121140.
Антитела против TNF-α по данному изобретению могут быть моноклональными, генетически модифицированными и иным способом модифицированными формами антител, включая химерные антитела, гуманизированные антитела, гетероконъюгатные антитела (например, биспецифичные антитела, диатела, триатела и тетратела) и антигенсвязывающие фрагменты антител, включающие, например, фрагменты Fab', F(ab')2, Fab, Fv, rlgG и scFv, но не ограничиваясь ими. Кроме того, если не указано иное, подразумевается, что термин «моноклональное антитело» (mAb) включает как интактные молекулы, так и фрагменты антитела (такие как, например, фрагменты Fab, Fab', F(ab')2, и Fv), которые способны к специфичному связыванию с белком.
Фрагменты Fab и F(ab')2 не имеют фрагмента Fc интактного антитела, подвергаются более быстрому клиренсу из системы кровообращения животного или из растения и могут иметь меньшее неспецифичное связывание с тканями, чем интактное антитело (Wahl et al., 1983, J. Nucl. Med. 24:316). Фрагмент Fab содержит константный домен легкой цепи и первый константный домен (Сн1) тяжелой цепи. Фрагменты Fab' отличаются от фрагментов Fab добавлением нескольких остатков на карбоксильном конце домена Сн1 тяжелой цепи, включая один или более чем один цистеин из шарнирной области антитела. Фрагменты F(ab') продуцируются посредством расщепления дисульфидной связи на цистеинах шарнирной области продукта расщепления F(ab')2 пепсином. Фрагмент «Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания мишени. Данная область состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в тесной, нековалентной ассоциации (димер VH-VL). Фрагменты антитела «одноцепочечный Fv» или «scFv» содержат домены VH и VL антитела в одной полипептидной цепи и также находятся в пределах объема данного изобретения. Другие антитела, охватываемые данным изобретением, включают «однодоменные антитела», которые состоят из одного домена VH или VL, который демонстрирует достаточную аффинность к молекуле-мишени. В конкретном воплощении однодоменное антитело представляет собой антитело верблюдовых (см., например, Riechmann, 1999, Journal of Immunological Methods 231: 25-38).
Антитела против TNF-α по данному изобретению предпочтительно представляют собой моноклональные антитела. Термин «моноклональное антитело» в том виде, как он здесь используется, не ограничивается антителами, полученными посредством гибридомной технологии. Термин «моноклональное антитело» относится к антителу, которое происходит из одного клона, включая любой эукариотический, прокариотический или фаговый клон, а не к способу, посредством которого оно получено. Моноклональные антитела, полезные в связи с настоящим описанием, можно получать с использованием широкого спектра методик, известных в данной области, включая применение гибридомной, рекомбинантной технологий и технологии фагового дисплея или их комбинации. Антитела по данному изобретению включают химерные, приматизированные, гуманизированные или человеческие антитела.
Антитела против TNF-α по данному изобретению могут представлять собой биспецифичные антитела. Биспецифичные антитела представляют собой моноклональные, часто человеческие или гуманизированные антитела, которые имеют специфичности связывания в отношении по меньшей мере двух разных антигенов. В настоящем описании одна из специфичностей связывания может быть направлена в отношении любых двух антигенов, таких как белок поверхности клетки, рецептор, субъединица рецептора, тканеспецифичный антиген, белок, происходящий из вируса, белок оболочки, кодируемый вирусом, белок бактериального происхождения или белок поверхности бактерии и т.д.
Антитела против TNF-α по данному изобретению включают дериватизированные антитела. Например, но не в качестве ограничения, дериватизированные антитела типично модифицированы посредством гликозилирования, ацетилирования, ПЭГ илирования, фосфорилирования, амидирования, дериватизации известными защитными/блокирущими группами, протеолитического расщепления, связывания с клеточным лигандом или другим белком и т.д. Посредством известных методик можно проводить любую из многочисленных химических модификаций, включающих специфичное химическое расщепление, ацетилирование, формилирование, метаболический синтез туникамицина и т.д., но не ограничивающихся ими. Кроме того, производное может содержать одну или более чем одну аминокислоту, не встречающуюся в природе, например, с использованием технологии ambrx (см., например, Wolfson, 2006, Chem. Biol. 13(10): 1011-2).
В еще одном воплощении данного изобретения антитела против TNF-α могут представлять собой антитела, последовательность которых была модифицирована для изменения по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, относительно соответствующей последовательности дикого типа. Например, в некоторых воплощениях исходные антитела и/или варианты антител по данному изобретению могут быть модифицированы для ослабления по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, относительно немодифицированного антитела, например, для ослабленного связывания с рецептором Fc (FcγR). Связывание с FcγR может быть ослаблено посредством мутирования иммуноглобулинового отрезка константной области антитела в конкретных областях, необходимых для взаимодействий с FcγR (см., например, Canfield, Morrison, 1991, J. Exp. Med. 173: 1483-1491 и Lund et al., 1991, J. Immunol. 147: 2657-2662). Уменьшение способности антитела к связыванию с FcγR также может уменьшать другие эффекторные функции, которые основываются на взаимодействиях с FcγR, такие как опсонизация, фагоцитоз и антигензависимая клеточная цитотоксичность («ADCC»).
В других воплощениях данного изобретения исходное антитело и/или вариант антитела могут быть модифицированы для приобретения или улучшения по меньшей мере одной биологической эффекторной функции, опосредованной константной областью, относительно немодифицированного антитела, например для усиления взаимодействий с FcγR (см., например, US 2006/0134709). Например, исходное антитело и/или варианты антитела по данному изобретению могут иметь константную область, которая связывается с FcγRIIa, FcγRIIB и/или с FcγRIIIa с большей аффинностью, чем соответствующая константная область дикого типа.
Таким образом, антитела против TNF-α по данному изобретению могут иметь изменения биологической активности, которые приводят к повышенной или пониженной опсонизации, фагоцитозу или ADCC. Такие изменения известны в данной области. Например, модификации в антителах, которые уменьшают активность ADCC, описаны в патенте США №5834597. Типичный вариант с ослабленной ADCC соответствует «мутанту 3» (показан на ФИГ. 4 патента США №5834597), в котором остаток 236 удален, и остатки 234, 235 и 237 (с использованием нумерации EU) заменены аланинами.
В некоторых воплощениях антитела против TNF-α по данному изобретению имеют низкие уровни или не имеют фукозы. Антитела с отсутствием фукозы связывали с повышенной активностью ADCC, особенно при низких дозах антитела. См. Shields et al., 2002, J. Biol. Chem. 277: 26733-26740; Shinkawa et al., 2003, J. Biol. Chem. 278: 3466-73. Способы получения антител, не содержащих фукозу, включают рост в клетках крысиной миеломы YB2/0 (АТСС CRL 1662). Клетки YB2/0 экспрессируют низкие уровни мРНК FUT8, которая кодирует α-1,6-фукозилтрансферазу, фермент, необходимый для фукозилирования полипептидов.
В еще одном аспекте антитела против TNF-α могут представлять собой антитела, которые были модифицированы для увеличения или уменьшения их аффинностей связывания с фетальным рецептором Fc, FcRn, например путем мутирования отрезка константной области иммуноглобулина в конкретных областях, участвующих во взаимодействиях с FcRn (см., например, WO 2005/123780). В конкретных воплощениях исходное антитело и/или вариант антитела класса IgG мутируют так, чтобы по меньшей мере один из аминокислотных остатков 250, 314 и 428 константной области тяжелой цепи был заменен один или в любой их комбинации, как, например, в положениях 250 и 428 или в положениях 250 и 314, или в положениях 314 и 428, или в положениях 250, 314 и 428, причем положения 250 и 428 представляют собой специфическую комбинацию. В том, что касается положения 250, заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от треонина, включая, без ограничения, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серии, валин, триптофан или тирозин. В том, что касается положения 314, заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от лейцина, включая, без ограничения, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, метионин, аспарагин, пролин, глутамин, аргинин, серии, треонин, валин, триптофан или тирозин. В том, что касается положения 428, заменяющий аминокислотный остаток может представлять собой любой аминокислотный остаток, отличный от метионина, включая, без ограничения, аланин, цистеин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, аспарагин, пролин, глутамин, аргинин, серии, треонин, валин, триптофан или тирозин. Такие мутации усиливают связывание антитела с FcRn, что защищает антитело от деградации и увеличивает его период полувыведения.
В других аспектах исходное антитело и/или вариант антитела имеет одну или более чем одну аминокислоту, вставленную в одну или более чем одну из его гипервариабельных областей, например, как описано в Jung, Pluckthun, 1997, Protein Engineering 10: 9, 959-966; Yazaki et al., 2004, Protein Eng. Des Sel. 17(5): 481-9. Epub 2004 Aug 17 и в заявке на патент США №2007/0280931.
Антитела против TNF-α по данному изобретению включают конъюгаты антител, которые модифицированы, например, ковалентным присоединением к антителу любого типа молекулы, так что ковалентное присоединение не мешает связыванию с TNF-α.
В некоторых аспектах антитело против TNF-α по данному изобретению можно конъюгировать с эффекторной группировкой или меткой. Термин «эффекторная группировка» в том виде, как он здесь используется, включает, например, антинеопластические агенты, лекарственные средства, токсины, биологически активные белки, например ферменты, другие антитела или фрагменты антител, синтетические или встречающиеся в природе полимеры, нуклеиновые кислоты (например, ДНК и РНК), радионуклиды, в частности радиоактивный йод, радиоизотопы, хелатированные металлы, наночастицы и репортерные группы, такие как флуоресцентные соединения или соединения, которые можно выявлять посредством спектроскопии ЯМР (ядерный магнитный резонанс) или ЭПР (электронный парамагнитный резонанс).
В одном примере антитела против TNF-α можно конъюгировать с эффекторной группировкой, такой как цитотоксический агент, радионуклид или группировка лекарственного средства, для модификации данного биологического ответа. Эффекторная группировка может представлять собой белок или полипептид, такой как, например и без ограничения, токсин (такой как абрин, рицин А, экзотоксин Pseudomonas или токсин Diphtheria), сигнальную молекулу (такую как α-интерферон, β-интерферон, фактор роста нервов, фактор роста тромбоцитов или тканевой активатор плазминогена), тромботический агент или антиангиогенный агент (например, ангиостатин или эндостатин) или модификатор биологического ответа, такой как цитокин или фактор роста (например, интерлейкин-1 (IL-1), интерлейкин-2 (IL-2), интерлейкин-6 (IL-6), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF) или фактор роста нервов (NGF)).
В другом примере эффекторные группировки могут представлять собой цитотоксины или цитотоксические агенты. Примеры цитотоксинов и цитотоксических агентов включают таксол, цитохалазин Б, грамицидин Д, бромистый этидий, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин Д, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин и их аналоги или гомологи.
Эффекторные группировки также включают антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, декарбазин), алкилирующие агенты (например, мехлоретамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин С5 и цис-дихлордиаминплатина(II) (DDP) (цисплатин), антрациклины (например, даунорубицин (раньше именовавшийся дауномицин) и доксорубицин), антибиотики (например, дактиномицин (раньше именовавшийся актиномицин), блеомицин, митрамицин, антрамицин (АМС), калихеамицины или дуокармицины) и антимитотические агенты (например, винкристин и винбластин), но не ограничиваются ими.
Другие эффекторные группировки могут включать радионуклиды, такие как 111In и 90Y, 177Lu, висмут213, калифорний252, иридий192 и вольфрам18s/рений188, и лекарственные средства, такие как алкилфосфохолины, ингибиторы топоизомеразы I, таксоиды и сурамин, но не ограничиваются ими.
Методики конъюгирования таких эффекторных группировок с антителами хорошо известны в данной области (см., например, Hellstrom et al., Controlled Drug Delivery, 2nd Ed., на стр. 623-53 (Robinson et al., eds., 1987)); Thorpe et al., 1982, Immunol. Rev. 62: 119-58 и Dubowchik et al., 1999, Pharmacology and Therapeutics 83: 67-123).
В некоторых аспектах антитело против TNF-α конъюгировано с низкомолекулярным токсином. В некоторых типичных воплощениях антитело против TNF-α по данному изобретению конъюгировано с доластатином или пептидными аналогами или производными долостатина, например, с ауристатином (патенты США №5635483 и 5780588). Группировка лекарственного средства доластатина или ауристатина может быть присоединена к антителу через его N (амино) конец или С (карбоксильный) конец (WO 02/088172). Типичные воплощения с ауристатином включают группировки DE и DF лекарственного средства монометилауристатина, связанные с N-концом, как раскрыто в патенте США №7498298, который включен сюда посредством ссылки во всей его полноте (раскрывая, например, линкеры и способы получения монометилвалиновых соединений, таких как ММАЕ (монометилауристатин Е) и MMAF (монометилауристатин F), конъюгированных с линкерами).
В других типичных воплощениях низкомолекулярные токсины включают калихеамицин, майтанзин (патент США №5208020), трихотен и СС1065, но не ограничиваются ими. В одном воплощении данного изобретения антитело конъюгировано с одной или более чем одной молекулой майтанзина (например, от примерно 1 до примерно 10 молекул майтанзина на молекулу антитела). Майтанзин, например, может быть превращен в May-SS-Me, который может быть восстановлен до May-SH3 и подвергнут взаимодействию с антителом (Chari et al., 1992, Cancer Research 52: 127-131) с получением конъюгата майтанзиноид-антитело или майтанзиноид-слияние с Fc. Структурные аналоги калихеамицина, которые также можно использовать, включают γ11, γ31, N-ацетил-γ11, PSAG и θ11, но не ограничиваются ими (Hinman et al., 1993, Cancer Research 53: 3336-3342; Lode et al., 1998, Cancer Research 58: 2925-2928; патент США №5714586; патент США №5712374; патент США №5264586; патент США №5773001).
Антитела по данному изобретению также можно конъюгировать с липосомами для направленной доставки (см., например, Park et al., 1997, Adv. Pharmacol. 40: 399-435; Marty & Schwendener, 2004, Methods in Molecular Medicine 109: 389-401).
Слово «метка» при использовании здесь относится к выявляемому соединению или композиции, которые можно непосредственно или опосредованно конъюгировать с антителом против TNF-α по данному изобретению. Метка может быть выявляемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение соединения-субстрата или композиции, которое является выявляемым. Подходящие флуоресцентные группировки включают флуоресцеин, флуоресцеина изотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и тому подобные, но не ограничиваются ими. Подходящие ферментативные метки включают щелочную фосфататзу, пероксидазу хрена, глюкозооксидазу и тому подобные, но не ограничиваются ими.
6.3 Нуклеиновые кислоты и системы экспрессии
Антитело против TNF-α по данному изобретению можно получать посредством рекомбинантной экспрессии генов легкой и тяжелой цепи иммуноглобулина в клетке-хозяине. Для рекомбинантной экспрессии антитела клетку-хозяина трансфицируют одним или более чем одним вектором рекомбинантной экспрессии, несущим фрагменты ДНК, кодирующие иммуноглобулиновые легкую и тяжелую цепи антитела, так что данные легкая и тяжелая цепи экспрессируются в клетке-хозяине и, возможно, секретируются в среду, в которой культивируют клетки-хозяева, из которой можно выделять антитела. Для получения генов тяжелой и легкой цепи антитела используют стандартные методологии рекомбинантных ДНК, включают данные гены в рекомбинантные экспрессионные векторы, и вводят данные векторы в клетки-хозяева, такие как клетки-хозяева, описанные в Molecular Cloning; A Laboratory Manual, Second Edition (Sambrook, Fritsch and Maniatis (eds.), Cold Spring Harbor, N.Y., 1989), Current Protocols in Molecular Biology (Ausubel, F.M. et al., eds., Greene Publishing Associates, 1989) и в патенте США №4816397.
Возможна экспрессия антител по данному изобретению либо в прокариотических, либо в эукариотических клетках-хозяевах. В определенных воплощениях для оптимальной секреции правильно свернутого и иммунологически активного антитела экспрессию антител осуществляют в эукариотических клетках, например клетках-хозяевах млекопитающих. Типичные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител по данному изобретению включают клетки яичника китайского хомяка (клетки СНО) (включая клетки СНО DHFR- (дефицитные по дегидрофолатредуктазе), описанные в Urlaub, Chasin, 1980, Proc. Natl. Acad. Sci. USA 77: 4216-4220, используемые с селектируемым маркером DHFR, например, как описано в Kaufman, Sharp, 1982, Mol. Biol. 159: 601-621), клетки миеломы NS0, клетки COS, клетки 293 и клетки SP2/0. При введении в клетки-хозяева млекопитающих рекомбинантных экспрессионных векторов, кодирующих гены антитела, антитела продуцируются путем культивирования данных клеток-хозяев в течение достаточного периода времени для обеспечения экспрессии антитела в клетках-хозяевах или секреции антитела в культуральную среду, в которой выращивают клетки-хозяева.
Клетки-хозяева также можно использовать для продуцирования частей интактных антител, таких как фрагменты Fab или молекулы scFv. Методики генной инженерии также можно использовать для удаления некоторой части или всей ДНК, кодирующей любую из двух или обе легкую и тяжелую цепи, которые не являются необходимыми для связывания с TNF-α. Молекулы, экспрессируемые из таких усеченных молекул ДНК, также охватываются антителами по данному изобретению.
Для рекомбинантной экспрессии антитела против TNF-α по данному изобретению клетку-хозяина можно котрансфицировать двумя экспрессионными векторами по данному описанию, причем первый вектор кодирует полипептид, происходящий из тяжелой цепи, и второй вектор кодирует полипептид, происходящий из легкой цепи. Типично каждый из двух векторов содержит отдельный селектируемый маркер. В качестве альтернативы можно использовать один вектор, который кодирует полипептиды как тяжелой, так и легкой цепи.
Как только получена нуклеиновая кислота, кодирующая одну или более чем одну часть D2E7 или антитела против TNF-α с последовательностями CDR, родственными последовательностям CDR D2E7, в кодирующую последовательность можно вводить другие изменения или мутации, например, для получения нуклеиновых кислот, кодирующих антитела с другими последовательностями CDR, антитела с пониженной аффинностью к рецептору Fc или антитела других подклассов.
Как только посредством рекомбинантной экспрессии продуцировано антитело против TNF-α по данному изобретению, его можно выделять и очищать любым способом, известным в данной области для очистки молекулы иммуноглобулина, например, посредством хроматографии (например, ионообменной, аффинной, особенно посредством аффинности в отношении TNF-α после селекции на белке А или белке G, и колоночной хроматографии с разделением по размеру (sizing column chromatography)), центрифугирования, дифференциальной растворимости или посредством любой другой стандартной методики для очистки белков. Кроме того, антитела против TNF-α по настоящему изобретению или их фрагменты можно сливать с последовательностями гетерологичных полипептидов, описанных здесь или известных в данной области из иного источника, для облегчения очистки.
После выделения антитело против TNF-α можно, если это желательно, очищать далее, например посредством высокоэффективной жидкостной хроматографии (см., например, Fisher, Laboratory Techniques In Biochemistry And Molecular Biology (Work, Burdon, eds., Elsevier, 1980)), или посредством гель-фильтрации на колонке Superdex™ 75 (Pharmacia Biotech AB, Уппсала, Швеция).
6.4. Терапевтические применения
Антитела против TNF-α по настоящему изобретению являются полезными для лечения расстройств или симптомов разных иммунных и аутоиммунных патологий, а также воспалительных заболеваний.
Патологии и заболевания, связанные с TNF-α, которые можно лечить антителами против TNF-α по данному изобретению, включают, без ограничения, следующие:
- острые и хронические иммунные и аутоиммунные патологии, такие как системная красная волчанка, ревматоидный артрит, тиреоидит, болезнь «трансплантат против хозяина», склеродермия, сахарный диабет, базедова болезнь и тому подобные;
- инфекции, включающие септический синдром, кахексию, циркуляторный коллапс и шок, возникающие в результате острой или хронической бактериальной инфекции, острые и хронические паразитарные и/или бактериальные, вирусные или грибковые инфекционные заболевания, такие как СПИД (синдром приобретенного иммунодефицита) (включая осложнения, такие как кахексия, аутоиммунные расстройства, умственное расстройство при СПИДе и инфекции), но не ограничивающиеся ими;
- воспалительные заболевания, такие как хронические воспалительные патологии и сосудистые воспалительные патологии, включающие хронические воспалительные патологии, такие как саркоидоз, хроническое воспалительное заболевание кишечника, язвенный колит и болезнь Крона, и сосудистые воспалительные патологии, такие как диссеминированное внутрисосудистое свертывание, атеросклероз и болезнь Кавасаки, но не ограничивающиеся ими;
- нейродегенеративные заболевания, включающие демиелинизирующие заболевания, такие как рассеянный склероз и острый поперечный миелит; экстрапирамидальные и мозжечковые расстройства, такие как поражения кортикоспинальной системы; расстройства базальных ганглиев или мозжечковые расстройства; гиперкинетические расстройства движения, такие как хорея Гентингтона и сенильная хорея, расстройства движения, индуцированные лекарственными средствами, такие как расстройства движения, индуцированные лекарственными средствами, которые блокируют ЦНС (центральная нервная система), дофаминовые рецепторы; гипокинетические расстройства движения, такие как болезнь Паркинсона; прогрессирующий надъядерный паралич, мозжечковые и относящиеся к спинному мозгу и мозжечку расстройства, такие как неструктурные поражения мозжечка; дегенерации спинного мозга и мозжечка (спинальная атаксия, атаксия Фридрейха, мозжечковые кортикальные дегенерации, множественные системные дегенерации (Менцеля, Дежерина-Тома, Ши-Драгера и Мачадо-Джозефа); системные расстройства (болезнь Рефсума, абеталипопротеинемия, атаксия, телеангиэктазия и митохондриальное мультисистемное расстройство); демиелинизирующие расстройства ядер, такие как рассеянный склероз, острый поперечный миелит; расстройства моторной единицы, такие как нейрогенные мышечные атрофии (дегенерация клеток переднего рога спинного мозга, такая как боковой амиотрофический склероз, детская спинальная мышечная атрофия и юношеская спинальная мышечная атрофия); болезнь Альцгеймера, синдром Дауна в среднем возрасте, болезнь с диффузными тельцами Леви; сенильная деменция с тельцами Леви, синдром Вернике-Корсакова; хронический алкоголизм; болезнь Крейтцфельдта-Якоба; подострый склерозирующий панэнцефалит, болезнь Галлервордена-Шпатца и деменция боксеров или их любое подмножество, но не ограничивающиеся ими;
- злокачественные патологии, включающие опухоли, секретирующие TNF-α, или другие злокачественные образования с участием TNF-α, такие как лейкозы (острый, хронический миелоцитарный, хронический лимфоцитарный и/или миелодиспластический синдром); лимфомы (ходжкинские и неходжкинские лимфомы, такие как злокачественные лимфомы (лимфома Беркитта или фунгоидный микоз), но не ограничивающиеся ими, и
- гепатит, индуцированный алкоголем.
В некоторых конкретных воплощениях антитела по данному изобретению используют для лечения любых показаний, для которых одобрен адалимумаб, например следующих: ревматоидный артрит (RA) (включая RA от умеренного до тяжелого у взрослых), полиартикулярный ювенильный идиопатический артрит (JIA) (включая JIA от умеренного до тяжелого у пациентов в возрасте 4 года и старше), псориатический артрит (PsA) (включая PsA у взрослых), анкилозирующий спондилит (AS) (включая AS у взрослых), болезнь Крона (CD) (включая CD от умеренной до тяжелой у взрослых), псориаз, например хронический бляшечный псориаз (Ps) (включая хронический бляшечный псориаз от умеренного до тяжелого у взрослых) и аксиальный спондилоартрит (axSpA) (включая тяжелый axSpA у взрослых пациентов, которые не имеют рентгенологического доказательства структурного повреждения).
Соответственно, согласно настоящему изобретению предложены способы лечения любого из вышеупомянутых заболеваний у пациента, нуждающегося в этом, включающие: введение пациенту антитела против TNF-α по данному изобретению. Возможно, указанное введение повторяют, например, через одни сутки, двое суток, трое суток, пять суток, одну неделю, две недели или один месяц. Повторное введение можно осуществлять в той же самой дозе или в другой дозе. Введение можно повторять один раз, дважды, три раза, четыре раза, пять раз, шесть раз, семь раз, восемь раз, девять раз, десять раз или более. Например, согласно определенным схемам дозировки пациент получает терапию антителом против TNF-α в течение длительного периода времени, например 6 месяцев, 1 год или более. Количество антитела против TNF-α, введенное пациенту, в некоторых воплощениях представляет собой терапевтически эффективное количество. «Терапевтически эффективное» количество антитела против TNF-α в том виде, как здесь используется данная фраза, можно вводить в виде одной дозы или на протяжении курса лечения, например на протяжении недели, двух недель, трех недель, одного месяца, трех месяцев, шести месяцев, одного года или дольше. Типичная дозировка будет зависеть от пациента и тяжести заболевания, но типично варьирует от 10 мг до 160 мг (например, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 60 мг, 80 мг, 100 мг, 120 мг, 140 мг или 160 мг). В определенных воплощениях согласно данному изобретению предложена фармацевтическая композиция, содержащая антитело против TNF-α, или способ лечения одного или более чем одного раскрытого здесь расстройства, в интервале дозировки, ограниченном любым из вышеупомянутых значений. Терапевтическая схема, в которой используется антитело против TNF-α по данному изобретению, будет варьировать в зависимости от возраста пациента, массы и состояния заболевания. Терапевтическая схема может продолжаться от 2 недель до неограниченного периода времени. В конкретных воплощениях терапевтическую схему продолжают в течение от 2 недель до 6 месяцев, от 3 месяцев до 5 лет, от 6 месяцев до 1 года или 2 лет, от 8 месяцев до 18 месяцев или тому подобное. Пациент, которому вводят антитело против TNF-α по данному изобретению, предпочтительно представляет собой человека. В некоторых аспектах человек представляет собой пациента-ребенка. В других аспектах человек представляет собой взрослого пациента.
Антитела против TNF-α по данному изобретению можно вводить в комбинации с по меньшей мере одним другим терапевтическим агентом («второй терапевтический агент»). Антитело против TNF-α и второй терапевтический агент можно вводить сопутствующее (либо одновременно, либо последовательно) или раздельно.
В некоторых аспектах второй терапевтический агент представляет собой противоревматическое лекарственное средство, противовоспалительный агент, химиотерапевтический агент, радиотерапевтический агент, иммуносупрессивный агент или цитотоксическое лекарственное средство.
Противоревматические лекарственные средства включают ауранофин, азатиоприн, хлорохин, D-пеницилламин, золота натрия тиомалат, гидроксихлорохин, миокризин, сульфасалазин и метотрексат, но не ограничиваются ими.
Противовоспалительные агенты включают дексаметазон, пентаза, месалазин, азакол, кодеина фосфат, бенорилат, фенбуфен, напрозин, диклофенак, этодолак и индометацин, аспирин и ибупрофен, но не ограничиваются ими.
Химиотерапевтические агенты включают радиоактивные молекулы, токсины, также именуемые цитотоксинами или цитотоксическими агентами, которые включают любой агент, который является вредным для жизнеспособности клеток, агенты и липосомы или другие везикулы, содержащие химиотерапевтические соединения, но не ограничиваются ими. Примеры подходящих химиотерапевтических агентов включают 1-дегидротестостерон, 5-фторурацилдекарбазин, 6-меркаптопурин, 6-тиогуанин, актиномицин Д, адриамицин, алдеслейкин, алкилирующие агенты, аллопуринол натрия, алтретамин, амифостин, анастрозол, антрамицин (АМС), антимитотические агенты, чус-дихлордиаминплатина(II) (DDP) (цисплатин), диаминодихлорплатина, антрациклины, антибиотики, антиметаболиты, аспарагиназа, живая BCG (бацилла Кальметта-Герена) (внутривезикулярная), бетаметазона натрия фосфат и бетаметазона ацетат, бикалутамид, блеомицина сульфат, бусульфан, кальция лейковорин, калихеамицин, капецитабин, карбоплатин, ломустин (CCNU), кармустин (BSNU), хлорамбуцил, цисплатин, кладрибин, колхицин, конъюгированные эстрогены, циклофосфамид, циклотосфамид, цитарабин, цитарабин, цитохалазин Б, цитоксан, дакарбазин, дактиномицин, дактиномицин (раньше известный как актиномицин), даунирубицин HCl, даунорубицина цитрат, денилейкин, дифтитокс, дексразоксан, дибромманнит, дигидроксиантрациндион, доцетаксел, долазетрона мезилат, доксорубицин HCl, дронабинол, L-аспарагиназа Е.coli, эметин, эпоетин-α, L-аспарагиназа Erwinia, этерифицированные эстрогены, эстрадиол, эстрамустина натрия фосфат, бромистый этидий, этинилэстрадиол, этидронат, этопозид, фактор citrovorum, этопозида фосфат, филграстим, флоксуридин, флуконазол, флударабина фосфат, фторурацил, флутамид, фолиновая кислота, гемцитабин HCl, глюкокортикоиды, гозерелина ацетат, грамицидин Д, гранизетрон HCl, гидроксимочевина, идарубицин HCl, ифосфамид, интерферон-α-2b, иринотекан HCl, летрозол, кальция лейковорин, лейпролида ацетат, левамизол HCl, лидокаин, ломустин, майтанзиноид, мехлорэтамин HCl, медроксипрогестерона ацетат, мегестрола ацетат, мелфалан HCl, меркаптопурин, месна, метотрексат, метилтестостерон, митрамицин, митомицин С, митотан, митоксантрон, нилутамид, октреотида ацетат, ондансетрон HCl, паклитаксел, динатрий памидронат, пентостатин, пилокарпин HCl, плимицин, полифепросан 20 с кармустиновым имплантом, натрий порфимер, прокаин, прокарбазин HCl, пропранолол, ритуксимаб, сарграмостим, стрептозотоцин, тамоксифен, таксол, тенипозид, тенопозид, тестолактон, тетракаин, тиоепа хлорамбуцил, тиогуанин, тиотепа, топотекан HCl, торемифена цитрат, D2E7, третиноин, валрубицин, винбластина сульфат, винкристина сульфат и винорелбина тартрат, но не ограничиваются ими.
В других аспектах данного изобретения второй терапевтический агент представляет собой антагонист TNF-α, отличный от антитела против TNF-α согласно данному изобретению. Примеры таких антагонистов TNF-α включают растворимые рецепторы TNF-α; этанерцепт (ENBREL; Immunex) или его фрагмент, производное или аналог; инфликсимаб (REMICADE; Centacor) или его производное, аналог или антигенсвязывающий фрагмент; IL-10 (интерлейкин-10), для которого известно, что он блокирует продукцию TNF-α посредством макрофагов, активируемых интерфероном-γ (Oswald et al., 1992, Proc. Natl. Acad. Sci. USA 89: 8676-8680), TNFR-IgG (Ashkenazi et al., 1991, Proc. Natl. Acad. Sci. USA 88: 10535-10539); мышиный продукт TBP-1 (Serono/Yeda); вакцина CytoTAb (Protherics); антисмысловая молекула 104838 (ISIS); пептид RDP-58 (SangStat); талидомид (Celgene); CDC-801 (Celgene); DPC-333 (Dupont); VX-745 (Vertex); AGIX-4207 (AtheroGenics); ITF-2357 (Italfarmaco); NPI-13021-31 (Nereus); SCIO-469 (Scios); таргетер TACE (TNF-α-превращающий фермент) (Immunix/AHP); CLX-120500 (Calyx); тиазолопирим (Dynavax); ауранофин (Ridaura) (SmithKline Beecham Pharmaceuticals); хинакрин (мепакрина дихлоргидрат); тенидап (Enablex); меланин (Large Scale Biological) и агенты против р38 МАРК от Uriach, но не ограничиваются ими.
Дополнительные вторые терапевтические агенты, полезные в комбинации с антителом против TNF-α, и конкретные показания, для которых полезной является комбинированная терапия такими вторыми терапевтическими агентами, раскрыты в WO 2004/004633, которая включена сюда посредством ссылки во всей ее полноте.
6.5. Фармацевтические композиции и фармацевтическое введение
Антитела против TNF-α по данному изобретению могут быть включены в фармацевтические композиции, подходящие для введения пациенту. Типично фармацевтическая композиция содержит антитело против TNF-α и фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» в том виде, как он здесь используется, включает любой и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотоничные и замедляющие абсорбцию агенты, и тому подобное, которые являются физиологически приемлемыми. Примеры фармацевтически приемлемых носителей включают один или более чем один из воды, физиологического раствора, забуференного фосфатом физиологического раствора, декстрозы, глицерина, этанола и тому подобных, а также их комбинаций. Во многих случаях предпочтительным будет включение в композицию изотоничных агентов, например сахаров, полиспиртов, таких как маннит, сорбит, или хлорида натрия. Фармацевтически приемлемые носители могут дополнительно содержать минорные количества вспомогательных веществ, таких как увлажнители или эмульгаторы, консерванты или буферы, которые увеличивают срок хранения или эффективность антитела или части антитела.
Композиции по данному изобретению могут находиться в ряде форм. Они включают, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, инъецируемые или инфузируемые растворы), дисперсии или суспензии и порошки. Предпочтительная форма зависит от намеченного способа введения и терапевтического применения. Типичные предпочтительные композиции находятся в форме инъецируемых или инфузируемых растворов. Предпочтительным способом введения является парентеральное (например, внутривенное, подкожное, внутрибрюшинное, внутримышечное). В предпочтительном воплощении антитело против TNF-α вводят посредством внутривенной инфузии или инъекции. В другом предпочтительном воплощении антитело против TNF-α вводят посредством внутримышечной или подкожной инъекции.
Антитела против TNF-α по данному изобретению могут быть предоставлены в фармацевтических наборах. Фармацевтический набор представляет собой упаковку, содержащую антитело против TNF-α по данному изобретению (например, либо в лиофилизированной форме, либо в виде водного раствора) и возможно одно или более чем одно из следующего: второй терапевтический агент, например, как описано выше; устройство для введения антитела против TNF-α, например шприц-ручка, игла и/или шприц; и вода фармацевтического уровня качества или буфер для ресуспендирования антитела при нахождении антитела в лиофилизированной форме.
В некоторых аспектах каждая единичная доза антитела против TNF-α упакована отдельно, и набор может содержать одну или более чем одну единичную дозу (например, две единичные дозы, три единичные дозы, четыре единичные дозы, пять единичных доз, восемь единичных доз, десять единичных доз или более). В конкретном воплощении каждая одна или более чем одна единичная доза содержится в шприце или шприце-ручке. Типичная единичная доза содержит от 10 мг до 160 мг антитела против TNF-α (например, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 60 мг, 80 мг, 100 мг, 120 мг, 140 мг или 160 мг). В конкретных воплощениях настоящего изобретения предложена единичная доза, содержащая антитело против TNF-α в интервале, ограниченном любым из вышеуказанных значений.
Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или буфер для лизиса) и тому подобное. В конкретном воплощении антитело и одна или более чем одна добавка могут быть предоставлены (индивидуально или в комбинации) в виде сухих порошков, обычно лиофилизированных, включающих эксципиенты, которые при растворении будут давать раствор, имеющий подходящую концентрацию.
7. ПРИМЕРЫ
7.1. Пример 1: векторы для экспрессии и дисплей на поверхности клеток
Синтетические домены вариабельной области легкой цепи (VL) и вариабельной области тяжелой цепи (VH) D2E7 (адалимумаб) были сконструированы коммерческим поставщиком, синтезирующим гены (DNA 2.0 Inc., Menlo Park, СА). На ФИГ. 1А - 1В показаны последовательности ДНК, транслированные аминокислотные последовательности, фланкирующие сайты рестрикции и CDR синтетических фрагментов VH и VL D2E7. Определяющие комплементарность области (CDR) показаны жирным подчеркнутым текстом. Синтетические VH и VL D2E7 клонировали в вектор pYA206, эписомный вектор, полученный из вируса Эпштейна-Барр, для экспрессии и дисплея антител на поверхности клеток млекопитающих. pYA206 представляет собой производное плазмиды pYA104 (Akamatsu et al., J. Immunol Methods, 2007 Oct 31; 327(1-2): 40-52) со следующими модификациями: 1) человеческий константный домен С лямбда был заменен человеческим константным доменом С каппа, 2) гликозидилфосфатидилинозитольный сигнал связывания (GPI якорь) был заменен трансмембранным доменом рецептора фактора роста тромбоцитов (PDGF-R), 3) уникальные сайты NotI и XhoI находятся выше от домена С каппа для клонирования доменов VL в рамке с С каппа и 4) уникальные сайты NgoMIV и Sacl находятся выше от IgG1 для клонирования доменов VH в рамке с константными областями IgG1.
pCW600 представляет собой производное плазмиды pYA206 с геном СН, замененным Fab.
Фрагмент VH D2E7 расщепляли NgoMIV и Sacl и фрагмент VL D2E7 расщепляли NotI и XhoI. Оба фрагмента клонировали в плазмиду pYA206 для создания плазмиды pYA206-D2E7. На ФИГ. 4 показана структура pYA206-D2E7. Данная плазмида содержит ген EBNA-1 (ядерный антиген вируса Эпштейна-Барр) и oriP из вируса Эпштейна-Барр, что обеспечивает репликацию в клетках млекопитающих в виде эписомы. Точка начала репликации pUC и ген устойчивости к ампициллину обеспечивают размножение плазмиды в Е.coli. Клетки-трансформанты млекопитающих отбирают с использованием гена устойчивости к пуромицину под контролем промотора SV40. Промотор CMV (вирус мозаики цветной капусты) и участок внутренней посадки рибосомы (IRES) обеспечивают экспрессию подвергающихся дисплею тяжелой и легкой цепей антитела. Экспрессируемое антитело связывается с клеточной мембраной посредством трансмембранного домена PDGF-R, слитого с концом константного домена IgG1.
Фрагмент VH D2E7 расщепляли NgoMIV и Sacl, фрагмент VL D2E7 расщепляли NotI и XhoI и оба фрагмента клонировали в плазмиду pCW600 для создания плазмиды pCW600-D2E7. На ФИГ. 4 показана структура pCW600-D2E7. Данная плазмида содержит ген EBNA-1 и oriP из вируса Эпштейна-Барр, что обеспечивает репликацию в клетках млекопитающих в виде эписомы. Точка начала репликации pUC и ген устойчивости к ампициллину обеспечивают размножение плазмиды в Е.coli. Клетки-трансформанты млекопитающих отбирают с использованием гена устойчивости к пуромицину под контролем промотора SV40. Промотор CMV и участок внутренней посадки рибосомы (IRES) обеспечивают экспрессию подвергающихся дисплею тяжелой и легкой цепей Fab. Экспрессируемый Fab связывается с клеточной мембраной посредством трансмембранного домена PDGF-R, слитого с концом константного домена IgG1.
7.2. Пример 2: дисплей на поверхности и титрационный анализ D2E7 посредством FACS
Клетки 293с18 (Американская коллекция типовых культур, Manassas, VA), которые экспрессируют белок EBNA-1, трансформировали pYA206-D2E7. Клетки 293с18 культивировали в средах DMEM (среда Игла, модифицированная по Дульбекко), дополненных 10% фетальной бычьей сыворотки (FBS) и 0,25 мг/мл G418. 0,125 мкг плазмиды pYA206-D2E7 или pCW600-D2E7 смешивали 1:200 с 25 мкг pUC19 в качестве плазмиды-носителя плюс 60 мкл липофектамина (Invitrogen, СА) и добавляли к 2×107 клеток 293с18. 200-кратный избыток плазмиды-носителя был предназначен для обеспечения того, чтобы каждая клетка была трансформирована самое большее одной плазмидой, содержащей D2E7. Через 48 часов трансформированные клетки отбирали путем добавления пуромицина и затем культивировали в течение еще 18 суток перед анализом FACS.
Человеческий TNF-α (R&D Systems, Minneapolis, MN) метили Alexa Fluor 647 (Invitrogen, CA). 1 мг человеческого TNF-α подвергали взаимодействию с 84 мкг реактива Alexa Fluor 647 в течение 30 минут при комнатной температуре и затем очищали от непрореагировавшего реактива с использованием колонки для гель-фильтрации. Клетки 293с18, трансфицированные pCW600-D2E7, дважды окрашивали антителом против человеческого IgG, меченным РЕ (Southern Biotech), в разведении 1/200 и разными концентрациями TNF-α, меченного Alexa Fluor 647, на льду в течение одного часа, промывали буфером для FACS (забуференный фосфатом физиологический раствор (PBS) плюс 0,5% бычьего сывороточного альбумина (BSA)) и анализировали на FacsCalibur (BD). Кривую титрования получали с использованием концентраций TNF-α, меченного Alexa Fluor 647, варьирующих от 20 нМ до 0,26 нМ. Средняя точка каждой кривой, в которой происходит полумаксимальное связывание, определяла ЕС50 (полумаксимальная эффективная концентрация) для комплекса антитело/антиген. Результаты для D2E7 дикого типа показаны на ФИГ. 5. В данном анализе Fab D2E7, подвергающийся дисплею на поверхности, связывается с TNF-α с ЕС50 0,15 нМ.
Антитела против D2E7 1Н11, 5А1 и 10F8 (антиидиотипические, анти-Id) конъюгировали с биотином. 1 мг каждого анти-Id подвергали взаимодействию с 43 мкг реактива сульфо-NHS-LC-биотин (Pierce) в течение двух часов при комнатной температуре. Избыток биотина удаляли посредством центрифугирования в микроцентрифужном фильтре от Amicon. Клетки 293с18, трансфицированные pCW600-D2E7, дважды окрашивали антителом против человеческого IgG, меченным РЕ (Southern Biotech), в разведении 1/200 и биотинилированными анти-Id в течение 1 часа, промывали буфером для FACS (забуференный фосфатом физиологический раствор (PBS) плюс 0,5% бычьего сывороточного альбумина (BSA)), затем окрашивали 1/200 разведением стрептавидина-АРС. Кривую титрования получали с использованием концентраций анти-Id, варьирующих от 20 нМ до 0,26 нМ. Средняя точка каждой кривой, в которой происходит полумаксимальное связывание, определяется как ЕС50 (полумаксимальная эффективная концентрация) для комплекса анти-Id/D2E7. Результат для каждого антиидиотипического антитела показан на ФИГ. 6. В данном анализе Fab D2E7, подвергающийся дисплею на поверхности, связывается с анти-Id 1Н11, 5А1 и 10F8 с ЕС50 0,77 нМ, 0,37 нМ и 1,28 нМ соответственно.
7.3. Пример 3: построение библиотек из мутантов D2E7 по одной аминокислоте
Каждое положение аминокислоты CDR D2E7 (подчеркнуты на ФИГ. 1А) - всего 34 положения VH и 27 положений VL, использовали в качестве мишени для NNK рандомизации. Использовали схему кодирования NNK (в которой N представляет собой А, С, G или Т, и K представляет собой G или Т), так как 1) для кодирования всех 20 встречающихся в природе аминокислот требуются только 32 кодона, 2) в данные 32 включен только один стоп-кодон (TAG), и 3) максимальная вырожденность (число разных кодонов, кодирующих одну аминокислоту) составляет 3, а не максимальную 6-кратную вырожденность, которая имеет место в полном генетическом коде из 64 кодонов.
61 отличный фрагмент ДНК, каждый с вырожденностью NNK в разных положениях CDR, был синтезирован коммерческим поставщиком синтетических генов (DNA 2.0, Menlo Park, СА). Данные фрагменты амплифицировали посредством ПЦР (полимеразная цепная реакция) с праймерами D2E7reampFwd  (SEQ ID NO: 11) и D2E7reampRev
(SEQ ID NO: 11) и D2E7reampRev  (SEQ ID NO: 12). ПЦР-продукты очищали, затем фрагменты VH расщепляли NgoMIV и Sacl, и фрагменты VL расщепляли NotI и XhoI. Все фрагменты разделяли на агарозном геле, очищали и субклонировали в плазмиду pCW600-D2E7, несущую противоположный фрагмент вариабельной области дикого типа. Образующиеся плазмиды раздельно трансформировали в клетки Е.coli Тор 10 (Invitrogen, СА) с образованием подбиблиотеки трансформантов для каждого из 61 отличного фрагмента ДНК. Трансформации проводили так, что получали по меньшей мере в 10 раз больше трансформантов Е.coli, чем общее число возможных кодонов в каждой подбиблиотеке. Образующиеся подбиблиотеки для VH и VL объединяли для создания двух конечных библиотек - библиотеки VH D2E7, содержащей 34 положения и 1088 разных кодонов, и библиотеки VL D2E7, содержащей 27 положений и всего 864 разных кодона.
(SEQ ID NO: 12). ПЦР-продукты очищали, затем фрагменты VH расщепляли NgoMIV и Sacl, и фрагменты VL расщепляли NotI и XhoI. Все фрагменты разделяли на агарозном геле, очищали и субклонировали в плазмиду pCW600-D2E7, несущую противоположный фрагмент вариабельной области дикого типа. Образующиеся плазмиды раздельно трансформировали в клетки Е.coli Тор 10 (Invitrogen, СА) с образованием подбиблиотеки трансформантов для каждого из 61 отличного фрагмента ДНК. Трансформации проводили так, что получали по меньшей мере в 10 раз больше трансформантов Е.coli, чем общее число возможных кодонов в каждой подбиблиотеке. Образующиеся подбиблиотеки для VH и VL объединяли для создания двух конечных библиотек - библиотеки VH D2E7, содержащей 34 положения и 1088 разных кодонов, и библиотеки VL D2E7, содержащей 27 положений и всего 864 разных кодона.
7.4. Пример 4: окрашивание FACS и 4-факторная сортировка библиотек Fab с точечными мутациями VH и VL D2E7 на предмет связывания TNF-α
Библиотеки VH и VL D2E7 трансфицировали в клетки 293с18 с использованием 0,5 мкг плазмиды из библиотеки, 100 мкг плазмиды-носителя pUC19 и 250 мкл липофектамина, подвергали селекции с 0,8 мкг/мл пуромицина после 2 суток и культивировали в течение еще 18 суток до сортировки FACS. Клетки окрашивали 0,15 наномолярным Alexa Fluor 647-TNF-α и 1:200 антитела против IgG, меченного РЕ (Southern Biotech), и сортировали на установке FACS MoFlo (Dako North America Inc., Carpinteria, СА). Профили сортировки FACS для D2E7 дикого типа и библиотек точечных мутаций VH показаны на ФИГ. 7А - 7Б. На панели А показан профиль FACS для клеток, трансформированных экспрессионной плазмидой pCW600 с Fab D2E7 дикого типа; по оси x показано окрашивание антителом против IgG, меченным РЕ, и по оси y показано окрашивание Alexa Fluor 647-TNF-α. Поскольку экспрессия антитела в популяции клеток является гетерогенной, профиль FACS показывает то, что индивидуальные точки данных грубо организованы вдоль диагональной линии, направленной к верхнему правому квадранту.
Клетки, окрашенные TNF-α, из библиотеки точечных мутаций VH сортировали на 4 подпопуляции, на основе ворот FACS (ФИГ. 7А - 7Б, панель Б). Поведение антитела дикого типа при аналогичных условиях FACS использовали для настройки ворот для сортировки клеток в популяцию с большей аффинностью (Н) (R4), популяцию с нейтральной или «средней» аффинностью (М) (R5), популяцию с меньшей аффинностью (L) (R6) и популяцию, не экспрессирующую IgG (Z) (R3). По оси x показано окрашивание антителом против IgG, меченным РЕ, и по оси y показано окрашивание человеческим TNF-α-AF647.
7.5. Пример 5: окрашивание FACS и 2-факторная сортировка библиотек Fab с точечными мутациями VH и VL D2E7 на предмет связывания с анти-Id
Клетки, экспрессирующие D2E7, совместно окрашивали 0,15 наномолярным Alexa Fluor 647-TNF-α и биотинилированными антиидиотипическими mAb в ЕС50 (1Н11 - 0,77 нМ, 5А1 - 0,37 нМ и 10F8 - 1,28 нМ), затем инкубировали в течение двух часов при комнатной температуре. Клетки затем промывали и инкубировали со стрептавидином-АРС и антителом против области каппа человеческого IgG, конъюгированным с FITC (флуоресцеина изотиоцианат), в течение одного часа при 4°С. Клетки промывали, затем сортировали на установке FACS MoFlo (Dako North America Inc., Carpinteria, СА). Профили сортировки FACS для D2E7 дикого типа и библиотеки VH, окрашенной 1Н11, показаны на ФИГ. 8А - 8Б. По оси x показано окрашивание антителом против IgG, конъюгированным с РЕ, и по оси y показано окрашивание анти-Id 1Н11-АРС. Проводили 2-факторную сортировку, собирая минимум два миллиона клеток в воротах «сортированные» (клетки со слабым связыванием с антиидиотипическим антителом) и «экспрессия» (клетки, позитивные в отношении связывания антителом против области каппа человеческого IgG, конъюгированным с FITC).
Поскольку экспрессия антитела в популяции клеток является гетерогенной, профиль FACS показывает индивидуальные точки данных, грубо организованные вдоль диагональной линии, направленной в верхний правый квадрант. Профили FACS для D2E7 дикого типа и библиотеки точечных мутаций VH показаны на ФИГ. 8, панели А и Б соответственно. Для того чтобы отобрать эталонную популяцию клеток для каждой библиотеки, которая содержит все экспрессируемые точечные мутации в их правильных частотах в библиотеке, ворота приближали к левому краю параллельно оси у; сортировка с использованием данных ворот отбирает все клетки, экспрессирующие IgG за пределами определенного уровня, независимо от того, насколько хорошо подвергающиеся дисплею антитела связываются с анти-Id. Их обозначали «ворота экспрессии» и «экспрессируемые популяции» (панель Б «R4»). Другие сортировки осуществляли с использованием верхней части ворот, поставленных грубо параллельно и сразу под главной диагональю популяции дикого типа; данные ворота были предназначены для отбора клеток, которые экспрессировали антитела с пониженной аффинностью связывания в отношении антиидиотипических антител, независимо от их общего уровня экспрессии IgG. Данные ворота и популяции были названы «ворота сортировки» и «сортированные популяции» (панель Б «R3»). И в воротах «сортированные», и в воротах «экспрессия» отбирали приблизительно 2000000 клеток.
7.6. Пример 6: массовое параллельное секвенирование популяций «экспрессируемые» и «сортированные»
Из клеточных популяций «экспрессируемые» и «сортированные» выделяли плазмиды и проводили ПЦР-амплификацию для получения коротких ампликонов, подходящих для массового параллельного секвенирования. Использовали праймеры ПЦР, которые подвергаются отжигу непосредственно снаружи от областей CDR1 и CDR3 домена VH и VL D2E7. Данными праймерами были: прямой праймер VH D2E7_VH_CDR1_for 
 (SEQ ID NO: 13); обратный праймер VH D2E7_VH_CDR3_rev
(SEQ ID NO: 13); обратный праймер VH D2E7_VH_CDR3_rev  (SEQ ID NO: 14); прямой праймер VL D2E7_VL_CDR1_for
(SEQ ID NO: 14); прямой праймер VL D2E7_VL_CDR1_for  (SEQ ID NO: 15); и обратный праймер VL D2E7_VL_CDR3_rev
(SEQ ID NO: 15); и обратный праймер VL D2E7_VL_CDR3_rev 
 (SEQ ID NO: 16). Таким образом, каждый ампликон содержал полные области CDR1, CDR2 и CDR3 для локализации и табулирования всех точечных мутаций, но в нем были опущены значительные части каркасов 1 и 4. Библиотеку VH и VL D2E7 ампликонов «сортированные» и «экспрессируемые» затем секвенировали с использованием секвенатора геномов FLX, как указано изготовителем. (454 Life Sciences, Branford, СТ).
(SEQ ID NO: 16). Таким образом, каждый ампликон содержал полные области CDR1, CDR2 и CDR3 для локализации и табулирования всех точечных мутаций, но в нем были опущены значительные части каркасов 1 и 4. Библиотеку VH и VL D2E7 ампликонов «сортированные» и «экспрессируемые» затем секвенировали с использованием секвенатора геномов FLX, как указано изготовителем. (454 Life Sciences, Branford, СТ).
Использовали компьютерную программу для проверки последовательностей и табулирования числа раз, которые была обнаружена каждая точечная мутация в популяциях «экспрессируемые» и «сортированные». Данная компьютерная программа исходно считывает и табулирует каждый кодон. Для аминокислот с более чем одним кодоном данная программа добавляет встречаемость разных кодонов для каждой аминокислоты, наряду с получением общего обзора поведения варианта с данной аминокислотой в каждой подпопуляции.
Для 4-факторной сортировки библиотек D2E7 для оценки связывания с TNF-α для каждого варианта кодона приведен балл отношения обогащения (ER). ER обозначает, насколько более или менее часто данный вариант обнаруживается в популяции Н по сравнению с его общей частотой. Аналогично отношения обогащения можно рассчитывать для каждого варианта в каждой из популяций М, L и Z. Ожидается, что вариантами с более высокой аффинностью обогащена популяция Н (ER>1) и обеднена (ER<1) популяция L. Наоборот, ожидается, что мутантами с меньшей аффинностью обеднена популяция Н (ER<1) и обогащена популяция L (ER>1). Можно идентифицировать варианты с большей, меньшей и нейтральной аффинностью, просто смотря на отношения обогащения для популяции Н.
В 2-факторном анализе FACS для оценки связывания библиотек D2E7 с антиидиотипическими антителами популяция «сортированные» содержит варианты, которые слабее связываются с антиидиотипическим антителом. В данном случае более высокое ER сортированных вариантов обозначает ослабленное связывание с антиидиотипическим антителом.
7.7. Пример 7: идентификация точечных мутаций с желательными свойствами
Для анализа данных число раз, которое обнаруживают мутацию в данном положении, нормируют по числу раз, которое секвенировано данное положение, и выражают как частоту на 1000 последовательностей. Затем частоту мутации в популяции сортированные делят на частоту в популяции экспрессируемые с получением отношения обогащения (ER), которое указывает на то, обогащается ли или обедняется мутацией популяция сортированные по сравнению с популяцией экспрессируемые, и в какой степени. Мутации, которыми обогащается популяция сортированные, будут иметь усиленное связывание с TNF-α, тогда как мутации, которыми популяция обедняется, будут иметь ослабленное связывание. Аналогично сортированные клетки, которые имели ослабленное связывание с антиидиотипическими антителами, будут иметь высокое отношение обогащения для данного конкретного антиидиотипического антитела.
7.8. Пример 8: анализ молчащих кодонов дикого типа
При определении того, была ли подпопуляция сортированные обогащена или обеднена вариантами в библиотеке, полезно сравнивать поведение данных вариантов с поведением белка дикого типа при таких же экспериментальных условиях. Это можно легко сделать, отслеживая поведение молчащих кодонов дикого типа - вариантов последовательностей ДНК, которые кодируют белок дикого типа, но которые содержат молчащую замену кодона, возникающую в результате рандомизации NNK. Например, в положении библиотеки, где кодон дикого типа представляет собой GGG (глицин), рандомизация NNK будет давать кодон GGT, также кодирующий глицин, но который можно отслеживать в описанных здесь способах сортировки и статистического анализа, подобно любому другому варианту. В зависимости от инициирующего кодона в любом положении везде может встречаться от нуля до трех молчащих кодонов дикого типа; на практике это обеспечивает то, что в типичной библиотеке CDR, покрывающей 50-65 разных положений, будет доступно несколько дюжин молчащих кодонов дикого типа. Среднее значение отношений обогащения данных молчащих диких типов можно использовать для определения средней точки эксперимента; варианты с улучшенной аффинностью будут обнаруживаться при значениях, превышающих данную среднюю точку, варианты с меньшей аффинностью будут обнаруживаться при значениях, меньших данной средней точки, и нейтральные варианты будут обнаруживаться вблизи от средней точки. На ФИГ. 9 показаны результаты анализа молчащих кодонов дикого типа. Полезные мутации (т.е. мутации с ослабленным связыванием с антиидиотипическим антителом 1Н11 и нейтральным связыванием с TNF-α) имели бы 1H11-ER выше чем 0,25 (средн. плюс 1 SD (стандартное отклонение)), и TNF-α-ER - от 1,21 до 1,59 (средн. плюс/минус 1 SD).
7.9. Пример 9: одноточечный анализ FACS
Для прогнозирования положений в CDR, которые приводили бы к пониженному связыванию с антиидиотипическими антителами, клетки 293с18, перенесенные в 96-луночные планшеты, трансфицировали подбиблиотеками с только одним положением, мутированным до 32 возможных кодонов (ФИГ. 10). После двух суток в культуре клетки отбирали и окрашивали антиидиотипическими антителами, конъюгированными с РЕ, при ЕС50 и TNF-oc-647 при ЕС50. Анализ FACS продемонстрировал положения, которым соответствует большая популяция клеток со слабым связыванием с антиидиотипическим антителом. На ФИГ. 11 показано, что некоторые положения (обведены) в VH могут быть мутированы для уменьшения связывания 1Н11, и что отсутствуют положения в VL, которые могут приводить к аналогичному эффекту. Аналогично на ФИГ. 12 показано, что связывание антиидиотипическими антителами 5А1 и 10F8 может быть снижено мутациями в определенных положениях в цепи VL. Мутации в цепи VH не снижают связывания с 5А1 и 10F8.
На ФИГ. 13А - 13Г показана модель Pymol D2E7 с отображением серым цветом положений в VH, прогнозируемых как важные для связывания 1Н11. Прогнозируемый эпитоп демонстрирует, что несмотря на то что данные положения рассеяны между тремя CDR, они являются смежными в модели и образуют конформационный и прерывистый эпитоп. Аналогично на ФИГ. 14А - 14Г показано, что положения в VL, важные в связывании 5А1 и 10F8, образуют конформационный или прерывистый эпитоп.
Для подтверждения пониженного связывания с антиидиотипическим антителом на поверхности клетки экспрессируют полноразмерный IgG с одиночной мутацией, затем окрашивают антиидиотипическим антителом, конъюгированным с AF647 при ЕС50 и антителом против IgG-PE. Для подтверждения нейтрального связывания с мишенью полноразмерный IgG на поверхности клетки окрашивают TNF-α-AF647 при ЕС50 и антителом против IgG-PE.
CDR1-2 VH (Y32) мутировали от Y до K, R, S, Т или V. На ФИГ. 15 показан одноточечный анализ FACS мутантов. Окрашивание FACS антиидиотипическим антителом 1Н11 подтверждает пониженное связывание у всех вариантов. Окрашивание TNF-α демонстрирует нейтральное связывание для всех мутантов за исключением Т, коррелирующее с меньшим ER данного мутанта на ФИГ. 16. Полезные мутации в VL D2E7, показанные на ФИГ. 16, были отобраны как мутации с пониженным связыванием с 1Н11 (1H11-ER выше, чем 0,25) и нейтральным связыванием с TNF-α (TNF-α-ER 1,21-1,60). Серым показаны нежелательные мутации.
На ФИГ. 17 представлены средние отношения обогащения 1Н11 по положению. Положения в VH D2E7 с высоким средним ER имеют больше возможных аминокислотных замен, приводящих к антителу с пониженным связыванием с анти-Id 1Н11.
На ФИГ. 18 представлены средние отношения обогащения в отношении 5А1 по положению. Положения в VL D2E7 с высоким средним ER имеют больше возможных аминокислотных замен, приводящих к антителу с пониженным связыванием с антиидиотипическим антителом 5А1.
На ФИГ. 19 представлены средние отношения обогащения 10F8 по положению. Положения в VL D2E7 с высоким средним ER имеют больше возможных аминокислотных замен, приводящих к антителу с пониженным связыванием с антиидиотипическим антителом 10F8.
7.10. Пример 10: анализ образования мостика с D2E7
Разработали анализ образования мостика с D2E7 для визуализации связывания D2E7 с антителами против адалимумаба (ADAb), полученными от доноров-людей. Планшеты ELISA для сильного связывания Immobilon покрывали 0,5 мкг/мл антитела D2E7 дикого типа в PBMS при 4°С в течение ночи. На следующие сутки планшеты промывали PBS, содержащим 0,1% Tween-20 (PBS/Tween). Планшеты блокировали 1% человеческим сывороточным альбумином в PBS (huAB/PBS) при комнатной температуре в течение 1-2 часов. Образцы человеческой сыворотки (Bioreclamation, NY) разводили в huAB/PBS и добавляли в планшеты ELISA. Наконец, добавляли биотинилированное антитело D2E7 дикого типа до конечной концентрации 15 нг/мл. Планшеты инкубировали при 4°С в течение ночи. На следующие сутки планшеты промывали в PBS/Tween. Стрептавидин-HRPO (МАВТЕСН) разводили 1:1000 согласно рекомендации изготовителя в huAB/PBS, и добавляли в планшеты 100 мкл/лунку. Планшеты инкубировали в течение 30 минут при комнатной температуре, затем один раз промывали PBS/Tween и дважды промывали дистиллированной водой. Добавляли ТМВ One Component (BioFX Laboratories), и окрашивание развивалось в течение 15 минут. Планшеты считывали при 650 нм. Включали позитивный контроль (мышиное моноклональное антитело против человеческого D2E7).
7.11. Пример 11: анализ ингибирования для подтверждения точечных мутаций в VH и VL D2E7
Имеющиеся в продаже образцы сыворотки от доноров-людей, в информированных согласиях которых в качестве лекарственного средства был перечислен адалимумаб, но не метотрексат, подвергали скринингу на предмет присутствия антител против адалимумаба («ADAb») с использованием анализа образования мостика из Примера 10. Доноры, которые продемонстрировали доказательство присутствия ADAb, были выбраны для дальнейшего исследования. Специфичность ADAb подтверждали проведением анализов ингибирования с использованием позитивных и негативных контролей, описанных ниже. ADAb выбранных доноров были специфичными в отношении фрагмента Fab D2E7.
Антитела-варианты, идентифицированные как имеющие пониженное связывание с мышиными антиидиотипическими антителами по сравнению с D2E7, подвергали скринингу на ингибирование в анализе образования мостика с D2E7. Ингибирование в анализе образования мостика антителом-вариантом демонстрирует, что данный вариант все еще может связываться ADAb сыворотки пациента. Следовательно, варианты, которые не препятствуют в анализе образования мостика, не имеют перекрестной реактивности с ADAb и, следовательно, представляют мутации в пределах эпитопа связывания антитела D2E7.
Планшеты ELISA Immobilon покрывали в течение ночи 0,5 мкг/мл D2E7 дикого типа, промывали и блокировали. В отдельном 96-луночном планшете варианты антител D2E7 разводили в huAb/PBS до 10 мкг/мл. Каждый вариант тестировали в двойной повторности. В качестве негативного контроля для связывания антитела против адалимумаба использовали герцептин и DP10, антитела IgG1, не являющиеся родственными D2E7. Антитело D2E7 дикого типа использовали в качестве позитивного контроля для ингибирования. Фрагменты Fab DP10 и D2E7 также использовали в качестве негативных и позитивных контролей соответственно. Сыворотку от доноров, демонстрирующих иммунный ответ на адалимумаб, разводили 1:25 в huAb/PBS и 100 мкл добавляли в лунки, содержащие варианты и контроли. Конечная концентрация сыворотки донора составляла 1:50. 100 мкл разведенной сыворотки с добавленными вариантами и контролями переносили в планшеты, покрытые D2E7. 100 мкл биотинилированного D2E7 в концентрации 30 нг/мл в huAb/PBS немедленно добавляли в планшеты. Планшеты инкубировали при 4°С в течение ночи. На следующие сутки планшеты промывали и добавляли разведенный стрептавидин-HRPO. Планшеты один раз промывали PBS/Tween-40, добавляли ТМВ One Component (BioFX Laboratories), и окрашивание развивалось в течение 15 минут. Планшеты считывали при 650 нм.
В качестве контроля во все тесты включали неродственное антитело DP10, и оно не имело влияния на связывание ADAb с D2E7 на планшетах. Процент ингибирования связывания ADAb с DP10 составлял в среднем 88 плюс/минус 12%. Анализ ингибирования осуществляли с использованием позитивных в отношении ADAb образцов сыворотки от четырех оплачиваемых доноров. Результаты, главным образом, перекрывались для всех четырех доноров, причем изменения в CDR3 VH имели наибольшее влияние на связывание ADAb (ФИГ. 20А - 20Б). Предпочтительные варианты отбирали двумя способами: на ФИГ. 21А показан список всех вариантов, которые имели процентное ингибирование, превышающее 2 стандартных отклонения относительно среднего для всех протестированных вариантов. На ФИГ. 21Б показаны все варианты, которые имели любую значимую активность у любого из четырех доноров. Наилучшей идентифицированной точечной мутацией была T100V с процентом ингибирования 53 плюс/минус 10%. Второй наилучшей мутацией была V95W со средним процентом ингибирования 47%. Наилучшим вариантом вне CDR3 VH был R30 VL с двумя вариантами аминокислотных замен со средней процентной долей ингибирования 23%.
Создали комбинацию вариантов на основе данных для одиночных вариантов. Создавали комбинации, которые содержали изменения и в VH, и в VL, в некоторых случаях включающие замены в варианте VL, имеющем замены G28S и A34S в CDR-L1 (нумерация по Kabat), соответствующие комбинации G5S плюс A11S в CDR-L1, как исходно описано в WO 2010/121140. Вариант остова VL с заменами G5S плюс A11S называется здесь VL-SS. Варианты антител экспрессировали, очищали и тестировали в анализе ингибирования с ADAb и в анализах аффинности связывания TNF-α. Результаты для связывания ADAb были усреднены для 2 доноров. Связывание оценивали с использованием тестирования поверхностным плазмонным резонансом (Biacore). Результаты показаны на Фиг.22. Варианты Y32K/SS-R30T и Y32K/SS-R30I демонстрировали наилучшую комбинацию уменьшения связывания ADA и сохраняли аффинность против TNF-α.
Все публикации, патенты, патентные заявки и другие документы, процитированные в данной заявке, являются тем самым включенными посредством ссылки во всей их полноте для всех задач в той же самой степени, как если бы каждая индивидуальная публикация, патент, патентная заявка или другой документ были индивидуально указаны как включенные посредством ссылки для всех задач.
В то время как были проиллюстрированы и описаны разные конкретные воплощения, будет понятно, что можно делать разные изменения, не отступая от сущности и объема данного изобретения(ий).
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ TNF-α И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2595379C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2011 |
|
RU2605928C2 |
| АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2017 |
|
RU2773355C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2007 |
|
RU2472807C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2012 |
|
RU2605327C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2016 |
|
RU2650767C2 |
| АНТИ-TIM3 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2723708C2 |
| PSCAXCD3, CD19XCD3, C-METXCD3, ЭНДОСИАЛИНXCD3, EPCAMXCD3, IGF-1RXCD3 ИЛИ FAP-АЛЬФАXCD3 БИСПЕЦИФИЧЕСКОЕ ОДНОЦЕПОЧЕЧНОЕ АНТИТЕЛО С МЕЖВИДОВОЙ СПЕЦИФИЧНОСТЬЮ | 2009 |
|
RU2547600C2 |
| АНТИТЕЛА ПРОТИВ AXL И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2577986C2 |





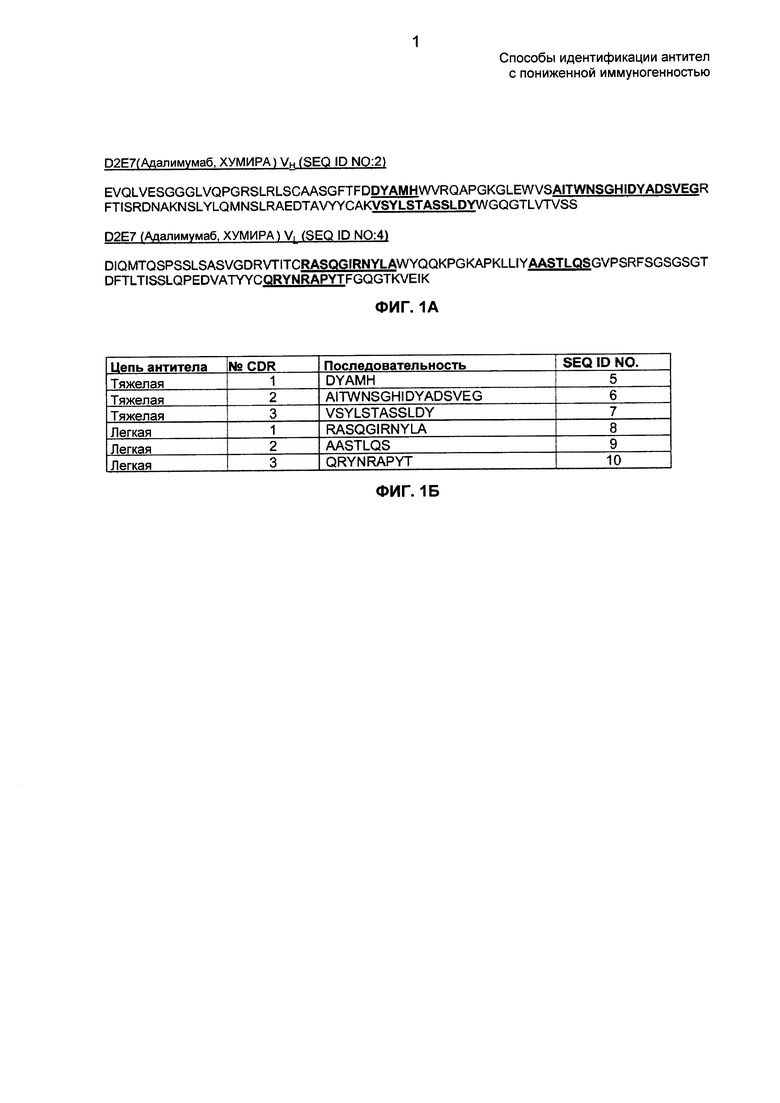

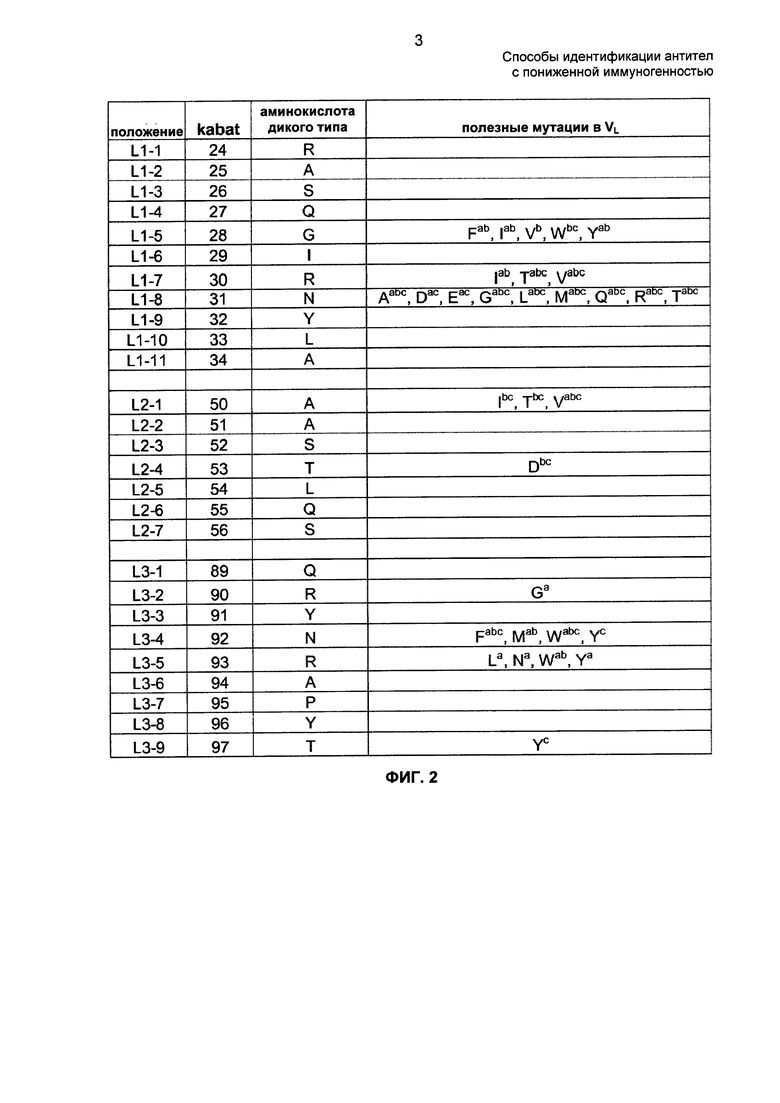
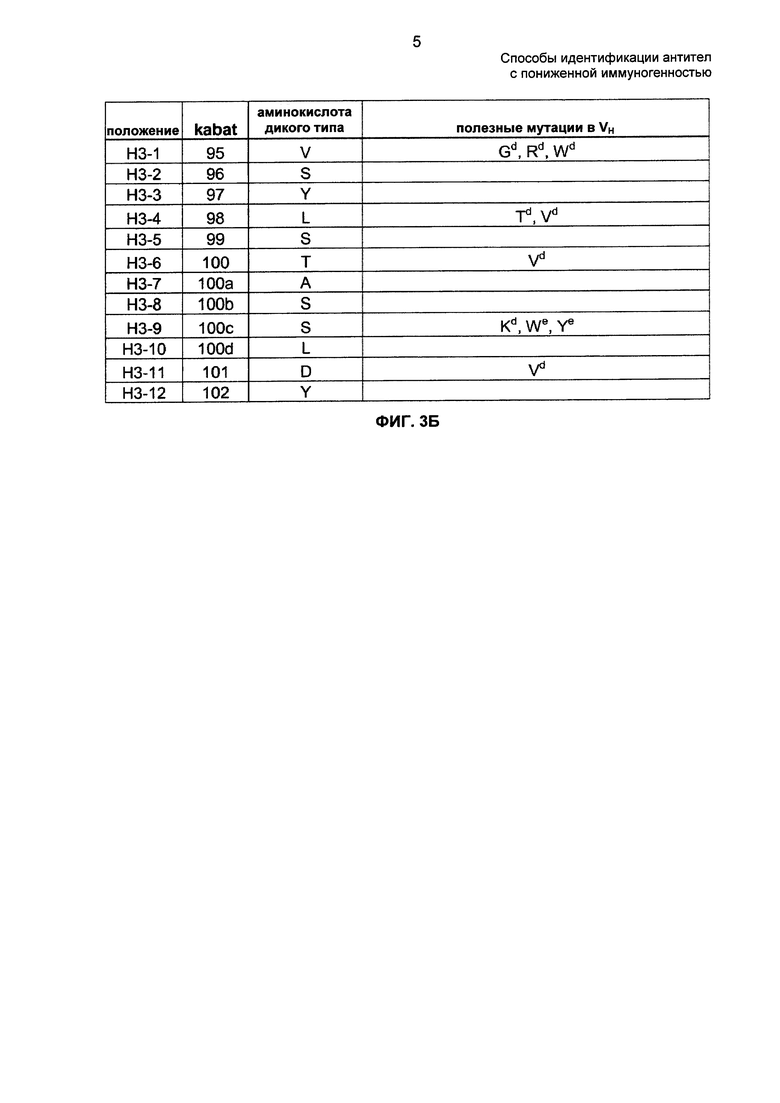
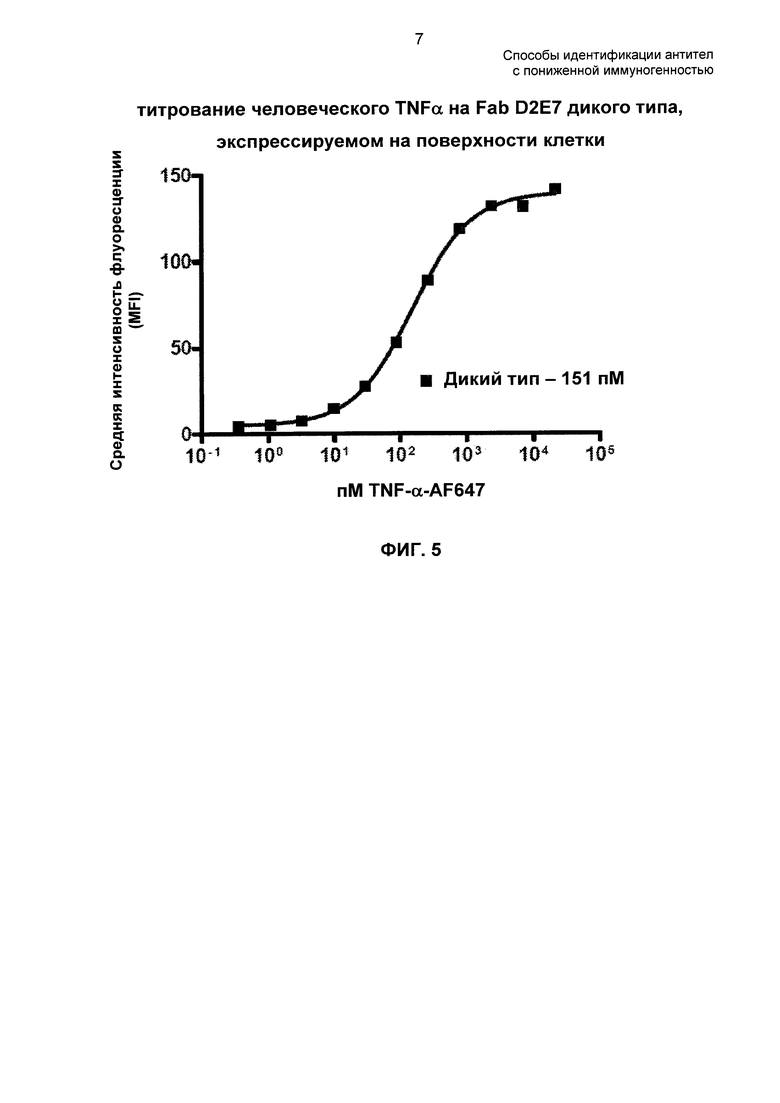
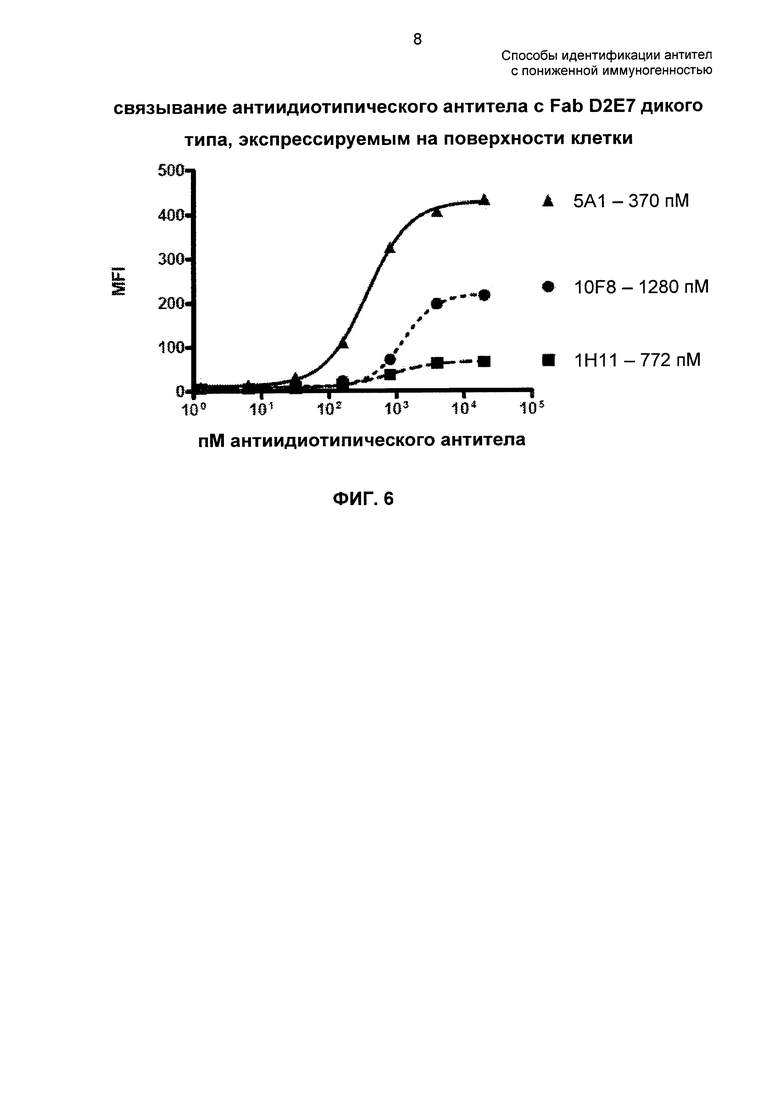
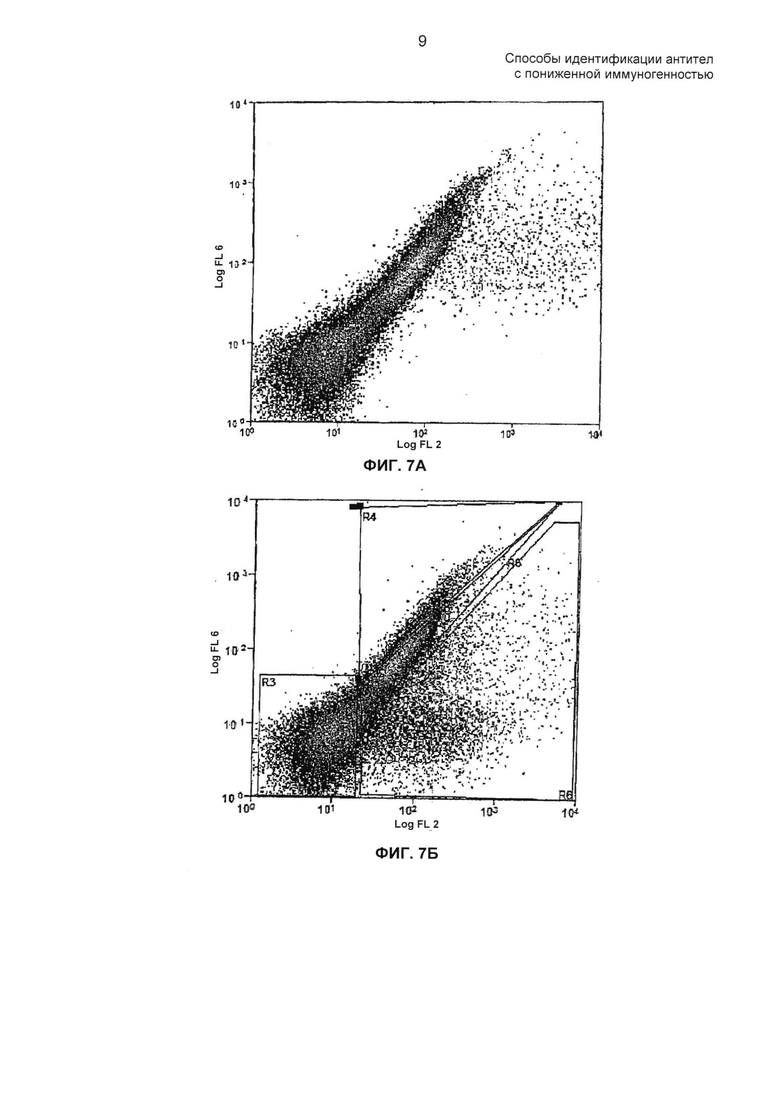
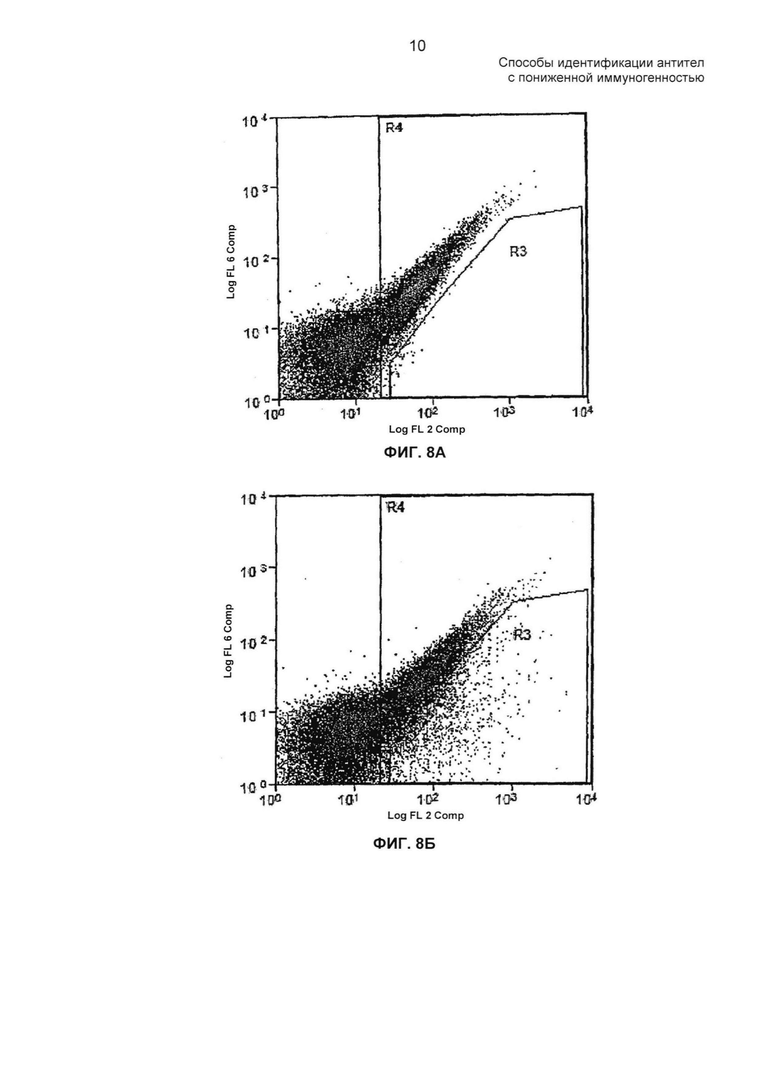
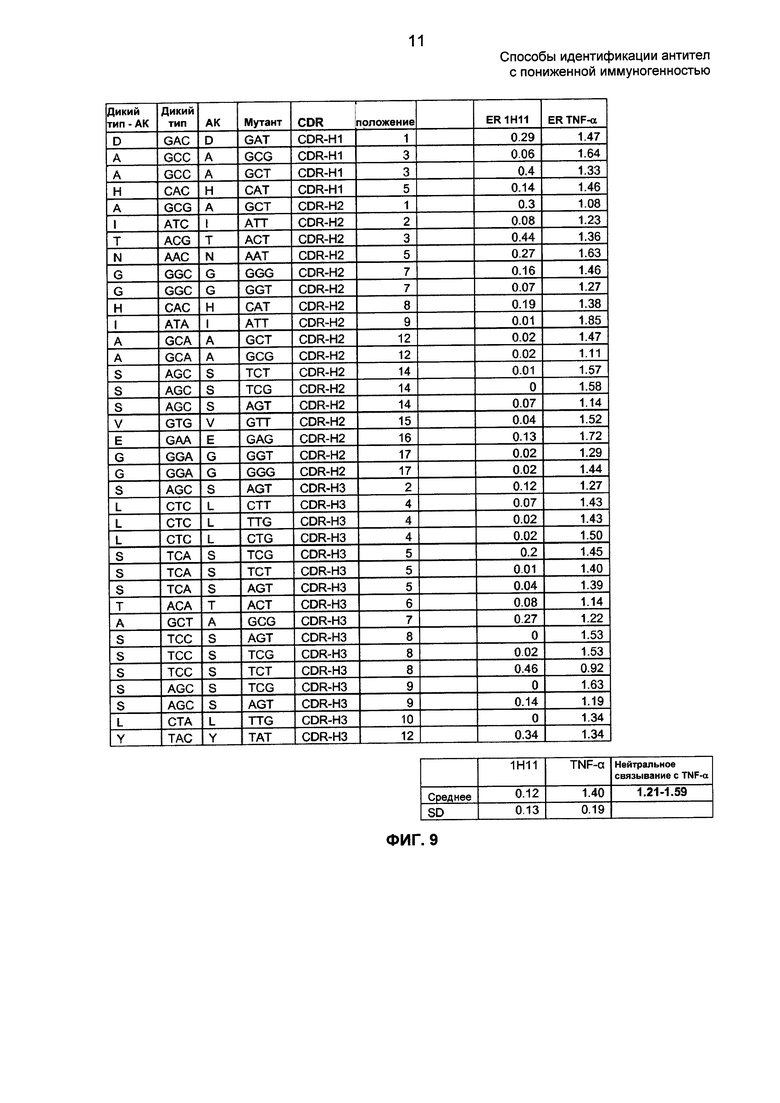
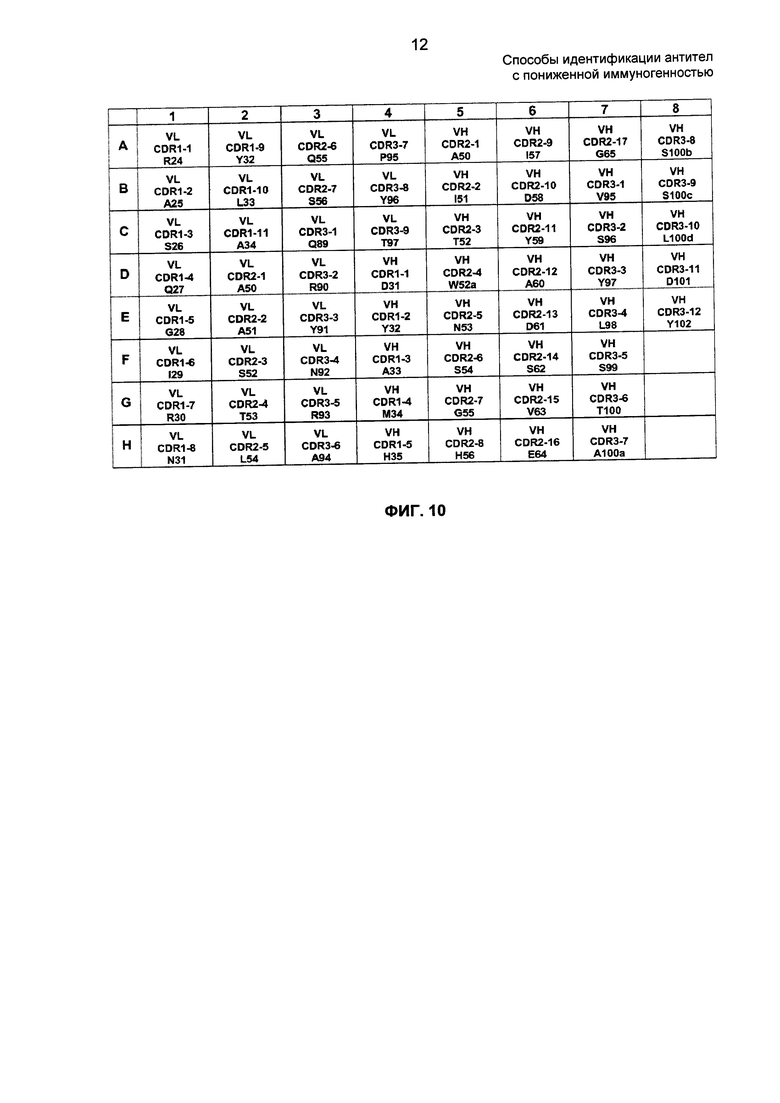
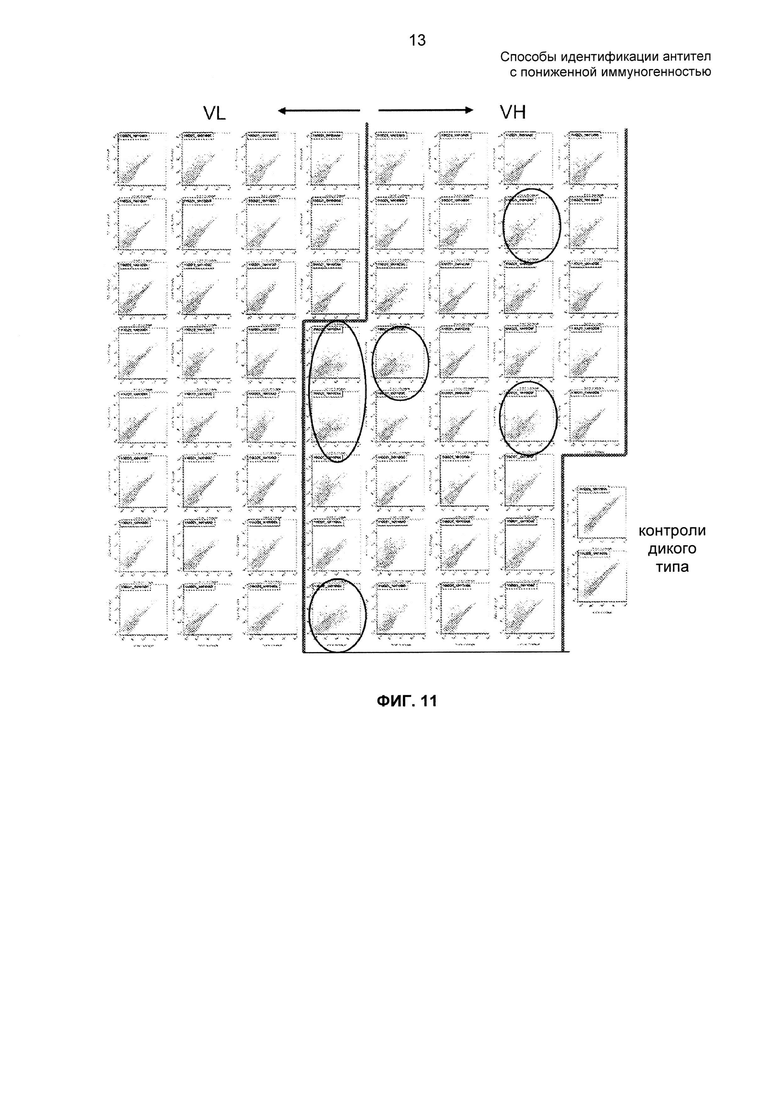
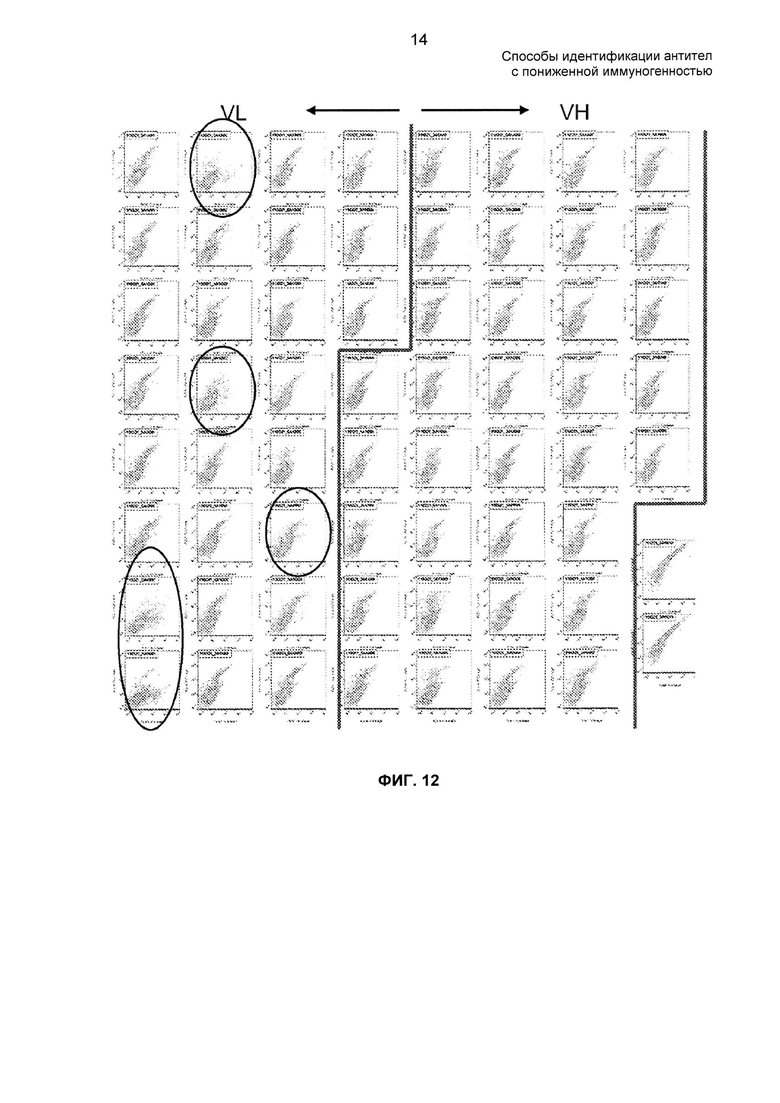
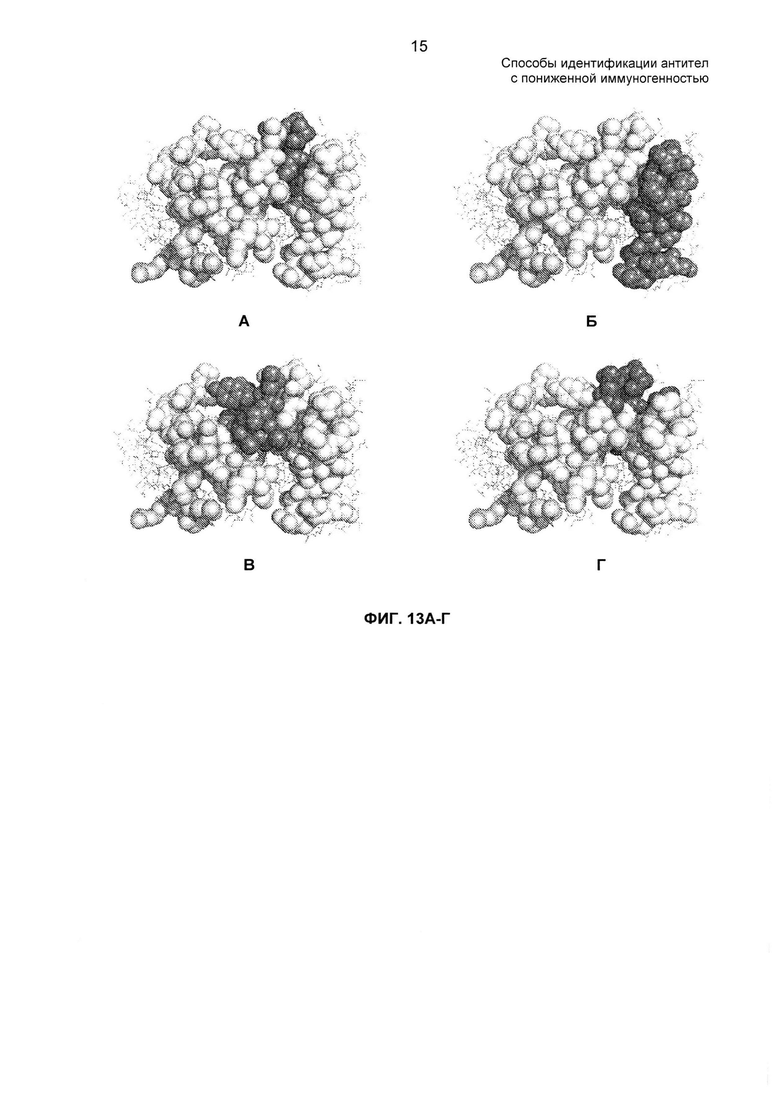
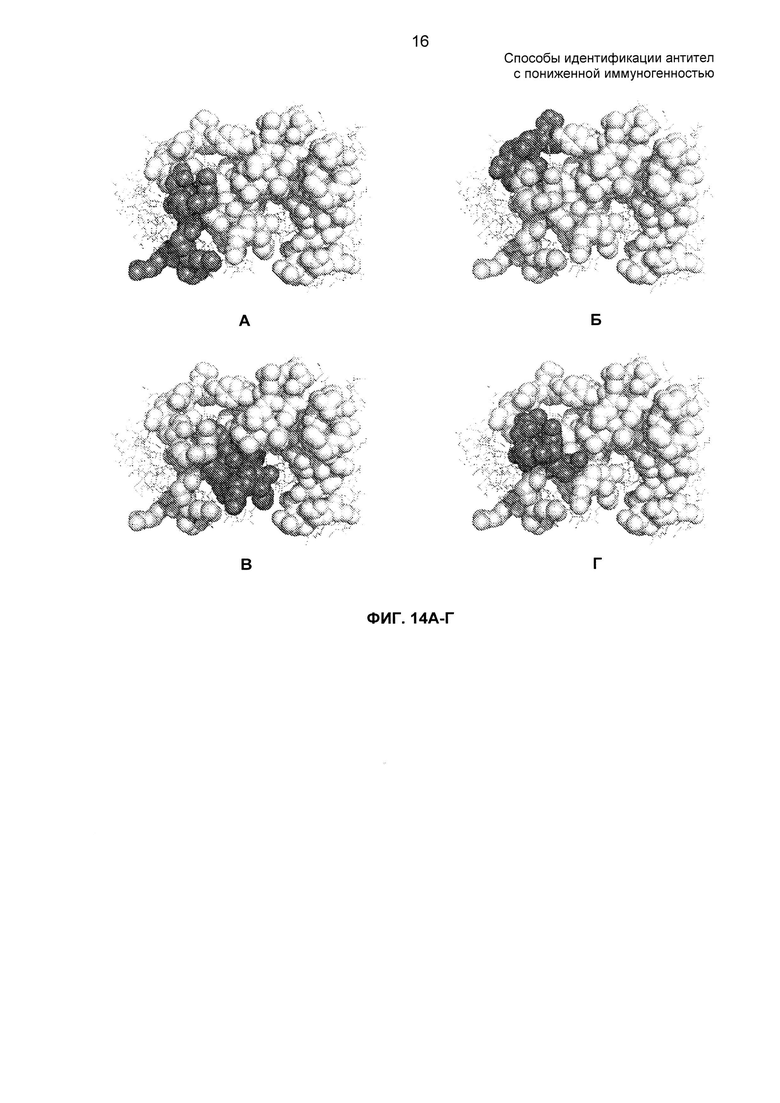
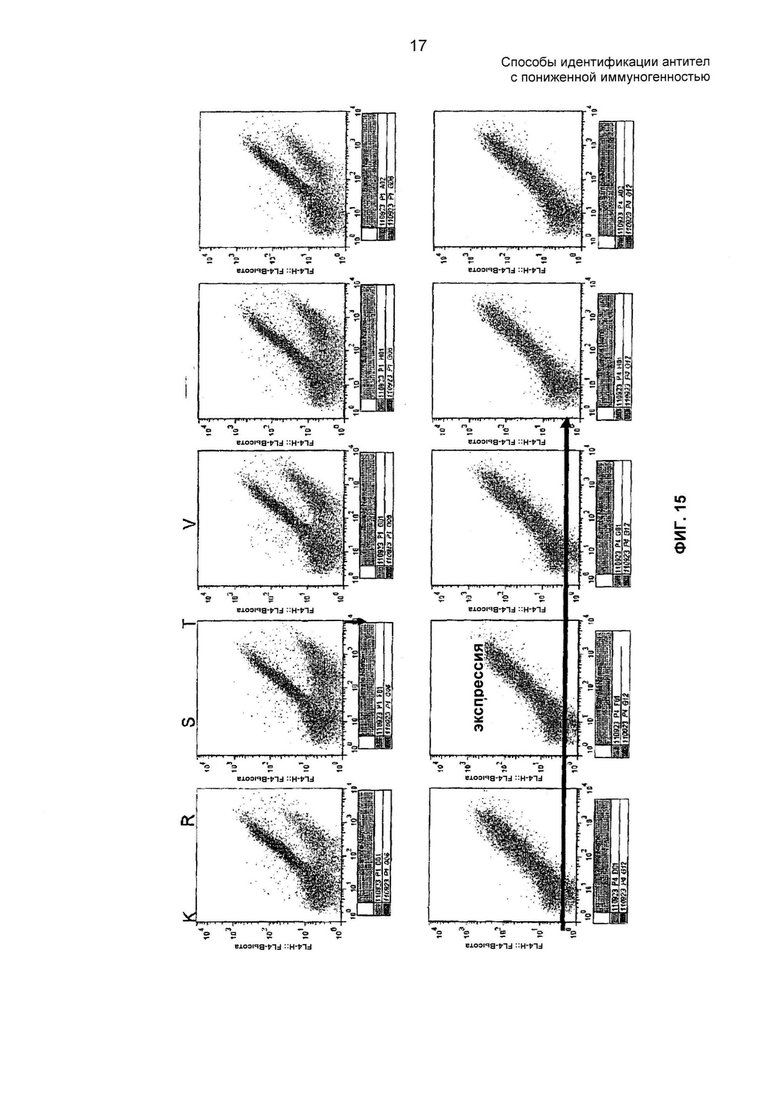
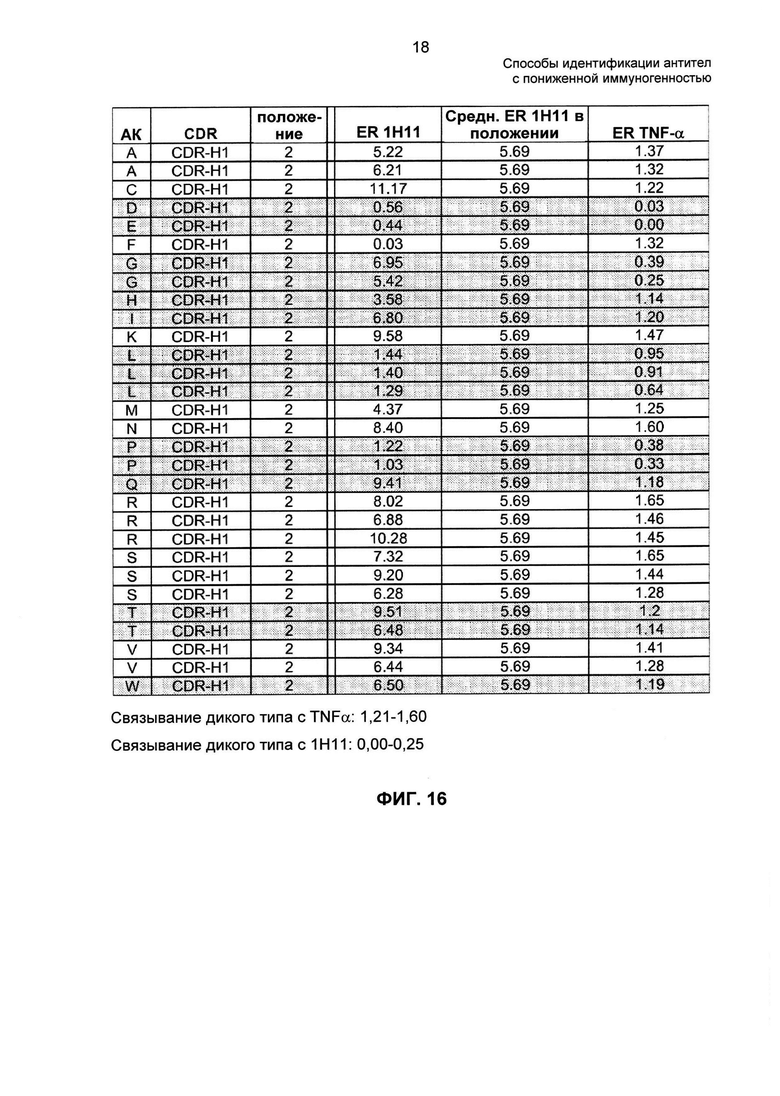
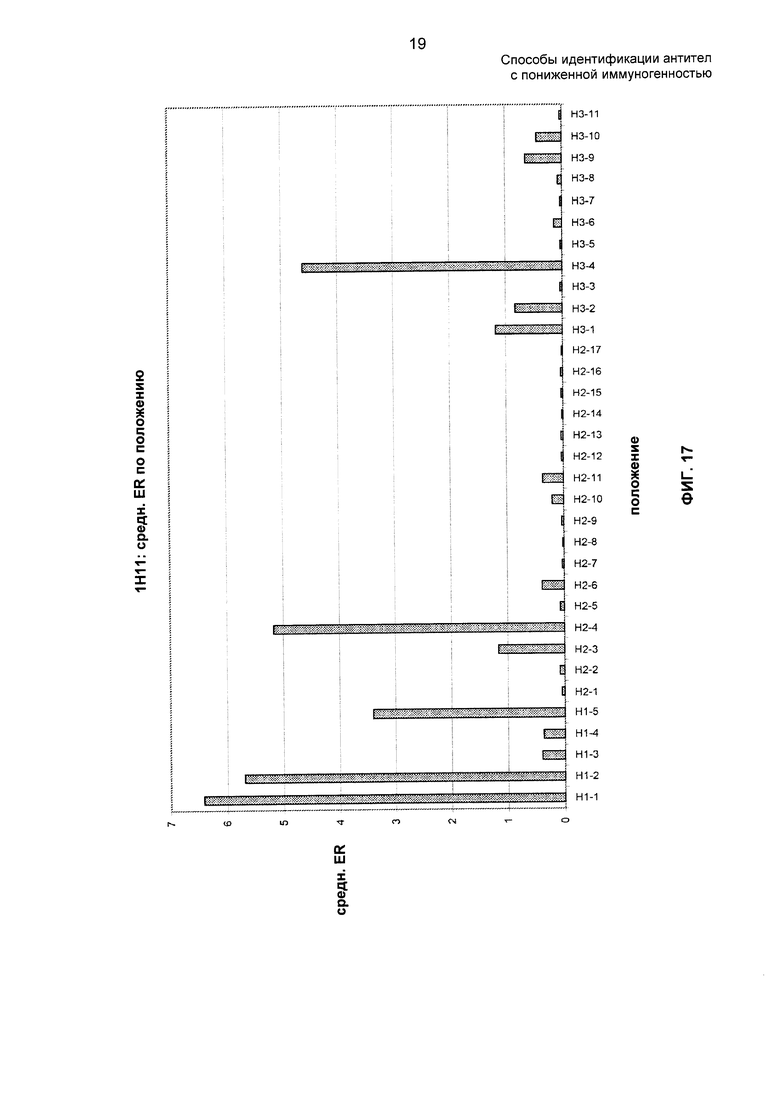
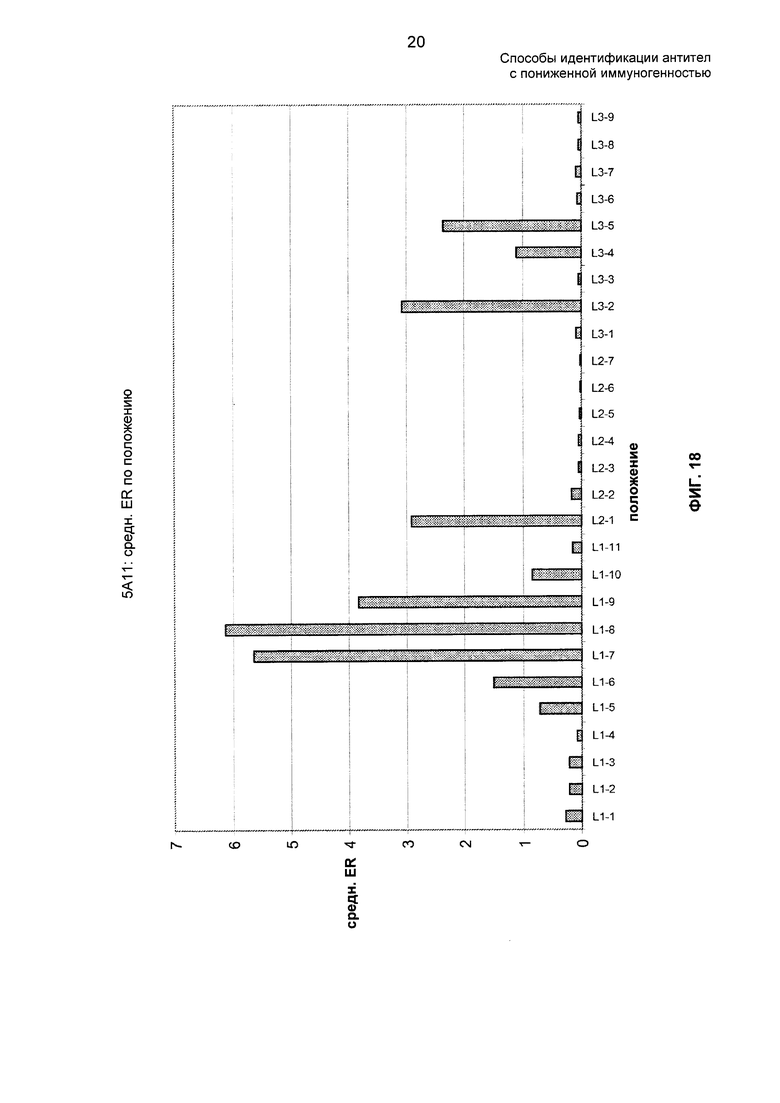
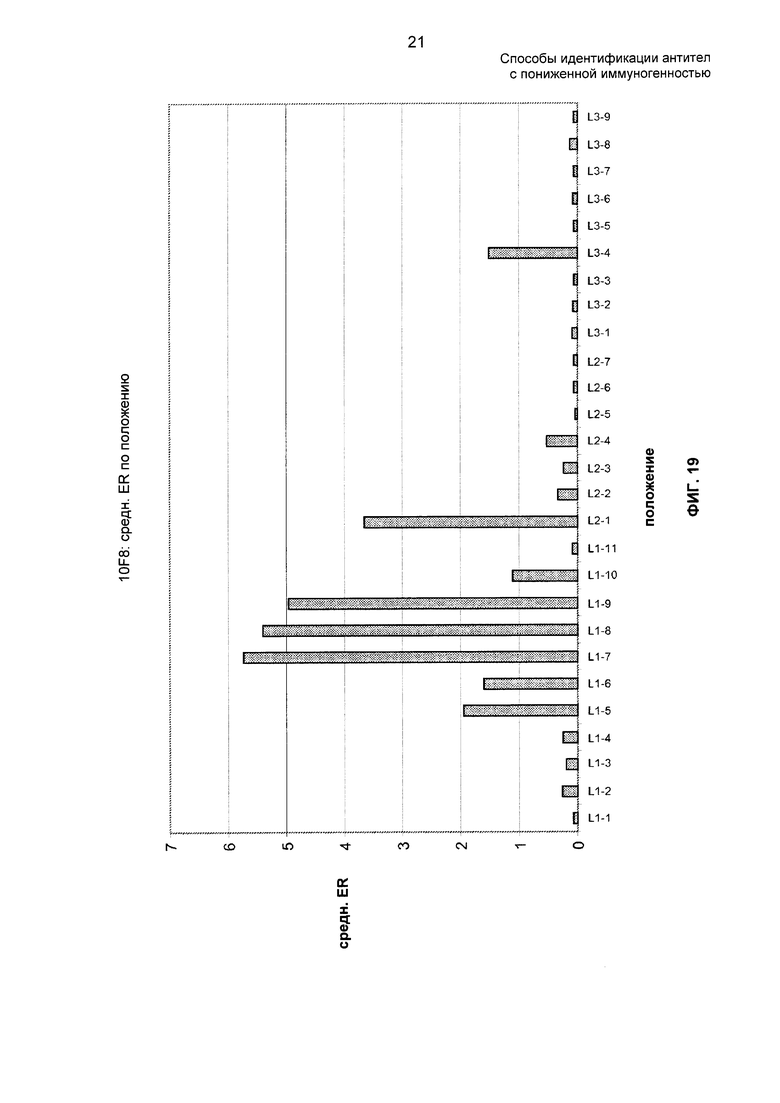
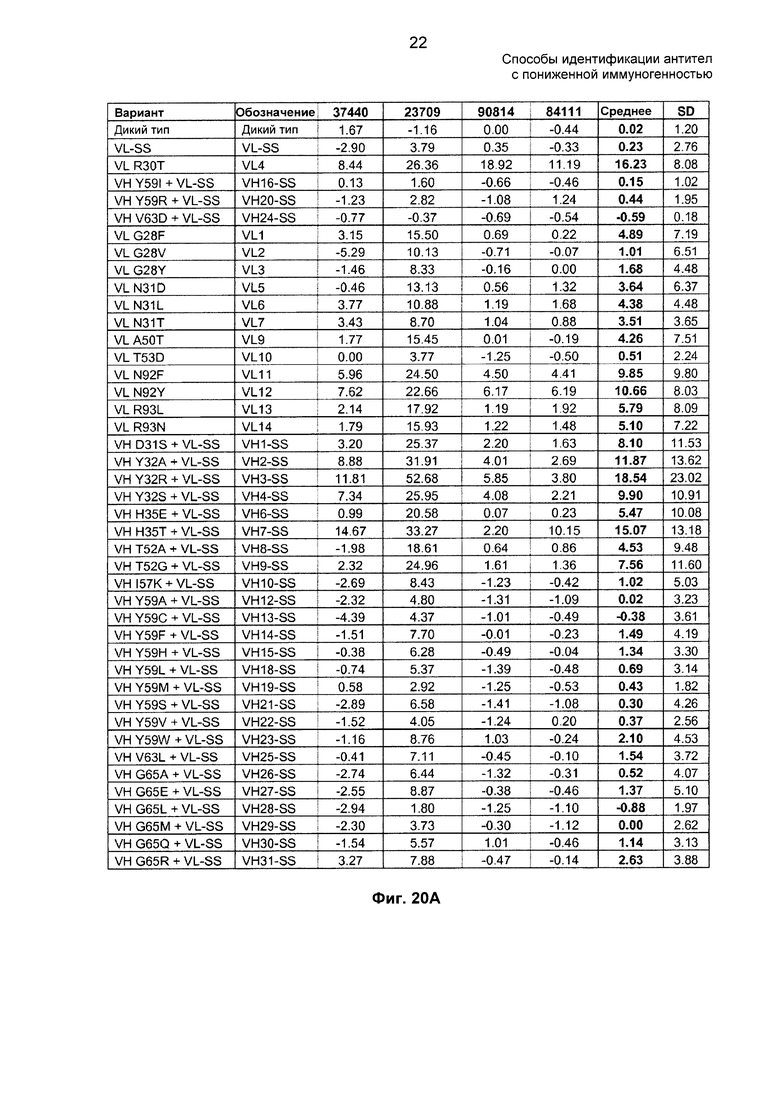
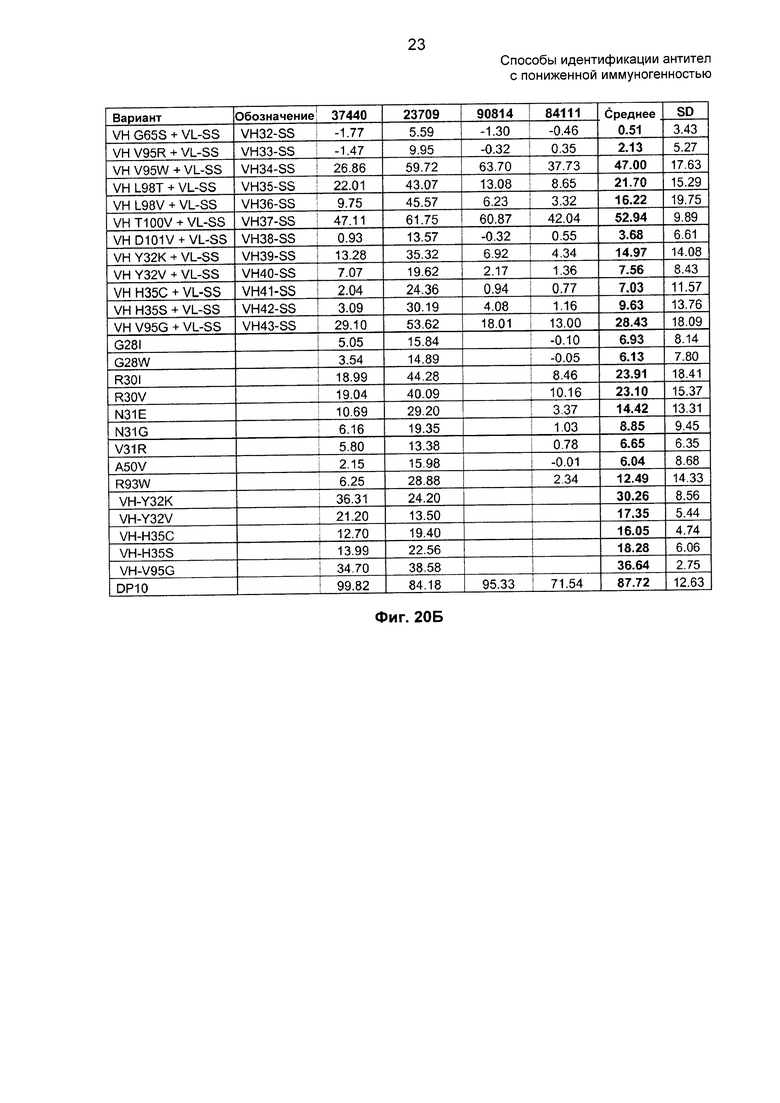
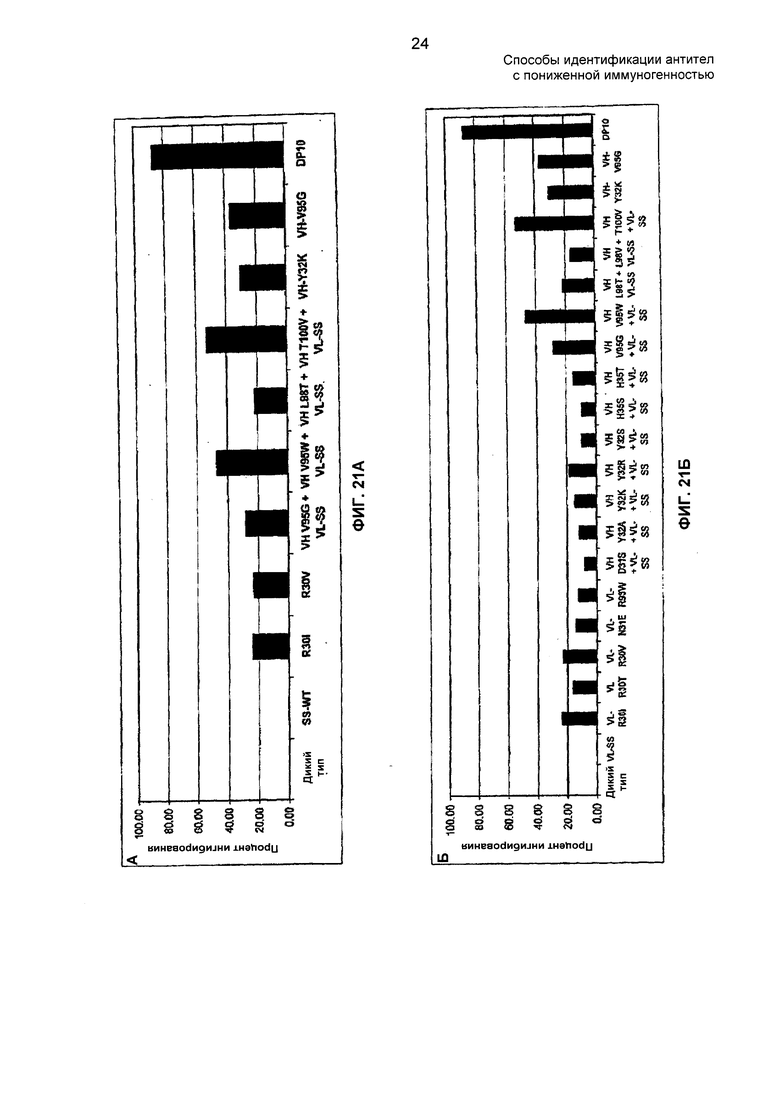
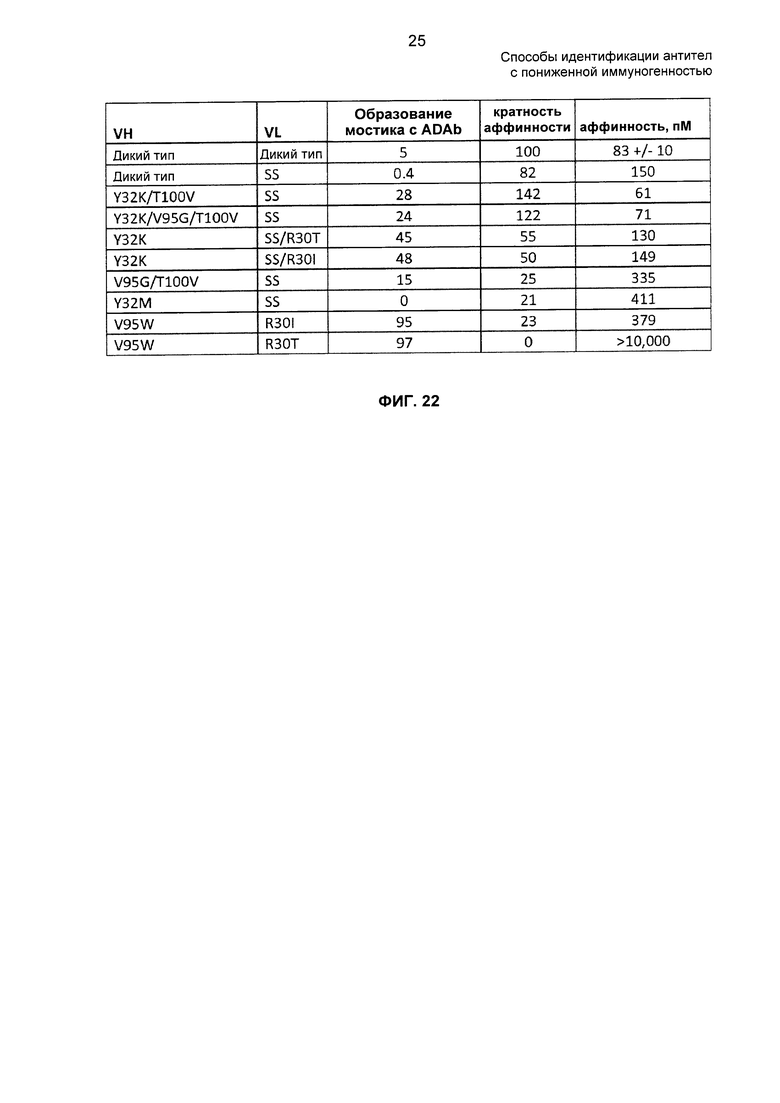
Представленные изобретения касаются варианта исходного антитела против TNF-α или исходного связывающего фрагмента антитела против TNF-α, молекулы нуклеиновой кислоты, клетки-хозяина, фармацевтической композиции и способа лечения. Охарактеризованный вариант исходного антитела или его связывающего фрагмента содержит шесть определяющих комплементарность областей («CDR»), имеющих аминокислотные последовательности, соответствующие SEQ ID NO: 5 (CDR-H1), SEQ ID NO: 6 (CDR-H2), SEQ ID NO: 7 (CDR-H3), SEQ ID NO: 8 (CDR-L1), SEQ ID NO: 9 (CDR-L2) и SEQ ID NO: 10 (CDR-L3), где данный вариант содержит замену Y2K в CDR-H1 и где шесть CDR в совокупности имеют вплоть до 8 аминокислотных замен по сравнению с последовательностями CDR исходного антитела или связывающего фрагмента. Представленные решения могут быть использованы для лечения такого иммунного расстройства, как ревматоидный артрит, юношеский идиопатический артрит, псориатический артрит, анкилозирующий спондилит, болезнь Крона, бляшечный псориаз и аксиальный спондилоартрит. 5 н. и 5 з.п. ф-лы, 22 ил., 11 пр.
1. Вариант исходного антитела против TNF-α или исходного связывающего фрагмента антитела против TNF-α, где исходное антитело или связывающий фрагмент содержит шесть определяющих комплементарность областей («CDR»), имеющих аминокислотные последовательности, соответствующие SEQ ID NO: 5 (CDR-H1), SEQ ID NO: 6 (CDR-H2), SEQ ID NO: 7 (CDR-H3), SEQ ID NO: 8 (CDR-L1), SEQ ID NO: 9 (CDR-L2) и SEQ ID NO: 10 (CDR-L3), где данный вариант содержит замену Y2K в CDR-H1, где шесть CDR в совокупности имеют вплоть до 8 аминокислотных замен по сравнению с последовательностями CDR исходного антитела или связывающего фрагмента.
2. Вариант по п. 1, который дополнительно содержит по меньшей мере одну из замен в тяжелой цепи: (1) T6V в CDR-H3 и (2) V1G в CDR-H3 и T6V в CDR-H3.
3. Вариант по п. 1 или 2, который дополнительно содержит по меньшей мере одну из замен в легкой цепи: (1) G5S в CDR-L1 и A11S в CDR-L1; (2) R7I в CDR-L1; (3) G5S в CDR-L1, R7T в CDR-L1 и A11S в CDR-L1; и (4) G5S в CDR-L1, R7I в CDR-L1 и A11S в CDR-L1.
4. Вариант по п. 1, который дополнительно содержит по меньшей мере одну из замен в легкой цепи: (1) R7I в CDR-L1 и (2) R7T в CDR-L1.
5. Вариант по п. 1, который дополнительно содержит по меньшей мере одну из замен в легкой цепи: (1) G5S в CDR-L1, R7T в CDR-L1 и A11S в CDR-L1 и (2) G5S в CDR-L1, R7I в CDR-L1 и A11S в CDR-L1.
6. Вариант по п. 1, в котором исходное антитело против TNF-α или исходный связывающий фрагмент против TNF-α содержит фрагмент вариабельной области тяжелой цепи, имеющий аминокислотную последовательность, соответствующую SEQ ID NO: 2, и фрагмент вариабельной области легкой цепи, имеющий аминокислотную последовательность, соответствующую SEQ ID NO: 4.
7. Молекула нуклеиновой кислоты, кодирующая вариант по любому из пп. 1-6.
8. Клетка-хозяин для экспрессии варианта по любому из пп. 1-6, содержащая молекулу нуклеиновой кислоты, кодирующую указанный вариант.
9. Фармацевтическая композиция для связывания TNF-α, содержащая вариант по любому из пп. 1-6 и фармацевтически приемлемый носитель.
10. Способ лечения иммунного расстройства у пациента-человека, включающий введение пациенту терапевтически эффективного количества варианта по любому из пп. 1-6, где иммунное расстройство выбрано из ревматоидного артрита, юношеского идиопатического артрита, псориатического артрита, анкилозирующего спондилита, болезни Крона, бляшечного псориаза и аксиального спондилоартрита.
| NOREEN R | |||
| GONZALES et al., Minimizing the Immunogenicity of Antibodies for Clinical Application, Tumor Biol 2005, Vol.26, pp.31-43 | |||
| WO 2009032128 A1, 12.03.2009 | |||
| FIONA A | |||
| HARDING et al., The immunogenicity of humanized and fully human antibodies Residual immunogenicity resides in the CDR regions, mAbs, 2010 May/June, Vol.2, No.3, pp.256-265 | |||
| SUN OK YOON et al., Construction, Affinity Maturation, and Biological Characterization of an Anti-tumor-associated Glycoprotein-72 Humanized Antibody, THE JOURNAL OF BIOLOGICAL CHEMISTRY, March 17, 2006, Vol | |||
| ПАРОПЕРЕГРЕВАТЕЛЬ ДЛЯ ТРУБЧАТЫХ ПАРОВЫХ КОТЛОВ С ЭЛЕМЕНТАМИ, СОСТОЯЩИМИ ИЗ ДВУХ ПЕТЕЛЬ, ВВОДИМЫХ В ПРОГАРНЫЕ ТРУБЫ КОТЛА | 1916 |
|
SU281A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Способ приготовления пористого кирпича | 1928 |
|
SU9288A1 |
Авторы
Даты
2018-03-22—Публикация
2013-09-18—Подача