Изобретение относится к области синтеза нано- и микрочастиц сложных оксидов металлов в сверхкритической воде и может найти применение в получении материалов и соединений высокой чистоты и с уникальными свойствами.
Для синтеза наноструктурных материалов, представителями которых являются наночастицы, нанопленки и нанопроволоки, предложено много методов, которые можно разделить на две принципиальные группы. Первая, получение наноструктур из материалов нормальных размеров, т.е. bulk materials. Вторая, получение наноструктур из систем молекулярного уровня.
Чистые окислы различных металлов находят широкое применение в практике. Многие окислы, в первую очередь Al2О3, W2O5, Cr2О3, Fe2O3 и др., используются в качестве катализаторов, другие для упрочнения металлов и для получения ферритов.
Основными методами синтеза или получения чистых окислов металлов являются термическое разложение солей (сухой метод) при высоких температурах и осаждение гидроокисей из растворов (влажный метод) с последующим их прокаливанием.
К основным недостаткам известных методов синтеза окислов металлов следует отнести:
1. Нитраты щелочных металлов, применяемые в качестве исходных веществ, при прокаливании переходят в нитриты и окислов не образуют.
2. Прокаливанием некоторых солей очень трудно получить, например, окислы стронция или бария, так как их карбонаты начинают разлагаться только при 1200-1300°С.
3. Прокаливанием солей трудно получить чистые окислы металлов.
4. Соли, образованные нелетучими кислотами (фосфаты, бораты, вольфраматы и др.), при нагревании не разлагаются, за исключением солей аммония и ртути, и потому не могут служить исходными веществами для получения окислов соответствующих металлов.
5. При прокаливании аммонийных солей выделяется аммиак-восстановитель, что может привести к загрязнению получаемого продукта низшими окислами элементов.
6. Поскольку большинство гидроокисей (для метода получения окислов металлов из гидроокисей), осаждаемых из растворов, трудно получить в чистом, свободном от примесей состоянии, трудно получить индивидуальные окислы в чистом виде также.
7. Дегидратация гидроокисей при их прокаливании не всегда идет до конца, и часто полученные таким образом окислы содержат небольшое количество гидроокиси.
8. Чистота и свойства окислов металлов, полученных этими методами, сильно зависит от режима и температуры прокаливания.
Сверхкритические флюиды являются привлекательной средой для синтеза, модификации и формирования наночастиц неорганических материалов, в частности окислов металлов (TiO2, Cr2O3, LiFePO4) [Reverchon E., Adami R. Nanomaterials and supercritical fluids // J. of Supercritical Fluids. 2006. V.37. P.1.; Jung J., Perrut M. Particle design using supercritical fluids: Literature and patent survey // J. of Supercritical Fluids. 2001. V.20. P.179.; Zhang Y., Erkey C. Preparation of supported metallic nanoparticles using supercritical fluids: A review // J. of Supercritical Fluids. 2006. V.38. P.252.; Aymonier C., Loppiner-Serani A., Reveron H., Garrabos Y., Cansell F. Review of supercritical fluids in inorganic materials science // J. of Supercritical Fluids. 2006. V.38. P.242]. Такие наноструктуры и материалы демонстрируют необычные свойства, отличные от таковых для массивных материалов.
Известен метод синтеза частиц окислов металлов [T.Adschiri, Y.Hakuta, K.Arai, Hydrothermal synthesis of metal oxide fine particles at supercritical conditions, Ind. Eng. Chem. Res. 39 (2000) 4901; T.Adschiri, Y.Hakuta, K.Sue, K.Arai, Hydrothermal synthesis of metal oxide nanoparticles at supercritical conditions, J. Nanopart. Res. 3 (2001) 227; A.Cabanas, J.Darr, E.Lester, M.Poliakoff, Continuous hydrothermal synthesis of inorganic materials in a near-critical water flow reactor; the one-step synthesis of nano-particulate Ce1-xZrxO2 (x=0-1) solid solutions, J. Mater. Chem. 11 (2001) 561], при помощи которого осуществляют гидротермический синтез нано- и микрочастиц окислов металлов в сверхкритической воде - ск-Н2О.
Несколько основных одно- и многостадийных химических реакций прекурсора и солей металлов могут реализовываться при синтезе частиц в ск-Н2О: гидролиз и дегидратация, термолиз, восстановление и окисление (как правило, в присутствии водорода). В области критических параметров воды увеличивается ее диссоциация и, следовательно, концентрация в ней Н+ и ОН-. В результате этого, гидротермический синтез в ск-Н2О наночастиц окислов металлов из их солей осуществляются в результате двухстадийных реакций гидролиза и дегидратации:
Гидролиз: MeBn+nOH-→Me(OH)n+nВ-
Дегидратация: Me(OH)n→MeOn/2+n/2H2O
Гидротермический метод прост в реализации и масштабировании, осуществляется в реакторах, автоклавах или проточных трубчатых реакторах, позволяет контролировать свойства и размер частиц.
Известен способ гидротермального синтеза частиц сложных оксидов металлов, принятый нами за прототип [JP 2001163700 (A) Arai Kunio, Ajiri Masafumi. Lithium-based composite metal oxide and method of producing the same], при помощи которого проводят непрерывный синтез наночастиц LiCoO2 в сверхкритической воде. Способ включает раздельную подачу в реактор растворов соли Со(NO3)2, гидрооксида лития - LiOH и пероксида водорода - Н2О2. Пероксид водорода в прототипе применяется для получения кислорода при разложении H2O2 и дальнейшее его участие в реакции окисления Со2+.
К главному недостатку прототипа следует отнести неконтролируемое образование Со3O4, вследствие использования кислорода, образующегося при разложении Н2O2.
Предлагаемое изобретение решает задачу эффективного синтеза соединений окислов металлов сложного состава.
Синтез наночастиц сложного оксида LiMeOx, где Me - Со, Ni, Zn, Cu, осуществляют смешением 0.1М водного раствора двух солей: нитрата лития LiNO3 и соли Me - Со, Ni, Zn, Cu со сверхкритической водой в реакторе проточного типа при температуре 370-390°С, давлении 220-230 атм.
Синтез наночастиц LiCoO2 осуществляют смешением 0.1М водного раствора двух солей: нитрата лития LiNO3 и сульфата кобальта CoSO4 со сверхкритической водой в реакторе проточного типа при температуре 380-390°С, давлении 226-230 атм.
Синтез наночастиц LiNiO2 осуществляют смешением 0.1М водного раствора двух солей: нитрата лития LiNO3 и уксуснокислого никеля Ni(СН3СОО)2 со сверхкритической водой в реакторе проточного типа при температуре 380-390°С, давлении 226-230 атм.
Синтез наночастиц LiCuO2 осуществляют смешением 0.1М водного раствора двух солей: нитрата лития LiNO3 и уксуснокислой меди Cu(СН3СОО)2 со сверхкритической водой в реакторе проточного типа при температуре 380-390°С, давлении 226-230 атм.
Синтез наночастиц LiZnO2 осуществляют смешением 0.1М водного раствора двух солей: нитрата лития LiNO3 и сульфата цинка ZnSO4 в реакторе проточного типа при температуре 370-380°С, давлении 220-230 атм.
Технический результат - синтез соединений окислов металлов на основе наночастиц, создание экологически чистой безотходной технологии.
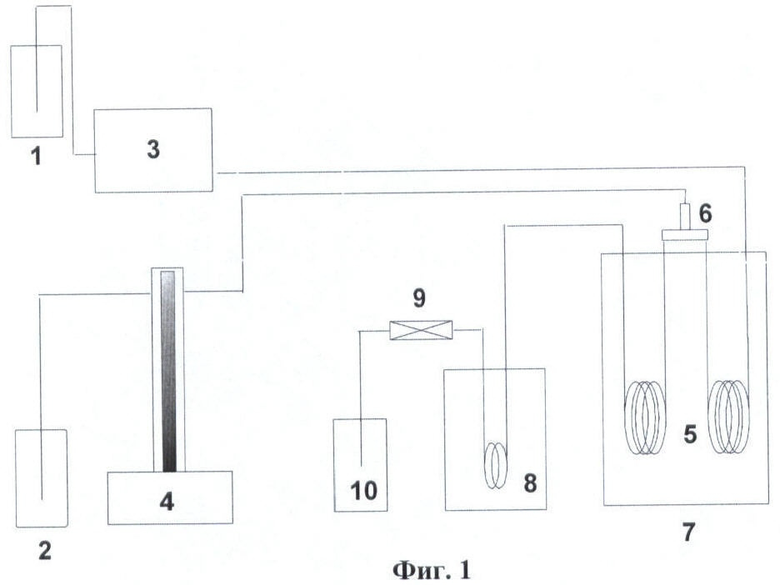
Исходные маточные растворы для синтеза LiСоО2, LiNiO2, LiZnO2, LiCuO2 готовят растворением в воде эквимолярных количеств безводного нитрата лития - LiNiO3 и одной из солей CoSO4·7H2O, Ni(СН3СОО)2·4Н2O, Ni(NO3)3·6H2O, Cu(СН3СОО)2·H2O, ZnSO4·7H2O. Гидротермический синтез соединений окислов двух металлов LiMeOx (LiCoO2, LiNiO2, LiZnO2, LiCuO2), одним из которых является Li, проводят в непрерывном режиме в реакторе проточного типа (Фиг.1).
Маточный раствор из емкости 2 шприцевым насосом 4 подают в трубчатый реактор 5 объемом 7.2 см3, помещенный в печь с кипящим слоем песка 7,- поток 1 через смеситель 6, в котором происходит его смешение со ск-H2O - поток 2, подаваемый поршневым насосом 3 из емкости 1 в непрерывном режиме. Превращения проводят при температурах и давлениях, близких к критическим параметрам смеси, содержащей более 95% воды, - температура 370-390°С, давление 220-230 атм. Продукты взаимодействия солей с ск-H2O выходят из реактора в теплообменник 8, через клапан обратного давления 9 в накопительную емкость 10.
Продукты гидротермического синтеза, в зависимости от размера и свойств образующихся кристаллов, часто представляют собой неосаждающуюся смесь частиц в воде. Выделение образующихся частиц окислов металлов из раствора для анализа твердой фазы проводят центрифугированием раствора или выпариванием, с последующей сушкой твердой фазы.
Структура, фазовый и элементный состав образцов полученных соединений анализируют методами электронной сканирующей микроскопии (HRTEM), рентгенофазового анализа (XRD). В отдельных случаях, образовавшиеся водные продукты анализируют с использованием метода UV спектроскопии.
Сущность изобретения иллюстрируется следующими примерами, иллюстрациями.
Пример 1. Синтез LiCoO2
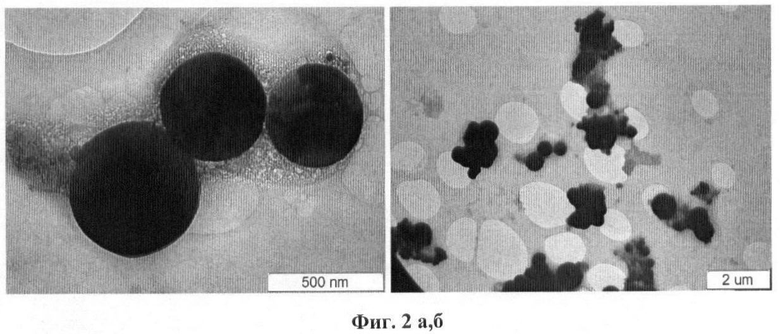
Для гидротермического синтеза соединения LiCoO2 готовят 0.1М водный раствор нитрата лития LiNO3 с сульфатом кобальта CoSO4. Температура гидротермического синтеза изменялась 380-390°С, давление 226-230 атм. На Фиг.2а, б приведены HRTEM снимки частиц-продуктов гидротермического синтеза. Видно, что частицы LiCoO2 имеют круглую форму размером ~500 нм. Эти частицы окружены «шубой», состоящей из продуктов, образовавшихся после высушивания растворителя. Крупные частицы размером ~500 нм образуют агломераты из 3-4 частиц, более мелкие >500 нм из 10 и более.
Пример 2. Синтез LiNiO2
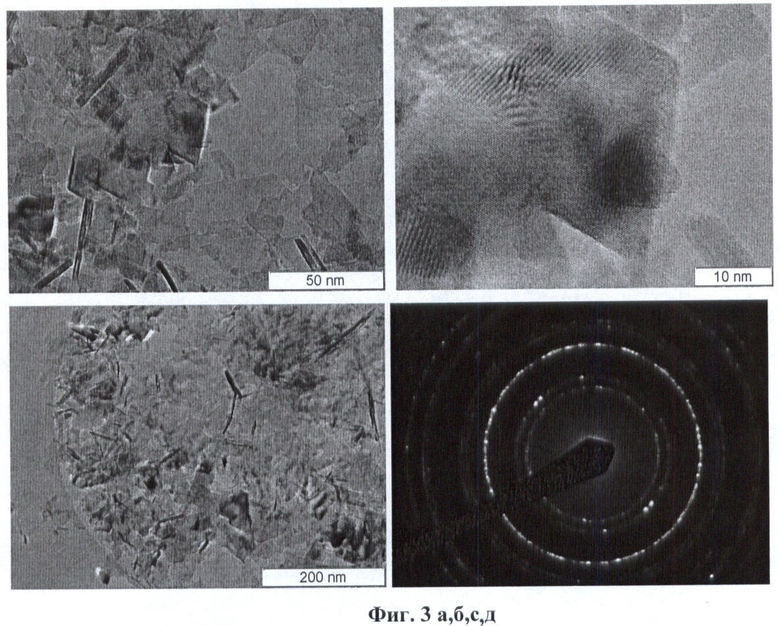
Для проведения синтеза готовят водный 0.1М раствор нитрата лития LiNO3 и уксуснокислого никеля Ni(СН3СОО)2. Температура синтеза изменялась 380-390°С, давление 226-230 атм. На Фиг.3а, б, с приведены снимки HRTEM синтезируемого образца целевого соединения, которое имеет вид слоистых пластин размером ~50 нм и толщиной около 2-3 нм. Для этой структуры расстояния межатомных плоскостей, Фиг.3д, соответствуют соединению LiNiO2. В исследуемом образце наблюдаются и более контрастные частицы с размерами 3-5 нм, для которых размер межатомных плоскостей равен 0.246 нм - такой же, как и для слоистой фазы. На основании этого делается вывод о том, что слоистая фаза - это LiNiO2 (высокая степень замещения никеля литием), а мелкие контрастные частицы с низкой степенью замещения представляют собой фазу NiO. Последнее подтверждается также данными рентгенофазового анализа.
Пример 3. Синтез LiCuO2
Маточный раствор (0.1М) готовят растворением солей нитрата лития LiNO3 и уксуснокислой меди Cu(СН3СОО)2 в воде. Температура гидротермического синтеза изменялась 380-390°С, давление 226-230 атм. По данным электронной сканирующей микроскопии синтезируемый образец представляет поликристаллическую смесь кристаллов с высокой степенью огранки, отвечающей кубической симметрии, и довольно однородных по габитусу, Фиг.4а, б. Их форма и размеры: изоморфная (кубики) ≈50 нм, вытянутая (параллелепипеды) ≈50×150 нм, уплощенная (пластины) 50×100 нм. Характерны дендритовидные сростки этих кристаллов. На поверхности кристаллов под пучком электронов в HRTEM образуется аморфный молекулярный слой с толщиной молекулярного порядка размеров, что характерно для кристаллических соединений лития.
Рассчитанные межатомные плоскостные расстояния, Фиг.4с (0.282 с; 0.257 с; 0.232 с; 0.1894 ср.; 0.1668 сл.; 0.1508 сл.; 0.1388 ср.), относятся с куприту лития - LiCuO2 и CuO. Данные XRD также подтверждают наличие значительного количества CuO.
Пример 4. Синтез LiZnO2
Маточный раствор (0.1М) готовят растворением солей нитрата лития LiNO3 и сульфата цинка ZnSO4 в воде. Температура гидротермического синтеза изменялась 370-380°С, давление 220-230 атм.
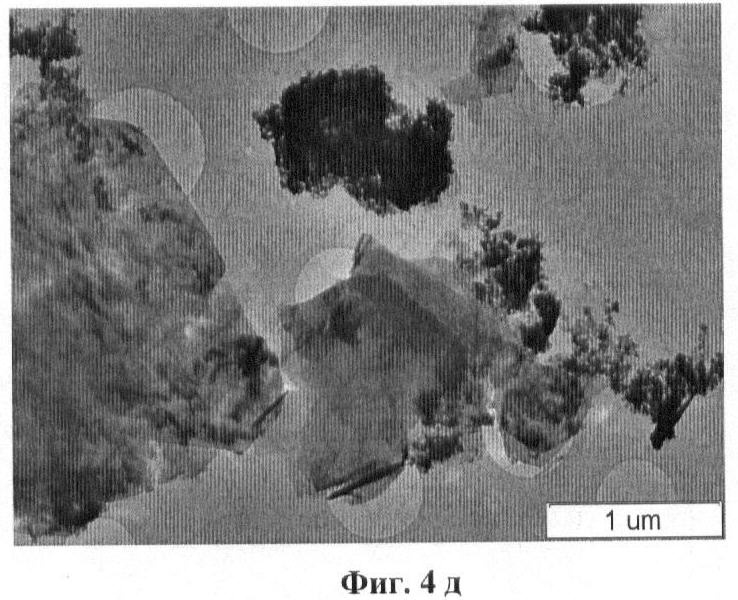
На Фиг.4д приведен ТЕМ снимок синтезируемого соединения LiZnO2. Видно, что продукт синтеза представлен двумя типами структур: пластины (характерные размеры: ~10 нм × ~1 мкм) и агрегаты изометричных кристаллов с размерами не более 10 нм. Пластины нестабильны под пучком электронов HRTEM - происходит разупорядочение структуры. EDX дает для пластин интенсивную линию Zn.
Приведенные примеры и иллюстрации демонстрируют, что предложенный метод и условия гидротермического синтеза позволяют синтезировать наночастицы окислов металлов требуемого размера и свойств.
Как видно из текста и примеров, изобретение решает задачу синтеза соединений окислов металлов на основе наночастиц, создания экологически чистой безотходной технологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕЗ НАНОЧАСТИЦ ОКСИДА ГАЛЛИЯ В СВЕРХКРИТИЧЕСКОЙ ВОДЕ | 2011 |
|
RU2487835C2 |
| СИНТЕЗ НАНОЧАСТИЦ ОКСИДА ЦЕРИЯ В СВЕРХКРИТИЧЕСКОЙ ВОДЕ | 2011 |
|
RU2488560C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛУПРОВОДНИКОВЫХ НАНОЧАСТИЦ | 2012 |
|
RU2517781C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕТАЛЛИЧЕСКИХ НАНОПОРОШКОВ | 2020 |
|
RU2742634C1 |
| СПОСОБ ТЕРМИЧЕСКОЙ ИЗОМЕРИЗАЦИИ АЛЬФА-/БЕТА-ПИНЕНОВ ИЛИ СКИПИДАРА | 2006 |
|
RU2320630C1 |
| Способ получения ароматических аминов | 2016 |
|
RU2627765C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАМФОЛЕНОВОГО АЛЬДЕГИДА | 2009 |
|
RU2402522C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИС/ТРАНС-ЦИТРАЛЕЙ И (ИЗО)ПИПЕРИТЕНОЛА | 2008 |
|
RU2357949C1 |
| Способ получения синтез-газа из CO | 2017 |
|
RU2668863C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ФЕНИЛЭТАНОЛА И ПАРАЗАМЕЩЕННЫХ 1-ФЕНИЛЭТАНОЛА | 2012 |
|
RU2487860C1 |

Изобретение может быть использовано в химической технологии. Для получения наночастиц сложного оксида LiMeO2, где Me - Со, Ni, Zn, Cu, смешивают 0,1 М водный раствор нитрата лития LiNO3 и соли Me - Со, Ni, Zn, Cu со сверхкритической водой в реакторе проточного типа при температуре 370-390°С, давлении 220-230 атм. В качестве солей металлов используют такие соли, как сульфат кобальта CoSO4, сульфат цинка ZnSO4, уксуснокислый никель Ni(СН3СОО)2, уксуснокислая медь Cu(СН3СОО)2. Изобретение позволяет синтезировать наночастицы сложных оксидов металлов с помощью экологически чистой безотходной технологии. 4 з.п. ф-лы, 4 ил.
1. Способ получения наночастиц сложного оксида LiMeO2, где Me - Со, Ni, Zn, Cu, отличающийся тем, что его осуществляют смешением 0,1 М водного раствора двух солей: нитрата лития LiNO3 и соли Me - Со, Ni, Zn, Cu со сверхкритической водой в реакторе проточного типа при температуре 370-390°С, давлении 220-230 атм.
2. Способ получения по п.1, отличающийся тем, что получение наночастиц LiCoC2 осуществляют смешением 0,1 М водного раствора двух солей: нитрата лития LiNO3 и сульфата кобальта CoSO4 со сверхкритической водой в реакторе проточного типа при температуре 380-390°С, давлении 226-230 атм.
3. Способ получения по п.1, отличающийся тем, что получение наночастиц LiNiO2 осуществляют смешением 0,1 М водного раствора двух солей: нитрата лития LiNO3 и уксуснокислого никеля Ni(СН3СОО)2 со сверхкритической водой в реакторе проточного типа при температуре 380-390°С, давлении 226-230 атм.
4. Способ получения по п.1, отличающийся тем, что получение наночастиц LiCuO2 осуществляют смешением 0,1 М водного раствора двух солей: нитрата лития LiNO3 и уксуснокислой меди Cu(СН3СОО)2 со сверхкритической водой в реакторе проточного типа при температуре 380-390°С, давлении 226-230 атм.
5. Способ получения по п.1, отличающийся тем, что получение наночастиц LiZnO2 осуществляют смешением 0,1 М водного раствора двух солей: нитрата лития LiNO3 и сульфата цинка ZnSO4 со сверхкритической водой в реакторе проточного типа при температуре 370-380°С, давлении 220-230 атм.
| JP 2001163700 A, 19.06.2001 | |||
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОДИСПЕРСНЫХ ЛИТИЙ МЕТАЛЛ ОКСИДОВ | 2002 |
|
RU2240974C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКСИДНЫХ СОЕДИНЕНИЙ ОБЩЕЙ ФОРМУЛЫ LIMO, ГДЕ M=FE, И/ИЛИ CO, И/ИЛИ NI | 2000 |
|
RU2183587C2 |
| Устройство для определения параметров коконов | 1987 |
|
SU1472829A1 |
| CN 101453006 A, 10.06.2009. | |||
Авторы
Даты
2012-01-10—Публикация
2010-03-11—Подача