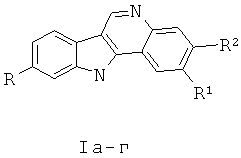
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 11H-индоло[2,3-с]хинолина, которые могут быть использованы в синтезе новых препаратов фармацевтического назначения.
Изобретение относится к разработке способа получения производных 11H-индоло[2,3-с]хинолина общей формулы I, представляющих интерес как вещества, обладающие противораковой активностью [Helissey P., Giorgi-Renault S., Renault J., Cros S., Chem. Pharm. Bull., 1989, 37, 675], а также которые могут быть использованы в синтезе противомалярийных препаратов-аналогов алкалоида изокриптолепина [Hostyn S., Maes B.U.W., Pieters L., Lemiere G.L.F., Matyus P., Hajos G., Dommisse R.A., Tetrahedron, 2005, 61, 1571].
В литературе описаны различные подходы к синтезу производных 11H-индоло[2,3-с]хинолина. Так, при кипячении азидов 3-фенилхинолина в о-дихлорбензоле происходит региоселективная термическая циклизация в производные 11H-индоло[2,3-с]хинолина [Trecourt F., Mongin F., Mallet M., Quéguiner G., Synthetic Communications, 1995, 25, 4011], также эти соединения получают окислительной фотохимической циклизацией 4-(N-фенил)аминохинолинов в смеси бензола, метанола и серной кислоты при облучении ультрафиолетом в присутствии следов йода [Dhanabal Т., Sangeetha R., Mohan P.S., Tetrahedron, 2006, 62, 6258].
Другим способом получения является реакция Фишера, взаимодействие 2,3-дигидро-1-H-хинолин-4-она с фенилгидразинами в уксусной кислоте в присутствии серной кислоты [Rousseil О., Buu-Hoi N.P., Jacquignon P., Journal of the Chemical Society, 1965, 5458; He L., Chang H., Chou Т., Savaraj N., Cheng C.C., European Journal of Medicinal Chemistry, 2003, 38, 101].
Существуют также методы, основанные на палладий катализируемой реакции циклизации 4-N-(2-галогенфенил)аминохинолина [Meyers С., Rombouts G., Loones K.T.J., Coelho A., Maes B.U.W., Adv. Synth. Catal., 2008, 350, 465; Jonckers T.H.M,. Maes B.U.W., Lemiere G.L.F., Rombouts G, Pieters L., Haemers A., Dommissea R.A., Synltett, 2003, 5, 615], приводящий к производным 11H-индоло[2,3-с]хинолина.
Недостатком описанных методов является либо низкая селективность, либо применение дорогостоящих катализаторов на основе палладия.
Задача изобретения - разработка способа получения производных 11Н-индоло[2,3-с]хинолина I, позволяющего расширить номенклатуру потенциально биологически активных веществ и представляющих собой удобные исходные соединения для синтеза аналогов алкалоида изокриптолепина.
Техническим результатом является обеспечение введения требуемых заместителей в целевой продукт при одновременном формировании хинолинового ядра.
Технический результат достигается тем, что в способе получения производных 11H-индоло[2,3-с]хинолина доступные 4-[2-(2-нитрофенил)-1H-индол-3-ил]-бут-3-ен-2-оны II [Butin A.V., Uchuskin M.G., Pilipenko A.S., Tsiunchik F.A., Cheshkov D.A., Trushkov I.V., Eur. J. Org. Chem., 2010, 920] кипятят в уксусной кислоте в присутствии карбонильного железа в течение 5 мин.
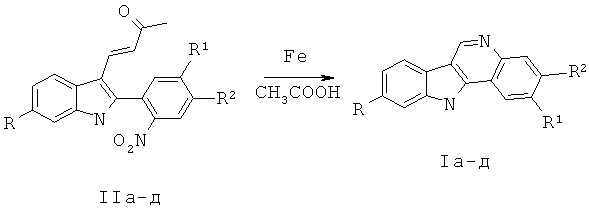
В основе заявляемого метода лежит взаимодействие электрофильного атома углерода с нуклеофильным атомом азота при одновременном формировании хинолинового каркаса, описанное в работе [MacPhillamy H.B., Dziemam R.L., Lucas R.A., Kuehne M.E., J. Am. Chem. Soc., 1958, 2172].
Температуры плавления, данные элементного анализа и спектральные характеристики 11H-индоло[2,3-с]хинолина Iа-д приведены в таблице 1.
Полученный технический результат позволяет расширить ряд производных 11H-индоло[2,3-с]хинолина Iа-д, а тем самым и номенклатуру потенциально биологически активных соединений.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Примеры осуществления заявляемого способа получения 11H-индоло[2,3-с]хинолина.
Пример 1.
Смесь 0.5 г (1.6 ммоль) 4-[2-(2-нитрофенил)-1H-индол-3-ил]-бут-3-ен-2-она Iа, 1.83 г (32 ммоль) карбонильного железа и 25 мл уксусной кислоты нагревают до полного растворения исходного соединения и кипятят в течение 5 мин. Затем реакционную смесь выливают в 500 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (20×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток перекристаллизовывают из 1,4-диоксана. Выход 68% (0. 24 г).
Тпл.>250 (разложение).
Найдено C18H14N2O3, % С, 82.60; Н 4.70; N 12.80.
Вычислено: С 82.55; Н 4.62; N 12.83.
Спектр 1Н ЯМР (CDCl3), (δ, м. д. и КССВ, J, Гц): 7.32-7.37 (м, 1Н, HAr), 7.48-7.53 (м, 1Н, HAr), 7.68-7.78 (м, 3Н, HAr), 8.13-8.16 (м, 1Н, HAr), 8.31-8.34 (м, 1Н, HAr), 8.52-8.55 (м, 1Н, HAr), 9.61 (с, 1Н, HPy), 12.75 (с, 1Н, NH).
Спектр 13С ЯМР (CDCl3), (δ, м. д.): 111.9, 114.3, 117.0, 120.1, 120.6, 121.9, 122.1, 125.6, 125.7, 128.1, 129.2, 138.8, 139.9, 144.6, 145.1.
Пример 2.
Смесь 0.5 г (1.6 ммоль) 4-[2-(2-нитрофенил)-1H-индол-3-ил]-бут-3-ен-2-она Ia, 0.183 г (3.2 ммоль) карбонильного железа и 25 мл уксусной кислоты нагревают до полного растворения исходного соединения и кипятят в течение 10 мин. Затем реакционную смесь выливают в 500 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (20×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток перекристаллизовывают из 1,4-диоксана. Выход 25% (0.09 г).
Пример 3.
Смесь 0.5 г (1.6 ммоль) 4-[2-(2-нитрофенил)-1H-индол-3-ил]-бут-3-ен-2-она Iа, 3.66 г (64 ммоль) карбонильного железа и 25 мл уксусной кислоты нагревают до полного растворения исходного соединения и кипятят в течение 5 мин. Затем реакционную смесь выливают в 500 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (20×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток перекристаллизовывают из 1,4-диоксана. Выход 67% (0.238 г).
Пример 4.
Смесь 0.5 г (1.6 ммоль) 4-[2-(2-нитрофенил)-1H-индол-3-ил]-бут-3-ен-2-она Iа, 1.83 г (32 ммоль) карбонильного железа и 25 мл уксусной кислоты нагревают до полного растворения исходного соединения и кипятят в течение 20 мин. Затем реакционную смесь выливают в 500 мл воды, нейтрализуют NaHCO3, экстрагируют этилацетатом (20×15 мл), объединенные органические фракции сушат сульфатом натрия, отфильтровывают с активированным углем и упаривают при пониженном давлении. Остаток перекристаллизовывают из 1,4-диоксана. Выход 55% (0.2 г).
В таблице 2 приведены данные о влиянии времени реакции, избытка карбонильного железа на выход 11H-индоло[2,3-с]хинолина Iа (примеры 1-4).
Как видно из таблицы 2, оптимальным условием синтеза целевого продукта 11H-индоло[2,3-с]хинолина I является кипячение 4-[2-(2-нитрофенил)-1H-индол-3-ил]-бут-3-ен-2-онов II, в уксусной кислоте с двадцатикратным избытком карбонильного железа в течение 5 мин. Увеличение избытка карбонильного железа не приводит к увеличению выхода продукта реакции, а при двукратном наблюдается осмоление и выход не превышает 25%.
Более продолжительное кипячение приводит к осмолению и, как следствие, к снижению выхода целевого продукта.
Заявляемым способом получен ряд производных 11H-индоло[2,3-с]хинолина Iа-д.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АРИЛ(ГЕТАРИЛ)-1Н-ИНДОЛОВ | 2010 |
|
RU2439056C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНДОЛИЗИНО[7,6-b]ИНДОЛА | 2010 |
|
RU2439073C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-{1-[(4-МЕТИЛФЕНИЛ)СУЛЬФОНИЛ]-1Н-ИНДОЛ-2-ИЛ}БУТ-3-ЕН-2-ОНА | 2012 |
|
RU2488581C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 4-(1Н-ИНДОЛ-3-ИЛ)-БУТ-3-ЕН-2-ОНА | 2009 |
|
RU2409564C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ (E)-4-(6,7-ДИМЕТОКСИ-2-МЕТИЛ-3-ХИНОЛИЛ)-3-БУТЕН-2-ОНА | 2010 |
|
RU2425034C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1Н-БЕНЗО[F]ХРОМЕН-2-ИЛ(АРИЛ)КЕТОНОВ | 2015 |
|
RU2633368C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ | 2012 |
|
RU2495027C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-R-6-R-5-АРИЛ-ПИРРОЛО[3,4-с]КАРБАЗОЛ-1,3(2Н,6Н)-ДИОНОВ | 2009 |
|
RU2404983C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ N-АЦЕТИЛ-4-ГИДРОКСИ-2-МЕТИЛ-5-(5-МЕТИЛФУР-2-ИЛ)-1Н-БЕНЗО[g]ИНДОЛА | 2008 |
|
RU2368611C9 |
| СПОСОБ ПОЛУЧЕНИЯ β-КЕТОСУЛЬФОНОВ И 1,4-ДИКЕТОНОВ | 2011 |
|
RU2455271C1 |
Настоящее изобретение относится к новому синтезу производных 11Н-индоло[2,3-с]хинолина формулы I, которые могут быть использованы в синтезе новых препаратов фармацевтического назначения. В способе получения производных 11Н-индоло[2,3-с]хинолина общей формулы I
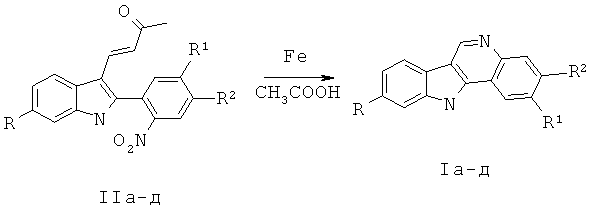
соответствующие 4-[2-(2-нитрофенил)-1Н-индол-3-ил]-бут-3-ен-2-оны II кипятят в уксусной кислоте в присутствии двадцатикратного мольного избытка карбонильного железа в течение 5 мин. Способ позволяет расширить ассортимент получаемых продуктов и упростить процесс за счет использования других исходных соединений и условий. 2 табл.
Способ получения производных 11Н-индоло[2,3-с]хинолина общей формулы I

характеризующийся тем, что производные 4-[2-(2-нитрофенил)-1Н-индол-3-ил]-бут-3-ен-2-она II кипятят в уксусной кислоте в присутствии двадцатикратного мольного избытка карбонильного железа в течение 5 мин.
| Дубовицкий С.В | |||
| и др | |||
| Известия АН, серия химическая, 1996, №11, 2797, MacPhillamy H.B | |||
| et al | |||
| Journal of the American Chemical Society, 1958, 2172, LM Werbel et al | |||
| Eur | |||
| J | |||
| Med | |||
| Chem., 1993, 28, 837-852 | |||
| George A.Kraus et al | |||
| Synthesis, 2010, 1386-1393 | |||
| Agarwal Piyush K., European Journal of Organic chemistry, 2009, 2, 292-303 | |||
| Meyers |
Авторы
Даты
2012-01-10—Публикация
2010-07-05—Подача