Изобретение относится к медицинской технике и может быть использовано в трансплантологии.
Обычно донорами органов становятся пациенты с тяжелой травмой или заболеванием головного мозга, приводящими к смерти мозга и гибели пациента. Изъятие органов производится только в специальных условиях, при которых поддерживается кровообращение и искусственное дыхание погибшего пациента, что приводит к дефициту донорских органов.
Эксплантация донорских органов у внезапно умерших пациентов не производится ввиду того, что вслед за остановкой кровообращения возникают гипоксия и ишемия, приводящие к дезинтеграции органов и тканей.
В то же время, применение перфузионных устройств является доказанной возможностью восстановления жизнеспособности донорских органов, позволяющей использовать нереализованный потенциал доноров с необратимой остановкой кровообращения.
Известен способ искусственного поддержания кровообращения и газообмена в органах донора до начала их эксплантации с помощью аппарата искусственного кровообращения в условиях глубокой гипотермии с аутологичной кровью [Gomez M., Alvarez J., Arias J., et al. Cardiopulmonary bypass and profound hypothermia as a means for obtaining kidney grafts from irreversible cardiac arrest donors: Cooling technique // Transplant. Proc. - 1993. - Vol.25. - P.1501-1503].
Способ заключается в том, что кровь из сосудистого русла эвакуируют, охлаждают, оксигенируют и возвращают обратно, повторяя эту операцию циклически и воспроизводя, тем самым, функцию не работающей сердечно-сосудистой системы.
Недостатком данного способа является то, что из перфузионного контура не удаляются активированные лейкоциты, которые вносят основной вклад в повреждение ткани донорских органов как через выделение протеологических ферментов, так и через обструктивный компонент, обтурируя просвет капилляров, приводя к связыванию тромбоцитов, эритроцитов, ухудшая функциональное состояние донорских органов и, тем самым, снижая их жизнеспособность.
Другим недостатком способа является то, что перфузия осуществляется в условиях гипотермии, что не позволяет воздействовать на функциональное состояние и восстанавливать жизнеспособность ишемически поврежденных органов.
Еще одним недостатком является отсутствие аппаратной перфузии ишемически поврежденного органа после изъятия, что уменьшает срок хранения органа и исключает возможность восстановления жизнеспособности и воздействия на функциональное состояние органа до трансплантации.
Известны способ и устройство для перфузии изолированного органа по авторскому свидетельству СССР №1687262, МПК А01N 1/00, публикация 30.10.1991 г. Устройство содержит перфузионную камеру с физиологическим раствором, в которую помещают изолированный орган (селезенку), и рабочую камеру с подогретой водой между источником пульсирующего давления, выполненным в виде эластичной камеры, и гибкой ограничительной пластиной. Регулируя уровень воды в рабочей камере, задают давление на изолированный орган, а подачей воздуха в рабочую камеру создают пульсирующее воздействие, передаваемое на орган.
Недостатком известного способа является то, что он не обеспечивает очистки сосудистой системы органа, необходимой для восстановления кровоснабжения и поддержания жизнеспособности органа.
Наиболее близким аналогом, принятым за прототип предлагаемого способа, является способ консервации органов, конечностей и тканевых лоскутов по патенту РФ №2134962 на изобретение, МПК А01N 1/02, публикация 27.08.1999 г.
Согласно прототипу после эксплантации донорский орган помещают в камеру для хранения органа, к которой подключают магистрали перфузионного устройства, имеющего три циркуляционных контура.
Первый контур, соединяемый с артерией органа, при помощи первого перистальтического насоса снабжает орган оксигенированным и очищенным посредством гемофильтра раствором перфузата.
Второй контур содержит резервуар питательного раствора, входы которого соединены с выходами венозных оттоков камеры, а выход соединен с входом второго перистальтического насоса, выход которого через гемофильтр соединен с входом перфузионного насоса первого циркуляционного контура. В гемофильтре производится дезинтоксикация венозного перфузата, обмен метаболитов, а также обогащение кислородом, который передается в первый контур в жидкой фазе из циркуляционного контура разведения, соединенного с источником кислорода.
Третий контур перфузионного устройства предназначен для периодической промывной чистки органа физиологическим водным раствором.
Параметры перфузии задаются посредством электронного блока управления. В магистралях первого и второго контуров производится измерение давления, а перед входом артериального притока камеры для хранения органа установлен воздухоуловитель, предотвращающий попадание в кровеносную систему органа воздушных пузырьков.
Перфузия проводится в нормотермических условиях (при комнатной температуре или температуре тела). В качестве перфузата используется водный питательный раствор, кровь или кровяной продукт.
Преимуществом прототипа является возможность поддержания обмена веществ и сохранения активности фибробластов для раневого лечения и заживления органа, что позволяет продлить сроки хранения органа.
Недостатком прототипа является то, что он рассчитан на сохранение жизнеспособности органов, изъятых из тела донора непосредственно после его смерти.
В обычной практике после констатации смерти больного для документального оформления разрешения на изъятие органа требуется значительное время, в течение которого происходит ишемическое повреждение органов.
Кроме этого способ не предусматривает удаления из перфузата активированных лейкоцитов, что создает предпосылки для развития тяжелых реперфузионных осложнений после трансплантации данных органов.
Задачей изобретения является повышение эффективности восстановления и поддержания жизнеспособности ишемически поврежденных донорских органов.
Достижение заявленного результата обеспечивается путем поэтапного восстановления жизнеспособности органа: сначала перед эксплантацией выполняют нормотермическую перфузию абдоминальной области в теле донора, а затем после эксплантации выполняют продолженную нормотермическую перфузию изолированного органа с одновремннои оценкой пригодности органа для пересадки, используя на обоих этапах в качестве перфузата модифицированный раствор на основе аутокрови.
Именно двухэтапная перфузия позволяет не только увеличить сроки хранения донорских органов, но сначала реабилитировать и восстановить функциональный резерв органов, ранее считавшиеся не пригодными для трансплантации из-за ишемических повреждений, возникающих после остановки кровообращения умершего (асистолические доноры), или из-за сопутствующих заболеваний умершего (доноры с расширенными критериями).
Сущность изобретения заключается в том, что в способе восстановления и поддержания жизнеспособности ишемически поврежденного донорского органа, включающем эксплантацию органа из тела донора и проведение нормотермической перфузии изолированного органа пульсирующим потоком обогащаемого кислородом перфузата на основе крови, перед эксплантацией органа в течение 2-3 часов проводят нормотермическую перфузию абдоминального региона кровоснабжения в теле донора пульсирующим потоком обогащаемого кислородом перфузата на основе крови, из которого дотельно удаляют активированные лейкоциты и недоокисленные продукты биохимического распада, затем орган эксплантируют и в процессе проведения нормотермичекой перфузии изолированного органа производят оценку пригодности его для пересадки, при этом в случае оптимального состояния имплантата начальное систолическое давление устанавливают равным 35 мм рт.ст., а для имплантатов с пограничными ишемическими повреждениями начальное систолическое устанавливают в диапазоне 40-45 мм рт.ст., а затем определяют степень раскрытия циркуляторного русла органа по изменению значения резистивного индекса, причем если в течение 4-6 часов значение резистивного индекса не уменьшается или возрастает, признают орган не пригодным для пересадки, а если в течение этого времени значение резистивного индекса снижается в 2-3 раза и скорость потока устанавливается в пределах 80-150 мл/мин, продолжают проведение перфузии вплоть до момента пересадки органа.
Кроме этого перфузат в объеме 4-4,5 л содержит
консервирующий раствор - 1,5-2 л,
перфторан - 400-600 мл,
гепарин - 50000 ЕД,
стрептокиназа -1,5 млн ЕД,
солумедрол - 300 мкг,
изоптин - 5 мг,
нитроглицерин - 5 мг,
аутокровь - остальное.
Кроме этого при необходимости транспортировки органа в другое лечебное учреждение камеру хранения органа помещают в охлаждаемый транспортный контейнер, и в процессе транспортировки выполняют перфузию консервирующим раствором при температуре 4-7°С.
Сущность изобретения поясняется чертежами, на которых представлены:
фиг.1 - устройство для проведения перфузии абдоминального региона кровоснабжения в теле донора;
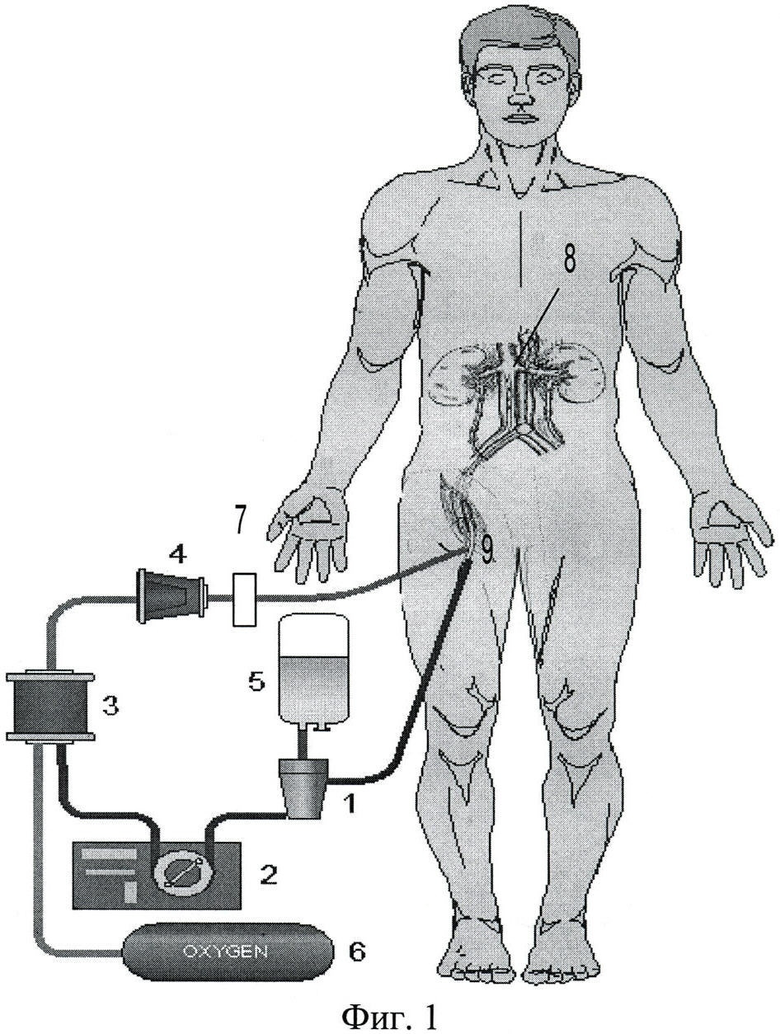
фиг.2 - устройство для проведения перфузии изолированного органа.
На фиг.1 обозначены
1 - венозный резервуар;
2 - механотронный перфузионный модуль, выполненный на основе перистальтического (роликового) насоса, со встроенным блоком управления, например модуль «Марс» разработки ЦНИИ робототехники и технической кибернетики, Санкт-Петербург;
3 - оксигенатор, например производства фирмы Gish Vision Biomedical, Inc, США;
4 - лейкоцитарный фильтр, например производства корпорации «Палл ГМБХ», Германия;
5 - емкость для консервирующего раствора;
6 - портативный источник кислорода с системой понижающих редукторов;
7 - абсорбционный фильтр на основе композитного материала с наноуглеродом;
8 - двухбаллонный трехпросветный катетер, например марки 16 F, производства фирмы «Balton, Ltd», Польша;
9 - венозная канюля.
Входы венозного резервуара 1 посредством соединительных трубок соединены с емкостью 5 для консервирующего раствором, из которой в циркуляционный контур вводятся все составные компоненты перфузата, кроме крови, и с венозной канюлей 9, установленной в нижней полой вене донора. Выход венозного резервуара 1 соединен с входом перфузионного модуля 2, к выходу которого подключена артериальная магистраль перфузионного контура с последовательно установленными в ней оксигенатором 3, лейкоцитарным фильтром 4 и абсорбционным фильтром 7. Выход артериальной магистрали соединен с двухбаллонным трехпросветным катетером 8, введенным в аорту донора.
На фиг.2 обозначены
10 - камера хранения органа, выполненная в виде одноразового контейнера из прозрачного пластика;
11 - перфузионный модуль с перистальтическим насосом и встроенным блоком управления;
12 - блок датчиков;
13 - оксигенатор с встроенным источником кислорода;
14 - лейкоцитарный фильтр;
15 - абсорбционный фильтр.
Устройство для перфузии изолированного органа содержит камеру 10 хранения органа, снабженную артериальным портом (канюлей), обеспечивающим соединение артериальной магистрали циркуляционного контура с артерией донорского органа, а также блоком 12 датчиков (давления, температуры, пузырьков газа и др.), показания которых обрабатываются блоком управления перфузионного модуля 11. Венозный отток из органа осуществляется непосредственно в камеру 10 и специального соединителя не требует. Ввод и отвод из камеры 11 перфузата, а также отбор проб перфузата на анализ производится через специальные патрубки камеры (для простоты не показаны). Патрубок отвода перфузата из камеры 10 хранения органа соединен посредством венозной магистрали циркуляционного контура с входом перфузионного модуля 11. К выходу перфузионного модуля подключена артериальная магистраль циркуляционного контура с последовательно установленными в ней оксигенатором 13, лейкоцитарным фильтром 14 и абсорбционным фильтром 15.
Способ осуществляют следующим образом.
После прибытия трансплантационной бригады и получения разрешения на изъятие органа донор доставляется в операционную. Осуществляют доступ к бедренным сосудам правой конечности, затем выполняют артериотомию общей бедренной артерии, через которую в аорту донора вводят двухбаллонный трехпросветный катетер 8, верхний баллон которого окклюзирует аорту выше почечных артерий. Через бедренную вену устанавливают кардиохирургическую венозную канюлю 9 (или катетер в нижнюю полую вену), через которую в венозный резервуар 1 емкостью 4-4,5 л выводится циркулирующий в контуре перфузат и осуществляется декомпрессия сосудистого русла.
После этого начинается перфузия органов абдоминальной области (брюшной полости) в теле донора. Первичное заполнение перфузионного контура выполняют консервирующим раствором «Кустодиол» в объеме 1,5-2 л при начальной скорости потока 500 мл/мин и частоте вращения ротора перистальтического насоса 30 об/мин, которые задаются установкой в соответствующее положение органов регулировки, выведенных на лицевую панель механотронного перфузионного модуля 2.
По мере освобождения сосудистого русла от крови, стекающей в венозный резервуар 1, постепенно (к середине перфузионного цикла) увеличивают скорость перфузии до 1200 мл/мин и постепенно вводят в резервуар 1 гепарин (50000 ЕД), стрептокиназу (1,5 млн ЕД), 400-600 мл перфторана, 300 мкг солумедрола, 5 мг изоптина и 5 мг нитроглицерина.
Выбор состава перфузата определяется следующим.
Введение в состав перфузата консервирующего раствора «Кустодиол» позволяет стабилизировать клеточные мембраны и уменьшить отек эндотелия и тканей ишемически поврежденных донорских органов.
Наличие в нем перфторана позволяет улучшить доставку кислорода к тканям, улучшить метаболизм и газообмен на уровне тканей, что поддерживает минимальный уровень метаболизма перфузируемых тканей. Помимо этого перфторан способен ослаблять эндотелиальное повреждение, что связано с наличием у него мембранопротекторных свойств, со способностью угнетать адгезию, хемотаксис и метаболизм лейкоцитов, а также ослаблять взаимодействие между лейкоцитами и эндотелием, тем самым, снижая степень лейкоцит-индуцированного повреждения тканей донорского органа.
Наличие в растворе стрептокиназы и гепарина позволяет осуществлять фармакологическое воздействие на конгломераты активированных лейкоцитов с форменными элементами крови, разобщая их связи, что способствует удалению лейкоцитов и восстановлению проходимости сосудистого русла, уменьшая, тем самым, степень реперфузионной травмы и улучшая качество трансплантата.
Введение в перфузат солумедрола оказывает на донорский орган противовоспалительное, противоаллергическое, противошоковое и иммуносупрессивное воздействие.
Использование изоптина позволяет предотвратить поступление в клетки кальция, который стимулирует процесс разрушения клеток, а использование нитроглицерина обеспечивает стабилизацию мембран эндотелиоцитов.
Перфузию абдоминального региона кровоснабжения в теле донора проводят в течение 2-3 час при температуре 23-27°С (нормотермические условия) и скорости потока кислорода 200-250 мл/мин.
При этом использование в контуре лейкоцитарного фильтра 4 позволяет провести санацию сосудистого русла от активированных лейкоцитов, конгломератов лейкоцитов между собой и с форменными элементами крови и, тем самым, уменьшить степень нарушения микроциркуляции, лейкоцит-индуцированного повреждения тканей и ишемически-реперфузионной травмы, увеличить жизнеспособность донорского органа.
Использование абсорбционного фильтра позволяет удалить из перфузата недоокисленные продукты биохимического распада и нормализовать значение рН раствора.
Выбор температурного режима обусловлен тем, что восстановление энергетического и функционального потенциала донорского органа и воздействие на микроциркуляторное русло возможно только в физиологических, нормотермических условиях.
Проведение перфузии абдоминального региона кровоснабжения в теле донора в течение 2-3 часов является необходимым и достаточным временным промежутком, в течение которого происходит максимально полное восстановление функционального и энергетического потенциала клеток ишемически поврежденных органов за счет поставки питательных веществ и кислорода к тканям и заканчивается подготовка донорского органа к последующему этапу - проведение нормотермической перфузии изолированного органа.
При этом решение о возможности изъятия органа принимается также на основании результатов исследования содержания лейкоцитов в циркулирующем потоке перфузата. При достижении величины содержания лейкоцитов на уровне 1×109 ед. и ниже результаты проведения перфузии признаются удовлетворительными.
Операция эксплантации донорских органов (например, почек) выполняется при продолжающейся перфузии, которую прекращают непосредственно перед извлечением органов.
После изъятия органа из тела донора производят обработку почечной артерии, которую фиксируют в перфузионной канюле, помещают орган в специальную кассету и вместе с ней фиксируют орган в камере 10 хранения органа перфузионного аппарата, которую заполняют раствором перфузата в объеме 1 л. Перфузионную канюлю соединяют с артериальной магистралью аппарата, а венозную магистраль аппарата подключают к патрубку отвода перфузата из камеры, т.к. отток из вены органа осуществляется пассивно.
Примером реализации аппарата для проведения перфузии изолированного органа может служить аппарат «Life Port™» компании «Organ Recovery System», США, выполненный по принципу термоизолированного бокса с прозрачной герметичной камерой хранения органа, встроенным роликовым насосом, измерителем скорости подачи раствора, термодатчиками, датчиками давления, блоком управления параметрами перфузии и компьютерным преобразователем, позволяющим графически отображать информацию.
В процессе проведения нормотермической перфузии изолированного органа, как и на первом этапе (перфузия абдоминального региона кровоснабжения в теле донора), производится оксигенация раствора перфузата и его очистка посредством лейкоцитарного и абсорбционного фильтров. В качестве перфузата используется модифицированный раствор на основе крови того же состава, что и на первом этапе, при температуре 23-27°С.
На этапе проведения перфузии изолированного органа производится селекция донорских органов и, в случае признания органа годным для пересадки, перфузия продолжается для поддержания функционального состояния органа вплоть до момента его пересадки.
Селекция органов производится в течение периода «тест-мониторинга», продолжающегося 4-6 часов.
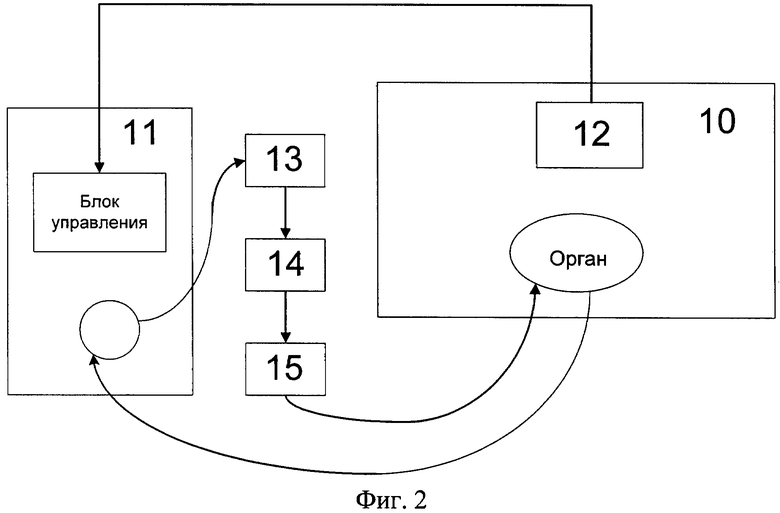
В это время проявляется степень раскрытия циркуляторного русла сосудов кровеносной системы органа, которую определяют по изменению резистивного индекса (RI). Этот показатель, по мнению большинства исследователей [Morgan S. et al. Outcomes after transplantation of deceased-donor kidneys with rising serum creatinine / S. Morgan [et al.] //American Journal of Transplantation. - 2007. - Vol.7 - P.1288-1292], имеет решающее значение для оценки качества трансплантата и определяется как соотношение установленного в аппарате систолического давления к величине потока перфузата, проходящего через трансплантат в единицу времени:
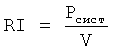 ,
,
где RI - резистивный индекс,
Рсист - систолическое давление, мм рт.ст,
V - скорость потока перфузата, мл/мин.
Начальное систолическое давление в перфузионном контуре устанавливают в зависимости от состояния трансплантата. При оптимальном его состоянии оно составляет 35 мм рт.ст., а для трансплантатов с сомнительными (пограничными) характеристиками - 40-45 мм рт.ст.
Если в течение 4-6 часов перфузии не происходит снижение RI или, напротив, происходит его увеличение, а скорость потока перфузата через орган существенно ниже нормального значения (100-150 мл/мин), это является основанием для отказа от пересадки органа.
Если снижение RI происходит, но медленными темпами постепенно увеличивают систолическое давление, но не более чем на 5 мм рт.ст. одномоментно, и продолжают наблюдение. Если в ответ на увеличение давления происходит увеличение скорости потока через орган на 10-15 мл/мин, продолжают перфузию при выбранных параметрах.
Орган признается пригодным для пересадки, если в течение 4-6 часов снижение RI происходит в 2-3 раза, а скорость потока устанавливается в пределах 80-150 мл/мин, после чего проведение перфузии продолжают до момента пересадки донорского органа.
При необходимости перевозки донорского органа в другое лечебное учреждение камеру хранения органа помещают в охлаждаемый транспортный контейнер и в процессе транспортировки органа продолжают перфузию консервирующим раствором при температуре 4-7°С.
Эффективность предлагаемого способа восстановления жизнеспособности донорского органа подтверждается приведенными ниже примерами клинических случаев.
Пример 1
Донор У., мужчина, 46 лет. 18 марта 2010 г. в 19 часов 40 мин доставлен в шоковый зал НИИ скорой помощи после автокатастрофы с диагнозом: закрытая черепно-мозговая травма, ушиб головного мозга, перелом шейных позвонков, перелом левого бедра, таза, гемопневмоторакс слева.
Выполнен лапароцентез, данных о повреждении органов брюшной полости не выявлено. Гипотония. Допамин в дозе 15-20 мг/кг/мин, в течение 4 часов. Нестабильная гемодинамика на уровне 80-95 мм рт.ст. Олигурия менее 30 мл в час. Выполнено дренирование левой плевральной полости, наложено скелетное вытяжение на левое бедро. Показаний к трепанации черепа не выявлено.
Внезапная остановка сердца в 23 часа 55 мин. Реанимационные мероприятия в течение 30 минут в полном объеме безуспешны. Констатация смерти - 00 часов 30 мин, 19 марта. Во время выполнения реанимационных мероприятий трансплантационным координатором вызвана бригада изъятия из Центра органного донорства. Региональным координатором оповещен судебно-медицинский эксперт.
Параллельно, в 00 часов 35 мин у трупа-донора взята кровь на типирование и выполнение серологических исследований. В 00 часов 45 мин труп-донор доставлен в операционную. В 01 час 15 мин выполнен доступ на бедренные сосуды, произведена канюляция бедренной артерии и вены. В 01 час 36 мин начата нормотермическая экстракорпоральная аппаратная перфузия с оксигенацией и удалением лейкоцитов. Параметры перфузии: скорость от 500 до 1200 мл/мин, скорость потока кислорода 200-250 мл/мин, температура раствора 25-27°С. Последовательно в контур введены 2 л консервирующего раствора «Кустодиол», перфторан в объеме 400 мл, стрептокиназа - 1,5 млн ЕД, солумедрол 300 мкг, блокатор кальциевых каналов (изоптин - 5 мг), нитроглицерин - 5 мг.
Прибытие эксперта через 1,5 часа после констатации смерти донора. Получено разрешение на изъятие.
Начало лапаротомии в 03 часа 05 мин. Во время лапаротомии обнаружена массивная забрюшинная гематома слева, левая почка полностью окружена гематомой, распространяющейся к ее воротам. От ее изъятия для трансплантации решено отказаться (позже взята для исследования). Правая почка изъята - без анатомических особенностей. Однородно розового цвета с участками цианоза. Выполнена пункционная биопсия трансплантата, материал отправлен в работу по экстренным показаниям. Окончание перфузии в 03 часа 42 мин.
После остановки нормотермической экстракорпоральной аппаратной перфузии выполнена правосторонняя нефрэктомия. Трансплантат без особенностей, сосуды одиночные (одна артерия и вена). Трансплантат обработан, выполнено подсоединение канюли к артерии. Почка помещена в камеру хранения органа аппарата «Life Port™» для проведения перфузии изолированного органа. Начало изолированной экстракорпоральной перфузии в 04 часа 04 мин. Задано систолическое давление 45 мм. рт.ст., что на 10 мм выше стандартного, установленного «по умолчанию» фирмой производителем. В течение первых четырех часов резистивный индекс снизился с 0,78 до 0,64, в это же время скорость потока через почечный трансплантат возросла с 45 до 57 мл/мин. По результатам тест-мониторинга, выявившего небольшое снижение резистивного индекса и повышение скорости потока, принято решение продолжать перфузию. По истечении 10 часов наблюдения значение резистивного индекса снизилось незначительно и составило 0,59, а скорость перфузии снизилась до 55 мл/мин.
Получены результаты «нулевой» биопсии - выраженные ишемические повреждения эпителия почечных канальцев, признаков гиалиноза артерий, гломерулосклероза и фиброза не выявлено. После выяснения причины низкой эффективности результатов аппаратной перфузии почка признана не пригодной для пересадки.
Пример 2
Донор М., 35 лет, мужчина. 16.10.2009 г. в 04 часа 25 минут поступил в шоковый зал многопрофильного стационара Санкт-Петербурга с диагнозом: закрытая черепно-мозговая травма, ушиб головного мозга тяжелой степени. Клинически у больного с момента поступления - атоническая кома. С 6 часов 15 мин до 8 часов 15 мин пациенту выполнена декомпрессионная трепанация черепа в связи с нарастающей внутримозговой гематомой. В 08 часов 25 мин произошла внезапная остановка сердечной деятельности. Реанимационные мероприятия в течение 35 мин - безуспешно. В 09 часов 00 мин констатирована биологическая смерть пациента.
Доклад в трансплантационные центры в 09 часов 05 мин. Прибытие донорской службы в 09 час 54 мин. Параллельно в 09 час 20 мин у трупа-донора взята кровь на типирование и выполнение серологических исследований, вызван судебно-медицинский эксперт. В 10 часов 05 мин труп-донор доставлен в операционную. В 10 часов 15 мин выполнен доступ на бедренные сосуды, произведена канюляция бедренной артерии и вены. В 10:31 начата нормотермическая экстракорпоральная аппаратная перфузия абдоминальной области в теле донора с оксигенацией и удалением из перфузавта лейкоцитов. Параметры перфузии: скорость от 500 до 1200 мл/мин, скорость потока кислорода 200-250 мл/мин, температура раствора 25-27°С. Последовательно в перфузионный контур введены 1,5 л консервирующкго раствора «Кустодиол», перфторан в объеме 600 мл, стрептокиназа - 1,5 млн ЕД, солумедрол - 300 мкг, гепарин - 50000 ЕД, изоптин - 5 мг, нитроглицерин - 5 мг.
В 11 часов 28 мин получено разрешение судебно-медицинского эксперта на изъятие донорских органов. Начало лапаротомии в 12 часов 45 мин. В брюшной полости органы розового цвета, местами отмечается вялая перистальтика кишечника. В результате ревизии брюшной полости патологических изменений органов и наличия патологических жидкостей не выявлено. Выполнено выделение обеих почек по стандартной методике. Мочеточники отсечены. При внешнем раздражении отмечается незначительная перистальтика мочеточника. Из просвета мочеточника по каплям отделяется моча. Окончание перфузии в 13 часов 11 мин.
После остановки перфузии выполнена билатеральная нефрэктомия. Трансплантаты без особенностей, сосуды одиночные (одна артерия и вена). Оба трансплантата обработаны, выполнено подсоединение канюль к артериям. Почки помещены в камеры хранения органа и подключены к магистралям аппаратов «Life Port™» для проведения перфузии изолированного органа. Начало перфузии изолированного органа - 13 часов 54 мин.
Начальные перфузионные характеристики: перфузат - модифицированный раствор на основе крови, температура 23-27°С, давление в контуре 30 мм рт.ст. с постепенным увеличением в течение 3-х часов до 40 мм рт.ст., скорость перфузии начальная 55 мл/мин, резистивный индекс 0,58-0,65. Редукция резистивного индекса в течение 10 часов до 0,23, скорость перфузии увеличилась до 98 мл/мин.
Почки признаны пригодными к пересадке.
Первый реципиент - женщина 58 лет. После трансплантации донорской почки наблюдалась отсроченная функция в течение 32 дней (14 процедур гемодиализа) с восстановлением допустимых показателей креатинина (213 ммоль/л) к 36 дню после трансплантации. К третьему месяцу после трансплантации креатинин составлял 134 ммоль/л.
Второй реципиент - женщина 61 год. После трансплантации донорской почки наблюдалась отсроченная функция в течение 21 дней (9 процедур гемодиализа) с восстановлением допустимых показателей креатинина (178 ммоль/л) к 27 дню после трансплантации. К третьему месяцу после трансплантации креатинин составлял 128 ммоль/л.
Таким образом, за счет поэтапного проведения перфузии предлагаемый способ позволяет восстанавливать жизнеспособность донорских органов с пограничными характеристиками, более точно оценивать их пригодность для пересадки и в течение длительного времени поддерживать функциональное состояние органа, пригодного для пересадки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСТРАКОРПОРАЛЬНОГО ВОССТАНОВЛЕНИЯ ПЕРФУЗИИ И ОКСИГЕНАЦИИ ВНУТРИ ТЕЛА ДОНОРА | 2017 |
|
RU2666515C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ЖИЗНЕСПОСОБНОСТИ ИШЕМИЧЕСКИ ПОВРЕЖДЕННЫХ ДОНОРСКИХ ОРГАНОВ | 2009 |
|
RU2423931C2 |
| УСТРОЙСТВО ЭКСТРАКОРПОРАЛЬНОЙ АППАРАТНОЙ ПЕРФУЗИИ ДОНОРСКИХ ОРГАНОВ ВНУТРИ ТЕЛА ДОНОРА | 2014 |
|
RU2570391C1 |
| Способ рекондиционирования донорского сердца | 2021 |
|
RU2777097C1 |
| СПОСОБ ПРЕЗЕРВИРОВАНИЯ МИОКАРДА ПРИ ТРАНСПЛАНТАЦИИ | 2013 |
|
RU2535036C1 |
| СПОСОБ ОЦЕНКИ КАЧЕСТВА ПОЧЕЧНЫХ ТРАНСПЛАНТАТОВ ОТ ДОНОРОВ С РАСШИРЕННЫМИ КРИТЕРИЯМИ | 2010 |
|
RU2436515C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЧЕЧНЫХ ТРАНСПЛАНТАТОВ ОТ ДОНОРОВ С ВНЕГОСПИТАЛЬНОЙ ОСТАНОВКОЙ КРОВООБРАЩЕНИЯ | 2023 |
|
RU2821024C1 |
| Раствор для предтрансплантационной подготовки донорских легких | 2023 |
|
RU2815501C1 |
| УСТРОЙСТВО ПРИВОДА НАСОСА ПЕРФУЗИОННОГО КОНТУРА ДЛЯ ВОССТАНОВЛЕНИЯ КРОВООБРАЩЕНИЯ И ОКСИГЕНАЦИИ КРОВИ | 2016 |
|
RU2617093C1 |
| Устройство для перфузионной консервации и рекондиционирования донорского сердца | 2020 |
|
RU2754592C1 |
Изобретение относится к медицине, а именно к трансплантологии, и предназначено для восстановления и поддержания жизнеспособности ишемически поврежденного донорского органа. Перед эксплантацией органа из тела донора в течение 2-3 часов проводят нормотермическую перфузию абдоминального региона кровоснабжения пульсирующим потоком обогащенного кислородом перфузата на основе крови, из которого дополнительно удаляют активированные лейкоциты и недоокисленные продукты биохимического распада. Проводят эксплантацию органа из тела донора. Проводят нормотермическую перфузию изолированного органа. В процессе проведения перфузии органа производят оценку пригодности его для пересадки. Начальное систолическое давление устанавливают равным 35 мм рт.ст в случае оптимального состояния импланта, 40-45 мм рт.ст. для имплантов с пограничными ишемическими повреждениями. Затем производят оценку степени раскрытия циркуляторного русла органа по изменению значения резистивного индекса. Если в течение 4-6 часов значение резистивного индекса не уменьшается или возрастает, признают орган не пригодным для пересадки. Если в течение этого времени значение резистивного индекса снижается в 2-3 раза и скорость потока устанавливается в пределах 80-150 мл/мин, продолжают проведение перфузии вплоть до момента пересадки донорского органа. Способ позволяет восстановить жизнеспособность донорских органов с пограничными характеристиками, точно оценить их пригодность для пересадки и поддержания в течение длительного времени функционального состояния органа, пригодного для пересадки. 2 з.п. ф-лы, 2 ил.
1. Способ восстановления и поддержания жизнеспособности ишемически поврежденного донорского органа, включающий эксплантацию органа из тела донора и проведение нормотермической перфузии изолированного органа пульсирующим потоком обогащаемого кислородом перфузата на основе крови, отличающийся тем, что перед эксплантацией органа в течение 2-3 ч проводят нормотермическую перфузию абдоминального региона кровоснабжения в теле донора пульсирующим потоком обогащаемого кислородом перфузата на основе крови, из которого дополнительно удаляют активированные лейкоциты и недоокисленные продукты биохимического распада, затем орган эксплантируют и в процессе проведения нормотермической перфузии изолированного органа производят оценку пригодности его для пересадки, при этом в случае оптимального состояния имплантата начальное систолическое давление устанавливают равным 35 мм рт.ст., а для имплантатов с пограничными ишемическими повреждениями начальное систолическое давление устанавливают в диапазоне 40-45 мм рт.ст., затем определяют степень раскрытия циркуляторного русла органа по изменению значения резистивного индекса, причем если в течение 4-6 ч значение резистивного индекса не уменьшается или возрастает, признают орган не пригодным для пересадки, а если в течение этого времени значение резистивного индекса снижается в 2-3 раза и скорость потока устанавливается в пределах 80-150 мл/мин, продолжают проведение перфузии вплоть до момента пересадки органа.
2. Способ по п.1, отличающийся тем, что перфузат в объеме 4-4,5 л содержит:
3. Способ по п.1, отличающийся тем, что при необходимости транспортировки органа камеру хранения органа помещают в охлаждаемый транспортный контейнер, и в процессе транпортировки выполняют перфузию консервирующим раствором при температуре 4-7°С.
| СПОСОБ И УСТРОЙСТВО КОНСЕРВАЦИИ ОРГАНОВ, КОНЕЧНОСТЕЙ И ТКАНЕВЫХ ЛОСКУТОВ | 1994 |
|
RU2134962C1 |
| Устройство для перфузии изолированных органов | 1989 |
|
SU1755803A1 |
| WO 2008150587 A, 11.12.2008 | |||
| БАГНЕНКО С.Ф | |||
| и др | |||
| Реабилитация донорских органов | |||
| Направление в консервации или новая парадигма в трансплантологии? Вестник трансплантологии и искусственных органов, т.11, №3, 2009, с.17-29 | |||
| STOWE DF et al | |||
| Low-flow perfusion of guinea pig isolated hearts with | |||
Авторы
Даты
2012-02-10—Публикация
2010-06-29—Подача