ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Этой заявкой заявлен приоритет предварительной Патентной Заявки США No. 60/920841 от 30 марта 2007, которая включена в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение касается способов, применяемых для лечения синдрома раздраженного кишечника (СРК) и, конкретно, для лечения одного или более подтипов этого заболевания, а также способов, применяемых для лечения диареи. Более конкретно, изобретение относится к применению периферически селективных агонистов каппа-опиоида, особенно к применению N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида или его фармакологически приемлемой соли для получения лекарственных средств, предназначенных для лечения диареи или для лечения СРК, особенно для лечения СРК с преобладанием диареи (СРК-Д) и СРК с перемежающимися диареей и констипацией (СРК-П), и ассоциированной с этим боли и/или дискомфорта.
УРОВЕНЬ ТЕХНИКИ
СРК подвержено приблизительно 10-15% или более всего населения. СРК представляет собой наиболее распространенное заболевание, диагностируемое гастроэнтерологами, и одно из наиболее распространенных расстройств, наблюдаемых врачами первичной медицинской помощи. СРК также обозначается как синдром раздраженной толстой кишки, слизистый колит, спастический колит, возбудимый желудок или раздраженная толстая кишка.
Синдром раздраженного кишечника характеризуется группой симптомов, в которых абдоминальная боль или дискомфорт ассоциированы с изменением в системе кишечника, такими как жидкий или более частый стул, диарея и/или констипация.
Синдром раздраженного кишечника понимают как многоплановое расстройство. У людей с СРК симптомы являются результатом того, что, по-видимому, является нарушением взаимодействия между кишкой или кишечником, мозгом и автономной нервной системой, что изменяет регуляцию перистальтики кишечника (моторную функцию) или сенсорную функцию.
Хотя патофизиология СРК еще недостаточно понятна, считают, что висцеральная гиперчувствительность имеет важную роль (Holtmann et al. (1997) Am. J. Gastroenterol, 92, 954-959; Trimble et al., (1995) Dig. Dis. Sci, 40, 1607-1613). Например, пациентов и контрольных субъектов оценивали на предмет пороговой величины боли в ответ на нарастающее вздутие сигмоидной кишки, индуцированное надувным баллоном, вводимым в полость тела. При одном и том же объеме вздутия пациенты давали боли более высокую бальную оценку по сравнению с контрольными субъектами. Это наблюдение воспроизводилось во многих исследованиях. Существует два аспекта висцеральной гиперчувствительности, гипералгезия и аллодиния. Гипералгезия обозначает ситуацию, в которой нормальные висцеральные ощущения испытываются при более низких внутрипросветных объемах. Аллодиния обозначает ситуацию, где боль или дискомфорт испытываются при объемах, обычно производящих нормальные эндогенные ощущения (смотри, например, Mayer & Gebhart, Basic and Clinical Aspects of Chronic Abdominal Pain, Vol. 9, 1 ed. Amsterdam: Elsevier, 1993:3-28). На моделях животных было показано, что асимадолин уменьшает ответные ощущения на желудочное и кишечное вздутие (Burton & Gebhart (1998) J. Pharmacol. Exp. Ther., 285, 707-715), но нет причин предполагать, что асимадолин будет селективно оказывать благоприятное воздействие на один или более подтипов СРК.
Параметры лечения СРК, как правило, включают множество способов, подбираемых каждому пациенту в зависимости от тяжести симптомов и подтипа СРК. Пациенты с диагностированными легкими симптомами СРК могут получать рекомендации по поводу терапии стресса и изменений питания и образа жизни. Пациенты с диагностированным умеренным проявлением СРК аналогичным образом консультируются по поводу дополнительных рекомендаций применения добавок клетчатки. В зависимости от симптомов, пациентам с умеренным проявлением СРК могут советовать использование противодиарейных средств, слабительных или антихолинергических агентов. Типичные противодиарейные средства включают лоперамид, аттапулгит и дифеноксилат. Типичные слабительные включают бисакодил, сенну, полиэтилен 3350, слабительные, увеличивающие объем кишечного содержимого, такие как псиллиум, поликарбофил кальция, метилцеллюлоза и фруктан. Пример антихолинергического агента, используемого в лечении СРК, представляет собой дицикломин.
Пациенты с диагностированным тяжелым проявлением СРК также могут получать лечение с помощью антидепрессантов, таких как трициклические антидепрессанты и селективные ингибиторы обратного захвата серотонина. Тяжелое проявление СРК также может лечиться с помощью алосетрона или тегасерода.
Алостерон представляет собой 5-HT3-антагонист, используемый для терапии тяжелого проявления СРК-Д только у женщин. Он действует на 5-HT3-рецепторы энтеральной нервной системы желудочно-кишечного тракта, и считают, что он расслабляет кишку и замедляет движение отходов жизнедеятельности через нижний отдел кишечника. Следует заметить, что лекарственное средство было удалено с рынка продаж всего через девять месяцев после его одобрения, так как его использование оказалось связано, по меньшей мере, с четырьмя смертельными случаями и тяжелыми побочными эффектами у 197 человек. В июне 2002 года Управление по контролю за продуктами и лекарственными средствами (FDA) снова разрешило с ограничениями продажу алостерона. Лекарственное средство может быть прописано врачами, вовлеченными в специальную программу, и предназначается для тяжелых случаев СРК-Д у женщин, не реагирующих на другие способы лечения. Это средство не одобрено для использования у мужчин.
Тегасерод представляет собой 5-HT4-агонист, используемый для терапии СРК с преобладанием констипации (СРК-К) у женщин. Он является стимулятором перистальтики. Терапевтический эффект достигается посредством активации 5-HT4-рецепторов энтеральной нервной системы желудочно-кишечного тракта. Тегасерод стимулирует желудочно-кишечную перистальтику и перистальтический рефлекс и, возможно, уменьшает абдоминальную боль. Это лекарственное средство было связано со случаями ишемического колита. Тегасерод не одобрен для использования у мужчин. В 2007 году тегасерод был изъят с рынка продаж из-за повышенного риска возникновения инфаркта, инсульта и нестабильной ангины у пациентов, принимающих тегасерод.
Лечение пациентов, страдающих СРК с перемежающейся системой поведения кишечника, представляет собой уникальную сложную клиническую проблему, и многие из исследованных лекарственных средств для СРК воздействуют или на диарею, или на констипацию и, таким образом, не могут быть подходящими для пациентов, страдающих СРК-П. В настоящее время не существует доступного фармацевтического лечения для терапии СРК-П.
Таким образом, в настоящее время существуют неудовлетворенные потребности для появления на рынке безвредного и эффективного терапевтического агента, предназначенного для лечения одного или более подтипов СРК у пациентов-мужчин и пациентов-женщин.
В настоящем изобретении было неожиданно обнаружено, что селективные модуляторы опиоидного рецептора, периферически селективные модуляторы опиоидного рецептора, периферически селективные модуляторы каппа-опиоидного рецептора и периферически селективные агонисты каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид или его фармакологически приемлемые соли могут применяться для лечения диареи или одного или более подтипов СРК и особенно применяются для лечения СРК-Д и СРК-П.
Все публикации, патенты и патентные заявки, цитированные в настоящей заявке, введены сюда с помощью ссылки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящем изобретении предлагаются новые способы, применяемые для лечения одного или более подтипов СРК. В одном воплощении подтипом является СРК-Д. В другом воплощении подтипом является СРК-П. В других воплощениях подтипом является СРК неопределенного типа (СРК-Н (IBS-U)). В следующих воплощениях способы предпочтительно применяются для лечения СРК-Д и СРК-П и в меньшей степени применяются для лечения СРК-Н.
В следующих аспектах способы применяются для лечения диареи, такой как диарея, вызванная вирусными инфекциями, паразитами, бактериальными токсинами, лекарственными средствами, искусственными подсластителями, хирургическим вмешательством и другими расстройствами пищеварения.
Способы применяются для лечения людей и особенно для лечения одновременно мужчин и женщин.
В одном аспекте в изобретении предлагается способ лечения СРК-Д, СРК-П или СРК-Н, включающий введение терапевтически эффективного количества фармацевтической композиции, включающей селективный модулятор опиоидного рецептора, периферически селективный модулятор опиоидного рецептора, периферически селективный модулятор каппа-опиоидного рецептора, периферически селективный агонист каппа-опиоидного рецептора и/или их фармакологически приемлемую соль, субъекту, страдающему СРК-Д, СРК-П или СРК-Н.
В другом аспекте изобретение охватывает способ лечения, по меньшей мере, одного симптома СРК-Д, СРК-П или СРК-Н, включающий введение указанному субъекту терапевтически эффективного количества фармацевтической композиции, включающей селективный модулятор опиоидного рецептора, периферически селективный модулятор опиоидного рецептора, периферически селективный модулятор каппа-опиоидного рецептора, периферически селективный агонист каппа-опиоидного рецептора и/или их фармакологически приемлемую соль. Симптомы выбраны из группы, состоящей из аномальной частоты стула, аномальной формы стула, аномального отхождения стула, отхождения слизи, ощущения крайней необходимости стула, ощущения аномального вздутия, боли, дискомфорта и их комбинации. Предполагается, что указанное введение облегчает боль и/или дискомфорт, вызванные заболеванием. В другом аспекте указанное введение нормализует перистальтику кишечника.
В одном аспекте фармацевтическая композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид, его фармацевтическое производное и/или его фармакологически приемлемую соль. В одном воплощении композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид или асимадолин.
Таким образом, в одном воплощении в настоящем изобретении предлагается способ лечения СРК-Д, СРК-П или СРК-Н, включающий введение субъекту, страдающему СРК-Д, СРК-П или СРК-Н, терапевтически приемлемого количества фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид или его фармакологически приемлемую соль.
В другом воплощении изобретение охватывает способ лечения, по меньшей мере, одного симптома СРК-Д, СРК-П или СРК-Н, включающий введение указанному субъекту терапевтически приемлемого количества фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид или его фармакологически приемлемую соль. Симптомы выбраны из группы, состоящей из аномальной частоты стула, аномальной формы стула, аномального отхождения стула, отхождения слизи, ощущения крайней необходимости стула, ощущения аномального вздутия, боли, дискомфорта и их комбинации. Предполагается, что указанное введение облегчает боль и/или дискомфорт, вызванные заболеванием. В другом аспекте указанное введение нормализует перистальтику кишечника.
В следующем воплощении изобретение охватывает способ лечения субъекта, страдающего диареей, включающий введение указанному субъекту терапевтически эффективного количества фармацевтической композиции, включающей селективный модулятор опиоидного рецептора, периферически селективный модулятор опиоидного рецептора, периферически селективный модулятор каппа-опиоидного рецептора, периферически селективный агонист каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль. В одном воплощении композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид или асимадолин.
Также изобретением охвачены наборы, включающие эффективное количество фармацевтической композиции, включающей селективный модулятор опиоидного рецептора, периферически селективный модулятор опиоидного рецептора, периферически селективный модулятор каппа-опиоидного рецептора, периферически селективный агонист каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль и инструкции по применению для введения указанного соединения субъекту, страдающему диареей или подтипом СРК. Например, подтип может представлять собой СРК-Д, СРК-П или СРК-Н. В одном аспекте фармацевтическая композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид гидрохлорид.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ.1A и B изображены изменение боли от исходного значения с помощью визуальной аналоговой шкалы (VAS) (A) и пропорция количества дней с приемлемым ослаблением боли (B) для подтипов СРК-П, СРК-К и СРК-Д. Эти фигуры поддерживают уменьшение боли у пациентов, страдающих СРК-П, получающих по требованию лечение с помощью асимадолина.
На ФИГ.2 изображено изменение стула в день против времени в неделях в результате получения лечения по требованию с помощью асимадолина для подтипов СРК-П, СРК-К и СРК-Д. Производили поправки для вычитания изменения в группах, подвергнутых лечению с помощью плацебо. Эта фигура поддерживает гипотезу о том, что асимадолин производит нормализацию функционирования кишечника.
На ФИГ.3A и B изображена пропорция месяцев с приемлемым ослаблением боли или дискомфорта, ассоциированных с СРК у субъектов, страдающих СРК, с исходной бальной оценкой боли >2. На ФИГ.3A показаны результаты для всех субъектов, страдающих СРК, и на ФИГ.3B показаны результаты для всех субъектов, страдающих СРК-Д. Эти наблюдения демонстрируют статистически значимое улучшение у субъектов, подвергнутых лечению с помощью асимадолина в количестве 0,5 мг и 1,0 мг.
На ФИГ.4 изображено сравнение эффекта лечения с помощью 0,5 мг асимадолина (дважды в день) на пропорцию месяцев с приемлемым ослаблением боли у субъектов, страдающих СРК-Д, с исходной бальной оценкой боли >2,0, с результатами двух испытаний Фазы III лекарственного средства ЛОТРОНЕКСТМ (LOTRONEXTM) (алосетрон). Лотронекс I относится к данным, опубликованным у Camilleri, et al., Lancet 2000, 355(9209): 1035-1040; Лотронекс II относится к данным, опубликованным у Camilleri, et al., Arch. Intern. Med. 2001, 161(14):1733-1740. Эта фигура демонстрирует, что у пациентов, страдающих СРК-Д, с исходной бальной оценкой боли >2, подвергнутых лечению с помощью 0,5 мг асимадолина дважды в день, наблюдали соизмеримое или лучшее ослабление симптомов СРК по сравнению с подобными пациентами, подвергнутыми лечению с помощью ЛОТРОНЕКСТМ (алосетрон). В испытании асимадолина использовали заметно более жесткое определение реакции, чем в испытаниях алосетрона: в испытании асимадолина требовалась реакция в течение 3 из 4 недель, в то время как в испытании алосетрона требовалась реакция в течение только 2 из 4 недель.
На ФИГ.5A и B изображена 12-недельная динамика эффекта лечения асимадолином субъектов, страдающих СРК-Д, с исходной бальной оценкой боли >2. Данные отражают процент респондентов, у кого наблюдалось адекватное ослабление боли или дискомфорта, вызванных СРК, в любую данную неделю испытания. ФИГ.5A демонстрирует, что статистически значимый эффект от лечения с помощью 0,5 мг асимадолина по отношению к плацебо наблюдали на протяжении большей части из 12 недель испытания, начиная с недели 2. На ФИГ.5B показано, что лечение с помощью 0,5 мг асимадолина приводит в результате к более быстрому и более значительному ослаблению боли или дискомфорта, вызванных СРК, у субъектов, страдающих СРК-Д, на протяжении 12-недельного испытания, чем лечение подобных субъектов с помощью лекарственного средства ЛОТРОНЕКСТМ (алосетрон), как опубликовано у Camilleri, et al. Arch. Intern. Med. 2001, 161(14):1733-1740.
На ФИГ.6A изображено сравнение между пропорцией месяцев с приемлемым ослаблением боли или дискомфорта, вызванных СРК, у всех субъектов, страдающих СРК-Д, с бальной оценкой боли >2, и того же у женщин, страдающих СРК-Д. График демонстрирует, что лечение с помощью 0,5 мг асимадолина производит очень похожие результаты для субъектов женщин и мужчин, страдающих СРК-Д. На ФИГ.6B изображено соотношение дней без боли для всех субъектов, страдающих СРК-Д, с бальной оценкой боли >2. График демонстрирует, что клинически значимое благоприятное действие наблюдается самое раннее на неделе 2, достигая максимума на неделе 3, и поддерживается на всем протяжении лечения. На ФИГ.6C изображен процент дней без боли в течение недель 1-12 клинического испытания для всех субъектов, страдающих СРК-Д, с бальной оценкой боли >2. В целом, у пациентов, страдающих СРК-Д, получавших 0,5 мг асимадолина, было на 21 больше дней без боли в течение 3-месячного исследования по сравнению с пациентами, получавшими плацебо.
На ФИГ.7A и B изображена пропорция месяцев с приемлемым ослаблением боли или дискомфорта, ассоциированных с СРК, у пациентов, страдающих СРК-П и СРК-К, с исходной бальной оценкой боли >2. На ФИГ.7A показаны результаты для субъектов, страдающих СРК-П, и на ФИГ.7B показаны результаты для субъектов, страдающих СРК-К. Эти фигуры демонстрируют статистически значимый эффект у субъектов, страдающих СРК-П, подвергнутых лечению с помощью 1,0 мг асимадолина, и демонстрируют отсутствие значительного ослабления боли у субъектов, страдающих СРК-К.
На ФИГ.8A, B и C изображены изменения бальной оценки боли у субъектов, страдающих СРК-Д (A, B) и СРК-П (C), с исходным значением бальных оценок боли >2. ФИГ.8A и B демонстрируют статистически значимое улучшение бальных оценок боли каждую неделю (начиная с недели 3) и каждый месяц у субъектов, страдающих СРК-Д, получавших 0,5 мг асимадолина. Подобным образом, ФИГ.8A и B демонстрируют статистически значимое улучшение бальных оценок боли каждый месяц у субъектов, страдающих СРК-Д, получавших 1,0 мг асимадолина. На ФИГ.8C показано, что при этих дозировках наблюдали отсутствие статистически значимого улучшения бальных оценок боли у субъектов, страдающих СРК-П.
На ФИГ.9A и B изображено ежемесячное процентное содержание респондентов, для которых наблюдали приемлемое ослабление боли или дискомфорта, ассоциированные с СРК. ФИГ.9A демонстрирует статистически значимое увеличение ежемесячного процентного содержания респондентов, страдающих СРК-Д, с исходными бальными оценками боли >2, подвергнутых лечению с помощью 0,5 мг асимадолина, в течение всех трех месяцев лечения. Напротив, на ФИГ.9B показано статистически значимое увеличение ежемесячного процентного содержания респондентов, страдающих СРК-П, с исходными бальными оценками боли >2, подвергнутых лечению с помощью 1,0 мг асимадолина, в первый месяц лечения.
На ФИГ.10A и B изображена пропорция месяцев с приемлемым ослаблением СРК-симптомов у субъектов, страдающих СРК-Д и СРК-П, с исходными бальными оценками боли >2. СРК-симптомы охватывают абдоминальную боль или дискомфорт, аномальную частоту стула, крайнюю необходимость стула, вздутие, аномальную консистенцию стула и другие вторичные симптомы. На ФИГ.10A показаны статистически значимые улучшения всех СРК-симптомов у субъектов, страдающих СРК-Д, подвергнутых лечению с помощью 0,5 мг или 1,0 мг асимадолина. Подобным образом, ФИГ.10B демонстрирует статистически значимое улучшение всех СРК-симптомов у субъектов, страдающих СРК-П, подвергнутых лечению с помощью 1,0 мг асимадолина.
На ФИГ.11A и B изображен эффект асимадолина на частоту стула у субъектов, страдающих СРК-Д, с исходными бальными оценками боли >2. На ФИГ.11A показано статистически значимое уменьшение ежедневной частоты стула у субъектов, страдающих СРК-Д, подвергнутых лечению с помощью 0,5 мг асимадолина, на второй и третий месяц лечения. ФИГ.11B демонстрирует еженедельную динамику ослабления частоты стула у субъектов, страдающих СРК-Д, подвергнутых лечению с помощью 0,5 мг асимадолина.
ФИГ.12 демонстрирует статистически значимое уменьшение крайней необходимости стула у пациентов, страдающих СРК-Д, с исходной бальной оценкой боли >2, подвергнутых лечению с помощью 0,5 мг или 1,0 мг асимадолина, в течение всех трех месяцев лечения.
На ФИГ.13 показаны статистически значимые уменьшения вздутия у пациентов, страдающих СРК-Д, с исходной бальной оценкой боли >2, подвергнутых лечению с помощью 0,5 мг асимадолина, на второй и третий месяцы лечения, и у пациентов, страдающих СРК-Д, подвергнутых лечению с помощью 1,0 мг асимадолина, на второй месяц лечения.
На ФИГ.14A и B изображены ежемесячные изменения консистенции стула, измеренные по Бристольской шкале, у субъектов, страдающих СРК-Д и СРК-К, с исходными бальными оценками боли >2. Хотя не наблюдали значимого статистического эффекта при любой из дозировок асимадолина, он, по-видимому, смягчает стул субъектов, страдающих СРК-К, и делает более твердым стул субъектов, страдающих СРК-Д, таким образом нормализуя консистенцию стула.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термины, используемые в настоящей заявке, следует понимать согласно общеупотребительным терминам, используемым специалистами в соответствующей области, если не указано иначе.
В настоящем изобретении предлагаются композиции и способы, применяемые для лечения одного или более подтипов СРК.
Римские критерии III представляют собой диагностические критерии для СРК. Римские критерии III можно обнаружить в интернете по адресу romecriteria.org и в публикации Longstreth et al., (2006) Gastroenterology, 130(5), 1480-1491. Согласно этим критериям у пациентов диагностируется СРК, когда у них имеется рецидивирующая абдоминальная боль или дискомфорт в течение 3 или более дней в месяц на протяжении предшествующих 3 месяцев, и симптомы начали проявляться 6 и более месяцев назад. Боль/дискомфорт должны также быть ассоциированы с 2 или более из следующих признаков: (1) улучшение дефекации; (2) изменение частоты стула или (3) изменение формы стула. Симптомы, которые поддерживают диагноз, но не являются частью диагностических критериев, включают аномальную частоту стула, аномальную форму стула, дефекацию с напряжением, крайнюю необходимость стула, ощущение незавершенного стула, отхождение слизи и вздутие. (Смотри для обзора публикацию Longstreth et al., (2006) Gastroenterology, 130(5), 1480-1491).
Подтипы СРК определяют с использованием Римских критериев III. По Римским критериям III СРК классифицируется на четыре подтипа: СРК-Д, СРК-К, СРК-П и СРК-Н. СРК-К определяется, если более чем 25% времени имеет место твердый/комковатый стул (по Бристольской шкале стула 1-2) и если менее чем 25% времени имеет место жидкий/кашицеобразный/водянистый стул (по Бристольской шкале стула 6-7). СРК-Д определяется, если более чем 25% времени имеет место жидкий/кашицеобразный/водянистый стул (по Бристольской шкале стула 6-7) и если менее чем 25% времени имеет место твердый/комковатый стул (по Бристольской шкале стула 1-2). СРК-П (также называемый смешанным СРК (СРК-С (IBS-M)) определяется, если более чем 25% времени имеет место твердый/комковатый стул (по Бристольской шкале стула 1-2) и если более чем 25% времени имеет место жидкий/кашицеобразный/водянистый стул (по Бристольской шкале стула 6-7). СРК-Н представляет собой СРК неопределенного типа, где недостаточно аномалии консистенции стула для удовлетворения критериям для СРК-К, СРК-Д или СРК-П. В Северной Америке случаи заболеваний разделены примерно поровну между СРК-К, СРК-Д или СРК-П (Olden (2003) Cleveland Clinic J. Med., 70(Supp 2), S3-S7).
Соединения и способы, описанные в настоящей заявке, применяются для лечения одного или более подтипов СРК. В одном воплощении подтипом является СРК-Д. В другом воплощении подтипом является СРК-П. В других воплощениях подтипом является СРК-Н. В следующих воплощениях способы предпочтительно применяются для лечения СРК-Д и СРК-П и в меньшей степени применяются для лечения СРК-Н. Способы применяются для лечения людей и применяются для лечения мужчин и женщин.
Изобретение, таким образом, относится к применению селективных модуляторов опиоидного рецептора, периферически селективных модуляторов опиоидного рецептора, периферически селективных модуляторов каппа-опиоидного рецептора и периферически селективных агонистов каппа-опиоидного рецептора и/или их фармакологически приемлемых солей для получения лекарственных средств для лечения одного или более подтипов СРК и особенно для лечения СРК-Д и СРК-П.
Изобретение, таким образом, относится к применению N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли для получения лекарственных средств для лечения одного или более подтипов СРК и особенно для лечения СРК-Д и СРК-П.
Активный ингредиент N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, его фармакологически приемлемых солей, и способы его получения описаны в Пат. США No 5532266, 6344566 и 6060504 и в публикации Barber et al. (B. J. Pharmacol (1994), 113, 1317-1327). N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид гидрохлорид обычно обозначается как асимадолин.
N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и его соли, включающие гидрохлорид, имеют анальгетическое, противовоспалительное, противоастматическое, диуретическое, противосудорожное, нейропротективное и противокашлевое действие, и, в качестве агониста каппа-опиоида, особенно подходит для лечения гиперальгезии, вызванной воспалением, для лечения отека мозга, в состояниях недостаточного снабжения кислородом (гипоксия), болевых состояний и для улучшения после вторичных повреждений из-за ишемии.
В Европейском патенте EP 0752246 и патенте США No. 5776972 описано применение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида или его фармакологически приемлемых солей для получения лекарственного средства для лечения воспалительных кишечных заболеваний и ассоциированных с ними симптомов заболеваний, для лечения тяжелых болевых состояний, особенно болевой гиперчувствительности, встречающейся при болях спины, ожоговых поражениях, солнечном ожоге и ревматических заболеваниях, и для лечения послеоперационной боли и кишечной непроходимости, которая часто встречается после абдоминальных операций.
Дополнительно, ранее предполагалось, что N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемая соль может являться подходящим для лечения функциональных желудочно-кишечных заболеваний, ассоциированных с болью и/или повышенной или пониженной перистальтикой (смотри Патентную Заявку США No. 10/514887 и публикацию Barber & Gottschlich (1997) Expert Opin Invest. Drugs, 6(10), 1351-1368). Такие заболевания включают СРК, не язвенную функциональную диспепсию, обстипацию, особенно индуцированную опиоидами обстипацию. Также предполагается, что асимадолин может применяться для лечения артрита, мигрени, псориаза или других вызывающих зуд заболеваний, дисменореи и фибромиалгии (смотри Патентную Публикацию США No. 20040157913).
Асимадолин обладает рядом привлекательных фармакокинетических и фармакодинамических характеристик в качестве терапевтического агента, включающих высокую биодоступность (50%), быстрое проявление, слабое проникновение через гематоэнцефалический барьер, высокую аффинность для каппа-опиоидного рецептора (IC50 1,2 нМ) и высокую селективность для каппа-опиоидного рецептора (соотношение значений IC50 асимадолина для каппа-, мю- и дельта-опиоидных рецепторов составляет примерно 1:501:498 соответственно), и период полужизни составляет примерно 2-3 часа. Биодоступность определяли у субъектов натощак, однако исследования взаимодействия с пищей показали, что еда, по существу, не влияет на биодоступность.
В одном аспекте изобретение охватывает способ лечения, по меньшей мере, одного симптома подтипов СРК, таких как СРК-Д, СРК-П или СРК-Н, включающий введение эффективного количества фармацевтической композиции, включающей селективный модулятор опиоидного рецептора, периферически селективный модулятор опиоидного рецептора, периферически селективный модулятор каппа-опиоидного рецептора, периферически селективный агонист каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль. Симптомы выбраны из группы, состоящей из аномальной частоты стула, аномальной формы стула, аномального отхождения стула, отхождения слизи и ощущения аномального вздутия, боли, дискомфорта и их комбинации. Предполагается, что указанное введение ослабляет боль и/или дискомфорт, вызванные заболеванием. В другом аспекте указанное введение нормализует перистальтику кишечника.
В следующих аспектах селективные модуляторы опиоидного рецептора, периферически селективные модуляторы опиоидного рецептора, периферически селективные модуляторы каппа-опиоидного рецептора, периферически селективные агонисты каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль применяют для лечения диареи. Они применяются для лечения диареи, вызванной вирусными инфекциями (т.e. HIV, Norwalk-вирусом, цитомегаловирусом, вирусным гепатитом, вирусом простого герпеса и ротавирусом), паразитами (т.e. ляблиями Giardia lamblia и криптоспоридией), бактериями (т.e. кампилобактером, сальмонеллами, шигеллами, E. coli), лекарственными средствами (т.e. антибиотиками), искусственными подстластителями (т.e. сорбитом и маннитом), хирургическим вмешательством, радиационной терапией, раком, диабетом, гипертиреозом и другими расстройствами пищеварения (т.e. болезнью Крона, глютеиновой болезнью и неспецифическим язвенным колитом). Эти заболевания представляют собой неограничивающие примеры причин диареи, и предполагается, что соединения, обсуждаемые в настоящей заявке, могут применяться в лечении диареи независимо от ее причины.
В следующих аспектах селективные модуляторы опиоидного рецептора, периферически селективные модуляторы опиоидного рецептора, периферически селективные модуляторы каппа-опиоидного рецептора, периферически селективные агонисты каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль применяют для получения лекарственных средств для лечения диареи.
Считают, что соединение является подходящим в качестве селективного модулятора опиоидного рецептора для применения согласно изобретению, если оно демонстрирует аффинность к опиоидным рецепторам, одному или более, более предпочтительно к мю- и каппа-опиоидным рецепторам, и особенно к каппа-опиоидному рецептору, который при определении в виде значения IC50 находится в интервале примерно от 0,01 нмоль примерно до 100 микромоль, в интервале примерно от 0,05 нмоль примерно до 10 микромоль, в интервале примерно от 0,1 нмоль примерно до 3 микромоль, в интервале примерно от 0,5 нмоль до 1 микромоль, или в наномолярном интервале. В определенных аспектах аффинность к каппа-опиоидному рецептору, определенная как значение IC50, составляет примерно 0,01 нМ, 0,05 нМ, 0,1 нМ, 0,2 нМ, 0,3 нМ, 0,4 нМ, 0,5 нМ, 0,6 нМ, 0,7 нМ, 0,8 нМ, 0,9 нМ, 1 нМ, 1,2 нМ, 1,5 нМ, 1,7 нМ, 2 нМ, 3, нМ, 4 нМ, 5 нМ, 10 нМ или выше.
На протяжении этого описания различные аспекты этого изобретения представлены в формате интервалов. Следует понимать, что описание в формате интервалов используется исключительно для удобства и краткости, и его не следует понимать, как жесткое ограничение рамок изобретения. Соответственно, следует считать, что описание интервала содержит определенным образом описанные все возможные субинтервалы, а также индивидуальные числовые значения внутри интервала. Например, следует считать, что описание интервала, такого как от 1 до 6, содержит определенным образом описанные все возможные субинтервалы, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д, а также индивидуальные числовые значения внутри этого интервала, например 1, 2, 3, 4, 5, и 6. Это применяется независимо от ширины интервала.
Соединение является подходящим для применения согласно изобретению, если оно обладает фармацевтическим периодом полужизни, который находится в интервале, составляющем примерно 1-10 часов, в интервале, составляющем примерно 1-8 часов, в интервале, составляющем примерно 1-6 часов, в интервале, составляющем примерно 1-4 часа, или в интервале, составляющем примерно 2-3 часа.
Считается, что соединение является подходящим для применения согласно изобретению, если оно является периферически селективным, т.е. демонстрирует слабое проникновение через гематоэнцефалический барьер. Периферически селективное соединение согласно изобретению обозначает соединение, которое демонстрирует высокую селективность для периферической нервной системы пациента при введении указанному пациенту. Периферически селективные соединения предпочтительно демонстрируют небольшое или недетектируемое влияние на центральную нервную систему пациента при введении указанному пациенту в дозировках на уровне, при котором они оказывают терапевтический эффект на периферическую нервную систему.
Считается, что соединение является подходящим для применения согласно изобретению, если соотношение его аффинности, определенной в виде значения IC50, к каппа-опиоидному рецептору к его аффинности, определенной в виде значения IC50, к другому подтипу опиоидного рецептора, находится в интервале примерно от 1:100 до 1:2000, в интервале примерно от 1:200 до 1:1500, в интервале примерно от 1:300 до 1:1200, в интервале примерно от 1:400 до 1:1000 или если соотношение составляет примерно 1:100, 1:200, 1:300, 1:400, 1:500, 1:600, 1:700, 1:800, 1.900, 1:1000 или менее. Считается, что соединение является подходящим для применения согласно изобретению, если у субъекта-человека оно демонстрирует биодоступность более чем или равную примерно 10%, 20%, 30%, 40%, 50%, 60% или 70%.
В одном аспекте, как описано выше, соединение, применяемое в способах по изобретению, представляет собой N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль. Также предполагается применение его фармацевтических производных, таких как описанные в Патентной Публикации США No. 20060122255.
Другие модулирующие соединения для применения согласно изобретению выбраны из группы, состоящей из Алвимопана (смотри, например, Am. J. Surg. 2001 Nov; 182 (5ASuppl): 27S-38S), Лоперамида (смотри, например, J. Pharmacol. Exp. Ther. 1999 Apr; 289 (1): 494-502), Спирадолина (смотри, например, Pol. J. Pharmacol. 1994 Jan-Apr; 46 (1-2): 37-41), Федотозина (смотри, например, Expert Opin. Investig. Drugs 2001 Jan, 10(1): 97-110), Пентазоцина (смотри, например, Biol. Pharm. Bull. 1997 Nov; 20(11): 1193-8), Энадолина (Psychopharmacology 2001 Sep;157(2):151-62), IC1204448 (смотри, например, Br. J. Pharmacol. 1992 Aug; 106(4): 783-9), U-50488H (смотри, например, Life Sci. 2002 Mar 1; 70(15): 1727-40), FE 200665 и FE 200666 (Riviere et al., 1999 Acta. Neurobiol. Exp. 59:186; Binder et al., 2001 Anesthesiology 94: 1034-1044), TRK-820 (смотри, например, Life Sci. 1999; 65(16): 1685-94), ADL 10-0101 (смотри, например, Pain 2002 Mar; 96(1-2): 13-22), ADL 10-0116 (смотри, например, Pain 2002 Mar; 96 (1-2): 13-22), ADL 1-0398 (от фирмы Adolor Corp., США), U 69,593 (смотри, например, J. Neurosci., 2000 Aug; 20(15):5874- 5879), EMD 60400 (Chirality 6: 685-689, 1994), Салвинорма A (Life Sciences 75:2615-2619, 2004), CR665 и CR666 (оба от фирмы Cara Therapeutics Inc.).
В одном аспекте изобретения модулирующие соединения выбраны из группы, состоящей из N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, ICI204448, U-50488H, ADL 10-0101, ADL 10-0116, ADL 1-0398, FE 200665, FE 200666, EMD 60400, U 69,593, CR665, CR666, их производных, комбинаций и фармацевтически приемлемых солей.
Таким образом, в одном воплощении в настоящем изобретении предлагается способ лечения СРК-Д, включающий введение терапевтически эффективного количества фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль, субъекту, страдающему СРК-Д. В другом аспекте в изобретении предлагается способ лечения СРК-П, включающий введение терапевтически эффективного количества фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль, субъекту, страдающему СРК-П. Еще в одном аспекте в изобретении предлагается лечение пациента, страдающего СРК-Н, с помощью терапевтически эффективного количества фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармакологически приемлемую соль.
В другом воплощении изобретение охватывает способ лечения, по меньшей мере, одного симптома СРК-Д, СРК-П или СРК-Н, включающий введение указанному субъекту терапевтически эффективного количества фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармацевтически приемлемую соль. Симптомы выбраны из группы, состоящей из аномальной частоты стула, аномальной формы стула, аномального выхода стула, выхода слизи, ощущения аномального вздутия, боли, дискомфорта и их комбинаций. Предполагается, что указанное введение ослабляет боль и/или дискомфорт, вызванные заболеванием. В другом аспекте указанное введение нормализует перистальтику кишечника.
В одном воплощении фармацевтическая композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид гидрохлорид.
В другом воплощении у индивидуума диагностируют подтип СРК перед введением фармацевтической композиции. Например, у индивидуума диагностируют СРК-Д, СРК-П, или СРК-Н перед введением фармацевтической композиции. В одном аспекте фармацевтическую композицию не вводят индивидууму после диагностирования СРК-К.
Фармацевтические композиции могут вводиться с помощью перорального пути введения, парентерального (например, с помощью внутримышечной инъекции, внутрибрюшинной, внутривенной, интрацистернальной инъекции или инфузии, подкожной инъекции или с помощью имплантата), с помощью ингаляционного аэрозоля, с помощью назального пути введения, вагинального, подъязычного или с помощью местных путей введения. Фармацевтические композиции могут быть представлены в подходящих единых дозированных лекарственных формах, удобных для каждого пути введения.
Подразумевается, что настоящее изобретение не ограничивается конкретными лекарственными формами или конкретными способами введения. В одном воплощении композиция представлена для перорального, парентерального, интраназального, местного введения или введения с помощью инъекции. Неограничивающие примеры введения с помощью инъекции представляют собой внутрикавернозную инъекцию, подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию и внутрикожную инъекцию. Фармацевтическая композиция может быть представлена для перорального введения в дозировке, которая находится в интервале, составляющем примерно от 0,1-25 мг в день. Фармацевтическая композиция также может быть представлена для введения с помощью инъекции в дозировке, которая находится в интервале, составляющем примерно от 0,1-25 мг в день. В других воплощениях дозировка находится в интервале, составляющем примерно от 0,1 мг примерно до 10 мг в день. В предпочтительных воплощениях дозировка находится в интервале, составляющем примерно от 0,3 мг примерно до 2,0 мг в день.
Согласно дополнительным свойствам в описанных воплощениях введение проводится в количестве примерно от 1 раза в день примерно до 4 раз в день. В одном аспекте введение проводится дважды в день. В следующем аспекте, указанное введение проводится согласно проявлению симптомов СРК у субъекта. Например, введение может проводиться p.r.n. или по необходимости в зависимости от симптомов у субъекта.
В одном аспекте субъекту, страдающему СРК-Д, вводится примерно 1 мг или примерно 2 мг в день. В других аспектах у субъекта, страдающего СРК-Д, диагностировали среднее или тяжелое болевое состояние. В одном аспекте среднее или тяжелое болевое состояние диагностировали на основе собственного сообщения субъекта о степени боли.
В другом аспекте субъекту, страдающему СРК-П, вводится примерно 1 мг или примерно 2 мг в день. В других аспектах у субъекта, страдающего СРК-П, диагностировали среднее или тяжелое болевое состояние.
Фармацевтические композиции по настоящему изобретению могут быть представлены в твердой или жидкой дозированной форме. Например, фармацевтические композиции могут быть представлены в твердом виде в форме таблеток, капсул, порошков и подобных компонентов. Фармацевтические композиции также могут быть представлены в жидком виде в форме сиропов, инъекционных смесей и подобных.
Фармацевтическая композиция может приниматься вместе с пищей или без нее. Если принимается без пищи, то она может приниматься перед едой или после еды.
Также изобретение охватывает наборы, включающие эффективное количество фармацевтической композиции, включающей селективный модулятор опиоидного рецептора, предпочтительно периферически селективный модулятор опиоидного рецептора, более предпочтительно периферически селективный модулятор каппа-опиоидного рецептора и особенно предпочтительно периферически селективный агонист каппа-опиоидного рецептора, или их фармакологически приемлемую соль, а также инструкции по применению для введения указанного соединения субъекту, страдающему подтипом СРК. Например, подтип может представлять собой СРК-П, СРК-Д или СРК-Н.
Изобретение дополнительно охватывает наборы, включающие эффективное количество фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид или его фармацевтически приемлемую соль, а также инструкции по применению для введения указанного соединения субъекту, страдающему подтипом СРК. Например, подтип может представлять собой СРК-П, СРК-Д или СРК-Н. В одном аспекте фармацевтическая композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид гидрохлорид.
Настоящее изобретение можно легче понять с помощью ссылки на следующее подробное описание предпочтительных воплощений изобретения и на раздел Примеров, включенных в настоящую заявку. Все патенты, патентные заявки, опубликованные заявки, вебсайты и другие публикации, на которые ссылаются в настоящей заявке, а также ссылки, цитированные в этих публикациях, введены в настоящую заявку с помощью ссылки. В случае, если существует множество определений для терминов, представленных в настоящей заявке, преимущественными будут определения, представленные в данном разделе.
Однако перед тем как раскрывать и описывать соединения, композиции и способы настоящего изобретения, следует понимать, что это изобретение не ограничено определенными солями, определенными подтипами СРК, определенными симптомами или определенными методами и т.д., которые в силу этого, конечно, могут варьироваться, и многочисленные модификации и вариации будут очевидны специалисту в данной области. Также следует понимать, что терминология, используемая в настоящей заявке, предназначена только для целей описания определенных воплощений и не рассматривается как ограничение.
A. Определения
При использовании в настоящей заявке форма единственного числа включает ссылки на множественное число до тех пор, пока не указано иначе. Например, ссылка на "активный агент" или "фармакологически активный агент" включает единственный активный агент, а также два или более различных активных агента в комбинации, ссылка на "фармакологически приемлемую соль" включает одну или более различных солей, а также единственную соль, ссылка на "носитель" включает смеси двух или более носителей, а также единственный носитель и тому подобное.
При использовании в настоящей заявке термины "субъект", "индивидуум" или "пациент" используются взаимозаменяемо, обозначают любое животное, включающее млекопитающих, предпочтительно мышей, крыс, других грызунов, кроликов, собак, кошек, свиней, крупный рогатый скот, овец, лошадей или приматов и наиболее предпочтительно людей. В другом воплощении, субъектом является субъект-человек. В других воплощениях субъектом-человеком является женщина или мужчина.
"Периферически селективное" соединение согласно изобретению обозначает соединение, которое демонстрирует небольшое или более предпочтительно недетектируемое влияние на центральную нервную систему пациента при введении указанному пациенту.
При использовании в настоящей заявке термин "активный агент" обозначает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид, его соли, сольваты, пролекарственные средства и/или его производные.
Соединение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид является известным и описано, например, в публикациях EP-A-0 569802 (Пат. США No. 5532226), EP-A-0 752246 (Пат. США No. 5776972 и Пат. США No. 5977161), DE-A-19849650, EP-A-0 761650 (Пат. США No. 6060504) и EP-A-1 073634 (Пат. США No. 6344566).
Асимадолин представляет собой активное вещество диарилацетамид-каппа-опиоидов. Его химическое обозначение представляет собой N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид, и его эмпирическая формула представляет собой C27H30N2O2×HCl. Молекулярная масса составляет 451,01, и структурная формула представляет собой
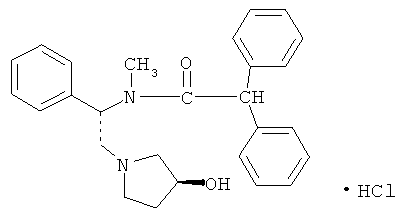
Асимадолин представляет собой белый порошок, который имеет растворимость в воде, составляющую 11,6 г/л, и растворимость в этаноле, составляющую 5,4 г/л. Вещество является немного чувствительным к влаге, но стабильно против нагревания, кислорода воздуха и света. Оно не гигроскопично.
Термин "N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид" охватывает соли, сольваты, пролекарственные средства и производные соединения. Например, он включает производные, описанные в Патентной Публикации США No. 20060122255. Изобретение также относится к оптически активным формам (стереоизомерам), предпочтительно к энантиомерам, рацематам и диастереомерам, и к гидратам и сольватам N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида. Термин "сольваты" согласно изобретению используют для обозначения представления инертных молекул растворителя на молекулах N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида благодаря их взаимной силе притяжения. Сольваты включают, например, моно- или дигидраты, или алкоголяты. "Пролекарственные средства" обозначают соединения, которые были модифицированы посредством дополнительных групп или которые содержат дополнительные группы, такие как, но не ограничиваясь ими, алкильные или ацильные группы, сахара или олигопептиды, которые быстро расщепляются в организме с получением активного агента.
При использовании в настоящей заявке термин "биодоступность" представляет собой измерение степени терапевтически активного лекарственного средства, которое достигает общей системы циркуляции и является доступным в месте действия.
При использовании в настоящей заявке термины "фармацевтически приемлемые соли" или "фармацевтически приемлемые производные" соединений по настоящему изобретению охватывают любые соли или сложные эфиры, которые могут быть легко получены специалистом в данной области. Фармацевтически приемлемые соли соединений по настоящему изобретению включают, например, соли, выделенные на основе фармацевтически приемлемых неорганических и органических кислот и оснований. Соли, выделенные на основе подходящих оснований, включают, но не ограничены ими, соли щелочных металлов (например, натрия), соли щелочноземельных металлов (например, магния), соли аммония и соли N(C1-4алкил)4 +. Примеры подходящих кислот включают, но не ограничены ими, хлороводородную кислоту, бромоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-p-сульфокислоту, винную, уксусную, лимонную, метансульфокислоту, муравьиную, бензойную, малоновую, нафталин-2-сульфокислоту и бензолсульфокислоту. Другие кислоты, такие как щавелевая, которые сами по себе не являются фармацевтически приемлемыми, могут применяться в получении солей, применяемых в качестве интермедиатов в получении соединений по изобретению и их фармацевтически приемлемых солей. В одном аспекте изобретения фармакологически приемлемая соль представляет собой N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид гидрохлорид, также известная как EMD 61753 и асимадолин.
При использовании в настоящей заявке, термины "лечить" или "терапевтический" и грамматически родственные им термины обозначают любое улучшение или ослабление любого проявления заболевания; полная ликвидация заболевания не требуется. Ослабление симптомов конкретного расстройства обозначает любое уменьшение симптомов или постоянное или временное, которое может быть отнесено за счет или может быть ассоциировано с введением композиции. В одном аспекте введение соединения по изобретению улучшает состояние, предотвращает или ослабляет симптомы или клинически наблюдаемые последствия для клинически диагностированных расстройств, описанных в настоящей заявке, включающих функциональные расстройства кишечника, такие как СРК и один или более подтипов СРК и диарею.
При использовании в настоящей заявке термин "введение" соединения обозначает подходящий способ предоставления субъекту соединения по изобретению.
При использовании в настоящей заявке термин "нормализует перистальтику кишечника" обозначает способность соединений по изобретению изменять перистальтику кишечника у субъекта, подвергнутого лечению, так что перистальтика становится ближе к стандартной или средней перистальтике, чем была до лечения. Например, нормализация перистальтики кишечника у субъектов, страдающих констипацией, включает в себя увеличение частоты отхождения стула и/или уменьшение твердости и комковатости стула, в то время как нормализация перистальтики кишечника у субъектов, страдающих диареей, включает в себя уменьшение частоты отхождения стула и/или получение менее водянистого и кашицеобразного стула.
В одном аспекте в изобретении описаны способы и композиции для уменьшения перистальтики кишечника. Перистальтика кишечника включает в себя спонтанные координированные расширения и сокращения желудка, кишечника, толстой кишки и прямой кишки для продвижения пищи по желудочно-кишечному тракту во время процесса пищеварения.
При использовании в настоящей заявке термин "дискомфорт" обозначает некомфортное ощущение, не описываемое как боль.
"Констипация" используется в ее обычном смысле с обозначением редкого или затрудненного стула.
"Диарея" используется в ее обычном смысле с обозначением частых и, как правило, изобильных выделений рыхлого или жидкого стула из кишечника без напряжения.
Посредством терминов "эффективное" количество или "терапевтически эффективное количество" лекарственного средства или фармакологически активного агента обозначают нетоксическое, но достаточное количество лекарственного средства или агента для получения целевого эффекта, т.е. ослабления симптомов, ассоциированных с одним или более подтипов СРК, как объяснено выше, или для ослабления симптомов диареи. Установлено, что эффективное количество лекарственного средства или фармакологически активного агента может варьироваться в зависимости от пути введения, выбранного соединения и от видов животных, которым вводится лекарственное средство или фармакологически активный агент, а также от возраста, веса, пола индивидуума, которому вводится лекарственное средство или фармакологически активный агент. Также установлено, что специалист в данной области может определить подходящие эффективные количества путем учета таких факторов, как метаболизм, биодоступность и другие факторы, которые влияют на уровень лекарственного средства или фармакологически активного агента в плазме после введения в количестве, соответствующем интервалам однократной дозы, раскрытым далее в настоящей заявке для различных путей введения.
С помощью терминов введения "по необходимости", также известного как введение "pro re nata" "prn", и введения "по требованию" или введения обозначают введение дозы активного агента в момент времени, когда желательно подавление болевых или не болевых симптомов СРК или когда желательно подавление диареи.
Альтернативно, активный агент вводится на постоянной основе, то есть ежедневно, много раз в день (т.e. 2-4 раза в день), или по более или менее частому графику. Определение графика введения также находится в компетенции специалиста в данной области.
При использовании в настоящей заявке фраза "фармакологический период полужизни" описывает время, требуемое для того, чтобы половина количества лекарственного средства или другого вещества, депонированного в живой организм, была метаболизирована или выведена из плазмы с помощью обычных биологических процессов. Эта фраза также взаимозаменяемо обозначается в настоящей заявке как "период полужизни".
"Фармацевтическое вспомогательное вещество" включает вещество, такое как адъювант, носитель, pH-регулирующие и буферные агенты, агенты, регулирующие тоничность, увлажняющие агенты, консерванты и им подобные.
"Фармацевтически приемлемая" обозначает нетоксическую, инертную композицию, которая физиологически совместима с людьми или другими млекопитающими.
"Фармацевтически приемлемая лекарственная форма" или "фармацевтическая композиция" обозначают композицию или лекарственную форму, которая позволяет эффективное распределение соединений по изобретению в том физическом месте, которое является наиболее подходящим для их целевой активности.
"Системное введение" обозначает in vivo-системную абсорбцию или накопление соединения в кровотоке с последующим распределением по всему организму.
B. Лечение заболевания
В изобретении предлагаются композиции и способы для лечения субъекта, страдающего СРК, и особенно для лечения одного или более подтипов СРК. В одном воплощении подтипом является СРК-П. В другом воплощении подтипом является СРК-Д. В других воплощениях подтипом является СРК-Н. Еще в других воплощениях способы конкретно применяются для лечения СРК-Д и СРК-П и в меньшей степени применяются для лечения СРК-Н.
В изобретении дополнительно предлагаются композиции и способы для лечения субъекта, страдающего диареей.
Способы применяются для лечения людей, особенно для лечения одновременно и мужчин и женщин.
Однократное или многократное введение активного агента может проводиться с использованием любого стандартного пути введения, включающего, но не ограниченного ими, пероральный путь, внутривенный, внутрибрюшинный, подкожный и внутрикожный путь введения.
Типичные лекарственные формы включают, но не ограничены ими, лекарственные формы, подходящие для парентерального введения, например для внутривенного, внутриартериального, внутримышечного или подкожного введения, включающие лекарственные формы, инкапсулированные в мицеллы, липосомы или капсулы с высвобождением лекарственного средства (активные агенты инкорпорированы внутри биосовместимой оболочки, созданной для медленного высвобождения); лекарственные формы для проглатывания; лекарственные формы для местного использования, такие как кремы, мази и гели; и другие лекарственные формы, такие как ингаляторы, аэрозоли и распылители. Дозировка соединений по изобретению варьируется согласно степени и серьезности необходимости лечения, активности вводимой композиции, общего состояния здоровья субъекта и других соображений, хорошо известных специалисту в данной области.
C. Фармацевтические композиции
Соединения по изобретению, описанные в настоящей заявке, могут быть введены в фармацевтические композиции, подходящие для введения. Такие композиции обычно включают агент и фармацевтически приемлемый носитель. Дополнительные активные соединения также могут быть введены в композиции.
Различные фармацевтические композиции и методы их получения и использования известны специалистам в данной области с учетом настоящего описания. Для подробного перечисления подходящих фармакологических композиций и ассоциированных с ними методов введения можно ссылаться на подробные методы, описанные в настоящей заявке, которые могут быть еще дополнены такими публикациями, как Remington: The Science and Practice of Pharmacy 20th Ed. (Lippincott, Williams & Wilkins 2003).
Подходящие композиции и дозированные формы включают таблетки, капсулы, каплеты, пилюли, гелевые капсулы, пастилки, дисперсионные растворы, суспензии, растворы, сиропы, трансдермальные пластыри, гели, порошки, взвеси, таблетки для рассасывания, кремы, пасты, гипсы, лосьоны, диски, суппозитории, жидкие распылители для назального или перорального введения, лекарственные формы для ингаляции в виде сухого порошка или аэрозоля, композиции и лекарственные формы для внутрипузырного введения и им подобные. Далее, специалист в данной области легко может установить подходящие лекарственные формы, включающие в себя эти композиции и дозированные формы, включающие эти лекарственные формы, описанные в настоящей заявке.
Фармацевтически приемлемые вещества, композиция или носитель, такие как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующее вещество, вовлечены в доставку или транспорт химического объекта из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами лекарственной формы и не должен вредить пациенту. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; вспомогательные вещества, такие как какао-масло и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этил олеат и этил лаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; растворы фосфатного буфера; и другие не токсические совместимые вещества, применяемые в фармацевтических лекарственных формах. Также могут присутствовать в композиции увлажняющие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, антиадгезионные агенты, агенты оболочки, подсластители, вкусовые агенты и ароматизаторы, консерванты и антиоксиданты.
Терапевтические лекарственные формы могут быть растворенными и вводиться посредством любого пути введения, способного доставить терапевтическую композицию к месту лечения у субъекта. Потенциально эффективные пути введения включают, но не ограничены ими, пероральное введение, внутривенное, парентеральное, внутрибрюшинное, внутримышечное, внутрикожное, введение внутрь органа, ортотопическое введение и им подобные. Одна лекарственная форма для внутривенной инъекции включает терапевтическую композицию, представленную в растворе консервированной бактериостатической воды, стерильной неконсервированной воды, и/или включает терапевтическую композицию, разведенную в поливинилхлориде, или включает полиэтиленовые пакетики, содержащие стерильный раствор для инъекций в виде 0,9% хлорида натрия, USP. Терапевтические препараты могут быть лиофилизованными и могут храниться в виде стерильных порошков, предпочтительно под вакуумом, и затем могут восстанавливаться в бактериостатической воде (содержащей, например, в качестве консерванта бензиловый спирт) или в стерильной воде перед инъекцией.
В клинических испытаниях, описанных в настоящей заявке, использовали таблетки, содержащие 0,15, 0,5 или 1,0 мг асимадолина и следующие неактивные ингредиенты: лактозу, микрокристаллическую целлюлозу, гипромеллозу, кроскармелозу натрия, стеарат магния, Макрогол 400, Диметикон 100, диоксид титана и оксид железа (III). Предполагается использование других активных ингредиентов.
В одном аспекте композиция представляет собой композицию с замедленным высвобождением.
Формы замедленного высвобождения обычно создают для поддержания терапевтических концентраций лекарственного средства в течение более чем 12 часов. Скорость абсорбции может контролироваться с помощью нанесения покрытия на частицы лекарственного средства с помощью воска или другого водонерастворимого вещества путем включения лекарственного средства в матрикс, из которого оно медленно высвобождается во время транзита через желудочно-кишечный тракт или путем образования комплекса лекарственного средства с ионо-обменными смолами.
Таким образом, например, лекарственная форма с замедленным высвобождением в форме таблетки может быть основана на использовании гидрофильного полимера, который набухает при контакте с жидкостями желудочно-кишечного тракта с образованием геля, который создает барьер, который служит оболочкой таблетки. Барьер ограничивает физические обмены между внутренней частью таблетки и окружающей средой. Как следствие, проникновение воды к матриксу таблетки и диффузия лекарственного средства замедляются, позволяя контролируемое замедленное высвобождение лекарственного средства.
В качестве матрицы для лекарственных средств с замедленным высвобождением могут использоваться различные типы полимеров, такие как поливинилхлорид, полиамиды полиэтилена, этилцеллюлоза, силикон, полимер (гидроксиэтилметакрилат), другие акриловые сополимеры и сополимеры поливинилацетата-поливинилхлорида.
Таким образом, лекарственная форма с замедленным высвобождением для доставки опиоидных модуляторов для высвобождения по настоящему изобретению предусматривает высвобождение в течение периода времени, который находится в интервале примерно от 2 часов примерно до 24 часов, предпочтительно примерно от 4 часов примерно до 24 часов и, следовательно, предусматривает высвобождение в течение периода времени, составляющего, по меньшей мере, 4 часа, по меньшей мере, 5 часов, по меньшей мере, 6 часов, по меньшей мере, 7 часов, по меньшей мере, 8 часов, по меньшей мере, 9 часов, по меньшей мере, 10 часов, по меньшей мере, 11 часов, по меньшей мере, 12 часов, по меньшей мере, 13 часов, по меньшей мере, 14 часов, по меньшей мере, 15 часов, по меньшей мере, 16 часов, по меньшей мере, 17 часов, по меньшей мере, 18 часов, по меньшей мере, 19 часов, по меньшей мере, 20 часов, по меньшей мере, 21 час, по меньшей мере, 22 часа, по меньшей мере, 23 часа или, по меньшей мере, 24 часа. Альтернативно, такая лекарственная форма с замедленным высвобождением предусматривает высвобождение опиоидных модуляторов в течение периода времени, составляющего более чем 24 часа и до 48 часов.
D. Дозировка и Введение
Концентрация активного агента в любой из вышеупомянутых дозированных форм и композиций может существенно варьироваться и будет зависеть от разнообразных факторов, включающих тип композиции или дозированной формы, соответствующий способ введения, природу и активность определенного активного агента и предназначенный профиль высвобождения лекарственного средства. Предпочтительные дозированные формы содержат однократную дозу активного агента, т.е. однократную терапевтически эффективную дозу. Для кремов, мазей и т.д. "однократная доза" требует концентрации активного ингредиента, которая обеспечивает однократную дозу в определенном количестве применяемой лекарственной формы. Однократная доза любого конкретного активного агента будет, конечно, зависеть от активного агента и способа введения.
Для активных агентов по настоящему изобретению однократная доза для перорального, трансмукозального, местного, трансдермального и парентерального введения находится в интервале, составляющем примерно от 1 нг примерно до 1000 мг, примерно от 5 нг примерно до 950 мг, примерно от 10 нг примерно до 900 мг, примерно от 20 нг примерно до 800 мг, примерно от 30 нг примерно до 750 мг, примерно от 40 нг примерно до 700 мг, примерно от 50 нг примерно до 650 мг, примерно от 100 нг примерно до 600 мг, примерно от 200 нг примерно до 550 мг, примерно от 250 нг примерно до 500 мг, примерно от 400 нг примерно до 450 мг, примерно от 500 нг примерно до 400 мг, примерно от 1 мкг примерно до 350 мг, примерно от 5 мкг примерно до 300 мг, примерно от 10 мкг примерно до 250 мг, примерно от 20 мкг примерно до 200 мг, примерно от 40 мкг примерно до 175 мг, примерно от 50 мкг примерно до 150 мг, примерно от 75 мкг примерно до 125 мг, примерно от 100 мкг примерно до 100 мг, примерно от 200 мкг примерно до 75 мг, примерно от 300 мкг примерно до 50 мг, примерно от 400 мкг примерно до 25 мг, примерно от 0,5 мг примерно до 20 мг, примерно от 0,5 мг примерно до 10 мг, примерно от 0,5 мг примерно до 5 мг, примерно от 0,1 мг примерно до 10 мг, примерно от 0,1 мг примерно до 5 мг, или примерно от 0,3 мг примерно до 2 мг.
В одном аспекте, где фармацевтическая композиция представлена для перорального введения один или два раза в день, однократная доза находится в интервале примерно от 0,3 мг примерно до 2 мг.
Терапевтически эффективное количество конкретного активного агента, вводимого данному индивидууму, будет, конечно, зависеть от ряда факторов, включающих концентрацию определенного активного агента, композиции или дозированной формы, выбранного способа введения, возраста и общего состояния индивидуума, подвергнутого лечению, пола индивидуума, тяжести его состояния и других факторов, известных медицинскому работнику.
В одном аспекте введение является кратковременным, в то время как в других аспектах введение является долгосрочным. С помощью термина "кратковременный" обозначают, что активный агент вводится пациенту в течение определенного периода времени, обычно измеряемого в днях или неделях. Например, активный агент может приниматься при продолжительных симптомах при лечении диареи. В другом примере активный агент может приниматься в течение периодов времени, составляющих 1, 2, 3, 4, 5, 6 или 7 дней или 1, 2, 3, 4, 5 или 6 или более недель. С помощью термина "долгосрочный" обозначают, что активный агент вводится пациенту в течение неопределенного периода времени. В одном примере активный агент принимается пациентом, страдающим СРК-П, СРК-Д или СРК-Н, для лечения заболевания и продолжает вводиться даже после ослабления одного или более симптомов.
Терапевтически эффективное количество согласно настоящему изобретению может включать количество, эффективное для демонстрации уменьшения частоты или интенсивности, по меньшей мере, одного симптома, ассоциированного с заболеванием. Например, у пациента, страдающего СРК, эффективное количество активных агентов по настоящему изобретению может представлять собой количество, эффективное для уменьшения абдоминальной боли и/или дискомфорта. Следующий пример эффективного количества активных агентов по настоящему изобретению для лечения пациента, страдающего диареей, будет представлять собой количество, эффективное для уменьшения проявления или частоты жидкого стула у пациента, страдающего диареей, у такого пациента, как страдающего СРК-П, СРК-Д, СРК-Н, или диареей, не связанной с СРК, или эффективное количества активных агентов будет представлять собой количество, достаточное для нормализации перистальтики кишечника.
Терапевтические способы, представленные выше, могут быть объединены с любой терапевтической схемой из широкого разнообразия терапевтических схем для лечения СРК или диареи. В одном воплощении, например, асимадолин вводят в сочетании с рекомендациями по терапии стресса и/или изменениями питания и образа жизни. В других аспектах асимадолин вводят в сочетании с введением добавок клетчатки, противодиарейных средств, слабительных, антихолинергических агентов, антидепрессантов, алостерона, тегасерода и/или их комбинаций. Дополнительно предполагается, что асимадолин может быть представлен совместно с добавками клетчатки, противодиарейными средствами, слабительными, антихолинергическими агентами, антидепрессантами, алостероном, тегасеродом и/или их комбинациями.
E. Наборы
В одном воплощении предлагается упакованный набор, который содержит фармацевтическую лекарственную форму для введения, т.е. фармацевтическую лекарственную форму, содержащую терапевтически эффективное количество селективного модулятора опиоидного рецептора, периферически селективного модулятора опиоидного рецептора, периферически селективного модулятора каппа-опиоидного рецептора, периферически селективного агониста каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, и/или его фармакологически приемлемых солей, контейнер, предпочтительно запаянный, для размещения лекарственной формы во время хранения и перед использованием, и инструкции по проведению введения лекарственного средства способом, эффективным для лечения СРК или диареи. Если лекарственное средство используется для диареи, могут быть определенные инструкции для лечения одного или более подтипов СРК. Инструкции обычно представляют собой письменные инструкции на упаковочной вставке и/или на маркировке. В зависимости от типа лекарственной формы и назначенного способа введения набор также может включать приспособление для введения лекарственной формы. Лекарственные формы могут представлять собой любые подходящие лекарственные формы, описанные в настоящей заявке. Например, лекарственные формы могут представлять пероральную дозированную форму, содержащую однократную дозу выбранной соли N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида.
Набор может содержать множество лекарственных форм различной или одинаковой дозировки одного и того же агента. Набор также может содержать множество лекарственных форм различных активных агентов. Набор может содержать лекарственные формы, подходящие для последовательного, раздельного и/или одновременного использования при лечении СРК.
Части набора могут независимо содержаться в одном или более контейнерах, таких как флаконы, шприцы, планшеты, ячейки, блистерные упаковки или любой другой тип фармацевтической упаковки.
Также в набор могут быть включены инструкции, или в виде вставок или в виде маркировки, указывающие количества компонентов для введения, руководства по введению и/или руководства для смешивания компонентов. В инструкциях также могут быть указаны типичные побочные эффекты и противопоказания с инструкциями для прекращения введения при появлении побочных эффектов. Системы, подверженные влиянию лечения с использованием асимадолина, могут включать скелетно-мышечную, центральную и периферическую нервную систему, психиатрическую, желудочно-кишечную, мочеполовую, респираторную и организм в целом. Побочные эффекты могут включать констипацию, диарею, головную боль, тошноту, синусит, абдоминальную боль и головокружение.
F. Страховое Требование
Вообще, оформление страхового требования для оплаты данного медицинского обслуживания или лекарственной терапии включает в себя уведомление страховой компании или любой другой организации, которая выдала страховой полис, против которой зарегистрировано требование, что было проведено медицинское обслуживание или лекарственная терапия. Затем проводят определение того, были ли проведенное медицинское обслуживание или лекарственная терапия предусмотрены по условиям полиса. Если предусмотрены, то затем оформляется страховое требование, что включает оплату, возмещение или ходатайство против отчислений.
Настоящее изобретение охватывает способ оформления страхового требования по страховому полису для селективного модулятора опиоидного рецептора, предпочтительно периферически селективного модулятора опиоидного рецептора, более предпочтительно периферически селективного модулятора каппа-опиоидного рецептора и особенно периферически селективного агониста каппа-опиоидного рецептора или одной из его фармакологически приемлемых солей, используемых в лечении СРК и более предпочтительно в лечении подтипа СРК. Этот способ включает: 1) получение уведомления, что было проведено лечение или дано предписание о лечении с использованием указанного селективного модулятора опиоидного рецептора, периферически селективного модулятора опиоидного рецептора, периферически селективного модулятора каппа-опиоидного рецептора и периферически селективного агониста каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, и/или его фармакологически приемлемой соли, 2) определение того, покрывается ли указанным страховым полисом указанное лечение с использованием указанного селективного модулятора опиоидного рецептора, периферически селективного модулятора опиоидного рецептора, периферически селективного модулятора каппа-опиоидного рецептора и периферически селективного агониста каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, и/или его фармакологически приемлемой соли; и 3) оформление указанного требования для лечения СРК с использованием указанного селективного модулятора опиоидного рецептора, периферически селективного модулятора опиоидного рецептора, периферически селективного модулятора каппа-опиоидного рецептора и периферически селективного агониста каппа-опиоидного рецептора, N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, и/или его фармакологически приемлемой соли, включая оплату, возмещение или ходатайство против отчислений. Этот способ охватывает оформление требования для использования асимадолина для лечения СРК-П, СРК-Д и СРК-Н.
Подразумевается, что следующие примеры не ограничивают рамки пунктов формулы изобретения, но скорее описывают примеры определенных воплощений. Подразумевается, что любые вариации типичных способов, которые встречаются специалисту в данной области, попадают в рамки настоящего изобретения. Понятно, что определенные свойства изобретения, которые для ясности описаны в контексте отдельных воплощений, также могут быть представлены в комбинации в одном воплощении. Наоборот, различные свойства изобретения, которые для краткости описаны в контексте одного воплощения, также могут быть представлены отдельно или в любой подходящей субкомбинации.
ПРИМЕРЫ
Пример 1
Введение асимадолина по требованию применяют для лечения СРК-П
Проводили рандомизированное, с параллельными группами, двойное слепое, контролируемое с помощью плацебо исследование, оценивающее эффекты изменяемой дозы асимадолина (0,5 мг p.r.n. до 1,0 мг q.i.d. в течение четырех недель) или идентично представленного плацебо на ослабление боли и желудочно-кишечных симптомов у участников, страдающих СРК.
Исследуемая Популяция
Всего было вовлечено 155 пациентов, страдающих СРК. Критерии включения в исследование включали не беременных, не кормящих грудью женщин в возрасте 18-65 лет; наличие диагноза СРК по Римским критериям II; отсутствие симптомов боязни; приемлемый метод контрацепции; и абдоминальная боль или дискомфорт, составляющие, по меньшей мере, 40 мм по 100 мм-визуальной аналоговой шкале (VAS) в течение, по меньшей мере, 4 из 14 дней во время вводного периода, но не более чем 60 мм по шкале VAS в течение не более чем 10 из 14 дней во время вводного периода. Критерии исключения из исследования включали гиперчувствительность к асимадолину или опиоидным агонистам; алкогольное или наркотическое злоупотребление, прежнее желудочно-кишечное хирургическое вмешательство (за исключением холецистэктомии, аппендэктомии или гистерэктомии); структурные или метаболические состояния, которые влияют на желудочно-кишечную систему; клинически значимые аномальные лабораторные значения при визите во время отбора; невозможность отказа от лекарственных средств, которые изменяют транзит пищи по желудочно-кишечному тракту, которые ингибируют CYP 3A4 и 2D6, от бензодиазепинов или любых анальгетиков.
Из 155 исходных субъектов 30 не прошли отбор, 13 не прошли рандомизацию, 9 отозвали согласие, 3 имели сопутствующее заболевание, 2 ушли на последующей стадии, и 1 отозвал согласие после рандомизации. 97 субъектов завершили исследование.
Протокол был одобрен IRB, и письменная информация о согласии была получена ото всех участников перед вовлечением в исследование.
Протокол Исследования
При визите во время отбора проводили собеседование, медосмотр, ЭКГ, стандартные лабораторные тесты, анкетирование по желудочно-кишечным заболеваниям [BDQ (Hahn et al., (1998) Dig. Dis. Sci. 43, 27145-2718)], выясняли боязнь стационара и степень депрессии [HADS (Zigmond & Snaith (1983) Acta Psychiatr Scand., 67(6), 361-70)] и анкетирование на предмет качества жизни [IBS QoL (Patrick et al., (1998) Dig Dis Sci., 43, 400-11)], и пациенты получали дневники для записи ежедневного состояния боли и других симптомов СРК. Через 2-недельный вводный период, необходимый для установления симптомов в исходной точке, пациентов, имеющих все критерии для входа в исследование, рандомизировали, и они получали исследуемое лекарственное средство или плацебо в течение двойного слепого периода лечения, составляющего четыре недели. Центр проведения клинического исследования был скрыт. Участники возвращались в исследовательский центр через две недели лечения и проводили ЭКГ и стандартные клинические лабораторные тесты. Пациенты возвращались через четыре недели лечения и проводили ЭКГ и стандартные клинические лабораторные тесты, заполняли анкеты BDQ, HADS и IBS QoL и собирали дневники с записями о состоянии боли и функционировании кишечника.
Во время двойного слепого периода лечения пациентов инструктировали как заполнять дневник по степени тяжести боли по шкале VAS всякий раз, когда они чувствовали боль, по меньшей мере, средней интенсивности в первый раз в течение дня, перед приемом первой дозы исследуемого лекарственного средства в течение того дня. Через два часа после приема лекарственного средства степень тяжести боли по шкале VAS оценивали снова. Если боль удавалось контролировать в достаточной степени в течение оставшейся части дня, это записывали в дневник. Если боль не удавалось контролировать в достаточной степени, пациентам разрешался повторный прием лекарственного средства (0,5-1,0 мг), но не ранее чем через четыре часа после предыдущей дозы. Пациентам разрешался прием до двух таблеток одновременно, до четырех таблеток в день.
Также собирали данные о частоте стула, консистенции [Бристольская Шкала Формы Стула (Heaton et al., (1991) Gut, 32(1), 73-9)], ежедневной легкости отхождения стула [адъективная шкала из 7 пунктов (Coulie et al., (2000) Gastroenterology, 119, 41-50)] и ежедневном приемлемом ослаблении (Camilleri et al., (2000) Lancet, 355, 1035-40) боли и дискомфорта, вызванными СРК, (двойной общий ожидаемый результат).
Отслеживание Безвредности
Побочные эффекты отслеживали в центре проведения клинического исследования ежедневно, пациенты получали номера телефонов для контактирования с исследователями, проводящими клиническое исследование, для сообщения о любых побочных эффектах. Дополнительный визит осуществляли через 2 недели после окончания двойного слепого периода лечения для дополнительного учета любых наблюдаемых аномалий при предыдущих визитах и для проведения медосмотра и повторного анкетирования BDQ.
Анализ Данных
Начальная оценка ожидаемых результатов в течение анализа заключалась в среднем уменьшении тяжести боли через 2 часа после первой дозы каждый день, когда участник испытывал, по меньшей мере, умеренную боль. По существу, записывали изменение интенсивности боли перед приемом и через два часа после приема первой дозы каждый день, которое составило, по меньшей мере, 30 мм по шкале VAS. Для каждого из этих дней уменьшение боли после первой дозы рассчитывали по формуле Различие Интенсивности Боли (PID) = Боль2ч - Боль0ч. Среднее уменьшение боли в эти дни рассчитывали по формуле: сначала суммировали все значения PID в течение периода лечения и делили этот результат на количество дней, в которые пациент испытывал боль при использовании лекарственного средства. Вторичная оценка ожидаемых результатов представляла собой оценку максимальной боли в течение дня каждый день (пять точек шкалы VAS), ежедневную оценку частоты стула (количество), ежедневную оценку консистенции стула (Бристольская шкала стула), ежедневную оценку легкости отхождения стула (адъективная шкала из 7 пунктов, ежедневную оценку приемлемого ослабления боли и дискомфорта, вызванными СРК, (двойной общий ожидаемый результат, анализированный как одновременно недискретная пропорция дней для субъекта и как дискретный номинальный ответ, >50% дней с приемлемым ослаблением), а также оценивали BDQ, HADS и качество жизни при синдроме раздраженного кишечника в начальной точке и конечной точке исследования.
Статистический Анализ
Эффекты лечения на первичную и вторичную оценку ожидаемых результатов оценивали с использованием ковариационного анализа (ANCOVA), вводящего соответствующие ковариаты (например, возраст, исходная тяжесть боли по бальной оценке VAS, пропорция дней с болью и исходная бальная оценка боязни HAD для анализа различий интенсивности боли). Вторичные анализы также проводили с вводом в качестве ковариаты преобладающего в функционировании кишечника подтипа СРК наряду с обработкой члена, характеризующего взаимодействие, в модели ANCOVA. Для первичного анализа после получения ожидаемых результатов для модели на основе популяции всех пациентов, прошедших рандомизацию (ITT), следовал ввод отсутствующих значений для ожидаемых результатов с использованием соответствующих общих средних значений (субъектов, у которых не было отсутствующих значений). Последующее регулирование ошибки степеней свободы для модели ANCOVA проводили путем вычитания одной степени свободы для каждого отсутствующего значения, введенного с целью получения подходящего отклонения остаточной ошибки для тестируемых эффектов лечения. Суммарные значения представлены в виде указанных средних значений выборки (IQR) или среднего значения (±SE).
РЕЗУЛЬТАТЫ
Исходные Симптомы и Демографические Данные
Шестьдесят субъектов рандомизировали для получения лечения по требованию с помощью асимадолина и сорок субъектов рандомизировали для получения лечения с помощью плацебо, как показано в Таблице 1A.
Демографические данные участников
(n=100)
(n=60)
n=40
Интервал
18-67
Интервал
18-67
Интервал
18-66
В Таблицах 1A и 1B суммированы характеристики субъектов, принимавших в течение четырех недель активное участие в испытании. Группу лечения и группу плацебо сравнивали по возрасту, подтипу СРК, желудочно-кишечным симптомам, бальной оценке боязни и депрессии и по бальным оценкам связанного с СРК качества жизни. На основе исходной BDQ-характеризации симптомов и истории болезни пациентов было представлено 39 случаев перемежающегося поведения кишечника, 27 с преобладанием констипации и 33 с преобладанием диареи (один субъект не смогли классифицировать); они были приблизительно одинаково рандомизированы для получения различного лечения, за исключением того, что было немного больше пациентов с СРК-Д для получения асимадолина по отношению к пациентам с СРК-Д для получения плацебо.
Исходные симптомы (среднее значение выборки и IQR или среднее значение + SEM)
Прием Лечения в течение 4-Недельного Испытания
Общее среднее число таблеток асимадолина или плацебо, используемых во время периода лечения, составило 14,5 (IQR=8,0 до 24,5): Среднее число таблеток плацебо 13,5 (IQR=9,5 до 19,5), Среднее число таблеток асимадолина 16,5 (IQR=8,0 до 25,5). Число таблеток в день, используемых при боли, составило 1,62 (1,18-1,83) для асимадолина, и 1,43 (1,08-1,88) для группы плацебо.
Эффект Исследуемого Лекарственного Средства, Получаемого По Требованию, на Абдоминальную Боль в Подгруппах СРК Согласно Преобладающему Поведению Кишечника
Значительное лечение взаимодействующих подтипов детектировали (p=0,004) по балльной оценке дельта интенсивности боли. Было больше оценок дельта в бальной оценке боли для субъектов, страдающих СРК-П, при лечении асимадолином по отношению к лечению с помощью плацебо. Парные сравнения (не регулированные) показали значительные различия в СРК-П (p=0,003), подтверждающие, что асимадолин был значительно лучше, чем плацебо у альтернативной группы (смотри Таблицу 2А, В, и С и ФИГ.1A). Не детектировали эффектов лечения взаимодействующих подтипов СРК по пропорциям дней с приемлемым ослаблением боли (смотри ФИГ.1B), хотя субъекты, страдающие СРК-К, обладали по существу меньшими пропорциями дней с приемлемым ослаблением, чем субъекты, страдающие другими двумя подтипами СРК (т.e. детектировали общий главный эффект подтипа, p=0,001). Таким образом, по-видимому, лекарственное средство является более эффективным при ослаблении симптомов СРК-П.
Функционирование кишечника при различных подтипах анализировали после коррекции для изменения относительно исходной точки благодаря плацебо, и оно продемонстрировано на ФИГ.2. Изменение частоты стула в день изображено на графике против времени в неделях. Наблюдали увеличение частоты стула в день для обоих подтипов, СРК-К и СРК-П, и наблюдали уменьшение для СРК-Д, что указывает на то, что асимадолин нормализует функционирование кишечника при различных подтипах СРК.
A. Функционирование кишечника относительно исходной точки исследования на основе преобладающего функционирования кишечника по данным анкеты
Реакция в виде Боязни и Депрессии
Бальная оценка боязни умеренно подвергалась влиянию с помощью лечения асимадолина (p=0,053), но числовые различия были небольшими (смотри Таблицу 1B).
Побочные Эффекты
Не наблюдали серьезных клинических или лабораторных побочных эффектов. Побочные эффекты, о которых сообщали более чем три раза, группировали по категориям, продемонстрированным в Таблице 3, побочные эффекты были похожи в каждой группе, за исключением большого числа желудочно-кишечных осложнений, о которых сообщали в группе плацебо.
Побочные эффекты (%)
В этом исследовании эффект на СРК-П наблюдали, когда пациентов анализировали по подтипу. Анализ продемонстрировал больше изменений в бальной оценке боли при лечении асимадолином против плацебо у пациентов, страдающих СРК с перемежающимся функционированием кишечника. Асимадолин хорошо переносился без замеченных значительных побочных эффектов.
Пример 2
Введение асимадолина с фиксированной дозой эффективно для лечения СРК-Д и СРК-П
Проводили 12-недельное рандомизированное, двойное слепое, с регулируемой дозой, контролируемое с помощью плацебо исследование, оценивающее эффекты фиксированной дозы асимадолина (0,15 мг, 0,5 мг или 1 мг b.i.d.) или идентично представленного плацебо на ослабление боли и желудочно-кишечных симптомов у участников, страдающих СРК.
Исследуемая Популяция и Протокол
Пациенты, страдающие СРК с преобладанием диареи (СРК-Д), с преобладанием констипации (СРК-К), и перемежающимся типом СРК, подвергались двухнедельному отбору для гарантирования приемлемых симптомов и согласия с системой сбора данных в виде системы интерактивного голосового взаимодействия (IVRS), которая следовала за 12-недельным лечением и последующим четырехнедельным периодом. Пациенты получали идентично представленный плацебо, 0,15 мг, 0,5 мг или таблетки асимадолина в количестве 1 мг b.i.d. в течение периода 12 недель. Во время отбора, лечения и последующего периода пациенты вводили данные каждый день на IVRS.
Первичные ожидаемые результаты представляли собой количество месяцев, когда пациент отвечал приемлемым ослаблением боли, где первичный критерий представлял собой вопрос, "В последние 7 дней вы испытывали приемлемое ослабление вашей боли или дискомфорта, связанных с СРК?" Этот критерий запрашивался один раз каждые 7 дней, и ежемесячно респондент отвечал "да", по меньшей мере, в течение 3 недель в месяц. Также собирали многочисленные вторичные ожидаемые результаты, такие как абдоминальная боль или дискомфорт, частота стула, крайняя необходимость стула, вздутие, консистенция стула, приемлемое ослабление симптомов СРК и затруднение стула. Дополнительно собирали побочные клинические эффекты, данные лабораторных тестов и электрокардиограммы (ЭКГ).
Исходные Симптомы и Демографические Данные
В целом проводили рандомизацию из 596 субъектов. Приблизительно 33% субъектов характеризовали с помощью перспективно определенных критериев как страдающих СРК-Д, 37% СРК-К и 31% СРК-П. 445 субъектов рандомизировали для лечения с регулированием дозы асимадолина и 151 субъект рандомизировали для приема плацебо. 451 субъект завершил 12-недельную активную часть испытания, а также последующий четырехнедельный период. Из тех, кто завершил испытание, 344 субъекта рандомизировали для приема различных доз асимадолина и 107 субъектов рандомизировали для приема плацебо. Демографические характеристики субъектов, кто завершил все испытание, продемонстрированы в Таблице 4A.
Демографические Данные Участников
Таблицы 4A и 4B суммируют характеристики субъектов, кто завершил 12-недельную активную часть испытания. Три группы лечения и группу плацебо, как правило, были сравнимы по возрасту, полу, подтипу СРК, бальным оценкам боли, а также по частоте, консистенции и крайней необходимости стула. На основе исходной BDQ-характеристики симптомов и истории болезни пациентов у 142 пациентов имело место перемежающееся поведение кишечника, у 164 преобладала констипация и у 145 преобладала диарея. Субъекты были приблизительно одинаково рандомизированы для получения различного лечения, за исключением того, что было немного больше пациентов с СРК-П для получения различных доз асимадолина по отношению к пациентам для получения плацебо.
Исходные симптомы
(% дней)
РЕЗУЛЬТАТЫ
Выводы
Из 596 рандомизированных субъектов 344 сообщали об исходной бальной оценке боли, составляющей 2 или выше. Бальная оценка проводилась самостоятельно по шкале 0-3, где 0 = нет боли, 1 = слабая боль, 2 = умеренная боль и 3 = тяжелая боль. Субъектов, имеющих бальную оценку 2 или выше, относили к категориям, имеющим умеренную или тяжелую боль. Из 344 субъектов с умеренной или тяжелой болью 104 классифицировали как имеющих СРК-Д, 114 - СРК-П и 126 - СРК-К.
Среди субъектов с умеренной или тяжелой болью наблюдали 17%-ное улучшение (23% vs. 40%) в процентном содержании месяцев с приемлемым ослаблением при обоих уровнях дозы, 0,5 мг (p=0,006) и 1 мг (p=0,005). Оценка субъектов по подтипу СРК обнаружила благоприятное действие на субъектов, страдающих СРК-Д и СРК-П (сравните ФИГ.3A с 3B). Среди субъектов, страдающих СРК-Д, наблюдали значительное увеличение процентного содержания месяцев с приемлемым ослаблением при дозе 0,5 мг по сравнению с плацебо (20% vs. 47%, p=0,011) и среди субъектов, страдающих СРК-П, 1 мг дозы по сравнению с плацебо (27% vs. 50%, p=0,022). Среди субъектов, страдающих СРК-Д, наблюдали значительное улучшение по части снижения крайней необходимости стула, адекватное ослабление симптомов СРК, частоты стула, вздутия и ежедневной боли при дозе 0,5 мг. Наблюдали значительное улучшение по части ослабления боли на 3 неделе, которое продолжалось на протяжении всех 12 недель лечения. Наблюдали благоприятное воздействие одновременно на пациентов-женщин и пациентов-мужчин. Не наблюдали благоприятного действия на боль у субъектов, страдающих СРК-К.
Эффект Лечения с помощью Асимадолина на Абдоминальную Боль или Дискомфорт в Подгруппах СРК Согласно Преобладающему типу Поведения Кишечника
У субъектов, страдающих СРК-Д, с умеренной или тяжелой болью наблюдали статистически значимое увеличение пропорции месяцев с приемлемым ослаблением при дозе асимадолина 0,5 мг по сравнению с плацебо (20% vs. 47%, p=0,011; смотри ФИГ.3B). Это улучшение сравнивали подходящим образом с результатами, полученными из двух испытаний Фазы III средства ЛОТРОНЕКСТМ (алосетрон) (смотри ФИГ.4). Лотронекс I относится к данным, полученным у Camilleri, et al., Lancet 2000, 355(9209): 1035-1040; Лотронекс II относится к данным, опубликованным у Camilleri, et al., Arch. Intern. Med. 2001, 161(14):1733-1740.
Статистически значимый эффект лечения с помощью асимадолина с дозой 0,5 мг по отношению к плацебо наблюдали на протяжении большей части из 12-недельного испытания, начиная с недели 2 (смотри ФИГ.5A). Кроме того, лечение с помощью асимадолина с дозой 0,5 мг приводило в результате к более быстрому и более значительному улучшению боли или дискомфорта, связанных с СРК, у субъектов, страдающих СРК-Д, на протяжении 12-недельного испытания, чем подобных субъектов с помощью ЛОТРОНЕКСАТМ (алосетрон), как опубликовано у Camilleri, et al., Arch. Intern. Med. 2001, 161(14):1733-1740 (ФИГ.5B).
Важно, что лечение с помощью асимадолина с дозой 0,5 мг получало результаты с высокой степенью подобия для субъектов-женщин и субъектов-мужчин, страдающих СРК-Д (смотри ФИГ.6A). Этот результат является значительным, поскольку в настоящее время не существует лекарственных средств, одобренных для лечения СРК-Д у пациентов-мужчин.
Количество дней без боли продемонстрировало улучшение на неделе 1, которое оставалось значительным в период 2-12 недель (смотри ФИГ.6B). Ранняя эффективность указывает на то, что асимадолин может применяться для кратковременного и долгосрочного лечения. Улучшение по части процентного содержания дней без боли наблюдали для доз асимадолина, составляющих 0,15, 0,5 и 1 мг (смотри ФИГ.6C). При дозе 0,5 мг наблюдали улучшение процентного содержания дней без боли над плацебо, составляющее 30%. Это гораздо выше, чем 10%-ное улучшение процентного содержания дней без боли, наблюдаемое при использовании ЛОТРОНЕКСАТМ, как опубликовано у Bardhan et al., Aliment Pharmacol Ther 2000;14:23-34.
Статистически значимое улучшение бальных оценок боли наблюдали каждую неделю (начиная с недели 3) и каждый месяц у субъектов, страдающих СРК-Д, получавших 0,5 мг асимадолина (смотри ФИГ.8A и B). Подобным образом, наблюдали статистически значимое улучшение бальных оценок боли каждый месяц и в течение шести из двенадцати недель испытания у субъектов, страдающих СРК-Д, получавших 1 мг асимадолина (смотри ФИГ.8A и B). Согласно этим результатам наблюдали статистически значимое увеличение процентного содержания ежемесячных респондентов, страдающих СРК-Д, подвергнутых лечению с помощью 0,5 мг асимадолина, в течение всех трех месяцев лечения (20% vs. 48%, p=0,045 в месяц 1 и 18% vs. 52%, p=0,010 в месяц 2 и 27% vs. 50%, p=0,010 в месяц 3; смотри ФИГ.9A). Не наблюдали никакого статистически значимого улучшения по части бальной оценки боли у субъектов, страдающих СРК-П, при этих дозировках (ФИГ.8C).
У субъектов, страдающих СРК-П, с умеренной или тяжелой болью наблюдали статистически значимое увеличение пропорции меясцев с приемлемым ослаблением боли при дозе 1 мг по сравнению с плацебо (27% vs. 50%, p=0,022; смотри ФИГ.7A). Согласно этим результатам наблюдали статистически значимое увеличение процентного содержания ежемесячных респондентов, страдающих СРК-П, подвергнутых лечению с помощью 1 мг асимадолина, в первый месяц лечения (19% v. 46%, p=0,017; смотри ФИГ.9B). Не наблюдали никакого статистически значимого эффекта по части бальной оценки боли у субъектов, страдающих СРК-П, подвергнутых лечению с помощью 1 мг асимадолина.
У субъектов, страдающих СРК-К, с умеренной или тяжелой болью не наблюдали статистически значимого улучшения по части ослабления абдоминальной боли или дискомфорта, ассоциированных с СРК (смотри ФИГ.7B).
Эффект Лечения с помощью Фиксированной Дозы Асимадолина на Симптомы СРК в Подгруппах СРК Согласно Преобладающему типу Поведения Кишечника
У субъектов, страдающих СРК-Д, с умеренной или тяжелой болью наблюдали статистически значимое улучшение по части приемлемого ослабления симптомов СРК, крайней необходимости стула, частоты стула и вздутия при дозе асимадолина 0,5 мг. Таким образом, статистически значимое улучшение всех симптомов СРК наблюдали у субъектов, страдающих СРК-Д, подвергнутых лечению с помощью 0,5 мг (23% vs. 47%, p=0,038; смотри ФИГ.10A) или 1 мг асимадолина (23% vs. 43%, p=0,039; смотри ФИГ.10A). Подобным образом, статистически значимое улучшение всех симптомов СРК наблюдали у субъектов, страдающих СРК-П, подвергнутых лечению с помощью 1 мг асимадолина (30% vs. 57%, p=0,032; ФИГ.10B).
Дополнительно, наблюдали резкое уменьшение ежедневной частоты стула у субъектов, страдающих СРК-Д, с умеренной или тяжелой болью, подвергнутых лечению с помощью 0,5 мг асимадолина, начиная с недели 3 и с продолжением до окончания лечения (смотри ФИГ.11A и B). Согласно этому результату сообщалось о статистически значимом снижении крайней необходимости стула у пациентов, страдающих СРК-Д с умеренной или тяжелой болью, подвергнутых лечению с помощью 0,5 мг или 1 мг асимадолина, в течение всех трех месяцев лечения (смотри ФИГ.12). Значительное снижение вздутия также наблюдали у пациентов, страдающих СРК-Д с умеренной или тяжелой болью, подвергнутых лечению с помощью 0,5 мг асимадолина, на второй и третий месяцы лечения (смотри ФИГ.13).
Хотя не наблюдали статистически значимых изменений консистенции стула у субъектов, страдающих СРК-Д и СРК-К, при любой из трех дозировок, по-видимому, асимадолин смягчает стул субъектов, страдающих СРК-К, и делает более твердым стул субъектов, страдающих СРК-Д, посредством чего нормализуется консистенция стула (смотри ФИГ.14A и B).
Побочные Эффекты
Не наблюдали никаких серьезных клинических или лабораторных побочных эффектов, связанных с лечением. Шесть побочных эффектов встречалось с частотой, по меньшей мере, 5%. Никакие побочные эффекты не продемонстрировали дозозависимого увеличения степени лечения. Как правило, побочные эффекты встречались более часто при самой низкой дозе асимадолина, чем при более высоких дозах. Наиболее распространенные побочные эффекты суммированы в Таблице 5.
Побочные эффекты (%)
В этом исследовании в результате лечения с помощью асимадолина с фиксированной дозой получили значительное улучшение состояния пациентов, страдающих СРК-Д с умеренной или тяжелой болью, по многим параметрам, включающим: боль, крайнюю необходимость стула и частоту стула, вздутие и все симптомы СРК. Эти эффекты исходно наблюдали в течение первого месяца лечения и продолжали наблюдать на протяжении трех месяцев лечения. Также наблюдали благоприятное действие на пациентов, страдающих СРК-П, по части ключевых ожидаемых результатов приемлемого ослабления боли и приемлемого ослабления симптомов. По-видимому, асимадолин хорошо переносится без побочных эффектов, встречающихся дозозависимым образом.
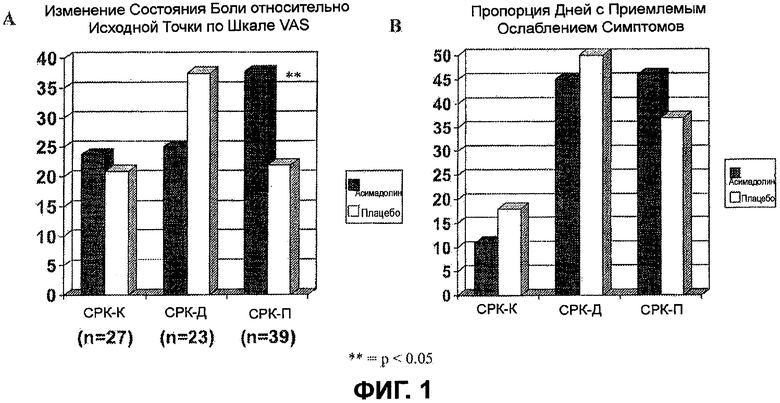
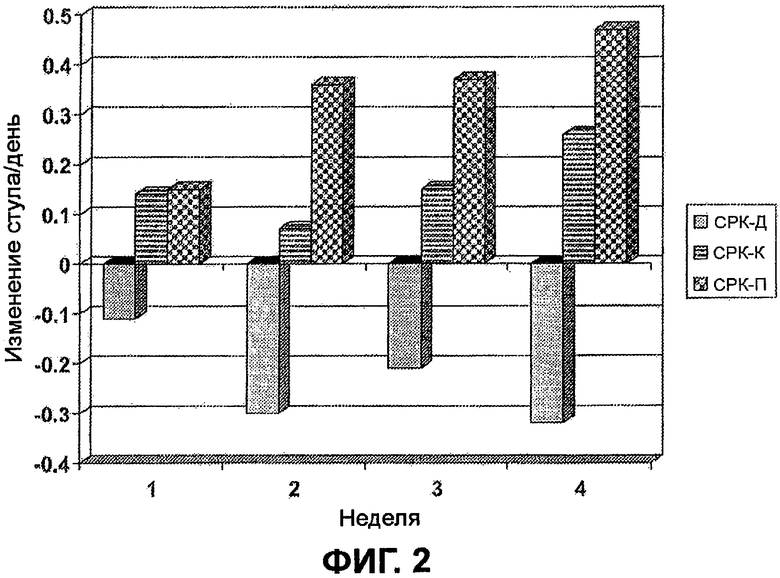
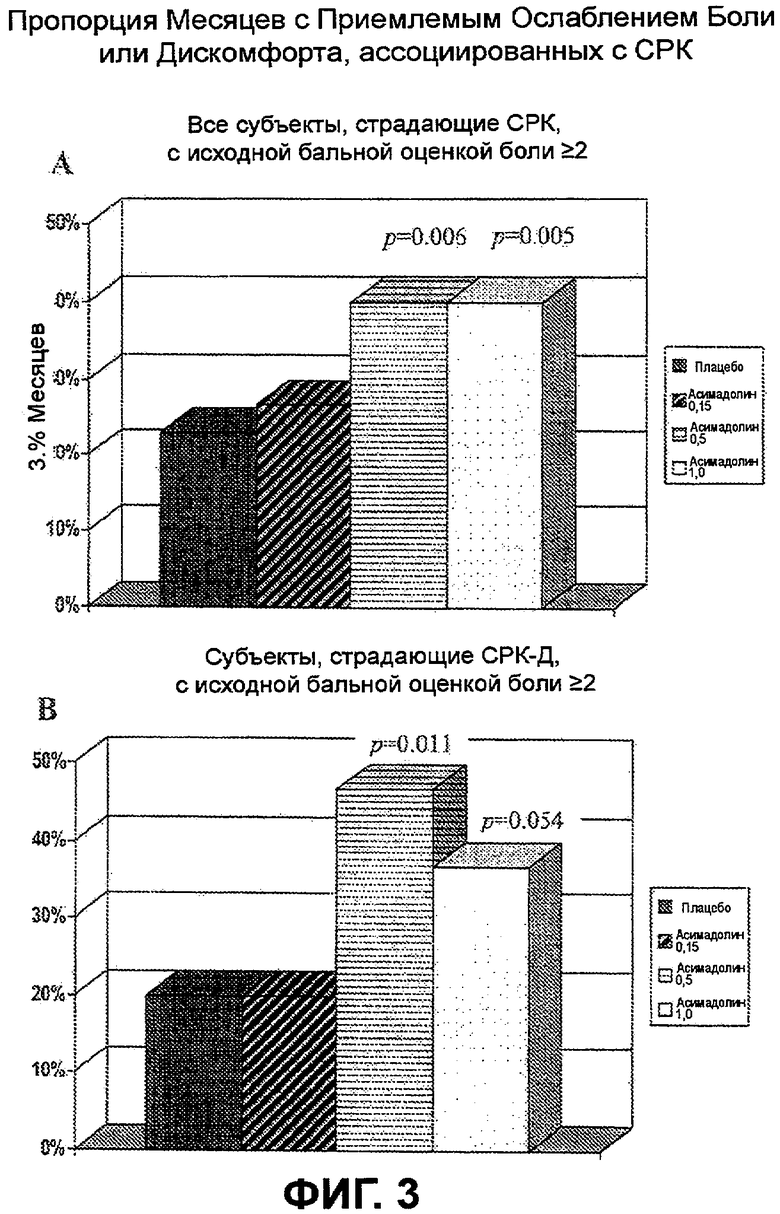
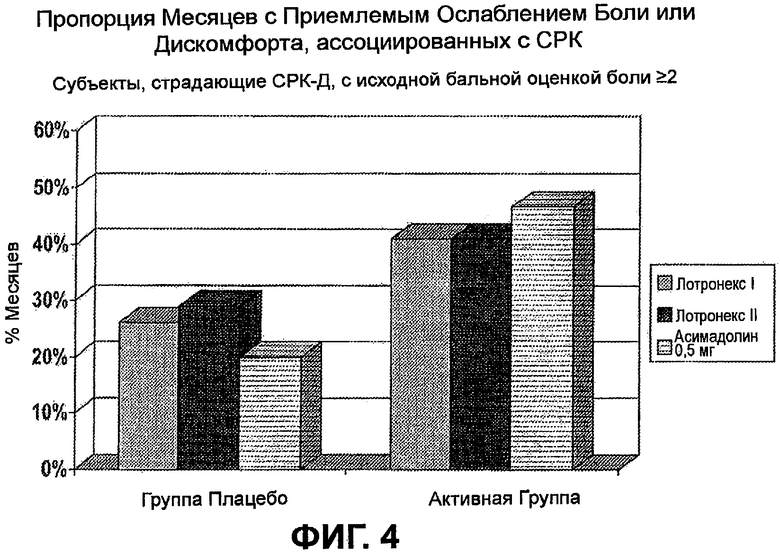
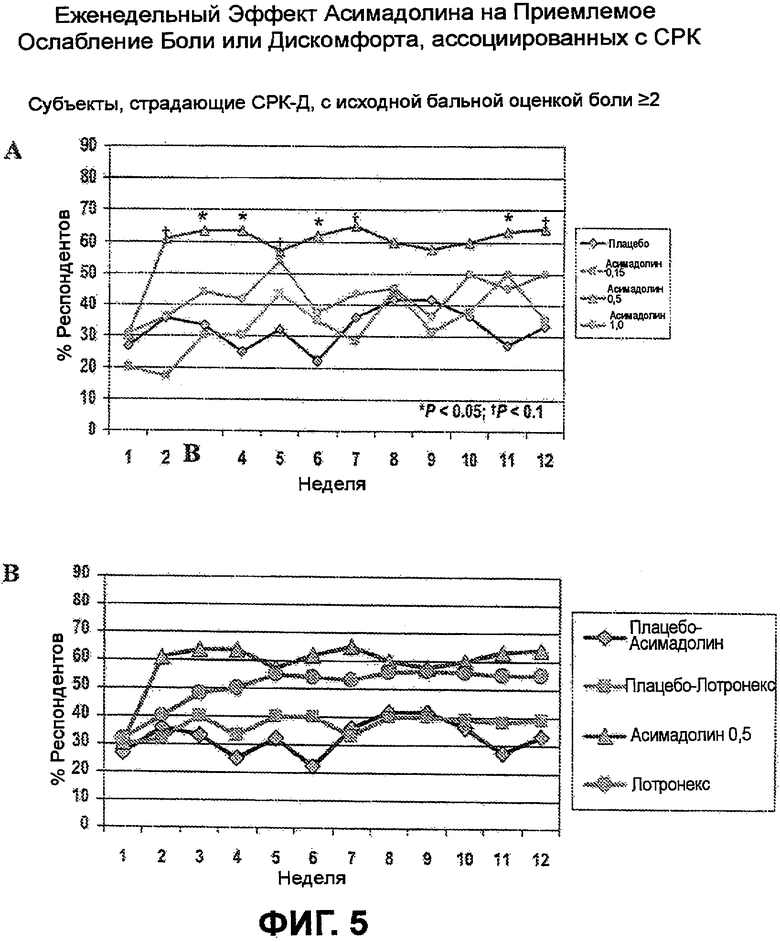
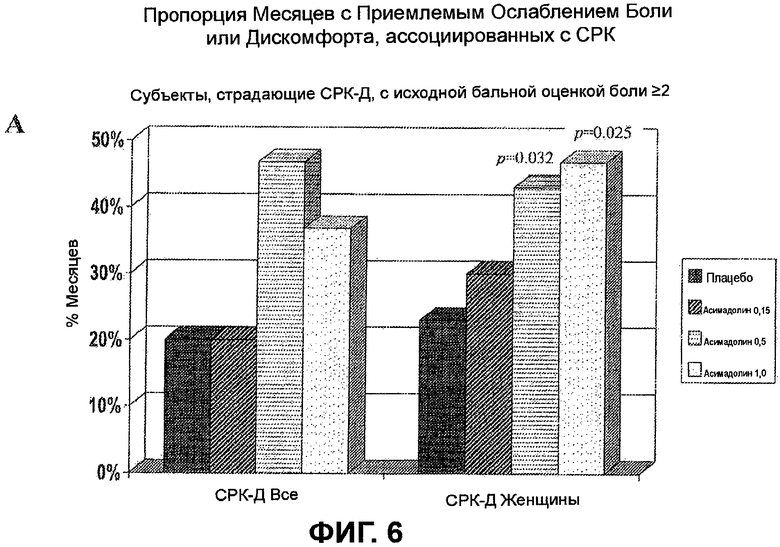
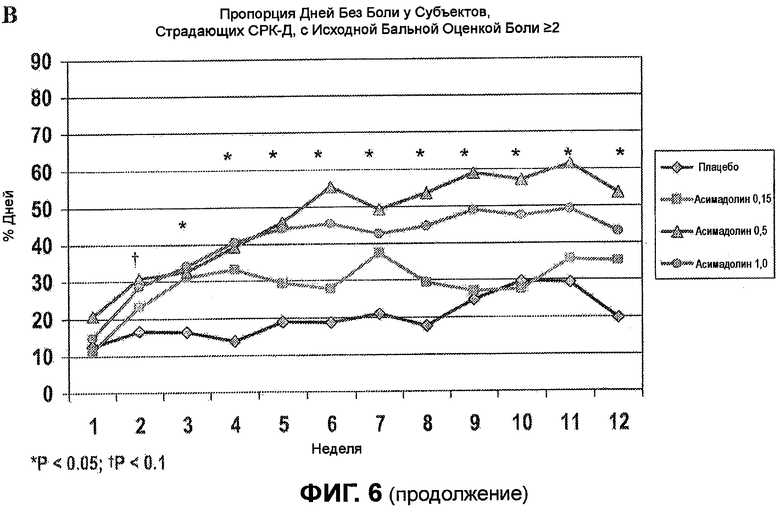
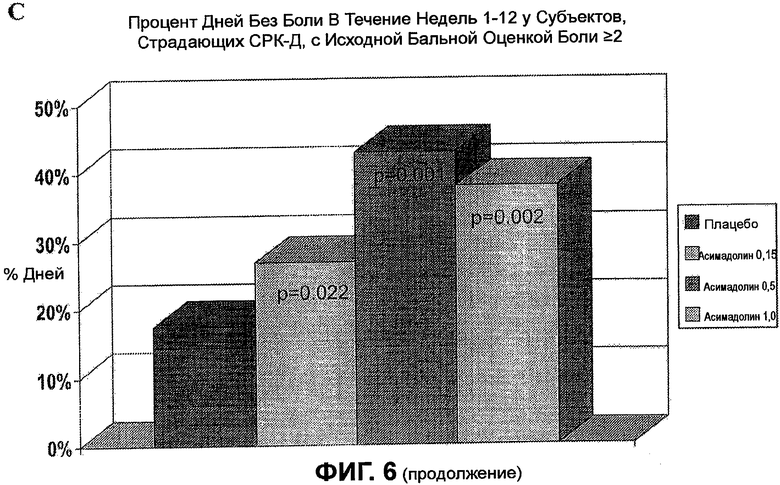
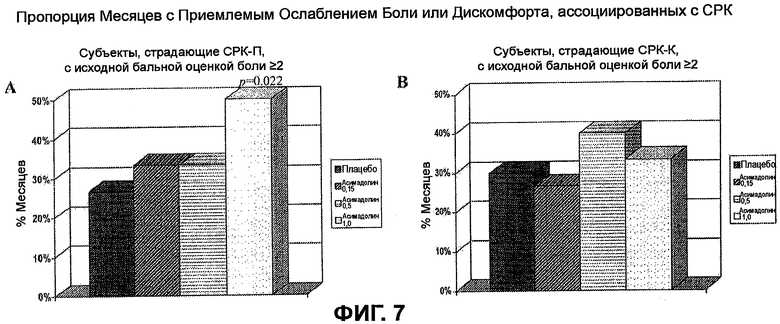
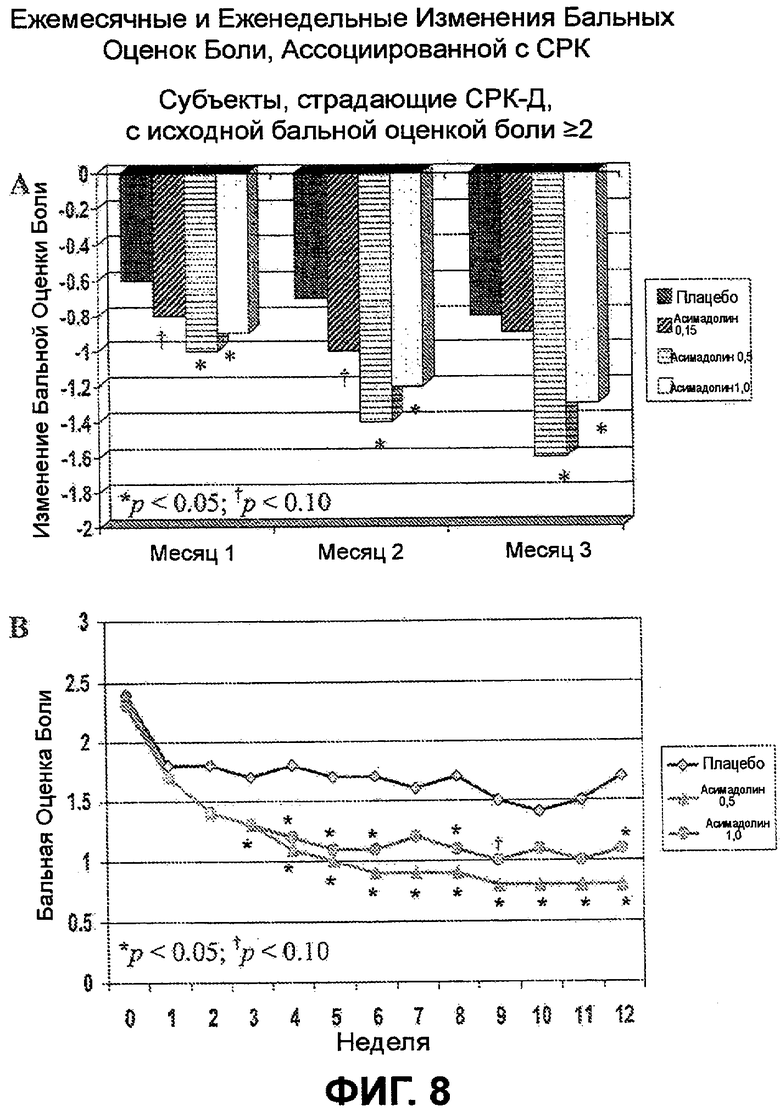
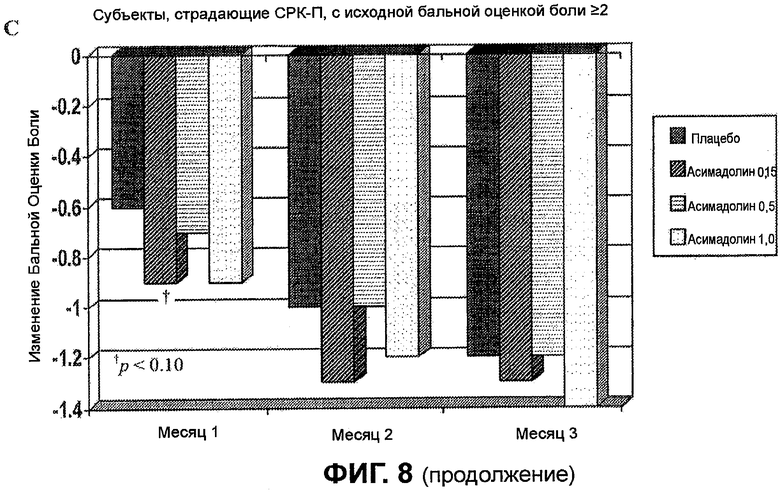
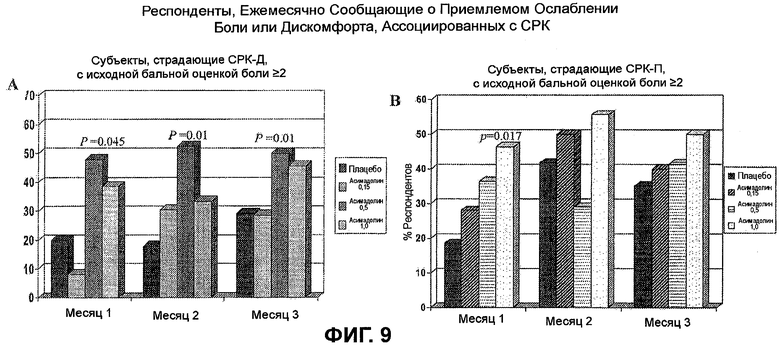
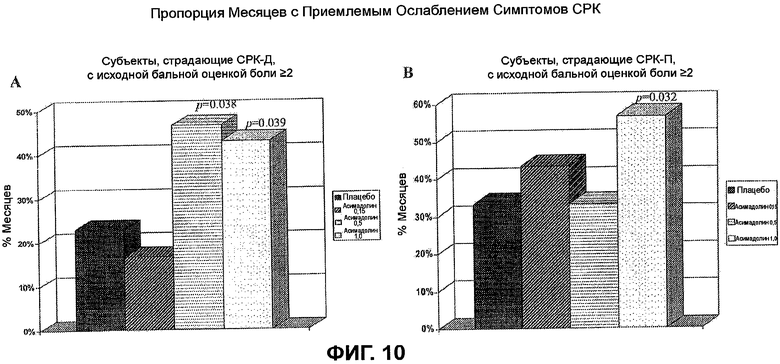
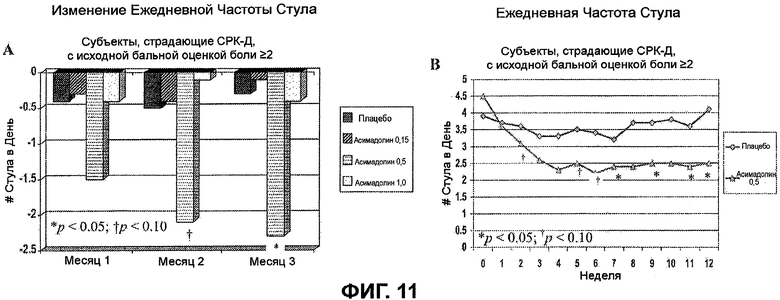
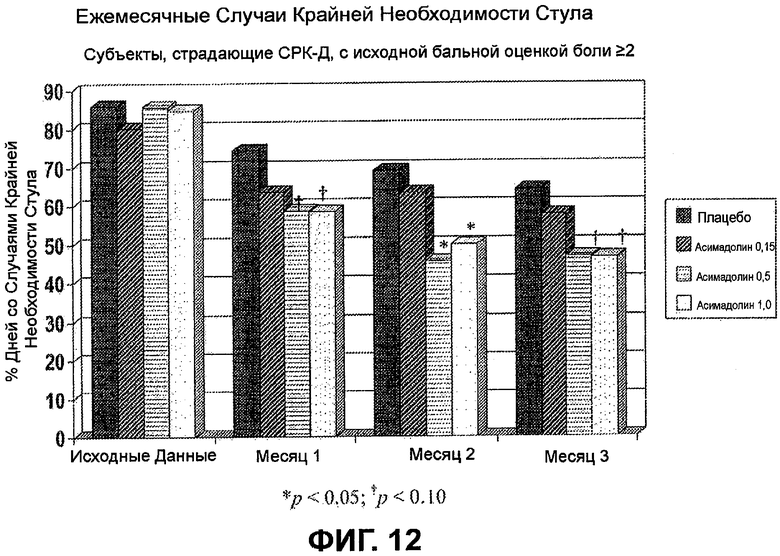
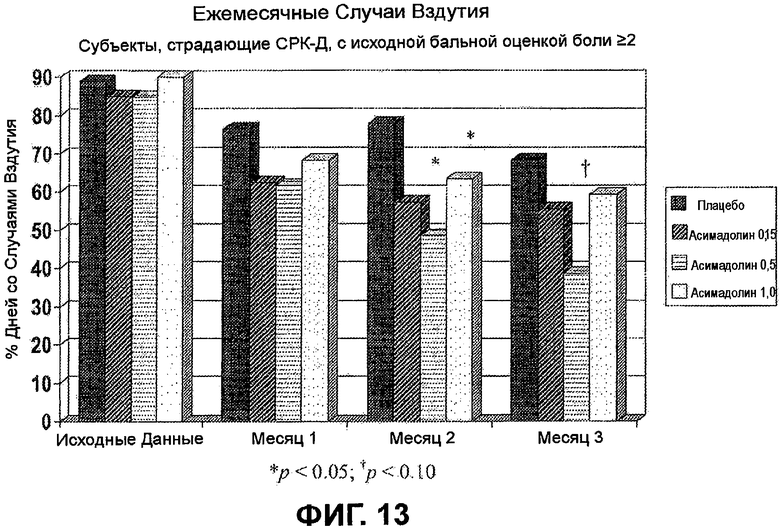

Группа изобретений относится к медицине и предназначена для лечения диареи или синдрома раздраженного кишечника (СРК) с преобладанием диареи (СРК-Д (IBS-D)) или СРК с перемежающимися диареей и констипацией (СРК-П (IBS-A)). Примененяют периферически селективный агонист каппа-опиоидов, в частности N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармацевтически приемлемую соль. Доза от 0,3 мг до 2,0 мг в день. Группа изобретений позволяет уменьшить симптомы СРК и уменьшить частоту стула при диарее. 5 н. и 23 з.п. ф-лы, 5 табл., 14 ил.
1. Применение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли для изготовления фармацевтической композиции для лечения синдрома раздраженного кишечника с преобладанием диареи (СРК-Д).
2. Применение по п.1, где соединение представляет собой N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид.
3. Применение по п.2, где лечение ослабляет боль и дискомфорт.
4. Применение по п.2, где лечение нормализует перистальтику кишечника.
5. Применение по п.2, где указанное лечение ослабляет, по меньшей мере, один симптом СРК, где симптом выбран из группы, состоящей из аномального ощущения крайней необходимости стула, аномальной частоты стула, аномальной формы стула, аномального отхождения стула, отхождения слизи и ощущения метеоризма или вздутия живота.
6. Применение по п.2, где субъект представляет собой млекопитающее.
7. Применение по п.2, где субъект представляет собой человека.
8. Применение по п.1, где вводят от примерно 0,3 мг до примерно 2 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
9. Применение по п.1, где вводят примерно 1,0 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
10. Применение по п.1, где вводят примерно 2,0 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
11. Применение по п.1, где вводят две дозы по примерно 0,5 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорида.
12. Применение по п.1, где вводят две дозы по примерно 1,0 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорида.
13. Применение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли для изготовления фармацевтической композиции для лечения синдрома раздраженного кишечника с перемежающимися диареей и констипацией (СРК-П).
14. Применение по п.13, где соединение представляет собой N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид.
15. Применение по п.13, где указанное лечение ослабляет, по меньшей мере, один симптом СРК, где симптом выбран из группы, состоящей из аномального ощущения крайней необходимости стула, аномальной частоты стула, аномальной формы стула, аномального отхождения стула, отхождения слизи и ощущения метеоризма или вздутия живота.
16. Применение по п.13, где субъект представляет собой млекопитающее.
17. Применение по п.13, где субъект представляет собой человека.
18. Применение по п.13, где вводят от примерно 0,3 мг до примерно 2 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
19. Применение по п.13, где вводят примерно 1,0 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
20. Применение по п.13, где вводят примерно 2,0 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
21. Применение по п.13, где вводят две дозы по примерно 0,5 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорида.
22. Применение по п.13, где вводят две дозы по примерно 1,0 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорида.
23. Применение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли для изготовления фармацевтической композиции для лечения диареи.
24. Применение по п.23, где вводят от примерно 0,3 мг до примерно 2 мг в день N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и/или его фармакологически приемлемой соли.
25. Набор, включающий эффективное количество фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармацевтически приемлемую соль, и инструкцию по введению указанного соединения субъекту, страдающему СРК-Д или СРК-П.
26. Набор по п.25, где фармацевтическая композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид.
27. Набор, включающий эффективное количество фармацевтической композиции, включающей N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид и/или его фармацевтически приемлемую соль, и инструкцию по введению указанного соединения субъекту, имеющему диарею.
28. Набор по п.27, где фармацевтическая композиция включает N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида гидрохлорид.
| RU 2005134359, 10.06.2006 | |||
| US 2005176746, 11.08.2005 | |||
| US 2004122230, 24.06.2004 | |||
| ЗВЯГИНЦЕВА Т.Д | |||
| Синдром раздраженного кишечника, медицинская газета Здоровье Украины, №73, июнь 2003 года, онлайн [найдено 01.04.11] [найдено из Интернет] http//health-ua.com/articles/245.html | |||
| GREENWOOD-VAN М | |||
| В, Comparison of the antidiarrheal effects of wood |
Авторы
Даты
2012-02-10—Публикация
2008-03-07—Подача