ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данная заявка содержит перечень последовательностей в машиночитаемой форме, который включен в данный документ с помощью ссылки.
ССЫЛКА НА АТОМНЫЕ КООРДИНАТЫ
В данной заявке на фигуре 6 изложены атомные координаты трехмерной структуры лизоцима Acremonium alkalophilum CBS114.92.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к полипептидам с лизоцимной активностью, каталитическим доменам и полинуклеотидам, кодирующим полипептиды и каталитические домены. Настоящее изобретение также относится к конструктам нуклеиновой кислоты, векторам и клеткам-хозяевам, содержащим полинуклеотиды, а также к способам получения и применения полипептидов и каталитических доменов.
Описание уровня техники
Лизоцим представляет собой О-гликозилгидролазу, продуцируемую в качестве защитного механизма против бактерий многими организмами. Фермент вызывает гидролиз клеточных стенок бактерий путем расщепления гликозидных связей пептидогликана; важной структурной молекулы у бактерий. После того как их клеточные стенки были ослаблены действием лизоцима, бактериальные клетки лизируются в результате воздействия осмотического давления.
Лизоцим встречается у многих организмов, таких как вирусы, растения, насекомые, птицы, рептилии и млекопитающие. У млекопитающих лизоцим был выделен из носового секрета, слюны, слез, кишечника, мочи и молока. Фермент расщепляет гликозидные связи между атомом углерода номер 1 N-ацетилмурамовой кислоты и атомом углерода номер 4 N-ацетил-D-глюкозамина. In vivo эти два углевода полимеризуются с образованием полисахарида клеточной стенки.
Существует возрастающая заинтересованность в потенциале лизоцимных ферментов в качестве противомикробных средств. Например, была продемонстрирована активность лизоцима в отношении таких патогенов, как Streptococcus pneumoniae, Bacillus anthracis, Enterococcus faecium, Bacillus stearothermophilus, Clostridium botulinum, Clostridium butyricum, Clostridium periringens, Clostridium sporogenes, Clostridium tyrobutyricum и Listeria monocytogenes.
Лизоцим был отнесен к пяти различным семействам гликозидгидролаз (GH) (CAZy, www.cazy.org): лизоцим белка куриного яйца (GH22), лизоцим белка куриного яйца (GH23), лизоцим бактериофага Т4 (GH24), белок жгутика Sphingomonas (GH73) и лизоцимы Chalaropsis (GH25). Лизоцимы из семейств GH23 и GH24 известны преимущественно у бактериофагов и не были идентифицированы у грибов. Оказалось, что лизоцим семейства GH25 не является структурно родственным с другими семействами лизоцима.
Предлагалось применение лизоцима в корме для животных (см., например, W0 00/21381 и WO 04/026334), при производстве сыра (см., например, WO 05/080559), консервации пищевых продуктов (Hughey and Johnson (1987) Appl Environ Microbiol 53:2165), как моющий средств (см., например, US 5041236 и ЕР 0425016), при уходе за полостью рта (см., например, US 4355022, WO 04/017988 и WO 08/124764), в косметологии и дерматологии, контрацепции, урологии и гинекологии (см., например, WO 08/124764).
Лизоцим GH25 был описан у Chalaropsis (Felsch JW, Ingagami Τ, and Hash JH. (1975), ʺThe N,Ο-Diacetylmuramidase of Chalaropsis species; V The complete amino acid sequence, J. Biol. Chem. 250(10): 3713-3720).
Лизоцим белка куриного яйца, который представляет собой основной продукт, доступный на коммерческом рынке, не расщепляет N,6-O-диацетилмурамидазу, например, в клеточных стенках Staphylococcus aureus и, следовательно, не способен лизировать этот важный патоген человека среди прочих (Masschalck В, Deckers D, Michiels CW (2002), ʺLytic and nonlytic mechanism of inactivation of gram-positive bacteria by lysozyme under atmospheric and high hydrostatic pressureʺ, J Food Prot. 65(12): 1916-23).
Наблюдали, что разные лизоцимы характеризовались разными специфичностями в отношении разных микроорганизмов. Таким образом, желательно иметь несколько доступных лизоцимов для того, чтобы была возможность выбора подходящих ферментов для каждого конкретного применения. Таким образом, новые полипептиды с лизоцимной активностью являются желательными.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к выделенным грибковым полипептидам, принадлежащим к семейству GH25 и обладающим лизоцимной активностью.
Настоящее изобретение дополнительно относится к выделенным полипептидам с лизоцимной активностью, выбранным из группы, состоящей из:
а) полипептида, последовательность которого по меньшей мере на 80% идентична зрелому полипептиду из SEQ ID NO: 4 или зрелому полипептиду из SEQ ID NO: 8;
(b) полипептида, кодируемого полинуклеотидом, последовательность которого по меньшей мере на 80% идентична кодирующей зрелый полипептид последовательности из SEQ ID NO: 3; кодирующей зрелый полипептид последовательности из SEQ ID NO: 7;
(c) полипептида, кодируемого полинуклеотидом, который гибридизуется в условиях умеренно-высокой жесткости с кодирующей зрелый полипептид последовательностью из SEQ ID NO: 3 или SEQ ID NO: 7, или последовательностью полной длины, комплементарной ей;
d) варианта зрелого полипептида из SEQ ID NO: 4 или SEQ ID NO: 8, содержащего замену, делецию и/или вставку в одном или более (например, нескольких) положениях; и
(е) фрагмента полипептида (а), (b), (с) или (d), который обладает лизоцимной активностью.
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим полипептиды; конструктам нуклеиновых кислот, рекомбинантным векторам экспрессии, рекомбинантным клеткам-хозяевам, содержащим полинуклеотиды; и к способам получения полипептидов.
Более того, настоящее изобретение относится к композициям, содержащим полипептид согласно настоящему изобретению, таким как моющие композиции, композиции корма для животных и композиции для экстракции бактериальной геномной ДНК.
Настоящее изобретение также относится к полипептидам согласно настоящему изобретению, обладающим противомикробной активностью, и способам применения полипептидов согласно настоящему изобретению в качестве ингибиторов образования биопленки, в моющих средствах, при уходе за зубами, в корме для животных и для разрушения клеточных стенок бактерий.
Настоящее изобретение также относится к полинуклеотиду, кодирующему сигнальный пептид, содержащий аминокислоты с 1 по 19 в SEQ ID NO: 4 или аминокислоты с -23 по -1 в SEQ ID NO: 8 или состоящий из них, который функционально связан с геном, кодирующим белок; к конструктам нуклеиновых кислот, векторам экспрессии и рекомбинантным клеткам-хозяевам, содержащим полинуклеотиды; и к способам получения белка.
Обзор перечня последовательностей
SEQ ID NO: 1 представляет собой последовательность ДНК гена Р244А7 GH24, которая выделена из Acremonium alkalophilum CBS 114.92.
SEQ ID NO: 2 представляет собой аминокислотную последовательность, которая выведена из SEQ ID NO: 1.
SEQ ID NO: 3 представляет собой последовательность ДНК гена Р242М9 GH25, которая выделена из Acremonium alkalophilum CBS114.92.
SEQ ID NO: 4 представляет собой аминокислотную последовательность, которая выведена из SEQ ID NO: 3.
SEQ ID NO: 5 представляет собой прямой праймер F-P242M9.
SEQ ID NO: 6 представляет собой обратный праймер F-P242M9.
SEQ ID NO: 7 представляет собой последовательность ДНК синтетически оптимизированного гена GH25.
SEQ ID NO: 8 представляет собой аминокислотную последовательность, которая выведена из SEQ ID NO: 7.
SEQ ID NO: 9 представляет собой прямой праймер BamHI.
SEQ ID NO: 10 представляет собой обратный праймер EcoRI.
Краткое описание фигур
На фигуре 1 показаны результаты анализов радиальной диффузии лизоцима GH24 Acremonium alcalophilum (ЕХР03890, SEQ ID NO: 2), лизоцима GH25 Acremonium alcalophilum (EXP03864, SEQ ID NO: 4) и эталонного лизоцима GH25 из Aspergillus fumigatus у S. carnosus и Ε. coli.
На фигуре 2 показана температурная стабильность лизоцима Р242М9 GH25 Acremonium alcalophilum (SEQ ID NO: 4) при 60, 76, 70, 75, 80 и 85°C через 30 или 60 секунд, которую определяют по падению оптической плотности раствора с ресуспендированным Micrococcus luteus АТТС №4698, измеренной на спектрофотометре при 540 нм.
На фигуре 3 показана термостабильность лизоцима GH25 Р242М9 (SEQ ID NO: 4), которую определяют с помощью дифференциальной сканирующей калориметрии (DSC) в 50 мМ ацетате Na рН 4,5, 50 мМ ацетате Na с рН 5,5 и 50 мМ MES (2-(N-морфолино)этансульфоновой кислоте), рН 6,5.
На фигуре 4 показана лизоцимная активность 4 концентраций лизоцима GH25 Р242М9 (SEQ ID NO: 4), синтетического лизоцима GH25 (SEQ ID NO: 8) и 11 вариантов SEQ ID NO: 8, которую определяют по падению оптической плотности раствора ресуспендированного Clostridium perfringens NN01260.
На фигуре 5 показана лизоцимная активность 4 концентраций лизоцима GH25 Р242М9 (SEQ ID NO: 4), синтетического лизоцима GH25 (SEQ ID NO: 8) и 11 вариантов SEQ ID NO: 8, которую определяют по падению оптической плотности раствора ресуспендированным клиническим изолятом Clostridium perfringens.
На фигуре 6 приведены атомные координаты трехмерной структуры лизоцима GH25 Acremonium alkalophilum CBS114.92. Эти атомные координаты могут помочь в создании трехмерной модели, описывающей структуру лизоцима GH25 Acremonium alkalophilum CBS114.92, и трехмерной модели гомологичных структур, таких как варианты вышеупомянутого лизоцима.
ОПРЕДЕЛЕНИЯ
Лизоцим. Выражение ʺлизоцимнаяʺ активность определено в данном документе как активность О-гликозилгидролазы, которая катализирует гидролиз гликозидной связи между двумя или более углеводами или между углеводом и неуглеводным фрагментом. Лизоцимы расщепляют гликозидную связь между определенными остатками в мукополисахаридах и мукопептидах клеточных стенок бактерий, как например, 1,4-бета-связи между остатками N-ацетилмурамовой кислоты и N-ацетил-D-глюкозамина в пептидогликане и между остатками N-ацетил-D-глкжозамина в хитодекстринах, что приводит в результате к лизису бактерий. Лизоцим принадлежит к классу ферментов ЕС 3.2.1.17. В контексте настоящего изобретения лизоцимную активность определяют в соответствии с анализом помутнения, описанным в примере 4. В одном аспекте полипептиды согласно настоящему изобретению обладают по меньшей мере 20%, например, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 100% лизоцимной активности зрелого полипептида с одной из SEQ ID NO: 4 или SEQ ID NO: 8.
Аллельный вариант. Выражение ʺаллельный вариантʺ означает любую из двух или более альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельное разнообразие возникает в естественных условиях вследствие мутации и может приводить в результате к полиморфизму в пределах популяций. Генные мутации могут быть молчащими (без изменений в кодируемом полипептиде) или могут кодировать полипептиды с измененными аминокислотными последовательностями. Аллельный вариант полипептида представляет собой полипептид, кодируемый аллельным вариантом гена.
Πротивомикробная активность. Выражение ʺпротивомикробная активностьʺ определено в данном документе как активность, которая уничтожает или подавляет рост микроорганизмов, таких как водоросли, археи, бактерии, грибы и/или простейшие. Противомикробная активность может, например, быть бактерицидной, что означает уничтожение бактерий, или бактериостатической, что означает предотвращение роста бактерий. Противомикробная активность может включать катализ гидролиза 1,4-бета-связей между остатками N-ацетилмурамовой кислоты и N-ацетил-D-глюкозамина в пептидогликане, а также между остатками N-ацетил-D-глкжозамина в хитодекстринах. Противомикробная активность может также включать связывание лизоцима с поверхностью микроорганизма и подавление его роста. Противомикробный эффект также может включать применение лизоцимов согласно настоящему изобретению для активации бактериальных аутолизинов, в качестве иммуностимулятора, при ингибировании или снижении количества бактериальных токсинов и при воздействии опсонинов. В контексте настоящего изобретения противомикробную активность определяют в соответствии с анализом противомикробной активности, описанным в примере 10.
Измененное/модифицированное свойство. Выражение ʺизмененное/модифицированное свойствоʺ определено как характеристика, связанная с вариантом, которая изменена или модифицирована по сравнению с исходным лизоцимом или идентифицированной эталонной последовательностью. Измененное или модифицированное свойство может представлять собой характеристику, связанную с вариантом, которая улучшена, если не указано иное, по сравнению с другим эталонным лизоцимом или исходным лизоцимом. Примеры свойств, которые могут быть изменены/модифицированы или улучшены, приведены ниже.
Термостабильность. Выражение ʺтермостабильностьʺ относится к лизоцимной активности после периода инкубирования при повышенной температуре по сравнению с исходной или идентифицированной эталонной последовательностью либо в буфере или при условиях, таких как имеющие место во время хранения/транспортировки продукта, или при условиях, подобных имеющим место во время промышленного применения варианта. Вариант может проявлять или не проявлять измененный профиль активности при разных температурах по сравнению с исходной формой. В одном аспекте термостабильность варианта с лизоцимной активностью составляет по меньшей мере в 1,0 раз больше, например, по меньшей мере в 1,1 раза больше, по меньшей мере в 1,5 раза больше, по меньшей мере в 1,8 раза больше, по меньшей мере в 2 раза больше, по меньшей мере в 5 раз больше, по меньшей мере в 10 раз, по меньшей мере в 15 раз больше, по меньшей мере в 20 раз больше и по меньшей мере в 25 раз больше термостабильности исходной или эталонной последовательности при выбранной температуре. Предпочтительно активность исследуют с применением анализа активности лизоцима по помутнению, описанном в разделе ʺМатериалы и способыʺ.
Температурный профиль/температурная стабильность. Выражение ʺтемпературный профиль/температурная стабильностьʺ относится к варианту фермента, проявляющему модифицированный температурный профиль по сравнению с исходной или идентифицированной эталонной последовательностью, где температурный профиль определен как зависимость лизоцимной активности от температуры. Активность при каждой температуре предпочтительно указана как относительная активность (в %), нормализованная к значению при оптимальной температуре. Оптимальная температура представляет собой такую температуру в пределах исследуемых температур (т.е. с шагом повышения на 5-10°С), при которых активность является наиболее высокой.
Стабильность при определенном рН. Выражение ʺстабильность при определенном рНʺ относится к варианту фермента, проявляющему структурную стабильность по сравнению с исходным лизоцимом или идентифицированной эталонной последовательностью после периода инкубирования при рН, который находится вне диапазона рН, в котором фермент является активным (диапазон рН, в котором фермент активен). Такой вариант может проявлять или не проявлять измененный профиль активности при разных значениях рН в сравнении с исходной формой. Например, вариант может не быть активным при повышенном или пониженном рН, но он способен сохранять свою трехмерную структуру и затем восстанавливать активность после возвращения к диапазону рН, в котором фермент активен. В качестве альтернативы, вариант может характеризоваться улучшенной способностью к рефолдингу по сравнению с исходной формой после инкубирования при повышенном или пониженном рН.
В одном аспекте профиль стабильности при разных значениях рН изменяют таким образом, что вариант лизоцима характеризуется улучшенной стабильностью при кислом рН. Как применяется в данном документе, кислый рН означает рН от 2 до 5,5, предпочтительно от 2,5 до 5,25, более предпочтительно от 3 до 5, еще более предпочтительно от 3,5 до 4. Предпочтительно, вариант лизоцима сохраняет по меньшей мере 40%, предпочтительно по меньшей мере 50%, 60%, 70% или 80%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% остаточной активности после инкубирования при заданном рН в течение 1 часа по сравнению с вариантом, который поддерживали при при рН 6,5 в течение того же времени. Предпочтительно, остаточная активность варианта лизоцима составляет по меньшей мере в 1,1 раза больше, по меньшей мере в 1,3 раза выше, по меньшей мере в 1,5 раза выше, предпочтительно по меньшей мере в 2 раза выше, более предпочтительно по меньшей мере в 5 раз выше, наиболее предпочтительно по меньшей мере в 7 раз выше и еще более предпочтительно по меньшей мере в 10 раз выше, чем остаточная активность исходного лизоцима или идентифицированной эталонной последовательности, которые были обработаны при тех же условиях. Предпочтительно активность исследуют с применением анализа активности лизоцима по помутнению, описанным в разделе ʺМатериалы и способыʺ.
Активность при определенном рН. Выражение ʺактивность при определенном рНʺ определено в данном документе как проявление изменения профиля активности варианта лизоцима в зависимости от рН по сравнению с профилем зависимости активности от рН исходного лизоцима или идентифицированной эталонной последовательности. Профиль активности в зависимости от рН представляет меру эффективности фермента в предотвращении микробного роста, ликвидации микробных клеток и/или осуществлении катализа реакции гидролиза в диапазоне рН при указанных условиях, таких как температура и состав растворителя. Лизоцим характеризуется конкретным диапазоном рН, в котором полипептид является стабильным и сохраняет ферментативную активность, за пределами этого диапазона лизоцим становится менее активным и возможно также менее стабильным. В пределах диапазона рН обычно присутствует оптимум рН, при котором лизоцим проявляет наиболее высокую активность.
Вариант лизоцима с улучшенной активностью при щелочном рН (например, рН от 7,5 до 12, предпочтительно от 8 до 11, более предпочтительно от 8,5 до 10, еще более предпочтительно от 9 до 9,5) будет способен функционировать в более щелочных средах, как например, в моющих средствах.
Вариант с улучшенной активностью при кислом рН (например, рН от 2 до 6,5, предпочтительно от 2,5 до 6, более предпочтительно от 3 до 5,5, еще более предпочтительно от 3,5 до 5) будет способен функционировать при более кислых условиях, как например, консерванты в определенных пищевых продуктах.
Вариант с улучшенной активностью при рН от нейтрального до слабокислого (например, рН от 4 до 7,0, предпочтительно от 4,5 до 6,5, более предпочтительно от 5 до 6,5) будет способен функционировать при слабокислых или нейтральных условиях, как например, для применения молекулы-эубиотика в кормах, для стабилизации здоровой микрофлоры у животных или при подавлении роста/колонизации кишечника вирусными, паразитическими или бактериальными патогенами в Gl трактах животных.
В одном аспекте профиль активности в зависимости от рН изменяют таким образом, что вариант лизоцима обладает улучшенной активностью при более щелочном рН. Предпочтительно, активность варианта лизоцима при рН по меньшей мере на 0,5 единицы выше, предпочтительно по меньшей мере на 1,0 единицу рН выше, более предпочтительно по меньшей мере на 1,5 единицы рН выше, еще более предпочтительно по меньшей мере на 2,0 единицы рН выше составляет по меньшей мере в 1,1 раза выше, предпочтительно по меньшей мере в 1,5 раза выше, более предпочтительно по меньшей мере в 2 раза выше, еще более предпочтительно по меньшей мере в 5 раз выше и наиболее предпочтительно по меньшей мере в 10 раз выше, чем таковая исходного фермента или идентифицированной эталонной последовательности. Предпочтительно, вариант лизоцима одновременно сохраняет по меньшей мере 40%, предпочтительно по меньшей мере 50%, 60%, 70%, или 80%, или 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 100% активности исходного лизоцима или идентифицированная эталонная последовательность проявляет при своем оптимуме рН. Предпочтительно активность исследуют с применением анализа активности лизоцима по помутнению, описанным в разделе ʺМатериалы и способыʺ.
В другом аспекте профиль активности в зависимости от рН изменяют таким образом, что вариант лизоцима обладает улучшенной активностью при более кислом рН. Предпочтительно, активность варианта лизоцима при рН по меньшей мере на 0,5 единицы ниже, предпочтительно по меньшей мере на 1,0 единицу рН ниже, более предпочтительно по меньшей мере на 1,5 единицы рН ниже, еще более предпочтительно по меньшей мере на 2,0 единицы рН ниже составляет по меньшей мере в 1,1 раза выше, предпочтительно по меньшей мере в 1,5 раза выше, более предпочтительно по меньшей мере в 2 раза выше, еще более предпочтительно по меньшей мере в 5 раз выше и наиболее предпочтительно по меньшей мере в 10 раз выше, чем таковая исходного фермента или идентифицированной эталонной последовательности. Предпочтительно, вариант лизоцима одновременно сохраняет по меньшей мере 40%, предпочтительно по меньшей мере 50%, 60%, 70%, или 80%, или 90%, более предпочтительно по меньшей мере 95%, еще более предпочтительно по меньшей мере 100% активности исходного лизоцима или идентифицированная эталонная последовательность проявляет при своем оптимуме рН. Предпочтительно активность исследуют с применением анализа активности лизоцима по помутнению, описанным в разделе ʺМатериалы и способыʺ.
Субстратная специфичность. Выражение ʺсубстратная специфичностьʺ относится к специфичности лизоцима в отношении типа бактерии, которую он может уничтожать/подавлять и/или в отношении модельных субстратов лизоцима (например, олигомеров p-NP-(NAG-NAM)n или p-NP-(NAG)m). Путем модификации субстратной специфичности лизоцима можно изменить тип бактерий, которые может уничтожать и/или подавлять лизоцим. В одном аспекте субстратную специфичность лизоцима расширяют, тем самым обеспечивая возможность уничтожения и/или подавления других типов бактерий помимо бактерий, которые может уничтожать и/или подавлять лизоцим дикого типа.
Чувствительность к гликированию. Неферментативное гликирование представляет собой самопроизвольный пострансляционный процесс, при котором восстанавливающие сахара связываются ковалентно со свободными аминогруппами в белках преимущественно по лизиновым (K) остаткам. Гликирование может воздействовать на активность лизоцима. Согласно настоящему изобретению чувствительность лизоцима к неферментативному гликированию можно снизить путем изменения определенных аминокислот.
Улучшенные свойства могут также включать термические свойства, как например, стабильность при гранулировании, стабильность при обработке паром, расширенный профиль активности в зависимости от температуры. Кроме того, улучшенные свойства могут включать чувствительность к протеазам и/или характер гликозилирования. Улучшения предпочтительно оценивают в зависимости от желаемых условий применения.
Каталитический домен. Выражение ʺкаталитический доменʺ означает участок фермента, содержащий каталитический аппарат фермента.
ʺДНК. Выражение ʺкДНКʺ означает молекулу ДНК, которую можно получить посредством обратной транскрипции из зрелой сплайсированной молекулы мРНК, полученной из эукариотической или прокариотической клетки. В кДНК отсутствуют последовательности интронов, которые могут присутствовать в соответствующей геномной ДНК. Исходный, первичный РНК-транскрипт представляет собой предшественник для мРНК, который подвергается процессингу в ходе ряда этапов, в том числе сплайсингу, до того, как станет зрелой сплайсированной мРНК.
Кодирующая последовательность. Выражение ʺкодирующая последовательностьʺ означает полинуклеотид, который непосредственно определяет аминокислотную последовательность полипептида. Границы кодирующей последовательности обычно определяются открытой рамкой считывания, которая начинается со старт-кодона, такого как ATG, GTG или TTG, и заканчивается стоп-кодоном, таким как ТАА, TAG или TGA.
Кодирующая последовательность может представлять собой геномную ДНК, кДНК, синтетическую ДНК или их сочетание.
Регуляторные последовательности. Выражение ʺрегуляторные последовательностиʺ означает последовательности нуклеиновой кислоты, необходимые для экспрессии полинуклеотида, кодирующего зрелый полипептид согласно настоящему изобретению. Каждая регуляторная последовательность может быть нативной (т.е. из того же гена) или чужеродной [т.е. из отличающегося гена) относительно полинуклеотида, кодирующего полипептид, или нативной или чужеродной друг относительно друга. Такие регуляторные последовательности включают без ограничения лидерную последовательность, последовательность полиаденилирования, последовательность пропептида, промотор, последовательность сигнального пептида и терминатор транскрипции. Как минимум, регуляторные последовательности включают промотор и сигналы остановки транскрипции и трансляции. В регуляторных последовательностях могут быть предусмотрены линкеры с целью введения специфических сайтов рестрикции, способствующих лигированию регуляторных последовательностей с кодирующим участком полинуклеотида, кодирующего полипептид.
Экспрессия. Выражение ʺэкспрессияʺ включает любой этап, вовлеченный в продуцирование полипептида, в том числе без ограничения транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Вектор экспрессии. Выражение ʺвектор экспрессииʺ означает линейную или циклическую молекулу ДНК, которая содержит полинуклеотид, кодирующий полипептид, и функционально связана с регуляторными последовательностями, которые обеспечивают ее экспрессию.
Фрагмент. Выражение ʺфрагментʺ означает полипептид или каталитический домен, у которого отсутствуют одна или несколько (например, некоторые) аминокислот с амино- и/или карбоксильного конца зрелого полипептида или домена; причем фрагмент обладает лизоцимной активностью. В одном аспекте фрагмент содержит по меньшей мере 184 аминокислотных остатка (например, аминокислоты с 25 по 208 в SEQ ID NO: 4) или по меньшей мере 195 аминокислотных остатков (например, аминокислоты с 22 по 216 в SEQ ID NO: 4). В одном аспекте фрагмент содержит по меньшей мере 184 аминокислотных остатка (например, аминокислоты с 10 по 193 в SEQ ID NO: 8) или по меньшей мере 195 аминокислотных остатков (например, аминокислоты с 5 по 199 в SEQ ID NO: 8).
Клетка-хозяин. Выражение ʺклетка-хозяинʺ означает любой тип клеток, который является чувствительным к трансформации, трансфекции, трансдукции или и подобному конструктом или вектором экспрессии нуклеиновой кислоты, содержащим полинуклеотид согласно настоящему изобретению. Выражение ʺклетка-хозяинʺ охватывает любое потомство исходной клетки, которое не является идентичным исходной клетке вследствие мутаций, которые имеют место в ходе репликации.
Выделенный. Выражение ʺвыделенныйʺ означает вещество в форме или окружении, которые не встречаются в естественных условиях. Неограничивающие примеры выделенных веществ включают (1) любое не встречающееся в естественных условиях вещество, (2) любое вещество, в том числе без ограничения любой фермент, вариант, нуклеиновую кислоту, белок, пептид или кофактор, которые по меньшей мере частично удалены из одной, или нескольких, или всех встречающихся в естественных условиях составляющих, с которыми они связаны в естественных условиях; (3) любое вещество, модифицированное руками человека в сравнении с таким веществом, встречающимся в природе; или (4) любое вещество, модифицированное путем увеличения количества вещества в сравнении с другими компонентами, с которыми оно связано в естественных условиях (например, несколько копий гена, кодирующего вещество; применение более сильного промотора, чем промотор, связанный в естественных условиях с геном, кодирующим вещество). Выделенное вещество может присутствовать в образце ферментативного бульона.
Зрелый полипептид. Выражение ʺзрелый полипептидʺ означает полипептид в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как процессинг N-концевой части, усечение С-концевой части, гликозилирование, фосфорилирование и т.д. В одном аспекте зрелый полипептид представляет собой аминокислоты с 20 по 227 в SEQ ID NO: 4 или аминокислоты с 1 по 208 в SEQ ID NO: 8 на основании данных программы SignalP (Nielsen et al., 1997, Protein Engineering 10: 1-6), с помощью которой предсказали, что аминокислоты с 1 по 19 в SEQ ID NO: 4 и аминокислоты с -40 по -18 в SEQ ID NO: 8 представляют собой сигнальные пептиды. Из уровня техники известно, что клетка-хозяин может продуцировать смесь двух или более разных зрелых полипептидов (т.е. с разными С-концевыми и/или N-концевыми аминокислотами), экспрессируемых одним тем же полинуклеотидом.
Кодирующая зрелый полипептид последовательность. Выражение ʺкодирующая последовательность зрелого полипептидаʺ означает полинуклеотид, который кодирует зрелый полипептид, обладающий лизоцимной активностью. В одном аспекте кодирующая зрелый полипептид последовательность представляет собой объединенную последовательность из нуклеотидов с 58 по 147 и нуклеотидов с 302 по 835 в SEQ ID NO: 3, а также нуклеотидов с 121 по 744 в SEQ ID NO: 7 на основе данных программы SignalP (Nielsen et al., 1997, выше), с помощью которой предсказали, что нуклеотиды с 1 по 63 в SEQ ID NO: 3 и нуклеотиды с 1 по 69 в SEQ ID NO: 7 кодируют сигнальные пептиды.
Конструкт нуклеиновой кислоты. Выражение ʺконструкт нуклеиновой кислотыʺ означает либо одно- либо двухцепочечную молекулу нуклеиновой кислоты, которая является выделенной из встречающегося в естественных условиях гена или является до некоторой степени модифицированной с тем, чтобы она содержала сегменты нуклеиновых кислот, которая в ином случае не может существовать в естественных условиях, или которая является синтетической, которая содержит одну или несколько регуляторных последовательностей.
Функционально связанный. Выражение ʺфункционально связанныйʺ означает конфигурацию, в которой регуляторная последовательность размещена в соответствующем положении относительно кодирующей последовательности полинуклеотида так, что регуляторная последовательность управляет экспрессией кодирующей последовательности.
Идентичность последовательности. Родство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается параметром ʺидентичность последовательностиʺ.
В контексте целей настоящего изобретения идентичность последовательности у двух аминокислотных последовательностей определяют с применением алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который применен в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версия 5.0.0 или более поздняя. Применяемыми параметрами являются штраф за открытие гэпа, составляющий 10, штраф за продление гэпа, составляющий 0,5, и матрица замен EBLOSUM62 (версия EMBOSS с BLOSUM62). Выводимые данные в Needle, помеченные ʺнаиболее длинный идентичный участокʺ (полученные с применением опции nobrief), применяют в качестве процентной идентичности и рассчитывают следующим образом:
(идентичные остатки ×100)/(длина выравниваемого участка - общее число гэпов в выравниваемом участке).
В контексте настоящего изобретения идентичность последовательности у двух последовательностей дезоксирибонуклеотидов определяют с применением алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, выше), который применен в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, выше), предпочтительно версия 5.0.0 или более поздняя. Применяемыми параметрами являются штраф за открытие гэпа, составляющий 10, штраф за продление гэпа, составляющий 0,5, и матрица замен EDNAFULL (версия EMBOSS с NCBI NUC4.4). Выводимые данные в Needle, помеченные ʺнаиболее длинный идентичный участокʺ (полученные с применением опции nobrief), применяют в качестве процентной идентичности и рассчитывают следующим образом:
(идентичные дезоксирибонуклеотиды ×100)/(длина выравниваемого участка - общее число гэпов в выравниваемом участке).
Условия жесткости. Условия различной жесткости определены ниже.
Выражение ʺусловия очень низкой жесткостиʺ означает для зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 25% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. Материал-носитель в конце промывают три раза, каждый раз в течение 15 минут с применением 2Х SSC, 0,2% SDS при 45°С.
Выражение ʺусловия низкой жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 25% формамиде после стандартной процедуры Саузерн-блоттнига в течение 12-24 часов. Материал-носитель в конце промывают три раза, каждый раз в течение 15 минут с применением 2Х SSC, 0,2% SDS при 50°С.
Выражение ʺусловия умеренной жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 35% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. Материал-носитель в конце промывают три раза, каждый раз в течение 15 минут с применением 2Х SSC, 0,2% SDS при 55°С.
Выражение ʺусловия умеренно-высокой жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 35% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. Материал-носитель в конце промывают три раза, каждый раз в течение 15 минут с применением 2Х SSC, 0,2% SDS при 60°С.
Выражение ʺусловия высокой жесткостиʺ означает в отношении зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 50% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. Материал-носитель в конце промывают три раза, каждый раз в течение 15 минут с применением 2Х SSC, 0,2% SDS при 65°С.
Выражение ʺусловия очень высокой жесткостиʺ означает для зондов длиной по меньшей мере 100 нуклеотидов предварительную гибридизацию и гибридизацию при 42°С в 5Х SSPE, 0,3% SDS, 200 микрограмм/мл разрезанной и денатурированной ДНК спермы лосося и 50% формамиде после стандартных процедур Саузерн-блоттинга в течение 12-24 часов. Материал-носитель в конце промывают три раза, каждый раз в течение 15 минут с применением 2Х SSC, 0,2% SDS при 70°С.
Подпоследовательность. Выражение ʺподпоследовательностьʺ означает полинуклеотид, у которого отсутствуют один или несколько (например, некоторые) нуклеотидов с 5ʹ и/или 3ʹ конца кодирующей последовательности зрелого полипептида; причем подпоследовательность кодирует фрагмент, обладающий лизоцимной активностью. В одном аспекте подпоследовательность содержит по меньшей мере 552 нуклеотида (например, объединенная последовательность из нуклеотидов с 73 по 147 и нуклеотидов с 302 по 778 в SEQ ID NO: 3) или по меньшей мере 585 нуклеотидов (например, объединенная последовательность из нуклеотидов с 64 по 147 и нуклеотидов с 302 по 802 в SEQ ID NO: 3). В дополнительном аспекте подпоследовательность содержит по меньшей мере 552 нуклеотида (например, последовательность из нуклеотидов с 148 по 699 в SEQ ID NO: 7) или по меньшей мере 585 нуклеотидов (например, последовательность из нуклеотидов с 133 по 717 в SEQ ID NO: 7).
Практически чистый полинуклеотид. Выражение ʺпрактически чистый полинуклеотидʺ означает, что препарат полинуклеотида не содержит других посторонних или нежелательных нуклеотидов и в форме, подходящей для применения в системах для получения созданных методами генной инженерии полипептидов. Таким образом, практически чистый полинуклеотид содержит не более 10%, не более 8%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% и не более 0,5% по весу отличного от полинуклеотида материала, с которым они связаны в своем естественном состоянии или при получении с помощью рекомбинации. По сути чистый полинуклеотид, тем не менее, может включать встречающиеся в естественных условиях 5ʹ и 3ʹ нетранслируемые участки, такие как промоторы и терминаторы. Предпочтительно, полинуклеотид является по меньшей мере на 90% чистым, например, по меньшей мере на 92% чистым, по меньшей мере на 94% чистым, по меньшей мере на 95% чистым, по меньшей мере на 96% чистым, по меньшей мере на 97% чистым, по меньшей мере на 98% чистым, по меньшей мере на 99% чистым и по меньшей мере на 99,5% чистым по весу. Полинуклеотиды согласно настоящему изобретению предпочтительно присутствуют в практически чистой форме.
Практически чистый полипептид. Выражение ʺпрактически чистый полипептидʺ означает препарат, который содержит не более 10%, не более 8%, не более 6%, не более 5%, не более 4%, не более 3%, не более 2%, не более 1% и не более 0,5% по весу отличного от полипептида материала, с которым они связаны в своем естественном состоянии или при получении с помощью рекомбинации. Предпочтительно, полипептид является по меньшей мере на 92% чистым, например, по меньшей мере на 94% чистым, по меньшей мере на 95% чистым, по меньшей мере на 96% чистым, по меньшей мере на 97% чистым, по меньшей мере на 98% чистым, по меньшей мере на 99%, по меньшей мере 99,5% чистым и на 100% чистым по весу всего материала полипептида, присутствующего в препарате. Полипептиды согласно настоящему изобретению предпочтительно присутствуют в практически чистой форме. Этого можно достичь, например, путем получения полипептида с помощью хорошо известных рекомбинантных способов или с помощью классических способов очистки.
Вариант. Выражение ʺвариантʺ означает полипептид, обладающий лизоцимной активностью, содержащий изменение, т.е. замену, вставку и/или делецию одного или нескольких (некоторых) аминокислотных остатков в одном или более (например, нескольких) положениях. Замена означает смену аминокислоты, занимающей некое положение, на отличную аминокислоту; делеция означает удаление аминокислоты, занимающей некое положение; и вставка означает присоединение 1, 2 или 3 аминокислот рядом с и непосредственно после аминокислоты, занимающей указанное положение. Вариант согласно настоящему изобретению может содержать от 1 до 5; от 1 до 10; от 1 до 15; от 1 до 20; от 1 до 25; от 1 до 30; от 1 до 35; от 1 до 40; от 1 до 45; т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45 изменений.
Варианты согласно настоящему изобретению содержат по меньшей мере одно изменение/модификацию, выбранную из группы, состоящей из положения номер 6, 10, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190, где положение соответствует положению в зрелой последовательности из SEQ ID NO: 8. Вариант последовательности полипептида предпочтительно является таковым, который не встречается в природе.
Лизоцим дикого типа. Выражение лизоцим ʺдикого типаʺ означает лизоцим, экспрессируемый в естественных условиях микроорганизмом, таким как бактерия, дрожжи или нитчатый гриб, встречающиеся в природе.
Условные обозначения для указания вариантов
В контексте настоящего изобретения зрелый полипептид, раскрытый в SEQ ID NO: 8, применяется для определения соответствующего аминокислотного остатка в другом лизоциме. Аминокислотную последовательность другого лизоцима выравнивают со зрелым полипептидом, раскрытым в SEQ ID NO: 8, и на основании выравнивания номер положения аминокислоты, соответствующий любому аминокислотному остатку в зрелом полипептиде, раскрытом в SEQ ID NO: 8, определяют с применением алгоритма Нидлмана-Вунша (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), который применен в программе Needle из пакета EMBOSS (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), предпочтительно версия 5.0.0 или более поздняя. Применяемыми параметрами являются штраф за открытие гэпа, составляющий 10, штраф за продление гэпа, составляющий 0,5, и матрица замен EBLOSUM62 (версия EMBOSS с BLOSUM62). Выводимые данные в Needle, помеченные ʺнаиболее длинный идентичный участокʺ (полученные с применением опции nobrief), применяют в качестве процентной идентичности и рассчитывают следующим образом: (идентичные остатки ×100)/(длина выравниваемого участка - общее число гэпов в выравниваемом участке). Для сравнения последовательностей и для расчета идентичности последовательностей применяют алгоритм Нидлмана-Вунша.
Идентификацию соответствующего аминокислотного остатка в другом лизоциме можно определить путем выравнивания последовательностей нескольких полипептидов с применением нескольких компьютерных программ, в том числе без ограничения MUSCLE (сравнение нескольких последовательностей по 1одПожиданию; версия 3.5 или более поздняя; Edgar, 2004, Nucleic Acids Research 32: 1792-1797), MAFFT (версия 6.857 или более поздняя; Katoh and Kuma, 2002, Nucleic Acids Research 30: 3059-3066; Katoh et al., 2005, Nucleic Acids Research 33: 511-518; Katoh and Toh, 2007, Bioinformatics 23: 372-374; Katoh et al., 2009, Methods in Molecular Biology 537: 39-64; Katoh and Toh, 2010, Bioinformatics 26: 1899-1900), и EMBOSS EMMA, в которой применяют ClustalW (1.83 или более поздняя; Thompson et al., 1994, Nucleic Acids Research 22. 4673-4680), с применением их соответствующих параметров по умолчанию.
Если другой фермент имеет отклонения от зрелого полипептида из SEQ ID NO: 8 так, что с помощью традиционного сравнения на основании последовательностей невозможно обнаружить их родство (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615), можно применять другие алгоритмы парного сравнения последовательностей. Большей чувствительности поиска по последовательности можно достичь с применением поисковых программ, которые применяют вероятностные представления семейств полипептидов (профилей) для поиска по базам данных. Например, программа PSI-BLAST создает профили посредством процесса итеративного поиска по базам данных и способна к выявлению отдаленных гомологов (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большей чувствительности можно достичь, если семейство или суперсемейство для полипептида имеет один или несколько представителей в базах данных структуры белков. Программы, такие как GenTHREADER (Jones, 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881), применяют информацию из ряда источников (PSI-BLAST, данные прогнозирования вторичной структуры, профили структурного выравнивания и потенциалы сольватации) в качестве вводимых данных в нейронную сеть, с помощью которой предсказали фолдинг структуры для последовательности, по которой задан запрос. Подобным образом, способ по Gough et al., 2000, J. Mol. Biol. 313: 903-919, можно применять для выравнивания последовательностей с неизвестной структурой с моделями суперсемейств, присутствующими в базе данных SCOP. Эти выравнивая можно, в свою очередь, применять для создания моделей гомологии для полипептида, и такие модели можно оценить в отношении точности с помощью ряда инструментов, разработанных для этой цели.
Для белков с известной структурой доступны некоторые инструменты и ресурсы для выведения и создания структурных выравниваний. Например суперсемейства белков в SCOP были выравнены по структуре, и результаты этих выравниваний находятся в открытом доступе, а также доступны для загрузки. Структуры двух или более белков можно выравнять с применением ряда алгоритмов, таких как выравнивание на основе матрицы расстояний (Holm and Sander, 1998, Proteins 33: 88-96) или комбинаторного продолжения (Shindyalov and Bourne, 1998, Protein Engineering 11: 739-747), и выполнение этих алгоритмов можно дополнительно применять для составления запросов по представляющей интерес структуре в базах данных структуры с целью нахождения возможных структурных гомологов (например, Holm and Park, 2000, Bioinformatics 16: 566-567).
При описании вариантов согласно настоящему изобретению описанная ниже номенклатура адаптирована для простоты упоминания. Применяется принятое IUPAC однобуквенное или трехбуквенное сокращение для аминокислот.
Замены. В отношении аминокислотной замены применяется следующая номенклатура: исходная аминокислота, положение, заменяющая аминокислота. Соответственно, замена треонина в положении 226 на аланин обозначается как ʺThr226Alaʺ или ʺТ226Аʺ. Несколько мутаций разделяют знаками сложения (ʺ+ʺ), например, ʺGly205Arg+Ser411Pheʺ или ʺG205R+S411Fʺ, представляющие замены в положениях 205 и 411 глицина (G) на аргинин (R) и серина (S) на фенилаланин (F), соответственно.
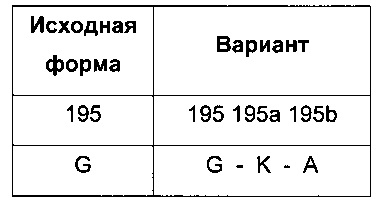
Делеции. В отношении делеции аминокислоты применяется следующая номенклатура: исходная аминокислота, положение, *. Соответственно, делеция глицина в положении 195 обозначается ʺGly195*ʺ или ʺG195*ʺ. Несколько делеций разделяют знаками сложения (ʺ+ʺ), например, ʺGly195*+Ser411*ʺ или ʺG195*+S411*ʺ.
Вставки. В отношении вставки аминокислоты применяется следующая номенклатура: исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота. Соответственно, вставка лизина после глицина в положении 195 обозначается ʺGly195GlyLysʺ или ʺG195GKʺ. Вставку нескольких аминокислот обозначают [исходная аминокислота, положение, исходная аминокислота, вставленная аминокислота #1, вставленная аминокислота #2 и т.д]. Например, вставка лизина и аланина после глицина в положении 195 обозначается ʺGly195GlyLysAlaʺ или ʺG195GKAʺ.
В таких случаях вставленный аминокислотный(е) остаток(и) нумеруют путем добавления строчных букв к номеру положения аминокислотного остатка, предшествующего вставленному(ым) аминокислотному(ым) остатку(ам). Следовательно, в вышеуказанном примере последовательность будет представлять собой:
Множественные изменения. Варианты, содержащие множественные изменения, разделяют знаками сложения (ʺ+ʺ), например, ʺArg170Tyr+Gly195Gluʺ или ʺR170Y+G195Eʺ, представляющие замену аргинина и глицина в положениях 170 и 195 на тирозин и глутаминовую кислоту, соответственно.
Различные изменения. В случаях когда различные изменения могут вводиться в неком положении, различные изменения разделяют запятой, например, ʺArg170Tyr,Gluʺ представляет замену аргинина в положении 170 на тирозин или глутаминовую кислоту. Следовательно, ʺTyr167Gly,Ala+Arg170Gly,Alaʺ обозначает следующие варианты: ʺTyr167Gly+Arg170Glyʺ, ʺTyr167Gly+Arg170Alaʺ, ʺTyr167Ala+Arg170Glyʺ и
ʺTyr167Ala+Arg170Alaʺ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Полипептиды с лизоцимной активностью
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 80%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 85%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 90%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 91%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 92%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 93%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 94%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 95%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 96%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 97%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 98%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 4 по меньшей мере на 99%, которые обладают лизоцимной активностью.
В одном аспекте полипептиды отличаются не более 45 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43 или 44, от зрелого полипептида из SEQ ID NO: 4.
Полипептид согласно настоящему изобретению предпочтительно содержит или состоит из аминокислотной последовательности из SEQ ID NO: 4 или ее аллельного варианта; или представляет собой ее фрагмент с лизоцимной активностью. В другом аспекте полипептид содержит или состоит из зрелого полипептида из SEQ ID NO: 4. В другом аспекте полипептид содержит или состоит из аминокислот с 20 по 227 в SEQ ID NO: 4.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 80%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 85%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 90%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 91%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 92%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 93%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 94%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 95%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 96%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 97%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 98%, которые обладают лизоцимной активностью.
В варианте осуществления настоящее изобретение относится к выделенным полипептидам, последовательность которых идентична зрелому полипептиду из SEQ ID NO: 8 по меньшей мере на 99%, которые обладают лизоцимной активностью.
В одном аспекте полипептиды отличаются не более 45 аминокислотами, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43 или 44, от зрелого полипептида из SEQ ID NO: 8.
Полипептид согласно настоящему изобретению предпочтительно содержит или состоит из аминокислотной последовательности из SEQ ID NO: 8 или ее аллельного варианта; или представляет собой ее фрагмент с лизоцимной активностью. В другом аспекте полипептид содержит или состоит из зрелого полипептида из SEQ ID NO: 8. В другом аспекте полипептид содержит или состоит из аминокислот с 20 по 227 в SEQ ID NO: 8.
В другом варианте осуществления настоящее изобретение относится к выделенному полипептиду с лизоцимной активностью, кодируемому полинуклеотидом, который гибридизуется в условиях умеренной жесткости, условиях умеренно-высокой жесткости, условиях высокой жесткости или условиях очень высокой жесткости с (i) кодирующей зрелый полипептид последовательностью из SEQ ID NO: 3 или SEQ ID NO: 7, (ii) последовательностью ее кДНК, или (iii) последовательностью полной длины, комплементарной (i) или (ii), (Sambrook et al., 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York).
Полинуклеотид из SEQ ID NO: 3 или SEQ ID NO: 7 или его подпоследовательность, a также полипептид из SEQ ID NO: 4 или SEQ ID NO: 8 или его фрагмент можно применять для конструирования зондов на основе нуклеиновой кислоты для идентификации и клонирования ДНК, кодирующей полипептид с лизоцимной активностью у штаммов разных родов или видов, в соответствии со способами, хорошо известными из уровня техники. В частности, такие зонды можно применять для гибридизации с геномной ДНК или кДНК представляющей интерес клетки после стандартных процедур Саузерн-блоттинга с целью идентификации и выделения их соответствующего гена. Такие зонды могут быть значительно короче полной последовательности, но должны иметь длину по меньшей мере 15, например, по меньшей мере 25, по меньшей мере 35 или по меньшей мере 70 нуклеотидов. Предпочтительно зонд на основе нуклеиновой кислоты имеет длину по меньшей мере 100 нуклеотидов, например, имеет длину по меньшей мере 200 нуклеотидов, по меньшей мере 300 нуклеотидов, по меньшей мере 400 нуклеотидов, по меньшей мере 500 нуклеотидов, по меньшей мере 600 нуклеотидов, по меньшей мере 700 нуклеотидов, по меньшей мере 800 нуклеотидов или по меньшей мере 900 нуклеотидов. Можно применять как ДНК-, так и РНК-зонды. Зонды, как правило, метят для выявления соответствующего гена (например, 32Р, 3Н, 35S, биотином или авидином). Такие зонды охватываются настоящим изобретением.
Библиотеку геномной ДНК или кДНК, полученную из таких прочих штаммов можно подвергнуть скринингу в отношении ДНК, которая гибридизуется с зондами, описанными выше, и кодирует полипептид с лизоцимной активностью. Геномную или другую ДНК из таких прочих штаммов можно разделить посредством электрофореза в агарозном или полиакриламидном геле или других методик разделения. ДНК из библиотек или разделенную ДНК можно перенести и иммобилизировать на нитроцеллюлозе или другом подходящем материале-носителе. С целью идентификации клона или ДНК, которые гибридизуются из SEQ ID NO: 3 или SEQ ID NO: 7 или ее подпоследовательностью, материал-носитель применяется в Саузерн-блоттинге.
В контексте настоящего изобретения гибридизация указывает на то, что полинуклеотид гибридизуются с меченым зондом на основе нуклеиновой кислоты, соответствующим (i) SEQ ID NO: 3 или SEQ ID NO: 7; (ii) кодирующей зрелый полипептид последовательности из SEQ ID NO: 3 или SEQ ID NO: 7; (iii) последовательности ее кДНК, (iv) последовательности полной длины, комплементарной ей; или (ν) ее подпоследовательности; в условиях с жесткостью от умеренной до очень высокой. Молекулы, с которыми зонд на основе нуклеиновой кислоты гибридизуются при этих условиях, можно выявить с применением, например, пленки для рентгенографии или других средств для выявления, известных из уровня техники.
В одном аспекте зонд на основе нуклеиновой кислоты представляет собой нуклеотиды с 58 по 147 или нуклеотиды с 302 по 835 в SEQ ID NO: 3 или нуклеотиды с 121 по 744 в SEQ ID NO: 7. В другом аспекте зонд на основе нуклеиновой кислоты представляет собой полинуклеотид, который кодирует полипептид из SEQ ID NO: 4 или SEQ ID NO: 8; его зрелый полипептид; или его фрагмент. В другом аспекте зонд на основе нуклеиновой кислоты представляет собой SEQ ID NO: 3 или SEQ ID NO: 7 или последовательность ее кДНК.
В другом варианте осуществления настоящее изобретение относится к выделенному полипептиду с лизоцимной активностью, кодируемому полинуклеотидом с последовательностью, идентичной кодирующей зрелый полипептид последовательности из SEQ ID NO: 3 или последовательности ее кДНК по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100%.
В дополнительном варианте осуществления настоящее изобретение относится к выделенному полипептиду с лизоцимной активностью, кодируемому полинуклеотидом с последовательностью идентичной кодирующей зрелый полипептид последовательности из SEQ ID NO: 7 или последовательности ее кДНК по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или 100%.
В предпочтительном варианте осуществления настоящее изобретение относится к вариантам зрелого полипептида из SEQ ID NO: 4, содержащим замену, делецию и/или вставку в одном или более (например, нескольких) положениях. В варианте осуществления количество аминокислотных замен, делеций и/или вставок, введенных в зрелый полипептид из SEQ ID NO: 4, составляет не более 45, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41,42,43, 44 или 45.
В предпочтительном варианте осуществления настоящее изобретение относится к вариантам зрелого полипептида из SEQ ID NO: 8, содержащим замену, делецию и/или вставку в одном или более (например, нескольких) положениях. В варианте осуществления количество аминокислотных замен, делеций и/или вставок, введенных в зрелый полипептид из SEQ ID NO: 8, составляет не более 45, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45.
Изменения аминокислот могут быть незначительными, то есть являются консервативными аминокислотными заменами или вставками, которые не оказывают значительного влияния на фолдинг и/или активность белка; небольшими делециями, как правило, 1-30 аминокислот; небольшими удлинениями на амино- или карбокси-конце, как например, метиониновый остаток на амино-конце; небольшим линкерным пептидом из 20-25 остатков; или небольшим удлинением, которое облегчает очистку путем изменения суммарного заряда, или другой функциональной группой, такой как полигистидиновый участок, антигенный эпитоп или связывающий домен.
Примеры консервативных замен являются замены в пределах групп основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и небольших аминокислот (глицин, аланин, серии, треонин и метионин). Аминокислотные замены, которые, в целом, не изменяют специфическую активность, известны из уровня техники и описаны, например, Н. Neurath and R.L. Hill, 1979, In, The Proteins, Academic Press, New York. Обычными заменами являются Ala/Ser, Val/IIe, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/IIe, Leu/Val, Ala/Glu и Asp/Gly.
В качестве альтернативы, изменения аминокислот имеют такую природу, что физико-химические свойства полипептидов изменяются. Например, изменения аминокислот могут улучшать термическую стабильность полипептида, изменять субстратную специфичность, изменять оптимум рН и подобное.
Незаменимые аминокислоты в полипептиде можно идентифицировать в соответствии с процедурами, известными из уровня техники, такими как, сайт-направленный метагенез или аланин-сканирующий мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). В последней методике отдельные мутации, заключающиеся в замене на аланин, вводят по каждому остатку в молекуле, и полученные в результате мутантные молекулы исследуют в отношении лизоцимной активности для идентификации аминокислотных остатков, которые являются определяющими для активности молекулы. См. также, Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Активный участок для ферментативного или другого биологического взаимодействия можно также определить с помощью физического анализа структуры, которую определяют такими методиками, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное мечение в сочетании с мутацией аминокислот предполагаемого контактирующего участка. См., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. Mol. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309: 59-64. Идентичность незаменимых аминокислот можно также вывести из выравнивания с родственным полипептидом.
Одну или несколько аминокислотных замен, делеций и/или вставок можно сделать и исследовать с применением известных способов мутагенеза, рекомбинации и/или шаффлинга с последующей соответствующей процедурой скрининга, как например, таковых, раскрытых в Reidhaar-Olson и Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413 или WO 95/22625. Другие способы, которые можно применять, включают ПЦР с применением неточной ДНК-полимеразы, фаговое отображение (например, Lowman et al., 1991, Biochemistry 30: 10832-10837; патент США №5223409; WO 92/06204) и направленный на участок мутагенез (Derbyshire et al., 1986, Gene 46: 145; Ner et al., 1988, DNA 7: 127).
Способы мутагенеза/шаффлинга можно объединить с автоматизированными способами скрининга с высокой пропускной способностью для выявления активности клонированных подвергнутых мутагенезу полипептидов, экспрессируемых клетками-хозяевами (Ness et а/., 1999, Nature Biotechnology 17: 893-896). Подвергнутые мутагенезу молекулы ДНК, которые кодируют активные полипептиды, можно извлечь из клеток-хозяев и быстро секвенировать с применением стандартных способов из уровня техники. Эти способы обеспечивают возможность быстрого определения важности отдельных аминокислотных остатков в полипептиде.
Полипептид может представлять собой гибридный полипептид, в котором участок одного полипептида слит с N-концом или С-концом участка другого полипептида.
Полипептид может представлять собой слитый полипептид или расщепляемый слитый полипептид, в котором другой полипептид слит с N-концом или С-концом полипептида согласно настоящему изобретению. Слитый полипептид получают путем слияния полинуклеотида, кодирующего другой полипептид, с полинуклеотидом согласно настоящему изобретению. Методики получения слитых полипептидов известны из уровня техники и включают лигирование кодирующих последовательностей, кодирующих полипептиды с тем, чтобы они находились в рамке и чтобы экспрессия слитого полипептида находилась под контролем одного и того же промотора(ов) и терминатора. Слитые полипептиды можно также конструировать с применением интеиновой технологии, в которой слитые полипептиды создаются постртрансляционно (Cooper et al., 1993, EMBO J. 12: 2575-2583; Dawson et al., 1994, Science 266: 776-779).
Слитый полипептид может дополнительно содержать сайт расщепления между двумя полипептидами. После секреции слитого белка сайт расщепляется с высвобождением двух полипептидов. Примеры сайтов расщепления включают без ограничения сайты, раскрытые в Martin et al., 2003, J. Ind. Microbiol. Biotechnol. 3: 568-576; Svetina et al., 2000, J. Biotechnol. 76: 245-251; Rasmussen-Wilson et al., 1997, Appl. Environ. Microbiol. 63: 3488-3493; Ward et al., 1995, Biotechnology 13: 498-503; и Contreras et al., 1991, Biotechnology 9: 378-381; Eaton et al., 1986, Biochemistry 25: 505-512; Collins-Racie et al., 1995, Biotechnology 13: 982-987; Carter et al., 1989, Proteins: Structure, Function, and Genetics 6: 240-248; и Stevens, 2003, Drug Discovery World 4: 35-48.
Кристаллическая структура лизоцима Acremonium alkalophilum CBS114.92 была получена с разрешением 1,3 А. Атомные координаты этой структуры приведены на фигуре 6. Эти атомные координаты можно применять для создания трехмерной модели, описывающей структуру лизоцима Acremonium alkalophilum CBS114.92 или гомологичные структуры (такие как варианты согласно настоящему изобретению).
Лизоцим Acremonium alkalophilum CBS 114.92 относится к семейству гидролаз GH25, которому присвоен номер по Е.С: 3.2.1.17. Каталитический механизм, как полагают, представляет собой классический механизм с сохранением по Кошланду с фактическим сохранением конфигурации в конформации относительно аномерного углерода. Это часто достигается с помощью механизма двухэтапного двойного замещения, включающего ковалентно связанное промежуточное соединение гликозил-фермент. Реакция происходит при содействии кислотных/основных и нуклеофильных механизмов, обеспечиваемом боковыми цепями двух аминокислот. На первом этапе (часто называемом этапом гликозилирования) один аминокислотный остаток (D95) играет роль нуклеофила, атакующего аномерный центр для замещения агликона и образования промежуточного соединения гликозил-фермент. В то же время второй аминокислотный остаток (Е97) функционирует в качестве кислотного катализатора и протонирует кислород в гликозиде при расщеплении связи. На втором этапе (часто называемом этапом дегликозилирования) промежуточное соединение гликозил-фермент подвергается гидролизу водой, причем второй аминокислотный остаток (Е97) теперь действует в качестве основного катализатора, депротонируя входящую молекулу воды. Значение pKa кислотной/основной группы, как полагают, циклически меняется от высокого до низкого значений при катализе для оптимизации ее роли на каждом этапе катализа.
С применением рентгеновской структуры аминокислотные остатки D95 и Е97 (с применением SEQ ID NO: 8 для нумерации) были идентифицированы в качестве каталитических остатков. В вариантах осуществления настоящего изобретения (дополнительно к одному или нескольким изменениям, перечисленным в данном документе) не производят каких-либо изменений аминокислот, соответствующих Е97 и D95 при применении SEQ ID NO: 8 для нумерации, в вариантах лизоцима согласно настоящему изобретению. У некоторых молекул лизоцима известно, что мутация по нуклеофильному остатку может давать фермент, который сохраняет некоторую каталитическую активность предположительно вследствие того, что вода (возможно в форме ОНʺ) может функционировать в качестве нуклеофила на этом первом этапе каталитического механизма (Malcolm, В.А. et al., (1989), ʺSite-directed mutagenesis of the catalytic residues Asp-52 and Glu-35 of chicken egg white lysozymeʺ, Proc. Natl. Acad. Sci. 86(1): 133-137).
Варианты с лизоцимной активностью
Варианты лизоцима согласно настоящему изобретению содержат или состоят из изменений в одном или более (например, нескольких) положениях, соответствующих положениям 6, 10, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190 в зрелом полипептиде из SEQ ID NO: 8, причем каждое изменение независимо представляет собой замену, вставку или делецию, при этом вариант обладает противомикробной и/или лизоцимной активностью.
В варианте осуществления изменение представляет собой замену. В другом варианте осуществления изменение представляет собой вставку. В дополнительном варианте осуществления изменение представляет собой делецию.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную зрелому полипептиду из SEQ ID NO: 4.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 93%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 85% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 90% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 93% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 95% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 96% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 97% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 98% идентичную зрелому полипептиду из SEQ ID NO: 8.
Варианты лизоцима согласно настоящему изобретению содержат или состоят из полипептида, содержащего аминокислотную последовательность по меньшей мере на 99% идентичную зрелому полипептиду из SEQ ID NO: 8.
В одном аспекте количество изменений в вариантах согласно настоящему изобретению составляет 1-45, например, 1-40, 1-35, 1-30, 1-25, 1-20, 1-15, 1-10 и 1-5, как например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45 изменений.
В другом аспекте вариант содержит изменение, такое как замена, вставка или делеция, в одном или более (например, нескольких) положениях, соответствующих положениям 6, 10, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и 190 в зрелом полипептиде из SEQ ID NO: 8. В другом аспекте вариант содержит изменение в двух положениях, соответствующих любому из положений 6, 10, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и 190 в зрелом полипептиде из SEQ ID NO: 8. В другом аспекте вариант содержит изменение в трех положениях, соответствующих любому из положений 6, 10, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и 190 в зрелом полипептиде из SEQ ID NO: 8. В другом аспекте вариант содержит изменение в каждом положении, соответствующих любому из положений 6, 10, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и 190 в зрелом полипептиде из SEQ ID NO: 8.
Вариант осуществления настоящего изобретения заключается в изменении профиля активности в зависимости от рН у лизоцима при сохранении лизоцимной активности и/или противомикробной активности. Предпочтительный вариант осуществления настоящего изобретения заключается в том, что лизоцим обладает улучшенной активностью при более щелочном рН; т.е. рН пиковой противомикробной или лизоцимной активности возрастает/становится более щелочным.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 10 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 10 (при применением SEQ ID NO: 8 для нумерации), которая изменяет профиль активности в зависимости от рН у лизоцима. В другом варианте осуществления изменение включает или заключается в замене W10H, которая повышает рН пиковой противомикробной активности.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 39 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 39 (при применением SEQ ID NO: 8 для нумерации), которая изменяет профиль активности в зависимости от рН у лизоцима. В другом варианте осуществления изменение включает или заключается в замене S39D, которая повышает рН пиковой противомикробной активности.
В другом варианте осуществления выделенный вариант согласно настоящему изобретению заключается в изменении в положении 10 (при применении SEQ ID NO: 8 для нумерации) вместе с изменением в одном или нескольких из следующих положений: 6, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190. Предпочтительный вариант осуществления заключается в замене W10H вместе с изменением в одном или нескольких из следующих положений: 6, 11, 28, 30, 33, 37, 39, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190.
В другом варианте осуществления выделенный вариант согласно настоящему изобретению заключается в изменении в положении 39 (при применении SEQ ID NO: 8 для нумерации) вместе с изменением в одном или нескольких из следующих положений: 6, 10, 11, 28, 30, 33, 37, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190. Предпочтительный вариант осуществления заключается в замене S39D вместе с изменением в одном или нескольких из следующих положений: 6, 10, 11, 28, 30, 33, 37, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190.
В дополнительном варианте осуществления выделенный вариант согласно настоящему изобретению заключается в изменении в положении 10 и 39 (при применении SEQ ID NO: 8 для нумерации). Предпочтительный вариант осуществления заключается в заменах W10H и S39D.
В дополнительном варианте осуществления выделенный вариант согласно настоящему изобретению заключается в изменении в положении 10 и 39 (при применении SEQ ID NO: 8 для нумерации) вместе с изменением в одном или нескольких из следующих положений: 6, 11, 28, 30, 33, 37, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190. Предпочтительный вариант осуществления заключается в заменах W10H и S39D вместе с изменением в одном или нескольких из следующих положений: 6, 11, 28, 30, 33, 37, 59, 60, 61, 62, 63, 92, 93, 94, 96, 98, 99, 100, 101, 106, 133, 134, 135, 136, 137, 139, 140, 142, 143, 158, 161, 162, 178, 183 и/или 190.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 6 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 6 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 11 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 11 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 30 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 30 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 33 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 33 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 37 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 37 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 101 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 101 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 139 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 139 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 161 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 161 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 162 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 162 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 183 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 183 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
В одном варианте осуществления выделенный вариант согласно настоящему изобретению содержит или заключается в изменении в положении 190 (при применении SEQ ID NO: 8 для нумерации). В варианте осуществления изменение включает или заключается в замене аминокислоты в положении 190 (при применением SEQ ID NO: 8 для нумерации), которая изменяет субстратную специфичность лизоцима.
Источники полипептидов с лизоцимной активностью
Полипептид с лизоцимной активностью согласно настоящему изобретению можно получить из микроорганизмов любого рода. В контексте настоящего изобретения выражение ʺполученный изʺ, которое применяется в данном документе применительно к определенному источнику, будет означать, что полипептид, кодируемый полинуклеотидом, продуцируется тем же источником или штаммом, в который был вставлен полинуклеотид из источника. В одном аспекте полипептид, полученный из заданного источника, секретируется за пределы клетки.
Полипептид может представлять собой полипептид грибов. Например, полипептид может представлять собой полипептид нитчатого гриба, такого как Acremonium, Aspergillus, Chrysosporium, Fusarium, Humicola, Penicillium, Thielavia, или полипептид Trichoderma.
В другом аспекте полипептид представляет собой полипептид Acremonium cellulolyticus, Aspergillus aculeatus, Aspergillus awamori, Aspergillus foetidus, Aspergillus fumigatus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Chrysosporium inops, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium merdarium, Chrysosporium pannicola, Chrysosporium queenslnicum, Chrysosporium tropicum, Chrysosporium zonatum, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola grisea, Humicola insolens, Humicola lanuginosa, Irpex lacteus, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium funiculosum, Penicillium purpurogenum, Phanerochaete chrysosporium, Thielavia achromatica, Thielavia albomyces, Thielavia albopilosa, Thielavia australeinsis, Thielavia fimeti, Thielavia microspora, Thielavia ovispora, Thielavia peruviana, Thielavia setosa, Thielavia spededonium, Thielavia subthermophila, Thielavia terrestris, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
В другом аспекте полипептид представляет собой полипептид Acremonium alcalophilum, например, полипептид, полученный из Acremonium alcalophilum CBS 114.92.
Будет понятно, что в отношении вышеупомянутых видов настоящее изобретение охватывает как совершенную, так и несовершенную стадии, а также другие таксономические эквиваленты, например анаморфы, вне зависимости от названия вида, под которым они известны. Специалисты в данной области техники легко поймут идентичность соответствующих эквивалентов.
Штаммы этих видов являются легкодоступными неограниченному кругу лиц в ряде коллекций культур, таких как Американская коллекция типовых культур (American Туре Culture Collection) (ATCC), Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ), Centraalbureau Voor Schimmelcultures (CBS) и Коллекция патентованных культур Службы сельскохозяйственных исследований (Agricultural Research Service Patent Culture Collection), Северный региональный исследовательский центр (Northern Regional Research Center) (NRRL).
Полипептид можно идентифицировать и получить из других источников, в том числе микроорганизмов, выделенных из природной среды (например, почвы, компостов, воды и т.д.), или образцов ДНК, полученных непосредственно из природных материалов (например, почвы, компостов, воды и т.д.), с применением вышеупомянутых зондов. Методики выделения микроорганизмов и ДНК непосредственно из естественных мест обитания хорошо известны из уровня техники. Полинуклеотид, кодирующий полипептид, можно затем получить подобным образом путем скрининга библиотеки геномной ДНК или кДНК другого микроорганизма или образца смешанной ДНК. После того как полинуклеотид, кодирующий полипептид, был выявлен зондом(ами), полинуклеотид можно выделить или клонировать с применением методик, которые хорошо известны специалисту в данной области техники (см., например, Sambrook et al., 1989, выше).
Полинуклеотиды
Настоящее изобретение также относится к выделенным полинуклеотидам, кодирующим полипептид согласно настоящему изобретению, который описан в данном документе.
Методики, применяемые для выделения или клонирования полинуклеотида, известны из уровня техники и включают выделение из геномной ДНК или кДНК или их комбинации. Клонирование полинуклеотидов из геномной ДНК можно осуществить, например, при применении хорошо известной полимеразной цепной реакции (ПЦР) или скрининга библиотек экспрессии с помощью антител для выявления клонированных фрагментов ДНК с общими структурными особенностями. См., например, Innis et al., 1990, PCR: A Guide to Methods and Application, Academic Press, New York. Можно применять другие процедуры амплификации нуклеиновой кислоты, такие как лигазная цепная реакция (LCR), активированная лигированием транскрипция (LAT) и реакция транскрипционной амплификации (NASBA). Полинуклеотиды можно клонировать из штамма Aspergillus или Acremonium или родственного организма, и следовательно, может, например, присутствовать аллельный или видовой вариант участка полинуклеотида, кодирующего полипептид.
Модификация полинуклеотида, кодирующего полипептид согласно настоящему изобретению, может быть необходима для синтеза полипептидов, по сути аналогичных указанному полипептиду. Выражение ʺпо сути аналогичныйʺ полипептиду, относится к не встречающимся в естественных условиях формам полипептида. Данные полипептиды могут отличаться некоторыми привнесенными конструктивными особенностями от полипептида, выделенного из его нативного источника, например, варианты, которые отличаются специфической активностью, термостабильностью, оптимумом рН или подобным. Варианты можно сконструировать на основе полинуклеотида, присутствующего в виде кодирующей зрелый полипептид последовательности из SEQ ID NO: 3 или SEQ ID NO: 7 или последовательностей их кДНК, например, их подпоследовательности, и/или путем введения нуклеотидных замен, которые не приводят в результате к изменению аминокислотной последовательности полипептида, но которые соответствуют применению кодона у организма-хозяина, предполагаемого для продуцирования фермента, или путем введения нуклеотидных замен, которые могут быть источником различных аминокислотных последовательностей. Для общего описания нуклеотидных замен, см., например, Ford et al., 1991, Protein Expression and Purification 2: 95-107.
Конструкты нуклеиновой кислоты
Настоящее изобретение также относится к конструктам нуклеиновой кислоты, содержащим полинуклеотид согласно настоящему изобретению, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют экспрессией кодирующей последовательности в подходящей клетке-хозяине в условиях, соответствующих регуляторным последовательностям.
С полинуклеотидом можно производить манипуляции рядом способов для обеспечения экспрессии полипептида. Манипуляция с полинуклеотидом до его вставки в вектор может быть желательной или необходимой в зависимости от вектора экспрессии. Методики модификации полинуклеотидов, в которых применяют способы с рекомбинантной ДНК, хорошо известны из уровня техники.
Регуляторная последовательность может представлять собой промотор, полинуклеотид, который узнается клеткой-хозяином для экспрессии полинуклеотида, кодирующего полипептид согласно настоящему изобретению. Промотор содержит последовательности, регулирующие транскрипцию, которые опосредуют экспрессию полипептида. Промотор может представлять собой любой полинуклеотид, который проявляет активность в отношении транскрипции в клетке-хозяине, в том числе мутантные, усеченные и гибридные промоторы, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды либо гомологичные, либо гетерологичные по отношению к клетке-хозяину.
Примеры подходящих промоторов для управления транскрипцией конструктов нуклеиновой кислоты согласно настоящему изобретению в бактериальной клетке-хозяине представляют собой промоторы, полученные из гена альфа-амилазы Bacillus amyloliquefaciens (amyQ), гена альфа-амилазы Bacillus licheniformis (amyL), гена пенициллиназы Bacillus licheniformis (penP), гена мальтогенной амилазы Bacillus stearothermophilus (amyM), гена левансахаразы Bacillus subtilis (sacB), генов xylA и xylB Bacillus subtilis, гена crylllA Bacillus thuringiensis (Agaisse and Lereclus, 1994, Molecular Microbiology 13: 97-107), lac оперона Ε. coli, trc промотора Ε. coli (Egon et al., 1988, Gene 69: 301-315), гена агаразы Streptomyces coelicolor (dagA) и гена прокариотической бета-лактамазы (Villa-Kamaroff et al., 1978, Proc. Natl. Acad. Sci. USA 75: 3727-3731), а также tac промотор (DeBoer et al., 1983, Proc. Natl. Acad. Sci. USA 80: 21-25). Дополнительные промоторы описаны в ʺUseful proteins from recombinant bacteriaʺ у Gilbert et al., 1980, Scientific American 242: 74-94; и в Sambrook et al., 1989, выше. Примеры тандемных промоторов раскрыты в WO 99/43835.
Примеры подходящих промоторов для управления транскрипцией конструктов нуклеиновой кислоты согласно настоящему изобретению в клетке-хозяине, относящейся к нитчатому грибу, представляют собой промоторы, полученные из генов ацетамидазы Aspergillus nidulans, нейтральной альфа-амилазы Aspergillus niger, устойчивой к кислоте альфа-амилазы Aspergillus niger, глюкоамилазы Aspergillus niger или Aspergillus awamori (glaA), TAKA амилазы Aspergillus oryzae, щелочной протеазы Aspergillus oryzae, триозофосфат-изомеразы Aspergillus oryzae, трипсин-подобной протеазы Fusarium oxysporum (WO 96/00787), амилоглюкозидазы Fusarium venenatum (WO 00/56900), Daria Fusarium venenatum (WO 00/56900), Quinn Fusarium venenatum (WO 00/56900), липазы Rhizomucor miehei, аспартат-протеиназы Rhizomucor miehei, бета-глюкозидазы Trichoderma reesei, целлобиогидролазы I Trichoderma reesei, целлобиогидролазы II Trichoderma reesei, эндоглюканазы I Trichoderma reesei, эндоглюканазы II Trichoderma reesei, эндоглюканазы III Trichoderma reesei, эндоглюканазы IV Trichoderma reesei, эндоглюканазы V Trichoderma reesei, ксиланазы I Trichoderma reesei, ксиланазы II Trichoderma reesei, бета-ксилозидазы Trichoderma reesei, а также промотор NA2-tpi (модифицированный промотор из гена нейтральной альфа-амилазы Aspergillus, в котором нетранслируемая лидерная последовательность была заменена на нетранслируемую лидерную последовательность из гена триозофосфат-изомеразы Aspergillus; неограничивающие примеры включают модифицированные промоторы из гена нейтральной альфа-амилазы Aspergillus niger, в которых нетранслируемая лидерная последовательность была заменена на нетранслируемую лидерную последовательность из гена триозофосфтат-изомеразы Aspergillus nidulans или Aspergillus oryzae); а также мутантные, усеченные и гибридные промоторы из них.
В хозяине, относящемся к дрожжам, пригодные промоторы являются полученными из генов енолазы (ENO-1) Saccharomyces cerevisiae, галактокиназы (GAL1) Saccharomyces cerevisiae, алкоголь-дегидрогеназы/глицеральдегид-3-фосфат-дегидрогеназы (ADH1, ADH2/GAP) Saccharomyces cerevisiae, триозофосфат-изомеразы (TPI) Saccharomyces cerevisiae, металлотионеина (CUP1) Saccharomyces cerevisiae и 3-фосфоглицерат-киназы Saccharomyces cerevisiae. Другие пригодные промоторы для клеток-хозяев, относящихся к дрожжам, описаны Romanos et al., 1992, Yeast 8: 423-488.
Регуляторная последовательность может также представлять собой терминатор транскрипции, который узнается клеткой-хозяином с терминацией транскрипции. Терминатор функционально связан с 3ʹ-концом полинуклеотида, кодирующего полипептид. В настоящем изобретении можно применять любой терминатор, который является функциональным в клетке-хозяине.
Предпочтительные терминаторы для бактериальных клеток-хозяев получены из генов щелочной протеазы (aprH) Bacillus clausii, альфа-амилазы (amyL) Bacillus licheniformis и рибосомной РНК (rrnB) Escherichia coli.
Предпочтительные терминаторы для клеток-хозяев, относящихся к нитчатым грибам, получены из генов антранилат-синтазы Aspergillus nidulans, глюкоамилазы Aspergillus niger, альфа-глюкозидазы Aspergillus niger, ТАКА-амилазы Aspergillus oryzae и трипсиноподобной протеазы Fusarium oxysporum.
Предпочтительные терминаторы для клеток-хозяев, относящихся к дрожжам, получены из генов енолазы Saccharomyces cerevisiae, цитохрома С (CYC1) Saccharomyces cerevisiae и глицеральдегид-3-фосфат-дегидрогеназы Saccharomyces cerevisiae. Другие пригодные терминаторы для клеток-хозяев, относящихся к дрожжам, описаны Romanos et al., 1992, выше.
Регуляторная последовательность может также представлять собой участок-стабилизатор мРНК, находящийся ниже промотора и выше кодирующей последовательности гена, который повышает экспрессию гена.
Примеры подходящих участков-стабилизаторов мРНК получены из гена cryIIIA Bacillus thuringiensis (WO 94/25612) и гена SP82 Bacillus subtilis (Hue et al., 1995, Journal of Bacteriology 177: 3465-3471).
Регуляторная последовательность может также представлять собой лидерную последовательность, нетранслируемый участок мРНК, который важен для трансляции клеткой-хозяином. Лидер функционально связан с 5ʹ-концом полинуклеотида, кодирующего полипептид. Можно применять любую лидерную последовательность, которая является функциональной в клетке-хозяине.
Предпочтительные лидерные последовательности для клеток-хозяев, относящихся к нитчатым грибам, получены из генов ТАКА-амилазы Aspergillus oryzae и триозофосфат-изомеразы Aspergillus nidulans.
Подходящие лидерные последовательности для клеток-хозяев, относящихся к дрожжам, получены из генов енолазы (ENO-1) Saccharomyces cerevisiae, 3-фосфоглицерат-киназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae и алкоголь-дегидрогеназы/глицеральдегид-3-фосфат-дегидрогеназы (ADH2/GAP) Saccharomyces cerevisiae.
Регуляторная последовательность может также представлять собой последовательность полиаденилирования, последовательность, функционально связанную с 3ʹ-концом полинкулеотида, и при транскрипции распознается клеткой-хозяином как сигнал к присоединению полиаденозиновых остатков к транскрибируемой мРНК. Можно применять любую последовательность полиаденилирования, которая является функциональной в клетке-хозяине.
Предпочтительные последовательности полиаденилирования для клеток-хозяев, относящихся к нитчатым грибам, получены из генов антранилат-синтазы Aspergillus nidulans, глюкоамилазы Aspergillus niger, альфа-глюкозидазы Aspergillus niger, ТАКА-амилазы Aspergillus oryzae и трипсиноподобной протеазы Fusarium oxysporum.
Пригодные последовательности полиаденилирования для клеток-хозяев, относящихся к дрожжам, описаны Guo and Sherman, 1995, Mol. Cellular Biol. 15: 5983-5990.
Регуляторная последовательность может также представлять собой сигнальный пептид, кодирующий участок, который кодирует сигнальный пептид, связанный с N-концом полипептида, и направляет полипептид по клеточному секреторному пути. 5ʹ-Конец кодирующей последовательности полинуклеотида может от природы содержать последовательность, кодирующую сигнальный пептид, связанную в естественных условиях в трансляционной рамке считывания с сегментом кодирующей последовательности, которая кодирует полипептид. В качестве альтернативы, 5ʹ-конец кодирующей последовательности может содержать последовательность, кодирующую сигнальный пептид, который является чужеродным относительно кодирующей последовательности. Последовательность, кодирующая чужеродный сигнальный пептид, может требоваться в тех случаях, когда кодирующая последовательность в естественных условиях не содержит последовательность, кодирующую сигнальный пептид. В качестве альтернативы, последовательностью, кодирующей чужеродный сигнальный пептид, можно просто заменить последовательность, кодирующую сигнальный пептид в естественных условиях, с целью повышения секреции полипептида. Тем не менее, можно применять любую последовательность, кодирующую сигнальный пептид, которая направляет экспрессируемый полипептид по секреторному пути в клетке-хозяине.
Эффективные кодирующие сигнальный пептид последовательности для бактериальных клеток-хозяев представляют собой последовательности, кодирующие сигнальный пептид, полученные из генов мальтогенной амилазы Bacillus NCIB 11837, субтилизина Bacillus licheniformis, бета-лактамазы Bacillus licheniformis, альфа-амилазы Bacillus stearothermophilus, нейтральных протеаз (nprT, nprS, nprM) Bacillus stearothermophilus и prsA Bacillus subtilis. Дополнительные сигнальные пептиды описаны Simonen and Palva, 1993, Microbiological Reviews 57: 109-137.
Эффективные кодирующие сигнальный пептид последовательности для клеток-хозяев, относящихся к нитчатым грибам, представляют собой последовательности, кодирующие сигнальный пептид, полученные из генов нейтральной амилазы Aspergillus niger, глюкоамилазы Aspergillus niger, TAKA-амилазы Aspergillus oryzae, целлюлазы Humicola insolens, эндоглюканазы V Humicola insolens, липазы Humicola lanuginosa и аспартат-протеиназы Rhizomucor miehei.
Пригодные сигнальные пептиды для клеток-хозяев, относящихся к дрожжам, получены из генов альфа-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие пригодные последовательности, кодирующие сигнальный пептид, описаны Romanos et al., 1992, выше.
Регуляторная последовательность может также представлять собой кодирующую последовательность пропептида, которая кодирует пропептид, расположенный на N-конце полипептида. Получаемый в результате полипептид известен как профермент или прополипептид (или, в некоторых случаях, зимоген). Прополипептид обычно неактивен и может быть превращен в активный полипептид путем каталитического или аутокаталитического отщепления пропептида от прополипептида. Последовательность, кодирующую пропептид, можно получить из генов щелочной протеазы (aprE) Bacillus subtilis, нейтральной протеазы (nprT) Bacillus subtilis, лакказы Myceliophthora thermophila (WO 95/33836), аспартат-протеиназы Rhizomucor miehei и альфа-фактора Saccharomyces cerevisiae.
В случае, если присутствуют последовательности как сигнального пептида, так и пропептида, последовательность пропептида расположена возле N-конца полипептида, и последовательность сигнального пептида расположена возле N-конца последовательности пропептида.
Также может быть желательным добавление регулирующих последовательностей, которые регулируют экспрессию полипептида относительно роста клетки-хозяина. Примеры регулирующих систем представляют собой таковые, которые вызывают включение или выключение экспрессии гена в ответ на химический или физический стимул, в том числе на присутствие регулирующего соединения. Регулирующие системы в прокариотических системах включают системы с lac, tac и trp операторами. У дрожжей можно применять систему ADH2 или систему GAL1. У нитчатых грибов можно применять глюкоамилазный промотор Aspergillus niger, ТАКА-альфа-амилазный промотор Aspergillus oryzae и глюкоамилазный промотор Aspergillus oryzae. Другими примерами регулирующих последовательностей являются таковые, которые обеспечивают возможность амплификации гена. В эукариотических системах эти регулирующие последовательности включают ген дигидрофолоат-редуктазы, который амплифицируется в присутствии метотрексата, и гены металлотионеина, которые амплифицируются с тяжелыми металлами. В этих случаях полинуклеотид, кодирующий полипептид, будет функционально связан с регулирующей последовательностью.
Векторы экспрессии
Настоящее изобретение также относится к рекомбинантным векторам экспрессии, содержащим полинуклеотид согласно настоящему изобретению, промотор и сигналы остановки транскрипции и трансляции. Различные нуклеотидные и регуляторные последовательности можно объединить вместе с получением рекомбинантного вектора экспрессии, который может включать один или несколько соответствующих сайтов рестрикции для обеспечения возможности вставки или замещения полинуклеотида, кодирующего полипептид, по таким сайтам. В качестве альтернативы, полинуклеотид можно экспрессировать посредством вставки полинуклеотида или конструкта нуклеиновой кислоты, содержащего полинуклеотид, в подходящий вектор для экспрессии. При создании вектора экспрессии кодирующая последовательность располагается в векторе таким образом, чтобы кодирующая последовательность была функционально связанной с подходящими регуляторными последовательностями для экспрессии.
Рекомбинантный вектор экспрессии может представлять собой любой вектор (например, плазмиду или вирус), который можно удобным образом подвергнуть процедурам с применением рекомбинантной ДНК и который может приводить к экспрессии полинуклеотида. Выбор вектора, как правило, будет зависеть от совместимости вектора с клеткой-хозяином, в которую должен быть введен вектор. Вектор может представлять собой линейную или замкнутую кольцевую плазмиду.
Вектор может представлять собой автономно реплицирующийся вектор, т.е. вектор, который существует в виде внехромосомной единицы, репликация которой является независимой от хромосомной репликации, например, плазмиду, внехромосомный элемент, минихромосому или искусственную хромосому. Вектор может содержать любые средства для обеспечения саморепликации. В качестве альтернативы, вектор может представлять собой таковой, который при введении в клетку-хозяина, интегрируется в геном и реплицируется вместе с хромосомой(ами), в которую он был интегрирован. Более того, можно применять один вектор или плазмиду или два или более векторов или плазмид, которые в совокупности содержат общую ДНК, которую необходимо ввести в геном клетки-хозяина или транспозон.
Вектор предпочтительно содержит один или несколько селектируемых маркеров, которые позволяют легко проводить отбор трансформированных, трансфицированных, трансдуцированных или подобных клеток. Селектируемый маркер представляет собой ген, продукт которого обеспечивает устойчивость к биоциду или вирусу, устойчивость к тяжелым металлам, прототрофию ауксотрофам и подобное.
Примеры бактериальных селектируемых маркеров представляют собой dal-гены Bacillus licheniformis или Bacillus subtilis или маркеры, которые придают устойчивость к антибиотикам, как например, устойчивость к ампициллину, хлорамфениколу, канамицину, неомицину, спектиномицину или тетрациклину. Подходящие маркеры для клеток-хозяев, относящихся к дрожжам, включают без ограничения ADE2, HIS3, LEU2, LYS2, МЕТЗ, TRP1 и URA3. Селектируемые маркеры для применения в клетке-хозяине, относящейся к нитчатому грибу, включают без ограничения amdS (ацетамидаза), argfS (орнитин-карбамоилтрансфераза), bar (фосфинотрицин-ацетилтрансфераза), hph (гигромицин-фосфотрансфераза), niaD (нитрат-редуктаза), pyrG (оротидин-5ʹ-фосфат-декарбоксилаза), sC (сульфат-аденилтрансфераза) и trpC (антранилат-синтаза), а также их эквиваленты. Для применения в клетке Aspergillus предпочтительными являются гены amdS и pyrG Aspergillus nidulans или Aspergillus oryzae и ген bar Streptomyces hygroscopicus.
Вектор предпочтительно содержит элемент(ы), которые обеспечивают интеграцию вектора в геном клетки-хозяина или автономную репликацию вектора в клетке независимо от генома.
Для интеграции в геном клетки-хозяина вектор может основываться на последовательности полинуклеотида, кодирующей полипептид или любой другой элемент вектора для интеграции в геном путем гомологичной или негомологичной рекомбинации. В качестве альтернативы, вектор может содержать дополнительные полинуклеотиды для управления интеграцией путем гомологичной рекомбинации в геном клетки-хозяина в точном местоположении(ях) в хромосоме(ах). Для повышения вероятности интеграции в точное местоположение интегрирующие элементы должны содержать достаточное количество нуклеиновых кислот, как например, от 100 до 10000 пар оснований, от 400 до 10000 пар оснований и от 800 до 10000 пар оснований, которые характеризуются высокой степенью идентичности последовательности с соответствующей последовательностью-мишенью для повышения возможности гомологичной рекомбинации. Интегрирующие элементы могут представлять собой любую последовательность, которая является гомологичной последовательности-мишени в геноме клетки-хозяина. Более того, интегрирующие элементы могут представлять собой некодирующие или кодирующие полинуклеотиды. С другой стороны, вектор можно интегрировать в геном клетки-хозяина путем негомологичной рекомбинации.
Для автономной репликации вектор может дополнительно содержать точку начала репликации, что обеспечивает возможность автономной репликации вектора в рассматриваемой клетке-хозяине. Точка начала репликации может представлять собой любой плазмидный репликатор, опосредующий автономную репликацию, который функционирует в клетке. Выражение ʺточка начала репликацииʺ или ʺплазмидный репликаторʺ означает полинуклеотид, который обеспечивает возможность репликации плазмиды или вектора in vivo.
Примеры точек начала репликации у бактерий представляют собой точки начала репликации из плазмид pBR322, pUC19, pACYC177 и pACYC184, обеспечивающие возможность репликации в Е. coli, и pUB110, рЕ194, рТАЮбО и ρΑΜβΙ, обеспечивающие возможность репликации в Bacillus.
Примеры точек начала репликации для применения у клеток-хозяев, относящихся к дрожжам, представляют собой точку начала репликации 2-микронной плазмиды, ARS1, ARS4, комбинацию ARS1 и CEN3 и комбинацию ARS4 и CEN6.
Примеры точек начала репликации, пригодных в клетке нитчатого гриба, представляют собой АМА1 и ANSI (Gems et al., 1991, Gene 98: 61-67; Cullen et al., 1987, Nucleic Acids Res. 15: 9163-9175; WO 00/24883). Выделение гена AMA1 и конструирование плазмид или векторов, содержащих ген, можно проводить в соответствии со способами, раскрытыми в WO 00/24883.
В клетку-хозяин для повышения продуцирования полипептида можно ввести более чем одну копию полинуклеотида согласно настоящему изобретению. Повышение числа копий полинуклеотида можно получить путем интеграции по меньшей мере одной дополнительной копии последовательности в геном клетки-хозяина или путем включения способного к амплификации гена-селектируемого маркера с полинуклеотидом, причем клетки, содержащие амплифицированные копии гена-селектируемого маркера и, следовательно, дополнительные копии полинуклеотида, можно отбирать путем культивирования клеток в присутствии подходящего селектируемого средства.
Процедуры, применяемые для лигирования описанных выше элементов для конструирования рекомбинантных векторов экспрессии согласно настоящему изобретению, хорошо известны специалисту в данной области техники (см., например, Sambrook et al., 1989, выше).
Сигнальный пептид
Настоящее изобретение также относится к выделенному полинуклеотиду, кодирующему сигнальный пептид, содержащий аминокислоты с 1 по 19 в SEQ ID NO: 4 или аминокислоты с -40 по -18 в SEQ ID NO: 4. Полинуклеотиды могут дополнительно содержать ген, кодирующий белок, который функционально связан с сигнальным пептидом. Белок предпочтительно является чужеродным по отношению к сигнальному пептиду. В одном аспекте полинуклеотид, кодирующий сигнальный пептид, представляет собой нуклеотиды 1-57 в SEQ ID NO: 3 или нуклеотиды с 1 по 69 в SEQ ID NO: 7.
Настоящее изобретение также относится к конструктам нуклеиновой кислоты, векторам экспрессии и рекомбинантным клеткам-хозяевам, содержащим такие полинуклеотиды.
Настоящее изобретение также относится к способам получения белка, включающим
(a) культивирование рекомбинантной клетки-хозяина, содержащей такой полинуклеотид; и
(b) извлечение белка.
Белок может быть нативным или гетерологичным по отношению к клетке-хозяину. Выражение ʺбелокʺ в данном документе не относится к конкретной длине кодируемого продукта и, следовательно, охватывает пептиды, олигопептиды и полипептиды. Выражение ʺбелокʺ также охватывает два или более полипептидов, объединенных с образованием кодируемого продукта. Белки также включают гибридные полипептиды и слитые полипептиды.
Предпочтительно, белок представляет собой гормон, фермент, рецептор или их часть, антитело или его часть или репортер. Например, белок может представлять собой гидролазу, изомеразу, лигазу, лиазу, оксидоредуктазу или трансферазу, например, аминопептидазу, амилазу, карбогидразу, карбоксипептидазу, каталазу, целлобиогидролазу, целлюлазу, хитиназу, кутиназу, циклодекстрин-гликозилтрансферазу, дезоксирибонуклеазу, эндоглюканазу, эстеразу, альфа-галактозидазу, бета-галактозидазу, глюкоамилазу, альфа-глюкозидазу, бета-глюкозидазу, инвертазу, лакказу, липазу, маннозидазу, мутаназу, оксидазу, пектинолитический фермент, пероксидазу, фитазу, полифенолоксидазу, протеолитический фермент, рибонуклеазу, трансглутаминазу, ксиланазу или бета-ксилозидазу.
Ген может быть получен из любого прокариотического, эукариотического или другого источника.
Клетки-хозяева
Настоящее изобретение также относится к рекомбинантным клеткам-хозяевам, содержащим полинуклеотид согласно настоящему изобретению, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют продуцированием полипептида согласно настоящему изобретению. Конструкт или вектор, содержащий полинуклеотид, вводят в клетку-хозяина с тем, чтобы конструкт или вектор сохранялся в виде интегрированного в хромосому элемента или в виде самореплицирующегося внехромосомного вектора, как описано ранее. Выражение ʺклетка-хозяинʺ охватывает любого потомка исходной клетки, который не является идентичным исходной клетке вследствие мутаций, которые имеют место в ходе репликации. Выбор клетки-хозяина будет в значительной степени зависеть от гена, кодирующего полипептид, и его источника.
Клетка-хозяин может представлять собой любую клетку, пригодную при рекомбинантном получении полипептида согласно настоящему изобретению, например, прокариота или эукариота.
Прокариотическая клетка-хозяин может представлять собой любую грамположительную или грамотрицательную бактерию. Грамположительные бактерии включают без ограничения Bacillus, Clostridium, Enterococcus, Geobacillus, Lactobacillus, Lactococcus, Oceanobacillus, Staphylococcus, Streptococcus и Streptomyces. Грамотрицательные бактерии включают без ограничения Campylobacter, Ε. coli, Flavobacterium, Fusobacterium, Helicobacter, llyobacter, Neisseria, Pseudomonas, Salmonella и Ureaplasma.
Бактериальная клетка-хозяин может представлять собой любую из клетки Bacillus, в том числе без ограничения клетки Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis и Bacillus thuringiensis.
Бактериальная клетка-хозяин может также представлять собой любую клетку Streptococcus, в том числе без ограничения клетки Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis и Streptococcus equi подвида Zooepidemicus.
Бактериальная клетка-хозяин может также представлять собой любую клетку Streptomyces, в том числе без ограничения клетки Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus и Streptomyces lividans.
Введение ДНК в клетку Bacillus можно осуществлять путем трансформации протопластов (см., например, Chang and Cohen, 1979, Mol. Gen. Genet. 168: 111-115), трансформации компетентных клеток (см., например, Young and Spizizen, 1961, J. Bacteriol. 81: 823-829, или Dubnau and Davidoff-Abelson, 1971, J. Mol. Biol. 56: 209-221), электропорации (см., например, Shigekawa and Dower, 1988, Biotechniques 6: 742-751) или конъюгации (см., например, Koehler and Thorne, 1987, J. Bacteriol. 169: 5271-5278). Введение ДНК в клетку Ε. coli можно осуществлять путем трансформации протопластов (см., например, Hanahan, 1983, J. Mol. Biol. 166: 557-580) или электропорации (см., например, Dower et al., 1988, Nucleic Acids Res. 16: 6127-6145). Введение ДНК в клетку Streptomyces можно осуществлять путем трансформации протопластов, электропорации (см., например, Gong et al., 2004, Folia Microbiol. (Praha) 49: 399-405), конъюгации (см., например, Mazodier et al., 1989, J. Bacteriol. 171: 3583-3585) или трансдукции (см., например, Burke et al., 2001, Proc. Natl. Acad. Sci. USA 98: 6289-6294). Введение ДНК в клетку Pseudomonas можно осуществлять путем электропорации (см., например, Choi et al., 2006, J. Microbiol. Methods 64: 391-397) или конъюгации (см., например, Pinedo and Smets, 2005, Appl. Environ. Microbiol. 71: 51-57). Введение ДНК в клетку Streptococcus можно осуществлять путем естественной компетентности (см., например, Perry and Kuramitsu, 1981, Infect. Immun. 32: 1295-1297), трансформации протопластов (см., например, Catt and Jollick, 1991, Microbios 68: 189-207), электропорации (см., например, Buckley et al., 1999, Appl. Environ. Microbiol. 65: 3800-3804) или конъюгации (см., например, Clewell, 1981, Microbiol. Rev. 45: 409-436). Тем не менее можно применять любой известный из уровня техники способ введения ДНК в клетку-хозяина.
Клетка-хозяин может также быть эукариотической клеткой, такой как клетка млекопитающего, насекомого, растения или гриба.
Клетка-хозяин может представлять собой клетку гриба. ʺГрибыʺ, как применяется в данном документе, включают отделы Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota, а также Oomycota и все митоспоровые грибы (как определено Hawksworth et al., In, Ainsworth and Bisbyʹs Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK).
Грибковая клетка-хозяин может представлять собой клетку дрожжей. ʺДрожжиʺ, как определено в данном документе, включают аскоспорогенные дрожжи (эндомицетовые), базидиоспорогенные дрожжи и дрожжи, принадлежащие к несовершенным грибам (бластомицеты). Поскольку классификация дрожжей в будущем может измениться, в контексте настоящего изобретения дрожжи следует определять как описано в Biology and Activities of Yeast (Skinner, Passmore, and Davenport, editors, Soc.App.Bacteriol. Symposium Sehes No. 9, 1980).
Клетка-хозяин, относящаяся к дрожжам, может представлять собой клетку Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia, как например, клетку Kluyveromyces lactis, Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis, Saccharomyces oviformis или Yarrowia lipolytica.
Грибковая клетка-хозяин может представлять собой клетку, относящуюся к нитчатому грибу. ʺНитчатые грибыʺ включают все нитчатые формы подотделов Eumycota и Oomycota (как определено Hawksworth et al., 1995, выше). Нитчатые грибы в целом характеризуются мицелиальной стенкой, состоящей из хитина, целлюлозы, глюкана, хитозана, маннана и других сложных полисахаридов. Вегетативный рост происходит путем удлинения гиф, а катаболизм углерода является облигатно аэробным. Напротив, вегетативный рост дрожжей, таких как Saccharomyces cerevisiae, происходит путем отпочковывания одноклеточного таллома, а катаболизм углерода может быть ферментативным.
Клетка-хозяин может представлять собой клетку Acremonium, Aspergillus, Aureobasidium, Bjerkandera, Ceriporiopsis, Chrysosporium, Coprinus, Coriolus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Phlebia, Piromyces, Pleurotus, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes или Trichoderma.
Например, клетка-хозяин, относящаяся к нитчатому грибу, может представлять собой клетку Aspergillus awamori, Aspergillus foetidus, Aspergillus fumigatus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Bjerkandera adusta, Ceriporiopsis aneirina, Ceriporiopsis caregiea, Ceriporiopsis gilvescehs, Ceriporiopsis pannocinta, Ceriporiopsis rivulosa, Ceriporiopsis subrufa, Ceriporiopsis subvermispora, Chrysosporium inops, Chrysosporium keratinophilum, Chrysosporium lucknowense, Chrysosporium merdarium, Chrysosporium pannicola, Chrysosporium queenslandicum, Chrysosporium tropicum, Chrysosporium zonatum, Coprinus cinereus, Coriolus hirsutus, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Phlebia radiata, Pleurotus eryngii, Thielavia terrestris, Trametes villosa, Trametes versicolor, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
Грибковые клетки можно трансформировать с помощью способа, включающего образование протопластов, трансформацию протопластов и регенерацию клеточной стенки способом, известным per se. Подходящие процедуры для трансформации клеток-хозяев Aspergillus и Trichoderma описаны в ЕР 238023, Yelton et al., 1984, Proc. Natl. Acad. Sci. USA 81: 1470-1474, и Christensen et al., 1988, Bio/Technology 6: 1419-1422. Подходящие способы трансформации видов рода Fusahum описаны Malardier et al., 1989, Gene 78: 147-156, и WO 96/00787. Дрожжи можно трансформировать с применением процедур, описанных Becker and Guarente, In Abelson, J.N. and Simon, M.I., editors, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp 182-187, Academic Press, Inc., New York; Ito etal., 1983, J. Bacteriol. 153: 163; и Hinnen et al., 1978, Proc. Natl. Acad. Sci. USA 75: 1920.
Способы получения
Настоящее изобретение также относится к способам получения полипептида согласно настоящему изобретению, включающим (а) культивирование клетки, которая в форме дикого типа продуцирует полипептид, в условиях, благоприятных для продуцирования полипептида; и (b) извлечение полипептида. В предпочтительном аспекте клетка представляет собой клетку Acremonium. В более предпочтительном аспекте клетка представляет собой клетку Acremonium alcalophilum. В наиболее предпочтительном аспекте клетка представляет собой Acremonium alcalophilum CBS114.92.
Настоящее изобретение также относится к способам получения полипептида согласно настоящему изобретению, включающим (а) культивирование рекомбинантной клетки-хозяина согласно настоящему изобретению в условиях, благоприятных для продуцирования полипептида; и (b) извлечение полипептида.
Клетки-хозяев культивируют в питательной среде, подходящей для продуцирования полипептида с применением способов, известных из уровня техники. Например, клетку можно культивировать путем культивирования во встряхиваемой колбе или при мелкомасштабной или крупномасштабной ферментации (в том числе непрерывной, периодической, с подпиткой или твердофазной ферментации) в лабораторных или промышленных ферментерах, осуществляемой в подходящей среде и при условиях, обеспечивающих возможность экспрессии и/или выделения полипептида. Культивирование проходит в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, с применением процедур, известных из уровня техники. Подходящие среды доступны от коммерческих поставщиков или могут быть приготовлены в соответствии с опубликованными композициями (например, в каталогах Американской коллекции типовых культур). Если полипептид секретируется в питательную среду, полипептид можно извлечь непосредственно из среды. Если полипептид не секретируется, его можно извлечь из клеточных лигированию.
Полипептид можно выявить с применением способов, известных из уровня техники, которые являются специфическими в отношении полипептидов, например, капельного анализа на лизоцим, как описано ниже. Эти способы выявления включают без ограничения применение специфических антител, образование продукта фермента или исчезновение субстрата фермента. Например, анализ ферментативной активности можно применять для определения активности полипептида.
Полипептид можно извлечь с применением способов, известных из уровня техники. Например, полипептид можно извлечь из питательной среды с помощью общепринятых процедур, в том числе без ограничения сбора, центрифугирования, фильтрования, экстракции, распылительной сушки, испарения или осаждения.
Полипептид можно очистить с помощью ряда процедур, известных из уровня техники, в том числе без ограничения хроматографии (например, ионообменной, аффинной, гидрофобной хроматографии, хроматофокусирования и гель-хроматографии), электрофоретических процедур (например, препаративного изоэлектрического фокусирования), дифференциальной растворимости (например, осаждение сульфатом аммония), SDS-PAGE или экстракции (см., например, Protein Purification, Janson and Ryden, editors, VCH Publishers, New York, 1989) с получением практически чистых вариантов.
В альтернативном аспекте полипептид не извлекают, а вместо этого применяют в качестве источника полипептида клетку-хозяина согласно настоящему изобретению, экспрессирующую полипептид.
Растения
Настоящее изобретение также относится к выделенным растениям, например, трансгенному растению, части растения или растительной клетке, содержащей полинуклеотид согласно настоящему изобретению с тем, чтобы экспрессировать и продуцировать полипептид или домен в пригодных для извлечения количествах. Полипептид или домен можно извлечь из растения или части растения. В качестве альтернативы, растение или часть растения, содержащие полипептид или домен, можно применять без дополнительной очистки для улучшения качества пищи или корма, например, улучшения пищевой ценности, вкусовой привлекательности и реологических свойств, или для устранения фактора, препятствующего усвоению питательных веществ.
Трансгенное растение может иметь две семядоли (двудольное) или одну семядолю (однодольное). Примерами однодольных растений являются злаковые растения, такие как мятлик (мятлик луговой, Роа), кормовая трава, такая как Festuca, Lolium, газонная трава, такая как Agrostis, и зерновые, например, пшеница, разновидности овса, рожь, ячмень, рис, сорго и маис (кукуруза).
Примерами двудольных растений являются табак, бобовые, такие как разновидности люпина, картофель, сахарная свекла, горох, бобы и соя, и крестоцветные растения (семейство Brassicaceae), такие как цветная капуста, рапс и близкородственный модельный организм Arabidopsis thaliana.
Примерами частей растения являются стебель, каллюс, листья, корень, плоды, семена и клубни, а также как отдельные ткани, содержащие эти части, например, эпидермис, мезофилл, паренхиму, сосудистые ткани, меристемы. Конкретные компартменты растительной клетки, такие как хлоропласты, апопласты, митохондрии, вакуоли, пероксисомы и цитоплазма, также рассматриваются как часть растения. Более того, любая растительная клетка вне зависимости от ткани, из которой она происходит, рассматривается как часть растения. Подобным образом, части растения, такие как конкретные ткани и клетки, выделенные для облегчения осуществления настоящего изобретения, также считают частями растения, например, зародыши, эндоспермы, алейрон и оболочки семени.
В объем настоящего изобретения также включено потомство таких растений, части растений и клетки растений.
Трансгенное растение или растительная клетка, экспрессирующая полипептид или домен, могут быть сконструированы в соответствии со способами, известными из уровня техники. Вкратце, растение или растительная клетка сконструированы путем включения одного или нескольких конструктов экспрессии, кодирующих полипептид или домен, в геном растения-хозяина или геном хлоропласта и размножения полученного в результате модифицированного растения или растительной клетки в трансгенное растение или растительную клетку.
Конструкт экспрессии представляет собой подходящий конструкт нуклеиновой кислоты, который содержит полинуклеотид, кодирующий полипептид или домен, функционально связанный с соответствующими регуляторными последовательностями, необходимыми для экспрессии полинуклеотида в выбранном растении или выбранной части растения. Более того, конструкт экспрессии может содержать селектируемый маркер, пригодный для идентификации растительных клеток, в которые был интегрирован конструкт экспрессии и последовательности ДНК, необходимые для введения конструкта в указанное растение (последнее зависит от способа введения ДНК, который применяют).
Выбор регуляторных последовательностей, таких как промоторные и терминаторные последовательности и необязательно последовательности сигнального или транзитного пептидов, определяется, например, на основании того когда, где и как желательна экспрессия полипептида или домена. Например, экспрессия гена, кодирующего полипептид или домен, может быть конститутивной или индуцибельной, или может быть связанной с развитием, стадиеспецифической или тканеспецифической, и генный продукт может быть нацелен на конкретную ткань или часть растения, как например, семена или листья. Регуляторные последовательности описаны, например, Tague et al., 1988, Plant Physiology 86: 506.
Для конститутивной экспрессии можно применять промотор 35S-CaMV, убиквитина 1 маиса или актина 1 риса (Franck et al., 1980, Cell 21: 285-294; Christensen et al., 1992, Plant Mol. Biol. 18: 675-689; Zhang et al., 1991, Plant Cell 3: 1155-1165). Орган-специфические промоторы могут представлять собой, например, промотор из запасающих поглощающих тканей, таких как семена, клубни картофеля и плоды (Edwards and Coruzzi, 1990, Ann. Rev. Genet. 24: 275-303), или из метаболических поглощающих тканей, таких как меристемы (Ito et al., 1994, Plant Mol. Biol. 24: 863-878), семяспецифический промотор, такой как глутелиновый, проламиновый, глобулиновый или альбуминовый промотор из риса (Wu et al., 1998, Plant Cell Physiol. 39: 885-889), промотор Vicia faba из гена легумина B4 и гена неизвестного белка семени из Vicia faba (Conrad et al., 1998, J. Plant Physiol. 152: 708-711), промотор из белка масляных телец семени (Chen et al., 1998, Plant Cell Physiol. 39: 935-941), промотор запасного белка napA из Brassica napus или любой другой семяспецифический промотор, известный из уровня техники, например, как описано в WO 91/14772. Более того, промотор может представлять собой специфический к листьям промотор, такой как промотор rbcs из риса или томата (Kyozuka et al., 1993, Plant Physiol. 102: 991-1000), промотор гена аденинметилтрансферазы вируса хлореллы (Mitra and Higgins, 1994, Plant Mol. Biol. 26: 85-93), промотор гена aldP из риса (Kagaya et al., 1995, Mol. Gen. Genet. 248: 668-674) или промотор, индуцируемый ранением, такой как промотор р\п2 картофеля (Xu et al., 1993, Plant Mol. Biol. 22: 573-588). Подобным образом, промотор может индуцироваться абиотическими воздействиями, такими как температура, засуха или изменения солености, или индуцироваться экзогенно вносимыми веществами, которые активируют промотор, например, этанол, эстрогены, гормоны растений, такие как этилен, абсцизовая кислота и гиббереллиновая кислота и тяжелые металлы.
Промоторный энхансерный элемент также можно применять для достижения более высоких уровней экспрессии полипептида или домена в растении. Например, промоторный энхансерный элемент может представлять собой интрон, который расположен между промотором и полинуклеотидом, кодирующим полипептид или домен. Например, Xu et al., 1993, выше, раскрывают применение первого интрона гена актина 1 риса для усиления экспрессии.
Селектируемый маркерный ген и любые другие части конструкта экспрессии могут быть выбраны из таковых, доступных в данной области.
Конструкт нуклеиновой кислоты включают в геном растения в соответствии с общепринятыми методиками, известными из уровня техники, в том числе опосредованной Agrobacterium трансформацией, опосредованной вирусом трансформации, микроинъекцией, бомбардировкой частицами, биолистической трансформацией и электропорацией (Gasser et al., 1990, Science 244: 1293; Potrykus, 1990, Bio/Technology 8: 535; Shimamoto et al., 1989, Nature 338: 274).
Опосредованный Agrobacterium tumefaciens перенос генов представляет собой способ создания трансгенных двудольных растений (для обзора, см. Hooykas and Schilperoort, 1992, Plant Mol. Biol. 19: 15-38) и для трансформации однодольных растений, хотя другие способы трансформации можно применять для этих растений. Способ создания трансгенных однодольных растений представляет собой бомбардировку частицами (микроскопические частицы золота или вольфрама, покрытые трансформирующей ДНК) эмбриональных каллюсов или развивающихся эмбрионов (Christou, 1992, Plant J. 2: 275-281; Shimamoto, 1994, Curr. Opin. Biotechnol. 5: 158-162; Vasil et al., 1992, Bio/Technology 10: 667-674). Альтернативный способ трансформации однодольных растений основан на трансформации протопластов, как описано Omirulleh et al., 1993, Plant Mol. Biol. 21: 415-428. Дополнительные способы трансформации включают описанные в патентах США №№6395966 и 7151204 (оба из которых включены в данный документ с помощью ссылки во всей своей полноте).
После трансформации трансформанты со встроенным конструктом экспрессии отбирают и регенерируют в целые растения в соответствии со способами, хорошо известными в данной области. Часто процедура трансформации создана для селективного удаления генов, по которым ведется отбор, либо во время регенерации, либо в следующих поколениях путем применения, например, контрансформации двумя отдельными конструктами Т-ДНК или сайт-специфического вырезания гена, по которому ведется отбор, специфической рекомбиназой.
Помимо непосредственной трансформации генотипа конкретного растения конструктом согласно настоящему изобретению, трансгенные растения можно получить путем скрещивания растения с конструктом со вторым растением, у которого конструкт отсутствует. Например, конструкт, кодирующий полипептид или домен, можно ввести в конкретный сорт растений путем скрещивания без необходимости когда-либо непосредственно трансформировать растение указанного сорта. Таким образом, настоящее изобретение охватывает не только растение, непосредственно регенерированное из клеток, которые были трансформированы в соответствии с настоящим изобретением, но также потомство таких растений. Как применяется в данном документе, потомство может относиться к потомкам любого поколения от родительского растения, полученного в соответствии с настоящим изобретением. Такое потомство может включать конструкт ДНК, полученный в соответствии с настоящим изобретением. Скрещивание приводит в результате к введению трансгена в линию растений путем перекрестного опыления исходной линии с донорной линией растений. Неограничивающие примеры таких этапов описаны в патенте США №7151204.
Растения можно получать посредством способа превращения путем возвратного скрещивания. Например, растения включают растения, называемые превращенным путем возвратного скрещивания генотипом, линией, инбредным растением или гибридом.
Генетические маркеры могут применяться для того, чтобы способствовать интрогрессии одного или нескольких трансгенов согласно настоящему изобретению из одного генетического окружения в другое. Отбор с помощью маркеров предоставляет преимущества по сравнению с традиционной селекцией в том, что его можно применять для того, чтобы избежать ошибок, вызванных фенотипической изменчивостью. Кроме того, генетические маркеры могут обеспечить данные, относящиеся к относительной степени содержания элитной зародышевой плазмы в отдельном потомке конкретного скрещивания. Например, если растение с желаемым признаком, которое в остальном не имеет агрономически желаемого генетического окружения, скрещивают с элитным родителем, генетические маркеры можно применять для отбора потомства которое не только обладает представляющим интерес признаком, но также имеет сравнительно высокую долю желаемой зародышевой плазмы. Таким образом, количество поколений, необходимое для интрогрессии одного или нескольких признаков в конкретное генетическое окружение, сведено к минимуму.
Настоящее изобретение также относится к способам получения полипептида или домена согласно настоящему изобретению, включающему (а) культивирование трансгенного растения или растительной клетки, содержащих полинуклеотид, кодирующий полипептид или домен в условиях, благоприятных для продуцирования полипептида или домена; и (b) извлечение полипептида или домена.
Применения
Примеры предпочтительных применений лизоцима или его композиции согласно настоящему изобретению приведены ниже. Дозу лизоцима и другие условия, при которых применяется лизоцим, можно определить на основе способов, известных из уровня техники.
Полипептиды согласно настоящему изобретению, как правило, полезны в любом участке, подверженном загрязнению бактериями, грибами, дрожжами или водорослями. Как правило, участки находятся в водных системах, таких как системы подачи охлаждающей воды, банно-прачечные воды, масляных системах, таких как смазочно-охлаждающие жидкости, смазочные материалы, нефтепромыслы и подобное, где желательным является уничтожение микроорганизмов или по меньшей мере контроль их роста. Тем не менее, настоящее изобретение можно также применять во всех применениях, для которых являются полезными известные композиции лизоцимов, как например, защита дерева, латекса, клеящего материала, клея, бумаги, картона, текстиля, кожи, пластиков, герметика и корма.
Лизоцим или его композицию согласно настоящему изобретению можно применять в нескольких применениях для разложения материала, содержащего пептидогликан или хитодекстрин, путем обработки материала лизоцимом или его композицией (см., например, Proctor and Cunningham, (1988) Critical Reviews in Food Science and Nutrition 26: 359-395; Carini et al. (1985) Microbiol. Alimen. Nutr. 3: 299-320; Hughey and Johnson (1987) Appl. Environ. Microbiol. 53: 2165-2170; Cunningham et al. (1991) Worldʹs Poultry Science Journal 47: 141-163).
Применения лизоцимов согласно настоящему изобретению для чистки и/или в моющих средствах
Лизоцим согласно настоящему изобретению предпочтительно вводят в состав и/или применяют вместе с моющими композициями, как описано ниже. Если мытье осуществляется многократно при температурах ниже 60°С, существует повышенная вероятность появления неприятного запаха в моечной машине (как при стирке, так и при мойке посуды) и на текстильных изделиях или изделиях, отмываемых в машине. Этот неприятный запах, вероятно, вызван микроорганизмами, такими как бактерии, грибы, водоросли или другие одноклеточные организмы, растущими в моечной машине.
Более того, настоящее изобретение относится к способу стирки тканей, включающему обработку тканей моющим раствором, содержащим моющую композицию и лизоцим или композицию лизоцима согласно настоящему изобретению. Обработку при стирке можно, например, осуществлять в процессе машинной мойки или в процессе ручной мойки. Моющий раствор может, например, представлять собой моющий раствор, содержащий моющую композицию и имеющий рН от 3 до 12.
Ткани, подвергающиеся способам согласно настоящему изобретению, могут представлять собой поддающиеся традиционной стирке, например, стирке в домашних условиях. Предпочтительно, основная часть белья для стирки представляет собой одежду и ткани, в том числе вязанные изделия, тканевые изделия, изделия из грубой хлопчатобумажной ткани, пряжу и ткань для полотенец, произведенные из хлопка, смесей хлопка или натуральных или созданных человеком целлюлозных полимеров (например, происходящих из древесной пульпы) или их смесей. Примерами смесей являются смеси хлопка или искусственного шелка/вискозы с одним или несколькими дополнительными материалами, такими как шерсть, синтетические волокна (например, полиамидные волокна, акриловые волокна, полиэфирные волокна, волокна из поливинилового спирта, поливинилхлоридные волокна, полиуретановые волокна, полимочевинные волокна, арамидные волокна) и целлюлозосодержащие волокна (например, искусственный шелк/вискоза, волокно рами, лен/полотно, джут, волокна из ацетата целлюлозы, лиоцелл).
Настоящее изобретение предусматривает способ снижения микробного загрязнения на поверхности, такой как предмет одежды из текстиля, или твердой поверхности, такой как металлические, пластиковые или резиновые части в моечной машине или посудомоечной машине, облицовочные плитки в ванной комнате, полы, верхние поверхности столов, сточные трубы, раковины и умывальники, путем обработки загрязненном микробами поверхности лизоцимом или композицией лизоцима согласно настоящему изобретению. Также ожидается, что такая обработка ослабит неприятный запах на текстильных изделиях и твердых поверхностях, содержащих микробное загрязнение.
Снижение микробного загрязнения можно оценить несколькими способами, например, позволив группе экспертов оценить, ослаб ли запах, в качестве альтернативы, с поверхности можно взять образец и культивировать для оценки того, снизилось ли подсчитанное количество микробов в результате обработки по сравнению с обработкой без лизоцима.
Применения лизоцимов согласно настоящему изобретению в корме для животных
Лизоцим согласно настоящему изобретению можно также применять в корме для животных. В варианте осуществления настоящее изобретение предусматривает способ получения композиции корма для животных, включающий добавление лизоцима согласно настоящему изобретению к одному или нескольким ингредиентам корма для животных.
Лизоцим согласно настоящему изобретению можно, например, применять для стабилизации здоровой микрофлоры у животных, в частности домашнего скота, такого как без ограничения овцы, козы, крупный рогатый скот (в том числе без ограничения крупный рогатый скот мясного направления, коровы и молодые телята), олени, боровы или свиньи (в том числе без ограничения поросята, растущие свиньи и свиноматки), домашней птицы (в том числе без ограничения гусей, индеек, уток и кур, таких как бройлеры, цыплята и куры-несушки); лошадей, лосей и кроликов, а также у рыбы (в том числе без ограничения лосося, форели, тиляпии, сома и карпов; и ракообразных (в том числе без ограничения мелких креветок и глубоководных креветок)) путем подавления роста/колонизации кишечника вирусами (такими как Coronaviridae, вирус репродуктивного и респираторного синдрома свиней (PRRSV), Persivirus, приводящий к вирусной диарее крупного рогатого скота, и подобные), паразитическими патогенами (простейшими, относящимися к кокцидиям, Eimeria maxima, Eimeria mitis) или бактериальными патогенами, такими как Clostridium perfringens, Escherichia coli, Campylobacter coli, C. hyointestinalis и С.jejuni, Yersinia ssp., Treponema suis, Brachyspira hyodysenteriae, Lawsonia intracellularis и Salmonella, такими как Salmonella enterica, Salmonella Typhimurium и Salmonella Mbandaka. В предпочтительном варианте осуществления лизоцим применяют у кур, и он обладает противомикробной активностью против Clostridium perfringens. В дополнительном варианте осуществления лизоцим согласно настоящему изобретению применяется в качестве добавки в корм, где он может обеспечить положительное воздействие на баланс микрофлоры в пищеварительном тракте курицы и тем самым улучшить характеристики животного.
Лизоцим согласно настоящему изобретению также можно применять в кормах для животных в качестве ферментов, повышающих качество корма, которые улучшают перевариваемость корма для повышения эффективности его применения в соответствии с WO 00/21381 и WO 04/026334.
В дополнительном варианте осуществления лизоцим согласно настоящему изобретению можно применять в качестве добавки в корм, где он может обеспечивать положительное воздействие на пищеварительный тракт животного и тем самым улучшать характеристики животного по приросту массы, коэффициенту усвоения корма (FCR) или улучшенному здоровью животного, как например, сниженному показателю смертности. FCR рассчитывают как потребление корма в г/животное относительно прироста массы в г/животное.
Применения лизоцимов согласно настоящему изобретению как противомикробных средств
Лизоцим согласно настоящему изобретению можно применять в качестве противомикробных средств. Одним аспектом настоящего изобретения является способ снижения микробного загрязнения, включающий обработку загрязненной микробами поверхности лизоцимом согласно настоящему изобретению.
Для оценки того, способен ли лизоцим согласно настоящему изобретению действовать как противомикробное средство, его можно исследовать в анализе помутнения. В этом анализе исследуется, способен ли лизоцим разрушать микробные клетки, например, высушенный субстрат из клеток Exiguobactehum undae (выделенных из дурно пахнущего носка) или клеток Micrococcus luteus, растворенных в буфере или моющем средстве, и, таким образом, снижать оптическую плотность (OD), например, при 540 нм, по сравнению с суспензией микробов, обработанной только буфером.
Применения лизоцимов согласно настоящему изобретению для дезинфекции и/или в качестве дезинфицирующих средств
Лизоцим согласно настоящему изобретению может быть полезным в качестве дезинфицирующего средства или применяться для дезинфекции, например при лечении инфекций в глазу или полости рта или для чистки и дезинфекции контактных линз и для предотвращения образования или удаления биопленки на поверхности в соответствии с патентом США №6777223.
Лизоцим согласно настоящему изобретению можно также применять при уходе за полостью рта. Например, лизоцим можно применять сам по себе или в комбинации с другими ферментами или даже противомикробными пептидами в зубной пасте или других продуктах для ухода за полостью рта. Полипептиды можно вводить в ротовую полость или наносить на изделие, которое должно быть введено в ротовую полость. См., например, WO 08/124764.
В целом, предполагается, что полипептиды согласно настоящему изобретению являются полезными для чистки, дезинфекции или подавления роста микробов на любой поверхности. Примерами поверхностей, которые могут преимущественно контактировать с полипептидами согласно настоящему изобретению, являются поверхности технологического оборудования, применяемого, например, в молочных, химических или фармацевтических технологических установках, системах санитарной очистки воды, нефтеперерабатывающих заводах, целлюлозно-бумажных предприятиях, технологических установках для очистки воды и градирнях. Полипептиды согласно настоящему изобретению следует применять в количестве, которое является эффективным для очистки, дезинфекции или подавления роста микробов на указанной поверхности.
Полипептиды согласно настоящему изобретению, кроме того, можно применять для очистки поверхностей и кухонных принадлежностей на предприятиях по производству пищевых продуктов и в любой зоне, в которой готовится или подается еда, как например, больницы, дома престарелых и рестораны.
Применения лизоцимов согласно настоящему изобретению в пищевой промышленности
Лизоцим согласно настоящему изобретению также можно применять для избирательного подавления неконтролируемого роста Clostridium tyrobutyricum во время созревания сыров, в частности, таковых, полученных из прессованных и приготовленных творогов, например, швейцарского сыра, пармезана, эдама, гауды, чеддера и многих других.
Лизоцим согласно настоящему изобретению можно также применять в виноделии для контроля или подавления микробного загрязнения.
Применения лизоцимов согласно настоящему изобретению как лечебных средств
Лизоцим согласно настоящему изобретению также можно применять для местного лечения дистрофических и воспалительных поражений кожи и мягких тканей. См., например, Palmieri and Boraldi (1977) Arch. Sci. Med. (Torino) 134:481-485.
Лизоцим согласно настоящему изобретению можно также применять при уходе за кожей. Например, полипептид наносят на кожу пациента, страдающего от поражения кожи, такого как акне. Лизоцим также можно применять в повязке на рану, которую прикладывают к раненой кожи, например, чтобы способствовать заживлению раны. См., например, заявку на патент США №20080254079.
Лизоцим согласно настоящему изобретению можно также применять в губной помаде, гигиенической губной помаде, геле для губ или блеске для губ. Например, такие продукты можно применять для лечения локализованной инфекции губ, например, герпетической лихорадки. См., например, заявку на патент США №20080254079.
Лизоцим согласно настоящему изобретению также можно применять при лечении заболеваний бронхолегочной системы.
Лизоцим согласно настоящему изобретению также можно применять в качестве пищеварительных ферментов или способствующих пищеварению средств. Лизоцим согласно настоящему изобретению можно также применять для улучшения применения мертвых/живых бактерий в качестве источника пищевых продуктов, например, путем контроля нежелательных микробных загрязнителей.
Лизоцим согласно настоящему изобретению можно также применять в качестве терапевтического средства у человека или другого животного, например, для контроля или подавления избыточного роста бактерий в кишечнике человека, страдающего от заболевания, например, заболевания поджелудочной железы или пациента с иммунодефицитом.
Применения лизоцимов согласно настоящему изобретению для экстракции бактериальной геномной ДНК
Лизоцим согласно настоящему изобретению можно также применять для содействия экстракции бактериальной геномной ДНК как из чистых культур, так и из природных образцов, содержащих несколько видов бактерий. Чтобы обеспечить возможность секвенирования бактериальной ДНК, бактериальные клеточные стенки должны быть разрушены для выделения ДНК внутри нее. Лизоцим белка куриного яйца представляет собой стандартный фермент, применяемый для выделения ДНК из грамположительных бактерий, и он работает путем гидролиза цепей пептидогликана, присутствующих в клеточной стенке, тем самым способствуя разрушению клеточных стенок. Тем не менее, некоторые грамположительные клеточные стенки не разрушаются лизоцимами белка куриного яйца. Например, рекомендуется, чтобы клетки, например Staphylococcus aureus, лизировались лизостафином, как описано в Pitcher and Saunders (1989), Арр. Environ. Microbiol. 56(3): 782-787. Тем не менее, эти способы не работают для всех типов грамположительных бактерий, и новые лизоцимы, таким образом, потенциально обеспечивают доступ к новым геномам, которые не могут быть выделены с коммерческими растворами лизоцима.
Добавление одного или нескольких лизоцимов согласно настоящему изобретению, необязательно вместе с лизостафином или лизоцимом белка куриного яйца дает возможность разрушения клеточных стенок из бактерий, предпочтительно грамположительных бактерий, что невозможно с применением доступных в настоящее время коммерческих растворов. В варианте осуществления лизоцим представляет собой лизоцим GH25 из SEQ ID NO: 4 или SEQ ID NO: 8 или его вариант. В дополнительном варианте осуществления лизоцим является эффективным в разрушении клеточных стенок бактерий, таких как Bacillus, Micrococcus, Zobellia, Cellulophaga и Streptomyces. Дополнительным вариантом осуществления является бактерия, такая как Bacillus subtilis, Micrococcus luteus, Zobellia uliginosa, Cellulophaga lytica и Streptomyces mobaraensis. В другом варианте осуществления лизоцим является эффективным в комбинации с лизоцимом белка куриного яйца в разрушении клеточных стенок бактерий, таких как Bacillus, Micrococcus, Zobellia, Cellulophaga и Streptomyces, таких как Bacillus subtilis, Micrococcus luteus, Zobellia uliginosa, Cellulophaga lytica и Streptomyces mobaraensis. Конкретный вариант осуществления заключается в разрушении клеточных стенок из бактерий Streptomyces mobaraensis.
Лизоцим согласно настоящему изобретению можно применять в композиции или наборе для разрушения клеточных стенок из бактерий, необязательно вместе с лизостафином или лизоцим белка куриного яйца. Компонент лизоцима может представлять собой лизоцим GH25 согласно настоящему изобретению или GH25 лизоцим из SEQ ID NO: 4 или SEQ ID NO: 8 или его вариант.
Другие применения лизоцимов согласно настоящему изобретению
Лизоцим согласно настоящему изобретению можно также применять для контроля роста микробов в процессе ферментации, как например, при производстве этанола или других продуктов из биомассы. См., например, WO 2007/109750. Соответственно, лизоцим можно применять, например, в способе получения продукта ферментации, включающем (а) ожижение и/или осахаривание углеводного материала и (b) ферментацию с применением ферментирующего организма, причем лизоцим согласно настоящему изобретению применяют в способе ферментации до, во время и/или после ферментации в концентрациях достаточных для уничтожения и/или подавления роста бактериальных клеток.
Лизоцим согласно настоящему изобретению можно также применять при контроле микробного роста на рыбных или креветочных фермах.
Другие применения включают консервацию пищевых продуктов, напитков, косметических средств, таких как лосьоны, кремы, гели, мази, мыла, шампуни, кондиционеры, антиперспиранты, дезодоранты, составы ферментов или ингредиенты пищевых продуктов.
Композиции
В еще одном дополнительном аспекте настоящее изобретение относится к композициям, содержащим полипептид согласно настоящему изобретению, обладающий противомикробной и/или лизоцимной активностью.
Композиция может содержать полипептид согласно настоящему изобретению в качестве основного ферментативного компонента, например, однокомпонентной композиции. В качестве альтернативы, композиция может содержать несколько веществ с ферментативной активностью, таких как аминопептидаза, амилаза, карбогидраза, карбоксипептидаза, каталаза, целлюлаза, хитиназа, кутиназа, циклодекстрин-гликозилтрансфераза, дезоксирибонуклеаза, эстераза, альфа-галактозидаза, бета-галактозидаза, глюкоамилаза, альфа-глюкозидаза, бета-глюкозидаза, галопероксидаза, инвертаза, лакказа, липаза, маннозидаза, оксидаза, пектинолитический фермент, пептидоглутаминаза, пероксидаза, фитаза, полифенолоксидаза, протеолитический фермент, рибонуклеаза, трансглутаминаза или ксиланаза.
Композиции можно получить в соответствии со способами, известными из уровня техники, и они могут иметь форму жидкой или сухой композиции. Например, композиция полипептида может иметь форму гранулята или микрогранулята. Полипептид, подлежащий включению в композицию, может быть стабилизирован в соответствии со способами, известными из уровня техники.
Ниже приведены примеры предпочтительных применений композиций полипептида согласно настоящему изобретению. Дозу композиции полипептида согласно настоящему изобретению и другие условия, при которых применяется композиция, можно определить на основе способов, известных из уровня техники.
Композиция для экстракции бактериальной геномной ДНК
Лизоцим согласно настоящему изобретению можно добавить в композицию для экстракции геномной ДНК из бактерий и, следовательно, он становится компонентом этой композиции. Кроме того, указанный лизоцим можно применять в комбинации с одним или несколькими дополнительными лизоцимами, такими как без ограничения лизостафин, мутанолизин или лизоцим белка куриного яйца. Композиция может представлять часть набора, который можно смешать в соответствии с набором инструкций для экстракции геномной ДНК из бактерий. Набор может содержать буфер, одно или несколько средств, связывающих ионы металла, таких как EDTA, протеазу, такую как протеиназы K, детергент, такой как SDS или Triton X, и один или несколько лизоцимов, таких как лизоцим GH25 согласно настоящему изобретению, лизостафин, мутанолизин или лизоцим белка куриного яйца. Бактериальную геномную ДНК можно экстрагировать как из чистых культур, так и из природных образцов, содержащих несколько видов бактерий. Предпочтительным вариантом осуществления является лизоцим GH25 из SEQ ID NO: 4 или SEQ ID NO: 8 или его вариант.
Композиции корма для животных
Настоящее изобретение также направлено на способы применения полипептидов согласно настоящему изобретению, обладающих лизоцимной активностью, в корме для животных, а также на кормовые композиции и добавки в корм, содержащие лизоцимы согласно настоящему изобретению.
Выражение животное включает всех животных, в том числе людей. Примерами животных являются нежвачные животные и жвачные животные. Жвачные животные включают, например, животных, таких как овцы, козы и крупный рогатый скот, например, крупный рогатый скот мясного направления и коровы. В конкретном варианте осуществления животное является нежвачным животным. Нежвачные животные включают животных с однокамерным желудком, например, боровы или свиньи (в том числе без ограничения поросята, растущие свиньи и свиноматки); домашняя птица, такая как индейки, гуси, утки и куры (в том числе без ограничения бройлерные куры, куры-несушки); лошади (в том числе без ограничения ʺгорячекровныеʺ, ʺхолоднокровныеʺ и ʺтеплокровныеʺ); молодые телята; и рыба (в том числе без ограничения лосось, форель, тиляпия, сом и карпы); и ракообразные (в том числе без ограничения мелкие креветки и глубоководные креветки).
Выражение корм или кормовая композиция означает любое соединение, препарат, смесь или композицию, подходящие или предназначенные для приема вовнутрь животным. При применении согласно настоящему изобретению лизоцим можно скармливать животному до, после или одновременно с пищевым рационом. Последнее предпочтительно. Такие композиции лизоцима, конечно, можно смешивать с другими ферментами.
Лизоцим можно добавлять в корм в любой форме, он может присутствовать в виде сравнительно чистого лизоцима или или в виде смеси с другими компонентами, предназначенными для добавления в корм для животных, т.е. в форме добавок в корма для животных, как например, так называемые премиксы для корма для животных. В дополнительном аспекте настоящее изобретение относится к композиции для применения в корме для животных, такой как корм для животных и добавки в корм для животных, например, премиксы.
Помимо лизоцима согласно настоящему изобретению добавки в корм для животных согласно настоящему изобретению содержат по меньшей мере один жирорастворимый витамин, и/или по меньшей мере один водорастворимый витамин, и/или по меньшей мере один микроэлемент, и/или по меньшей мере один макроэлемент.
Кроме того, необязательно ингредиентами-добавками в корм являются красители, например, каротиноиды, такие как бета-каротин, астаксантин и лютеин; стабилизаторы; добавки, улучшающие рост, и душистые соединения/ароматизаторы, например, креозол, анетол, дека-, ундека- и/или додека-лактоны, иононы, железо, гингерол, пиперидин, пропилиденфталид, бутиленфталид, капсаицин и/или таннин; полиненасыщенные жирные кислоты (PUFA); молекулы, образующие активные формы кислорода; также можно применять подложку, которая может содержать, например, 40-50% по весу древесных волокон, 8-10% по весу стеарина, 4-5% по весу порошка куркумы, 4-58% по весу порошка розмарина, 22-28% по весу известняка, 1-3% по весу камеди, такой как аравийская камедь, 5-50% по весу сахара и/или крахмала и 5-15% по весу воды.
Корм или добавка в корм согласно настоящему изобретению может также содержать по меньшей мере один другой фермент, выбранный из фитазы (ЕС 3.1.3.8 или 3.1.3.26); ксиланазы (ЕС 3.2.1.8); галактаназы (ЕС 3.2.1.89); альфа-галактозидазы (ЕС 3.2.1.22); протеазы (ЕС 3.4), фосфолипазы А1 (ЕС 3.1.1.32); фосфолипазы А2 (ЕС 3.1.1.4); лизофосфолипазы (ЕС 3.1.1.5); фосфолипазы С (3.1.4.3); фосфолипазы D (ЕС 3.1.4.4); амилазы, такой как, например, альфа-амилазы (ЕС 3.2.1.1); и/или бета-глюканазы (ЕС 3.2.1.4 или ЕС 3.2.1.6).
Примерами полиненасыщенных жирных кислот являются С18, С20 и С22 полиненасыщенные жирные кислоты, такие как арахидоновая кислота, докозагексаеновая кислота, ейкозапентаеновая кислота и гамма-линолевая кислота.
Примерами молекул, образующих активные формы кислорода, являются химические продукты, такие как перборат, персульфат или перкарбонат; и ферменты, такие как оксидаза, оксигеназа или синтетаза.
Обычно жиро- и водорастворимые витамины, а также микроэлементы составляют часть так называемого премикса, предназначенного для добавления в корм, тогда как макроэлементы обычно отдельно добавляют в корм. Любой из этих типов композиций при обогащении протеазой согласно настоящему изобретению является добавкой в корм для животных согласно настоящему изобретению.
В конкретном варианте осуществления добавка в корм для животных согласно настоящему изобретению предназначена для включения (или предписана как таковая, которая должна быть включена) в рационы животных или корм для животных на уровне от 0,1 части на миллион до 1000 частей на миллион, предпочтительно от 0,5 части на миллион до 200 частей на миллион и более предпочтительно от 1 части на миллион до 100 частей на миллион. Вышеупомянутые уровни дозы также можно применять для премиксов.
Композиция корма для животных согласно настоящему изобретению может содержать по меньшей мере один растительный белок, такой как полученный из или происходящий из растения, в том числе модифицированные белки и производные белков. Растительные белки могут быть получены из источников растительного белка, таких как бобовые и зерновые, например, материалы из растений семейств Fabaceae (Leguminosae), Cruciferaceae, Chenopodiaceae и Poaceae, такие как соевая мука, люпиновая мука и рапсовая мука. В качестве альтернативы, источником растительного белка является материал из одного или нескольких растений семейства Chenopodiaceae, например, свекла, сахарная свекла, шпинат или киноа. Другими примерами источников растительного белка являются семена рапса, семена подсолнечника, семена хлопчатника, а также капуста и зерновые, такие как ячмень, пшеница, рожь, овес, маис (кукуруза), рис, тритикале и сорго.
Композиция корма для животных согласно настоящему изобретению может также содержать животный белок, такой как мясная и костная мука, перьевая мука и/или рыбная мука, как правило, в количестве 0-25%. Композиция корма для животных согласно настоящему изобретению может также содержать сухую гранулированную барду (DDGS), как правило, в количествах 0-30%.
В еще более конкретных вариантах осуществления композиция корма для животных согласно настоящему изобретению содержит 0-80% маиса; и/или 0-80% сорго; и/или 0-70% пшеницы; и/или 0-70% ячменя; и/или 0-30% овса; и/или 0-40% соевой муки; и/или 0-25% рыбной муки; и/или 0-25% мясной и костной муки; и/или 0-20% сыворотки.
Пищевые рационы для животных можно, например, производить в виде мешанки (негранулированном) или в виде гранулированного корма. Как правило, молотые комбикорма смешивают и существенные количества самых важных витаминов и минералов добавляют в соответствии со спецификациями для указанного вида. Ферменты можно добавить в виде твердых или жидких составов ферментов. Например, для мешанки твердый или жидкий состав с ферментом можно добавлять до или во время этапа смешивания ингредиентов. Для гранулированного корма препарат лизоцима/фермента (жидкий или твердый) можно также добавлять до или во время этапа добавления ингредиента корма. Как правило, жидкий препарат лизоцима/фермента добавляют после этапа гранулирования. Фермент также можно включать в добавку в корм или премикс.
Конечная концентрация фермента в пищевом рационе находится в пределах диапазона 0,01-200 мг белка-фермента на кг пищевого рациона, например, в диапазоне 0,5-25 мг белка-фермента на кг пищевого рациона.
Чистящие композиции или моющие композиции
Лизоцим согласно настоящему изобретению можно добавлять в моющую композицию и, следовательно, он становится ее частью, в частности в жидкое моющее средство с рН 7 или ниже.
Моющую композицию согласно настоящему изобретению можно, например, составить в виде моющей композиции для ручной или машинной стирки, включающей композицию добавок для стирки, подходящую для предварительной обработки испачканных тканей и выполаскивания добавленной композиции мягчителя тканей, или ее можно составить в виде моющей композиции для применения в обычных процессах чистки твердых поверхностей в домашнем хозяйстве, или ее можно составить для режимов ручной и машинной мойки посуды.
В конкретном аспекте настоящее изобретение обеспечивает моющую добавку, содержащую лизоцим согласно настоящему изобретению. Моющая добавка, также как и моющая композиция, может содержать один или несколько других ферментов, таких как протеаза, липаза, кутиназа, амилаза, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например лакказа, и/или пероксидаза.
В целом, свойства выбранного фермента(ов) должны быть совместимыми с выбранным моющим средством (т.е. оптимум рН, совместимость с другими ферментативными и неферментативными ингредиентами и т.д.), при этом фермент(ы) должны присутствовать в эффективных количествах.
В одном варианте осуществления настоящее изобретение направлено на чистящие композиции или моющие композиции, содержащие фермент согласно настоящему изобретению в комбинации с одним или несколькими дополнительными чистящими компонентами. Выбор дополнительных чистящих компонентов находится в компетенции специалиста в данной области и включает общепринятые ингредиенты, в том числе иллюстративные неограничивающие компоненты, изложенные ниже.
Выбор компонентов может включать при уходе за текстильным изделием учет типа текстильного изделия, которое следует подвергнуть чистке, тип и/или степень загрязнения, температуру, при которой должна происходить чистка, и состав моющего продукта. Хотя компоненты, упомянутые ниже, разделены на категории в соответствии с конкретной функцией, это не следует толковать как ограничение, поскольку компонент может иметь одну или несколько дополнительных функций, которые известны специалисту в данной области.
Чистящая композиция или моющая композиция может быть подходящей для стирки текстильных изделий, таких как, например, ткани, материя или полотно, или для чистки твердых поверхностей, таких как, например, полы, столы, или для мытья посуды.
Настоящее изобретение также относится к полинуклеотидам, кодирующим полипептиды, конструктам нуклеиновой кислоты, векторам и клеткам-хозяевам, содержащим полинуклеотиды, а также к способам получения и применения полипептидов.
Поверхностно-активные вещества
Моющая композиция может содержать одно или несколько поверхностно-активных веществ, которые могут быть анионными, и/или катионными, и/или неионными, и/или полуполярными, и/или цвиттер-ионными или их смесью. В конкретном варианте осуществления моющая композиция включает смесь одного или нескольких неионных поверхностно-активных веществ и одного или нескольких анионных поверхностно-активных веществ. Поверхностно-активное(ые) вещество(а) обычно присутствует(ют) в количестве от приблизительно 0,1% до 60% по весу, таком как от приблизительно 1% до приблизительно 40%, или от приблизительно 3% до приблизительно 20%, или от приблизительно 3% до приблизительно 10%. Поверхностно-активное(ые) вещество(а) выбирают основываясь на целевом применении для очистки, и включает любое(ые) традиционное(ые) поверхностно-активное(ые) вещество(а), известное(ые) в данной области техники. Для применения в моющих средствах, можно применять любое поверхностно-активное вещество, известное в данной области техники.
Тогда как моющее средство, включенное в данный документ, будет обычно содержать от приблизительно 1% до приблизительно 40% по весу, как например от приблизительно 5% до приблизительно 30%, включая от приблизительно 5% до приблизительно 15% или от приблизительно 20% до приблизительно 25% анионного поверхностно-активного вещества. Неограничивающие примеры анионных поверхностно-активных веществ включают сульфаты и сульфонаты, в частности, линейные алкилбензолсульфонаты (LAS), изомеры LAS, разветвленные алкилбензолсульфонаты (BABS), фенилалкенсульфонаты, альфа-олефинсульфонаты (AOS), олефинсульфонаты, алкенсульфонаты, алкен-2,3-диилбис(сульфаты), гидроксиалкенсульфонаты и дисульфонаты, алкилсульфаты (AS), такие как додецилсульфат натрия (SDS), сульфаты жирных спиртов (FAS), сульфаты первичных спиртов (PAS), сложные эфиры серной кислоты и спиртов (AES, или AEOS, или FES, также известные как этоксисульфаты спиртов или сложные эфиры серной кислоты и жирных спиртов; вторичные алкенсульфонаты (SAS), сульфонаты парафина (PS), сульфонаты сложных эфиров, сложные эфиры глицерина и сульфонированных жирных кислот, метиловые сложные эфиры жирных альфа-сульфокислот (альфа-SFMe или SES), включая сульфонат сложного метилового эфира (MES), алкил- или алкенилянтарную кислоту, додецил/тетрадеценил янтарную кислоту (DTSA), жирнокислотные производные аминокислот, сложные диэфиры и моноэфиры сульфоянтарной кислоты или мыло и их комбинации.
При их включении моющее средство обычно будет содержать от приблизительно 0% до приблизительно 10% по весу катионного поверхностно-активного вещества. Неограничивающие примеры катионных поверхностно-активных веществ включают четвертичный алкилдиметилэтаноламин (ADMEAQ), бромид цетилтриметиламмония (СТАВ), хлорид диметилдистеариламмония (DSDMAC) и алкилбензилдиметиламмоний, алкильные соединения четвертичного аммония, алкоксилированные соединения четвертичного аммония (AQA) и их комбинации.
Тогда как моющее средство, включенное в данный документ, будет обычно содержать от приблизительно 0,2% до приблизительно 40% по весу неионного поверхностно-активного вещества, например от приблизительно 0,5% до приблизительно 30%, в частности от приблизительно 1% до приблизительно 20%, от приблизительно 3% до приблизительно 10%, такой как от приблизительно 3% до приблизительно 5% или от приблизительно 8% до приблизительно 12%. Неограничивающие примеры неионных поверхностно-активных веществ включают этоксилаты спиртов (АЕ или АЕО), пропоксилаты спиртов, пропоксилированные жирные спирты (PFA), алкиловые сложные эфиры алкоксилированных жирных кислот, такие как алкиловые сложные эфиры этоксилированных и/или пропоксилированных жирных кислот, алкилфенолэтоксилаты (АРЕ), оксиэтилированные алкилфенолы (NPE), алкилполигликозиды (APG), алкоксилированные амины, моноэтаноламиды жирных кислот (FAM), диэтаноламиды жирных кислот (FADA), моноэтаноламиды этоксилированных жирных кислот (EFAM), моноэтаноламиды пропоксилированной жирной кислоты (PFAM), амиды полигидроксиалкильных жирных кислот или N-ацил-N-алкилыные производные глюкозамина (глюкамиды, GA, или глюкамид жирной кислоты, FAGA), а также продукты доступные под торговой маркой SPAN и TWEEN и их комбинации.
При их включении моющее средство обычно будет содержать от приблизительно 0% до приблизительно 10% по весу полуполярного поверхностно-активного вещества. Неограничивающие примеры полуполярных поверхностно-активных веществ включают аминоксиды (АО), такие как алкилдиметиламиноксид, N-(кокоалкил)-N,N-диметиламиноксид и N-(таллоу-алкил)-N,N-бис(2-гидроксиэтил)аминоксид, алканоламиды жирных кислот и алканоламиды этоксилированных жирных кислот и их комбинации.
При их включении моющее средство обычно будет содержать от приблизительно 0% до приблизительно 10% по весу цвиттерионного поверхностно-активного вещества. Неограничивающие примеры цвиттерионных поверхностно-активных веществ включают бетаин, алкилдиметилбетаин, сульфобетаин и их комбинации.
Гидротропы
Гидротроп представляет собой соединение, которое солюбилизирует гидрофобные соединения в водных растворах (или, в противоположном случае, полярные соединения в неполярном окружении). Как правило, гидротропы имеют как гидрофобный, так и гидрофильный характер (так называемые амфифильные свойства, которые известны у поверхностно-активных веществ); тем не менее, молекулярная структура гидротропов обычно не способствует спонтанной аутоагрегации, см., например, обзор в Hodgdon and Kaler (2007), Current Opinion in Colloid & Interface Science 12: 121-128. Гидротропы не проявляют критическую концентрацию, выше которой происходит аутоагрегация, что обнаруживается у поверхностно-активных веществ и липидов, образующих мицеллярные, ламеллярные или другие хорошо определенные мезофазы. Между тем, многие гидротропы проявляют процесс агрегации непрерывного типа, когда размеры агрегатов растут с возрастанием концентрации. Тем не менее, многие гидротропы изменяют фазовое поведение, стабильность и коллоидные свойства систем, содержащих вещества полярного и неполярного характера, в том числе смеси воды, масла, поверхностно-активных веществ и полимеров. Гидротропы обычно применяют в отраслях, охватывающих фармацевтику, личную гигиену, пищевую промышленность и вплоть до применений в технике. Применение гидротропов в моющих композициях дает, например, более концентрированные составы поверхностно-активных веществ (как в процессе компактизации жидких моющих средств путем удаления воды), не вызывая нежелательного явления, такого как разделение фаз или высокая вязкость.
Моющее средство может содержать 0-5% по весу, как например, от приблизительно 0,5 до приблизительно 5%, или от приблизительно 3% до приблизительно 5% гидротропа. Для применения в моющих средствах, можно применять любой гидротроп, известный в данной области техники. Неограничивающие примеры гидротропов включают бензолсульфонат натрия, п-толуолсульфонат натрия (STS), ксилолсульфонат натрия (SXS), кумолсульфонат натрия (SCS), кумолсульфонат натрия, аминоксиды, спирты и полигликолевые эфиры, гидроксинафтоат натрия, гидроксинафталинсульфонат натрия, этилгексилсульфат натрия и их комбинации.
Средства, усиливающие моющее действие, и средства, способствующие усилению моющего действия
Моющая композиция может содержать приблизительно 0-65% по весу, как например, от приблизительно 5% до приблизительно 45% средства, усиливающего моющее действие, или средства, способствующего усилению моющего действия, или их смеси в моющем средстве. В моющем средстве для мытья посуды, уровень средства, усиливающее моющее действие, составляет обычно 40-65%, в частности 50-65%. Средство, усиливающее моющее действие, и/или средство, способствующее усилению моющего действия, может представлять собой, в частности, хелатирующее средство, которое образует водорастворимые комплексы с Ca и Mg. Любое средство, усиливающее моющее действие, и/или средство, способствующее усилению моющего действия, известные в данной области техники, могут быть применены в моющих средствах для стирки. Неограничивающие примеры средств, усиливающих моющее действие, включают цеолиты, дифосфаты (пирофосфаты), трифосфаты, такие как трифосфат натрия (STP или STPP), карбонаты, такие как карбонат натрия, растворимые силикаты, такие как метасиликат натрия, слоистые силикаты (например, SKS-6 от Hoechst), этаноламины, такие как 2-аминоэтан-1-ол (МЕА), диэтаноламин (DEA, также известный как иминодиэтанол), триэтаноламин (TEA, также известный как 2,2ʹ,2ʺ-нитрилотриэтанол) и карбоксиметилинулин (CMI) и их комбинации.
Моющая композиция может также содержать 0-20% по весу, как например, от приблизительно 5% до приблизительно 10% средства, способствующего усилению моющего действия, или их смеси в моющем средстве. Моющая композиция может включать средство, способствующее усилению моющего действия, само по себе, или в сочетании со средством, усиливающим моющее действие, например, средством, усиливающим моющее действие, на основе цеолита. Неограничивающие примеры средств, способствующих усилению моющего действия, включают гомополимеры полиакрилата или их сополимеры, как например, поли(акриловая кислота) (РАА) или сополимер акриловой кислоты/малеиновой кислоты (РАА/РМА). Дополнительные неограничивающие примеры включают цитрат, хелатирующие средства, такие как аминокарбоксилаты, аминополикарбоксилаты, а также фосфонаты и алкил- или алкенилянтарную кислоту. Дополнительные конкретные примеры включают 2,2ʹ,2ʺ-нитрилотриуксусную кислоту (NTA), этилендиаминтетрауксусную кислоту (EDTA), диэтилентриаминпентауксусную кислоту (DTPA), иминодиянтарную кислоту (IDS), этилендиамин-N,Nʹ-диянтарную кислоту (EDDS), метилглициндиуксусную кислоту (MGDA), глутаминовую кислоту-N,N-диуксусную кислоту (GLDA), 1-гидроксиэтан-1,1-дифосфоновую кислоту (HEDP), этилендиаминтетра-(метиленфосфоновую кислоту) (EDTMPA), диэтилентриаминпентакис(метиленфосфоновую кислоту) (DTPMPA или DTMPA), N-(2-гидроксиэтил)иминодиуксусную кислоту (EDG), аспарагиновую кислоту-N-моноуксусную кислоту (ASMA), аспарагиновую кислоту-N,N-диуксусную кислоту (ASDA), аспарагиновую кислоту-N-монопропионовую кислоту (ASMP), иминодиянтарную кислоту (IDA), N-(2-сульфометил)-аспарагиновую кислоту (SMAS), N-(2-сульфоэтил)-аспарагиновую кислоту (SEAS), N-(2-сульфометил)-глутаминовую кислоту (SMGL), N-(2-сульфоэтил)-глутаминовую кислоту (SEGL), N-метилиминодиуксусную кислоту (MIDA), α-аланин-N,N-диуксусную кислоту (α-ALDA), серин-N, N-диуксусную кислоту (SEDA), изосерин-N,N-диуксусную кислоту (ISDA), фенилаланин-N,N-диуксусную кислоту (PHDA), антраниловую кислоту-N,N-диуксусную кислоту (ANDA), сульфаниловую кислоту-N,N-диуксусную кислоту (SLDA), таурин-N,N-диуксусную кислоту (TUDA) и сульфометил-N,N-диуксусную кислоту (SMDA), N-{2-гидроксиэтил)-этилидендиамин-N,Nʹ,Nʹ-триацетат (HEDTA), диэтанолглицин (DEG), диэтилентриамин-пента(метиленфосфоновую кислоту) (DTPMP), аминотрис(метиленфосфоновую кислоту) (АТМР) и их комбинации и соли. Дополнительные иллюстративные средства, усиливающие моющее действие, и/или средства, способствующие усилению моющего действия, описаны, например, в WO 09/102854, US 5977053.
Отбеливающие системы
Моющее средство может содержать 0-50% по весу, как например, от приблизительно 0,1% до приблизительно 25% отбеливающей системы. Может быть применена любая отбеливающая система, известная из уровня техники для применения в стиральных порошках. Компоненты пригодной отбеливающей системы включают катализаторы отбеливания, фотоотбеливатели, активаторы отбеливания, источники перекиси водорода, такие как перкарбонат натрия и пербораты натрия, заранее сформированные перкислоты и их смеси. Пригодные заранее сформированные перкислоты включают, но без ограничения, пероксикарбоновые кислоты и соли, перугольные кислоты и соли, перимидиновые кислоты и соли, пероксимоносерные кислоты и соли, например, Oxone (R), и их смеси. Неограничивающие примеры отбеливающих систем включают отбеливающие системы на основе перекиси, которые могут содержать, например, неорганическую соль, в том числе соли щелочных металлов, такие как натриевые соли пербората (обычно моно- или тетрагидраты), перкарбонаты, персульфаты, перфосфаты, персиликатные соли, в комбинации с активатором отбеливания, образующим перкислоту. В данном документе выражение активатор отбеливания означает соединение, которое реагирует с пероксидным отбеливателем, таким как перекись водорода, с образованием перкислоты. Перкислота, полученная таким образом, представляет собой активированный отбеливатель. Подходящие активаторы отбеливания для применения в настоящем изобретении, включают таковые, относящиеся к классу сложных эфиров, амидов, имидов или ангидридов. Подходящими примерами являются тетраацетилендиамин (TAED), 4-[(3,5,5-триметилгексаноил)окси]бензолсульфонат натрия (ISONOBS), диперокси-додекановая кислота, 4-(додеканоилокси)бензолсульфонат (LOBS), 4-(деканоилокси)бензолсульфонат, 4-(деканоилокси)бензоат (DOBS), 4-(нонаноилокси)-бензолсульфонат (NOBS) и/или таковые, раскрытые в WO 98/17767. Конкретное семейство активаторов отбеливания, которое представляет интерес, раскрыто в ЕР 624154 и наиболее предпочтительным в этом семействе является ацетилтриэтилцитрат (АТС). АТС или короткоцепочечный триглицерид, такой как триацин, имеет такое преимущество, что является экологически безопасным, так как в конце концов разрушается до лимонной кислоты и спирта. Кроме того, ацетилтриэтилцитрат и триацетин имеют хорошую гидролитическую стабильность в продукте при хранении и являются эффективным активатором отбеливания. Наконец, АТС обеспечивает хорошую вместимость наполнителя в добавке для стирки. Альтернативно, отбеливающая система может содержать пероксикислоты, например, амидного, имидного или сульфонового типа. Отбеливающая система может дополнительно содержать перкислоты, такие как 6-(фталимино)пероксигексановая кислота (РАР). Отбеливающая система может дополнительно включать катализатор отбеливания. В некоторых вариантах осуществления отбеливающий компонент может представлять собой органический катализатор, выбранный из группы, состоящей из органических катализаторов со следующими формулами:
(iii) и их смеси; где каждый R1 независимо представляет собой разветвленную алкильную группу, содержащую от 9 до 24 атомов углерода, или неразветвленную алкильную группу, содержащую от 11 до 24 атомов углерода, предпочтительно каждый R1 независимо представляет собой разветвленную алкильную группу, содержащую от 9 до 18 атомов углерода, или неразветвленную алкильную группу, содержащую от 11 до 18 атомов углерода, более предпочтительно каждый R1 независимо выбран из группы, состоящей из 2-пропилгептила, 2-бутилоктила, 2-пентилнонила, 2-гексилдецила, н-додецила, н-тетрадецила, н-гексадецила, н-октадецила, изо-нонила, изо-децила, изо-тридецила и изо-пентадецила. Другие иллюстративные отбеливающие системы описаны, например, в WO 2007/087258, WO 2007/087244, WO 2007/087259 и WO 2007/087242. Подходящие фотоотбеливатели могут, например, представлять собой сульфированный фталоцианин цинка.
Полимеры
Моющее средство может содержать 0-10% по весу, как например, 0,5-5%, 2-5%, 0,5-2% или 0,2-1% полимера. Для применения в моющих средствах, можно использовать любой полимер, известный в данной области техники. Полимер может функционировать в качестве средства, способствующего усилению моющего действия, которое упомянуто выше, или может обеспечивать препятствие переосаждению, защиту волокон, грязеотталкивание, ингибирование переноса красителя, очистку от жира и/или антивспенивающие свойства. Некоторые полимеры могут характеризоваться более чем одним из вышеупомянутых свойств и/или более чем одним из нижеприведенных мотивов. Иллюстративные полимеры включают (карбоксиметил)целлюлозу (CMC), поливиниловый спирт) (PVA), поли(винилпирролидон) (PVP), поли(этиленгликоль) или поли(этиленоксид) (PEG), этоксилированный поли(этиленимин), карбоксиметилинулин (CMI) и поликарбоксилаты, такие как РАА, РАА/РМА, полиаспарагиновую кислоту и сополимеры лаурилметакрилат/акриловая кислота, гидрофобно модифицированную CMC (НМ-СМС) и кремнийогранические соединения, сополимеры терефталевой кислоты и олигомерные гликоли, сополимеры поли(этилентерефталата) и поли(оксиэтилентерефталата) (РЕТ-РОЕТ), PVP, поли(винилимидазол) (PVI), поли(винилпиридин-N-оксид) (PVPO или PVPNO) и поливинилпирролидон-винилимидазол (PVPVI). Дополнительные иллюстративные полимеры включают сульфированные поликарбоксилаты, полиэтиленоксид и полипропиленоксид (РЕО-РРО) и этоксисульфат дикватерния. Другие иллюстративные полимеры раскрыты, например, в WO 2006/130575. Также предполагаются соли вышеупомянутых полимеров.
Окрашивающие средства для тканей
Моющие композиции согласно настоящему изобретению могут также включать окрашивающие средства для тканей, такие как красители или пигменты, которые при составлении в моющих композициях могут откладываться на ткани, когда указанная ткань контактирует с моющим раствором, содержащим указанные моющие композиции, и, следовательно, они изменяют тон указанной ткани посредством поглощения/отражения видимого света. Флуоресцентные отбеливающие средства излучают по меньшей мере некоторое количество видимого света. Напротив, окрашивающие средства для тканей изменяют тон поверхности, поскольку они поглощают по меньшей мере часть света видимой части спектра. Подходящие окрашивающие средства для тканей включают красители и конъюгаты краситель-глина, а также они могут включать пигменты. Подходящие красители включают красители-малые молекулы и полимерные красители. Подходящие красители-малые молекулы включают красители-малые молекулы, выбранные из группы, состоящей из красителей, попадающих при классификации по цветовому индексу (C.I.) в Direct Blue, Direct Red, Direct Violet, Acid Blue, Acid Red, Acid Violet, Basic Blue, Basic Violet и Basic Red или их смеси, например, как описано в WO 2005/03274, WO 2005/03275, WO 2005/03276 и ЕР 1876226 (тем самым включены с помощью ссылки). Моющая композиция предпочтительно содержит от приблизительно 0,00003 вес.% до приблизительно 0,2 вес.%, от приблизительно 0,00008 вес.% до приблизительно 0,05 вес.% или даже от приблизительно 0,0001 вес.% до приблизительно 0,04 вес.% окрашивающего средства для тканей. Композиция может содержать от 0,0001 вес.% до 0,2 вес.% окрашивающего средства для тканей, это может быть особенно предпочтительным, когда композиция присутствует в форме пакета со стандартной дозой. Подходящие окрашивающие средства также раскрыты, например, в WO 2007/087257 и WO 2007/087243.
Дополнительные ферменты
В одном аспекте настоящее изобретение обеспечивает моющую добавку, содержащую лизоцим согласно настоящему изобретению. Моющая добавка, также как и моющая композиция, может содержать один или несколько [дополнительных] ферментов, таких как протеаза, липаза, кутиназа, амилаза, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например лакказа, и/или пероксидаза.
В целом, свойства выбранного фермента(ов) должны быть совместимыми с выбранным моющим средством (т.е. оптимум рН, совместимость с другими ферментативными и неферментативными ингредиентами и т.д.), при этом фермент(ы) должны присутствовать в эффективных количествах.
Целлюлазы. Пригодные целлюлазы включают таковые бактериального или грибкового происхождения. Включают химически модифицированные или мутанты белковой инженерии. Пригодные целлюлазы включают целлюлазы из рода Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, например, грибковые целлюлазы, полученные от Humicola insolens, Myceliophthora thermophila и Fusarium oxysporum, раскрытые в US 4435307, US 5648263, US 5691178, US 5776757 и WO 89/09259.
Особенно пригодными целлюлазами являются щелочные или нейтральные целлюлазы, обладающие преимуществами сохранения цвета. Примерами таких целлюлаз являются целлюлазы, описанные в ЕР 0495257, ЕР 0531372, WO 96/11262, WO 96/29397, WO 98/08940. Другими примерами являются такие варианты целлюлаз, как описанные в WO 94/07998, ЕР 0531315, US 5457046, US 5686593, US 5763254, WO 95/24471, WO 98/12307 и PCT/DK98/00299.
Коммерчески доступные целлюлазы включают Celluzyme™, и Carezyme™ (Novozymes A/S), Clazinase™, и Puradax HA™ (Genencor International Inc.), и KAC-500(B)™ (Kao Corporation).
Протеазы. Подходящие протеазы включают таковые животного, растительного или микробного происхождения. Микробное происхождение является предпочтительным. Включены химически модифицированные или мутанты белковой инженерии. Протеаза может представлять собой сериновую протеазу или металлопротеазу, предпочтительно щелочную микробную протеазу или трипсин-подобную протеазу. Примерами щелочных фосфатаз являются субтилизины, особенно таковые, полученные из Bacillus, например, субтилизин Novo, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168 (описанные в WO 89/06279). Примерами трипсин-подобных протеаз являются трипсин (например, свиного или бычьего происхождения) и протеаза Fusarium, описанная в WO 89/06270 и WO 94/25583.
Примерами полезных протеаз являются варианты, описанные в WO 92/19729, WO 98/20115, WO 98/20116 и WO 98/34946, особенно варианты с заменами в одном или нескольких из следующих положений: 27, 36, 57, 76, 87, 97, 101, 104, 120, 123, 167, 170, 194, 206, 218, 222, 224, 235 и 274.
Предпочтительные коммерчески доступные ферменты-протеазы включают Alcalase™, Savinase™, Primase™, Duralase™, Esperase™ и Kannase™ (Novozymes A/S), Maxatase™, Maxacal™, Maxapem™, Properase™, Purafect™, Purafect OxP™, FN2™ и FN3™ (Genencor International Inc.).
Липазы и кутиназы. Пригодные липазы и кутиназы включают таковые бактериального или грибкового происхождения. Включены химически модифицированные мутантные ферменты или мутантные ферменты, полученные с применением белковой инженерии. Примеры включают липазу из Thermomyces, например, из Т. lanuginosus (ранее называемый Humicola lanuginosa), которая описана в ЕР 258068 и ЕР 305216, кутиназу из Humicola, например, Н. insolens (WO 96/13580), липазу из штаммов Pseudomonas (некоторые из них сейчас переименованы в Burkholdeha), например, P. alcaligenes или P. pseudoalcaligenes (ЕР 218272), P. cepacia (ЕР 331376), P. sp.штамм SD705 (WO 95/06720 & WO 96/27002), Р. wisconsinensis (WO 96/12012), липазы GDSL-типа Streptomyces (WO 10/065455), кутиназу из Magnaporthe grisea (WO 10/107560), кутиназу из Pseudomonas mendocina (US 5389536), липазу из Thermobifida fusca (WO 11/084412), липазу Geobacillus stearothermophilus (WO 11/084417), липазу из Bacillus subtilis (WO 11/084599) и липазу из Streptomyces griseus (WO 11/150157) и S. pristinaespiralis (WO 12/137147).
Другими примерами являются варианты липаз, такие как описанные в ЕР 407225, WO 92/05249, WO 94/01541, WO 94/25578, WO 95/14783, WO 95/30744, WO 95/35381, WO 95/22615, WO 96/00292, WO 97/04079, WO 97/07202, WO 00/34450, WO 00/60063, WO 01/92502, WO 07/87508 и WO 09/109500.
Предпочтительные коммерческие продукты на основе липаз включают Lipolase™, Lipex™; Lipolex™ и Lipoclean™ (Novozymes A/S), Lumafast (первоначально от Genencor) и Lipomax (первоначально от Gist-Brocades).
Другими примерами являются липазы, иногда называемые ацилтрансферазами или пергидролазами, например, ацилтрансферазы с гомологией с липазой A Cuida antarctica (WO 10/111143), ацилтрансферазы из Mycobacterium smegmatis (WO 05/56782), пергидролазы из семейства СЕ 7 (WO 09/67279) и варианты пергидролазы М. smegmatis, в частности, вариант S54V, используемый в коммерческом продукте Gentle Power Bleach от Huntsman Textile Effects Pte Ltd (WO 10/100028).
Амилазы. Пригодные амилазы (α и/или β) включают таковые бактериального или грибкового происхождения. Включены химически модифицированные или мутанты белковой инженерии. Амилазы включают, например, α-амилазы полученные из Bacillus, например, специальный штамм Bacillus licheniformis, описанный более детально в GB 1296839.
Примерами полезных амилаз являются варианты, описанные в WO 94/02597, WO 94/18314, WO 96/23873 и WO 97/43424, особенно варианты с заменами в одном или нескольких из следующих положений: 15, 23, 105, 106, 124, 128, 133, 154, 156, 181, 188, 190, 197, 202, 208, 209, 243, 264, 304, 305, 391, 408 и 444.
Коммерчески доступные амилазы представляют собой Duramyl™, Termamyl™, Fungamyl™, Stainzyme ™, Natalase™ и BAN™ (Novozymes A/S), Rapidase™ и Purastar™ (от Genencor International Inc.).
Пероксидазы/оксидазы. Подходящие пероксидазы/оксидазы включают таковые растительного, бактериального или грибкового происхождения. Включены химически модифицированные или мутанты белковой инженерии. Примеры полезных пероксидаз включают пероксидазы из Coprinus, например из С.cinereus, и их варианты, как описанные в WO 93/24618, WO 95/10602 и WO 98/15257. Коммерчески доступные пероксидазы включают Guardzyme™ (Novozymes A/S).
Фермент(ы) в моющем средстве могут быть включен(ы) в моющую композицию путем добавления отдельных добавок, содержащих один или несколько ферментов, или путем добавления комбинированной добавки, содержащей все из этих ферментов. Моющую добавку согласно настоящему изобретению, т.е., отдельную добавку или комбинированную добавку, можно составить, например, в виде гранулята, жидкости, взвеси и т.д. Предпочтительные составы моющих добавок представляют собой грануляты, в частности непылящие грануляты, жидкости, в частности стабилизированные жидкости, или взвеси.
Непылящие грануляты можно получать, например, как раскрыто в US 4106991 и 4661452, и на них можно наносить покрытие с применением способов, известных из уровня техники. Примерами восковидных покрывающих материалов являются поли(этиленоксидные) продукты (полиэтиленгликоль, PEG) со средней молярной массой 1000-20000; этоксилированные нонилфенолы с 16-50 этиленоксидными единицами; этоксилированные жирные спирты, в которых спирт содержит от 12 до 20 атомов углерода и в которых присутствует от 15 до 80 этиленоксидных единиц; жирные спирты; жирные киспоты; а также моно-, и ди-, и триглицериды жирных кислот.Примеры пленкообразующих покрывающих материалов, подходящих для нанесения с помощью методик с применением псевдоожиженного слоя, приведены в GB 1483591. Жидкие препараты фермента можно, например, стабилизировать путем добавления полиола, такого как пропиленгликоль, сахара или сахароспирта, молочной кислоты или борной кислоты в соответствии с общепризнанными способами. Защищенные ферменты можно получать в соответствии со способом, раскрытым в ЕР 238216.
Вспомогательные материалы
Также могут быть применены любые моющие компоненты, известные из уровня техники для применения в стиральных порошках. Другие необязательные моющие компоненты включают антикоррозионные средства, средства, препятствующие стягиванию, средства против переосаждения, средства, препятствующие сморщиванию, бактерициды, связующие, ингибиторы коррозии, разрыхлители/разрыхляющие средства, красители, стабилизаторы ферментов (в том числе борная кислота, бораты, CMC и/или полиолы, такие как пропиленгликоль), кондиционеры для тканей, в том числе глины, наполнители/технологические добавки, флуоресцентные отбеливающие
средства/оптические отбеливатели, пенообразователи, регуляторы пенообразования (образования мыльной пены), отдушки, средства, суспендирующие загрязнение, мягчители, подавители образования мыльной пены, ингибиторы потускнения и средства, способствующие капиллярному затеканию, либо отдельно, либо в комбинации. Может быть применен любой ингредиент, известный из уровня техники для применения в стиральных порошках. Выбор таких ингредиентов находится в компетенции специалиста в данной области техники.
Диспергирующие средства. Моющие композиции согласно настоящему изобретению могут также содержать диспергирующие средства. В частности, порошковые моющие средства могут содержать диспергирующие средства. Подходящие водорастворимые органические материалы включают гомо- или сополимерные кислоты или их соли, в которых поликарбоновая кислота содержит по меньшей мере два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода. Подходящими диспергирующими средствами являются, например, описанные в Powdered Detergents, Surfactant science series volume 71, Marcel Dekker, Inc.
Средства, ингибируюшие перенос красителя. Моющие композиции согласно настоящему изобретению могут также включать одно или несколько средств, ингибирующих перенос красителя. Подходящие полимерные средства, ингибирующие перенос красителя, включают без ограничения полимеры поливинилпирролидона, полимеры полиамин-N-оксида, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси. Если они присутствуют в представленной композиции, средства, ингибирующие перенос красителя, могут присутствовать при уровнях от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,01% до приблизительно 5% или даже от приблизительно 0,1% до приблизительно 3% по весу композиции.
Флуоресцентное отбеливающее средство. Моющие композиции согласно настоящему изобретению предпочтительно будут также содержать дополнительные компоненты, которые могут очищать окрашенные изделия, такие как флуоресцентное отбеливающее средство или оптические отбеливатели. Если он присутствует, то оптический отбеливатель предпочтительно присутствует при уровне от приблизительно 0,01% до приблизительно 0,5%. В композиции согласно настоящему изобретению может применяться любое флуоресцентное отбеливающее средство, подходящее для применения в композиции стирального порошка. Наиболее часто применяемые флуоресцентные отбеливающие средства представляют собой таковые, относящиеся к классам производных диаминостильбен-сульфоновой кислоты, диарилпиразолиновых производных и бисфенилдистириловых производных. Примеры флуоресцентных отбеливающих средств типа производных диаминостильбен-сульфоновой кислоты включают натриевые соли 4,4ʹ-бис-(2-диэтаноламино-4-анилино-в-триазин-6-иламино)стильбен-2,2ʹ-дисульфоната; 4,4ʹ-бис-(2,4-дианилино-з-триазин-6-иламино)стильбен-2.2ʹ-дисульфоната; 4,4ʹ-бис-(2-анилино-4(N-метил-N-2-гидрокси-этиламино)-з-триазин-6-иламино)стильбен-2,2ʹ-дисульфоната, 4,4ʹ-бис-(4-фенил-2,1,3-триазол-2-ил)стильбен-2,2ʹ-дисульфоната; 4,4ʹ-бис-(2-анилино-4(1-метил-2-гидрокси-этиламино)-з-триазин-6-иламино)стильбен-2,2ʹ-дисульфоната и 2-(стильбил-4ʺ-нафто-1.,2ʹ:4,5)-1,2,3-тризол-2ʺ-сульфоната. Предпочтительные флуоресцентные отбеливающие средства представляют собой Tinopal DMS и Tinopal CBS, доступные от Ciba-Geigy AG, Базель, Швейцария. Tinopal DMS представляет собой натриевую соль 4,4ʹ-бис-(2-морфолино-4 анилино-з-триазин-6-иламино)стильбен-дисульфоната. Tinopal CBS представляет собой динатриевую соль 2,2ʹ-бис-(фенил-стирил)дисульфоната. Предпочтительными также являются флуоресцентные отбеливающие средства, коммерчески доступные как Parawhite КХ, поставляемый Paramount Minerals and Chemicals, Мумбай, Индия. Другие флуоресцирующие вещества, подходящие для применения в настоящем изобретении, включают 1-3-диарилпиразолины и 7-алкиламинокумарины. Уровни подходящего флуоресцентного оптического отбеливателя включают нижние уровни от приблизительно 0,01, от 0,05, от приблизительно 0,1 или даже от прибпизительно 0,2 вес.% до верхних уровней 0,5 или или даже 0,75 вес.%.
Грязеотталкиваюшие полимеры. Моющие композиции согласно настоящему изобретению также могут включать один или несколько грязеотталкивающих полимеров, которые способствуют удалению загрязнений с тканей, таких как хлопок и ткани на основе полиэстера, в частности для удаления гидрофобных загрязнений с тканей на основе полиэстера. Грязеотталкивающими полимерами могут, например, являться неионные или анионные полимеры на основе терефталата, поливинилкапролактам и родственные сополимеры, виниловые привитые сополимеры, сложный полиэфир-полиамиды, см., например, главу 7 в Powdered Detergents, Surfactant science series volume 71, Marcel Dekker, Inc. Другим типом грязеотталкивающих полимеров являются амфифильные алкоксилированные полимеры для очистки от жира, содержащие сердцевинную структуру и множество алкоксилатных групп, прикрепленных к этой сердцевинной структуре. Сердцевинная структура может содержать полиалкилениминную структуру или полиалканоламинную структуру, которые подробно описаны в WO 2009/087523 (тем самым включены с помощью ссылки). Более того, статистические привитые сополимеры являются подходящими грязеотталкивающими полимерами. Подходящие привитые сополимеры более подробно описаны в WO 2007/138054, WO 2006/108856 и WO 2006/113314 (тем самым включены с помощью ссылки). Другими грязеотталкивающими полимерами являются замещенные полисахаридные структуры, особенно замещенные целлюлозные производные, такие как модифицированные производные целлюлозы, такие как описанные в ЕР 1867808 или WO 2003/040279 (оба из которых тем самым включены с помощью ссылки). Подходящие целлюлозные полимеры включают целлюлозу, эфиры целлюлозы, сложные эфиры целлюлозы, амиды целлюлозы и их смеси. Подходящие целлюлозные полимеры включают анионно-модифицированную целлюлозу, неинно-модифицированную целлюлозу, катионно-модифицированную целлюлозу, цвиттерионно-модифицированную целлюлозу и их смеси. Подходящие целлюлозные полимеры включают метилцеллюлозу, карбоксиметилцеллюлозу, этил целлюлозу, гидроксиэтилцеллюлозу, гидроксипропилметилцеллюлозу, сложный эфир карбоксиметилцеллюлозы и их смеси.
Средства против переосаждения. Моющие композиции согласно настоящему изобретению могут также включать одно или несколько средств против переосаждения, таких как карбоксиметилцеллюлоза (CMC), поливиниловый спирт (PVA), поливинилпирролидон (PVP), полиоксиэтилен и/или полиэтиленгликоль (PEG), гомополимеры акриловой кислоты, сополимеры акриловой кислоты и малеиновой кислоты и этоксилированные полиэтиленимины. Полимеры на основе целлюлозы, описанные как грязеотталкивающие полимеры выше могут также функционировать в качестве средств против переосаждения.
Другие подходящие вспомогательные материалы включают без ограничения средства, препятствующие стягиванию, средства, препятствующие сморщиванию, бактерициды, связующие, носители, красители, стабилизаторы ферментов, мягчители тканей, наполнители, регуляторы пенообразования, гидротропы, отдушки, пигменты, подавители образования пузырьков, растворители и структурообразующие средства для жидких моющих средств и/или средства, обеспечивающие эластичность структуры.
Биопленки
Микроорганизмы, растущие в биопленках, являются менее чувствительными ко всем типам противомикробных средств, чем те же микроорганизмы при росте в традиционных суспензионных культурах.
Хорошо известно, что испытывающие недостаток питательных веществ бактерии являются гораздо менее чувствительными к ряду противомикробных воздействий. Например, ряд классических антибиотиков, таких как пенициллин, слабо проявляет себя у медленно делящихся или неделящихся бактерий. Поскольку лизоцим атакует и уничтожает пептидогликановый слой вне зависимости от состояния роста бактерий, он остается эффективным.
Контроль биопленки; пример трубки для подачи воды в стоматологии:
Наросты биопленки внутри трубки для подачи воды в стоматологии могут содержать биопленки, содержащие Pseudomonas aeruginosa, Proteus mirabilis, Legionella sp.и многие другие. Также существует возможность колонизации видами, обычно обнаруживаемыми в ротовой полости, в результате отказа клапанов, препятствующих втягиванию, внутри системы. Риск перекрестной инфекции становится еще больше возможного риска появления, если вовлечены пациенты с иммунодефицитом, и за последние несколько лет количество пациентов в этой категории продолжает устойчиво возрастать. Существует потребность в эффективном контроле накопления бактериальной биопленки в трубках для подачи воды в стоматологии. Обзор биопленок можно найти в: Watnick Ρ and Kolter R (2000), ʺBiofilm, city of microbesʺ, J 6acteno/.; 182(10):2675-9.
Типичным примером коммерческого продукта в виде леденца от боли в горле является Lysopaine, производимый BOEHRINGER INGELHEIM FRANCE,
Активные ингредиенты:
БАЦИТРАЦИН 200 международных единиц
(до 65 международных единиц/мг)
ПАПАИН 2 мг
до 30 ΝΚ/мг
ЛИЗОЦИМА ХЛОРГИДРАТ 5 мг
до 26000 единиц FIP/мг: единицы определены путем измерения кинетических характеристик OD при лизисе бактерий, суспендированных в буфере. Количество единиц при определении измеряли по вызванному лизисом изменению мутности бактериальной культуры, суспендированной в буфере.
Ингредиенты, не относящиеся активным ингредиентам:
вспомогательное вещество САХАРИН
вспомогательное вещество СТЕАРАТ МАГНИЯ
ментоловый ароматизатор
вспомогательное вещество СОРБИТ
Для местного лечения точечных инфекций, ограниченных слизистой оболочкой ротоглотки. Предупреждение, если клинические признаки общей бактериальной инфекции являются очевидными, рекомендуется терапия антибиотиками.
Зубная паста
Лизоцим можно применять сам по себе или в комбинации с другими ферментами или даже противомикробными пептидами. Примерами других ферментов являются глюкозооксидаза и лактопероксидаза.
Характерной композицией зубной пасты, включающей лизоцим, является ʺBioteneʺ от Laclede, Inc., 2030 East University Drive, Rancho Domiguez, CA 90220, USA.
Активные ингредиенты
содержание: лактопероксидаза (100 г);
неактивные ингредиенты:
глюкозооксидаза, лизоцим, монофторфосфат натрия, сорбит, глицерин, пирофосфат кальция, гидроокись кремния, ксилит, целлюлозная камедь, ароматизатор, бензоат натрия, бета-d-глюкоза, тиоцианат калия.
Настоящее изобретение дополнительно описывается следующими примерами, которые не следует толковать как ограничивающие объем настоящего изобретения.
ПРИМЕРЫ
Штаммы
Штамм МТ3568 Aspergillus oryzae использовали для экспрессии гена Acremonium alkalophilum, кодирующего фермент GH25. A. oryzae МТ3568 представляет собой производное Aspergillus oryzae JaL355 (WO 2002/40694) с разрушенным геном amdS (ацетамидаза), в котором аксотрофия по pyrG была восстановлена путем разрушения гена ацетамидазы (amdS) с геном pyrG в A. oryzae. Согласно Central Bureau vor Schnimmelkulture, Acremonium alkalophilum CBS 114.92 был выделен A. Yoneda в 1984 году из осадка сточных вод от компоста из свиных фекалий около озера Tsukui Lake, Япония. Aspergillus oryzae Tod 512 использовали для экспрессии гена Acremonium alkalophilum, кодирующего фермент GH25 (SEQ ID: 7) и варианты. A. oryzae и штамм, лишенный pyrG, можно трансформировать геном pyrG и трансформанты можно отбирать по их способности к росту в отсутствие уридина.
Среды и растворы
Среда YP состояла из 10 г дрожжевого экстракта, 20 г бактопептона и деионизированной воды в объеме до 1 литра.
Среда LB состояла из 10 г триптона, 5 г дрожжевого экстракта, 5 г хлорида натрия и деионизированной воды в объеме до 1 литра.
Среда MDU-2 Bp в расчете на литр состояла из 45 г мальтозы-1H2O, 7 г дрожжевого экстракта, 12 г KH2PO4, 1 г MgSO4⋅7H2O, 2 г K2SO4, 5 г мочевины, 1 г NaCl, 0,5 мл раствора металлов AMG, содержащихся в следовых количествах, с рН 5,0.
Среда G2-Gly состояла из 18 г дрожжевого экстракта, 24 г глицерина (86-88%), 1 мл Dowfax 63N10 и деионизированной воды в объеме до 1 литра.
Агаровая среда Horikoshi состояла из: 1% (вес./об.) декстрозы, 1% растворимого крахмала, 0,5% (вес./об.) пептона, 0,5% (вес./об.) дрожжевого экстракта, 0,02% (вес./об.) MgSO4⋅7H2O, 0,1% (вес./об.) K2HPO4 и 15 г (вес./об.) бакто-агара. 1% (вес./об.) Na2CO3 добавляли по отдельности после стерилизации.
Плашки с бакто-агаром состояли из среды LB и 15 г бакто-агара на литр.
Плашки с PDA агаром состояли из картофельного отвара (картофельный отвар получали путем кипячения 300 г нарезанных ломтиками (отмытых, но не чищеных) картофелин в воде в течение 30 минут и последующего сливания или сцеживания бульона через марлю. Затем добавляли дистиллированную воду до достижения общего объема суспензии один литр с последующим добавлением 20 г (вес./об.) декстрозы и 20 г (вес./об.) агарового порошка. Среду стерилизовали автоклавированием при давлении 15 фунтов на квадратный дюйм в течение15 минут (Bacteriological Analytical Manual, 8th Edition, Revision A, 1998).
Плашки с сахарозой COVE состояли из 342 г сахарозы, 20 г агарового порошка, 20 мл солевого раствора COVE и деионизированной воды в объеме до 1 литра. Среду стерилизовали автоклавированием при давлении 15 фунтов на квадратный дюйм в течение15 минут (Bacteriological Analytical Manual, 8th Edition, Revision A, 1998). Среду охлаждали до 60°C и добавляли 10 мМ ацетамида, 15 мМ CsCl и Triton Х-100 (50 мкг/500 мл).
Плашки с сахарозой и NaNO3 состояли из 20 мл солевого раствора COVE, 20 г агарового порошка, 342 г сахарозы и деионизированной воды в объеме до 1 литра. Среду стерилизовали автоклавированием при давлении 15 фунтов на квадратный дюйм в течение15 минут (Bacteriological Analytical Manual, 8th Edition, Revision A, 1998). Среду охлаждали до 60°C и добавляли 10 мМ NaNO3 и Triton Х-100 (50 мкг/500 мл).
Плашки с LB агаром состояли из 37 г LB агара и деионизированной воды в объеме до 1 литра.
Солевой раствор COVE состоял из 26 г MgSO4⋅7H2O, 26 г KCL, 26 г KH2PO4, 50 мл раствора металлов COVE, содержащихся в следовых количествах, и деионизированной воды в объеме до 1 литра.
Раствор металлов COVE, содержащихся в следовых количествах, состоял из 0,04 г Na2B4O7⋅10H2O, 0,4 г CuSO4⋅5H2O, 1,2 г FeSO4⋅7H2O, 0,7 г MnSO4⋅H2O, 0,8 г Na2MoO4⋅2H2O, 10 г ZnSO4⋅7H2O и деионизированной воды в объеме до 1 литра.
Металлы AMG, содержащиеся в следовых количествах, состояли в расчете на литр из 14,3 г ZnSO4⋅7H2O, 2,5 г CuSO4-5H2O, 0,5 г NiCl2, 13,8 г FeSO4, 8,5 г MnSO4, 3,0 г лимонной кислоты.
Среды на скошенном агаре COVE N-qly состояли из 10 г 100% глицерина, 50 мл солевого раствора COVE, 218 г сорбита, 2,02 г ΚΝO3, 25 г агара и деионизированной воды в объеме до 1 литра.
Пример 1: Анализ лизоцима
Xanthomonas campestris представляет собой организм-продуцент для всех способов продуцирования ксантановой камеди. Отделение клеток Xanthomonas от раствора ксантана с высокой вязкостью является дорогостоящим способом при промышленном производстве (Homma et al., ЕР 690072, Murofushi et al., EP 718311, US 5702927). В настоящее время преимущественным способом извлечения ксантана из ферментационной жидкости является осаждение со спиртом, в основном изопропанолом, после пастеризации для разрушения бактериальных клеток и ферментов (Cottrell, W.I.; Kang, S.К. Dev. (1978), ʺXanthan gum: A unique bacterial polysaccharide for food applicationsʺ, Ind. Microbiol, 19: 177). Затем осадок ксантана/клеточного дебриса лиофилизируют и размалывают в порошок. Спирт извлекают путем перегонки. Вследствие существенных количеств дебриса клеточных стенок Xanthomonas в некоторых коммерческих препаратах ксантановой камеди, а также того, что этот дебрис представляет собой богатый пептидогликаном материал клеточных стенок Xanthomonas, камедь можно применять в качестве удобного материала для анализа активности разрушения пептидогликана.
Анализ на плашках твердой среды
Коммерчески доступную ксанатановую камедь (Sigma #G-1253) растворяли в буферном растворе или среде для роста бактерий до концентрации 0,5% вес./об. в присутствии 0,7% агарозы и затем автоклавировали. Препараты ферментов, супернатанты или целые организмы либо осаждают в лунках, вырезанных из плашек с бакто-агаром, или осаждают непосредственно на поверхность среды. Препараты способны образовывать прозрачные зоны на плашках. Эти прозрачные зоны могут указывать на разрушение материала бактериальной клеточной стенки.
Анализ прозрачности в жидкой среде
Полученную из коммерческих источников ксантановую камедь растворяют в буферном растворе в присутствии или в отсутствие хлорида натрия. Раствор автоклавируют и используют для исследования очищения ксантановой камеди. Препараты ферментов, супернатанты или целые организмы добавляют в среду для анализа и инкубируют.Полученные в результате обработки образцы измеряют на спектрофотометре для определения OD раствора. Как правило, используют длину волны 600 нм.
Пример 2: Клонирование и характеристика гена, кодирующего лизоцим из Acremonioum alkalophilum (SEQ ID NO: 4)
Информацию о геномных последовательностях получали от Объединенного института генома при Департаменте энергетики США (U.S. Department of Energy Joint Genome Institute (JGI)). Согласно Central Bureau vor Schnimmelkulture, Acremonium alkalophilum CBS 114.92 был выделен A. Yoneda в 1984 году из осадка сточных вод от компоста из свиных фекалий около озера Tsukui Lake, Япония. Предварительная сборка генома была загружена из JGI и ее анализировали с применением Pedant-ProTM Sequence Analysis Suite (Biomax Informatics AG, Мартинсрид, Германия). Модели генов, построенные с помощью программного обеспечения, использовали в качестве отправной точки для выявления гомологов GH25 в геноме. Более точные модели генов строили вручную с применением нескольких известных последовательностей белков GH25 в качестве шаблона.
Acremonium alkalophilum CBS 114.92 размножали на агаре Horikoshi, рН 9, в течение 7 дней при 30 С. Мицелии собирали непосредственно из плашек и ДНК выделяли с помощью набора FastDNA SPIN Kit для почвы (www.mpbio.com). ДНК элюировали в 100 мкл 10 мМ TRIS буфера, 0,1 мМ EDTA, рН 7,5 и хранили при 4°С до применения.
Пара синтетических олигонуклеотидных праймеров, показанных в таблице 1 ниже, сконструировали для ПЦР амплификации гена Р242М9 GH25 A. alkalophilum CBS114.92 из геномной ДНК A. alkalophilum. Набор для клонирования IN-FUSION™ Cloning Kit (Clontech, Маунтин-Вью, Калифорния, США) использовали для клонирования фрагмента непосредственно в вектор экспрессии pDau109 (WO 2005/042735).

Буквы, выделенные жирным шрифтом, представляют кодирующую последовательность. Последовательность, выделенная подчеркиванием, является гомологичной сайтам вставки в pDau109.
Реакционная смесь ПЦР (25 мкл) состояла из 12,5 мкл 2Х IPROOF™ HF Master Mix, 0,5 мкл праймера F-Р242М9 (100 мкМ), 0,5 мкл праймера R-Р242М9 (100 мкМ), 0,5 мкл геномной ДНК (100 нг/мкл) и 11 мкл деионизированной воды.
Реакционная смесь ПЦР (25 мкл) состояла из ДНК полимеразы Phusion High-Fidelity DNA Polymerase (кат. № F-530S, Thermoscientific, США), 5 мкл 5Х буфера Pfusion, 0,5 мкл 10 мМ dNTP, 0,5 мкл праймера F-Р242М9 (100 мкМ), 0,5 мкл праймера R-Р242М9 (100 мкМ), 0,5 мкл геномной ДНК (100 нг/мкл) и 18 мкл деионизированной воды. Реакционную смесь ПЦР инкубировали в термоциклере с двумя блоками DYAD® (ΜJ Research Inc., Уолтем, Массачуссетс, США), запрограммированном на 1 цикл при 95°С в течение 2 минут; 35 циклов, каждый при 98°С в течение 10 секунд, 72°С в течение 2 минут и 30 секунд, 1 цикл при 72°С в течение 10 минут.Образцы охлаждали до 12°С перед удалением и дальнейшей обработкой.
Пять мкл реакционной смеси ПЦР анализировали с помощью электрофореза в 1% агарозном геле с применением ТАЕ буфера, при этом наблюдали полосу продукта длиной 874 п. о. Оставшуюся реакционную смесь ПЦР очищали с применением набора для очистки ДНК из полоски геля после проведения ПЦР ILLUSTRA™ GFX™ PCR DNA and Gel Band Purification Kit в соответствии с инструкциями производителя.
Фрагмент затем клонировали в pDau109, расщепленную Hind III и Bam HI, с применением набора для клонирования IN-FUSION™ Cloning Kit, что давало в результате плазмиду рР242М9. Клонирование гена Р242М9 в pDau109, расщепленную Hind Ill-Bam HI, приводило в результате к транскрипции гена Р242М9 Aspergillus aculeatus под контролем двойного промотора NA2-tpi. NA2-tpi представляет собой модифицированный промотор из гена, кодирующего нейтральную альфа-амилазу Aspergillus niger, в котором нетранслируемая лидерная последовательность была заменена нетранслируемой лидерной последовательностью из гена, кодирующего триозофосфат-изомеразу Aspergillus nidulans.
Протокол клонирования выполняли в соответствии с инструкциями к набору для клонирования IN-FUSION™ Cloning Kit с созданием конструкта Р242М9 GH25. Обработанную плазмиду и вставку трансформировали в клетки Е. coli Fusion Blue™ (Clontech, Маунтин-Вью, Калифорния, США) в соответствии с протоколом производителя и высаживали на плашки с LB, дополненные 50 мкг ампициллина на мл. После инкубирования при 37°С в течение ночи наблюдали рост колоний при отборе с ампициллином на плашках с LB. Десять колоний, трансформированных конструктом Р242М9 GH25, культивировали в среде LB, дополненной 50 мкг ампициллина на литр, и плазмиду выделяли с применением мини-набора FASTPIasmid mini kit от 5Prime (5 PRIME GmbH, Konigstrasse 4a, 22767 Гамбург, Германия) в соответствии с инструкциями производителя.
Выделенные плазмиды секвенировали с праймерами вектора и с целью определения типичного клона экспрессии плазмиды, который не содержит ошибок, возникших вследствие ПЦР. Секвенирование ДНК геномных клонов GH25 Acremonium alkalophilum CBS 114.92 осуществляли с применением автоматического секвенатора ДНК модель 3730xl от Applied Biosystems с применением набора химических реактивов BIG-DYE™ terminator chemistry версии 3.1 (Applied Biosystems, Inc., Фостер Сити, Калифорния, США) и стратегии ПЦР с ʺшагающими праймерамиʺ. Данные последовательности нуклеиновой кислоты тщательно проверяли в отношении качества и все последовательности сравнивали друг с другом с помощью программного обеспечения PHRED/PHRAP (Вашингтонский университет, Сиэтл, Вашингтон, США). Полученные последовательности были идентичны последовательностям из JGI.
Нуклеотидная последовательность и выведенная аминокислотная последовательность гена Р242М9 GH25 Acremonium alkalophilum показаны в SEQ ID NO: 3 и SEQ ID NO: 4, соответственно. Кодирующая последовательность составляет 838 п.о., включая стоп-кодон, и она прерывается одним интроном из 154 п.о. (нуклеотиды с 148 по 301). Прогнозируемый кодируемый белок состоит из 227 аминокислот.С применением программы SignalP (Nielsen et al., 1997, Protein Engineering 10: 1-6) был предсказан сигнальный пептид из 19 остатков. Предсказанный зрелый белок содержит 207 аминокислот.
Штамм МТ3568 Aspergillus oryzae использовали во всех изобретениях. Aspergillus oryzae МТ3568 представляет собой производное A. oryzae Jal_355 с разрушенным геном amdS (ацетамидазы) (WO 2002/40694), в котором аксотрофия по pyrG была восстановлена в процессе нокаутирования гена amdS A. oryzae. Протопласты A. oryzae МТ3568 получали в соответствии со способом из Европейского патента ЕР0238023, страницы 14-15. Свежие протопласты A. oryzae МТ3568 получали и трансформировали плазмидой рР242М9 GH25. Плазмидную ДНК из указанных выше протопластов согласно процедуре mini prep использовали для трансформации A. oryzae МТ3568.
Для трансформации использовали шесть мкл, содержащие приблизительно 3,0 мкг общей ДНК. ДНК аккуратно добавляли к 100 мкл протопластов A. oryzae МТ3568 и 250 мкл 60% PEG 4000 (Sigma-Aldrich кат. №95904). 60% (вес./об.) PEG 4000 готовили следующим способом: порошок PEG 4000 растворяли в дистиллированной H2O и затем нагревали в течение 10-20 секунд в микроволновой печи при мощности 800 Ватт до растворения. Разведенный раствор охлаждали до комнатной температуры и затем доводили раствором CaCl2 и раствором Tris-HCl (рН 7,5) до конечной концентрации 10 мМ каждого из них. После добавления 60% раствора PEG 4000 пробирку аккуратно перемешивали и инкубировали при 37°С в течение 30 минут.Смесь добавляли к 6 мл верхнего агара с 10 мМ ацетамидом и высевали на плашки с COVE-сорбитом, содержащие 10 мМ ацетамид.
Плашки инкубировали при 37°С в течение 3 или более дней, а затем перемещали в 26°С на два дня. Споры от 4 отдельных колоний собирали путем погружения белой 10 мкл иглы для инокуляции (Nunc A/S, Дания) вначале в 0,1% раствор TWEEN® 80, контакта образующей споры колонии на плашке для отбора и осуществления пересева штрихом на свежие плашки с COVE-сорбитом, содержащие 10 мМ ацетамид. После 5 дней при 26°С споры из пересеянных штрихом колоний использовали для инокуляции 96-луночного планшета с глубокими лунками (NUNC, кат.№260251, Thermoscientific, США). Лунки планшета с глубокими лунками содержали 500 мкл либо среду YP+2% глюкозы, либо среду YP+2% мальтодекстрина. Инокулированные планшеты запечатывали газопроницаемой лентой (89009-656, VWR.com). Планшеты инкубировали в стационарных условиях при 30 С в течение 5 дней. Экспрессию подтверждали путем анализа 20 мкл собранной культуральной жидкости на SDS-PAGE с применением 10% Bis-Tris геля NUPAGE® (Invitrogen, Карлсбад, Калифорния, США) и окрашивания кумасси синим. Отбирали один трансформант для дальнейшей работы и обозначали A. oryzae ЕХР03864.
Споры ЕХР03864 инокулировали в среду DAP-4C-1 (100 мл в 500 мл встряхиваемую колбу Эрленмейера с перегородками). Культуры инкубировали при 26°С и 150 об/мин 3 дня и, если необходимо, 4 дня. SDS гель прогоняли, как указанно выше, для определения количества белка.
Тест на лизоцимную активность на плашках
Капельный анализ осуществляли с помощью ксантановой камеди при рН 5, 7 и 8, как описано в разделе об анализе лизоцима на плашках.
1,5% раствор агарозы (Invitrogen кат.15510-027, степень чистоты для электрофореза) готовили в следующих буферах:
рН~5 - в воде
рН~7 - в 0,02М фосфате калия с рН 7
рН~8 - в 0,02М фосфате калия с рН 8
Агарозу автоклавировали в течение 20 минут при 121°С. 0,5% Ксантановую камедь (Sigma G1253) растворяли в расплавленной 1,5% агарозе и смесь выливали в чашки Петри. Когда среда в чашках затвердевала, лунки для внесения образца делали с применением наконечника для пипетки Р-1000 (отсеченного до диаметра 3 мм), присоединенного к вакуумному шлангу.
20 мкл культуральной жидкости от ЕХР03899 помещали в лунки для внесения и инкубировали при 37°С в течение ночи. Образцы с лизоцимной активностью наблюдали по прозрачным зонам, в которых наблюдали клеточный дебрис в ксантановой камеди. Культуральные жидкости от ЕХР03864 проявляли такие прозрачные зоны, тогда как нетрансформированный трансформационный хозяин МТ3568 Aspergillus oryzae не давал заметных прозрачных зон. Оставшуюся жикость из культуры ЕХР03899 фильтровали через фильтр на горловине флакона Fast PES с порогом отсечения 0,22 мкм, и хранили в аликвотах при -20°С до дальнейшего применения.
Пример 3: RDA (анализы с помощью радиальной диффузии)
Первоначально, противомикробная активность культуральных супернатантов и очищенных фракций,содержащих рекомбинантно экспрессируемые лизоцимы, подтверждали с применением RDA, которые ранее описаны Lehrer et al. (Lehrer Rl, Rosenman M, Harwig SS et al. (1991), ʺUltrasensitive assays for endogenous antimicrobial polypeptidesʺ, J Immunol Methods, 137: 167-73), с несколькими модификациями. Вкратце, 30 мл расплавленного 1/10 бульона Мюллера-Хинтона (МНВ) (Sambrook J, Fritsch EF, Maniatis Т. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 1989) с 1% агарозы охлаждали до 42°С, дополняли до концентрации 5,0×105 КОЕ/мл S. carnosus ATCC 51365 или Ε. coli DSM682 (ATCC 10536) и выливали в однолуночный планшет omnitray (Nunc). На планшет omnitray накладывали TSP планшет (Nunc) и оставляли для затвердения. Через 1 час TSP планшет удаляли; при этом оставалось 96 1-мм лунок в которых можно исследовать 10 мкл представляющего интерес соединения.
В виде капли наносят по 10 мкл исследуемого раствора на лунку и планшеты инкубируют в течение ночи при 37°С.На следующий день прозрачные зоны указывали на отсутствие роста исследуемых бактерий и, следовательно, на противомикробную активность. Прозрачные зоны визуализировали путем окрашивания МТТ (бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия, желтый тетразол), который восстанавливается до пурпурного формазана в живых клетках (Mosmann, Tim (1983), ʺRapid colorimetric assay for cellular growth и survival: application to proliferation и cytotoxicity assaysʺ, Journal of Immunological Methods 65 (1-2): 55-63). Это окрашивание дает черное окрашивание живых клеток и не дает окрашивания прозрачных зон без живых клеток.
Лизоцим GH25 Aspergillus fumigatus (полученный, как раскрыто в Korczynska et al, Acta Cryst. (2010) F66, 973-977) был включен в исследование в качестве эталонного соединения. Очищенные образцы, показанные в таблице 2 ниже, исследовали в RDA анализе.

Измерение прозрачных зон
Эксперимент осуществляли в трех повторностях, причем все из них давали в результате одинаковые измеренные прозрачные зоны/зоны подавления, см. фигуру 1. В таблице 3 ниже приведены прозрачные зоны в мм.
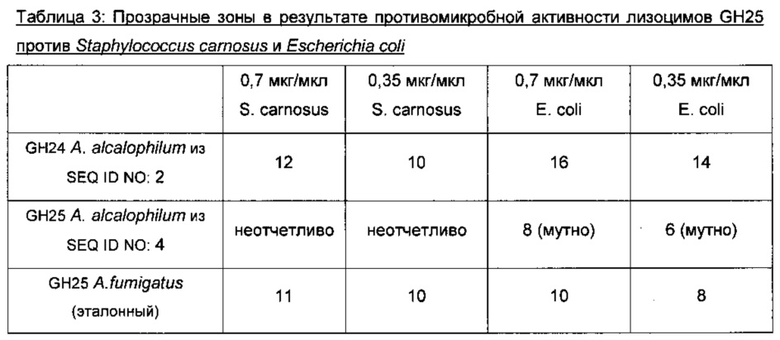
Очищенный лизоцим GH24 A. alcalophilum (SEQ ID NO: 4) проявлял противомикробную активность против живых клеток грамположительных бактерий Staphylococcus carnosus и грамотрицательных бактерий Escherichia coli.
Противомикробная активность не наблюдалась в культуральных супернатантах от нетрансформированного продуцирующего хозяина Aspergillus (результаты не показаны).
Большие прозрачные зоны с неопределенными границами наблюдали вокруг зоны внесения GH24 A. alcalophilum (SEQ ID NO: 2). Эксперимент указывает на то, что лизоцим A. alcalophilum (SEQ ID NO: 2) и эталонный GH25 лизоцим Aspergillus fumigatus обладают различной активностью и специфичностью в отношении двух бактерий, исследуемых в этом примере.
Пример 4: Анализ помутнения
Активность лизоцима определяли путем измерения снижения (падения) поглощения/оптической плотности раствора ресуспендированного Micrococcus lysodeikticus АТТС №4698 (Sigma-Aldrich М3770) или Exiguobactehum undea (DSM14481), измеренной на спектрофотометре при 540 нм.
Приготовление субстрата Micrococcus lysodeikticus
Перед применением клетки ресуспендировали в лимонной кислоте - фосфатном буфере с рН 6,5 до концентрации 0,5 мг клеток/мл и измеряли оптическую плотность (OD) при 540 нм. Суспензию клеток затем доводили с тем, чтобы концентрация клеток соответствовала OD540=1,0. Доведенную суспензию клеток затем хранили холодной до применения. Ресуспендированные клетки использовались не позднее чем через 4 часа.
Приготовление буфера лимонная кислота-фосфат с рН 6,5
29 мл 0,1 Μ лимонной кислоты смешивали с 61 мл 0,2 Μ Na2HPO4 и рН доводили HCl или NaOH до рН 6,5.
Приготовление высушенных клеток Exiguobacterium undae (субстрат)
Культуру Е. undae (DSM14481) выращивали в 100 мл среды LB (Fluka 51208, 25 г/л) в 500 мл встряхиваемой колбе при 30°С, 250 об/мин в течение ночи. Выращиваемую в течение ночи культуру затем центрифугировали при 20°С и 5000 g в течение 10 минут, и осадок промывали два раза в стерильной воде milliQ, и ресуспендировали в воде Milli-Q. Отмытые клетки центрифугировали в течение 1 минуты при 13000 об/мин и декантировали как можно больше супернатанта. Отмытые клетки высушивали в вакуумной центрифуге в течение 1 часа. Клеточный осадок ресуспендировали в буфере лимонная кислота-фосфат с рН 6,5 с тем, чтобы оптическая плотность (OD) при 540 нм=1.
Измерение противомикробной активности лизоцима в анализе помутнения
Образец лизоцима, который нужно подвергнуть измерению, разводили до концентрации 100-200 мг белка-фермента/л в буфере лимонная кислота-фостфат с рН 6,5 и держали на льду до применения. В 96-луночном микротитровальном планшете (Nunc) 200 мкл субстрата добавляли в каждую лунку и планшет инкубировали при 25°С или 37°С в течение 5 минут в микропланшет-ридере VERSAmax (Molecular Devices). После инкубирования поглощение в каждой лунке измеряли при 540 нм (начальное значение). Чтобы начать измерение активности, 20 мкл разведенного образца лизоцима добавляли к каждому субстрату (200 мкл) и измерение кинетики поглощения при 540 нм проводили в течение минимум 30 минут и вплоть до 24 часов при 25°С или 37°С.Измеренное поглощение при 540 нм отслеживали для каждой лунки и со временем падение поглощения наблюдали, если лизоцим обладал лизоцимной активностью.
Лизоцим GH25 Aspergillus fumigatus (Korczynska et al (2010), выше) был включен в исследование в качестве эталонного соединения, и результаты показаны в таблице 4 ниже.
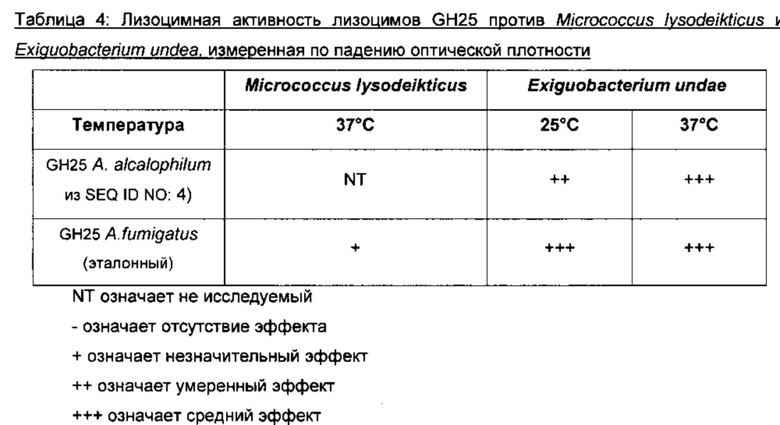
Пример 5: Очистка белка Р242М9 GH25 в Aspergillus oryzae
Ферментационный супернатант с лизоцимом фильтровали через фильтр на горловине флакона Fast PES с порогом отсечения 0,22 мкм. рН доводили до 4,5 10% уксусной кислотой. После доведения рН раствор становился слегка мутным и ее удаляли с помощью фильтрования через фильтр на горловине флакона Fast PES с порогом отсечения 0,22 мкм.
После предварительной обработки 650 мкл содержащего лизоцим раствора очищали с помощью хроматографии на сефарозе SP приблизительно 50 мл в ХК26 колонке с применением в качестве буфера А 50 мМ ацетата Na с рН 4,5 и в качестве буфера В-50 мМ ацетата Na+1 Μ NaCl с рН 4,5. Фракции из колонки объединяли на основании хроматограммы (поглощение при 280 и 254 нм) и SDS-PAGE анализа. Объединенные фракции подвергали замене буфера в 50 мМ ацетате Na, рН 5,5, и концентрировали с применением центробежных фильтров Amicon с порогом отсечения 10 кДа.
Молекулярный вес, который оценивали по SDS-PAGE, составлял приблизительно 22 кДа, а чистота составляла >95%.
Пример 6: Температурная стабильность Р242М9 GH25
Температурную стабильность определяли для лизоцима Р242М9 GH25 Acremonium alcalophilum (SEQ ID NO: 4). Целью исследования является определение остаточной активности лизоцима GH25 Acremonium alcalophilum после термической обработки при 60°С-85°С.
Образцы инкубировали при различной температуре в течение короткого периода времени (30 с и 60 с), после чего измеряли остаточную активность в течение 1 часа при 37°С в буфере лимонная кислота-фосфат с применением грамположительных бактерий Micrococcus luteus в качестве субстрата. Падение OD в анализе помутнения при 540 нм использовали для определения лизоцимной активности.
Термическая обработка
Термическую обработку осуществляли в буферном растворе с лизоцимом GH25 Acremonium alcalophilum (SEQ ID NO: 4) в предварительно нагретом ПЦР термоциклере (ПЦР система GeneAmp 9700) в течение 30/60 с при разных температурах. 60, 65, 70, 75, 80 и 85°С использовали в течение либо 30, либо 60 секунд, после чего пробирки помещали на водяную баню для моментального охлаждения образцов.
Анализ помутнения
Активность лизоцима определяли путем измерения снижения (падения) поглощения/оптической плотности раствора ресуспендированного Micrococcus luteus (также названного Micrococcus lysodeikticus) АТТС №4698 (Sigma-Aldrich М3770), измеренной на спектрофотометре при 540 нм.
Приготовление субстрата Micrococcus luteus
Перед применением клетки ресуспендировали в буфере лимонная кислота-фосфат (полученный путем смешивания 29 мл 0,1 Μ лимонной кислоты с 61 мл 0,2 Μ Na2HPO4 и доведения до рН 6,5 с помощью HCl или NaOH) до концентрации 0,5 мг клеток/мл и измеряли оптическую плотность (OD) при 540 нм. Суспензию клеток затем доводили таким образом, что концентрация клеток соответствовала OD540=1,0. Доведенную суспензию клеток затем хранили холодной до применения. Суспендированные клетки использовали не позднее чем через 4 часа.
Измерение противомикробной активности лизоцима в анализе помутнения
Образец лизоцима разводили до концентрации 100-200 мг белка-фермента/л в буфере лимонная кислота-фосфат и держали на льду до применения. В 96-луночном микротитровальном планшете (Nunc) 200 мкл субстрата Micrococcus luteus добавляли в каждую лунку и планшет инкубировали при 37°С в течение 5 минут в микропланшет-ридере VERSAmax (Molecular Devices). После инкубирования поглощение в каждой лунке измеряли при 540 нм (начальное значение). Чтобы начать измерение активности, разведенный образец лизоцима (20 мкл) добавляли к разведенному субстрату с доведенным рН (200 мкл) в каждую лунку и измерение кинетики поглощения при 540 нм проводили в течение минимум 30 минут и вплоть до 24 часов при 37°С.
Измеренное поглощение при 540 нм отслеживали для каждой лунки и со временем наблюдали падение поглощения, если лизоцим обладал лизоцимной активностью. Различие между поглощением в Т=0 и моменты времени рассчитывали как ΔΟD и сравнивали между исследуемыми веществами (таблица 5 и фигура 2). Процент остаточной активности рассчитывали путем сравнения ΔΟD для подвергнутого термической обработке образца с AOD для образца, который не подвергали термической обработке. Вышеописанный эксперимент осуществляли в трех повторностях.
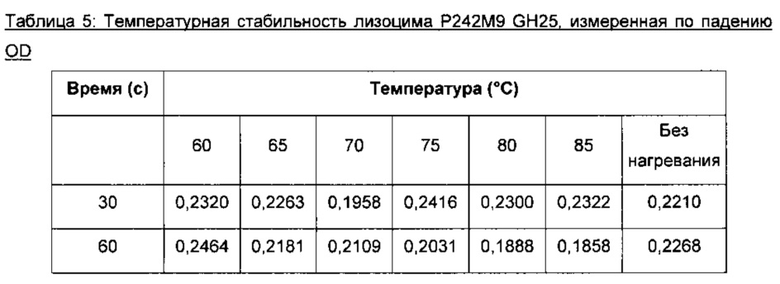
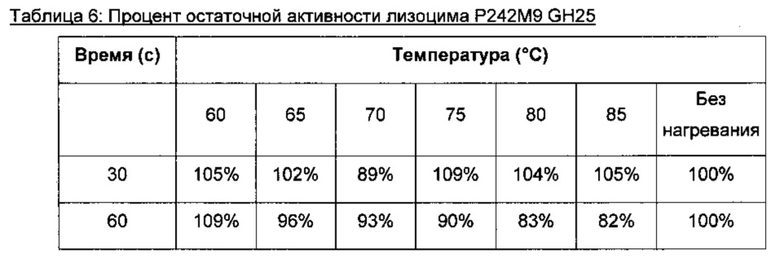
Результаты указывают на то, что лизоцим Р242М9 GH25 является стабильным через 30 секунд даже при 85°С, и что лизоцим GH25 сохраняет более 80% активности даже через 60 секунд при 85°С.
Пример 7: Термостабильность Р242М9 GH25, определенная с применением DSC
Аликвоту образца белка лизоцима (Р242М9 GH25), очищенного как описано в примере 7, подвергали заменен буфера (см. буфер в таблице ниже) с применение предварительно упакованной PD-10 колонке. Образец фильтровали через 0,45 мкм фильтр и разводили буфером до примерно 2 единиц А280. Буфер использовали в качестве эталонного раствора. Термостабильность лизоцима при различных значениях рН определяли с помощью дифференциальной сканирующей калориметрии (DSC) с применением инструмента VP-capillary DSC (MicroCal Inc., Пискатауэй, Нью-Джерси, США), оборудованного автосемплером. Температуру термической денатурации, Td (°С), принимали за вершину пика денатурации (главный эндотермический пик) на термограммах (Ср в сравнении с Т), полученных после нагревания растворов лизоцима в буфере при постоянной программируемой скорости нагревания.
Раствор образца и эталонный раствор (примерно 0,5 мл) предварительно термически уравновешивали в течение 10 минут при 20°С и осуществляли DSC сканирование при температуре от 20 до 110°С скорости сканирования 200 К/час.Обработку данных осуществляют с применением программного обеспечения MicroCal Origin (версия 7.0383). Температуры денатурации определяли с точностью примерно+/-0,5°С. Результаты измерений DSC кратко изложены в таблице 7 и на фигуре 3.

Пример 8: Клонирование и экспрессия кодирующих лизоцим генов из Acremonioum alkalophilum (SEQ ID NO: 8)
Исходя из нуклеотидной последовательности, идентифицированной как SEQ ID NO: 3, синтетический ген из SEQ ID NO: 7 синтезировали с помощью Gene Art (GENEART AG BioPark, Josef-Engert-Str. 11, 93053, Регенсбург, Германия). Набор праймеров ПЦР, приведенный ниже в таблице 8, использовали для ПЦР амплификации синтетического гена GH25. С целью клонирования сайты рестрикции BamHI и EcoRI вводили в конец полученного с помощью фрагмента ПЦР (сайты рестрикции в последовательностях нижеперечисленных праймеров выделены подчеркиванием, и буквы, выделенные жирным шрифтом, представляют кодирующую последовательность).

Полученный с помощью ПЦР фрагмент очищали центрифугированием, расщепляли BamHI и EcoRI (New England Biolabs) и лигировали с применением набора для лигирования Rapid DNA Ligation kit (Roche) в двухпромоторный плазмидный вектор экспрессии в A. Oryzae/E. coli pENI1898, который сначала был расщеплен BamHI и EcoRI. pENI1898 модифицирован из вектора pENI1861 (WO 03/070956) так, что последовательность ΑΜΑ (Clutterbuck A. J., et al. (1991) Gene 98 (1): 61-67) была удалена при расщеплении вектора Hindlll с последующим повторным лигированием вектора, очищенного с помощью агарозного геля. Кроме того, pENI1861 несет ген pyrG и способен дополнять лишенный pyrG штамм Aspergillus.
После 5 минут инкубирования при комнатной температуре реакционную смесь от лигирования трансформировали в компетентные Е. coli ТОР 10 клетки (Invitrogen), которые помещали на плашки с LB агаром, содержащие 150 мкг/мл ампициллин. Плашки инкубировали в течение 16 часов при 37°С. Плазмидную ДНК очищали от выбранных трансформантов и секвенировали для подтверждения процедуры клонирования.
Прогнозируемый кодируемый белок состоит из 248 аминокислот и содержит сигнальный пептид из 23 остатков и зрелый белок из 207 аминокислот.Зрелая последовательность из SEQ ID NO: 4 является идентичной зрелой последовательности из SEQ ID NO: 8.
Пример 9: Клонирование и экспрессия вариантов лизоцима GH25
Варианты гена GH25
Клонировали и экспрессировали 10 вариантов, содержащих изменения одной аминокислоты в синтетическом гене лизоцима GH25. Варианты лизоцима GH25 состоят из следующих единичных замен: W10H, Y28M, S39D, G92P, А93М, Е97А, V133M, T142N, F178I или D190A.
Клонирование вариантов GH25
Для создания GH25 вариантов, которые описаны выше, сайт направленный мутагенез на основе ПЦР выполняли с мутагенными праймерами, которые вводили желаемое изменение последовательности (замены). Праймеры конструировали так, чтобы мутации находились в середине олигонуклеотида с достаточным количеством фланкирующих нуклеотидов (15-25). Плазмидную ДНК, содержащую GH25, использовали в качестве матрицы и ПЦР проводили с корректирующей ДНК полимеразой (ДНК полимераза Phusion (New England Biolabs). ПЦР продукты использовали для трансформации компетентных клеток Е. coli ТОР 10 (Invitrogen) в соответствии с инструкциями производителя. Плазмидную ДНК выделяли из моноклональных трансформированных штаммов Е. coli и секвенировали для подтверждения присутствия желаемой замены.
Трансформация и экспрессия GH25 и вариантов
Плазмидную ДНК pENI1898, кодирующую ген лизоцима, использовали для трансформации в протопласты A. oryzae ТоС1512 (WO 2005/070962), как описано в примере 2, и высевали на плашки с сахарозой и NaNO3 без уридина для отбора трансформантов, несущих соответствующие конструкты. Плашки инкубировали в течение 72 часов при 37°С.
Отдельные колонии выделяли путем пересева штрихом колоний на плашки с сахарозой и NaN03 в течение 72 часов при 37°С и выращивали на среде YP при 34°С в течение 72 часов. Колонии, экспрессирующие лизоцим, отбирали после оценки бульона с помощью анализа помутнения в 50 мМ 3,3-диметилглутаровой кислоте при рН 6,4 с клеточными стенками Micrococcus lysodeikticus в качестве субстратов. Кроме того, экспрессию лизоцима подтверждали путем визуального наблюдения полосы, соответствующей примерно 23 кДа, при анализе SDS-PAGE.
Трансформанты, экспрессирующие лизоцим, подвергали пересеву штрихом и выращивали на средах на скошенном агаре COVE N-gly при 37°С в течение еще 5 дней, и инокулировали в 200 мл встряхиваемую колбу со средой G2-Gly. После культивирования с энергичным встряхиванием при 30°С в течение 1 дня 3 мл каждой культуры переносили в 200 мл MDU-2Bp во встряхиваемой колбе с культивированием при 30°С в течение 3 дней. Культуральные бульоны очищали подобно очищению лизоцима Р242М9 GH25 в примере 6 выше.
Пример 10: Противомикробная активность
Исследовали противомикробную активность лизоцима Р242М9 GH25, синтетического GH25 лизоцима и 11 вариантов синтетического GH25 лизоцима в отношении двух штаммов Clostridium perfringens.
Способ и материалы
Активность определяли как по измерению оптической плотности, так и по количеству колониеобразующих единиц в культурах Cl. perfringens до и после воздействия лизоцима. Воздействие активных лизоцимов на Cl. perfringens будет приводить в результате к гибели бактерий и соответствующему снижению как оптической плотности (падение OD), так и количества колониеобразующих единиц.
Вкратце, маточные растворы лизоцима разводили в PBS (рН 6) до концентраций 50 мкг/мл. Осуществляли двукратные разведения этих 50 мкг/мл растворов в PBS (рН 6) до конечных концентраций 0,4 мкг/мл.
Затем выращиваемые в течение ночи культуры Cl. perfringens ресуспендировали в PBS (рН 6). OD546 измеряли и доводили до 1. Культуры (75 мкл) смешивали в микротитровалных планшетах (Nunc) в соотношении 1:1 с приготовленными растворами лизоцима (75 мкл), что приводило в результате к воздействию на Cl. perfringens конечных концентраций лизоцимов, находящихся в диапазоне 0,4-25 мкг/мл (всего 7 концентраций для указанных лизоцимов). На культуры воздействовали в течение 4 часов при 42°С. OD5406 и КОЕ/мл измеряли в моменты времени 0 и 4 часа после воздействия.
Результаты
Результаты исследования активности показаны в таблицах 9, 10 и 11, а также на фигурах 4 и 5. В таблице 9 показано уменьшение количества колониеобразующих единиц двух штаммов Clostridium perfringens на мл (КОЕ/мл) GH25 лизоцимом или вариантом. Воздействие активных лизоцимов, как правило, приводило в результате к снижению количества КОЕ/мл на 1-2 порядка. Лизоцимную активность оценивали как значительную, если снижение количества КОЕ/мл составляло ≥1 порядка.
В таблицею показано падение оптической плотности (дельта OD) Clostridium perfringens NN01260 после воздействия лизоцима Р242М9 GH25 (SEQ ID NO: 4), синтетического лизоцима GH25 (SEQ ID NO: 8) или 11 вариантов SEQ ID NO: 8. В таблице 11 показано падение оптической плотности (дельта OD) клинического изолята Clostridium perfringens при воздействии лизоцима Р242М9 GH25 (SEQ ID NO: 4), синтетического лизоцима GH25 (SEQ ID NO: 8) или 11 вариантов SEQ ID NO: 8.

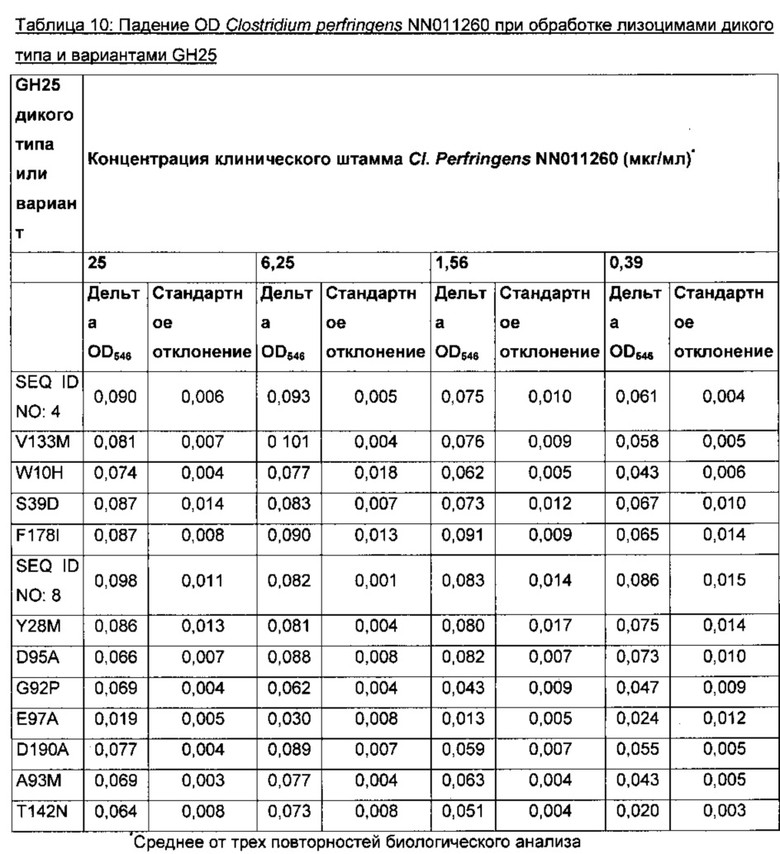

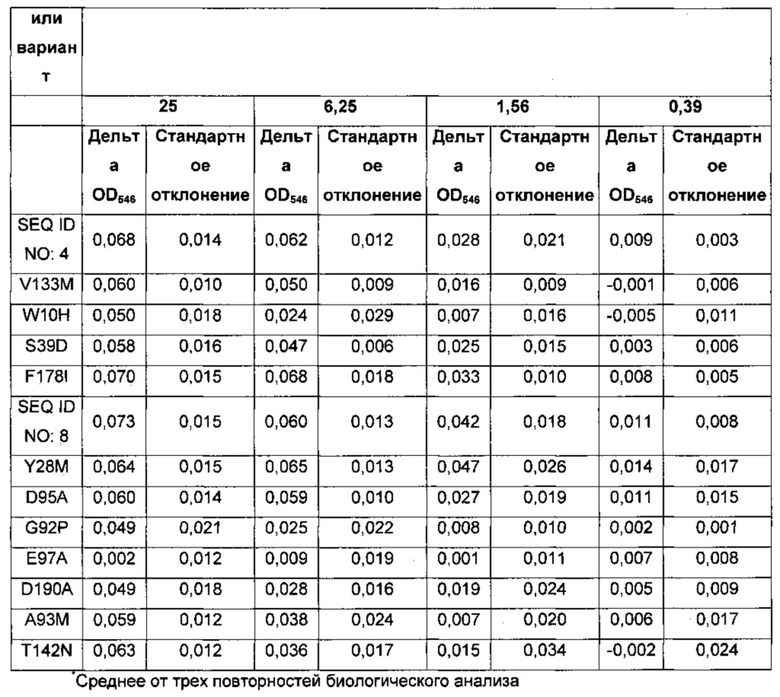
Результаты указывают на то, что мутация по 9 положениям не приводит в результате к потере лизоцимной активности. Тем не менее, мутация по положению 97 приводила в результате к потере активности, указывая на то, что по этому положению не может быть введена мутация.
Пример 11: Профиль активности в зависимости от рН
Профиль активности в зависимости от рН для лизоцима согласно настоящему изобретению определяли путем измерения уменьшения (падения) поглощения/оптической плотности раствора ресуспендированного Micrococcus luteus АТТС №4698 (Sigma-Aldrich М3770), измеренной на спектрофотометре при 540 нм в диапазоне значений рН с целью определения того, при каком рН GH25 лизоцим или вариант обладает пиковой лизоцимной активностью.
Субстрат Micrococcus luteus готовили, как описано в примере 6. Противомикробную активность лизоцима измеряли, как описано в примере 6, за исключением того, что буфер лимонная кислота-фосфат доводили до одного из следующих значений рН HCl или NaOH до начала эксперимента: 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5 и 7,0. Описанный выше эксперимент осуществляли в двух повторностях или трех повторностях, и результаты приведены в таблице 12 ниже.
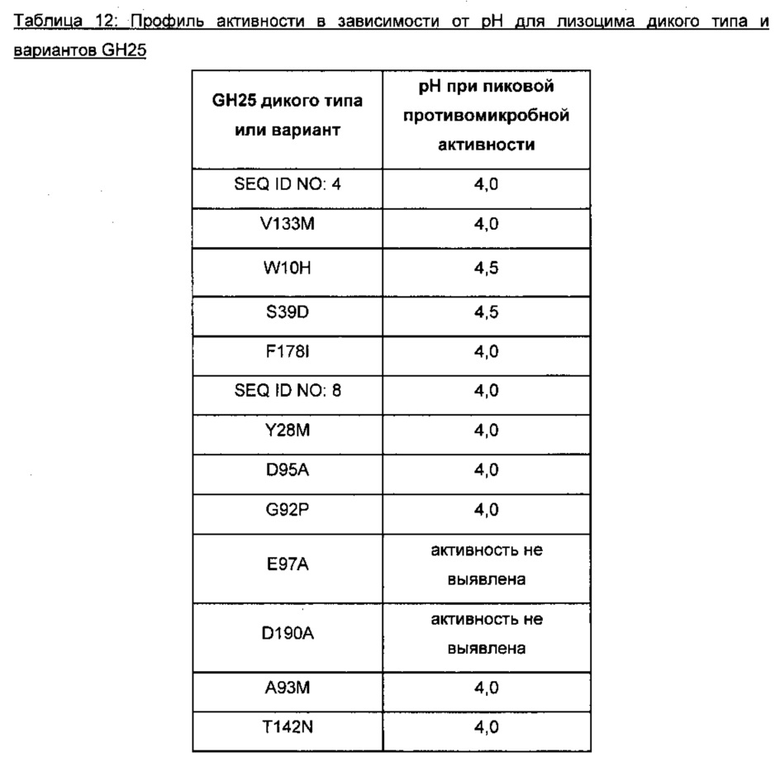
Результаты указывают на то, что варианты лизоцима GH25 согласно настоящему изобретению, имеющие замены Y28M, G92P, А93М, V133M, T142N или F178I, сохраняли противомикробную активность без значительного изменения профиля активности в зависимости от рН по сравнению с лизоцимом дикого типа. Варианты GH25 лизоцима согласно настоящему изобретению, имеющие замену W10H или S39D, что приводило в результате к измененному профилю зависимости от рН так, что профиль зависимости от рН повышался на 0,5 единицы рН при сохранении противомикробной активности.
Пример 12: Стабильность в желудочной среде
Активность лизоцима белка куриного яйца, лизоцима GH25 A. alcalophilum (SEQ ID NO: 8 и двух вариантов (W10H и S39D) исследовали в анализе помутнения после инкубирования в течение до 1 часа в искусственном желудочном соке (рН 2), содержащем пепсин. Эту активность затем сравнивали со стандартной кривой, полученной для каждого лизоцима при идентичных или эквивалентных условиях, но без инкубирования с желудочным соком, содержащим пепсин.
Различные лизоцимы инкубировали в искусственном желудочном соке в течение промежутка времени в 0, 15, 30 или 60 минут.После инкубирования стоп-буфер добавляли для повышения рН и, следовательно, для избежания низкого рН и для предотвращения разрушения пепсином пептидных связей лизоцима. После дезактивации пепсина анализ активности по помутнению осуществляли совместно с построением стандартной кривой для различных концентраций указанного лизоцима для сравнения.
Искусственный желудочный сок: (HCI рН 2, 1 мг/мл пепсина, 0,1 М NaCl).
Раствор А: 0,01 Μ HCl, 0,1 Μ NaCl (приготовлена путем смешивания 275 мкл 1 Μ HCl с 2,5 мл 1 Μ NaCl и добавления 22,23 мл воды MQ до общего объема 25 мл).
Раствор В: 0,01 Μ HCl, 0,1 Μ NaCl, 10 мг/мл пепсина (приготовлен путем отвешивания 50 мг пепсина и добавления 5 мл раствора А).
Получение стандартной кривой
Искусственный желудочный сок (160 мкл) добавляли в каждую лунку микротитровального планшета с последующим добавлением 20 мкл буфера лимонная кислота-фосфат (рН 7 для лизоцима белка куриного яйца, рН 4 для лизоцима GH25 A. alcalophilum и рН 4,5 для вариантов W10H и S39D). Раствор лизоцима (20 мкл) затем добавляли к субстрату Micrococcus luteus (20 мкл, приготовлен, как описано в примере 6) добавляли в каждую лунку (стандартная кривая, а также образцы для динамического ряда) и OD при 540 нм измеряли каждую минуту в течение одного часа при 37°С.
Противомикробную активность измеряли, как описано в примере 6, за исключением того, что буфер лимонная кислота-фосфат доводили до оптимального рН для различных лизоцимов (как указано в предыдущем абзаце) путем добавления HCl или NaOH. Описанный выше эксперимент осуществляли в двух повторностях, и результаты приведены в таблице 13 ниже.
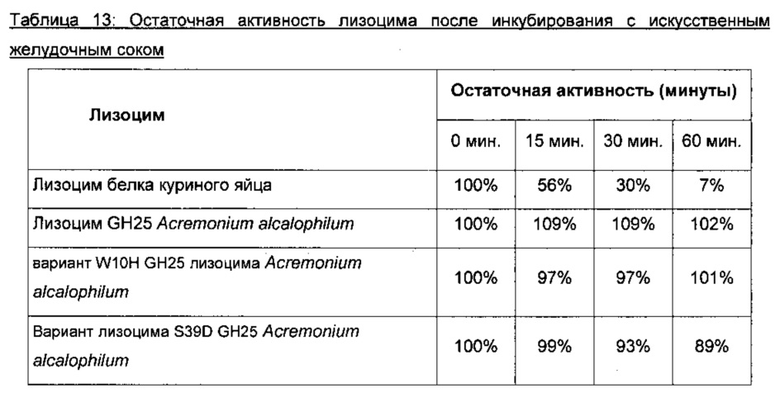
Остаточная лизоцимная активность после инкубирования в искусственном желудочном соке резко снижалась для лизоцимов белка куриного яйца даже через 15 минут. При сравнении лизоцим GH25 из Acremonium alcalophilum не проявлял уменьшения активности. Кроме того, два варианта GH25 с заменой W10H или S39D также сохраняли лизоцимную активность, проявляя подобную остаточную активность, что и GH25 лизоцимы из Acremonium alcalophilum.
Пример 13: Выделение геномной ДНК
Выход бактериальной геномной ДНК при очистке с добавлением лизоцима GH25 Acremonium alcalophilum (SEQ ID NO. 8) и комбинации лизоцима белка куриного яйца и лизоцима GH25 Acremonium alcalophilum (SEQ ID NO. 8) сравнивали с очисткой ДНК без лизоцима и только с лизоцимом белка куриного яйца. Геномную ДНК выделяли из пяти различных бактерий.
Способ
Бактериальную массу получали либо путем соскабливания клеток с агаровой плашки петлей для инокуляции, либо путем центрифугирования жидкой культуры (см. таблицу 14). ДНК выделяли с применением модифицированной версии набора QIAamp DNA Blood Mini Kit (кат. №51106) очищали либо с применением Qiagen QIAcube, либо вручную.
Выделение ДНК с применением QIAcube:
Соскоб колоний, соответствующий 10 мкл бактериологической петле, ресуспендировали в 3 мл буфера М9 (приготовленного путем растворения 8,77 г Na2HP0.2H20, 3 г КН2Р04, 4 г NaCl и 0,2 г MgS04.7H20 в 1000 мл Н20 и доведения рН до 7 с применением NaOH или HCI). Раствор центрифугировали в течение 5 мин при 3000 об/мин и осадок ресуспендировали в 3 мл буфера Р1 (включен в набор Qiagen №51106). Аликвоты 200 мкл добавляли в 12 2 мл пробирок и 15 мкл воды, лизоцима GH25 A. alcalophilum (10 мг/мл), лизоцима белка куриного яйца (10 мг/мл) или смеси 1:1 GH25 лизоцима A. alcalophilum (10 мг/мл)+лизоцим белка куриного яйца (10 мг/мл) добавляли в пробирки в трех повторностях. Пробирки помещали в QIAcube подвергали обработке в соответствии с рекомендациями Qiagen.
Ручное выделение ДНК
Осадки из жидких культур и соскобы колоний ресуспендировали в 3 мл буфера М9. Бактериальные суспензии в буфере М9 центрифугировали в течение 5 мин при 3000 об/мин и осадки ресуспендировали в 3 мл буфера Р1. Аликвоты 200 мкл добавляли в 12 2 мл пробирок и 15 мкл воды, лизоцима GH25 A. alcalophilum (10 мг/мл), лизоцима белка куриного яйца (10 мг/мл) или смеси 1:1 GH25 лизоцима A. alcalophilum (10 мг/мл)+лизоцим белка куриного яйца (10 мг/мл) добавляли в пробирки в трех повторностях. Пробирки инкубировали при 37°С в течение 30 мин, после чего добавляли 25 мкл протеазы Qiagen и 200 мкл буфера AL Qiagen. Пробирки затем инкубировали при 56°С в течение 20 мин 210 мкл 96% этанола затем добавляли в каждую пробирку. Пробирки перемешивали на вортекс-мешалке и жидкости переносили на спин-колонки Qiagen, и центрифугировали при 8000 об/мин в течение 1 мин Колонки промывали дважды 500 мкл буфера AW1 (включен в набор Qiagen №51106). После первой промывки колонки центрифугировали в течение 1 мин при 8000 об/мин и после второй промывки колонки центрифугировали в течение 3 мин при 15000 об/мин Геномную ДНК элюировали из колонки путем добавления 100 мкл воды milliQ (нагретой до 70°С) в каждую колонку, инкубировали в течение 1 мин при комнатной температуре и центрифугировали в пробирках Eppendorf при 8000 об/мин в течение 1 мин. Все инкубирования проводили в трех повторностях.
Результаты
Выход геномной ДНК оценивали путем прогона выделенный ДНК на агарозном геле и визуального наблюдения интенсивности полоски ДНК (таблица 15). Относительный выход ДНК для 4 разных обработок каждого бактериального штамма оценивали визуально с применением 4 различных оценок.

Применение лизоцима GH25 A. alcalophilum давало практически такой же или лучший выход геномной ДНК в 3 из 6 случаев по сравнению с лизоцимом белка куриного яйца. Применение комбинации лизоцима GH25 A. alcalophilum и лизоцима белка куриного яйца давало практически такой же или лучший выход геномной ДНК в 5 из 6 случаев по сравнению с любым из лизоцимов по отдельности.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЮЩАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2737535C2 |
| ПРИМЕНЕНИЕ ВАРИАНТОВ ПРОТЕАЗЫ | 2010 |
|
RU2639534C2 |
| Композиции, содержащие липазы, и способы обработки поверхности | 2013 |
|
RU2612215C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |
| ВАРИАНТЫ СУБТИЛАЗ | 2010 |
|
RU2651525C2 |
| ФЕРМЕНТ ПРОТЕАЗА И ЕГО ПРИМЕНЕНИЯ | 2012 |
|
RU2611043C2 |
| СПОСОБЫ ПОВЫШЕНИЯ УСИЛИВАЮЩЕЙ ЦЕЛЛЮЛОЛИТИЧЕСКОЙ АКТИВНОСТИ ПОЛИПЕПТИДА | 2008 |
|
RU2510417C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ЭНДОПЕПТИДАЗНОЙ АКТИВНОСТЬЮ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2011 |
|
RU2583293C2 |
| ВАРИАНТЫ СЕМЕЙСТВА, СОСТОЯЩЕГО ИЗ 44 КСИЛОГЛЮКАНАЗ | 2009 |
|
RU2545721C2 |
| МОДИФИЦИРОВАННЫЕ ФИТАЗЫ | 2003 |
|
RU2329301C2 |









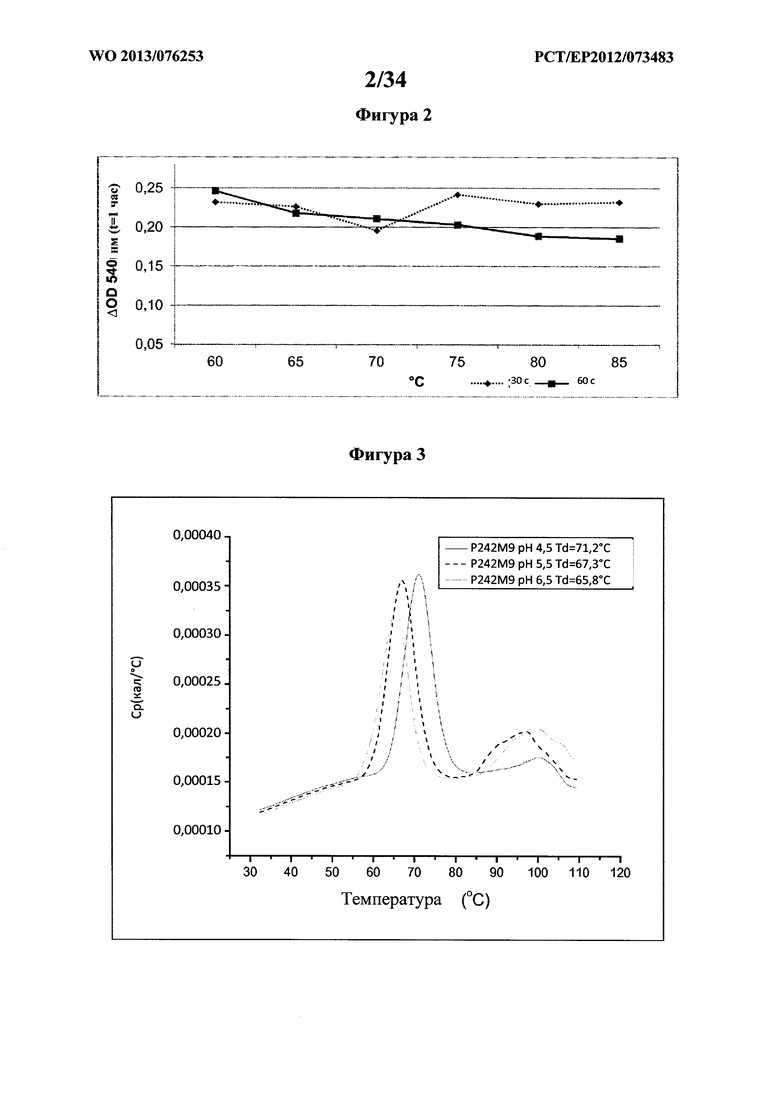
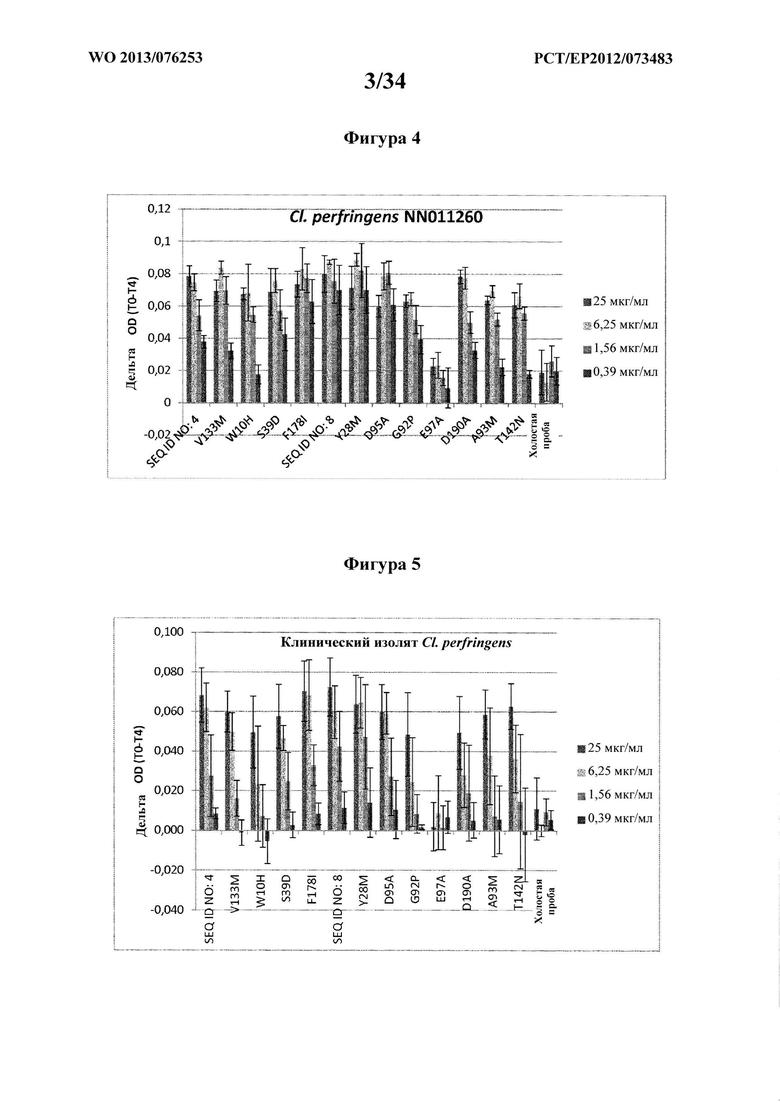
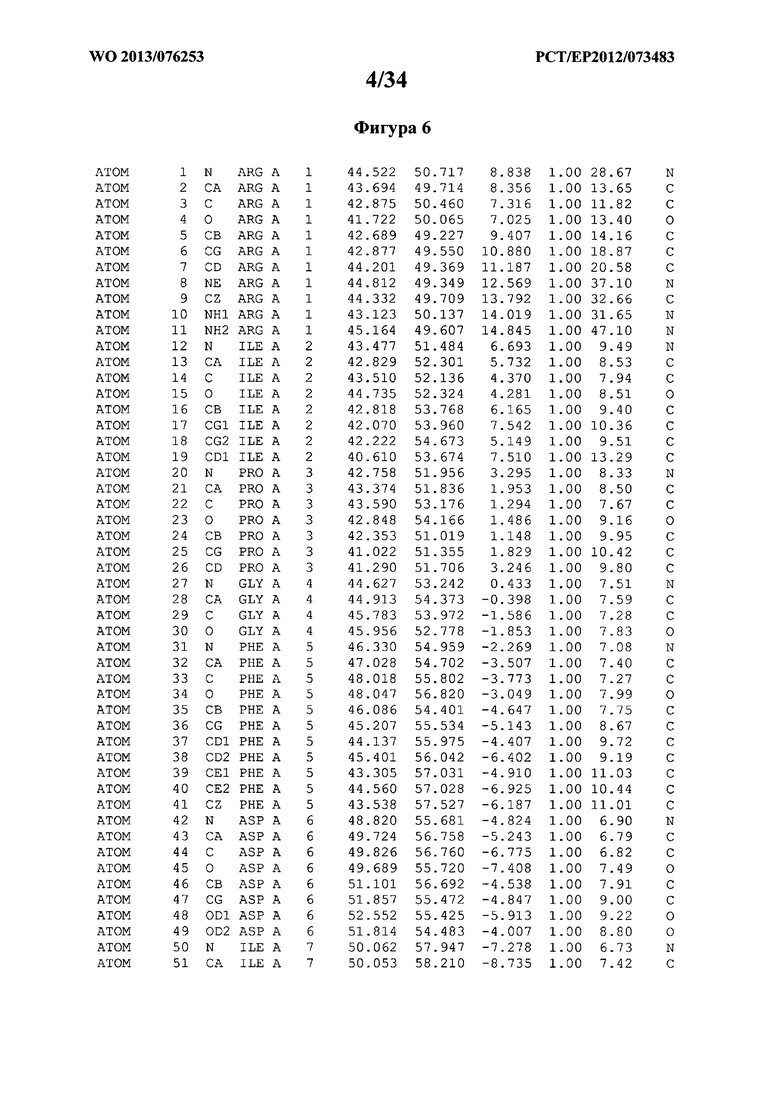
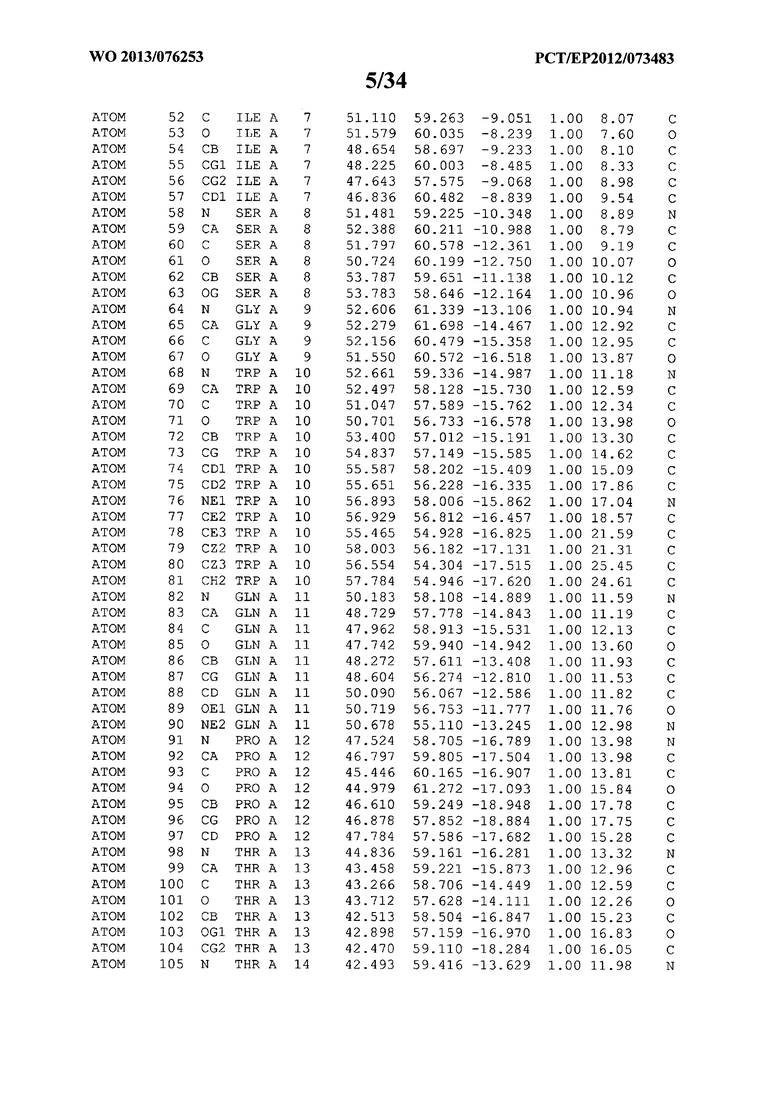
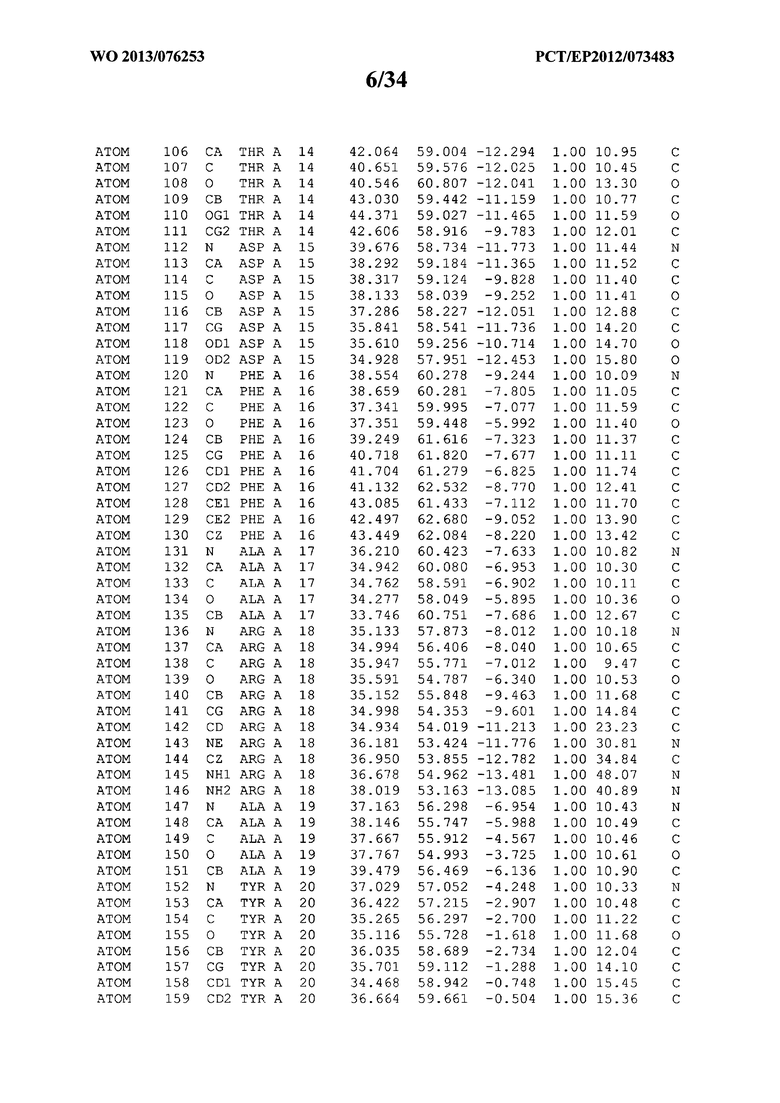
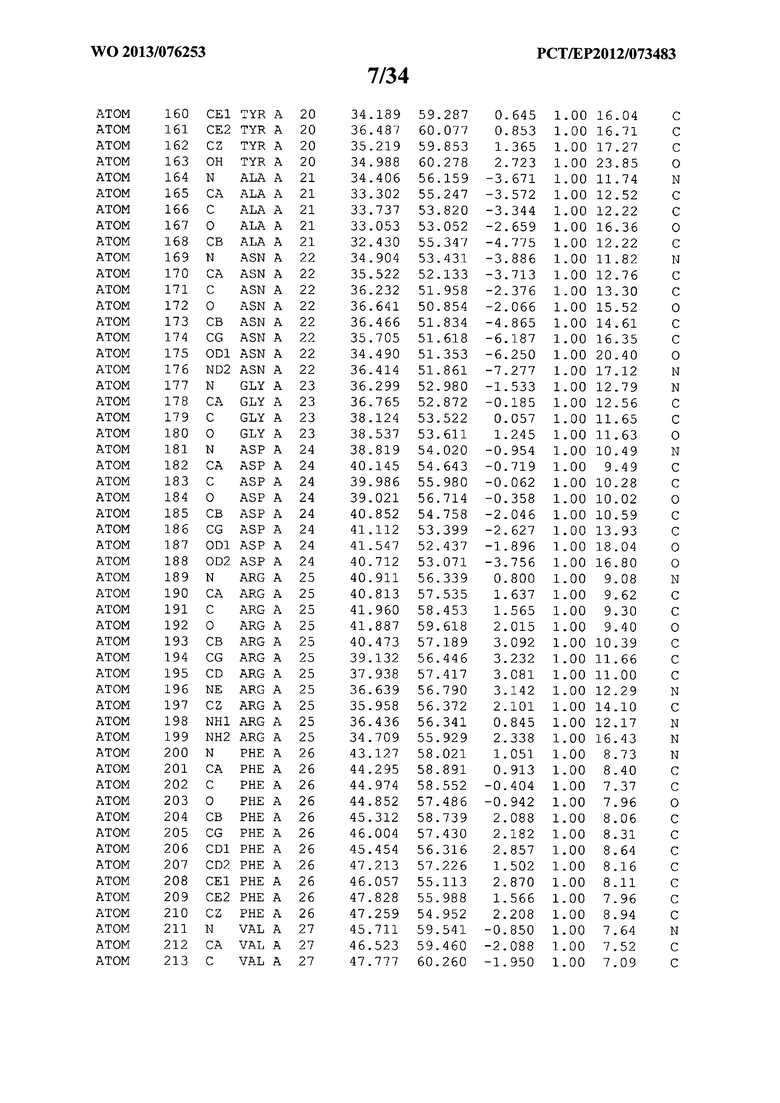

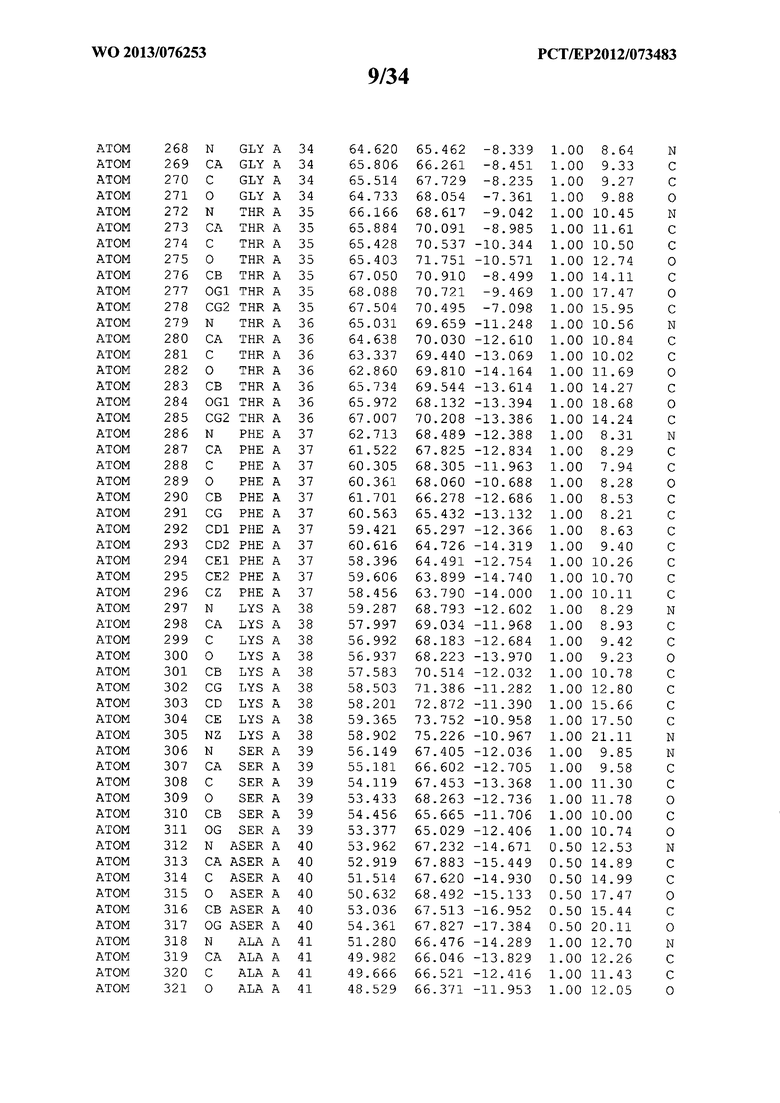
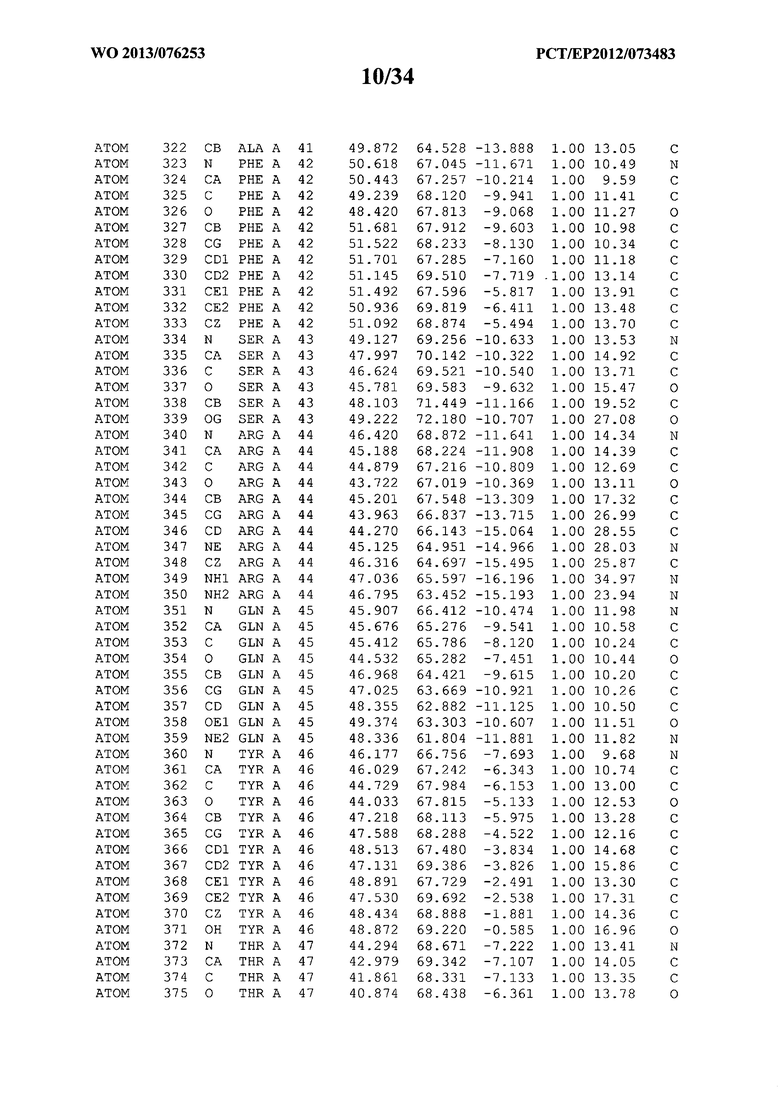
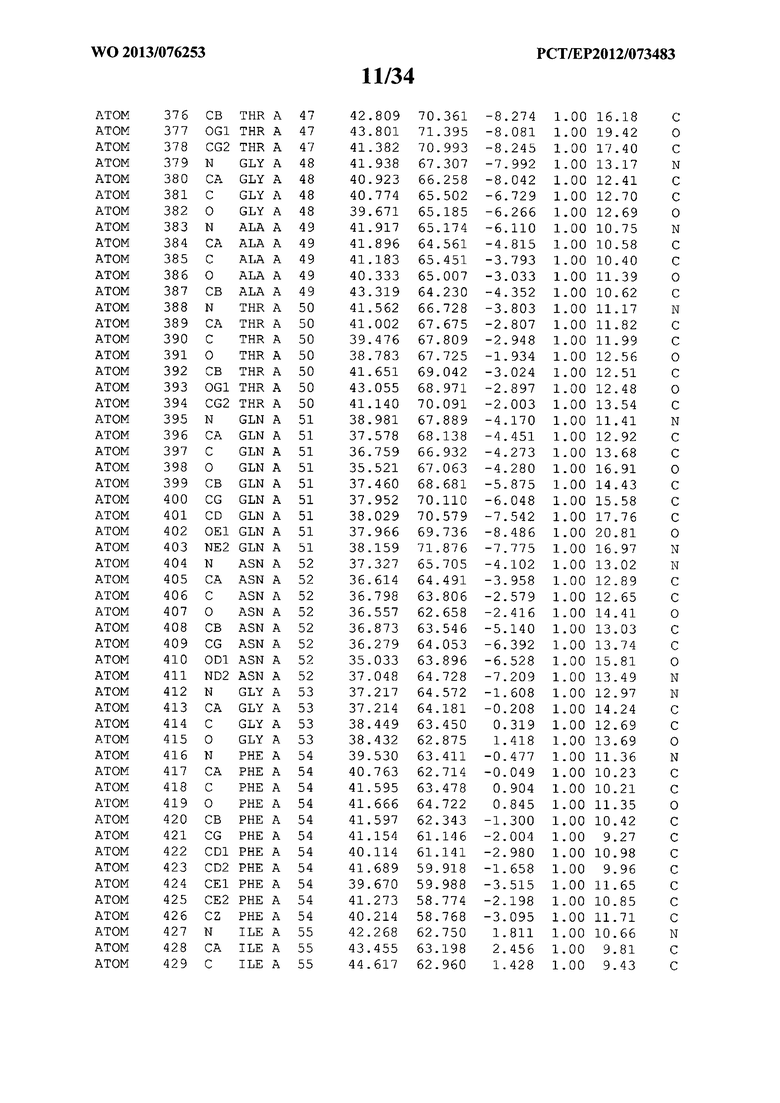
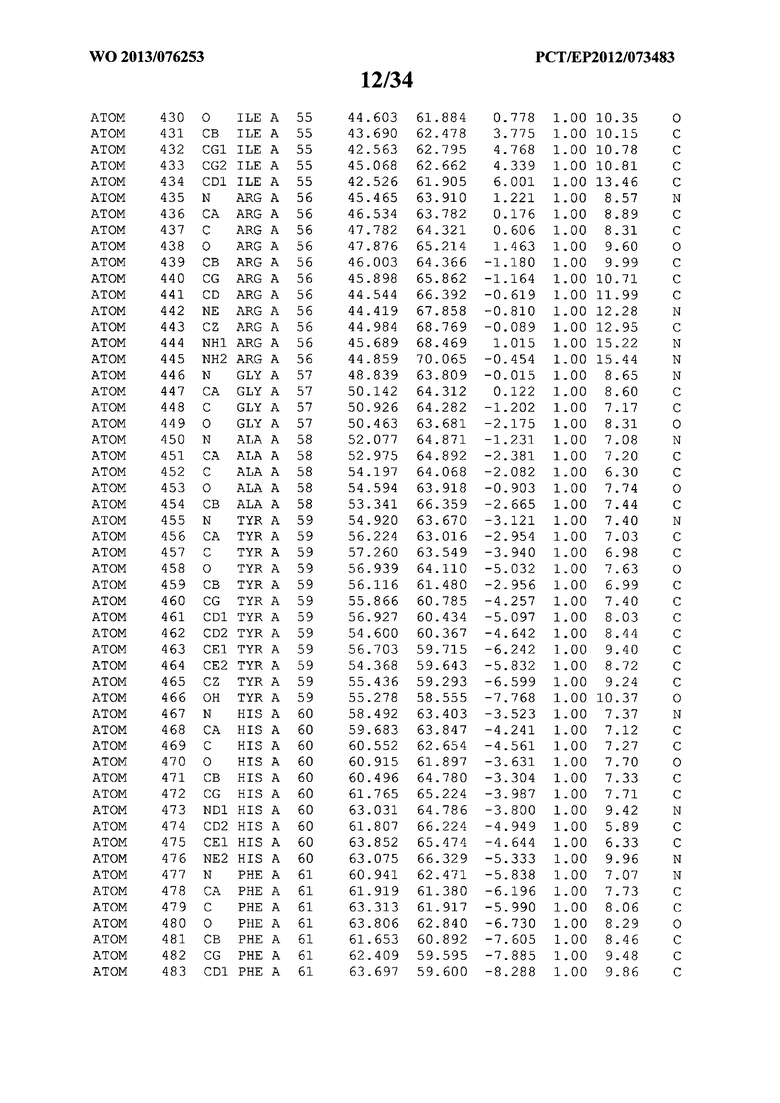
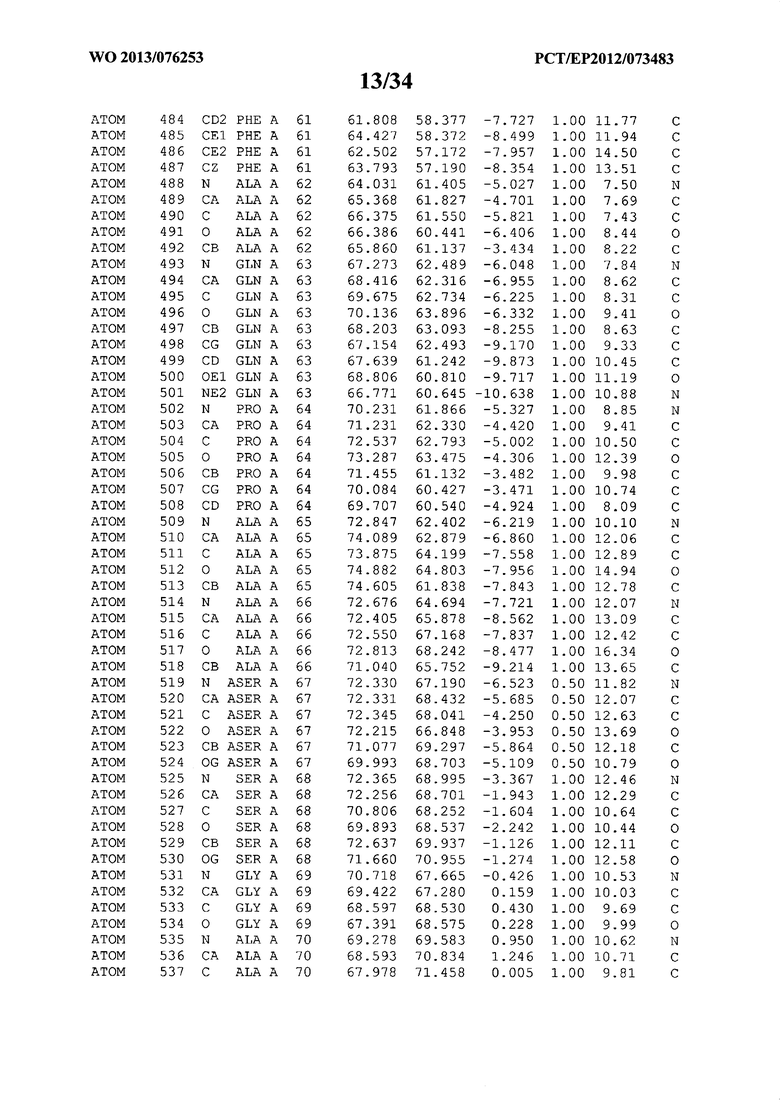
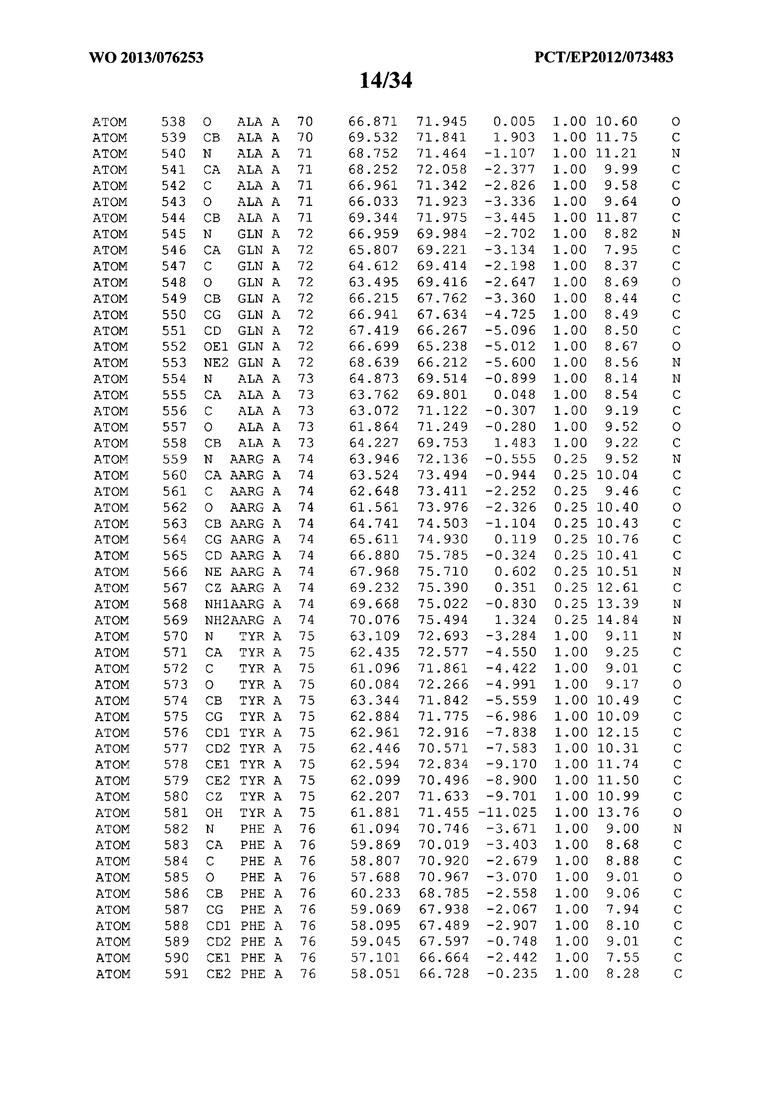
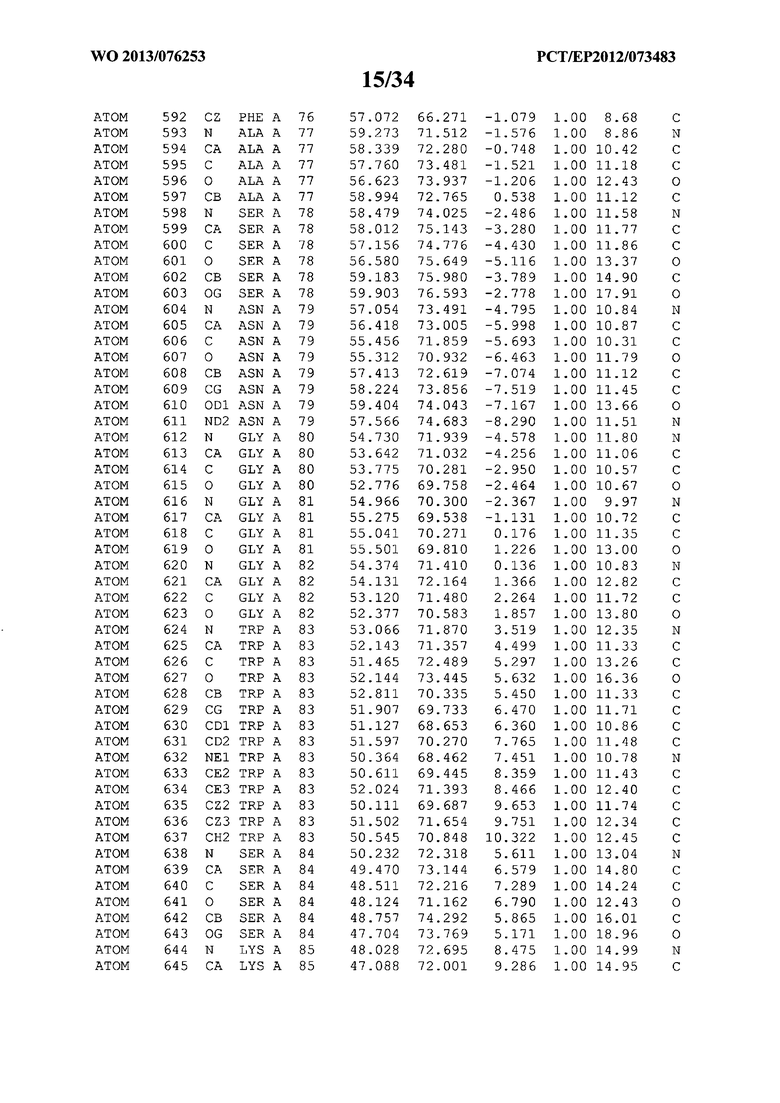
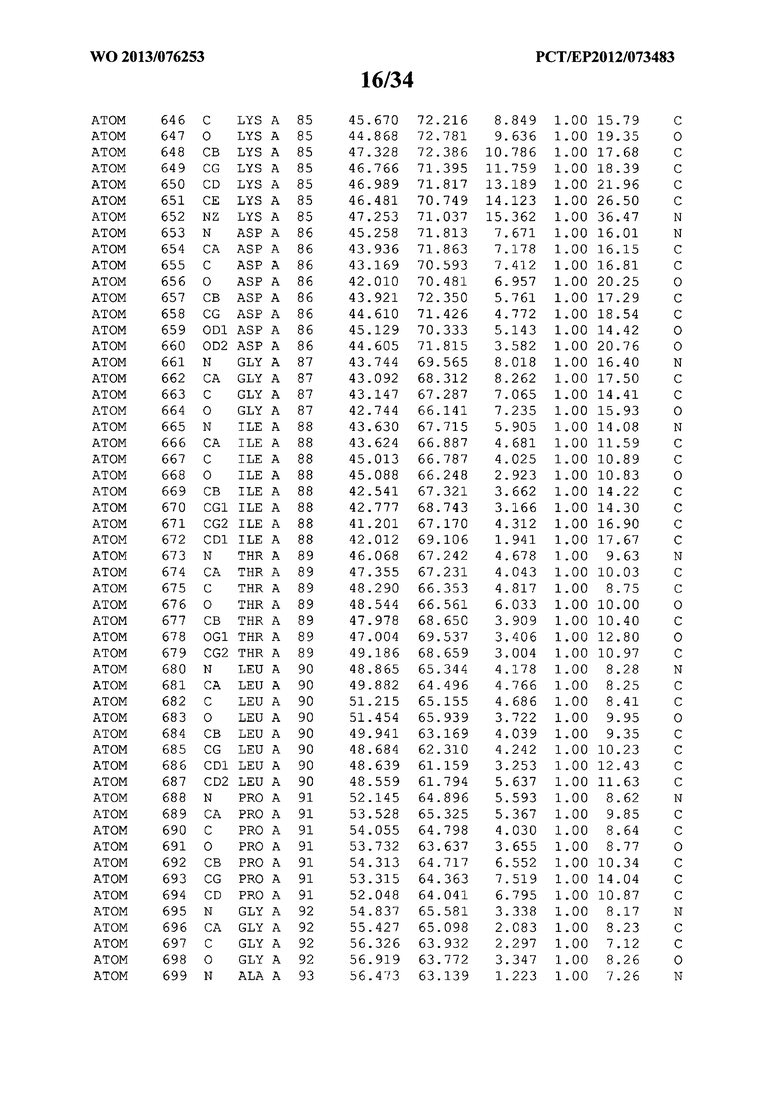
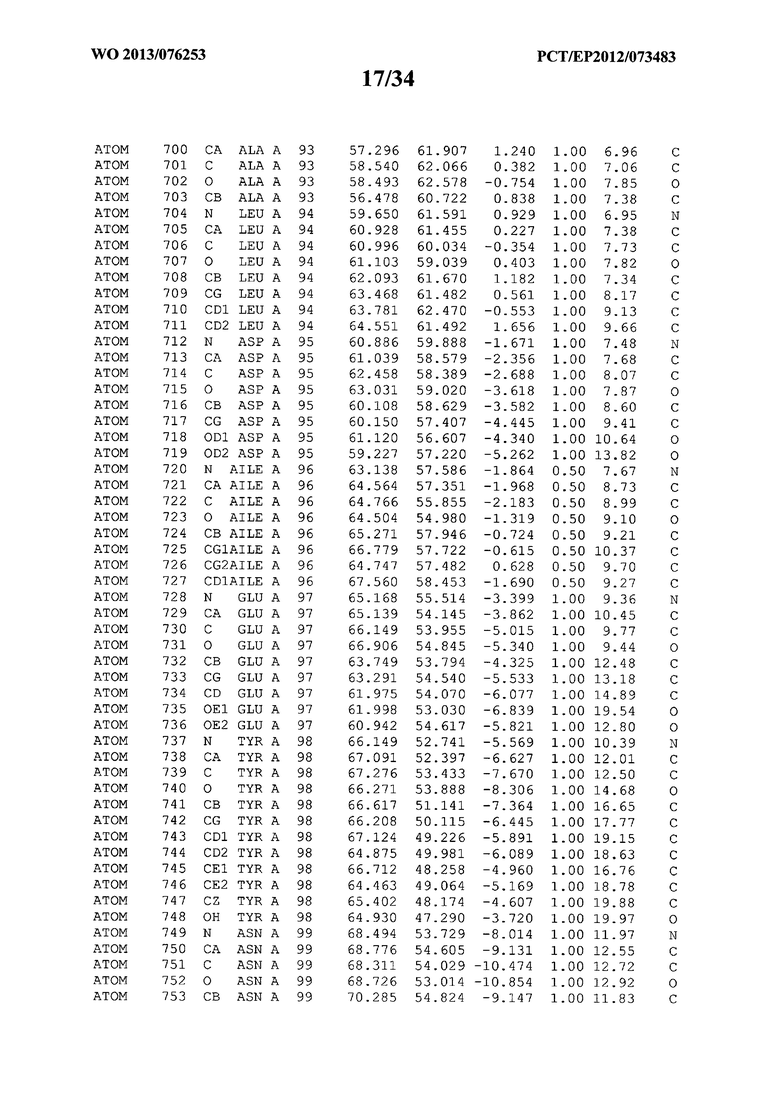
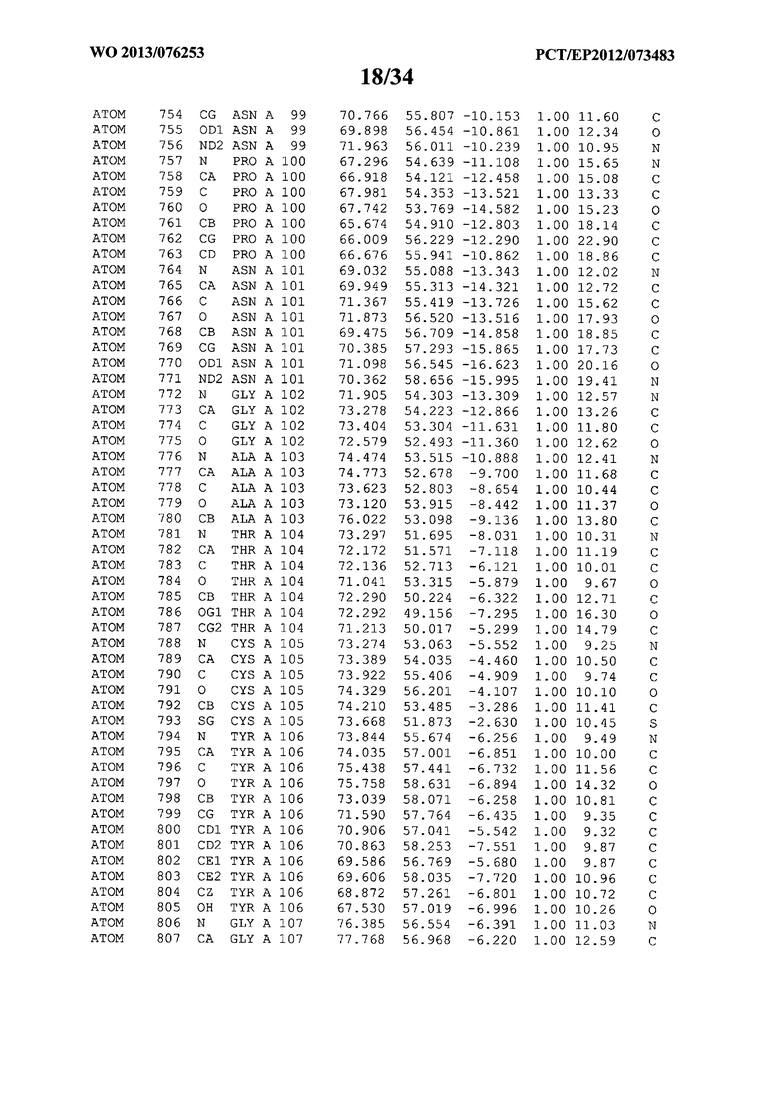
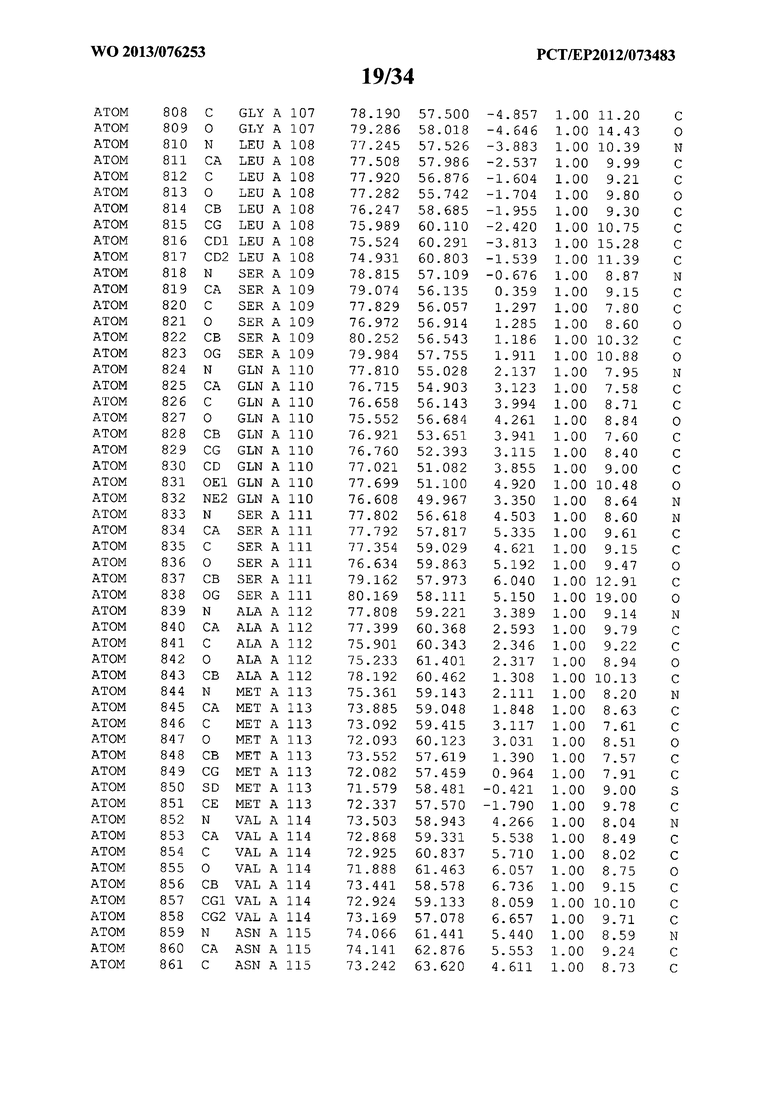
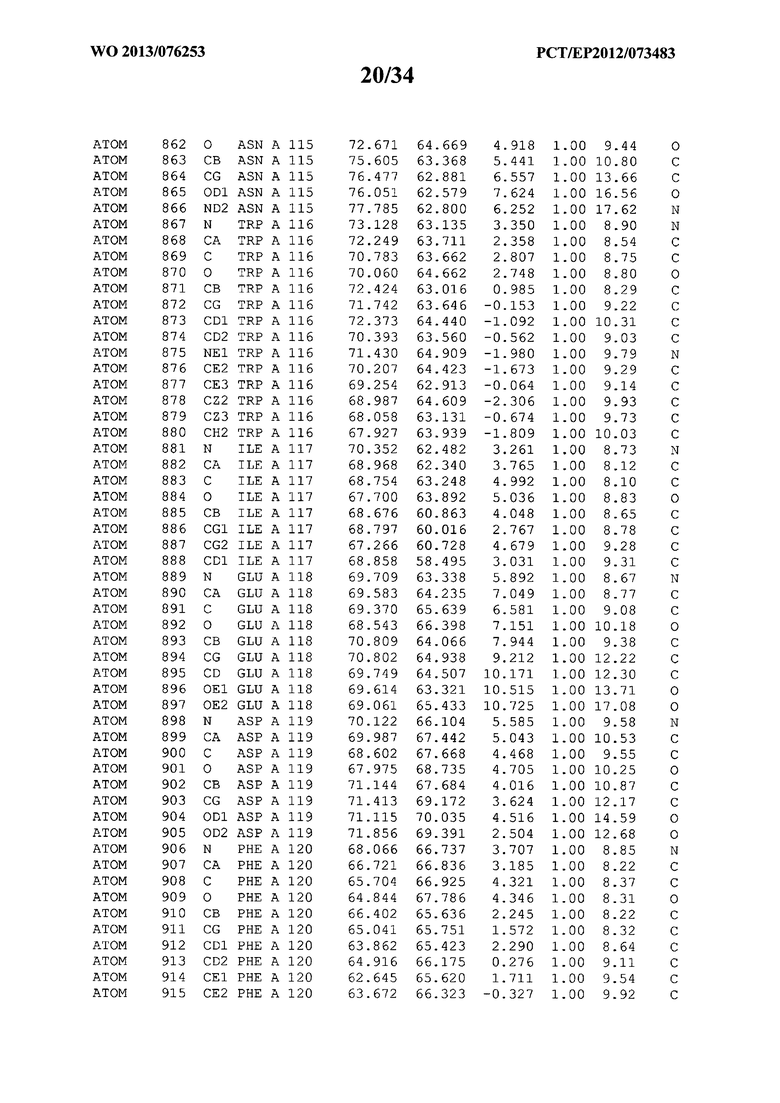
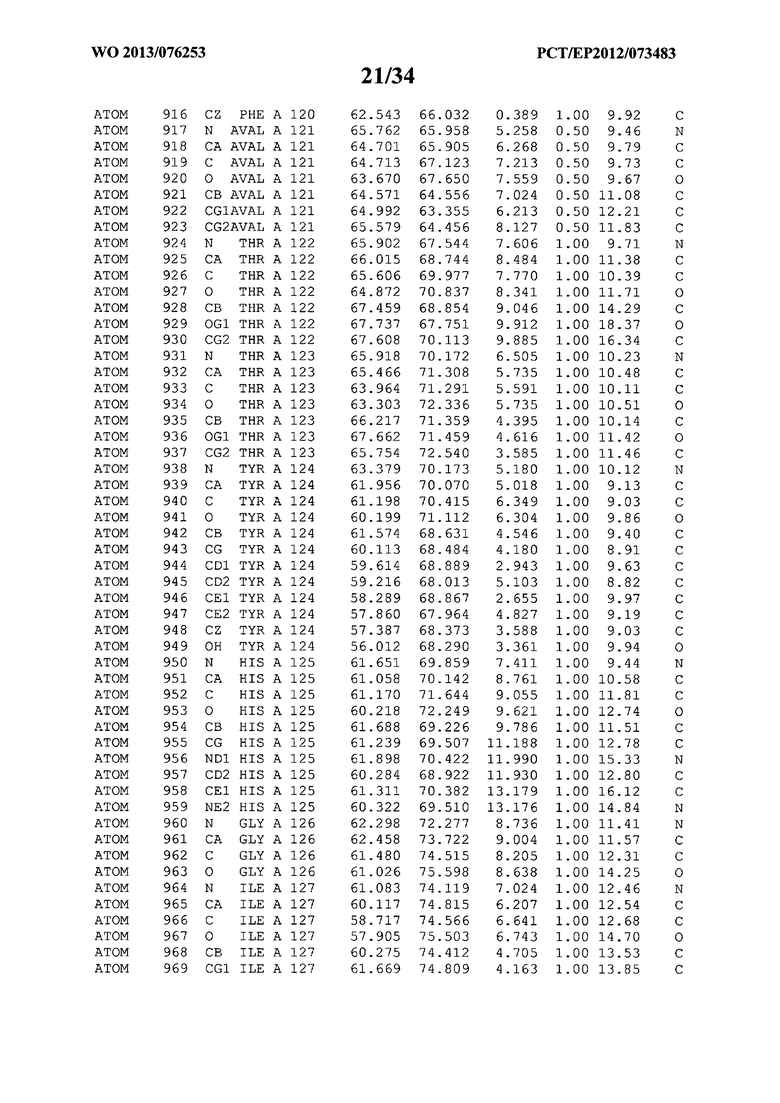
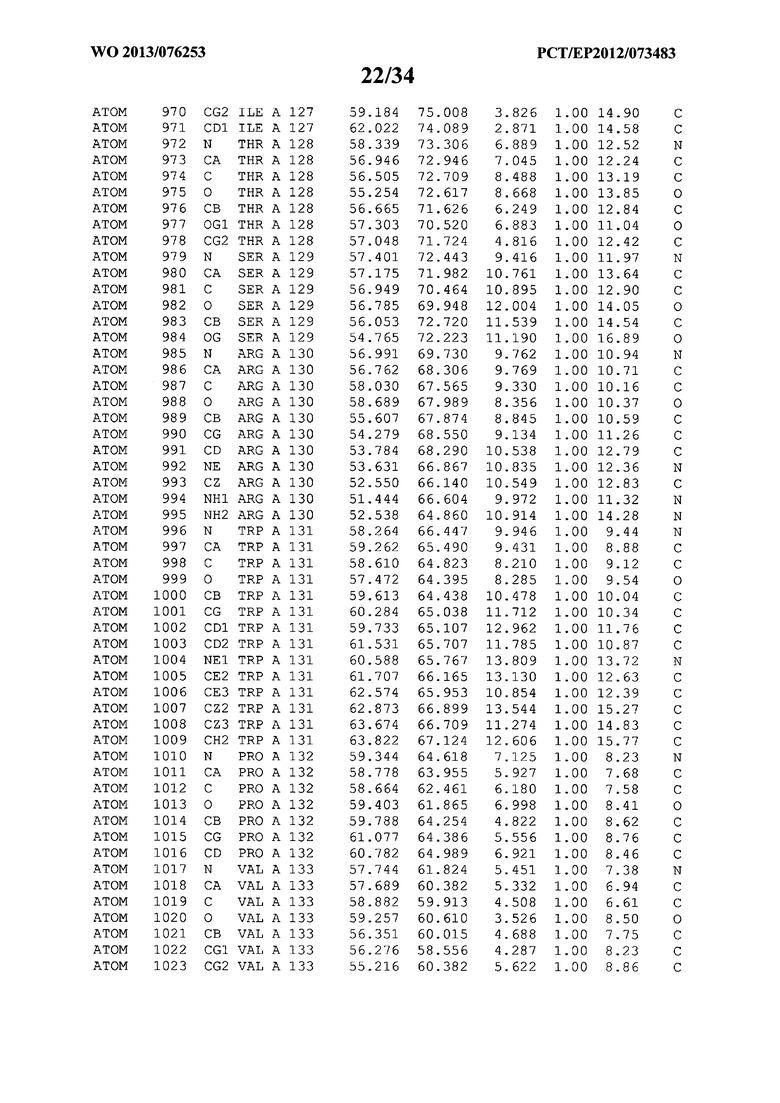
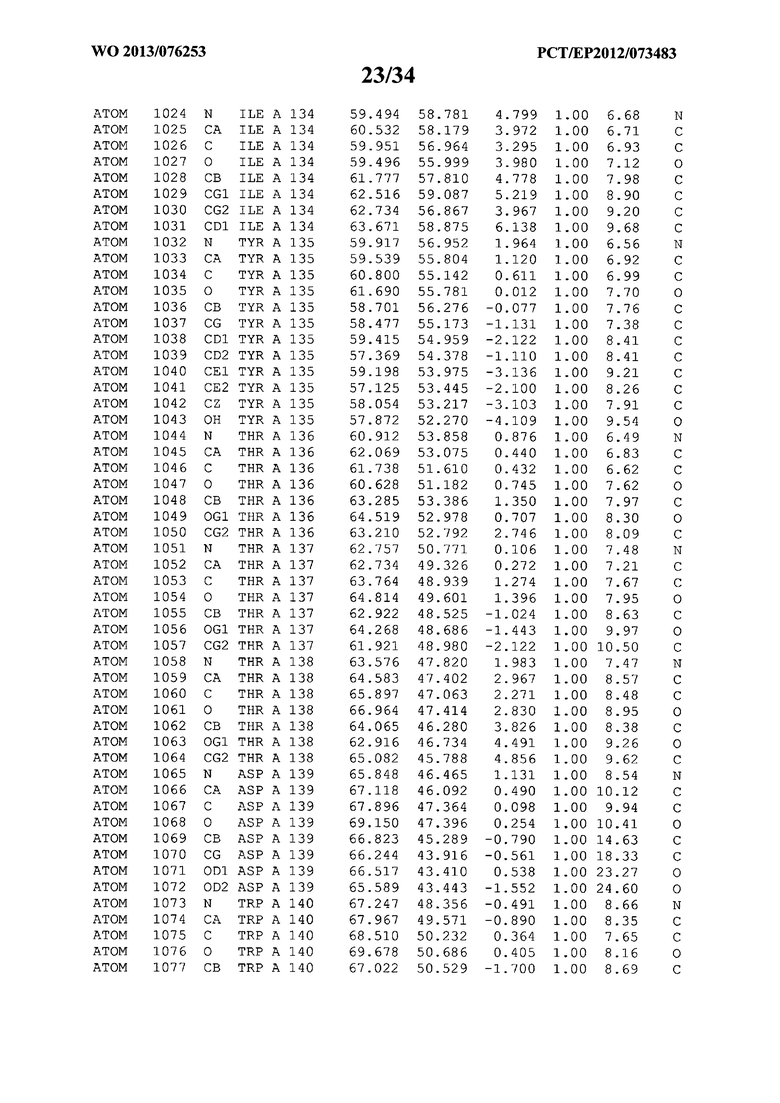
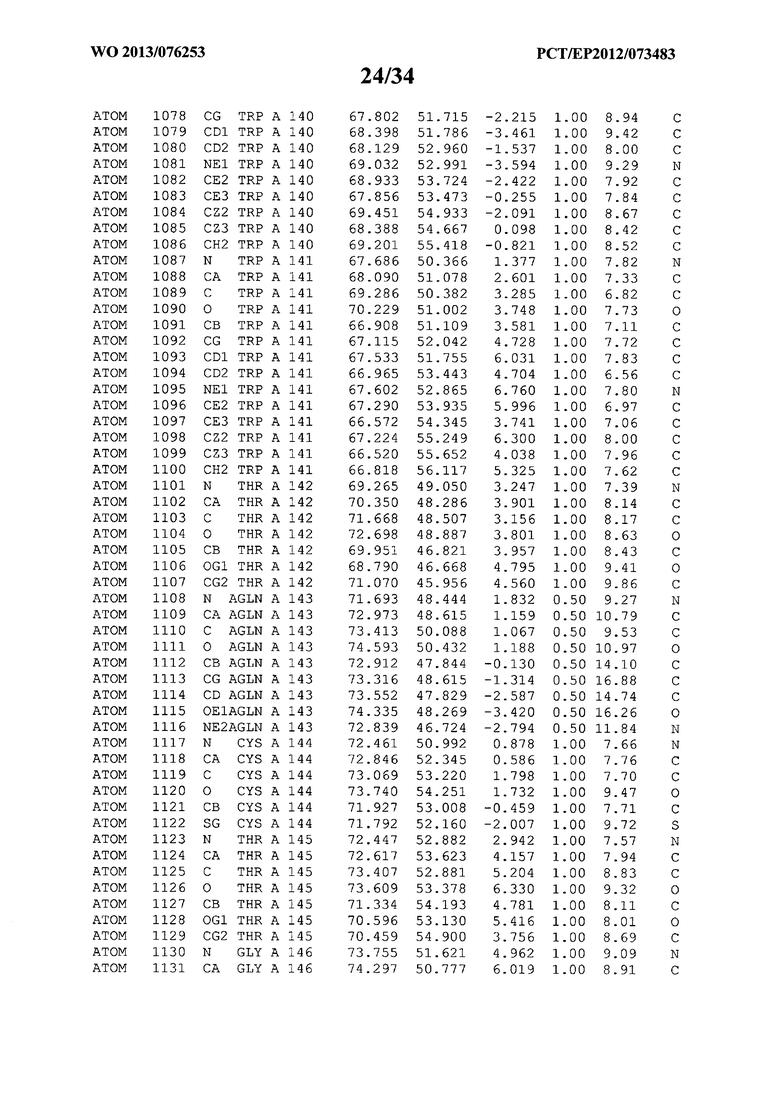
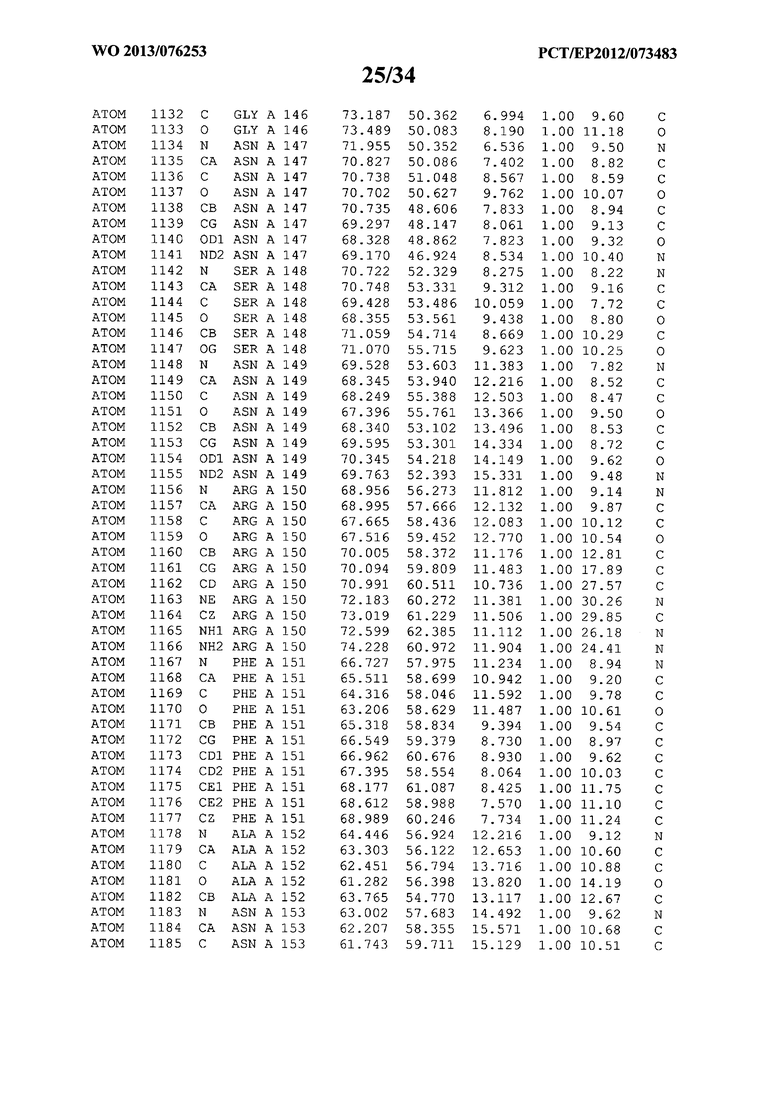
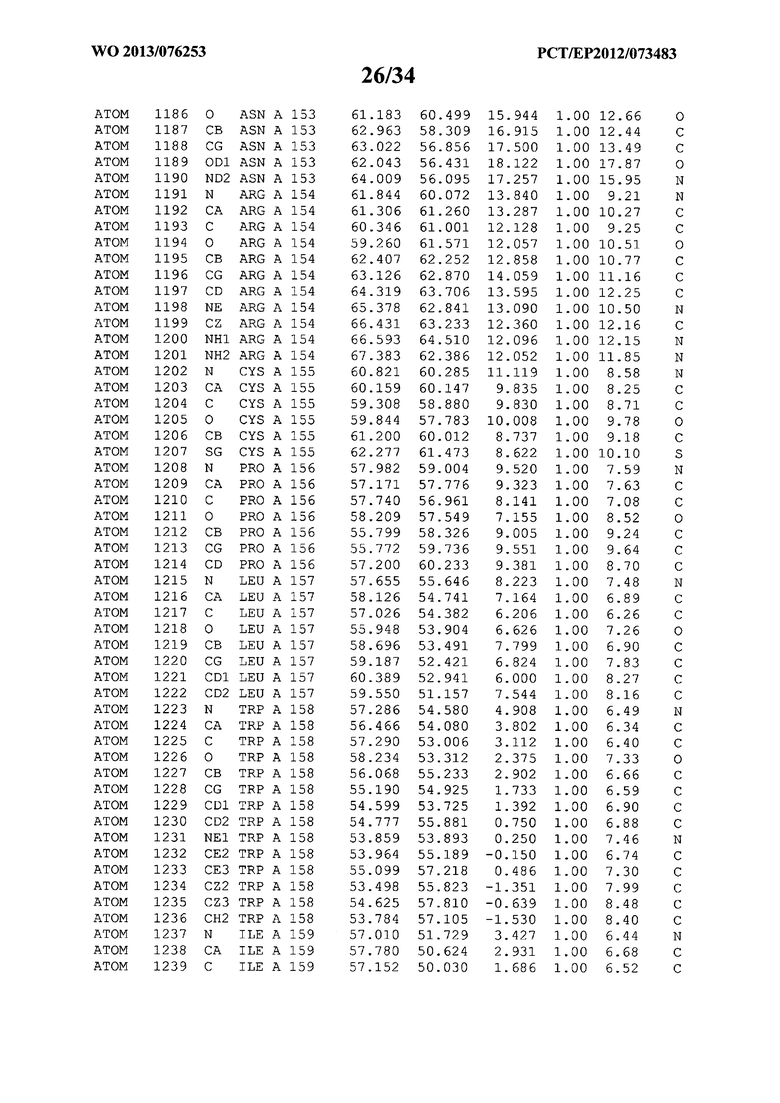
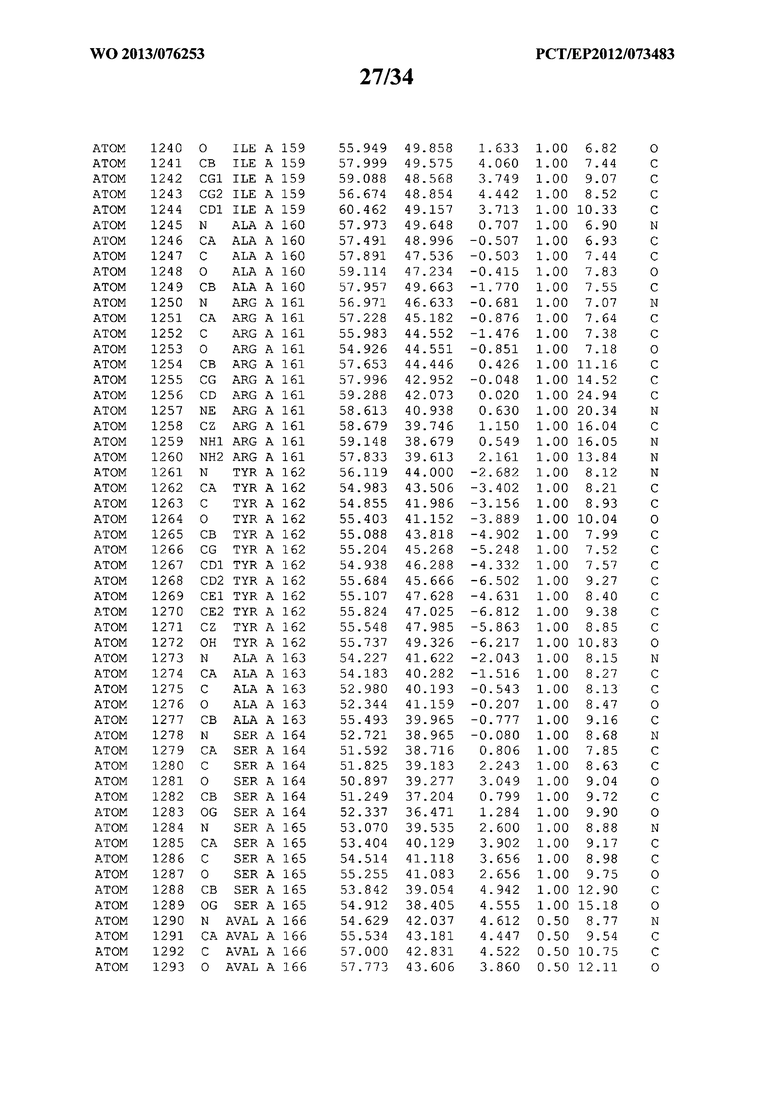
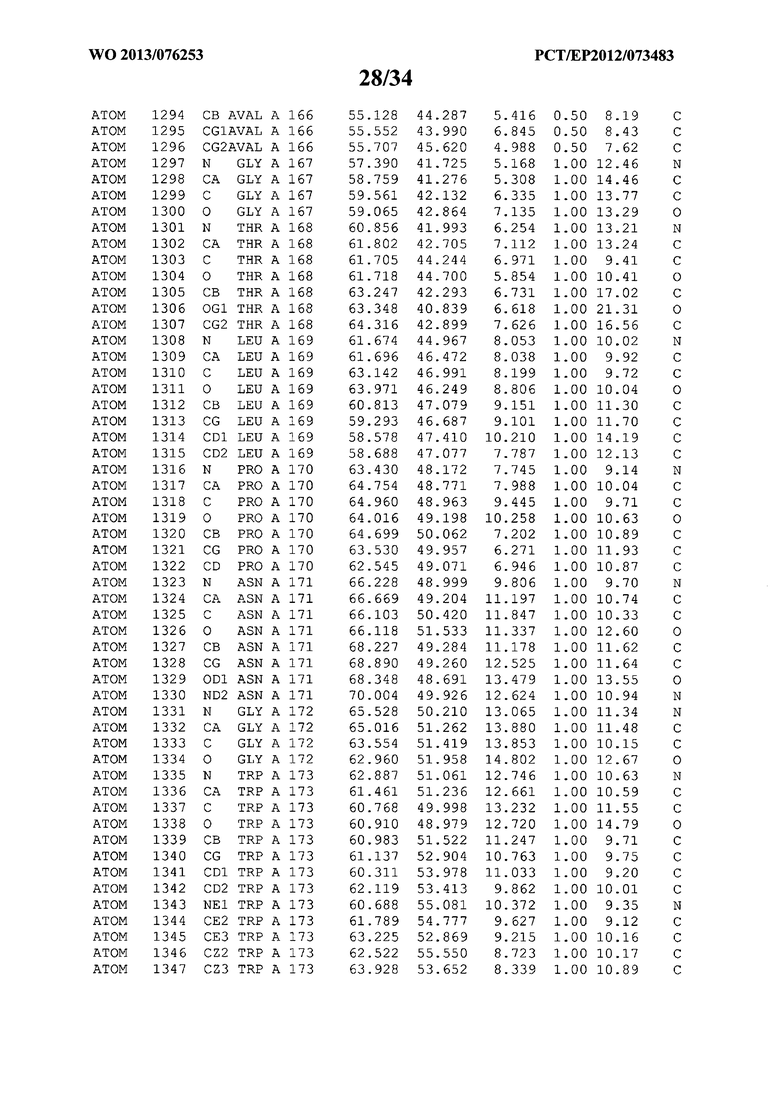
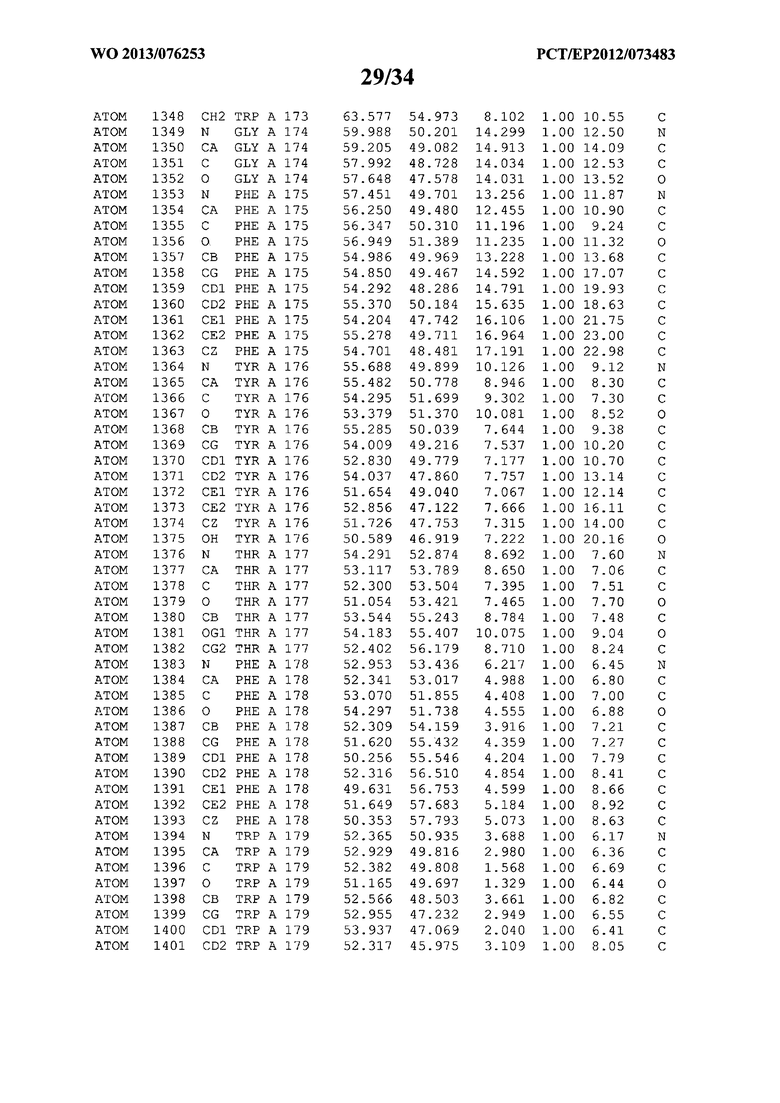
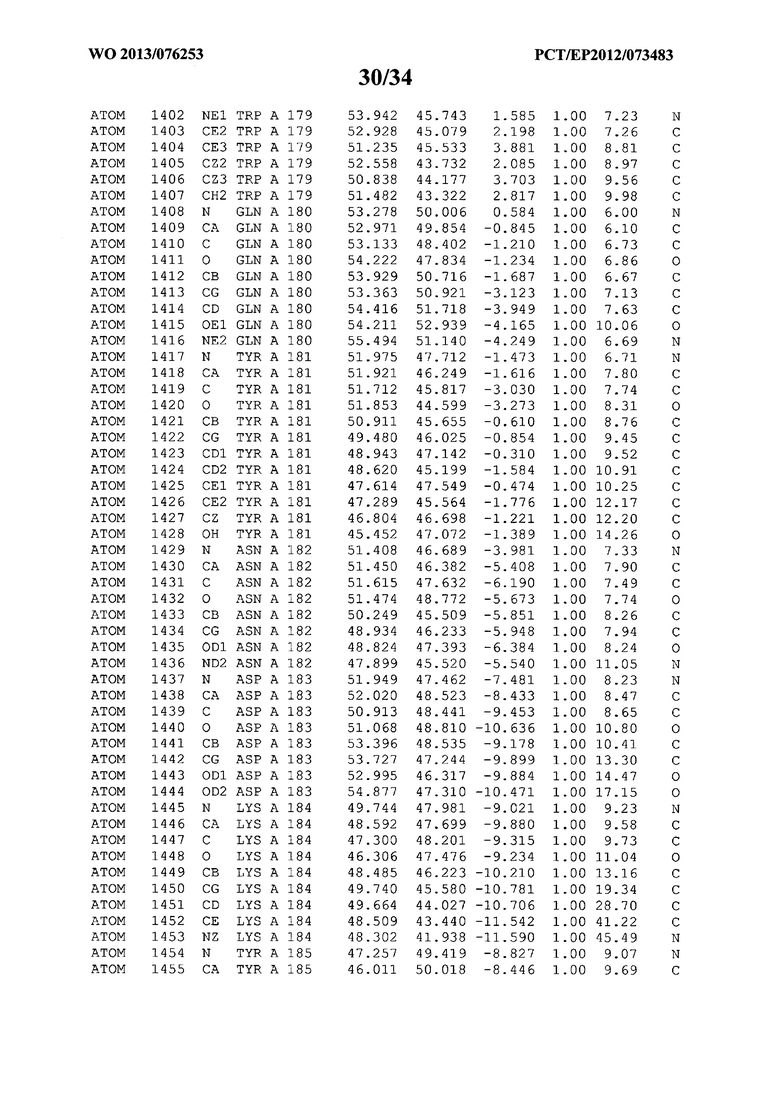
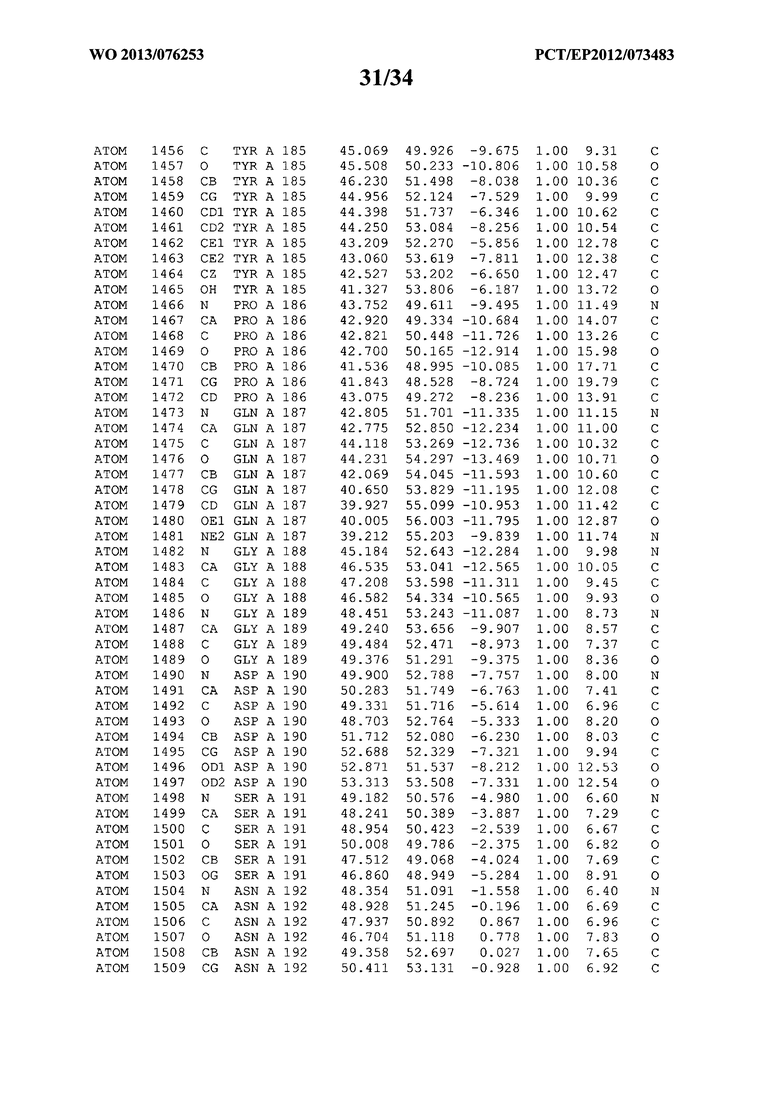
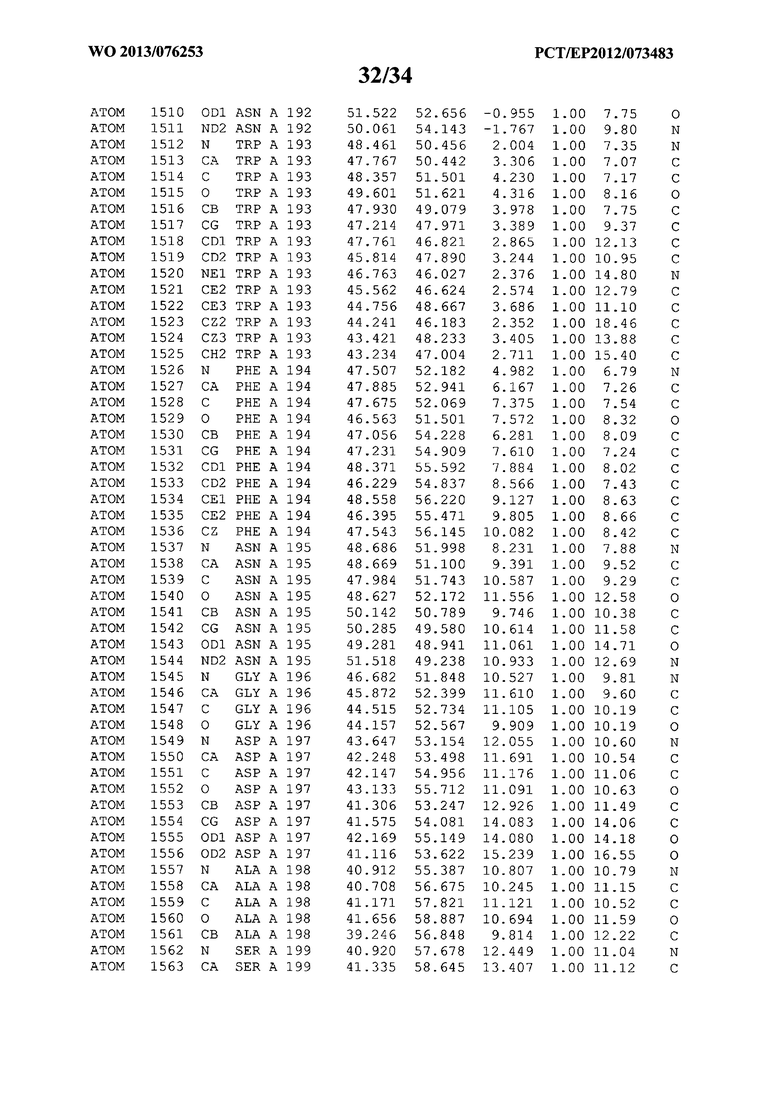
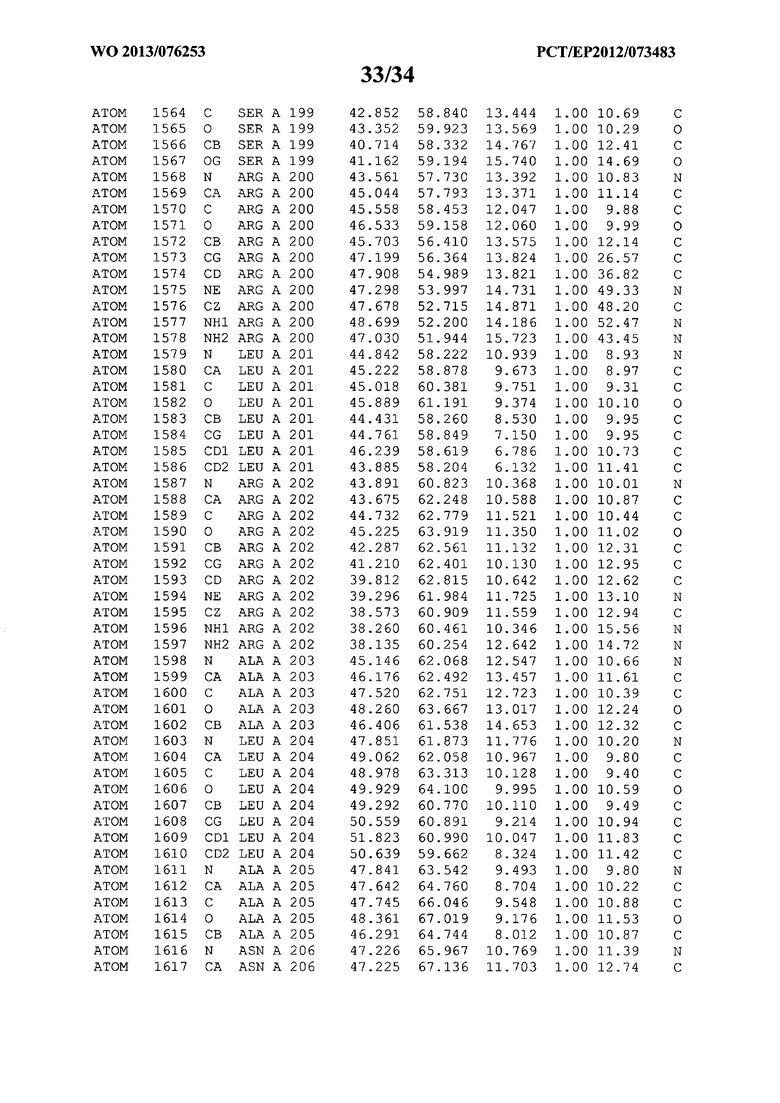
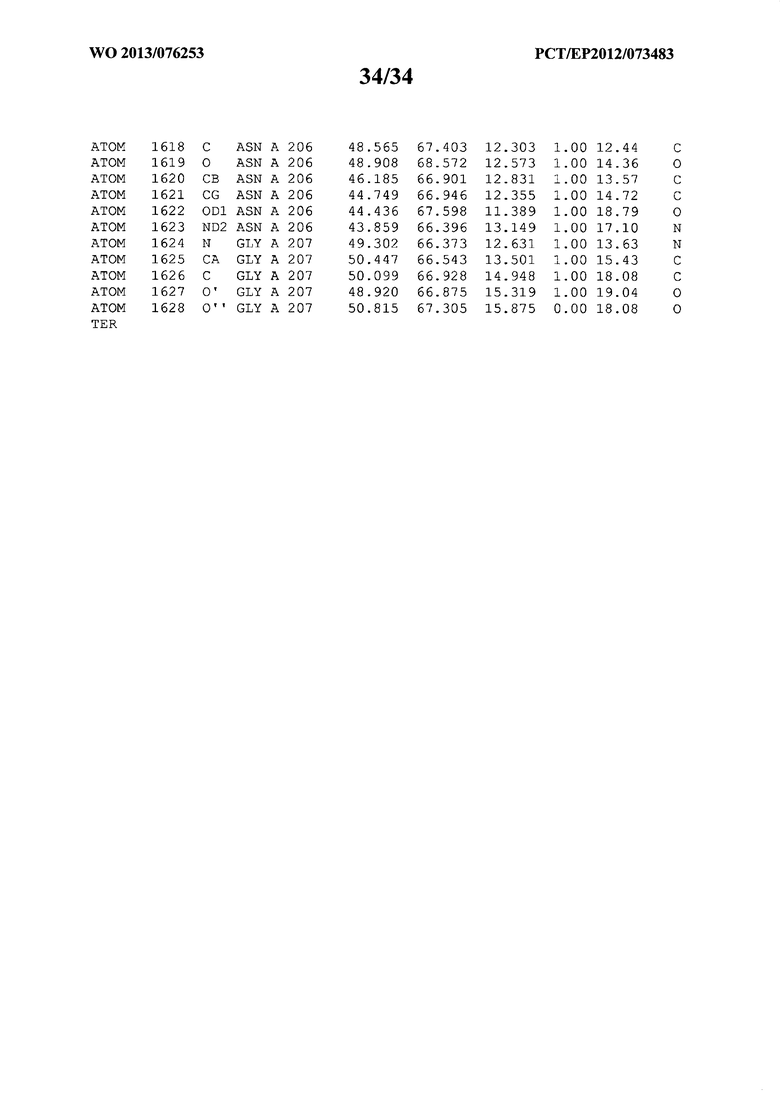
Группа изобретений относится к области биотехнологии. Представлен выделенный полипептид, обладающий лизоцимной активностью. Представлен выделенный полинуклеотид, кодирующий указанный полипептид. Представлены композиция для экстракции бактериальной геномной ДНК, композиция корма для животных и добавка в корм для животных, содержащие указанный полипептид. Представлен способ выделения ДНК из бактерий с использованием указанного полипептида. Представлен вектор экспрессии нуклеиновой кислоты, содержащий указанный полинуклеотид, функционально связанный с регуляторными последовательностями. Представлена рекомбинантная клетка-хозяин бактерии или гриба для получения указанного полипептида, содержащая указанный полинуклеотид, функционально связанный с регуляторными последовательностями. Представлен способ получения полипептида, обладающего лизоцимной активностью с использованием указанной клетки-хозяина. Группа изобретений позволяет получать лизоцимный фермент с улучшенной термостабильностью даже при 85 °C, при использовании которого можно избежать потери активности фермента на производственных стадиях, сопряженных с температурным воздействием. 15 н. и 5 з.п. ф-лы, 6 ил., 15 табл., 13 пр.
1. Выделенный полипептид, обладающий лизоцимной активностью, выбранный из группы, состоящей из:
(a) полипептида, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична аминокислотам с 20 по 227 из SEQ ID NO: 4 или аминокислотам с 1 по 208 из SEQ ID NO: 8;
(b) полипептида, кодируемого полинуклеотидом, последовательность которого по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99% или на 100% идентична кодирующей зрелый полипептид последовательности из SEQ ID NO: 3 или кодирующей зрелый полипептид последовательности из SEQ ID NO: 7;
(c) полипептида, кодируемого полинуклеотидом, который гибридизуется в условиях умеренно-высокой жесткости с кодирующей зрелый полипептид последовательностью из SEQ ID NO: 3 или SEQ ID NO: 7, или последовательностью полной длины, комплементарной ей; и
(d) варианта аминокислот с 20 по 227 из SEQ ID NO: 4 или аминокислот с 1 по 208 SEQ ID NO: 8, содержащего замену, делецию и/или вставку в одном или более (например, нескольких) положениях, причем указанные полипептиды отличаются не более чем на 45 аминокислот от зрелого полипептида из SEQ ID NO: 8, и причем указанная мутация выбрана из группы, состоящей из W10H, Y28M, S39D, G92P, А93М, D95A, V133M, T142N, F178I и D190A.
2. Полипептид по п.1, выбранный из полипептидов, содержащих или состоящих из SEQ ID NO: 4 или SEQ ID NO: 8, или аминокислот с 20 по 227 из SEQ ID NO: 4 или аминокислот с 1 по 208 из SEQ ID NO: 8.
3. Полипептид по любому из пп.1, 2, который представляет собой вариант зрелого полипептида из SEQ ID NO: 4 или SEQ ID NO: 8, содержащего замену, делецию и/или вставку в одном или более (нескольких) положениях.
4. Композиция для экстракции бактериальной геномной ДНК, причем указанная композиция содержит эффективное количество полипептида по любому из пп.1-3.
5. Композиция для экстракции бактериальной геномной ДНК по п.4, отличающаяся тем, что композиция дополнительно содержит эффективное количество одного или нескольких дополнительных лизоцимов.
6. Композиция корма для животных, содержащая полипептид по любому из пп.1-3, причем концентрация полипептида в пищевом рационе находится в пределах диапазона 0,01-200 мг белка-фермента на кг пищевого рациона.
7. Композиция корма для животных по п.6, которая дополнительно содержит одну или несколько амилаз; фитаз; ксиланаз; галактаназ; альфа-галактозидаз; протеаз, фосфолипаз, бета-глюканаз или любую их смесь.
8. Добавка в корм для животных, содержащая:
по меньшей мере один полипептид по любому из пп.1-3, причем концентрация полипептида в пищевом рационе находится в пределах диапазона 0,01-200 мг белка-фермента на кг пищевого рациона; и
по меньшей мере один жирорастворимый витамин, и/или
по меньшей мере один водорастворимый витамин, и/или
по меньшей мере один микроэлемент.
9. Добавка в корм для животных по п.8, которая дополнительно содержит одну или несколько амилаз; фитаз; ксиланаз; галактаназ; альфа-галактозидаз; протеаз, фосфолипаз, бета-глюканаз или любую их смесь.
10. Применение полипептида по любому из пп.1-3 в качестве ингибитора образования биопленки.
11. Применение полипептида по любому из пп.1-3 в стоматологической композиции.
12. Применение полипептида по любому из пп.1-3 в моющей композиции.
13. Применение полипептида по любому из пп.1-3 в корме для животных.
14. Применение полипептида по любому из пп.1-3 для разрушения клеточных стенок бактерий.
15. Применение по п.14, где полипептид применяется в способе выделения ДНК из бактерий.
16. Способ выделения ДНК из бактерий, включающий:
(a) обработку выделенных бактерий полипептидом по любому из пп.1-3 и
(b) извлечение бактериальной ДНК.
17. Выделенный полинуклеотид, кодирующий полипептид по любому из пп.1-3.
18. Конструкт или вектор экспрессии нуклеиновой кислоты, содержащий полинуклеотид по п.17, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют продуцированием полипептида в экспрессирующем хозяине.
19. Рекомбинантная клетка-хозяин бактерии или гриба для получения полипептида по любому из пп.1-3, содержащая полинуклеотид по п.17, функционально связанный с одной или несколькими регуляторными последовательностями, которые управляют продуцированием полипептида.
20. Способ получения полипептида, обладающего лизоцимной активностью, включающий:
(a) культивирование клетки-хозяина по п.19 в условиях, благоприятных для продуцирования полипептида; и
(b) извлечение полипептида.
| US 7635470 B2, 22.12.2009 | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ БАКТЕРИОСТАТИЧЕСКОЙ И БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ ПРОТИВ СПОР БАКТЕРИЙ И ВЕГЕТАТИВНЫХ КЛЕТОК, И СПОСОБ ОБРАБОТКИ ЕЮ ПРОДУКТОВ ПИТАНИЯ | 2002 |
|
RU2306774C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ХРОМОСОМНОЙ ДНК ИЗ БАКТЕРИАЛЬНЫХ КЛЕТОК ВОЗБУДИТЕЛЯ ЧУМЫ YERSINIA PESTIS | 2002 |
|
RU2232818C1 |
Авторы
Даты
2017-05-11—Публикация
2012-11-23—Подача